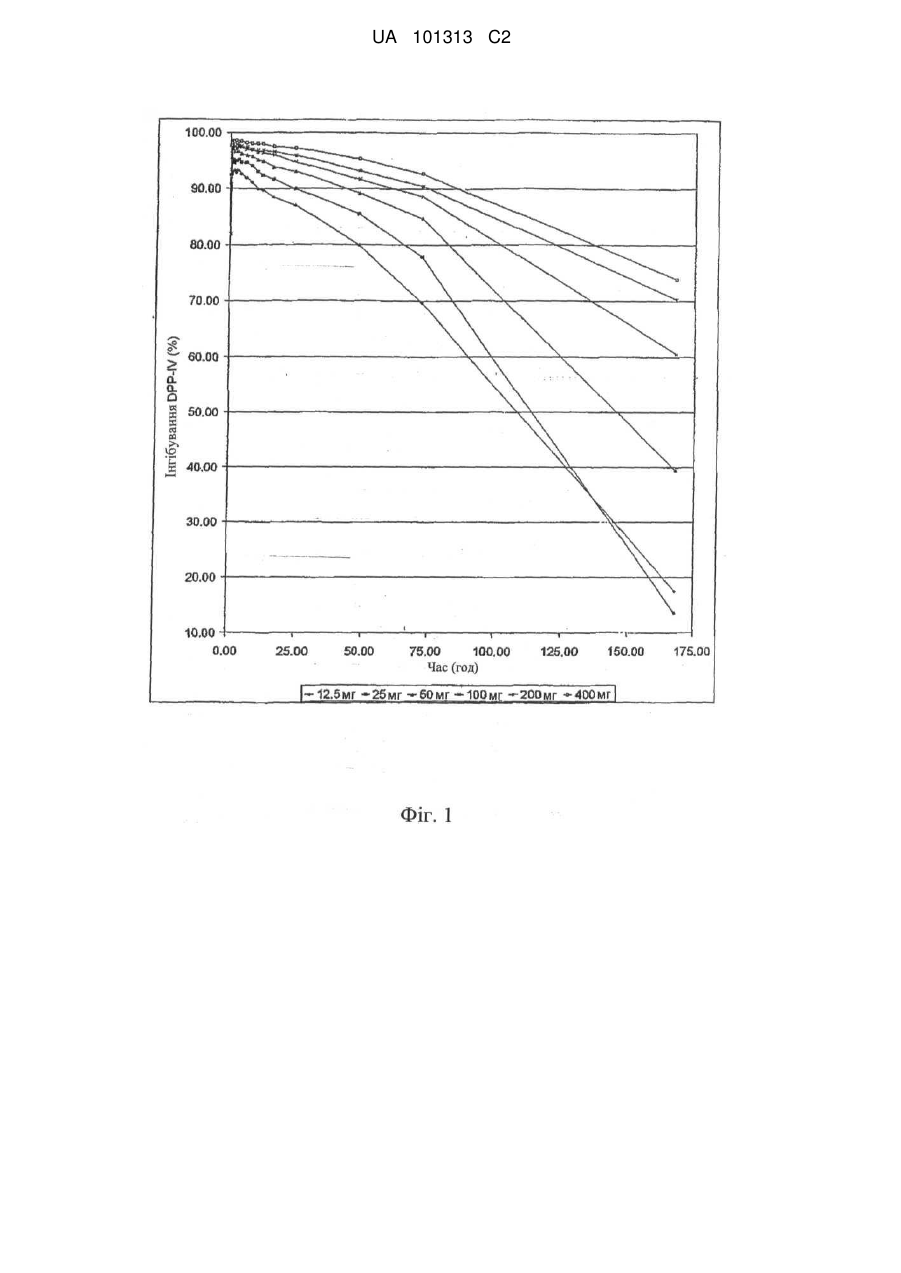
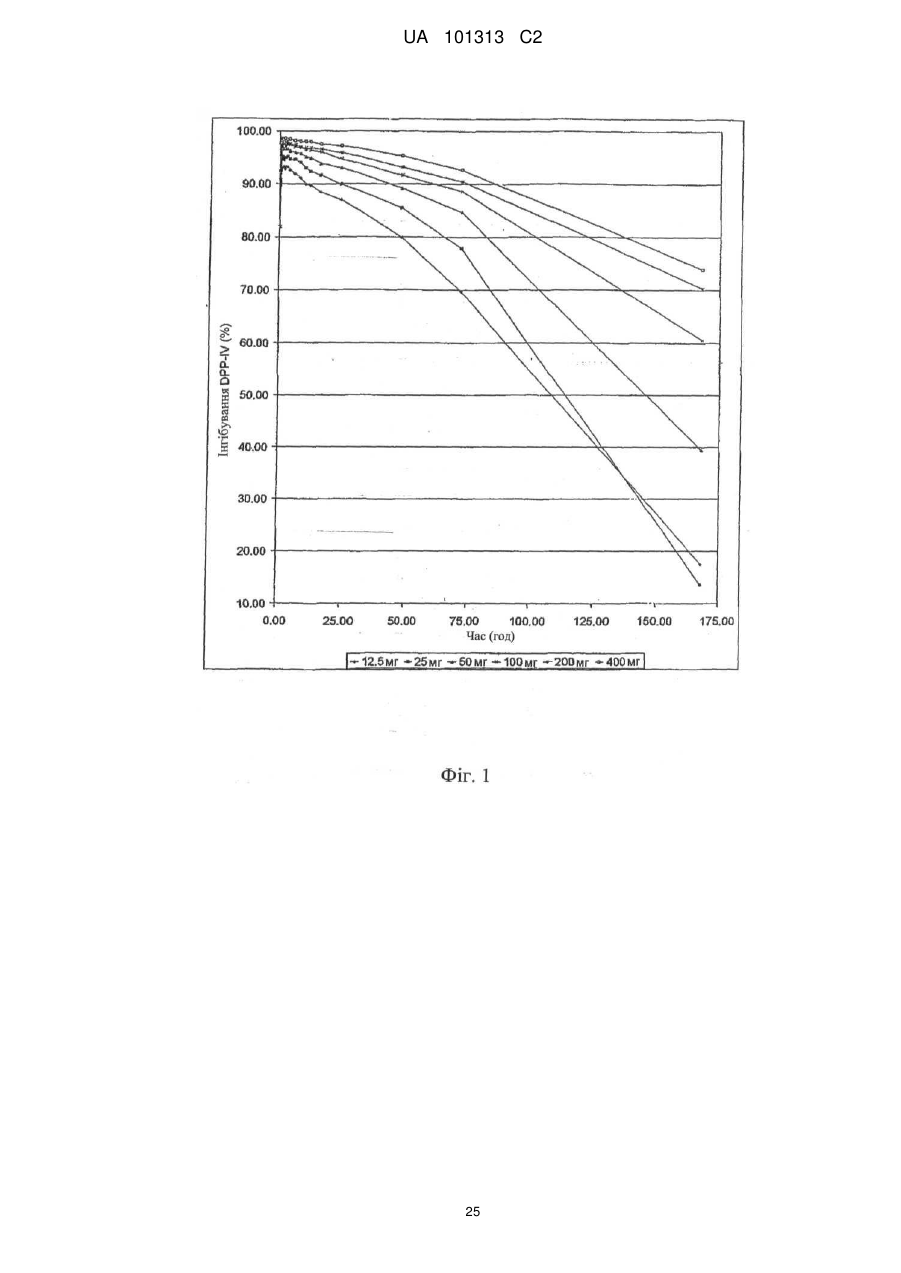
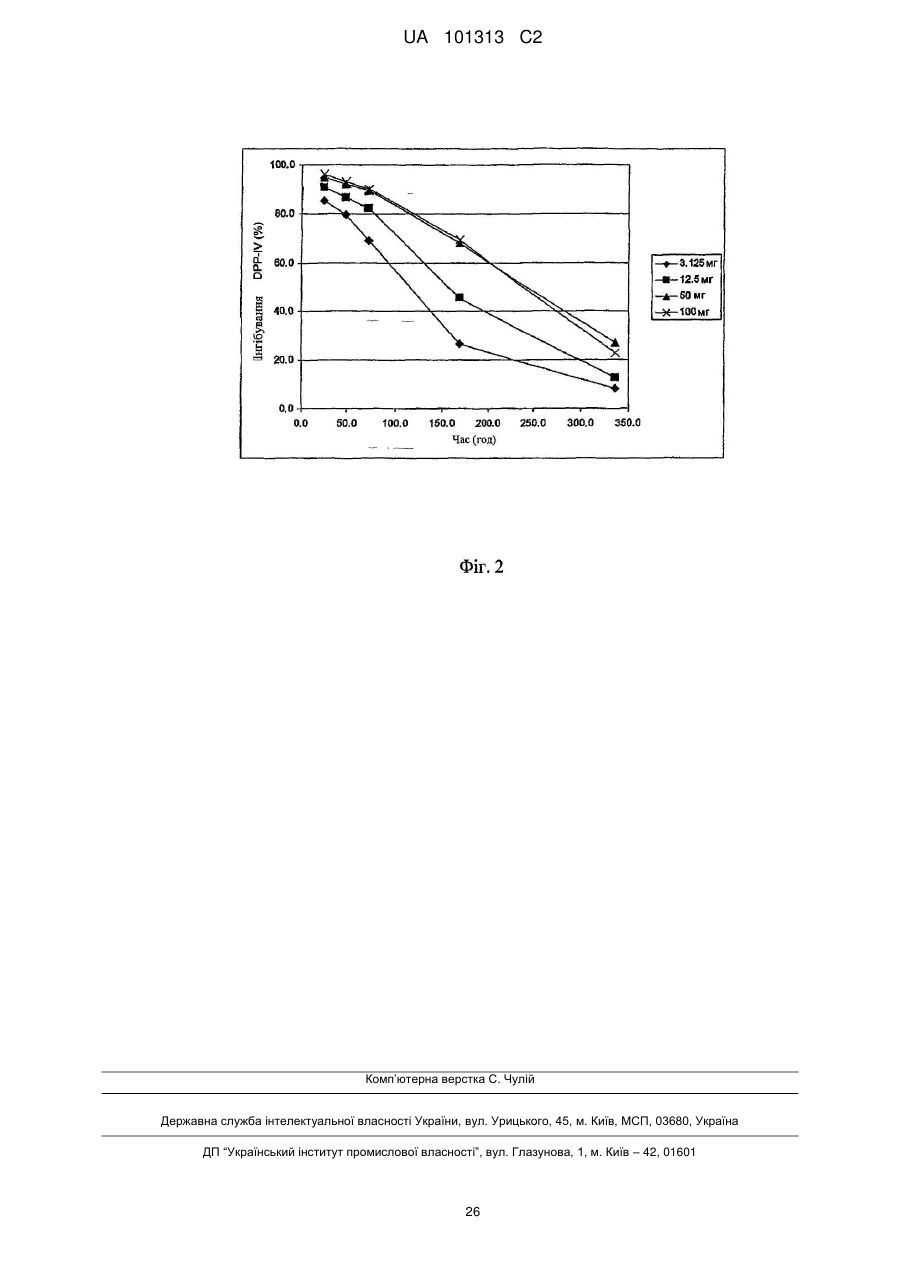
Щотижневе введення інгібіторів дипептидилпептидази
Формула / Реферат
1. Застосування сполуки І формули

як лікарського засобу для лікування діабету І типу, де сполука І вводиться щотижнево у тижневій дозі більше ніж 250 мг.
2. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 275 мг.
3. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 300 мг.
4. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 350 мг.
5. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 400 мг.
6. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає не більше 500 мг.
7. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає не більше 400 мг.
8. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає не більше 350 мг.
9. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 500 мг.
10. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 400 мг.
11. Застосування за п. 1, де вказана тижнева дозована форма адаптована для введення шляхом, вибраним з групи, яка складається з орального, парентерального, інтраперитонеального, внутрішньовенного, інтраартеріального, трансдермального, сублінгвального, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомального, за допомогою інгаляцій, вагінального, внутрішньоочного, за допомогою місцевої доставки, підшкірного, введення в жирову тканину, введення в суглоб, внутрішньоочеревинного і інтратекального введення.
12. Застосування за п. 1, де вказана дозована форма для введення раз на тиждень адаптована для орального введення.
13. Застосування за п. 1, де вказана дозована форма для введення раз на тиждень являє собою тверду препаративну форму, адаптовану для орального введення.
14. Застосування за п. 1, де вказана дозована форма для введення раз на тиждень являє собою таблетку або капсулу, адаптовану для орального введення.
15. Застосування за п. 1, де вказана дозована форма для введення щотижнево, являє собою препаративну форму для уповільненого вивільнення, адаптовану для орального введення.
16. Застосування за п. 1, де сполука І присутня у формі вільної основи.
17. Застосування за п. 1, де сполука І присутня у формі фармацевтично прийнятної солі.
18. Застосування за п. 1, де сполука І присутня у формі сукцинатної солі.
19. Застосування сполуки І формули

як лікарського засобу для лікування діабету II типу, де сполука І вводиться щотижнево у тижневій дозі більше ніж 250 мг.
20. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 275 мг.
21. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 300 мг.
22. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 350 мг.
23. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 400 мг.
24. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає не більше 500 мг.
25. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає не більше 400 мг.
26. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає не більше 350 мг.
27. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 500 мг.
28. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 400 мг.
29. Застосування за п. 19, де вказана тижнева дозована форма адаптована для введення шляхом, вибраним з групи, яка складається з орального, парентерального, інтраперитонеального, внутрішньовенного, інтраартеріального, трансдермального, сублінгвального, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомального, за допомогою інгаляції, вагінального, внутрішньоочного, за допомогою місцевої доставки, підшкірного, введення в жирову тканину, введення в суглоб, внутрішньоочеревинного і інтратекального введення.
30. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень адаптована для орального введення.
31. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень являє собою тверду препаративну форму, адаптовану для орального введення.
32. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень являє собою таблетку або капсулу, адаптовану для орального введення.
33. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень включає препаративну форму для уповільненого вивільнення, адаптовану для орального введення.
34. Застосування за п. 19, де сполука І присутня у формі вільної основи.
35. Застосування за п. 19, де сполука І присутня у формі фармацевтично прийнятної солі.
36. Застосування за п. 19, де сполука І присутня у формі сукцинатної солі.
37. Застосування сполуки І формули

як лікарського засобу для лікування переддіабетичного стану, де сполука І вводиться щотижнево у тижневій дозі більше ніж 250 мг.
38. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 275 мг.
39. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 300 мг.
40. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 350 мг.
41. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 400 мг.
42. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає не більше 500 мг.
43. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає не більше 400 мг.
44. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає не більше 350 мг.
45. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 500 мг.
46. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 400 мг.
47. Застосування за п. 37, де вказана тижнева дозована форма адаптована для введення шляхом, вибраним з групи, яка складається з орального, парентерального, інтраперитонеального, внутрішньовенного, інтраартеріального, трансдермального, сублінгвального, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомального, за допомогою інгаляцій, вагінального, внутрішньоочного, за допомогою місцевої доставки, підшкірного, введення в жирову тканину, введення в суглоб, внутрішньоочеревинного і інтратекального введення.
48. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень адаптована для орального введення.
49. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень являє собою тверду препаративну форму, адаптовану для орального введення.
50. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень являє собою таблетку або капсулу, адаптовану для орального введення.
51. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень включає препаративну форму для уповільненого вивільнення, адаптовану для орального введення.
52. Застосування за п. 37, де сполука І присутня у формі вільної основи.
53. Застосування за п. 37, де сполука І присутня у формі фармацевтично прийнятної солі.
54. Застосування за п. 37, де сполука І присутня у формі сукцинатної солі.
Текст
Реферат: Винахід належить до медицини, стосується фармацевтичної композиції, яка включає 2-[6-(3амінопіперидин-1-іл)-3-метил-2,4-дюксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4-фторбензонітрил і його фармацевтично прийнятну сіль, а також набори і вироби, що включають фармацевтичні композиції, а також способи застосування фармацевтичних композицій. UA 101313 C2 (12) UA 101313 C2 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки винаходу Винахід стосується способу введення сполук і фармацевтичних композицій, що використовуються для інгібування дипептидилпептидази IV, а також способів лікування, основаних на такому введенні. Попередній рівень техніки винаходу Опис пов'язаної галузі техніки Діпептидилпептідаза IV (IUBMB Enzyme Nomenclature EC.3.4.14.5) являє собою мембранний білок II типу, який в літературі називали величезною множиною назв, включаючи DPP4, DP4, DAP-IV, FAP, білок, утворюючий комплекс з аденозиндеаміназою 2, білок, зв'язуючий аденозиндеаміназу (ADAbp), дипептидиламінопептидаза IV; Xaa-Proдипептидиламінопептидаза; Gly-Pro нафтиламідаза, постпролін дипептидиламінопептидаза IV; лімфоцитарний антигенний CD26; глікопротеїн GP110; дипетидилпептидаза IV; гліцилпролінамінопептидаза; гліцилпролінамінопептидаза; Х-пролілдипептидиламінопептидаза; pep X; лейкоцитарний антигенний CD26; гліцилпролілдипептидиламінопептидаза; дипептидилпептидгідролаза; гліцилпроліламінопептидаза; дипептидиламінопептидаза IV; DPP IV/CD26; аміноацилпролілдипептидиламінопептидаза; молекула, стимулююча Т клітини Tp109; X-PDAP. У даному описі дипептидилпептидазу IV називають як «DPP-IV». DPP-IV являє собою некласичну серинову амінодипептидазу, яка видаляє дипептиди XaaPro з амінокінця (N-кінця) поліпептидів і білків. Також повідомляли про залежне від DPP-IV повільне вивільнення дипептидів типу X-Gly або X-Ser для деяких природних пептидів. DPP-IV постійно експресується на епителіальних і ендотеліальних клітинах множини різних тканин (кишечника, печінки, легені, нирок і плаценти) і також виявляється в рідинах організму. DPP-IV також експресується на циркулюючих Т-лімфоцитах, і є ідентичною поверхневому антигену клітин CD26. DPP-IV відповідає за метаболічне розщеплення певних ендогенних пептидів (GLP-1 (7-36), глюкагон) in vivo і має продемонстровану протеолітичну активністю відносно множини інших пептидів (GHRH, NPY, GLP-2, VIP) in vitro. GLP-1 (7-36) являє собою пептид з 29 амінокислот, що утворюється при посттрансляційному процесингу проглюкагону в тонкій кишці. GLP-1 (7-36) має множину ефектів in vivo, включаючи стимуляцію секреції інсуліну, інгібування секреції глюкагону, стимуляцію насичення і сповільнення спустошення шлунка. На основі його фізіологічного профілю, вважають, що дія GLP-1 (7-36) буде корисною для попередження і лікування діабету II типу і потенційно ожиріння. Наприклад, було виявлено, що екзогенне введення GLP-1 (7-36) (безперервна інфузія) пацієнтам з діабетом є ефективним в цій популяції пацієнтів. На жаль, GLP-1 (7-36) швидко розкладається in vivo, і було показано, що він має короткий період напівжиття in vivo (t1/2=1,5 хвилин). На основі дослідження генетично виведених мишей, нокаутованих по DPP-IV, і в дослідженнях in vivo/in vitro з селективними інгібіторами DPP-IV було показано, що DPP-IV є основним ферментом, що руйнує GLP-1 (7-36) in vivo. GLP-1 (7-36) ефективно розкладається DPP-IV до GLP-1 (9-36), який приблизно діє як фізіологічний антагоніст GLP-1 (7-36). Отже, вважають, що інгібування DPP-IV in vivo застосовне для потенціювання ендогенних рівнів GLP-1 (7-36) і зменшення утворення його антагоніста GLP-1 (9-36). Отже, вважають, що інгібітори DPPIV будуть застосовними засобами для попередження, сповільнення прогресування і/або лікування станів, опосередкованих DPP-IV, зокрема, діабету, і точніше, цукрового діабету 2 типу, діабетичної дисліпідемії, станів порушеної толерантності до глюкози (ПТГ), станів порушеної глікемії натщесерце (ПГН), метаболічного ацидозу, кетозу, регуляції апетиту і ожиріння. Було показано, що декілька сполук інгібують DPP-IV. Проте, все ще існує необхідність в нових інгібіторах DPP-IV і способах введення таких інгібіторів для лікування захворювань. Опис винаходу Короткий опис винаходу Запропонований спосіб, що включає: введення пацієнту щотижня дози від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково від 50 мг/тиждень до 400 мг/тиждень сполуки I і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки I. В одному варіанті вводять щотижневу дозу сполуки I 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 400 мг або 500 мг, необов'язково вводять щотижневу дозу сполуки I 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг або 400 мг. 1 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 Також пропонується спосіб, що включає введення пацієнту щотижневої дози більш ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I і необов'язково щонайменше 400 мг сполуки I. В одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 500 мг. У іншому варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 400 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 350 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 500 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 400 мг. У інших варіантах пацієнту вводять щотижневі дози 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I. У ще одному варіанті введення здійснюють 1 разів в тиждень, і воно може необов'язково проводитися 1 разів в тиждень у вигляді однократної дози. Необов'язково, введення проводять 1 разів в тиждень протягом періоду щонайменше 1 місяць, необов'язково протягом періоду щонайменше 2 місяці і необов'язково протягом періоду щонайменше 3 місяці. У одному варіанті введення здійснюють вранці і необов'язково проводять вранці перед першою іжею пацієнта. Введення може здійснюватися величезною множиною шляхів введення, включаючи, але, не обмежуючись, шлях, вибраний з групи, що складається з перорального, парентерального, інтраперитонеального, внутрішньовенного, інтраартеріального, трансдермального, сублінгвального, внутрішньом'язового, ректального, трансбуккального, інтраназального, ліпосомального, за допомогою інгаляцій, вагінального, внутрішньоочного, за допомогою місцевої доставки, підшкірного, введення в жирову тканину, введення в суглоб, внутрішньочеревинного і інтратекального введення. У одному певному варіанті введення здійснюють перорально. Також пропонується спосіб введення сполуки I в комбінації з одним або більше протидіабетичними препаратами або інкретиновими сполуками, іншими, ніж сполука I. В одному варіанті, здійснюють такий метод комбінованої терапії, де щотижнева доза становить від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково від 50 мг/тиждень до 400 мг/тиждень сполуки I, і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки I. В одному варіанті щотижневу дозу сполуки I 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 400 мг або 500 мг вводять пацієнту в комбінації з одним або більше протидіабетичними сполуками, іншими, ніж сполука I. У наступному варіанті здійснюють такий спосіб комбінованої терапії, де пацієнту вводять щотижневу дозу більше ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I, і необов'язково щонайменше 400 мг сполуки I. В ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 500 мг. У іншому варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 400 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 350 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 500 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 400 мг. У інших варіантах щотижневу дозу сполуки I 275 мг, 300 мг, 350 мг, 400 мг або 500 мг вводять пацієнту в комбінації з одним або більше протидіабетичними сполуками, іншими, ніж сполука I. Відносно кожного з вищезазначених варіантів здійснення винаходу і їх варіантів сполука I може бути введена у вигляді вільної основи або у вигляді її фармацевтично прийнятної солі. У певних варіантах сполуку I вводять у вигляді солі HCl, метансульфонату, сукцинату, бензоату, толуолсульфонату, R-(-)манделату або бензолсульфонату сполуки I. Також пропонуються фармацевтичні композиції. У одному варіанті здійснення винаходу забезпечують фармацевтичну композицію, яка складена в лікарській формі, що містить разову дозу, де така лікарська форма, що містить разову дозу, становить від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково від 50 мг/тиждень до 400 мг/тиждень сполуки I, і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки I. В певних варіантах фармацевтична композиція включає 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 400 мг або 500 мг сполуки I. 2 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому варіанті здійснення винаходу пропонується фармацевтична композиція, яка складена в лікарській формі, що містить разову дозу, де така лікарська форма, що містить разову дозу, включає більше ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I, і необов'язково щонайменше 400 мг сполуки I. В одному варіанті фармацевтична композиція включає не більше ніж 500 мг сполуки I. В іншому варіанті фармацевтична композиція включає не більше ніж 400 мг сполуки I. В ще одному варіанті фармацевтична композиція включає не більше ніж 350 мг сполуки I. В ще одному варіанті фармацевтична композиція включає більше ніж 250 мг і не більше ніж 500 мг сполуки I. В наступному варіанті фармацевтична композиція включає більше ніж 250 мг і не більше ніж 400 мг сполуки I. В інших варіантах фармацевтична композиція включає 275 мг, 300 мг, 350 мг, 400 мг і 500 мг сполуки I. У іншому варіанті здійснення винаходу пропонується фармацевтична композиція, яка включає сполуку I і одну або більше протидіабетичну або інкретинову сполуку, іншу, ніж сполука I в лікарській формі, що містить разову дозу. У одному варіанті сполука I присутня в лікарській формі, що містить разову дозу, в кількості від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково від 50 мг/тиждень до 400 мг/тиждень сполуки I і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки I. В певних варіантах фармацевтична композиція включає 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 400 мг або 500 мг сполуки I. У ще одному варіанті сполука I присутня в лікарській формі, що містить разову дозу, в кількості більш ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I, і необов'язково щонайменше 400 мг сполуки I. В наступному варіанті фармацевтична композиція включає не більше ніж 500 мг сполуки I. В іншому варіанті фармацевтична композиція включає не більше ніж 400 мг сполуки I. В ще одному варіанті фармацевтична композиція включає не більше ніж 350 мг сполуки I. В ще одному варіанті фармацевтична композиція включає більше ніж 250 мг і не більше ніж 500 мг сполуки I. В додатковому варіанті фармацевтична композиція включає більше ніж 250 мг і не більше ніж 400 мг сполуки I. В інших варіантах фармацевтична композиція включає 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I. Відносно кожного з вищезазначених варіантів здійснення винаходу і їх варіантів, що стосується фармацевтичних композицій, сполука I може бути присутня в фармацевтичній композиції у вигляді вільної основи або у вигляді його фармацевтично прийнятної солі. У певних варіантах сполука I присутня у вигляді солі HCl, метасульфонату, сукцинату, бензоату, толуолсульфонату, R(-)-манделату або бензолсулфонату сполуки I. Також відносно кожного з вищезазначених варіантів здійснення винаходу і їх варіантів, що стосується фармацевтичних композицій, фармацевтична композиція може необов'язково бути лікарською формою для перорального введення, що містить разову дозу, необов'язково, твердою композицією, пристосованою для перорального введення, і необов'язково таблеткою або капсулою, пристосованою для перорального введення. Крім того, відносно кожного з вищезгаданих варіантів здійснення винаходу і їх варіантів, що стосується фармацевтичних композицій, фармацевтична композиція може необов'язково бути лікарською формою, пристосованою для парентерального (підшкірного, внутрішньовенного, субдермального або внутрішньом'язового) введення, що містить разову дозу, необов'язково композицією розчину, пристосованою для парентерального введення, і необов'язково композицією суспензії, пристосованою для парентерального введення. Фармацевтична композиція також може бути композицією продовженого вивільнення, пристосованою для перорального введення. Також відносно кожного з вищезгаданих варіантів здійснення винаходу і їх варіантів, що стосується фармацевтичних композицій, фармацевтична композиція може використовуватися для попередження або лікування станів, опосередкованих DPP-IV, такого як діабет і, зокрема, цукровий діабет 2 типу; діабетична дисліпідемія; порушена толерантність до глюкози (ПТГ); порушена глікемія натщесерце (ПГН); метаболічний ацидоз; кетоз; регуляція апетиту; ожиріння; ускладнення, асоційовані з діабетом, включаючи діабетичну нейропатію, діабетичну ретинопатію і захворювання нирок; гіперліпідемія, включаючи гіпертригліцеридемію, гіперхолестеринемію, гіпоЛПВПемію і постпрандіальну гіперліпідемію; артеріосклероз; гіпертонія; інфаркт міокарда; стенокардія; інфаркт головного мозку, інсульт і метаболічний синдром. Комбінації сполуки I з одним або більше протидіабетичними або інкретиновими сполуками, іншими, ніж сполука I, мають чудові ефекти, такі як 1) посилення терапевтичних ефектів сполуки 3 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 I і/або протидіабетичних або інкретинових сполук; 2) зменшення побічних ефектів сполуки I і/або протидіабетичних або інкретинових сполук; і 3) зменшення дози сполуки I і/або протидіабетичних або інкретинових сполук. Відповідно, даний винахід включає способи введення сполуки I в комбінації з одним або більше протидіабетичними або інкретиновими сполуками і фармацевтичних композицій, що включають сполуку I разом з одним або більше іншими протидіабетичними або інкретиновими сполуками. Зазначено, що в даному описі забезпечено декілька різних діапазонів доз для певних протидіабетичних і інкретинових сполук. У рамки даного винаходу включені комбінації лікарських засобів, охоплюючі описані діапазони для сполуки I в комбінації з будь-яким з діапазонів доз, описаних в даному описі для інших протидіабетичних або інкретинових сполук. Відносно кожного з вищезгаданих варіантів здійснення винаходу і їх варіантів, що стосується способів і фармацевтичних композицій, що включають одну або більше протидіабетичних або інкретинових сполук, іншу, ніж сполука I, одну або більше протидіабетичних або інкретинових сполук можуть бути вибрані з будь-якої з множини відомих протидіабетичних засобів і інкретинових сполук. У одному варіанті, одна або більше протидіабетичних або інкретинових сполук, що використовуються в комбінації із сполукою I, можуть необов'язково бути вибрані з групи, що складається з модуляторів сигнального шляху інсуліну, сполук, що впливають на порушену продукцію глюкози печінкою, підсилювачів чутливості до інсуліну і підсилювачів секреції інсуліну. Одна або більше протидіабетичних або інкретинових сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути вибрані з групи, що складається з інгібіторів протеїнтирозинфосфатази, інгібіторів глютамін-фруктозо-6фосфатамідотрансферази, інгібіторів глюкозо-6-фосфатази, інгібіторів фруктозо-1,6бисфосфатази, інгібіторів глікогенфосфорилази, антагоністів рецепторів глюкагону, інгібіторів фосфоенолпіруваткарбоксикінази, інгібіторів піруватдегідрогенази кінази, інгібіторів альфаглюкозидази, інгібіторів спустошення шлунка, активаторів глюкокінази, агоністів рецепторів GLP1, агоністів рецепторів GLP-2, модуляторів UCP, модуляторів RXR, інгібіторів GSK-3, модуляторів PPAR, метформіну, інсуліну, α2-адренергічних антагоністів, деацетилаз (наприклад, резерватрол, агоніст сиртуїну, поліфеноли), і інгібіторів натрійзалежного транспорту глюкози (SGLT2). Одна або більше протидіабетичних або інкретинових сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути вибрані з групи, що складається з інгібіторів GSK-3, агоністів рецептора ретиноїдів Х, агоністів Beta-3 AR, модуляторів UCP, антидіабетичних тіазолідиндіонів, агоністів PPAR гамма неглітазонового типу, подвійних агоністів PPAR гамма/PPAR альфа, протидіабетичних сполук, що містять ванадій, і бігуанідів. Одна або більше протидіабетичних або інкретинових сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути тіазолідиндіонами, вибираними з групи, що складається з (S)-((3,4-дигідро-2-(фенілметил)-2Н-1-бензопіран-6-іл)метилтіазолідин2,4-діону, 5-{[4-(3-(5-метил-2-феніл-4-оксазоліл)-1-оксопропіл)феніл]метил}тіазолідин-2,4-діону, 5-{[4-(1-метилциклогексил)метокси)феніл]метил}тіазолідин-2,4-діону, 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діону, 5-{4-(2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діону, 5-(2-нафтилсульфоніл)тіазолідин-2,4-діону, біс{4[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метану, 5-{4-[2-(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діону, 5-[4-(1-феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діону, 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діону, 5-[3-(4-хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діону, 5-[3-(4-хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діону, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діону, 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діону, 5-{[4-((3,4-дигідро-6-гідрокси-2,5,7,8тетраметил-2Н-1-бензопіран-2-іл)метокси)феніл]метил}тіазолідин-2,4-діону, 5-[6-(2фторбензилокси)нафталін-2-ілметил]тіазолідин-2,4-діону, 5-([2-(2-нафтил)бензоксазол-5іл]метил}тіазолідин-2,4-діону і 5-(2,4-діоксотіазолідин-5-ілметил)-2-метокси-N-(4трифторметилбензил)бензаміду, включаючи їх будь-які фармацевтично прийнятні солі. У одному варіанті, одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, включають метформін. У одному певному варіанті метформін в цій комбінації включає одну або більше його фармацевтично прийнятних солей. У іншому певному варіанті метформін в цій комбінації включає сіль HCl метформіну. У ще одному певному варіанті метформін в цій комбінації вводять в добовій дозі від 125 до 2550 мг. У ще одному варіанті метформін в цій комбінації вводять в добовій дозі від 250 до 2550 мг. У інших варіантах 4 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 метформін в цій комбінації вводять в композиції негайного вивільнення або тривалого вивільнення. У іншому варіанті одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, включає одне або більш похідних сульфонілсечовини. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути вибрані з групи, що складається з глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі. У одному варіанті одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, включають глімепірид. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть бути вибрані з групи, що складається з інкретинових гормонів або їх імітаторів, антагоністів імідазолінових рецепторів бет-клітин і стимуляторів секреції інсуліну короткої дії. У іншому варіанті, одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, включають інсулін. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, можуть також необов'язково бути одним або більше за агоністами GLP-1, включаючи, наприклад, екзенатид. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути одним або більше агоністами GLP-2, включаючи, наприклад, людський рекомбінантний GLP-2. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, можуть також необов'язково бути одним або більше протидіабетичними похідними Dфенілаланіну. Один або більше протидіабетичних засобів, що використовуються в комбінації із сполукою I, можуть необов'язково бути вибрані з групи, що складається з репаглініду, мітиглініду і натеглініду, включаючи їх будь-які фармацевтично прийнятні солі. У одному варіанті, одна або більше протидіабетичних сполук, що вводяться в комбінації із сполукою I, включають гідрат кальцієвої солі мітиглініду. Однією або більше протидіабетичними сполуками, що використовуються в комбінації із сполукою I, можуть також необов'язково бути один або більше інгібіторів альфа-глюкозидази. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть бути вибрані з групи, що складається з акарбози, воглібози і міглітолу, включаючи їх будь-які фармацевтично прийнятні солі. У одному варіанті одна або більше протидіабетичних сполук, що вводяться в комбінації із сполукою I, включають воглібозу. У іншому варіанті воглібозу в цій комбінації вводять в добовій дозі від 0,1 до 1 мг. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути розиглітазоном, включаючи його будь-які фармацевтично прийнятні солі. У одному варіанті розиглітазон в цій комбінації включає малеатну сіль розиглітазону. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути тезаглітазаром, мураглітазаром або навеглітазаром, включаючи їх будь-які фармацевтично прийнятні солі. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково бути піоглітазоном, включаючи його будь-які фармацевтично прийнятні солі. У одному варіанті піоглітазон в цій комбінації включає HCl сіль піоглітазону. У іншому варіанті піоглітазон в цій комбінації вводять в добовій дозі від 7,5 до 60 мг. У ще одному варіанті піоглітазон в цій комбінації вводять в добовій дозі від 15 до 45 мг. Одна або більше протидіабетичних сполук, що використовуються в комбінації із сполукою I, також можуть необов'язково включати метформін і піоглітазон. У одному варіанті піоглітазон в цій комбінації включає одну або більш його фармацевтично прийнятних солей. У іншому варіанті піоглітазон в цій комбінації включає HCl сіль піоглітазону. У ще одному варіанті піоглітазон в цій комбінації вводять в добовій дозі від 7,5 до 60 мг. У ще одному варіанті піоглітазон в цій комбінації вводять в добовій дозі від 15 до 45 мг. У іншому варіанті кожного з вищезгаданих варіантів метформін в цій комбінації включає його одну або більше фармацевтично прийнятну сіль. У одному певному варіанті метформін в цій комбінації включає HCl сіль метформіну. У іншому певному варіанті метформін в цій комбінації вводять в добовій дозі від 125 до 2550 мг. У ще одному варіанті метформін в цій комбінації вводять в добовій дозі від 250 до 2550 мг. 5 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 Сполука I і фармацевтичні композиції, що включають сполуку I, можуть використовуватися для лікування ряду захворювань. У одному варіанті введення сполуки I або фармацевтичної композиції, що включає сполуку I, проводять для лікування у пацієнта патологічного стану діабету I типу або II типу. У іншому варіанті введення сполуки I або фармацевтичної композиції, що включає сполуку I, проводять для лікування пацієнтів з предіабетом. У ще одному варіанті введення сполуки I або фармацевтичної композиції, що включає сполуку I, проводять для лікування запального захворювання кишечника, хвороби Крона, ентериту, індукованого хіміотерапією, запалення слизової оболонки порожнини рота або синдрому короткої кишки. У ще одному варіанті введення сполуки I або фармацевтичної композиції, що включає сполуку I, проводять для підвищення приживлення після трансплантації кісткового мозку. У іншому варіанті введення сполуки I або фармацевтичної композиції, що включає сполуку I, проводять для лікування пацієнта, страждаючого від станів, опосередкованих DDP-IV, таких як діабет і точніше, цукровий діабет 2 типу; діабетична дисліпідемія; порушена толерантність до глюкози (ПТГ); порушена глікемія натщесерце (ПГН); метаболічний ацидоз; кетоз; регуляція апетиту; ожиріння; ускладнення, асоційовані з діабетом, включаючи діабетичну нейропатію, діабетичну ретинопатію і захворювання нирок; гіперліпідемія, включаючи гіпертригліцеридемію, гіперхолестеринемію, гіпоЛПВПемію і постпрандіальну гіперліпідемію; артеріосклероз; гіпертонія; інфаркт міокарда; стенокардія; інфаркт головного мозку; інсульт і метаболічний синдром. Крім того, сполука I і фармацевтичні композиції, що включають сполуку I, можуть використовуватися для попередження або лікування захворювань, опосередкованих DPP-IV, такого як діабет і точніше, цукровий діабет 2 типу; діабетична дисліпідемія; порушена толерантність до глюкози (ПТГ); порушена глікемія натщесерце (ПГН); метаболічний ацидоз; кетоз; регуляція апетиту; ожиріння; ускладнення, асоційовані з діабетом, включаючи діабетичну нейропатію, діабетичну ретинопатію і захворювання нирок; гіперліпідемія, включаючи гіпертригліцеридемію, гіперхолестеринемію, гіпоЛПВПемію і постпрандіальну гіперліпідемію; артеріосклероз; гіпертонія; інфаркт міокарда; стенокардія; інфаркт головного мозку; інсульт і метаболічний синдром. Також забезпечують набори, що включають декілька доз фармацевтичних композицій відповідно до даного винаходу. У одному варіанті набори додатково включають інструкції, які містять одну або більше форм інформації, вибраної з групи, що складається з вказівки патологічного стану, для лікування якого повинна вводитися фармацевтична композиція, інформацію по зберіганню фармацевтичної композиції, інформацію по дозуванню і інструкції, що стосуються того, як вводити фармацевтичну композицію. Також забезпечують вироби, що включають декілька доз фармацевтичної композиції відповідно до даного винаходу. У одному варіанті виробу додатково включають пакувальні матеріали, такі як контейнер для зберігання множини доз фармацевтичної композиції або ярлик, вказуючий на одне або більш з патологічного стану, для якого сполуку вводять, інформації про зберігання, інформацію по введенню і/або інструкцій, що стосуються того, як вводити композицію. Відповідно, даний винахід стосується [1] способу, що включає: введення пацієнту щотижневої дози більше ніж 250 мг сполуки I, де щотижневу дозу вводять один раз на тиждень, [2] способу за вищезазначеним [1], де щотижнева доза сполуки I, що вводиться пацієнту, становить щонайменше 275 мг, [3] способу за вищезазначеним [1], де щотижнева доза сполуки I, що вводиться пацієнту, становить щонайменше 300 мг, [4] способу за вищезазначеним [1], де щотижнева доза сполуки I, що вводиться пацієнту, становить щонайменше 350 мг, [5] способу за вищезазначеним [1], де щотижнева доза сполуки I, що вводиться пацієнту, становить щонайменше 400 мг, [6] способу за будь-яким з вищезазначених [1]-[5] де щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 500 мг, [7] способу за будь-яким з вищезазначених [1]-[4] де щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 400 мг, [8] способу за будь-яким з вищезазначених [1]-[3], де щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 350 мг, [9] способу за вищезазначеним [1], де щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 500 мг, 6 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 [10] способу за вищезазначеним [1], де щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 400 мг, [11] способу за будь-яким з вищезазначених [1]-[10], де сполуку I вводять у вигляді вільної основи, [12] способу за будь-яким з вищезазначених [1]-[10], де сполуку I вводять у вигляді фармацевтично прийнятної солі, [13] способу за будь-яким з вищезазначених [1]-[10], де сполуку I вводять у вигляді сукцинатної солі, [14] фармацевтичної композиції, складеної в лікарській формі, що містить разову дозу, що включає більше ніж 250 мг сполуки I, [15] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає щонайменше 275 мг сполуки I, [16] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає щонайменше 300 мг сполуки I, [17] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає щонайменше 350 мг сполуки I, [18] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає не більше ніж 500 мг сполуки I, [19] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає не більше ніж 400 мг сполуки I, [20] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає не більше ніж 350 мг сполуки I, [21] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає більше ніж 250 мг і не більше ніж 500 мг сполуки I, [22] фармацевтичної композиції за вищезазначеним [14], де лікарська форма, що містить разову дозу, включає більше ніж 250 мг і не більше ніж 400 мг сполуки I, [23] фармацевтичної композиції за будь-яким з вищезазначених [14]-[22], де сполука I присутня в фармацевтичній композиції у вигляді вільної основи, [24] фармацевтичної композиції за будь-яким з вищезазначених [14]-[22], де сполука I присутня в фармацевтичній композиції у вигляді фармацевтично прийнятної солі, [25] фармацевтичної композиції за будь-яким з вищезазначених [14]-[22], де сполука I присутня в фармацевтичній композиції в формі сукцинатної солі, [26] застосуванню сполуки I для одержання фармацевтичної композиції за будь-яким з вищезазначених [14]-[25], [27] способу лікування діабету, включаючому введення пацієнту щотижневої дози більше ніж 250 мг сполуки I, де щотижневу дозу вводять один раз на тиждень, [28] способу лікування раку, включаючому введення пацієнту щотижневої дози більш ніж 250 мг сполуки I, де щотижневу дозу вводять один раз на тиждень, [29] способу лікування аутоімунних розладів, включаючому введення пацієнту щотижневої дози більше ніж 250 мг сполуки I, де щотижневу дозу вводять один раз на тиждень, [30] способу лікування ВІЛ-інфекції, що включає введення пацієнту щотижневої дози більше ніж 250 мг сполуки I, де щотижневу дозу вводять один раз на тиждень, і подібне. Відносно всіх вищезазначених варіантів здійснення винаходу зазначено, що варіанти можуть бути інтерпретовані як відкриті в тому значенні, що способи можуть включати додаткові дії крім вказаних, включаючи введення пацієнту інших фармацевтично активних матеріалів. Подібним образом, якщо не указано інакше, фармацевтичні композиції, набори і вироби можуть додатково включати інші матеріали, включаючи інші фармацевтично активні матеріали. Короткий опис креслень На фіг. 1 проілюстроване інгібування DPP-IV в плазмі людей після однократного перорального введення сполуки I. На фіг. 2 проілюстроване інгібування DPP-IV в плазмі людей після однократного перорального введення сполуки I. Докладний опис винаходу Визначення Якщо не указане інакше, наступні терміни, що використовуються в описі і формулі винаходу, повинні мати наступні значення для цілей даної заявки. «Захворювання» специфічно включає будь-який стан нездоров'я тварини або його частини і включає стан нездоров'я, який може бути викликане або бути властивим медичній або 7 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 ветеринарній терапії, що застосовується у цієї тварини, тобто «побічні ефекти» такого лікування. «Фармацевтично прийнятний» означає, що він є застосовним для одержання фармацевтичної композиції, яка загалом є безпечною, нетоксичною і ні біологічно ні іншим чином небажаною і включає, що вона може бути прийнятною для ветеринарного застосування, а також фармацевтичного застосування у людей. «Фармацевтично прийнятні солі» означають солі, які є фармацевтично прийнятними, як визначено вище, і які мають бажану фармакологічну активність. Такі солі включають, але не обмежуються, адитивні солі кислот, одержані з неорганічними кислотами, такими як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і подібні; або з органічними кислотами, такими як оцтова кислота, трифтороцтова кислота, пропіонова кислота, гексанова кислота, гептанова кислота, циклопентанпропіонова кислота, гліколева кислота, піруватна кислота, молочна кислота, малонова кислота, янтарна кислота, яблучна кислота, малеїнова кислота, фумарова кислота, виннокаменна кислота, лимонна кислота, бензойна кислота, о-(4-гідроксибензоїл)бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, п-хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, п-толуолсульфонова кислота, камфорсульфонова кислота, 4-метилбіцикло[2.2.2]окт-2-ен-1-карбонова кислота, глюкогептонова кислота, 4,4' метиленбис(3-гідрокси-2-ен-1-карбонова кислота), 3-фенілпропіонова кислота, триметилоцтова кислота, третинна бутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глютамова кислота, гідроксинафтоєва кислота, саліцилова кислота, стеаринова кислота, муконова кислота і подібні. Фармацевтично прийнятні солі також включають, але не обмежуються, адитивні солі основ, які можуть бути утворені, коли присутні кислі протони здатні реагувати з неорганічними або органічними основами. Прийнятні неорганічні основи включають, але не обмежуються, гідроксид натрію, карбонат натрію, гідроксид калію, гідроксид алюмінію і гідроксид кальцію. Прийнятні органічні основи включають, але не обмежуються, етаноламін, діетаноламін, триетаноламін, трометамін, N-метилглюкамін і подібні. «Суб'єкт» і «пацієнт» включає людей і ссавців надлюдського роду (наприклад, собак, кішок, кроликів, велика рогата худоба, коней, овець, кіз, свиней, оленів і подібне) і нессавців (наприклад, птахів і подібних). «Терапевтично ефективна кількість» означає, що кількість сполуки, яка при введенні тварині для лікування захворювань досить для здійснення такого лікування захворювання. «Лікування» або «спосіб лікування» означає будь-яке введення терапевтично ефективної кількості сполуки і включає: (1) попередження розвитку захворювання у тварини, яка може бути схильна до захворювання, але ще не має історії або ознак патології або симптомів захворювання, (2) інгібування захворювання у тварини, яка має або виявляє ознаки патології або симптомів захворювання (тобто зупинка подальшого розвитку патології і/або патології), або (3) полегшення захворювання у тварини, яка має або виявляє ознаки патології або симптомів захворювання (тобто зворотний розвиток патології і/або симптомів). Докладний опис винаходу 1. 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2н-піримідин-1-ілметил]-4фторбензонітрил і його композиції Даний винахід загалом стосується введення 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо3,4-дигідро-2Н-піримідин-1-ілметил]-4-фторбензонітрилу («сполука I»), структура якого представлена нижче. У прикладі 1 описаний один спосіб синтезу сполуки I. Відмічено, що можуть бути використані інші способи для синтезу сполуки I в рамках розуміння звичайного фахівця в галузі техніки. Як детально описано нижче, сполука I має ефекти тривалого інгібування DPP-IV. Сполука I може вводитися в формі вільної основи, а також може вводитися в формі солей, гітратів і проліків, які перетворюються in vivo в форму вільної основи сполуки I. Наприклад, в 8 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 рамках даного винаходу знаходиться введення сполуки I у вигляді фармацевтично прийнятних солей, одержаних з різних органічних і неорганічних кислот і основ відповідно до методик, добре відомих в галузі техніки. Як використовується в даному описі, сполука I призначена для охоплення солей, гітратів і проліків сполуки I, якщо не указане інше. Фармацевтично прийнятна сіль сполуки I переважно має поліпшені фармакокінетичні властивості в порівнянні з формою вільної основи сполуки I. Фармацевтично прийнятні солі також можуть додавати бажані фармакокінетичні властивості сполуці I, яких вона раніше не мала, і навіть можуть позитивно впливати на фармакодинаміку сполуки відносно її терапевтичної активності в організмі. Певні приклади солей, гітратів і проліків сполуки I включають, але не обмежуються формами солей, утворених неорганічними або органічними кислотами, наприклад, галогенводні, такі як гідрохлорид, гідробромід і гідройодид; інші мінеральні кислоти і їх відповідні солі, такі як сульфат, нітрат, фосфат, і інш.; алкил і моноарилсульфонати, такі як етансульфонат, толуолсулфонат і бензолсульфонат; і інші органічні кислоти і їх відповідні солі, такі як ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, саліцилат і аскорбат. Додаткові адитивні солі кислот включають, але не обмежуються: адіпат, альгінат, аргінат, аспартат, бісульфат, бісульфіт, бромід, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, циклопентанпропіонат, диглюконат, дигідрофосфат, динітробензоат, додецилсульфат, фумарат, галактерат (з слизової кислоти), галактуронат, глюкогептаноат, глюконат, глютамат, гліцерофосфат, гемісукцинат, гемісульфат, гептаноат, гексаноат, гіпурат, гідрохлорид, гідробромід, гідройодид, 2-гідроксіетансульфонат, йодид, ізотіонат, с-бутират, лактат, лактобіонат, малат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногідрофосфат, 2-нафталінсульфонат, нікотинат, нітрат, оксалат, олеат, памоат, пектинат, персульфат, фенілацетат, 3-фенілпропіонат, фосфат, фосфонат і фталат. У певних варіантах сполуку I вводять у вигляді солі HCl, метансульфонату, сукцинату, бензоату, толуолсульфонату, R-(-)манделату або бензолсульфонату сполуки I. В прикладі 1 описано одержання різних сольових форм сполуки I, включаючи солі ТФО, HCl, бензойної, птолуолсульфонової, янтарної, R-(-)-мигдалевої і бензолсульфонової кислот. 2. Введення і застосування сполуки i Даний винахід загалом стосується способу, що включає введення сполуки I пацієнту в щотижневій дозі від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково від 50 мг/тиждень до 400 мг/тиждень сполуки I і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки I. Специфічні дозування, які можуть бути використані, включають, але не обмежуються 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 400 мг і 500 мг сполуки I в тиждень. Зазначено, що якщо особливим чином не указане інше, сполука I може вводитися в формі його вільної основи або у вигляді фармацевтично прийнятної солі. Однак, дозування і діапазони, вказане в даному описі, завжди основані на молекулярній масі форми вільної основи сполуки I. Даний винахід також стосується способу, що включає введення пацієнту сполуки I в щотижневій дозі більше ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I і необов'язково щонайменше 400 мг сполуки I. В одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 500 мг. У іншому варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 400 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 350 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 500 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 400 мг. У інших варіантах пацієнту вводять щотижневу дозу 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I. Відмічено, що якщо особливим чином не указане інше, сполука I може вводитися в формі вільної основи або у вигляді фармацевтично прийнятної солі. Однак, дозування і діапазони, представлені в даному описі, основані на молекулярній масі форми вільної основи сполуки I. Сполука I може вводитися за допомогою будь-якого шляху введення. У певних варіантах здійснення винаходу, однак, спосіб за даним винаходом являє собою пероральне введення сполуки I. Такий тип введення є переважним, оскільки він легкий і може використовуватися пацієнтом самостійно. Сполука I можна вводити один або більше разів в тиждень. Перевагою даного винаходу, однак, є те, що сполука I може ефективно вводитися в дозуванні, вказаному в даному описі, 9 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 один раз на тиждень і також може вводитися у вигляді лікарської форми, що містить разову дозу, один раз на тиждень. Через можливість введення сполуки I в дозуванні, вказаному в даному описі, тільки один раз на тиждень і перорально, для пацієнтів полегшується самостійне введення сполуки I, що поліпшує прихильність до лікування серед пацієнтів, яким потрібно інгібування активності DPP-IV in vivo. Переважно, сполука I придатна для тривалого безперервного застосування і може вводитися пацієнтам протягом тривалого періоду часу. Відповідно, може здійснюватися спосіб, коли сполуку I вводять пацієнту кожний тиждень (необов'язково 1 разів щотижня) протягом періоду щонайменше 1 місяці, необов'язково протягом щонайменше 2 місяців, необов'язково протягом щонайменше 3 місяців і, якщо необхідно, необов'язково протягом тривалості течії захворювання пацієнтів. Переважно, сполуку I можна вводити в будь-який час протягом дня. Необов'язково, сполуку I вводять один раз на тиждень, коли введення здійснюють вранці перед їжею. Оскільки сполука I може стимулювати секрецію інсуліну, коли рівень глюкози крові досягає 100 мг/дл і вище, може бути корисним мати сполуку I в системній циркуляції перед виникаючим постпрандіально підвищенням рівня глюкози в крові. Сполука I може вводитися будь-якому пацієнту, який одержує користь від курсу лікування, що приводить до зменшення активність DPP-IV in vivo. Як детально описано нижче, на фіг. 1 і 2 проілюстрований ефект, що спостерігається, як введення сполуки I впливає на активність DPPIV в людській плазмі після однократного перорального введення. Як може бути видно з даних, показаних на фіг. 1, шляхом введення сполуки I в дозі, вказаній в даному описі, сполука I може ефективно використовуватися при патологічних станах, де бажано знизити активність DPP-IV плазми. У світлі представлених даних вважають, що коли щонайменше 12,5 мг сполуки I вводять пацієнту, активність DPP-IV в плазмі пацієнта може знижуватися на більше ніж 10% відносно вихідного протягом періоду щонайменше 168 годин після введення; коли щонайменше 50 мг сполуки I вводять пацієнту, активність DPP-IV плазми пацієнта може бути знижена більш ніж на 35% відносно початкового протягом періоду щонайменше 168 годин після введення; і коли 200 мг або 400 мг сполуки I вводять пацієнту, активність DPP-IV в плазмі пацієнта може бути знижена більше ніж на 70% відносно початкового протягом періоду щонайменше 168 годин після введення. Приклади певного свідчення для введення сполуки I включають, але не обмежуються, попередження, сповільнення прогресування і/або лікування станів, опосередкованих DPP-IV, зокрема, діабету і точніше, цукрового діабету 2 типу, діабетичної дисліпідемії, порушеної толерантності до глюкози (ПТГ), порушеної глікемії натщесерце (ПГН), метаболічного ацидозу, кетозу, регуляції апетиту, ожиріння і ускладнень, асоційованого з діабетом, включаючи діабетичну нейропатію, діабетичну ретинопатію, запальні захворювання кишечника, хворобу Крона, ентерит, індукований хіміотерапією, запалення слизової оболонки порожнини рота, синдром короткої кишки і захворювання нирок. Стани, опосередковані DPP-IV, включають гіперліпідемію, таку як гіпертригліцеридемія, гіперхолестеринемія, гіпоЛПВПемія і постпрандіальна гіперліпідемія; артеріосклероз; гіпертонія; інфаркт міокарда, стенокардія, інфаркт головного мозку, інсульт і метаболічний синдром. Вважають, що введення сполуки I пацієнтам з діабетом I або II типу після мінімального лікування протягом щонайменше 30 днів поліпшить один або більше серцево-судинних показників. Також вважають, що введення сполуки I в комбінації з одним або більше протидіабетичними або інкретиновими сполуками пацієнтам з діабетом I або II типу після мінімального лікування протягом щонайменше 30 днів поліпшить один або більше серцевосудинних показників. Приклади серцево-судинних показників, які можуть бути поліпшені, включають, але не обмежуються зниженням середнього систолічного артеріального тиску, збільшенням холестерину ЛПВП, поліпшенням співвідношення ЛПНП/ЛПВП і зниженням тригліцеридів. Також вважають, що введення сполуки I в комбінації з одним або більше протидіабетичними або інкретиновими сполуками пацієнтам із запальними захворюваннями шлунково-кишкового тракту (включаючи, але, не обмежуючись, запальні захворювання кишечника, хвороба Крони, ентерит, індукований хіміотерапією, запалення слизової оболонки порожнини рота і синдром короткої кишки) після мінімального лікування протягом щонайменше 30 днів поліпшить стан слизової оболонки шлунково-кишкового тракту. Поліпшення стану слизової оболонки шлунковокишкового тракту може бути продемонстроване за допомогою, але не обмежене, збільшенням площі поверхні кишечника, зменшенням запалення і/або збільшенням всмоктування поживних речовин. 10 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 Введення сполуки I один раз на тиждень в дозуванні, вказаному в даному описі, пацієнту з діабетом 2 типу також може бути корисним. Пацієнти, одержуючі сполуку I, також можуть мати порушення секреції інсуліну острівцями підшлункової залоза швидше, ніж пацієнти, у яких розвинулася інсулінорезистентність в периферичних інсуліночутливих тканинах/органах. Переважно, введення сполуки I один раз на тиждень в дозуванні, вказаному в даному описі, також може використовуватися для лікування пацієнтів, у яких є предіабет. Вважають, що введення сполуки I пацієнту, який має предіабет, служить для сповільнення розвитку у такого пацієнта діабету II типу. Постійне підвищення глюкози крові десенсибілізує функцію острівців підшлункової залоза і порушує секрецію інсуліну. Шляхом поліпшення рівня циклічної АМФ і динаміки кальцію в бета клітинах, клітини активують гени, поновлюючі пошкоджені компоненти бета клітин, і є менш схильними глюкозотоксичності. Чекають, що введення сполуки I один раз на тиждень в дозуванні, вказаному в даному описі, володіє діапазоном бажаних біологічних ефектів in vivo. Наприклад, введення сполуки I один раз на тиждень в дозуванні, вказаному в даному описі, при порівнянні з плацебоконтролем знижує рівень глюкози крові пацієнта. Таке зниження постпрандіального рівня глюкози крові допомагає пацієнтам з діабетом підтримувати більш низький рівень глюкози крові. При введенні сполуки I один раз на тиждень в дозуванні, вказаному в даному описі, також чекають одержати ефект підвищення рівня інсуліну пацієнта або чутливості до інсуліну. Інсулін полегшує надходження глюкози в м'язи, жирову і деякі інші тканини. Механізм, за допомогою якого клітини можуть споживати глюкозу, здійснюється шляхом полегшеної дифузії при стимуляції рецепторів інсуліну. С-пептид і інсулін є білковими ланцюгами, створеними активацією і розподілом проінсуліну (неактивного попередника інсуліну). С-пептид і інсулін створюються і зберігаються в бета клітинах підшлункової залози. Коли інсулін вивільняється в кровотік, також вивільняється така ж кількість С-пептиду. Це робить С-пептид корисним як маркер продукції інсуліну. Чекають, що введення сполуки I відповідно до винаходу збільшить рівень С-пептиду пацієнта. Також чекають, що введення сполуки I один раз на тиждень в дозуванні, вказаному в даному описі, після тривалого лікування сполукою I має ефект зниження рівня гемоглобіну А1с пацієнта більше ніж на 0,5% при порівнянні з плацебоконтролем. Також чекають, що, крім того, введення сполуки I один раз на тиждень в дозуванні, вказаному в даному описі, володіє ефектом зниження рівня гемоглобіну А1с пацієнта більше ніж на 0,2% при порівнянні з плацебоконтролем після тривалого лікування сполукою I. Відомо, що значення Hb-A1c прямо пропорційні концентрації глюкози в крові протягом тривалості життя еритроцитів. Отже, Hb-A1c вказує на рівень глюкозу крові пацієнтів протягом попередніх 90 днів, в більшій мірі в останні 30 днів. Отже, зниження гемоглобіну А1с пацієнта, що спостерігається підтверджує тривале зниження рівня глюкози крові пацієнта внаслідок введення сполуки I один раз в доби в дозуванні, вказаному в даному описі. 3. Комбінована терапія, що включає сполуку I Даний винахід також стосується застосування сполуки I в комбінації з одним або більше іншими протидіабетичними і/або інкретиновими сполуками. Приклади таких інших протидіабетичних сполук включають, але не обмежуються, модулятори сигнального шляху інсуліну, як інгібітори протеїнтирозинфосфатази (РТРази) і інгібітори глютамін-фруктозо-6фосфатамідотрансферази (GFAT); сполуки, що впливають на порушену продукцію глюкози печінкою, як інгібітори глюкозо-6-фосфатази (G6Pази), інгібітори фруктозо-1,6-бісфосфатази (F1,6-BPази), інгібітори глікогенфосфорилази (GP), антагоністи рецепторів глюкагону і інгібітори фосфоенолпіруваткарбоксикінази (PEPCK); інгібітори піруватдегідрогенази кінази (PDHK); підсилювачі чутливості до інсуліну (сенситайзери інсуліну); підсилювачі секреції інсуліну (секретагоги інсуліну); інгібітори альфа-глюкозидази; інгібітори спустошення шлунка; активатори глюкокінази, агоністи рецепторів GLP-1, агоністи рецепторів GLP-2, модулятори UCP, модулятори RXR, інгібітори GSK-3, модулятори PPAR, метформін, інсулін; і α2- адренергічні антагоністи. Сполука I може вводитися з такою щонайменше одною протидіабетичною сполукою або одночасно у вигляді однократної дози, одночасно в окремих дозах або послідовно (тобто коли один вводять до або після введення іншого). Приклади інгібіторів РТРази, які можуть використовуватися в комбінації із сполукою I, включають, але не обмежуються описаними в патентах США №№ 6057316, 6001867 і РСТ публікаціях №№ WO99/58518, WO 99/58522, WO 99/46268, WO 99/46267, WO 99/46244, WO99/46237, WO 99/46236 і WO 99/15529. Приклади інгібіторів GFAT, які можуть бути використані в комбінації із сполукою I, включають, але не обмежуються описаними в Mol. Cell. Endocrinol. 1997, 135(1), 67-77. 11 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади інгібіторів G6Pази, які можуть бути використані в комбінації із сполукою I, включають, але не обмежуються описаними в РСТ публікаціях №№ WO 00/14090, WO99/40062 і WO 98/40385, Європейської патентної публікації № EP682024 і Diabetes 1998, 47, 1630-1636. Приклади інгібіторів F-1,6-BPази, які можуть бути використані в комбінації із сполукою I, включають, але не обмежуються описаними в РСТ публікації №№ WO 00/14095, WO 99/47549, WO 98/39343 і WO 98/39342. Приклади інгібіторів GP, які можуть бути використані в комбінації із сполукою I, включають, але не обмежуються описаними в патенті США № 5998463, РСТ публікації №№ WO 99/26659, WO 97/31901, WO 96/39384 і WO9639385 і Європейської патентної публікації №№ ЕР978279 і ЕР 846464. Приклади антагоністів рецепторів глюкагона, які можуть використовуватися в комбінації із сполукою I, включають, але не обмежуються описаними в патентах США №№ 5880139 і 5776954, РСТ публікаціях №№ WO 99/01423, WO 98/22109, WO98/22108, WO 98/21957, WO 97/16442 і WO 98/04528 і описаними в Bioorg Med. Chem. LEtt 1992, 2, 915-918, J.Med. Chem. 1998, 41, 5150-5157 і J. Biol. Chem. 1999, 274, 8694-8697. Приклади інгібіторів PEPCK, які можуть використовуватися в комбінації із сполукою I, включають, але не обмежуються описаними в патенті США № 6030837 і Mol.Biol. Diabetes 1994, 2, 283-99. Приклади інгібіторів PDHK, які можуть використовуватися в комбінації із сполукою I, включають, але не обмежуються описаними в J. Med. Chem. 42 (1999) 2741-2746. Приклади підсилювачів чутливості до інсуліну, які можуть бути використані в комбінації із сполукою I, включають, але не обмежуються, інгібітори GSK-3, агоністи рецепторів ретиноїду Х (RXR), агоністи Бета-3 AR, модулятори UCP, протидіабетичні тіазолідиндіони (глітазони), агоністи PPAR гамма неглітазонового типу, подвійні агоністи PPAR гамма/PPAR альфа, протидіабетичні сполуки, що містять ванадій, і бігуаніди, такі як метформін. Приклади інгібіторів GSK-3 включають, але не обмежуються описаними в РСТ публікаціях №№ WO 00/21927 і WO 97/41854. Приклади модуляторів RXR включають, але не обмежуються описаними в патентах США №№ 4981784, 5071773, 5298429 і 5506102 і РСТ публікаціях №№ WO89/05355, WO91/06677, WO92/05447, WO93/11235, WO95/18380, WO94/23068 і WO93/23431. Приклади агоністів Бета-3 AR включають, але не обмежуються CL-316243 (Lederle Laboratories) і описаними в патенті США № 5705515 і РСТ публікації №№ WO99/29672, WO 98/32753, WO 98/20005, WO 98/09625, WO 97/46556 і WO 97/37646. Приклади модуляторів UCP включають агоністи UCP-1, UCP-2 і UCP-3. Приклади модуляторів UCP включають, але не обмежуються описаними в Vidal-Puig et al., Biochem. Biophys. Res. Commun., Vol. 235(1) pp.79-82 (1997). Приклади протидіабетичних, тих, що модулюють PPAR тіазолідиндіонів (глітазоноів) включають, але не обмежуються, (S)-((3,4-гідидро-2-(фенілметил)-2Н-1-бензопіран-6іл)метилтіазолідин-2,4-діон (енглітазон), 5-{[4-(3-(5-метил-2-феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діон (дарглітазон), 5-{[4-(1метилциклогексил)метокси)феніл]метил}тіазолідин-2,4-діон (циглітазон), 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон (DRF2189), 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}-тіазолідин-2,4-діон (BM-13.1246), 5-(2-нафтилсульфоніл)тіазолідин2,4-діон (AY-31637), біс{4-[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метан (YM268), 5-{4-[2-(5метил-2-феніл-4-оксазоліл)-2-гідроксіетокси]бензил}тіазолідин-2,4-діон (AD-5075), 5-[4-(1-феніл1-циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діон (DN-108), 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон (розиглітазон), 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон, що є на ринку під торговим найменуванням ACTOSTM), 5-[6-(2-фторбензилокси)нафталін-2-ілметил]тіазолідин-2,4-діон (MCC555), 5-([2-(2-нафтил)бензоксазол-5-іл]метил}тіазолідин-2,4-діон (Т-174), едаглітазон (BM13-1258), ривоглітазон (CS-011) і 5-(2,4-діоксотіазолідин-5-ілметил)-2-метокси-N-(4трифторметилбензил)бензамід (KRP297). Приклади агоністів PPAR гамма неглітазонового типу включають, але не обмежуються аналогами N-(2-бензоїлфеніл)-L-тирозину, таким як GI-262570, регліксан (JTT501) і FK-614 і метаглідазен (MBX-102). Приклади подвійних агоністів PPAR гамма/PPAR альфа включають, але не обмежуються омега-[(оксохіназолінілалкокси)феніл]алканоатами і їх аналогами, включаючи описані в РСТ 12 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 публікації № WO 99/08501 і Diabetes 2000, 49(5), 759-767; тезаглітазар, мураглітазар і навеглітазар. Приклади протидіабетичних сполук, що містять ванадій, включають, але не обмежуються описаними в патенті США № 5866563. Метформін (диметилдигуанід) і його сіль гідрохлорид є на ринку під торговим найменуванням GLUCOPHAGETM. Приклади підсилювачів секреції до інсуліну включають, але не обмежуються антагоністами рецепторів глюкагону (як описані вище), похідними сульфонілсечовини, інкретиновими гормонами або їх імітаторами, особливо агоністами глюкагоноподібного пептиду-1 (GLP-1) або агоністами GLP-1, антагоністами імідазолінових рецепторів бета-клітин і стимуляторами секреції інсуліну короткої дії, як протидіабетичні похідні фенілоцтової кислоти, протидіабетичні похідні D-фенілаланіну і мітиглінід і його фармацевтично прийнятні солі. Приклади похідних сульфонілсечовини включають, але не обмежуються глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид. Толбутамід, глібенкламід, гліклазид, гліборнурид, гліквідон, глізоксепид і глімепірид можуть вводитися в формі, в якій вони є на ринку під торговими найменуваннями RASTINON HOECHSTTM, AZUGLUCONTM, DIAMICRONTTM, GLUBORIDTM, GLURENORMTM, PRODIABANTM і AMARYLTM, відповідно. Приклади агоністів GLP-1 включають, але не обмежуються описаними в патентах США №№ 5120712, 5118666 і 5512549 і РСТ публікаціях № WO 91/11457. Зокрема агоністи GLP-1 включають такі сполуки як GLP-1 (7-37), в якому карбоксикінцева амідна функціональна група Arg36 замінена Gly в 37 положенні молекули GLP-1 (7-36)NH2 і його варіанти і аналоги, включаючи GLN9-GLP-1 (7-37), D-GLN9-GLP-1 (7-37), ацетил LYS9-GLP-1 (7-37), LYS18-GLP-1 (7-37) і, зокрема, GLP-1 (7-37)OH, VAL8-GLP-1 (7-37), GLY8-GLP-1 (7-37), THR8-GLP-1 (7-37), GLP-1 (7-37) і 4-імідазопропіонил-GLP-1. Одним певним прикладом агоніста GLP-1 є Екзенатід, пептидний амід з 39 амінокислот, який є на ринку під торговим найменуванням BYETTATM. Екзенатид має емпіричну формулу C184H282N50O60S і молекулярну масу 4186,6 дальтон. Амінокислотна послідовність Екзенатіда є наступною: H-His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-S. Приклади глюкагоноподібного пептиду-2 (GLP-2) або агоністів GLP-2 включають, але не обмежуються описаними в патенті США № 7056886 і РСТ публікаціях №№ WO 00/53208, WO 01/49314 і WO 03/099854. Одним певним прикладом агоніста GLP-2 є TEDUGLUTIDETM пептидний амід з 39 амінокислот (NPS Pharmaceuticals, Inc.). Приклади антагоністів імідазолінових рецепторів бета клітин включають, але не обмежуються описаними в РСТ публікації № WO 00/78726 і J.Pharmacol. Exp. Ther. 1996; 278; 82-89. Прикладом протидіабетичного похідного фенілоцтової кислоти є репаглінід і його фармацевтично прийнятні солі. Приклади протидіабетичних похідних D-фенілаланіна включають, але не обмежуються натеглінідом (N-[(транс-4-ізопропілциклогексил)карбоніл]-D-фенілаланін, ЕР 196222 і ЕР 526171) і репаглінідом (S-2-етокси-4-{2-[(3-метил-1-[2-(1-піперидиніл)феніл]бутил]аміно]-2оксоетил}бензойна кислота, ЕР 0147850 А2 і ЕР 0207331 А1). Натеглінід включає певні кристалічні форми (поліморфи), описані в патенті США № 5488510 і європейській патентній заявці № ЕР 0526171 В1. Репаглінід і натеглінід можуть вводитися в формі, в якій вони є на ринку під торговими найменуваннями NOVONORMTM і STARLIXTM, відповідно. Приклади інгібіторів альфа-глюкозидази включають, але не обмежуються акарбозою, N-(1,3дигідрокси-2-пропіл)валіоламіном (воглібоза) і похідним 1-дезоксинойриміцину міглітолом. Акарбоза являє собою 4'', 6''-дидезокси-4'[(1S)-(1,4,6/5)-4,5,6-тригідрокси-3-гідроксиметил-2циклогексеніламіно)мальтотриозу. Структура акарбози може також бути описана як О-4,6дидезокси-{[1S, 4R, 5S, 6S]-4,5,6-тригідрокси-3-(гідроксиметил)-2-циклогексен-1-іл]аміно)альфаD-глюкопіранозил-(1-4)-О-альфа-D-глюкопіранозил-(1-4)-D-глюкопіраноза (патент США № 4062950 і європейська патентна заявка № 0226121). Акарбоза і міглітол можуть вводитися в формах, в яких вони є на ринку під торговими найменуваннями GLUCOBAYTM і DIASTABOL 50TM, відповідно. Приклади інгібіторів спустошення шлунку, інші, ніж GLP-1, включають, але не обмежуються описаними в J.Clin. Endocrinol. Metab. 2000, 85(3), 1043-1048, і Diabetes Care 1998; 21; 897-893, особливо Амілін і його аналоги, такі як прамлінтид. Амілін описаний в Diabetologia 39, 1996, 492499. 13 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади α2-адренергічних антагоністів включають, але не обмежуються мідаглізолом, який описаний в Diabetes 36, 1987, 216-220. Інсулін, який може використовуватися в комбінації із сполукою I, включає, але не обмежується препаратами тваринного інсуліну, екстрагованими з підшлункової залоза бика і свині; препаратами людського інсуліну, генетично синтезованими з використанням Escherichia coli або дріжджів; цинк інсуліном; протамін цинк інсуліном; фрагментом або похідним інсуліну (наприклад, INS-1) і пероральними препаратами інсуліну. У одному певному варіанті здійснення винаходу протидіабетичну сполуку, що вводиться в комбінації із сполукою I, вибирають з групи, що складається з натеглініду, мітиглініду, репаглініду, метформіну, екзенатиду, розиглітазону, тезаглітазару, піоглітазону, глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі. Приклади препаратів і композицій інгібіторів РТРази, інгібіторів GSK-3, ненизкомолекулярних імітуючих з'єднань, інгібіторів GFAT, інгібіторів G6Pази, антагоністів рецепторів глюкагону, інгібіторів PEPCK, інгібіторів F-1,6-BPази, інгібіторів GP, модуляторів RXR, агоністів Бета-3 AR, інгібіторів PDHK, інгібіторів спустошення шлунка і модуляторів UCP описані в патентах, заявках і посиланнях, представлених в даному описі. У випадку комбінованої терапії із сполукою I інші протидіабетичні сполуки можуть вводитися (наприклад, шлях і дозування) чином, відомим для таких сполук. Сполуки I і інші протидіабетичні сполуки можуть вводитися послідовно (тобто окремо) або в один і той же час, або один після іншого в двох окремих лікарських формах або в одній комбінованій, лікарській формі, що містить разову дозу. У одному певному варіанті здійснення винаходу іншу протидіабетичну сполуку вводять із сполукою I у вигляді комбінованої лікарської форми, що містить разову дозу. Доза протидіабетичної сполуки може бути вибрана з діапазону, відомого як клінічно що використовується для такої сполуки. Будь-яка терапевтична сполука для лікування ускладнень діабету, антигіперліпідемическі сполуки, сполуки проти ожиріння або антигіпертензивні сполуки можуть використовуватися в комбінації із сполукою I таким же чином, як вищезгадані протидіабетичні сполуки. Приклади терапевтичних сполук для лікування ускладнень діабету включають, але не обмежуються інгібіторами альдозоредуктази, такими як толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, СТ-112 і ранірестат; нейротрофічними чинниками і сполуками, що підвищують їх, такими як NGF, NT-3, BDNF і підсилювачами продукції-секреції нейротрофіну, описаними в WO01/14372 (наприклад, 4-(4хлорфеніл)-2-(2-метил-1-імідазоліл)-5-[3-(2-метилфенокси)пропіл]оксазол); стимуляторами нейроногенезу, такими як Y-128; інгібіторами РКС, такими як рубоксистаурин мезилат; інгібіторами AGE, такими як ALT946, пімагедин, бромід N-фенацилтіазолію (ALT766), ALT-711, EXO-226, піридорін і піридоксамін; поглиначами реактивних форм кисню, такими як тіоктова кислота; засобами, що розширюють судини головного мозку, такими як тіаприд і мексилетин; агоністами рецепторів соматостатину, такими як BIM23190; і інгібіторами кінази-1, регулюючої сигнал апоптозу (ASK-1). Приклади антигіперліпідемических сполук включають, але не обмежуються інгібіторами HMG-CoA редуктази, такими як правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, розувастатин і пітавастатин; інгібіторами скваленсинтази, такими як сполуки, описані в WO 97/10224 (наприклад, N-[(3R, 5S)[-1-(3ацетокси-2,2-диметилпропіл)-7-хлор-5-(2,3-диметоксифеніл)-2-оксо-1,2,3,5-тетрагідро-4,1бензоксазепин-3-іл]ацетил]піперидин-4-оцтова кислота); фібратними сполуками, такими як безафібрат, клофібрат, симфібрат і клинофібрат; інгібіторами АСАТ, такими як авасиміб і ефлусиміб; аніонообмінними смолами, такими як колестирамін; пробукол; препаратами нікотинової кислоти, такими як нікомол і нісеритрол; етилікозапентат; і рослинними стеринами, такими як сойстерин і γ-оризанол. Приклади препаратів від ожиріння включають, але не обмежуються, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс; антагоністи рецепторів МСН, такі як SB-568849 і SNAP-7941; антагоністи нейропептиду Y, такі як СР-422935; антагоністи канабіноїдних рецепторів, такі як SR-141716 і SR-147778; антагоністи греліну; інгібітори 11гідроксистероїддегідрогенази, такі як BVT-3498; інгібітори панкреатичної ліпази, такі як орлістат і ATL-962; агоністи Бета-3 AR, такі як AJ-9677; пептидні аноректики, такі як лептин і CNTF (війчастий нейротропний чинник); агоністи холецистокініну, такі як лінтитрипт і FPL-15849; і засоби, стримуючі апетит, такі як Р-57. Приклади антигіпертензивних сполук включають інгібітори ангіотензинперетворюючого ферменту, такі як каптоприл, еналаприл і делаприл; антагоністи ангіотензину II, такі як кандесартан цилексетил, лозартан, епросартан, валсартан, телмісартан, ірбесартан, олмесартан медоксоміл, тазосартан і 1-[[2'-(2,5-дигідро-5-оксо-4Н1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил]-2-етокси-1Н-бензімідазол-7-карбонова кислота; 14 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 блокатори кальцієвих каналів, такі як манідипін, ніфедипін, нікардипін, амлодипиін і ефонідипін; засоби, що відкривають калієві канали, такі як левкромакалім, L-27152, AL0671 і NIP-121; клонідин; деацетилази, такі як резерватрол, агоністи сиртуїну; поліфеноли; агоністи MCR4; інгібітори натрій-залежного транспорту глюкози (SGLT2). Структури активних речовин, вказаних в даному описі кодовими номерами, генеричними або торговими найменуваннями, можуть бути одержані з останнього видання стандартного каталогу «The Merck Index» або з баз даних, наприклад, Міжнародних патентів (наприклад, IMS World Publications). Їх відповідний зміст таким чином включений у вигляді посилання. Будь-який фахівець в галузі техніки повністю здатний визначити активні речовини і, на основі таких посилань, також здатний одержати і дослідити фармацевтичні показники і властивості в стандартних моделях, що тестуються, і in vitro і in vivo. 4. Композиції, що включають сплуку I Сполука I може бути включена в фармацевтичну композицію, адаптовану для різних шляхів введення. Наприклад, сполука I може міститися в фармацевтичній композиції, придатній для введення шляхом, вибираним з групи, що складається з перорального, парентерального, внутрішньочеревинного, внутрішньовенного, інтраартеріального, черезшкірного, сублінгвального, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомального, введення за допомогою інгаляції, вагінального, інтраокулярного, за допомогою місцевого введення (наприклад, за допомогою катетера або стенту), підшкірного, введення в жирову тканину, введення в суглоб, інтраперитонеального і інтратекального введення. Як така, сполука I може бути рецептована у множині фармацевтично прийнятних композицій, включаючи ін'єкційні форми (наприклад, підшкірні, внутрішньовенні, внутрішньом'язові і інтраперитонеальні ін'єкції), краплинні інфузії, форми для зовнішнього нанесення (наприклад, препарати назальних спреїв, трансдермальні препарати; мазі і інш.) і супозиторії (наприклад, ректальні і вагінальні супозиторії). Такі різні фармацевтично прийнятні сполуки можуть бути одержані відомими методиками, що звичайно використовуються в фармацевтичній промисловості з фармацевтично прийнятним носієм, що звичайно використовується в фармацевтичній промисловості. Як використовується в даному описі, композиція, що включає сполуку I, охоплює форми вільної основи сполуки I, солі, гідрати і проліки сполуки I, а також інші матеріали, які можуть бути включені в такі композиції для призначених цілей, включаючи інші активні інгредієнти, якщо не указане інше. Певні сольові форми сполуки I, які можуть використовуватися, включають, але не обмежуються солі HCl, метансулфонат, сукцинат, бензоат, толуолсульфонат, R-(-)манделат або бензолсульфонат сполуки I. Як указано вище, сполука I може переважно використовуватися при введенні пацієнту в щотижневій дозі від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень, необов'язково, від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково, від 50 мг/тиждень до 400 мг/тиждень сполуки I і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки I. Специфічні дозування, які можуть використовуватися, включають, але не обмежуються, 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 400 мг і 500 мг сполуки I в тиждень. Як також відмічено вище бажано вводити сполуку I один раз на тиждень. Відповідно, фармацевтичні композиції за даним винаходом можуть бути в лікарській формі, що містить разову дозу, що включає від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень, необов'язково, від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково, від 50 мг/тиждень до 400 мг/тиждень сполуки I і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки I. В специфічних варіантах здійснення винаходу фармацевтична композиція включає 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 400 мг і 500 мг сполуки I. В кожному випадку представлене дозування і діапазони сполуки I основані на молекулярній масі форми вільної основи сполуки I. Сполука I також може переважно використовуватися при введенні пацієнту в щотижневій дозі більше ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I і необов'язково щонайменше 400 мг сполуки I. В одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 500 мг. У іншому варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 400 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить не більше ніж 350 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить більше ніж 250 мг і не більше ніж 500 мг. У ще одному варіанті щотижнева доза сполуки I, що вводиться пацієнту, становить 15 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше ніж 250 мг і не більше ніж 400 мг. Специфічне дозування, яке може використовуватися, включає, але не обмежується, 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I в тиждень. У кожному випадку представлене дозування і діапазони сполуки I основані на молекулярній масі форми вільної основи сполуки I. Як також відмічено вище бажано вводити сполуку I один раз на тиждень. Відповідно, фармацевтичні композиції за даним винаходом можуть бути в лікарській формі, що містить разову дозу, що включає дозу від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень, необов'язково від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково від 50 мг/тиждень до 400 мг/тиждень сполуки I і необов'язково від 100 мг/тиждень до 400 мг/тиждень з'єднання. У інших варіаціях, фармацевтична композиція включає 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I. В кожному випадку представлене дозування і діапазони сполуки I основані на молекулярній масі форми вільної основи сполуки I. Фармацевтичні композиції за даним винаходом також можуть бути в лікарській формі, що містить разову дозу, що включає дозу більше ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I і необов'язково щонайменше 400 мг сполуки I. В одному варіанті, фармацевтична композиція включає не більше ніж 500 мг сполуки I. В іншому варіанті фармацевтична композиція включає не більше ніж 400 мг сполуки I. В інших варіантах фармацевтична композиція включає не більше ніж 350 мг сполуки I. В ще одному варіанті фармацевтична композиція включає більше ніж 250 мг і не більше ніж 500 мг сполуки I. В додатковому варіанті фармацевтична композиція включає більше ніж 250 мг і не більше ніж 400 мг сполуки I. В інших варіантах фармацевтична композиція включає 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I. В кожному випадку дозування, що забезпечується і діапазони сполуки I основані на молекулярній масі форми вільної основи сполуки I. Як також відмічено вище, сполука I може переважно використовуватися при пероральному введенні. Відповідно, композиції за даним винаходом можуть необов'язково бути пристосовані для перорального введення. У одному варіанті така фармацевтична композиція є твердою композицією, призначеною для перорального введення. У цьому відношенні композиція, наприклад, може бути в формі таблетки або капсули. У іншому варіанті така фармацевтична композиція являє собою рідку композицію, призначену для перорального введення. Як також відмічено вище, сполука I може переважно використовуватися при введенні парентерально. Відповідно, композиції за даним винаходом можуть необов'язково бути пристосовані для парентерального введення. У одному варіанті така фармацевтична композиція являє собою композицію розчину, призначеного для парентерального введення. У іншому варіанті така фармацевтична композиція являє собою композицію суспензії, призначеної для парентерального введення. Як відмічено вище, сполука I може переважно використовуватися в комбінації з одним або більше протидіабетичними і/або інкретиновими сполуками. Відповідно, композиції за даним винаходом можуть необов'язково включати сполуку I в комбінації з одним або більше протидіабетичними засобами або інкретиновими сполуками в комбінованій лікарській формі, що містить разову дозу. Необов'язково, така комбінована лікарська форма, що містить разову дозу, що включає сполуку I в комбінації з одним або більше протидіабетичними і/або інкретиновими сполуками, призначена для перорального введення і необов'язково є твердою пероральною лікарською формою. Альтернативно, така комбінована лікарська форма, що містить разову дозу, що включає сполуку I в комбінації з одним або більше протидіабетичними і/або інкретиновими сполуками, може бути адаптована для парентерального введення і необов'язково являє собою форму розчину. У одному варіанті така комбінована лікарська форма, що містить разову дозу, що включає сполуку I в комбінації з одним або більш іншими протидіабетичними сполуками, включає дозу для пацієнта від 1 мг/тиждень до 500 мг/тиждень сполуки I, необов'язково від 12,5 мг/тиждень до 400 мг/тиждень сполуки I, необов'язково від 20 мг/тиждень до 400 мг/тиждень, необов'язково від 20 мг/тиждень до 200 мг/тиждень сполуки I, необов'язково від 50 мг/тиждень до 400 мг/тиждень сполуки I і необов'язково від 100 мг/тиждень до 400 мг/тиждень сполуки І. У інших варіантах фармацевтична композиція включає 3,125 мг, 12,5 мг, 20 мг, 25 мг, 50 мг, 75 мг, 100 мг, 125 мг, 150 мг, 175 мг, 200 мг, 250 мг, 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I. У іншому варіанті така комбінована лікарська форма, що містить разову дозу, що включає сполуку I в комбінації з одним або більш іншими протидіабетичними сполуками, включає дозу більше ніж 250 мг сполуки I, необов'язково щонайменше 275 мг сполуки I, необов'язково 16 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше 300 мг сполуки I, необов'язково щонайменше 350 мг сполуки I і необов'язково щонайменше 400 мг сполуки I. В одному варіанті, фармацевтична композиція включає не більше ніж 500 мг сполуки I. В іншому варіанті фармацевтична композиція включає не більше ніж 400 мг сполуки I. В ще одному варіанті фармацевтична композиція включає не більше ніж 350 мг сполуки I. В ще одному варіанті, фармацевтична композиція включає більше ніж 250 мг і не більше ніж 500 мг сполуки I. В додатковому варіанті фармацевтична композиція включає більше ніж 250 мг і не більше ніж 400 мг сполуки I. В інших варіантах фармацевтична композиція включає 275 мг, 300 мг, 350 мг, 400 мг або 500 мг сполуки I. Будь-яка протидіабетична сполука або група протидіабетичних сполук можуть бути скомбіновані із сполукою I для одержання такої комбінованої лікарської форми, що містить разову дозу. У певних варіантах здійснення винаходу така комбінована лікарська форма, що містить разову дозу, включає сполуку I і один або більше членів групи, що складається з модуляторів шляху передачі сигналу інсуліну, як інгібітори протеїнтирозинфосфатази (РТРази) і інгібітори глютамінфруктозо-6-фосфатамідотрансферази (GFAT), сполуки, що впливають на порушену продукцію глюкози печінкою, як інгібітори глюкозо-6-фосфатази (G6Pази), інгібітори фруктозо-1,6-бисфосфатази (F-1,6-BPази), інгібітори глікогенфосфорилази (GP), антагоністи рецепторів глюкагону і інгібітори фосфоенолпіруваткарбоксикінази (PEPCK), інгібітори піруватдегідрогеназокінази (PDHK), підсилювачі чутливості до інсуліну (інсулін сенситайзери), підсилювачі секреції інсуліну (інсулін-секретагоги), інгібітори альфа-глюкозидази, інгібітори спустошення шлунка, активатори глюкокінази, агоністи рецептора GLP-1, агоністи рецептора GLP-2, модулятори UCP, модулятори RXR, інгібітори GSK-3, модулятори PPAR, метформін, інсулін і α2-адренергічні антагоністи. Сполука I може вводитися з щонайменше однією протидіабетичною сполукою або одночасно в разовій дозі, в один і той же час в окремих дозах або послідовно (тобто де одну вводять до або після введення іншої). У одному варіанті така комбінована лікарська форма, що містить разову дозу, включає сполуку I і протидіабетичний тіазолідиндіон. Певні приклади тіазолідиндіонів, які можуть використовуватися в такому варіанті, включають, але не обмежуються (S)-((3,4,-дигідро-2(фенілметил)-2Н-1-бензопіран-6-іл)метилтіазолідин-2,4-діон (енглітазон), 5-{[4-(3-(5-метил-2феніл-4-оксазоліл)-1-оксопропіл)феніл]метил}тіазолідин-2,4-діон (дарглітазон), 5-{[4-(1метилциклогексил)метокси)феніл]метил}тіазолідин-2,4-діон (циглітазон), 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон (DRF2189), 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діон (BM-13.1246), 5-(2-нафтилсульфоніл)тіазолідин2,4-діон (AY-31637), біс{4-[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метан (YM268), 5-{4-[2-(5метил-2-феніл-4-оксазоліл)-2-гідроксіетокси]бензил}тіазолідин-2,4-діон (AD-5075), 5-[4-(1-феніл1-циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діон (DN-108), 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил]тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4-хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон (розиглітазон), 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон), 5-[6-(2-фторбензилокси)нафталін2-ілметил]тіазолідин-2,4-діон (МСС555), 5-([2-(2-нафтил)бензоксазол-5-іл]метил)тіазолідин-2,4діон (Т-174), едаглітазон (ВМ-13-1258), ривоглітазон (CS-011) і 5-(2,4-діоксотіазолідин-5ілметил)2-метокси-N-(4-трифторметилбензил)бензамід (KRP297). У одному певному варіанті тіазолідиндіон в такій комбінованій лікарській формі, що містить разову дозу, являє собою 5-{[4-(2-(5-етил-2-піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон) і його сіль гідрохлорид, який знаходиться на ринку під торговим найменуванням ACTOSTM. У іншому певному варіанті тіазолідиндіоном є 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діон (розиглітазон) і його малеатна сіль. У іншому варіанті така комбінована лікарська форма, що містить разову дозу, включає сполуку I і агоніст PPAR гамма неглітазонового типу. У іншому варіанті така комбінована лікарська форма, що містить разову дозу, включає сполуку I і бігуанід. Певним прикладом бігуаніда, який може бути використаний в цьому варіанті, є метформін (диметилдигуанід) і його сіль гідрохлорид, який є на ринку під торговим найменуванням GLUCOPHAGETM. У іншому варіанті така комбінована лікарська форма, що містить разову дозу, включає сполуку I і похідну сульфонілсечовини. Певні приклади похідних сульфонілсечовини, які можуть використовуватися в цьому варіанті, включають, але не обмежуються, глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид. Толбутамід, 17 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 глібенкламід, гліклазид, гліборнурид, гліквідон, глізоксепід і глімепірид можуть вводитися в формі, в якій вони є на ринку під торговими найменуваннями RASTINON HOECHSTTM, AZUGLUCONTM, DIAMICRONTTM, GLUBORIDTM, GLURENORMTM, PRO-DIABANTM і AMARYLTM, відповідно. У іншому варіанті така комбінована лікарська форма, що містить разову дозу, включає сполуку I і протидіабетичне похідне D-фенілаланіну. Певні приклади протидіабетичних похідних D-фенілаланіну, які можуть бути використані в цьому варіанті, включають, але не обмежуються, репаглінід і натеглінід, які можуть вводитися в формі, в якій вони є на ринку під торговими найменуваннями NOVONORMTM і STARLIXTM, відповідно. У іншому варіанті така комбінована лікарська форма, що містить разову дозу, включає сполуку I і інгібітор альфа-глюкозидази. Певні приклади інгібіторів альфа-глюкозидази, які можуть бути використані в цьому варіанті, включають, але не обмежуються, акарбозу, міглітол і воглібозу, які можуть вводитися в формі, в якій вони є на ринку під торговими найменуваннями GLUCOBAYTM, DIASTABOL 50TM і BASENTM, відповідно. У одному певному варіанті здійснення протидіабетична сполука, що вводиться в комбінації із сполукою I в такій комбінованій лікарській формі, що містить разову дозу, вибирають з групи, що складається з натеглініду, репаглініду, метформіну, екзенатиду, розиглітазону, піоглітазону, глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи будь-які їх фармацевтично прийнятні солі. Відносно кожного з вищезгаданих варіантів здійснення винаходу і варіантів, що стосується комбінованої лікарської форми, що містить разову дозу, що включає комбінацію сполуки I і одного або більше інших протидіабетичних сполук, фармацевтична композиція може необов'язково бути пристосована для перорального введення і може необов'язково бути твердою композицією, такою як таблетка або капсула, або може альтернативно бути представлена в рідкій композиції, пристосованій для перорального введення. Доза протидіабетичної сполуки може бути вибрана з діапазону, відомого як такий, що клінічно використовується для такої сполуки. Будь-яка з терапевтичних сполук для лікування діабетичних ускладнень, антигіперліпідемических сполук, засобів для лікування ожиріння або антигіпертензивних сполук може бути використана в комбінації із сполукою I таким же чином, як вищезгадані протидіабетичні сполуки. Приклади терапевтичних сполук для лікування діабетичних ускладнень включають, але не обмежуються інгібіторами альдозоредуктази, такими як толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, СТ-112 і ранірестат; нейротрофічними чинниками і сполуками, що підвищують їх, такими як NGF, NT-3, BDNF і промотори продукції-секреції нейротрофіну, описані в WO 01/14372 (наприклад, 4-(4хлорфеніл)-2-(2-метил-1-імідазоліл)-5-[3-(2-метилфенокси)пропіл]оксазол); стимуляторами нейроногенезу, такими як Y-128; інгібіторами РКС, такими як рубоксистаурин мезилат; інгібіторами AGE, такими як ALT946, пімагедин, бромід N-фенацилтіазолу (ALT766), ALT-711, EXO-226, піридорин і піридоксамін; поглиначами реактивних форм кисню, такими як тіоктова кислота; засобами, що розширюють судини головного мозку, такими як тіаприд і мексилетин; агоністами рецепторів соматостатину, такими як BIM23190; і інгібіторами кінази-1, регулюючої сигнал апоптозу (ASK-1). Приклади антигіперліпідемических сполук включають, але не обмежуються інгібіторами HMG-CoA редуктази, такими як правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, розувастатин і пітавастатин; інгібіторами скваленсинтази, такими як сполуки, описані в WO97/10224 (наприклад, N-[(3R, 5S)[-1-(3ацетокси-2,2-диметилпропіл)-7-хлор-5-(2,3-диметоксифеніл)-2-оксо-1,2,3,5-тетрагідро-4,1бензоксазепин-3-іл]ацетил]піперидин-4-оцтова кислота); фібратними сполуками, такими як безафібрат, клофібрат, симфібрат і клинофібрат; інгібіторами АСАТ, такими як авазиміб і ефлуциміб; аніонообмінними смолами, такими як колестирамін; пробукол; препаратами нікотинової кислоти, такими як нікомол і ніцеритрол; етилікозапентат; і рослинними стеринами, такими як соєвий стерин і γ-оризанол. Приклади препаратів для лікування ожиріння включають, але не обмежуються, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс; антагоністи рецепторів МСН, такі як SB-568849 і SNAP-7941; антагоністи нейропептиду Y, такі як СР-422935; антагоністи канабіноїдних рецепторів, такі як SR-141716 і SR-147778; антагоністи греліну; інгібітори 11 βгідроксистероїддегідрогенази, такі як BVT-3498; інгібітори панкреатичної ліпази, такі як орлістат і ATL-962; агоністи Бета-3 AR, такі як AJ-9677; пептидні засоби, що знижують апетит, такі як лептин і CNTF (війковий нейротропний чинник); агоністи холецистокініну, такі як лінтитрипт і FPL-15849; і придушувачі апетиту, такі як Р-57. Приклади антигіпертензивних сполук включають інгібітори ангіотензинперетворюючого ферменту, такі як каптоприл, еналаприл і делаприл; 18 UA 101313 C2 5 10 15 20 25 30 35 40 45 50 55 60 антагоністи ангіотензину II, такі як кандесартан цилексетил, лозартан, епросартан, валсартан, телмісартан, ірбесартан, олмесартан медоксомил, тазосартан і 1-[[2'-(2,5-дигідро-5-оксо-4Н1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил]-2-етокси-1Н-бензімідазол-7-карбонова кислота; блокатори кальцієвих каналів, такі як манідипін, ніфедипін, нікардипін, амлодипін і ефонідипін; засрби, що відкривають калієві канали, такі як левкромакалім, L-27152, AL0671 і NIP-121; і клонідин. 5. Набори і вироби, що включають сполуку I Даний винахід також стосується наборів, що включають фармацевтичну композицію відповідно до даного винаходу, що містить сполуку I (і необов'язково одну або більше протидіабетичних або інкретинових сполук), де такий набір додатково включає інструкції, які містять одну або більше форми інформації, вибрану з групи, що складається з вказівки на патологічний стан, для лікування якого вводиться фармацевтична композиція, інформацію про зберігання фармацевтичної композиції, інформацію про дозування і інструкцію, що стосуються того, як вводити фармацевтичну композицію. Набір також може включати пакувальні матеріали. Пакувальні матеріали також можуть включати контейнер для розміщення фармацевтичної композиції. Контейнер може необов'язково включати ярлик, вказуючий патологічні стани, для лікування яких вводиться фармацевтична композиція, інформацію про зберігання, інформацію про дозування і/або інструкцію, що стосуються того, як вводити композицію. Набір може також включати додаткові компоненти для зберігання або введення композиції. Набір також може включати композицію в лікарській формі, що містить разову дозу або декілька доз. У одному варіанті здійснення винаходу фармацевтична композиція в наборі включає декілька доз фармацевтичної композиції за даним винаходом, де така фармацевтична композиція являє собою лікарську форму, що містить разову дозу, яка включає сполуку I в одному з діапазонів дозування, вказаних в даному описі. У інших варіантах здійснення винаходу, фармацевтична композиція в наборі включає декілька доз фармацевтичної композиції за даним винаходом, де така фармацевтична композиція знаходиться в лікарській формі, що містить разову дозу, яка включає сполуку I і одне або більш з інших протидіабетичних або інкретинових сполук, вказаних в даному описі. Даний винахід також стосується виробів, що включають фармацевтичну композицію за даним винаходом, що містить сполуку I (і необов'язково одну або більше інших протидіабетичних або інкретинових сполук), де такі вироби додатково включають пакувальні матеріали. У одному варіанті пакувальні матеріали включають контейнер для розміщення композиції. У іншому варіанті винахід забезпечує виріб, де контейнер включає ярлик, вказуючий на один або більше параметрів з групи, що складається з патологічного стану, для лікування якого вводять композицію, інформації про зберігання, інформацію про дозування і/або інструкцію, що стосуються того, як вводити композицію. У одному варіанті здійснення винаходу фармацевтична композиція у виробі включає декілька доз фармацевтичної композиції за даним винаходом, де така фармацевтична композиція знаходиться в лікарській формі, що містить разову дозу, яка включає сполуку I в одному з діапазонів дозування, вказаних в даному описі. У іншому варіанті здійснення винаходу фармацевтична композиція у виробі включає декілька доз фармацевтичної композиції за даним винаходом, де така фармацевтична композиція знаходиться в лікарській формі, що містить разову дозу, яка включає сполуку I і одне або більше за іншу протидіабетичних або інкретинових сполук, вказану в даному описі. Зазначено, що пакувальні матеріали, що використовуються в наборах і виробах за даним винаходом, можуть являти собою множину розділених контейнерів, таких як розділена пляшка або розділений фольгований пакет. Контейнер може бути будь-якого звичайного контуру або форми, відомого в галузі техніки, які зроблені з фармацевтично прийнятного матеріалу, наприклад, паперу або картонної коробки, скляної або пластикової пляшки або флакона, що повторно герметизується пакету (наприклад, для зберігання «запасу» таблеток для приміщення в інший контейнер) або блістерної упаковки з окремими дозами для видавлення з упаковки у відповідності зі схемою лікування. Контейнер, що використовується, буде залежати від точної форми дозування, що використовується. Можливо спільне використання більш ніж одного контейнера в єдиній упаковці для продажу лікарської форми, що містить разову дозу. Наприклад, таблетки можуть міститися в бутлі, який в свою чергу міститься в коробці. Одним певним прикладом набору за даним винаходом є так звана блістерна упаковка. Блістерні упаковки добре відомі в фармацевтичній промисловості і широко використовуються для упаковки фармацевтичних лікарських форм (таблетки, капсули і подібні). Блістерні упаковки звичайно складаються з листа відносно твердого матеріалу (переважно твердого прозорого пластикового матеріалу), покритого фольгою. Під час процесу упаковки в твердому матеріалі 19 UA 101313 C2 5 10 15 20 25 30 35 формують поглиблення. Поглиблення мають розмір і форму окремих таблеток, що упаковуються або капсул або можуть мати форму і розмір для розміщення декількох таблеток, що упаковуються і/або капсул. Потім таблетки або капсули відповідно вміщують в поглиблення, і лист відносно твердого матеріалу герметизують пластиковою фольгою з розташуванням фольги навпроти освічених поглиблень. У результаті таблетки або капсули герметизують окремо або разом, за бажанням, в поглибленнях між фольгою і листом. Лист переважно має таку щільність, що таблетки або капсули можуть бути виділені з блістерной упаковки шляхом ручного натиснення на поглиблення, внаслідок чого в фользі утворяться отвори в місці поглиблення. Потім таблетка або капсула може бути видавлена через вказаний отвір. Приклади 1. Одержання 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1ілметил]-4-фторбензонітрилу і фармацевтично прийнятних солей Суміш 2-бром-5-фтортолуолу (2) (3,5 г, 18,5 ммоль) і CuCN (2 г, 22 ммоль) в ДМФ (100 мл) нагрівали в колбі із зворотним холодильником протягом 24 годин. Реакційну суміш розводили водою і екстрагували гексаном. Органічну фракцію сушили над MgSO4 і розчинник видаляли 1 для одержання продукту 3 (вихід 60%). H-ЯМР (400 МГц, CDCl3): 7,60 (дд, J=5,6, 8,8 Гц, 1H), 6,93-7,06 (м, 2H), 2,55 (с, 3H). 2-бромметил-4-фторбензонітрил (4) Суміш 4-фтор-2-метилбензонітрилу (3) (2 г, 14,8 ммоль), NBS (2,64 г, 15 ммоль) і AIBN (100 мг) в CCl4 нагрівали із зворотним холодильником в атмосфері азоту протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури. Тверду речовину видаляли фільтрацією. Органічний розчин концентрували для одержання сирого продукту у вигляді масла, яке 1 використали на наступній стадії без додаткового очищення. H-ЯМР (400 МГц, CDCl3): 7,68 (дд, J=5,2, 8,4 Гц, 1H), 7,28 (дд, J=2,4, 8,8 Гц, 1H), 7,12 (м, 1H), 4,6 (с, 2H). 2-(6-хлор-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил)-4-фторбензонітрил (6) Суміш сирого 3-метил-6-хлорурацилу (5) (0,6 г, 3,8 ммоль), 2-бромометил-4фторбензонітрилу (0,86 г, 4 ммоль) і K2CO3 (0,5 г, 4 ммоль) в ДМСО (10 мл) перемішували при 60ºС протягом 2 годин. Реакційну суміш розводили водою і екстрагували EtOAc. Органічну фракцію сушили над MgSO4 і розчинник видаляли. Залишок очищали колоночной 1 хроматографией. Одержували 0,66 г продукту (вихід: 60%). H-ЯМР (400 МГц, CDCl3): 7,73 (дд, J=7,2, 8,4 Гц, 1H), 7,26 (д, J=4,0 Гц, 1H), 7,11-7,17 (м, 1H), 6,94 (дд, J=2,0, 9,0 Гц, 1H), 6,034 (с, 2H), 3,39 (с, 3H), MS (ES) [m+Н] розрахований для C13H9ClFN3O2, 293,68; виявлений 293,68. 2-[6-(3-амінопіперидин-1-іл)-3-метил 2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрил, сіль ТФО (1) (сіль ТФО сполуки I) 2-(6-хлор-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил)-4-фторбензонітрил (5) (300 мг, 1,0 ммоль), дигідрохлорид (R)-3-амінопіперидину (266 мг, 1,5 ммоль) і бікарбонат натрію (500 мг, 5,4 ммоль) перемішували в герметичній пробірці в EtOH (3 мл) при 100ºС протягом 2 20 UA 101313 C2 1 5 10 15 20 25 30 35 40 45 50 годин. Остаточну сполуку одержували у вигляді солі ТФО після очищення ВЕРХ. H-ЯМР (400 МГц, CD3OD): 7,77-7,84 (м, 1H), 7,16-7,27 (м, 2H), 5,46 (с, 1H), 5,17-5,34 (ABq, 2H, J=35,2, 15,6 Гц), 3,33-3,47 (м, 2H), 3,22 (с, 3H), 2,98-3,08 (м, 1H), 2,67-2,92 (м, 2H), 2,07-2,17 (м, 1H), 1,82-1,92 (м, 1H), 1,51-1,79 (м, 2H), MS (ES) [m+Н] розрахований для C 18H20FN5O2, 357,38; виявлений, 357,38. 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбкензонітрил, сіль HCl ТФО сіль сполуки I суспендували в ДХМ і потім промивали насиченим Na2CO3. Органічний шар сушили і видаляли у вакуумі. Залишок розчиняли в ацетонітрилі і при 0ºС додавали HCl в 1 діоксані (1,5 екв.). Після видалення розчинника одержували сіль HCl. H-ЯМР (400 МГц, CD3OD): 7,77-7,84 (м, 1H), 7,12-7,26 (м, 2H), 5,47 (с, 1H), 5,21-5,32 (ABq, 2H, J=32,0, 16,0 Гц), 3,35-3,5 (м, 2H), 3,22 (с, 3H), 3,01-3,1 (м, 1H), 2,69-2,93 (м, 2H), 2,07-2,17 (м, 1H), 1,83-1,93 (м, 1H), 1,551,80 (м, 2H), MS (ES) [m+Н] розрахований для C18H20FN5O2, 357,38; виявлений, 357,38. Загальна методика для одержання солей сполуки I Бензонітриловий продукт при бажанні може бути виділений у вигляді вільної основи, але переважно продукт може бути додатково перетворений у відповідну адитивної сіль кислоти. Зокрема, бензонітриловий продукт (приблизно 10 мг) в розчині MeOH (1 мл) обробляли різними кислотами (1,05 еквівалентів). Розчинам дозволяли стояти протягом трьох днів відкритими на повітрі. Якщо утворювався осадок, суміш фільтрували і сіль сушили. Якщо тверда речовина не утворювалася, суміш концентрували у вакуумі і осад виділяли. Таким чином одержували солі сполуки I з наступних кислот: бензойної, п-толуолсульфонової, янтарної, R-(-)мигдалевої і бензолсульфонової. Стадії виділення і/або очищення проміжних сполук в описаному вище способі необов'язково можуть бути пропущені, якщо проміжний продукт з реакційної суміші виходить у вигляді відносно чистих з'єднань і побічні продукти або домішки реакційної суміші не впливають на подальші стадії реакції. Коли можливо, одна або більше за стадії виділення можуть бути виключені для забезпечення більш короткого часу обробки, і виключення додаткової обробки також може давати більш високий вихід реакції. 2. Ефект введення на активність DPP-IV плазми Однократну дозу сполуки I вводили перорально 6 людям в дозуванні 12,5 мг, 25 мг, 50 мг, 100 мг, 200 мг і 400 мг, відповідно (всього 36 людей). На фіг. 1 проілюстрований ефект, що спостерігається, який введення сполуки I надає після введення на активність людської DPP-IV плазми. Як можна відмітити, через 168 годин після введення сполуки I знижувало активність DPP-IV в людській плазмі більш ніж на 10% відносно вихідного. Отже, як можна бачити з даних, показаних на Фіг.1, шляхом введення сполуки I один раз на тиждень в дозі, вказаній в даному описі, сполука I може ефективно використовуватися відносно патологічних станів, при яких бажано знизити активність DPP-IV плазми. У світлі представлених даних вважають, що коли пацієнту вводять щонайменше 50 мг сполуки I, активність DPP-IV плазми пацієнта може бути знижена більше ніж на 35% відносно початкового протягом періоду щонайменше 168 годин після введення, коли пацієнту вводять щонайменше 100 мг сполуки I, активність DPP-IV плазми пацієнта може бути знижена більше ніж на 60% відносно початкового протягом періоду щонайменше 168 годин після введення і, коли пацієнту вводять щонайменше 200 мг сполуки I, активність DPP-IV плазми пацієнта може бути знижена більше ніж на 70% відносно початкового протягом періоду щонайменше 168 годин після введення. 3. Ефект введення на активність DPP-IV плазми Однократну дозу сполуки I вводили людям перорально в дозуванні 3,125 мг (9 людям), 12,5 мг (8 людям), 50 мг (7 людям) і 100 мг (8 людям), відповідно. На фіг. 2 проілюстрований ефект, що спостерігається, який введення сполуки I здійснює на активність DPP-IV плазми людини після введення. Як може бути видно, сполука I знижувала активність DPP-IV в людській плазмі більше ніж на 20% відносно вихідного через 168 годин після введення. Отже, як може бути видно з даних, показаних на фіг. 2, шляхом введення сполуки I один раз на тиждень в 21 UA 101313 C2 5 10 дозуванні, вказаному в даному описі, сполука I може ефективно використовуватися відносно патологічних станів, при яких бажано знизити активність DPP-IV плазми. У світлі представлених даних вважають, що коли пацієнту вводять щонайменше 50 мг сполуки I, активність DPP-IV плазми пацієнта може бути знижена більш ніж на 65% відносно початкового протягом періоду щонайменше 168 годин після введення. Для фахівця в галузі техніки очевидно, що можуть бути здійснені різні модифікації і варіанти відносно сполук, композицій, наборів і способів за даним винаходом без відхилення від рамок і суті винаходу. Отже, даний винахід охоплює забезпечені модифікації і варіанти даного винаходу, які витікають з рамок прикладеної формули винаходу і її еквівалентів. Дана заявка основана на попередній заявці США № 60/894624, зміст якої включений в даний опис у вигляді посилання. ФОРМУЛА ВИНАХОДУ 15 1. Застосування сполуки І формули O N H2N N N O F NC 20 25 30 35 40 45 як лікарського засобу для лікування діабету І типу, де сполука І вводиться щотижнево у тижневій дозі більше ніж 250 мг. 2. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 275 мг. 3. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 300 мг. 4. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 350 мг. 5. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає щонайменше 400 мг. 6. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає не більше 500 мг. 7. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає не більше 400 мг. 8. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає не більше 350 мг. 9. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 500 мг. 10. Застосування за п. 1, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 400 мг. 11. Застосування за п. 1, де вказана тижнева дозована форма адаптована для введення шляхом, вибраним з групи, яка складається з орального, парентерального, інтраперитонеального, внутрішньовенного, інтраартеріального, трансдермального, сублінгвального, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомального, за допомогою інгаляцій, вагінального, внутрішньоочного, за допомогою місцевої доставки, підшкірного, введення в жирову тканину, введення в суглоб, внутрішньоочеревинного і інтратекального введення. 12. Застосування за п. 1, де вказана дозована форма для введення раз на тиждень адаптована для орального введення. 13. Застосування за п. 1, де вказана дозована форма для введення раз на тиждень являє собою тверду препаративну форму, адаптовану для орального введення. 14. Застосування за п. 1, де вказана дозована форма для введення раз на тиждень являє собою таблетку або капсулу, адаптовану для орального введення. 15. Застосування за п. 1, де вказана дозована форма для введення щотижнево, являє собою препаративну форму для уповільненого вивільнення, адаптовану для орального введення. 16. Застосування за п. 1, де сполука І присутня у формі вільної основи. 17. Застосування за п. 1, де сполука І присутня у формі фармацевтично прийнятної солі. 18. Застосування за п. 1, де сполука І присутня у формі сукцинатної солі. 19. Застосування сполуки І формули 22 UA 101313 C2 O N H2N N O N F NC 5 10 15 20 25 30 35 як лікарського засобу для лікування діабету II типу, де сполука І вводиться щотижнево у тижневій дозі більше ніж 250 мг. 20. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 275 мг. 21. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 300 мг. 22. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 350 мг. 23. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає щонайменше 400 мг. 24. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає не більше 500 мг. 25. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає не більше 400 мг. 26. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає не більше 350 мг. 27. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 500 мг. 28. Застосування за п. 19, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 400 мг. 29. Застосування за п. 19, де вказана тижнева дозована форма адаптована для введення шляхом, вибраним з групи, яка складається з орального, парентерального, інтраперитонеального, внутрішньовенного, інтраартеріального, трансдермального, сублінгвального, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомального, за допомогою інгаляції, вагінального, внутрішньоочного, за допомогою місцевої доставки, підшкірного, введення в жирову тканину, введення в суглоб, внутрішньоочеревинного і інтратекального введення. 30. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень адаптована для орального введення. 31. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень являє собою тверду препаративну форму, адаптовану для орального введення. 32. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень являє собою таблетку або капсулу, адаптовану для орального введення. 33. Застосування за п. 19, де вказана дозована форма для введення раз на тиждень включає препаративну форму для уповільненого вивільнення, адаптовану для орального введення. 34. Застосування за п. 19, де сполука І присутня у формі вільної основи. 35. Застосування за п. 19, де сполука І присутня у формі фармацевтично прийнятної солі. 36. Застосування за п. 19, де сполука І присутня у формі сукцинатної солі. 37. Застосування сполуки І формули O N H2N N N O F NC 23 UA 101313 C2 5 10 15 20 25 30 35 як лікарського засобу для лікування переддіабетичного стану, де сполука І вводиться щотижнево у тижневій дозі більше ніж 250 мг. 38. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 275 мг. 39. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 300 мг. 40. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 350 мг. 41. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає щонайменше 400 мг. 42. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає не більше 500 мг. 43. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає не більше 400 мг. 44. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає не більше 350 мг. 45. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 500 мг. 46. Застосування за п. 37, де тижнева доза сполуки І, що вводиться, складає більше 250 мг і не більше 400 мг. 47. Застосування за п. 37, де вказана тижнева дозована форма адаптована для введення шляхом, вибраним з групи, яка складається з орального, парентерального, інтраперитонеального, внутрішньовенного, інтраартеріального, трансдермального, сублінгвального, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомального, за допомогою інгаляцій, вагінального, внутрішньоочного, за допомогою місцевої доставки, підшкірного, введення в жирову тканину, введення в суглоб, внутрішньоочеревинного і інтратекального введення. 48. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень адаптована для орального введення. 49. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень являє собою тверду препаративну форму, адаптовану для орального введення. 50. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень являє собою таблетку або капсулу, адаптовану для орального введення. 51. Застосування за п. 37, де вказана дозована форма для введення раз на тиждень включає препаративну форму для уповільненого вивільнення, адаптовану для орального введення. 52. Застосування за п. 37, де сполука І присутня у формі вільної основи. 53. Застосування за п. 37, де сполука І присутня у формі фармацевтично прийнятної солі. 54. Застосування за п. 37, де сполука І присутня у формі сукцинатної солі. 24 UA 101313 C2 25 UA 101313 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 26
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;weekly administration of dipeptidyl peptidase inhibitors
Автори англійськоюOgawa, Atsushi
Назва патенту російськоюЕженедельное введение ингибиторов дипептидилпептидазы
Автори російськоюОгава Ацуси
МПК / Мітки
МПК: A61P 31/18, A61P 3/10, A61K 31/513, A61P 35/00
Мітки: інгібіторів, щотижневе, введення, дипептидилпептидази
Код посилання
<a href="https://ua.patents.su/28-101313-shhotizhneve-vvedennya-ingibitoriv-dipeptidilpeptidazi.html" target="_blank" rel="follow" title="База патентів України">Щотижневе введення інгібіторів дипептидилпептидази</a>
Попередній патент: Модулятори фармакокінетичних властивостей терапевтичних препаратів
Наступний патент: Система очищення води та спосіб очищення води
Випадковий патент: Спосіб фізичної реабілітації підлітків і молоді з першим ступенем сколіозу