Фармацевтична композиція інгібіторів дипептидилпептидази
Формула / Реферат
1. Фармацевтична композиція, приготована в стандартній лікарській формі, при цьому вказана стандартна лікарська форма містить від 1 мг до 250 мг сполуки І, де сполука І має формулу
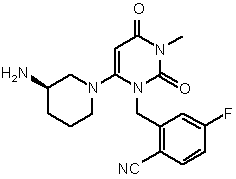 .
.
2. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить від 5 мг до 200 мг сполуки І.
3. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить від 5 мг до 150 мг сполуки І.
4. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить від 15 мг до 100 мг сполуки І.
5. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить 5 мг сполуки І.
6. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить 6,25 мг сполуки І.
7. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить 10 мг сполуки І.
8. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить 20 мг сполуки І.
9. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить 25 мг сполуки І.
10. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить 50 мг сполуки І.
11. Фармацевтична композиція за п. 1, в якій вказана стандартна лікарська форма містить 100 мг сполуки І.
12. Фармацевтична композиція за будь-яким з пп. 1-11, в якій вказана стандартна лікарська форма додатково містить одну або декілька антидіабетичних сполук, відмінних від сполуки І.
13. Фармацевтична композиція, приготована в стандартній лікарській формі, при цьому вказана стандартна лікарська форма містить від 1 мг до 250 мг сполуки І і одну або декілька антидіабетичних сполук, відмінних від сполуки І, де сполука І має формулу
 .
.
14. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з модуляторів шляху передачі сигналу інсуліну, сполук, що впливають на порушену регуляцію продукції глюкози в печінці, підсилювачів чутливості до інсуліну і підсилювачів секреції інсуліну.
15. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з інгібіторів протеїнтирозинфосфатази, інгібіторів глутамінфруктозо-6-фосфатамідотрансферази, інгібіторів глюкозо-6-фосфатази, інгібіторів фруктозо-1,6-бісфосфатази, інгібіторів глікогенфосфорилази, антагоністів рецепторів глюкагону, інгібіторів фосфоенолпіруваткарбоксикінази, інгібіторів кінази піруватдегідрогенази, інгібіторів альфа-глюкозидази, інгібіторів випорожнення шлунка, інсуліну і α2-адренергічних антагоністів.
16. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з інгібіторів GSK-3, агоністів ретиноїдного рецептора X, агоністів бета-3 AR, модуляторів UCP, антидіабетичних тіазолідиндіонів, агоністів PPAR-гамма неглітазонового типу, подвійних агоністів PPAR-гaммa/PPAR-альфа, антидіабетичних ванадійвмісних сполук і бігуанідів.
17. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з
(S)-(3,4-дигідро-2-(фенілметил)-2Н-1-бензопіран-6-іл)метилтіазолідин-2,4-діону,
5-{[4-(3-(5-метил-2-феніл-4-оксазоліл)-1-оксопропіл)феніл]метил}тіазолідин-2,4-діону,
5-{[4-(1-метилциклогексил)метоксифеніл]метил}тіазолідин-2,4-діону,
5-{[4-(2-(1-індоліл)етокси)феніл]метил}тіазолідин-2,4-діону,
5-{4-[2-(5-метил-2-феніл-4-оксазоліл)етокси]бензил}тіазолідин-2,4-діону,
5-(2-нафтилсульфоніл)тіазолідин-2,4-діону,
біс{4-[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метану,
5-{4-[2-(5-метил-2-феніл-4-оксазоліл)-2-гідроксіетокси]бензил}тіазолідин-2,4-діону,
5-[4-(1-феніл-1-циклопропанкарбоніламіно)бензил]тіазолідин-2,4-діону,
5-[4-(2-(2,3-дигідроіндол-1-іл)етокси)фенілметил]тіазолідин-2,4-діону,
5-[3-(4-хлорфеніл)-2-пропініл]-5-фенілсульфонілтіазолідин-2,4-діону,
5-[3-(4-хлорфеніл)-2-пропініл]-5-(4-фторфенілсульфоніл)тіазолідин-2,4-діону,
5-{[4-(2-(метил-2-піридиніламіно)етокси)феніл]метил}тіазолідин-2,4-діону,
5-{[2-(2-нафтил)бензоксазол-5-іл]метил}тіазолідин-2,4-діону і
5-(2,4-діоксотіазолідин-5-ілметил)-2-метокси-N-(4-трифторметилбензил)бензаміду, включаючи їх будь-які фармацевтично прийнятні солі.
18. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить метформін, включаючи його будь-які фармацевтично прийнятні солі.
19. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить похідне сульфонілсечовини.
20. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі.
21. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з інкретинових гормонів або їх міметиків, антагоністів рецептора імідазоліну бета-клітин і короткочасно діючих стимуляторів секреції інсуліну.
22. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить інсулін.
23. Фармацевтична композиція за будь-яким з пп. 1-12, в якій вказана стандартна лікарська форма містить один або декілька агоністів GLP-1.
24. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить один або декілька агоністів GLP-2.
25. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить ексенатид.
26. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з репаглініду, мітиглініду і натеглініду, включаючи їх будь-які фармацевтично прийнятні солі.
27. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить один або декілька інгібіторів альфа-глюкозидази.
28. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з акарбози, воглібози і міглітолу, включаючи їх будь-які фармацевтично прийнятні солі.
29. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить розиглітазон, включаючи його будь-які фармацевтично прийнятні солі.
30. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить піоглітазон, включаючи його будь-які фармацевтично прийнятні солі.
31. Фармацевтична композиція за будь-яким з пп. 1-13, в якій вказана стандартна лікарська форма містить метформін і піоглітазон, включаючи їх будь-які фармацевтично прийнятні солі.
32. Фармацевтична композиція за будь-яким з пп. 30 і 31, в якій піоглітазон являє собою піоглітазон-НСl.
33. Фармацевтична композиція за будь-яким з пп. 1-32, в якій вказана стандартна лікарська форма призначена для перорального введення.
34. Фармацевтична композиція за будь-яким з пп. 1-32, в якій вказана стандартна лікарська форма являє собою твердий препарат, призначений для перорального введення.
35. Фармацевтична композиція за будь-яким з пп. 1-32, в якій вказана стандартна лікарська форма являє собою таблетку або капсулу, призначену для перорального введення.
36. Фармацевтична композиція за будь-яким з пп. 1-32, в якій вказана стандартна лікарська форма являє собою препарат тривалого вивільнення, призначений для перорального введення.
37. Фармацевтична композиція за будь-яким з пп. 1-36, в якій сполука І присутня в фармацевтичній композиції у вигляді вільної основи.
38. Фармацевтична композиція за будь-яким з пп. 1-36, в якій сполука І присутня в фармацевтичній композиції у вигляді фармацевтично прийнятної солі.
39. Фармацевтична композиція за будь-яким з пп. 1-36, в якій сполука І присутня в фармацевтичній композиції у вигляді сукцинатної солі.
40. Набір, що містить:
декілька доз фармацевтичної композиції за будь-яким з пп. 1-40; і інструкції, які містять одну або декілька форм інформації, вибраних з групи, що складається із зазначення патологічного стану, у випадку якого необхідно вводити фармацевтичну композицію, інформації про зберігання фармацевтичної композиції, інформації про дози і інструкцій по введенню фармацевтичної композиції.
41. Виріб, що містить:
декілька доз фармацевтичної композиції за будь-яким з пп. 1-40; і пакувальні матеріали.
42. Виріб за п. 41, в якому пакувальний матеріал включає контейнер для зберігання декількох доз фармацевтичної композиції.
43. Виріб за п. 42, в якому контейнер має етикетку, на якій вказана одна або декілька форм інформації з групи, що складається з інформації про патологічний стан, у випадку якого необхідно вводити сполуку, інформації про зберігання, інформації про дози і/або інструкцій по введенню композиції.
44. Застосування фармацевтичної композиції за будь-яким з пп. 1-40 в комбінації з однією або декількома антидіабетичними сполуками, відмінними від сполуки І, для виробництва фармацевтичного засобу для лікування діабету типу II, де сполука І має формулу
 .
.
45. Застосування фармацевтичної композиції за будь-яким з пп. 1-40 для виробництва фармацевтичного засобу, що містить комбінацію сполуки І і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу II, де сполука І має формулу
 .
.
46. Застосування однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для виробництва фармацевтичного засобу, що містить комбінацію фармацевтичної композиції за будь-яким з пп. 1-40 і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу II, де сполука І має формулу
 .
.
47. Застосування фармацевтичної композиції за будь-яким з пп. 1-40 у комбінації з однією або декількома антидіабетичними сполуками, відмінними від сполуки І, для виробництва фармацевтичного засобу для лікування діабету типу І, де сполука І має формулу
 .
.
48. Застосування фармацевтичної композиції за будь-яким з пп. 1-40 для виробництва фармацевтичного засобу, який містить комбінацію сполуки І і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу І, де сполука І має формулу
 .
.
49. Застосування однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для виробництва фармацевтичного засобу, який містить комбінацію фармацевтичної композиції за будь-яким з пп. 1-40 і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу І, де сполука І має формулу
 .
.
Текст
1. Фармацевтична композиція, приготована в стандартній лікарській формі, при цьому вказана стандартна лікарська форма містить від 1мг до 250 мг сполуки І, де сполука І має формулу 2 (13) 1 3 рів глюкозо-6-фосфатази, інгібіторів фруктозо-1,6бісфосфатази, інгібіторів глікогенфосфорилази, антагоністів рецепторів глюкагону, інгібіторів фосфоенолпіруваткарбоксикінази, інгібіторів кінази піруватдегідрогенази, інгібіторів альфаглюкозидази, інгібіторів випорожнення шлунка, інсуліну і α2-адренергічних антагоністів. 16. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з інгібіторів GSK-3, агоністів ретиноїдного рецептора X, агоністів бета-3 AR, модуляторів UCP, антидіабетичних тіазолідиндіонів, агоністів PPAR-гамма неглітазонового типу, подвійних агоністів PPARгaммa/PPAR-альфа, антидіабетичних ванадійвмісних сполук і бігуанідів. 17. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з (S)-(3,4-дигідро-2-(фенілметил)-2Н-1-бензопіран-6іл)метилтіазолідин-2,4-діону, 5-{[4-(3-(5-метил-2-феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діону, 5-{[4-(1метилциклогексил)метоксифеніл]метил}тіазолідин2,4-діону, 5-{[4-(2-(1-індоліл)етокси)феніл]метил}тіазолідин2,4-діону, 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси]бензил}тіазолідин-2,4-діону, 5-(2-нафтилсульфоніл)тіазолідин-2,4-діону, біс{4-[(2,4-діоксо-5тіазолідиніл)метил]феніл}метану, 5-{4-[2-(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діону, 5-[4-(1-феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4діону, 5-[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил]тіазолідин-2,4-діону, 5-[3-(4-хлорфеніл)-2-пропініл]-5фенілсульфонілтіазолідин-2,4-діону, 5-[3-(4-хлорфеніл)-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діону, 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4діону, 5-{[2-(2-нафтил)бензоксазол-5-іл]метил}тіазолідин2,4-діону і 5-(2,4-діоксотіазолідин-5-ілметил)-2-метокси-N-(4трифторметилбензил)бензаміду, включаючи їх будь-які фармацевтично прийнятні солі. 18. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить метформін, включаючи його будь-які фармацевтично прийнятні солі. 19. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить похідне сульфонілсечовини. 20. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з глізок 93689 4 сепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі. 21. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з інкретинових гормонів або їх міметиків, антагоністів рецептора імідазоліну бета-клітин і короткочасно діючих стимуляторів секреції інсуліну. 22. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить інсулін. 23. Фармацевтична композиція за будь-яким з пп.1-12, в якій вказана стандартна лікарська форма містить один або декілька агоністів GLP-1. 24. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить один або декілька агоністів GLP-2. 25. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить ексенатид. 26. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з репаглініду, мітиглініду і натеглініду, включаючи їх будьякі фармацевтично прийнятні солі. 27. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить один або декілька інгібіторів альфаглюкозидази. 28. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить одну або декілька антидіабетичних сполук, вибраних з групи, що складається з акарбози, воглібози і міглітолу, включаючи їх будь-які фармацевтично прийнятні солі. 29. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить розиглітазон, включаючи його будь-які фармацевтично прийнятні солі. 30. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить піоглітазон, включаючи його будь-які фармацевтично прийнятні солі. 31. Фармацевтична композиція за будь-яким з пп.1-13, в якій вказана стандартна лікарська форма містить метформін і піоглітазон, включаючи їх будь-які фармацевтично прийнятні солі. 32. Фармацевтична композиція за будь-яким з пп.30 і 31, в якій піоглітазон являє собою піоглітазон-НСl. 33. Фармацевтична композиція за будь-яким з пп.1-32, в якій вказана стандартна лікарська форма призначена для перорального введення. 34. Фармацевтична композиція за будь-яким з пп.1-32, в якій вказана стандартна лікарська форма являє собою твердий препарат, призначений для перорального введення. 35. Фармацевтична композиція за будь-яким з пп.1-32, в якій вказана стандартна лікарська фор 5 93689 ма являє собою таблетку або капсулу, призначену для перорального введення. 36. Фармацевтична композиція за будь-яким з пп.1-32, в якій вказана стандартна лікарська форма являє собою препарат тривалого вивільнення, призначений для перорального введення. 37. Фармацевтична композиція за будь-яким з пп.1-36, в якій сполука І присутня в фармацевтичній композиції у вигляді вільної основи. 38. Фармацевтична композиція за будь-яким з пп.1-36, в якій сполука І присутня в фармацевтичній композиції у вигляді фармацевтично прийнятної солі. 39. Фармацевтична композиція за будь-яким з пп.1-36, в якій сполука І присутня в фармацевтичній композиції у вигляді сукцинатної солі. 40. Набір, що містить: декілька доз фармацевтичної композиції за будьяким з пп.1-40; і інструкції, які містять одну або декілька форм інформації, вибраних з групи, що складається із зазначення патологічного стану, у випадку якого необхідно вводити фармацевтичну композицію, інформації про зберігання фармацевтичної композиції, інформації про дози і інструкцій по введенню фармацевтичної композиції. 41. Виріб, що містить: декілька доз фармацевтичної композиції за будьяким з пп.1-40; і пакувальні матеріали. 42. Виріб за п.41, в якому пакувальний матеріал включає контейнер для зберігання декількох доз фармацевтичної композиції. 43. Виріб за п.42, в якому контейнер має етикетку, на якій вказана одна або декілька форм інформації з групи, що складається з інформації про патологічний стан, у випадку якого необхідно вводити сполуку, інформації про зберігання, інформації про дози і/або інструкцій по введенню композиції. 44. Застосування фармацевтичної композиції за будь-яким з пп.1-40 в комбінації з однією або декількома антидіабетичними сполуками, відмінними від сполуки І, для виробництва фармацевтичного засобу для лікування діабету типу II, де сполука І має формулу O N H2 N N N O F NC . 45. Застосування фармацевтичної композиції за будь-яким з пп.1-40 для виробництва фармацевтичного засобу, що містить комбінацію сполуки І і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу II, де сполука І має формулу 6 46. Застосування однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для виробництва фармацевтичного засобу, що містить комбінацію фармацевтичної композиції за будь-яким з пп.1-40 і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу II, де сполука І має формулу O N H2 N N N O F NC . 47. Застосування фармацевтичної композиції за будь-яким з пп.1-40 у комбінації з однією або декількома антидіабетичними сполуками, відмінними від сполуки І, для виробництва фармацевтичного засобу для лікування діабету типу І, де сполука І має формулу O N H2 N N N O F NC . 48. Застосування фармацевтичної композиції за будь-яким з пп.1-40 для виробництва фармацевтичного засобу, який містить комбінацію сполуки І і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу І, де сполука І має формулу O N H2 N N N O F NC . 49. Застосування однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для виробництва фармацевтичного засобу, який містить комбінацію фармацевтичної композиції за будьяким з пп.1-40 і однієї або декількох антидіабетичних сполук, відмінних від сполуки І, для лікування діабету типу І, де сполука І має формулу O N H2 N N N O F O NC N H2 N N N O F NC . . 7 Даний винахід стосується способу введення сполук, що використовуються для інгібування дипептидилпептидази IV, а також способів лікування, заснованих на вказаному введенні. Дипептидилпептидаза IV (згідно з номенклатурою ферментів IUBMB ЕС.3.4.14.5) є мембранним білком типу II, який в літературі має широку безліч назв, включаючи DPP4, DP4, DAP-IV, FAPp, білок 2, що утворює комплекс з аденозиндезаміназою, білок, що зв'язує аденозиндезаміназу (ADAbp), дипептидиламінопептидаза IV; Xaa-Proдипептидиламінопептидаза; Gly-Proнафтиламідаза; постпроліндипептидиламінопептидаза IV; лімфоцитарний антиген CD26; глікопротеїн GP110; дипептидилпептидаза IV; гліцилпролінамінопептидаза; гліцилпролінамінопептидаза; Хпролілдипептидиламінопептидаза; pep X; лейкоцитарний антиген CD26; гліцилпролілдипептидиламінопептидаза; дипептидилпептидгідролаза; гліцилпроліламінопептидаза; дипептидиламінопептидаза IV; DPP IV/CD26; аміноацилпролілдипептидиламінопептидаза; молекула Тр103, що ініціює Т-клітини; X-PDAP. Дипептидилпептидаза IV в даному описі згадується як «DPP-IV». DPP-IV є некласичною сериновою амінодипептидазою, яка відщеплює дипептиди Хаа-Рrо з амінокінця (N-кінця) поліпептидів і білків. Також повідомлялося, що залежне від DPP-IV повільне вивільнення дипептидів типу X-Gly або X-Ser відбувається у випадку деяких пептидів, що зустрічаються в природі. DPP-IV конститутивно експресується на епітеліальних і ендотеліальних клітинах безлічі різних тканин (кишечник, печінка, легеня, нирка і плацента), а також виявляється в рідинах організму. DPPIV також експресується на циркулюючих Тлімфоцитах, і було показано, що DPP-IV тотожна антигену клітинної поверхні CD-26. DPP-IV відповідальна за метаболічне розщеплення деяких ендогенних пептидів (GLP-1 (7-36), глюкагон) in vivo і проявляє протеолітичну активність проти ряду інших пептидів (GHRH, NPY, GLP2, VIP) in vitro. GLP-1 (7-36) є 29-амінокислотним пептидом, отриманим внаслідок посттрансляційного процесингу проглюкагону в тонкому кишечнику. GLP-1 (7-36) чинить безліч впливів in vivo, включаючи стимуляцію секреції інсуліну, інгібування секреції глюкагону, посилення почуття насичення і сповільнення випорожнення шлунка. На основі фізіологічного профілю вважають, що дії GLP-1 (7-36) корисні для запобігання і лікування діабету типу II і, ймовірно, ожиріння. Наприклад, виявлено, що екзогенне введення GLP-1 (7-36) (безперервна інфузія) пацієнтам з діабетом є ефективним у вказаній популяції пацієнтів. На жаль, GLP-1 (7-36) швидко розпадається in vivo і, як було показано, має короткий час напівжиття in vivo (t1/2=1,5 хвилини). На основі дослідження генетично виведених нокаутованих по DPP-IV мишей і на основі дослі 93689 8 джень in vivo/in vitro з використанням вибіркових інгібіторів DPP-IV показано, що DPP-IV є основним ферментом, що розщеплює GLP-1 (7-36) in vivo. GLP-1 (7-36) ефективно розщеплюється ферментом DPP-IV до GLP-1 (9-36), який, як передбачається, діє як фізіологічний антагоніст GLP-1 (7-36). Тому вважають, що інгібування DPP-IV in vivo застосовне для підвищення ендогенних рівнів GLP-1 (7-36) і зменшення утворення його антагоніста GLP-1 (9-36). Таким чином, вважають, що інгібітори DPP-IV є засобами, застосовними для запобігання, сповільнення прогресування і/або лікування станів, опосередкованих DPP-IV, зокрема діабету, і більш конкретно цукрового діабету типу 2, діабетичної дисліпідемії, станів порушення толерантності до глюкози (IGT), станів порушення рівня глюкози в плазмі натщесерце (IFG), метаболічного ацидозу, кетозу, регуляції апетиту і ожиріння. Показано, що декілька сполук інгібують DPPIV. Однак все ще існує потреба в нових інгібіторах DPP-IV і способах введення вказаних інгібіторів для лікування захворювання. Пропонується спосіб, що включає: введення добової дози від 1мг/добу до 250мг/добу сполуки І пацієнту, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І. В одному варіанті вводять добову дозу 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг сполуки І. В іншому варіанті один раз на тиждень вводять дозу 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг сполуки І. В одному варіанті введення здійснюють 1 раз на добу і необов'язково можуть здійснювати 1 раз на добу у вигляді однократної дози. Необов'язково введення здійснюють 1 раз на добу протягом періоду часу, що складає щонайменше 30 днів, і необов'язково протягом періоду часу, що складає щонайменше 60 днів. В одному варіанті введення здійснюють 1 раз на добу вранці і необов'язково здійснюють 1 раз на добу вранці до першої їди пацієнтом в цей день. В одному варіанті введення здійснюють 1 раз на тиждень і необов'язково можуть здійснювати 1 раз на тиждень у вигляді однократної дози. Необов'язково введення здійснюють 1 раз на тиждень протягом періоду часу, що складає щонайменше 30 днів, і необов'язково протягом періоду часу, що складає щонайменше 60 днів. В одному варіанті введення здійснюють 1 раз на тиждень вранці і необов'язково здійснюють 1 раз на тиждень вранці перед першим прийомом їжі пацієнтом в цей день. Введення можна здійснювати різними шляхами введення, включаючи, без обмеження, шлях, вибраний з групи, що складається з перорального, парентерального, внутрішньоочеревинного, внутрішньовенного, внутрішньоартеріального, трансдермального, під'язикового, внутрішньом'язового, ректального, трасбукального, інтраназального, 9 ліпосомного, інгаляційного, вагінального, внутрішньоочного, введення шляхом локальної доставки, підшкірного, введення в жирову тканину, внутрішньосуглобового, внутрішньоочеревинного і інтратекального введення. В одному конкретному варіанті введення здійснюють перорально. Сполуку І можна використовувати для лікування ряду захворювань. В одному варіанті введення сполуки І здійснюють для лікування вказаного патологічного стану у пацієнта, як діабет типу І або типу II. В іншому варіанті введення сполуки І здійснюють для лікування переддіабетичного стану пацієнта. У ще одному варіанті введення сполуки І здійснюють для лікування запального захворювання кишечника, хвороби Крона, індукованого хіміотерапією ентериту, мукозиту слизової оболонки порожнини рота або синдрому укороченої кишки. В іншому варіанті введення сполуки І здійснюють для лікування пацієнта, що страждає від станів, опосередкованих DPP-IV, таких як діабет і більш конкретно цукровий діабет типу 2; діабетична дисліпідемія; порушення толерантності до глюкози (IGT); порушення рівня глюкози в плазмі натщесерце (IFG); метаболічний ацидоз; кетоз; регуляція апетиту; ожиріння; ускладнення, пов'язані з діабетом, включаючи діабетичну нейропатію, діабетичну ретинопатію і хворобу нирок; гіперліпідемія, включаючи гіпертригліцеридемію, гіперхолестеринемію, низький рівень ЛПВЩ і постпрандіальну гіперліпідемію; артеріосклероз; гіпертонія; інфаркт міокарда, стенокардія, церебральний інфаркт, апоплексія головного мозку і метаболічний синдром. Також пропонується спосіб введення сполуки І в комбінації з однією або декількома антидіабетичними або інкретиновими сполуками, що відрізняються від сполуки І. В одному варіанті здійснюють такий спосіб комбінованої терапії, при якому пацієнту вводять добову дозу від 1мг/добу до 250мг/добу сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І. В одному варіанті добову дозу 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг сполуки І вводять пацієнту в комбінації з однією або декількома антидіабетичними сполуками, що відрізняються від сполуки І. В одному варіанті здійснюють такий спосіб комбінованої терапії, при якому пацієнту один раз на тиждень вводять дозу, що складає від 1мг до 250мг сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І. В одному варіанті пацієнту один раз на тиждень вводять дозу 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг, 150мг або 200мг сполуки І в комбінації з однією або декількома антидіабетичними сполуками, що відрізняються від сполуки І. Потрібно зазначити, що в даному винаході пропонується декілька різних діапазонів доз для конкретних антидіабетичних сполук і інкретинів. Мається на увазі, що в об'єм даного винаходу включені комбінації лікарських засобів, що охоплюють будь-який з описаних діапазонів сполуки І в 93689 10 комбінації з будь-якими описаними в даному описі1 діапазонами доз для інших антидіабетичних сполук або інкретинів. Комбінація сполуки І з однією або декількома антидіабетичними сполуками, що відрізняються від сполуки І, забезпечує чудові ефекти, такі як 1) посилення терапевтичних ефектів сполуки І і/або антидіабетичних сполук; 2) зменшення побічних ефектів сполуки І і/або антидіабетичних сполук; і 3) зменшення дози сполуки І і/або антидіабетичних сполук. Одна або декілька антидіабетичних сполук або інкретинів, що вводяться в комбінації із сполукою І, необов'язково можуть бути вибрані з групи, що складається з модуляторів шляху передачі сигналу інсуліну, сполук, що впливають на порушену регуляцію продукції глюкози в печінці, підсилювачів чутливості до інсуліну і підсилювачів секреції інсуліну. Одна або декілька антидіабетичних сполук або інкретинів, що вводяться в комбінації із сполукою І, також необов'язково можуть бути вибрані з групи, що складається з інгібіторів протеїнтирозинфосфатази, інгібіторів глутамін-фруктозо-6фосфатамідотрансферази, інгібіторів глюкозо-6фосфатази, інгібіторів фруктозо-1,6-бісфосфатази, інгібіторів глікогенфосфорилази, антагоністів рецепторів глюкагону, інгібіторів фосфоенолпіруваткарбоксикінази, інгібіторів кінази піруватдегідрогенази, інгібіторів альфа-глюкозидази, інгібіторів випорожнення шлунка, активаторів глюкокінази, агоністів рецептора GLP-1, агоністів рецептора GLP-2, модуляторів UCP, модуляторів RXR, інгібіторів GSK-3, модуляторів PPAR, метформіну, інсуліну і антагоністів α2-адренергічних рецепторів. Одна або декілька антидіабетичних сполук або інкретинів, що вводяться в комбінації із сполукою І, також необов'язково можуть бути вибрані з групи, що складається з інгібіторів GSK-3, агоністів ретиноїдного рецептора X, агоністів бета-3 AR, модуляторів UCP, антидіабетичних тіазолідиндіонів, агоністів PPAR-гамма неглітазонового типу, подвійних агоністів PPAR-гамма/PPAR-альфа, антидіабетичних ванадійвмісних сполук і бігуанідів. Одна або декілька антидіабетичних сполук або інкретинів, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою тіазолідиндіони, вибрані з групи, що складається з (S)((3,4-дигідро-2-(фенілметил)-2Н-1-бензопіран-6ш)метилтіазолідин-2,4-діону, 5-{[4-(3-(5-метил-2феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діону, 5-{[4(1метилциклогексил)метоксц)феніл]метил]тіазолідин-2,4-діону, 5{[4-(2-(1-індоліл)етокси)феніл]метил}тіазолідин2,4-діону, 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діону, 5(2-нафтилсульфоніл)тіазолідин-2,4-діону, біс{4[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метану, 5{4-[2-(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діону, 5-[4-(1феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4діону, 5-{[4-(2-(2,3-дигідроіндол-1 11 іл)етокси)фенілметил)тіазолідин-2,4-діону, 5-[3-(4хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діону, 5-[3-(4хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діону, 5-{[4-(2(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4діону, 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діону, 5-{[4-((3,4-дигідро-6-гідрокси-2,5,7,8-тетраметил2Н-1-бензопіран-2іл)метокси)феніл]метил)тіазолідин-2,4-діону, 5-[6(2-фторбензилокси)нафталін-2-ілметил]тіазолідин2,4-діону, 5-([2-(2-нафтил)бензоксазол-5іл]метил}тіазолідин-2,4-діону і 5-(2,4діоксотіазолідин-5-ілметил)-2-метокси-Н-(4трифторметилбензил)бензаміду, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, включають метформін. В одному конкретному варіанті метформін у вказаній комбінації включає одну або декілька його фармацевтично прийнятних солей. В іншому конкретному варіанті метформін у вказаній комбінації включає НСІ-сіль метформіну. У ще одному конкретному варіанті метформін у вказаній комбінації вводять в добовій дозі, що складає від 125 до 2550мг. У ще одному варіанті метформін у вказаній комбінації вводять в добовій дозі, що складає від 250 до 2550мг. В іншому варіанті одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, включають одне або декілька похідних сульфонілсечовини. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть бути вибрані з групи, що складається з глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, включають глімепірид. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть бути вибрані з групи, що складається з інкретинових гормонів або їх міметиків, антагоністів рецептора імідазоліну бета-клітин і короткочасно діючих стимуляторів секреції інсуліну. В іншому варіанті одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, включають інсулін. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою один або декілька агоністів GLP-1, включаючи, наприклад, екстендатид. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою один або декілька 93689 12 агоністів GLP-2, включаючи, наприклад, рекомбінантний GLP-2 людини. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою одне або декілька антидіабетичних похідних D-фенілаланіну. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть бути вибрані з групи, що складається з репаглініду, мітиглініду і натеглініду, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, включають гідрат кальцієвої солі мітиглініду. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою один або декілька інгібіторів альфа-глюкозидази. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть бути вибрані з групи, що складається з акарбози, воглібози і міглітолу, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одну або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, включають воглібозу. В іншому варіанті воглібозу у вказаній комбінації вводять в добовій дозі від 0,1 до 1мг. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою розиглітазон, включаючи його будь-які фармацевтично прийнятні солі. В одному варіанті розиглітазон у вказаній комбінації являє собою малеатну сіль розиглітазону. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою тезаглітазар, мураглітазар або навеглітазар, включаючи їх будь-які фармацевтично прийнятні солі. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть являти собою піоглітазон, включаючи його будь-які фармацевтично прийнятні солі. В одному варіанті піоглітазон у вказаній комбінації являє собою НСІ-сіль піоглітазону. В іншому варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 7,5 до 60мг. У ще одному варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 15 до 45мг. Одна або декілька антидіабетичних сполук, що вводяться в комбінації із сполукою І, також необов'язково можуть включати метформін і піоглітазон. В одному варіанті піоглітазон у вказаній комбінації являє собою одну або декілька його фармацевтично прийнятних солей. В іншому варіанті піоглітазон у вказаній комбінації являє собою НСІ-сіль піоглітазону. У ще одному варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 7,5 до 60мг. У ще одному варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 15 до 45мг. В іншому варіанті кожного з вказаних вище варіантів метформін у вказаній комбінації являє собою одну або декілька його фармацевтично прийнятних солей. В одному конкретному варіанті 13 метформін у вказаній комбінації являє собою НСІсіль метформіну. В іншому конкретному варіанті метформін у вказаній комбінації вводять в добовій дозі від 125 до 2550мг. У ще одному варіанті метформін у вказаній комбінації вводять в добовій дозі від 250 до 2550мг. Що стосується кожного з вказаних вище варіантів здійснення і їх варіацій, то сполуку І можна вводити у вигляді вільної основи або у вигляді її фармацевтично прийнятної солі. У конкретних варіантах сполуку І вводять у вигляді НСІ-солі, метансульфонату, сукцинату, бензоату, толуолсульфонату, R-(-)манделату або бензолсульфонатної солі сполуки І. Також пропонуються фармацевтичні композиції. В одному варіанті пропонується фармацевтична композиція, яку отримують в стандартній лікарській формі, при цьому вказана стандартна лікарська форма містить від 1мг/добу до 250мг/добу сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І. В конкретних варіантах фармацевтична композиція містить 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг сполуки І. В одному варіанті пропонується фармацевтична композиція, яку готують в стандартній лікарській формі, при цьому вказана стандартна лікарська форма містить від 1мг/тиждень до 250мг/тиждень сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І. В конкретних варіантах фармацевтична композиція містить 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг сполуки І, що вводяться один раз на тиждень. В іншому варіанті пропонується фармацевтична композиція, яка містить сполуку І і одну або декілька антидіабетичних або інкретинових сполук, що відрізняються від сполуки І, в стандартній лікарській формі. Необов'язково сполука І присутня в стандартній лікарській формі в кількості від 1мг/добу до 250мг/добу сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І. В конкретних варіантах фармацевтична композиція містить 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг сполуки І. Комбінація сполуки І з однією або декількома антидіабетичними сполуками, що відрізняються від сполуки І, забезпечує чудові дії, такі як 1) посилення терапевтичних дії сполуки І і/або антидіабетичних сполук; 2) зменшення побічних дій сполуки І і/або антидіабетичних сполук; і 3) зменшення дози сполуки І і/або антидіабетичних сполук. Згідно з вказаним вище варіантом одна або декілька антидіабетичних сполук, що входять в фармацевтичну композицію, необов'язково можуть бути вибрані з групи, що складається з модуляторів шляху передачі сигналу інсуліну, сполук, що впливають на порушену регуляцію продукції глюкози в печінці, підсилювачів чутливості до інсуліну, інкретинів і підсилювачів секреції інсуліну. 93689 14 Також згідно з вказаним вище варіантом одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, необов'язково можуть бути вибрані з групи, що складається з інгібіторів протеїнтирозинфосфатаз, інгібіторів глутамін-фруктозо-6-фосфатамідотрансферази, інгібіторів глюкозо-6-фосфатази, інгібіторів фруктозо-1,6-бісфосфатази, інгібіторів глікогенфосфорилази, антагоністів рецептора глюкагону, інгібіторів фосфоенолпіруваткарбоксикінази, інгібіторів кінази піруватдегідрогенази, інгібіторів альфаглюкозидази, інгібіторів випорожнення шлунка, активаторів глюкокінази, агоністів рецептора GLP1, агоністів рецептора GLP-2, модуляторів UCP, модуляторів RXR, інгібіторів GSK-3, модуляторів PPAR, метформіну, інсуліну і антагоністів α2адренергічних рецепторів. Також згідно з вказаним вище варіантом одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, необов'язково можуть бути вибрані з групи, що складається з інгібіторів GSK-3, агоністів ретиноїдного рецептора X, агоністів бета-3 AR, модуляторів UCP, антидіабетичних тіазолідиндіонів, агоністів PPARгамма неглітазонового типу, подвійних агоністів PPAR-гамма/PPAR-альфа, антидіабетичних ванадійвмісних сполук і бігуанідів. Також згідно з вказаним вище варіантом одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, необов'язково можуть являти собою тіазолідиндіони, вибрані з групи, що складається з (S)-((3,4-дигідро-2(фенілметил)-2Н-1-бензопіран-6іл)метилтіазолідин-2,4-діону, 5-{[4-(3-(5-метил-2феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діону, 5-{[4(1метилциклогексил)метокси)феніл]метил]тіазолідин-2,4-діону, 5{[4-(2-(1-індоліл)етокси)феніл]метил}тіазолідин2,4-діону, 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діону, 5(2-нафтилсульфоніл)тіазолідин-2,4-діону, біс{4[(2,4-діоксо-5-тіазолідиніл)метил]феніл}метану, 5{4-[2-(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діону, 5-[4-(1феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4діону, 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діону, 5-[3-(4хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діону, 5-[3-(4хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діону, 5-{[4-(2(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4діону, 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діону, 5-{[4-((3,4-дигідро-6-гідрокси-2,5,7,8-тетраметил2Н-1-бензопіран-2іл)метокси)феніл]метил)тіазолідин-2,4-діону, 5-[6(2-фторбензилокси)нафталін-2-ілметил]тіазолідин2,4-діону, 5-{[2-(2-нафтил)бензоксазол-5іл]метил}тіазолідин-2,4-діону і 5-(2,4діоксотіазолідин-5-ілметил)-2-метокси-N-(4 15 трифторметилбензил)бензаміду, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають метформін. В одному конкретному варіанті метформін у вказаній комбінації включає одну або декілька його фармацевтично прийнятних солей. В іншому конкретному варіанті метформін у вказаній комбінації являє собою НСІ-сіль метформіну. У ще одному конкретному варіанті метформін у вказаній комбінації вводять в добовій дозі, що складає від 125 до 2550мг. У ще одному варіанті метформін у вказаній комбінації вводять в добовій дозі, що складає від 250 до 2550мг. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають одне або декілька похідних сульфонілсечовини. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають антидіабетичну сполуку, вибрану з групи, що складається з глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають глімепірид. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають антидіабетичну сполуку, вибрану з групи, що складається з інкретинових гормонів або їх міметиків, антагоністів рецептора імідазоліну бета-клітин і короткочасно діючих стимуляторів секреції інсуліну. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають інсулін. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають один або декілька агоністів GLP-1. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають один або декілька агоністів GLP-2, включаючи, наприклад, рекомбінантні форми GLP-2 людини. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають одне або декілька антидіабетичних похідних D-фенілаланіну. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають антидіабетичну сполуку, вибрану з групи, що складається з репаглініду і натеглініду, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають гідрат кальцієвої солі мітиглініду. 93689 16 В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають один або декілька інгібіторів альфа-глюкозидази. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають антидіабетичну сполуку, вибрану з групи, що складається з акарбози, воглібози і міглітолу, включаючи їх будь-які фармацевтично прийнятні солі. В одному варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають воглібозу. В іншому варіанті воглібозу у вказаній комбінації вводять в добовій дозі від 0,1 до 1мг. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають розиглітазон, включаючи його будь-які фармацевтично прийнятні солі. В одному варіанті розиглітазон у вказаній комбінації являє собою малеатну сіль розиглітазону. Одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, також необов'язково можуть являти собою тезаглітазар, мураглітазар або навеглітазар, включаючи їх будь-які фармацевтично прийнятні солі. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають піоглітазон, включаючи його будь-які фармацевтично прийнятні солі. В одному конкретному варіанті піоглітазон у вказаній комбінації являє собою НСІ-сіль піоглітазону. В іншому конкретному варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 7,5 до 60мг. У ще одному конкретному варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 15 до 45мг. В іншому варіанті одна або декілька антидіабетичних сполук, що входять до складу фармацевтичної композиції, включають метформін і піоглітазон. В одному конкретному варіанті піоглітазон у вказаній комбінації являє собою одну або декілька його фармацевтично прийнятних солей. В іншому конкретному варіанті піоглітазон у вказаній комбінації являє собою НСІ-сіль піоглітазону. У ще одному конкретному варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 7,5 до 60мг. У ще одному конкретному варіанті піоглітазон у вказаній комбінації вводять в добовій дозі від 15 до 45мг. В іншому варіанті кожного з вказаних вище варіантів метформін у вказаній комбінації являє собою одну або декілька його фармацевтично прийнятних солей. У ще одному варіанті метформін у вказаній комбінації являє собою НСІ-сіль метформіну. В іншому варіанті метформін у вказаній комбінації вводять в добовій дозі від 125 до 2550мг. У ще одному варіанті метформін у вказаній комбінації вводять в добовій дозі від 250 до 2550мг. Що стосується кожного з вказаних вище варіантів здійснення і їх варіацій, що стосуються фармацевтичних композицій, то сполуку І можна вводити у вигляді вільної основи або у вигляді її фармацевтично прийнятної солі. У конкретних 17 варіантах сполуку І вводять у вигляді НСІ-солі, метансульфонату, сукцинату, бензоату, толуолсульфонату, R-(-)манделату або бензолсульфонатної солі сполуки І. Також відносно вказаних вище варіантів здійснення і їх варіацій, що стосуються фармацевтичних композицій, фармацевтична композиція необов'язково може бути у вигляді стандартної лікарської форми, застосовної для перорального введення, необов'язково в формі твердого препарату, застосовного для перорального введення, і необов'язково в формі таблетки або капсули, застосовної для перорального введення. Фармацевтичний препарат також може являти собою препарат повільного вивільнення, застосовний для перорального введення. Також відносно кожного з вказаних вище варіантів здійснення і їх варіацій, що стосуються фармацевтичних композицій, фармацевтична композиція може бути використана для запобігання або лікування станів, опосередкованих DPP-IV, таких як діабет і більш конкретно цукровий діабет типу 2; діабетична дисліпідемія; порушення толерантності до глюкози (IGТ); порушення рівня глюкози в плазмі натщесерце (IFG); метаболічний ацидоз; кетоз; регуляція апетиту; ожиріння; ускладнення, пов'язані з діабетом, включаючи діабетичну нейропатію, діабетичну ретинопатію і хворобу нирок; гіперліпідемія, включаючи гіпертригліцеридемію, гіперхолестеринемію, низький рівень ЛПВЩ і постпрандіальну гіперліпідемію; артеріосклероз; гіпертонія; інфаркт міокарда, стенокардія, церебральний інфаркт, апоплексія головного мозку і метаболічний синдром. Також відносно кожного з вказаних вище варіантів здійснення і їх варіацій, що стосуються фармацевтичних композицій, фармацевтична композиція необов'язково може бути у вигляді стандартної лікарської форми, застосовної для парентерального (підшкірного, внутрішньовенного, субдермального або внутрішньом'язового) введення, необов'язково в формі препарату у вигляді розчину, застосовного для парентерального введення, і необов'язково в формі препарату у вигляді суспензії, застосовної для парентерального введення. Фармацевтичний препарат також може являти собою препарат повільного вивільнення, застосовний для перорального введення. Також пропонуються набори, що містять декілька доз фармацевтичної композиції згідно з даним винаходом. В одному варіанті набори додатково містять інструкції, в яких є одна або декілька форм інформації, вибрані з групи, що складається із зазначення патологічного стану, у разі якого необхідно вводити фармацевтичну композицію, інформації про зберігання фармацевтичної композиції, інформації про дози, і інструкцій по введенню фармацевтичної композиції. Також пропонуються вироби, що містять декілька доз фармацевтичної композиції згідно з даним винаходом. В одному варіанті виробу додатково містяться матеріали упаковки, такі як контейнер для зберігання декількох доз фармацевтичної композиції і/або етикетка, що вказує одну 93689 18 або декілька форм інформації з групи, що складається із зазначення патологічного стану, у разі якого необхідно вводити сполуку, інформації про зберігання, інформації про дози і/або інструкцій по введенню композиції. Відносно всіх вказаних вище варіантів здійснення потрібно зазначити, що варіанти необхідно інтерпретувати як неостаточні, з можливими поправками в тому значенні, що способи можуть включати додаткові дії, крім вказаних, включаючи введення пацієнту інших фармацевтично активних речовин. Подібним чином, якщо не обумовлено особливо, фармацевтичні композиції, набори і вироби додатково можуть містити інші речовини, включаючи інші фармацевтично активні речовини. На кресленні (Фіг.) показане інгібування DPPIV в плазмі після однократного перорального введення сполуки І мавпі. Визначення Якщо не обумовлено особливо, наступні терміни, що використовуються в описі і формулі винаходу, з метою даного опису повинні мати наступні значення. «Захворювання» зокрема включає будь-який патологічний стан тварини або її частини і включає патологічний стан, який може бути викликаний або виникає внаслідок медичного або ветеринарного лікування, що застосовується по відношенню до вказаної тварини, тобто «побічні дії» вказаної терапії. «Фармацевтично прийнятний» означає застосовний для отримання фармацевтичної композиції, яка загалом безпечна, нетоксична і не є біологічно або в іншому відношенні неприйнятною, і включає компоненти, прийнятні для застосування у ветеринарії, а також фармацевтичного застосування на людині. «Фармацевтично прийнятні солі» означає солі, які є фармацевтично прийнятними, як визначено вище, і які мають необхідну фармакологічну активність. Вказані солі включають, без обмеження, кислотно-адитивні солі, утворені з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і тому подібні; або з органічними кислотами, такими як оцтова кислота, трифтороцтова кислота, пропіонова кислота, капронова кислота, гептанова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, малонова кислота, янтарна кислота, яблучна кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, о-(4гідроксибензоїл)бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, п-хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, птолуолсульфонова кислота, камфорсульфонова кислота, 4-метилбіцикло[2.2.2]окт-2-ен-1карбонова кислота, глюкогептонова кислота, 4,4'метиленбіс(3-гідроксі-2-ен-1-карбонова кислота), 3-фенілпропіонова кислота, трим етил оцтова кислота, трет-бутилоцтова кислота, лаурилсірчана 19 кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота і тому подібні. Фармацевтично прийнятні солі також включають, без обмеження, основно-адитивні солі, які можуть бути утворені, коли наявні протони кислоти здатні взаємодіяти з неорганічними або органічними основами. Прийнятні неорганічні основи включають, без обмеження, гідроксид натрію, карбонат натрію, гідроксид калію, гідроксид алюмінію і гідроксид кальцію. Прийнятні органічні основи включають, без обмеження, етаноламін, діетаноламін, триетаноламін, трометамін, Nметилглюкамін і тому подібні. «Терапевтично ефективна кількість» означає таку кількість сполуки, яка при введенні тварині для лікування захворювання є достатньою для здійснення вказаного лікування захворювання. «Лікування» або «здійснення лікування» означає будь-яке введення терапевтично ефективної кількості сполуки і включає: (1) запобігання появі захворювання у тварини, яка може бути схильна до захворювання, але ще не хворіє на нього або у якого ще не виявляється патологія або симптоматика захворювання, (2) пригнічення захворювання у тварини, яка хворіє на нього або у якої виявляється патологія або симптоматика захворювання (тобто зупинку подальшого розвитку патології і/або симптоматики), або (3) ослаблення захворювання у тварини, яка хворіє на нього або у якої виявляється патологія або симптоматика захворювання (тобто ремісії патології і/або симптоматики). 1. 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрил і його композиції Даний винахід загалом стосується введення 2[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрилу (званого в даному описі «сполука І»), структура якого представлена нижче. Приклад 1 описує один спосіб синтезу сполуки І. Слід зазначити, що можуть бути використані інші способи синтезу сполуки І, які можуть бути відомі фахівцеві в даній галузі. Сполуку І можна вводити в формі вільної основи, а також можна вводити в формі солей, гідратів і проліків, які перетворюються in vivo в форму вільної основи сполуки І. Наприклад, в об'єм даного винаходу включене введення сполуки І у вигляді фармацевтично прийнятної солі, отриманої з використанням різних органічних і неорганічних кислот і основ способами, добре відомими в даній галузі. У значенні, що використовується в даному описі мається на увазі, що сполука І охоплює солі, 93689 20 гідрати і проліки сполуки І, якщо не обумовлено особливо. Фармацевтично прийнятна сіль сполуки І переважно має поліпшені фармакокінетичні властивості в порівнянні з формою вільної основи сполуки І. Фармацевтично прийнятні солі також початково можуть додавати необхідні фармакокінетичні властивості сполуці І, яких вона раніше не мала, і навіть можуть позитивно впливати на фармакодинаміку сполуки відносно терапевтичної активності в організмі. Конкретні приклади солей, гідратів і проліків сполуки І включають, без обмеження, форми солей, утворених неорганічними або органічними кислотами, наприклад, гідрогалогеніди, такі як гідрохлорид, гідробромід, гідройодид; інші неорганічні кислоти і відповідні солі вказаних кислот, такі як сульфат, нітрат, фосфат і т.д.; алкіл- і моноарилсульфонати, такі як етансульфонат, толуолсульфонат і бензолсульфонат; і інші органічні кислоти і відповідні солі вказаних кислот, такі як ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, саліцилат і аскорбат. Наступні кислотноадитивні солі включають без обмеження: адипат, альгінат, аргінат, аспартат, бісульфат, бісульфіт, бромід, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, циклопентанпропіонат, диглюконат, дигідрофосфат, динітробензоат, додецилсульфат, фумарат, галактерат (з муцинової кислоти), галактуронат, глюкогептаноат, глюконат, глутамат, гліцерофосфат, гемісукцинат, гемісульфат, гептаноат, гексаноат, гіпурат, гідрохлорид, гідробромід, гідройодид, 2гідроксіетансульфонат, йодид, ізетіонат, ізобутират, лактат, лактобіонат, малат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногідрофосфат, 2-нафталінсульфонат, нікотинат, нітрат, оксалат, олеат, памоат, пектинат, персульфат, фенілацетат, 3-фенілпропіонат, фосфат, фосфонат і фталат. У конкретних варіантах сполуку І вводять у вигляді НСІ-солі, метансульфонату, сукцинату, бензоату, толуолсульфонату, R-(-)манделату або бензолсульфонатної солі сполуки І. В прикладі 1 описано отримання сукцинатної солі сполуки І. 2. Введення і застосування сполуки І Даний винахід, загалом, стосується способу, що включає введення сполуки І пацієнту в добовій дозі від 1мг/добу до 250мг/добу сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І (в кожному випадку в розрахунку на основі молекулярної маси форми вільної основи сполуки І). Конкретні дозові кількості, які можна застосовувати, включають, без обмеження, 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг і 100мг сполуки І на добу. Потрібно зазначити, що, якщо не обумовлено особливо, сполуку І можна вводити в формі вільної основи або у вигляді фармацевтично прийнятної солі. Однак дозові кількості і діапазони, наведені в даному описі, завжди засновані на молекулярній масі форми вільної основи сполуки І. Даний винахід також стосується способу, що включає введення сполуки І пацієнту один раз на 21 тиждень в дозі від 1мг/добу до 250мг/добу сполуки І, необов'язково від 10мг до 200мг сполуки І, необов'язково від 10мг до 150мг сполуки І і необов'язково від 10мг до 100мг сполуки І (в кожному випадку в розрахунку на основі молекулярної маси форми вільної основи сполуки І). Конкретні дозові кількості, які можна застосовувати, включають, без обмеження, 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг і 100мг сполуки І на тиждень по схемі введення один раз на тиждень. Потрібно зазначити, що якщо не обумовлено особливо, сполуку І можна вводити в формі вільної основи або у вигляді фармацевтично прийнятної солі. Однак дозові кількості і діапазони, наведені в даному описі, завжди засновані на молекулярній масі форми вільної основи сполуки І. Сполуку І можна вводити будь-яким способом введення. Однак в конкретних варіантах спосіб згідно з даним винаходом здійснюють на практиці пероральним введенням сполуки І. Вказаний тип введення має переваги, оскільки є простим, і пацієнт може здійснювати введення самостійно. Сполуку І можна вводити один або декілька разів на добу. Однак перевага даного винаходу полягає в тому, що сполуку І можна ефективно вводити при рівнях доз, вказаних в даному описі, один раз на добу, а також можна вводити в стандартній лікарській формі один раз на добу. Наявність можливості вводити сполуку І при дотриманні рівнів доз, вказаних в даному описі, тільки один раз на добу і перорально, полегшує пацієнтам самостійне введення сполуки І, таким чином поліпшуючи дотримання режиму прийому пацієнтами, яким потрібно інгібування in vivo активності DPP-IV. Перевага полягає в тому, що сполука І підходить для тривалого безперервного застосування і її можна вводити пацієнтам протягом тривалого періоду часу. Відповідно можна здійснювати спосіб, при якому сполуку І вводять пацієнту кожний день (необов'язково 1 раз на день) протягом періоду часу, що складає щонайменше 1 місяць, необов'язково протягом щонайменше 3 місяців і при необхідності необов'язково протягом всього захворювання пацієнтів. Внаслідок тривалої інгібуючої дії сполук І на DPP-IV, передбачається, що може бути використана схема дозування з менш частим введенням, ніж один раз на добу. Перевага полягає в тому, що сполуку І можна вводити в будь-який час доби. Необов'язково сполуку І вводять щодня один раз на добу, при цьому введення здійснюють вранці до їди. Оскільки сполука І може стимулювати секрецію інсуліну, коли рівень глюкози в крові стає вищим за 100мг/дл, то може бути корисною наявність сполуки І в кровообігу до підвищення рівня глюкози в крові, яке відбувається після їди. Сполуку І можна вводити будь-якому пацієнту, який отримує користь від лікування, що приводить до зменшення активності DPP-IV in vivo. На Фіг. і в прикладі 3 описана дія, що спостерігається, яку чинить введення сполуки І на активність DPP-IV в плазмі мавп після однократного перорального введення. 93689 22 Як можна бачити за даними, показаним на Фіг.1, за допомогою введення сполуки І один раз на добу на рівні доз, вказаних в даному описі, сполуку І можна ефективно використовувати відносно патологічних станів, при яких потрібне зменшення активності DPP-IV в плазмі. Беручи до уваги представлені дані, вважають, що при введенні пацієнту щонайменше 2,5мг сполуки І, активність DPP-IV в плазмі пацієнта може бути знижена на більш, ніж 60% в порівнянні з вихідним рівнем протягом періоду часу, що складає щонайменше 6 годин, 12 годин, 18 годин і навіть 24 години після введення. Приклади конкретних застосувань способу на основі введення сполуки І включають, без обмеження, попередження, сповільнення прогресування і/або лікування станів, опосередкованих DPPIV, зокрема діабету і більш конкретно цукрового діабету типу 2, діабетичної дисліпідемії, порушення толерантності до глюкози (IGT), порушення рівня глюкози в плазмі натщесерце (IFG), метаболічного ацидозу, кетозу, регуляції апетиту, ожиріння і ускладнень, пов'язаних з діабетом, включаючи діабетичну нейропатію, діабетичну ретинопатію, запального захворювання кишечника, хвороби Крона, індукованого хіміотерапією ентериту, мукозиту слизової оболонки рота, синдрому укороченої кишки і захворювання нирок. Стани, опосередковані DPP-IV, крім того, включають гіперліпідемію, таку як гіпертригліцеридемія, гіперхолестеринемія, низький рівень ЛПВЩ і постпрандіальна гіперліпідемія; артеріосклероз; гіпертонію; інфаркт міокарда, стенокардію, церебральний інфаркт, апоплексію головного мозку і метаболічний синдром. Передбачається, що введення сполуки І пацієнтам з діабетом типу І або типу II після мінімального лікування щонайменше протягом 30 діб буде поліпшувати один або декілька показників серцево-судинної системи. Приклади показників серцево-судинної системи, які можуть бути поліпшені, включають, без обмеження, зниження середнього систолічного кров'яного тиску, збільшення рівня холестерину ЛПВЩ, поліпшення співвідношення ЛПНП/ЛПВЩ і зменшення рівня тригліцеридів. Також передбачається, що введення сполуки І в комбінації з одним або декількома антидіабетичними сполуками пацієнтам з діабетом типу І або типу II після мінімального лікування протягом щонайменше 30 діб, буде поліпшувати один або декілька показників серцево-судинної системи. Приклади показників серцево-судинної системи, які можуть бути поліпшені, включають, без обмеження, зниження середнього систолічного кров'яного тиску, збільшення рівня холестерину ЛПВЩ, поліпшення співвідношення ЛПНП/ЛПВЩ і зменшення рівня тригліцеридів. Також передбачається, що введення сполуки І в комбінації з одним або декількома антидіабетичними засобами або інкретинами пацієнтам з шлунково-кишковими запальними захворюваннями (включаючи, без обмеження, запальне захворювання кишечника, хворобу Крона, індукований хіміотерапією ентерит, мукозит слизової оболонки ротової порожнини і синдром укороченої кишки) після мінімального лікування протягом щонайменше 30 діб буде поліпшувати стан слизової оболо 23 нки, що вистилає шлунково-кишковий тракт. Показниками поліпшення стану слизової оболонки, що вистилає шлунково-кишковий тракт, можуть бути необов'язково збільшення площі поверхні кишечника, зменшення запалення і/або збільшення всмоктування поживних речовин. В одному варіанті сполуку І вводять пацієнту з діабетом типу 2. Пацієнти, що одержують сполуку І, також можуть мати порушення функції секреції інсуліну з острівців підшлункової залози, а не розвинену резистентність до інсуліну в периферичних чутливих до інсуліну тканинах/органі. Перевага полягає в тому, що введення сполуки І один раз на добу або один раз на тиждень при рівнях доз, вказаних в даному описі, також можна використовувати для лікування пацієнтів, у яких має місце переддіабетичний стан. Передбачається, що введення сполуки І пацієнту, у якого є переддіабетичний стан, служить для сповільнення розвитку діабету типу II у вказаного пацієнта. Тривале збільшення рівня глюкози в крові десенсибілізує функцію острівців підшлункової залози і порушує секрецію інсуліну. При підвищенні рівнів циклічного АМФ і поліпшенні динаміки кальцію в бета-клітинах активуються гени, що поновлюють пошкоджені клітинні компоненти, і клітини стають менш схильними до токсичної дії глюкози. Передбачається, що введення сполуки І один раз на добу або один раз на тиждень при рівнях доз, вказаних в даному описі, чинить ряд бажаних біологічних дій in vivo. Наприклад, введення сполуки І один раз на добу або один раз на тиждень при рівнях доз, вказаних в даному описі, знижує рівень глюкози в крові пацієнта в порівнянні з контролем у вигляді плацебо. Вказане зниження постпрандіальних рівнів глюкози в крові допомагає пацієнтам з діабетом підтримувати більш низькі рівні глюкози. Також передбачається, що введення сполуки І один раз на добу або один раз на тиждень при рівнях доз, вказаних в даному описі, впливає у вигляді збільшення рівня інсуліну у пацієнта або чутливості до інсуліну. Інсулін сприяє надходженню глюкози в м'язову, жирову і декілька інших тканин. Механізм, за допомогою якого клітини можуть поглинати глюкозу, здійснюється за допомогою полегшеної дифузії при стимуляції рецептора інсуліну. С-пептид і інсулін являють собою ланцюги білка, що утворюються при активації і розщепленні проінсуліну (неактивного попередника інсуліну). Спептид і інсулін утворюються і зберігаються в бета-клітинах підшлункової залози. Коли інсулін вивільняється в кров'яне русло, також вивільняються рівні кількості С-пептиду. Це робить С-пептид застосовним як маркер продукції інсуліну. Передбачається, що введення сполуки І згідно з даним винаходом збільшує рівень С-пептиду у пацієнта. Також передбачається, що введення сполуки І один раз на добу при рівнях доз, вказаних в даному описі, впливає у вигляді зниження рівня гемоглобіну А 1с у пацієнта на більш, ніж 0,5% в порівнянні з контролем у вигляді плацебо після тривалого лікування сполукою І. Крім того, також передбачається, що введення сполуки І один раз на тиждень при рівнях доз, вказаних в даному 93689 24 описі, впливає у вигляді зниження рівня гемоглобіну Ale у пацієнта на більш, ніж 0,2% в порівнянні з контролем у вигляді плацебо після тривалого лікування сполукою І. Відомо, що значення Нb-А1с прямо пропорційні концентрації глюкози в крові, що спостерігається протягом періоду часу, який відповідає тривалості життя еритроцитів. Таким чином, Нb-А1с є показником рівнів глюкози в крові пацієнта в останні попередні 90 днів, особливо в останні 30 днів. Таким чином, зменшення рівня гемоглобіну, що спостерігається Ale у пацієнта, підтверджує стійке зниження рівнів глюкози в крові пацієнта внаслідок введення сполуки І один раз на добу у разі рівнів доз, вказаних в даному описі. 3. Комбінована терапія, що включає сполуку І Даний винахід також стосується застосування сполуки І в комбінації з однією або декількома іншими антидіабетичними сполуками і/або інкретинами. Приклади інших антидіабетичних сполук включають, без обмеження, модулятори шляху передачі сигналу інсуліну, подібні до інгібіторів протеїнтирозинфосфатази (РТР-ази) і інгібіторів глутамін-фруктозо-6-фосфатамідотрансферази (GFAT); сполуки, що впливають на порушену регуляцію продукції глюкози в печінці, подібні до інгібіторів глюкозо-6-фосфатази (G6P-ази), інгібіторів фруктозо-1,6-бісфосфатази (F-1,6-BP-aзи), інгібіторів глікогенфосфорилази (GP), антагоністів рецептора глюкагону і інгібіторів фосфоенолпіруваткарбоксикінази (РЕРСК); інгібітори кінази піруватдегідрогенази (PDHK); підсилювачі чутливості до інсуліну (сенсибілізатори інсуліну); підсилювачі секреції інсуліну (стимулятори секреції інсуліну); інгібітори альфа-глюкозидази; інгібітори випорожнення шлунка; активатори глюкокінази, агоністи рецептора GLP-1, агоністи рецептора GLP-2, модулятори UCP, модулятори RXR, інгібітори GSK-3, модулятори PPAR, метформін, інсулін; і антагоністи α2-адренергічних рецепторів. Сполуку І можна вводити щонайменше з однією іншою антидіабетичною сполукою або одночасно у вигляді однієї дози, в один час у вигляді роздільних доз або послідовно (тобто коли одну сполуку вводять до або після іншої сполуки). Приклади інгібіторів РТР-ази, які можна використати в комбінації із сполукою І, включають, без обмеження, інгібітори, описані в патентах США №№6057316, 6001867 і публікаціях РСТ №№WO 99/58518, WO 99/58522, WO 99/46268, WO 99/46267, WO 99/46244, WO 99/46237, WO 99/46236 і WO 99/15529. Приклади інгібіторів GFAT, які можна використовувати в комбінації із сполукою І, включають, без обмеження, інгібітори, описані в Моl. Cell. Endocrinol. 1997, 135(1), 67-77. Приклади інгібіторів G6P-aзи, які можна використовувати в комбінації із сполукою І, включають, без обмеження, інгібітори, описані в публікаціях РСТ №№WO 00/14090, WO 99/40062 і WO 98/40385, публікації європейського патенту №ЕР682024 і в Diabetes 1998, 47,1630-1636. Приклади інгібіторів F-1,6-BP-aзи, які можна використати в комбінації із сполукою І, включають, без обмеження, інгібітори, описані в публікаціях 25 РСТ №№WO 00/14095, WO 99/47549, WO 98/39344, WO 98/39343 і WO 98/39342. Приклади інгібіторів GP, які можна використати в комбінації із сполукою І, включають, без обмеження, інгібітори, описані в патенті США №5998463, публікаціях РСТ №№WO 99/26659, WO 97/31901, WO 96/39384 і WO9639385 і публікаціях європейських патентів №№ЕР 978279 і ЕР 846464. Приклади антагоністів рецепторів глюкагону, які можна використати в комбінації із сполукою І, включають, без обмеження, антагоністи, описані в патентах США №№5880139 і 5776954, публікаціях РСТ №№WO 99/01423, WO 98/22109, WO 98/22108, WO 98/21957, WO 97/16442 і WO 98/04528, і антагоністи, описані в Bioorg. Med. Chem. Lett 1992, 2, 915-918, J. Med. Chem. 1998, 41, 5150-5157, і J. Biol Chem. 1999, 274, 8694-8697. Приклади інгібіторів РЕРСК, які можна використати в комбінації із сполукою І, включають, без обмеження, інгібітори, описані в патенті США №6030837 і в Моl. Biol. Diabetes 1994, 2, 283-99. Приклади інгібіторів PDHK, які можна використати в комбінації із сполукою І, включають, без обмеження, інгібітори, описані в J. Med. Chem. 42 (1999) 2741-2746. Приклади підсилювачів чутливості до інсуліну, які можна використати в комбінації із сполукою І, включають, без обмеження, інгібітори GSK-3, агоністи ретиноїдного рецептора X (RXR), агоністи бета-3 AR, модулятори UCP, антидіабетичні тіазолідиндіони (глітазони), агоністи PPAR-гамма неглітазонового типу, подвійні агоністи РРАRгамма/РРАR-альфа, антидіабетичні ванадійвмісні сполуки і бігу аніди, такі як метформін. Приклади інгібіторів GSK-3 включають, без обмеження, інгібітори, описані в публікаціях РСТ №№WO 00/21927 і WO 97/41854. Приклади модуляторів RXR включають, без обмеження, модулятори, описані в патентах США №№4981784, 5071773, 5298429 і 5506102 і публікаціях РСТ №№WO89/05355, WO91/06677, WO92/05447, WO93/11235, WO95/18380, WO94/23068 і WO93/23431. Приклади агоністів бета-3 AR включають, без обмеження, CL-316243 (Lederle Laboratories) і агоністи, описані в патенті США №5705515 і публікаціях РСТ №№WO 99/29672, WO 98/32753, WO 98/20005, WO 98/09625, WO 97/46556 і WO 97/37646. Приклади модуляторів UCP включають агоністи UCP-1, UCP-2 і UCP-3. Приклади модуляторів UCP включають, без обмеження, модулятори, описані в Vidal-Puig et al., Biochem. Biophys. Res. Commun., Vol. 235(1) pp.79-82 (1997). Приклади антидіабетичних тіазолідиндіонів, що модулюють PPAR, (глітазонів) включають, без обмеження, (S)-((3,4-дигідро-2-(фенілметил)-2Н-1бензопіран-6-іл)метилтіазолідин-2,4-діон (енглітазон), 5-{[4-(3-(5-метил-2-феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діон (дарглітазон), 5-{[4-(1метилциклогексил)метокси)феніл]метил]тіазолідин-2,4-діон (циглітазон), 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон 93689 26 (DRF2189), 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діон (ВМ13.1246), 5-(2-нафтилсульфоніл)тіазолідин-2,4діон (AY-31637), біс{4-[(2,4-діоксо-5тіазолідиніл)метил]феніл}метан (YM268), 5-{4-[2(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діон (AD5075), 5-[4-(1-феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4діон (DN-108), 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діон, 5-[3-(4хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4хлорфеніл])-2-пропініл]-5-(4фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4діон (розиглітазон), 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон; що продається під торговою маркою ACTOS™), 5-[6-(2-фторбензилокси)нафталін-2ілметил]тіазолідин-2,4-діон (МСС555), 5-([2-(2нафтил)бензоксазол-5-іл]метил}тіазолідин-2,4-діон (Т-174), едаглітазон (ВМ-13-1258), ривоглітазон (CS-011) і 5-(2,4-діоксотіазолідин-5-ілметил)-2метокси-N-(4-трифторметилбензил)бензамід (KRP297). Приклади агоністів PPAR-гамма неглітазонового типу включають, без обмеження, аналоги N(2-бензоїлфеніл)-L-тирозину, такі як GI-262570, регліксан (JTT501) і FK-614 і метаглідазен (МВХ102). Приклади подвійних агоністів РРАRгамма/РРАR-альфа включають, без обмеження, омега-[(оксохіназолінілалкокси)феніл]алканоати і їх аналоги, включаючи такі, які описані в публікації РСТ №WO 99/08501 і Diabetes 200O, 49(5), 759767; тезаглітазар, мураглітазар і навеглітазар. Приклади антидіабетичних ванадійвмісних сполук включають, без обмеження, сполуки, описані в патенті США №5866563. Метформін (диметилдигуанід) і його гідрохлоридна сіль продаються під торговою маркою GLUCOPHAGE™ Приклади підсилювачів секреції інсуліну включають, без обмеження, антагоністи рецептора глюкагону (які описані вище), похідні сульфонілсечовини, інкретинові гормони або їх міметики, особливо глюкагон-подібний пептид-1 (GLP-1) або агоністи GLP-1, антагоністи рецептора імідазоліну бета-клітин і короткочасно діючі стимулятори секреції інсуліну, подібні до антидіабетичних похідних фенілоцтової кислоти, антидіабетичні похідні Dфенілаланіну і мітиглінід і його фармацевтично прийнятні солі. Приклади похідних сульфонілсечовини включають, без обмеження, глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид. Толбутамід, глібенкламід, гліклазид, гліборнурид, гліквідон, глізоксепід і глімепірид можна вводити в формі, в якій вони продаються під торговими марками RASTINON HOECHST™, AZUGLUCON™, DIAMICRONT™, 27 GLUBORID™, GLURENORM™, PRO-DIABAN™ і AMARYL™, відповідно. Приклади агоністів GLP-1 включають, без обмеження, агоністи, описані в патентах США №№5120712, 5118666 і 5512549 і публікаціях РСТ №WO 91/11457. Зокрема, агоністи GLP-1 включають сполуки, подібні до GLP-1 (7-37), в якому амідна функціональна група на карбоксильному кінці Arg36 замінена Gly в положенні 37 молекули GLP1 (7-36)NH2, і його варіанти і аналоги, включаючи GLN9-GLP-1 (7-37), D-GLN9-GLP-1 (7-37), aцeтилLYS9-GLP-1 (7-37), LYS18-GLP-1 (7-37) і, зокрема, GLP-1 (7-37)OH, VAL8-GLP-1 (7-37), GLY8-GLP-1 (7-37), THR8-GLP-1 (7-37), GLP-1 (7-37) і 4імідазопропіоніл-ОЕР-1. Одним конкретним прикладом агоніста GLP-1 є екстендатид, амід 39-амінокислотного пептиду, який продається під торговою маркою BYETTA™. Ексенатид має емпіричну формулу C184H282N50O60S і молекулярну масу 4186,6 дальтон. Ексенатид має наступну амінокислотну послідовність: H-His-Gly-Glu-Gly-Thr-Phe-Thr-SerAsp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-ArgLeu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-SerSer-Gly-Ala-Pro-Pro-Pro-Ser-NH2. Приклади глюкагон-подібного пептиду-2 (GLP2) або агоністів GLP-2 включають, без обмеження, сполуки, описані в патенті США №7056886 і публікаціях РСТ №№WO 00/53208, WO 01/49314 і WO 03/099854. Одним конкретним прикладом агоніста GLP-2 є TEDUGLUTIDE™, амід 39амінокислотного пептиду (NPS Pharmaceuticals, Inc.). Приклади антагоністів рецептора імідазоліну бета-клітин включають, без обмеження, антагоністи, описані в публікації РСТ №WO 00/78726 і в J. Pharmacol. Exp. Ther. 1996, 278, 82-89. Прикладом антидіабетичного похідного фенілоцтової кислоти є репаглінід і його фармацевтично прийнятні солі. Приклади антидіабетичних похідних Dфенілаланіну включають, без обмеження, натеглінід (N-[(транс-4-ізопропілциклогексил)карбоніл]-Офенілаланін, ЕР 196222 і ЕР 526171) і репаглінід ((S)-2-етокси-4-{2-[[3-метил-1-[2-(1піперидиніл)феніл]бутил]аміно]-2оксоетил}бензойна кислота, ЕР 0147850 А2 і ЕР 0207331 А1). Мається на увазі, що натеглінід включає конкретні кристалічні форми (поліморфи), описані в патенті США №5488510 і публікації європейського патенту №ЕР 0526171 В1. Репаглінід і натеглінід можуть бути введені в формі, в якій вони продаються під торговою маркою NOVONORM™ і STARLIX™, відповідно. Приклади інгібіторів альфа-глюкозидази включають, без обмеження, акарбозу, N-(1,3дигідрокси-2-пропіл)валіоламін (воглібозу) і похідне 1-дезоксинойіриміцину міглітол. Акарбоза являє собою 4",6"-дидезокси-4'-[(1S)-(1,4,6/5)-4,5,6тригідрокси-3-гідроксиметил-2циклогексеніламіно)мальтотриозу. Структура акарбози також може бути описана як O-4,6дидезокси-4-{[1S,4R,5S,6S]-4,5,6-тригідрокси-3(гідроксиметил)-2-циклогексен-1-іл]аміно)-альфаD-глюкопіранозил-(1-4)-O-альфа-D 93689 28 глюкопіранозил-(1-4)-D-глюкопіраноза (патент США №4062950 і публікація європейського патенту №ЕР 0226121). Акарбозу і міглітол можна вводити в формах, які продаються під торговими марками GLUCOBAY™ і DIASTABOL 50™, відповідно. Приклади інгібіторів випорожнення шлунка, що відрізняються від GLP-1, включають, без обмеження, інгібітори, описані в J. Clin. Endocrinol. Metab. 2000, 85(3), 1043-1048, і Diabetes Care 1998; 21; 897-893, зокрема амілін і його аналоги, такі як прамлінтид. Амілін описаний в Diabetologia 39, 1996, 492-499. Приклади α2-адренергічних антагоністів включають, без обмеження, мідаглізол, який описаний в Diabetes 36, 1987, 216-220. Інсулін, який можна використовувати в комбінації із сполукою І, включає, без обмеження, препарати інсуліну тварин, екстрагованого з підшлункової залози корів і свиней; препарати інсуліну людини, генетично синтезованого з використанням Escherichia coli або дріжджів; цинк-інсулін; протамін-цинк-інсулін; фрагмент або похідне інсуліну (наприклад, INS-1) і пероральний препарат інсуліну. В одному конкретному варіанті антидіабетична сполука, що вводиться в комбінації із сполукою І, вибрана з групи, що складається з натеглініду, мітиглініду, репаглініду, метформіну, екстендатиду, розиглітазону, тезаглітазару, піоглітазону, глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі. Приклади отримання і приготування препаратів інгібіторів РТР-ази, інгібіторів GSK-3, міметиків, що не є малими молекулами, інгібіторів GFAT, інгібіторів G6P-aзи, антагоністів рецептора глюкагону, інгібіторів РЕРСК і інгібіторів F-1,6-BP-aзи, інгібіторів GP, модуляторів RXR, агоністів бета-3 AR, інгібіторів PDHK, інгібіторів випорожнення шлунка і модуляторів UCP описані в патентах, заявках і публікаціях, вказаних в даному описі. У разі комбінованої терапії із сполукою І інша антидіабетична сполука може бути введена (наприклад, відносно шляху і форми дозування) таким чином, який відомий для вказаної сполуки. Сполука І і інша антидіабетична сполука можуть бути введені послідовно (тобто в різних точках часу) або в один і той же час, або одна після іншої окремо у вигляді двох різних форм дозування, або у вигляді однієї комбінованої стандартної лікарської форми. В одному конкретному варіанті іншу антидіабетичну сполуку вводять із сполукою І у вигляді однієї комбінованої стандартної лікарської форми. Доза антидіабетичної сполуки може бути вибрана з діапазону, відомого для клінічного застосування вказаної сполуки. Будь-які терапевтичні сполуки для лікування діабетичних ускладнень, антигіперліпідемічні сполуки, сполуки проти ожиріння або протигіпертонічні сполуки можна використовувати в комбінації із сполукою І таким же чином, як і вказані вище антидіабетичні сполуки. Приклади терапевтичних сполук для лікування діабетичних ускладнень включають без обмежен 29 ня, інгібітори альдозоредуктази, такі як толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, CΤ-112 і ранірестат; нейротрофічні фактори і сполуки, що збільшують їх рівень, такі як NGF, NT-3, BDNF і активатори продукціїсекреції нейротрофіну, описані в WO 01/14372 (наприклад, 4-(4-хлорфеніл)-2-(2-метил-1імідазоліл)-5-[3-(2-метилфенокси)пропіл]оксазол); стимулятори регенерації нервової тканини, такі як Υ-128; інгібітори РКС, такі як мезилат рубоксистаурину; інгібітори AGE, такі як ALT946, пімагедин, бромід N-фенацилтіазолію (ALT766), ALT-711, ЕХО-226, піридорин і піридоксамін; пастки активних форм кисню, такі як тіоктова кислота; засоби, що розширюють судини головного мозку, такі як тіаприд і мексилетин; агоністи рецептора соматостатину, такі як ВІМ23190; і інгібітори кінази-1, що регулює сигнали апоптозу (ASK-1). Приклади антигіперліпідемічних сполук включають, без обмеження, інгібітори HMG-CoA-редуктази, такі як правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, росувастатин і пітавастатин; інгібітори скваленсинтази, такі як сполуки, описані в WO97/10224 (наприклад, N-[[(ЗЯ,58)-1-(3ацетокси-2,2-диметилпропіл)-7-хлор-5-(2,3диметоксифеніл)-2-оксо-1,2,3,5-тетрагідро-4,1бензоксазепін-3-іл]ацетил]піперидин-4-оцтова кислота); фібратні сполуки, такі як безафібрат, клофібрат, симфібрат і клинофібрат; інгібітори АСАТ, такі як авасиміб і ефлуциміб; аніонообмінні смоли, такі як колестирамін; пробукол; засновані на нікотиновій кислоті лікарські засоби, такі як нікомол і ніцеритрол; етилікозапентат; і рослинні стерини, такі як соєвий стерин і -оризанол. Приклади сполук проти ожиріння включають, без обмеження, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс; антагоністи рецептора МСН, такі як SB-568849 і SNAP-7941; антагоністи нейропептиду Y, такі як СР-422935; антагоністи канабіноїдних рецепторів, такі як SR141716 і SR-147778; антагоністи греліну; інгібітори 11 β-гідроксистероїддегідрогенази, такі як BVT3498; інгібітори ліпази підшлункової залози, такі як орлістат і ATL-962; агоністи бета-3 AR, такі як AJ9677; пептидні засоби, що знижують апетит, такі як лептин і CNTF (циліарний нейротрофічний фактор); агоністи холецистокініну, такі як лінтитрипт і FPL-15849; і засіб, що стримує споживання їжі, такий як Р-57. Приклади протигіпертонічних сполук включають інгібітори ферменту перетворення ангіотензину, такі як каптоприл, еналаприл і делаприл; антагоністи ангіотензину II, такі як кандесартан цилексетил, лозартан, епросартан, валсартан, телмісартан, ірбесартан, олмесартан медоксоміл, тазосартан і 1-[[2'-(2,5-дигідро-5-оксо-4Н-1,2,4оксадіазол-3-іл)біфеніл-4-іл]метил]-2-етокси-1Hбензімідазол-7-карбонова кислота; блокатори кальцієвих каналів, такі як манідипін, ніфедипін, нікардипін, амлодипін і ефонідипін; відкривачі калієвих каналів, такі як левкромакалім, L-27152, AL0671 і NIP-121; і клонідин. Структуру активних засобів, вказаних в даному описі кодовими номерами, родовими або комерційними назвами, можна знайти в сучасній редакції 93689 30 стандартного керівництва «The Merck Index» або в базах даних, наприклад, міжнародних патентів (наприклад, IMS World Publications). Відповідний зміст вказаних джерел включений в даний опис у вигляді посилання. Будь-який фахівець в даній галузі цілком може ідентифікувати активні засоби, а також на основі вказаних посилань може створити і тестувати показання до фармацевтичного застосування і фармацевтичні властивості в стандартних моделях для тестування, як in vitro, так і in vivo. 4. Композиції, що містять сполуку І Сполука І може входити до складу фармацевтичної композиції, пристосованої для різних шляхів введення. Наприклад, сполука І може входити до складу фармацевтичної композиції, пристосованої для введення шляхом, вибраним з групи, що складається з перорального, парентерального, внутрішньоочеревинного, внутрішньовенного, внутрішньоартеріального, трансдермального, під'язикового, внутрішньом'язового, ректального, трансбукального, інтраназального, ліпосомного, інгаляційного, вагінального, внутрішньоочного введення, локальної доставки (наприклад, через катетер або стент), підшкірного, введення в жирову тканину, внутрішньосуглобового, внутрішньоочеревинного і інтратекального введення. Як така сполука І може бути приготована в різних фармацевтично прийнятних композиціях, включаючи ін'єкційні форми (наприклад, для підшкірних, внутрішньовенних, внутрішньом'язових і внутрішньоочеревинних ін'єкцій), крапельні інфузії, форми для зовнішнього застосування (наприклад, препарати у вигляді назальних спреїв, трансдермальні препарати; мазі і т.д.) і супозиторії (наприклад, ректальні і вагінальні супозиторії). Вказані різні фармацевтично прийнятні композиції можуть бути приготовані різними способами, що звичайно використовуються в фармацевтичній промисловості, з фармацевтично прийнятним носієм, що звичайно використовується в фармацевтичній промисловості. У значенні, що використовується в даному описі, мається на увазі, що композиція, що містить сполуку І, включає форму вільної основи сполуки І, солі, гідрати і проліки сполуки І, а також інші речовини, які можуть бути включені до складу вказаної композиції для досягнення передбачуваної мети, включаючи інші активні інгредієнти, якщо не обумовлено особливо. Конкретні форми солей сполуки І, які можуть бути використані, включають, без обмеження, НСІ-сіль, метансульфонат, сукцинат, бензоат, толуолсульфонат, R-(-)манделат або бензолсульфонатну сіль сполуки І. Як вказано вище, сполуку І переважно можна застосовувати при введенні пацієнту в добовій дозі від 1мг/добу до 250мг/добу сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І (в кожному випадку з розрахунку на молекулярну масу форми вільної основи сполуки І). Конкретні дозові кількості, які можна використати, включають, без обмеження, 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг і 100мг сполуки І на добу. Як вказано вище, бажано вво 31 дити сполуку І один раз на добу. Відповідно, фармацевтичні композиції згідно з даним винаходом можуть бути в стандартній лікарській формі, що містить від 1мг/добу до 250мг/добу сполуки І, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І. В конкретних варіантах фармацевтична композиція містить 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг або 100мг сполуки І. Як вказано вище, сполуку І переважно можна застосовувати за допомогою перорального введення. Відповідно, композиції згідно з даним винаходом необов'язково можуть бути пристосовані для перорального введення. В одному варіанті вказана фармацевтична композиція являє собою твердий препарат, призначений для перорального введення. У цьому відношенні композиція, наприклад, може бути в формі таблетки або капсули. У прикладі 2 пропонуються приклади твердих препаратів, що містять сполуку І, призначених для перорального введення. В іншому варіанті вказана фармацевтична композиція являє собою рідкий препарат, пристосований для перорального введення. Також, як вказано вище, сполуку І переважно можна застосовувати за допомогою парентерального введення. Відповідно, композиції згідно з даним винаходом необов'язково можуть бути пристосовані для парентерального введення. В одному варіанті вказана фармацевтична композиція являє собою склад у вигляді розчину, призначений для парентерального введення. В іншому варіанті вказана фармацевтична композиція являє собою суспензійний препарат, пристосований для парентерального введення. Як вказано вище, сполуку І переважно можна застосовувати в комбінації з однією або декількома іншими антидіабетичними сполуками і/або інкретинами. Відповідно, композиції згідно з даним винаходом необов'язково можуть містити сполуку І в комбінації з однією або декількома іншими антидіабетичними сполуками або інкретинами в одній комбінованій стандартній лікарській формі. Необов'язково вказана комбінована стандартна лікарська форма, що містить сполуку І в комбінації з однією або декількома іншими антидіабетичними сполуками і/або інкретинами, призначена для перорального введення і необов'язково являє собою тверду пероральну лікарську форму. Альтернативно, вказана комбінована стандартна лікарська форма, що містить сполуку І в комбінації з одним або декількома іншими антидіабетичними засобами і/або інкретинами, може бути призначена для парентерального введення і необов'язково може мати форму дозованого розчину. В одному варіанті вказана комбінована стандартна лікарська форма, що містить сполуку І в комбінації з однією або декількома іншими анти діабетичними сполуками, містить від 1мг/добу до 250мг/добу сполуки І, що вводиться пацієнту, необов'язково від 2,5мг до 200мг сполуки І, необов'язково від 2,5мг до 150мг сполуки І і необов'язково від 5мг до 100мг сполуки І (в кожному випадку з розрахунку на молекулярну масу форми вільної 93689 32 основи сполуки І). У конкретних варіантах вказана комбінована стандартна лікарська форма, що містить сполуку І в комбінації з однією або декількома іншими антидіабетичними сполуками, містить 2,5мг, 5мг, 6,25мг, 10мг, 20мг, 25мг, 50мг, 75мг і 100мг сполуки І. Будь-яку антидіабетичну сполуку або групу антидіабетичних сполук можна об'єднувати із сполукою І з утворенням вказаної комбінованої стандартної лікарської форми. У конкретних варіантах вказана комбінована стандартна лікарська форма містить сполуку І і один або декілька представників групи, що складається з модуляторів шляху передачі сигналу інсуліну, подібних до інгібіторів протеїнтирозинфосфатази (РТР-ази) і інгібіторів глутамін-фруктозо-6-фосфатамідотрансферази (GFAT), сполук, що впливають на порушену регуляцію продукції глюкози в печінці, подібних до інгібіторів глюкозо-6-фосфатази (G6P-ази), інгібіторів фруктозо-1,6-бісфосфатази (F-1,6-BP-a3n), інгібіторів глікогенфосфорилази (GP), антагоністів рецептора глюкагону і інгібіторів фосфоенолпіруваткарбоксикінази (РЕРСК), інгібіторів кінази піруватдегідрогенази (PDHK), підсилювачів чутливості до інсуліну (сенсибілізаторів інсуліну), підсилювачів секреції інсуліну (стимуляторів секреції інсуліну), інгібіторів альфа-глюкозидази, інгібіторів випорожнення шлунка, активаторів глюкокінази, агоністів рецептора GLP-1, агоністів рецептора GLP-2, модуляторів UCP, модуляторів RXR, інгібіторів GSK-3, модуляторів PPAR, метформіну, інсуліну і антагоністів α2-адренергічних рецепторів. Сполуку І можна вводити щонайменше з однією іншою антидіабетичною сполукою або одночасно у вигляді однієї дози, в один час у вигляді роздільних доз або послідовно (тобто коли одну сполуку вводять до або після іншої сполуки). В одному варіанті вказана комбінована стандартна лікарська форма містить сполуку І і антидіабетичний тіазолідиндіон. Конкретні приклади тіазолідиндіонів, які можна використати в даному варіанті, включають, без обмеження, (S)-((3,4дигідро-2-(фенілметил)-2Н-1-бензопіран-6іл)метилтіазолідин-2,4-діон (енглітазон), 5-{[4-(3-(5метил-2-феніл-4-оксазоліл)-1оксопропіл)феніл]метил}тіазолідин-2,4-діон (дарглітазон), 5-{[4-(1метилциклогексил)метокси)феніл]метил]тіазолідин-2,4-діон (циглітазон), 5-{[4-(2-(1індоліл)етокси)феніл]метил}тіазолідин-2,4-діон (DRF2189), 5-{4-[2-(5-метил-2-феніл-4оксазоліл)етокси)]бензил}тіазолідин-2,4-діон (ВМ13.1246), 5-(2-нафтилсульфоніл)тіазолідин-2,4діон (AY-31637), біс{4-[(2,4-діоксо-5тіазолідиніл)метил]феніл}метан (YM268), 5-{4-[2(5-метил-2-феніл-4-оксазоліл)-2гідроксіетокси]бензил}тіазолідин-2,4-діон (AD5075), 5-[4-(1-феніл-1циклопропанкарбоніламіно)бензил]тіазолідин-2,4діон (DN-108), 5-{[4-(2-(2,3-дигідроіндол-1іл)етокси)фенілметил)тіазолідин-2,4-діон, 5-[3-(4хлорфеніл])-2-пропініл]-5фенілсульфоніл)тіазолідин-2,4-діон, 5-[3-(4хлорфеніл])-2-пропініл]-5-(4 33 фторфенілсульфоніл)тіазолідин-2,4-діон, 5-{[4-(2(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4діон (розиглітазон), 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон), 5-[6-(2-фторбензилокси)нафталін-2ілметил]тіазолідин-2,4-діон (МСС555), 5-([2-(2нафтил)бензоксазол-5-іл]метил}тіазолідин-2,4-діон (Т-174), едаглітазон (ВМ-13-1258), ривоглітазон (CS-011) і 5-(2,4-діоксотіазолідин-5-ілметил)-2метокси-Н-(4-трифторметилбензил)бензамід (KRP297). В одному конкретному варіанті тіазолідиндіоном у вказаній комбінованій стандартній лікарській формі є 5-{[4-(2-(5-етил-2піридил)етокси)феніл]метил}тіазолідин-2,4-діон (піоглітазон) і його гідрохлоридна сіль, яка продається під торговою маркою ACTOS™. В іншому конкретному варіанті тіазолідиндіоном є 5-{[4-(2-(метил-2піридиніламіно)етокси)феніл]метил}тіазолідин-2,4діон (розиглітазон) і його малеатна сіль. В іншому варіанті вказана комбінована стандартна лікарська форма містить сполуку І і агоніст PPAR-гамма неглітазонового типу. В іншому варіанті вказана комбінована стандартна лікарська форма містить сполуку І і бігуанід. Конкретним прикладом бігуаніду, який можна використовувати в даному варіанті, є метформін (диметилдигуанід) і його гідрохлоридна сіль, яка продається під торговою маркою GLUCOPHAGE . В іншому варіанті вказана комбінована стандартна лікарська форма містить сполуку І і похідне сульфонілсечовини. Конкретні приклади похідних сульфонілсечовини, які можна використати в даному варіанті, включають, без обмеження, глізоксепід, глібурид, глібенкламід, ацетогексамід, хлорпропамід, гліборнурид, толбутамід, толазамід, гліпізид, карбутамід, гліквідон, глігексамід, фенбутамід, толцикламід, глімепірид і гліклазид. Толбутамід, глібенкламід, гліклазид, гліборнурид, гліквідон, глізоксепід і глімепірид можна вводити в формі, в якій вони продаються під торговими марками RASTINON HOECHST™, AZUGLUCON™, DIAMICRONT™, GLUBORID™, GLURENORM™, PRO-DIABAN™ і AMARYL™, відповідно. В іншому варіанті вказана комбінована стандартна лікарська форма містить сполуку І і антидіабетичне похідне D-фенілаланіну. Конкретні приклади антидіабетичних похідних D-фенілаланіну, які можна використовувати в даному варіанті, включають, без обмеження, репаглінід і натеглінід, які можна вводити в формі, в якій вони продаються під торговими марками NOVONORM™ і STARLIX™, відповідно. В іншому варіанті вказана комбінована стандартна лікарська форма містить сполуку І і інгібітор альфа-глюкозидази. Конкретні приклади інгібіторів альфа-глюкозидази, які можна використовувати в даному варіанті, включають, без обмеження, акарбозу, міглітол і воглібозу, які можна вводити в формі, в якій вони продаються під торговими марками GLUCOBAY™, DIASTABOL 50™ і BASEN™, відповідно. 93689 34 В одному конкретному варіанті антидіабетична сполука, що вводиться в комбінації із сполукою І у вказаній комбінованій стандартній лікарській формі, вибрана з групи, що складається з натеглініду, репаглініду, метформіну, екстендатиду, розиглітазону, піоглітазону, глізоксепіду, глібуриду, глібенкламіду, ацетогексаміду, хлорпропаміду, гліборнуриду, толбутаміду, толазаміду, гліпізиду, карбутаміду, гліквідону, глігексаміду, фенбутаміду, толцикламіду, глімепіриду і гліклазиду, включаючи їх будь-які фармацевтично прийнятні солі. Що стосується кожного з вказаних вище варіантів здійснення і їх варіацій, що стосуються комбінованої стандартної лікарської форми, що містить комбінацію сполуки І і однієї або декількох інших антидіабетичних сполук, то фармацевтична композиція необов'язково може бути адаптована для перорального введення і в зв'язку з цим необов'язково може являти собою твердий препарат, такий як таблетка або капсула, або, альтернативно, може бути у вигляді рідкого препарату, адаптованого для перорального введення. Доза антидіабетичної сполуки може бути вибрана з діапазону, відомого для клінічного застосування вказаної сполуки. Будь-які терапевтичні сполуки для лікування діабетичних ускладнень, антигіперліпідемічні сполуки, сполуки проти ожиріння або протигіпертонічні сполуки можна використовувати в комбінації із сполукою І таким же чином, як і вказані вище антидіабетичні сполуки. Приклади терапевтичних сполук для лікування діабетичних ускладнень включають, без обмеження, інгібітори альдозоредуктази, такі як толрестат, епалрестат, зенарестат, зополрестат, міналрестат, фідарестат, СТ-112 і ранірестат; нейтрофічні фактори і сполуки, що збільшують їх рівень, такі як NGF, NT-3, BDNF і активатори продукції-секреції нейротрофіну, описані в WO 01/14372 (наприклад, 4-(4-хлорфеніл)-2(2-метил-1-імідазоліл)-5-[3-(2метилфенокси)пропіл]оксазол); стимулятори регенераціїнервової тканини, такі як Y-128; інгібітори РКС, такі як мезилат рубоксистаурину; інгібітори AGE, такі як ALT946, пімагедин, бромід Nфенацилтіазолію (ALT766), ALT-711, ЕХО-226, піридорин і піридоксамін; пастки активних форм кисню, такі як тіоктова кислота; засоби, що розширюють судини головного мозку, такі як тіаприд і мексилетин; агоністи рецептора соматостатину, такі як ВІМ23190; і інгібітори кінази-1, що регулює сигнали апоптозу (ASK-1). Приклади антигіперліпідемічних сполук включають, без обмеження, інгібітори HMG-CoA-редуктази, такі як правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, росувастатин і пітавастатин; інгібітори скваленсинтази, такі як сполуки, описані в WO97/10224 (наприклад, К-[[(ЗК,58)-1-(3-ацетокси-2,2диметилпропіл)-7-хлор-5-(2,3-диметоксифеніл)-2оксо-1,2,3,5-тетрагідро-4,1-бензоксазепін-3іл]ацетил]піперидин-4-оцтова кислота); фібратні сполуки, такі як безафібрат, клофібрат, симфібрат і клинофібрат; інгібітори АСАТ, такі як авасиміб і ефлуциміб; аніонообмінні смоли, такі як колестирамін; пробукол; засновані на нікотиновій кислоті лікарські засоби, такі як нікомол і ніцеритрол; етилікозапентат; і рослинні стерини, такі як соєвий 35 стерин і -оризанол. Приклади сполук проти ожиріння включають, без обмеження, дексфенфлурамін, фенфлурамін, фентермін, сибутрамін, амфепрамон, дексамфетамін, мазіндол, фенілпропаноламін, клобензорекс; антагоністи рецептора МСН, такі як SB-568849 і SNAP-7941; антагоністи нейропептиду Υ, такі як СР-422935; антагоністи канабіноїдних рецепторів, такі як SR141716 і SR-147778; антагоністи греліну; інгібітори 11β-гідроксистероїддегідрогенази, такі як BVT3498; інгібітори ліпази підшлункової залози, такі як орлістат і ATL-962; агоністи бета-3 AR, такі як AJ9677; пептидні засоби, що знижують апетит, такі як лептин і CNTF (циліарний нейротрофічний фактор); агоністи холецистокініну, такі як лінтитрипт і FPL-15849; і засіб, що стримує споживання їжі, такий як Р-57. Приклади протигіпертонічних сполук включають інгібітори ферменту перетворення ангіотензину, такі як каптоприл, еналаприл і делаприл; антагоністи ангіотензину II, такі як кандесартан цилексетил, лозартан, епросартан, валсартан, телмісартан, ірбесартан, олмесартан медоксоміл, тазосартан і 1-[[2'-(2,5-дигідро-5-оксо-4Н-1,2,4оксадіазол-3-іл)біфеніл-4-іл]метил]-2-етокси-1Нбензімідазол-7-карбонова кислота; блокатори кальцієвих каналів, такі як манідипін, ніфедипін, нікардипін, амлодипін і ефонідипін; відкривачі калієвих каналів, такі як левкромакалім, L-27152, AL0671 і ΝΙΡ-121; і клонідин. 5. Набори і вироби, що містять сполуку І Даний винахід також стосується наборів, що містять фармацевтичну композицію згідно з даним винаходом, що містить сполуку І (і необов'язково одну або декілька інших антидіабетичних сполук), при цьому вказаний набір додатково містить інструкції, в яких є одна або декілька форм інформації, вибраних з групи, що складається із зазначення патологічного стану, у разі якого необхідно вводити фармацевтичну композицію, інформації про зберігання фармацевтичної композиції, інформації про дози і інструкцій по введенню фармацевтичної композиції. Набір також може містити пакувальні матеріали. Пакувальний матеріал також може включати контейнер для зберігання фармацевтичної композиції. Контейнер необов'язково може мати етикетку, на якій вказаний патологічний стан, при якому необхідно вводити фармацевтичну композицію, наведена інформація про зберігання, інформація про дози і/або інструкція відносно того, як вводити композицію. Набір також може містити додаткові компоненти для зберігання або введення композиції. Набір також може містити композицію в формі дози, що вводиться однократно, або багаторазових доз. В одному варіанті фармацевтична композиція в наборі містить декілька доз фармацевтичної композиції згідно з даним винаходом, при цьому вказана фармацевтична композиція являє собою стандартну лікарську форму, яка містить сполуку І в одному з діапазонів доз, вказаних в даному описі. В іншому варіанті фармацевтична композиція в наборі містить декілька доз фармацевтичної композиції згідно з даним винаходом, при цьому вказана фармацевтична композиція являє собою 93689 36 стандартну лікарську форму, яка містить сполуку І і одну або декілька інших антидіабетичних сполук, вказаних в даному описі. Даний винахід також стосується виробів, що містять фармацевтичну композицію згідно з даним винаходом, що містить сполуку І (і необов'язково одну або декілька інших антидіабетичних сполук), при цьому вказані вироби додатково містять пакувальні матеріали. В одному варіанті пакувальний матеріал включає контейнер для зберігання композиції. В іншому варіанті винахід стосується виробу, в якому контейнер має етикетку, на якій вказана одна або декілька форм інформації з групи, що складається з патологічного стану, у разі якого необхідно вводити композицію, інформації про зберігання, інформації про дози і/або інструкції по введенню композиції. В одному варіанті фармацевтична композиція у виробі містить декілька доз фармацевтичної композиції згідно з даним винаходом, при цьому вказана фармацевтична композиція являє собою стандартну лікарську форму, яка містить сполуку І в одному з діапазонів доз, вказаних в даному описі. В іншому варіанті фармацевтична композиція у виробі містить декілька доз фармацевтичної композиції згідно з даним винаходом, при цьому вказана фармацевтична композиція являє собою стандартну лікарську форму, яка містить сполуку І і одну або декілька інших антидіабетичних сполук, вказаних в даному описі. Потрібно зазначити, що з пакувального матеріалу, що використовується в наборах і виробах згідно з даним винаходом, можуть складатися декілька окремих контейнерів, наприклад, окремих флаконів або окремих упаковок з фольги. Контейнер може мати будь-яку звичайну конфігурацію або форму, яка відома в даній галузі і зроблена з фармацевтично прийнятного матеріалу, наприклад, паперова або картонна коробочка, скляний або пластиковий флакон або баночка, мішечок, що герметично закривається багато разів (наприклад, для зберігання «запасу» таблеток для приміщення їх в різні контейнери), або блістерна упаковка, що містить окремі дози, що видавлюються з упаковки згідно з терапевтичною схемою. Контейнер, який, буде використаний, залежить від конкретної форми дозування, що використовується. Можливо використання більше одного контейнера разом для однієї упаковки при продажу стандартної лікарської форми. Наприклад, таблетки можуть знаходитися у флаконі, який в свою чергу знаходиться в коробочці. Одним конкретним прикладом набору згідно з даним винаходом є так звана блістерна упаковка. Блістерні упаковки добре відомі в пакувальній промисловості і широко використовуються для упаковки фармацевтичних стандартних лікарських форм (таблеток, капсул і тому подібного). Блістерні упаковки звичайно складаються з листа відносно жорсткого матеріалу (переважно листа прозорої пластмаси), покритого фольгою. У ході здійснення процесу упаковування в жорсткому матеріалі утворюють поглиблення. Поглиблення мають розмір і форму окремих таблеток або кап 37 93689 38 сул, які необхідно упакувати, або можуть мати розмір і форму для розміщення декількох таблеток і/або капсул, які необхідно упакувати. Потім таблетки або капсули відповідно вміщують в поглиблення і лист відносно жорсткого матеріалу запаюють зверху полімерною фольгованою плівкою, при цьому лицьову сторону фольги розташовують протилежно напряму, в якому створювали поглиблення. У результаті таблетки або капсули запаюють окремо або запаюють разом, в залежності від потреби, в поглибленнях між фольгою і листом. Міцність листа переважно така, що таблетки або капсули можна витягнути з блістерної упаковки, натискаючи вручну на поглиблення, при цьому в фользі утворюється отвір в місці поглиблення. Таблетку або капсулу потім можна витягнути через вказаний отвір. Приклади 1. Отримання 2-[6-(3-амінопіперидин-1-іл)-3метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1ілметил]-4-фторбензонітрилу і фармацевтично прийнятних солей 4-фтор-2-метилбензонітрил (3) Суміш 2-бром-5-фтортолуолу (2) (3,5г, 18,5ммоль) і CuCN (2г, 22ммоль) в ДМФА (100мл) кип'ятили із зворотним холодильником протягом 24 годин. Реакційну суміш розбавляли водою і екстрагували гексаном. Органічний шар сушили над MgSO4 і розчинник видаляли, отримуючи продукт 3 (вихід 60%). 1Н-ЯМР (400МГц, CDCl3): δ 7,60 (дд, J=5,6, 8,8Гц, 1Н), 6,93-7,06 (м, 2Н), 2,55 (с, 3Н). 2-бромметил-4-фторбензонітрил (4) Суміш 4-фтор-2-метилбензонітрилу (3) (2г, 14,8ммоль), NBS (2,64г, 15ммоль) і AIBN (100мг) в ССl4 кип'ятили із зворотним холодильником в атмосфері азоту протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури. Тверду речовину видаляли фільтруванням. Органічний розчин концентрували, отримуючи неочищений продукт у вигляді масла, який використовували на наступній стадії без додаткового очищення. 1HЯМР (400МГц, CDCI3): δ 7,68 (дд, J=5,2, 8,4Гц, 1H), 7,28 (дд, J=2,4, 8,8Гц, 1H), 7,12 (м, 1H), 4,6 (с, 2Н). 2-(6-хлор-3-метил-2,4-діоксо-3,4-дигідро-2Нпіримідин-1-ілметил)-4-фторбензонітрил (6) Суміш неочищеного 3-метил-6-хлорурацилу (5) (0,6г, 3,8ммоль), 2-бромметил-4фторбензонітрилу (0,86г, 4ммоль) і K2СО3 (0,5г, 4ммоль) в ДМСО (10мл) перемішували при 60°С протягом 2 годин. Реакційну суміш розбавляли водою і екстрагували ЕtOАс. Органічний шар сушили над MgSO4 і розчинник видаляли. Залишок очищали хроматографією на колонці. Отримували 0,66г продукту (вихід: 60%). 1Н-ЯМР (400МГц, CDCI3): δ 7,73 (дд, J=7,2, 8,4Гц, 1Н), 7,26 (д, J=4,0Гц, 1H), 7,11-7,17 (м, 1H), 6,94 (дд, J=2,0, 9,0Гц, 1Н) 6,034 (с, 2Н), 3,39 (с, 3Н). МС (ES) [m+Н] обчислено для C13H9CIFN3O2, 293,68; знайдено 293,68. 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбешонітрил, ТФА-сіль (1) (ТФА-сіль сполуки І) 2-(6-хлор-3-метил-2,4-діоксо-3,4-дигідро-2Нпіримідин-1-ілметил)-4-фторбензонітрил (5) (300мг, 1,0ммоль), дигідрохлорид (R)-3амінопіперидину (266мг, 1,5ммоль) і бікарбонат натрію (500мг, 5,4ммоль) перемішували в герметично закритій пробірці в ЕtOН (3мл) при 100°С протягом 2 годин. Після очищення ВЕРХ отримували кінцеву сполуку у вигляді ТФА-солі. 1Н-ЯМР (400МГц, CD3OD): δ 7,77-7,84 (м, 1H), 7,16-7,27 (м, 2Н), 5,46 (с, 1Н), 5,17-5,34 (ABq, 2Н, J=35,2, 15,6Гц), 3,33-3,47 (м, 2Н), 3,22 (с, 3Н), 2,98-3,08 (м, 1H) 2,67-3,92 (м, 2Н), 2,07-2,17 (м, 1H), 1,82-1,92 (м, 1H), 1,51-1,79 (м, 2Н). MS (ES) [m+H] обчислено для C18H20FN5O2, 357,38; знайдено 357,38. 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрил, НСІ-сіль 39 93689 ТФА-сіль сполуки І суспендували в ДХМ і потім промивали насиченим Na2CO3. Органічний шар сушили і розчинник видаляли у вакуумі. Залишок розчиняли в ацетонітрилі і додавали НСl в діоксані (1,5 еквіваленти) при 0°С. Після видалення розчинника отримували НСІ-сіль. 1Н-ЯМР (400МГц, CD3OD): δ 7,77-7,84 (м, 1H), 7,12-7,26 (м, 2Н), 5,47 (с, 1H), 5,21-5,32 (ABq, 2H, J-32,0, 16,0Гц), 3,35-3,5 (м, 2Н), 3,22 (с, 3Н), 3,01-3,1 (м, 1H), 2,69-2,93 (м, 2Н), 2,07-2,17 (м, 1Н), 1,83-1,93 (м, 1H), 1,55-1,80 (м, 2Н). МС (ES) [m+Н] обчислено для C18H20FN5O2, 357,38; знайдено 357,38. Загальний спосіб отримання солей сполуки І Продукт бензонітрил при необхідності може бути виділений у вигляді вільної основи, але переважно продукт може бути далі перетворений у відповідну кислотно-адитивну сіль. Зокрема, продукт бензонітрил (приблизно 10мг) в розчині МеОН (1мл) обробляли різними кислотами (1,05 еквівалента). Розчини залишали стояти протягом трьох діб на відкритому повітрі. Якщо утворювався осад, то суміш фільтрували і сіль сушили. Якщо не утворювалося твердої речовини, то суміш концентру 40 вали у вакуумі і виділяли залишок. Таким чином отримували солі 34, використовуючи наступні кислоти: бензойну, п-толуолсульфонову, янтарну, R-()-мигдалеву і бензолсульфонову. Стадії виділення і/або очищення проміжних сполук в описаному вище способі необов'язково можна уникнути, якщо проміжні продукти з реакційної суміші отримують у вигляді відносно чистих сполук і побічні продукти або домішки в реакційній суміші не заважають наступним стадіям реакції. У тому випадку, коли це можливо, одна або декілька стадій виділення можуть бути виключені, щоб зменшити час обробки, і виключення додаткової обробки також може давати більш високі загальні виходи реакції. 2. Типові препарати, що містять сукцинатну сіль 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрилу Пропонуються приклади препаратів в формі таблеток, які можна використовувати для введення сукцинатної солі 2-[6-(3-амінопіперидин-1-іл)-3метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1ілметил]-4-фторбензонітрилу (сукцинатна сіль сполуки І) згідно з даним винаходом. Потрібно зазначити, що препарати, що пропонуються в даному описі, можуть варіювати, як відомо в даній галузі. Типовими препаратами в формі таблеток є наступні препарати: 25мг сполуки І (маса форми вільної основи) на таблетку Склад ядра таблетки (1) (2) (3) (4) (5) (6) 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрил (сукцинатна сіль) Моногідрат лактози, NF, Ph, Eur (FOREMOST 316 FAST FLO) Мікрокристалічна целюлоза, NF, Ph, Eur (AVICEL PH 102) Кроскармелоза натрію, NF, Ph, Eur (AC-DO-SOL) Колоїдний діоксид кремнію, NF, Ph, Eur (CAB-O-SIL M-5P) Стеарат магнію, NF, Ph, Eur (MALLINCKRODT, небичачий Hyqual) РАЗОМ (на таблетку) 17,0мг 224,6мг 120,1мг 32,0мг 3,2мг 3,2мг 400,0мг Плівкове покриття (всього 12,0мг) (1) Opadry II 85F18422, біле - частина 1 (COLORCON) (2) Opadry II 85F18422, біле - частина 2 (COLORCON) (3) Oradrv II 85F18422. біле - частина 3 (COLORCON) 12,5мг сполуки І (маса форми вільної основи) на таблетку Склад ядра таблетки (1) (2) (3) (4) (5) (6) 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрил(сукцинатна сіль) Моногідрат лактози, NF, Ph, Eur (FOREMOST 316 FAST FLO) Мікрокристалічна целюлоза, NF, Ph, Eur (AVICEL PH 102) Кроскармелоза натрію, NF, Ph, Eur (AC-DO-SOL) Колоїдний діоксид·кремнію, NF, Ph, Eur (CAB-O-SIL M-5P) Стеарат магнію, NF, Ph, Eur (MALLINCKRODT, небичачий Hyqual) РАЗОМ (на таблетку) Плівкове покриття (всього 12,0мг) 34,0мг 207,6мг 120,1мг 32,0мг 3,2мг 3,2мг 400,0мг 41 93689 42 (1) Opadry II 85F18422, біле - частина 1 (COLORCON) (2) Opadry II 85F18422, біле - частина 2 (COLORCON) (3) Opadry II 85F18422, біле - частина 3 (COLORCON) 50мг сполуки І (маса форми вільної основи) на таблетку Склад ядра таблетки (1) (2) (3) (4) (5) (6) 2-[6-(3-амінопіперидин-1-іл)-3-метил-2,4-діоксо-3,4-дигідро-2Н-піримідин-1-ілметил]-4фторбензонітрил (сукцинатна сіль) Моногідрат лактози, NF, Ph, Eur (FOREMOST 316 FAST FLO) Мікрокристалічна целюлоза, NF, Ph, Eur (AVICEL PH 102) Кроскармелоза натрію, NF, Ph, Eur (AC-DO-SOL) Колоїдний діоксид кремнію, NF, Ph, Eur (CAB-O-SIL M-5P) Стеарат магнію, NF, Ph, Eur (MALLINCKRODT, небичачий Hyqual) РАЗОМ (на таблетку) 68,0мг 173,6мг 120,1мг 32,0мг 3,2мг 3,2мг 400,0мг Плівкове покриття (всього 12,0мг) (1) Opadry II 85F18422, біле - частина 1 (COLORCON) (2) Opadry II 85F18422, біле - частина 2 (COLORCON) (3) Opadry II 85F18422, біле - частина 3 (COLORCON) 6. Вплив введення на активність DPP-IV в плазмі Однократну дозу сполуки І вводили перорально мавпі в дозі 0,3мг/кг. На кресленні (Фіг.) показаний ефект, що спостерігається, який чинить введення сполуки І на активність DPP-IV в плазмі мавпи після введення дози. Як можна бачити, сполука І зменшувала активність DPP-IV в плазмі мавпи на більш, ніж 90% в порівнянні з вихідним рівнем через 12 годин після введення дози. Таким чином, як можна бачити на основі даних, показаних на Фіг., за допомогою введення сполуки І один раз на добу при рівнях доз, вказаних в даному описі, сполуку І можна ефективно застосовувати у разі патологічних станів, при яких потрібне зменшення активності DPP-IV в плазмі. Беручи до уваги представлені дані, вважають, що при введенні пацієнту щонайменше 25мг сполуки І активність DPP-IV в плазмі пацієнта може бути знижена на більш, ніж 60% в порівнянні з вихідним рівнем протягом періоду часу, що складає щонайменше 6 годин, 12 годин, 18 годин і навіть 24 години після введення. 7. Вплив спільного введення з піоглітазоном на рівень глюкози в плазмі Вплив введення сполуки І в комбінації з піоглітазоном досліджували за допомогою вимірювання рівнів глюкози в плазмі у мишей. Самців мишей db/db (BKS.Cg-+Leprdb/+Leprdb) (6-тижневого віку, CLEA Japan (Tokyo, Japan)) ділили на 4 групи (n=7 в кожній групі), включаючи групи A-D. Група А мала вільний доступ до порошкового корму СЕ-2 (CLEA Japan) протягом 21 дня. Група В мала вільний доступ до порошкового корму СЕ-2 (CLEA Japan), що містить 0,03% (мас/мас.) сукцинатної солі сполуки І, протягом 21 дня. Розрахована доза сполуки І в групі В, що становить 74,8±2,5 (середня±SD)мг/кг маси тіла/добу. Група С мала вільний доступ до порошкового корму СЕ-2 (CLEA Japan), що містить 0,0075% (мас/мас.) гідрохлориду піоглітазону, протягом 21 дня. Розрахована доза піоглітазону в групі С, що становить 17,7±0,6 (середня±SD)мг/кг маси тіла/добу. Група D мала вільний доступ до порошкового корму СЕ-2 (CLEA Japan), що містить 0,03% (мас/мас.) сукцинатної солі сполуки І в комбінації з 0,0075% (мас/мас.) гідрохлориду піоглітазону, протягом 21 дня. Розраховані дози сполуки І і піоглітазону в групі D, що складають 63,1±1,9 (середня±SD)мг/кг маси тіла/добу і 15,8±0,5 (середня±SD)мг/кг маси тіла/добу, відповідно. Протягом 21 дня введення порошкового корму не було значущих відмінностей кількості порошкового корму, що вводився, між вказаними вище 4 групами. Після 21 дня введення порошкового корму брали зразки крові з очної вени мишей капілярною піпеткою в умовах їди, і рівні глюкози в плазмі вимірювали ферментативно, використовуючи автоматичний аналізатор 7080 (Hitachi, Japan). Результати показані в таблиці. Значення в таблиці означають середнє (n=7)± стандартне відхилення. Таблиця Група Група А (контроль) Група В (сполука І) Група С (піоглітазон) Група D (сполука І плюс піоглітазон) Рівень глюкози в плазмі (мг/дл) 472,9±74,6 410,3±47,9 394,4±47,9 256,1±62,5 Як показано в таблиці 1, комбінація сполуки І з піоглітазоном чинить чудову дію, знижуючи рівні глюкози в плазмі. Фахівцям в даній галузі буде зрозуміло, що можуть бути здійснені різні модифікації і варіанти, що стосуються сполук, композицій, наборів і способів згідно з даним винаходом, не відходячи від суті і не виходячи за рамки об'єму винаходу. Таким чином, мається на увазі, що даний винахід охоплює модифікації і варіанти даного винаходу, які входять в об'єм прикладених пунктів формули винаходу і їх еквівалентів. 43 Комп’ютерна верстка Т. Чепелева 93689 Підписне 44 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAdministration of dipeptidyl peptidase inhibitors
Автори англійськоюChristopher, Ronald J., Covington, Paul
Назва патенту російськоюФармацевтическая композиция ингибиторов дипептидилпептидазы
Автори російськоюКристофер Роналд Дж., Ковингтон Пол
МПК / Мітки
МПК: A61P 3/10, A61K 31/44, A61K 31/513
Мітки: дипептидилпептидази, композиція, фармацевтична, інгібіторів
Код посилання
<a href="https://ua.patents.su/22-93689-farmacevtichna-kompoziciya-ingibitoriv-dipeptidilpeptidazi.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція інгібіторів дипептидилпептидази</a>
Попередній патент: Лита сталева стрічка (варіанти)
Наступний патент: Спосіб посіву зернових культур і трав
Випадковий патент: Модифікований фактор viii свині та його використання у терапевтичних цілях












