Гібридні білки-аналоги glp-1
Номер патенту: 87458
Опубліковано: 27.07.2009
Автори: Глезнер Вольфганг, Міллікан Рон Лі,мол., Вік Ендрю Марк
Формула / Реферат
1. Гетерологічний гібридний білок, до складу якого входить аналог GLP-1, що містить послідовність, вибрану з групи, яка включає:
a) (послідовність № 1)
His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Gly-Gly,
де Хаа8 вибраний з Gly і Val;
b) (послідовність № 2)
His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Lys-Asn-Gly-Gly-Gly,
де Хаа8 вибраний з Gly і Val;
c) (послідовність № 3)
His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Gly-Pro,
де Хаа8 вибраний з Gly і Val;
d) (послідовність № 4)
His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Lys-Asn-Gly-Gly-Pro,
де Хаа8 вибраний з Gly і Val;
e) (послідовність № 5)
His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Gly,
де Хаа8 вибраний з Gly і Val;
f) (послідовність № 6)
His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Lys-Asn-Gly-Gly,
де Хаа8 вибраний з Gly і Val;
злитий з Fc-фрагментом імуноглобуліну, що містить послідовність № 7:
Ala-Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-Pro-Cys-Pro-Ala-Pro-Xaa16-Xaa17-Xaa18-Gly-Gly-Pro-Ser-Val-Phe-Leu-Phe-Pro-Pro-Lys-Pro-Lys-Asp-Thr-Leu-Met-Ile-Ser-Arg-Thr-Pro-Glu-Val-Thr-Cys-Val-Val-Val-Asp-Val-Ser-Gln-Glu-Asp-Pro-Glu-Val-Gln-Phe-Asn-Trp-Tyr-Val-Asp-Gly-Val-Glu-Val-His-Asn-Ala-Lys-Thr-Lys-Pro-Arg-Glu-Glu-Gln-Phe-Xaa80-Ser-Thr-Tyr-Arg-Val-Val-Ser-Val-Leu-Thr-Val-Leu-His-Gln-Asp-Trp-Leu-Asn-Gly-Lys-Glu-Tyr-Lys-Cys-Lys-Val-Ser-Asn-Lys-Gly-Leu-Pro-Ser-Ser-Ile-Glu-Lys-Thr-Ile-Ser-Lys-Ala-Lys-Gly-Gln-Pro-Arg-Glu-Pro-Gln-Val-Tyr-Thr-Leu-Pro-Pro-Ser-Gln-Glu-Glu-Met-Thr-Lys-Asn-Gln-Val-Ser-Leu-Thr-Cys-Leu-Val-Lys-Gly-Phe-Tyr-Pro-Ser-Asp-Ile-Ala-Val-Glu-Trp-Glu-Ser-Asn-Gly-Gln-Pro-Glu-Asn-Asn-Tyr-Lys-Thr-Thr-Pro-Pro-Val-Leu-Asp-Ser-Asp-Gly-Ser-Phe-Phe-Leu-Tyr-Ser-Arg-Leu-Thr-Val-Asp-Lys-Ser-Arg-Trp-Gln-Glu-Gly-Asn-Val-Phe-Ser-Cys-Ser-Val-Met-His-Glu-Ala-Leu-His-Asn-His-Tyr-Thr-Gln-Lys-Ser-Leu-Ser-Leu-Ser-Leu-Gly-Xaa230 (послідовність № 7),
де:
Xaa у положенні 16 - Pro або Glu;
Xaa у положенні 17 - Phe, Val або Ala;
Xaa у положенні 18 - Leu, Glu або Ala;
Xaa у положенні 80 - Asn або Ala; і
Xaa у положенні 230 - Lys або відсутній.
2. Гетерологічний гібридний білок за п. 1, який відрізняється тим, що залишок гліцину С-кінця аналога GLP-1 злитий із залишком аланіну N-кінця Fc-фрагмента через пептидний лінкер, що містить послідовність, вибрану з групи, що включає:
a) Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (послідовність № 8);
b) Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (послідовність № 19); і
c) Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (послідовність № 21).
3. Гетерологічний гібридний білок за п. 2, який відрізняється тим, що лінкер містить послідовність № 8.
4. Гетерологічний гібридний білок за будь-яким із пп. 1-3, який відрізняється тим, що Хаа у положенні 8 аналога GLP-1 є Gly.
5. Гетерологічний гібридний білок за будь-яким із пп. 1-3, який відрізняється тим, що Хаа у положенні 8 аналога GLP-1 є Val.
6. Гетерологічний гібридний білок за будь-яким із пп. 1-3, який відрізняється тим, що аналог GLP-1 містить послідовність № 1.
7. Гетерологічний гібридний білок, вибраний з групи, що включає:
a) Gly8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P); b) Gly8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A); с) Gly8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, N297A); d) Gly8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A, N297A); e) Gly8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P); f) Gly8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, F234A, L235A); g) Gly8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, N297A); h) Gly8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, F234A, L235A, N297A); i) Gly8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P); j) Gly8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, F234A, L235A); k) Gly8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, N297A); l) Gly8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, F234A, L235A, N297A); і їхні форми з видаленим лізином (форми des-K).
8. Гетерологічний гібридний білок, вибраний з групи, що включає:
a) Val8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P); b) Val8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A); с) Val8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, N297A); d) Val8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A, N297A); e) Val8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P); f) Val8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, F234A, L235A); g) Val8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, N297A); h) Val8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, F234A, L235A, N297A); i) Val8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P); j) Val8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, F234A, L235A); k) Val8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, N297A); l) Val8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, F234A, L235A, N297A); і їхні форми з видаленим лізином (форми des-K).
9. Застосування гетерологічного гібридного білка за будь-яким із пп. 1-8 як лікарського засобу.
10. Застосування гетерологічного гібридного білка за будь-яким із пп. 1-8 для виготовлення лікарського засобу для лікування інсулінонезалежного цукрового діабету.
11. Застосування гетерологічного гібридного білка за будь-яким із пп. 1-8 для виготовлення лікарського засобу для лікування ожиріння або викликання втрати маси у суб'єкта з надлишковою масою тіла.
Текст
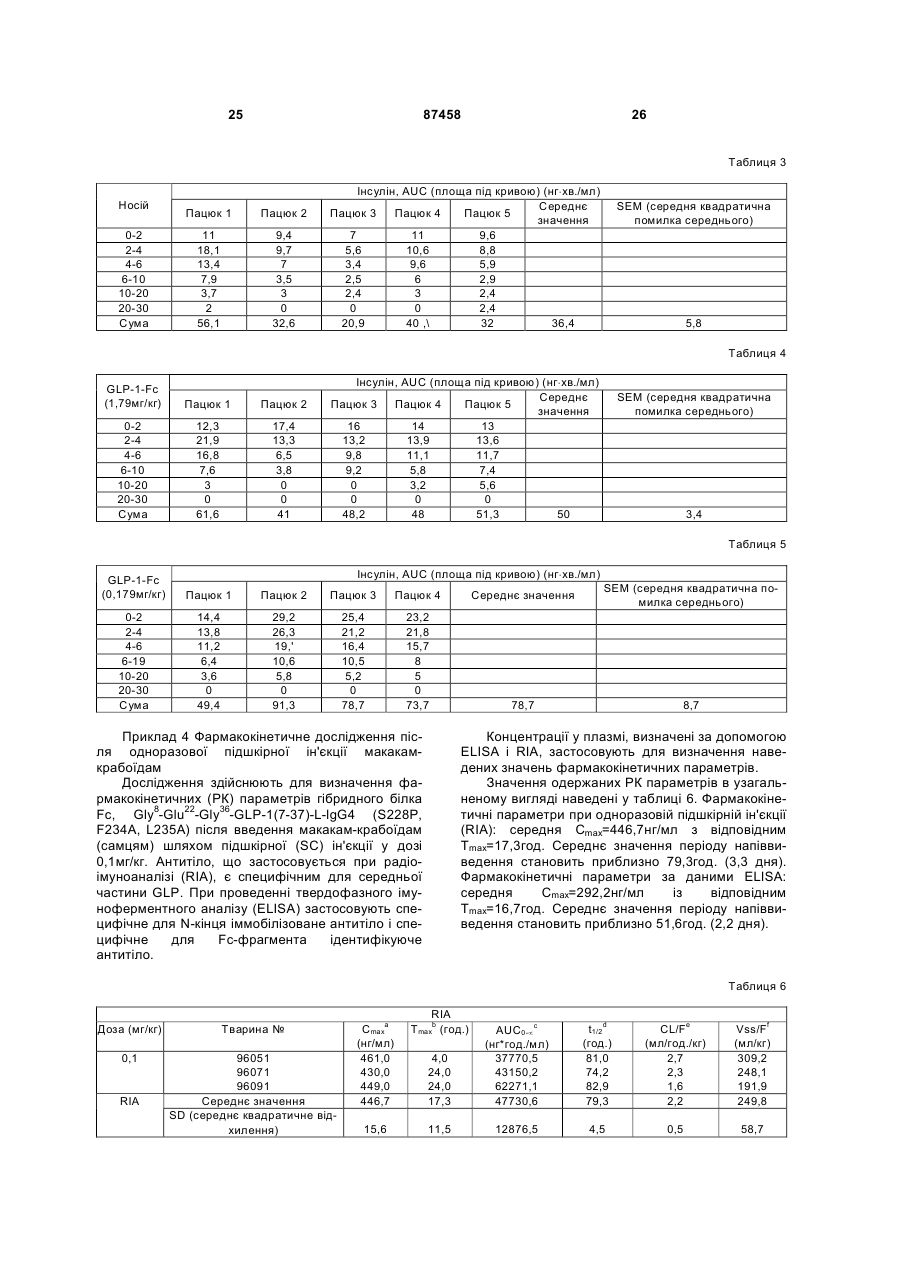
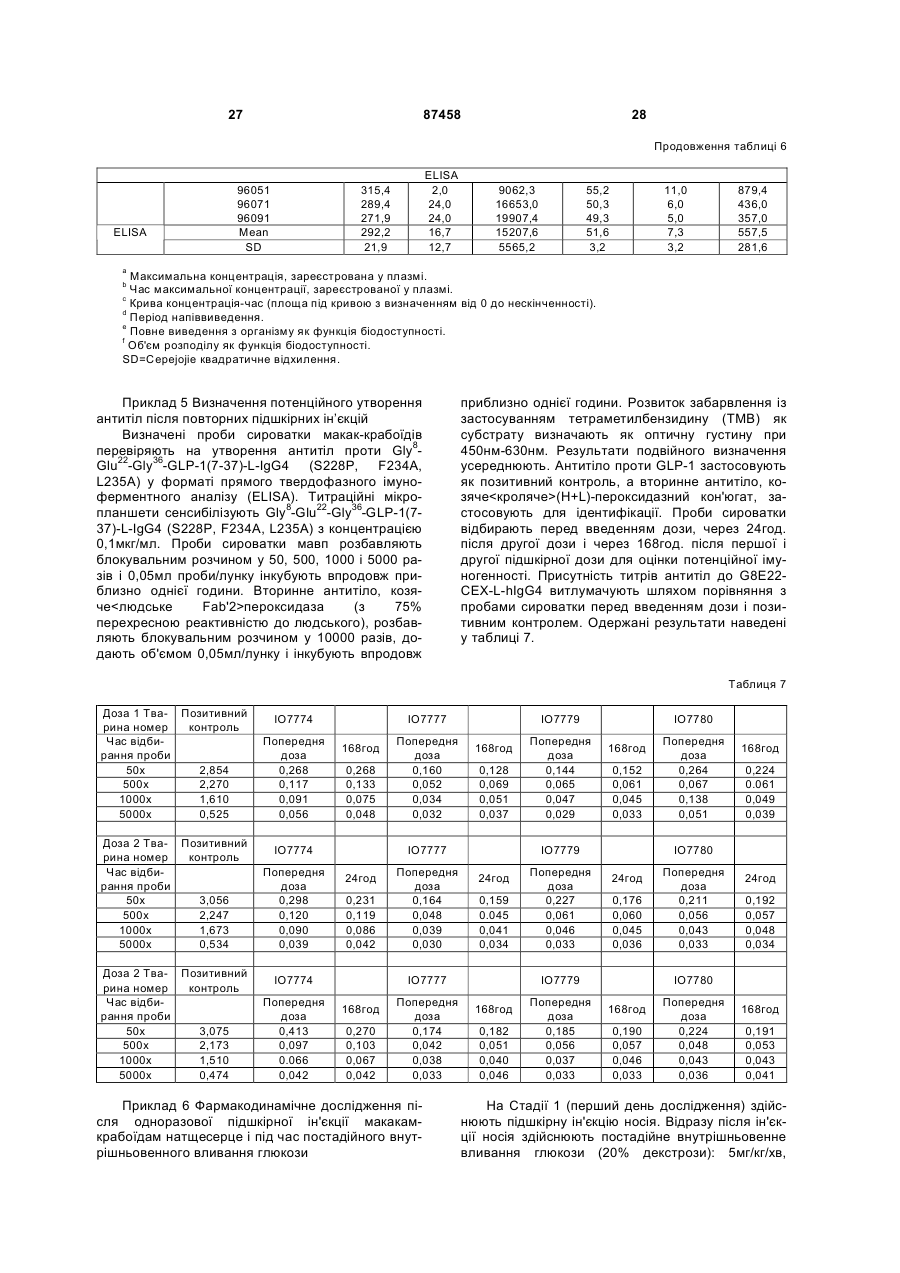
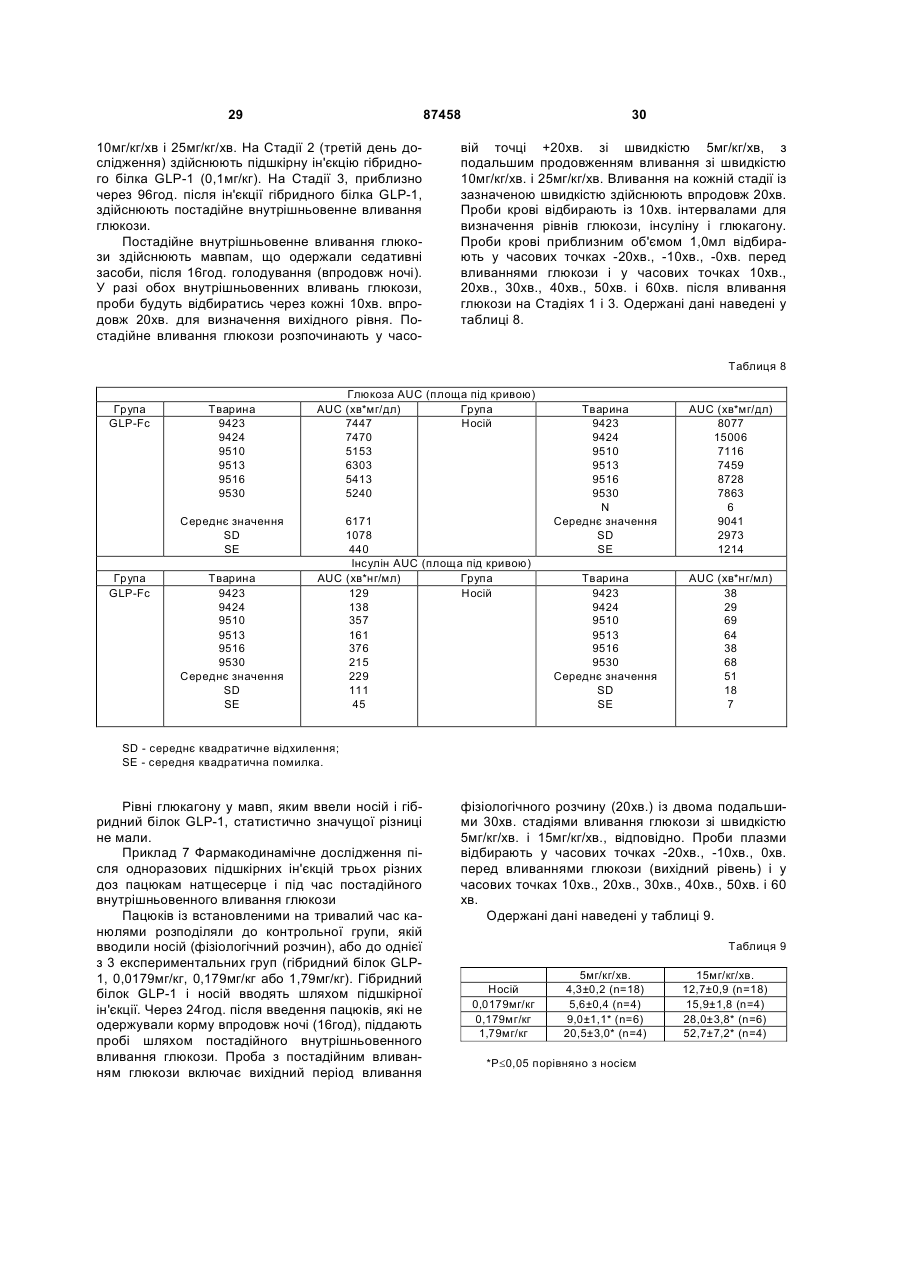
1. Гетерологічний гібридний білок, до складу якого входить аналог GLP-1, що містить послідовність, вибрану з групи, яка включає: a) (послідовність № 1) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-SerTyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-TrpLeu-Val-Lys-Gly-Gly-Gly, де Хаа8 вибраний з Gly і Val; b) (послідовність № 2) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-SerTyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-TrpLeu-Lys-Asn-Gly-Gly-Gly, де Хаа8 вибраний з Gly і Val; c) (послідовність № 3) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-SerTyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-TrpLeu-Val-Lys-Gly-Gly-Pro, де Хаа8 вибраний з Gly і Val; d) (послідовність № 4) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-SerTyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-TrpLeu-Lys-Asn-Gly-Gly-Pro, де Хаа8 вибраний з Gly і Val; e) (послідовність № 5) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-SerTyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-TrpLeu-Val-Lys-Gly-Gly, де Хаа8 вибраний з Gly і Val; f) (послідовність № 6) 2 (19) 1 3 87458 4 c) Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-GlyGly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-GlySer-Gly-Gly-Gly-Gly-Ser (послідовність № 21). 3. Гетерологічний гібридний білок за п.2, який відрізняється тим, що лінкер містить послідовність № 8. 4. Гетерологічний гібридний білок за будь-яким із пп.1-3, який відрізняється тим, що Хаа у положенні 8 аналога GLP-1 є Gly. 5. Гетерологічний гібридний білок за будь-яким із пп.1-3, який відрізняється тим, що Хаа у положенні 8 аналога GLP-1 є Val. 6. Гетерологічний гібридний білок за будь-яким із пп.1-3, який відрізняється тим, що аналог GLP-1 містить послідовність № 1. 7. Гетерологічний гібридний білок, вибраний з групи, що включає: a) Gly8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P); b) Gly8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A); с) Gly8-Glu22-Gly36-GLP-1(7-37)-1LIgG4 (S228P, N297A); d) Gly8-Glu22-Gly36-GLP-1(737)-1L-IgG4 (S228P, F234A, L235A, N297A); e) Gly8Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P); f) Gly8Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, F234A, L235A); g) Gly8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, N297A); h) Gly8-Glu22-Gly36-GLP-1(7-37)1,5L-IgG4 (S228P, F234A, L235A, N297A); i) Gly8Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P); j) Gly8Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, F234A, L235A); k) Gly8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, N297A); l) Gly8-Glu22-Gly36-GLP-1(7-37)-2L IgG4 (S228P, F234A, L235A, N297A); і їхні форми з видаленим лізином (форми des-K). 8. Гетерологічний гібридний білок, вибраний з групи, що включає: a) Val8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P); b) Val8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A); с) Val8-Glu22-Gly36-GLP-1(7-37)-1LIgG4 (S228P, N297A); d) Val8-Glu22-Gly36-GLP-1(737)-1L-IgG4 (S228P, F234A, L235A, N297A); e) Val8Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P); f) Val8Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, F234A, L235A); g) Val8-Glu22-Gly36-GLP-1(7-37)-1,5L-IgG4 (S228P, N297A); h) Val8-Glu22-Gly36-GLP-1(7-37)1,5L-IgG4 (S228P, F234A, L235A, N297A); i) Val8Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P); j) Val8Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, F234A, L235A); k) Val8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, N297A); l) Val8-Glu22-Gly36-GLP-1(7-37)-2LIgG4 (S228P, F234A, L235A, N297A); і їхні форми з видаленим лізином (форми des-K). 9. Застосування гетерологічного гібридного білка за будь-яким із пп.1-8 як лікарського засобу. 10. Застосування гетерологічного гібридного білка за будь-яким із пп.1-8 для виготовлення лікарського засобу для лікування інсулінонезалежного цукрового діабету. 11. Застосування гетерологічного гібридного білка за будь-яким із пп.1-8 для виготовлення лікарського засобу для лікування ожиріння або викликання втрати маси у суб'єкта з надлишковою масою тіла. Цей винахід має відношення до аналогів глюкагоноподібного пептиду, злитих із білками, що мають ефект подовження періоду напіввиведення цих пептидів in vivo. Ці гібридні білки можуть застосовуватись для лікування діабету, а також ряду інших станів або розладів. Під час клінічних випробувань аналоги і похідні глюкагоноподібного пептиду-1 (GLP-1) продемонстрували придатність для лікування діабету типу 2. GLP-1 індукує численні біологічні ефекти, наприклад, стимулювання секреції інсуліну, пригнічення секреції глюкагону, пригнічення випорожнювання шлунка або кишечнику, пригнічення рухової функції шлунка або перистальтики кишечнику і індукування втрати маси тіла. Суттєвою характеристикою GLP-1 є його здатність до стимулювання секреції інсуліну без пов'язаного з цим ризику гіпоглікемії, що спостерігається у разі проведення інсулінотерапії або застосування пероральних методів лікування деяких типів, під час здійснення яких відбувається підвищення експресії інсуліну. Придатність методів лікування із залученням пептидів GLP-1 обмежується тим, що GLP-1(1-37) має низьку активність, а два природні "укорочені" пептиди, GLP-1(7-37)OH та GLP-1(7-36)NH2, швидко виводяться in vivo і мають надзвичайно короткий період напіввиведення in vivo. Відомо, що ен догенно продукована дипептидилпептидаза IV (DPP-IV) інактивує циркулюючі пептиди GLP-1 шляхом видалення N-кінцевих залишків гістидину та аланіну і.є головною причиною короткого періоду напіввиведення in vivo. Вдавались до різних способів подовження періоду напіввиведення пептиду GLP-1 або уповільнення виведення згаданого пептиду з організму з одночасним збереженням біологічної активності. Один із варіантів підходу включає злиття пептиду GLP-1 з Fc-фрагментом імуноглобуліну. Імуноглобуліни, як правило, мають довгий період напіввиведення in vivo із системи кровообігу. Тривалість періоду напіввиведення молекул IgG у людей, наприклад, може досягати 23 днів. Відповідальність за цю стійкість in vivo частково несе Fc-фрагмент згаданого імуноглобуліну. Перевага гібридних білків GLP-1-Fc полягає у стабільності, що надається їм Fc-фрагментом імуноглобуліну, з одночасним збереженням біологічної активності молекули GLP-1. Хоча цей варіант підходу є прийнятним для одержання лікарських засобів на основі GLP-1 (Дивись WO 02/46227), залишається, однак, загальна проблема, що полягає у антигенності різних гібридних білків у разі їх повторного введення впродовж тривалих періодів часу. Ця проблема 5 набуває особливої гостроти у разі лікарських засобів на основі гібридних білків GLP-1-Fc, оскільки хворий на діабет, після діагностування цього захворювання, повинен лікуватись впродовж усього життя. Окрім того, лікарські засоби на основі гібридних білків, що містять Fc-фрагмент, можуть викликати проблеми у разі, якщо згаданий Fcфрагмент зберігає небажані ефекторні функції. Цей винахід намагається подолати проблеми, пов'язані з потенційною імуногенністю і ефекторною активністю, що можуть виникати у разі введення гібридних білків GLP-1-Fc, шляхом ідентифікації конкретних гібридних білків GLP-1-Fc, які мають зменшений ризик індукування імунної реакції після повторного і тривалого введення і більше не мають ефекторної функції. Ці конкретні гібридні білки мають заміни у різних положеннях складової частини, що являє собою GLP-1, а також Fcфрагмента молекули. Заміни, опис яких наведено, забезпечують підвищену активність, підвищують стабільність in vivo, ліквідують ефекторну функцію і зменшують ймовірність того, що згадана молекула буде розпізнана адаптивними елементами імунної системи. Сполуки за цим винаходом включають гетерологічні гібридні білки, до складу яких входить аналог GLP-1, що містить послідовність, вибрану з групи, яка включає: a) (ПОСЛІДОВНІСТЬ №1) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-SerSer-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-IleAla-Trp-Leu-Val-Lys-Gly-Gly-Gly, де Xaa8 вибраний з Gly і Val; b) (ПОСЛІДОВНІСТЬ №2) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-SerSer-Tyr-Leu-Glu-Glu-Gln-Аlа-Аlа-Lуs-Glu-Рhе-llе-АlаТrp-Lеu-Lуs-Аsn-Gly-Gly-Gly, де Xaa8 вибраний з Gly і Val; c) (ПОСЛІДОВНІСТЬ №3) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-SerSer-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-IleAla-Trp-Leu-Val-Lys-Gly-Gly-Pro, де Xaa8 вибраний з Gly і Val; d) (ПОСЛІДОВНІСТЬ №4) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-SerSer-Tyr-Leu-Glu-Glu-Gln-Аlа-Аlа-Lуs-Glu-Рhе-ІlеАlа-Тrp-Lеu-Lуs-Аsn-Gly-Gly-Рrо, де Xaa8 вибраний з Gly і Val; e) (ПОСЛІДОВНІСТЬ №5) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-SerSer-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-IleAla-Trp-Leu-Val-Lys-Gly-Gly, де Xaa8 вибраний з Gly і Val; f) (ПОСЛІДОВНІСТЬ №6) His-Xaa8-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-SerSer-Tyr-Leu-Glu-Glu-Gln-Аlа-Аlа-Lуs-Glu-Рhе-llе-АlаТrp-Lеu-Lуs-Аsn-Glу-Glу, де Хаа8 вибраний з Gly і Val; злитий з Fc-фрагментом імуноглобуліну, що містить ПОСЛІДОВНІСТЬ №7: Ala-Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro-ProCys-Pro-Ala-Pro-Xaa16-Xaa17-Xaa18-Gly-Gly-Pro-SerVal-Phe-Leu-Phe-Pro-Pro-Lys-Pro-Lys-Asp-Thr-LeuMet-Ile-Ser-Arg-Thr-Pro-Glu-Val-Thr-Cys-Val-Val-ValAsp-Val-Ser-Gln-Glu-Asp-Pro-Glu-Val-Gln-Phe-Asn 87458 6 Trp-Tyr-Val-Asp-Gly-Val-Glu-Val-His-Asn-Ala-LysThr-Lys-Pro-Arg-Glu-Glu-Gln-Phe-Xaa80-Ser-Thr-TyrArg-Val-Val-Ser-Val-Leu-Thr-Val-Leu-His-Gln-AspTrp-Leu-Asn-Gly-Lys-Glu-Tyr-Lys-Cys-Lys-Val-SerAsn-Lys-Gly-Leu-Pro-Ser-Ser-Ile-Glu-Lys-Thr-Ile-SerLys-Ala-Lys-Gly-Gln-Pro-Arg-Glu-Pro-Gln-Val-TyrThr-Leu-Pro-Pro-Ser-Gln-Glu-Glu-Met-Thr-Lys-AsnGln-Val-Ser-Leu-Thr-Cys-Lеu-Vаl-Lуs-Сlу-Рhе-ТутРrо-Sеr-Аsр-Ilе-Аlа-Vаl-Glu-Тup-Сlu-Ser-Asn-GlyGln-Pro-Glu-Asn-Asn-Tyr-Lys-Thr-Thr-Pro-Pro-ValLeu-Asp-Ser-Asp-Gly-Ser-Phe-Phe-Leu-Tyr-Ser-ArgLeu-Thr-Val-Asp-Lys-Ser-Arg-Trp-Gln-Glu-Gly-AsnVal-Phe-Ser-Cys-Ser-Val-Met-His-Glu-Ala-Leu-HisAsn-His-Tyr-Thr-Gln-Lys-Ser-Leu-Ser-Leu-Ser-LeuGly-Xaa230 (ПОСЛІДОВНІСТЬ №7), де: Xaa у положенні 16 - Pro або Glu; Xaa у положенні 17 - Phe, Val або Ala; Xaa у положенні 18 - Leu, Glu або Ala; Xaa у положенні 80 - Asn або Ala; і Xaa у положенні 230 - Lys або відсутня. С-кінець складової частини, що являє собою аналог GLP-1, і N-кінець Fc-фрагмента гетерологічних гібридних білків за цим винаходом, зливаються, за варіантом, якому віддають перевагу, через 1, 1,5 або 2 повтори G-збагаченого пептидного лінкера, що має послідовність Gly-Gly-GlyGly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (ПОСЛІДОВНІСТЬ №8). Цей винахід включає також полінуклеотиди, що кодують гетерологічні гібридні білки за цим винаходом, а також вектори і клітини-хазяї, що містять такі полінуклеотиди. Цей винахід стосується також способів лікування хворих, що страждають як на інсулінонезалежний, так і на інсулінозалежний діабет, ожиріння і різні інші розлади та стани, що включають введення гетерологічних гібридних білків, що обговорюються у цьому описі. Гетерологічні гібридні білки за цим винаходом включають складову частину, що являє собою аналог GLP-1, і Fc-фрагмент. Складова частина, що являє собою аналог GLP-1, і Fc-фрагмент включають заміни у послідовності нативного GLP1 і послідовності людського IgG4, відповідно, які забезпечують можливість одержання білка з підвищеною активністю і стабільністю in vivo. порівняно з нативним GLP-1 або аналогами GLP-1, не злитими з послідовністю Fc, з одночасним зменшенням потенціалу індукування утворення антитіл після тривалого і повторного введення людям. Нативний GLP-1 обробляють in vivo таким чином, що перші 6 амінокислот від молекули відщеплюються. За традицією, прийнятою у цій галузі, аміно-кінепь GLP-1 має номер 7, у той час як карбоксильний кінець має номер 37. Інші амінокислоти поліпептиду нумеруються послідовно, як показано у ПОСЛІДОВНОСТІ №9. Наприклад, положення 8 займає аланін, а положення 22 займає гліцин. Підданий обробці пептид може бути додатково модифікований in vivo таким чином, що С-кінцевий залишок гліцину видаляється і замінюється на амідну групу. Таким чином, GLP-1(737)OH і GLР-1(7-36)амід являють собою дві нативні форми молекули. GLP-1(7-37)OH має амінокис 7 лотну послідовність, представлену ПОСЛІДОВНІСТЮ №9: 7 His-Ala-Glu-10Gly-Thr-Phe-Thr-Ser-15Asp-ValSer-Ser-Tyr-20Leu-Glu-Glу-Gln-Аlа-25Аlа-Lуs-GluРhе-Ilе-30Аlа-Тrp-Lеu-Vаl-Lus-35Glу-Аrg-37Gly (ПОСЛІДОВНІСТЬ №9). Складова частина гетерологічного гібридного білка, що являє собою аналог GLP-1, включає три головні заміни у положеннях 8, 22 і 36, відносно нативного GLP-1(7-37). Заміна у положенні 8 зменшує швидкість, з якою ендогенний фермент дипептиділпептидаза IV (DPP-IV) інактивує аналог. DPP-IV розщеплює нативний GLP-1 між другою та третьою амінокислотами (між положенням 8 і положенням 9), і одержана молекула є менш активною. Таким чином, гетерологічні гібридні білки за цим винаходом є стійкими до DPP-IV. Заміна у положенні 22 зменшує потенціал молекули до агрегування і підвищення активності молекули. Заміна у положенні 36 у контексті аналога із замінами у положенні 8 і положенні 22, а також у контексті гібридного білка у цілому, зменшує ризик того, що згаданий гібридний білок буде індукувати нейтралізуючу імунну реакцію після повторного і тривалого введення людям. Центральним явищем у породженні як гуморальної, так і клітинно-опосередкованої імунних реакцій є активація і клональна експансія Т-клітинхелперів (ТH-клітин). Активація ТH-клітин ініціюється взаємодією комплексу рецептор Т-клітин (TCR)CD3 з обробленим антигенним пептидом, зв'язаним з молекулою головного комплексу гістосумісності (МНС) класу II, у присутності антигенпрезентуючої клітини (АРС). Взаємодія ТH-клітин із антигеном ініціює каскад біохімічних явищ, який індукує вступ спочиваючих ТH-клітин до клітинного циклу (перехід G0®G1). Активовані Т-клітини проходять через клітинний цикл, розмножуються і диференціюються на клітини пам'яті або ефекторні клітини. Для ідентифікації потенційних антигенних детермінант, аналізу була піддана наведена нижче послідовність: His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-SerSer-Tyr-Leu-Glu-Glu-Gln-Ala-Ala-Lys-Glu-Phe-IleAla-Trp-Leu-Val-Lys-Gly-Arg-Gly-Gly-Gly-Gly-GlySer-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-GlyGly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-GlyGly-Ser-Ala-Glu-Ser-Lys-Tyr-Gly-Pro-Pro-Cys-Pro (ПОСЛІДОВНІСТЬ №10). Ця послідовність являє собою послідовність аналога GLP-1 із замінами у положеннях 8 і 22 відносно нативної послідовності, з подальшими 2 копіями послідовності G-збагаченого пептидного лінкера, за якими йдуть перші 10 амінокислот Fcфрагмента, який одержали з людського IgG4. Термін "антигенна детермінанта", що вживається у цьому описі, означає ділянку білкової молекули, з якою може зв'язуватись антитіло. Імуногенна антигенна детермінанта визначається як частина білка, що викликає утворення антитіл, коли імуногеном є білок у цілому. Картування антигенних детермінант включало сканування послідовностей із застосуванням ковзного вікна з дев'яти амінокислот, у поєднанні з методами статистичного аналізу ви 87458 8 сокого рівня, для добування інформації, що містилась у цих структурах. Запатентований пакет програм, відомий як EpiMatrix™, застосовували для аналізу послідовності та ідентифікації пептидів, які можуть із високим ступенем ймовірності викликати імунну реакцію у разі презентації Т-клітинам. Під час аналізу відносно взаємодії з рецептором МНС класу II були застосовані вісім широко розповсюджених алелей. До числа цих алелей належали DRB1*0101, DRB1*0301, DRB1*0401, DRB1*0701, DRB1*0801, DRB1*1101, DRB1*1301 і DRB1*1501. Припустили, що сильна антигенна детермінанта повинна була знаходитись на ділянці з'єднання С-кінця складової частини, що являє собою аналог GLP-1, і початку лінкера. Ця антигенна детермінанта має послідовність Trp-Leu-Val-Lys-Gly-Arg-GlyGly-Gly (ПОСЛІДОВНІСТЬ №11), що взаємодіє з DRB1*0801. Цей винахід має відношення до відкриття, яке полягає у тому, що ця антигенна детермінанта може бути ліквідована шляхом заміни Скінця аналога GLP-1 на одну з наведених нижче послідовностей: Trp-Leu-Val-Lys-Gly-Gly-Gly (ПОСЛІДОВНІСТЬ №12); Trp-Leu-Lys-Asn-Gly-Gly-Gly (ПОСЛІДОВНІСТЬ №13); Trp-Leu-Val-Lys-Gly-GlyPro (ПОСЛІДОВНІСТЬ №14); Τrp-Leu-Lys-Asn-GlyGly-Pro (ПОСЛІДОВНІСТЬ №15); Trp-Leu-Val-LysGly-Gly (ПОСЛІДОВНІСТЬ №16); іTrp-Leu-Lys-AsnGly-Gly (ПОСЛІДОВНІСТЬ №17). Гетерологічні гібридні білки за цим винаходом містять Fc-фрагмент, одержаний з людського IgG4, який включає, однак, одну або декілька замін, порівняно з людською послідовністю дикого типу. Словосполучення "Fc-фрагмент імуноглобуліну", що застосовують у цьому описі, має значення, яке цьому словосполученню традиційно надають у галузі імунолога. Зокрема, цей термін означає фрагмент антитіла, що не містить двох антигензв'язуючих ділянок (Fab-фрагментів) антитіла. Fc-фрагмент складається з константних ділянок обох важких ланцюгів антитіла, що зв'язуються між собою нековалентними і дисульфідними зв'язками. Fc-фрагмент може включати шарнірні ділянки і проходити через домени СН2 і СНЗ до С-кінця антитіла. Fc-фрагмент може додатково включати один або декілька сайтів глікозилування. Існує п'ять типів людських імуноглобулінів із різними ефекторними функціями і фармакокінетичними властивостями. IgG є найстабільнішим із п'яти типів і його період напіввиведення із сироватки людей становить приблизно 23 дні. Існує чотири підкласи IgG (G1, G2, G3 і G4), кожен з яких має різні біологічні функції, відомі як ефекторні функції. Ці ефекторні функції, як правило, опосередковуються через взаємодію з рецептором Fc (FcgR) або шляхом зв'язування C1q і комплемента. Наслідком зв'язування з FcgR може бути антитілозалежний клітинно-опосередкований цитоліз, у той час як наслідком зв'язування з факторами комплементу може бути клітинний лізис, опосередкований комплементом. При конструюванні гетерологічних гібридних білків Fc, де Fc-фрагмент застосовується виключно з огляду на його здатність до подовження періоду напіввиведення, важливо звести до мінімального рівня будь-яку ефекторну функцію. Так, гетерологічні гібридні білки за 9 цим винаходом одержують із застосуванням Fcфрагмента людського IgG4 завдяки його ослабленій здатності до зв'язування FcgR і факторів комплементу, порівняно, з іншими підтипами IgG. Було показано, однак, що IgG4 виснажує клітинимішені у людей [Іссакс (Issacs) та інші, (1996) Сlin. Ехр. Immunol. 106:427-433]. Оскільки гетерологічні гібридні білки за цим винаходом спрямовуються на бета-клітини підшлункової залози для індукування експресії інсуліну, застосування фрагмента IgG4 у гібридному білку Fc могло б ініціювати імунну реакцію проти панкреатичних бета-клітин шляхом взаємодії згаданого гібридного білка з рецептором GLP-1, присутнім на панкреатичних бета-клітинах. Таким чином, Fc-фрагмент IgG4, що є складовою частиною гібридних білків за цим винаходом, включає заміни, що ліквідують ефекторну функцію. Fc-фрагмент IgG4 гібридних білків за цим винаходом може включати одну або декілька із наведених нижче замін: заміну глутамату на пролін (залишок 233), фенілаланіну на аланін або валін (залишок 234) і лейцину на аланін або глутамат (залишок 235) (нумерація Євросоюзу, Кабат Е.А. (Kabat E.A.) та інші, (1991) Sequences of Proteins of Immunological Interest, 5th Ed., U.S. Dept. of Health and Human Services, Bethesda, штат Меріленд, публікація Національного інституту здоров'я (США) №91-3242). Ці залишки відповідають положенням 16, 17 і 18 у ПОСЛІДОВНОСТІ №7. Далі, видалення N-зв'язаного сайту глікозилування з Fcфрагмента IgG4 шляхом заміни Asn на Ala (залишок 297, нумерація Євросоюзу), що відповідає положенню 80 ПОСЛІДОВНОСТІ №7, є іншим способом забезпечення ліквідації залишкової ефекторної активності у контексті гетерологічного гібридного білка. На додаток до цього, Fc-фрагмент IgG4 гетерологічних гібридних білків за цим винаходом містить заміну, що стабілізує утворення димеру важкого ланцюга і запобігає утворенню напів-IgG Fc ланцюгів. Гетерологічні гібридні білки за цим винаходом, за варіантом, якому віддають перевагу, існують у вигляді димерів, об'єднаних дисульфідними зв'язками і різними нековалентними зв'язками. IgG4 дикого типу містить мотив Pro-Pro-CysPro-Ser-Cys (ПОСЛІДОВНІСТЬ №18), що розпочинається на залишку 224 (нумерація Євросоюзу). Цей мотив у одному ланцюзі аналога GLP-1-Fc утворює дисульфідні зв'язки з відповідним мотивом у іншому ланцюзі аналога GLP-1-Fc. Однак присутність серину у згаданому мотиві спричинює утворення одноланцюгових гібридних білків. Цей винахід має відношення до гетерологічних гібридних білків Fc, де послідовність IgG додатково модифікована таким чином, що серин у положенні 228 (нумерація Євросоюзу) замінюють на пролін (амінокислотний залишок 11 у ПОСЛІДОВНОСТІ №7). С-кінцевий залишок лізину, присутній у нативній молекулі, може бути видалений у Fc-фрагменті (що походить з IgG4) гетерологічних гібридних білків, що обговорюються у цьому описі (положення 230 ПОСЛІДОВНОСТІ №7; видалений лізин позначається як des-K). Гібридні білки, що експресуються клітинами деяких типів (наприклад, кліти 87458 10 нами NS0), де лізин кодується С-кінцевим кодоном, є гетерогенними, оскільки частина молекул має лізин, як С-кінцеву амінокислоту, а у частини молекул лізин є видаленим. Згадане видалення у клітинах ссавців деяких типів обумовлюється дією протеаз під час експресії. Таким чином, для запобігання цієї гетерогенності, перевагу віддають тому, щоб генно-інженерні конструкції для експресії гібридних білків Fc були позбавлені С-кінцевого кодону для лізину. За варіантом, якому віддають перевагу, Скінцева амінокислота складової частини, що являє собою аналог GLP-1 і обговорюється у цьому описі, зливається з N-кінцем складової частини, що являє собою Fc-фрагмент IgG4, через збагачений гліцином лінкер. In vivo функція і стабільність гетерологічних гібридних білків за цим винаходом можуть оптимізуватись шляхом додання невеликих пептидних лінкерів для запобігання потенційно небажаних взаємодій доменів. Окрім того, збагачений гліцином лінкер забезпечує певну структурну гнучкість, завдяки чому складова частина, що являє собою аналог GLP-1, може продуктивно взаємодіяти з рецептором GLP-1 на клітинахмішенях, наприклад, бета-клітинах підшлункової залози. Ці лінкери, однак, можуть значно підвищити ризик того, що гібридний білок виявиться імуногенним in vivo. Таким чином, за варіантом, якому віддають перевагу, довжина цих лінкерів повинна бути не більшою за необхідну для запобігання небажаних взаємодій доменів та/або оптимізації біологічної активності та/або стабільності. За варіантом, якому віддають перевагу, збагачений гліцином лінкер включає послідовність: Gly-Gly-GlyGly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (ПОСЛІДОВНІСТЬ №8). Незважаючи на те, що у гетерологічних гібридних білках за цим винаходом може застосовуватись більша кількість копій цього лінкера, за варіантом, якому віддають перевагу, застосовується одна копія цього лінкера для зведення ризику імуногенності, пов'язаної з тривалим і повторним введеннями, до мінімального рівня. До гетерологічних гібридних білків GLP-1-Fc за цим винаходом, яким віддають перевагу, належать білки, наведені нижче: Gly8-Glu22-Gly36-GLP-1(737)-1L-IgG4 (S228P), Gly8-Glu22-Gly36-GLP-1(7-37)1L-IgG4 (S228P, F234A, L235A), Gly8-Glu22-Gly36GLP-1(7-37)-1L-IgG4 (S228P, N297A), Gly8-Gtu22Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A, N297A), Gly8-Glu22-Gly36-GLP-1(7-37)-1,5LIgG4(S228P), Gly8-Glu22-Gly36-GLP-1(7-37)-1,5LIgG4 (S228P, F234A, L235A), Gly8-Glu22-Gly36-GLP1(7-37)-1,5L-IgG4 (S228P, N297A), Gly8-Glu22-Gly36GLP-1(7-37)-1,5L-IgG4 (S228P, F234A, L235A, N297A), Gly8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P), Gly8-Glu22-Gly36-GLP-1(7-37)-2L-IgG4 (S228P, F234A, L235A), Gly8-Glu22-Gly36-GLP-1(737)-2L-IgG4 (S228P, N297A), Gly8-Glu22-Gly36-GLP1(7-37)-2L-IgG4 (S228P, F234A, L235A, N297A) та Val8 і усі вищезазначені білки з видаленим лізином (форми des-K). Номенклатура, що вживається у цьому описі, для позначення конкретних гетерологічних гібридних білків, визначається таким чином: конкретні заміни у складовій частині гібридного білка, що 11 являє собою GLP-1, позначаються шляхом указания конкретної амінокислоти, що замінюється, з подальшим номером залишку. GLP-1(1-37) означає, що складова частина зрілого гібридного білка, що являє собою GLP-1, починається з His у положенні 7 і закінчується Gly у положенні 37. L означає лінкер із послідовністю Gly-Gly-Gly-Gly-Ser-GlyGly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (ПОСЛІДОВНІСТЬ №8). Число, яке безпосередньо передує L, означає кількість лінкерів, що відокремлюють складову частину, що являє собою GLP-1, від складової частини, що являє собою Fcфрагмент. Лінкер, позначений як 1,5L, означає послідовність Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-GlyGly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (ПОСЛІДОВНІСТЬ №19). IgG4 означає аналог послідовності Fc-фрагмента людського IgG4, позначеної як ПОСЛІДОВНІСТЬ №7. Заміни у складовій частині гетерологічного гібридного білка, що являє собою Fc-фрагмент IgG4, вказуються у дужках. Амінокислота дикого типу вказується прийнятим для неї скороченням із подальшим номером положення у контексті послідовності IgG4 у цілому (із застосуванням нумерації Євросоюзу), з подальшим указанням амінокислоти, що замінюється у цьому положенні, із застосуванням прийнятого для цієї кислоти скорочення. Хоча гетерологічні гібридні білки за цим винаходом можна одержувати найрізноманітнішими методами, перевагу, однак, зважаючи на розмір гібридного білка, віддають методам генної інженерії. У цілях цього винаходу, що розкриваються у описі і заявляються у пунктах формули винаходу, нижче надається визначення загальних молекулярно-біологічних термінів і скорочень. Термін "пара нуклеотидів'' або "п.н.", що вживається у цьому описі, має відношення до ДНК або РНК. Скорочення А, С, G і Τ відповідають 5'монофосфатним формам дезоксирибонуклеозидів (дезокси)аденозину, (дезокси)цитидину, (дезокси)гуанозину і тимідину, відповідно, коли вони зустрічаються у молекулах ДНК. Скорочення U, С, G і А відповідають 5'-монофосфатним формам рибонуклеозидів уридину, цитидину, гуанозину і аденозину, відповідно, коли вони зустрічаються у молекулах РНК У двонитковій ДНК, пара нуклеотидів може означати А у парі з Τ або С у парі з G. У разі ДНК/РНК, гетеродуплексна пара нуклеотидів може означати А у парі з U або С у парі з G. (Дивись визначення терміну "комплементарний", наведене нижче). Термін "гідроліз" або "рестрикція" ДНК означає каталітичне розщеплення ДНК за допомогою рестриктази, що діє лише на певні послідовності у складі ДНК ("ендонуклеази, специфічні відносно певних послідовностей"). Різноманітні застосовані у цьому винаході рестриктази є наявними на ринку, і умови їх реагування, кофактори і інші вимоги застосовувались у межах знань пересічного фахівця у цій галузі. Відповідні буфери і кількість субстрату для конкретної рестриктази вказуються виробником або можуть бути легко знайдені у літературі. Термін "літування" означає процес утворення фосфодіефірних зв'язків між двома фрагментами 87458 12 двониткової нуклеїнової кислоти. У разі відсутності інших вказівок, літування може здійснюватись із застосуванням відомих буферів і умов за допомогою ДНК-лігази, наприклад, ДНК-лігази фага Т4. Термін "плазміда" означає позахромосомний (як правило) автореплікаційний генетичний елемент. Словосполучення "вектор клонування рекомбінантної ДНК", що вживається у цьому описі, означає будь-який агент з автономною реплікацією, у тому числі, але без обмеження, плазміди і фаги, що містить молекулу ДНК, до якої може бути або був доданий один або декілька додаткових сегментів ДНК. Словосполучення "вектор експресії рекомбінантної ДНК", що вживається у цьому описі, означає будь-який вектор клонування рекомбінантної ДНК, до якого було введено промотор для регулювання транскрипції ДНК-вставки. Термін "транскрипція" означає процес, під час якого інформація, що міститься у нуклеотидній послідовності ДНК, передається на послідовність комплементарної РНК. Термін "трансфекція" означає поглинання вектора експресії клітиною-хазяїном незалежно від того, експресуються чи ні, фактично, будь-які кодувальні послідовності. Пересічному фахівцю у цій галузі відомі численні способи трансфекції, наприклад, кальційфосфатне співосадження, трансфекція ліпосомами і електропорація. Трансфекція, як правило, визнається успішною у тому разі, коли у межах клітини-хазяїна спостерігаються будь-які ознаки дії цього вектора. Термін "трансформація" означає введення ДНК до організму, завдяки чому ДНК реплікується або як позахромосомний елемент, або шляхом хромосомної інтеграції. Способи трансформації хазяїв-бактерій і еукаріотів є добре відомими у цій галузі; багато з цих способів, наприклад, ядерна ін'єкція, злиття протопластів або обробка кальцієм із застосуванням хлориду кальцію, в узагальненій формі наведено у довіднику Дж. Сембрук (J. Sambrook) та інші, Molecular Cloning: A Laboratory Manual, (1989). Взагалі, у разі введення ДНК до дріжджів, термін "трансформація" застосовується у протилежність терміну "трансфекція". Термін "трансляція", що вживається у цьому описі, означає процес, під час якого генетична інформація матричної (інформаційної) РНК (мРНК) застосовується для визначення і спрямування синтезу поліпептидного ланцюга. Термін "вектор" означає нуклеїновокислотну сполуку, що застосовується для трансфекції та/або трансформації клітин при маніпуляції генами, яка несе полінуклеотидні послідовності, що відповідають певним білковим молекулам, які, у разі об'єднання з придатними регулярними послідовностями, наділяють специфічними властивостями клітину-хазяїна, яку піддають трансфекції та/або трансформації. Прийнятними векторами є плазміди, віруси і бактеріофаги. Штучні вектори конструюють шляхом розрізування і з'єднання молекул ДНК з різних джерел за допомогою рестриктаз і лігаз. Термін "вектор", що вживається у цьому описі, включає вектори для клонування рекомбіна 13 нтної ДНК і вектори для експресії рекомбінантної ДНК. Термін "комплементарний" або "комплементарність", що вживається у цьому описі, означає пару основ (пуринів і піримідинів), які, через водневі зв'язки, об'єднуються у двониткову нуклеїнову кислоту. Комплементарними є такі пари основ: гуанін і цитозин; аденін і тимін; аденін і урацил. Термін "праймер" означає фрагмент нуклеїнової кислоти, який відіграє роль ініціювального субстрату для ферментативної або синтетичної елонгації. Термін "промотор" означає послідовність ДНК, що спрямовує транскрипцію ДНК на РНК. Термін "зонд" означає нуклеїновокислотну сполуку або її фрагмент, що гібридизується з іншою нуклеїновокислотною сполукою. Термін "лідерна послідовність" означає послідовність амінокислот, що може видалятись ферментативним або хімічним шляхом з одержанням необхідного поліпептиду. Словосполучення "послідовність сигналу секреції" означає послідовність амінокислот, присутню, як правило, на N-кінцевій ділянці більшого полілептиду, що ініціює асоціацію цього поліпептиду з компартментами клітинної мембрани, наприклад, ендоплазматичною сіткою, і секрецію цього поліпетиду через плазматичну мембрану. Білки людського IgG4 дикого типу можна одержати з різноманітних джерел. Ці білки, наприклад, можна одержати з бібліотеки кДНК, одержаної з клітин, що експресують необхідну мРНК на рівні, що піддається виявленню. Бібліотеки можуть піддаватись скринінгу за допомогою зондів, сконструйованих із застосуванням опублікованої послідовності ДНК або білкової послідовності для конкретного необхідного білка. Опис константних ділянок легкого або важкого ланцюга імуноглобулінів наведено, наприклад, у Адамс (Adams) та інші, (1980) Biochemistry 19:2711-2719; Гугет (Goughet) та інші, (1980) Biochemistry 19: 27022710; Долбі (Dolby) та інші, (1980) Proc. Natl Acad. Set USA 77: 6027-6031; Райе (Rice) та інші, (1982) Proc. Natl. Acad. Sci. USA 79: 7862-7862; Фелкнер (Falkner) та інші, (1982) Nature 298: 286-288 і Моррісон (Morrison) та інші, (1984) Ann. Rev. Immunol. 2: 239-256. Скринінг бібліотеки кДНК або геномної бібліотеки за допомогою вибраного зонду може здійснюватись за стандартними методиками, які, наприклад, описані у довіднику Сембрук (Sambrook) та інші, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY (1989). Альтернативним засобом виділення гена, що кодує імуноглобуліновий білок, є застосування методики ПЛР [Сембрук (Sambrook) та інші, вище; Діффенбах (Dieffenbach) та інші, PCR Primer: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY (1995)]. ПЛР-праймери можуть конструюватись на основі опублікованих послідовностей. Взагалі, непроцесовані послідовності дикого типу, клоновані з конкретної бібліотеки, можуть правити за матрицю для одержання аналогів Fcфрагмента IgG4 за цим винаходом, що зберігають здатність до забезпечення довшого періоду напів 87458 14 виведення з плазми аналога GLP-1, що є складовою частиною гібридного білка. Аналоги Fcфрагмента IgG4 можна одержати за допомогою ПЛР із праймерами, сконструйованими для гібридизації з послідовностями, що відповідають необхідним кінцям фрагмента. ПЛР-праймери можуть також конструюватись для одержання сайтів рестрикції для полегшення клонування у векторах експресії. ДНК, що кодує аналоги GLP-1 за цим винаходом, можна одержати найрізноманітнішими способами, у тому числі методами клонування, подібними до описаних вище, а також шляхом хімічного синтезування ДНК. Хімічний синтез може бути привабливим, зважаючи на невелику довжину кодованого пептиду. Амінокислотна послідовність GLP-1 і послідовність препроглюкагонового гена опубліковані. [Лопес (Lopez) та інші, (1983) Рrос. Natl. Acad. ScL, USA 80: 5485-5489; Белл (Bell) та інші, (1983) Nature, 302: 716-718; Хейнріх Дж. (Heinrich G.) та інші, (1984) Endocrinol, 115: 21762181; Гільон Μ. (Ghiglione Μ.) та інші, (1984) Diabetologia 27: 599-600]. Таким чином, праймери для одержання ДНК, що кодує описані аналоги GLP-1, можуть конструюватись на основі нативної послідовності. Ген, що кодує гібридний білок, може конструюватись шляхом літування ДНК, що кодує аналог GLP-1, у межах рамки зчитування з ДНК, що кодує описані білки IgG Fc. ДНК, що кодує GLP-1 дикого типу і Fc-фрагменти IgG4, може бути підданий мутації перед літуванням або у контексті кДНК, що кодує гібридний білок у цілому. У цій галузі добре відомі різноманітні методики мутагенезу. Ген, що кодує аналог GLP-1, і ген, що кодує білок-аналог IgG4 Fc, можуть також об'єднуватись у межах рамки зчитування через ДНК, що кодує G-збагачений лінкерний пептид. Послідовність ДНК, якій віддають перевагу, що кодує один із гетерологічних гібридних білків за цим винаходом, якому віддають перевагу, Gly8-Glu22-Gly36-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A, des K), наведено як ПОСЛІДОВНІСТЬ №20: CACGGCGAGGGCACCTTCACCTCCGACGTG TCCTCCTATCTCGAGGAGCAGGCCGCCAAGGAA TTCATCGCCTGGCTGGTGAAGGGCGGCGGCGGT GGTGGTGGCTCCGGAGGCGGCGGCTCTGGTGG CGGTGGCAGCGCTGAGTCCAAATATGGTCCCCC ATGCCCACCCTGCCCAGCACCTGAGGCCGCCGG GGGACCATCAGTCTTCCTGTTCCCCCCAAAACCC AAGGACACTCTCATGATCTCCCGGACCCCTGAGG TCACGTGCGTGGTGGTGGACGTGAGCCAGGAAG ACCCCGAGGTCCAGTTCAACTGGTACGTGGATG GCGTGGAGGTGCATAATGCCAAGACAAAGCCGC GGGAGGAGCAGTTCAACAGCACGTACCGTGTGG TCAGCGTCCTCACCGTCCTGCACCAGGACTGGC TGAACGGCAAGGAGTACAAGTGCAAGGTCTCCAA CAAAGGCCTCCCGTCCTCCATCGAGAAAACCATC TCCAAAGCCAAAGGGCAGCCCCGAGAGCCACAG GTGTACACCCTGCCCCCATCCCAGGAGGAGATG ACCAAGAACCAGGTCAGCCTGACCTGCCTGGTC AAAGGCTTCTACCCCAGCGACATCGCCGTGGAG TGGGAAAGCAATGGGCAGCCGGAGAACAACTAC AAGACCACGCCTCCCGTGCTGGACTCCGACGGC TCCTTCTTCCTCTACAGCAGGCTAACCGTGGACA 15 AGAGCAGGTGGCAGGAGGGGAATGTCTTCTCAT GCTCCGTGATGCATGAGGCTCTGCACAACCACTA CACACAGAAGAGCCTCTCCCTGTCTCTGGGT (ПОСЛІДОВНІСТЬ №20). Клітини-хазяї трансфікуються або трансформуються векторами експресії або векторами клонування, опис яких наведено, для продукування гетерологічних гібридних білків і культивування у звичайних живильних середовищах, відповідним чином модифікованих для індукування промоторів, відбирання трансформантів або ампліфікації генів, що кодують необхідні послідовності. Умови культивування, наприклад, живильні середовища, температура, рН тощо, можуть бути вибрані досвідченим фахівцем без зайвого експериментування. Взагалі, принципи, методики і практичні способи доведення продуктивності клітинних культур до максимального рівня можна знайти у Mammalian Cell Biotechnology: A Practical Approach, редактор Μ. Батлер (Μ. Butler), (IRL Press, 1991) і Сембрук (Sambrook) та інші, вище. Способи трансфекції є відомими пересічному досвідченому фахівцю, наприклад, СаРО4 і електропорація. Загальні аспекти трансформації систем клітин-хазяїв ссавців описані у патенті США 4,399,216. Дріжджі, як правило, піддають трансформації за способом, описаним у ван Солінген (van Solingen) та інші, J. Bad. 130(2): 946-7 (1977) і Хсяо (Hsiao) та інші, Proc. Natl. Acad. Sci. USA 76(8): 3829-33 (1979). Введення ДНК до клітин може здійснюватись і за допомогою інших способів, наприклад, шляхом мікроін'єкції ядра, електропорації, злиття бактеріальних протопластів з інтактними клітинами або за допомогою полікатіонів, наприклад, полібрену або поліомітину. Різні способи трансформації клітин ссавців дивись у Коун (Keown) та інші, Methods in Enzymology 185: 527-37 (1990); Мансур (Mansour) та інші, Nature 336(6197): 348-52 (1988). Придатними клітинами-хазяями для клонування або експресії нуклеїнової кислоти (наприклад, ДНК) у векторах є клітини дріжджів або вищих еукаріотів. Мікроби-еукаріоти, наприклад, нитчасті гриби або дріжджі, є придатними хазяями для клонування або експресії векторів гібридних білків. Широко застосовуваним нижчим еукаріотним мікроорганізмом-хазяїном є Saccharomyces cerevisiae. Іншими є Schizosaccharomyces pombe [Біч (Beach) і Нерс (Nurse), Nature 290: 140-3 (1981); ЕР 139383, опублікований 2 травня 1995 року]; хазяї Muyveromyces [патент США №4,943,529; Флір (Fleer) та інші, Bio/Technology 9(10): 968-75 (1991)], наприклад, K. lactis (MW98-8C, CBS683, CBS4574) [де Лувенкур (de Louvencourt) та інші, J. Bacteriol. 154(2): 737-42 (1983)]; K. fiagilis (ATCC (Американська колекція типових культур) 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906) [Ван ден Берг (Van den Berg) та інші, Bio/Technology 8(2): 135-9 (1990)]; K. thermotoierans, K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070) [Срікрішна (Sreekrishna) та інші, J. Basic Microbiol 28(4): 265-78 (1988)]; Candid; Trichoderma reesia (EP 244234); Neurospora crassa [Кейс (Case) та інші, Proc. Natl. Acad. Sci. USA 76(10): 5259-63 87458 16 (1979)]; Schwanniomyces, наприклад, Schwanniomyces occidentulis (EP 394538, опублікований 31 жовтня 1990 року); і нитчасті гриби, наприклад, Neurospora, Penidllium, Tolypocladium (WO 91/00357, опублікована 10 січня 1991 року) і хазяї Aspergillus, наприклад, A. nidulans [Балланс (Ballance) та інші, Biochem. Biophys. Res. Comm. 112(1): 284-9 (1983)]; Тілбурн (Tilburn) та інші, Gene 26(2-3): 205-21 (1983); Йєлтон (Yelton) та інші, Proc. Natl. Acad. Sci. USA 81(5): 1470-4 (1984)] і A. niger [Келлі (Kelly) і Хайнс (Hynes), EMBO J. 4(2): 475-9 (1985)]. Метилотропні дріжджі вибирають із родів, що включають Hansenula, Candida, Шоескега, Pichia, Saccharomyces, Torulopsis і Rhodotoruia. Перелік конкретних видів, типових для дріжджів цього класу, можна знайти у К. Ентоні (С. Antony), The Biochemistry of Methylotrophs 269 (1982). Придатні клітини-хазяї для експресії гібридних білків за цим винаходом одержують із багатоклітинних організмів. Прикладами клітин безхребетних є клітини комах, наприклад, Drosophila S2 і Spodoptera Sp, Spodoptera high5, a також клітини рослин. Прикладами придатних ліній клітин-хазяїв ссавців є клітини мієломи NS0, яєчника китайського хом'яка (СНО), SP2 і клітини COS. Більш специфічними прикладами є лінія клітин нирок мавпи CV1, трансформована SV40 (мавпячий вірус 40) (COS-7, АТСС CRL 1651); лінія клітин нирки людського зародка [293 або клітини 293, субклоновані для росту у суспензійній культурі, Грехем (Graham) та інші, J. Gen. Virol, 36(1): 59-74 (1977)]; клітини яєчника китайського xoм’яка/-DHFR (дигідрофолатредуктаза) [СНО, Урлоб (Urlaub) і Чезін (Chasin), Proc. Natl. Acad. Sci. USA, 77(7): 4216-20 (1980)]; фолікулоцити яєчок мишей [TM4, Мейдер (Mather), Biol. Reprod. 23(1):243-52 (1980)]; людські легеневі клітини (W138. АТСС CCL 75); людські печінкові клітини (Hep G2, НВ 8065) і мишачі клітини пухлини молочної залози (ММТ 060562, АТСС CCL51). Лінією клітин для продукування гібридних білків Fc за цим винаходом, якій віддають перевагу, є лінія клітин мієломи NS0, доступна від Європейської колекції культивованих клітин тварин (ЕСАСС, номер за каталогом 85110503) і описана у Гелфр Дж. (Galfre G.) і Мілстейн К. (Milstein С.) ((1981) Methods in Enzymology 73(13): 3-46; і Preparation of Monoclonal Antibodies: Strategies and Procedures, Academic Press, N.Y., N.Y.). Гібридні білки за цим винаходом можна одержати безпосередньо методами генної інженерії або у вигляді білка, що має сигнальну послідовність або інші додаткові послідовності, що створюють специфічний сайт розщеплення на N-кінці зрілого гібридного білка. Взагалі, згадана сигнальна послідовність може бути складовою частиною вектора або вона може бути частиною ДНК, що кодує гібридний білок, яка вставляється до вектора. У разі секреції у дріжджах, сигнальною послідовністю може бути, наприклад, лідерна послідовність дріжджової інвертази, лідерна послідовність альфа-фактора (у тому числі, лідерні послідовності кофакторів Saccharomyces і Kluyveromyces; опис останніх наведено у патенті США 5,010,182) або лідерна послідовність кислої фосфатази, лідерна 17 послідовність глюкоамілази С. albicans (ЕР 362,179) або сигнальна послідовність, описана у WO 90/13646. У разі експресії у клітинах ссавців, сигнальні послідовності ссавців можуть застосовуватись для спрямування секреції білка, наприклад, сигнальні послідовності з секретованих поліпептидів того самого або спорідненого виду, а також вірусні секреторні лідерні послідовності. Обидва вектори, експресії і клонування, включають нуклеїновокислотну послідовність, що надає вектору можливість реплікації у одній або декількох вибраних клітинах-хазяях. Вектори експресії і клонування, як правило, містять селекційний ген, який називають також селекційним маркером. Типові селекційні гени кодують білки, що (а) наділяють стійкістю до антибіотиків або інших токсинів, наприклад, неоміцину, метотрексату або тетрацикліну, (b) доповнюють автотрофні недостатності або (с) постачають критичні поживні речовини, недоступні із живильних середовищ повного складу, наприклад, ген, що кодує рацемазу D-аланіну для Bacilli. Прикладом придатних селекційних маркерів для клітин ссавців є маркери, що надають можливість ідентифікації клітин, компетентних для поглинання нуклеїнової кислоти, що кодує гібридний білок, наприклад, DHFR (дигідрофолатредуктаза) або тимідинкіназа. Придатною клітиною-хазяїном, у разі застосування DHFR дикого типу, є лінія клітин СНО, дефіцитних за активністю DHFR, яка була одержана і розмножена, як описано [Урлоб (Urlsub) і Чезін (Chasin), Proc. Natl. Acad. Set USA, 77(7): 4216-20 (1980)]. Придатним селекційним геном для застосування на дріжджах є ген trpl, присутній у дріжджовій плазміді YRp7 [Стінчкомб (Stinchcomb) та інші, Nature 282(5734): 39-43 (1979); Кінгсмен (Kingsman) та інші, Gene 7(2): 14152 (1979); Щампер (Tschumper) та інші, Gene 10(2): 157-66 (1980)]. Ген trpl відіграє роль селекційного маркера для мутантного штаму дріжджів, нездатних до росту у триптофані, наприклад, АТСС №44076 або РЕРС1 [Джоне (Jones), Genetics 85: 23-33 (1977)]. Вектори експресії і клонування, як правило, містять промотор, функціонально зв'язаний з нуклеїновокислотною послідовністю, що кодує гібридний білок, для спрямування синтезу мРНК. Промотори, що розпізнаються різноманітними потенційними клітинами-хазяями, є добре відомими. Прикладами придатних промоторних послідовностей для застосування з дріжджами-хазяями є промотори для 3-фосфотліцераткінази [Хіцман (Hitzeman) та інші, J. Вsol. Chem. 255(24): 12073-80 (1980)] або інших гліколітичних ферментів [Хесс (Hess) та інші, J. Adv. Enzyme Reg. 7: 149 (1968); Холланд (Holland), Biochemistry 17(23): 4900-7 (1978)], наприклад, енолази, гліцеральдегід-3фосфатдегідрогенази, гексокінази, піруватдекарбоксилази, фосфофруктокінази, глюкозо-6фосфатізомерази, 3-фосфогліцератмутази, піруваткінази, тріозофосфатізомерази, фосфоглюкозоізомерази та глюкокінази. Іншими дріжджовими промоторами, які є індуцибельними промоторами, додаткова перевага яких полягає у транскрипції, що регулюється умовами росту, є промоторні ді 87458 18 лянки алкогольдегідрогенази 2, ізоцитохрому С, кислої фосфатази, розщеплювальні ферменти, пов'язані з метаболізмом азоту, металотіонеїн, гліцеральдегід-3-фосфатдегідрогеназа і ферменти, що несуть відповідальність за використання мальтози і галактози. Прийнятні вектори і промотори для застосування у разі дріжджової експресії додатково описані у ЕР 73,657. Транскрипція мРНК, що кодує гібридний білок, із векторів у клітинах-хазяях ссавців, може контролюватись, наприклад, промоторами, одержаними з геномів вірусів, наприклад, вірусу поліоми, вірусу віспи птиці, аденовірусу (наприклад, аденовірусу 2), вірусу папіломи великої рогатої худоби, вірусу саркоми птиці, цитомегаловірусу, ретровірусу, вірусу гепатиту В і мавпячого вірусу 40 (SV40), з гетерологічних промоторів ссавців, наприклад, промотору актину або промотору імуноглобуліну та з промоторів теплового шоку, за умови, що такі промотори є сумісними із системами клітин-хазяїв. Транскрипція полінуклеотиду, що кодує гібридний білок, вищими еукаріотами, може бути посилена шляхом введення енхансерної послідовності до вектора. Енхансери являють собою цис-діючі елементи ДНК, як правило, від приблизно 10п.н. до 300п.н., які діють на промотор для посилення його транскрипції. Зараз відомо багато енхансерних послідовностей з генів ссавців (глобін, елестаза, альбумін, α-кетопротеїн і інсулін). Застосовуватись, однак, буде, як правило, енхансер із вірусу еукаріотної клітини. Прикладами є енхансер SV40 на пізньому боці сайту ініціації реплікації (п.н. 100270), енхансер раннього промотору цитомегаловірусу, енхансер вірусу поліоми на пізньому боці сайту ініціації реплікації і енхансери аденовірусу. Енхансер може бути сплайсингованим до вектора у положенні 5' або 3' до кодувальної послідовності гібридного білка, однак за варіантом, якому віддають перевагу, він розмішується на 5'-кінцевій ділянці від промотору. Вектори експресії, що застосовуються на еукаріотних клітинах-хазяях (клітини дріжджів, грибів, комах, рослин, тварин, людей або клітини, що містять ядро, з інших багатоклітинних організмів), будуть також містити послідовності, необхідні для закінчення транскрипції і для стабілізації мРНК. Такі послідовності є, як правило, доступними з 5' і, подеколи, з 3' нетрансльованих ділянок еукаріотних або вірусних ДНК або кДНК. Ці ділянки містить нуклеотидні сегменти, транскрибовані як фрагменти поліаденілування на нетрансльованій частині мРНК, що кодує гібридний білок. З культурального середовища або з лізатів клітин-хазяїв можуть бути виділені різні форми гібридного білка. Якщо білок зв'язаний з мембраною, його можна відокремити від мембрани за допомогою розчину відповідного детергенту (наприклад, тритону-Х 100) або шляхом ферментативного відщеплення. Клітини, що застосовуються для експресії гібридного білка, можуть руйнуватись різноманітними фізичними або хімічними засобами, наприклад, періодичним заморожуванням-відтаюванням, обробкою ультразвуком, механічним руйнуванням або за допомогою агентів для лізису клітин. 19 Після завершення експресії гетерологічних гібридних білків за цим винаходом у відповідній клітини-хазяїні, аналоги можуть виділятись і очищатись. Нижче наведені приклади прийнятних методів очищення: фракціонування на карбоксиметилцелюлозі; гель-фільтрація (наприклад, сефадекс G-75); аніонообмінна смола (наприклад, DEAE (діетиламіноетилцелюлоза) або Mono-Q); катіонний обмін (наприклад, на карбоксиметилсефадексі або Mono-S); металеві хелатні колонки для зв'язування форм поліпептиду з міченими антигенними детермінантами; високоефективна рідинна хроматографія (HPLC) з оберненою фазою; хроматофокусування; силікагель; осадження етанолом і осадження сульфатом амонію. Можуть застосовуватись різні способи очищення білка і такі способи у цій галузі є відомими і описуються, наприклад, у роботах Дейчер (Deutscher), Methods in Enzymology 182: 83-9 (1990) і Скопе (Scopes), Protein Purification: Principles and Practice, Springer-Verlag, NY (1982). Вибрана стадія(-ї) очищення буде(-уть) залежати від природи застосованого процесу продукування і конкретного одержаного гібридного білка. Наприклад, гібридні білки, що містять Fc-фрагмент, можуть бути ефективно очищені із застосуванням афінної матриці білка А або білка G. Для елюювання гібридного білка з афінної матриці можуть застосовуватись буфери з низьким або високим рН. М'які умови елюювання допоможуть запобігти необоротній денатурації гібридного білка. Гетерологічні гібридні білки за цим винаходом можуть комбінуватись з одним або декількома наповнювачами. Гібридні білки за цим винаходом можуть комбінуватись із фармацевтично прийнятним буфером і з регулюванням рН для забезпечення прийнятної стабільності і встановлення рН, прийнятного для парентерального введення. Факультативно може додаватись один або декілька фармацевтично прийнятних протимікробних засобів. Фармацевтично прийнятними протимікробними засобами, яким віддають перевагу, є метакрезол і фенол. Одна або декілька фармацевтично прийнятних солей можуть додаватись для регулювання іонної сили або ізотонічності. Один або декілька наповнювачів можуть додаватись до додаткового регулювання ізотонічності композиції. Прикладом наповнювача для регулювання ізотонічності є гліцерин. Фармацевтично прийнятними засобами, придатними для введення людині або іншій істоті є, таким чином, засоби, що не містять токсичних елементів або небажаних забруднювачів і не перешкоджають активності активних сполук, що входять до їхнього складу. Гетерологічним гібридним білкам за цим винаходом може надаватись форма розчинної композиції або ліофілізованого порошку, що може відновлюватись за допомогою відповідного розріджувача. Ліофілізованою дозованою лікарською формою є форма, у якій гібридний білок є стійким, з/без буферної ємності для підтримки рН розчину вище передбачуваної для строку придатності при збереженні відновленого продукту. За варіантом, якому віддають перевагу, розчин, що містить обговорювані гетерологічні гібридні білки, 87458 20 перед ліофілізацією повинен бути достатньо ізотонічним для забезпечення одержання ізотонічних розчинів після відновлення. Фармацевтично прийнятна сольова форма гетерологічних гібридних білків за цим винаходом входить до обсягу цього винаходу. Кислотами, які звичайно застосовуються для одержання солей, які одержують доданням кислоти, є неорганічні кислоти, наприклад, хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, фосфорна кислота тощо, і органічні кислоти, наприклад, n-толуолсульфонова кислота, метансульфонова кислота, щавлева кислота, n-бромфенілсульфонова кислота, вугільна кислота, бурштинова кислота, лимонна кислота, бензойна кислота, оцтова кислота тощо. Солями, що одержують доданням кислоти, яким віддають перевагу, є солі, одержані за допомогою мінеральних кислот, наприклад, хлористоводневої кислоти і бромистоводневої кислоти. Солями, одержаними доданням основи, є солі, одержані шляхом додання неорганічних основ, наприклад, гідроксидів, карбонатів, бікарбонатів амонію або лужних чи лужноземельних металів тощо. Такими основами, придатними для одержання солей за цим винаходом, є, таким чином, гідроксид натрію, гідроксид калію, гідроксид амонію, карбонат калію тощо. Гетерологічні гібридні білки за цим винаходом мають біологічну активність. Біологічна активність означає здатність гібридного білка зв'язуватись з рецептором in vivo, активувати його і викликати реакцію. Реакціями є (але ними не обмежуються) секреція інсуліну, пригнічення глюкагону, пригнічення апетиту, втрата маси тіла, викликання відчуття пересичення, пригнічення апоптозу, індукування проліферації панкреатичних бета-клітин і диференціації панкреатичних бета-клітин. Репрезентативну кількість гібридних білків GLP-1 випробували на активність як in vitro, так і in vivo. Приклади 1 і 2 надають активність in vitro, виходячи зі здатності гібридного білка до взаємодії з людським рецептором GLP-1 і активації його. У обох серіях експериментів використовували клітини НЕK293 (культура клітин нирки людського ембріона), що надекспресують людський рецептор GLP-1. Активація рецептора GLP-1 у цих клітинах викликає активацію аденілатциклази, яка, у свою чергу, індукує експресію репортерного гена, що стимулюється цАМФ-реагуючим елементом (CRE). Приклад 1 (таблиця 1) надає дані, де репортерним геном є бета-лактамаза, а Приклад 2 (таблиця 2) надає дані, де репортерним геном є люцифераза. Приклад 3 надає дані, одержані після введення одного з гетерологічних гібридних білків за цим винаходом пацюкам. Наведені дані разом показують, що гібридні білки є здатними до зв'язування з рецептором GLP-1 і активації його і видаються більш активними in vitro, аніж Val8-GLP-1(7-37)OH. Окрім того, дані, одержані на пацюках, вказують на те, що гібридні білки є активними in vivo і мають довший період напіввиведення, аніж нативний GLP-1. Введення гетерологічних гібридних білків може здійснюватись будь-яким шляхом, ефектив 21 ність якого відома пересічному лікарю. Одним із таких способів є введення периферичним парентеральним шляхом. Під парентеральним введенням у медичній літературі традиційно розуміється ін'єкція лікарської форми до організму за допомогою стерильного шприца або якогось іншого медичного пристрою, наприклад, насоса для вливання. Периферичні парентеральні шляхи можуть включати внутрішньовенний, внутрішньом'язовий, підшкірний і внутрішньоочеревинний шляхи введення. Гетерологічні гібридні білки за цим винаходом можуть також бути придатними для введення пероральним, ректальним, назальним шляхами або через нижні відділи дихальних шляхів, які є непарентеральними шляхами. З цих непарентеральних шляхів перевагу віддають введенню через нижні відділи дихальних шляхів і введенню пероральним шляхом. Гібридні білки за цим винаходом можуть застосовуватись для лікування різноманітних захворювань і станів. Гібридні білки за цим винаходом проявляють свої біологічні ефекти, головним чином, шляхом дії на рецептор, який у цьому описі згадується як "рецептор GLP-1". Суб'єктів із хворобами та/або станами, що позитивно реагують на стимуляцію рецептора GLP-1 або на введення сполук GLP-1, можна, таким чином, лікувати гібридними білками GLP-1 за цим винаходом. Про цих суб'єктів кажуть, що вони "потребують лікування сполуками GLP-1" або "потребують стимуляції рецептора GLP-1". До їх числа належать суб'єкти з інсулінонезалежним діабетом, інсулінозалежним діабетом, інсультом (дивись WO 00/16797), інфарктом міокарда (дивись WO 98/08531), ожирінням (дивись WO 98/19698), змінами катаболізму після хірургічного втручання (дивись патент США №6,006,753), функціональною диспепсією і синдромом подразнення товстої кишки (дивись WO 99/64060). До їх числа належать також суб'єкти, що потребують профілактичного лікування сполукою GLP-1, наприклад, суб'єкти з ризиком розвитку інсулінонезалежного. діабету (дивись WO 00/07617). Суб'єктами з ризиком розвитку інсулінонезалежного діабету є суб'єкти з порушеною толерантністю до глюкози або порушеними рівнями глюкози крові натщесерце, суб'єкти, маса тіла яких на приблизно 25% перевищує нормальну масу тіла для росту та будови тіла цього суб'єкта, суб'єкти з частковою панкреатектомією, суб'єкти, один або обидва батьки яких страждають на інсулінонезалежний діабет, суб'єкти з діабетом вагітних і суб'єкти, що хворіли на гострий або хронічний панкреатит. Ефективною кількістю гібридних білків GLP-1Fc, опис яких наведено, є кількість, що забезпечує одержання необхідного терапевтичного та/або профілактичного ефекту без спричинення неприйнятних побічних ефектів у разі введення суб'єкту, що потребує стимуляції рецептора GLP-1. Словосполучення "необхідний терапевтичний ефект" включає один або декілька з наведених нижче пунктів: 1) поліпшення симптому(-ів), пов'язаного(-их) з хворобою або станом; 2) затримку появи симптомів, пов'язаних із хворобою або ста 87458 22 ном; 3) збільшення тривалості життя порівняно з відсутністю лікування; і 4) підвищення якості життя порівняно з відсутністю лікування. Наприклад, "ефективною кількістю" гібридного білка GLP-1-Fc для лікування діабету є кількість, що забезпечить підвищену можливість регулювання концентрації глюкози крові, аніж за відсутності лікування, наслідком чого буде затримка появи діабетичних ускладнень, наприклад, ретинопатії, невропатії або хвороби нирок. "Ефективною кількістю" гібридного білка GLP-1-Fc для запобігання діабету є така кількість, яка уповільнить, порівняно з відсутністю лікування, появу підвищених рівнів глюкози крові, що потребує лікування антигіпоглікемічними лікарськими засобами, наприклад, сульфонілсечовиною, тіазолідиндіонами, інсуліном та/або бісгуанідинами. Доза гібридного білка, ефективна для нормалізації рівня глюкози крові пацієнта, буде залежати від ряду факторів, які включають, без обмеження, стать суб'єкта, масу і вік, тяжкість нездатності регулювання глюкози крові, шлях введення і біодоступність, фармакокінетичний профіль гібридного білка, активність і склад композиції. Дози можуть бути у межах від 0,01мг/кг до 1мг/кг маси тіла, за варіантом, якому віддають перевагу, у межах від 0,05мг/кг до 0,5мг/кг маси тіла. За варіантом, якому віддають перевагу, гібридні білки за цим винаходом повинні вводитись один раз на два тижні або один раз на тиждень. У залежності від хвороби, яку лікують, може виникнути необхідність частішого введення гібридного білка, наприклад, від двох до трьох разів на тиждень. Цей винахід далі буде описуватись як необмежувальний приклад із посиланням на наведеш нижче Приклади. Приклад 1 - In vitro аналіз активації рецептора GLP-1 Клітини НЕК-293, що експресують рецептор людського GLP-1, висівають (2000040000клітин/лунку/100мкл модифікованого за способом Дульбекко середовища Ігла (DMEM) з 10% сироватки зародка великої рогатої худоби (FBS)) на сенсибілізований полі-сі-лізином 96-лунковий планшет чорного кольору з прозорим дном (із застосуванням системи CRE-BLAM). Через день після висівання середовище видаляють і додають 80мкл безплазмового DMEM. На третій день після висівання до кожної лунки додають 20мкл безплазмового DMEM з 0,5% BSA (сироватковий альбумін великої рогатої худоби), що містить різні концентрації різних гетерологічних гібридних білків GLP-1-Fc, для одержання дозозалежної кривої. Для одержання дозозалежної кривої, за допомогою якої можуть бути визначені значення ЕС50, застосовували в загальній кількості чотирнадцять розведень, що містили від 3нМ до 30нМ гетерологічного гібридного білка GLP-1-Fc. Після 5год. інкубування з гібридним білком додають 20мкл βлактамазного субстрату (CCF2/AM, PanVera LLC) і під час 1год. інкубування на цитофлуорографі визначають рівень флуоресценції. Цей аналіз додатково описано у роботі Злокарнік (Zlokarnik) та інші (1998), Science, 278: 84-88. Випробуванню підда 23 87458 24 ють різні гібридні білки GLP-1-Fc; значення ЕС50 подані у Таблиці 1. Ці значення наведені відносно значень, визначених для Val8-GLP-1(7-37)OH, що застосовується як внутрішній контроль під час кожного експерименту. Приклад 2 - In vitro аналіз активації рецептора GLP-1 Клітини НЕК-293, що стабільно експресують рецептор людського GLP-1, висівають (30000 клітин/лунку/80мкл модифікованого за способом Дульбекко середовища Ігла (DMEM) F12 із низьким вмістом сироватки) на 96-лункові планшети (із застосуванням системи CRE-люцифераза). Через день після висівання 20мкл аліквоти експериментального білка, розчинені у 0,5% BSA, змішують і інкубують із клітинами впродовж 5год. Для одержання дозозалежної кривої, за допомогою якої можуть бути визначені значення ЕС50, перед доданням до клітин одержали в загальній кількості 12 розведень (5´ концентрація), що містили від 3пМ до 3нМ кожного експериментального білка. Після інкубування безпосередньо до кожного планшета додають 100мкл люциферази з обережним перемішуванням впродовж 2 хв. Планшети вміщують до люмінометра Тrі-luх і визначають світловіддачу, що є наслідком експресії люциферази. Випробуванню піддають різні гібридні білки GLP-1Fc; значення ЕС50 подані у Таблиці 2. Ці значення наведені відносно значень, визначених для Val8GLP-1(7-37)OH, що застосовується як внутрішній контроль під час кожного експерименту. Оскільки випробувані нижче гібридні білки є димерами, значення коректують з урахуванням 2-кратної різниці молярності. Приклад 3 - Внутрішньовенна проба на толерантність до глюкози на пацюках Гібридний білок Fc, Gly8-Glu22-Gly36-GLP-1(737)-L-IgG4 (S228P, F234A, L235A), піддають внутрішньовенній пробі на толерантність до глюкози (IVGTT) на пацюках. До кожної з трьох груп входить щонайменше чотири пацюки. Група І одержує носій (таблиця 3), Група II одержує 1,79мг/кг Gly8Glu22-Gly36-GLP-1(7-37)-L-IgG4 (S228P, F234A, L235A) у вигляді разової підшкірної ін'єкції (табли ця 4) і Група IIІ одержує 0,179мг/кг Gly8-Glu22-Gly36GLP-1(7-37)-L-IgG4 (S228P, F234A, L235A) у вигляді разової підшкірної ін'єкції (таблиця 5). Пацюки одержують підшкірну ін'єкцію вранці у День 1. Через 24год. після першої ін'єкції ударною дозою вливають 1мкл глюкози (D50) на грам маси тіла пацюка. Проби крові відбирають через 2хв., 4хв., 6хв., 10хв., 20хв. і 30хв. після вливання ударної дози глюкози. 25 87458 26 Таблиця 3 Носій 0-2 2-4 4-6 6-10 10-20 20-30 Сума Пацюк 1 Пацюк 2 11 18,1 13,4 7,9 3,7 2 56,1 9,4 9,7 7 3,5 3 0 32,6 Інсулін, AUC (площа під кривою) (нг×хв./мл) Середнє Пацюк 3 Пацюк 4 Пацюк 5 значення 7 11 9,6 5,6 10,6 8,8 3,4 9,6 5,9 2,5 6 2,9 2,4 3 2,4 0 0 2,4 20,9 40 ,\ 32 36,4 SEM (середня квадратична помилка середнього) 5,8 Таблиця 4 GLP-1-Fc (1,79мг/кг) Пацюк 1 Пацюк 2 0-2 2-4 4-6 6-10 10-20 20-30 Сума 12,3 21,9 16,8 7,6 3 0 61,6 17,4 13,3 6,5 3,8 0 0 41 Інсулін, AUC (площа під кривою) (нг×хв./мл) Середнє Пацюк 3 Пацюк 4 Пацюк 5 значення 16 14 13 13,2 13,9 13,6 9,8 11,1 11,7 9,2 5,8 7,4 0 3,2 5,6 0 0 0 48,2 48 51,3 50 SEM (середня квадратична помилка середнього) 3,4 Таблиця 5 Інсулін, AUC (площа під кривою) (нг×хв./мл) GLP-1-Fc (0,179мг/кг) Пацюк 1 Пацюк 2 Пацюк 3 Пацюк 4 Середнє значення SEM (середня квадратична помилка середнього) 0-2 2-4 4-6 6-19 10-20 20-30 Сума 14,4 13,8 11,2 6,4 3,6 0 49,4 29,2 26,3 19,' 10,6 5,8 0 91,3 25,4 21,2 16,4 10,5 5,2 0 78,7 23,2 21,8 15,7 8 5 0 73,7 78,7 8,7 Приклад 4 Фармакокінетичне дослідження після одноразової підшкірної ін'єкції макакамкрабоїдам Дослідження здійснюють для визначення фармакокінетичних (РК) параметрів гібридного білка Fc, Gly8-Glu22-Gly36-GLΡ-1(7-37)-L-lgG4 (S228P, F234A, L235A) після введення макакам-крабоїдам (самцям) шляхом підшкірної (SC) ін'єкції у дозі 0,1мг/кг. Антитіло, що застосовується при радіоімуноаналізі (RIA), є специфічним для середньої частини GLP. При проведенні твердофазного імуноферментного аналізу (ELISA) застосовують специфічне для N-кінця іммобілізоване антитіло і специфічне для Fc-фрагмента ідентифікуюче антитіло. Концентрації у плазмі, визначені за допомогою ELISA і RIA, застосовують для визначення наведених значень фармакокінетичних параметрів. Значення одержаних РК параметрів в узагальненому вигляді наведені у таблиці 6. Фармакокінетичні параметри при одноразовій підшкірній ін'єкції (RIA): середня Сmах=446,7нг/мл з відповідним Тmах=17,3год. Середнє значення періоду напіввиведення становить приблизно 79,3год. (3,3 дня). Фармакокінетичні параметри за даними ELISA: середня Сmах=292,2нг/мл із відповідним Тmах=16,7год. Середнє значення періоду напіввиведення становить приблизно 51,6год. (2,2 дня). Таблиця 6 Доза (мг/кг) Тварина № 0,1 96051 96071 96091 Середнє значення SD (середнє квадратичне відхилення) RIA a Сmах (нг/мл) 461,0 430,0 449,0 446,7 15,6 RIA b Tmах (год.) c d e f 4,0 24,0 24,0 17,3 AUC0-µ (нг*год./мл) 37770,5 43150,2 62271,1 47730,6 t1/2 (год.) 81,0 74,2 82,9 79,3 CL/F (мл/год./кг) 2,7 2,3 1,6 2,2 Vss/F (мл/кг) 309,2 248,1 191,9 249,8 11,5 12876,5 4,5 0,5 58,7 27 87458 28 Продовження таблиці 6 ELISA 96051 96071 96091 Mean SD ELISA 2,0 24,0 24,0 16,7 12,7 315,4 289,4 271,9 292,2 21,9 9062,3 16653,0 19907,4 15207,6 5565,2 55,2 50,3 49,3 51,6 3,2 11,0 6,0 5,0 7,3 3,2 879,4 436,0 357,0 557,5 281,6 а Максимальна концентрація, зареєстрована у плазмі. Час максимальної концентрації, зареєстрованої у плазмі. Крива концентрація-час (площа під кривою з визначенням від 0 до нескінченності). d Період напіввиведення. е Повне виведення з організму як функція біодоступності. f Об'єм розподілу як функція біодоступності. SD=Cepejojie квадратичне відхилення. b с Приклад 5 Визначення потенційного утворення антитіл після повторних підшкірних ін’єкцій Визначені проби сироватки макак-крабоїдів перевіряють на утворення антитіл проти Gly8Glu22-Gly36-GLP-1(7-37)-L-IgG4 (S228P, F234A, L235A) у форматі прямого твердофазного імуноферментного аналізу (ELISA). Титраційні мікропланшети сенсибілізують Gly8-Glu22-Gly36-GLP-1(737)-L-IgG4 (S228P, F234A, L235A) з концентрацією 0,1мкг/мл. Проби сироватки мавп розбавляють блокувальним розчином у 50, 500, 1000 і 5000 разів і 0,05мл проби/лунку інкубують впродовж приблизно однієї години. Вторинне антитіло, козяче
ДивитисяДодаткова інформація
Назва патенту англійськоюHybrid proteins - glp-1 analogs
Автори англійськоюGlaesner Wolfgang, Millican Rohn L, Vick Andrew Mark
Назва патенту російськоюГибридные белки-аналоги glp-1
Автори російськоюГлезнер Вольфганг, Милликан Рон Ли, млад., Вик Эндрю Марк
МПК / Мітки
МПК: A61P 3/04, C07K 14/605, A61P 3/10, C07K 14/50, A61K 38/26
Мітки: білки-аналоги, гібридні, glp-1
Код посилання
<a href="https://ua.patents.su/28-87458-gibridni-bilki-analogi-glp-1.html" target="_blank" rel="follow" title="База патентів України">Гібридні білки-аналоги glp-1</a>
Попередній патент: Спосіб оправлення каменя у металевій деталі та інструмент для оправлення каменя
Наступний патент: Спосіб синтезу стирилових похідних четвертинних солей циклопента[с]хінолінію з високим рівнем протистафілококової і антикандидозної активності
Випадковий патент: Комбінація для профілактики та лікування сніду, фармацевтична композиція на її основі, спосіб отримання фармацевтичної композиції