Аналоги камптотецину, способи їх одержання, проміжні сполуки та фармацевтична композиція, що містить зазначені аналоги камптотецину
Номер патенту: 63891
Опубліковано: 16.02.2004
Автори: БІГГ Денніс, Пла Родас Франциск, Пом'єр Жак, УЛІБАРРІ Жерар, ЛАВЕРНЬ Олів'є
Формула / Реферат
1. Аналоги камптотецину формул (І) і (II)
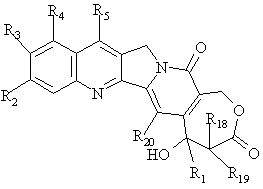 (I),
(I),
 (ІІ)
(ІІ)
у рацемічній формі, енантіомерній або будь-якій комбінації зазначених форм, де
R1 являє собою нижчий алкіл, нижчий алкеніл, нижчий алкініл, нижчий галоалкіл і нижчий алкіл нижчого алкокси або нижчий алкіл нижчого алкілтіо;
R2, R3, R4 являють собою незалежно один від одного Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкеніл, ціано, нижчий ціаноалкіл, нітро, нижчий нітроалкіл, амідо, нижчий амідоалкіл, гідразино, нижчий гідразиноалкіл, азидо, нижчий азидоалкіл, (CH2)mNR6R7, (СН2)mОR6, (СН2)mSR6, (СН2)mСO2R6, (СН2)mNR6C(O)R8, (СН2)mС(O)R8, (СН2)mOC(O)R8, O(СН2)mNR6R7, OC(O)NR6R7, ОС(O)(СН2)mСO2R6 або (CH2)n[N=X], OC(O)[N=X], (СН2)mOC(O)[N=X], арил або нижчий арилалкіл, заміщений або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкіл нижчого алкокси, або R2 і R3 разом формують ланцюг, що містить від 3 до 4 зв'язків, де елементи ланцюга вибирають серед групи, що містить СН, СН2, О, S, N або NR9;
R5 являє собою Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий алкіл нижчого алкілтіо, циклоалкіл, ціаноалкіл нижчого циклоалкілу, ціаноалкіл, нижчий сульфонілалкіл нижчого алкілу, нижчий гідроксіалкіл, нітро, (СН2)mС(O)R8, (СН2)mNR6C(O)R8, (СН2)mNR6R7, (СН2)mN(CH3)(СН2)nNR6R7, (СН2)mOC(O)R8, (СН2)mOC(O)NR6R7, (СН2)mS(O)qR11, (СН2)mP(O)R12R13, (CH2)2P(S)R12R13 або (CH2)n[N=X], OC(O)[N=X], (СН2)mOC(O)[N=X], арил або нижчий арилалкіл, заміщений або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкіл нижчого алкокси;
R6 та R7 являють собою незалежно один від одного Н, нижчий алкіл, нижчий гідроксіалкіл, нижчий алкіл нижчого аміноалкілу, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси, нижчий галоалкіл, або арил або нижчий арилалкіл, заміщений або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкіл нижчого алкокси;
R8 являє собою Н, нижчий алкіл, нижчий гідроксіалкіл, аміно, нижчий алкіламіно, нижчий алкіл нижчого алкіламіну, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий галоалкіл, або арил або нижчий арилалкіл, заміщений або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкіл нижчого алкокси;
R9 являє собою Н, нижчий алкіл, нижчий галоалкіл, арил, або заміщений арил однією або більше групами, що вибрані серед нижчого алкілрадикалу, гало, нітроаміно, нижчого алкіламіно, нижчого галоалкілу, нижчого гідроксіалкілу, нижчого алкокси або нижчого алкілу нижчого алкокси;
R10 являє собою Н, нижчий алкіл, нижчий галоалкіл, нижчий алкокси, арил або арил, заміщений однією або більше групами, що вибрані серед нижчого алкіл-радикалу, нижчого галоалкілу, нижчого гідроксіалкілу, або нижчого алкілу нижчого алкокси;
R11 являє собою нижчий алкіл, арил, (СН2)mОR14, (СН2)mSR14, (CH2)2NR14R15 або (СН2)m[N=X];
R12 та R13 незалежно один від одного являють собою нижчий алкіл, арил, нижчий алкокси, арилокси або аміно;
R14 та R15 незалежно один від одного являють собою Н, нижчий алкіл або арил;
R16 являє собою Н або OR21;
R17 являє собою OR16 або NR6R7;
R18 та R19 являють собою незалежно один від одного Н, гало, нижчий алкіл, нижчий алкокси або гідрокси;
R20 являє собою Н або гало;
R21 являє собою Н, нижчий алкіл, CНО або С(O)(СН2)mСН3;
m являє собою ціле число від 0 до 6;
n дорівнює 1 або 2; і
q дорівнює цілому числу від 0 до 2; і [N=X] являє собою гетероциклічну групу, що має від 4 до 7 зв'язків, причому Х являє собою необхідний ланцюг для завершення зазначеної гетероциклічної групи та є вибраним із групи, що містить О, S, СН2, СН, N, NR9, COR9; або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, яка відрізняється тим, що
R1 являє собою нижчий алкіл, нижчий алкеніл, нижчий галоалкіл, нижчий алкіл нижчого алкокси або нижчий алкіл нижчого алкілтіо;
R5 являє собою Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий алкіл нижчого алкілтіо, циклоалкіл, алкіл нижчого циклоалкілу, ціано, ціаноалкіл, нижчий гідроксіалкіл, нітро, (СН2)mC(O)R8, (СН2)mNR6C(O)R8, (СН2)mNR6R7, (СН2)mN(CH3)(CH2)nNR6R7, (СН2)mOC(O)R8, (СН2)mOC(O)NR6R7 або (СН2)n[N=X], або OC(O)[N=X], (СН2)mOC(O)[N=X], арил або арил нижчий алкіл, заміщений або незаміщений;
R12 та R13 незалежно один від одного являють собою нижчий алкіл;
R16 являє собою OR21;
R18, R19, R20 являють собою Н, або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, яка відрізняється тим, що
R1 являє собою нижчий алкіл, нижчий алкеніл, нижчий галоалкіл або нижчий алкіл нижчого алкокси;
R2, R3 та R4 незалежно один від одного являють собою Н, гало, нижчий галоалкіл, нижчий алкіл, нітро, амідо, нижчий амідоалкіл, гідразино, нижчий гідразиноалкіл, азидо, нижчий азидоалкіл, (СН2)mNR6R7, (СН2)mОR6, (СН2)mSR6, (СН2)mC(O)R8, OC(O)NR6R7, (CH2)n[N=X] або (CH2)mOC(O)[N=X], заміщений або незаміщений, або OC(O)[N=X], або R2 і R3 разом формують ланцюг із 3 або 4 зв'язків, у яких зазначені елементи ланцюга вибирають із групи, яка містить СН, СН2, О, S, N або NR9;
R5 являє собою Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий алкіл нижчого алкілтіо, нижчийгідроксіалкіл, нітро, (СН2)2mC(O)R8, (СН2)mNR6C(O)R8, (СН2)mNR6R7, (СН2)mN(СН3)(СН2)nNR6R7, (СН2)mOC(O)R8, (СН2)mOC(O)NR6R7 або (CH2)n[N=X], або OC(O)[N=X], заміщений або незаміщений, або (СН2)mOC(O)[N=X];
R6 та R7 являють собою незалежно один від одного Н, нижчий алкіл, нижчий гідроксіалкіл, нижчий аміноалкіл нижчого алкілу, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкіл нижчого алкокси, арил, нижчий арилалкіл або нижчий галоалкіл;
R8 являє собою Н, нижчий алкіл, нижчий гідроксіалкіл, нижчий алкіламіно, нижчий аміноалкіл нижчого алкілу, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий галоалкіл, арил або нижчий арилалкіл;
R9 являє собою Н, нижчий алкіл, або нижчий галоалкіл;
R10 являє собою Н, нижчий алкіл, нижчий галоалкіл або нижчий алкокси;
R11 являє собою нижчий алкіл; і
R14 та R15 являють собою незалежно один від одного Н або нижчий алкіл;
або її фармацевтично прийнятна сіль.
4. Сполука за п. 3, яка відрізняється тим, що R1 являє собою етилову групу, або її фармацевтично прийнятна сіль.
5. Сполука за п. 4, яка відрізняється тим, що вона має формулу (І) або являє собою її фармацевтично прийнятну сіль.
6. Сполука за п. 4, яка відрізняється тим, що вона має формулу (II) або являє собою її фармацевтично прийнятну сіль.
7. Сполука за п. 5, яка відрізняється тим, що
R2 та R3 незалежно один від одного являють собою Н, нижчий алкіл, гало, нижчий галоалкіл або (СН2)mOR6, або R2 і R3 разом формують метилендіокси або етилендіокси; і
R4 та R5 незалежно один від одного являють собою Н, нижчий алкіл, (СН2)mNR6R7 або (СН2)n[N=X], заміщений або незаміщений нижчим алкілом; або її фармацевтично прийнятна сіль.
8. Сполука за п. 7, яка відрізняється тим, що R4 являє собою Н або (СН2)mNR6R7, де R6 R7 незалежно один від одного являють собою Н або нижчий алкіл, a R5 являє собою Н, нижчий алкіл або (CH2)n[N=X], заміщений або незаміщений; і [N=X] являє собою піперазинілову або морфолінілову групу, а зазначений замісник являє собою нижчий алкіл; або її фармацевтично прийнятна сіль.
9. Сполука за п. 8, яка відрізняється тим, що R2 являє собою Н або гало, а R3 являє собою Н, нижчий алкіл, гало або OR6, де R6 являє собою Н, нижчий алкіл або нижчий арилалкіл; або її фармацевтично прийнятна сіль.
10. Сполука за п. 9, яка відрізняється тим, що R2 являє собою Н, фтор або хлор; а R3 являє собою Н, хлор, фтор, метил або метокси; або її фармацевтично прийнятна сіль.
11. Сполука за п. 8, яка відрізняється тим, що R2 і R6 разом формують метилендіокси або етилендіокси; або її фармацевтично прийнятна сіль.
12. Сполука за п. 5, яка відрізняється тим, що зазначену сполуку вибирають зі сполук, що відповідають наступним формулам:
5-етил-4,5-дигідро-5-гідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5,12-діетил-4,5-дигідро-5-гідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
8-етил-2,3,8,9-тетрагідро-8-гідрокси-10Н,12Н-[1,4]діоксино[2,3-g]оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-10,13(15Н)діон,
10-бензилоксі-5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-4,5-дигідро-5,10-дигідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
11-(диметиламіно)метил-5-етил-4,5-дигідро-5,10-дигідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-9-фтор-4,5-дигідро-5-гідрокси-10-метоксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
9-хлор-5-етил-4,5-дигідро-5-гідрокси-10-метил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-9,10-дифтор-4,5-дигідро-5-гідроксі-1Н-оксепіно13',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
7-етил-7,8-дигідро-7-гідрокси-9Н,11Н-[1,3]діоксоло[4,5-g]оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-9,12(14Н)діон,
9-хлор-5-етил-4,5-дигідро-5-гідрокси-10-метоксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-4,5-дигідро-5-гідрокси-10-метоксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
9,11-дихлор-5-етил-4,5-дигідро-5-гідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-9-фтор-4,5-дигідро-5-гідрокси-10-метил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-10-фтор-4,5-дигідро-5-гідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
10-хлор-5-етил-4,5-дигідро-5-гідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
10-хлор-5-етил-9-фтор-4,5-дигідро-5-гідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5,12-діетил-4,5-дигідро-5,10-дигідрокси-11-морфолінометил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5,12-діетил-9-фтор-4,5-дигідро-5-гідрокси-10-метоксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-4,5-дигідро-5-гідрокси-12-метил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
9-хлор-5-етил-4,5-дигідро-5-гідрокси-10-метокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
9-хлор-5-етил-4,5-дигідро-5-гідрокси-10-метокси-12-морфолінометил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-4,5-дигідро-5-гідрокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-4,5-дигідро-5-гідрокси-12-піперидинометил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-4,5-дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-10-фтор-4,5-дигідро-5-гідрокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-10-фтор-4,5-дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-9-фтор-4,5-дигідро-5-гідрокси-10-метил-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-9-фтор-4,5-дигідро-5-гідрокси-10-метил-12-морфолінометил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
5-етил-9-фтор-4,5-дигідро-5-гідрокси-10-метил-12-піперидинометил)-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон,
8-етил-2,3,8,9-тетрагідро-8-гідрокси-16-(4-метилпіперазинометил)-10Н,12Н-(1,4)діоксино(2,3-g)оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-10,13(15Н)діон,
9-хлор-5-етил-10-фтор-4,5-дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон;
або її фармацевтично прийнятна сіль.
13. Сполука за п. 12, яка відрізняється тим, що вона має наступну формулу: 5-етил-9,10-дифтор-4,5-дигідро-5-гідроксі-1Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15(4Н,13Н)діон; або її фармацевтично прийнятна сіль.
14. Сполука за п. 6, яка відрізняється тим, що R2 і R3 являють собою незалежно один від одного Н, нижчий алкіл, гало, нижчий галоалкіл, або (СН2)mОR6, або R2 і R3 разом формують метилендіокси або етилендіокси; R4 і R5 являють собою незалежно один від одного Н, і нижчий алкіл, (СН2)mNR6R7, або (CH2)n[N=X], незаміщений або заміщений нижчим алкілом; R20 являє собою Н, a R17 являє собою OR6, де R6 являє собою Н або нижчий алкіл, або NR6R7, де R6 і R7 незалежно один від одного являють собою Н, нижчий алкіл, арил, або нижчий арилалкіл; або її фармацевтично прийнятна сіль.
15. Сполука за п. 12, яка відрізняється тим, що R4 являє собою Н або (СН2)mNR6R7, де R6 і R7 являють собою незалежно один від одного Н або нижчий алкіл; R5 являє собою Н, нижчий алкіл, або (СН2)n[N=Х], незаміщений або заміщений нижчим алкілом, a [N=X] є піперазинілом або морфолінілом і R17 являє собою OR6, де R6 являє собою Н або нижчий алкіл; або її фармацевтично прийнятна сіль.
16. Сполука за п. 14, яка відрізняється тим, що R2 являє собою Н або гало; R3 являє собою Н, нижчий алкіл, гало або OR6, де R6 являє собою Н, нижчий алкіл або нижчий арилалкіл ; або її фармацевтично прийнятна сіль.
17. Сполука за п. 16, яка відрізняється тим, що R2 являє собою Н, хлор або фтор; R3 являє собою Н, фтор, хлор, метил або метокси; або її фармацевтично прийнятна сіль.
18. Сполука за п. 15, яка відрізняється тим, що R2 і R3 разом формують діоксиметилен або діоксіетилен; або її фармацевтично прийнятна сіль.
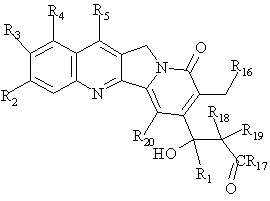
19. Сполука за п. 6, яка відрізняється тим, що зазначену сполуку вибирають зі сполук, що відповідають наступним формулам:
трет-бутил ![]() -етил-
-етил-![]() -гідрокси-
-гідрокси-![]() -(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-iл)пропіонат,
-(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-iл)пропіонат,
етил ![]() -етил-
-етил-![]() -гідрокси-
-гідрокси-![]() -(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-іл)пропіонат,
-(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-іл)пропіонат,
![]() -етил-
-етил-![]() -гідрокси-
-гідрокси-![]() -(8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7-іл)пропіонова кислота,
-(8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7-іл)пропіонова кислота,
метил ![]() -етил-
-етил-![]() -гідрокси-
-гідрокси-![]() -(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-іл)пропіонат,
-(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-іл)пропіонат,
етил ![]() -етил-
-етил-![]() -дифтор-
-дифтор-![]() -гідрокси-
-гідрокси-![]() -(8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7iл)пропіонат,
-(8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7iл)пропіонат,
етил ![]() -етил-
-етил-![]() -гідрокси-
-гідрокси-![]() -(8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7-іл)пропіонат,
-(8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7-іл)пропіонат,
трет-бутил-![]() -етил-
-етил-![]() -гідрокси-
-гідрокси-![]() -(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-iл)пропіонат,
-(8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-iл)пропіонат,
![]() -етил-
-етил-![]() -(12-етил-8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7-іл)-
-(12-етил-8-гідроксиметил-9-оксо(11Н)iндолізино[1,2-b]хінолін-7-іл)-![]() -гідроксипропіонова кислота,
-гідроксипропіонова кислота,
![]() -(12-бензилокси-8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-іл)-
-(12-бензилокси-8-гідроксиметил-9-оксо(11Н)індолізино[1,2-b]хінолін-7-іл)-![]() -етил-
-етил-![]() -гідроксипропіонова кислота (Е);
-гідроксипропіонова кислота (Е);
або її фармацевтично прийнятна сіль.
20. Спосіб одержання сполук формул (І) і (II) за будь-яким з пп. 1-19, в якому ![]() -гідроксилактон камптотецину загальної формули
-гідроксилактон камптотецину загальної формули
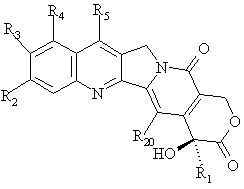 ,
,
де R1, R2, R3, R4, R5 і R20 мають вищенаведені значення,
відновлюють для одержання ![]() -гідроксилактолу загальної формули А
-гідроксилактолу загальної формули А
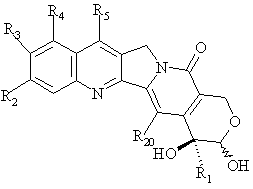 , A
, A
де R1, R2, R3, R4, R5 та R20 мають вищенаведені значення;
вуглець-вуглецевий зв'язок, що зв'язує сусідній карбінол сполуки А, яка утворена таким чином, розривають за допомогою окислювача з одержанням сполуки формули В
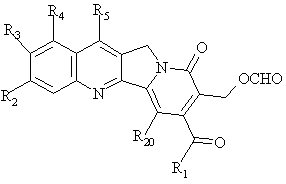 , B
, B
де R1, R2, R3, R4, R5 та R20 мають вищенаведені значення;
далі її обробляють за допомогою функціонального алкілуючого агента та розривають формільну функціональну групу сполуки формули В з одержанням ![]() -гідроксіефіру загальної формули С
-гідроксіефіру загальної формули С
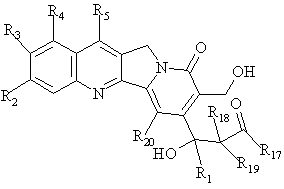 , C
, C
де R1, R2, R3, R4, R5, R18, R19 та R20 мають вищенаведені значення, R17 являє собою
OR6, де R6 являє собою нижчий алкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси або арил, або нижчий арилалкіл;
циклізують зазначену сполуку загальної формули С, з одержанням ![]() -гідроксилактонічної сполуки загальної формули D
-гідроксилактонічної сполуки загальної формули D
 , D
, D
де R1, R2, R3, R4, R5, R18, R19 та R20 мають вищенаведені значення,
розмикають лактон загальної формули D, з одержанням сполуки формули Е
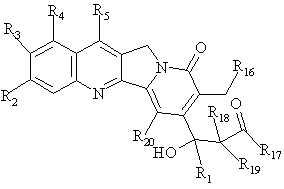 , E
, E
де R1, R2, R3, R4, R5, R18, R19 та R20 мають вищенаведені значення; R16 являє собою OR21, де R21 являє собою Н або нижчий алкіл; R17 являє собою OR6 або NHR6 і R6 являє собою Н, нижчий алкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси або арил, або нижчий арилалкіл.
21. Спосіб одержання сполук формул (І) і (II) за будь-яким з пп. 1-19, в якому проводять взаємодію сполуки загальної формули М
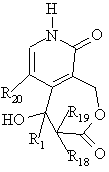 , M
, M
де R1, R18 та R19 мають вищенаведені значення, a R20 являє собою атом водню або галогену
з 2-гало-3-хінолінметанолом загальної формули N
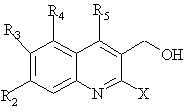 , N
, N
де R2, R3, R4, R5 мають вищенаведені значення, а Х являє собою атом галогену, з одержанням сполуки формули О
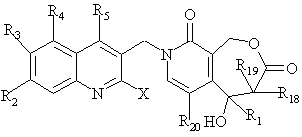 , О
, О
де R1, R2, R3, R4, R5, R18, R19, R20 та X мають вищенаведені значення;
потім циклізують сполуку загальної формули О з одержанням сполуки формули D, як це наведено вище.
22. Проміжні сполуки формули І,
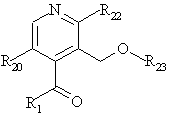 , І
, І
де
R1 являє собою нижчий алкіл, нижчий алкеніл, нижчий алкініл, нижчий галоалкіл, нижчий алкіл нижчого алкокси, або нижчий алкіл нижчого алкілтіо; R20 являє собою Н або гало, R22 являє собою Н, F, Сl або нижчий алкокси; і R23 являє собою первинну гідрокси захисну групу.
23. Проміжні сполуки формули М
 , M
, M
де R1 являє собою нижчий алкіл, нижчий алкеніл, нижчий алкініл, нижчий галоалкіл, нижчий алкіл нижчого алкокси, або нижчий алкіл нижчого алкілтіо;
R18 та R19 незалежно один від одного являють собою Н, гало, нижчий алкіл, нижчий алкокси або гідрокси; і R20 являє собою Н або гало.
24. Сполука за п. 23, яка відрізняється тим, що R1 являє собою етил, a R18, R19 та R20 являють собою Н.
25. Сполуки формул (І) і (II), що діють як медикаменти, як вони визначені у пп. 1-19, а також їх адитивні солі разом з фармацевтично прийнятними мінеральними та органічними кислотами зазначених сполук формул (І) і (II).
26. Фармацевтична композиція, що містить як активний інгредієнт принаймні одну зі сполук формул (І) і (II) за пп. 1-19.
27. Сполуки формул (І) і (II) за п. 25, які призначені для інгібування топоізомерази.
28. Сполуки формул (І) і (II) за п. 25, які діють як протипухлинні медикаменти.
29. Сполуки формул (І) і (II) за п. 25, які діють як противірусні медикаменти.
30. Сполуки формул (І) і (II) за п. 25, які діють як протипаразитарні медикаменти.
Текст
Камптотецин становить собою природну сполуку, що вперше була виділена з листя та кори китайської рослини, яка має назву camptotheca acuminata [див. Wall et al. J. Amer. Chem. Soc. 88: 3888(1966)]. Камптотецин становить собою пентациклічну сполуку, що містить фрагмент індолізіно[1,2-b]хіноліну, сплавлений, з шестиланцюговим α-гідроксилактоном. Вуглець на позиції 20, який несе α-гідрокси, є асиметричним та надає молекулі обертальну енергію. Природна форма камптотецину має чисту "S" конфігурацію відносно вуглецю на позиції 20 і підкоряється отакій формулі: Камптотецин надає антипроліферувальну активність декільком канцерогенним клітинним лініям, до яких належать клітинні лінії пухлин товстої кишки, легені і грудей людини [Suffness, М. et al; the Alkaloids Chemistry and Pharmacology, Brass, A., ed., Vol. 25, p. 73(Academic Press, 1985)]. Припускають, що антипроліферувальна активність камптотецину зв'язана з її інгобуючою активністю топоізомерази І ДНК. Було показано, що а-гідроксилактон є абсолютно необхідним як для активності камптотецину in vivo, так і in vitro [Camptothecins: New Anticancer Agents, Putmesil, M. et al., ed., p. 27(CRC Press. 1995); Wall, M. et al., Cancer Res. 55: 753(1995); Hertzberg et al, J. Med. Chem. 32: 715(1982) і Crow et al. J. Med. Chem. 35: 160(1992)]. Цей винахід стосується нового класу сполук камптотецину, у яких β-гідроксилактон заміщує природний α-гідроксилактон камптотецину. Сполуки згідно з цим винаходом виявляють значну біологічну активність, яка є несподіваною для відомого рівня техніки. Таким чином, винахід має своєю метою створення нових сполук камптотецину, які відрізняються від відомих сполук камптотецину тим, що вони містять β-гідроксилактон(або його відкриту гідроксикарбоксильну форму) замість α-гідроксилактону(або його відкритої гідроксикарбоксильної форми); або фармацевтично придатну сіль останнього. Під сполукою камптотецину розуміють сполуку, що має такий самий структурний скелет, що і камптотецин(тобто фрагмент індолізіно[1,2-b] хіноліну, який є сплавленим з шестиланцюговим гідроксилактоном), з або без інших хімічних заміщень на скелетній структурі(наприклад, на сполуках камптотецину). Як показано нижче, спеціалістам у цій галузі добре відомі різні сполуки камптотецину. Під β-гідроксилактоном розуміють лактон, який містить додатковий атом вуглецю між вуглецем карбоксилу та α-вуглецем, що має гідрокси - групу на α-гідроксилактону. Семиланцюговий β-гідроксилактон з "закритими" або "відкритими" ланцюгами, у якому ефірний зв'язок між карбоніловою групою та сусіднім атомом кисню є гідролізованим, що показує через створення карбоновокислотної групи та гідроксильної групи, які групи можуть або не можуть бути заміщені. Сполука камптотецину згідно з цим винаходом може, крім того, мати заміщення на фрагменті індолізіно[1,2-5] хіноліну(наприклад, для поліпшення розчинності сполуки) або на відкритому або закритому β-гідроксилактону(наприклад, для поліпшення стабільності сполуки). Прикладами заміщення на закритому β-гідроксилактоні є заміщення алкілу(наприклад, етилом) на β-вуглець. Прикладами заміщення на відкритому β-гідроксилактоні є заміщення алкілу на β-вуглець, заміщення(наприклад, амідування) на результаті карбонової кислоти, і заміщення(наприклад, етерифікація) або приглушення результату гідроксильної групи. Зокрема, об'єктом цього винаходу є сполуки формули(І) та формули(II) у рацемічній формі, енантіоморфній або будь-якій комбінації зазначених форм, де R1 становить собою нижчий алкіл, нижчий алкеніл, нижчий алкініл, нижчий галоалкіл і нижчий алкіл нижчого алкокси або нижчий алкіл нижчого алкілтіо; R2 R3 R4 становлять собою незалежно один від одного Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкеніл, ціано, нижчий ціаноалкіл, нітро, нижчий нітроалкіл, амідо, нижчий амідоалкіл, гідразино, нижчий гідразиноалкіл, азидо, нижчий азидоалкіл,(CH2)mNR6R7(CH2)mOR6,(CH2)mSR6(CH2)mCO2R6(CH2)mNR6C(O)R8,(CH2)mC(O)R8,(CH2)mOC(O)R8) O(CH2)mNR6R7, OC(O)NR6R7 OC(O)(CH2)mCO2R6 або(CH2)n[N=X], OC(O)[N=X],(CH2)mOC(O)[N=X](де у цьому винаходу [N=X] становить собою гетероциклічну групу, що містить 4 - 7 ланцюгів з атомом азоту N, який є елементом гетероциклічної групи, а X становить собою одержані у результаті елементи, які потрібні для завершення гетероциклічної групи, вибраної із групи, що містить О, S, СН2, СН, N, NR9 і COR10), арил або нижчий арилалкіл, заміщений(тобто заміщений від 1 до 4 разів на гетероциклічній або ариловій групі) або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксиалкіл, нижчий алкокси або нижчий алкіл нижчого алкокси) або R2 і R3 разом формують ланцюг, що містить від 3 до 4 зв'язків, де елементи ланцюга вибирають серед групи, що містить СН, СН2,О, S, N або NR9; R5 становить собою Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий алкіл нижчого алкілтіо, циклоалкіл, алкіл нижчого циклоалкілу, ціано, ціаноалкіл, нижчий сульфонілалкіл нижчого алкілу, нижчий гідроксиалкіл, нітро,(CH2)mC(O)R8,(CH2)mNR6C(O)R8)(CH2)mNR6R7.(CH2)mN(CH3)(CH2)n NR6R7)(CH2)mOC(O)R8)(CH2)mOC(O)N R6R7)(CH2)mS(O)qR11(CH2)mP(O)R12R13.(CH2)2P(S)R12R13 або(CH2)n[N=X], OC(O)[N=X],(CH2)mOC(O)[N=X], арил або заміщений нижчий арилалкіл(тобто заміщення здійснюється від одного до чотирьох разів на ариловій групі або гетероарилу), або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксиалкіл, нижчий алкокси або нижчий алкіл нижчого алкокси; R6 і R7 становлять собою незалежно один від одного Н, і нижчий алкіл, нижчий гідроксиалкіл, нижчий аміноалкіл нижчого алкілу, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси, нижчий галоалкіл, або арил або заміщений нижчий арилалкіл(тобто заміщений від одного до чотирьох разів на ариловій групі), або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксиалкіл, нижчий алкокси або нижчий алкіл нижчого алкокси; R8 становить собою Н, і нижчий алкіл, нижчий гідроксиалкіл, аміно, нижчий алкіламіно, нижчий аміноалкіл нижчого алкілу, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий галоалкіл, або арил або заміщений нижчий арилалкіл(тобто заміщений від одного до чотирьох разів на арильній групі), або незаміщений, у якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксиалкіл, нижчий алкокси, або нижчий алкіл нижчого алкокси; R9 становить собою Н, нижчий алкіл, нижчий галоалкіл, арил, або заміщений арил однією або більше групами, вибраними серед нижчого алкіл-радикалу, гало, нітроаміну, нижчого алкіламіну, нижчого галоалкілу, нижчого гідроксиалкілу, нижчого алкокси, або нижчого алкілу нижчого алкокси; R10 становить собою Н, нижчий алкіл, нижчий галоалкіл, нижчий алкокси, арил або заміщений арил(тобто забезпечуючи від одного до чотирьох замісників на ариловій групі) однією або більше групами, вибраними із нижчого алкіл-радикалу, нижчого галоалкілу, нижчого гідроксиалкілу, або нижчого алкілу нижчого алкокси; R11 становить собою нижчий алкіл, арил,(CH2 )mOR14,(CH2)mSR14,(CH2)2NR14R15 або(CH2)m[N=X]; R12 і R13 незалежно один від одного становлять собою нижчий алкіл, арил, нижчий алкокси, арилокси або аміно; R14 і R15 незалежно один від одного становлять собою Н, і нижчий алкіл або арил; R16 становить собою Н або OR21; R17 становить собою OR6 або NR6R7; R18 і R19 становлять собою незалежно один від одного Н, гало, нижчий алкіл, нижчий алкокси або гідрокси; R20 становить собою Н або гало; R21 становить собою Н, нижчий алкіл, СНО або С(О)(СН2)mСН3; m становить собою ціле число, що має значення, яке знаходиться між 0 і 6; n дорівнює 1 або 2; та q дорівнює цілому числу від 0 до 2; і [N=X] становить собою гетероциклічну групу, що має від 4 до 7 зв'язків, причому X становить собою необхідний ланцюг для завершення зазначеної гетероциклічної групи та вибраний із групи, що містить О, S, СН2, СН, N, NR9 COR9; або фармацевтично придатну сіль останньої. Зокрема, об'єктом цього винаходу є сполуки формул(І) і(II), що визначені вище, у яких R1 становить собою нижчий алкіл, нижчий алкеніл, нижчий галоалкіл, нижчий алкіл нижчого апкокси або нижчий алкіл нижчого алкілтіо; R5 становить собою Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий алкіл нижчого алкілтіо, циклоалкіл, алкіл нижчого циклоалкілу, ціано, ціаноалкіл, нижчий гідроксиалкіл, нітро,(CH2)mC(O)R8,(CH2)mNR6C(O)R8,(CH2)mNR6R7,(CH2)mN(CH3)(CH2)nNR6R7,(CH2)mOC(O)R8,(CH2)mOC(O)N R6R7, або(CH2)n[N=X], OC(O)[N=X],(CH2)mOC[N=X], арил або нижчий заміщений або незаміщений арилалкіл; R12 і R13-незалежно один від одного становлять собою нижчий алкіл; R16 становить собою OR21; a R18, R19 і R20 становлять собою Н. Зокрема об'єктом цього винаходу є сполуки формул(І) і(II), що визначені вище, де R1 становить собою нижчий алкіл, нижчий алкеніл, нижчий галоалкіл або нижчий алкіл нижчого алкокси; R2, R3 і R4 незалежно один від одного становлять собою Н, гало, нижчий галоалкіл, нижчий алкіл, нітро, амідо, нижчий амідоалкіл, гідразино, нижчий гідразиноалкіл, азидо, нижчий азидоалкіл,(CH2)mNR6R7,(CH2)mOR6,(CH2)mSR6,(CH2)mC(O)R8, OC(O)NR6R7,(CH2)n[N=X], або(CH2)mOC(O)[N=X], заміщений або незаміщений, або OC(O)[N=X]; або R2 і R3 разом формують ланцюг із 3 або 4 зв'язків, у яких зазначені елементи ланцюга вибирають із групи, яка містить СН, СН2, О, S, N або NR9; R5 становить собою Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкіл нижчого алкокси, нижчий алкіл нижчого алкілтіо, нижчий гідроксиалкіл, нітро,(CH)2mC(O)R8,(CH2)mNR6C(O)R8,(CH2)mNR6R7,(CH2)mN(CH3)(CH2)nNR6R7,(CH2)mOC(O)R8)(CH2)mOC(O)N R6R7, або(CH2)n[N=XJ, або OC(O)[N=X], заміщений або незаміщений, або(CH2)mO(CO)[N=X]; R6 і R7 становлять собою незалежно один від одного Н, нижчий алкіл, нижчий гідроксиалкіл, нижчий аміноалкіл нижчого алкілу, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоапкілу, нижчий алкіл нижчого алкокси, арил, нижчий арилалкіл або нижчий галоалкіл; R8 становить собою Н, і нижчий алкіл, нижчий гідроксиалкіл, нижчий алкіламіно, нижчий аміноалкіл нижчого алкілу, нижчий аміноалкіл, циклоалкіл, алкіл нижчого циклоапкілу, нижчий алкеніл, нижчий алкокси, нижчий алкіл нижчого апкокси, нижчий галоалкіл, арил або нижчий арилалкіл; R9 становить. собою Н, нижчий алкіл, або нижчий галоалкіл; R10 становить собою Н, і нижчий алкіл, нижчий галоалкіл або нижчий алкокси; R11 становить собою нижчий алкіл; та R14 і R15 становлять собою незалежно один від одного Н або нижчий алкіл. Зокрема, об'єктом цього винаходу є сполуки формули І, що визначені вище, де R1 становить собою етилову групу; R2 і R3 незалежно один від одного становлять собою Н, нижчий алкіл, гало, нижчий галоалкіл або(CH2)mОR6, або R2 і R3 разом формують метилендіокси або етилендіокси, і R4 і R5 незалежно один від одного становлять собою Н, і нижчий алкіл,(CH2)mNR6R7 або(CH2)n[N=X], заміщений або незаміщений нижчим алкілом. Найкраще, коли R4 становить собою Н або(CH2)mNR6R7, Де R6 і R7 незалежно один від одного становлять собою Н або нижчий алкіл, a R5 становить собою Н, і нижчий алкіл або(CH2)n[N=X], заміщений або незаміщений нижчим алкілом; прикладом заміщеного або незаміщеного [N=X] можна назвати радикал піперидину, морфолініл, піперазиніл, імідазоліл і 4-метилпіперазиніл. Деякою мірою краще, коли R2 становить собою Н або гало, і, найкраще, Н, хлоро або фторо; і R3 становить собою Н, нижчий алкіл, гало або OR6, де R6 становить собою Н, нижчий алкіл або нижчий арилалкіл, і найкраще, Н, фторо, хлоро, метил або метокси. У рівноцінній найкращій мірі R2 і R3 разом формують метилендіокси або етилендіокси. Зокрема, винахід стосується продуктів, які описані нижче у прикладах, особливо продуктів, які відповідають отаким формулам: -5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно [3',4': 6,7]-індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон -5,12-діетил-4,5-дигідро-5-гідрокси-1Н-оксепіно [3,4': 6,7]-індолізіно[1,2-b]хінолін-3,15(4H, 13Н)-діон -8-етил-2,3,8,9-етрагідро-8-гідрокси-10Н,12H-[1,4]діоксино[1,2,-g]-оксепіно[3',4',: 6,7]індолізіно[1,2b]хінолін-10,13(15Н)-діон -10-бензилокси-5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон -5-етил-4,5-дигідро-5,10,-дигідрокси-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон -11-(диметиламіно)метил-5-етил-4,5-дигідро-5,10,-дигідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н,13Н)-діон -5-етил-9-фторо-4,5-дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон -9-хлоро-5-етил-4,5-дигідро-5-гідрокси-10-метил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон -5-етил-9,10-дифторо-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4: 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)діон -7-етил-7,8-дигідро-7-гідрокси-9Н,11Н-[1,3]діоксоло[4,5-g]оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін9,12(14Н)-діон -9-хлоро-5-етил-4,5-дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон. -5-етил-4,5-дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)діон -9,11-дихлоро-5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4H,13Н)діон -5-етил-9-фторо-4,5-дигідро-5-гідрокси-10-метил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4H,13Н)-діон -5-етил-10-фторо-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -10-хлоро-5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -10-хлоро-5-етил-9-фторо-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон -5,12-діетил-4,5-дигідро-5,10-дигідрокси-11-морфолінометил-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон -5,12-діетил-9-фторо-4,5-дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін3,15(4Н,13Н)-діон -5-етил-4,5-дигідро-5-гідрокси-12-метил-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -9-хлоро-5-етил-4,5-дигідро-5-гідрокси-10-метокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -9-хлоро-5-етил-4,5-дигідро-5-гідрокси-10-метокси-12-морфолінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон 5-етил-4,5-дигідро-5-гідрокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2b]хінолін-3,15(4Н,13Н)-діон -5-етил-4,5-дигідро-5-гідрокси-12-піперидинометил-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін3,15(4Н,13Н)-діон -5-етил-4,5-дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[З',4': 6,7]-індолізіно[1,2-b]хінолін3,15(4Н,13Н)-діон -5-етил-10-фторо-4,5-дигідро-5-гідрокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -5-етил-10-фторо-4,5-дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2b]хінолін-3,15(4Н,13Н)-діон -5-етил-9-фторо-4,5-дигідро-5-гідрокси-10-метил-12-(4-метилпіперазинолметил)-1Н-оксепіно[3',4': 6,7] індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -5-етил-9-фторо-4,5-дигідро-5-гідрокси-10-метил-12-морфолінометил-1Н-оксепіно[3,4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -5-етил-9-фторо-4,5-дигідро-5-гідрокси-10-метил-12-піперидинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н,13Н)-діон -8-етил-2,3,8,9-тетрагідро-8-гідрокси-16-(4-метилпіперазинометил)-10Н,12Н-(1,4)діоксино(2,3g)оксепіно[3',4': 6,7]-індолізіно[1,2-b]хінолін-10,13(15Н)-діон -9-хлоро-5-етил-10-фторо-4,5-дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4H, 13Н)-діон або фармацевтично придатна сіль останнього. Зокрема, об'єктом винаходу у рівній мірі є сполуки формули(II), які описані вище, де R1 становить собою етилову групу; R2 і R3 становлять собою незалежно один від одного Н, і нижчий алкіл, гало, нижчий галоалкіл, або(CH2)mOR6, або R2 і R3 разом формують метилендіокси або етилендіокси; R4 і R5 становлять собою незалежно один від одного Н, і нижчий алкіл,(CH2)mNR6R7,(CH2)n[N=X], незаміщений або заміщений нижчим алкілом; R20 становить собою Н, a R17 становить собою OR6, де R6 становить собою Н або нижчий алкіл, або NR6R7, де R6 і R7 незалежно один від одного становлять собою Н, і нижчий алкіл, арил, або нижчий арилалкіл. Найкраще, щоб R4 становив собою Н або(CH2)mNR6R7, де R6 і R7 незалежно один від одного становили собою Н або нижчий алкіл; R5 становив собою Н, нижчий алкіл або(CH2)n[N=X], незаміщений або заміщений нижчим алкілом, a R17 становив собою OR6, де R6 становить собою Н або нижчий алкіл; або фармацевтично придатну сіль останнього. Як приклад [N=X] можна навести радикали піперидилу, морфолінілу, піперазинілу, імідазолілу і 4-метилпіперазинілу. Ще більш найкраще, щоб R2 становив собою Н або гало, і, найкраще, Н, хлоро або фторо; R3 становив собою Н, нижчий алкіл, гало або OR6 де R6 становить собою Н, нижчий алкіл або нижчий арилалкіл і, найкраще, Н, фторо, хлоро, метил або метокси. Однаковою мірою найкраще, щоб R2 і R3 разом формували метилендіокси або етилендіокси. Зокрема об'єктом цього винаходу є продукти, що описані у нижченаведених прикладах, особливо продукти, які відповідають отаким формулам: -терт-бутил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-пропіонат -етил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-пропіонат -β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-пропіонова кислота -метил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-пропіонат -етил-β-етил-α,α-дифторо-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)пропіонат -етил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-пропіонат -терт-бутил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-пропіонат -β-етил-γ-(12-етил-8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-β-гідроксипропіонова кислота -γ-(12-бензилокси-8-гідроксиметил-9-оксо(11Н)-індолізино-[1,2-b]хінолін-7-іл)-β-етил-βгідроксипропіонова кислота(E) -або фармацевтично придатна сіль останнього. У цьому описі термін "нижчий" відносно груп алкілу, алкілтіо та алкокси означає насичені аліфатичні вуглеводневі групи, лінійні або розгалужені, що містять від одного до шести атомів вуглецю, наприклад, метил, етил, пропіл, ізопропіл, бутил, t-бутил, метилтіо, етилтіо, метокси та етокси. Відносно до алкенілових або алкінілових груп термін "нижчий" означає групи, які містять від двох до шести атомів вуглецю та одну або більше подвійних або потрійних зв'язків, як наприклад, вініл, алліл, ізофеніл, пентаніл, гексаміл, пегеніл етініл, пегініл, і бутиніл. Термін "циклоалкіл" означає циклічну структуру, яка має від 3 до 7 атомів вуглецю, наприклад, циклопропілові, циклобутилові, циклопентилові або циклогексилові групи. Термін "арил" означає моно-, ді- або трициклічну вуглеводневу сполуку, що має принаймні одну ароматичну циклічну структуру, причому кожна зазначена циклічна структура містить максимум 7 зв'язків, наприклад, феніл, нафтил, антрацил, біфеніл або інденіл. Термін "гало" означає хлоро, бромо, йодо або фторо. Радикали, що відповідають нижчому галоалкілу, нижчому ціаноалкілу, нижчому нітроалкілу, нижчому амідоалкілу, нижчому гідразиноалкілу, нижчому азидоалкілу, нижчому арилалкілу, нижчому гідроксиалкілу, нижчому алкілу нижчого алкокси, нижчому алкілу нижчого алкілтіо та нижчому алкілу нижчого алкілсульфонилу, заміщуються відповідно від однієї до трьох групами гало, ціано, нітро, амідо, гідразино, азидо, арилу, гідрокси, нижчого алкокси, нижчого алкілтіо або нижчого сульфонілу. Нижчий алкіламіно-радикал може містити одну або дві групи нижчого алкілу та становити собою, наприклад, NHCH3, NHCH2CH3 , N(CH3 )2 або N(CH3)(CH2CH3). Прикладами [N=X] можуть бути піперидинілові, морфолінілові, піперизинілові та імідазолилові групи. Як це спостерігається у камптотецину, атом вуглецю, який має функцію гідрокси на βгідроксилактоновій або на β-гідроксикарбоксилатній групі сполук згідно з цим винаходом, є асиметричним. Отож, сполуки згідно з цим винаходом мають дві можливі енантіомерні конфігурації, тобто конфігурації "R" і "S". Цей винахід розглядає зазначені дві енантіомерні. конфігурації та усі комбінації зазначених конфігурацій, які містять також рацемічні суміші "RS". З метою спрощення у випадках, коли будь-яка специфічна конфігурація не показана у структурних формулах, розуміється, що у цих формулах подані обидві енантіомерні конфігурації та їх суміші. Об'єктом цього винаходу також є способи виготовлення сполук узагальненої формули І і II, або із камптотецину, або із заміщеного камптотецину, або через загальний хімічний синтез. Таким чином, винахід стосується способу виготовлення сполук формули І і II згідно з цим винаходом, де вихідним матеріалом є камптотецин або заміщений камптотецин, який відрізняється тим, що: -α-гідроксилактон камптотецину відновлюють до узагальненої формули де R1 R2 R3 R4 R5 і R20 мають вищенаведені значення, для одержання α-гідроксилактолу узагальненої формули А де R1 R2 R3 R4 R5 і R20 мають вищенаведені значення. У сформованої таким чином сполуки А вуглець вуглецевий зв'язок, що зв'язує сусідній карбинол, розрізають за допомогою оброблення відповідним окиснюючим агентом з метою одержання сполуки формули В де R1 R2 R3 R4 R5 і R20 мають вищенаведені значення. Далі її обробляють за допомогою функціонального алкілізуючого агента та розрізають формільну функціональну групу сполуки формули В з метою одержання β - гідроксиефіру узагальненої формули С де R1 R2 R3 R4 R5 R18 R19 і R20 мають вищенаведені значення, R17 становить собою OR6, де R6 становить собою нижчий алкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси або арил, або нижчий арил алкіл; -зазначену сполуку узагальненої формули С циклізують, що спричиняє одержання βгідроксилактонічної сполуки узагальненої формули D де R1 R2 R3 R4 R5 R18 R19 і R20 мають вищенаведені значення, -лактон узагальненої формули D відкривають, що веде до одержання сполуки формули Е де R1 R2 R3 R4 R5 R1. R19 і R20 мають вищенаведені значення; R16 становить собою OR21, де R21 становить собою Н або нижчий алкіл; R17 становить собою OR6 або NHR6 і R6 становить собою Н, нижчий алкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси або арил, або нижчий арилалкіл. Певні сполуки формули Е можуть бути одержані також через гідроліз ефірної функції відповідних сполук формули С. Сполуки узагальненої формули Е, де R16 і/або R17 становлять собою незалежно один від одного гідрокси-радикал, можуть бути етерифіковані або амідовані за класичними умовами, які відомі спеціалістам у цій галузі, для одержання ефірів або амідів, що відповідають формулі Е. У вищенаведеному способі групи R1, R2, R3 і R4 при необхідності можуть бути захищені згідно з класичними способами захисту [Greene Т., Protective Groups in Organic Synthesis 10-86(John Wiley and Sons, 1981)]. Протягом цій процедури відбувається відновлення за допомогою відновлюючого агента у відповідному розчиннику, такому, наприклад, як борогідрид натрію у метанолі. Етап, який відповідає формуванню сполуки В із сполуки А, відбувається за умовами окислення, такими, наприклад, як наявність тетраацетату свинцю, йодної кислоти або метаперіодату натрію у відповідному розчиннику, такому, наприклад, як оцтова кислота. Оброблення функціоналізованим алкілувальним агентом можна здійснювати за допомогою металевої похідної, наприклад, літію або цинку або за допомогою карбоксильного ефіру у безводному апротонному розчиннику, такому, наприклад, тетрагідрофурані. Етап лактонізації, на якому сполуку D одержують із сполуки С, звичайно виконують за кислими умовами, наприклад, через оброблення трифтороцтовою кислотою, або хлористоводневим газом, розчиненим у ангідрідному розчиннику, наприклад, у дихлорметані або діоксані. Розрив лактонової циклічної структури сполуки D з метою одержання сполуки Е може бути виконано, наприклад, через гідролізування за лужними умовами з подальшою нейтралізацією. Приклади заміщених камптотецинів, які використовують як вихідні продукти, можна знайти у патентах США №№ 4 473 692, 4 604 463, 4 894 956, 5 162 532, 5 395 939, 5 315 007, 5 264 579, 5 258 516, 5 254 690, 5 212 317 і 5 341 745, заявках на патент РСТ №№ US91/08028, US 94/06451, US90/05172, US92/04611, US93/10987, US91/09598, ЕР94/03058 і ЕР95/00393, заявках на європейський патент №№ 325 247, 495 432, 321 122 і 540 099. Цей винахід також стосується способу виготовлення сполук формул І і II, який відрізняється тим, що, сполуку узагальненої формули М з'єднують де R1 R18 і R19 мають вищенаведені значення, a R20 становить собою атом водню або галогену, з'єднують з 2-гало-3-хінолін-метанолом узагальненої формули N де R2, R3, R4 і R5 мають вищенаведені значення, а X становить собою атом галогену, що приводить до одержання сполуки формули О де R1, R3, R3, R4, R5, R18. R19, R20 і X мають вищенаведені значення; -далі сполуку узагальненої формули O циклізують для одержання сполуки формули D, як це наведено вище. У вищеописаному способі групи R1, R2, R3 і R4 при необхідності можуть бути захищені згідно з класичними способами захисту [див. Greene Т., Protective Groups in Organic Synthesis, 10-86(John Wiley and Sons, 1981)]. Створення сполуки О із сполук узагальненої формули М і N, здійснюють через оброблення, яке відоме спеціалістам у цій галузі під назвою реакції Мітсунобу [див. Mitsunobu О. et al., Synthesis. P.1(1981)]. Вона включає заміщення гідроксильної функції сполуки N нуклеофілом, наприклад, сполукою М, або депротонованою похідною останнього через оброблення за допомогою фосфіну, наприклад, трифенілфосфіну, і похідної азодикарбоксилату, наприклад, діетилазодикарбоксилату у апротонному розчиннику, такому, наприклад, як тетрагідрофуран або N,N-диметилформамід. Циклізація сполуки О трапляється найкраще у присутності палідинового каталізатора(наприклад, діацетату паладію) за основними умовами(що забезпечуються, наприклад, за допомогою лужного ацетату, який можливо комбінувати з агентом фазового переходу, таким, наприклад, як бромід тетрабутил амонію, у апротонному розчиннику, наприклад, ацетонітрилі або N,N-диметилформаміді, у температурному діапазоні від 50°С до 120°С [див. R. Grigg et al., Tetrahedron 46, p. 4003(1990)]. Сполуки узагальненої формули М є новими. Вони можуть бути одержані згідно із способом, який відрізняється тим, що -карбоніл піридину узагальненої формули де R1 та R20 мають вищенаведені значення, a R22 становить собою атом галогену або нижчий алкокси, захищають за допомогою ацеталевої функції, що приводить до одержання сполуки узагальненої формули F де R1, R20 і R22 мають вищенаведені значення, а групи Z і Z' становлять собою незалежно один від одного нижчий алкіл або разом формують насичений вуглеводневий ланцюг, що містить від 2 до 4 атомів вуглецю; -гідроксиметилову функцію вводять до сполуки узагальненої формули F, що приводить до одержання сполуки узагальненої формули G де R1, R20, R22. Z і Z'мають вищенаведені значення; -потім захищають спиртову функцію сполуки узагальненої формули G, що приводить до одержання сполуки узагальненої формули Н де R1, R20, R22, Z і Z' мають вищенаведені значення, a R23 становить собою захисну групу спиртової групи; -знімають захист з ацеталу сполуки узагальненої формули Н, що приводить до одержання сполуки узагальненої формули І' де R1, R20, R22 і R23 мають вищенаведені значення; - сполуку формули 1' обробляють функціоналізованим алкілуючим агентом, що приводить до одержання β-гідроксиефіру сполуки узагальненої формули J де R1, R20, R22 і R23 мають вищенаведені значення, R18 і R19 визначені в узагальненій формулі II, a R17 становить собою OR6 і R6 становить собою нижчий алкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси, або арил, або нижчий арилалкіл; -захисну групу R23 розщеплюють із сполуки узагальненої формули J, що приводить до одержання сполуки узагальненої формули К де R1, R18, R19, R20 і R22 мають вищенаведені значення, a R17 становить собою OR6 і R6 становить собою нижчий алкіл, циклоалкіл, алкіл нижчого циклоалкілу, нижчий алкеніл, нижчий алкіл нижчого алкокси або арил, або нижчий арилалкіл; -сполуку узагальненої формули К циклізують з метою формування сполуки узагальненої формули L де R1, R18, R19, R20 і R22 мають вищенаведені значення, і нарешті -радикал R22 сполуки L перетворюють у карбоніл, що приводить до одержання сполуки узагальненої формули М де R1, R18, R19 i R20 мають вищенаведені значення. Карбонільну функцію 4-ацил-2-піридину(одержану, наприклад, згідно з Lamattina, J. L. J. Heterocyclic Chem. 20, p. 553(1983)], найкраще захищають ацетальною функцією, найкраще циклічним ацеталом, згідно з класичними умовами, які відомі спеціалістам у цій галузі [Greene Т., Protective Groups in Organic Synthesis, 10 - 86(John Wiley and Sons, 1981)]. Коли R22 становить собою хлоро або фторо, то одержаний таким чином проміжний продукт обробляють алкоголятом натрію або алкоголятом калію у апротонному розчиннику(наприклад, ацетонітрилі), або у спирті, із якого виділений алкоголят, у температурному діапазоні від 0°С до 100°С, що приводить до одержання сполуки узагальненої формули F. Остання може бути літіірована на позиції 3 через оброблення арил- або алкіл-літієм(наприклад, мезитил-літієм) у ефіризованому розчиннику, наприклад, тетрагідрофурані, у температурному діапазоні від -100°С до 0°С. До одержаної таким чином літіірованої проміжної речовини додають формілуючий електрофіл, наприклад, N,N-диметилформамід, і одержаний альдегід після гідролізу обробляють відновлюючим агентом, наприклад, борогідридом натрію, що приводить до одержання сполуки узагальненої формули G. Захист спиртової функції сполуки G здійснюють згідно з класичними умовами, відомими спеціалістам у цій галузі, що приводить до одержання сполуки узагальненої формули Н. Прикладами захисних груп спирту є групи, які формують ефіри [наприклад, метил, метоксиметил, тетрагідропіраніл, 2-метоксиетокси метил, бензилоксиметил, t-бутил і бензил(заміщений або ні)] і ефіри(наприклад, формат, ацетат, ізобутират). Інші приклади інших первинних гідроксильних захисних груп наведені у Greene Т., Protective Groups in Organic Synthesis, 10-86(John Wiley and Sons, 1981). Зняття з захисту сполук узагальненої формули Н, що веде до одержання сполуки узагальненої формули I', виконують за вибраними умовами навколишнього середовища, що підтримають цілісність радикалу R23 наприклад, через оброблення за кислими умовами(наприклад, трифтороцтовою кислотою). Вибрані умови захисту і зняття з захисту функціональних груп відомі спеціалістам у цій галузі [Greene Т., Protective Groups in Organic Synthesis, 10-86(John Wiley and Sons, 1981)]. Оброблення сполуки I' функціоналізованим алкілуючим агентом, що веде до одержання βгідроксиефіру сполуки узагальненої формули J, може бути виконаним за допомогою енолату літію або цинкової похідної карбоксильного ефіру у апротонному безводному розчиннику, наприклад, тетрагідрофурані. Захисну групу R23 сполуки узагальненої формули J розщіплюють, що приводить до одержання сполуки узагальненої формули К за незахищеними умовами, які відомі спеціалістам у цій галузі. Наприклад, коли R23 становить собою бензилову групу, спиртовий розчин сполуки узагальненої формули J та паладієвий каталізатор можуть бути піддані дії водневої атмосфери при тиску у діапазоні від 0,5 до 10 бар. Циклізація одержаної таким чином сполуки узагальненої формули К може бути здійснена за кислими умовами(наприклад, через оброблення трифтороцтовою кислотою або хлористоводневим газом, розчиненим у безводному розчиннику, наприклад, дихлорметані або діоксані, що приводить до одержання β-гідроксилактонової циклічної структури, яка має сім зв'язків, як і у сполуки узагальненої формули L. Сполуки узагальненої формули L можуть бути перетворені у піридини узагальненої формули М, наприклад, через оброблення гарячою хлорводневою кислотою або йодидом триметилсилілу. Зазначений 2-гало-3-хінолін-метанол узагальненої формули N може бути одержаним із ацетанілідів сполуки узагальненої формули Р де R2, R3, і R4 мають значення, що визначені в узагальнених формулах сполук І і II. У способах, наведених нижче, групи R2, R3 і R4 можуть бути захищені при необхідності згідно з класичними способами захисту [Greene Т., Protective Groups in Organic Synthesis, 10-86(John Wiley and Sons, 1981)]. Далі сполуки формули N можуть бути одержані згідно з отаким способом: зазначені аніліни формули Р піддають N-ацетилуванню через оброблення ацетилуючим агентом, таким, наприклад, як оцтовий ангідрид. Одержані таким чином ацетаніліди обробляють при температурі, що знаходиться у діапазоні від 50°С до 100°С, найкраще 75°С, реактивом, відомим спеціалістам у цій галузі як реактив Вілсмейєра(Vilsmeyer)(одержаним через дію фосфорил оксихлориду на N,N-диметилформамід при температурі, що знаходиться у діапазоні від 0°С до 10°С), що приводить до одержання відповідного 2хлоро-3-хінолінкарбальдегіду [див., наприклад, Meth-Connet al., J. Chem. Soc, Perkin Trans. I p. 1520(1981); Meth-Cohn et al., J. Chem. Soc., Perkin Trans. I p. 2509(1981); і Nakasimhan et al., J. Am. Chem. Soc, 112, p. 4431(1990)]. Хлорин на позиції 2 2-хлоро-3-хінолінкарбальдегідів може бути заміщений йодом або бромом через нагрівання продукту в інертному розчиннику, наприклад, у ацетонітрилі у присутності солі йоду або брому(наприклад, йодиду натрію або броміду тетрабутиламонію). З метою каталізування зазначеного перетворення може бути потрібна слідова кількість кислоти, наприклад, концентрованої соляної кислоти. Зазначені 2-гало-3-хінолінкарбальдегіди легко відновлюють до 2-гало-3-хінолінметанолів, відповідних узагальненій формулі N, за класичними умовами, які відомі спеціалістам у цій галузі, наприклад, через оброблення у спиртовому розчиннику(наприклад, метанолі) боргідридом натрію при температурі, що знаходиться у діапазоні від 0°С до 40°С. Сполуки формули N можуть бути також одержані згідно з отаким способом: зазначені аніліни узагальненої формули Р, наприклад, такі, що визначені вище, ацилують через реакцію з нітрилом(наприклад, хлороацетонітрилом або пропіонітрилом) у присутності трихлориду бору та іншої кислоти Льюїса, наприклад, трихлориду алюмінію, тетрахлориду титану або хлориду діетилалюмінію у апротонному розчиннику або суміші апротонного розчинника з подальшим гідролізом [див. Sugasawa Т., et al., J. Am. Chem. Soc. 100, p. 4842(1978)]. Далі одержану проміжну речовину обробляють хлоридом етилмалонілу у апротонному розчиннику, наприклад, ацетонітрилі, у присутності основи, наприклад триетиламіну, далі обробляють лужним алкоголятoм, наприклад, метилатом натрію у метанолі, що приводить до одержання етил 2-гідрокси-3-хінолінкарбоксилату, заміщеного на позиції 4. Останній перетворюють у етил 2-хлоро-3-хінолінкарбоксилат через оброблення фосфорилоксихлоридом. Коли позиція 4 хіноліну несе хлорметильну групу, нуклеофільне заміщення можна здійснювати через оброблення вторинним аміном, таким, наприклад, як диметиламін, N-метил піперазин, морфолін або піперидин. Далі етил 2-хлоро-3-хінолінкарбоксилат відновлюють за допомогою гідриду діізобутилалюмінію у апротонному розчиннику, наприклад, дихлорметані, що приводить до одержання 2-хлоро-3 хінолінометанолу узагальненої формули N. Аналоги проміжних(N) сполук описані у літературі, і, зокрема, у заявці на патент РСТ №95/05427. Об'єктом цього винаходу є також нові промислові продукти, а саме нові промислові продукти, призначені для виготовлення продуктів формул(І) і(II), продуктів формули Г і М, як це описано вище. Певні сполуки згідно з цим винаходом можуть бути одержані у формі фармацевтично придатних солей згідно з відомими способами. Зазначені придатні солі містять, наприклад, але не виключно, приєднані солі неорганічних кислот, наприклад, хлоргідрат, сульфат, фосфат, дифосфат, бромгідрат і нітрат, або органічні кислоти, наприклад, ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метан сульфонат, р-толуолсульфонат, памоат, саліцилат, оксалат і стеарат. Солі, створені на основах, наприклад, на гідроксиді натрію або калію, також належать до сфери застосування цього винаходу, коли вони придатні для вживання. Інші приклади фармацевтично придатних солей наведені у "Pharmaceutical Salts", J. Pharm. Sei. 66: 1(1977). Сполуки згідно з цим винаходом мають важливі фармакологічні властивості. Це стосується того, що сполуки згідно з цим винаходом мають інгібуючий ефект на топоізомеразу І і/або II та антипухлинну активність. Діюча методика припускає, що сполуки згідно з цим винаходом мають антипаразитарну і/або антивірусну активність. Сполуки згідно з цим винаходом можна таким чином використовувати у різних терапевтичних засобах лікування. Зазначені сполуки можуть інгібувати топоізомеразу, наприклад, типів І і/або II, у пацієнта, наприклад, у ссавців, таких як людина, через введення зазначеному пацієнту терапевтично ефективної кількості сполук формули(І) або формули(II). Сполуки згідно з цим винаходом мають також антипухлинну активність. їх можна використовувати для лікування пухлин, наприклад, пухлин, обумовлених топоізомеразою, через введення пацієнту терапевтично ефективної кількості сполуки формули(І) або формули(II). Деякими прикладами пухлин або карцином є карциноми стравоходу, шлунка, кишечника, прямої кишки, оральної порожнини, глотки, гортані, ободочної кишки, легенів, грудей, шийки матки, слизової оболонки матки, яєчника, передміхурової залози, яєчок, сечового міхура, нирок, печінки, підшлункової залози, з'єднувальних тканин, кісток, шкіри, очей, мозку та центральної нервової системи, а також карциноми щитовидної залози, лейкемія, захворювання Ходжкіна(Hodgkin's), лімфоми, які відрізняються від лімфом Ходжкіна, меланоматоз та інш. Зазначені сполуки можуть бути також використані для лікування паразитних інфекцій через інгібування кров'яних жгутикових(наприклад, при інфекціях, обумовлених жгутиковими trypanosoma і leishmania) або через інгібування плазмодію(наприклад, при малярії), а також для лікування вірусних інфекцій або захворювань. Ці властивості обумовлюють придатність продуктів формули І і II для фармацевтичного використання. Об'єктом цієї заявки є також продукти формули І і II, які можна використовувати як медикаменти, як вони були зазначені вище, а також додаткові солі з фармацевтично придатними органічними або мінеральними кислотами, причому зазначені продукти формул І і II, а також фармацевтичні композиції містять як активний інгредієнт один з медикаментів, що зазначено вище. Цей винахід стосується таким чином фармацевтичних композицій, що містять сполуку згідно з цим винаходом або її додаткову сіль фармацевтично придатної кислоти разом з фармацевтично придатним носієм згідно з вибраним способом введення(наприклад, оральним, внутрішньовенним, внутрішньоперитонеальним, внутрішньом'язковим, внутрішньошкірним або зашкірним). Фармацевтична композиція(наприклад, терапевтична) може бути у формі твердого тіла, ріднини, ліпосоми або ліпідної міцели. Зазначена фармацевтична композиція може бути у формі твердих тіл, наприклад, порошків, пілюль, таблеток, ліпосом, гранул, капсул або супозіторіїв. Пілюлі, таблетки або капсули можуть бути покриті речовиною, що захищає композицію від впливу шлункової кислоти або ензімів у шлунку пацієнта досить тривалий час, що дозволяє композиції проходити без перетравлювання у малий кішечник останнього. Таким чином, зазначена сполука може також вводитися локально, наприклад, через розміщення поблизу пухлини. Зазначену сполуку можна також вводити згідно з методом затримання її вивільнення(наприклад, завдяки композиції, що затримує її вивільнення, або інфузійному насосу). Відповідним твердим середовищем може бути, наприклад, фосфат кальцію, стеарат магнію, карбонат магнію, тальк, цукри, лактоза, декстрин, амідон, желатин, целюлоза, метил целюлоза, натрій карбоксиметил целюлоза, полівінілпіролідин та віск. Фармацевтичні композиції, що містять сполуку згідно з цим винаходом можуть бути подані у формі рідини, наприклад, розчинів, емульсій, суспензій або рецептур, які забезпечують затримання вивільнення сполуки. Відповідні рідкі носії можуть становити собою воду, органічні розчинники, наприклад, гліцерин, або гліколі, наприклад, поліетиленгліколь, а також їх суміші у різних пропорціях у воді. Об'єктом цього винаходу є також використання вищенаведених продуктів формул І і II для виготовлення медикаментів, призначених для інгібування топоізомерази, особливо топоізомерази першого та другого типів, медикаментів, призначених для лікування пухлин, медикаментів, призначених для лікування паразитарних інфекцій, а також медикаментів, призначених для лікування вірусних інфекцій та захворювань. Доза сполуки згідно з цим винаходом, що призначена для лікування вищенаведених захворювань та розладів, змінюється у залежності від способу введення, віку та ваги тіла пацієнта, а також його стану, і повинна бути встановлена індивідуально лікарем або ветеринаром. Така доза має назву у цьому опису "терапевтично ефективна кількість". У наступному експериментальному розділі можна знайти ілюстративні дані про фармакологічні властивості зазначених сполук. Коли усі технічні та наукові терміни, які використані у цьому описі, не визначені іншім чином, вони мають такі самі значення, що зрозумілі звичайному спеціалісту у галузі, до якої належить цей винахід. Таким же чином, усі наведені у цьому опису публикації, заявки на патент, патенти та усі інші посилання подаються як матеріали - посилання. Нищенаведені посилання призначені для ілюстрації вищезазначених способів та ні у якому разі не повинні розглядуватися як обмежуючі об'єм винаходу. Експетиментальний розділ Приклад 1: tert-бутил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)-пропіонат 1а 4-етил-3,4-дигідрокси-1Н-пірано[3',4': 6,7]індолізіно[1,2-b]хінолін-14(4Н, 12Н)-он Борогідрид натрію(14г, 370мМ) порційно додають до суспензії(S)-(+)-камптотецину(14г, 40мМ), який можна одержати із різних комерційних джерел, наприклад, Aldrich Chemical Co.(Milwaukee, Wl), у метанолі(750мл) та одержану суміш повільно нагрівають до 55°С з метою виготовлення чистого розчину, який далі перемішують протягом 16 годин при температурі навколишнього середовища. Після цього розчинник випарюють при зменшеному тиску, осад відновлюють у воді(250мл), нейтралізують через додавання оцтової кислоти(21мл) та витримують протягом 2 годин при температурі 4°С. Одержану суспензію фільтрують і промивають послідовно холодною водою, ацетоном і діетиловим ефіром, що після сушіння при зменшеному тиску дозволяє одержати бажану сполуку у вигляді твердого тіла білого кольору, що має точку плавлення 280°С. 1б 8-формілоксиметил-7-пропіоніліндолізіно[1,2-b]хінолін-9(11Н)-он Розчин метаперіодату натрію(14г, 65мМ) у воді(140мл) додають по краплям до суспензії 4-етил-3,4дигідрокси-1Н-пірано[3',4': 6,7]індолізіно[1,2-b]хінолін-14(4Н, 12Н)-он(13,4г, 38мМ) у льодяній оцтовій кислоті(720мл) і одержаний розчин перемішують протягом однієї години при температурі навколишнього середовища. Далі реакційну суміш подають у суміш льоду та води(650мл) і одержану суспензію перемішують протягом півгодини, а потім фільтрують і послідовно промивають водою, ізопропиловим спиртом і сумішшю діетилового ефіру та спирту, що після сушіння при зменшеному тиску веде до одержання бажаної сполуки(11,5г) у вигляді твердого тіла блідножовтого кольору, що має точку плавлення більше 200°С. 1в tert-бутил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)-пропіонат Суспензію цинку(6,5г,.100мМ), яка перемішана за допомогою магнітного змішувача у безводному діетилефірі(50мл) у атмосфері аргону, активують через додавання крапля за краплею хлоротриметилсілану(0,75мл, 5,7мМ). Знову перемішують протягом 15 хвилин при температурі навколишнього середовища з метою нагрівання до появи флегми. Далі видаляють теплову баню і крапля за краплею додають tert-бутил-бромацетат(15мл, 100мМ) при швидкості, яка достатня для підтримання флегми. Знову забезпечують зовнішнє нагрівання протягом однієї години. Одержаний із реактиву Реформатського(Reformatsky) розчин, що містить ефір, охолоджують до температури навколишнього середовища, а далі переносять за допомогою піпетки до суспензії 8-формілоксиметил-7пропіоніліндолізіно[1,2-b]хінолін-9(11Н)-он(1,6г, 4,7мМ) у безводному тетрагідрофурані(40мл) у атмосфері аргону. Реакційну суміш перемішують у флегмі протягом однієї години, далі охолоджують до температури навколишнього середовища, після чого реакцію припиняють через додавання насиченого хлоріду амонію(100мл) та екстрагують за допомогою хлороформу(3 х 100мл). Комбіновані екстракти хлороформу висушують на сульфаті натрію, випарюють та осад очищають за допомогою гель-хроматографії на кремінному гелі(1 - 2%MEOH/CH2CI 2), що забезпечує можливість одержання 0,64г бажаної сполуки(31%) у вигляді твердого тіла блідножовтого кольору з точкою плавлення 146 - 149°С. NMR-1H(CDCI 3); 0.93(t,3H); 1.37(s, 9H); 1.99(m,2H); 2.97(dd, 2Н); 3.5(se, 1H); 5.10(s,2H); 5.24(s, 2H); 7.40(s,1H); 7.59(t, 1H); 7.83(t, 1H); 7.90(d,1H); 8.20(d, 1H); 8.34(s, 1H). NMR-CI3(CDC! 3); 8.18; 27.90; 34.59; 45.34; 49.91; 58.55; 77.39; 82.42; 100.52; 127.67; 127.97; 128.10; 128.64; 129.44; 129.79; 130.42; 130.99; 142.86; 148.69; 152.75; 155.16; 162.38; 172.24. IR(КВг); 764; 1016; 1157; 1580; 1651; 1726. де NMR(тут і далі) означає ядерний магнітний резонанс(ЯМР) IR означає інфрачервону спектроскопію(ІЧС) Приклад 2: етил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)-пропіонат Суспензію цинку(500мг, 7,64мМ) і 8-формілоксиметил-7-пропіоніліндолізіно[1,2-b]хінолін-9(11Н)он(400мг, 1,15мМ) у безводному тетрагідрофурані(20мл), що містить 10мг гідрохінону, нагрівають до появи флегми у атмосфері аргону. Видаляють теплову баню і через додавання краплі етилбромацетату та невеликого кристала йоду починають екзотермічну реакцію. Флегму зберігають шляхом додавання крапля за краплею етилбромацетату(500мкл, 4,48мМ), далі реакційну суміш знову нагрівають у стані флегми протягом однієї години. Після охолодження до температури навколишнього середовища реакцію припиняють через додавання насиченого хлористого амонію(10мл) та метанолу(30мл). Одержану у результаті суміш перемішують протягом 5 хвилин, а далі фільтрують та випарюють. Осад розчиняють у дихлорметані(30мл), промивають водою і висушують на сульфаті натрію. Далі видаляють розчинник та роблять очищення за допомогою колончатої хроматографії(SiO2, СН2СІ 2/МеOН 98/2), що веде до одержання 230мг бажаної сполуки(49%) у вигляді твердого тіла жовтого кольору з точкою плавлення 157161°С. NMR-1H(CDCl3): 0.93(t, 3Н); 1.20(t, 3Н); 2.02(m,2H); 3.07(dd, 2H); 4.11(q,2H); 4.9(se, 1H); 5.08(s, 2H); 5.23(s, 2H); 7.45(s, 1H); 7.62(t, 1H); 7.80(t, 1H); 7.90(d, 1H); 8.22(d, 1H); 8.36(s, 1H). NMR С13(CDC13): 8.09; 14.01; 34.67; 44.85; 49.94; 58.31; 61.09; 77.21; 100.78; 127.78; 127.96; 128.11; 128.72; 129.16; 129.65; 130.60; 131.32; 142.76; 148.28; 152.55; 155.09; 162.22; 172.59. IR(KBr):766; 1009; 1184; 1582; 1647; 1750. Приклад 3: 5-етил-4,5-дигідро-5- гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон: tert-бутил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)пропіонат(1,45г, 3,32мМ) розчиняють у безводному дихлорметані(25мл) та обробляють насиченим розчином хлористого водню у дихлорметані(100мл). Одержану суміш витримують при температурі -20°С протягом 16 годин. Осад фільтрують, промивають метанолом і висушують при зниженому тиску, що веде до одержання 662мг(55%) бажаної сполуки у вигляді твердого тіла жовтого кольору з точкою плавлення(т. п.) більше 300°С. NMR-1Н(DMSO): 0.90(t, 3Н); 1.20(q,2H); 3.27(dd, 2Н); 5.29(s, 2H); 5.49(dd,2H); 7.42(s,1H); 7.73(t,1H); 7.90(t,1H); 8.16(t,2H); 8.71(s, 1H). NMR C13(DMSO): 8.45; 36.48; 42.54; 50.68; 61.44; 73.34; 99.78; 122.71; 127.83; 128.15; 128.75; 129.08; 130.07; 130.61; 131.81; 144.66; 148.04; 152.80; 155.91; 159.26; 172.08. IR(KBr):761; 1127; 1204; 1285; 1580; 1653; 1757. Приклад 4: β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)-пропіонова кислота Водний розчин гідроксиду калію(0,1N, 30мл) додають до 5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діону(500мг, 1,38мМ) і одержану суспензію перемішують протягом 16 годин, що веде до одержання майже чистої рідини, яку далі фільтрують. Фільтрат підкисляють до pH = 3,5 за допомогою 1N соляної кислоти та осад жовтого кольору відновлюють за допомогою фільтрування, промивають водою та ацетоном, далі висушують при зменшеному тиску. Бажану сполуку(415мг, 79%) одержують у вигляді моногідрату, який має т. п. 165 - 167°С. NMR-1Н(DMSO): 0.82(t, 3Н); 2.10(m, 2H); 2.83(d, 2H); 3.12(d, 2H); 3.25(se, 1H); 4.81(s,2H); 5.26(s,2H); 5.76(se, 1H); 7.38(s, 1H); 7.71(t, 1H); 7.84(t, 1H); 8.10(d, 1H); 8.18(d, 1H); 8.34(s, 1H); 12.15(se, 1H). NMR C1(DMSO): 8.16; 34.80; 46.71; 50.36; 55.73; 76.53; 100.17; 127.50; 128.00; 128.26; 128.69; 129.06; 130.01; 130.45; 131.63; 142.57; 148.09; 153.19; 156.07; 161.22; 172.27. IR(KBr): 1020; 1188; 1413; 1586; 1651; 1694. Приклад 5: метил-β-етил-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)-пропіонат 5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон(180мг, 0,5мМ) у суспензії з метанолом(50мл) обробляють за допомогою 6N висушеного хлористого водню у метанолі(0,5мл) та підтримують у стані флегми до повного розчинення(4 години). Летючі сполуки випарюють та осад розчиняють у дихлорметані(50мл), промивають розведеним гідроксидом натрію(0.05N, 15мл) і сольовим розчином(15мл). Органічну фракцію висушують на сульфаті натрію та випарюють. Твердий осад очищають за допомогою силікагелевої колончатої хроматографії(МеОН у 3% / СН2СІ 2), продукт очищають та відновлюють у діетиловому ефірі, фільтрують і висушують, що веде до одержання 120мг(58%) бажаної сполуки у вигляді твердого тіла блідножовтого кольору з точкою плавлення 163 166°С. NMR-1Н(CDCI 3): 0.93(t, 3Н); 2.2(m, 2Н); 3.05(dd, 2H); 3.49(s, 3Н); 3,62(s, 3Н); 4.93(s, 2Н); 5.22(d, 2Н); 5.52(s, 1H); 7.21(s, 1H); 7,62(t, 1H); 7.81(t, 1H); 7.91(d, 1H); 8.22(d, 1H); 8.36(s, 1H). NMR С13(CDCI 3): 7.74; 35.54; 46,82; 50.15; 51.67; 58.10; 65.33; 78.03, 100.17; 125.57; 127.70; 128.04; 128.10; 128.35; 129.53; 130.39; 130.94; 143.87; 148.75; 152.94; 157.83; 161.74; 171.35. IR(KBr): 1207; 1595; 2655; 1709. Приклад 6: eтил-β-етил-α,α-дифторо-β-гідрокси-γ-(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)пропіонат Приблизно половину загальної кількості етил бромфторацетату(1,8мл, 14мМ), 8-формілоксиметил-7пропіоніліндолізіно [1,2-b]хінолін-9(11Н)-ону(2,0г, 5,75мМ), одержаного, як це описано у Прикладі 16, у суспензії з безводним ТГФ(тетрагідрофуран) (10мл) додають крапля за краплею у атмосфері аргону до суспензії цинку(1,25г, 17,2мМ) у безводному ТГФ у стані флегми(40мл), далі додають залишкову частину етил бромфторацетату. Реакційну суміш підтримують у стані флегми протягом ще однієї півгодини. Після охолодженння до температури навколишнього середовища реакцію припиняють через додавання насиченого водного хлористого амонію(20мл) і реакційну суміш екстрагують за допомогою дихлорметану(3 х 20мл). Комбіновані органічні екстракти висушують та концентрують. Осад регенерують у діетиловому ефірі(10мл), фільтрують і очищають за допомогою колончатої хроматографії(SiO2, CH2CI 2/MeOH 98/2), що веде до одержання 664мг бажаної сполуки(26%) у вигляді твердого тіла жовтого кольору з точкою плавлення 208 - 209°С. NMR-1Н(CDCl3): 0.91(t, 3Н); 1.38(t, 3Н); 2.32(m, 2Н); 4.8(se, 1H); 4.38(q, 2H); 5.09(d, 2H); 5.13(dd, 2H); 7.42(s, 1H); 7.55(t, 1H); 7.72(t, 1H); 7.79(d, 1H); 8.08(d, 1H); 8.22(s, 1H) NMR С13(CDCI 3): 6.97; 13.93; 28.63; 50.18; 56.27; 63.15; 77.20; 81.96(t); 101.27; 116.40(t); 127.67; 127.77; 127.97;,128.31; 129.26; 130.33; 130.94; 131.23; 143.16; 148.34; 150.20; 151.91; 161.21; 163.21(t) IR(KBr): 1124; 1308; 1591; 1647; 1748. Приклад 7; етил-β-етил-β-гідрокси-у-(8 гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b] хінолін-7-іл)-пропіонат Суспензію цинку(1,25г, 19,1мМ)-8-метил-7-пропіоніліндолізіно[1,2-b]хінолін-9-(11Н)-ону(500мг, 1,43мМ), таку, яку одержав Кінгсбері [Kingsbury W. D., Tetrahedron Lett. 29: 6847(1988)], та ацетат срібла(250мг, 1,50мМ) у безводному тетрагідрофурані(10мл) перемішують при температурі навколишнього середовища у атмосфері аргону. Після 10 хвилин реакційну суміш активують через додавання крапля за краплею молярного розчину хлородіетилалюмінію(10мл, 10мМ), після чого крапля за краплею додають етил бромацетат(1,25мл, 11,3мМ) та одержану суміш витримують для проведення реакції протягом 5 годин. Реакцію припиняють через послідовне додавання етилового спирту(10мл) та насиченого розчину тартрату калію і натрію(10л). Одержану суміш знову перемішують протягом однієї години, фільтрують і концентрують при зменшеному тиску. Осад відновлюють у дихлорметані(10мл), промивають водою, висушують, концентрують і очищають за допомогою колончатої хроматографії(SiO2, CH2CI 2/MeOH 98/2), що веде до одержання 93мг бажаної сполуки(15%) у вигляді твердого тіла блідножовтого кольору з точкою плавлення 185 - 188°С. NMR-1Н(CDCI 3): 0.91(t, 3Н); 1.17(t, 3Н); 1.99(m, 2Н); 2.49(s, 3H); 3.10(dd, 2Н); 4.11(q, 2Н); 4.6(se. 1Н) 5.25(s, 2Н); 7.65(t, 1Н); 7.67(s, 1H); 7.80(t, 1H); 7.90(d, 1H); 8.22(d, 1H); 8.34(s, 1H). NMR С13(CDCl3): 8.02; 13.99; 14.72; 33.14; 43.97; 50.02; 61.0; 76.54; 101.90; 127.65; 127.84; 128.08; 128.81; 128.88; 130.74; 131.59; 131.65; 140.33; 147.64; 152.96; 153.61; 162.11; 172.91. IR(KBr): 762; 1192; 1576; 1653; 1740. Приклад 8: tert-бутил β-етил-β-гідрокси-γ-(8 гідроксиметил-9-оксо(11H)-індолізіно-[1,2-b]хінолін-7-іл)-пропіонат Оцтовий ангідрид(70мкл, 0,7мМ) крапля за краплею додають до розчину tert-бутил β-етил β-гідрокси-γ(8-гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)-пропіонату(200мг, 0,46мМ) і триетиламіну(140мкл, 1мМ) у дихлорметані(5мл) та одержану суміш перемішують при температурі навколишнього середовища протягом 21 години. Летючі сполуки випарюють і осад очищають за допомогою силікагелевої хроматографії(1 - 2% МЕОН/СН2Сl2, що веде до одержання 152мг бажаної сполуки у вигляді твердого тіла жовтого кольору з т. п. 195 - 196°С. NMR-1Н(CDCI 3): 0.88(t, 3Н); 1.32(s, 9Н); 1.93(m, 2Н); 2.07(s, 3Н); 2.97(dd, 2H); 4.8(se, 1H); 5.28(s, 2H); 5.59(dd, 2H); 7.39(s, 1H); 7.63(t, 1H); 7.80(t, 1H); 7.90(d, 1H); 8.23(d, 1H); 8.34(s, 1H). NMR C13(CDCl3): 8.02; 21.06; 27.91; 35.05; 45.58; 50.16; 59.23; 77.52; 82.26; 100.59; 124.21; 127.91; 128.10; 128.14; 128.97; 129.18; 130.68; 131.46; 142.85; 148.29; 152.43; 158.49; 161.83; 171.13; 171.90. Приклад 9: 5,12-діетил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку виготовляють аналогічно способу, що описаний у Прикладі 1, за винятком того, що на етапі 1а замість камптотецину використовують 7-етил камптотецин [Sawada et al., Chem. Pharm. Bull. 39: 2574(1991)]. Бажану сполуку одержують у вигляді твердого тіла яскравого жовтого кольору з т. п., що перевершує 270°С. NMR-1H(DMSO): 0.92(t, 3Н); 1.39(t, 3Н); 1.93(q, 2Н); 3.08(d, 2H); 3.25(q, 2Н); 3.51(d, 2Н); 5.32(s, 2Н); 5.52(dd, 2Н); 7.42(s, 1Н); 7.76(t, 1H); 7.89(t, 1H); 8.18(d, 1H); 8.32(d, 1H). NMR C13(DMSO): 8.46; 14.15; 22.42; 36.50; 42.54; 49.95; 61.45; 73.35; 99.68; 122.61; 124.27; 126.76; 127.70; 128.27; 129.92; 130.18; 145.17; 145.82; 148.57; 152.15; 155.89; 159.26; 172.08. Приклад 10: β-етил-γ-(12-етил-8-гідроксиметил-9-оксо(11Р)-індолізіно-[1,2-b]хінолін-7-іл)-β-гідрокси-пропіонова кислота Цю сполуку одержують аналогічно способу, що описаний у Прикладі 4, за винятком того, що замість 5етил-4,5дигідро-5-гідрокси-1Н-оксепіно [3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діону використовують 5,12-діетил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон. Бажану сполуку одержують у вигляді твердого тіла трохи не зовсім білого кольору з т. п. 238 - 239°С NMR-1Н(DMSO): 0.82(t, 3Н); 1.35(t, 3Н); 2.01(m, 2H); 2.85(d, 2H); 3.18(d,2H); 3.22(q, 2H); 4.81(s 2Н); 5.00(se, 1H); 5.24(s, 2H); 5.78(se, 1H); 7.38(s, 1H); 7.77(t, 1H); 7.86(t, 1H); 8.18(d, 1H); 8.28(d, 1H); 12.10(se, 1H). NMR C13(DMSO): 8.12; 14.15; 22.41; 34.78; 46.74; 49.65; 55.71; 76.51; 100.04; 124.22; 126.63; 127.48; 128.12; 128.21; 129.94; 130.02; 143.10; 11; 148.69; 152.62; 156.03; 161.22; 172.22. Приклад 11: 8-етил-2,3,8,9-тетрагідро-8-гідрокси-10Н-[1,4]діоксино[2,3-g]оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін10,13(15Н)-діон 11а 2-етил-2-(2-метокси-4-піридил)-1,3-діоксолан(F) Воду азеотропно переганяють протягом однієї ночі за допомогою приладу Dean Stark із суміші 2-хлоро4-пропіонілпіридину(10г, 59мМ), яку одержують згідно з [Lamattina J. L. Heterocyclic Chem. 20, p. 553(1983)], етиленгліколю, р-толуолсульфокислоти(250мг) у толуолі(150мл). Далі розчинник видаляють при зменшеному тиску, кислоту нейтралізують за допомогою насиченого водного бікарбонату(100мл) і продукт екстрагують, використовуючи ефір. Комбіновані ефіризовані екстракти промивають сольовим розчином, висушують на сульфаті натрію та випарюють, що веде до одержання 13,3г(96%) неочищеного продукту, захищеного карбоніловою групою, який приводять до стану флегми за допомогою 3 еквівалентів метоксиду натрію у ацетонітрилі до закінчення реакції, що контролюється за допомогою тонкошарової хроматографії: SiO2 tert-бутил метилоксид/гексан (ТБМО/ГК) 50/50. Далі розчин ацетонітрилу фільтрують та випарюють. Осад відновлюють у ефірі, промивають водою та сольовим розчином, висушують на сульфаті натрію та випарюють, що веде до одержання олії коричневого кольору, яку переганяють при температурі 70 - 75°С і тиску 0,04мбар; 10,7г(загальне повернення 81%) продукту(F) відновлюють у вигляді прозорої рідини. 11б 2-етил-2-(3-гідроксиметил-2-метокси-4-піридил)-1,3-діоксолан(G) tert-бутиллітій(1,7М у пентані, 100мл, 170мМ) додають крапля за краплею за допомогою піпетки до розчину броммесітилену(13мл, 85мМ) у безводному тетрагідрофурані(300мл) при температурі -78°С у атмосфері аргону. Одержаний осад білого кольору перемішують при температурі -78°С протягом однієї години, далі додають 2-етил-2-(2-метокси-4-піридил)-1,3-діоксолан(10г, 44,8мМ) та реакційну суміш перемішують протягом 15 хвилин при температурі -78°С, 1 годину при 0°С та 1 годину при температурі навколишнього середовища. Після другого охолодження до -78°С додають безводний N,Nдиметилформамід(100мМ) та реакційну суміш витримують з метою повторного нагріву до температури навколишнього середовища, а далі перемішують протягом 16 годин, після чого аналізують за допомогою тонкошарової хроматографії SiO2, tert-бутил метилоксид/гексан(ТБМО/ГК) 50/50 з повною витратою початкової сполуки. Реакцію припиняють за допомогою насиченого хлориду амонію та реакційну суміш екстрагують діетиловим ефіром(200мл, 50мл, 50мл). Комбіновані екстракти висушують на сульфаті натрію та випарюють для одержання олії жовтого кольору, яку очищають за допомогою колончатої хроматографії(SiO2, ТБМО/ГК: 0/100 до 5/95 для вимивання похідних мезітилену, потім 20/80 до 50/50 для вимивання продукту) для одержання проміжного альдегіду(7г). Зазначений альдегід розчинюють у метанолі(100мл) та обробляють борогідридом натрію(5г, 132мМ) і одержану суміш перемішують до повної витрати проміжного альдегіду(приблизно 1 годину) шляхом аналітичного визначення за допомогою тонкошарової хроматографії. Потім розчинник випарюють, осад відновлюють у ефірі, промивають водою та сольовим розчином, висушують, а розчинник випарюють. За допомогою колончатої хроматографії(SiO2, ТБМО/ГК 10/90 до 50/50) осаду одержують 7г(загальне повернення 62%) продукту(G) у вигляді олії жовтого кольору. 11в 2-(3-бензилоксиметил-2-метокси-4-піридил)-2-етил-1,3-діоксолан(H) Розчин 2-етил-2-(3-гідроксиметил-2-метокси-4-піридил)-1,3-діоксолану(7г, 30мМ) та хлористого бензилу(5мл, 45мМ) у безводному тетрагідрофурані(150мл) крапля за краплею додають до суспензії гідриду натрію(80% у мінеральній олії, 1,85г, 61мМ) у безводному тетрагідрофурані(100мл) та реакційну суміш підтримують у стані флегми протягом 16 годин. Далі реакційну суміш витримують з метою охолодження до температури навколишнього середовища, після чого реакцію припиняють за допомогою води(50мл) та реакційну суміш концентрують при зменшеному тиску. Осад розчинюють у діетиловому ефіру(150мл) та промивають водою і сольовим розчином, висушують і випарюють. Очищення за допомогою колончатої хроматографії(SiO2, ТБМО/ГК; від 5/95 до 20/80) веде до одержання 9г(87%) продукту, захищеного бензилом(H), у вигляді прозорої олії. 11г 1-(3-бензилоксиметил-2-метокси-4-піридил)-пропан-1-он(І') 2-(3-бензилоксиметил-2-метокси-4-піридил)-2-етил-1,3-діоксолан(9г, 27мМ) обробляють трифтороцтовою кислотою(10мл) та водою(5мл) у тепловій бані при температурі 120°С протягом 3 годин. Реакційну суміш концентрують при зменшеному тиску і залишкові сліди кислоти нейтралізують через додавання насиченого водного бікарбонату натрію. Подальше екстрагування ефіром виконують за допомогою колончатої хроматографії(SiO2, ТБМО/ГК; 10/90) для одержання 5,5г(70%) продукту(І). 11е tert-бутил β-етил-β-гідрокси-γ-(3-бензилоксиметил-2-метокси-4-піридил) пропіонат tert-бутил бромацетат(13мл, 80мМ) крапля за краплею додають до суспензії цинку(5,3г, 80мМ, активованого через оброблення 6N НСІ протягом 10 секунд, а далі послідовно промивають водою до одержання нейтрального pH, ацетоном та діетиловим ефіром) у безводному тетрафурані(60мл) за умовами флегми. Реакційне середовище витримують за умовами флегми ще 10 хвилин, після чого припиняють додавання. Додають розчин 1-(3-бензилоксиметил-2-метокси-4-піридил)-пропан-1-ону(5,8г, 20мМ) у безводному тетрафурані та реакційну суміш перемішують у стані флегми протягом ще однієї години. Реакцію припиняють при 0°С за допомогою насиченого водного хлориду амонію(100мл) та реакційну суміш екстрагують діетиловим ефіром. Комбіновані екстракти висушують на сульфаті натрію та випарюють, одержуючи при цьому олію жовтого кольору, яку очищають за допомогою колончатої хроматографії(SiO2, ТБМО/ГК; 5/95 до 10/90), для одержання tert-бутилового ефіру(J) (7г, 95%) у вигляді прозорої олії. 11ж tert-бутил β-етил-β-гідрокси-γ-(3-гідроксиметил-2-метокси-4-піридил) пропіонат tert-бутил β-етил-β-гідрокси-γ-(3-гідроксиметил-2-метокси-4-піридил)пропіонат(1г, 2,5мМ) гідрогенізують при атмосферному тиску і температурі навколишнього середовища, використовуючи 5% паладію на активованому вугіллі як каталізатор(50мг) та чистий етанол як розчинник(10мл). Одразу ж після закінчення реакції(6 годин) каталізатор відділяють через фільтрацію, а розчинник випарюють, що веде до одержання 0,7г(90%) продукту(К) достатньої чистоти для подальшого реакційного використання для синтезу. 11з 5-етил-1,5-дигідро-5-гідрокси-9-метокси-оксепіно[3,4-с]піридин-3(4Н)-он(L) tert-бутил β-етил-β-гідрокси-γ-(3-гідроксиметил-2-метокси-4-піридил)пропіонат(8,8г, 28мМ) обробляють трифтороцтовою кислотою(30мл) протягом 3 годин при температурі навколишнього середовища. Летючі компоненти випарюють, а залишок очищають за допомогою колончатої хроматографії(SiO2, СН2СІ 2/МеОН; 100/0 до 98/2) для одержання прозорої олії, яка після оброблення толуолом дає 5,9г продукту(L) у вигляді кристалів білого кольору з т. п. 97°С. 11и 5-етил-1,5-дигідро-5-гідрокси-оксепіно[3,4-с]піридин-3,9(4Н,8Н)-діон(М) 1N соляну кислоту(20мл) та 5-етил-1,5-дигідро-5-гідрокси-9-метокси-оксепіно[3,4-с] піридин-3(4Н)он(0,5г, 2,1мМ) нагрівають до стану флегми протягом 9 годин. Реакційну суміш концентрують під тиском і осад знову висушують через дворазове додавання і випарювання толуолу, далі витримують протягом усієї ночі при зменшеному тиску у присутності пентоксиду фосфору. Одержану олію розчинюють у безводному ацетонітрилі(5мл) і перемішують у атмосфері аргону протягом 24 годин. Осад фільтрують та висушують, що веде до одержання 0,23г(49%) твердого тіла білого кольору(М) з т. п. 118 - 119°С. 11к 6,7-етилендіокси-2-йодо-3-хінолін-метанол(N) Використовують процедури, що описані у [Meth-Cohn et. al., J. Chem. Soc. Perkin Trans. I, p., 1520(1981), Meth-Cohn et. al., J. Chem. Soc. Perkin Trans. I, p. 2509(1981); і Nakasimhan et al., J. Am. Chem. Soc. 112, p. 4431(1990)]. 3,4-етилендіоксиацетанілід(22г, 113мМ) додають до реактиву Вілсмейєра(Vilsmeyer), одержаному через додавання крапля за краплею оксихлориду фосфорилу(71мл, 0,77мМ) до безводного диметилформаміду(23мл, 0,28мМ), охолоджують у бані з льодовою водою протягом 0,5 години у атмосфері аргону. Одержану суміш нагрівають до 75°С протягом 16 годин. Після охолодження до температури навколишнього середовища реакційну суміш додають до суміші льоду та води(300мл) та екстрагують за допомогою дихлорметану(5 х 200мл). Комбіновані органічні екстракти висушують на сульфаті натрію, фільтрують і концентрують. Твердий осад розміщують у суспензії у дихлорметані(20мл), фільтрують та висушують при зменшеному тиску, що веде до одержання 10г(35%) 2хлоро-6,7-етилендіоксихінолін-3-карбалдегіду у вигляді твердого тіла жовтого кольору з т. п. 222 - 224°С. Цю проміжну речовину обробляють йодидом натрію(30г, 0,2мМ) та концентрованою соляною кислотою(1,5мл) у ацетонітрилі у стані флегми(150мл) протягом 24 годин. Після охолодження до температури навколишнього середовища розчинник видаляють при зменшеному тиску та залишок відновлюють у 50% водному тетрагідрофурані(200мл), фільтрують, промивають тетрагідрофураном і висушують при зменшеному тиску, що веде до одержання 12г 6,7-діоксиетилен-2-йодохінолін-3карбалдегіду у вигляді твердого тіла жовтого кольору з т. п. 155 - 157°С. Вищенаведену проміжну сполуку обробляють борогідридом натрію(2г, 52мМ) у метанолі(200мл) при температурі навколишнього середовища протягом 0,5 години. Розчинник видаляють при зменшеному тиску, а залишок відновлюють у воді та фільтрують. Одержане тверде тіло висушують при зменшеному тиску у присутності пентоксиду фосфору для одержання 11г 6,7-етилендіокси-2-йодохінолін-3-іл-метанолу у вигляді твердого тіла жовтого кольору з т. п. 178 - 180°С. 11л 5-етил-8-(6,7-діоксиетилен-2-йодо-3-хінолінметил)-1,5-дигідро-5-гідрокси-оксепіно[3,4-с]піридин3,9(4Н,8Н)-діон(О) Діетил азодикарбоксилат(570мкл, 3,6мМ) крапля за краплею додають протягом більше 5 хвилин до розчину 5-етил-1,5-дигідро-5-гідрокси-оксепіно[3,4-с]піридин-3,9(4Н, 8Н)-діону(400мг, 1,79мМ), сполуки, одержаної на попередньому етапі 11к(770мг, 2,23мМ) та трифенілфосфіну(934мг, 3,58мМ) у суміші безводного ТГФ/ДМСО(при об'ємному співвідношенні 8 : 1,45мл) та одержану суміш перемішують у атмосфері аргону при температурі навколишнього середовища протягом 16 годин. Далі реакційну суміш концентрують при зменшеному тиску і осад розчиняють у хлороформі(100мл). Одержаний розчин промивають сольовим розчином(4 х 50мл), висушують на сульфаті натрію та випарюють. Осад очищають за допомогою колончатої хроматографії(SiO2, СН2СІ 2/МеОН; 99/1 до 98/2), одержуючи 650мг(66%) продукту(О) у вигляді твердого тіла білого кольору з т. п. 165 - 167°С. 11м 8-етил-2,3,8,9-тетрагідро-8-гідрокси-10Н, 12Н-[1,4]діоксино[2,3-д]оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-10,13(15Н)-діон 5-етил-8-(6,7-етилендіокси-2-йодохінолін-3-іл)метил-4,5-дигідро-5-гідрокси-(1Н,3Н)окceпінo[3,4с]піридин-3-діон(600мг, 1,1мМ), бромід тетрабутиламонію(352г, 1,1мМ), ацетат натрію(359мг, 4,4мМ) і ацетат паладію II(98мг, 0,43мМ) розчиняють у безводному ацетонітрилі(40мл) та нагрівають до 90°С у атмосфері аргону протягом 16 годин. Після охолодження до температури навколишнього середовища із розчину червонуватого кольору видаляють осад білого кольору. Цей осад фільтрують та висушують при зменшеному тиску. Неочищений продукт кладуть у суспензію у воді, фільтрують та висушують при зменшеному тиску на пентоксиді фосфору, одержуючи 250мг бажаної сполуки у вигляді твердого тіла ясножовтого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.91(t, 3Н); 1.87(га, 2Н); 3.08(d, 1Н); 3.51(d, 1Н); 4.45(8,2Н); 5.19(s, 2H); 5.47(dd, 2Н); 6.02(se, 1Н); 7.33(s, 1H); 7.54(s, 1H); 7.55(s, 1H); 8.43(s, 1H). NMR-C13(DMSO): 8.43; 36.47; 42.54; 50.52; 61.43; 64.43(2C); 73.31; 99.07; 112.27; 113.14; 122.00; 124.24; 128.18; 129.74; 144.59; 145.01; 145.33; 147.63; 150.88; 155.88; 159.23; 172.07. Приклад 12: 10-бензилокси-5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)діон 12а (6-бензилокси-2-йодо-3-хінолін) метанол Цю сполуку готують способом, аналогічним способу, що застосований на етапі 11к Прикладу 11, але замість 3,4-етилендіоксиацетаніліду використовують 4-бензилоксиацетанілід. Очищення за допомогою колончатої хроматографії на силікагелі та використання дихлорметану як елюенту потрібно для видалення(8% повернення) з достатньою чистотою проміжного 6-бензилокси-2-хлорхінолін-3-карбалдегіду з т. п. 180 - 182°С. Далі, обмін подальшого відновлення галогену до борогідриду натрію веде до одержання(6-бензилокси-2-йодохінолін-3-іл)метанолу з т. п. 147 - 149°С. 12б 8-(6-бензилокси-2-йодо-3-хінолінметил)-1,5-дигідрокси-5-етил-5-гідрокси-оксепіно[3,4-с]піридин3,9(4Н, 8Н)-діон Цю сполуку одержують, способом, аналогічним способу, що застосований на етапі 11к Прикладу 11, але замість 6,7-етилендіокси-2-йодохінолін-3-іл)-метанолу використовують(6-бензилокси-2-йодохінолін-3іл)метанол. Ця сполука має вигляд твердого тіла білого кольору з т. п. 197 - 199°С. 12в 10-бензилокси-5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку готують способом, аналогічним способу, що застосований на етапі 11к Прикладу 11, але замість 5-етил-8-(6,7-етилендіокси-2-йодохінолін-3-іл)метил-4,5дигідро-5-гідрокси-(1Н, 3Н)оксепіно[3,4-с] піридин-3-діону використовують-8-(6-бензилокси-2-йодо-3-хінолінметил)-1,5-дигідрокси-5-етил-5-гідроксиоксепіно[3,4-с]піридин-3,9(4Н, 8Н)-діон. Бажана сполука має вигляд твердого тіла ясножовтого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.90(t, 3Н); 1.85(m, 2Н); 3.08(d, 1H); 3.50(d, 1H); 5.25(s, 2H); 5.30(s, 2H); 5.50(dd, 2H); 6.05(s, 1H); 7.30 - 7.70(m, 8H); 8.10(d, 1H); 8.55(s. 1H). NMR-C13(DMSO): 8.43; 36.48; 38.28; 50.65; 61.42; 70.00; 73.32; 99.05; 107.71; 122.05; 123.42; 128.18; 128.26; 128.70; 129.40; 130.19; 130.48; 130.63; 136.65; 144.18; 144.90; 150.53; 155.91; 157.31; 159.24; 172.06. Приклад 13 γ-(12-бензилокси-8гідроксиметил-9-оксо(11Н)-індолізіно-[1,2-b]хінолін-7-іл)-β-етил-β-гідроксипропіонова кислота(E) Цю сполуку готують способом, аналогічним способу, що застосований у Прикладі 4, але замість 5етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діону використовують 10-бензилокси-5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон. Зазначена сполука має вигляд твердого тіла жовтого кольору, т. п. 171 - 173°С. NMR-1H(DMSO): 0.80(t, 3Н); 2.00(m, 2Н); 2.85(d, 1H); 3.15(d, 1H); 4.80(s, 2H); 5.25(s, 2H); 5.30(s, 2H); 5.75(se, 1H); 7.30(s, 1H); 7.35 - 7.70(m, 7H); 8.10(d, 1H); 8.55(s, 1H). NMR-C13(DMSO): 8.11; 34.75; 46.68; 50.35; 55.70; 69.97; 76.51; 99.45; 107.78; 123.28; 127.64; 128.18(2C); 128.26; 128.70(2C); 129.33; 130.17; 130.47; 130.57; 136.69; 142.79; 144.17; 150.93; 156.03; 157.19; 161.20. Приклад 14 5-етил-4,5дигідро-5,10-дигідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон. 10-бензилокси-5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)діон(370г, 0,79мМ) обробляють воднем при атмосферному тиску та температурі навколишнього середовища, використовуючи 10% паладію на активованому вугіллі як каталізатор(60мг) і трифтороцтову кислоту як розчинник(15мл). Одразу ж після закінчення реакції(16 годин) до реакційної суміші додають дихлорметан(50мл) і метанол(50мл), каталізатор відфільтровують, а летючі компоненти випарюють при зменшеному тиску, що дозволяє одержати бажану сполуку у неочищеній формі, яка містить сліди трифтороцтової кислоти. Зазначені сліди видаляють через сумісну перегонку за допомогою 1,4-діоксану. Одержаний продукт становить собою тверде тіло оранжевого кольору з т. п. 150°С(d), який має чистоту, достатню для подальшого реакційного використання. NMR-1H(DMSO): 0.89(t, 3H); 1.85(q, 2H); 3.02(d, 1H); 3.45(d, 1H); 5.19(s, 2H); 5.37(d, 1H); 5.50(d. 1H); 5.98(se, 1H); 7.26(s, 1H); 7.31(s, 1H); 7.40(d, 1H); 8.00(d, 1H); 8.42(s, 1H); 10.32(s, 1H). NMR-C13(DMSO): 8.47; 36.50; 42.61; 50.57; 61.46; 73.35; 98.84; 109.02; 121.83; 123.18; 129.50; 129.85; 130.12; 130.80; 143.39; 145.10; 149.69; 155.97; 156.82; 159.30; 172.11. Приклад 15 11-(диметиламіно)метил-5-етил-4,5дигідро-5,10-дигідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон. 15а 11-(диметиламіно)метил-5-етил-4,5дигідро-5,10-дигідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон. Суспензію 10-бензилокси-5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4Н, 13Н)-діону(260г, 0,69мМ) у оцтовій кислоті(15мл) обробляють 37% водного формальдегіду(500мкл) і 40% водного диметиламіну(500мкл) та одержану суміш перемішують при температурі навколишнього середовища протягом 16 годин. Реакційну суміш концентрують до сухості, а залишок очищають за допомогою колончатої хроматографії(SiO2, СН2СІ 2/МеОН;.100/0 до 90/10), з подальшою кристалізацією за допомогою ацетонітрилу, одержуючи 102мг бажаної сполуки. 15б 11-(диметиламіно)метил-5-етил-4,5 игідро-5,10-дигідрокси-1Н-оксепіно[3',4': 6,7]-індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон хлоргідрат Розведену соляну кислоту(1N) крапля за краплею додають до суспензії 11-(диметиламіно)метил-5етил-4,5дигідро-5,10-дигідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діону(102мг) у воді до повного розчинення. Воду випарюють при зменшеному тиску, а залишок кладуть у суспензію у ацетонітрил(5мл) та фільтрують, одержуючи 103мг бажаної солі, т. п. 248°С(d). NMR-1H(DMSO): 0.88(t, 3Н); 1.85(m,2H); 2.84(s, 6Н); 3.08(d, 1H); 3.5(d, 1H); 4.73(s, 2H); 5.47(dd, 2H); 7.33(s, 1H); 7.38(s, 1H); 7.72(d, 1H); 8.19(d, 1H); 8.99(s, 1H); 9.92(se, 1H); 11.45(s, 1H) NMR-C13(DMSO): 8.46; 34.36; 42.44(3C; 50.61(2C); 61.42; 73.35; 99.19; 108.63; 122.21; 122.36; 126.86; 129.13; 130.61; 133.09; 143.53; 144.70; 149.76; 155.98; 157.17; 159.27; 172.06. Приклад 16: 5-етил-9-фторо-4,5дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із 3-фторо-4-метоксианіліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.89(t, 3H); 1.85(q, 2H); 3.08(d, 1H); 3.49(d, 1H); 4.00(s, 3H); 5.25(s, 2H); 5.39(d, 1H); 5.51(d, 1H); 6.00(s, 1H); 7.32(s, 1H); 7.72(d, 1H); 7.91(d, 1H); 8.58(s, 1H). NMR-C13(DMSO): 8.43; 36.48; 42.51; 50.68; 56.60; 61.42; 73.29; 99.25; 108.68; 113.52; 122.23; 126.33; 129.99; 130.30; 143.79; 144.70; 148 42; 151.18; 153.19; 155.81; 159.20; 172.06. IR(KBr): 1259; 1503; 1602; 1737. Приклад 17: 9-хлоро-5-етил-4,5дигідро-5-гідрокси-10-метил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із 3-хлоро-4-метоксианіліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1Н(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 2.55(s, 3Н); 3.07(d, 1H); 3 45(d, 1Н); 5.25(s, 2Н); 5.39(d, 1Н); 5.51(d, 1Н); 6.05(s, 1Н); 7.39(s, 1H); 8.10(s, 1Н); 8.20(s, 1H); 8.60(s, 1H). NMR-C13(DMSO): 8.43; 20.20; 36.47; 42.49; 50.67; 61.41; 73.28; 99 87; 122.82; 126.98; 127.99; 129.60; 130.53; 131.08; 135.64; 136.56; 144.39; 147.11; 153.10; 155.85; 159.18; 172.03. IR(KBr): 1208; 1479; 1606; 1656; 1724. Приклад 18: 5-етил-9,10-дифторо-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)діон Цю сполуку одержують із 3,4-дифтороаніліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1H); 3.47(d, 1H); 5.25(s, 2H); 5.39(d, 1H); 5.51(d, 1H); 6.05(s, 1H); 7.39(s, 1H); 8.15(q, 1H); 8.25(q, 1H); 8.68(q, 1H). NMR-C13(DMSO): 8.41; 36.45; 42.48; 50.68; 61.40; 73.25; 99.92; 114.14; 115.42; 115.58; 122.96; 125.52; 130.56; 131.46; 144.21; 145.25; 142.36; 153.41; 155.85; 159.15; 172.00 IR(KBr): 1266; 1512; 1581; 1618; 1751. Приклад 19: 7-етил-7,8-дигідро-7-гідрокси-9Н,11Н-[1,3]діоксоло[4,5-g]оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін9,12(14Н)-діон Цю сполуку одержують із 3,4-метилендіоксианіліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло бежевого кольору з т. п. більше 250°С. NMR-1Н(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1Н); 3.45(d, 1H); 5.20(s, 2Н); 5.39(d, 1Н); 5.51(d, 1Н); 6.00(s, 1H); 6.30(s, 1Н); 7.30(s, 1H); 7.49(d, 2H); 8.45(s, 1H). NMR-C13(DMSO): 8.43; 36.49; 42.56; 50.58; 61.42; 73.31; 98.87; 102.75; 103.33; 104.92; 121.76; 125.74; 128.59; 130.33; 145.08; 146.69; 148.78; 150.19; 151.49; 155.90; 159.24; 172.08. IR(KBr): 1248; 1459; 1606; 1731 Приклад 20: 9-хлоро-5-етил-4,5дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із 3-хлоро-4-метоксианіліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло білого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1H); 3.45(d, 1H); 4.01(s, 3H); 5.22(s, 2H); 5.39(d, 1H); 5.51(d, 1H); 6.02(s, 1H); 7.31(s, 1H); 7.68(s, 1H); 8.20(s, 1H); 8.55(s, 1H). NMR-C13(DMSO): 8.82; 36.27; 42.30; 50.48; 56.69; 61.23; 73.08; 99.16;, 107.44; 122.16; 127.12; 128.12; 128.25; 130.02; 130.53; 143.29; 144.37; 151.12; 153.29; 155.71; 158.98; 171.84. IR(Kbr): 1056; 1256; 1483; 1592; 1657; 1747 Приклад 21: 5-етил-4,5дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із 4-метоксианіліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1H); 3.45(d, 1H); 3.95(s, 3Н); 5.28(s, 2H); 5.40(d, 1H); 5.51(d, 1H); 6.00(s, 1H); 7.38(s, 1H); 7.51(d, 2H); 8.07(d, 1H); 8.55(s, 1H). NMR-C13(DMSO): 8.45;. 36.48; 42.51; 50.64; 55.92; 61.42; 73.33; 93.01; 106.49; 122.02; 123.19; 129.59; 130.20; 130.43; 144.17; 144.94; 150.40; 155.92; 158.31; 159.26; 172.07. IR(Kbr): 1251; 1604; 1655; 1735 Приклад 22: 9,11-дихлоро-5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)діон Цю сполуку одержують із 3,5-дихлороаніліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1Н(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1H); 3.45(d, 1H); 5.30(s, 2H); 5.41(d, 1H); 5.55(d, 1H); 6.08(s, 1H); 7.41(s, 1H); 8.05(s, 1H); 8.21(s, 1H); 8.91(s, 1H). NMR-C13(DMSO): 8.35; 36.45; 42.51; 51.03; 61.39; 73.25; 100.62; 123.55; 124.63; 127.60; 128.08; 128.56; 132.06; 132.19; 134.53; 143.77; 148.80; 154.88; 155.82; 159.13; 171.98. IR(KBr): 1064; 1275; 1586; 1651; 1743. Приклад 23: 5-етил-9-фторо-4,5дигідро-5-гідрокси-10-метил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із 3-фторо-4-метиланіліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.89(t, 3Н); 1.85(q, 2Н); 2.49(s, 3Н); 3.08(d, 1H); 3.49(d, 1H); 5.21(s, 2H); 5.39(d, 1H); 5.51(d, 1H); 6.05(s, 1H); 7.39(s, 1H); 7.87(d, 1H); 8.05(d, 1H); 8.61(s, 1H). NMR-C13(DMSO): 8.40; 15.14; 36.45; 42.52; 50.60; 61.41; 73.28; 99.71; 112.00; 122.66; 125.38; 127.66; 129.59; 130.28; 144.49; 147.88; 152.88; 155.85; 159.18; 162.25; 172.02. IR(KBr): 1054; 1580; 1651; 1760. Приклад 24: 5-етил-10-фторо-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із 4-фтороаніліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло білого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1H); 3.45(d, 1H); 5.29(s, 2H); 5.39(d, 1H); 5.55(d, 1H); 6.30(s, 1H); 7.39(s, 1H); 7.80(q, 1H); 7.99(q, 1H); 8.23(q, 1H); 8.68(s, 1H). NMR-C13(DMSO): 8.40; 36.46; 42.48; 50.66; 61.41; 73.31; 99.68; 111.83; 122.75; 128.93; 130.93; 131.22; 131.93; 144.46; 145.27; 152.60; 155.89; 159.21; 172.04. IR(KBr): 1209; 1589; 1659; 1739 Приклад 25: 10-хлоро-5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із 4-хлороаніліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1Н(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1H); 3.47(d, 1H); 5.251(s, 2Н); 5.39(d, 1Н); 5.51(d, 1H); 6.05(s, 1H); 7.39(s, 1H); 7.89(d, 1H); 8.19(d, 1H); 8.29(s, 1H); 8.67(s, 1H). NMR-C13(DMSO): 8.40; 36.46; 42.48; 50.70; 61.42; 73.31; 100.00; 122.96; 1127.31' 127.42; 128.87; 131.11; 132.12; 144.34; 146.53; 153.38; 155.88; 159.20; 172.04 IR(KBr): 1069; 1483; 1606; 1741. Приклад 26: 10-хлоро-5-етил-9-фторо-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4H, 13Н)-діон Цю сполуку одержують із 4-хлоро-3-фтороаніліну згідно з методом, який описаний у Прикладі 11, етапи к, л та м. Одержують тверде тіло жовтого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.85(t, 3Н); 1.85(q, 2Н); 3.07(d, 1H); 3.45(d, 1H); 5.25(S.2H); 5.39(d, 1H); 5.51(d, 1H); 6.05(s, 1H); 7.40(s, 1H); 8.20(d, 1H); 8.40(d, 1H); 8.68(s, 1H) NMR-C13(DMSO): 8.38; 36.47; 42.58; 50.71; 61.40; 73.26; 99.99; 133.59; 123.09; 124.28; 127.74; 130.64; 131.31; 144.13; 145.08; 153.57; 154.13; 155.84; 156.61; 159.14; 172.00. IR(KBr): 1488; 1583; 1655; 1743. Приклад 27: 5,12-діетил-4,5дигідро-5,10-дигідрокси-11-морфолінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон Цю сполуку одержують із морфоліну згідно з методом, який описаний у Прикладі 15а. Одержують тверде тіло білого кольору з т. п. більше 250°С. NMR-1Н(DMSO): 0.85(t, 3Н); 1.87(q, 2Н); 2.53(s, 4Н); 3.03(d, 1H); 3.45(d, 1H); 3.57(s, 4H); 4.02(s, 2H); 5.01(s, 2H); 5.38(d, 1H); 5.52(d, 1H); 6.0(se, 1H); 7.30(s, 1H); 7.42(d, 1H); 7.95(d, 1H); 8.82(s, 1H). NMR-C13(DMSO): 8.45; 3.49; 42.58; 53.04; 61.44; 66.33; 73.33; 98.81; 113.78; 121.81; 122.74; 126.80; 129.05; 129.91; 143.72; 145.07; 149.24; 155.06; 156.92; 159.28; 172.08. IR(KBr): 1515; 1595; 1654; 1736. Приклад 28: 5,12-діетил-9-фторо-4,5дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4Н, 13Н)-діон 28а 5-фторо-4-метокси-2-пропіоніланілін [Цей продукт одержують згідно з Sugasawa Т., Toyoda Т., Adachi M., Saskura К., J. Am. Chem. Soc, 100(1978), p. 4842 – 4852]. Розчин 3-фторо-4-метокси-аніліну(20г, 142мМ) у безводному дихлорметані(200мл) в атмосфері аргону і температурі 0°С крапля за краплею додають до трихлориду бору(1М у гептані, 156мл, 156мМ). Одержану таким чином суспензію рожевого кольору перемішують протягом 5 хвилин. Далі малими порціями крапля за краплею додають пропіонітрил(33мл, 420мМ), а потім трихлорид алюмінію(20,9г, 156мМ). Реакційну суміш нагрівають до стану флегми протягом 3 годин, охолоджують при 0°С, гідролізують через обережне додавання 2N соляної кислоти(100мл), далі доводять до стану флегми протягом 45 хвилин. Після охолодження до 0°С одержують осад, який далі фільтрують, промивають за допомогою дихлорметану, далі відновлюють у воді(300мл). Підвищують основність водної фази до лужного pH, екстрагують за допомогою дихлорметану, а далі етилацетату. Органічну фазу висушують(MgSO4), далі випарюють та одержують неочищений продукт, який очищають за допомогою колончатої хроматографії(SiO2, AcOEt/Hpt: 1/99 до 20/80). Одержують 15,3г твердого тіла жовтого кольору. NMR-1H(CDCl3): 1.20(t, 3Н); 2.92(q, 2Н); 3.83(s, 3Н); 6.2(s, 2H); 6.40(d, 2Н); 7.32(d, 2H). IR(КВг): 857; 1148; 1240; 1561; 1583; 1662. 28б Етил-4-етил-7-фторо-2-гідрокси-6-метокси-3-хінолінкарбоксилат Розчин 5-фторо-4-метокси-2-пропіоніланіліну(15,3г, 77,5мМ) та триетиламіну(13,9мл, 100мМ) у безводному ацетонітрилі(110мл) у атмосфері аргону та температурі 0°С крапля за краплею додають до розчину хлориду етилмалонілу(12,9мл, 100мМ) у безводному ацетонітрилі(30мл). Реакційне середовище витримують доки її температура не досягне температури навколишнього середовища, додають розчин етилату натрію(одержаному з 1,8г, 78мм натрію у 80мл етанолу), далі перемішують протягом 12 годин при температурі навколишнього середовища. Реакційну суміш наливають у льодову воду(100мл) та перемішують протягом 2 годин, далі осад фільтрують і промивають водою, етанолом і ефіром. Одержують 19,4г твердого тіла білого кольору. NMR-1Н(CDCI 3): 1.25(m, 6Н); 2.78(q, 2Н); 3.92(s, 3Н); 4.30(q, 2H); 7.15(d, 2H); 7.40(d, 2Н); 11.93(s, 1H). IR(КВг):786; 1083; 1410; 1521; 1644; 1725. 28в Етил 2-хлоро-4-етил-7-фторо-6-метокси-3-хінолінкарбоксилат Суспензію етил-4-етил-7-фторо-6-метокси-3-хінолінкарбоксилату(19,4г, 0,066М) у хлористому фосфорилі(243мл) доводять до стану флегми протягом 6 годин. Хлористий фосфорил дистилюють. Реакційну суміш наливають у льодову воду. З метою зробити її розчинною відновлюють за допомогою дихлорметану. Органічну фазу промивають водою, а потім насиченим розчином хлористого натрію. Органічну фазу висушують на сульфаті магнію і розчинник випарюють. Залишок суспендують у ефірі та відфільтровують неперетворений вихідний продукт(4г). Фільтрат випарюють і залишок очищають за допомогою колончатої хроматографії(SiO2, AcOEt/Hpt: 5/95 до 20/80). Одержують 10,9г твердого тіла білого кольору. NMR-1H(CDCl3): 1.30(t, 3H); 1.39(t, 3H); 3.08(g, 2H); 4.09(s, 3H); 4.49(g, 2H); 7.64(d, 2H); 7.86(d, 2H) IR(КВг): 865; 1016; 1082; 1190; 1224; 1253; 1272; 1508; 1571; 1732 28г 2-хлоро-4-етил-7-фторо-6-метокси-3-хінолінметанол Розчин етил 2-хлоро-4-етил-7-фторо-6-метокси-3-хінолінкарбоксилату(10,8г, 35мМ) у безводному дихлорметані(200мл) крапля за краплею обробляють гідридом діізобутилалюмінію(1M у дихлорметані, 65мл, 65мМ) при температурі навколишнього середовища та у інертній атмосфері, далі нагрівають до 40°С протягом 4 годин. Охолоджують до 0°С, обережно додають 20% водний розчин сегнетової солі та дихлорметан(200мл) і перемішують протягом 1 години. Декантують, промивають тричі водою, висушують органічну фазу на сульфаті магнію і випарюють розчинник. Осад очищають за допомогою колончатої хроматографії(SiO2, AcOEt/Hpt: 5/95 до 50/50). Одержують 6г твердого тіла білого кольору. NMR-1Н(CDCl3): 1.28(1, 3Н); 3.25(q, 2Н); 4.04(s, 3Н); 4.77(d, 2H); 5.27(t, 1H); 7.55(d, 2Н); 7.73(d, 2H). IR(КВг): 840; 864; 1023; 1232; 1267; 1317; 1444; 1511; 1569. 28д 5,12-діетил-9-фторо-4,5дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b] хінолін3,15(4Н, 13Н)-діон 2-хлоро-4-етил-7-фторо-6-метокси-3-хінолінметанол зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, описаною у Прикладі 11, етап 11м. Одержують тверде тіло жовтого кольору з т. п. більше 275°С. NMR-1Н(CF3COOD): 1.07(m, 3Н); 1.62(m, 3Н); 2.27(m, 2Н); 3.44(d, 1H); 3.54(m, 2H); 3.91(d, 1H); 4.25(s, 3Н); 5.60(d, 1H); 5.74(s, 2H); 5.98(d, 1H); 7.85(m, 1H); 8.16(m, 1H); 8.31(s, 1H). NMR-C13(CF3COOD): 9.03; 14.20; 26.68; 38.77; 43.98; 53.79; 58.27; 64.73; 77.93; 106.85; 109.24; 110.15; 128.99; 129.20; 131.61; 137.32; 141.23; 144.13; 154.79; 158.32; 160.25; 160.81; 179.30. IR(KBr): 1013; 1068; 1265; 1466; 1514; 1601; 1655; 1748. Приклад 29: 5-етил-4,5дигідро-5-гідрокси-12-метил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон У процедурах, що описані у прикладах 28б, 28в і 28г, використовують 2-ацетиланілін, одержуючи при цьому 2-хлоро-4-метил-3 хінолінметанол. Останній зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, описаною у Прикладі 11, етап 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С. NMR-1H(DMSO): 0.87(t, 3Н); 1.87(q, 2Н); 2.78(s, 3Н); 2.80(d, 1H); 3.55(d, 1H); 5.27(s, 2H); 5.42(d, 1H); 5.52(d, 1H); 6.04(s, 1H); 7.39(s, 1H); 7.75(t, 1H); 7.88(t, 1H); 8.13(d, 1H); 8.25(d, 1H). NMR-C13(DMSO): 8.23; 36.26; 42.36; 62.00; 73.11; 78.65; 79.13; 79.25; 99.52; 122.36; 124.30; 127.67; 129.54; 129.55; 129.56; 140.11; 145.06; 148.07; 152.00; 155.79; 159.09; 171.89. IR(KBr): 1649; 1751; 3404. Приклад 30: 9-хлоро-5-етил-4,5дигідро-5-гідрокси-10-метокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон 30а 5-хлоро-2-хлороацетил-4-метоксианілін Цей продукт одержують згідно з [Sugasawa Т., Toyoda Т., Adachi M., Sasakura К., J. Am. Chem. Soc, 100(1978), p. 4842 - 4852]. Молярний розчин трихлориду бору у гексані(164мл, 164мМ), хлороацетонітрил(11,4мл, 180мМ) і молярний розчин хлористого діетилалюмінію у гексані(164мл, 164мМ) крапля за краплею додають послідовно до розчину 3-хлоро-4-метокси-аніліну(23,6г, 150мМ) у інертній атмосфері при 0°С. Реакційне середовище нагрівають до стану флегми протягом 1 години, далі охолоджують до 0°С, гідролізують через обережне додавання 2N соляної кислоти(90мл), далі витримують у стані флегми протягом 1 години. Знову охолоджують та додають концентрований розчин бікарбонату натрію до одержання величини pH, що дорівнює 14. Зазначений розчин екстрагують етилацетатом; органічну фазу промивають водою, а потім солоною водою. Висушують на сульфаті магнію, фільтрують та випарюють при зменшеному тиску. Залишок відновлюють у ізопентані, декантують, далі відновлюють те, що є нерозчиненим, у мінімальній кількості ізопропілового ефіру і додають ізопентан для осадження продукту. Фільтрують і висушують у вакуумі. Одержують 17,26г твердого тіла коричневого кольору. NMR-1Н(СDСІз): 3.82(s, 3Н); 4.60(з, 2Н); 6.11(s, 2H); 6.78(s. 1H); 7.11(s, 1H). 30б Етил 7-хлоро-4-хлорометил-2-гідрокси-6-метокси-3-хінолін-карбоксилат Хлористий етилмалоніл(17мл, 131мМ) крапля за краплею додають до розчину 5-хлоро-2-хлороацетил4-метоксианіліну(17г, 73мМ) і триетиламіну(18,5мл, 131мМ) у ангідриді ацетонітрилу(310мл) у атмосфері аргону при 0°С. Перемішують протягом 2 годин при температурі навколишнього середовища, далі при 0°С крапля за краплею додають розчин етанолату натрію у етанолі(одержаному із 1,88г, 80мм натрію у 90мл етанолу). Перемішують протягом 12 годин при температурі навколишнього середовища. Додають 300мл води, перемішують ще 20 хвилин. Осад фільтрують, промивають водою, етанолом і етиловим ефіром. Після сушіння у вакуумі одержують 16,7г твердого тіла жовтуватого кольору. NMR-1H(DMSO): 1.31(t,3H); 3.95(s, 3Н); 4.36(q, 2H); 4.95(s, 2H); 7.46(s, 1H); 7.49(s, 1H). 30в Етил 2,7-хлоро-4-хлорометил-6-метокси-3-хінолін-карбоксилат Суспензію етил 7-хлоро-4-хлорометил-2-гідрокси-6-метокси-3-хінолін карбоксилату(116,7г, 50мМ) у хлористому фосфорилі(100мл) доводять до стану флегми протягом 6 годин. Хлористий фосфорил дистилюють. Залишок відновлюють у воді та переміщують протягом 30 хвилин. Осад фільтрують і промивають водою до нейтралізації. Осад відновлюють у дихлорметані за допомогою насиченого розчину хлористого натрію. Фільтрують на слої селіту і фільтрат декантують. Органічну фазу знову промивають насиченим розчином хлористого натрію. Висушують на сульфаті магнію та фільтрують і випарюють при зменшеному тиску. Одержують 15,88г олії коричневого кольору. NMR-1Н(CDCl3): 1.47(t, 3Н); 4.08(t, 3Н); 4.55(q, 2Н); 4.87(s, 2H); 7.35(s, 1Н); 8.09(s, 1Н). 30г Етил 2,7-хлоро-6-метокси-4-(4-метилпіперазинометил)-3-хінолін-карбоксилат Суміш етил 2,7-хлоро-4-хлорометил-6-метокси-3-хінолін-карбоксилату(6,9г, 20мМ) і Nметилпіперазину(9мл, 80мМ) нагрівають до 60°С протягом 30 хвилин. Реакційну масу розчиняють у воді та екстрагують за допомогою етилацетату. Органічну фазу декантують і промивають водою. Висушують на сульфаті магнію, фільтрують та випарюють при зменшеному тиску. Відновлюють осад у воді, перемішують протягом 15 хвилин, фільтрують, промивають водою та висушують у вакуумі. Очищають осад за допомогою колончатої хроматографії(SiO2, MeOH/СН2СІ 2: 5/95 до 8/92). Одержують 6,7г твердого тіла бежевого кольору. NMR-1Н(CDCl3): 1.45(t, 3Н); 2.28(s, 3Н); 2.35 - 2.70(m, 8Н); 3.86(s 2H) 4.04(s, 3Н); 4.48(q, 2Н); 7.77(s, 1H); 8.05(s, 1H). 30д 2,7-хлоро-6-метокси-4-(4-метилпіперазинометил)-3-хінолін-метанол Етил 2,7-хлоро-6-метокси-4-(4-метилпіперазинометил)-3-хінолін-карбоксилат(6г, 14,5мМ) розчиняють у хлористому метилені(120мл). Повільно додають молярний розчин гідриду діізобутил алюмінію у хлористому метилені(60мл, 60мМ). Перемішують протягом 1 години при температурі навколишнього середовища. Повільно. наливають реакційну масу у 300мл 20% розчину сегнетової солі. Перемішують 1 годину; фільтрують на селіті; органічну фазу декантують, промивають насиченим розчином хлориду натрію. Висушують на сульфаті магнію, фільтрують та випарюють при зменшеному тиску. Тверде тіло відновлюють за допомогою ізопропилового ecbiov. Фільтрують та висушують у вакуумі. Одержують 4,3г бажаної сполуки у вигляді твердого тіла жовтого кольору. NMR-1Н(CDCl3): 2.27(s, 3Н); 2.30 - 2.80(m, 8Н); 4.03(s, 3Н); 4.08(s, 2Н) 4.96(s, 2Н); 5.95(s, 1H); 7.37(s, 1H); 8.05(s, 1H). 30е 9-хлоро-5-етил-4,5дигідро-5-гідрокси-10-метокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон 2,7-хлоро-6-метокси-4-(4-метилпіперазинометил)-3-хінолін-метанол зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11к. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у описі етапу 11м. Одержують тверде тіло жовтого кольору, т. п. більше 250°С. NMR-1Н(DMSO): 0.87(t, 3Н); 1.84(q, 2Н); 2.53(s, 4Н); 3.08(d, 1H); 3.47(d, 1Н); 3.58(s, 4H); 4.06(s, 5Н); 5.30(s, 2Н); 5.42(q, 2Н); 6.03(s, 1H); 7.31(s, 1Н); 7.91(s, 1Н); 8.16(s, 1H). NMR-C13(DMSO): 8.42; 36.53; 50.65; 53.30; 56.67; 62.00; 66.50; 73.32; 99.31; 104.86; 122.32; 126.94; 126.70; 129.83; 130.44; 138.89; 144.22; 144.85; 151.05; 153.17; 155.92; 159.19; 172.06. IR(КВг):862; 1063; 1116; 1248; 1595; 1655; 1744; 3449. Приклад 31: 9-хлоро-5-етил-4,5дигідро-5-гідрокси-10-метокси-12-морфолінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Використовуючи 3-хлоро-4-метоксианілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил-2,7-хлоро-6-метокси-4-хлорометил-3-хінолін-карбоксилат, який обробляють згідно з процедурою, описаною у прикладі 30г, застосовуючи замість N-метилпіперазину морфолін, далі відновлюють розчин згідно з способом, що описаний у прикладі 30д у відповідному хінолінметанолі. Зазначену сполуку зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11к. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло бежевого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.87(t, 3Н); 1.84(q. 2Н); 2.15(s, 3Н); 2.32(s, 4H); 2.50(s, 4Н); 3.08(d, 1H); 3.47(d, 1Н); 4.06(s, 5Н); 5.29(s, 2Н); 5.46(q, 2H); 6.06(s, 1Н); 7.31(s, 1Н); 7.92(s, 1Н); 8.17(s, 1H). NMR-C13(DMSO):8.42; 36.51; 42.57; 45.93; 50.66; 52.83; 55.05; 56.09; 56.72; 61.44; 73.29; 99.30; 104.89; 122.32; 126.89; 127.63; 129.85; 130.16; 138.78; 144.18; 144.81; 151.03; 153.01; 155.10; 159.17; 172.07. IR(КВг): 1055; 1252; 1596; 1655; 1747; 3449. Приклад 32: 5-етил-4,5дигідро-5-гідрокси-12-(4-метил-піперазинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон Використовуючи анілін у процедурах, що описані у прикладах 30а, 306 і 30в, одержують етил 2-хлоро4-хлорометил-3-хінолін-карбоксилат, який обробляють згідно з процедурою, яка описана у прикладі 30г, застосовуючи N-метил піперазин, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Зазначену сполуку зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С NMR-1H(DMSO): 0.86(t, 3Н); 1.87(q, 2Н); 2.14(s, 3Н); 2.32 - 2.60(m, 8H); 3.05(d, 1H); 3.48(d, 1H); 4.09(q, 2H); 5.42(d, 1H), 5.52(d, 1H); 6.03(se, 1H); 7.40(s, 1H); 7.72(t, 1H); 7.85(t, 1H); 8.16(d, 1H); 8.45(d, 1H). IR(KBr): 1652; 1735; 3424. Приклад 33: 5-етил-4,5дигідро-5-гідрокси-12-піперидинометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Використовуючи анілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро4-хлорометил-3-хінолін-карбоксилат, який обробляють згідно з процедурою, яка описана у прикладі 30г, застосовуючи піперидин замість N-метил піперазину, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Зазначену сполуку зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С. NMR-1Н(DMSO): 0.86(t, 3Н); 1.40(se, 2Н); 1.48(se, 4Н); 1.87(q, 2H); 2.50(s, 4H); 3.05(d, 1Н); 3.48(d, 1H); 4.04(q, 2Н); 5.33(s, 2Н); 5.42(d, 1Н); 5.51(d, 1Н); 6.07(se, 1H); 7.75(t, 1H); 7.85(t, 1H); 8.15(d, 1H); 8.45(d, 1H). NMR-C13(DMSO): 8.47; 23.50; 25.82; 36.50; 42.50; 50.68; 54.47; 58.00; 61.42; 73.35; 99.55; 122.61; 125.31; 127.58; 129.54; 129.55; 129.56; 129.57; 140.49; 144.95; 148.63; 152.41; 155.90; 159.23; 172.07. IR(KBr): 1659; 1727; 3408. Приклад 34: 5-етил-4,5дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Використовуючи анілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро4-хлорометил-3-хінолін-карбоксилат, який обробляють згідно з процедурою, описаною у прикладі 30г, застосовуючи замість N-метилпіперазину морфолін, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Зазначену сполуку зв'язують з сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С. NMR-1Н(DMSO): 0.86(t,3H); 1.87(q, 2Н); 3.05(d, 1H); 3.30(s, 4H); 3.49(d, 1H); 3.55(se, 4H); 4.10(q, 2H); 5.35(s, 2H); 5.40(d, 1H); 5.54(d, 1H); 6.04(s, 1H); 7.72(t, 1H); 7.85(t, 1H); 8.16(d, 1H); 8.47(d, 1H). NMR-C13(DMSO): 8.42; 36.51; 42.57; 50.68; 53.51; 56.06; 61.42; 66.41; 73.34; 99.56; 122.64; 125.25; 127.56; 129.81; 139.55; 144.92; 148.62; 152.39; 155.89; 159.21; 172.05. IR(KBr): 1657; 1729; 3347. Приклад 35: 5-етил-10-фторо-4,5дигідро-5-гідрокси-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Використовуючи 4-фтороанілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро-4-хлорометил-6-фторо-3-хінолін-карбоксилат, який обробляють згідно з процедурою, описаною у прикладі 30г, застосовуючи N-метилпіперазин, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Зазначену сполуку зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 275°С. NMR-1H(DMSO): 0.87(t, 3Н); 1.85(q, 2Н); 2.15(s, 3H); 2.31(m, 4H); 2.50(m, 4Н); 3.07(d, 1H); 3.48(d, 1H); 4.04(m, 2H); 5.31(s, 2H); 5.40(d, 1H); 5.53(d, 1H); 6.05(s, 1H); 7.38(s, 1H); 7.77(m, 1H); 8.19(m, 2H). NMR-C13(DMSO): 8.43; 36.51; 42.54; 45.89; 50.67; 52.92; 54.93; 55.92; 73.32; 99.56; 122.69; 130.43; 132.40; 139.69; 144.70; 145.84; 152.19; 155.90; 159.17; 172.05. IR(KBr):836; 1051; 1217; 1291; 1612; 1662; 1726. Приклад 36: 5-етил-10-фторо-4,5дигідро-5-гідрокси-12-морфолінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон Використовуючи 4-фтороанілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро-4-хлорометил-6-фторо-3-хінолін-карбоксилат, який обробляють згідно з процедурою, описаною у прикладі 30г, застосовуючи замість N-метилліперазину морфолін, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Зазначену сполуку зв'язують з сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло бежевого кольору з т. п. більше 250°С. NMR-1H(DMSO): 0.87(m, 3Н); 1.85(m, 2Н); 2.51(m, 4H); 3.06(d, 1H); 3.48(d, 1H); 3.56(m, 4H); 4.05(m, 2H); 5.34(s, 2H); 5.40(d, 1H); 5.53(d, 1H); 6.04(s, 1H); 7.38(s, 1H); 7.77(m, 1H); 8.21(m, 2H). NMR-C13(DMSO): 8.40; 36.47; 42.52; 50.59; 53.40; 56.14; 61.44; 66.41; 73.29; 99.58; 109.05; 109.28; 120.11; 120.37; 122.68; 128.53; 130.53; 132.43; 139.13; 144.62; 145.79; 152.07; 155.94; 159.14; 161.59; 172.04. IR(KBr):834; 860; 1061; 1118; 1215; 1286; 1516; 1609; 1658; 1734. Приклад 37: 5-етил-9-фторо-4,5дигідро-5-гідрокси-10-метил-12-(4-метилпіперазинометил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон Використовуючи 3-фторо-4-метиланілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро-4-хлорометил-7-фторо-6-метил-3-хінолінкарбоксилат, який обробляють згідно з процедурою, описаною у прикладі 30г, застосовуючи N-метилпіперазин, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Зазначену сполуку зв'язують з сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С. NMR-1H(CDCl3): 1.00(t, 3Н); 2.00(q, 2Н); 2.35(s, 3Н); 2.50(s, 3Н); 2.61(m, 8Н); 3.33(d, 1H); 3.39(d, 1H); 3.97(d, 1H); 4.07(d, 1H); 5.17(d, 1H); 5.38(d, 1H); 5.52(d. 1H); 5.63(d, 1H); 7.13(d, 1H); 7.28(s, 1H); 7.99(d, 1H). IR(KBr): 1652; 1747; 3430. Приклад 38: 5-етил-9-фторо-4,5дигідро-5-гідрокси-10-метил-12-морфолінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон Використовуючи 3-фторо-4-метиланілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро-4-хлорометил-7-фторо-6-метил-3-хінолінкарбоксилат, який обробляють згідно з процедурою, описаною у прикладі 30г, застосовуючи замість N-метилпіперазину морфолін, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Зазначену сполуку зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С. NMR-1H(DMSO+CDCl3): 1.00(t, 3Н); 2.02(q, 2Н); 2.57(s, 3Н); 2.60(s, 4Н); 3.23(d, 1H); 3.45(d, 1H); 3.75(s, 4H); 4.11(s, 2H); 5.44(s, 2H); 5.47(d, 1H); 5.65(d, 1H); 7.62(s, 1H); 7.73(d, 1H); 8.24(d, 1H). NMR-C13(CF3CO2D): 8.35; 13.93; 16.01; 22.24; 25.29; 38.18; 43.42; 54.19; 56.04; 56.74; 64.16; 65.09; 77.48; 108.29; 108.57; 128.07; 128.70; 129.90; 135.64; 138.03; 139.86; 141.10; 141.56; 147.78; 158.30; 161.87; 178.72. IR(KBr):117; 1609; 1654; 1750; 3437. Приклад 39: 5-етил-9-фторо-4,5дигідро-5-гідрокси-10-метил-12-піперидинометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон Використовуючи 3-фторо-4-метиланілін згідно з процедурами, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро-4-хлорометил-7-фторо-6-метил-3-хінолінкарбоксилат, який обробляють згідно з процедурою, яка описана у прикладі 30г, застосовуючи замість N-метилпіперазину піперидин, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолін метанолі. Зазначену сполуку зв’язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С. NMR-1H(CF3CO2D): 1.09(s, 3Н); 1.70(t, 1Н); 2.03(m, 5Н); 2.25(s, 2H); 2.70(s, 3H); 3.54(d, 3Н); 3.88(d, 1H); 4.01(se, 2H); 5.30(q, 2H); 5.65(d, 1H); 5.96(d, 1H); 6.10(s, 2H); 8.16(d, 1H); 8.35(s, 1H); 8.61(s, 1H). NMR-C13(CF3CO2D): 8.47; 16.07; 20.93; 22.18; 24.76; 38.28; 43.53; 54.30; 56.12; 58.33; 64.24; 77.56; 108.37; 111.30; 128.20; 129.02; 129.98; 135.60; 138.29; 139.90; 141.60; 142.26; 147.57; 158.28; 161.90; 167.63; 170.31; 178.82. IR(KBr):1605; 1657; 1728; 3399. Приклад 40: 8-етил-2,3,8,9-тетрагідро-8-гідрокси-16-(4-метил-піперазинометил-10Н,12Н(1,4)діоксино(2,3-g)оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-10,13(15Н)-діон Використовуючи 3,4-етилендіоксианілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2-хлоро-4-хлорометил-6,7-етилендіокси-3-хінолінкарбоксилат, який обробляють згідно з процедурою, описаною у прикладі 30г, застосовуючи N-метилпіперазин, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Останній зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло жовтого кольору з т. п. більше 260°С. NMR-1H(DMSO): 0.92(t, 3Н); 1.89(q, 2H); 2.16(s, 3Н); 2.50(m, 8H); 3.12(d, 1H); 3.50(d, 1H); 3.95(s, 2H); 4.47(s, 4H); 5.19(q, 2H); 5.43(d, 1H); 5.56(d, 1H); 7.35(s, 1H); 7.54(s, 1H); 7.76(s, 1H). NMR-C13(DMSO): 8.45; 24.80; 36.51; 42.48; 45.90; 50.45; 52.98; 54.91; 56.10; 61.44; 64.43; 73.30; 99.03; 109.46; 113.51; 121.95; 123.51; 127.76; 137.99; 145.00; 145.14; 145.27; 147.24; 150.53; 155.90; 159.18; 172.27; 177.00. IR(KBr): 1656; 1743; 3422. Приклад 41: 9-хлоро-5-етил-10-фторо-4,5дигідро-5-гідрокси-12-морфолінонометил-1Н-оксепіно[3',4': 6,7]індолізіно [1,2-b]хінолін-3,15(4Н, 13Н)-діон Використовуючи 3-хлоро-4-фтороанілін у процедурах, що описані у прикладах 30а, 30б і 30в, одержують етил 2,7-дихлоро-4-хлорометил-6-фторо-6-3-хінолінкарбоксилат, який обробляють згідно з процедурою, що описана у прикладі 30г, застосовуючи замість N-метилпіперазину морфолін, далі відновлюють розчин згідно з методом, що описаний у прикладі 30д, у відповідному хінолінметанолі. Останній зв'язують із сполукою(М), як це описано у Прикладі 11, етап 11л. Одержаний зв'язаний продукт циклізують згідно з процедурою, яка наведена у прикладі 11м. Одержують тверде тіло бежевого кольору з т. п. більше 250°С. NMR-1Н(CF3COOD): 1.09(t, 3Н); 2.30(m, 2Н); 3.50(d, 1H); 3.90(d, 1H); 3.98(d, 4H); 4.36(s, 4H); 5.38(q, 2H); 5.64(d, 1H); 5.96(d, 1H); 6.23(q, 2H); 8.57(d, 1Н); 8.60(s, 1Н); 8.85(d, 1H). NMR-C13(CF3COOD): 8.10; 37.80; 43.11; 54.31; 55.78; 63.75; 65.11; 77.06; 128.28; 129.55; 130.33; 136.26; 137.11; 138.40; 139.67; 139.85; 148.58; 157.54; 159.74; 161.31; 178.00. IR(КВт):848; 1042; 1230; 1609; 1658; 1750; 3310; 3387. Приклад 42: Розщеплення 5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4Н, 13Н)-діону Суміш β-етил-β-гідрокси-γ-(8-гідроксиметиліндолізіно[1,2-b]хінолін-9-(11Н)-он-7-іл)-пропіоновоїкислоти(19,5г, 52мМ) і L-(-)-α-метилбензиламіну(12,12г, 100мМ) у чистому етанолі(II) кип'ятять, фільтрують у гарячому стані та витримують протягом 68 годин. Осад фільтрують і промивають етанолом і ефіром, що веде до одержання 9,8г твердого тіла білого кольору. Аналіз за допомогою афінної хроматографії високого тиску у хіральній фазі(Хіральна АХВТ на колонці Chiral-AGP(Chromthech, Stockholm, Sweden) 100 x 4мм, 2% ацетонітрилового елюанту у 10мм фосфатного буферу при pH = 6,9, елюантні піки на 4,5 та 7,5 хвилині) показує два піки, охоплюючих відповідно 24% та 76% загальної поверхні обох піків. Тверде тіло відновлюють у 93% етанолу(350мл) у стані флегми, далі витримують протягом 48 годин. Осад фільтрують, потім промивають етанолом та ефіром, щоб одержати 4,8г твердого тіла білого кольору, що забезпечує отримання двох піків, охоплюючих відповідно 9% і 91% загальної поверхні обох піків, за допомогою хіральної АХВТ. Тверде тіло відновлюють у 50% етанолу(48мл) у стані флегми, а далі витримують протягом 48 годин. Осад фільтрують, потім промивають етанолом та ефіром, одержуючи 2,7г твердого тіла білого кольору, яке має два піки, охоплюючих відповідно 1% та 99% загальної поверхні обох піків, за допомогою хіральної АХВТ. Одержану сіль обробляють, діастереоізомерично збагачують, відновлюють у дистилованій воді(20мл) за допомогою оцтової кислоти(0,35мл, 6,4мМ) протягом 15 хвилин. Одержаний осад фільтрують, промивають водою, ацетоном і ефіром, потім висушують у вакуумі при 80°С, одержуючи 1,1г твердого тіла білого кольору. Останній відновлюють у чистому етанолі(55мл) через додавання концентрованої соляної кислоти(11,5 N, 11мМ), одержуючи розчин жовтого кольору, який перемішують при температурі навколишнього середовища протягом 68 годин. Одержаний таким чином осад фільтрують і промивають водою, етанолом та ефіром, далі висушують у вакуумі при 80°С, одержуючи 770мг енантіомерично збагаченого 5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4Н, 13Н)-діону. Аналіз за допомогою хіральної АХВТ(колонка Chiral-AGP, елютована за допомогою 2 5% градієнта ацетонітрилу у 10мм фосфатного буферу, pH = 6,9, елюантні піки на 15 та 20 хвилинах) показує енантіомеричний надлишок, який дорівнює 98%. Вищеописану процедуру повторюють, замінюючи L-(-)-α-метилбензиламін на D-(+)-α-метилбензиламін. Таким чином одержують інший енантіомер 5-етил4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діону. При застосуванні вищенаведених процедур можна також виготовляти отакі продукти, які є частиною цього винаходу, серед яких найкращі продукти становлять собою: 10-бензилокси-5,12-діетил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон 5,12-діетил-4,5-дигідро-5,10-дигідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон 5,12-діетил-4,5-дигідро-5,10-дигідрокси-11-диметиламінометил-1Н-оксепіно[3',4': 6,7]індолізіно[1,2b]хінолін-3,15(4Н, 13Н)-діон 5-етил-4,5-дигідро-5-гідрокси-9,10-диметокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон 10-бромо-5-етил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон 11-бромо-5-етил-4,5-дигідро-5-гідрокси-10-метокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4Н, 13Н)-діон 5-етил-12-диметиламінометил-4,5-дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4Н, 13Н)-діон 5-етил-4,5-дигідро-5-гідрокси-1Н,3Н-циклопента[g]-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,16(14Н)діон 7-етил-7,8-дигідро-7-гідрокси-16-(4-метилпіперазинометил)-9Н,11Н-[1,3]діоксоло[4,5-д]оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-9,12(14Н)-діон 5-етил-4,5-дигідро-5-гідрокси-12-(1-імідазилметил)-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін-3,15(4Н, 13Н)-діон 8-етил-8,9-дигідро-8-гідрокси-10Н,12Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]піридо[2,3-g]хінолін-10,13(15Н)діон 5-етил-4,5,9,10,11,12-гексагідро-5-гідрокси-1Н,3Н-бензо[g]оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,17(15Н)-діон 8-етил-8,9-дигідро-8-гідрокси-14Н,10Н,12Н-[1,3]діоксино[4,5-g]оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін10,13(15Н)-діон 7-етил-7,8-дигідро-7-гідрокси-1Н,9Н,11Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]піроло-[2,3-g]хінолін9,12(14Н)-діон 7-етил-7,8-дигідро-7-гідрокси-1Н,9Н,11Н-імідазо[4,5-д]оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін9,12(14Н)-діон 7-етил-7,8-дигідро-7-гідрокси-1Н,9Н,11Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]1,2,3-триазоло-[4,5-g]хінолін9,12(14Н)-діон 7-етил-7,8-дигідро-7-гідрокси-9Н,11Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]триазоло-[4,5-g]хінолін9,12(14Н)-діон 7-етил-7,8-дигідро-7-гідрокси-9Н,11Н-оксазоло[4,5-g]оксепіно[3',4': 6,7]індолізіно[1,2-b]-хінолін9,12(14Н)-діон Фармацевтичне дослідження продуктів згідно з цим винаходом 1. Тест на активність релаксаційної активності ДНК, індукованої топоізомеразою 1. Усі реакції виконують у реакційному буфері(20мкг), який містить 50мм трис-НСІ(pH = 7,5), 50мм КСІ, 0,5мм дитіотритолу, 10мм МgСІ 2, 0,1мм етилдіамін тетраоцтової кислоти(ЕДТК), 30мкл/мл бичачої альбумінової сироватки та 300нг охолодженого pUC19(Pharmacia Biotech, Orsay, France) з або без сполук з метою дослідження визначених концентрацій. Усі сполуки, які підлягають дослідженню, по-перше розчиняють у 50мм диметилсульфоксиду(ДМСО), причому інші розчинення виконують дистильованою водою. Кінцева концентрація у ДМСО не перевершує 1%(у об'ємному співвідношенні). Реакцію починають через додавання 1 одиниці топоізомерази 1, очищеної ДНК телячого тимуса(Gibco-BRL, Paisley, United Kingdom) і здійснюють її протягом 15 хвилин при 37°С. Реакції припиняють через додавання 3мкл суміші, що містить 1% сульфату додецилсірчанокислого натрію, 20мл ЕДТК та 500мкг/мл протеїнази К(Boehringer Mannheim, Melan, France). Після додаткового періоду інкубування(30 хвилин) при 37°С до зразків додають 2мкл заряджаючого буферу, що містить Na2 HPO4, 0,3% бромфенолової сині та 16% Фіколу. Зазначені зразки піддають електрофорезу на гелі агарози(при напрузі від 1,2 до 1В/см) протягом 20 годин у буфері, що містить 36мм Трис-НСІ(pH = 7,8), 30мм Na2HPO4, 1мм ЕДТК і 2мкг/мл хлорохіну. Гель підфарбовують за допомогою 2мкг/мл бромистого етідію, фотографують при ультрафіолетовому випромінюванні з довжиною хвилі 312нм за допомогою фотографічного приладу та вимірюють інтенсивність флуоресценції, використовуючи камеру bioProfil(Vilber Lourmat, Lyon, France) з метою визначення процента релаксованої ДНК. Кожен експеримент виконують тричі при однакових умовах. У кожному експерименті плазміду охолодженої ДНК інкубують одну або з топоізомеразою 1. Реакцію закінчують у інтервалі часу, що дорівнює 15 хвилинам, для кожної сполуки, яку досліджують або використовують як контрольну, плазміду охолодженої ДНК інкубують у присутності 500мкМ сполуки, що досліджують, з або без ферменту та зазначеної сполуки при концентраціях, що дорівнюють 10мкМ, 100мкМ, 200мкМ, 500мкМ. Як це показано у Таблиці І, зразки, що наведені у Прикладах 2, 3, 4, 9, 10 і 11, інгібують релаксаційну активність, обумовлену топоізомеразою 1, у залежності від дози. Таблиця І Приклад Приклад 2 Приклад 3 Приклад 4 Приклад 9 Приклад 10 Приклад 11 10 97.9 79.9 99.1 77.1 96.9 65.0 Процент ослабленої ДНК Концентрація, нМ 100 78.3 59.9 82.2 33.9 45.4 50.3 200 73.2 55.0 67.6 29.7 26.2 39.8 500 51.1 45.7 32.9 20.4 8.7 31.0 2. Дослідження клітинної проліферації У цьому дослідженні використовують вісім клітинних ліній пухлини: L1210(лімфоцитарний лейкоз миші), НСТ15 і LOVO(клітинні лінії аденокарциноми товстої кишки людини), А549(карцинома легень людини), А172, U373, U87(гліобластома людини). Усі зазначені лінії одержують із Американської колекції типових культур(АКТК), Rockville, Md. Культури клітин L1210 у суспензії культивують у середовищі Іглу(Eagle), модифікованого Далбеко(Dulbecco) (DMEM) (Biowhitaker, Verviers, Belgium) з додатком 10% фетальної телячої сироватки, яка інактивована за допомогою нагрівання, 2мм глутаміну, 50 одиниць/мл пеніциліну та 50мкл/мл стрептоміцину. Клітини НТ29 культивують у моношарових культурах у середовищі 5аМсСоу(Gibco, Paislay, United Kingdom) з додатком 10% фетальної телячої сироватки, яка інактивована за допомогою нагрівання, далі додають 2мм глутаміну та 50мкг гентаміцину. Інші клітини культивують у потрібному середовищі модифікованого Єрлу(Earle) (ЕМЕМ: Gibco, Paislay, United Kingdom) з додатком 5% фетальної телячої сироватки, яка інактивована за допомогою нагрівання, 2мм глутаміну, 50 одиниць/мл пеніциліну та 50мкл/мл стрептоміцину. Усі зазначені клітинні лінії культивують при 37°С у зволоженій атмосфері, що містить 95% повітря та 5% СО2. Інгібування зазначених клітинних ліній пухлини визначають за допомогою тесту МТТ, при якому 1500 клітин L1210 у середовищі культури(згідно з потребами клітинної культури) висівають у комірку мікрокюветної зони(рівень тканинної культури: 96 комірок, плоске дно) за 24 години перед обробленням сполуками, що досліджують. Для зазначених досліджень, які стосуються впливу доз, клітини інкубують з кожною із досліджуваних сполук або їх відповідного розчинника(контрольного) протягом 48 годин у пулі з кінцевою концентрацією, що дорівнює 1,10-10 - 1,10 -4 М. Усі сполуки розчиняють безпосередньо перед використанням у диметилсульфоксиді(ДМСО) при концентрації 50мМ. Інші розведення речовин, які діють як медикаменти, виконують у культуральному середовищі. Кінцева концентрація ДМСО ніколи не перевершує 0,2%(у об'ємному співвідношенні). Розчини речовин, які діють як медикаменти та використовуються як контрольні, замінюють розчинником, який послідовно розводять таким самим способом, що і сполуки, які досліджують. Після інкубаційного періоду до кожної комірки додають маркіруючий реактив МТТ(3-[4,5-диметилтіазол2-іл]-2,5-дифенілтетразолій; триазолова синь, Сигма М 565, Sigma, St. Louis МО) при кінцевій концентрації, що дорівнює 0,3мг/мл у кожній комірці. Клітини інкубують протягом 4 годин у зволоженій атмосфері. Цей етап дозволяє мітохондріальній дизогідрогеназі живих клітин перетворюватись у жовту тетразолієву сіль МТТ у пурпурових кристалах формазану. Надосадову рідину видаляють, сформовані формазанові кристали розчиняють за допомогою ДМСО. Визначають кількість одержаного пофарбованого розчину за допомогою поглинення при довжині хвилі 570нм, використовуючи скануючий багатокюветний спектрофотометр, у якому використовується свіп-сигнал. Дані, які стосуються проліферації, виражають у процентах живих клітин в оброблених комірках відносно живих клітин у контрольних комірках. Кожна точка становить собою середню величину, визначену по даним трьох експериментів, причому у кожному експерименті виконують шість вимірювань. Для інших клітинних ліній(НСТ15, LOVO, А549, А172, U373, U87) від 1000 до 2000 клітин висівають у комірку мікрокюветних бляшок за 24 години перед лікуванням. їх інкубують з кожною із досліджуваних сполук або їх відповідних розчинників(для контролю) протягом 72 годин при кінцевому концентраційному пулі, що дорівнює 1,10-10 - 1,10-4M. Результати виражають у процентах проліферації, які обчислюються шляхом поділення значення оптичної густини(ОГ) клітин, оброблених речовинами, які діють як медикаменти, на величину ОГ для контрольних клітин(клітин, які оброблені ДМСО). Як це показано у Таблиці II, сполуки, що досліджуються, інгібують проліферацію клітин у залежності від дози. Таблиця ІІ Приклад 6 Приклад 3 L1210 НСТ15 LOVO А549 А172 U373 U87 L1210 НСТ15 LOVO А549 А172 U373 U87 L1210 НСТ15 LOVO А549 А172 U373 U87 L1210 НСТ15 LOVO А549 А172 U373 U87 L1210 НСТ15 LOVO А549 А172 U373 U87 Процент клітинної проліферації Концентрація, нМ Лінії клітин Приклад 4 Приклад 9 Приклад 10 Приклад 11 0.1 87.22 86.00 108.00 132.00 89.00 99.00 108.00 92.14 91.00 80.00 71.00 93.00 86.00 98.00 74.04 94.00 74.00 91.00 97.00 89.00 105.00 91.51 111.00 71.00 71.00 93.00 96.00 96.00 91.99 71.00 66.00 82.00 95.00 50.00 40.00 1 68.92 84.00 86.00 111.00 101.00 98.00 85.00 97.14 92.00 75.00 76.00 92.00 85.00 101.00 62.05 89.00 85.00 88.00 89.00 69.00 72.00 97.94 87.00 76.00 76.00 92.00 104.00 79.00 81.37 63.00 42.00 44.00 53.00 30.00 21.00 10 42.64 58.00 54.00 75.00 68.00 40.00 42.00 91.08 86.00 79.00 71.00 98.00 89.00 98.00 44.72 59.00 44.00 50.00 44.00 24.00 14.00 89.28 103.00 77.00 71.00 91.00 87.00 89.00 23.16 45.00 29.00 29.00 47.00 25.00 12.00 100 26.85 44.00 31.00 39.00 37.00 24.00 23.00 86.28 78.00 69.00 56.00 97.00 63.00 74.00 34.01 35.00 31.00 31.00 36.00 18.00 7.00 67.32 63.00 52.00 56.00 60.00 35.00 17.00 16.38 23.00 21.00 26.00 39.00 8.00 6.00 1000 10.83 18.00 23.00 35.00 27.00 17.00 15.00 46.79 54.00 38.00 26.00 44.00 30.00 11.00 20.20 15.00 21.00 23.00 19.00 8.00 4.00 31.51 42.00 29.00 36.00 39.00 20.00 6.00 5.59 12.00 8.00 4.00 12.00 2.00 1.00 10000 2.11 9.00 10.00 10.00 10.00 13.00 5.00 27.80 20.00 21.00 22.00 31.00 16.00 6.00 4.34 8.00 4.00 5.00 3.00 3.00 2.00 19.78 17.00 18.00 22.00 15.00 10.00 5.00 1.45 9.00 3.00 3.00 3.00 1.00 1.00 100000 2.20 13.00 12.00 11.00 7.00 9.00 6.00 8.09 7.00 5.00 12.00 10.00 2.00 2.00 1.58 3.00 2.00 3.00 1.00 1.00 6.00 3.65 9.00 4.00 7.00 3.00 2.00 2.00 1.04 9.00 3.00 2.00 2.00 2.00 1.00 1. Тест на розвиток in vivo Сполуки згідно з цим винаходом досліджують in vivo, використовуючи лінії клітин L1210 лімфобластичного лейкозу миші. Клітини пухлини зберігають за допомогою серії внутрішньоперитональних ін'єкцій мишам(DBA/2 Lafacedu, Lyon, France). У експериментальному дослідженні внутрішньоперитонально вводять 106 клітин/0,2мл у самку миші B6D2F1. Лікування починають через 1 день після інокуляції лейкозу і продовжують протягом від 4 до 8 діб. Ін'єкції досліджуваних сполук здійснюють внутрішньовенно або внутрішньоперитонально при різних концентраціях, а об'єм ін'єкції регулюють, виходячи з рахунку 0,1мл/10г ваги тіла. Миші, яких не піддають лікуванню, умирають між 9 і 14 добами після ін'єкції у клітини L1210 лімфобластичного лейкозу, а миші, яких піддають лікуванню, залишаються живими тривалий час до 60 діб. Експеримент проводять з 5-етил-4,5дигідро-5-гідрокси-1Н-оксепіно[3',4': 6,7]індолізіно[1,2-b]хінолін3,15(4Н, 13Н)-діоном. Ця сполука на 50% збільшує тривалість життя миші при концентрації від 0,32 до 2,5мг/кг при введенні внутрішньоперитонально протягом 4 діб і при концентрації від 0,32 до 5мг/кг при введенні внутрішньовенно протягом 8 діб.
ДивитисяДодаткова інформація
Назва патенту англійськоюCamptothecine analogues, method for preparing thereof, intermediate compounds and a pharmaceutical composition containing said camptothecine analogues
Назва патенту російськоюАналоги камптотецина, способы их получения, промежуточные соединения и фармацевтическая композиция, содержащая указанные аналоги камптотецина
МПК / Мітки
МПК: C07D 471/14, C07D 213/61, A61K 31/47, C07D 491/044, A61P 43/00, A61P 33/02, A61P 35/00, C07D 491/04, A61P 33/00, C07D 213/64, A61P 31/12, C07D 491/22, A61K 31/4745, A61K 31/5377, A61K 31/496
Мітки: містить, камптотецину, проміжні, зазначені, фармацевтична, одержання, аналоги, способи, композиція, сполуки
Код посилання
<a href="https://ua.patents.su/25-63891-analogi-kamptotecinu-sposobi-kh-oderzhannya-promizhni-spoluki-ta-farmacevtichna-kompoziciya-shho-mistit-zaznacheni-analogi-kamptotecinu.html" target="_blank" rel="follow" title="База патентів України">Аналоги камптотецину, способи їх одержання, проміжні сполуки та фармацевтична композиція, що містить зазначені аналоги камптотецину</a>












