Застосування частинок твердого носія для поліпшення технологічних характеристик фармацевтичного агента
Номер патенту: 101193
Опубліковано: 11.03.2013
Автори: Оліяй Реза, Меннінг Марк М., Козіара Джоанна М., Стріклі Роберт Г., Йу Річард, Матіас Аніта А., Карні Брайан П.
Формула / Реферат
1. Композиція, яка містить множину частинок твердого носія, кожна з яких має поверхню і/або пори; і сполуку формули (І):
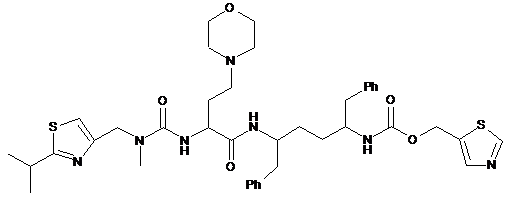 (I)
(I)
або її фармацевтично прийнятну сіль, у порах або на поверхні частинок твердого носія.
2. Композиція за п. 1, яка відрізняється тим, що кожна частка твердого носія включає каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк.
3. Композиція за п. 1, яка відрізняється тим, що множину частинок твердого носія являють собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок приблизно від 10 до приблизно 120 мікронів, і питомою поверхнею, визначеною за методом БЕТ, від приблизно 40 до приблизно 400 м2/г.
4. Композиція за п. 3, яка відрізняється тим, що діоксид кремнію являє собою гідрофільний високодисперсний діоксид кремнію.
5. Композиція за будь-яким з пп. 3-4, яка відрізняється тим, що частинки діоксиду кремнію мають середній діаметр 20-40 мікронів.
6. Композиція за будь-яким з пп. 3-5, яка відрізняється тим, що частинки діоксиду кремнію мають питому поверхню, визначену за методом БЕТ щонайменше 150 м2/г.
7. Композиція за будь-яким з пп. 3-6, яка відрізняється тим, що сполука формули (І) покриває стінки пор і поверхню частинок діоксиду кремнію.
8. Композиція за будь-яким з пп. 1-5, яка відрізняється тим, що відсоткове відношення маси сполуки формули (І) до маси частинок твердого носія становить 50 %±10 %.
9. Композиція за будь-яким з пп. 1-8, що додатково включає одну або більше фармацевтично прийнятних допоміжних речовин.
10. Композиція за п. 9, яка перетворена в лікарську форму для перорального введення.
11. Композиція за п. 10, яка являє собою таблетку.
12. Композиція за будь-яким з пп. 1-11, яка відрізняється тим, що сполука формули (І) має підвищений до 99±1 % вміст стереоізомера формули (Іа):
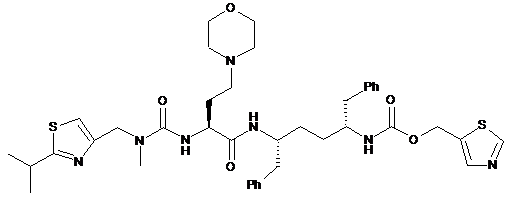 (Ia).
(Ia).
13. Спосіб, який включає комбінування сполуки формули (І):
 (I)
(I)
придатного розчинника, і множину частинок твердого носія для отримання суміші.
14. Спосіб за п. 13, який відрізняється тим, що кожна частка твердого носія являє собою каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк.
15. Спосіб за п. 13, який відрізняється тим, що множину частинок твердого носія являють собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від приблизно 40 до приблизно 400 м2/г.
16. Спосіб за п. 15, який відрізняється тим, що частинки діоксиду кремнію являють собою гідрофільний високодисперсний діоксид кремнію.
17. Спосіб за п. 15 або п. 16, який відрізняється тим, що частинки діоксиду кремнію мають середній діаметр 20-40 мікронів.
18. Спосіб за будь-яким з пп. 15-17, який відрізняється тим, що частинки діоксиду кремнію мають питому поверхню, визначену за методом БЕТ, щонайменше 150 м2/г.
19. Спосіб за будь-яким з пп. 15-18, який відрізняється тим, що маса сполуки формули (І), ділена на масу частинок діоксиду кремнію, становить 1,0±0,5.
20. Спосіб за будь-яким з пп. 15-19, який відрізняється тим, що розчинник являє собою (С1-С6) спирт.
21. Спосіб за будь-яким з пп. 15-19, який відрізняється тим, що розчинник містить етанол.
22. Продукт, отриманий за способом, описаним в кожному із пп. 13-21.
23. Таблетка, яка містить: 1) сполуку формули (І):
 (I)
(I)
або її фармацевтично прийнятну сіль, і 2) множину частинок твердого носія.
24. Таблетка за п. 23, яка відрізняється тим, що кожна частинка твердого носія являє собою каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк.
25. Таблетка за п. 23, яка відрізняється тим, що множину частинок твердого носія являють собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від приблизно 40 до приблизно 400 м2/г.
26. Таблетка за будь-яким з пп. 23-25, що додатково включає інший терапевтичний агент.
27. Таблетка за п. 23, що додатково включає 3) мікрокристалічну целюлозу; 4) гідроксипропілцелюлозу; 5) кроскармелозу натрію і 6) стеарат магнію.
28. Таблетка за будь-яким з пп. 23-27, яка відрізняється тим, що сполука формули (І) має підвищений до 99±1 % вміст стереоізомера формули (Іа):
 (Ia).
(Ia).
29. Таблетка за будь-яким з пп. 25-28, яка містить приблизно 10 мг сполуки формули (І); приблизної 115 мг частинок діоксиду кремнію; приблизно 151 мг мікрокристалічної целюлози; приблизно 6 мг гідроксипропілцелюлози; приблизно 15 мг кроскармелози натрію і приблизно 3 мг стеарату магнію.
30. Таблетка за будь-яким з пп. 25-28, яка містить приблизно 25 мг сполуки формули (І); приблизно 115 мг частинок діоксиду кремнію; приблизно 136 мг мікрокристалічної целюлози; приблизно 6 мг гідроксипропілцелюлози; приблизно 15 мг кроскармелози натрію і приблизно 3 мг стеарату магнію.
31. Таблетка за будь-яким з пп. 25-28, яка містить приблизно 100 мг сполуки формули (І); приблизно 115 мг частинок діоксиду кремнію; приблизно 61 мг мікрокристалічної целюлози; приблизно 6 мг гідроксипропілцелюлози; приблизно 15 мг кроскармелози натрію; і приблизно 3 мг стеарату магнію.
32. Фармацевтична композиція, яка містить множину частинок твердого носія; сполуку формули (Іа); дизопроксил фумарат тенофовіру; емтрицитабін і елвітегравір.
33. Фармацевтична композиція за п. 32, яка відрізняється тим, що кожна частинка твердого носія являє собою каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк.
34. Фармацевтична композиція за п. 33, яка відрізняється тим, що множину частинок твердого носія являють собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, з середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від приблизно 40 до приблизно 400 м2/г.
35. Композиція за п. 34, яка відрізняється тим, що діоксид кремнію являє собою гідрофільний високодисперсний діоксид кремнію.
36. Композиція за будь-яким з пп. 34-35, яка відрізняється тим, що частинки діоксиду кремнію мають середній діаметр 20-40 мікронів.
37. Композиція за будь-яким з пп. 34-36, яка відрізняється тим, що частинки діоксиду кремнію мають питому поверхню, визначену за методом БЕТ, щонайменше 150 м2/г.
38. Композиція за будь-яким з пп. 34-37, яка відрізняється тим, що сполука формули (І) покриває стінки пор і поверхню частинок діоксиду кремнію.
39. Композиція за будь-яким з пп. 34-38, яка відрізняється тим, що відношення маси сполуки формули (І) до маси частинок діоксиду кремнію становить 1±0,05 %.
40. Композиція за п. 34, яка перетворена в лікарську форму для перорального ведення.
41. Композиція за п. 40, яка перетворена у форму таблетки.
Текст
Реферат: Винахід належить до галузі фармацевтики і стосується композицій, що містять множину частинок твердого носія, кожна з яких має поверхню і/або пори; і сполуку формули (І): UA 101193 C2 (12) UA 101193 C2 O N Ph O H N S N N N H O S N H O N O Ph (I) або її фармацевтично прийнятну сіль, у порах або на поверхні частинок твердого носія. Винахід також стосується способу одержання композиції, продукту, одержаного вказаним способом та таблетки. UA 101193 C2 5 Ця заявка заявляє пріоритет згідно з попередньою заявкою на патент США № 61/049,935, поданою 2 травня 2008 р.; попередній заявці на патент США № 61/150,655, поданій 6 лютого 2009; і попередній заявці на патент США № 61/150,652, поданій 6 лютого 2009. Зміст кожної із цих заявок повністю включено в цю заявку за допомогою посилання. Рівень техніки У публікації міжнародної заявки WO 03/037379 розкрите використання гранульованих матеріалів на основі отриманого пірогенетичним способом діоксиду кремнію у певних особливих фармацевтичних композиціях. Також описані адсорбати, що включають гранульований матеріал і ще одну речовину (наприклад, фармацевтично активний компонент). 10 15 20 25 30 35 40 45 У публікації міжнародної заявки № WO 2008/010921 розкриті сполуки і фармацевтичні композиції, які поліпшують фармакокінетичні властивості лікарських препаратів, що вводяться разом з ними, шляхом інгібування монооксигенази цитохрому P-450. Один з таких інгібіторів являє собою сполуку формули (I). На жаль, властивості сполуки формули (I) у твердому стані створюють складності для її обробки та застосування у промислових масштабах. Наприклад, її низька температура склування, гігроскопічність і відсутність кристалічності, поряд з її не сипучою природою, викликають особливі складності при її обробці і перетворенні в лікарську форму (наприклад, таблетку). У цей час існує необхідність у поліпшених лікарських формах сполуки формули (I) і вдосконалених способах обробки та перетворення в лікарську форму сполуки формули (I) у промислових масштабах. Такі поліпшені способи можуть усунути одну або більше із існуючих на сьогоднішній день проблем, пов'язаних з обробкою сполуки і перетворенням її в лікарську форму. Короткий опис винаходу Коли сполуку формули (I), або її фармацевтично прийнятна сіль, змішують із частками певного особливого твердого носія (наприклад, похідними діоксиду кремнію) комбінація, що отримується у результаті, набуває несподіваним чином поліпшені фізичні властивості. Наприклад, незважаючи на те, що як сполука формули (I), так і вихідні матеріали колоїдного діоксиду кремнію в Прикладі 2 є гігроскопічними за своєю природою, комбінація, що отримується у результаті, має порівняно низьку гігроскопічність. Крім того комбінація, що отримується у результаті, являє собою сипучий порошок з високою здатністю до навантаження для сполуки формули (I), прийнятною фізичною і хімічною стабільністю, здатністю швидкого вивільнення лікарського засобу та чудовою пресованістю. Таким чином комбінація, що отримується у результаті, може з легкістю бути перетворена у тверді форми дозування (наприклад, таблетки), що мають хорошу здатність вивільнення лікарського засобу, низьку ламкість, хорошу хімічну і фізичні стабільність і низький вміст залишкових розчинників. Композиції згідно з винаходом являють собою значне досягнення, завдяки якому можливий більш інтенсивний розвиток промислового виробництва сполуки формули (I) для застосування її у лікуванні вірусних інфекцій, таких як ВІЛ. Відповідно, згідно з одним варіантом реалізації винаходу запропонована композиція, що включає множину частинок твердого носія, кожна з яких має поверхню і/або пори, і сполуку формули (I): 1 UA 101193 C2 O N Ph O S N N O H N N H 10 15 20 25 30 35 40 45 O O (I) 5 S N H N Ph або її фармацевтично прийнятну сіль, у порах або на поверхні частинок твердого носія. Згідно з іншим варіантом реалізації винаходу також запропонований спосіб, що включає комбінування сполуки формули (I), придатного розчинника, і множину частинок твердого носія для одержання суміші. Така суміш придатна для одержання фармацевтичних лікарських форм, які включають сполуку формули (I). Згідно з іншим варіантом реалізації винаходу запропонована таблетка, що включає: 1) сполуку формули (I) і 2) множину частинок твердого носія. Згідно з іншим варіантом реалізації винаходу запропонована фармацевтична композиція, що містить множину частинок твердого носія; сполуку формули (Ia); дизопроксил фумарат тенофовіру; емтрицитабін і елвітегравір. Згідно з іншим варіантом реалізації винаходи запропоновані способи і проміжні суміші придатні для одержання композицій згідно з винаходом. Згідно з винаходом також запропонований спосіб інгібування цитохрому P-450, що включає введення фармацевтично прийнятної композиції згідно з цим винаходом ссавцю, що потребує такого лікування (наприклад, людині). Згідно з винаходом запропонована композиція для застосування в медичних цілях (наприклад, для застосування при інгібуванні цитохрому P-450 у ссавців), а також застосування композиції згідно з винаходом для одержання лікарського препарату придатного для інгібування цитохрому P-450 у ссавця, такого як людина. Згідно з іншим варіантом реалізації винаходу також запропоновані композиції, отримані у відповідності зі способами, описаними в даній заявці. Короткий опис фігур ФІГ. 1 ілюструє процес одержання фармацевтичної лікарської форми згідно з винаходом, а також способи обробки згідно з винаходом. ФІГ.2 ілюструє дані оцінки поглинання води з Прикладу 2 для типової композиції згідно з винаходом. ФІГ.3 ілюструє дані оцінки пресованості з Прикладу 3 для типової композиції згідно з винаходом. ФІГ. 4 ілюструє одержання фармацевтичної лікарської форми згідно з винаходом, а також способи обробки згідно з винаходом. ФІГ. 5 ілюструє одержання фармацевтичної лікарської форми згідно з винаходом, а також способи обробки згідно з винаходом. ФІГ. 6 ілюструє одержання додаткових лікарських форм згідно з винаходом, а також додаткові способи обробки згідно з винаходом. Докладний опис винаходу Фахівцям у даній галузі техніки буде очевидно, що сполуки формули (I) можуть існувати - і можуть бути виділені - в оптично активних і рацемічних формах. Деякі сполуки можуть проявляти поліморфізм. Необхідно розуміти, що цей винахід включає будь-які рацемічні, оптично активні, поліморфні або стереоізомерічні форми, або їх суміші, сполуки формули (I), які мають корисні властивості, описані в цій заявці. При цьому методи одержання оптично активних форм добре відомі в даній галузі техніки (наприклад, шляхом поділу рацемічної форми за допомогою перекристалізації, шляхом синтезу з оптично активних вихідних матеріалів, шляхом хірального синтезу або шляхом хроматографічного поділу з використанням хіральної нерухливої фази). Відповідно до одного варіанту реалізації винаходу сполука формули (I), яка включена в композиції згідно з цим винаходом, має підвищений вміст стереоізомера формули (Ia): 2 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 який являє собою тіазол-5-ілметил (2R, 5R)-5-((S)-2-(3-((2-ізопропілтіазол-4-іл)метил)-3метилуреїдо)-4-морфолінбутанамідо)-1,6-дифенілгексан-2-ілкарбамат. Відповідно до одного варіанту реалізації сполука формули (I) має підвищений до 85 ± 5 % вміст стереоізомера формули (Ia). Згідно з іншим варіантом реалізації сполука формули (I) має підвищений до 90±5 % вміст стереоізомера формули (Ia). Згідно з іншим варіантом реалізації сполука формули (I) має підвищений до 95±2 % вміст стереоізомера формули (Ia). Згідно з іншим варіантом реалізації сполука формули (I) має підвищений до 99±1 % вміст стереоізомера формули (Ia). Згідно з іншим варіантом реалізації сполука формули (I) є чистим стереоізомером формули (Ia). Тверді носії Сполука формули (I) може бути змішана з будь-яким придатним твердим носієм, за умови, що отримана в результаті комбінація має фізичні властивості, що дозволяють перетворювати її в лікарську форму з більшою легкістю, ніж вихідну сполуку. Наприклад придатні тверді носії включають каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію і тальк. Відповідно до одного варіанту реалізації винаходу твердий носій може включати силікат кальцію (такий як Zeopharm), або алюмометасилікат магнію (такий як Neusilin). При використанні в даній заявці термін "навантажений на твердий носій" включає без обмежень до сполуки формули (I), що покриває стінки пор і поверхню твердого носія. Похідні діоксиду кремнію, що придатні для використання в композиції згідно з винаходом, і способи одержання таких похідних діоксиду кремнію включають похідні і способи, описані в публікації міжнародної заявки № WO 03/037379 і посиланнях, наведених у даній заявці. Як правило, ці похідні діоксиду кремнію включають гранульований гідрофільний високодисперсний діоксид кремнію із середнім діаметром частинок від 10 до 120 мікронів і питомою поверхнею, 2 визначеною за методом БЕТ, від 40 до 400 м /г (у відповідності зі стандартом DIN 66 131 для азоту). Також об'єм пор похідних діоксиду кремнію звичайно становить від приблизно 0,5 до 2,5 мл/г, причому пори, об'ємяких становить менше ніж приблизно 5 % від загального об'єму пор, мають діаметр менше ніж приблизно 5 нм, інші пори є мезопорами і макропорами. Крім того, похідні діоксиду кремнію, як правило, мають pH у діапазоні від приблизно 3,6 до приблизно 8,5 і трамбувальну щільність від приблизно 220 до приблизно 700 г/л. Конкретний кремнеоксидний матеріал, який зокрема придатний у композиціях і способах згідно з цим винаходом, являє собою AEROPERL® 300 (високодисперсний діоксид кремнію), вироблений Evonik Degussa AG (Дюссельдорф, Німеччина). Однак, також можуть використовуватися інші матеріали, що мають фізичні і хімічні властивості, подібні до матеріалів з діоксиду кремнію, описаних у цій заявці. Відповідно до одного варіанту реалізації винаходу частинки діоксиду кремнію мають середній діаметр 20-40 мікронів. Відповідно до одного варіанту реалізації винаходу частинки 2 діоксиду кремнію мають питому поверхню, визначену за методом БЕТ, щонайменше 150 м /г. Відповідно до одного варіанту реалізації винаходу частинки діоксиду кремнію мають питому 2 поверхню, визначену за методом БЕТ, щонайменше 200 м /г. Відповідно до одного варіанту реалізації винаходу частинки діоксиду кремнію мають питому поверхню, визначену за методом 2 БЕТ, щонайменше 250 м /г. Відповідно до одного варіанту реалізації винаходу частинки 2 діоксиду кремнію мають питому поверхню, визначену за методом БЕТ, щонайменше 275 м /г. У композиціях згідно з винаходом сполука формули (I), як правило, покриває стінки пор або поверхню частинок високодисперсного кремнію. Було визначено, що, як правило, на ці частинки діоксиду кремнію може бути навантажено аж до приблизно 60 % (мас.) сполуки формули (I). Висока здатність до навантаження є важливою у фармацевтичній галузі застосування. Відповідно до одного варіанту реалізації винаходу відношення маси сполуки формули (I) до маси частинок діоксиду кремнію становить 20 % ± 15 %. Відповідно до одного варіанту реалізації винаходу відношення маси сполуки формули (I) до маси частинок діоксиду кремнію становить 50 % ± 10 %. Відповідно до одного варіанту реалізації винаходу відношення маси сполуки формули (I) до маси частинок діоксду кремнію становить 45 % ± 15 %. Відповідно до одного варіанту реалізації винаходу (маса сполуки формули II), розділена на (масу твердого 3 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 носія, наприклад, похідного діоксиду кремнію), у композиції становить від приблизно 0,8 до приблизно 1,2. Згідно з іншим варіантом реалізації винаходу (маса сполуки формули II), розділена на (масу твердого носія, наприклад, похідного діоксиду кремнію), у композиції становить 1,0±0,5. Композиції згідно з цим винаходом, що є придатними для введення як лікарські препарати, як правило, містять одну або більше фармацевтично прийнятних допоміжних речовин. Навантаження Сполука формули (I) може бути навантажена на твердий носій з використанням будь-якого придатного способу. Наприклад, сполука формули (I) може бути навантажена на твердий носій шляхом: a) розпилення розчину сполуки (наприклад, розчину сполуки в спиртовому розчиннику, такому як етанол) на твердий носій, наприклад, як описано в Прикладі 1, нижче; b) комбінування сполуки формули (I) придатного розчинника (наприклад, летучого розчинника, такого як дихлорметан) і твердого носія; випарювання розчинника і виділення отриманого в результаті твердого матеріалу; або c) комбінування сполуки формули (I) і придатного летучого розчинника (наприклад, галогенізованого вуглеводню, такого як дихлорметан), і твердого носія; додавання антирозчинника (наприклад, сильно неполярного розчинника, такого як гексани або гептан) і виділення отриманого в результаті твердого матеріалу (як описано в Прикладі 4). На Фігурі 1 представлено одержання фармацевтичної лікарської форми, що містить сполуку формули (I), у відповідності зі способом згідно з цим винаходом. Сполука формули (I) може бути змішана з придатним розчинником і множинучю частинок діоксиду кремнію з одержанням суміші. Факультативно, сполука формули (I) може бути змішана з придатним розчинником при перемішуванні. Як правило, відсоткове масове відношення сполуки формули (I) до частинок діоксиду кремнію до моменту змішання становить приблизно 50 % ± 10 %. Відповідно до одного варіанту реалізації винаходу масове відношення сполуки формули (I) до частинок діоксиду кремнію до моменту змішання становить приблизно 20 % ± 10 %. Згідно з іншим варіантом реалізації винаходу масове відношення сполуки формули (I) до частинок діоксиду кремнію до моменту змішання становить приблизно 30 % ± 10 %. Як розчинник може використовуватися будь-який розчинник, у якому сполука формули (I) розчинна. Як правило, розчинник містить летучий органічний розчинник, такий як, наприклад, (C1-C6) спирт (наприклад, етанол). Як описано в Прикладі 4, нижче, сполука формули (I) може також бути навантажена на кремнеоксидний матеріал шляхом розчинення сполуки в придатному розчиннику з одержанням розчину, що містить Сполуку I; додавання частинок діоксиду кремнію до розчину для одержання суміші; можливого збовтування або перемішування суміші; додавання антирозчинника до суміші і виділення суміші у вигляді твердої речовини, що включає сполуку формули (I) на частинках діоксиду кремнію. Придатні розчинники включають органічні розчинники, такі як кетони (наприклад, ацетон), спирти (наприклад, етанол) і галогенізовані вуглеводні (наприклад, дихлорметан). Придатні антирозчинники включають сильно неполярні розчинники (наприклад, гексан або гептан). Кінцева суміш у вигляді твердої речовини може бути виділена за допомогою будь-якого придатного методу поділу (наприклад, фільтрації). Одна або більше фармацевтично прийнятних допоміжних речовин можуть бути додані в суміш для одержання другої суміші. Ці фармацевтично прийнятні допоміжні речовини можуть включати наповнювачі, зв'язувальні речовини і розпушувачі. Для того, щоб поліпшити обробку суміші в наступному процесі грануляції у водних умовах, можна вибрати наповнювачі та розпушувачі, сумісні із цим процесом у водних умовах. Наприклад, було виявлено, що мікрокристалічна целюлоза (наповнювач) і кроскармелоза натрію (розпушувач) є особливо сумісними з наступним процесом грануляції у водних умовах. Також було виявлено, що гідроксипропілцелюлоза (зв'язувальна речовина) є особливо сумісною з наступним процесом грануляції. Відповідно до одного варіанту реалізації винаходу масове відношення мікрокристалічної целюлози до загальної маси другої суміші становить приблизно 50 % ± 20 %. Відповідно до одного варіанту реалізації винаходу масове відношення гідроксипропілцелюлози до загальної маси другої суміші становить приблизно 2 % ± 1 %. Відповідно до одного варіанту реалізації винаходу масове відношення кроскармелози натрію становить 5 % ± 2 %. Після додавання фармацевтично прийнятних допоміжних речовин другу суміш можна перемішати, наприклад, з використанням механічного змішувача, такого як гранулятор з великим зусиллям зрушення (Niro-Fielder, модель PMA-25). До другої суміші можна додати воду для одержання вологого гранулята, який потім може бути підданий деагломерації, наприклад, за допомогою сита 20 меш. Висушування, наприклад, з використанням сушарки в псевдозрідженому шарі (Fluid Air, модель 20), дозволяє одержати 4 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 висушений матеріал, який включає тверді частинки. Відповідно до одного варіанту реалізації вміст вологи у висушеному матеріалі становить менше ніж приблизно 10,0 %, що визначено у відповідності зі значеннями втрати в масі при висушуванні (loss on drying, LOD). Згідно з іншим варіантом реалізації вміст вологи у висушеному матеріалі становить менше ніж приблизно 5,0 %, що визначено у відповідності зі значеннями втрати в масі при висушуванні (LOD). Згідно з іншим варіантом реалізації вміст вологи у висушеному матеріалі становить менше ніж приблизно 1,0 %, що визначено у відповідності зі значеннями втрати в масі при висушуванні (LOD). Розмір частинки можна зменшити, наприклад, з використанням сита 40 меш або придатного млина (Quadro Comil, модель 197/S) для одержання третьої суміші. Придатна фармацевтично прийнятна зм'якшувальна/змащувальна речовина (наприклад, стеарат магнію, стеаринова кислота, стеарат кальцію, стеарат цинку або прежелатинізований крохмаль) може бути додана в третю суміш для одержання четвертої суміші. Відповідно до одного варіанту реалізації масове відношення стеарата магнію до загальної маси четвертої суміші становить 1 % ± 0,5 %. Відповідно до одного варіанту реалізації винаходу запропонована композиція, отримана у відповідності зі способами, описаними в цій заявці. Згідно з винаходом також запропонований продукт, отриманий на кожному з етапів процесів, описаних у цій заявці. Фармацевтичні лікарські форми, що включають сполуку формули (I) Відповідно до одного варіанту реалізації винаходу запропоновані фармацевтичні композиції, що включають сполуку формули (I), які можуть бути введені ссавцеві пацієнтові, такому як людина, у різних формах, адаптованих до обраного способу введення (наприклад, пероральному способу). Таким чином, композиції згідно з цим винаходом можуть вводитися у комбінації з одним або більш фармацевтично прийнятними компонентами, такими як інертний розріджувач або їстівний носій, що засвоюється. Вони можуть бути поміщені у тверді або м'які желатинові капсули, можуть бути спресовані в таблетки, або ж можуть бути безпосередньо включені в харчові продукти раціону пацієнта. Для перорального введення в терапевтичних цілях активна сполука може бути комбінована з одним або більше допоміжними речовинами і використовуватися у формі таблеток для приймання всередину, таблеток для трансбукального застосування, пастилок, капсул, еліксирів, суспензій, сиропів, пластинок і т.п. Такі композиції і препарати звичайно містять щонайменше 0,1 % активної сполуки. Процентний вміст композицій і препаратів, безумовно, може варіювати і звичайно становить від приблизно 2 до приблизно 60 % від маси даної одиничної дозованої форми. Вміст активної сполуки в таких композиціях, які використовуються в терапевтичних цілях, є достатнім для досягнення ефективного рівня дозування. Таблетки, пастилки, пігулки, капсули і т.п. можуть також включати наступні компоненти: зв'язувальні речовини, такі як гідроксипропілцелюлоза, повідон або гідроксипропіл метилцелюлоза; наповнювачі, такі як мікрокристалічна целюлоза, прежелатинізований крохмаль, крохмаль, маніт або моногідрат лактози; дезінтегруючі агенти, такі як кроскармелоза натрію, зшитий повідон або натрієва сіль гліколяту крохмалю; змащувальна речовина, така як стеарат магнію, стеаринова кислота, або інші стеарати металів; також може бути доданий підсолоджувач, такий як сахароза, фруктоза, лактоза або аспартам або ароматизатор, такий як перцева м'ята, олія грушанки або вишневий ароматизатор. Якщо форма одиниці дозування являє собою капсулу, вона може включати, крім перерахованих вище агентів, рідкий носій, такий як рослинна олія або поліетиленгліколь. Різні інші матеріали можуть використовуватися як покриття, або ж іншим чином модифікувати фізичну форму твердої одиниці дозування. Наприклад, таблетки, пігулки або капсули можуть бути покриті желатином, полімерами, восками, шелаком, цукром і т.п. Безумовно, будь-який матеріал, що використовується у приготуванні будь-якої форми одиниці дозування, як правило, є фармацевтично прийнятним і фактично не токсичним у кількостях, що використовуються. Крім того, композиції згідно з винаходом можуть бути включені в препарати і пристрої вповільненого вивільнення. Композиції згідно з винаходом можуть також використовуватися для місцевого застосування, наприклад, трансдермального, трансбукального або сублінгвального. Відповідно, згідно з винаходом також запропоновані фармацевтичні композиції, перетворені в лікарські форми для таких способів місцевого застосування. Необхідні дози сполук формули I можуть бути визначені шляхом порівняння їх in vitro активності та in vivo активності на тваринних моделях. Методи екстраполяції значень ефективних доз для мишей та інших тварин на людину відомі в даній галузі. Кількість композиції згідно з винаходом, необхідна для використання в терапевтичних цілях, буде варіювати залежно від способу введення, природи захворювання, яке необхідно лікувати, і 5 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 віку та стану пацієнта, і в остаточному підсумку визначається лікарем або лікаремконсультантом. У цілому, однак, прийнятна доза сполуки формули (I) перебуває в межах від приблизно 0,05 до приблизно 100 мг/кг, наприклад, від приблизно 0,05 до приблизно 50 мг/кг маси тіла на день, краще в межах від 0,05 до 10 мг/кг/день, найкраще в межах від 0,05 до 5 мг/кг/день. Сполука зручно перетворена в одиничну дозовану лікарську форму; наприклад таку, що містить приблизно від 5 до 500 мг, приблизно від 5 до 250 мг, або приблизно від 10 до 100 мг сполуки формули (I). Відповідно до одного варіанту реалізації винаходу запропонована композиція, що містить приблизно 5, приблизно 25 або приблизно 100 мг сполуки формули (I), перетворена в одиничну дозовану лікарську форму, яка також включає частинки твердого носія (наприклад, частинки діоксиду кремнію), і один або більше фармацевтично прийнятних носіїв. Здатність сполуки формули (I) інгібувати цитохром P-450 може бути оцінена, відповідно до методики, описаної в публікації міжнародної заявки WO 2008/010921. Комбіновані лікарські форми Як описано в публікації міжнародної заявки № WO 2008/010921, сполука формули (I) приводить до поліпшення фармакокінетичних властивостей лікарського препарату, що вводиться разом з нею, наприклад, шляхом інгібування монооксигенази цитохрому P-450. Відповідно, згідно з іншим варіантом реалізації, фармацевтичні композиції згідно з цим винаходом можуть також містити щонайменше один додатковий терапевтичний агент. Додатковий терапевтичний агент може являти собою будь-який агент, що має терапевтичний ефект при використанні в комбінації зі сполукою згідно з цим винаходом. Наприклад, додатковий терапевтичний агент, що використовується у комбінації зі сполукою формули (I), може являти собою будь-який агент, який підданий окисному метаболізму, залежному від ферментів типу цитохрому P-450, особливо монооксигенази цитохрому P-450, наприклад, 1A2, 2B6, 2C8, 2C19, 2C9, 2D6, 2E1, 3A4, 5, 7 і т.д. В одному прикладі додатковий терапевтичний агент може являти собою будь-який противірусний агент, наприклад, агент, спрямований проти ВІЛ, агент, спрямований проти ВГС і т.д., антибактеріальний агент, протигрибковий агент, імуномодулятор, наприклад, імуносупресор, протипухлинний препарат, хіміотерапевтичний агент, агенти, що використовуються при лікуванні захворювань серцево-судинної системи, неврологічних захворювань, і т.д. В іншому прикладі додатковий терапевтичний агент може являти собою будь-який інгібітор протонної помпи, протисудомний засіб, НПВП, пероральний гіпоглікемічний засіб, антагоніст рецептора ангіотензину II, похідне сульфонілсечовини, бета-блокатор, антидепресант, антипсихотичний засіб або анестетик, або їх комбінацію. В іншому прикладі додатковий терапевтичний агент може являти собою будь-який 1) макролідний антибіотик, наприклад, кларитроміцин, еритроміцин, телітроміцин, 2) антиаритмічний препарат, наприклад, хінідин=>3-OH, 3) бензодиазепін, наприклад, алпразолам, диазепам=>3OH, мідазолам, триазолам, 4) імуномодулятор, наприклад, циклоспорин, такролімус (FK506), 5) противірусний препарат, спрямований проти ВІЛ, наприклад, індинавір, нелфінавір, ритонавір, саквінавір, 6) прокінетик, наприклад, цисаприд, 7) антигістамін, наприклад, астемізол, хлорфенірамін, терфенідин, 8) блокатор кальцієвих каналів, наприклад, амлодипін, дильтіазем, фелодипін, лерканідипін, ніфедипін, нісолдипін, нітрендипін, верапаміл, 9) інгібітор ГМГ-КоА-редуктази, наприклад, аторвастатин, церивастатин, ловастатин, сімвастатин, або 10) 6 бета-OH-стероїд, наприклад, естрадіол, гідрокортизон, прогестерон, тестостерон. В іншому прикладі додатковий терапевтичний агент може являти собою альфентаніл, апрепітант, аріпіпразол, буспірон, кафергот, кофеїн, TMU, цилостазол, кокаїн, N-деметильоване похідне кодеїну, дапсон, декстрометорфан, доцетаксел, домперидон, еплеренон, фентаніл, фінастерид, глівек, галоперидол, іринотекан, ЛААМ, лідокаїн, метадон, натеглінід, ондансетрон, пімозид, пропранолол, кветиапін, хінін, салметерол, сілденафіл, сіролімус, тамоксифен, паклітаксел, терфенадин, тразодон, вінкрістин, залеплон або золпідем, або їх комбінацію. Відповідно до одного конкретного варіанту реалізації винаходу запропонована фармацевтична композиція, що містить 1) сполуку формули (I), 2) множину частинок твердого носія і 3) щонайменше один додатковий терапевтичний агент, обраний із групи, що включає сполуки, що інгібують протеазу ВІЛ, не нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеотидні інгібітори зворотної транскриптази ВІЛ, інгібітори інтегрази ВІЛ, не нуклеозидні інгібітори ВГC, інгібітори CCR5, та їх комбінації, і 4) фармацевтично прийнятна допоміжна речовина. Відповідно до одного конкретного варіанту реалізації винаходу запропонована 6 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтична композиція, що містить 1) сполуку формули (I), 2) множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 2 мікронів і питомою поверхнею, визначеною за методом БЕТ, від 40 до 400 м /г і 3) щонайменше один додатковий терапевтичний агент, обраний із групи, що включає сполуки, що інгібують протеазу ВІЛ, не нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеотидні інгібітори зворотної транскриптази ВІЛ, інгібітори інтегрази ВІЛ, не нуклеозидні інгібітори ВГC, інгібітори CCR5, та їх комбінації, і 4) фармацевтично прийнятна допоміжна речовина. Згідно з іншим варіантом реалізації цього винаходу запропоновані фармацевтичні композиції, що містять 1) сполуку формули (I), 2) множину частинок твердого носія і 3) щонайменше один додатковий терапевтичний агент, обраний із групи, що включає ампренавір, атазанавір, фосампренавір, індинавір, лопінавір, ритонавір, нелфінавір, саквінавір, типранавір, бреканавір, дарунавір,TMC-126, TMC-114, мозенавір (DMP-450), JE-2147 (AG1776), L-756423, RO0334649, KNI-272, DPC-681, DPC-684, GW640385X, DG17, PPL-100, DG35, AG 1859, каправірин, емівірин, делавіридин, ефавіренц, невірапін, (+) каланолід A, етравірин, GW5634, DPC-083, DPC-961, DPC-963, MIV-150, TMC-120, TMC-278 (рілпівірин), BILR 355 BS, VRX 840773, UK-453061, RDEA806, зидовудин, емтрицитабін, діданозин, ставудин, залцитабін, ламівудин, абакавір, амдоксовір, елвуцитабін, аловудин, MIV-210, Рацивір (-FTC), D-d4FC, фосфазид, фозивудин тідоксил, априцитібін AVX754, амдоксовір, KP-1461, і фосалвудин тідоксил (раніше HDP 99.0003), дизопроксил фумарат тенофовіру, адефовір дипівоксил, GS9131, куркумін, похідні куркуміну, цикорієва кислота, похідні цикорієвої кислоти, 3,5дикафеоліхінову кислоту, похідні 3,5-дикафеоліхінової кислоти, ауринтрикарбонову кислоту, похідні ауринтрикарбонової кислоти, фенілетиловий ефір кофеїнової кислоти, похідні фенілетилового ефіру кофеїнової кислоти, тирфостин, похідні тирфостину, кверцетин, похідні кверцетину, S-1360, зинтевір (AR-177), L-870812, L-870810, MK-0518 (ралтегравір), елвітегравір, BMS-538158, GSK364735C, BMS-707035, MK-2048, BA 011, енфувіртид, сифувіртид, FB006M, TRI-1144, AMD-070, SP01A, BMS-488043, Blockaide/CR, імунітин, похідні бензімідазолу, похідні бензо-1,2,4-тіадиазину, похідні фенілаланіну, аплавірок, вікривірок, і маравирок, циклоспорин, FK-506, рапаміцин, паклітаксел, таксотер, кларитроміцин, A-77003, A-80987, MK-639, саквінавір, VX-478, AG1343, DMP-323, XM-450, BILA 2011 BS, BILA 1096 BS, BILA 2185 BS, BMS 186,318, LB71262, SC-52151, SC-629 (N, N-диметилгліцил-N-(2-гідрокси-3-(((4метоксифеніл)сульфоніл)(2-метилпропіл)амін)-1 -(фенілметил)пропіл)-3-метил-L-валінамід), KNI-272, CGP 53437, CGP 57813 і U-103017 і 4) фармацевтично прийнятний носій або допоміжну речовину. Згідно з іншим варіантом реалізації цього винаходу запропоновані фармацевтичні композиції, що містять 1) сполуку формули (I), 2) множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою 2 поверхнею, визначеною за методом БЕТ, від 40 до 400 м /г і 3) щонайменше один додатковий терапевтичний агент, обраний із групи, що включає ампренавір, атазанавір, фосампренавір, індинавір, лопінавір, ритонавір, нелфінавір, саквінавір, типранавір, бреканавір, дарунавір, TMC126, TMC-114, мозенавір (DMP-450), JE-2147 (AG1776), L-756423, RO0334649, KNI-272, DPC681, DPC-684, GW640385X, DG17, PPL-100, DG35, AG 1859, каправірин, емівірин, делавіридин, ефавіренц, невірапін, (+) каланолід A, етравірин, GW5634, DPC-083, DPC-961, DPC-963, MIV150, TMC-120, TMC-278 (рілпівірин), BILR 355 BS, VRX 840773, UK-453061, RDEA806, зидовудин, емтрицитабін, діданозин, ставудин, залцитабін, ламівудин, абакавір, амдоксовір, елвуцитабін, аловудин, MIV-210, Рацивір (-FTC), D-d4FC, фосфазид, фозивудин тідоксил, априцитібтин AVX754, амдоксовір, KP-1461 і фосалвудин тідоксил (раніше HDP 99.0003), дизопроксил фумарат тенофовіру, адефовір дипівоксил, GS-9131, куркумін, похідні куркуміну, цикорієву кислоту, похідні цикорієвої кислоти, 3,5-дикафеоліхінову кислоту, похідні 3,5дикафеоліхінової кислоти, ауринтрикарбонову кислоту, похідні ауринтрикарбонової кислоти, фенілетиловий ефір кофеїнової кислоти, похідні фенілетилового ефіру кофеїнової кислоти, тирфостин, похідні тирфостину, кверцетин, похідні кверцетину, S-1360, зинтевір (AR-177), L870812, L-870810, MK-0518 (ралтегравір), елвітегравір, BMS-538158, GSK364735C, BMS-707035, MK-2048, BA 011, енфувіртид, сифувіртид, FB006M, TRI-1144, AMD-070, SP01A, BMS-488043, Blockaide/ CR, імунітин, похідні бензімідазолу, похідні бензо-1,2,4-тіадиазину, похідні фенілаланіну, аплавірок, вікривірок, і маравірок, циклоспорин, FK-506, рапаміцин, паклітаксел, таксотер, кларитроміцин, A-77003, A-80987, MK-639, саквінавір, VX-478, AG1343, DMP-323, XM450, BILA 2011 BS, BILA 1096 BS, BILA 2185 BS, BMS 186,318, LB71262, SC-52151, SC-629 (N, N-диметилгліцил-N-(2-гідрокси-3-(((4-метоксифеніл)сульфоніл)(2-метилпропіл)амін)-1 (фенілметил)пропіл)-3-метил-L-валінамід), KNI-272, CGP 53437, CGP 57813 і U-103017 і 4) 7 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятний носій або допоміжну речовину. Згідно з іншим варіантом реалізації цього винаходу запропоновані фармацевтичні композиції, що містять 1) сполуку формули (I), 2) множину частинок твердого носія і 3) два або три додаткові терапевтичні агенти. Наприклад, додаткових терапевтичних агенти, обраних із класу інгібіторів протеази ВІЛ, не нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ та інгібіторів інтегрази ВІЛ. Два або три додаткові терапевтичні агенти можуть бути різними терапевтичними агентами, обраними з одного класу терапевтичних агентів, або ж обраними з різних класів терапевтичних агентів. Згідно з іншим варіантом реалізації цього винаходу запропоновані фармацевтичні композиції, що містять 1) сполуку формули (I), 2) множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою 2 поверхнею, визначеною за методом БЕТ, від 40 до 400 м /г і 3) два або три додаткові терапевтичні агенти, наприклад, додаткових терапевтичних агенти, обраних із класу інгібіторів протеази ВІЛ, не нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеозидних інгібіторів зворотної транскриптази ВІЛ, нуклеотидних інгібіторів зворотної транскриптази ВІЛ та інгібіторів інтегрази ВІЛ. Два або три додаткові терапевтичні агенти можуть бути різними терапевтичними агентами, обраними з одного класу терапевтичних агентів, або ж обраними з різних класів терапевтичних агентів. Згідно з іншим варіантом реалізації винаходу запропоновані фармацевтичні композиції, що містять множину частинок твердого носія і трикомпонентну комбінацію агентів, обрану з наступних комбінацій: Формула (I)/дизопроксил фумарат тенофовіру/GS-9131, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/рілпівірин, Формула (I)/GS-9131/емтрицитабін, Формула (I)/GS-9131/елвітегравір, Формула (I)/GS-9131/ефавіренц, Формула (I)/GS-9131/атазанавір, Формула (I)/GS-9131/дарунавір, Формула (I)/GS-9131/ралтегравір, Формула (I)/GS9131/рілпівірин, Формула (I)/емтрицитабін/елвітегравір, Формула (I)/емтрицитабін/ефавіренц, Формула (I)/емтрицитабін/атазанавір, Формула (I)/емтрицитабін/дарунавір, Формула (I)/емтрицитабін/ралтегравір, Формула (I)/емтрицитабін/рілпівірин, Формула (I)/елвітегравір/ефавіренц, Формула (I)/елвітегравір/атазанавір, Формула (I)/елвітегравір/дарунавір, Формула (I)/елвітегравір/ралтегравір, Формула (I)/елвітегравір/рілпівірин, Формула (I)/ефавіренц/атазанавір, Формула (I)/ефавіренц/дарунавір, Формула (I)/ефавіренц/ралтегравір, Формула (I)/ефавіренц/рілпівірин, Формула (I)/атазанавір/дарунавір, Формула (I)/атазанавір/ралтегравір, Формула (I)/атазанавір/рілпівірин, Формула (I)/дарунавір/ралтегравір, Формула (I)/дарунавір/рілпівірин і Формула (I)/ралтегравір/рілпівірин. Згідно з іншим варіантом реалізації винаходу запропоновані фармацевтичні композиції, що містять множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, 2 від 40 до 400 м /г, і трикомпонентну комбінацію агентів, обраних з наступних комбінацій: Формула (I)/дизопроксил фумарат тенофовіру/GS-9131, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/рілпівірин, Формула (I)/GS-9131/емтрицитабін, Формула (I)/GS-9131/елвітегравір, Формула (I)/GS-9131/ефавіренц, Формула (I)/GS-9131/атазанавір, Формула (I)/GS9131/дарунавір, Формула (I)/GS-9131/ралтегравір, Формула (I)/GS-9131/рілпівірин, Формула (I)/емтрицитабін/елвітегравір, Формула (I)/емтрицитабін/ефавіренц, Формула (I)/емтрицитабін/атазанавір, Формула (I)/емтрицитабін/дарунавір, Формула (I)/емтрицитабін/ралтегравір, Формула (I)/емтрицитабін/рілпівірин, Формула (I)/елвітегравір/ефавіренц, Формула (I)/елвітегравір/атазанавір, Формула (I)/елвітегравір/дарунавір, Формула (I)/елвітегравір/ралтегравір, Формула (I)/елвітегравір/рілпівірин, Формула (I)/ефавіренц/атазанавір, Формула (I)/ефавіренц/дарунавір, Формула (I)/ефавіренц/ралтегравір, Формула (I)/ефавіренц/рілпівірин, Формула (I)/атазанавір/дарунавір, Формула (I)/атазанавір/ралтегравір, Формула (I)/атазанавір/рілпівірин, Формула (I)/дарунавір/ралтегравір, Формула (I)/дарунавір/рілпівірин і Формула 8 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 (I)/ралтегравір/рілпівірин. Згідно з іншим варіантом реалізації винаходу запропоновані фармацевтичні композиції, які включають множину частинок твердого носія і чотирьохкомпонентну комбінацію агентів, обрану з наступних комбінацій: Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/емтрицитабін, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/елвітегравір, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/GS9131/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/елвітегравір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/дарунавір/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/дарунавір/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/ралтегравір/рілпівірин, Формула (I)/GS-9131/емтрицитабін/елвітегравір, Формула (I)/GS-9131/емтрицитабін/ефавіренц, Формула (I)/GS-9131/емтрицитабін/атазанавір, Формула (I)/GS-9131/емтрицитабін/дарунавір, Формула (I)/GS-9131/емтрицитабін/ралтегравір, Формула (I)/GS-9131/емтрицитабін/рілпівірин, Формула (I)/GS-9131/елвітегравір/ефавіренц, Формула (I)/GS-9131/елвітегравір/атазанавір, Формула (I)/GS-9131/елвітегравір/дарунавір, Формула (I)/GS-9131/елвітегравір/ралтегравір, Формула (I)/GS-9131/елвітегравір/рілпівірин, Формула (I)/GS-9131/ефавіренц/атазанавір, Формула (I)/GS-9131/ефавіренц/дарунавір, Формула (I)/GS9131/ефавіренц/ралтегравір, Формула (I)/GS-9131/ефавіренц/рілпівірин, Формула (I)/GS9131/атазанавір/дарунавір, Формула (I)/GS-9131/атазанавір/ралтегравір, Формула (I)/GS9131/атазанавір/рілпівірин, Формула (I)/GS-9131/дарунавір/ралтегравір, Формула (I)/GS9131/дарунавір/рілпівірин, Формула (I)/GS-9131/ралтегравір/рілпівірин, Формула (I)/емтрицитабін/елвітегравір/ефавіренц, Формула (I)/емтрицитабін/елвітегравір/атазанавір, Формула (I)/емтрицитабін/елвітегравір/дарунавір, Формула (I)/емтрицитабін/елвітегравір/ралтегравір, Формула (I)/емтрицитабін/елвітегравір/рілпівірин, Формула (I)/емтрицитабін/ефавіренц/атазанавір, Формула (I)/емтрицитабін/ефавіренц/дарунавір, Формула (I)/емтрицитабін/ефавіренц/ралтегравір, Формула (I)/емтрицитабін/ефавіренц/рілпівірин, Формула (I)/емтрицитабін/атазанавір/дарунавір, Формула (I)/емтрицитабін/атазанавір/ралтегравір, Формула (I)/емтрицитабін/атазанавір/рілпівірин, Формула (I)/емтрицитабін/дарунавір/ралтегравір, Формула (I)/емтрицитабін/дарунавір/рілпівірин, Формула (I)/емтрицитабін/ралтегравір/рілпівірин, Формула (I)/елвітегравір/ефавіренц/атазанавір, Формула (I)/елвітегравір/ефавіренц/дарунавір, Формула (I)/елвітегравір/ефавіренц/ралтегравір, Формула (I)/елвітегравір/ефавіренц/рілпівірин, Формула (I)/елвітегравір/атазанавір/дарунавір, Формула (I)/елвітегравір/атазанавір/ралтегравір, Формула (I)/елвітегравір/атазанавір/рілпівірин, Формула (I)/елвітегравір/дарунавір/ралтегравір, Формула (I)/елвітегравір/дарунавір/рілпівірин, Формула (I)/елвітегравір/ралтегравір/рілпівірин, Формула (I)/ефавіренц/атазанавір/дарунавір, Формула (I)/ефавіренц/атазанавір/ралтегравір, Формула (I)/ефавіренц/атазанавір/рілпівірин, Формула (I)/ефавіренц/дарунавір/ралтегравір, Формула (I)/ефавіренц/дарунавір/рілпівірин, Формула (I)/ефавіренц/ралтегравір/рілпівірин, Формула (I)/атазанавір/дарунавір/ралтегравір, Формула (I)/атазанавір/дарунавір/рілпівірин, і Формула (I)/дарунавір/ралтегравір/рілпівірин. Згідно з іншим варіантом реалізації винаходу запропоновані фармацевтичні композиції, що 9 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 містять множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, 2 від 40 до 400 м /г і чотирьохкомпонентну комбінацію агентів, обрану з наступних комбінацій: Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/емтрицитабін, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/елвітегравір, Формула (I)/дизопроксил фумарат тенофовіру/GS9131/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/GS-9131/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/GS9131/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/елвітегравір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/емтрицитабін/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/ефавіренц, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/елвітегравір/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/атазанавір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/ефавіренц/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір/дарунавір, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/атазанавір/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/дарунавір/ралтегравір, Формула (I)/дизопроксил фумарат тенофовіру/дарунавір/рілпівірин, Формула (I)/дизопроксил фумарат тенофовіру/ралтегравір/рілпівірин, Формула (I)/GS-9131/емтрицитабін/елвітегравір, Формула (I)/GS-9131/емтрицитабін/ефавіренц, Формула (I)/GS-9131/емтрицитабін/атазанавір, Формула (I)/GS-9131/емтрицитабін/дарунавір, Формула (I)/GS-9131/емтрицитабін/ралтегравір, Формула (I)/GS-9131/емтрицитабін/рілпівірин, Формула (I)/GS-9131/елвітегравір/ефавіренц, Формула (I)/GS-9131/елвітегравір/атазанавір, Формула (I)/GS-9131/елвітегравір/дарунавір, Формула (I)/GS-9131/елвітегравір/ралтегравір, Формула (I)/GS-9131/елвітегравір/рілпівірин, Формула (I)/GS-9131/ефавіренц/атазанавір, Формула (I)/GS-9131/ефавіренц/дарунавір, Формула (I)/GS9131/ефавіренц/ралтегравір, Формула (I)/GS-9131/ефавіренц/рілпівірин, Формула (I)/GS9131/атазанавір/дарунавір, Формула (I)/GS-9131/атазанавір/ралтегравір, Формула (I)/GS9131/атазанавір/рілпівірин, Формула (I)/GS-9131/дарунавір/ралтегравір, Формула (I)/GS9131/дарунавір/рілпівірин, Формула (I)/GS-9131/ралтегравір/рілпівірин, Формула (I)/емтрицитабін/елвітегравір/ефавіренц, Формула (I)/емтрицитабін/елвітегравір/атазанавір, Формула (I)/емтрицитабін/елвітегравір/дарунавір, Формула (I)/емтрицитабін/елвітегравір/ралтегравір, Формула (I)/емтрицитабін/елвітегравір/рілпівірин, Формула (I)/емтрицитабін/ефавіренц/атазанавір, Формула (I)/емтрицитабін/ефавіренц/дарунавір, Формула (I)/емтрицитабін/ефавіренц/ралтегравір, Формула (I)/емтрицитабін/ефавіренц/рілпівірин, Формула (I)/емтрицитабін/атазанавір/дарунавір, Формула (I)/емтрицитабін/атазанавір/ралтегравір, Формула (I)/емтрицитабін/атазанавір/рілпівірин, Формула (I)/емтрицитабін/дарунавір/ралтегравір, Формула (I)/емтрицитабін/дарунавір/рілпівірин, Формула (I)/емтрицитабін/ралтегравір/рілпівірин, Формула (I)/елвітегравір/ефавіренц/атазанавір, Формула (I)/елвітегравір/ефавіренц/дарунавір, Формула (I)/елвітегравір/ефавіренц/ралтегравір, Формула (I)/елвітегравір/ефавіренц/рілпівірин, Формула (I)/елвітегравір/атазанавір/дарунавір, Формула (I)/елвітегравір/атазанавір/ралтегравір, Формула (I)/елвітегравір/атазанавір/рілпівірин, Формула (I)/елвітегравір/дарунавір/ралтегравір, Формула (I)/елвітегравір/дарунавір/рілпівірин, Формула (I)/елвітегравір/ралтегравір/рілпівірин, Формула (I)/ефавіренц/атазанавір/дарунавір, Формула (I)/ефавіренц/атазанавір/ралтегравір, Формула (I)/ефавіренц/атазанавір/рілпівірин, Формула (I)/ефавіренц/дарунавір/ралтегравір, Формула (I)/ефавіренц/дарунавір/рілпівірин, Формула (I)/ефавіренц/ралтегравір/рілпівірин, Формула (I)/атазанавір/дарунавір/ралтегравір, Формула (I)/атазанавір/дарунавір/рілпівірин і Формула (I)/дарунавір/ралтегравір/рілпівірин. Способи комбінованого лікування Відповідно до одного варіанту реалізації композиції згідно з винаходом, що містять сполуку 10 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 формули (I), можуть використовуватися окремо, наприклад, для інгібування монооксигенази цитохрому P-450. Згідно з іншим варіантом реалізації композиції згідно з винаходом можуть використовуватися в комбінації з іншими активними терапевтичними компонентами або агентами. Краще, інші активні терапевтичні компоненти або агенти метаболізуються ферментами сімейства цитохрому P-450 (або піддані цитохром P-450-залежному окисному метаболізму), наприклад, ферментами монооксигеназами, такими як 1A2, 2B6, 2C8, 2C19, 2C9, 2D6, 2E1, 3A4, 5, 7 і т.д. Також передбачається, що композиції згідно з винаходом, що містять сполуку формули (I), можуть бути введені разом з будь-яким іншим активним терапевтичним агентом або компонентом, який по суті метаболізується ферментами монооксигеназами сімейства цитохрому P-450, наприклад, монооксигеназою цитохромом P-450 3A, таким чином, знижуючи кількість іншого активного терапевтичного агента, що метаболізується, або компонента або швидкість, з якою він метаболізується, що приводить до поліпшення фармакокінетичних властивостей іншого активного терапевтичного агента або компонента. Таке поліпшення може включати підвищення рівня в плазмі крові іншого терапевтичного агента або компонент або підтримка більш ефективного з терапевтичної точки зору рівня в плазмі крові іншого терапевтичного активного агента або компонента у порівнянні з рівнем у плазмі крові цього терапевтичного агента або компонента при введенні його у відсутності композиції згідно з винаходом формули, що включає сполуку (I). Спільне введення сполуки формули (I) з одним або більше іншими активними терапевтичними агентами в цілому відноситься до одночасного або послідовного введення сполуки формули (I) і одного або більше інших активних терапевтичних агентів таким чином, щоб в організмі пацієнта була присутня терапевтично ефективна кількість як сполуки формули (I), так і одного або більше інших активних терапевтичних агентів. Спільне введення включає введення одиниць дозування сполуки формули (I) до або після введення одиниць дозування одного або більше інших активних терапевтичних агентів, наприклад, введення сполуки формули (I) протягом секунд, хвилин або годин після введення одного або більше активних терапевтичних агентів. Наприклад, спочатку може бути введена одинична доза сполуки формули (I) з наступним введенням протягом декількох секунд або хвилин одиничної дози одного або більше інших активних терапевтичних агентів. Альтернативно, спочатку може бути введена одинична доза одного або більше інших терапевтичних агентів з наступним введенням одиничної дози сполуки формули (I) протягом декількох секунд або хвилин. У деяких випадках може бути кращим початкове введення одиничної дози сполуки формули (I) з наступним введенням протягом декількох годин (наприклад, від 1 до 12 годин) одиничної дози одного або більше інших активних терапевтичних агентів. В інших випадках може бути кращим споконвічне введення одиничної дози одного або більше інших активних терапевтичних агентів з наступним введенням протягом декількох годин (наприклад, від 1 до 12 годин) одиничної дози сполуки формули (I). Згідно з ще одним варіантом цього винаходу запропонований спосіб поліпшення фармакокінетичних властивостей лікарського препарату, який метаболізується монооксигеназою цитохромом P-450, що включає введення пацієнтові, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом, що містить сполуку формули (I) і множину частинок твердого носія. Згідно з ще одним варіантом цього винаходу запропонований спосіб поліпшення фармакокінетичних властивостей лікарського препарату, який метаболізується монооксигеназою цитохромом P-450, що включає введення пацієнтові, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою 2/ поверхнею, визначеною за методом БЕТ, від 40 до 400 м г. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб поліпшення фармакокінетичних властивостей лікарського препарату, який метаболізується монооксигеназою цитохромом P-450, що включає введення пацієнтові, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія. Згідно з ще одним варіантом цього винаходу запропонований спосіб поліпшення фармакокінетичних властивостей лікарського препарату, який метаболізується монооксигеназою цитохромом P-450, що включає введення пацієнтові, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких 11 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою 2/ поверхнею, визначеною за методом БЕТ, від 40 до 400 м г. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб поліпшення фармакокінетичних властивостей лікарського препарату, який метаболізується монооксигеназою цитохромом P-450 3А, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб поліпшення фармакокінетичних властивостей лікарського препарату, який метаболізується монооксигеназою цитохромом P-450 3А, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою 2 поверхнею, визначеною за методом БЕТ, від 40 до 400 м /г. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб підвищення рівня в плазмі крові лікарського препарату, який метаболізується монооксигеназою цитохромом P450, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб підвищення рівня в плазмі крові лікарського препарату, який метаболізується монооксигеназою цитохромом P450, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, 2 від 40 до 400 м /г. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб підвищення рівня в плазмі крові лікарського препарату, який метаболізується монооксигеназою цитохромом P450, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб підвищення рівня в плазмі крові лікарського препарату, який метаболізується монооксигеназою цитохромом P450, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, 2 від 40 до 400 м /г. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб підвищення рівня в плазмі крові лікарського препарату, який метаболізується монооксигеназою цитохромом P-450 3А, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб підвищення рівня в плазмі крові лікарського препарату, який метаболізується монооксигеназою цитохромом P-450 3А, що включає введення пацієнту, що одержує лікування зазначеним лікарським препаратом, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, 2 від 40 до 400 м /г. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб інгібування монооксигенази цитохрому P-450 3A у пацієнта, що включає введення пацієнту, що потребує такого введення, кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія, ефективної для інгібування монооксигенази цитохрому P-450 3A. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб інгібування монооксигенази цитохрому P-450 3A у пацієнта, що включає введення пацієнту, що потребує такого введення, кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від 40 до 12 UA 101193 C2 2 5 10 15 20 25 30 35 40 45 50 55 60 400 м /г, ефективної для інгібування монооксигенази цитохрому P-450 3A. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб лікування ВІЛінфекції, що включає введення пацієнту, що потребує такого введення, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія, у комбінації з терапевтично ефективною кількістю одного або більше додаткових терапевтичних агентів, обраних із групи, що включає сполуки, що інгібують протеазу ВІЛ, не нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеотидні інгібітори зворотної транскриптази ВІЛ, інгібітори інтегрази ВІЛ та інгібітори CCR5. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб лікування ВІЛінфекції, що включає введення пацієнту, що потребує такого введення, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок 2 від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від 40 до 400 м /г, у комбінації з терапевтично ефективною кількістю одного або більше додаткових терапевтичних агентів, обраних із групи, що включає сполуки, що інгібують протеазу ВІЛ, не нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеозидні інгібітори зворотної транскриптази ВІЛ, нуклеотидні інгібітори зворотної транскриптази ВІЛ, інгібітори інтегрази ВІЛ та інгібітори CCR5. Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб лікування ВІЛінфекції, що включає введення пацієнту, що потребує такого введення, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія, у комбінації з терапевтично ефективною кількістю одного або більше додаткових терапевтичних агентів, обраних із групи, що включає ампренавір, атазанавір, фосампренавір, індинавір, лопінавір, ритонавір, нелфінавір, саквінавір, типранавір, бреканавір, дарунавір, TMC-126, TMC-114, мозенавір (DMP-450), JE-2147 (AG1776), L-756423, RO0334649, KNI-272, DPC-681, DPC-684, і GW640385X, DG17, PPL-100, DG35, AG 1859, каправірин, емівірин, делавіридин, ефавіренц, невірапін, (+) каланолід A, етравірин, GW5634, DPC-083, DPC-961, DPC-963, MIV-150, TMC-120, TMC-278 (рілпівірин), ефавіренц, BILR 355 BS, VRX 840773, UK-453061, RDEA806, зидовудин, емтрицитабін, діданозин, ставудин, залцитабін, ламівудин, абакавір, амдоксовір, елвуцитабін, аловудин, MIV-210, рацивір (-FTC), D-d4FC, емтрицитабін, фосфазид, фозивудин тідоксил, априцитібтин (AVX754), амдоксовір, KP-1461, фосалвудин тідоксил (раніше HDP 99.0003), дизопроксил фумарат тенофовіру, адефовір дипівоксил, куркумін, похідні куркуміну, цикорієву кислоту, похідні цикорієвої кислоти, 3,5дикафеоліхінову кислоту, похідні 3,5-дикафеоліхінової кислоти, ауринтрикарбонову кислоту, похідні ауринтрикарбонової кислоти, фенілетиловий ефір кофеїнової кислоти, похідні фенілетилового ефіру кофеїнової кислоти, тирфостин, похідні тирфостину, кверцетин, похідні кверцетину, S-1360, зинтевір (AR-177), L-870812, L-870810, MK-0518 (ралтегравір), елвітегравір, BMS-538158, GSK364735C, BMS-707035, MK-2048, і BA 011, енфувіртид, сифувіртид, FB006M, і TRI-1144, AMD-070, інгібітор проникнення, SP01A, BMS-488043, BlockAide/ CR, a G6PD та інгібітор NADH-оксидази, імунітин, аплавірок, вікривірок вікривірок, маравірок, PRO-140, INCB15050, PF-232798 (Pfizer), CCR5mAb004, BAS-100, SPI-452, REP 9, SP-01A, TNX-355, DES6, ODN-93, ODN-112, VGV-1, PA-457 (бевіримат), Ампліген, HRG214, Цитолін, VGX-410, KD247, AMZ 0026, CYT 99007A-221 HIV, DEBIO-025, BAY 50-4798, MDX010 (іпілімумаб), PBS 119, ALG 889 і PA-1050040 (PA-040). Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб лікування ВІЛінфекції, що включає введення пацієнту, що потребує такого введення, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок 2 від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від 40 до 400 м /г, у комбінації з терапевтично ефективною кількістю одного або більше додаткових терапевтичних агентів, обраних із групи, що включає ампренавір, атазанавір, фосампренавір, індинавір, лопінавір, ритонавір, нелфінавір, саквінавір, типранавір, бреканавір, дарунавір, TMC-126, TMC114, мозенавір (DMP-450), JE-2147 (AG1776), L-756423, RO0334649, KNI-272, DPC-681, DPC684, і GW640385X, DG17, PPL-100, DG35, AG 1859, каправірин, емівірин, делавіридин, ефавіренц, невірапін, (+) каланолід A, етравірин, GW5634, DPC-083, DPC-961, DPC-963, MIV150, TMC-120, TMC-278 (рілпівірин), ефавіренц, BILR 355 BS, VRX 840773, UK-453061, RDEA806, зидовудин, емтрицитабін, діданозин, ставудин, залцитабін, ламівудин, абакавір, амдоксовір, елвуцитабін, аловудин, MIV-210, рацивір (-FTC), D-d4FC, емтрицитабін, фосфазид, фозивудин тідоксил, априцитібтин (AVX754), амдоксовір, KP-1461, фосалвудин тідоксил (раніше HDP 99.0003), дизопроксил фумарат тенофовіру, адефовір дипівоксил, куркумін, похідні 13 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 куркуміну, цикорієву кислоту, похідні цикорієвої кислоти, 3,5-дикафеоліхінову кислоту, похідні 3,5-дикафеоліхінової кислоти, ауринтрикарбонову кислоту, похідні ауринтрикарбонової кислоти, фенілетиловий ефір кофеїнової кислоти, похідні фенілетилового ефіру кофеїнової кислоти, тирфостин, похідні тирфостину, кверцетин, похідні кверцетину, S-1360, зинтевір (AR-177), L870812, L-870810, MK-0518 (ралтегравір), елвітегравір, BMS-538158, GSK364735C, BMS-707035, MK-2048, і BA 011, енфувіртид, сифувіртид, FB006M, і TRI-1144, AMD-070, інгібітор проникнення, SP01A, BMS-488043, BlockAide/ CR, G6PD та інгібітор NADH-оксидази, імунітин, аплавірок, вікривірок, маравірок, PRO-140, INCB15050, PF-232798 (Pfizer), CCR5mAb004, BAS100, SPI-452, REP 9, SP-01A, TNX-355, DES6, ODN-93, ODN-112, VGV-1, PA-457 (бевіримат), Ампліген, HRG214, Цитолін, VGX-410, KD-247, AMZ 0026, CYT 99007A-221 HIV, DEBIO-025, BAY 50-4798, MDX010 (іпілімумаб), PBS 119, ALG 889, і PA-1050040 (PA-040). Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб лікування інфекції ВГС, що включає введення пацієнту, що потребує такого введення, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок твердого носія, у комбінації з терапевтично ефективною кількістю одного або більше додаткових терапевтичних агентів, обраних із групи, що включає пегільований рІФН-альфа 2b, пегільований рІФН-альфа 2a, рІФН-альфа 2b, рІФН-альфа 2a, консенсус ІФН-альфа (інферген), реаферон, інтермакс альфа, рІФН-бета, інферген + актимун, DUROS-ІФН-омега, локтерон, альбуферон, ребіф, інтерферон-альфа для перорального введення, ІФН-альфа 2b XL, AVI-005, ПЕГ-інферген, і пегільований ІФН-бета, ребетол, копегус, вірамідин (тарибавірин), NM-283, валопіцитабін, R1626, PSI-6130 (R1656), HCV-796, BILB 1941, XTL-2125, MK-0608, NM-107, R7128 (R4048), VCH-759, PF-868554, GSK625433, SCH-503034 (SCH-7), VX-950 (телапревір), BILN-2065, BMS-605339, ITMN-191, MX-3253 (целгосивір), UT-231B, IDN-6556, ME 3738, LB84451, MitoQ, похідні бензімідазолу, похідні бензо-1,2,4-тіадиазину, похідні фенілаланіну, A-831, A-689, задаксин, нітазоксанід (Аліну), BIVN-401 (віростат), PYN-17 (altirex), KPE02003002, актилон (CPG-10101), KRN-7000, civacir, GI-5005, ANA-975, XTL-6865, ANA 971, NOV-205, тарвацин, EHC-18, NIM811, DEBIO-025, VGX-410C, EMZ-702, AVI 4065, Бавітуксимаб, Oglufanide, і VX-497 (меримеподіб). Згідно з ще одним варіантом реалізації в цій заявці запропонований спосіб лікування інфекції ВГС, що включає введення пацієнту, що потребує такого введення, терапевтично ефективної кількості композиції згідно з винаходом формули, що містить сполуку (I) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок 2 від 10 до 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від 40 до 400 м /г, у комбінації з терапевтично ефективною кількістю одного або більше додаткових терапевтичних агентів, обраних з групи, що включає пегільований рІФН-альфа 2b, пегільований рІФН-альфа 2a, рІФН-альфа 2b, рІФН-альфа 2a, консенсус ІФН-альфа (інферген), реаферон, інтермакс альфа, рІФН-бета, інферген + актимун, DUROS-ІФН-омега, локтерон, альбуферон, ребіф, Інтерферон-альфа для перорального введения, ІФН-альфа 2b XL, AVI-005, PEGІнферген, і пегільований ІФН-бета, ребетол, копегус, вірамідин (тарибавірин), NM-283, валопіцитабін, R1626, PSI-6130 (R1656), HCV-796, BILB 1941, XTL-2125, MK-0608, NM-107, R7128 (R4048), VCH-759, PF-868554, GSK625433, SCH-503034 (SCH-7), VX-950 (телапревір), BILN-2065, BMS605339, ITMN-191, MX-3253 (целгосивір), UT-231B, IDN-6556, ME 3738, LB-84451, MitoQ, похідні бензімідазолу, похідні бензо-1,2,4-тіадиазину, похідні фенілаланіну, A-831, A-689, задаксин, нітазоксанід (Аліну), BIVN-401 (віростат), PYN-17 (altirex), KPE02003002, актилон (CPG-10101), KRN-7000, civacir, GI-5005, ANA-975, XTL-6865, ANA 971, NOV-205, тарвацин, EHC-18, NIM811, DEBIO-025, VGX-410C, EMZ-702, AVI 4065, Бавітуксимаб, Oglufanide і VX-497 (меримеподіб). Конкретні варіанти реалізації винаходу Конкретні варіанти реалізації, описані в даній заявці, є винятково ілюстративними і жодним чином не виключають інші варіанти реалізації винаходу. Відповідно до одного конкретного варіанту реалізації винаходу запропонований спосіб, що включає комбінування сполуки формули (I): 14 UA 101193 C2 O N Ph O S N N O H N N H 10 15 20 25 O O (I) 5 S N H N Ph придатного розчинника і множину частинок твердого носія для одержання першої суміші; можливе перемішування першої суміші; можливе додавання одного або більше фармацевтично прийнятних допоміжних речовин (наприклад, наповнювача, зв'язувальної речовини і розпушувача) до суміші для одержання другої суміші; можливе додавання іншого терапевтичного агента до суміші; можливе перемішування другої суміші; можливе додавання води до другої суміші для одержання вологого грануляту; можлива деагломерація вологого грануляту; можливе сушіння для одержання висушеного матеріалу, який включає тверді частинки; можливе здрібнювання твердих частинок для одержання третьої суміші; і можливе комбінування третьої суміші і фармацевтично прийнятної змащувальної речовини для одержання четвертої суміші. Відповідно до одного конкретного варіанту реалізації винаходу запропоновані перша, друга, третя або четверта суміш, описані вище. Відповідно до одного конкретного варіанту реалізації винаходу запропонована композиція, що включає сполуку формули (I), або її фармацевтично прийнятну сіль, і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від 2 приблизно 40 до приблизно 400 м /г. Далі винахід проілюстрований за допомогою необмежуючих Прикладів. Одержання сполуки формули (Ia) Сполука формули (Ia), або її сіль, може бути отримана шляхом сполучення кислої солі формули X, де M являє собою протиіон, з аміном формули IX з формуванням відповідного аміду формули (Ia), як описано в публікації міжнародної заявки WO 2008/103949 (наприклад, див. стор.254). O N Ph O O Me N H N N H2N + O M O N H N Ph X S S O IX O N Ph O S N N N H H N O O N H O S N Ph Ia 15 Organic solvent UA 101193 C2 5 10 15 20 25 30 35 40 45 Organic solvent - Органічний розчинник Реакцію формування аміду можна здійснювати при стандартних умовах. Наприклад, її можна проводити в придатному органічному розчиннику (наприклад, тетрагідрофурані або дихлорметані) у присутності придатного єднального агента (наприклад, EDC•HCl і HOBt). Інші придатні умови і єднальні реагенти для аміду відомі в даній галузі. Реакцію звичайно проводять при температурі від приблизно -30 °C до приблизно 20 °C. Кінцевий реакційний розчин, що включає сполуку формули (Ia) у дихлорметані (ДХМ), можна безпосередньо використовувати в процесах, представлених на Фігурі 6, з одержанням типових композицій згідно з винаходом, або ж розчин сполуки в дихлорметані може бути змішаний з етанолом, і отримана в результаті суміш може бути очищена з видаленням дихлорметану і одержанням розчину сполуки формули (Ia) в етанолі. Цей розчин в етанолі може бути змішаний із частками діоксиду кремнію та випарений (як показано в лівому стовпчику Фігури 6) для одержання композиції, що включає сполуку формули (Ia), навантажену на частинки діоксиду кремнію. Альтернативно, розчин сполуки в дихлорметані може бути змішаний із частками діоксиду кремнію, доданий антирозчинник і отримана в результаті суміш може бути відфільтрована та висушена (як показано в правому стовпчику Фігури 6) з одержанням композиції, що включає сполуку формули (Ia), навантажену на частинки діоксиду кремнію. Приклад 1. Одержання типової композиції згідно з винаходом Розчин сполуки формули (Ia) в етанолі, приготовлений як описано вище, використовували в наступному процесі. 1. Зважували 374 г розчину сполуки (0.64 M) і допоміжні речовини: 195,5 г колоїдного діоксиду кремнію, 103,7 г мікрокристалічної целюлози, 10,2 г гідроксипропілцелюлози, 25,5 г кроскармелози натрію і 5,1 г стеарату магнію. Коректували масу сполуки виходячи з концентрації розчину і вмісту домішок з відповідним зниженням маси мікрокристалічної целюлози. 2. Додавали колоїдний діоксид кремнію в 3-l гранулятор з великим зусиллям зрушення і розпорошували розчин сполуки на колоїдний діоксид кремнію протягом 6-8 хвилин при перемішуванні порошку при швидкості обертання лопаті 150 об/хв. 3. Перемішували протягом додаткових 2 хвилин для рівномірного розподілу розчину сполуки в суміші колоїдного діоксиду кремнію. 4. Додавали мікрокристалічну целюлозу, гідроксипропілцелюлозу і кроскармелозу натрію в гранулятор з великим зусиллям зрушення/змішувач і перемішували протягом 1 хвилини. 5. Проводили вологу грануляцію суміші, що перемішується. Додавали очищену воду, гомогенізуючи при цьому при швидкості обертання лопаті 150 об/хв і швидкості обертання подрібнювача 1800 об/хв, з формуванням прийнятного грануляту (приблизно 250-300 г води). Після додавання води, масу зволожнювали при тих же параметрах обертання лопаті та подрібнювача протягом 1 хвилини. При необхідності додавали ще воду і проводили додаткову грануляцію вологої маси для завершення процесу формування гранул. 6. Вологий гранулят пропускали крізь млин або сито для руйнування великих агломератів. 7. Вологий гранулят переносили на сушарку в псевдозрідженому шарі і висушували гранули при температурі на вході 75 °C. Гранули сушили доти, доки вміст вологи не становив не більше ніж 1,0 %, що визначали на підставі втрати в масі при висушуванні (loss on drying, LOD). 8. Висушений гранулят пропускали крізь млин при швидкості обертання лопаті 1250 об/хв із гніздом млинарського сита 0,032 дюйма. 9. Здрібнений висушений гранулят переносили у барабанний змішувач придатного розміру. 10. До здрібненого висушеного грануляту додавали стеарат магнію і гомогенізували протягом 3 хвилин з одержанням кінцевої порошкоподібної суміші. 11. Кінцеву порошкоподібну суміш пресували у таблетки з використанням таблеткового преса. 50 55 60 Приклад 2. Оцінка поглинання води для типової композиції згідно з винаходом Значення поглинання води для AEROPERL® 300 (високодисперсного діоксиду кремнію), Сполуки й зразка AEROPERL® 300 (високодисперсного діоксиду кремнію), навантаженого 50,0 % (мас.) Сполуки, вимірювали, як описано нижче. Сполуку формули (I) розчиняли в етанолі і отриманий розчин наносили на зразок високодисперсного діоксиду кремнію, рівний за масою кількості сполуки формули (I). Отриману в результаті суміш інтенсивно перемішували і розчинник випарювали для одержання матеріалу сполуки/AEROPERL® 300 (високодисперсний діоксид кремнію), який використовували в аналізі поглинання, нижче. Гігроскопічність зразків вимірювали на підставі динаміки поглинання пари (dynamic vapor 16 UA 101193 C2 5 10 15 20 25 sorption, DVS) на приладі DVS Advantage-1 (Surface Measurement Systems, SMS, Allentown, PA). В експерименті на DVS збільшення/зниження маси зразка вимірювали при різних рівнях відносної вологості (%ВВ) при постійній температурі. Прилад включає мікроваги з однією ємністю, що містить зразок (як правило приблизно 5-10 мг зразку), і порожньою ємністю для порівняння і генератор водяної пари для досягнення бажаного рівня відносної вологості. Усі експерименти проводили при постійній температурі 25 °C. У випадку всіх експериментів зразки спочатку висушували під безперервним струмом сухого азоту протягом 1 години для одержання сухої маси m0. Відносну вологість потім підвищували до 75 % і в міру того, як зразки поглинали воду, фіксували збільшення маси. Усі експерименти проводилися доти, доки не досягалося масової рівноваги при 75 % ВВ (як правило, протягом 10-25 годин). Як показано на Фігурі 2, гігроскопічність AEROPERL® 300 (високодисперсного діоксиду кремнію) і гігроскопічність Сполуки значно вище, ніж гігроскопічність суміші сполука/AEROPERL® 300 (високодисперсний діоксид кремнію). При 75 % ВВ Сполуку і Aeroperl адсорбували 4,8 і 9,3 % (мас.) води, відповідно. За тих самих умов Aeroperl, навантажений Сполукою, адсорбував тільки 2,4 % вологи. Приклад 3. Оцінка пресованості типової композиції згідно з винаходом Пресованість композиції згідно з винаходом - зразку AEROPERL® 300 (високодисперсного діоксиду кремнію), навантаженого 50,0 % (мас.) Сполуки - порівнювали із пресованістю подібної композиції, що не включає Сполуку. Пресованість визначали з використанням гідравлічного лабораторного преса (Fred Carver, Inc., Wabash, IN, США) з єдиною круглою 3/8 - дюймовою плоскою плитою зі скошеними краями. Порошкоподібні суміші пресували з одержанням пресовок масою приблизно 300 мг і пресували в таблетки при силі пресування в межах від 500 до 2000 фунтів. Масові пресовки визначали за допомогою ваг з верхнім навантаженням (Sartorius, Göttingen, Німеччина), товщину пресовки визначали з використанням мікрометра (Absolute Digimatic, Mitutoyo, Токіо, Японія) і міцність пресовки визначали з використанням тестера міцності (VK 200, Varian, Inc., Palo Alto, CA, США). Межа міцності (МПа) розраховували із середніх значень для десяти пресовок з використанням наступного рівняння: TensileStrength (MPa) 30 35 40 45 50 55 2HC T D 1000 Де: Tensile Strenth (Mpa)= Межа міцності (МПа) H = міцність пресовки, кгс (кілограм-сила, 1 кгс дорівнює силі тиску маси 1 кг) -1 2 C=9.807 × 10-2 Пакг см T = товщина пресовки, см D = діаметр пресовки, см Сполуку формули (I) навантажували на високодисперсний діоксид кремнію, як описано в Прикладі 1, і отриманий у результаті матеріал використовували для оцінки пресованості. Пресованість композиції, що включає Сполуку, була набагато більшою у порівнянні з пресованістю композиції, що не включає Сполуку (тобто, плацебо), як показано на Фігурі 3. Плацебо-композиція мала слабку пресованість, на що вказує низька межа міцності в діапазоні від 0,6 до 1,2 МПа при силі пресування в межах від 500 до 2000 фунтів. Таблетки з низької межею міцності не мають внутрішньої сили, необхідної для підтримки їх цілісності в процесі виробництва таблеток у промислових масштабах і наступних етапів обробки, таких як нанесення плівкового покриття. Композиція, що включає Сполуку, несподіваним чином проявляла підвищену здатність до пресування, на що вказує збільшення межі міцності від 2,7 до 7,1 МПа при силі пресування в межах від 500 до 2000 фунтів. Це значне поліпшення показника межі міцності може забезпечити прийнятна межа міцності і здатність підтримки цілісності таблетки в процесі виробництва таблеток у промислових масштабах. Приклад 4. Одержання сполуки I, навантаженої на Aeroperl Розчин сполуки формули (Ia) (60 г) у дихлорметані (300 мл) наповнювали Aeroperl (60 г) і суміш перемішували протягом щонайменше 30 хвилин. Після цього повільно додавали гептан (1,8 л) протягом однієї години. Отриману в результаті суспензію перемішували протягом приблизно 1 години і тверду речовину виділяли шляхом фільтрації. Шар продукту промивали гептаном (500 мл). Отриманий у результаті продукт у вигляді твердої речовини сушили у вакуумі при кімнатній температурі протягом приблизно 24 годин. Сполуку формули (I), навантажену на Aeroperl, (приблизно 50 % за масою) виділяли у вигляді білого порошку (112 г продукту, вихід 92,5 %). Приклад 5. Типові лікарські форми згідно з винаходом 17 UA 101193 C2 Далі йдуть приклади типових фармацевтичних форм дозування згідно з винаходом, що включають сполуки формул Ia, II, III і IV. O HO N H CH3 Ph O S N N N H H N O CH 3 O N H O H 3C S O N OH N Ph F O O Ia Cl II . 5 Компоненти Сполука формули III Сіль формули IV Сполука формули II Сполука формули Ia Колоїдний діоксид кремнію Моногідрат лактози Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Всього 10 Лікарська форма сполуки формули Ia (75 мг) Мас. % мг у таблетці 16,5 200,0 24,7 300,0 12,4 150,0 6,2 75,0 7,1 86,3 0,9 10,9 20,9 253,8 0,6 7,5 0,4 4,5 0,9 11,3 7,7 93,1 1,7 20,1 100 1212 Лікарська форма сполуки формули Ia (100 мг) Мас. % мг у таблетці 15,5 200,0 23,3 300,0 11,7 150,0 7,8 100,0 8,9 115,0 0,8 10,9 20,9 269,0 0,6 7,5 0,5 6,0 0,9 11,3 7,5 96,8 1,6 20,9 100 1287 Приклад 6. Типові лікарські форми згідно з винаходом Далі йдуть приклади типових фармацевтичних форм дозування згідно з винаходом, що включають сполуки формул Ia, II, III, і IV. Компоненти Сполука формули III Сіль формули IV Сполука формули II Сполука формули Ia Колоїдний діоксид кремнію Моногідрат лактози Мікрокристалічна целюлоза Гідроксипропілцелюлоза Гідроксипропілцелюлоза Лаурилсульфат натрію Кроскармелоза натрію Стеарат магнію Всього Лікарська форма сполуки формули Ia (150 мг) Мас. % мг у таблетці 13,9 200,0 20,9 300,0 10,4 150,0 10,4 150,0 12,0 172,5 0,8 10,9 20,8 299,5 0,5 7,5 0,6 9,0 0,8 11,3 7,3 104,3 1,6 22,4 100 1437 18 UA 101193 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 7. Типові композиції згідно з винаходом Відповідно до одного варіанту реалізації винаходу запропонована композиція, що містить сполуку формули (Ia) і сполуку формули (II) і множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, визначеною за методом БЕТ, від приблизно 40 до приблизно 2 400 м /г, де масове відношення сполуки формули (Ia) до сполуки формули (II) становить 1±0.5. Приклад 8. Типові композиції згідно з винаходом Відповідно до одного варіанту реалізації винаходу запропонована композиція, що включає 150 мг ± 10 % сполуки формули Ia; 150 мг ± 10 % сполуки формули II; 200 мг ± 10 % сполуки формули III і 300 мг ± 10 % сполуки формули IV. Приклад 9. Одержання типових лікарських форм згідно з винаходом у вигляді таблеток Процес виготовлення комбінованої таблетки з фіксованою дозою, що містить сполуки формул Ia, II, III і IV, включає наступні етапи: 1) грануляція в псевдозрідженому шарі і висушування сполуки формули II, 2) грануляція з великим зусиллям зрушення і сушіння в псевдозрідженому шарі сполуки формули Ia, 3) суха грануляція сполуки формули III і суха грануляція солі Формули IV, 4) здрібнювання сухого грануляту сполуки формули III і здрібнювання сухого грануляту солі Формули IV, 5) гомогенізовані сполуки формули III і солі Формули IV, 6) гомогенізовані сполуки формули Ia і сполуки формули II, 7) двошарове пресування з одним шаром, що включає суміш сполуки формули Ia і Формули II, та іншим шаром, що включає суміш сполуки формули III і Формули IV, з формуванням таблетки, 8) покриття таблеток і 9) упаковка покритих таблеток. Сполука формули (Ia) навантажувалася на високодисперсний діоксид кремнію на етапі 2), вище, за допомогою грануляції з більшим зусиллям зрушення і процесу сушіння в псевдозрідженому шарі, описаного в Прикладі 1. Внутрішній контроль маси для двошарової таблетки був вище у порівнянні з контролем для тришарової таблетки. Контроль маси для двошарових таблеток для шару, що включає сполуку формули Ia і Формули II, становить між 100,2 % і 100,8 % від середньої маси контрольного шару. Середня маса цілої таблетки становила між 99,5 % і 100,7 % від середньої маси контрольної таблетки. Значення відносного стандартного відхилення (ВСВ) для шару, що містить сполуки формули Ia і Формули II, перебувало в межах від 1,4 % до 2,2 %, тоді як ВСВ для цілої таблетки становило між 0,7 % і 1,2 %. Такі низькі значення ВСВ вказують на слабку варіабельність ваги в ході процесу пресування двошарової таблетки. Ламкість таблеток на початку і наприкінці процесу пресування становила 0,0 %. Не спостерігалося відколотих, ушкоджених або зламаних таблеток під час процесу двошарового пресування. Приклад 10. Одержання типової композиції згідно з винаходом Типову композицію згідно з винаходом, що включає діоксид кремнію як твердий носій, одержували, як описано нижче. 1. Зважували 7,7 г розчину сполуки (в етанолі) і допоміжні речовини: 3,83 г діоксиду кремнію, 2,03 г мікрокристалічної целюлози, 0,2 г гідроксипропілцелюлози, 0,5 г кроскармелози натрію і 0,1 г стеарату магнію. Коректували масу сполуки на основі концентрації розчину і вмісту домішок із супутнім зниженням маси мікрокристалічної целюлози. 2. Додавали діоксид кремнію (syloid 244) у ступку і наносили розчин сполуки на діоксид кремнію протягом 1-2 хвилин при перемішуванні порошку за допомогою товкачика. 3. Перемішували протягом додаткових 2 хвилин для рівномірного розподілу розчину сполуки в суміші діоксиду кремнію. 4. Додавали мікрокристалічну целюлозу, гідроксипропілцелюлозу і кроскармелозу натрію в ступку та перемішували протягом 1 хвилини. 5. Проводили вологу грануляцію перемішаної суміші. Додавали очищену воду при перемішуванні товкачиком з одержанням прийнятного грануляту (приблизно 7,5 г води). 6. Вологий гранулят пропускали крізь сито для руйнування великих агломератів. 7. Вологий гранулят переносили на поличну сушарку і сушили гранули при 50 °C. Гранули сушили до вмісту вологи не більш ніж 1,0 %, що визначається на основі втрати в масі при висушуванні (LOD). 8. Висушений гранулят пропускали крізь сито. 9. Перемелений висушений гранулят додавали у барабанний змішувач придатного розміру. 10. Стеарат магнію додавали до перемеленого висушеного грануляту і перемішували протягом 1 хвилини з одержанням кінцевої порошкоподібної суміші. 11. Кінцеву порошкоподібну суміш пресували у таблетки з використанням таблеткового преса. Додаткові типові композиції згідно з винаходом також одержували за допомогою процесів, 19 UA 101193 C2 30 що відповідають якому-небудь із вищеописаних способів, за винятком заміщення діоксиду кремнію, що використовується в цих способах, на тальк, Aerosil 200 або Aerosli 200 VV. Приклад 11. Одержання типової композиції згідно з винаходом Типову композицію згідно з винаходом одержували, як описано нижче і як показано на Фігурі 4. 1. Зважували 74,4 г сполуки I, навантаженої на Aeroperl (готували, як описано в Прикладі 4) і допоміжні речовини: 20,1 г мікрокристалічної целюлози, 5,02 г кроскармелози натрію, і 0,5 г стеарату магнію. Коректували масу сполуки на підставі процентного навантаження сполуки на кремеоксидний матеріал і вмісту домішок з відповідним зменшенням маси мікрокристалічної целюлози. 2. Додавали сполуку I на Aeroperl, мікрокристалічну целюлозу і кроскармелозу натрію в змішувач. Гомогенізували протягом 5 хвилин. 3. Додавали стеарат магнію і гомогенізували протягом 3 хвилин. 4. Висушений гранулят гомогенізували з використанням роликового преса. Використовували наступні параметри: проміжок = 1,5 мм, сила 3,0 кН і розмір гнізд 0,8 мм. 5. Гранулят пропускали крізь млин або сито для руйнування великих агломератів. 6. Кінцеву порошкоподібну суміш пресували у таблетки з використанням таблеткового преса. Приклад 12. Одержання типової композиції згідно з винаходом Типова композиція згідно з винаходом може бути отримана, як описано нижче і як показано на Фігурі 5. Зважували 40,9 г сполуки I, навантаженої на Aeroperl (приготовлений, як описано в Прикладі 4) і допоміжні речовини: 15,8 г мікрокристалічної целюлози, 3,0 г кроскармелози натрію і 0,3 г стеарату магнію. Коректували масу сполуки на основі процентного навантаження сполуки на діоксид кремнію і вмісту домішок з відповідним зменшенням маси мікрокристалічної целюлози. 1. Додавали сполуку I на Aeroperl, мікрокристалічну целюлозу і кроскармелозу натрію в змішувач. Перемішували протягом 5 хвилин. 2. Додавали стеарат магнію і перемішували протягом 3 хвилин. 3. Пресували кінцеву порошкоподібну суміш у таблетки з використанням таблеткового преса. 35 Приклад 13. Типові лікарські форми згідно з винаходом Далі йдуть приклади типових фармацевтичних форм дозування, що включають сполуку формули I ("Сполука X"), для використання в терапевтичних або профілактичних цілях у людини. 5 10 15 20 25 Таблетка 1 Сполука X Діоксид кремнію (AEROPERL® 300 (високодисперсний діоксид кремнію) Мікрокристалічна целюлоза (Avicel PH101) Гідроксипропілцелюлоза (Klucel LF) Кроскармелоза натрію (Ac - Di - Sol) Стеарат магнію (Hyqual) мг у таблетці 10,0 Таблетка 2 Сполука X Діоксид кремнію 300AEROPERL® (високодисперсний діоксид кремнію) Мікрокристалічна целюлоза (Avicel PH101) мг у таблетці 25,0 115,0 151,0 6,0 15,0 3,0 300,0 115,0 136,0 20 UA 101193 C2 Гідроксипропілцелюлоза (Klucel LF) Кроскармелоза натрію (Ac - Di - Sol) Стеарат магнію (Hyqual) 6,0 15,0 3,0 300,0 Таблетка 3 Сполука X Діоксид кремнію AEROPERL® 300 (високодисперсний діоксид кремнію) Мікрокристалічна целюлоза (Avicel PH101) Гідроксипропілцелюлоза (Klucel LF) Кроскармелоза натрію (Ac - Di - Sol) Стеарат магнію (Hyqual) Таблетка 4 Сполука X Діоксид кремнію (наприклад, Syloid 244) Мікрокристалічна целюлоза (Avicel PH101) Гідроксипропілцелюлоза (Klucel LF) Кроскармелоза натрію (Ac - Di - Sol) Стеарат магнію (Hyqual) 5 10 мг у таблетці 100,0 мг у таблетці 150,0 115 61,0 6,0 15,0 3,0 300,0 172,5 91,5 9,0 22,5 4,5 450,0 Перераховані вище лікарські форми можуть бути отримані за допомогою стандартних методів, добре відомих в галузі фармацевтики. Усі публікації, патенти та патентні документи включені в дану заявку за допомогою посилання, як якби вони були окремо включені за допомогою посилань. Винахід описаний на прикладі різних конкретних і кращих варіантів і способів реалізації. Однак, необхідно розуміти, що в рамках цього винаходу можливі різні варіації і модифікації розглянутих варіантів та способів реалізації в обсязі винаходу. ФОРМУЛА ВИНАХОДУ 15 1. Композиція, яка містить множину частинок твердого носія, кожна з яких має поверхню і/або пори; і сполуку формули (І): O N Ph O H N S N N O S N H N H O N O Ph (I) 21 UA 101193 C2 5 10 15 20 або її фармацевтично прийнятну сіль, у порах або на поверхні частинок твердого носія. 2. Композиція за п. 1, яка відрізняється тим, що кожна частка твердого носія включає каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк. 3. Композиція за п. 1, яка відрізняється тим, що множина частинок твердого носія являє собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок приблизно від 10 до приблизно 120 мікронів, і питомою поверхнею, визначеною за 2 методом БЕТ, від приблизно 40 до приблизно 400 м /г. 4. Композиція за п. 3, яка відрізняється тим, що діоксид кремнію являє собою гідрофільний високодисперсний діоксид кремнію. 5. Композиція за будь-яким з пп. 3-4, яка відрізняється тим, що частинки діоксиду кремнію мають середній діаметр 20-40 мікронів. 6. Композиція за будь-яким з пп. 3-5, яка відрізняється тим, що частинки діоксиду кремнію 2 мають питому поверхню, визначену за методом БЕТ щонайменше 150 м /г. 7. Композиція за будь-яким з пп. 3-6, яка відрізняється тим, що сполука формули (І) покриває стінки пор і поверхню частинок діоксиду кремнію. 8. Композиція за будь-яким з пп. 1-5, яка відрізняється тим, що відсоткове відношення маси сполуки формули (І) до маси частинок твердого носія становить 50 %±10 %. 9. Композиція за будь-яким з пп. 1-8, що додатково включає одну або більше фармацевтично прийнятних допоміжних речовин. 10. Композиція за п. 9, яка перетворена в лікарську форму для перорального введення. 11. Композиція за п. 10, яка являє собою таблетку. 12. Композиція за будь-яким з пп. 1-11, яка відрізняється тим, що сполука формули (І) має підвищений до 99±1 % вміст стереоізомера формули (Іа): O N Ph O H N S S N O N H N H N O N O Ph (Ia). 25 13. Спосіб, який включає комбінування сполуки формули (І): O N Ph O H N S N N S N H N H 35 O N O Ph 30 O (I) придатного розчинника, і множину частинок твердого носія для отримання суміші. 14. Спосіб за п. 13, який відрізняється тим, що кожна частка твердого носія являє собою каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк. 15. Спосіб за п. 13, який відрізняється тим, що множина частинок твердого носія являє собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, визначеною за 2 методом БЕТ, від приблизно 40 до приблизно 400 м /г. 22 UA 101193 C2 5 10 16. Спосіб за п. 15, який відрізняється тим, що частинки діоксиду кремнію являють собою гідрофільний високодисперсний діоксид кремнію. 17. Спосіб за п. 15 або п. 16, який відрізняється тим, що частинки діоксиду кремнію мають середній діаметр 20-40 мікронів. 18. Спосіб за будь-яким з пп. 15-17, який відрізняється тим, що частинки діоксиду кремнію 2 мають питому поверхню, визначену за методом БЕТ, щонайменше 150 м /г. 19. Спосіб за будь-яким з пп. 15-18, який відрізняється тим, що маса сполуки формули (І), ділена на масу частинок діоксиду кремнію, становить 1,0±0,5. 20. Спосіб за будь-яким з пп. 15-19, який відрізняється тим, що розчинник являє собою (С 1-С6) спирт. 21. Спосіб за будь-яким з пп. 15-19, який відрізняється тим, що розчинник містить етанол. 22. Продукт, отриманий за способом, описаним в кожному із пп. 13-21. 23. Таблетка, яка містить: 1) сполуку формули (І): O N Ph O H N S S N O N H N H N O N O Ph 15 20 25 (I) або її фармацевтично прийнятну сіль і 2) множину частинок твердого носія. 24. Таблетка за п. 23, яка відрізняється тим, що кожна частинка твердого носія являє собою каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк. 25. Таблетка за п. 23, яка відрізняється тим, що множина частинок твердого носія являє собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, із середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, визначеною за 2 методом БЕТ, від приблизно 40 до приблизно 400 м /г. 26. Таблетка за будь-яким з пп. 23-25, що додатково включає інший терапевтичний агент. 27. Таблетка за п. 23, що додатково включає 3) мікрокристалічну целюлозу; 4) гідроксипропілцелюлозу; 5) кроскармелозу натрію і 6) стеарат магнію. 28. Таблетка за будь-яким з пп. 23-27, яка відрізняється тим, що сполука формули (І) має підвищений до 99±1 % вміст стереоізомера формули (Іа): O N Ph O H N S N N S N H N H 35 O N O Ph 30 O (Ia). 29. Таблетка за будь-яким з пп. 25-28, яка містить приблизно 10 мг сполуки формули (І); приблизно 115 мг частинок діоксиду кремнію; приблизно 151 мг мікрокристалічної целюлози; приблизно 6 мг гідроксипропілцелюлози; приблизно 15 мг кроскармелози натрію і приблизно 3 мг стеарату магнію. 30. Таблетка за будь-яким з пп. 25-28, яка містить приблизно 25 мг сполуки формули (І); приблизно 115 мг частинок діоксиду кремнію; приблизно 136 мг мікрокристалічної целюлози; приблизно 6 мг гідроксипропілцелюлози; приблизно 15 мг кроскармелози натрію і приблизно 3 мг стеарату магнію. 23 UA 101193 C2 5 10 15 20 25 31. Таблетка за будь-яким з пп. 25-28, яка містить приблизно 100 мг сполуки формули (І); приблизно 115 мг частинок діоксиду кремнію; приблизно 61 мг мікрокристалічної целюлози; приблизно 6 мг гідроксипропілцелюлози; приблизно 15 мг кроскармелози натрію; і приблизно 3 мг стеарату магнію. 32. Фармацевтична композиція, яка містить множину частинок твердого носія; сполуку формули (Іа); дизопроксил фумарат тенофовіру; емтрицитабін і елвітегравір. 33. Фармацевтична композиція за п. 32, яка відрізняється тим, що кожна частинка твердого носія являє собою каолін, бентоніт, гекторит, колоїдний алюмосилікат магнію, діоксид кремнію, трисилікат магнію, гідроксид алюмінію, гідроксид магнію, оксид магнію або тальк. 34. Фармацевтична композиція за п. 33, яка відрізняється тим, що множину частинок твердого носія являють собою множину частинок діоксиду кремнію, кожна з яких має поверхню і пори, з середнім діаметром частинок від приблизно 10 до приблизно 120 мікронів і питомою поверхнею, 2 визначеною за методом БЕТ, від приблизно 40 до приблизно 400 м /г. 35. Композиція за п. 34, яка відрізняється тим, що діоксид кремнію являє собою гідрофільний високодисперсний діоксид кремнію. 36. Композиція за будь-яким з пп. 34-35, яка відрізняється тим, що частинки діоксиду кремнію мають середній діаметр 20-40 мікронів. 37. Композиція за будь-яким з пп. 34-36, яка відрізняється тим, що частинки діоксиду кремнію 2 мають питому поверхню, визначену за методом БЕТ, щонайменше 150 м /г. 38. Композиція за будь-яким з пп. 34-37, яка відрізняється тим, що сполука формули (І) покриває стінки пор і поверхню частинок діоксиду кремнію. 39. Композиція за будь-яким з пп. 34-38, яка відрізняється тим, що відношення маси сполуки формули (І) до маси частинок діоксиду кремнію становить 1±0,05 %. 40. Композиція за п. 34, яка перетворена в лікарську форму для перорального ведення. 41. Композиція за п. 40, яка перетворена у форму таблетки. 24 UA 101193 C2 25 UA 101193 C2 26 UA 101193 C2 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 27
ДивитисяДодаткова інформація
Назва патенту англійськоюThe use of solid carrier particles to improve the processability of a pharmaceutical agent
Автори англійськоюKoziara, Joanna, M., Menning, Mark, M., Oliyai, Reza, Strickley, Robert, G., Yu, Richard, Kearney, Brian, P., Mathias, Anita, A.
Назва патенту російськоюПрименение частичек твердого носителя для улучшения технологических характеристик фармацевтического агента
Автори російськоюКозиара Джоанна М., Меннинг Марк М., Олияй Реза, Стрикли Роберт Г., Йу Ричард, Карни Брайан П., Матиас Анита А.
МПК / Мітки
МПК: A61K 31/427, A61K 9/14, A61K 9/20, A61K 47/04, A61P 43/00, A61K 31/5377
Мітки: носія, агента, технологічних, фармацевтичного, застосування, частинок, поліпшення, твердого, характеристик
Код посилання
<a href="https://ua.patents.su/29-101193-zastosuvannya-chastinok-tverdogo-nosiya-dlya-polipshennya-tekhnologichnikh-kharakteristik-farmacevtichnogo-agenta.html" target="_blank" rel="follow" title="База патентів України">Застосування частинок твердого носія для поліпшення технологічних характеристик фармацевтичного агента</a>
Попередній патент: Спосіб лікування раку молочної залози
Наступний патент: Вертикальний комбінований сировинний/продуктовий теплообмінник зі змінюваним кутом відбивача
Випадковий патент: Бункер для зерна зернозбирального комбайна












