Арилпіперазини і їх застосування як антагоністів альфа2c
Номер патенту: 105647
Опубліковано: 10.06.2014
Автори: Дін Белл Девід, Вольфарт Герд, Толванен Арто, Хольм Патрік
Формула / Реферат
1. Сполука формули І:
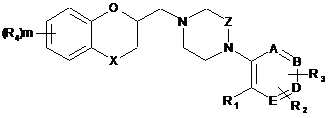 , I
, I
де
X являє собою О;
Z являє собою -[СН2]n-;
А, В, D і Е незалежно являють собою С або N, при умові, що щонайменше три елементи з А, В, D і Е являють собою С;
R1 являє собою Н, галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл;
R3 являє собою Н або феніл;
R4 являє собою галоген;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0 або 1; і
n має значення 1 або 2;
в міченій або неміченій формі, або її фармацевтично прийнятні сіль або фармацевтично прийнятний складний ефір,
за умови, що
a) R1, R2 і R3 не є одночасно Н;
b) в тому випадку, коли А означає С, а дві групи з R1, R2 і R3 являють собою Н, то третя група з R1, R2 і R3 не є галогеном;
c) сполука не являє собою 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(6-метилпіридин-2-іл)піперазин.
2. Сполука за п. 1, де А, В, D і Е являють собою С.
3. Сполука за п. 1, де А являє собою N; і В, D і Е являють собою С.
4. Сполука за будь-яким з пп. 1-3, де n має значення 1.
5. Сполука за будь-яким з пп. 1-3, де n має значення 2.
6. Сполука за п. 1, де
X являє собою О;
Z являє собою -[СН2]n-;
А являє собою С або N;
В, D і Е являють собою С;
R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1-С6)алкіл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл;
R3 являє собою Н або феніл;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0; і
n має значення 1 або 2.
7. Сполука за п. 6, де
X являє собою О;
Z являє собою -[СН2]n-;
A, В, D і Е являють собою С;
R1 являє собою (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)aлкiл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н або галоген;
R3 являє собою Н;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0; і
n має значення 1 або 2.
8. Сполука за п. 6, де
X являє собою О;
Z являє собою -[СН2]n-;
А являє собою N;
B, D і Е являють собою С;
R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н або галоген;
R3 являє собою Н;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0; і
n має значення 1 або 2.
9. Сполука за п. 6, де
X являє собою О;
Z являє собою -[СН2]n-;
А являє собою N;
В, D і Е являють собою С;
R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1-С6)aлкiл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл;
R3 являє собою Н або феніл;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0; і
n має значення 1.
10. Сполука за п. 6, де
X являє собою О;
Z являє собою -[СН2]n-;
А являє собою N;
В, D і Е являють собою С;
R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1-С6)алкіл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл;
R3 являє собою Н або феніл;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0; і
n має значення 2.
11. Сполука за п. 6, де
X являє собою О;
Z являє собою -[СН2]n-;
А, В, D і Е являють собою С;
R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1-С6)алкіл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл;
R3 являє собою Н або феніл;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0; і
n має значення 1.
12. Сполука за п. 6, де
X являє собою О;
Z являє собою -[СН2]n-;
А, В, D і Е являють собою С;
R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1-С6)алкіл, (R5)2N-(C=O)- або фурил;
R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл;
R3 являє собою Н або феніл;
R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл;
m має значення 0; і
n має значення 2.
13. Сполука за п. 1, де сполука вибрана з групи:
метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол,
1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(метоксиметил)феніл)піперазин,
2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензонітрил,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанамін,
1-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)-N-метилметанамін,
1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(етоксиметил)феніл)піперазин,
2-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)пропан-2-ол,
1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2-іл)піперазин, (S)-(2-(4-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол,
(S)-(2-(4-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол·НСl,
(S)-1-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2-іл)піперазин·НСl,
(S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-((2-фторетокси)метил)піридин-2-іл)піперазин,
1-(2,3-дихлорфеніл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол,
(S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(метоксиметил)феніл)піперазин,
(R)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(метоксиметил)феніл)піперазин,
(S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол,
(S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2-іл)піперазин,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-6-фторфеніл)метанол,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-3-фторфеніл)метанол,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-5-фторфеніл)метанол,
(S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-пропілфеніл)піперазин,
(S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(трифторметокси)феніл)піперазин, (S)-1-(біфеніл-3-іл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин,
(S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(фуран-2-іл)феніл)піперазин,
(S)-етил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат,
(S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-о-толілпіперазин,
(S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-м-толілпіперазин,
(S)-(3-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-4-метилфеніл)метанол,
(S)-(3-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол,
(S)-2-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)етанол,
метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)бензоат,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)феніл)метанол,
2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинонітрил,
2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинамід,
(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3-іл)метанол aбо
(S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3-іл)метанол.
14. Мічена ізотопом вуглецю сполука формули І за п. 1.
15. Сполука за п. 14, де сполука являє собою (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-([11С]-метоксиметил)піридин-2-іл)піперазин.
16. Сполука за будь-яким з пп. 1-13 для застосування як лікарського засобу.
17. Сполука за будь-яким з пп. 1-13 для застосування в лікуванні захворювання або стану, де антагоніст альфа2С-адренорецептора є придатним.
18. Сполука за п. 17, де захворювання або стан являє собою психічний розлад, спровокований стресом, хворобу Паркінсона, депресію, шизофренію, синдром гіперактивності з дефіцитом уваги, посттравматичний стресовий розлад, обсесивно-компульсивний розлад особистості (синдром нав'язливих станів), синдром Туретта, блефароспазм або інші фокальні дистонії, скроневочасткову епілепсію з психозом, зумовлений дією лікарського засобу психоз, хворобу Хантінгтона, розлад, викликаний флуктуацією рівнів статевих гормонів, панічний розлад, хворобу Альцгеймера або помірні когнітивні порушення.
19. Спосіб лікування захворювання або стану, в якому, як вказано, антагоніст альфа2С-адренорецепторів є придатним, де спосіб включає введення ссавцеві, який потребує такого лікування, ефективної кількості щонайменше однієї сполуки за п. 1.
20. Спосіб за п. 19, де захворювання або стан являє собою психічний розлад, спровокований стресом, хворобу Паркінсона, депресію, шизофренію, синдром гіперактивності з дефіцитом уваги, посттравматичний стресовий розлад, обсесивно-компульсивний розлад особистості (синдром нав'язливих станів), синдром Туретта, блефароспазм або інші фокальні дистонії, скроневочасткову епілепсію з психозом, зумовлений дією лікарського засобу психоз, хворобу Хантінгтона, розлад, викликаний флуктуацією рівнів статевих гормонів, панічний розлад, хворобу Альцгеймера або помірні когнітивні порушення.
21. Фармацевтична композиція, що містить щонайменше одну сполуку відповідно до будь-якого з пп. 1-13 і фармацевтично прийнятний носій, розріджувач і/або ексципієнт.
22. Фармацевтична композиція за п. 21, де композиція містить додатково щонайменше один інший активний інгредієнт.
23. Застосування міченої сполуки за будь-яким з пп. 1-13 як селективної відносно альфа2С-рецептора сполуки-ізотопного РЕТ-маркера в дослідженнях тварин і людей методом позитронно-емісійної томографії (PET).
24. Застосування міченої ізотопом 11С сполуки за будь-яким з пп. 1-13 для застосування як селективної відносно альфа2С-рецептора сполуки-ізотопного РЕТ-маркера в дослідженнях тварин і людей методом позитронно-емісійної томографії (PET).
25. Застосування за п. 24, де сполука являє собою (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-([11С]-метоксиметил)піридин-2-іл)піперазин.
Текст
Реферат: Сполука формули (І) UA 105647 C2 (12) UA 105647 C2 O N (R4)m X z N A B R1 E D 2 R R3 , (I) де X, Z, А, В, D, E, R1-R4 і m є такими ж, як вони визначені в пунктах формули, проявляє антагоністичну активність відносно альфа2С-адренорецепторів і, таким чином, є придатною як антагоніст альфа2С-адренорецепторів. UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Даний винахід стосується фармакологічно активних арилпіперазинів, або їх фармацевтично прийнятних солей і складних ефірів, а також фармацевтичних композицій, що містять їх, і їх застосування як альфа-2С-антагоністів. Сполуки за даним винаходом можуть бути використані в їх міченій або неміченій формі. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ У даній галузі є загальновідомим і загальноприйнятим той факт, що сполуки, що проявляють альфа-адренергічну активність, можуть бути використані для лікування широкого ряду захворювань і станів периферичної системи і центральної нервової системи (CNS). Альфа-адренергічні рецептори можуть бути поділені по фармакологічному базису на альфа1- і альфа2-адренорецептори, які (і той, і інший) можуть бути додатково поділені на підтипи. Три генетично кодованих підтипи, а саме альфа2А-, альфа2В- і альфа2Садренорецептори, були виявлені у людини. Четвертий підтип, що фармакологічно визначається, а саме альфа2D-адренорецептор, відомий у деяких інших ссавців і у гризунів. Він співпадає з альфа2А-адренорецептором, що визначається генетично. Підтипи альфа-2-адренорецептора мають виразні розподіли в тканинах і функціональні ролі. Наприклад, тоді як альфа2А-адренорецептори широко експресовані в різних тканинах, альфа2С-адренорецептори сконцентровані в центральній нервовій системі і, як виявляється, відіграють роль в модулюванні специфічних опосередкованих центральною нервовою системою поведінкових і фізіологічних реакцій. Деякі сполуки, які є неспецифічними відносно будь-яких вищезазначених підтипів альфа2адренорецепторів, і деякі сполуки, які є специфічними відносно певних підтипів альфа2адренорецепторів, відомі в даній галузі. Наприклад, атипамезол, розкритий в європейському патенті EP 183492 А1 (сполука XV на сторінці 13), є неспецифічним антагоністом альфа2адренорецепторів. Сполуки, які є селективними антагоністами відносно альфа2С-підтипу адренорецепторів і які є корисними для лікування психічного захворювання, наприклад, психічного розладу, викликаного стресом, описані в патенті US 5902807. Такі сполуки являють собою, наприклад, MK-912 і ВАМ-1303. Похідні імідазолу, що мають активність, подібну до активності агоніста, відносно альфа2В- або альфа2В/2С-адренорецепторів, розкриті в міжнародній публікації WO 99/28300. Похідні хіноліну, придатні як антагоністи альфа2адренорецепторів, розкриті в міжнародних публікаціях WO 01/64645 і WO 2004/067513. Похідні арилхінолізину, придатні як антагоністи альфа2-адренорецепторів, розкриті в міжнародній публікації WO 03/082866. Для того, щоб мати можливість знизити ризик небажаних явищ під час лікування, було б бажано посилити селективність антагоністів альфа2-адренорецепторів. Наприклад, використання неселективних антагоністів альфа2-адренорецепторів зв'язують з побічними ефектами, такими як підвищення кров'яного тиску, частота серцевих скорочень, виділення слинних залоз, секреція шлунково-кишкового тракту і неспокій/страх. Також була б бажана посилена активність антагоністів альфа2С-адренорецепторів, з тим, щоб мати можливість знизити необхідну дозу. Що стосується відомих арилпіперазинів, в патенті US 3362956 був розкритий 1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-метоксифеніл)піперазин. У публікації: Indian J. Chem. 20B (1981) 1063, був розкритий 1-(хроман-2-ілметил)-4-о-толілпіперазин. Фторфенілпіперазин був розкритий, наприклад, в публікації: Eur. Med. Chem. 35 (2000) 663. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Метою даного винаходу є забезпечення додаткових антагоністів альфа2Садренорецепторів, які можуть бути використані для лікування захворювань або станів периферичної або центральної нервової системи, де антагоністи альфа2С-адренорецепторів, як згадано, є придатними. Відповідно до цього, метою даного винаходу є забезпечення додаткових сполук, які повинні бути використані як антагоністи альфа2С-адренорецепторів в лікуванні ссавців. Крім того, забезпечують фармацевтичні композиції, що містять сполуки за даним винаходом. Антагоністи альфа2-адренорецепторів за даним винаходом мають поліпшену селективність відносно альфа2С-підтипу адренорецептора і/або поліпшену активність. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід стосується нових антагоністів альфа2С-адренорецепторів, що мають загальну формулу I: 1 UA 105647 C2 , 5 10 15 20 25 30 35 40 45 50 де Х являє собою О, S або CH2; Z являє собою -[CH2]n-; А, В, D і Е незалежно являють собою С або N, при умові, що щонайменше три елементи з А, В, D і Е являють собою С; R1 являє собою Н, галоген, гідроксигрупу, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1С6)алкіл, гідроксі(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-, CN, (R5)2N-, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)-, SH-(С1-С6)алкіл, гідроксі(С1С6)алкіл-S-(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл-S-(C1-C6)алкіл, гідроксі(С1-С6)алкіл-S(Op)-(С1С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл-S(Op)-(C1-C6)алкіл або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу або гідроксі(С1-С6)алкіл; R3 являє собою Н, галоген, (С1-С6)алкіл або феніл; R4 являє собою галоген, гідроксигрупу, (С1-С6)алкіл, (С1-С6)алкоксигрупу, CN або (R5)2N-; R5 являє собою, незалежно в кожному випадку, Н, (С1-С6)алкіл або (С1-С6)алкоксі(С1С6)алкіл; m має значення 0, 1 або 2; n має значення 1 або 2; і р має значення 1 або 2, в міченій або неміченій формі, або їх фармацевтично прийнятної солі або фармацевтично прийнятного складного ефіру, з тими обмовками, що полягають в тому, що а) R1, R2 і R3 не є одночасно Н; b) в тому випадку, коли А означає С, а дві групи з R1, R2 і R3 являють собою Н, то третя група з R1, R2 і R3 не є галогеном; с) сполука не являє собою 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2метоксифеніл)піперазин, 1-(хроман-2-ілметил)-4-о-толілпіперазин або 1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(6- метилпіридин-2-іл)піперазин. У можливій підгрупі сполук формули I Х являє собою О. У додатковій можливій підгрупі сполук формули I А, В, D і Е являють собою С. У ще одній можливій підгрупі сполук формули I А являє собою N; а В, D і Е являють собою С. У додатковій можливій підгрупі сполук формули I n має значення 1. У додатковій можливій підгрупі сполук формули I n має значення 2. У іншій можливій підгрупі сполук формули I Х являє собою О, S або CH2; Z являє собою -[CH2]n-; А являє собою С або N; В, D і Е являють собою С; R1 являє собою Н, галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н, (С1-С6)алкіл або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1 або 2; наприклад, Х являє собою О; Z являє собою -[CH2]n-; А являє собою С або N; В, D і Е являють собою С; 2 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 R1 являє собою галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н, (С1-С6)алкіл або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1 або 2, як наприклад, Х являє собою О; Z являє собою -[CH2]n-; А, В, D і Е являють собою С; R1 являє собою (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(C1C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н або галоген; R3 являє собою Н; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1 або 2; або Х являє собою О; Z являє собою -[CH2]n-; А являє собою N; В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н або галоген; R3 являє собою Н; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1 або 2; або Х являє собою О; Z являє собою -[CH2]n-; А являє собою N; В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н, (С1-С6)алкіл або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1; або Х являє собою О; Z являє собою -[CH2]n-; А являє собою N; В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкоксі-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н, (С1-С6)алкіл або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 2; або Х являє собою О; Z являє собою -[CH2]n-; А, В, D і Е являють собою С; 3 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 R1 являє собою галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н, (С1-С6)алкіл або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1; або Х являє собою О; Z являє собою -[CH2]n-; А, В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, (С1-С6)алкоксигрупу, гідроксі(С1-С6)алкіл, (С1С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(С=О)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н, (С1-С6)алкіл або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 2. У ще одній можливій підгрупі сполук формули I сполука являє собою метил-2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат, (2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол, 1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(метоксиметил)феніл)піперазин, 2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензонітрил, (2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанамін, 1-(2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)-N-метилметанамін, 1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(етоксиметил)феніл)піперазин, 2-(2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)пропан-2-ол, 1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2-іл)піперазин, (S)-(2-(4-((7фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол, (S)-(2-(4((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол•HCl, (S)1-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2іл)піперазин•HCl, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-((2фторетокси)метил)піридин-2-іл)піперазин, 1-(2,3-дихлорфеніл)-4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2іл)метил)піперазин-1-іл)піридин-3-іл)метанол, (S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2іл)метил)піперазин-1-іл)піридин-3-іл)метанол, (S)-1-((2,3дигідробензо[b][1,4]діоксин-2іл)метил)-4-(2-(метоксиметил)феніл)піперазин, (R)-1-((2,3-дигідробензо[b][1,4]діоксин-2іл)метил)-4-(2-(метоксиметил)феніл)піперазин, (S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2іл)метил)піперазин-1-іл)феніл)метанол, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3(метоксиметил)піридин-2-іл)піперазин, (1-((2,3-дигідробензо[b][1,4]оксатиїн-2-іл)метил)-4-(2(метоксиметил)феніл)піперазин, 1-(хроман-2-ілметил)-4-(2-(метоксиметил)феніл)піперазин, (2(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-6-фторфеніл)метанол, (2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-3-фторфеніл)метанол, (2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-5-фторфеніл)метанол, (S)-1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-пропілфеніл)піперазин, (S)-1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(трифторметокси)феніл)піперазин, (S)-1-(біфеніл-3іл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин, (S)-1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(фуран-2-іл)феніл)піперазин, (S)-етил-2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат, (S)-1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-о-толілпіперазин, (S)-1-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-4-м-толілпіперазин, (S)-(3-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-4-метилфеніл)метанол, (S)-(3-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол, (S)-2-(2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)етанол, метил-2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)бензоат, (2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)феніл)метанол, 2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинонітрил, 2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинамід, (2-(4-((2,3 4 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3-іл)метанол або (S)-(2-(4-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3-іл)метанол. Терміни, що використовуються в цьому документі, мають значення, вказані нижче. Термін "щонайменше, один", що використовується при описі значень нижче, стосується однієї або декількох характеристик, наприклад, однієї характеристики. Термін "гідрокси", що застосовується в цьому документі, як такий або як частина іншої групи, стосується групи -ОН. Термін «(С1-С6)алкіл", який застосовують в цьому документі, як такий або як частина іншої групи, стосується насиченої вуглеводневої групи з нерозгалуженим або розгалуженим ланцюгом, що має 1, 2, 3, 4, 5 або 6 атом(ів) вуглецю. Репрезентативні приклади (С 1-С6)алкілу включають метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил, і н-гексил, але не обмежуються цим. Термін "(С1-С6)алкоксигрупа", який застосовують в цьому документі, як такий або як частина іншої групи, стосується (С1-С6)алкільної групи, яка визначена в цьому документі, і яка приєднана до фрагмента вихідної молекули через атом кисню. Репрезентативні приклади (С1С6)алкоксигрупи включають метоксигрупу, етоксигрупу, н-пропоксигрупу, н-бутоксигрупу, ізобутоксигрупу, втор-бутоксигрупу, трет-бутоксигрупу, 2,2-диметилпропоксигрупу, 3метилбутоксигрупу і н-гексоксигрупу, але не обмежуються цим. Термін "гало" або "галоген", який застосовують в цьому документі, як такий або як частина іншої групи, стосується фтору, хлору, брому або йоду. Термін "гідроксі(С1-С6)алкіл", який застосовують в цьому документі, як такий або як частина іншої групи, стосується щонайменше однієї гідроксигрупи, яка визначена в цьому документі, і яка приєднана до фрагмента вихідної молекули через (С 1-С6)алкільну групу, яка визначена в цьому документі. Репрезентативні приклади гідроксі(С 1-С6)алкілу включають гідроксиметил, 1гідроксіетил, 2-гідроксіетил, 2,2-дигідроксіетил, 1-гідроксипропіл, 3-гідроксипропіл, 1-гідрокси-1метилетил і 1-гідрокси-1-метилпропіл, але не обмежуються цим. Термін "(С1-С6)алкоксі(С1-С6)алкіл", який застосовують в цьому документі, як такий або як частина іншої групи, стосується щонайменше однієї (С 1-С6)алкоксигрупи, яка визначена в цьому документі, і яка приєднана до фрагмента вихідної молекули через (С 1-С6)алкільну групу, яка визначена в цьому документі. У тому випадку, коли існує декілька (С 1-С6)алкоксигруп, то ці (С1С6)алкоксигрупи можуть бути однаковими або різними. Репрезентативні приклади (С 1С6)алкоксі(С1-С6)алкілу включають метоксиметил, етоксиметил, пропоксиметил, 2-метоксіетил, 2-етоксіетил, 2,2-диметоксіетил, 1-метил-2-пропоксіетил, 1-метокси-1-метилетил і 4метоксибутил, але не обмежуються цим. Термін "гідроксі(С1-С6)алкоксигрупа", який застосовують в цьому документі, як така або як частина іншої групи, стосується щонайменше однієї гідроксигрупи, яка визначена в цьому документі, і яка приєднана до фрагмента вихідної молекули через (С1-С6)алкоксигрупу, яка визначена в цьому документі. Репрезентативні приклади гідроксі(С 1-С6)алкоксигрупи включають гідроксиметоксигрупу, дигідроксиметоксигрупу, 2-гідроксіетоксигрупу, 2-гідроксипропоксигрупу, 3-гідроксипропоксигрупу, 2-гідроксибутоксигрупу і 2-гідрокси-1-метилетоксигрупу, але не обмежуються цим. Термін "(С1-С6)алкоксі(С1-С6)алкоксигрупа", який застосовують в цьому документі, як така або як частина іншої групи, стосується щонайменше однієї (С 1-С6)алкоксигрупи, яка визначена в цьому документі, і яка приєднана до фрагмента вихідної молекули через (С 1-С6)алкоксигрупу, яка визначена в цьому документі. Ці (С1-С6)алкоксигрупи можуть бути однаковими або різними. Репрезентативні приклади (С1-С6)алкоксі(С1-С6)алкоксигрупи включають метоксиметоксигрупу, пропоксиметоксигрупу, 2-метоксіетоксигрупу, 2-етоксіетоксигрупу, 2-бутоксіетоксигрупу, 2,2диметоксіетоксигрупу, 1-метил-2-пропоксіетоксигрупу, 2-метоксипропоксигрупу і 4метоксибутоксигрупу, але не обмежуються цим. Термін "галоген(С1-С6)алкоксигрупа", який застосовують в цьому документі, як така або як частина іншої групи, стосується щонайменше одного галогену, який визначений в цьому документі, і який приєднаний до фрагмента вихідної молекули через (С 1-С6)алкоксигрупу, яка визначена в цьому документі. У тому випадку, коли є в наявності декілька галогенів, галогени можуть бути однаковими або різними. Репрезентативні приклади галоген(С 1-С6)алкоксигрупи включають фторметоксигрупу, хлорметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, 2-брометоксигрупу, 2,2,2-трихлоретоксигрупу, 3-бромпропоксигрупу, 2-хлорпропоксигрупу і 4хлорбутоксигрупу, але не обмежуються цим. Вираз "сполука за винаходом", який застосовують в цьому документі, стосується сполук формули I. 5 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтично прийнятні солі, наприклад, солі приєднання кислот, причому як органічних, так і неорганічних кислот, відомі в галузі фармацевтики. Репрезентативні приклади фармацевтично прийнятних солей приєднання кислот включають хлориди, броміди, сульфати, нітрати, фосфати, сульфонати, метансульфонати, форміати, тартрати, малеати, цитрати, бензоати, саліцилати, аскорбати, ацетати і оксалати, але не обмежуються цим. Фармацевтично прийнятні складні ефіри, в тому випадку, коли вони застосовні, можуть бути отримані відомими способами з використанням фармацевтично прийнятних кислот, які є традиційними в галузі фармацевтики і які зберігають фармакологічні властивості вільної форми. Необмежувальні приклади цього складного ефіру включають складний ефір аліфатичних або ароматичних спиртів. Репрезентативні приклади фармацевтично прийнятних складних ефірів включають метилові, етилові, н-пропілові, ізопропілові, н-бутилові, ізобутилові, втор-бутилові, трет-бутилові, і бензилові складні ефіри, але не обмежуються цим. Винахід включає в рамках свого об'єму всі можливі геометричні ізомери, наприклад, Z- і Еізомери (цис- і транс-ізомери), сполук, а також всі можливі оптичні ізомери, наприклад, діастереомери і енантіомери, сполук. Крім того, винахід включає в рамках свого об'єму і той і інший індивідуальний ізомер і їх будь-які суміші, наприклад, рацемічні суміші. Індивідуальні ізомери можуть бути отримані з використанням відповідних ізомерних форм вихідної речовини, або вони можуть бути розділені після отримання кінцевої сполуки відповідно до загальноприйнятих способів розділення. Для розділення оптичних ізомерів, наприклад, енантіомерів, з їх суміші можуть бути використані загальноприйняті способи розділення, наприклад, фракційна кристалізація. Винахід додатково включає мічені ізотопом сполуки формули I, наприклад, мічену ізотопом 11 вуглецю сполуку формули I; таку як (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-([ С]метоксиметил)піридин-2-іл)піперазин. Ізотопно мічена або мічена радіоактивним ізотопом сполука являє собою сполуку формули I, де один або більше атомів замінені або заміщені атомом, що має атомну масу або масове число, що відрізняється від атомної маси або масового числа, що звичайно виявляється в природі. Приклади ізотопів, які можуть бути впроваджені в сполуку за винаходом, включають 2 3 11 ізотопи водню, вуглецю, азоту, кисню, фосфору, сірки, фтору, йоду і хлору, такі як Н, Н, С, 13 14 13 15 15 17 18 31 32 35 18 123 125 36 С, С, N, N, О, О, О, Р, Р, S, F, I, I і Сl, або будь-яку їх підгрупу, але не обмежуються цим. Радіоактивний ізотоп, який впроваджують в мічені радіоактивним ізотопом сполуки, що розглядаються в даний момент, будуть залежати від конкретного застосування тієї 11 13 15 18 міченої радіоактивним ізотопом сполуки. Позитронно-активні ізотопи, такі як С, N, О і F, є придатними для досліджень методами позитронно-емісійної томографії (PET). (Textbook of drug rd design and discovery. 3 edition, Chapter 8: Radiotracers: synthesis and use in imaging by C. Halldin and T. Hogberg.) Позитронно-емісійна томографія (PET) до даного часу являє собою єдиний спосіб, який може надати кількісну інформацію по молекулярному розпізнаванню (наприклад, зв'язування з рецептором) in vivo у людини. Однак не існує ізотопних маркерів, доступних для вивчення заповнення (окупації) альфа2С-адренорецепторів. Мічені сполуки формули I можуть бути використані як нові ізотопні РЕТ-маркери, селективні відносно альфа2С-рецепторів у людини і ссавців; наприклад, як нові ізотопні РЕТ-маркери, селективні відносно альфа2С-рецепторів, можуть бути використані мічені ізотопом вуглець-11 сполуки формули I. Мічені ізотопом сполуки за винаходом, як правило, можуть бути приготовані за допомогою наступних методик, аналогічних методикам, розкритим в схемах і/або в прикладах, викладених в цьому документі нижче, шляхом заміни неізотопно міченого реагенту на мічений ізотопом реагент. Наприклад, мічені ізотопом вуглецю сполуки формули I можуть бути приготовані 11 шляхом метилування прийнятної речовини-попередника, з використанням декількох різних С11 мічених метилуючих агентів. Репрезентативні приклади С-мічених метилуючих агентів 11 11 11 включають С-йодометан, С-бромметан і С-метилтрифлат (метилтрифторметансульфонат), але не обмежуються цим. Фахівець в даній галузі також розуміє, що згадана прийнятна речовина-попередник повинна містити прийнятну реакційноздатну функціональну групу, таку як гідроксигрупа, тіол, карбоксил або аміногрупа. Сполуки за винаходом можуть бути приготовлені за допомогою різноманітних синтетичних шляхів аналогічно або згідно зі способами, відомими в літературі, з використанням відповідних вихідних речовин. Вихідні речовини, що використовуються у викладених в цьому документі способах, або є комерційно доступними, або можуть бути отримані відомими в літературі синтетичними шляхами. 6 UA 105647 C2 Сполуки формули I, як правило, складаються з прийнятних фрагментів кислоти і арилпіперазину. Наприклад, вихідні речовини, що містять бензодіоксанову кільцеву систему, являють собою сполуки з формулами А і В: . 5 10 15 Одна вихідна сполука являє собою 2,3-дигідробензо[b][1,4]діоксин-2-карбонову кислоту (формула А, R4=Н), яка є комерційно доступною і також легко розділяється на її енантіомери, що описано в журналі Tetrahedron: Asymmetry 16 (2005) 1639. Сполуки формули В, що мають відхідну групу L (найбільш прийнятним є галоген, мезилат або тозилат) і групу(пи) R4 (яка визначена вище), можуть бути отримані відповідно до відомих способів. У тому випадку, коли R4=Н, енантіомери формули В легко отримують з відповідного енантіомеру формули А за допомогою відновлення і вбудовування бажаної відхідної групи. Інша половина в формулі I, тобто арилпіперазини і гомопіперазини формули С, в тому випадку, коли є комерційно недоступними, може бути синтезована за допомогою алкілування піперазину, в більшості випадків захищеного по атому N, з допомогою електрон-дефіцитного арилгалогеніду. . 20 У формулі С Z є таким же, як визначений вище, і Ar являє собою: , 25 де А, В, D, Е і R1-R3 є такими самими, як визначені вище. У більшості випадків сполуки формули I можуть бути отримані аналогічно або згідно з наступною схемою 1: 7 UA 105647 C2 , 5 де Х, Z, Ar, R4 і m є такими ж, як визначені вище. Цей спосіб є особливо прийнятним для отримання енантіомерів формули I, оскільки енантіомери формули А є легко доступними. Інший шлях для отримання сполук формули I являє собою пряме алкілування арилпіперазинів С за допомогою бензодіоксанів В, що показано на схемі 2: , 10 де L, R4, m, Z і Ar є такими ж, як визначені вище. Крім того, звичайний спосіб конструювання арилпіперазинів через замикання кільця біс(хлоретил)амінів за допомогою анілінів (наприклад, Tetrahedron Lett. 46 (2005) 7921 і посилання, наведені в цій публікації) застосовують до похідних бензодіоксану. Реакційна взаємодія сполуки D із заміщеними анілінами Е приводить до сполук формули I (схема 3): 15 , 20 де R1-R3 є такими ж, як визначені вище. У деяких випадках застосовують злегка змінений порядок дій, в порівнянні зі схемою 2. (2,3дигідробензо[b][1,4]діоксин-2-іл)(піперазин-1-іл)метанон F, що випускається промислово, алкілують з допомогою електрон-дефіцитних арилгалогенідів G з наданням проміжних сполук Н, які можна додатково перетворювати в певні сполуки формули I (схема 4): 8 UA 105647 C2 , 5 10 15 20 25 30 35 40 45 50 де Х являє собою галоген, EWG означає електроноакцепторну групу (наприклад, COOR, CHO і так далі) і R2 і R3 є такими ж, як визначені вище. У синтезі гомопіперазинів в основному використовують шляхи, описані в схемах 1 і 2. Фахівцеві в даній галузі буде зрозуміло, що при необхідності в будь-яку вихідну речовину або проміжну сполуку в реакціях, описаних вище, можуть бути введені захисні групи способом, відомим в даній галузі. Згодом з будь-якої функціональної групи, по якій введена захисна група, може бути знята ця захисна група способом, відомим в даній галузі. Синтетичні шляхи, описані вище, призначені для ілюстрування отримання сполук формули I, і отримання жодним чином не обмежене цим, тобто, також існують інші можливі синтетичні способи, які знаходяться в рамках відомих знань фахівця в даній галузі. Сполуки формули I можуть бути перетворені, якщо бажано, в їх фармацевтично прийнятну сольову або складноефірну форму з використанням способів, відомих в даній галузі. Даний винахід буде роз'яснений більш детально за допомогою наступних прикладів. Приклади призначені лише з метою ілюстрування і не обмежують об'єм винаходу, визначений в пунктах формули винаходу. Скорочення: ACN = ацетонітрил, DCM = дихлорметан, DIPEA=N, N-діізопропілетиламін, DMF=N, N-диметилформамід, EtOAc = етилацетат, IPA = ізопропанол, LAH = літій-алюмогідрид, LC-MS = рідинна хроматографія-мас-спектрометрія, RT = кімнатна температура, THF = тетрагідрофуран, TLC = тонкошарова хроматографія. Колонкову хроматографію проводять на силікагелі 60, отриманому в компанії Merck, або з використанням приладу CombiFlash нарівні з колонками Redisep, що поставляються (і те і інше) компанією Teledyne ISCO. Мікрохвильове нагрівання здійснюють з використанням мікрохвильового реактора Emrys Optimiser від компанії Personal Chemistry або мікрохвильового 1 реактора Initiator 2,0 від компанії Biotage. Структури продуктів підтверджують з допомогою НЯМР-спектроскопії. Спектри вимірюють на приладі Bruker Avance 400. Аналіз методом рідинної хроматографії-мас-спектроскопії (LC-MS) здійснюють з використанням високоефективного рідинного хроматографа (HPLC) Waters 2690 Alliance і одноквадрупольного мас-спектрометра Waters Micromass ZQ4000 з використанням іонізації електророзпиленням (ESI). Отримання вихідних речовин Метил-2-(піперазин-1-іл)бензоат отримують в дві стадії з 1-бензилпіперазину і метил-2фторбензоату, слідуючи напрямам, вказаним в міжнародній публікації WO 03/009850. Метил-2-(1,4-діазепан-1-іл)нікотинат отримують з використанням способу, описаного в патенті США 6562827. (R)-2,3-Дигідробензо[b][1,4]діоксин-2-карбонову кислоту виділяють з комерційно доступного рацемату так, як описано в публікації: Tetrahedron: Asymmetry 16 (2005) 1639. (R)-2,3-Дигідробензо[b][1,4]діоксин-2-іл)метилметансульфонат отримують з (R)-2,3дигідробензо[b][1,4]діоксин-2-карбонової кислоти відповідно до методики публікації: Tetrahedron: Asymmetry 14 (2003) 3779. (R)-2,3-Дигідробензо[b][1,4]діоксин-2-карбонілхлорид отримують стандартним способом шляхом кип'ятіння із зворотним холодильником (R)-2,3-дигідробензо[1,4]діоксин-2-карбонової кислоти з надлишком тіонілхлориду в толуолі протягом 3 годин. Упарювання досуха дає хлорангідрид кислоти з високим виходом. 2,3-Дигідробензо[b][1,4]оксатиїн-2-карбонову кислоту отримують з етил-2,3дигідробензо[b][1,4]оксатиїн-2-карбоксилату відповідно до методики публікації: J. Med. Chem. 27 (1984) 1535. Отримання проміжних сполук Проміжна сполука А1: Етил-2-(4-бензилпіперазин-1-іл)нікотинат Суміш етил-2-хлорнікотинату (43,5 г, 234 ммоль), 1-бензилпіперазину (39,8 мл, 234 ммоль) і K2СО3 (35,5 г, 257 ммоль) в диметилформаміді (200 мл) кип'ятять із зворотним холодильником 9 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 4 годин. Після охолоджування до кімнатної температури суміш виливають в крижану воду (800 мл). Водну фазу екстрагують три рази (3) етилацетатом, і об'єднані органічні шари промивають водою і соляним розчином. Сушіння і упарювання дає 75,5 г сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 1,36 (т, 3Н), 2,54-2,57 (м, 4Н), 3,43-3,46 (м, 4Н), 3,55 (с, 2Н), 4,32 (кв., 2Н), 6,69-6,72 (дд, 1Н), 7,34-7,36 (м, 5Н), 7,92-7,96 (дд, 1Н), 8,24-8,27 (дд, 1Н). Проміжна сполука А2: (2-(4-Бензилпіперазин-1-іл)піридин-3-іл)метанол Гранули літій-алюмогідриду (9,3 г, 246 ммоль) розчиняють в безводному тетрагідрофурані (240 мл) при 45 °С в атмосфері азоту. Після охолоджування до кімнатної температури додають етил-2-(4-бензилпіперазин-1-іл)нікотинат (40 г, 123 ммоль) в безводному тетрагідрофурані (300 мл). Суміш кип'ятять із зворотним холодильником протягом 2 годин 15 хвилин. До гарячої реакційної суміші повільно додають 4 М розчин КОН (61,5 мл), перемішування продовжують протягом додаткових 20 хвилин при 60 °С. Осад відфільтровують і промивають етилацетатом, і фільтрат упарюють досуха, що дає 33,6 г спирту, вказаного в заголовку. 1 Н-ЯМР (CDCl3): δ 2,62-2,65 (м, 4Н), 3,16-3,19 (м, 4Н), 3,59 (с, 2Н), 4,20-4,35 (шир. с, 1Н), 4,73 (с, 2Н), 6,97-7,00 (дд, 1Н), 7,24-7,37 (м, 5Н), 7,53-7,55 (дд, 1Н), 8,26-8,28 (дд, 1Н). Проміжна сполука А3: 1-Бензил-4-(3-(метоксиметил)піридин-2-іл)піперазин Дисперсію гідриду натрію (60 % в маслі, 14 г, 349 ммоль) в безводному тетрагідрофурані (170 мл) нагрівають до 60 °С в атмосфері азоту. До цієї суміші додають по краплях (2-(4бензилпіперазин-1-іл)піридин-3-іл)метанол (33 г, 116 ммоль) в безводному тетрагідрофурані (170 мл). Після перемішування протягом 3 годин при 60 °С суміш охолоджують до 0 °С і додають метилйодид (9,4 мл, 151 ммоль) в безводному тетрагідрофурані (70 мл). Суміш додатково перемішують протягом 1 години при кімнатній температурі і повторно охолоджують до 0 °С. Додають воду доти, поки не припиниться піноутворення, і після того додають додаткову кількість води (300 мл). Сирий продукт екстрагують етилацетатом, і об'єднані органічні шари упарюють. До залишку додають воду (300 мл), і регулюють рН з доведенням до 1-2 за допомогою концентрованої HCl. Суміш перемішують при 40-50 °С протягом 1 години, після чого додають етилацетат і фази розділяють. Органічну фазу промивають однократно 1 М розчином HCl (30 мл). Кислотні водні фази об'єднують, рН коректують з доведенням до 10 за допомогою 5 М розчину NaOH з подальшим екстрагуванням етилацетатом, що виконується три рази (3). Об'єднані органічні фази промивають водою, сушать і упарюють, що дає 26,6 г сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 2,59-2,62 (м, 4Н), 3,19-3,22 (м, 4Н), 3,40 (с, 3Н), 3,59 (с, 2Н), 4,40 (с, 2Н), 6,90-6,93 (дд, 1Н), 7,26-7,37 (м, 5Н), 7,65-7,68 (дд, 1Н), 8,22-8,24 (дд, 1Н). Проміжна сполука А4: 1-(3-(Метоксиметил)піридин-2-іл)піперазин У потоці азоту в 1-літрову реакційну колбу завантажують 10 %-ий паладієвий каталізатор на вуглецевому носії (Pd/С, 5,26 г, 20 масс. %) і метиловий спирт (400 мл). До суміші додають 1бензил-4-(3-(метоксиметил)піридин-2-іл)піперазин (26,3 г, 88 ммоль) в метиловому спирті (100 мл) і форміат амонію (16,7 г, 265 ммоль), і суміш, що виходить в результаті, потім кип'ятять із зворотним холодильником протягом 2 годин 15 хвилин. Під час цього періоду всередині конденсатора-холодильника акумулюється параформальдегід. Паладієвий каталізатор відфільтровують через шар целіту, який промивають дихлорметаном. Об'єднані фільтрати упарюють, і до залишку додають насичений сольовий розчин і дихлорметан. Органічну фазу відділяють, промивають насиченим розчином NaHCO 3, сушать і упарюють досуха з наданням 16,5 г піперазину, вказаного в заголовку. 1 Н-ЯМР (CDCl3): δ 3,03-3,05 (м, 4Н), 3,14-3,17 (м, 4Н), 3,42 (с, 3Н), 4,43 (с, 2Н), 6,92-6,95 (дд, 1Н), 7,68-7,70 (дд, 1Н), 8,23-8,25 (дд, 1Н). Проміжна сполука А5: Етил-2-(піперазин-1-іл)нікотинат Так само, як викладено вище, суміш етил-2-(4-бензилпіперазин-1-іл)нікотинату (14,97 г, 46,0 ммоль), форміату амонію (6,38 г, 101 ммоль) і 10 %-го паладієвого каталізатора на вуглецевому носії Pd/С (3 г, 46,0 ммоль) в метанолі (150 мл) кип'ятять із зворотним холодильником протягом 2 годин. Після охолоджування суміш фільтрують через целіт. Фільтрат концентрують у вакуумі з наданням 10,25 г сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 1,39 (т, 3Н), 2,95-2,99 (м, 4Н), 3,35-3,40 (м, 4Н), 4,36 (кв., 2Н), 6,72-6,74 (м, 1Н), 7,94-7,99 (м, 1Н), 8,26-8,30 (м, 1Н). Проміжна сполука А6: 1-Бензил-4-(2-(метоксиметил)феніл)піперазин Так само, як при отриманні проміжної сполуки А3, (2-(4-бензилпіперазин-1-іл)феніл)метанол (30 г, 0,106 моль) обробляють гідридом натрію (60 % в маслі, 13 г, 0,325 моль) в безводному тетрагідрофурані (365 мл) при 60 °С протягом 4 годин. Потім суміш охолоджують до 10 °С і додають MeI (8,6 мл, 1,3 екв.) в тетрагідрофурані (96 мл). Після перемішування при 20-22 °С 10 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 1 години суміш охолоджують до 10 °С і додають по краплях воду до припинення бурхливого виділення пухирців газу. Потім додають додаткову кількість води (600 мл) з подальшим екстрагуванням етилацетатом (3500 мл). Після видалення мінерального масла, що утворюється з гідриду натрію, отримують 29 г сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 2,61 (шир. с, 4Н), 2,96 (т, 4Н), 3,41 (с, 3Н), 3,58 (с, 2Н), 4,52 (с, 2Н), 7,057,11 (м, 2Н), 7,22-7,39 (м, 6Н), 7,42 (дд, 1Н). Проміжна сполука А7: 1-(2-(Метоксиметіл)феніл)піперазин Так само, як при отриманні проміжної сполуки А4, суміш 1-бензил-4-(2(метоксиметил)феніл)піперазину (14,0 г, 47,2 ммоль), форміату амонію (9,38 г, 0,149 моль) і 10 %-го паладієвого каталізатора на вуглецевому носії (Pd/С, 2,3 г) в метиловому спирті (260 мл) кип'ятять із зворотним холодильником протягом 1 години. Паладієвий каталізатор відфільтровують, метиловий спирт випарюють і до залишку додають воду (300 мл). Водну фазу екстрагують етилацетатом (3100 мл), і об'єднані органічні шари промивають водою і 1 М розчином NaHCO3. Після сушіння і упарювання отримують 7,1 г сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 1,57 (шир. с, 1Н), 2,85-2,93 (м, 4Н), 2,99-3,06 (м, 4Н), 3,43 (с, 3Н), 4,54 (с, 2Н), 7,05-7,13 (м, 2Н), 7,27 (ддд, 1Н), 7,44 (дд, 1Н). Проміжна сполука А8: трет-Бутил-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4діазепан-1-карбоксилат Суміш 2-(бромметил)-2,3-дигідробензо[b][1,4]діоксину (150 мг, 0,65 ммоль), трет-бутил-1,4діазепан-1-карбоксилату (130 мг, 0,65 ммоль) і діізопропілетиламіну (DIPEA, 0,4 мл, 2,32 ммоль) в диметилформаміді (1,5 мл) нагрівають в мікрохвильовому реакторі при 160 °С протягом 10 хвилин і потім виливають у воду. Суміш екстрагують етилацетатом (320 мл). Органічний шар сушать і упарюють досуха. Сирий продукт очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 93,4 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 1,39 (с, 9Н), 1,71 (м, 2Н), 2,72 (м, 6Н), 3,35 (м, 4Н), 3,96 (м, 1Н), 4,27 (м, 2Н), 6,82 (м, 4Н). Проміжна сполука А9: 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан Суміш трет-бутил-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1карбоксилату (1,68 г, 4,82 ммоль) і концентрованої HCl (2 мл) перемішують при кімнатній температурі протягом 3 годин. Суміш виливають в крижану воду, підлужують з доведенням рН до 9 і екстрагують дихлорметаном (320 мл). Органічний шар сушать і упарюють, що дає 0,96 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 1,80 (м, 2Н), 2,52 (с, 1Н), 2,60-3,10 (м, 10Н), 3,98 (м, 1Н), 4,27 (м, 2Н), 6,82 (м, 4Н). Проміжна сполука А10: (R)-N, N-Біс(2-хлоретил)-2,3-дигідробензо[b][1,4]діоксин-2карбоксамід (R)-2,3-Дигідробензо[b][1,4]діоксин-2-карбонілхлорид (11,1 ммоль) піддають взаємодії з біс(2-хлоретил)амін•HCl (1,89 г, 10,6 ммоль) в присутності триетиламіну (3,43 мл, 24,4 ммоль) в дихлорметані (20 мл). Водна обробка, в тому числі промивання за допомогою 1 М розчину NaOH і 1 М розчину HCl, дає 5,72 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 3,64-3,82 (м, 6Н), 3,99-4,01 (м, 2Н), 4,26-4,36 (м, 1Н), 4,48-4,55 (м, 1Н), 4,91-4,96 (м, 1Н), 6,83-6,95 (м, 4Н). Проміжна сполука А11: (S)-2-Хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2іл)метил)етанамін•HCl (R)-N, N-Біс(2-хлоретил)-2,3-дигідробензо[b][1,4]діоксин-2-карбоксамід (3,04 г, 9,99 ммоль) розчиняють в тетрагідрофурані (50 мл). Додають 1 М розчин комплексу BH 3•THF (50 мл, 50 ммоль) і суміш кип'ятять із зворотним холодильником протягом 2 годин в інертній атмосфері. Після охолоджування додають 6 М розчин HCl (20 мл) і суміш перемішують при 65 °С протягом 20 хвилин. Суміш охолоджують, і її роблять лужною шляхом додавання твердого KOH. Додають воду (50 мл). Суміш екстрагують етилацетатом (350 мл), органічні шари об'єднують, сушать і упарюють досуха. Сирий продукт очищають з допомогою флеш-хроматографії, що дає 1,98 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 2,81-2,88 (м, 1Н), 2,91-3,10 (м, 4Н), 3,50-3,59 (м, 5Н), 4,00-4,25 (м, 1Н), 4,19-4,27 (м, 1Н), 4,28-4,34 (м, 1Н), 6,81-6,91 (м, 4Н). Отримання сполук за винаходом Через алкілування арилпіперазинів за допомогою 2-(2-бромметил)-2,3дигідробензо[b][1,4]діоксину ПРИКЛАД 1: Метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат Суміш 2-(бромметил)-2,3-дигідробензо[b][1,4]діоксину (0,53 г, 2,406 ммоль), метил-2(піперазин-1-іл)бензоату (0,55 г, 2,406 ммоль) і К2СО3 (0,366 г, 2,647 ммоль) в 11 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 диметилформаміді (20 мл) нагрівають в мікрохвильовому реакторі при 150 °С протягом 2 годин. До охолодженої суміші додають воду, потім проводять екстрагування етилацетатом три рази. Об'єднані екстракти добре промивають водою і насиченим сольовим розчином, сушать і упарюють, що дає сирий продукт, який очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 0,397 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 2,62-2,82 (м, 6Н), 3,05-3,13 (м, 4Н), 3,89 (с, 3Н), 4,02 (дд, 1Н), 4,29-4,40 (м, 2Н), 6,80-6,92 (м, 4Н), 7,02 (дд, 1Н), 7,04 (д, 1Н), 7,41 (дд, 1Н), 7,73 (д, 1Н). ПРИКЛАД 2: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол Метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат (0,60 г, 1,629 ммоль) відновлюють літій-алюмогідридом (0,31 г, 8,145 ммоль) в тетрагідрофурані (50 мл). Після закінчення 1 години при кімнатній температурі, суміш обробляють за допомогою 2 М розчину NaOH, що дає сирий продукт, який очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 0,476 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 2,62-2,90 (м, 6Н), 3,00-3,06 (м, 4Н), 4,04 (дд, 1Н), 4,30-4,38 (м, 2Н), 4,80 (с, 2Н), 5,26 (шир. с, 1Н), 6,81-6,93 (м, 4Н), 7,08-7,32 (м, 4Н). ПРИКЛАД 3: 1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2метоксиметил)феніл)піперазин (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол (356 мг, 1,05 ммоль) обробляють спочатку гідридом натрію (60 % розчин, 126 мг, 3,14 ммоль) в безводному тетрагідрофурані (2 мл) при 60 °С протягом 2 годин. Потім до охолодженої (приблизно 10 °С) суміші додають метилйодид (0,08 мл, 1,26 ммоль) в безводному тетрагідрофурані (1 мл), і перемішування продовжують протягом 1 години при кімнатній температурі. Суміш виливають в крижану воду і екстрагують етилацетатом. Сирий продукт, отриманий після сушіння і упарювання, очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 155 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 2,62-2,82 (м, 6Н), 2,82-3,02 (м, 4Н), 3,42 (с, 3Н), 4,03 (дд, 1Н), 4,31-4,39 (м, 2Н), 4,53 (с, 2Н), 6,81-6,93 (м, 4Н), 7,06-7,12 (м, 2Н), 7,27 (дд, 1Н), 7,43 (д, 1Н). Сполуку, отриману вище, (155 мг, 0,44 ммоль) розчиняють в етилацетаті (3 мл) і додають 1 М розчин HCl в діетиловому ефірі (Et2O) (0,6 мл). Осад відфільтровують, промивають невеликою кількістю холодного етилацетату і сушать у вакуумі при 30 °С з отриманням 153 мг солянокислої солі сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 3,17-3,28 (м, 4Н), 3,29-3,64 (м, 5Н), 3,34 (с, 3Н), 3,77 (шир.д, 1Н), 4,09 (дд, 1Н), 4,36 (дд, 1Н), 4,47 (с, 2Н), 5,00 (м, 1Н), 6,86-7,00 (м, 4Н), 7,10-7,17 (м, 2Н), 7,32 (дд, 1Н), 7,39 (д, 1Н), 11,27 (шир. с, 1Н). ПРИКЛАД 4: 2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензонітрил Суміш 2-(бромметил)-2,3-дигідробензо[b][1,4]діоксину (0,624 г, 2,72 ммоль), 1-(2ціанофеніл)піперазину (0,510 г, 2,72 ммоль) і К2СО3 (0,414 г, 3,00 ммоль) в диметилформаміді (20 мл) нагрівають в мікрохвильовому реакторі при 200 °С протягом 7 хвилин. До охолодженої суміші додають воду, потім проводять екстрагування етилацетатом три рази. Об'єднані екстракти промивають добре водою і насиченим сольовим розчином, сушать і упарюють з отриманням сирого продукту, який очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 0,42 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 2,67 (дд, 1Н), 2,71-2,88 (м, 5Н), 3,20-3,30 (м, 4Н), 4,03 (дд, 1Н), 4,29-4,39 (м, 2Н), 6,81-6,93 (м, 4Н), 6,97-7,05 (м, 2Н), 7,48 (дд, 1Н), 7,56 (д, 1Н). ПРИКЛАД 5: 2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)феніл)метанамін 2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензонітрил (0,55 г, 1,640 ммоль) відновлюють літій-алюмогідридом (124 мг, 3,28 ммоль) при кип'ятінні із зворотним холодильником в тетрагідрофурані (20 мл) (2 години). Обробка 2 н. розчином NaOH дає сирий продукт, який очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), з отриманням 0,285 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 1,62 (шир. с, 2Н), 2,61-2,85 (м, 6Н), 2,91-3,02 (м, 4Н), 3,89 (с, 2Н), 4,03 (дд, 1Н), 4,30-4,39 (м, 2Н), 6,79-6,93 (м, 4Н), 7,09 (дд, 1Н), 7,13 (д, 1Н), 7,24 (дд, 1Н), 7,31 (д, 1Н). ПРИКЛАД 6: 1-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)- Nметилметанамін (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанамін (240 мг, 0,71 ммоль) перемішують в дихлорметані (5 мл) і триетиламіні (0,15 мл, 1,06 ммоль). Суміш охолоджують до 0 °С з подальшим додаванням етилхлорформіату (0,10 мл) в безводному дихлорметані (1 мл). Охолоджувальну баню видаляють, і перемішування продовжують протягом 30 хвилин. Потім додають воду, фазу з дихлорметаном відділяють, і водний шар 12 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 екстрагують однократно дихлорметаном. Після процедур сушіння отримують 231 мг карбаматної проміжної сполуки. Її вмить відновлюють літій-алюмогідридом (85 мг, 2,24 ммоль) при кип'ятінні із зворотним холодильником в тетрагідрофурані (5 мл). Обробка 2 н. розчином NaOH дає сирий продукт, який очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), з отриманням 91 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 2,30 (шир. с, 1Н), 2,44 (с, 3Н), 2,60-2,73 (м, 6Н), 2,91-3,04 (м, 4Н), 3,80 (с, 2Н), 4,03 (дд, 1Н), 4,30-4,39 (м, 2Н), 6,80-6,93 (м, 4Н), 7,07 (дд, 1Н), 7,12 (д, 1Н), 7,24 (дд, 1Н), 7,31 (д, 1Н). ПРИКЛАД 7: 1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2(етоксиметил)феніл)піперазин Аналогічно прикладу 3, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)феніл)метанол (335 мг, 0,984 ммоль) обробляють гідридом натрію (3 екв.) з подальшим проведенням реакції з етилйодидом (184 мг, 1,181 ммоль). Сирий продукт очищають двічі флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 31 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 1,25 (т, 3Н), 2,61-2,83 (м, 6Н), 2,90-3,05 (м, 4Н), 3,58 (кв., 2Н), 4,03 (дд, 1Н), 4,30-4,40 (м, 2Н), 4,57 (с, 2Н), 6,80-6,93 (м, 4Н), 7,07 (д, 1Н), 7,09 (дд, 1Н), 7,25 (дд, 1Н), 7,45 (д, 1Н). ПРИКЛАД 8: 2-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)феніл)пропан-2-ол Метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат (370 мг, 1,0 ммоль) кип'ятять із зворотним холодильником з 3 М розчином MeMgCl/THF (1,5 мл) в безводному тетрагідрофурані (7 мл) протягом 3 годин. Надлишок реагенту Гріньяра розкладають обережним додаванням 1 М розчину HCl, після чого суміш роблять лужною за допомогою 1 М розчину NaOH. Додають додаткову кількість води, і водну фазу екстрагують етилацетатом. Промивання об'єднаних екстрактів водою, сушіння і упарювання дають 380 мг сирого спиртового продукту. Чисту сполуку, вказану в заголовку, отримують за допомогою очищення флеш-хроматографією (з використанням градієнта складу гептан:етилацетат). 1 Н-ЯМР (СDCl3): δ 1,58 (с, 6Н), 2,45-2,60 (м, 2Н), 2,66 (дд, 1Н), 2,77 (дд, 1Н), 2,94-3,16 (м, 6Н), 4,04 (дд, 1Н), 4,30-4,38 (м, 2Н), 6,81-6,92 (м, 4Н), 7,19 (дд, 1Н), 7,26 (дд, 1Н), 7,30 (д, 1Н), 7,36 (д, 1Н), 9,12 (шир. с, 1Н). ПРИКЛАД 9: 1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2іл)піперазин Суміш 2-(бромметил)-2,3-дигідробензо[b][1,4]діоксину (1,6 г, 6,98 ммоль), 1-(3(метоксиметил)піридин-2-іл)піперазину (1,3 г, 6,27 ммоль), К2СО3 (0,87 г, 6,30 ммоль) і КI (52 мг, 0,31 ммоль) в диметилформаміді (35 мл) нагрівають при 120 °С протягом 4,5 годин. До охолодженої суміші додають воду, потім проводять екстрагування етилацетатом. Об'єднані органічні шари екстрагують 1 н. розчином HCl, кислотну фазу роблять лужною і екстрагують етилацетатом. Сушіння і упарювання дають 1,99 г сирого продукту, який перекристалізовують з ізопропанолу з отриманням 1,23 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDCl3): δ 2,63-2,82 (м, 6Н), 3,21 (шир. т, 4Н), 3,42 (с, 3Н), 4,03 (дд, 1Н), 4,32-4,39 (м, 2Н), 4,42 (с, 2Н), 6,80-6,92 (м, 4Н), 6,93 (дд, 1Н), 7,68 (дд, 1Н), 8,24 (дд, 1Н). ПРИКЛАД 10: (S)-(2-(4-((7-Фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)піридин-3-іл)метанол Стадія А: (S)-Етил-2-(4-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)нікотинат Суміш (R)-(7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил-4-метилбензол-сульфонату (1,23 г, 3,6 ммоль), етил-2-(піперазин-1-іл)нікотинату (0,85 г, 3,6 ммоль) і К2СО3 (0,55 г, 4,0 ммоль) в ацетонітрилі (10 мл) нагрівають в мікрохвильовому реакторі при 150 °С протягом 40 хвилин. Розчинник випарюють і додають воду (50 мл). Екстракція етилацетатом (330 мл) дає після сушіння і упарювання суміш, що включає неочищений продукт, яку очищають флешхроматографією (з використанням градієнта складу дихлорметан:метиловий спирт), з отриманням 1,12 г сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 1,30 (т, 3Н), 2,52-2,62 (м, 6Н), 3,32-3,34 (м, 4Н), 3,97 (дд, 1Н), 4,27 (кв., 2Н), 4,31 (м, 1Н), 4,42 (м, 1Н), 6,66 (м, 1Н), 6,78 (дд, 1Н), 6,82 (дд, 1Н), 6,88 (дд, 1Н), 7,90 (дд, 1Н), 8,37 (дд, 1Н). СтадіяВ: (S)-(2-(4-((7-Фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)піридин-3-іл)метанол (S)-Етил-2-(4-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)нікотинат (1,12 г, 2,80 ммоль) розчиняють в тетрагідрофурані (10 мл) і додають по краплях до 13 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 охолодженого (0-5 °С) розчину літій-алюмогідриду (0,53 г, 14,0 ммоль) в тетрагідрофурані (10 мл). Потім суміші дають нагрітися до температури навколишнього середовища і після 2годинного перемішування до суміші обережно додають воду (10 мл). Додають целіт, і тверді частинки відфільтровують і промивають етилацетатом. Об'єднані фільтрати упарюють досуха і піддають однократному спільному випаровуванню з толуолом. Додають толуол (20 мл) і 1 М розчин HCl (40 мл), шари розділяють і воду екстрагують толуолом (20 мл). Водну фазу роблять лужною за допомогою NaOH і екстрагують етилацетатом (240 мл). Органічну фазу сушать і упарюють з отриманням 0,85 г сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 2,64-2,79 (м, 6Н), 3,18-3,20 (м, 4Н), 3,97-4,02 (м, 1Н), 4,09 (м, 1Н), 4,294,37 (м, 2Н), 4,74 (м, 2Н), 6,52-6,57 (м, 1Н), 6,61-6,64 (м, 1Н), 6,78-6,82 (м, 1Н), 7,00-7,03 (м, 1Н), 7,56-7,58 (м, 1Н), 8,28-8,29 (м, 1Н). ПРИКЛАД 11: (S)-(2-(4-((7-Фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)піридин-3-іл)метанол•HCl (S)-(2-(4-((7-Фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метанол (0,76 г, 2,1 ммоль) розчиняють в ізопропанолі (4 мл) при нагріванні і додають 8 % розчин HCl/етилацетат (4 мл). Осад відфільтровують, що дає 0,56 г продукту, вказаного в заголовку. 1 Н-ЯМР (CDCl3): δ 3,38-3,46 (м, 4Н), 3,57-3,67 (м, 3Н), 4,07-4,15 (м, 5Н), 4,28-4,32 (м, 1Н), 4,68 (м, 2Н), 5,08 (м, 1Н), 6,52-6,57 (м, 1Н), 6,60-6,65 (м, 1Н), 6,71-6,74 (м, 1Н), 6,83-6,87 (м, 1Н), 8,16-8,18 (м, 1Н), 8,28-8,30 (м, 1Н). ПРИКЛАД 12: (S)-1-((7-Фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3(метоксиметил)піридин-2-іл)піперазин•HCl (R)-(7-Фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил-4-метилбензолсульфонат (1,353 г, 4 ммоль), 1-(3-(метоксиметил)піридин-2-іл)піперазин (0,829 г, 4 ммоль), карбонат калію (0,608 г, 4,40 ммоль) і ацетонітрил (10 мл) змішують і нагрівають в мікрохвильовому реакторі при 120 °С протягом 60 хвилин. Суміш упарюють, додають воду (50 мл). Водну суміш екстрагують етилацетатом (320 мл). Органічну суміш сушать і упарюють досуха. Флеш-хроматографія (з використанням градієнта складу гептан:етилацетат) дає чистий продукт, який розчиняють в 10 % розчині HCl/етиловий спирт і упарюють досуха. Цю процедуру повторюють. Отримують 1,64 г сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 2,49-2,51 (м, 6Н), 3,08-3,28 (м, 4Н), 3,33 (с, 3Н), 3,96-4,00 (м, 1Н), 4,294,33 (м, 1Н), 4,37 (с, 2Н), 4,40-4,47 (м, 2Н), 6,64-6,68 (м, 1Н), 6,78-6,81 (м, 1Н), 6,87-6,90 (м, 1Н), 6,98-7,00 (м, 1Н), 7,67-7,69 (м, 1Н), 8,18-8,20 (м, 1Н). ПРИКЛАД 13: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-((2фторетокси)метил)піридин-2-іл)піперазин Стадія А: (S)-2-((2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метоксі)етанол До суміші (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2метоксиметил)феніл)піперазину (300 мг, 0,88 ммоль) і 50 % розчину NaOH (75 мл) додають тетра-н-бутил-амонійбромід (28 мг, 0,088 ммоль, 10 моль. %) і суміш перемішують протягом 15 хвилин. Додають повільно 2-(3-брометокси)тетрагідро-2Н-піран (0,42 мл, 2,64 ммоль, 300 моль. %), і реакційну суміш нагрівають до 60 °С. Після закінчення 2 годин додають насичений сольовий розчин (100 мл) і суміш екстрагують толуолом (250 мл + 75 мл). Об'єднані органічні шари промивають насиченим сольовим розчином (50 мл), сушать над сульфатом натрію, фільтрують і концентрують досуха. Залишок розчиняють в ацетоні (10 мл) і додають 1 М розчин HCl доти, поки рН не досягне значення ~3 (індикаторний рН-папір). Після перемішування протягом ночі рН коректують з доведенням до 1-2, і суміш перемішують протягом ночі. Суміш нейтралізують за допомогою 50 % розчину NaOH (індикаторний рН-папір), і ацетон випарюють. Додають дихлорметан (20 мл) і суміш промивають водою (10 мл), насиченим розчином NaHCO 3 (5 мл) і насиченим сольовим розчином (10 мл). Органічний шар сушать над Na 2SO4, фільтрують і концентрують у вакуумі. Очищення колонковою хроматографією (етилацетат:гептан, 3:2-4:10:1, об'єм/об'єм) надає 253 мг сполуки, вказаної в заголовку. Стадія В: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-((2фторетокси)метил)піридин-2-іл)піперазин (S)-2-((2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метоксі)етанол (250 мг, 0,65 ммоль) і безводний дихлорметан (8,8 мл) завантажують під азотом в суху 50-мілілітрову круглодонну колбу, оснащену магнітною мішалкою і термометром. Розчин охолоджують до ~0 °С і додають діетиламіно-трифторид сірки (DAST, 127 мкл, 0,97 ммоль, 150 моль. %). Реакційній суміші дають нагрітися до кімнатної температури і після закінчення 2 годин додають додаткову кількість діетиламіно-трифториду сірки (DAST, 42 мкл, 14 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 0,32 ммоль, 50 моль. %). У сукупності реакційну суміш перемішують протягом 7,5 годин. Додають насичений розчин Na2CO3 (3,9 мл) при 0 °С. Суміші дають нагрітися до кімнатної температури і додають воду (1,5 мл). Шари розділяють, і водний шар екстрагують дихлорметаном (24 мл). Об'єднані органічні шари сушать над Na 2SO4, фільтрують і концентрують у вакуумі. Очищення колонковою хроматографією (етилацетат:гептан, 1:1-1:0, об'єм/об'єм) дає 155 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (MeOH-d4): δ 2,70-2,81 (м, 6Н), 3,19-3,22 (м, 4Н), 3,66-3,70 (м, 1Н), 3,85-3,98 (м, 1Н), 3,98-4,01 (м, 1Н), 4,28-4,46 (м, 3Н), 4,56 (с, 2Н), 4,66-4,70 (м, 1Н), 6,76-7,84 (м, 4Н), 7,04-7,06 (м, 1Н), 7,78-7,82 (м, 1Н), 8,15-8,18 (м, 1Н). Через відновлення амідних проміжних сполук ПРИКЛАД 14: 1-(2,3-Дихлорфеніл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин Стадія А: (4-(2,3-Дихлорфеніл)піперазин-1-іл)(2,3-дигідробензо[b][1,4]діоксин-2-іл)метанон 2,3-Дигідробензо[b][1,4]діоксин-2-карбонілхлорид (220 мг, 1,11 ммоль) піддають взаємодії з 1-(2,3-дихлорфеніл)піперазином (257 мг, 1,11 ммоль) і триетиламіном (0,23 мл, 1,66 ммоль) в дихлорметані (3 мл) при 0 °С. Потім перемішеній суміші дають нагрітися до кімнатної температури. Додають воду, шар з дихлорметаном відділяють, і водну фазу екстрагують однократно дихлорметаном. Об'єднані органічні шари промивають водою, сушать і упарюють, що дає 330 мг сирого аміду, який використовують без очищення на наступній стадії. 1 Н-ЯМР (CDCl3): δ 2,98-3,18 (м, 4Н), 3,67-3,83 (м, 2Н), 3,91-4,04 (м, 2Н), 4,36 (дд, 1Н), 4,53 (дд, 1Н), 4,88 (дд, 1Н), 6,80-7,25 (м, 7Н). Стадія В: 1-(2,3-Дихлорфеніл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин (4-(2,3-Дихлорфеніл)піперазин-1-іл)(2,3-дигідробензо[b][1,4]діоксин-2-іл)метанон (328 мг, 0,834 ммоль) відновлюють літій-алюмогідридом (158 мг, 4,17 ммоль) при кип'ятінні із зворотним холодильником в тетрагідрофурані (20 мл) (3 години). Обробка за допомогою 2 н. розчину NaOH дає сирий продукт, який очищають флеш-хроматографією (гептан/етилацетат/триетиламін, 7:3:0,5), з отриманням 134 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 2,63-2,85 (м, 6Н), 3,05-3,15 (м, 4Н), 4,03 (дд, 1Н), 4,30-4,40 (м, 2Н), 6,807,02 (м, 5Н), 7,12-7,18 (м, 2Н). ПРИКЛАД 15: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метанол Стадія А: Етил-2-(4-(2,3-дигідробензо[b][1,4]діоксин-2-карбоніл)піперазин-1-іл)нікотинат 2,3-Дигідробензо[b][1,4]діоксин-2-карбонілхлорид (1,032 ммоль) перемішують в суміші тетрагідрофуран/вода з співвідношенням 7:3 (10 мл). Додають етил-2-(піперазин-1-іл)нікотинат (220 мг, 0,935 ммоль) при 0 °С. Потім суміш перемішують при кімнатній температурі протягом 4 годин. Тетрагідрофуран видаляють випарюванням, і водну фазу, що залишилася, екстрагують дихлорметаном (20 мл). Органічну фазу промивають (вода, 1 М розчин HCl і 1 М розчин Na2CO3), сушать і упарюють досуха, що дає 255 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 1,39 (т, 3Н), 3,44-3,78 (м, 4Н), 3,86-3,40 (м, 4Н), 4,31-4,39 (м, 3Н), 4,48-4,53 (м, 1Н), 4,84-4,90 (м, 1Н), 6,79-6,97 (м, 5Н), 7,95-7,99 (м, 1Н), 8,29-8,33 (м, 1Н). Стадія В: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метанол Етил-2-(4-(2,3-дигідробензо[b][1,4]діоксин-2-карбоніл)піперазин-1-іл)нікотинат (255 мг, 0,642 ммоль) розчиняють в тетрагідрофурані (3 мл) і охолоджують на крижаній бані. Додають літійалюмогідрид (77 мг, 2,03 ммоль), і суміш перемішують протягом 1 години, при цьому температурі дають досягнути значень кімнатної температури. Реакційну суміш гасять водою. Суміш фільтрують через целіт і упарюють досуха. Флеш-хроматографія дає 43 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): дивись приклад 16. ПРИКЛАД 16: (S)-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метанол Стадія А: (R)-Етил-2-(4-((2,3-дигідробензо)[b][1,4]діоксин-2-карбоніл)піперазин-1-іл)нікотинат (R)-2,3-Дигідробензо[b][1,4]діоксин-2-карбонілхлорид (10,3 г, 52 ммоль) в тетрагідрофурані (30 мл) додають по краплях в крижану суміш тетрагідрофурану (100 мл), води (40 мл), етил-2(піперазин-1-іл)нікотинату (10,2 г, 43,4 ммоль) і К 2СО3 (5,99 г, 43,4 ммоль). Температурі дають досягнути значень кімнатної температури. Суміш перемішують протягом 17 годин і концентрують у вакуумі. Додають воду (100 мл). Цю суміш екстрагують етилацетатом (2250 мл). Органічні шари об'єднують, сушать і упарюють досуха з отриманням 14,7 г сирого продукту. Частину цього (13,7 г) очищають флеш-хроматографією з отриманням 10,7 г сполуки, вказаної в заголовку. 15 UA 105647 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н-ЯМР (CDCl3): δ 1,39 (т, 3Н), 3,44-3,78 (м, 4Н), 3,86-3,40 (м, 4Н), 4,31-4,39 (м, 3Н), 4,48-4,53 (м, 1Н), 4,84-4,90 (м, 1Н), 6,79-6,97 (м, 5Н), 7,95-7,99 (м, 1Н), 8,29-8,33 (м, 1Н). Стадія В: (S)-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метанол До крижаної суспензії літій-алюмогідриду (1,232 г, 30,8 ммоль) і тетрагідрофурану (120 мл) додають по краплях розчин (R)-етил-2-(4-(2,3-дигідробензо[b][1,4]діоксин-2-карбоніл)піперазин1-іл)нікотинату (3,065 г, 7,71 ммоль) в тетрагідрофурані (30 мл). Температурі дають досягнути значень кімнатної температури, і суміш перемішують протягом 3 годин. Додають воду (20 мл). Суміш фільтрують через целіт і упарюють досуха. Флеш-хроматографія дає 560 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 2,6-2,9 (м, 6Н), 3,19 (шир. т, 4Н), 4,03 (дд, 1Н), 4,14 (шир. с, 1Н), 4,30-4,39 (м, 2Н), 4,73 (с, 2Н), 6,80-6,92 (м, 4Н), 7,00 (дд, 1Н), 7,57 (дд, 1Н), 8,27 (дд, 1Н). ПРИКЛАД 17: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2(метоксиметил)феніл)піперазин Стадія А: (R)-(2,3-Дигідробензо[b][1,4]діоксин-2-іл)(4-(2-(метоксиметил)феніл)піперазин-1іл)метанон Так само, як в прикладі 14, на стадії А, (R)-2,3-дигідробензо[b][1,4]діоксин-2-карбонілхлорид (220 мг, 1,11 ммоль) піддають взаємодії з 1-(2-(метоксиметил)феніл)піперазином (229 мг, 1,11 ммоль) і триетиламіном (0,23 мл, 1,66 ммоль) в дихлорметані (3,3 мл) при 0 °С, що дає 300 мг сирого бажаного аміду. 1 Н-ЯМР (CDCl3): δ 2,88-3,12 (м, 4Н), 3,44 (с, 3Н), 3,66-3,81 (м, 2Н), 3,83-3,98 (м, 2Н), 4,36 (дд, 1Н), 4,52 (дд, 1Н), 4,56 (с, 2Н), 4,88 (дд, 1Н), 6,82-6,95 (м, 4Н), 7,08 (д, 1Н), 7,14 (дд, 1Н), 7,30 (дд, 1Н), 7,45 (д, 1Н). Стадія В: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2(метоксиметил)феніл)піперазин (R)-(2,3-Дигідробензо[b][1,4]діоксин-2-іл)(4-(2-(метоксиметил)феніл)піперазин-1-іл)метанон (366 мг, 0,99 ммоль) відновлюють літій-алюмогідридом (188 мг, 4,97 ммоль) в безводному тетрагідрофурані (22 мл, кип'ятіння із зворотним холодильником 2 години). Обробка за допомогою 2 н. розчину NaOH дає сирий продукт, який очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 90 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): дивись приклад 3. ПРИКЛАД 18: (R)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2(метоксиметил)феніл)піперазин Відповідний (R)-ізомер отримують так само, як у вищенаведеному прикладі 17, спочатку шляхом реакційної взаємодії (S)-2,3-дигідробензо[b][1,4]діоксин-2-карбонілхлориду (220 мг, 1,11 ммоль) і 1-(2-(метоксиметил)феніл)піперазину (229 мг, 1,11 ммоль) в присутності триетиламіну (0,23 мл, 1,66 ммоль) в дихлорметані (3,3 мл). Відновлення сирого аміду (345 мг, 0,94 ммоль) за допомогою 5 екв. літій-алюмогідриду (178 мг, 4,68 ммоль) при кип'ятінні із зворотним холодильником в тетрагідрофурані дає, після очищення флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), 87 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): дивись приклад 3. ПРИКЛАД 19: (S)-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)феніл)метанол Стадія А: (R)-Метил-2-(4-(2,3-дигідробензо[b][1,4]діоксин-2-карбоніл)піперазин-1-іл)бензоат Так само, як в прикладі 17, (R)-2,3-дигідробензо[b][1,4]діоксин-2-карбонілхлорид (0,50 г, 2,54 ммоль) піддають взаємодії з метил-2-(піперазин-1-іл)бензоатом (0,56 г, 2,54 ммоль) і триетиламіном (0,54 мл, 3,81 ммоль) в дихлорметані (8 мл) при 0 °С, що дає 0,87 г неочищеного аміду. 1 Н-ЯМР (CDCl3): δ 3,00-3,23 (м, 4Н), 3,68-3,83 (м, 2Н), 3,88-4,00 (м, 2Н), 3,90 (с, 3Н), 4,35 (дд, 1Н), 4,52 (дд, 1Н), 4,87 (дд, 1Н), 6,82-6,95 (м, 4Н), 7,04-7,11 (м, 2Н), 7,46 (дд, 1Н), 7,81 (д, 1Н). Стадія В: (S)-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол Вищезазначений амід (0,87 г, 2,27 ммоль) відновлюють літій-алюмогідридом (0,52 г, 13,65 ммоль) в безводному тетрагідрофурані (55 мл, кип'ятіння із зворотним холодильником 2 години). Обробка за допомогою 2,5 М розчину NaOH дає сирий продукт, який очищають флешхроматографією (з використанням градієнта складу гептан:етилацетат), з отриманням 188 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): дивись приклад 2. ПРИКЛАД 20: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин2-іл)піперазин 16 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія А: (R)-(2,3-Дигідробензо[b][1,4]діоксин-2-іл)(4-(3-(метоксиметил)піридин-2іл)піперазин-1-іл)метанон 1-(3-(Метоксиметил)піридин-2-іл)піперазин (25 г, 121 ммоль) і К2СО3 (25 г, 181 ммоль) розчиняють в суміші води (200 мл) і тетрагідрофурану (300 мл). Сирий (R)-2,3дигідробензо[b][1,4]діоксин-2-карбонілхлорид, заздалегідь отриманий з (R)-2,3дигідробензо[b][1,4]діоксин-2-карбонової кислоти (28,3 г, 157 ммоль), розчиняють в безводному тетрагідрофурані (100 мл) і додають за 10 хвилин до суміші при 20±5 °С при ефективному перемішуванні. Перемішування продовжують протягом додаткових 30 хвилин при кімнатній температурі, після чого розділяють фази. Органічну фазу промивають насиченим сольовим розчином, сушать і упарюють з отриманням 42,4 г продукту, вказаного в заголовку. 1 Н-ЯМР (CDCl3): δ 3,17-3,37 (м, 4Н), 3,45 (с, 3Н), 3,70-3,78 (м, 3Н), 3,85-3,96 (м, 2Н), 4,33-4,38 (м, 1Н), 4,45 (с, 2Н), 4,51-4,54 (м, 1Н), 4,87-4,89 (дд, 1Н), 6,85-7,02 (м, 5Н), 7,71-7,73 (дд, 1Н), 8,26-8,27 (дд, 1Н). Стадія В: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2іл)піперазин (R)-(2,3-Дигідробензо[b][1,4]діоксин-2-іл)(4-(3-(метоксиметил)піридин-2-іл)піперазин-1іл)метанон (42 г, 108 ммоль) розчиняють в тетрагідрофурані (420 мл). До перемішеного розчину додають повільно 1 М розчин BH3•THF (397 мл, 397 ммоль) при підтриманні температури нижче 40 °С. Перемішування продовжують протягом 2,5 годин при 40 °С. Після охолоджування до кімнатної температури додають метиловий спирт (120 мл) і воду (65 мл), і розчинники випарюють. До залишку додають етиловий спирт (65 мл), воду (65 мл) і концентровану HCl (63 мл) і суміш нагрівають протягом 1,5 години при 60 °С. При охолоджуванні рН суміші коректують з доведенням до 10 за допомогою 50 % розчину NaOH. Додають дихлорметан і утворений осад відфільтровують. Фази розділяють і водну фазу промивають дихлорметаном. Об'єднані органічні шари сушать і упарюють. Сирий продукт перекристалізовують з ізопропанолу, що дає 29 г чистої сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 2,65-2,79 (м, 6Н), 3,20-3,22 (м, 4Н), 3,42 (с, 3Н), 4,01-4,06 (дд, 1Н), 4,334,37 (м, 2Н), 4,42 (с, 2Н), 6,83-6,96 (м, 5Н), 7,68-7,70 (дд, 1Н), 8,23-8,25 (дд, 1Н). ПРИКЛАД 21: (1-((2,3-Дигідробензо[b][1,4]оксатиїн-2-іл)метил)-4-(2(метоксиметил)феніл)піперазин Стадія А: (2,3-Дигідробензо[b][1,4]оксатиїн-2-іл)(4-(2-(метоксиметил)феніл)піперазин-1іл)метанон 2,3-Дигідробензо[b][1,4]оксатиїн-2-карбонову кислоту (112 мг, 0,48 ммоль) обробляють тіонілхлоридом (0,21 мл, 2,85 ммоль) при кип'ятінні із зворотним холодильником в толуолі протягом 1 години. Після охолоджування суміш упарюють досуха і повторно розчиняють в дихлорметані (2 мл). Цей розчин додають до перемішеної суміші 1-(3-(метоксиметил)піридин-2іл)піперазину (100 мг, 0,48 ммоль), триетиламіну (0,080 мл, 0,57 ммоль) і дихлорметану (1 мл). Після закінчення 30 хвилин при кімнатній температурі, суміш промивають за допомогою 1 М розчину Na2CO3 і упарюють досуха, що дає 119 мг сирого аміду. 1 Н-ЯМР (CDCl3): δ 2,89-3,11 (м, 4Н), 3,18-3,23 (м, 1Н), 3,41-3,55 (м, 4Н), 3,64-3,99 (м, 4Н), 4,56 (с, 2Н), 4,89-4,92 (м, 1Н), 6,85-6,92 (м, 2Н), 6,97-7,05 (м, 1Н), 7,06-7,18 (м, 3Н), 7,26-7,33 (м, 1Н), 7,42-7,49 (м, 1Н). Стадія В: (1-((2,3-Дигідробенза[b][1,4]оксатиїн-2-іл)метил)-4-(2(метоксиметил)феніл)піперазин Амід, отриманий на стадії А, (119 мг, 0,309 ммоль) відновлюють літій-алюмогідридом (65 мг, 1,70 ммоль) в безводному тетрагідрофурані (4 мл), спочатку при кімнатній температурі протягом 2 годин і потім при температурі флегмації протягом 30 хвилин. Обробка за допомогою 1 М розчину NaOH і води дає, після фільтрації і упарювання, сирий продукт. Його очищають флешхроматографією (з використанням градієнта складу гептан:етилацетат) з отриманням 30 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 2,63-2,88 (м, 6Н), 2,94-3,00 (м, 4Н), 3,02-3,10 (м, 1Н), 3,15-3,22 (м, 1Н), 3,42 (с, 3Н), 4,35-4,45 (м, 1Н), 4,53 (с, 2Н), 6,82-6,88 (м, 2Н), 6,97-7,02 (м, 1Н), 7,04-7,12 (м, 3Н), 7,24-7,30 (м, 1Н), 7,42-7,45 (м, 1Н). ПРИКЛАД 22: 1-(Хроман-2-ілметил)-4-(2-(метоксиметил)феніл)піперазин Стадія А: Хроман-2-іл(4-(2-(метоксиметил)феніл)піперазин-1-іл)метанон Так само, як у вищенаведеному прикладі, неочищений хроман-2-карбонілхлорид, отриманий з хроман-2-карбонової кислоти (198 мг, 1,11 ммоль), піддають взаємодії з 1-(2(метоксиметил)феніл)піперазином (229 мг, 1,11 ммоль) в присутності триетиламіну (0,23 мл, 1,67 ммоль) в дихлорметані (3,3 мл) з отриманням 343 мг сирого аміду, який використовують як такий на наступній стадії. 17 UA 105647 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н-ЯМР (CDCl3): δ 2,20-2,29 (м, 2Н), 2,82-3,08 (м, 6Н), 3,43 (с, 3Н), 3,68-3,95 (м, 4Н), 4,56 (с, 2Н), 4,82 (дд, 1Н), 6,83-6,91 (м, 2Н), 7,05-7,17 (м, 2Н), 7,29 (ддд, 1Н), 7,45 (дд, 1Н). Стадія В: 1-(Хроман-2-ілметил)-4-(2-(метоксиметил)феніл)піперазин Вищезазначений амід (339 мг, 0,925 ммоль) відновлюють літій-алюмогідридом (176 мг, 4,63 ммоль) при кип'ятінні із зворотним холодильником в тетрагідрофурані (20 мл) (3 години). Обробка за допомогою 2 н. розчину NaOH дає сирий продукт, який очищають флешхроматографією (з використанням градієнта складу гептан:етилацетат), з отриманням 139 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (CDCl3): δ 1,75-1,88 (м, 1Н), 2,04-2,14 (м, 1Н), 2,61-2,93 (м, 8Н), 2,98 (шир. т, 4Н), 3,42 (с, 3Н), 4,20-4,28 (м, 1Н), 4,54 (с, 2Н), 6,80-6,87 (м, 2Н), 7,02-7,12 (м, 4Н), 7,26 (ддд, 1Н), 7,43 (дд, 1Н). Сполуку обробляють за допомогою 1 М розчину HCl/діетиловий ефір в етилацетаті з отриманням солянокислої солі звичайним способом. 1 Н-ЯМР (DMSO-d6): δ 1,68-1,82 (м, 1Н), 2,01-2,11 (м, 1Н), 2,72-2,93 (м, 2Н), 3,16-3,28 (м, 4Н), 3,30-3,65 (м, 8Н), 3,72-3,81 (м, 1Н), 4,48 (м, 2Н), 4,65-4,75 (м, 1Н), 6,83-6,92 (м, 2Н), 7,08-7,18 (м, 4Н), 7,32 (дд, 1Н), 7,40 (д, 1Н), 10,75 (шир. с, 1Н). Через алкілування похідних піперазину за допомогою електрон-дефіцитних галогенаренів ПРИКЛАД 23: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-6фторфеніл)метанол Стадія А: 2-(4-(2,3-Дигідробензо[b][1,4]діоксин-2-карбоніл)піперазин-1-іл)-6фторбензальдегід Суміш (2,3-дигідробензо[b][1,4]діоксин-2-іл)(піперазин-1-іл)метанону (0,20 г, 0,81 ммоль), 2,6дифторбензальдегіду (0,36 г, 2,56 ммоль) і К2СО3 (0,59 г, 4,26 ммоль) в диметилформаміді (7 мл) нагрівають в мікрохвильовому реакторі при 160 °С протягом 20 хвилин. Суміш виливають у воду і екстрагують етилацетатом (35 мл). Органічний шар сушать і упарюють, що дає 0,35 г альдегіду, вказаного в заголовку. 1 Н-ЯМР (DMSO-d6): δ 3,11 (м, 4Н), 3,71 (м, 4Н), 4,21 (м, 1Н), 4,41 (м, 1Н), 5,27 (м, 1Н), 6,83 (м, 3Н), 6,94 (м, 2Н), 7,05 (м, 1Н), 7,61 (м, 1Н), 10,21 (с, 1Н). Стадія В: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-6фторфеніл)метанол Неочищений продукт, отриманий на вищенаведеній стадії, (0,32 г, 0,90 ммоль) в тетрагідрофурані (5 мл) додають до суспензії літій-алюмогідриду (0,17 г, 4,46 ммоль) в безводному тетрагідрофурані (2 мл). Реакційну суміш нагрівають в мікрохвильовому реакторі при 80 °С протягом 10 хвилин, після чого її виливають в крижану воду і екстрагують етилацетатом (310 мл). Об'єднані органічні шари сушать і упарюють. Сирий продукт очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 36 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 2,61 (м, 6Н), 3,01 (м, 4Н), 4,02 (м, 1Н), 4,30 (м, 2Н), 4,51 (с, 2Н), 5,01 (с, 1Н), 6,86 (м, 6Н), 7,31 (м, 1Н). ПРИКЛАД 24: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-3фторфеніл)метанол Стадія А: 2-(4-(2,3-Дигідробензо[b][1,4]діоксин-2-карбоніл)піперазин-1-іл)-3фторбензальдегід (2,3-Дигідробензо[b][1,4]діоксин-2-іл)(піперазин-1-іл)метанон (0,20 г, 0,81 ммоль), 2,3дифторбензальдегід (0,18 г, 1,28 ммоль) і К2СО3 (0,29 г, 2,13 ммоль) в диметилформаміді (3 мл) нагрівають в мікрохвильовому реакторі при 160 °С протягом 20 хвилин. Суміш виливають у воду і екстрагують етилацетатом (35 мл). Після сушіння і упарювання отримують 0,14 г неочищеного альдегіду. 1 Н-ЯМР (DMSO-d6): δ 3,19 (м, 4Н), 3,60 (м, 4Н), 4,12 (м, 1Н), 4,39 (м, 1Н), 5,22 (м, 1Н), 6,83 (м, 4Н), 7,56 (м, 1Н), 7,70 (м, 1Н), 7,80 (м, 1Н), 10,21 (с, 1Н). Стадія В: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-3фторфеніл)метанол Продукт, отриманий вищезазначеним способом, (0,32 г, 0,90 ммоль) в безводному тетрагідрофурані (4 мл) додають до суспензії літій-алюмогідриду (0,17 г, 4,46 ммоль) в безводному тетрагідрофурані (2 мл). Реакційну суміш нагрівають в умовах мікрохвильового опромінення при 80 °С протягом 10 хвилин, після чого її обробляють так само, як в прикладі 23, на стадії В. Сирий продукт очищають колонковою хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 18,0 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 2,61 (м, 6Н), 3,01 (м, 4Н), 4,02 (м, 1Н), 4,30 (м, 2Н), 4,53 (с, 2Н), 5,01 (с, 1Н), 6,85 (м, 6Н), 7,30 (м, 1Н). 18 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 ПРИКЛАД 25: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-5фторфеніл)метанол Стадія А: 2-(4-(2,3-Дигідробензо[b][1,4]діоксин-2-карбоніл)піперазин-1-іл)-5фторбензальдегід Так само, як в двох попередніх прикладах, (2,3-дигідробензо[b][1,4]діоксин-2-іл)(піперазин-1іл)метанон (0,20 г, 0,81 ммоль), 2,5-дифторбензальдегід (0,38 г, 2,70 ммоль) і К2СО3 (0,62 г, 4,50 ммоль) в диметилформаміді (7 мл) піддають реакції в умовах мікрохвильового опромінення при 160 °С протягом 15 хвилин. Обробка, виконана так само, як вказано вище, дає 0,27 г альдегідної проміжної сполуки. 1 Н-ЯМР (DMSO-d6): δ 3,10 (м, 4Н), 3,70 (м, 4Н), 4,21 (м, 1Н), 4,40 (м, 1Н), 5,28 (м, 1Н), 6,83 (м, 3Н), 6,90 (м, 2Н), 7,40 (м, 1Н), 7,60 (м, 1Н), 10,18 (с, 1Н). Стадія В: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-5фторфеніл)метанол Продукт, отриманий на стадії А, (0,27 г, 0,70 ммоль) відновлюють літій-алюмогідридом (0,13 г, 3,50 ммоль) в безводному тетрагідрофурані (5 мл) так само, як вказано вище. Сирий продукт очищають флеш-хроматографією (з використанням градієнта складу гептан:етилацетат), що дає 13,1 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 2,61 (м, 6Н), 3,01 (м, 4Н), 4,03 (м, 1Н), 4,51 (м, 2Н), 4,51 (д, 2Н), 5,45 (т, 1Н), 6,86 (м, 6Н), 7,21 (м, 1Н). Арилпіперазини через замикання циклів Загальна методика: Відповідне похідне аніліну (0,2 ммоль), (S)-2-хлор-N-(2-хлоретил)-N((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанамін (0,25 ммоль), триетиламін (0,105 мл, 0,75 ммоль) і ацетонітрил (ACN, 1 мл) змішують і нагрівають в запаяній ампулі при 180 °С протягом 1-2 годин з використанням мікрохвильового реактора. Після охолоджування суміш поглинається на шарі-пробці з силікагелю. Флеш-хроматографія з використанням градієнта складу гептан/етилацетат дає бажану сполуку. ПРИКЛАД 26: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-пропілфеніл)піперазин З використанням загальноприйнятої методики 2-пропіланілін піддають взаємодії з (S)-2хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном, що дає 10,4 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 0,97 (т, 3Н), 1,59-1,71 (м, 2Н), 2,58-2,83 (м, 12Н), 3,98-4,08 (м, 1Н), 4,334,38 (м, 2Н), 6,82-6,92 (м, 4Н), 7,00-7,23 (м, 4Н). ПРИКЛАД 27: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2(трифторметокси)феніл)піперазин З використанням загальноприйнятої методики 2-(трифторметоксі)анілін піддають взаємодії з (S)-2-хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 2,3 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,60-2,84 (м, 4Н), 3,05-3,16 (м, 4Н), 4,00-4,06 (м, 1Н), 4,08-4,16 (м, 2Н), 4,30-4,37 (м, 2Н), 6,82-6,92 (м, 4Н), 6,97-7,05 (м, 2Н), 7,16-7,25 (м, 2Н). ПРИКЛАД 28: (S)-1-(Біфеніл-3-іл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин З використанням загальноприйнятої методики біфеніл-3-амін піддають взаємодії з (S)-2хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 12,9 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,62-2,88 (м, 6Н), 3,23-3,35 (м, 4Н), 3,99-4,04 (м, 1Н), 4,32-4,40 (м, 2Н), 6,78-6,99 (м, 5Н), 7,04-7,18 (м, 2Н), 7,31-7,50 (м, 4Н), 7,56-7,21 (м, 2Н). ПРИКЛАД 29: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(фуран-2іл)феніл)піперазин З використанням загальноприйнятої методики 2-(фуран-2-іл)анілін піддають взаємодії з (S)2-хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 6,4 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,59-2,89 (м, 6Н), 2,90-3,08 (м, 4Н), 3,99-4,07 (м, 1Н), 4,29-4,40 (м, 2Н), 6,47-6,52 (м, 1Н), 6,80-6,93 (м, 4Н), 7,08-7,30 (м, 4Н), 7,44-7,49 (м, 1Н), 7,77-7,82 (м, 1Н). ПРИКЛАД 30: (S)-Етил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)бензоат 19 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 З використанням загальноприйнятої методики етил-2-амінобензоат піддають взаємодії з (S)2-хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 5,0 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 1,39 (т, 3Н), 2,61-2,83 (м, 6Н), 3,01-3,17 (м, 4Н), 3,91-4,06 (м, 1Н), 4,30-4,40 (м, 4Н), 6,81-6,92 (м, 4Н), 6,97-7,07 (м, 2Н), 7,37-7,44 (м, 1Н), 7,69-7,74 (м, 1Н). ПРИКЛАД 31: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-о-толілпіперазин З використанням загальноприйнятої методики о-толуїдин піддають взаємодії з (S)-2-хлор-N(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 27,6 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,30 (с, 3Н), 2,59-2,85 (м, 6Н), 2,85-3,01 (м, 4Н), 3,96-4,10 (м, 1Н), 4,28-4,42 (м, 2Н), 6,79-6,95 (м, 4Н), 6,95-7,09 (м, 2Н), 7,15-7,22 (м, 2Н). ПРИКЛАД 32: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-м-толілпіперазин З використанням загальноприйнятої методики м-толуїдин піддають взаємодії з (S)-2-хлор-N(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 17,5 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,31 (с, 3Н), 2,66-2,85 (м, 6Н), 3,15-3,28 (м, 4Н), 3,97-4,09 (м, 1Н), 4,26-4,42 (м, 2Н), 6,65-6,80 (м, 3Н), 6,80-6,94 (м, 4Н), 7,09-7,23 (м, 1Н). ПРИКЛАД 33: (S)-(3-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-4метилфеніл)метанол З використанням загальноприйнятої методики (3-аміно-4-метилфеніл)метанол піддають взаємодії з (S)-2-хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 5,2 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,29 (с, 3Н), 2,62-2,85 (м, 6Н), 2,92-2,98 (м, 4Н), 4,00-4,07 (м, 1Н), 4,30-4,39 (м, 2Н), 4,64 (с, 2Н), 6,80-6,94 (м, 4Н), 6,97-7,01 (м, 1Н), 7,03-7,06 (м, 1Н), 7,14-7,20 (м, 1Н). ПРИКЛАД 34: (S)-(3-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)феніл)метанол З використанням загальноприйнятої методики, (3-амінофеніл)метанол піддають взаємодії з (S)-2-хлор-N-(2-хлоретил)-N-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)етанаміном з отриманням 18,9 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,57-2,87 (м, 6Н), 3,20-3,26 (м, 4Н), 3,94-4,00 (м, 1Н), 4,24-4,40 (м, 2Н), 4,66 (с, 2Н), 6,80-6,97 (м, 5Н), 6,93-6,97 (м, 1Н), 7,18-7,27 (м, 2Н). ПРИКЛАД 35: (S)-2-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1іл)феніл)етанол 3-(2-Амінофеніл)етан-1-ол (24 мг, 0,172 ммоль), (S)-2-хлор-N-(2-хлоретил)-N-((2,3дигідробензо[b][1,4]діоксин-2-іл)метил)етанамін (50 мг, 0,172 ммоль), триетиламін (0,060 мл, 0,43 ммоль) і ацетонітрил (0,5 мл) змішують і нагрівають в запаяній ампулі при 180 °С протягом 2 годин з використанням мікрохвильового реактора. Після охолоджування суміш поглинається на шарі-пробці з силікагелю. Флеш-хроматографія з використанням градієнта складу гептан/етилацетат дає 15,0 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 2,50-3,19 (м, 14Н), 3,74-3,19 (м, 2Н), 3,98-4,08 (м, 1Н), 4,26-4,38 (м, 2Н), 4,89 (шир. с, 1Н), 6,75-6,96 (м, 4Н), 7,07-7,28 (м, 4Н). Гомопіперазини ПРИКЛАД 36: Метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1іл)бензоат Суміш 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепану (0,21 г, 0,86 ммоль), метил-2-фторбензоату (0,20 г, 1,28 ммоль) і K2CО3 (0,18 г, 1,30 ммоль) в диметилформаміді (8 мл) нагрівають в мікрохвильовому реакторі при 220 °С протягом 30 хвилин. Суміш виливають у воду і екстрагують етилацетатом (320 мл). Органічний шар сушать і упарюють. Сирий продукт очищають флеш-хроматографією (з використанням градієнта складу дихлорметан:метиловий спирт), що дає 0,20 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 1,91 (м, 2Н), 2,73 (м, 1Н), 2,86 (м, 4Н), 3,43 (м, 4Н), 3,88 (с, 3Н), 3,97 (дд, 1Н), 4,33 (м, 2Н), 6,85 (м, 1Н), 6,97 (д, 1Н), 7,31 (т, 1Н), 7,59 (дд, 1Н). ПРИКЛАД 37: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1іл)феніл)метанол До суспензії літій-алюмогідриду (100 мг, 2,63 ммоль) в безводному тетрагідрофурані (2 мл) додають метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)бензоат (200 мг, 0,52 ммоль) в безводному тетрагідрофурані (5 мл). Реакційну суміш нагрівають в мікрохвильовому реакторі при 80 °С протягом 10 хвилин. Реакційну суміш виливають в крижану воду і екстрагують етилацетатом (320 мл). Об'єднані органічні фази сушать і упарюють. Флеш 20 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 хроматографія (склад елюента гептан/етилацетат, 40:60) сирого продукту дає 41 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 1,92 (м, 2Н), 2,75 (м, 1Н), 2,95 (м, 6Н), 3,19 (м, 4Н), 4,04 (м, 1Н), 4,35 (м, 1Н), 4,38 (дд, 1Н), 4,78 (с, 2Н), 6,89 (м, 4Н), 7,07 (т, 1Н), 7,18 (м, 3Н). ПРИКЛАД 38: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1іл)нікотинонітрил Суміш 2-(бромметил)-2,3-дигідробензо[b][1,4]діоксину (150 мг, 0,65 ммоль), 2-(1,4-діазепан1-іл)нікотинонітрилу (131 мг, 0,65 ммоль) і N, N-діізопропілетиламіну (DIPEA, 0,4 мл, 2,32 ммоль) в диметилформаміді (1,5 мл) нагрівають в мікрохвильовому реакторі при 160 °С протягом 20 хвилин. Суміш виливають у воду і екстрагують етилацетатом (320 мл). Об'єднані органічні шари сушать і упарюють досуха. Сирий продукт очищають флеш-хроматографією (з використанням градієнта складу дихлорметан:метиловий спирт), що дає 97 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 1,91 (м, 2Н), 2,49-2,51 (м, 4Н), 2,73 (м, 2Н), 3,08-3,92 (м, 5Н), 4,23 (м, 2Н), 6,72 (дд, 1Н), 6,81 (м, 4Н), 7,93 (дд, 1Н), 8,33 (дд, 1Н). ПРИКЛАД 39: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1іл)нікотинамід Суміш 2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинонітрилу (1,36 г, 3,88 ммоль), NaOH (70 % розчин, 25 мл) в етиловому спирті (25 мл) нагрівають при 140 °С протягом 10 годин. Суміш виливають у воду і екстрагують етилацетатом (310 мл). Об'єднані органічні шари сушать і упарюють, що дає 0,64 г сполуки, вказаної в заголовку. 1 Н-ЯМР (DMSO-d6): δ 1,84 (м, 2Н), 2,63 (м, 5Н), 2,87 (м, 2Н), 3,51 (т, 2Н), 3,59 (т, 2Н), 3,92 (дд, 1Н), 4,23 (м, 2Н), 6,62 (дд, 1Н), 6,82 (м, 4Н), 7,29 (с, 1Н), 7,52 (д, 1Н), 7,54 (с, 1Н), 8,10 (д, 1Н). ПРИКЛАД 40: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3іл)метанол Стадія А: 2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинова кислота Водну фазу, отриману у вищезазначеному експерименті, підкисляють до рН 5 і екстрагують етилацетатом (310 мл). Об'єднані екстракти сушать і упарюють, що дає 0,27 г продукту, вказаного в заголовку. 1 Н-ЯМР (DMSO-d6): δ 1,91 (м, 2Н), 2,62 (м, 5Н), 2,80 (м, 2Н), 3,49 (т, 2Н), 3,55 (т, 2Н), 3,92 (дд, 1Н), 4,25 (м, 2Н), 6,73 (дд, 1Н), 6,84 (м, 4Н), 7,80 (д, 1Н), 8,10 (д, 1Н). Стадія В: (2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3іл)метанол До суспензії літій-алюмогідриду (0,10 г, 2,63 ммоль) в безводному тетрагідрофурані (3 мл) додають вищезазначене отримане похідне нікотинової кислоти (0,19 г, 0,51 ммоль) в безводному тетрагідрофурані (10 мл). Реакційну суміш нагрівають в мікрохвильовому реакторі при 80 °С протягом 10 хвилин. Реакційну суміш виливають в крижану воду і екстрагують етилацетатом (310 мл). Об'єднані органічні фази сушать і упарюють. Сирий продукт очищають флеш-хроматографією (з використанням градієнта складу дихлорметан:метиловий спирт), що дає 0,11 г сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 1,96 (м, 2Н), 2,78 (м, 2Н), 2,93 (м, 6Н), 3,45 (м, 5Н), 4,04 (м, 1Н), 4,33 (м, 1Н), 4,36 (м, 1Н), 4,68 (с, 1Н), 6,83 (м, 4Н), 7,55 (д, 1Н), 8,20 (д, 1Н). ПРИКЛАД 41: (S)-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1іл)піридин-3-іл)метанол Стадія А: (S)-Метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1іл)нікотинат (R)-(2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил-метансульфонат (311 мг, 1,27 ммоль), метил2-(1,4-діазепан-1-іл)нікотинат (300 мг, 1,27 ммоль), К2СО3 (194 мг, 1,40 ммоль) і KI (12 мг) нагрівають в диметилформаміді (9 мл) при 120 °С протягом 2 годин. Охолоджену суміш виливають у воду, після цього проводять екстрагування етилацетатом. Об'єднані екстракти промивають декілька разів водою, сушать і упарюють. Очищення сирого продукту флешхроматографією (склад елюента гептан/етилацетат, 1:1) дає 71 мг сполуки, вказаної в заголовку. 1 Н-ЯМР (СDСl3): δ 1,92-2,02 (м, 2Н), 2,60-2,82 (м, 4Н), 2,85-3,01 (м, 2Н), 3,48 (т, 2Н), 3,65 (т, 2Н), 3,86 (с, 3Н), 3,95 (дд, 1Н), 4,18-4,29 (м, 2Н), 6,61 (дд, 1Н), 6,78-6,88 (м, 4Н), 7,86 (дд, 1Н), 8,21 (дд, 1Н). Стадія В: (S)-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3іл)метанол 21 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 Складний ефір, отриманий на вищенаведеній стадії, (71 мг, 0,19 ммоль) відновлюють літійалюмогідридом (28 мг, 0,74 ммоль) в безводному тетрагідрофурані (5 мл, кип'ятіння із зворотним холодильником протягом 2 годин), що дає, після стандартної обробки за допомогою 2,5 М розчину NaOH, 67 мг спирту, вказаного в заголовку. 1 Н-ЯМР (СDСl3): δ 1,87-2,02 (м, 2Н), 2,75 (дд, 1Н), 2,82-3,01 (м, 5Н), 3,43 (дд, 2Н), 3,48 (м, 2Н), 4,01 (дд, 1Н), 4,23-4,31 (м, 1Н), 4,33 (дд, 1Н), 4,67 (с, 2Н), 6,80-6,90 (м, 5Н), 7,55 (дд, 1Н), 8,18 (дд, 1Н). Отримання міченого маркера для досліджень методом PET (позитронно-емісійна томографія) 11 ПРИКЛАД 42: (S)-1-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-([ C]метоксиметил)піридин-2-іл)піперазин (S)-(2-(4-((2,3-Дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол (1 11 мг) піддають метилюванню за допомогою [ C]метил-трифлату в ацетонітрилі (ACN, 0,2 мл), в присутності 1 М розчину гідроксиду тетрабутиламонію (0,003 мл), протягом 3 хвилин при 80 °С. Очищення за допомогою високоефективної рідинної хроматографії (HPLC) дає сполуку, вказану в заголовку, що підходить для приготування складу і для використання як міченого 11 ізотопом С маркеру для досліджень методом PET (позитронно-емісійна томографія). 11 11 [ C]метил-трифлат отримують, виходячи з [ C]йодометану, відповідно до методики, описаної в публікації: Appl. Radiat. Isot. 43 (1992) 1383. 11 11 [ C]йодометан отримують, виходячи зі зробленого на циклотроні [ C]метану, відповідно до методики, описаної в публікації: Appl. Radiat. Isot. 48 (1997) 153. Як вже згадано раніше в цьому документі, сполуки формули I показують цікаві фармакологічні властивості, а саме, вони проявляють поліпшену селективність відносно альфа2С-підтипу адренорецептора і/або посилену активність. Згадані властивості продемонстровані за допомогою фармакологічного випробування, представленого нижче. ЕКСПЕРИМЕНТ 1: ВИЗНАЧЕННЯ антагоністичної активності відносно альфа2А- і альфа2Садренорецепторів in vitro У цьому експерименті використовують клітини яєчника китайського хом'яка (CHO), стабільно трансфіковані альфа2А- або альфа2С-рецепторами (University of Turku, Фінляндія), і які були котрансфіковані вектором експресії pCEP-Gα16 (Molecular Devices, CA, USA). Клітини підтримують при 37 °С в атмосфері 5 % СО2/95 % повітря. Клітини вирощують в середовищі Хема F12, доповненому 10 % FCS (фетальна теляча сироватка), 25 мМ HEPES (N-2гідроксіетил-піперазин-N-2-етансульфокислота), 100 Міжн. Од./мл пеніциліну, 100 мкг/мл стрептоміцину, 500 мкг/мл генетицину і 240 мкг/мл гідроміцину В. Клітини субкультивують двічі на тиждень за допомогою 0,25 %-го розчину трипсину і 1 мМ розчину EDTA (етилендіамінтетраоцтова кислота). Коефіцієнт субкультивування становить 1:5-1:20. Середовище для вирощування міняють кожні 2 або 3 дні. Всі реагенти для культивування клітин постачаються компанією Gibco. За день до експерименту клітини висівають в 96-ямкові планшети з чорними стінками і з прозорим дном з щільністю 30000-45000 клітин/ямку. Середовище для вирощування видаляють, і клітини інкубують з випробуваними сполуками і з реагентом FLIPR Calcium 3 Assay (Molecular Devices, CA, USA) протягом 1 години при 37 °С в темряві. Випробувані сполуки (концентрації в клітинах 100 пМ-10 мкМ) розчиняють в розчині Рінгера з пробенецидом, що складається з 150 мМ NaCl, 3 мМ KCl, 1,2 мМ MgCl 2, 1 мМ CaCl2, 5 мМ глюкози, 20 мМ HEPES (N-2-гідроксіетил-піперазин-N-2-етансульфокислота) і 2,5 мМ пробенециду (рН 7,4, що коректується за допомогою 1,0 М розчину NaOH). Осмолярність коректують з доведенням до 322 міліосмолей з допомогою осмометра Osmostat OM-6020 (DIC Kyoto Daiichi Kagagu Co. Ltd, Japan). Зміни внутрішньоклітинного кальцію відстежують з використанням настільного скануючого флуориметра FLEXstation з вбудованим терміналом для перенесення рідини (Molecular Devices, CA, USA) і виводять дані на дисплей з використанням програмного забезпечення SOFTmax PRO (версія 3.2). Всі експерименти проводять при 37 °С. Випробувані сполуки, розчинені в розчині Рінгера з пробенецидом, наносять з допомогою установки FLEX в момент часу через 17 сек. Значення IC50 для даної випробуваної сполуки визначають по кривих залежності доза-відповідь, і воно знаходиться в діапазоні від 0,01 нМ до 10 мкМ. Для того щоб виявити антагонізм, клітини стимулюють або за допомогою 100 нМ адреналіну, або за допомогою 200 нМ норадреналіну, і випробувані сполуки додають до клітин щонайменше за 5 хвилин до початку експерименту. Звичайно роблять чотири повторних вимірювання при кожній концентрації і семи різних рівнях доз. Наприклад, якщо число планшетів, з яких отримують результати, становить три, то 84 (4*7*3) ямки, відповідно, вимірюють для побудови взаємозалежності доза-відповідь. Зразки збуджують при довжині хвилі 485 нм, і емісію детектують при довжині хвилі 525 нм за допомогою фільтра з обмеженою 22 UA 105647 C2 5 смугою пропущення на довжині хвилі 515 нм. Час зчитування становить 60 секунд на ямку, і значення чутливості фотоелектронного помножувача встановлюють на 15. В обчисленнях використовують значення мінімальної флуоресценції, яке віднімають від максимального значення для кожної ямки. Для аналізування результатів використовують програмне забезпечення SOFTmax PRO (версія 3.2). Підбір кривої по точках відповідно до отриманих даних по залежності доза антагоніста-відповідь здійснюють за допомогою необмеженого рівняння Хіла, а значення IC50 підбирають за допомогою рівняння Michaelis-Menten з використанням комп'ютерної програми Sigma Plot 8.0. Результати показані в таблиці 1. 10 Таблиця 1 Антагоністична активність відносно альфа2А- і альфа2С-рецепторів in vitro Сполука Сполука прикладу 17 Сполука прикладу 36 Сполука прикладу 31 Сполука прикладу 29 Сполука прикладу 23 Сполука прикладу 18 15 20 25 30 35 40 45 IC50/нМ Альфа2А-рецептори Альфа2С-рецептори 2175 8,2 3900 13,7 16929 17,6 12703 18,0 10741 30,6 41061 134,4 Ефекти сполук формули I in vivo можуть бути продемонстровані за допомогою фармакологічних випробувань, які описані в міжнародній публікації WO 03/082866. Сполуки формули I проявляють антагоністичну активність відносно альфа2С-рецепторів. Даний винахід, таким чином, забезпечує сполуки для застосування як лікарського засобу. Також забезпечують сполуки для застосування в лікуванні захворювань або станів, де, як вказано, антагоніст альфа2С-рецепторів є придатним. Крім того, забезпечують спосіб лікування захворювань або станів, де, як вказано, антагоніст альфа2С-рецепторів є придатним. У згаданому способі ефективну кількість щонайменше однієї сполуки формули I вводять ссавцю, наприклад, людині, який потребує такого лікування. Також забезпечують застосування сполук формули I у приготуванні лікарського засобу для лікування захворювань або станів, де, як вказано, антагоніст альфа2С-рецепторів є придатним. В одному варіанті здійснення винаходу вищезгадане захворювання або стан, де, як вказано, антагоніст альфа2С-рецепторів є придатним, являє собою психічний розлад, спровокований стресом, хворобу Паркінсона, депресію, шизофренію, синдром гіперактивності з дефіцитом уваги, посттравматичний стресовий розлад, обсесивно-компульсивний розлад особистості (синдром нав'язливих станів), синдром Туретта, блефароспазм або інші фокальні дистонії, скроневодольову епілепсію з психозом, зумовлений дією лікарського засобу психоз, хворобу Хантінгтона, розлад, викликаний флуктуацією рівнів статевих гормонів, панічний розлад, хворобу Альцгеймера або помірні когнітивні порушення; наприклад, психічний розлад, спровокований стресом, хворобу Паркінсона, депресію, шизофренію, синдром гіперактивності з дефіцитом уваги, обсесивно-компульсивний розлад особистості (синдром нав'язливих станів) або хворобу Альцгеймера; як наприклад, психічний розлад, спровокований стресом, депресію або шизофренію. Репрезентативні приклади зумовлених дією лікарського засобу психозів включають психоз, викликаний хронічним застосуванням допамінергічних засобів, але не обмежуються цим. Репрезентативні приклади розладів, викликаних флуктуацією рівнів статевих гормонів, включають передменструальний синдром і припливи крові, але не обмежуються цим. Сполуки за винаходом можуть бути введені, наприклад, ентерально, місцево або парентерально за допомогою будь-якого фармацевтичного складу, придатного для згаданого введення і що містить щонайменше одну активну сполуку формули I у фармацевтично прийнятних і ефективних кількостях разом з фармацевтично прийнятними розріджувачами, носіями і/або ексципієнтами, відомими в даній галузі. Виготовлення таких фармацевтичних складів відоме в даній галузі. Терапевтична доза, яка повинна бути дана суб'єкту, що потребує лікування, буде варіювати в залежності від сполуки, яка повинна бути введена, від біологічного виду, віку і статі суб'єкта, що підлягає лікуванню, конкретного стану, що підлягає лікуванню, а також від шляху і способу введення, і буде легко визначена фахівцем в даній галузі. Відповідно до цього, звичайне 23 UA 105647 C2 5 10 15 20 дозування для перорального введення складає від 10 нг/кг до 100 мг/кг в день, і для парентерального введення складає від 1 нг/кг до 10 мг/кг для дорослої особи ссавця. Сполуки за винаходом дають суб'єкту як такі або в комбінації з одним чи більше іншими активними інгредієнтами, де кожен інгредієнт взятий в своїй власній композиції або деякі або всі активні інгредієнти об'єднані в одній композиції, і/або з прийнятними фармацевтичними ексципієнтами. Прийнятні фармацевтичні ексципієнти включають традиційно використовувані ексципієнти і технологічні допоміжні добавки, такі як наповнювачі, зв'язувальні речовини, речовини для поліпшення розкладання таблеток, ковзні речовини, розчинники, гелеутворювальні добавки, емульгатори, стабілізатори, забарвлюючі речовини і/або консерванти. Сполуки за винаходом складені в лікарські форми з використанням загальновідомих фармацевтичних способів виготовлення. Лікарські форми можуть являти собою, наприклад, таблетки, капсули, гранули, супозиторії, емульсії, суспензії або розчини. В залежності від шляху введення і галенової форми, кількість активного інгредієнта в складі звичайно може варіювати від 0,01 % до 100 % по масі. Фахівцеві в даній галузі буде ясно, що варіанти здійснення, описані в цій заявці, можуть бути змінені без виходу за рамки ідеї винаходу. Фахівцеві в даній галузі також буде зрозуміло, що винахід не є обмеженим розкритими конкретними варіантами здійснення, і, як мають на увазі, також охоплює модифікації варіантів здійснення, які знаходяться в межах об'єму даного винаходу. ФОРМУЛА ВИНАХОДУ 1. Сполука формули І: O N (R4)m X 25 30 35 40 45 50 Z N A B R1 E D R2 R3 ,I де X являє собою О; Z являє собою -[СН2]n-; А, В, D і Е незалежно являють собою С або N, при умові, що щонайменше три елементи з А, В, D і Е являють собою С; R1 являє собою Н, галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1-С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(C1-C6)алкіл, (R5)2N-(C=O)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н або феніл; R4 являє собою галоген; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0 або 1; і n має значення 1 або 2; в міченій або неміченій формі, або її фармацевтично прийнятна сіль або фармацевтично прийнятний складний ефір, за умови, що a) R1, R2 і R3 не є одночасно Н; b) в тому випадку, коли А означає С, а дві групи з R 1, R2 і R3 являють собою Н, то третя група з R1, R2 і R3 не є галогеном; c) сполука не являє собою 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(6-метилпіридин-2іл)піперазин. 2. Сполука за п. 1, де А, В, D і Е являють собою С. 3. Сполука за п. 1, де А являє собою N; і В, D і Е являють собою С. 4. Сполука за будь-яким з пп. 1-3, де n має значення 1. 5. Сполука за будь-яким з пп. 1-3, де n має значення 2. 6. Сполука за п. 1, де X являє собою О; Z являє собою -[СН2]n-; 24 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 А являє собою С або N; В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1С6)алкіл, (R5)2N-(C=O)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1 або 2. 7. Сполука за п. 6, де X являє собою О; Z являє собою -[СН2]n-; A, В, D і Е являють собою С; R1 являє собою (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(C1C6)aлкiл, (R5)2N-(C=O)- або фурил; R2 являє собою Н або галоген; R3 являє собою Н; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1 або 2. 8. Сполука за п. 6, де X являє собою О; Z являє собою -[СН2]n-; А являє собою N; B, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(C1C6)алкіл, (R5)2N-(C=O)- або фурил; R2 являє собою Н або галоген; R3 являє собою Н; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1 або 2. 9. Сполука за п. 6, де X являє собою О; Z являє собою -[СН2]n-; А являє собою N; В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1С6)aлкiл, (R5)2N-(C=O)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1. 10. Сполука за п. 6, де X являє собою О; Z являє собою -[СН2]n-; А являє собою N; В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1С6)алкіл, (R5)2N-(C=O)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і 25 UA 105647 C2 5 10 15 20 25 30 35 40 45 50 55 60 n має значення 2. 11. Сполука за п. 6, де X являє собою О; Z являє собою -[СН2]n-; А, В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN, (R5)2N-(С1С6)алкіл, (R5)2N-(C=O)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 1. 12. Сполука за п. 6, де X являє собою О; Z являє собою -[СН2]n-; А, В, D і Е являють собою С; R1 являє собою галоген, (С1-С6)алкіл, гідроксі(С1-С6)алкіл, (С1-С6)алкоксі(С1-С6)алкіл, галоген(С1С6)алкоксигрупу, галоген(С1-С6)алкоксі(С1-С6)алкіл, (С1-С6)алкокси-(С=О)-, CN,(R5)2N-(С1С6)алкіл, (R5)2N-(C=O)- або фурил; R2 являє собою Н, галоген, (С1-С6)алкіл або гідроксі(С1-С6)алкіл; R3 являє собою Н або феніл; R5 являє собою, незалежно в кожному випадку, Н або (С1-С6)алкіл; m має значення 0; і n має значення 2. 13. Сполука за п. 1, де сполука вибрана з групи: метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол, 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(метоксиметил)феніл)піперазин, 2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензонітрил, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанамін, 1-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)-N-метилметанамін, 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(етоксиметил)феніл)піперазин, 2-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)пропан-2-ол, 1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2-іл)піперазин, (S)-(2(4-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол, (S)-(2-(4-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3іл)метанолНСl, (S)-1-((7-фтор-2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2іл)піперазинНСl, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-((2-фторетокси)метил)піридин-2іл)піперазин, 1-(2,3-дихлорфеніл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол, (S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)піридин-3-іл)метанол, (S)-1((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(метоксиметил)феніл)піперазин, (R)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(метоксиметил)феніл)піперазин, (S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(3-(метоксиметил)піридин-2-іл)піперазин, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-6-фторфеніл)метанол, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-3-фторфеніл)метанол, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-5-фторфеніл)метанол, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-пропілфеніл)піперазин, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(трифторметокси)феніл)піперазин, (S)-1(біфеніл-3-іл)-4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-(2-(фуран-2-іл)феніл)піперазин, (S)-етил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)бензоат, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-о-толілпіперазин, (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-4-м-толілпіперазин, (S)-(3-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)-4-метилфеніл)метанол, 26 UA 105647 C2 5 10 15 20 25 30 35 40 (S)-(3-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)метанол, (S)-2-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)піперазин-1-іл)феніл)етанол, метил-2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)бензоат, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)феніл)метанол, 2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинонітрил, 2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)нікотинамід, (2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3-іл)метанол aбо (S)-(2-(4-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)-1,4-діазепан-1-іл)піридин-3-іл)метанол. 14. Мічена ізотопом вуглецю сполука формули І за п. 1. 15. Сполука за п. 14, де сполука являє собою (S)-1-((2,3-дигідробензо[b][1,4]діоксин-2-іл)метил)11 4-(3-([ С]-метоксиметил)піридин-2-іл)піперазин. 16. Сполука за будь-яким з пп. 1-13 для застосування як лікарського засобу. 17. Сполука за будь-яким з пп. 1-13 для застосування в лікуванні захворювання або стану, де антагоніст альфа2С-адренорецептора є придатним. 18. Сполука за п. 17, де захворювання або стан являє собою психічний розлад, спровокований стресом, хворобу Паркінсона, депресію, шизофренію, синдром гіперактивності з дефіцитом уваги, посттравматичний стресовий розлад, обсесивно-компульсивний розлад особистості (синдром нав'язливих станів), синдром Туретта, блефароспазм або інші фокальні дистонії, скроневочасткову епілепсію з психозом, зумовлений дією лікарського засобу психоз, хворобу Хантінгтона, розлад, викликаний флуктуацією рівнів статевих гормонів, панічний розлад, хворобу Альцгеймера або помірні когнітивні порушення. 19. Спосіб лікування захворювання або стану, в якому, як вказано, антагоніст альфа2Садренорецепторів є придатним, де спосіб включає введення ссавцеві, який потребує такого лікування, ефективної кількості щонайменше однієї сполуки за п. 1. 20. Спосіб за п. 19, де захворювання або стан являє собою психічний розлад, спровокований стресом, хворобу Паркінсона, депресію, шизофренію, синдром гіперактивності з дефіцитом уваги, посттравматичний стресовий розлад, обсесивно-компульсивний розлад особистості (синдром нав'язливих станів), синдром Туретта, блефароспазм або інші фокальні дистонії, скроневочасткову епілепсію з психозом, зумовлений дією лікарського засобу психоз, хворобу Хантінгтона, розлад, викликаний флуктуацією рівнів статевих гормонів, панічний розлад, хворобу Альцгеймера або помірні когнітивні порушення. 21. Фармацевтична композиція, що містить щонайменше одну сполуку відповідно до будь-якого з пп. 1-13 і фармацевтично прийнятний носій, розріджувач і/або ексципієнт. 22. Фармацевтична композиція за п. 21, де композиція містить додатково щонайменше один інший активний інгредієнт. 23. Застосування міченої сполуки за будь-яким з пп. 1-13 як селективної відносно альфа2Срецептора сполуки-ізотопного РЕТ-маркера в дослідженнях тварин і людей методом позитронно-емісійної томографії (PET). 11 24. Застосування міченої ізотопом С сполуки за будь-яким з пп. 1-13 для застосування як селективної відносно альфа2С-рецептора сполуки-ізотопного РЕТ-маркера в дослідженнях тварин і людей методом позитронно-емісійної томографії (PET). 25. Застосування за п. 24, де сполука являє собою (S)-1-((2,3-дигідробензо[b][1,4]діоксин-211 іл)метил)-4-(3-([ С]-метоксиметил)піридин-2-іл)піперазин. Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 27
ДивитисяДодаткова інформація
Назва патенту англійськоюAryl ріреrаzіnе аnd тнеіr usе аs аlрна2с аnтаgоnіsтs
Автори англійськоюDin Belle David, Holm, Patrik, Tolvanen, Arto, Wohlfahrt, Gerd
Автори російськоюТолванен Арто, Вольфарт Герд
МПК / Мітки
МПК: C07D 311/74, C07D 319/20, C07D 327/00, C07D 411/00, A61K 31/4433, C07D 405/12, A61K 31/353, A61P 25/00
Мітки: застосування, альфа2c, антагоністів, арилпіперазини
Код посилання
<a href="https://ua.patents.su/29-105647-arilpiperazini-i-kh-zastosuvannya-yak-antagonistiv-alfa2c.html" target="_blank" rel="follow" title="База патентів України">Арилпіперазини і їх застосування як антагоністів альфа2c</a>
Попередній патент: Декоративний елемент для водопровідної арматури і спосіб його виготовлення
Наступний патент: Екструдати з голчатими активними речовинами
Випадковий патент: Сплав на основі олова












