Гібридні білки, фармацевтична композиція, що містить гібридний білок, ізольована молекула днк, що містить гібридний білок, вектор експресії, клітина-хазяїн, спосіб продукування гібридного білка, спосіб індукува
Номер патенту: 52646
Опубліковано: 15.01.2003
Автори: Кампбелл Роберт К., Джеймсон Брендфорд А., Чаппел Скотт С.
Формула / Реферат
1. Гібридний білок, який містить дві різні коекспресовані амінокислотні послідовності, що утворюють гетеродимер, кожна з яких містить:
(a) щонайменше одну амінокислотну послідовність, вибрану з групи, що складається з ланцюга гомомерного рецептора, ланцюга гетеромерного рецептора, ліганду, відмінного від гонадотропіну, фрагмента згаданого ланцюга згаданого гомогенного рецептора, згаданого ланцюга згаданого гетеромерного рецептора або згаданого ліганду, причому згаданий ліганд або його фрагмент зберігає здатність до зв’язування ліганду з рецептором, і згаданий ланцюг згаданого гомомерного рецептора або його фрагмент і згаданий ланцюг згаданого гетеромерного рецептора або його фрагмент зберігають здатність до зв'язування ліганду з рецептором самі по собі або в комбінації з гомологічним чи гетерологічним ланцюгом згаданого рецептора; і
(b) субодиницю гетеродимерного білкового гормону або її фрагмент, який зберігає здатність субодиниці до утворення гетеродимеру з іншими його субодиницями;
в якому послідовності (а) і (b) з'єднані між собою безпосередньо або через пептидний лінкер і в якому послідовності (b) кожної зі згаданих двох коекспресованих послідовностей агреговані між собою так, що вони димеризовані і утворюють гетеродимер.
2. Гібридний білок за п. 1, який відрізняється тим, що згадана послідовність (а) вибрана з групи, що складається з протеїну-1, який зв'язує фактор некрозу пухлин (ТВР1), протеїну-2, який зв'язує фактор некрозу пухлин (ТВР2), або фрагмента згаданого ТВР1 чи ТВР2, який крім того містить область зв'язування ліганду; позаклітинної області рецептора IFN![]() або рецептора IFN
або рецептора IFN![]() ; рецептора гонадотропіну або його позаклітинних фрагментів; та інтерлейкіну-6 (IL-6), IFN-
; рецептора гонадотропіну або його позаклітинних фрагментів; та інтерлейкіну-6 (IL-6), IFN-![]() , тромбопоетину (ТРО) або їх фрагментів.
, тромбопоетину (ТРО) або їх фрагментів.
3. Гібридний білок за п. 1, який відрізняється тим, що згадана послідовність (b) вибрана з групи, що складається з субодиниць хоріонічного гонадотропіну людини (hCG), фолікулостимулюючого гормону (FSH), лютеїнізуючого гормону (LH), тиреоїдного гормону (TSH) або інгібітину та їх фрагментів.
4. Гібридний білок за п. 1, який відрізняється тим, що послідовність (а) приєднана безпосередньо або через лінкер до кінцевої аміногрупи послідовності (b).
5. Гібридний білок за п. 1, який відрізняється тим, що послідовність (а) приєднана безпосередньо або через лінкер до кінцевої карбоксильної групи послідовності (b).
6. Гібридний білок за п. 1, який відрізняється тим, що кожна з двох згаданих коекспресованих амінокислотних послідовностей включає послідовність для ТВР1 або її фрагмент, що містить залишки амінокислот 20 - 161 або 20 - 190 ТВР1 як послідовність (а) і відповідні![]() і
і ![]() субодиниці hCG або їх фрагменти як послідовність (b), причому дві згадані коекспресовані амінокислотні послідовності утворюють гетеродимерний комплекс шляхом асоціації згаданих
субодиниці hCG або їх фрагменти як послідовність (b), причому дві згадані коекспресовані амінокислотні послідовності утворюють гетеродимерний комплекс шляхом асоціації згаданих ![]() і
і ![]() субодиниць hCG або їх фрагментів.
субодиниць hCG або їх фрагментів.
7. Гібридний білок за п. 1, який відрізняється тим, що кожна з двох згаданих коекспресованих амінокислотних послідовностей включає позаклітинну область рецептора гонадотропіну як послідовність (а) та відповідні ![]() і
і ![]() субодиниці гонадотропіну як послідовність (b).
субодиниці гонадотропіну як послідовність (b).
8. Гібридний білок за п. 7, який відрізняється тим, що згадана послідовність (а) є позаклітинною областю рецептора FSH і послідовність (b) є субодиницею FSH.
9. Гібридний білок за п.7, який відрізняється тим, що згадані послідовності (a) і (b) з’єднані пептидним містком.
10. Гібридний білок за п.9, який відрізняється тим, що згаданий пептидний лінкер включає сайт ферментативного розщеплення.
11. Гібридний білок за п.10, який відрізняється тим, що згаданий сайт ферментативного розщеплення є сайтом розщеплення тромбіну.
12. Гібридний білок за п.10, який відрізняється тим, що згаданий сайт ферментативного розщеплення розпізнається й розщеплюється ферментом, який міститься в яєчнику.
13. Гібридний білок за п.9, який відрізняється тим, що згаданий пептидний лінкер діє як гнучке шарнірне зєднання.
14. Гібридний білок за п.1, який відрізняється тим, що кожна з двох згаданих коекспресованих амінокислотних послідовностей складається здебільшого з послідовностей (a) і (b).
15. Фармацевтична композиція, яка відрізняється тим, що містить гібридний білок за п.1 та фармацевтично прийнятний носій та/або наповнювач.
16. Ізольована молекула ДНК, яка кодує гібридний білок, причому згаданий гібридний білок містить дві різні коекспресовані амінокислотні послідовності, що утворюють гетеродимер, кожна з яких містить:
(a) щонайменше одну амінокислотну послідовність, вибрану з групи, що складається з ланцюга гомомерного рецептора, ланцюга гетеромерного рецептора, ліганду, відмінного від гонадотропіну, фрагмента згаданого ланцюга згаданого гомогенного рецептора, згаданого ланцюга згаданого гетеромерного рецептора або згаданого ліганду, причому згаданий ліганд або його фрагмент зберігає здатність до зв’язування ліганду з рецептором, і згаданий ланцюг згаданого гомомерного рецептора або його фрагмент і згаданий ланцюг згаданого гетеромерного рецептора або його фрагмент зберігають здатність до зв'язування ліганду з рецептором самі по собі або в комбінації з гомологічним чи гетерологічним ланцюгом згаданого рецептора; і
(b) субодиницю гетеродимерного білкового гормону або її фрагмент, який зберігає здатність субодиниці до утворення гетеродимеру з іншими його субодиницями;
в якому послідовності (а) і (b) з'єднані між собою безпосередньо або через пептидний лінкер і в якому послідовності (b) кожної зі згаданих двох коекспресованих послідовностей агреговані між собою так, що вони димеризовані і утворюють гетеродимер.
17. Вектор експресії, до складу якого входить молекула ДНК за п.16.
18. Клітина-хазяїн, що містить вектор експресії за п.17, яка здатна до експресії згаданого гібридного білка.
19. Спосіб продукування гібридного білка, який включає культивування клітини-хазяїна за п.18 і виділення експресованого нею гібридного білка.
20. Спосіб індукування визрівання фолікулів, який включає введення суб’єкту, який цього потребує, фармацевтичної композиції, до складу якої входить гібридний білок за п.8
Текст
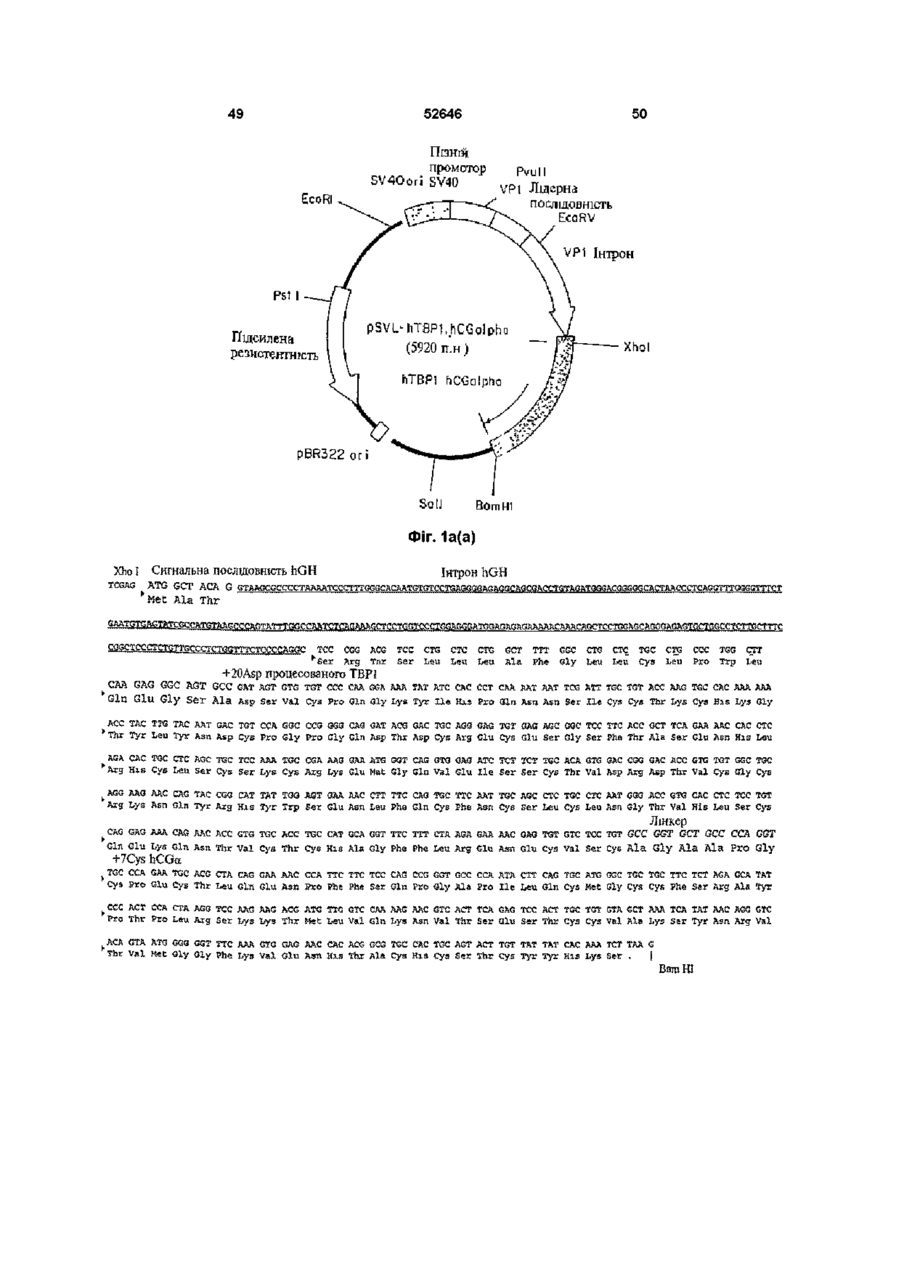
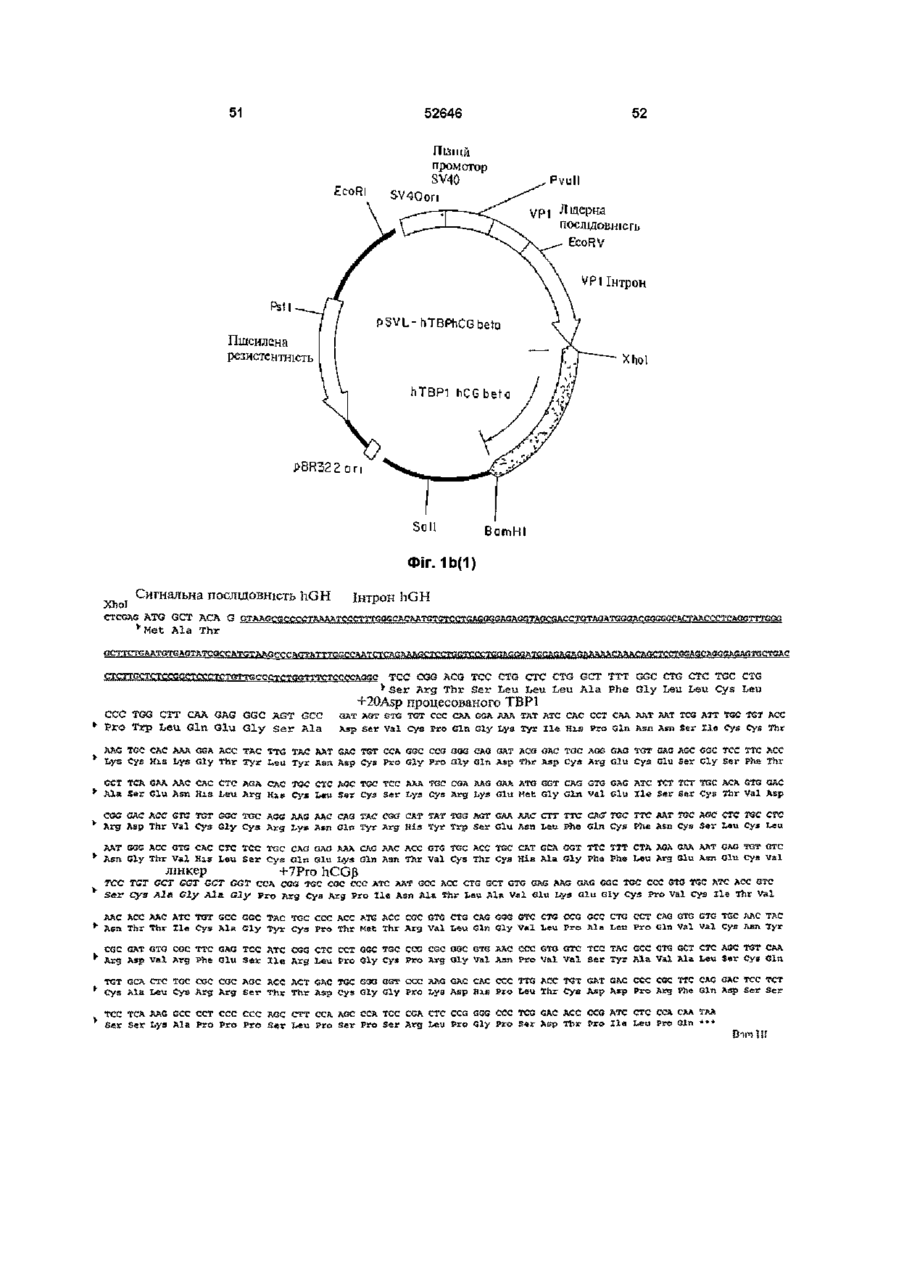
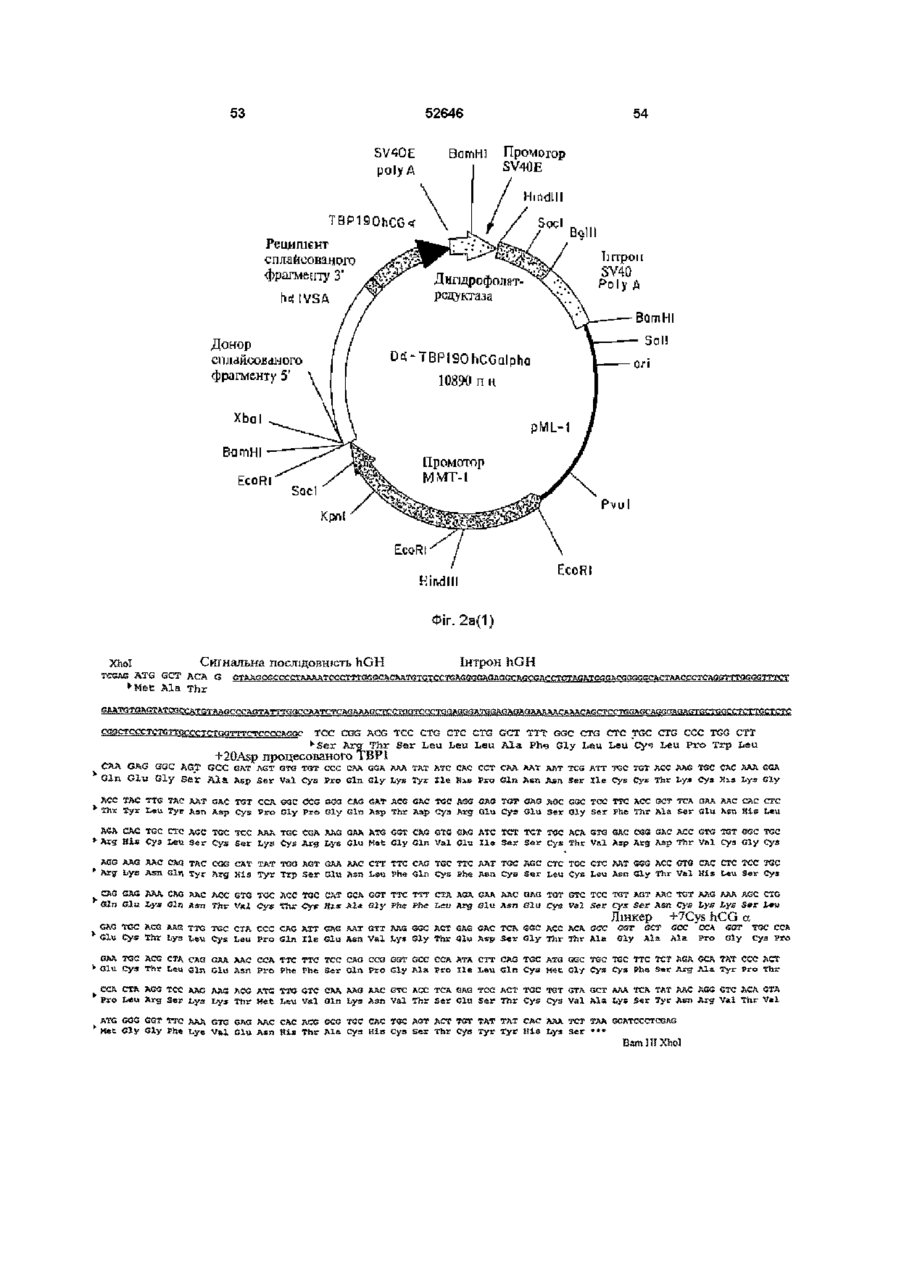
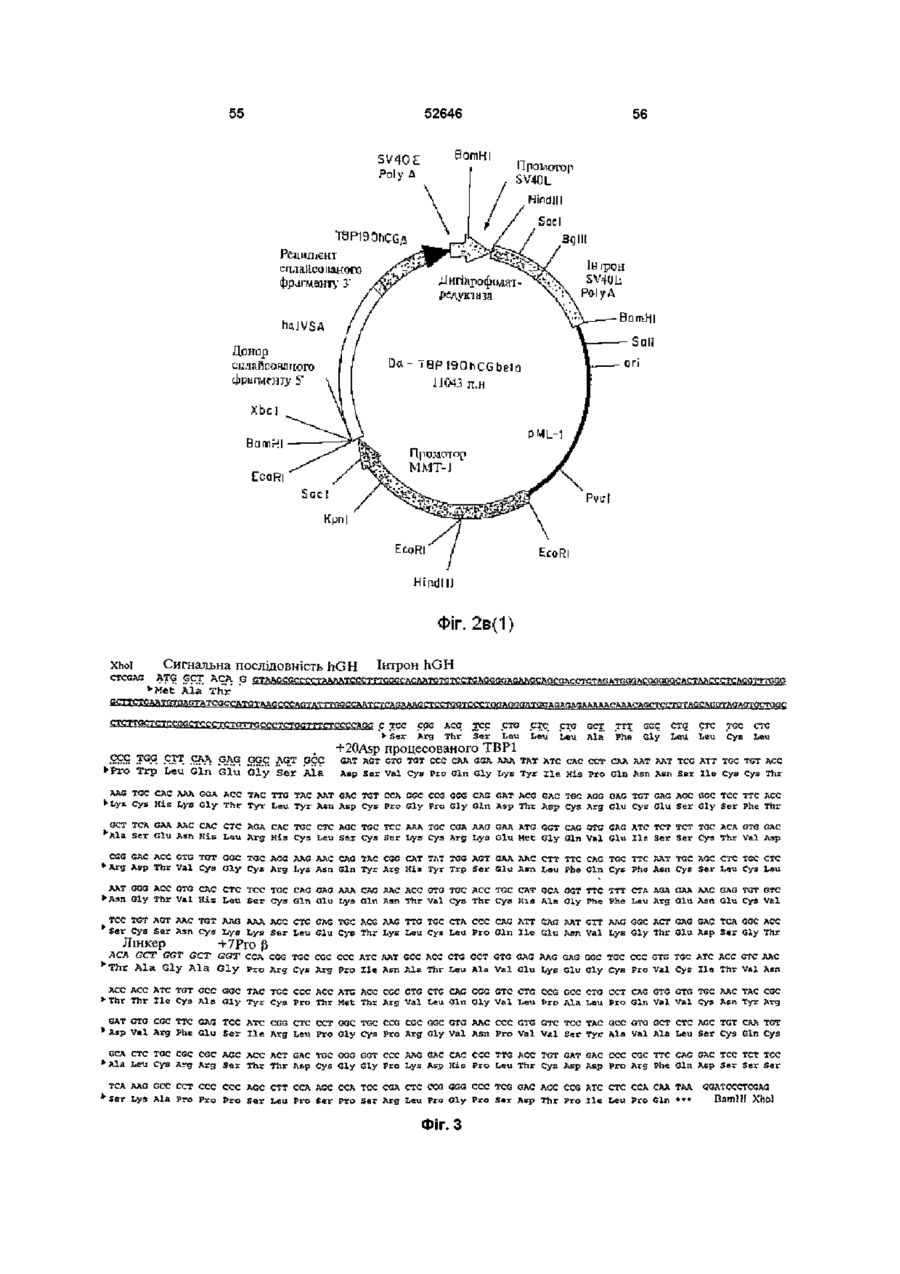
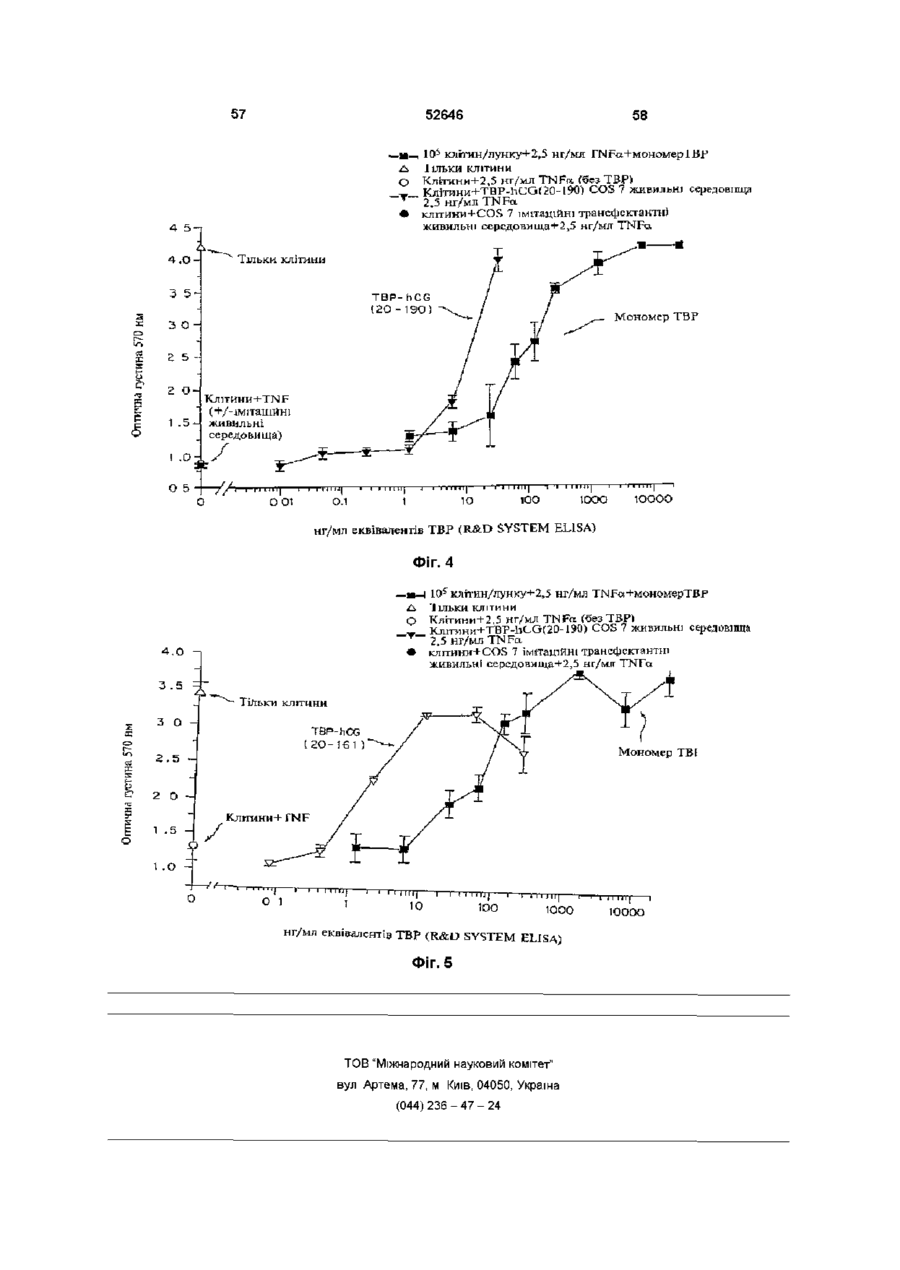
Рецептори також можуть виступати або функціонувати, як багатоланцюгові комплекси Наприклад, рецептори TNF трансдукують сигнал після агрегування з утворенням димерів (8, 9) Ліганди до цих рецепторів стимулюють агрегування двох або трьох рецепторних ланцюгів, завдяки чому забезпечується механізм активації рецептору Наприклад, TNF-опосеред коване 52646 наслідків штравенозного впорскування ліпополісахаридів (LPS) (16) Однак, незважаючи на широкорозповсюджене використання імуноглобулінових злитих білків, ця стратегія має декілька недоліків Один з них полягає утому, що певні Fc домени імуноглобуліну беруть участь у ефекторних функціях імунної системи Згадані функції можуть бути небажаними за певних терапевтичних обставин (22) Друге обмеження належить до особливих випадків, коли виникає необхідність у продукуванні гетеромірних злитих білків, наприклад, розчинних аналогів рецепторів гетеромірного IL-6 (інтерлейкшу-6) або інтерферону типу І Незважаючи на існування численних методів продукування біфункцюнальних антитіл (наприклад, шляхом котрансфекцм або злиття Розчинні зв'язувальні білки можуть бути гібридом), ефективність синтезу значно придатними для лікування хвороб людей Було погіршується сумішшю гомодимерів та показано, наприклад, що розчинні рецептори TNF гетеродимерів, які, як правило, при цьому ефективно діють у тваринних моделях артриту (18, утворюються (23) Нещодавно з'явилось декілька 19) повідомлень, у яких наведено опис використання Оскільки TNF має три зв'язувальні сайти для чинників зв'язування лейцину для направлення свого рецептору (10-12) і димеризація клітинного складання гетеродимерів (24-26) Це видається поверхневого рецептору є достатньою для перспективним підходом для дослідницьких цілей, бюактивності (8, 9), можливо, що зв'язування однак використані ненативні або штрацелюлярні одиночного розчинного рецептору з TNF залишить ПОСЛІДОВНОСТІ можуть виявитись непридатними відкритою можливість того, що цей комплекс (1 3) для постійного застосування у КЛІНІЧНИХ умовах розчинного рецептору TNF (тримеру) ще зможе внаслідок антигенності Обмеженнями можуть зв'язувати та активувати пару клітинних виявитись також ефективність складання та поверхневих рецепторів TNF Для досягнення СТІЙКІСТЬ після складання пригнічувального ефекту слід було б очікувати, що два зв'язувальні сайти рецептору на тримері TNF З іншого боку, у конкретному випадку повинні бути зайнятими або блокованими рецепторів TNF було встановлено, що певні розчинним зв'язувальним білком У модифікації рецептору р55 TNF полегшують альтернативному варіанті, зв'язувальний білок гомодимеризацію та передачу сигналу у разі може блокувати відповідну орієнтацію TNF на відсутності ліганду (27, 28) Було встановлено, що КЛІТИННІЙ поверхні цитоплазматична ділянка рецептору, яку називають "мовчазним доменом", може діяти як Взагалі, відчувалась необхідність гомодимеризаційний чинник (28, ЗО) Як синтезування білків, до складу яких входило б два альтернатива імуноглобуліновому гібридному рецепторних (або ліганд них) ланцюги, тобто білку, наслідком злиття екстрацелюлярного димерного гібридного білку Див Уеллеч (Wallach) домену рецептору TNF з його цитоплазматичним та ш , патент США № 5478925 мовчазним доменом може, можливо, бути Головну стратегію, яку було використано для секретування білку, який може димеризуватись у одержання димерних або мультимерних гібридних разі відсутності TNF Такі злиті білки було розкрито білків, до складу яких входили зв'язувальні домени та заявлено у міжнародний заявці WO 95/31544 з екстрацелюлярних рецепторів, становило злиття цих білків з константними ділянками важкого Третя додаткова стратегія, яку було ланцюгу антитіла використано для одержання димерів розчинних рецепторів TNF, полягала у хімічному зшиванні Згадана стратегія привела, наприклад, до мономерних білків з поліетиленгліколем (31) створення імуноадгезинів CD4 (20) Це гібридні молекули, до складу яких входять перші два (або Суть винаходу усі чотири) імуноглобуліноподібні домени CD4, Альтернативним способом одержання таких злиті з константною ділянкою важких та легких димерних білків, який надає деякі важливі ланцюгів антитіла Цю стратегію утворення переваги, є один з варіантів втілення цього гібридних молекул було адаптовано до рецепторів винаходу, суть якого полягає у використанні TNF (10, 16, 21), завдяки чому було одержано природного гетеродимерного остову, який генно-інженерні конструкції з вищою активністю in відповідає циркулюючому неімуноглобуліновому vitro, аніж умономерних розчинних зв'язувальних білку з довгим періодом напіврозпаду білків Переважним прикладом є hCG, тобто білок, який добре секретується, має висоїсу СТІЙКІСТЬ та Широко розповсюдженою є думка про те, що довгий період напіврозпаду (32-33) Приймаючи до більш висока активність димерних злитих білків m уваги головну роль hCG, як маркеру вагітності, vitro повинна перетворюватись на більш високу було розроблено багато реактивів для КІЛЬКІСНОГО активність in vivo Підтвердженням цього є одне з визначення та вивчення цього білку in vivo та in досліджень, результати якого демонструють, як vitro На додаток до цього, hCG екстенсивно мінімум, п'ятдесятикратне підвищення активності вивчали за допомогою мутагенезу, відомо, що злитого білку р75 (TBP2)-lg при захисті мишей ВІД агрегування активує рецептори TNF (10-12) Модулювання взаємодій за типом білок-білок може бути корисним механізмом для терапевтичного втручання у разі різноманітних захворювань та патологічних відхилень Розчинні зв'язувальні білки, які можуть взаємодіяти з лігандами, потенційно здатні до вилучення ліганду з рецептору, наслідком чого є зменшення активації цього конкретного рецепторного шляху У альтернативному варіанті, вилучення ліганду може затримати його елімінацію або деградацію, що тим самим спричинює подовження його ефекту та, можливо, його явної з активності in vivo У разі TNF, розчинні рецептори TNF пов'язувались, головним чином, з пригніченням активності TNF (13-17) 52646 8 невеликі делецм білку, наприклад, видалення п'яти використовувати для інактивації компонентів залишків на крайньому карбоксикінці а субодиниці, гібридного білку за цим винаходом Згадане можуть ефективно ліквідувати його біологічну обмеження активності може також здійснюватись активність з одночасним збереженням його шляхом використання засобів технології здатності до утворення гетеродимеру (34, 35) рекомбінантних ДНК для зміни кодувальної Було показано, що невеликі інсерцм, до ЗО ПОСЛІДОВНОСТІ гібридного білісу таким чином, який амінокислот, добре суміщаються на аміно- та безпосередньо обумовлює обмеження активності карбоксикінцях а субодиниці (36), у той час, як одного компоненту або робить білок більш злиття а субодиниці з карбоксикінцем 3 субодиниці І> придатним для наступної хімічної або також має незначний вплив на утворення ферментативної модифікації гетеродимеру (37) Наслідком утворення вищезгаданих гібридних Повідомлялось також про аналог hCG, у якого білків буде поява монофункцюнальних, Fc домен імуноглобуліну було злито з С-кінцями 3 І> біфункцюнальних або мультифункцюнальних субодиниці hCG, ця генно-інженерна конструкція, молекул, у залежності від амінокислотних однак, не секретувалась і не було здійснено спроб, послідовностей (а), які комбінуються з (Ь) У кожній спрямованих на и комбінування з а субодиницею парі (а) може зв'язуватись з амінокінцями або з (38) карбоксикінцями (Ь), або з обома Таким чином, головною ціллю цього винаходу До складу моноклонального гібридного білку є гібридний білок, до складу якого входять дві за цим винаходом може, наприклад, входити коекспресовані амінокислотні ПОСЛІДОВНОСТІ, ЯКІ екстрацелюлярний домен рецептору утворюють димер, причому до складу кожної з них гонадотропіну, пов'язаний з однією з ВІДПОВІДНИХ входить рецептор-зв'язувальних субодиниць як мінімум, одна амінокислотна ПОСЛІДОВНІСТЬ, гонадотропіну ВІДПОВІДНО ДО ЦЬОГО варіанту яку вибирають з-посеред гомомерного рецептору, втілення цього винаходу, гібридний білок за цим ланцюгу гетеромерного рецептору, ліганду та їх винаходом може бути молекулою, у якої, фрагментів, та наприклад, екстрацелюлярний домен рецептору FSH є пов'язаним з FSH для підвищення періоду субодиниця гетеродимерного білкового напіврозпаду у плазмі та поліпшення біологічної гормону або його фрагменти, де (а) та (Ь) зв'язані активності безпосередньо або через пептидний лінкер та у кожній парі дві субодиниці (Ь) є різними і здатними Цей препарат може бути застосованим для до агрегування з утворенням димерного індукування визрівання фолікул у методах комплексу штучного репродукування, наприклад, індукуванні овуляції або заплідненні in vitro, а також ВІДПОВІДНО ДО ЦЬОГО винаходу, лінкер може використовуватись, як засіб суттєвого підсилення бути ферментативне пдролізованим біологічної активності згаданого гормону, що є ПОСЛІДОВНІСТЬ (а), у переважному варіанті, обов'язковим для успішного здійснення згаданого вибирають з-посеред екстрацелюлярного домену процесу, завдяки чому зменшується потреба як у Рецептору 1 TNF (55 кілодальтон, який також самому гормоні, так і у КІЛЬКОСТІ впорскувань, називають ТВР1), екстрацелюлярного домену необхідній для досягнення овуляції Рецептору 2 TNF (75 кілодальтон, який також називають ТВР2), або їх фрагментів, до складу Рецептор фолікулостимулювального гормону яких ще входить ліганд-зв'язувальний домен, (FSH) та одержання екстрацелюлярного домену екстрацелюлярних доменів рецепторів IL-6 (які рецептору фолікулостимулювального гормону також називають др80 та др130), (FSH) людини було описано, ВІДПОВІДНО, у WO екстрацелюлярного домену рецептору а/ІІ92/16620 та WO 96/38575 штерферону (IFN) або рецептору у-інтерферону, ВІДПОВІДНО ДО конкретного варіанту втілення, рецептору гонадотропшу або його екстрацелюлярний домен рецептору екстрацелюлярних фрагментів, легких ланцюгів фолікулостимулювального гормону людини (ECD) антитіл або їх фрагментів, які факультативно може лігуватись зі збереженням рамки зчитування пов'язані з ВІДПОВІДНИМИ важкими ланцюгами, пептидним лінкером, до складу якого входить сайт важких ланцюгів антитіл або їх фрагментів, які розпізнавання/розщеплення тромбіну (29) та який факультативно пов'язані з ВІДПОВІДНИМИ легкими представляє "зв'язане" плече Пептидний лінкер ланцюгами, Fab-доменів антитіла, або лігандних зв'язує екстрацелюлярний домен FSH з білків, наприклад, ЦИТОКІНІВ, факторів росту або субодиницею FSH Це забезпечує можливість гормонів, за виключенням гонадотропшів, до видалення екстрацелюлярного домену рецептору специфічних прикладів яких належать IL-6, IFN-&, FSH шляхом розщеплення на сайті розщеплення ТРО (тканинний активатор плазміногену) або їх тромбіну у разі, коли згадана молекула фрагменти зустрічається з тромбіном у великому крузі кровообігу ПОСЛІДОВНІСТЬ (Ь), у переважному варіанті, вибирають з-посеред hCG, FSH У іншому варіанті втілення цього винаходу, (фолікулостимулювальний гормон), LH замість сайту розщеплення тромбіну (лютеїнізувальний гормон), TSH (тиреотропний використовують сайт розпізнавання того гормон), субодиниць інгибшу або їх фрагментів ферменту, найбільша КІЛЬКІСТЬ якого знаходиться у яєчнику Таким чином, по мірі переміщення Модифікації білків, наприклад, хімічну молекули ECD-FSH до яєчнику, вона піддається деградацію або протеазне розщеплення остову впливу ферментів, які знаходяться у найбільших білку, або ХІМІЧНІ або ферментативні модифікації концентраціях у цій тканині і ECD буде видалено, певних бокових ланцюгів амінокислот, можна 52646 10 завдяки чому FSH може взаємодіяти з вектор експресії або два вектори експресії рецептором, зв'язаним з мембраною вводяться до придатної клітини-хазяїна, яка після цього експресує вектор(-и) для одержання У ще іншому варіанті втілення цього винаходу, гібридного білку за цим винаходом, як визначено замість сайту розпізнавання ферменту між ECD та перед тим FSH тонується гнучка шарнірна ділянка, завдяки чому ECD ферментативне зі згаданого гормону не Переважним способом одержання гібриду за видаляється Таким чином, коли молекула ECDцим винаходом є використання полімеразноFSH надходить до яєчнику, між ECD, який ланцюгової реакції з застосуванням знаходиться на шарнірній ДІЛЯНЦІ, та ECD олігонуклеотидів, специфічних для необхідних рецептору FSH, який знаходиться на КЛІТИННІЙ послідовностей, призначених для копіювання з мембрані яєчнику, виникає конкуренція клонів, які кодують ПОСЛІДОВНОСТІ (а) та (Ь) У додатковому переважному варіанті втілення Експресія будь-якого з рекомбінантних білків цього винаходу, до складу гібридного протеїну за цим винаходом, як згадувалось у цьому описі, входить агрегат пари послідовностей аа, до може здійснюватись у еукарютичних клітинах складу однієї з яких входить ТВР1 (або фрагменти (наприклад, клітинах дріжджів, комах або ссавців) від аа 20 до аа 161 або до аа 190), як (а), та а або прокарютичних клітинах з використанням субодиниця hCG, як (Ь), у той час, як до складу ВІДПОВІДНИХ векторів експресії Може іншої завжди входить ТВР1 (або ті ж самі застосовуватись будь-який метод, відомий у цій фрагменти, що були вказані перед тим), як (а), та галузі техніки (І субодиниця hCG або и фрагменти, як (Ь) Наприклад, молекули ДНК, які кодують білки, ВІДПОВІДНО ДО ЦЬОГО варіанту втілення, у одержані будь-яким з вищезгаданих способів, залежності від конкретної ПОСЛІДОВНОСТІ, яка вставляють до ВІДПОВІДНО сконструйованих обирається, як (Ь) (І3> субодиниця hCG у цілому або векторів експресії за допомогою способів, добре и фрагменти, або модифікації), одержаний відомих у цій галузі техніки (див Сембрук гібридний білок буде мати одну активність (тільки (Sambrook) та ш, 1989) Дволанцюгова кДНК активність ТВР1) або комбінацію активностей зв'язується з плазмідним вектором шляхом (активності ТВР з активністю hCG) У останньому гомополімерного нарощування або шляхом згаданому випадку гібридний білок може бути рестрикційного зв'язування з залученням використано, наприклад, у комбінованому використання синтетичних лінкерів ДНК або лікуванні саркоми Капоші та послаблення способів літування по "тупим" кінцям для метаболізму при СНІДі літування молекул ДНК використовують ДНКлігази, а небажаному поєднанню запобігають У додатковому варіанті втілення цього шляхом обробки лужною фосфатазою винаходу, між двома субодиницями (Ь) додається один або більше ковалентних зв'язків для Для забезпечення здатності до експресування підсилення стабільності 10 одержаного гібридного необхідного білку, до складу вектору експресії білку Це може бути здійснено, наприклад, повинні входити також специфічні нуклеотидні доданням одного або більшої КІЛЬКОСТІ ненативних ПОСЛІДОВНОСТІ, які включають транскрипційну та міжланцюгових дисульфідних зв'язків Сайти для трансляційну регуляторну інформацію, зв'язану з цих перехресних зшивок можуть бути визначеними ДНК, яка кодує необхідний протеїн таким чином, з відомих структур гетеродимерних гормонів що забезпечуйся експресія гену та продукування Наприклад, придатним сайтом у hCG може буги білку По-перше, для транскрибування гену йому розміщення цистешових залишків на залишку повинен передувати промотор, який розпізнається Lys45 субодиниці а та залишку Glu21 субодиниці 3 І> РНК-полімеразою, з яким згадана полімераза шляхом заміни сольового містку (не ко валентного зв'язується і, таким чином, розпочинає процес зв'язку) дисульфід ним зв'язком (ковалентним транскрипції Існує цілий ряд подібних придатних зв'язком) Іншою ціллю цього винаходу є для використання промоторів, які працюють з поліетиленгліколізовані або ІНШІ ХІМІЧНО різною ефективністю (сильні та слабкі промотори) модифіковані форми гібридних білків У разі еукарютичних хазяїв, у залежності від природи згаданого хазяїна, можуть Додатковою ціллю цього винаходу є молекула використовуватись різні транскрипційні та ДНК, до складу якої входить ПОСЛІДОВНІСТЬ ДНК, трансляційні регуляторні ПОСЛІДОВНОСТІ ВОНИ яка кодує вищезгаданий гібридний білок, а також можуть бути одержані з вірусних джерел, нуклеотидні ПОСЛІДОВНОСТІ, які, по суті, здійснюють наприклад, з аденовірусів, папіломатозного вірусу те ж саме До "нуклеотидних послідовностей, які, великої рогатої худоби, вакуолізувального вірусу по суті, здійснюють те ж саме", належать усі ІНШІ мавп і т ш , де регуляторні сигнали пов'язані з ПОСЛІДОВНОСТІ нуклеїнової кислоти, які внаслідок конкретним геном, який має високий рівень виродження генетичного коду також кодують дану експресії До прикладів належить ТК амінокислотну ПОСЛІДОВНІСТЬ (тимідинкіназний) промотор вірусу герпесу, ранній Для продукування гібридного білку за цим промотор SV40, промотор гену да14 дріжджів і т ш винаходом, ПОСЛІДОВНІСТЬ (а) ДНК, як і (Ь), Можуть вибиратись регуляторні сигнали одержують з існуючих клонів ПОСЛІДОВНІСТЬ ДНК, започаткування транскрипції, які забезпечують яка кодує необхідну ПОСЛІДОВНІСТЬ (а), зв'язана з можливість репресії та активації, завдяки чому ПОСЛІДОВНІСТЮ ДНК, яка кодує необхідну може модулюватись експресія генів ПОСЛІДОВНІСТЬ (Ь) Ці два злиті продукти вставляються до та зв'язуються з ВІДПОВІДНОЮ Молекула ДНК, до складу якої входить плазмідою або кожен з них вставляється до та нуклеотидна ПОСЛІДОВНІСТЬ, яка кодує гібридний зв'язується з різними плазмідами Після утворення білок за цим винаходом, вставляється до вектору( 12 11 52646 їв), який має функціонально зв'язані за допомогою будь-якого з методів, відомих щодо транскрипційні та трансляційні регуляторні досягнення цієї мети, тобто, за будь-якою сигнали і який є здатним до інтегрування традиційною процедурою, яка включає необхідної ПОСЛІДОВНОСТІ генів до клітини-хазяїна екстрагування, осадження, хроматографування, Клітини, ЯКІ піддаються постійному електрофорез і т ш Додатковою процедурою трансформуванню шляхом введення ДНК, також очистки, якій може надаватись перевага для можуть відбиратись шляхом введення одного або очищення білку за цим винаходом, є афінна більшої КІЛЬКОСТІ маркерів, які забезпечують вибір хроматографія з використанням моноклональних клітин-хазяїв, які вміщують вектор експресії антитіл, які зв'язують цільовий білок і які Згаданий маркер може також забезпечувати утворюються та іммобілізуються на гелевій ауксотрофного хазяїна фототропними матриці, яка знаходиться у колонці Неочищені здатностями, СТІЙКІСТЮ ДО бюцидів, наприклад, препарати, до складу яких входить антибіотиків або важких металів, наприклад, МІДІ І рекомбінантний білок, пропускають через колонку т ш Ген селективного маркеру може або Білок буде зв'язано у колонці специфічним безпосередньо зв'язуватись з послідовностями антитілом, у той час, як домішки пройдуть через генів ДНК, які призначені до експреси, або колонку Після промивки білок елююють з гелю за вводитись до тієї ж самої клітини шляхом допомогою зміни рН або концентрації ІОНІВ котрансфекцм Для забезпечення оптимального Термін "гібридний білок", який використано у синтезу білків за цим винаходом може також цьому описі, у родовому значенні відноситься до виникнути потреба у додаткових елементах білку, який складається з двох або більше різних білків або їх фрагментів До важливих факторів під час вибору конкретної плазміди або вектору на основі вірусу Термін "злитий білок", який використано у належать легкість, з якою клітини-реципієнти, які цьому описі, означає гібридний білок, який вміщують згаданий вектор, можуть розпізнаватись складається з двох або більше білків або їх та відокремлюватись від клітин-реципієнтів, які фрагментів, ковалентне зв'язаних між собою згаданого вектору не вміщують, КІЛЬКІСТЬ КОПІЙ Термін "агрегація", який використано у цьому згаданого вектору, яка є необхідною у конкретного описі, означає утворення специфічних хазяїна, чи є необхідність у "човниковому" нековалентних взаємодій між двома переміщенні згаданого вектору між клітинамиполіпептидними ланцюгами, які утворюють хазяями різних видів комплекс, наприклад, таких, які існують між а та (і субодиницями гетеродимерного гормону Після ТОГО, ЯК вектор(-и) або ПОСЛІДОВНІСТЬ (наприклад, FSH, LH, hCG або TSH) ДНК, до складу яких входить згадана генноінженерна конструкція(-іі), є готовими до експреси, Термін "ліганд" або "лігандний білок", який генно-інженерна конструкція(-іі) ДНК може бути використано у цьому описі, означає молекулу, за введена до відповідної клітини-хазяїна за виключенням антитіла або імуноглобуліну, допомогою будь-якого з цілого ряду придатних придатну до зв'язування ліганд-зв'язувальним засобів трансформації, трансфекцп, кон'югації, доменом рецептору, така молекула може існувати злиття протопластів, електропорацм, осадження за у природному стані або може бути ХІМІЧНО допомогою фосфату кальцію, безпосереднього модифікованою або ХІМІЧНО синтезованою мікровпорскування і т ш Термін "ліганд-зв'язувальний домен", який використано у цьому описі, означає ділянку Клітини-хазяї можуть бути прокарютичними рецептору, яку залучено до зв'язування ліганду і або еукарютичними Перевага надається яка, взагалі, є ділянкою або, по суті, представляє еукарютичним хазяям, наприклад, клітинам собою екстрацелюлярний домен у цілому ссавців, наприклад, людини, мавпи, миші та клітинам яєчнику китайського хом'ячка (СНО), Термін "рецептор", який використано у цьому оскільки вони забезпечують посттрансляційні описі, означає мембранний білок, зв'язування модифікації білкових молекул, у тому числі, якого з ВІДПОВІДНИМ лігандом запускає вторинні ВІДПОВІДНИЙ спосіб впорядкування білкового КЛІТИННІ реакції, наслідком яких є активація або ланцюгу або глікозилювання на ВІДПОВІДНИХ пригнічення штрацелюлярного процесу сайтах Клітини дріжджів також можуть Цей винахід, своїм додатковим аспектом, забезпечувати посттрансляційні модифікації надає використання гібридного білку, як пептидів, у тому числі глікозилювання Існує ряд медикаменту Згаданий медикамент, у стратегій рекомбінантних ДНК, у яких переважному варіанті, надається у формі використовують ПОСЛІДОВНОСТІ сильних промоторів фармацевтичної композиції, до складу якої та велику КІЛЬКІСТЬ копій плазмід, які можуть бути входить білок за цим винаходом разом з одним використані для продукування необхідних білків у або більшою КІЛЬКІСТЮ фармацевтичне прийнятних дріжджах Дріжджі розпізнають лідерні носив та/або наповнювачів Такі фармацевтичні ПОСЛІДОВНОСТІ на продуктах клонованих генів композиції представляють собою додатковий ссавців та секретують пептиди, які несуть лідерні аспект цього винаходу ПОСЛІДОВНОСТІ (тобто, попередники пептидів) Короткий опис малюнків Після введення вектору(-ів), клітини-хазяї Цей винахід буде більш зрозумілим у разі вирощують на селективному середовищі, яке посилання на малюнки, які додаються, на яких відбирає для росту тільки ті клітини, які вміщують Ф і г 1 (а) та 1 (Ь) - генно-інженерні конструкції вектор Наслідком експресії послідовності(-ей) TBP(20-161)-hCGa га TBP(20-161)-hCGG, клонованих генів є утворення необхідних білків ВІДПОВІДНО, та ВІДПОВІДНІ ПОСЛІДОВНОСТІ (ПОСЛІДОВНОСТІ №№ 1-4) ПОСЛІДОВНІСТЬ лінкера, Очищення рекомбінантних білків здійснюється 13 зображена (ПОСЛІДОВНІСТЬ зображена 52646 на фіг 1 (а), є Ala-Gly-Ala-Ala-Pro-Gly № на (ПОСЛІДОВНІСТЬ № 9) ПОСЛІДОВНІСТЬ фіг 1(Ь), є лінкера, Ala-Gly-Ala-Gly 10) Фіг2(а) та 2(Ь) — генно-інженерні конструкції ТВР(20-190)-hCGa та ТВР(20-190)-hCGB, ВІДПОВІДНО, та (ПОСЛІДОВНОСТІ №№ ВІДПОВІДНІ ПОСЛІДОВНОСТІ 5-8) Фіг 3 - графік, який ілюструє дозозалежний захисний ефект TBP-hCG (20-190), який експресовано клітинами СНО проти цитотоксичності, індукованої TNFa, відносно клітин ВТ-20та різних контролів Фіг 4 — графік, який ілюструє дозозалежний захисний ефект TBP-hCG (20-190), який експресовано клітинами COS, проти цитотоксичності, індукованої TNFa, відносно клітин ВТ-20та різних контролів Фіг 5 — графік, який ілюструє дозозалежний захисний ефект очищеного засобами афінної хроматографії TBP-hCG (20-161), який експресовано клітинами СНО, проти цитотоксичності, індукованої TNFa, відносно клітин ВТ-20та різних контролів Докладний опис переважних варіантів втілення винаходу Цей винахід буде описано за допомогою наступних Прикладів, які не повинні розглядатися як такі, що будь-яким чином обмежують цей винахід Приклади Матеріали та методи КЛІТИННІ ЛІНІЇ, використані у цьому дослідженні, було одержано з Американської колекції типових культур (АТСС), Роквілл, Меріленд, якщо не вказано інше Клітинну ЛІНІЮ CHO-DUKX було одержано від Л Чазіна (L Chasm) з Колумбійського університету через Д Хаузмана (D Houseman) з Масачусетського технологічного інституту (39) Клітини CHO-DUKX, які позбавлені функціонального гену для дипдрофолатредуктази, повсякденно підтримували у повному а-плюс модифікованому середовищі Ігла (а(+)МЕМ), доповненому 10% сироватки зародку великої рогатої худоби (FBS) Клітини COS-7 повсякденно підтримували у модифікованому за способом Дульбекко середовищі Ігла (DMEM), доповненому 10% FBS У разі відсутності інших вказівок, клітини розводили для підтримки їх у лог-фазі росту, культуральні реактиви було одержано від компанії GIBCO (Гренд Айленд, Нью-Йорк) 1 Складання генно-інженерних конструкцій, які кодують гібридні білки Основу нумераційних розподілів рецептору р55 TNF складає робота Уеллеча (40) по т о н у в а н н ю , у той час, як основу нумераційних розподілів субодиниць hCG складають нумераційні розподіли з робіт Фідса (Fiddes) (41, 42) по т о н у в а н н ю Скорочення ТВР, або зв'язувальний білок TNF, означає ділянки екстрацелюлярних доменів рецепторів TNF, здатних до зв'язування TNF У цих прикладах генно-інженерні конструкції ДНК будуть називатися ТВР-пбридними білками з партнером та ділянкою ТВР, зазначеною у номенклатурі генно-інженерної конструкції До с т а д у усіх генно-інженерних 14 конструкцій TBP-hCG замість нативної сигнальної ПОСЛІДОВНОСТІ р55 входить сигнальний пептид гормону росту людини (hGH) На додаток до цього, сигнальний пептид hGH розміщено таким чином, що він безпосередньо передує залишку Asp20 ТВР, завдяки чому, як гадають, цей перший залишок перетворюється у зрілий білок, який секретується Ці модифікації не є суттєвими для основної концепції використання hCG, як партнеру гібридного білку ДНК, які кодують гібридні білки, було сконструйовано з застосуванням методології полімеразно-ланцюгової реакції (43) a TBP1(20-161)-hCG Вихідну генно-інженерну конструкцію TBP-hCG було сконструйовано таким чином, що до її с т а д у входив ліганд-зв'язувальний домен з екстрацелюлярної ділянки рецептору р55 TNF (від Asp20 до залишку Cys161, включно), злитий через короткий лінкер з а та (і субодиницями hCG (з започаткуванням на залишках aCys7 або ВРго7, ВІДПОВІДНО) Ц Я генно-інженерна конструкція, яка у подальшому буде іменуватись TBP1(20-161)-hCG, є гетеродимером двох модифікованих субодиниць hCG TBP1(20-161)-hCGaTaTBP1(20-161)-hCGG Для генно-інженерної конструкції ТВР1(20161)-hCGa було використано олігодеоксинуклеотидні праймери, які наведено далі Праймер 1 (аВ) ТТТ ТСТ CGA GAT GGC TAG AGG ТАА GCG ССС (ПОСЛІДОВНІСТЬ № 11) Праймер 2 (а) АСС TGG GGC AGC ACC GGC АСА GGA GAC АСА СТС GTT ТТС (ПОСЛІДОВНІСТЬ №12) Праймер 3 (а) TGT GCC GGT GCT GCC ССА GGT TGC CCA GAA TGC ACG СТА CAG (ПОСЛІДОВНІСТЬ № 13) Праймер 4 (а) ТТТ TGG АТС СТТ AAG TGT GAT ААТ AAC AAG ТАС АТТ (ПОСЛІДОВНІСТЬ № 14) Ці та усі ІНШІ праймери, які описано у цих Прикладах, було синтезовано на апараті для синтезування ДНК Applied Biosystems Model 392 (компанія АВІ, Фостер-Сіті, Каліфорнія), з застосуванням хімії фосфорамідиту Оскільки обидві генно-інженерні конструкції субодиниці TBP-hCG мають однаковий 5'-кшець (тобто, 5'-кшець генно-інженерної конструкції liGH/TBP), праймер 1 (аіі) було використано для обох генно-інженерних конструкцій субодиниці TBP-hCG Для генно-інженерної конструкції TBPI(20-161)-hCGB було використано ІНШІ праймери, які наведено далі Праймер 2 (IS) CCG TGG ACC AGC ACC AGC АСА GGA GAC АСА СТС GTT ТТС (ПОСЛІДОВНІСТЬ №15) Праймер З (IS) TGT GCT GGT GCT GGT ССА CGG TGC CGC ССС АТС ААТ (ПОСЛІДОВНІСТЬ № 16) Праймер 4 (В) ТТТ TGG АТС СТТ ATT GGA GGA TCG GGG TG (ПОСЛІДОВНІСТЬ № GTG 17) Праймери 2 (а) та 3 (а) є зворотними комплементами і охоплюють як З'-кінець кодувальної ділянки екстрацелюлярного домену р55, так і 5'-кшець а субодиниці hCG Подібним же чином, праймери 2 (В) та З (В) також є зворотними комплементами і охоплюють як З'-кінець 15 кодувальної ділянки екстрацелюлярного домену р55, так і 5'-кшець te субодиниці hCG Кожну з двох генно-інженерних конструкцій субодиниці TBP-hCG було піддано двом полімеразно-ланцюговим реакціям У першій з них було використано праймери 1 (ate) та 2 (а або te), плазміду, яка кодує розчинні залишки 20-180 р55 було використано, як матрицю, якій передував сигнальний пептид (плазміда pCMVhGHspcDNA pA4) У другій з них було використано праймери 3 (а або te) та 4 (а або te), як матрицю було використано плазміду pSVL-hCGa або pSVL-hCGte (44) Для проведення полімеразно-ланцюгової реакції було використано полімеразу Vent (TM) від компанії New England Biolabs (Беверлі, Масачусетс) ВІДПОВІДНО ДО рекомендацій виробника Реакцію здійснювали впродовж 25 циклів за наступних умов ЮОмкг матричної ДНК, 1 мкг кожного праймеру, 2Од полімерази Vent (TM) (компанія New England Biolabs), денатурація при 99°С впродовж ЗО секунд, ренатурація при 59°С впродовж ЗО секунд для праймерів 1 (ate) та 2 (а), 59°С впродовж ЗО секунд для праймерів 3 (а) та 4 (а), 57°С впродовж ЗО секунд для праймерів І (ate) та 2 (te), 63°С впродовж ЗО секунд для праймерів З (te) та 4 (te), подовження при 75°С впродовж 75 секунд Продукти полімеразно-ланцюгової реакції мали потрібний розмір, що було перевірено засобами електрофорезу у 2% агарозному гелі з забарвленням етидію бромідом Після цього фрагменти очищали на колонці Wizard (компанія Promega) ВІДПОВІДНО ДО рекомендацій виробника колонки Кінцеву кодувальну ПОСЛІДОВНІСТЬ ДЛЯ TBP1(20-161)-hCGa складали за допомогою полімеразно-ланцюгової реакції злиття з використанням праймеру 1 (ate) та праймеру 4 (а) та, як матриці, очищених продуктів з фрагментів р55 та hCGa, одержаних у перших полімеразноланцюгових реакціях Спочатку дві матриці, які, внаслідок перекриття праймерів 2 (а) та 3 (а) можна було піддавати денатурації та ренатурацм разом, пропустили через 10 циклів полімеразноланцюгової реакції за відсутності будь-яких доданих праймерів Умови проведення цих циклів були, по суті, ті ж самі, що і у попередніх, за виключенням того, що ренатурацію здійснювали при 67°С, а подовження проходило впродовж 2 хвилин У КІНЦІ згаданих 10 циклів було додано праймери 1 (ate) та 4 (а), після чого здійснено ще 10 циклів Умови проведення кінцевої групи реакцій були такими ж самими, що і раніш, за виключенням того, що температура проведення ренатурацм дорівнювала 59°С, а подовження здійснювали впродовж 75 секунд Результати аналізу продуктів цієї реакції за допомогою електрофорезу у 1 % агарозному гелі підтвердили одержання необхідного фрагменту, який дорівнював, приблизно, 1100 п н Продукти 52646 16 реакції пропускали через колонку Wizard з метою очищення фрагменту, який після цього розщеплювали за допомогою Xbal та ВатНІ і піддавали поновному очищенню у 0,7% агарозному гелі з низькою температурою розтоплення Очищений фрагмент було субклоновано до плазміди pSVL (компанія Pharmacia), яку перед тим було піддано розщепленню за допомогою Xbal та ВатНІ та очищенню у 0,8% агарозному гелі з низькою температурою розтоплення Після літування за допомогою лігази Т4 згадану суміш було використано для трансформування AG1 Е соїі з наступним висіванням на планшети з лактобюзою/ампіциліном для культивування впродовж ночі при 37°С ДНК плазмід з ампіцилінрезистентних колоній аналізували шляхом розщеплення за допомогою Xbal та ВатНІ для підтвердження присутності інсерційного сегменту (який вирізається у цьому переварі) Було виявлено шість клонів, які вміщували інсерційні сегменти Один з них (клон 7) було відібрано для подальшої розробки, його було позначено pSVLTBPhCGa (як такий, що вміщував ТВР1(20161)-hCGa) Результати дідеоксисеквенування ДНК (за допомогою Sequenase™, компанія U S Biochemicals, Клівленд, Огайо) інсерційного сегменту цього вектору підтвердили коректність цієї генно-інженерної конструкції та відсутність небажаних перебудов Кінцеву кодувальнуПОСЛІДОВНІСТЬ ДЛЯ TBP1(20-161)-hCGte складали у спосіб, подібний до наведеного для TBP1(20-161)-hCGa за допомогою полімеразно-ланцюгової реакції злиття та праймерів 1 (ate) та 4 (te) і, як матриці, очищених продуктів з фрагментів р55 та hCGte, одержаних у перших полімеразно-ланцюгових реакціях Одержану плазміду pSVL, яка вміщувала необхідний інсерційний сегмент, було позначено, як pSVLTBPhCGte b TBP(20-190)-hCG Другу групу білків TBP-hCG було одержано шляхом модифікування генно-інженерних конструкцій TBP(20-161)-hCG для одержання аналогу, до складу якого входив сегмент ТВР, який простягався від Asp 20 до Thr 190, замість ділянки 20-161 вихідного аналогу Це було здійснено заміною фрагменту між сайтами Bg1ll та Xbal у плазміді pSVLTBPhCGa на фрагмент, одержаний за допомогою полімеразно-ланцюгової реакції, до складу якого входила згадала перебудова Згаданий фрагмент було одержано за допомогою полімеразно-ланцюгової реакції злиття Було використано наступні праймери Праймер 1 ТТТ TAG АТС ТСТ ТСТ TGC GTG GAC (ПОСЛІДОВНІСТЬ № АСА 18) Праймер 2 TGT GGT GCC TGA GTC СТС AGT (ПОСЛІДОВНІСТЬ № 19) Праймер З ACT GAG GAC TCA АСА GCC GGT GCT GCC CCA (ПОСЛІДОВНІСТЬ № GGC ACC GGT TG 20) Праймер 4 ТТТ ITC TAG AGA AGC AGC AGC AGC CCA TG (ПОСЛІДОВНІСТЬ № 21) Праймери 1 та 2 було використано для одержання ПОСЛІДОВНОСТІ, яка кодує додаткові залишки р55 від 161-190 Полімеразно-ланцюгову 18 17 52646 реакцію здійснювали, по суті, як описано перед допомогою Xhol та його тонування до Xholтим з використанням 1мкг кожного праймеру та розщепленого Da pUC-p55, як матриці Подібним же чином, 2 Тимчасова та стабільна експресія гібридних праимери 3 та 4 було використано для одержання, білків за допомогою полімеразно-ланцюгової реакції, Трансфекцію клітин COS-7 (Американська лінкеру між З'-кінцем ТВР-кодувальної ділянки та колекція типових культур CRL 1651, № 46) для 5'-кшцем а кодувальної ділянки субодиниці hCG з тимчасової експресії гібридних білків TBP-hCG використанням, як матриці, плазміди було здійснено за допомогою електропорацм (47) pSVLTBPhCGa За даними аналізу засобами Клітини COS-7 на етапі експоненціального росту електрофорезу у поліакриламідному гелі (PAGE) видаляли шляхом трипсинізацм, збирали за (8% гель), продукти згаданих полімеразнодопомогою не дуже активного центрифугування ланцюгових реакцій мали ВІДПОВІДНИЙ розмір (800 об/хв, 4 хвилини), промивали холодним (приблизно, 296 п н та 121 п н , ВІДПОВІДНО) ПІСЛЯ фізрозчином, забуференим фосфатом (PBS), рН цього вони буї и піддані очищенню за допомогою 7,3-7,4, після чого осаджували центрифугуванням 6 колонки Wizard Склад праймерів 2 та 3 був таким, Клітини ресуспендували у концентрації 5 х 10 що до нього входила ділянка перекриття, завдяки клітин на 400мкл холодного PBS і змішували з чому два продукти полімеразно-ланцюгової реакції Юмкг плазмідної ДНК у попередньо охолодженій (з праймерів 1 та 2 та з праймерів 3 та 4) можна кюветі для електропорацм з 2мм проміжком Для було піддавати ренатурацм для полімеразнокотрансфекцій було використано по 5мкг кожної ланцюгової реакції злиття з праймерами 1 та 4 плазміди Кювету та клітини додатково Після реакції злиття було одержано необхідний охолоджували на льоду впродовж 10 хвилин, після продукт (приблизно, 400 п н), який очищали за чого піддавали електропорацм за допомогою допомогою 1,5% агарозного гелю та колонки апарату ВТХ Модель 600 (125 В, 950 мФ, R=8) Wisard Після ЦЬОГО згадану ДНК розщеплювали за Далі клітини охолоджували на льоду впродовж 10 допомогою Bg1ll га Xbal і лігували з Bg1 Il/Xbalхвилин, переносили до 15мл конічної колби, у якій розщепленою pSVLTBPhCGa Присутність знаходилось 9,5мл повного живильного інсерційного сегменту у плазмідах, виділених з середовища (модифіковане за способом трансформованої AG1 Е соїі було підтверджено Дульбекко середовище Ігла (DMEM), доповнене розщепленням за допомогою Вд1ІІ та ХЬаІ Нову 10% сироватки зародку великої рогатої худоби генно-інженерну конструкцію було позначено, як (FBS) та 1% L-глутамшу) і витримували при pSVLTBP(20-190)-hCGa кімнатній температурі впродовж 5 хвилин Після обережного перемішування у 15мл колбі, вміст у Подібним же чином, плазміду pSVLTBPhCGIi повному об'ємі висівали на два планшети Р100 і було модифіковано шляхом заміни фрагменту поміщали до термостату (37°С, 5% СОг) Через 18 Bglll-XcmL Однак, це було здійснено шляхом годин згадане середовище було замінено, і, у субклонування продукту простої полімеразнодеяких випадках, до складу нових середовищ ланцюгової реакції, а не продукту полімеразновходили лише 1% або 0% FBS Через 72 години ланцюгової реакції злиття Було використано кондиційовані середовища збирали, праимери 1 та 2Ь (див далі), та pUC-p55, як матрицю центрифугували для видалення клітин, після чого Праймер 2b TTT ТСС АСА GCC AGG GTG зберігали замороженими при -70°С GCA TTG ATG GGG CGG CAC CGT GGA ССА Трансфекцм клітин CHO-DUKX (СНО) для GCA CCA GCT GTG GTG ССТ GAG ТСС ТСА GTG тимчасової або стабільної експресії здійснювали (ПОСЛІДОВНІСТЬ № 22) за допомогою осадження ДНК фосфатом кальцію За двадцять чотири години до трансфекцм, клітини Одержаний продукт полімеразно-ланцюгової СНО на етапі експоненціального росту висівали на реакції (приблизно, 337 п к ) було перевірено, як культуральні чашки діаметром 100мм з густиною описано перед тим, розщеплено за допомогою 7,5 х 105 клітин на чашку У день трансфекцм Юмкг Bg1ll та Хеті, після чого ліговано з Вд1 ІІ/ХЬаІплазмідної ДНК переносили до 0,5мл розщепленою pSVLTBPhCGIi Присутність трансфекційного буферу (див далі), додавали інсерційного сегменту у плазмідах, виділених з 31мкл 2М СаСЬ, розчин ДНК-СаСЬ інтенсивно трансформованої AG1 Е соїі було підтверджено перемішували і відстоювали при кімнатній розщепленням за допомогою Вд1ІІ та Xcml Нову температурі впродовж 45 хвилин Після цього генно-інженерну конструкцію було позначено, як згадані середовища з чашок відсмоктували, до pSVLTBP(20-190)-hCGG клітин за допомогою стерильної пластикової У подальшому нові генно-інженерні конструкції піпетки додавали ДНК і залишали клітини при було перевірено шляхом секвенування ДНК кімнатній температурі на 20 хвилин По На додаток до продукування цих нових завершенню цього часового періоду, до чашок плазмід на основі pSVL, ці генно-інженерні додавали 5мл повного а(+)МЕМ, до складу якого конструкції було також субклоновано до інших входило 10% FBS, з їх наступним інкубуванням векторів експреси, які, можливо, були більш при 37°С впродовж 4-6 годин Після цього придатними для стабільної експресії у СНО, середовища з чашок видаляли відсмоктуванням, зокрема, до вектору Da, який раніше було клітини піддавали гліцериновому шоку шляхом їх описано, як плазміду CLH3AXSV2DHFR (45) Це інкубування з розчином 15% гліцерину у було здійснено шляхом перетворення сайту трансфекційному буфері при 37°С впродовж 3,5 BamHI, який фланкував інсерційні сегменти у хвилини Після видалення гліцеринового розчину векторах на основі pSVL, на сайт Xhol, з клітини ДВІЧІ промивали PBS, додавали Юмл наступним видаленням інсерційного сегменту за 20 19 52646 повного а(+)МЕМ, 10% FBS і знову вміщували до ДВІЧІ промивали промивальним розчином термостату (37°С) Для здійснення постійних Додавали (ЮОмкл/лунку) первинне трансфекцій, клітини через 48 годин розводили 1 ідентифікувальне антитіло, розведене 1 5000 у 10 і додавали вибіркове середовище (повне арозріджувачі та шкубували впродовж 1 години при мінус MEM (без нуклеозидів), 10% діалізованої 37°С Додавали (ЮОмкл/лунку) вторинне FBS та 0,02мкМ метотрексату) Нетрансфектовані ідентифікувальне антитіло (кролячий антикозячий (нерезистентні) клітини, як правило, видаляли Ід, кон'югований пероксидазою з хрону), розведене через 3-4 тижні з одержанням популяції 1 5000 у розріджувачі, і після інкубування трансфектованих метотрексат-резистентних клівпродовж 1 години при 37°С планшет тричі тин промивали промивальним розчином Додавали 100 мкл субстратного розчину ТМВ (компанія 3 Кількісне визначення експресії Kirkegaard and Perry Laboratories), планшет Секретування гібридних білків шкубували впродовж 20 хвилин у темряві при трансфектованими клітинами визначали за кімнатній температурі, після чого ферментативну допомогою комерційного тест-набору для реакцію зупиняли шляхом додання 50мкл/лунку розчинного р55 (компанія R&D Systems, 0,3 М H2SO4 Після ЦЬОГО планшет аналізували за Мінеаполіс, Мінесота) ВІДПОВІДНО ДО інструкцій допомогою апарату для читання виробника Цей тест, крім того, допомагав мікротитрувальних планшетів, який було визначити рівні гібридних білків у кондиційованому виставлено на довжину хвилі 450нм та обробленому середовищах, які було використано, як основу для вибору доз, 5 Часткова очистка призначених для застосування при постановці Для поліпшення КІЛЬКІСНОГО визначення бюпроб активності згаданих гібридних білків, гібридні білки TBP-hCG піддавали частковому очищенню 4 Визначення утворення гетеродимеру засобами імуноафшної хроматографії Було Для визначення здатності гібридних застосовано моноклональне антитіло, комерційне субодиниць TBP-hCG до об'єднання та утворення доступне від компанії R&D Systems (МАВ № 225) гетеродимерів, було здійснено імуноферментний Колонку було заповнено CNBr-активованою сендвіч-аналіз з застосуванням антитіл до сефарозою, до якої вносили антитіла у субодиниць hCG У цьому аналізі моноклональне ВІДПОВІДНОСТІ з інструкціями виробника (компанія антитіло до 3 субодиниці hCG наносять на І> Pharmacia) мікротитраційні планшети і використовують для захвату досліджуваної речовини Первинним Збір кожної лінії клітин (п'ять зборів для кожної ідентифікувальним антитілом є козяче лінії), якому піддавали кондицюновані політональне антитіло, одержане проти а конфлюентні культури у матрацах Т-175, щоденно субодиниці TSH людини (№ 082422G - компанія складав 50мл середовища SFMII (компанія Biodesign International, Кенненбункпорт, Мен), яке, GIBCO) Збори піддавали центрифугуванню у свою чергу, ідентифікували за допомогою (ЮООоб/хв) для видалення клітинного дебрісу кролячого антикозячого політонального антитіла, Після ЦЬОГО матеріал піддавали аналізу на вміст кон'югованого пероксидазсю з хрону (компанія ТВР за допомогою комерційного набору для Сарреї, Дархем, Північна Кароліна) імуноаналізу та концентрували (апарати Centncon компанії Amicon, Беверлі, Масачусетс) таким У цій роботі було використано декілька різних чином, що явна концентрація ТВР становила, анти-hCG 3 субодиничних антитіл, усі вони І> приблизно, 50нг/мл продемонстрували відсутність перехресної реактивності з вільною а субодиницею Одне з цих Десять мл концентрованого TBP-hCG (зразок антитіл (3/6) використовується у комерційне № 18873) вносили, приблизно, до 1М NaCI шляхом доступному тест-наборі MAIAclone hCG (компанія додання NaCI, і провідність згаданого розчину Biodata, Рим, Італія) доводили, приблизно, до рівня 85мікросіменсів/см Згаданий розчин пропускати через 0,5мл анти-ТВР Мікротитраційні планшети з високим рівнем імуноафшну колонку Елюент збирали і знов зв'язування білків (компанія Costar № 3590) пропускати через колонку Після цього колонку сенсибілізували іммобілізованим антитілом промивали 1М NaCI у PBS Зв'язаний ТВР(20-161)шляхом інкубування (2 години при 37°С) з hCG збирали після елюювання 50тМ лимонною ЮОмкл/лунку 5мкг/мл розчину антитіла у буфері кислотою (рН 2,5) Елюат (приблизно, 7мл) для сенсибілізування поверхні (PBS, рН 7,4, 0,1 концентрували фільтруванням за допомогою шМ Са++, 0,1 mM Mg++) Після одноразової апарату Amicon Centncon- 10's у ВІДПОВІДНОСТІ ДО промивки промивальним розчином (PBS, рН 7,4 + інструкцій виробника (компакія Amicon) до об'єму, 0,1% Твін 20) планшет блокували шляхом приблизно, 200мкл Приблизно, 800мкл PBS заповнення лунок доверху (400мкл/лунку) додавали дня доведення об'єму зразку до 1мл, блокувальним розчином (3% сироваткового який зберігали при 4°С до проведення бюпроби альбуміну великої рогатої худоби (BSA, фракція VА-4503 Sigma) у PBS, рН 7,4) та шкубували 6 Визначення анти-TNF активності впродовж однієї години при 37°С або впродовж Для оцінки аналогів розчинних рецепторів TNF ночі при 4°С Після ЦЬОГО планшет ДВІЧІ промивали було розроблено численні проби на TNFпромивальним розчином і додавали еталонні та шдуковану цитотоксичність in vitro Нами було експериментальні зразки, розведені у розріджувачі використано пробу з застосуванням клітинної лінії (5 мг/мл BSA у PBS, рН 7,4) до одержання ЮОмкл карциноми грудної залози людини - клітини ВТ-20 об'єму Після інкубування зразків та планшету (Американська колекція типових культур НТВ 19) впродовж двох годин при 37°С, планшет знову Використання цях клітин, як основи бюпроби на 22 21 52646 TNF, було описано раніше (48) Ці клітини цього у ці лунки висівають клітини з густиною 1 х 5 культивують при 37°С у середовищі RPMI 1640, 10 клітин/лунку КІЛЬКІСТЬ доданого TNFa було доповненому 10% шактивовакої нагріванням FBS визначено перед тим під час проведення Клітини вирощували до максимального 80-90% титраційних досліджень, і вона представляє собою злиття, для чого клітини через 3-4 дні розводили дозу, яка вбиває, приблизно, 50% клітин до посівної густини, яка складала, приблизно, 3 * Після додання зразків клітини культивують 6 2 10 клітин на матрац Т175см впродовж 48 годин при 39°С, після чого за допомогою забарвлювання кристалвюлетом та У пробі на клітинах ВТ-20 включення апарату для читання мікротитрувальних планшетів клітинного барвника, кристал вюлету, (570нм), визначають долю життєздатних клітин використовують, як ідентифікаційний метод визначення виживаності клітин після обробки TNF Результати Мертві клітини нездатні до поглинання та 1 Експериментальні генно-інженерні утримування барвника конструкції Стисло, протокол, який використовують для Схеми проведення досліджень гібридних білків проведення проби на анти-TNF активність, у скороченому узагальненому вигляді наведено виглядає наступним чином Рекомбінантний TNFa далі, з порівняльною метою було досліджено дза людини (компанія R&D Systems) та контрольні білки мономерний розчинний р55 (гекспериментальні зразки вирощують у пТВР-1) та димерний білок, одержаний злиттям живильному середовищі (RPMI 1640 з 5% ТВР-імуноглобуліну (TBP-lgG3) (одержаний, по шактивованої нагріванням FBS) і додають до суті, як описано у (10)) лунок 96-лункових культуральних планшетів Після Генно-інженерна конструкція r-hTBP-1 TBP-lgG3 TBP(20-161)-hCG TBP(20-190)-hCG N-кшецьТВР С-кшецьТВР Партнер для злиття Суміш 9 та 20 Суміш 9 та 20 20 20 180 190 161 190 Відсутній Константна ділянка важкого ланцюгу lgG3 hCGaTa пССр(гетеродимер) hCGaTa пССр(гетеродимер) ПОСЛІДОВНОСТІ ДНК, ЯКІ кодують ТВР(20-190)hCG та TBP(20-161)-hCG наведено на фіг 1 та 2, ВІДПОВІДНО 2 Секретування білків TBP-hCG Було встановлено, що усі досліджені генноінженерні конструкції продукувались та секретувались до культуральних середовищ трансфектованими клітинами ссавців Ілюстративні дані наведено у Таблицях 1 та 2 3 Складання злитих білків TBP-hCG (а/ІІ) до гетеродимерів Комбінацію TBP-hCGa та TBP-hCGR, було перевірено за допомогою імуноферментного сендвіч-аналізу для гетеродимеру hCG Гетеродимер було виявлено лише у разі комбінованої трансфекцм злитих субодиниць а та 3 (Таблиця 3) І> 4 Гібридні білки TBP-hCG демонструють підвищену активність v порівнянні з мономером ТВР Було встановлено, що гібридні білки, одержані у клітинах COS-7 або СНО, були активними інгибіторами TNFoc у бюпробі на ВТ-20 Узагальнені результати випробування деяких зразків наведено у Таблиці 4 До зразків на середовищах їх було включено негативні контролі 31 (кондиційовані середовища з імітаційних трансфекцій) Як показано на фіг 3-5 (точки на осі у), наслідком додавання TNF (2,5нг/мл) було явне зниження КІЛЬКОСТІ життєздатних клітин (за результатами визначення оптичної густини (OD 570)) У кожному випадку, максимальним захисним ефектом у активних зразків було відновлення життєздатності клітин до рівня, який спостерігався за відсутністю доданого TNF (тобто, контроль з поміткою "тільки КЛІТИНИ") Обидва позитивні контролі, r-hTBP-1 та ТВРlgG3, посідають захисні властивості, причому вони демонструють очевидну дозозалежність та ED50 (ефективні дози), які дорівнюють, приблизно, ІООнг/мл для r-hTBP-1 (фіг 3-5) та, приблизно, 1,5нг/мл для TBP-lgG3 (фіг 3), ВІДПОВІДНО Генно-інженерні конструкції TBP-hCG з середовищ їх (СНО або COS) або одержані шляхом імуноочищення, демонструють дозозалежний рівень захисту, причому ED50 коливаються у межах, приблизно, 2-11нг/мл (фіг 35) Результати бюпроб in vitro наведено у Таблиці 5 Наведені дані свідчать проте, що гібридні білки пригнічують цитотоксичність TNF і що вони значно активніші, аніж мономер ТВР Негативні контролі були позбавлені захисної активності На додаток до можливості того, що димеризація ТВР може підвищувати активність, можливо також, що активність гібридних білків не пов'язана з димерною взаємодією з ТВР, а, скоріше, зі стеричним пригніченням внаслідок того, що партнер гібриду втручається у зв'язування TBP/TNF з клітинноповерхневими рецепторами TNF Усі джерела, процитовані у цьому описі, у тому числі, журнальні статті або резюме, опубліковані або ВІДПОВІДНІ заявки на патенти США або зарубіжні патенти, видані патенти США або зарубіжні патенти та будь-які ІНШІ джерела, у повному обсязі включено до цього опису як посилання, утому числі, усі дані, таблиці, малюнки та текст, представлені у згаданих джерелах Додатково, усі джерела у повному обсязі, згадані у джерелах, які згадуються у цьому описі, також включено до цього опису як посилання Посилання на етапи відомих способів, етапи 24 23 52646 традиційних способів, ВІДОМІ або традиційні TBP-hCG (20-161) 2,7 способи ні в якому разі не є припущенням того, що Контроль
ДивитисяДодаткова інформація
Назва патенту англійськоюHybrid proteins, pharmaceutical composition including hybrid protein, insulated dna molecule including hybrid protein, expression vector, host cell, method for producing hybrid protein, method for inducing follicle maturing
Автори англійськоюCampbell Robert K.
Назва патенту російськоюГибридные белки, фармацевтическая композиция, которая содержит гибридный белок, изолированая молекула днк, которая содержит гибридный белок, вектор экспресии, клетка-хозяин, способ продуцирования гибридного белка, способ индукуцирования вызревания фолликулов
Автори російськоюКампбелл Роберт К.
МПК / Мітки
МПК: C07K 14/59, C07K 14/715
Мітки: білка, днк, клітина-хазяїн, гібридні, спосіб, індукува, ізольована, гібридний, композиція, білок, експресії, молекула, містить, фармацевтична, продукування, гібридного, білки, вектор
Код посилання
<a href="https://ua.patents.su/29-52646-gibridni-bilki-farmacevtichna-kompoziciya-shho-mistit-gibridnijj-bilok-izolovana-molekula-dnk-shho-mistit-gibridnijj-bilok-vektor-ekspresi-klitina-khazyan-sposib-produkuvannya-gibr.html" target="_blank" rel="follow" title="База патентів України">Гібридні білки, фармацевтична композиція, що містить гібридний білок, ізольована молекула днк, що містить гібридний білок, вектор експресії, клітина-хазяїн, спосіб продукування гібридного білка, спосіб індукува</a>
Попередній патент: Похідні 2-(3н)-оксазолону як інгібітори, спосіб їх отримання та фармацевтична композиція, що їх містить
Наступний патент: Спосіб підвищення швидкості видобування метану з підземного вугільного відкладу
Випадковий патент: Спосіб оцінки ефективності лікування ніацином хворих на ішемічну хворобу серця з стенокардією, поєднану з хронічним панкреатитом