Похідні 2-(3н)-оксазолону як інгібітори, спосіб їх отримання та фармацевтична композиція, що їх містить
Номер патенту: 52645
Опубліковано: 15.01.2003
Автори: Пуджол Ногуера Ферран, Пуіг Дуран Карлес, Фернандес Форнер Долорс
Формула / Реферат
1. Соединение 2-(3Н)-оксазолона формулы (I):
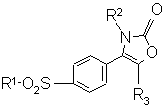 , (I)
, (I)
где:
R1 является алкильной группой или группой -NR4R5, где каждый R4 и R5 независимо являются водородом или алкильной или бензильной группой;
R2 является нафтильной, тетрагидронафтильной, незамещенной фенильной или фенильной группой, замещенной от 1 до 3 атомами галогена или алкильной, гидрокси, алкокси или трифторметильной группой; и
R3 является водородом или алкильной группой.
2. Соединение по п. 1, в котором R2 является 2-нафтильной группой или фенильной группой, замещенной 1 или 2 атомами галогена или алкильной, алкокси или трифторметильной группами.
3. Соединение по п. 1 или 2, в котором алкильные группы или фрагменты содержат от 1 до 6 атомов углерода.
4. Соединение по любому одному из предшествующих пунктов, где R1 является метильной группой или аминогруппой.
5. Соединение по любому одному из предшествующих пунктов, где R3 является атомом водорода или метильной группой.
6. Соединение по любому одному из предшествующих пунктов, где R3 является атомом водорода.
7. Соединение по любому одному из предшествующих пунктов, где R2 является фенильной группой, замещенной одним или двумя атомами галогена или метильными группами.
8. Соединение по любому одному из предшествующих пунктов, где R2 является фенильной группой, замещенной единственным заместителем в 3- или 4- положении.
9. Соединение по любому одному из предшествующих пунктов 1 - 7, где R2 является фенильной группой, замещенной двумя атомами галогена в 2- и 4- положении или в 3- и 4-положении.
10. 3-(4-фторфенил)-4-(4-метилсульфонилфенил)-2-(3Н)-оксазолон,
3-(2-фторфенил)-4-(4-аминосульфонилфенил)-2-(3Н)-оксазолон,
3-(3,4-дихлорфенил)-4-(4-аминосульфонилфенил)-2-(3Н)-оксазолон, и
3-(2,4-дихлорфенил)-4-(4-аминосульфонилфенил)-2-(3Н)-оксазолон.
11. Способ получения соединения формулы (I), как определено в любом из предшествующих пунктов, включающий:
а) когда R1 является алкильной группой или группой -NR4R5 (R4 и R5 не являются атомами водорода), взаимодействие карбамата формулы (V):
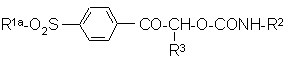 , (V)
, (V)
где R2 и R3 являются такими, как определено в п. 1, и R1a является алкильной группой –NR4aR5a, где каждый R4a и R5a независомо является алкильной или бензильной группой с безводной уксусной кислотой;
b) когда R1 является алкильной группой, взаимодействие меркаптопроизводного формулы (VIII):
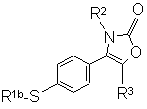 , (VIII)
, (VIII)
где R2 и R3 являются такими, как определено в п. 1, и R1b является алкильной группой, с окислителем;
с) когда R1 является группой -NR4R5, где R4 и R5 являются такими, как определено в п. 1, взаимодействие производного хлорсульфонила формулы(XI):
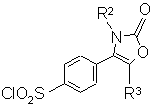 , (XI)
, (XI)
где R2, R3 являются такими, как определено в п. 1, с амином формулы (XII):
R4-NH-R5, (ΧII)
где R4, R5 являются такими, как определено выше; или
d) когда R1 является группой -NR4R5, где R4 и R5 являются водородом, дебензилирование соответствующего соединения формулы (IX):
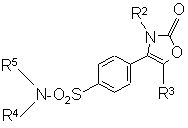 , (IX)
, (IX)
где R2, R3, R4 и R5 являются такими, как определено в п. 1, при условии, что по меньшей мере один из R4 и R5 является бензильной группой.
12. Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно соединение формулы (I), как определено в любом одном из пунктов 1 - 10, и фармацевтически приемлемый носитель или разбавитель.
13. Соединение формулы (I) по любому из пунктов 1 - 10 для лечения человека или животного посредством терапии.
14. Соединение формулы (I) по любому из пунктов 1-10 для лечения боли, жара или воспаления, для ингибирования сокращения гладкой мышцы, вызванного простаноидом, или для профилактики колоректального рака.
Текст
1 Соединение 2-(ЗН)-оксазолона формулы (І) R2 О где R является алкильнои груг /ппои или группой NR4R5, где каждый R4 и R независимо являются водородом или алкильнои или бензильной группой, R2 является нафтильной, тетрагидронафтильной, незамещенной фенильной или фенильной группой, замещенной от 1 до 3 атомами галогена или алкильнои, гидрокси, алкокси или тр и фтор мети л ьной группой, и R3 является водородом или алкильнои группой 2 Соединение по п 1, в котором R2 является 2нафтильной группой или фенильной группой, замещенной 1 или 2 атомами галогена или алкильнои, алкокси или трифторметильной группами 3 Соединение по п 1 или 2, в котором алкильные группы или фрагменты содержат от 1 до 6 атомов углерода 4 Соединение по любому одному из предшествующих пунктов, где R1 является метильной группой или аминогруппой 5 Соединение по любому одному из предшествующих пунктов, где R3 является атомом водорода или метильной группой 6 Соединение по любому одному из предшествующих пунктов, где R3 является атомом водорода 7 Соединение по любому одному из предшест вующих пунктов, где R является фенильной группой, замещенной одним или двумя атомами галогена или метильными группами 8 Соединение по любому одному из предшествующих пунктов, где R2 является фенильной группой, замещенной единственным заместителем в 3- или 4- положении 9 Соединение по любому одному из предшествующих пунктов 1 - 7, где R2 является фенильной группой, замещенной двумя атомами галогена в 2и 4- положении или в 3- и 4-положении 10 3-(4-фторфенил)-4-(4-метилсульфонилфенил)2-(ЗН)-оксазолон, 3-(2-фторфенил)-4-(4-аминосульфонилфенил)-2(ЗН)-оксазолон, 3-(3,4-дихлорфенил)-4-(4аминосульфонилфенил)-2-(ЗН)-оксазолон, и 3-(2,4-дихлорфенил)-4-(4аминосульфонилфенил)-2-(ЗН)-оксазолон 11 Способ получения соединения формулы (I), как определено в любом из предшествующих пунктов, включающий а) когда R1 является алкильнои группой или группой -NR4R5 (R4 и R5 не являются атомами водорода), взаимодействие карбамата формулы (V) 2 CO-CH-O-CONH-R R3 , (V) где R2 и R3 являются такими, как определено в п 1, и R1a является алкильнои группой -NR 4a R 5a , где каждый R4a и R5a независомо является алкильнои или бензильной группой с безводной уксусной кислотой, Ь) когда R1 является алкильнои группой, взаимодействие меркаптопроизводного формулы (VIII) О где R2 и R3 являются такими, как определено в п 1, и R' является алкильнои группой, с окислителем, с) когда R1 является группой -NR4R5, где R4 и R5 являются такими, как определено в п 1, взаимодействие производного хлорсульфонила форму О ю (О ю 52645 лы(Х1) CIO z где R , R~ являются такими,как определено в п 1, с амином формулы (XII) 4 5 R -NH-R ; (XII) 4 5 где R R являются такими. как определено выше, или 1 4 5 4 5 d) когда R является группой -NR R , где R и R являются водородом, дебензилирование соответствующего соединения формулы (IX) 4 2 3 4 5 где R , R , R и R являются такими, как определено в п 1, при условии, что по меньшей мере 4 5 один из R и R является бензильной группой 12 Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно соединение формулы (I), как определено в любом одном из пунктов 1 - 10, и фармацевтически приемлемый носитель или разбавитель 13 Соединение формулы (I) по любому из пунктов 1 - 1 0 для лечения человека или животного посредством терапии 14 Соединение формулы (I) по любому из пунктов 1-10 для лечения боли, жара или воспаления, для ингибирования сокращения гладкой мышцы, вызванного простаноидом, или для профилактики колоректального рака N-0 R4 (IX) Настоящее изобретение относится к новым терапевтически пригодным производным 2-(ЗН)оксазолона, способам их получения и к содержащим их фармацевтическим композициям Полагают, что механизм действия нестероидных противовоспалительных лекарственных средств состоит в ингибировании ферментной циклооксигеназы (СОХ) и в последовательном превращении арахидоновой кислоты в простагландини Идентификация изоферментов циклооксигеназы-1 (СОХ-1) и циклооксигенаэы-2 (СОХ-2) привела к гипотезе, состоящей в том, что ингибирование, в особенности селективное ингибирование, СОХ-2, будет снижать воспаление без побочных эффектов классических нестероидных противовоспалительных лекарственных средств, желудочную и почечную токсичность В соответствии с этой гипотезой, обнаружено, что некоторые производные 2-(ЗН)-оксазолона ингибируют СОХ-2 и селективно ингибируют СОХ2 в предпочтении к СОХ-1, Эти производные обладают эффективностью и толерантностью при лечении СОХ-2 опосредованных заболеваний, таких как воспаление, боль, жар и астма, и оказывают меньшие побочные действия, такие как ульцерогенная активность Соответственно настоящее изобретение предлагает соединение 2-(ЗН)-оксазолона формулы (1) где R является алкильной группой или группой NR4R5, где каждый R4 и R5 независимо являются водородом или алкильной или бензильной группой, R2 является нафтильной (предпочтительно 2нафтил), тетрагидронафтильной, незамещенной фенильной или фенильной группой, замещенной от 1 до 3 атомами галогена (предпочтительно хлором или фтором) или алкильной, гидрокси, алкокси или трифторметильной группой, R3 является водородом или алкильной группой Алкильные группы или фрагменты, как например в алкокси группах, упомянутые в отношении групп R1-R5, обычно представляют низший алкил, то есть содержащие до 6, и в особенности, до 4-х атомов углерода, при этом углеводородная цепь является разветвленной или неразветвленной Предпочтительной алкильной группой или фрагментом является метил Заместители в фенильном кольце могут быть в любом положении Так, например, единственный заместитель может быть в 2-, 3- или 4-положении, или два заместителя могут быть в 2- и 4- положении или 3- и 4- положении Предпочтительными соединениями формулы (1) являются такие, где R1 является алкильной или аминогруппой, R2 является фенильной группой, замещенной одним или двумя атомами галогена (в особенности хлором или фтором), и R3 является водородом Заместители в фенильной группе, представленные R2, могут быть одинаковыми или различными Значительный интерес представляют следующие соединения 3-(4-фторфенил)-4-(4метилсульфонилфенил)-2-(ЗН)-оксазолон, 3-(2фторфенил)-4-(4-аминосульфонилфенил)-2-(ЗН)оксаэолон, 3-(3,4-дихлорфенил)-4-(4аминосульфонилфенил)-2-(ЗН)-оксазолон, и 3 (2,4-дихлорфенил)-4-(4-аминосульфонилфенил)2-(ЗН)-оксазолон Настоящее изобретение предлагает также способы получения соединения формулы (1), ко1 торые зависят от определения R Настоящее изобретение предлагает способ 1 получения соединения формулы (1), где R явля4 5 ется алкильной группой или группой -NR R , в ко4 5 торой R и R отличны от водорода, а именно производного 2-(ЗН)-оксазолона формулы (2) 52645 Для получения соединения формулы (2) карбамат может быть нагрет до температуры от 80°С до 120°С с избытком безводной уксусной кислоты Настоящее изобретение также предлагает 1 способ получения соединения формулы (1) где R является группой, а именно производного 2-(ЗН)оксазолона формулы (7) (7) 1b (2) где R1a является алкильной группой -NR4aR5a, в которой каждый R4a и R5a независимо является алкильной или бензильной группой, и R2 и R3 являются такими, как они определены выше, который включает взаимодействие карбамата формулы (5), O-CH-O-CONH-R2 (5) R3 где R1, R2 и R3 являются такими, как они определены выше, с безводной уксусной кислотой Карбамат формулы (5) может быть получен, например, путем взаимодействия фенацильного спирта формулы (3) о-снон (3) h где R1a и R3 являются такими, как определено выше, с изоцианатом формулы (4) OCN- R' (4) где R является таким, как определено выше Реакцию между фенацильным спиртом формулы (3) и изоцианатом формулы (4) можно осуществить путем нагревания смеси этих двух исходных веществ, необязательно в присутствии органического растворителя, как например толуола или ксилола, при температуре от 80°С до 200°С Карбамат формулы (5) может быть также получен путем взаимодействия тиопроизводного формулы (6) ? R3 где R1, R2 и R3 являются такими, как определено выше, с окислителем, предпочтительно монопероксифталатом магния или 3хлорпероксибензойной кислотой Реакцию предпочтительно осуществляют в органическом растворителе, как например в смеси метиленхлорида с метанолом или этанолом, при температуре от 10°Сдо40°С Карбамат формулы (5) после каждого процесса может быть выделен известными методами 2 3 где R является алкильной группой, и R и R являются такими как определено выше, путем взаимодействия меркаптопроизводного формулы (8) О где R1b, R2 и R3 являются такими как определено выше, с окислителем, предпочтительно с монопероксифталатом магния или 3хлорпероксибензойной кислотой Реакцию между меркаптопроизводным формулы (8) и, окислителем осуществляют предпочтительно, как описывалось ранее для соединения формулы (6), в органическом растворителе, как например в смеси метиленхлорида с метанолом или этанолом, при температуре от 10°С до 40°С Настоящее изобретение дополнительно предлагает способ получения соединения формулы (1), где R1 является группой -NR4R5, а именно производного 2-(ЗН)-оксазолона формулы (9) О Л () 9 й5, \ 2 3 4 5 где R , R , R и R являются такими, как определено выше, путем взаимодействия производного хлорсульфонила формулы (11) Р 4 CS O I2 Л N где R , R являются такими, как определено выше, с амином формулы (12), R4-NH-R5 (12) где R4, R5являютcя такими, как определено выше Данную реакцию предпочтительно осуществляют при температуре от 10°С до 40°С 52645 Производное хлорсульфонила формулы (11) может быть получено, например, путем взаимодействия соединения формулы (10) где R , R являются такими, как определено выше, с хлорсульфоновой кислотой, предпочтительно при температуре от 80°С до 120°С Настоящее изобретение, кроме того, предлагает способ получения соединения формулы (1), 1 4 5 4 5 где R является группой -NR R , где R и R являются водородом, а именно производного 2-(ЗН)оксазолона формулы (13) HgN-023 где R , R являются такими, как определено выше, путем дебензилирования соответствующего соединения формулы (9), где R4, R5 являются такими, как определено выше, при условии, что, по меньшей мере, один, предпочтительно оба, из R4, R5 является бензильной группой, например производного 2-(ЗН)-оксазолона формулы (13) N-O2S (14) где R , R являются такими, как определено выше Дебензилирование осуществляет предпочтительно с избытком трифторуксусной, серной и метансульфоновой кислоты при температуре от 0°Сдо120°С Промежуточные соединения формул (3) и (4), применяемые при получении соединений изобретения, могут быть получены способами, описанными в литературе, например, в М F Saettone, J Org Chem, 31, р 1959(1966) Промежуточные соединения формул (13) и (10) могут быть получены тем же самым способом, раскрытым для получения соединений (2) с применением соответствующих исходных веществ Далее настоящее изобретение иллюстрирует следующие биологические испытания и данные Для анализа цельного клеточного СОХ-1 и СОХ-2 маточные растворы (10 3М) лекарственных средств растворили в 50% диметилсульфоксиде и с помощью среды осуществили дополнительные разбавления Наполнитель для лекарственного средства, при применяемых концентрациях, не оказывал влияния на ферментативные активности 8 Ингибирование активности циклооксигеназы-1 (СОХ-1) в тромбоцитах человека Из периферической крови человека, полученной от здоровых доноров, которые отказывались принимать какие-либо нестероидные противовосполительные лекарственные средства в течение, по меньшей мере, предшествующей недели, выделили тромбоциты Для воспрепятствования свертывания крови ее обрабатывали 2мг/мл натриевой соли EDTA и центрифугировали при 180д в течение 10 минут при комнатной температуре с получением богатой тромбоцитами плазмы Для получения тромбоцитного осадка обогащенную тромбоцитами плазму центрифугировали в течение 20 минут при 2000а и 4°С Клетки дважды 2 2+ промывали PBS без Са и Мд и повторно суспендировали сбалансированным солевым раствором Хенка (HBSS) до получения 5x107 клеток Тромбоциты (107) предварительно инкубировали с лекарственными средствами в течение 15 минут при 37°С и затем инкубации продолжали в течение дополнительных 15 минут в присутствии 50|JM арахидоновой кислоты С применением твердофазного иммуноанализа (ELISA) измеряли в супернатантах получение тромбоксана Вг в ответ на арахидоновую кислоту Результаты выражали в виде среднего от значений ICso полученных в результате проведения трех независимых экспериментов Ингибирование активности циклооксигеназы-2 (СОХ-2) в клеточной линии HUV-EC-C Эндотелиальная клеточная линия HUV-EC-C человека выражает селективность изофермента циклооксигеназы-2 после обработки форбол-12миристат-13-ацетатом (РМА) (Miralpeix et al , "Agents and Actions", 44 S274(1995) HUV-EC-C клетки выращивали в F12K среде Хама (Ham), содержащей 10% эмбриональную бычью сыворотку, 100цг/мл гепарина и 50 цг/мл добавки для роста эндотелиальных клеток (ECGS) Эксперименты осуществляли с применением 19-27 пассажей 4 HUV-EC-C Клетки (2x10 ) засевали на чашки Петри с 96-ю лунками и до начала экспериментов делали неактивными путем удаления в течение 48 часов фактора роста Для индуцирования изофермента СОХ-2 активные HUV-EC-C клетки в течение 6 часов при 37°С обрабатывали 50нМ ТРА Затем культуральную среду изменили и клетки в течение 30 минут при 37°С инкубировали с лекарственными средствами Затем добавили арахидоновую кислоту (50|JM) И клетки инкубировали в течение дополнительных 30 минут С применением твердофазного иммуноанализа (ELISA) определили получение простагландина Ег в супернатантах в ответ на арахидоновую кислоту Результаты выразили в виде среднего от значения ІСбо, полученных в результате проведения независимых экспериментов Ульцерогенная активность Животные Использовали крыс-самцов Wistar, (Interfauna, U К Ltd), весящих около 120-150г Их выдерживали в цикле свет-темнота 12 12 часов (свет включали в 7 00 утра) при комнатной температуре (22±1°С) До осуществления эксперимента животные голодали в течение 18 часов, имел при этом свободный доступ к питьевой воде 52645 Методика Эксперименты проводили с 9 до 17 часов Соединения вводили оральным путем и через 6 часов после дозировки лекарственного средства животных исследовали Желудок каждой крысы удаляли, открывали и осторожно промывали Определяя количество и размер язв в гландулярном желудке, с применением параметрической шкалы (Cosen и Mazure), оценивали макроскопическую степень эрозий Каждый желудок классифицировали, таким образом, с помощью изменения индекса и сравнивали с повреждением желудка, вызванным пероральным приемом 100мг/кг кеторолака, применяемого в качестве положительного стандарта Обработку в каждом эксперименте осуществляли произвольно Противовосполительная активность (адъювантный артрит) Использовали крыс самцов Wistar, весящих 175-200г, имеющих свободный доступ к пище и воде До начала эксперимента животные получали внутриплантарную инъекцию суспензии Mycobactenum tuberculosis в парафиновом масле (0,5мг/крысу) в левую заднюю лапу Группе из 8 контрольных крыс, не пораженных артритом, вводили парантерально только парафиновое масло На 11 и 14 день после индуцирования артрита с применением водного плетизмографа измеряли объем задней лапы каждой крысы Отбирали животных, объем лап которых за это время увеличился Крыс распределяли на группы из 8 крыс, имеющих равные средние объемы лап и приблизительно равное стандартное отклонение 10 Испытуемые соединения вводили перорально 1 раз ежедневно в течение 7 дней (14-20 день) Не пораженные и пораженные артритом контрольные крысы получали только наполнитель в течение 7 дней Объемы задних лап измеряли через 20 часов после последней дозы (на 21 день) Массу тела определяли каждый второй день Результаты выражали в виде процента ингибирования воспаления (объем лапы) для каждой подверженной лечению группы, принимая во внимание как пораженных артритом, так и не пораженных артритом контрольных крыс с наполнителем Для статистических исследований применяли испытание ANOVA Лекарственные средства Для анализа цельного клеточного СОХ-1 и 3 СОХ-2 маточные растворы (10 М) лекарственных средств растворяли в 50% диметилсульфоксиде и с помощью среды осуществляли дополнительные разбавления Наполнители для лекарственного средства, при применяемых концентрациях, не оказывали влияния на ферментативную активность Для анализа in vitro все лекарственные средства вводили в наполнителе (0,1% Tween 80+0,5% метилцеллюлоза в дисциллированной воде) объемом 5мл/кг Результаты Результаты, полученные от проведения биологических анализов, показаны в таблицах 1, 2 и 3 Таблица 1 Ингибирование СОХ-1 и СОХ-2 Соединение (*) СОХ-1 (иМ) (**) СОХ-2 ((иМ) (**) Отношение СОХ-1 СОХ-2 Индометацин 6 9 12 0 047 127 >100 >100 015 32 011 04 03 39 6 >909 >250 16 17 18 20 23 27 9 >100 15 35 46 0 008 0 03 0 53 0 06 0 26 3487 >3333 28 58 3 177 26 27 22 6 89 0 0096 01 2354 89 (*) Смотри структуры в таблице4 Индометацин представляет собой 1-(4-хлорбензоил)-5метокси-2метилиндол-3-уксусную кислоту, несте роидное противовоспалительное лекарственное средство (**) Результаты выражены в виде значений 1С50 11 52645 Таблица 2 Противовоспалительная аісгивность Соединение Индометацин 6 18 20 23 26 27 %Ингибирования (доза, м г/кг) 64(1) 52(3) 63(1) 67(1) 62(1) 65(1) 64(1) Таблица 3 Ульцерогенная активность Соединение Индометацин 6 20 26 27 UD50 (мг/кг) 17 >100 >100 >100 >100 Как показано в таблицеї, соединения формулы (1) являются селективными и сильнодействующими ингибиторами СОХ-2, Было обнаружено, что соединения примеров являются более эффективными при ингибировании активности СОХ-2, чем при ингибировании активности СОХ-1, тогда как эталонное соединение индометацин является сильнодействующим и эффективным ингибитором СОХ-1 Вследствие их низкой СОХ-1 активности соединения формулы (1) проявляют значительную противовоспалительную активность (смотри таблицу2) и выгода от их применения состоит в том, что они оказывают значительно менее опасные побочные действия, чем обычно применяемые нестероидные противовоспалительные лекарственные средства, (например, желудочно-кишечная токсичность (смотри таблицуЗ), побочное действие на почки, ослабленное действие на время кровотечения и индуцирования астмы у субъектов, чувствительных к аспирину) Настоящее изобретение предлагает соединение формулы (1) для применения в способе лечения человека или животного посредством терапии, в особенности для лечения боли, жара или воспаления, для ингибирования сокращения гладкой мышцы, вызванного простаноидом, или для профилактики колоректального рака Настоящее изобретение также предлагает применение соединения формулы (1) в производстве лекарственных препаратов для лечения боли, жара или воспаления для ингибирования сокращения гладкой мышцы, вызванного простаноидом, или для профилактики колоректального рака Соединения формулы (1) являются пригодными для ослабления боли, жара и воспаления при множестве состояний, включающих ревматическую атаку, симптомы, связанные с эпидемическим гриппом или другими вирусными инфекциями, насморк, задненижнюю и шейную боль, 12 дисменорею, головную боль, зубную боль, растяжения и деформации, миозиты, невралгию, синовит, бурсит, тендинит, травмы, хирургические и стоматологические процедуры и артриты, включающие ревматоидные артриты, остеоартриты, подагрические артириты, спондилоартропатии, системную красную волчанку и болезнь СтиллаШоффара Они могут быть также использованы при лечение кожных воспалительных нарушений, как например псориаза, экземы, жжения и дерматитов, Такие соединения могут быть также использованы для профилактики колоректального рака Соединения формулы (1) будут ингибировать также вызванное простаноидом сокращение гладкой мышцы и поэтому могут быть использованы для лечения дисменореи, при преждевременных родах, для лечения астмы и бронхитов Соединения формулы (1) могут быть использованы в качестве альтернативы обычным нестероидным противовоспалительным лекарственным средствам, в частности, когда такие нестероидные противовоспалительные лекарственные средства могут быть противопоказаны, как например, для лечения больных, страдающих желудочнокишечными расстройствами, включающими пептические язвы, гастриты, регионарный энтерит, неспецифический язвенный колит, дивертикулит, болезнь Крона, синдром воспалительного кишечника и синдром раздраженной толстой кишки, желудочно-кишечное кровотечение и нарушение коагуляции заболевания почек (например, нарушенной функцией почек), до хирургического вмешательства или приема антикоагулянтов, и астмой, вызванной чувствительностью к нестероидным противовоспалительным лекарственным средствам Соединения могут быть также использованы для лечения воспалений при заболеваниях таких, как сосудистые заболевания, мигрень, узелковый периартериит, тиреоидин, апластическая анемия, болезнь Ходжкина, склеродермия, диабет типа I, миастения, саркоидоз, нефротический синдром, синдром Бехчета, полимиозит, аллергия, конъюктивит, гингивит и миокарднкая ишемия Соединения настоящего изобретения являются ингибиторами фермента циклооксигеназы-2, и поэтому они являются пригодными для лечения перечисленных выше заболеваний, опосредованных циклооксигеназой-2 Настоящее изобретение предлагает также фармацевтическую композицию, которая содержит в качестве активного ингредиента, по меньшей мере, одно производное 2-(ЗН)-оксазолона формулы (1) и фармацевтически приемлемый носитель или разбавитель Композиции предпочтительно находятся в форме, подходящей для перорального, местного, ректального, трансдермального, назального или парентерального введения, а также для ингаляции Фармацевтически приемлемые носители или разбавители, которые смешивают с активным соединением или соединениями для образования композиций данного изобретения, являются хорошо известными сами по себе, и действительные 14 13 52645 используемые эксципиенты зависят, между проПримері чим, от предназначенного метода введения комa) Смесь 4-метилсульфонилфенацилового позиций Композиции данного изобретения предспирта (Зг, 0,014моля), температура плавления почтительно приспособлены для перорального 133-135°С, и 4-фторфенилизоцианата (5мл, введения 0,044моля) перемешивают в течение 1 часа при 100°С, после охлаждения полученное твердое В этом случае композиции для перорального обрабатывают диизопропиловым эфиром (30мл), введения могут иметь форму таблеток, капсул, собирают фильтрацией и промывают 10% смесью лепешек или шипучих гранул или жидких препараметанола в диэтиловом эфире Получают 4тов, таких как эликсиры, сиропы или суспензии, метилсульфонилфенацил ІЧ-(4-фторфенил) карвсех содержащих одно или более соединений бамат (3,5г) в виде белого твердого вещества, изобретения Такие препараты могут быть полутемпература плавления 198-200°С (разл ) чены способами, хорошо известными в данной области, например путем смешивания производb) Раствор вышеназванного соединения (Зг, ного 2-(ЗН)-оксазолона формулы (1) с фармацев0,0085молей) в безводной уксусной кислоте тически приемлемым носителем или разбавите(30мл) кипятят с обратным холодильником в течелем ние 8 часов В вакууме удаляют растворитель, из смеси ацетонитрила (10мл) к диизопропилового Разбавители, которые могут быть использоваэфира (20мл) выкристаллизовывают остаток и ны при получении композиций, включают те жидзатем перекристаллизовывают из смеси этанола и кие и твердые разбавители, которые совместимы метиленхлорида Получают 3-(4-фторфенил)-4-(4с активным ингредиентом, вместе с красителями и метилсульфонилфенил)-2-(ЗН)-оксазолон (1,9г), вкусовыми добавками, если желательно Таблетки температура плавления 170-172°С Это соединеили капсулы могут подходяще содержать активние имеет другую кристаллическую форму с темный ингредиент в количестве между 10 и 500мг и пературой плавления 152-153°С предпочтительно от 15 до 100мг Соединения могут быть также введены а гранулы, покрытые соПример2 ответствующими природными или синтетическими a) Раствор 4-метилтиофенацилового спирта полимерами, известными в данной области, с по(1 г, 5,5ммоля) и 4-фенилизоцианата (1,08г, лучением свойств длительного выделения, или 5,4ммоля) в безводном ксилоле (10мл) кипятят с могут быть введены с полимерами в таблетирообратным холодильником в течение 5 часов Заванную форму с получением таких же свойств тем реакционную смесь охлаждают и твердое фильтруют и промывают диизопропиловым эфиЖидкие композиции, приспособленные для ром, получая 4-метилтиофенацил N-(4перорального применения, могут быть в форме бромфенил) карбамат в виде белого твердого верастворов, суспензий или аэрозолей Растворы щества (1,8г) могут представлять собой водно-спиртовые растворы 2-(ЗН)-оксазолона в сочетании, например, с b) Раствор вышеуказанного карбамата (1,8г, сахарозой или сорбитом для образования сиропа 4,7ммоля} в безводной уксусной кислоте (18мл) Суспензии могут содержать нерастворимую или кипятят с обратным холодильником в течение 16 микроинкапсулированную форму активного сочасов, в вакууме удаляют растворитель и остаток единений изобретения в сочетании с водой и друобрабатывают ацетоном, Образованное белое гими приемлемыми растворителями вместе с суствердое отфильтровывают и получают 3-(4пендирующим агентом или вкусовой добавкой бромфенил)-4-(4-метилтиофенил)-2-(ЗН)оксазолон (1г), Композиции для ингаляции могут быть в форме растворов, суспензий или микронизированного c) К раствору вышеназванного соединения (1г, порошка, содержащегося в соответствующем ин2,7ммоля) в метаноле (Змл) и метиленхлориде галяторе (17мл) медленно добавляют гексагидрат монопероксифталата магния (2,13г, 4,3ммоля), и смесь Композиции для парентерального введения перемешивают при комнатной температуре в темогут быть получены в форме микроэмульсий или чение 2 часов Затем ее промывают 4М водным микросуспензий в воде или соответствующей жидраствором бикарбамата натрия, сушат (Na2S04) и кости для парентерального введения при пониженном давлении удаляют растворитель При лечении человека дозы производных 2Остаток перекристаллизовывают из метиленхло(ЗН)-оксазолона зависят от желательного эффекрида/этанола с получением 3-(4-бромфенил)-4-(4та и продолжительности лечения, дозы для метилсульфонилфенил)-2-(ЗН)-оксазолона (0,63г), взрослого человека составляют обычно между температура плавления 217-219°С 15мг и 500мг в день В общем, врач будет назначать дозу с учетом возраста и веса пациента, коПримерЗ торому необходимо лечение Раствор фенацил І\І-(4-фторфенил) карбамата (9,6г, 35ммолей) в безводной уксусной кислоте Производные 2-(ЗН)-оксазолона формулы (1) (96мл) кипятят с обратным холодильником в течемогут быть использованы в способе лечения люние 16 часов При пониженном давлении удаляют бого из вышеперечисленных состояний, вклюрастворитель и кристаллизуют твердое, которое чающем введение субъекту, нуждающемуся в тасобирают фильтрацией и промывают диэтиловым ком лечении, эффективного количества эфиром Получают 3-(4-фторфенил)-4-фенил-2производного формулы (1) (ЗН)-оксазолон (7,8г), температура плавления Далее изобретение иллюстрируют следующие 145-147°С примеры Ь) Смесь вышеназванного соединения (4г, 15,7ммоля) и хлорсульфоновой кислоты (2,1мл, 16 15 52645 31,6ммоля) нагревают при 100°С в течение 4 чаЬ) Раствор вышеописанного соединения (2г, сов, охлаждают и затем вливают в смесь воды со 3,54ммоля) в метансульфоновой кислоте (15мл) льдом Осажденное твердое экстрагируют этилперемешивают при 100°С в течение получаса ацетатом, сушат (Na2S04) и в вакууме удаляют Реакционную смесь вливают в смесь воды со растворитель К остатку добавляют концентрирольдом, осажденное твердое собирают фильтраванный гидроксид аммония (40мл), перемешивают цией и затем обрабатывают этанолом Отфильтпри комнатной температуре в течение получаса и ровывают нерастворимое твердое и раствор проэкстрагируют метиленхлоридом Органический пускают через хроматографическую колонку, раствор сушат (Na2S04), при пониженном давлесодержащую силикагель в качестве элюента мении удаляют растворитель, и остаток перекритиленхлоридметанол (95 5) Получают 3сталл изовывают из этанола Получают 3-(4(3,4лцихлорфенил)-4-(4-аминосульфонилфенил)фторфенил)-4-(4-аминосульфонилфенил)-2-(ЗН)2-(ЗН)-оксазолон (0,9г) температура плавления оксазолон (0,89г), температура плавления 211158-161 °С 213°С Другие производные 2-(ЗН)-оксазолона формулы (1) представленные в таблице4, получают в Пример4 соответствии со способами, раскрытыми в этих а) Раствор 4-(N,Nпримерах, но при соответствующих исходных ведибензиламиносульфонил)фенацил N-(3,4ществах дихлорфенил)карбамата (2,6г, 4,46ммоля) в безводной уксусной кислоте (25мм) кипятят с обратным холодильником в течение 6 часов При пониженном давлении удаляют растворитель и полученное масло обрабатывают диэтиловым эфиром Кристаллизуют 3-(3,4-дахлорфенип)-4[4(г\І,І\І-дибензиламиносульфонил)фенил]-2-(ЗН)оксазолон (2,0г), температура плавления 128130°С Таблица 4 Соединение R1 R^ R^ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС НзС H2N H2N H2N (C4H5-CH3)2N НзС H2N H2N H2N H2N H2N НзС-NH C4H5CH2-N-CH3 (H3C)2N C4H5 4H3C-C4H4 H H H H H H H H H H H H H H H H H H H H H H3C H H H H H H H H ЗН3С-С6Н4 2F-C 6 H 4 Зг-СбН4 4F-C 6 H 4 ЗСІ-С6Н4 4CI-C 6 H 4 4Br-C 6 H 4 4F3C-C4H4 ЗСІ,4Нз-СО-С6Нз 2,4flHF-C6H3 3,4flHF-C6H3 3CI,4F-C6H3 2,4диСІ-С6Нз 3,4диСІ-С6Нз 2-нафтил 4F-C6H4 3CI,4F-C6H3 3,4диСІ-С6Нз 3CI,4F-C6H3 4F-C6H4 4CI-C6H4 4CI,3F-C6H3 ЗСІ-С6Н4 2F-C 6 H 4 2,4flHF-C 4 H 3 2,4flHF-C 4 H 3 2,4flHF-C 4 H 3 2,4flHF-C 4 H 3 Способ примера 1 1 1 1 2 1,2 1 1 2 1 1 1 1 1 1 1 1 3 4 4 1 1 4 4 4 4 4 4 1 1 T пл ,°С 207-210 213-214 195-197 186-187 138-139 170-172 177-178 220-221 217-219 189-190 154-156 155-156 177-178 175-177 199-200 197-199 222-223 211-213 247-249 158-161 128-130 205-206 211-212 186-187 176-177 178-179 190-192 136-138 125-127 157-159 17 52645 Последующие примеры иллюстрируют фармацевтические композиции в соответствии с настоящим изобретением и методики их получения Пример5 Из следующего состава получают 10000 таблеток, каждая из которых содержит 50мг 3-(4хлорфенил)-4-(4-метилсульфонилфенил)-2-(ЗН)оксазолона (активный ингредиент) Активный ингредиент 500г Микрокристаллическая целлюлоза 390г Высушенная распылением лактоза 1,990г Карбоксиметиловый крахмал 80г Натрийстеарилфумарат 20г Коллоидный диоксид кремния 20г Методика Все порошки пропускают через сито с размером ячейки 0,6мм, затем в течение 20 минут перемешивают в соответствующем смесителе и 18 прессуют в 300мг таблетки с использованием Эмм дисков и плоских скошенных пуансонов Время расслоения таблеток составляет примерно 3 минуты Примерб Из следующего состава получают 100000 капсул, каждая из которых содержит 100мг 3-(4фторфенил)-4-(4-метилсульфонилфенил)-2-(ЗН)оксазолона (активный ингредиент) Активный ингредиент 10кг Моногидрат лактозы 20кг Кукурузный крахмал 2кг Стеарат магния 0,4кг Коллоидный диоксид кремния 0,2кг Методика Вышеперечисленные ингредиенты просеивают через сито с размером ячеек бОмеш, загружают в подходящий смеситель и наполняют в 100000 желатиновых капсул ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 2-(3н)-oxazalone as inhibitors, a process of production thereof and a pharmaceutical composition containing them
Назва патенту російськоюПроизводные 2-(3н)-оксазолона как ингибиторы, способ их получения и содержащая их фармацевтическая композиция
МПК / Мітки
МПК: A61P 11/06, A61K 31/421, A61K 31/42, C07D 263/38, A61P 11/00, A61K 31/00
Мітки: похідні, містить, отримання, 2-(3н)-оксазолону, інгібітори, спосіб, композиція, фармацевтична
Код посилання
<a href="https://ua.patents.su/9-52645-pokhidni-2-3n-oksazolonu-yak-ingibitori-sposib-kh-otrimannya-ta-farmacevtichna-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-(3н)-оксазолону як інгібітори, спосіб їх отримання та фармацевтична композиція, що їх містить</a>












