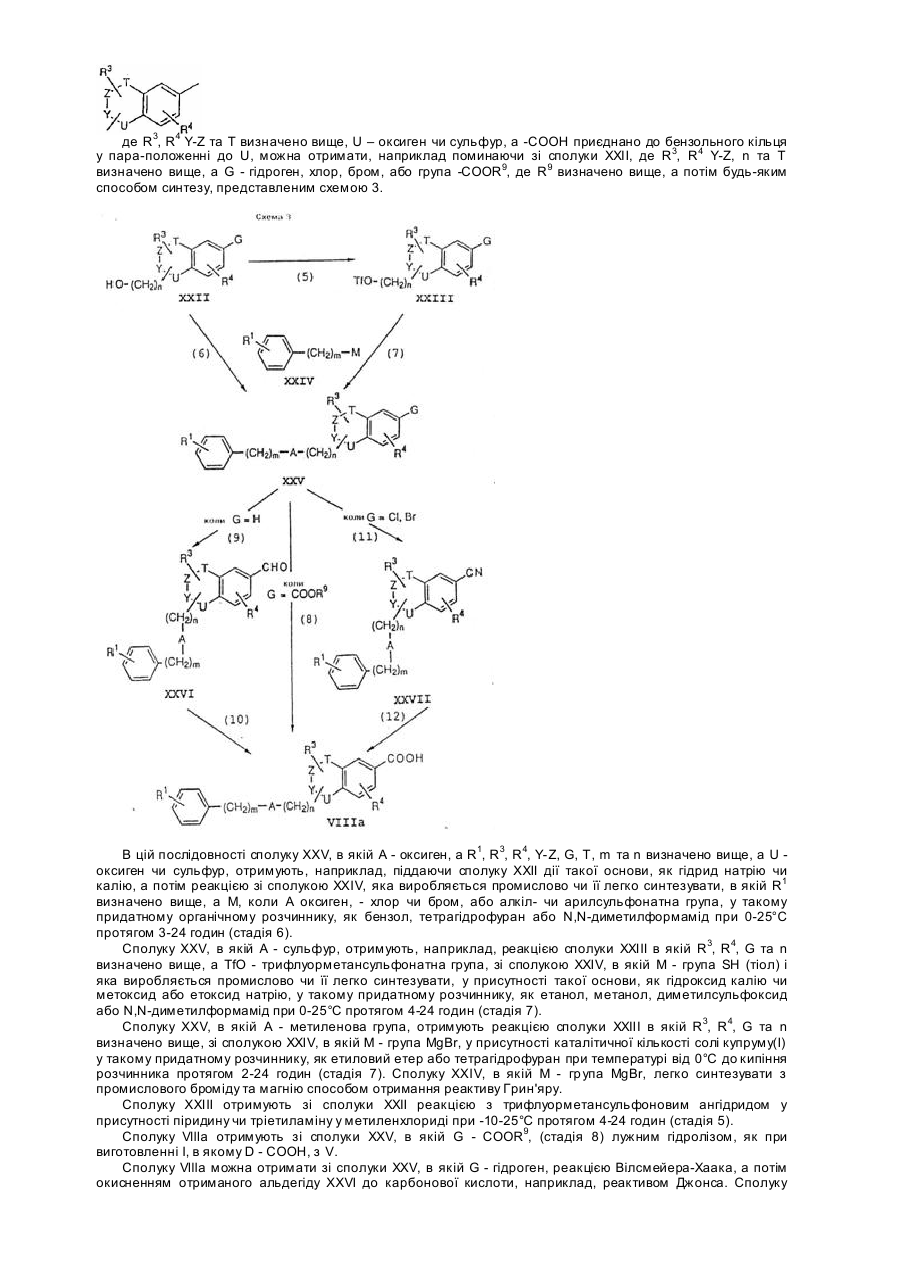
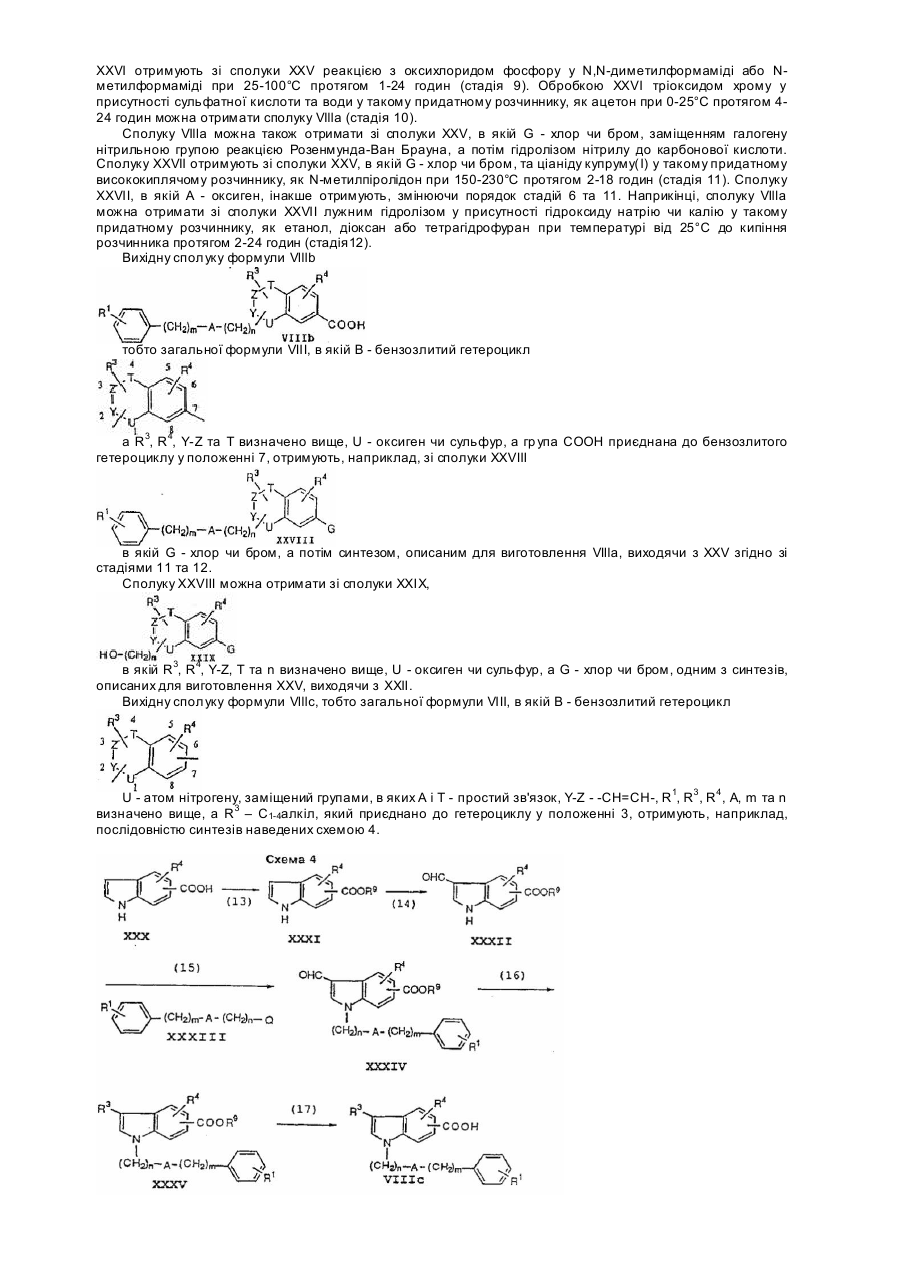
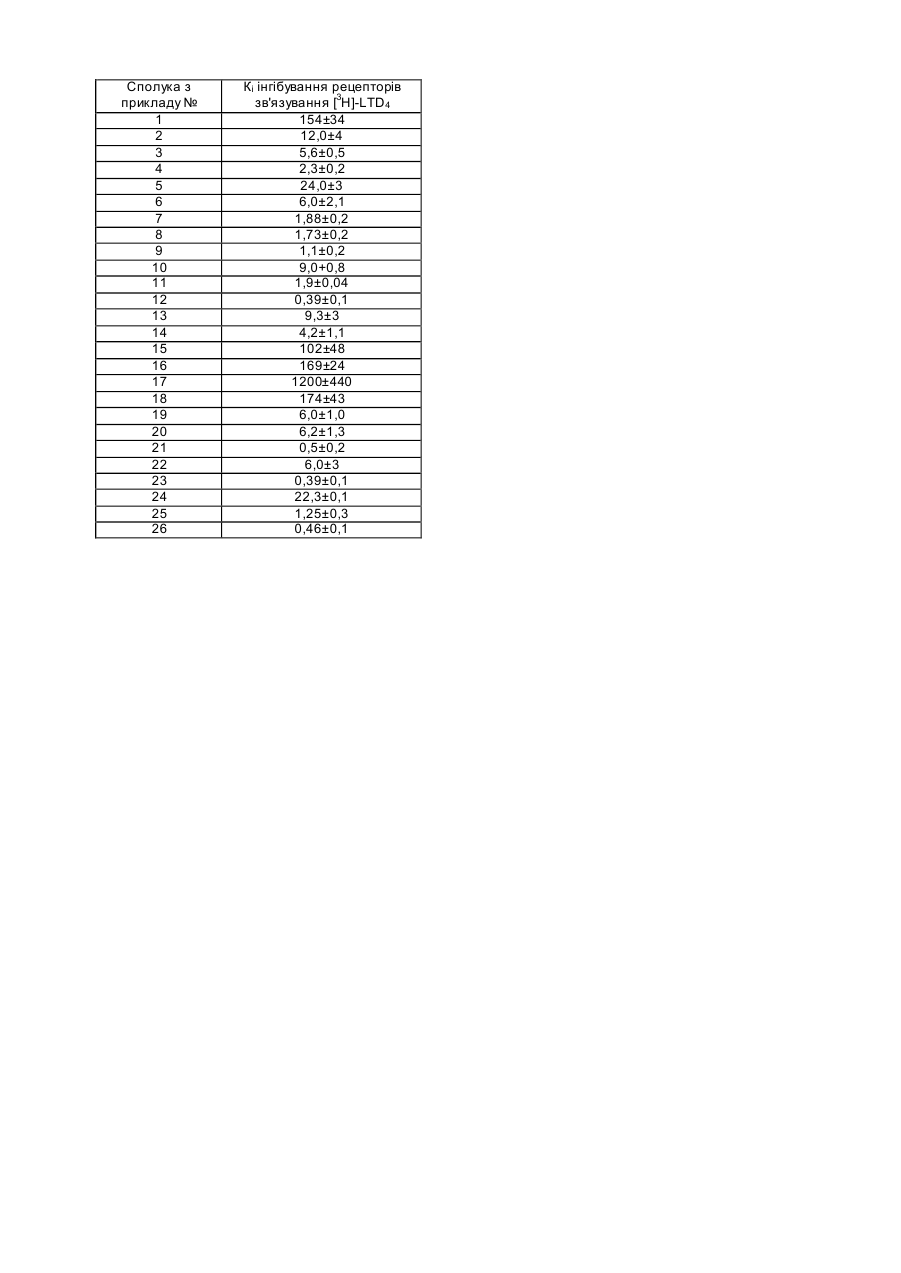
Похідні бензопірану та спосіб їх одержання
Номер патенту: 65535
Опубліковано: 15.04.2004
Автори: Паскуаль Авеллана Хайме, Маулен Каселлас Давід, Карганіко Джермано, Паломер Бенет Альберт, Гарсія Перес Ма Луіса
Формула / Реферат
1. Сполука формули (І)
(I),
де
А - атом оксигену чи сульфуру або метиленова група;
В - а) злитий з бензольним кільцем гетероцикл
,
де
U - атом оксигену чи сульфуру або група NR5, в якій R5 - гідроген чи С1-4алкіл, як варіант, R5 може бути заміщено замісником, що містить А, коли цей замісник приєднано до злитого з бензольним кільцем гетероциклу у положенні 1;
Z-Y - два з'єднані разом простим чи подвійним зв'язком атоми карбону;
Т - простий зв'язок, метиленова чи карбонільна група;
і де:
замісник, що містить А, приєднано до будь-якого з можливих положень 1, 2, 3 чи 4 злитого з бензольним кільцем гетероциклу;
замісник, що містить С, приєднано до положень 6 чи 7 злитого з бензольним кільцем гетероциклу;
б) феніл
,
де замісник, що містить С, приєднано до положень 3, 4 чи 5;
С - бірадикал, який представлено:
а) коли В - злитий з бензольним кільцем гетероцикл, групами -CONR7-, -CSNR7-, -SO2NR7-, -СН2О-, -СН=СН-, в яких R7 - гідроген чи метил;
б) коли B - феніл, групами –SO2NR7-, -СН2О-, -СН=СН-, де R7 - гідроген чи метил;
D - 5-тетразоліл або група -COOR8, де R8 - гідроген чи С1-4алкіл, або фенілалкіл з менше, ніж 10 атомами карбону;
R1, R2, R3, R4 та R6, незалежно один від одного - гідроген, галоген, С1-4алкіл, -ОСН3 або -ОН;
m та n = 0-4,
а також її сольвати, фармацевтично прийнятні солі, усі можливі стереоізомери та їх суміші.
2. Сполука за п. 1, яка відрізняється тим, що R1 та R2 - гідроген, флуор чи хлор, а D - 5-тетразоліл або група -COOR8, де R8 - гідроген, метил, етил чи бензил.
3. Сполука за будь-яким з п. 1 або 2, яка відрізняється тим, що В - злитий з бензольним кільцем гетероцикл
,
а С - групи -CONR7- або -СН=СН-.
4. Сполука за п. 3, яка відрізняється тим, що R3 - гідроген чи метил, a U - група NR5, в якій R5 - гідроген чи метил, чи може бути заміщений замісником, що містить А.
5. Сполука за п. 3, яка відрізняється тим, що R3 - гідроген, R4 - гідроген, флуор, хлор, метил чи метоксил, а U - атом оксигену.
6. Сполука за п. 3, яка відрізняється тим, що замісник, який включає С, приєднано у положенні 6 до центрального злитого з бензольним кільцем гетероциклу.
7. Сполука за будь-яким з п. 4 або 6, яка відрізняється тим, що Т - простий зв'язок чи карбонільна група, Z-Y – група -СН=СН-, а замісник, що включає А, приєднано до центрального злитого з бензольним кільцем гетероциклу у позиції 1 чи 2.
8. Сполука за будь-яким з п. 5 або 6, яка відрізняється тим, що замісник, який включає А, приєднано до центрального злитого з бензольним кільцем гетероциклу у позиції 2.
9. Сполука за будь-яким з пп. 3 - 8, яка відрізняється тим, що m та n дорівнюють 1 - 2.
10. Сполука за будь-яким з п. 1 або 2, яка відрізняється тим, що В – заміщений феніл
,
а С - групи -СН=СН-, -СН2О- або -SO2NR7-, де R7 - гідроген чи метил.
11. Сполука за п. 10, яка відрізняється тим, що замісники, які включають А та С, приєднано до фенільної групи у параположенні один відносно одного.
12. Сполука за будь-яким з п. 10 або 11, яка відрізняється тим, що R6 - гідроген, флуор, хлор, метил чи метоксил, n = 0, А - атом оксигену чи сульфуру, a m = 3-5.
13. Сполука за п. 1, яка відрізняється тим, що її вибрано з нижченаведених:
8-[2-(бензилоксиметил)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(бензилоксиметил)хроман-6-карбоксамід; 8-[2-(3-фенілпропіл)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)хроман-6-карбоксамід; 8-[2-(бензилоксиметил)бензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-(2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамід; 8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід; 8-(2-бензилтіометил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксамід; 8-[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-6-флуор-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-1-(4-фенілбутил)-3-метиліндол-5-карбоксамід; 8-[[4-(4-фенілбутокси)феніл]метилокси]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[[4-(4-фенілбутокси)феніл]сульфоніламіно]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[4-(4-флуорфенілбутокси)феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-(4-фенілбутокси)-2-флуорфеніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-хлорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-метилфеніл)бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(E)-2-[4-[4-(4-мeтoкcифeнiл)бутокси]фeнiл]eтeн-1-iл]-4-oкco-2-(5-1H-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-[4-(ізопропіл)феніл]бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-[4-(т-бутил)феніл]бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-хлорфеніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-флуорфеніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-метилфеніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-метоксифеніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-[4-(ізопропіл)феніл]пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-[4-(т-бутил)феніл]пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран.
14. Сполука за будь-яким з пп. 1-12, яка відрізняється тим, що вона придатна для виготовлення лікувальних засобів при терапевтичному лікуванні лейкотрієн-опосередкованих захворювань.
15. Сполука за п. 14, яка відрізняється тим, що лейкотриєнопосередковані захворювання є запальними чи алергічними.
16. Сполука за п. 15, яка відрізняється тим, що запальними чи алергічними захворюваннями є алергічні риніти, бронхіальна астма, алергічні кон'юнктивіти, ревматоїдні артрити, остеоартрити, тендиніти, бурсити або псоріаз.
17. Сполука за п. 14, яка відрізняється тим, що лейкотриєнопосередковані захворювання є серцево-судинними.
18. Сполука за п. 17, яка відрізняється тим, що серцево-судинними захворюваннями є серцева ішемія, інфаркт міокарду, коронарний спазм, серцева анафілаксія, церебральна водянка та ендотоксичний шок.
19. Спосіб одержання сполук загальної формули (І) за п. 1, а також їх фармацевтично прийнятних солей, згідно з яким:
коли у загальній формулі (І) D - COOR8, вихідна сполука загальної формули (II)
(II),
де R1, R2, А, В, С, m та n визначені вище, реагує з промисловою сполукою формули (III)
(III),
де R9 - залишок R8, за винятком гідрогену, у присутності основи з утворенням сполуки формули (IV)
(IV),
яку піддають кислотній обробці з утворенням сполуки формули (V)
(V),
яка збігається з формулою (І), коли D - COOR8, або, коли у формулі (І) D - СООН, її перетворюють в формулу (І) видаленням групи R9 лужним гідролізом, за необхідністю сполуку загальної формули (І) перетворюють у бажану сіль обробкою основою чи придатним іонообмінником звичайними способами.
20. Спосіб одержання сполук загальної формули (І) за п. 1, а також їх фармацевтично прийнятних солей, згідно з яким:
коли у загальній формулі (І) D - 5-тетразоліл, сполука формули (VI)
(VI),
де R1, R2, А, В, С, m та n визначені вище, реагує з азидом натрію з утворенням сполуки формули (VII)
(VII),
яка збігається з формулою (I), коли D - 5-тетразоліл.
21. Спосіб одержання сполук загальної формули (І) за п. 1, а також їх фармацевтично прийнятних солей, згідно з яким:
коли у загальній формулі (I) С - -CO-NR7, сполука формули (VIII)
(VIII),
де R1, А, В, m та n визначені вище, реагує зі сполукою формули (IX)
(IX),
де R2 та R7 визначені вище, а Е збігається з D в формулі (І), коли D - COOR8, а коли у формулі (I) D - СООН, Е містить придатну групу, що протектує карбоксильну, реакцію проводять, одержавши спочатку хлорангідрид сполуки формули (VIII) звичайним способом з наступною взаємодією її зі сполукою формули (IX) у присутності основи з одержанням сполуки формули (X)
,(X)
яка збігається з формулою (І), коли у формулі (І) С - -CO-NR7-, або її перетворюють в формулу (I), де С - -СО-NR7-, видаленням будь-якої СООН-протектуючої групи, що присутня в Е.
22. Спосіб одержання сполук загальної формули (І) за п. 1, а також їх фармацевтично прийнятних солей, згідно з яким:
коли у загальній формулі (I), в якій С - -CH2O-, вихідна сполука формули (XI)
(XI),
де R1, А, В, m та n визначені вище, а Х - атом хлору чи брому або алкіл- чи арилсульфонатна група, реагує зі сполукою формули (XII)
(XII),
де R2 та Е визначені вище, у присутності основи з одержанням сполуки формули (XIII)
(XIII),
яка збігається з формулою (I), коли С - -СН2О-, або її перетворюють в формулу (І), де С - -СН2О-, видаленням будь-якої СООН-протектуючої групи, що присутня в Е.
23. Спосіб одержання сполук загальної формули (І) за п. 1, а також їх фармацевтично прийнятних солей, згідно з яким:
коли у загальній формулі (I) С - -SO2NR7-, a A - оксиген чи сульфур, сполука формули (XIV)
(XIV),
де R2, R7, В, E та n визначені вище, а А - оксиген чи сульфур, реагує зі сполукою формули (XV)
(XV),
де R1, X, та m визначені вище, у присутності основи з одержанням сполуки формули (XVI)
(XVI),
яка збігається з формулою (І), коли у формулі (І) С - -SO2NR7-, a A - оксиген чи сульфур, або її перетворюють в формулу (І), де С - -SO2NR7-, a A - оксиген чи сульфур, видаленням будь-якої СООН-протектуючої групи, що присутня в Е.
Текст
Згідно з винаходом запропоновано похідні бензопірану, їх фармацевтично прийнятні солі та сольвати, що виявляють антагоністичну активність відносно лейкотрієну, а також спосіб виготовлення цих похідних та спосіб їх терапевтичного застосування. Добре відомо, що більшість ейкозаноїдів, простагландинів, лейкотрієнів та споріднених сполук походять з жирної кислоти з 20 атомами карбону та 4 ненасиченими зв'язками у ланцюгу - арахідонової (АК), яка докорінно естерифікує у 2-положенні гідроксил гліцерину з фосфоліпідів клітинних мембран, з яких вона вивільняється під дією ліпази, фосфоліпази А2 (ФЛА2) ("CRC Handbook of Eicosanoids fnd Relative Lipids" vol. 2, Ed. A.L. Willis, CRS Press Inc., Florida (1989)). Після вивільнення АК метаболізується у ссавців головним чином двома різними шляхами або ферментними системами. Під дією циклооксигенази вона утворює простагландини та тромбоксани, з яких найважливіші PGE2 та ТхА2 , які безпосередньо включено при запаленнях (Higgs et ak. Annals of Clinical Research 16, 287, (1984)). Під дією ліпоксигенази вона утворює лейкотрієни, з яких найважливіший LTB4, та пептид-лейкотрієни LTC4, LTD4 та LTE4 . Всі вони також включені у реакції запалення, виявляючи хемотактичну активність, стимулюючи секрецію лізоцимних ферментів та граючи важливу роль при безпосередніх реакціях гіперчутливості (Bailey and Casey, Ann. Rep. Med. Chem., 17 203 (1982)). Лейкотрієн LTB4 є сильним хемотактичним агентом, який промотує інфільтрацію лейкоцитів та їх наступну грануляцію (Salmon et al., Prog. Drug. Res., 37 9 (1991)). Добре відомо, що LTC4 та LTD4 сильно впливають на стягування бронхів людини (Dahlen et al., Nature, 288 484 (1980)), призводячи до звуження дихальних шляхі в при запаленнях та вироблення слизу (Marom et al., Am. Rev. Resp. Dis., 126 449 (1982)), отже, вони задіяні у патогенезі бронхіальної астми, хронічних бронхітів, алергічних ринітів то що. Пептид-лейкотрієни також призводять до транссудації крові, викликаної зростанням проникності судин (Camp et al., Br. J. Pharmacol., 80 497 (1983)), вони також включені у деякі такі запальні хвороби, як атопічна екзема та псоріаз. З іншого боку, спостерігали деякі впливи пептид-лейкотрієнів на серцево-судинну систему людини; їх, головним чином, включено до патогенезу ішемічної кардіопатії. Таке відношення підтверджують факти, що коронарні артерії здатні виробляти ці медіатори (Piomelli et at., J. CІіn.Res., 33 521А (1985)). Ці впливи разом з сильними скороченнями, що спостерігають у тканині серця, викликаними LTC4 та LTD4, підтверджують, що ці медіатори можуть призводити до таких інших серцево-судинних розладів, як коронарний спазм, серцева анафілаксія, церебральна водянка та ендотоксичний шок. З ви щесказаного ясно, що регуляція біологічної активності лейкотрієнів сполуками, що інгібують їх вивільнення або є їх антагоністами, є новим функціональним підходом до попередження, пом'якшення або поліпшення різних алергічних, анафілактичних, запальних та тромботичних станів, в яких приймають участь такі медіатори. У літературі описано деякі сполуки, що можна вважати, структурно подібними сполукам згідно з винаходом, а крім того, які мають інгібуючий вплив на лейкотрієни. Toda et al. (ЕР 173516) описали N-[4оксо-2-(1Н-5-тетразолт)-4Н-1-бензопіран-8-іл]-4-і(4-фенілбутокси)бензамід та його похідні як сильні антагоністи лейкотрієнів. Усі ці похідні мають амідну чи тіоамідну групи у молекулах в якості містка між ліпофільним угруп уванням та карбоциклом, що включає кислотне угрупування. Отже, сполуки, розкриті у цьому винаході, окрім інших функціональних груп та містків між іншими ліофільними та полярними угр уповуваннями можуть включати аміди, а в інших випадках такі похідні не включено у загальну формулу патенту Toda et al. З іншого боку, похідні згідно з винаходом мають як перевагу дуже високу біоактивність при пероральному вживанні внаслідок їх метаболічної та хімічної стабільності. З іншого боку Huang F.C. et al. (патенти США 4977162 та 5082849) описують 4-оксю-7-[[3-(2хінолінметокси)феніл]метокси]-2-(1Н-5-тетразоліл)-4Н-1-бензпіран та його похідні як потенційні лейкотреїнові антагоністи. Всі ці сполуки є похідними хіноліну, що включають етери, тіоетери, сульфоксиди, сульфони, аміди, кетони, вінілени та аміни як містки між хромановим або еквівалентним гетероциклом з кислотною функцією та хіноліновмісним ліпофільним угруп уванням. Отже, такі сполуки відрізняються від сполук згідно з винаходом, оскільки у загальну формулу їх включено хінолін, який не представлено у загальній формулі сполук згідно з винаходом та у формулі винаходу. Однак, одержання сполук з високою антагоністичною активністю до лейкотрієнів та гарною біоактивністю при пероральному застосуванні є поки що нерозв’язаною проблемою для відомих зараз антагоністів. Згідно з винаходом запропоновано серію нових сполук, що виявляють вищезгадану антагоністичну дію та гарне засвоєння при пероральному застосуванні і корисні у терапії. Згідно з винаходом запропоновано нові похідні бензопірану загальної формули І де А - атом оксигену чи сульфур у або метиленова група; В - а) бензозлитий гетероцикл де U - атом оксигену чи сульфур у або група NR5, в якій R5 - гідроген чи С1-4алкіл, як варіант, R5 може бути заміщено замісником, що містить А, коли цей замісник приєднано до бензозлитого гетероциклу у положенні 1; Z-Y - два з'єднані разом простим чи подвійним зв'язком атоми карбону; Τ - простий зв'язок, метиленова чи карбонільна група; і де: замісник, що містить А, приєднано до будь-якого з можливих положень 1, 2, 3 чи 4 бензозлитого гетероциклу; замісник, що містить С, приєднано до положень 6 чи 7 бензозлитого гетероциклу; б) феніл де замісник, що містить С, приєднано до положень 3, 4 чи 5; С - бірадикал, який представлено: а) коли В - бензозлитий гетероцикл, групами -CONR7-, -CSNR7-, -SO2NR7-, -СН2О-, -СН=СН-, в яких R7 гідроген чи метил; б) коли С - феніл, групами -SO2NR7-, -СН2О-, -СН=СН-, де R7 - гідроген чи метил; D - 5-тетразоліл або група -COOR8, де R8 - гідроген чи С 1-4алкіл, або феніл алкіл з менше, ніж 10 атомами карбону; R1, R2, R3, R 4 та R6 , незалежно один від одного - гідроген, галоген, С1-4алкіл, -ОСН3 або -ОН; m та n=1-4. Згідно з винаходом також запропоновано спосіб виготовлення похідних бензопірану, а також їх використання у терапії. До рамок винаходу також включено сольвати та фармацевтично прийнятні солі сполук формули і, особливо солі формули Іа де М+ - катіон лужного металу, наприклад, натрію чи калію, або частка катіона лужно-земельного металу, наприклад, 1/2(кальцію чи магнію) але похідний від амінів чи амонію катіон, наприклад, етаноламоній, діетаноламоній, тріетаноламоній, трис(гідроксиметил)метиламоній. Сполуки формули І можуть мати один чи більше асиметричних атомів карбону у своїй стр уктурі. Винахід включає усі можливі стереоізомери, а також їх суміші. В кращих сполуках R1, R2 - гідроген, флуор чи хлор, a D - 5-тетразоліл або група -GOOR8, де R8 гідроген, метил, етил чи бензил. В кращих сполуках також В - бензозлитий гетероцикл, а С - групи -CONR 7- або -СН=СН-. В інших кращи х сполуках формули і В - феніл, а С - групи -SO 2NR7-, -СН2О- або -СН=СН-. В найкращих сполуках R3 - гідроген чи метил, а С - групи -CONR7- або –СН = СН-, m та n=1-2, В бензозлитий гетероцикл, в якому Ζ-Υ - два з'єднані разом подвійним зв'язком атоми карбону, Τ - простий зв'язок чи карбонільна група, U - група NR5, в якій R5 - гідроген чи метил, або R5 може бути заміщено замісником, що містить А, і де замісник, що включає С, приєднано у положенні 6 до бензозлитого гетероциклу, а замісник, що включає А, приєднано до бензозлитого гетероциклу у положенні 1 чи 2. В найкращих сполуках формули І також R3 - гідроген, R4 - гідроген, флуор, хлор, метил чи метоксил, С групи -CONR7- або -СН=СН -, m та n=1-2, В - бензозлитий гетероцикл, в якому Ζ-Υ - два з'єднані разом простим чи подвійним зв'язком атоми карбону, Τ - простий зв'язок чи метиленова група, U - атом оксигену, і де замісник, що включає С, приєднано у положенні 6 до бензозлитого гетероциклу, а замісник, що включає А, приєднано до бензозлитого гетероциклу у положенні 2 згідно з вищенаведеною нумерацією. В найкращих сполуках загальної формули І також С - групи -CONR7- або -СН=СН -, n=0, m=3-5, а В феніл, в якому замісники, що містять А та С, приєднано до фенілу у відповідному відносному параположенні. Найкращі сполуки формули І згідно з винаходом включають: 8-[2-(бензилоксиметил)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-okco-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(бензилоксиметил)хроман-6-карбоксамід; 8-[2-(3-фенілпропіл)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)хроман-6-карбоксамід; 8-[2-(бензилоксиметил)бензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-(2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-бензилоксиметил-2,3-дигідробензофуран-5карбоксамід; 8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3-дигідробензофуран-5карбоксамід; 8-(2-бензилтіометил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(4'-флуорбензилоксиметил)-2,3дигідробензофуран-5-карбоксамід; 8-[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота; 8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-6-флуор-4-оксо-4Н-1-бензопіран-2карбонова кислота; 8-[4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота; 8-[6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота; N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-1-(4-фенілбутил)-3-метиліндол-5-карбоксамід; 8-[[4-(4-фенілбутокси)феніл]метилокси]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[[4-(4-фенілбутокси)феніл]сульфоніламіно]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-флуор феніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[4-(4-флуорфенілбутокси)феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-(4-фенілбутокси)-2-флуорфеніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота; 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2карбонова кислота; 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-хлорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-метилфеніл)бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензоліран; 8-[(Е)-2-[4-[4-(4-метоксифеніл)бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-[4-(ізопропіл)феніл]бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-{{Е)-2-[4-[4-[4-(т-бутил)феніл]бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-хлорфеніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-флуор феніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[{Е)-2-[4-[4-(4-метилфеніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-(4-метоксифеніл)пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-[4-(ізопропіл)феніл]пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; 8-[(Е)-2-[4-[4-[4-(т-бутил)феніл]пропілокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопіран; а також як естери карбонових кислот, описані у прикладах. Згідно з винаходом сполуки загальної формули І отримують за одним з нижченаведених способів: а) коли у загальній формулі D - COOR 8, вихідна сполука формули II де R1, R2. А, В, С m та n позначено вище, реагує з промисловою сполукою III де R9 - залишок R8, за винятком гідрогена, у присутності такого алкоксиду, як метоксид чи етоксид натрію, у такому придатному розчиннику, як спирт, з якого утворена відповідна основа, етиловий етер, тетрагідрофуран або їх суміш, при температурі 50-85°С протягом 3-18 годин. Утворену сполуку IV піддають обробці концентрованою чи розведеною соляною кислотою у такому придатному розчиннику, як етанол, метанол, тетрагідрофуран чи їх суміш, при температурі від 25°С до кипіння розчинника протягом 1-24 годин з утворенням сполуки V яка збігається з І, коли D - COOR 8, а коли у формулі І D - СООН, її перетворюють в І видаленням групи R9 лужним гідролізом обробкою такою придатною основою, як гідроксид літію, натрію чи калію у водному розчині, у такому придатному органічному розчині, як метанол, етанол, тетрагідрофуран, при температурі від 0°С до кипіння розчинника протягом 0,5-18 годин. б) коли у загальній формулі D - 5-тетразоліл, вихідна сполука формули VI де R1, R2, А, В, С, m та n позначено вище, реагує з азидом натрію у присутності такої м'якої кислоти, як хлорид амонію чи піридинію, у такому придатному розчиннику, як Ν,Ν-диметилформамід, при температурі від 25°С до кипіння розчинника протягом 1-24 годин з утворенням сполуки VII яка збігається з І, коли D - 5-тетразапіл, в) за альтернативним способом виготовлення сполуки загальної формули І, в якій С - -CO-NR7, вихідна сполука VIII де R1, А, В, m та n позначено вище, реагує зі сполукою IX де R2 та R7 позначено вище, а Е збігається з D в І, коли D - COOR8, а коли у формулі І D - СООН, Ε містить придатну групу, що протектує карбоксильну, наприклад, метиловий, етиловий чи бензиловий естер. Реакцію між VIII та IX проводять, виготовивши спочатку хлорангідрид сполуки VIII при надлишку оксалілхлориду, при температурі 50-80°С протягом 0,5-1,5 годин з наступною взаємодією зі сполукою IX у присутності такої основи, як тріетиламін, 4-диметиламінопіридин або піридин, у такому придатному апротонному розчиннику, як хлороформ, метиленхлорид або Ν,Ν-диметилформамід при температурі 040°С протягом 3-24 годин. Отримана сполука X збігається з І, коли у формулі І С - -CO-NR7-, або її перетворюють в І, де С - -СО-NR7-, видаленням будь-якої СООН-протектуючої гр упи, що присутня в Е, отже, коли Ε - наприклад, метиловий чи етиловий естер, її можна видалити лужним гідролізом, як вищеописано для сполуки І, в якій D - СООН, починаючи з V. г) за способом виготовлення сполуки загальної формули І, в якій С - -СН2О-, вихідна сполука формули XI де R1, А, В, m та n позначено вище, а X - атом хлору чи брому або алкіл- чи арилсульфонатна група, реагує зі сполукою XII де R2 та Ε позначено вище, у присутності такої основи, як гідроксид, апкоксид або карбонат металу, у такому придатному розчиннику, як етанол, метанол або Ν,Ν-диметилформамід при 25-80°С протягом 5-48 годин. Отримана сполука XIII збігається з І, коли у формулі І С - -СН2О-, або її перетворюють в І, де С - -СН2О-, видаленням будь-якої СООН-протектуючої групи, що присутня в Е, отже, коли Ε -наприклад, метиловий чи етиловий естер, її можна видалити лужним гідролізом, як вищеописано для виготовлення сполуки І, в якій D - СООН, починаючи з V. д) за способом виготовлення сполуки загальної формули І, в якій С - -SO2NR7-, а А – оксиген чи сульфур, ви хідна сполука формули XIV де R2, R7, Β, Ε та n позначено вище, а А - оксиген чи сульфур, реагує з XV де R1, X, та m позначено вище. Реакцію між XIV та XV проводять, виготовивши спочатку сіль реакцією XIV з такою придатною для рКа спирту чи тіолу основою, як гідрид, гідроксид, алкоксид або карбонат металу, у такому придатному розчиннику, як тетрагідрофуран або Ν,Ν-диметилформамід при 25-80°С протягом 2-18 годин. Отримана сполука XVI збігається з І, коли у формулі І С - -SC2NR7-, a A - оксиген чи сульфур, або її перетворюють в І, де С - SO2NR7-, a A - оксиген чи сульфур, видаленням будь-якої СООН-протектуючої гр упи, що присутня в Е, отже, коли Ε - наприклад, метиловий чи етиловий естер, її можна видалити лужним гідролізом, як вищеописано для виготовлення сполуки І, в якій D - СООН, починаючи з V. е) сполуку загальної формули І, в якій С - -CSNR7-, виготовляють зі сполуки формули І, в якій А - CONR7-, обробкою реагентом Лоуссона в умовах, описаних у літературі (Clausen et aІ., Tetrahedron, 37 3635 (1981)). За бажанням мати конкретну сіль загальної формули І сполуку І можна обробити придатною для цього основою чи іонообмінником звичайними способами. Отже, наприклад, І можна обробити гідроксидом натрію або трис(гідроксиметил)метиламіном у такому придатному розчиннику, як суміш води з метанолом чи етанодам протягом 15хв.-2 годин між 25°С та температурою кипіння розчинника. Вихідну речовину формули VI можна отримати, починаючи зі сполуки формули V, способом, описаним схемою 1. В цій послідовності сполуку VI можна отримати дегідратуванням карбоксаміду XVII, · наприклад, оксохлоридом фосфору, у такому розчиннику, як Ν,Ν-диметилформамід при 0-50°С протягом 3-24 годин (стадія 2). Карбоксамід XVII можна отримати амінолізом естеру V, наприклад, обробкою газуватим аміаком у такому придатному розчиннику, як метанол, етанол, тетрагідрофуран чи їх суміш при -30-25°С протягом 0,25-24 годин (стадія 1). Вихідну сполуку формули ІІа, тобто загальної формули II, в якій С - -CONR7-, можна отримати, наприклад, реакцією сполуки VIII зі сполукою XVIII де R2 та R7 визначено вище, а далі способом, описаним для виготовлення сполуки X, виходячи з VIII та IX. Вихідну сполук у формули ІІб, тобто загальної формули II, в якій С - -СН=СН -, можна отримати, наприклад, способом, показаним схемою 2. В цій послідовності вихідну сполуку XX можна отримати, наприклад, реакцією Віттіга між сполукою ХІХ та промисловим метилсульфонатом у присутності такої придатної основи, як бутиллітій, амід натрію або біс(триметилсиліл)амід літію у такому інертному розчиннику, як тетрагідрофуран чи етиловий етер при 025°С протягом 0,75-36 годин (стадія 3). Сполуку формули ІІб можна отримати реакцією сполуки XX зі сполукою XXI у загальних умовах для реакцій приєднання олефінів, які каталізуються комплексами паладію(0) (реакція Хека). Далі, реакцію між XX та XXI проводять у присутності ацетату паладію(ІІ) та тріетиламіну у присутності такого розчинника, як ацетонітрил при його температурі кипіння протягом 10-48 годин (стадія 4). Вихідну сполуку VІlla, тобто формули VIII, в якій В - бензозлитий гетероцикл де R3, R4 Y-Z та Τ визначено вище, U – оксиген чи сульфур, а -СООН приєднано до бензольного кільця у пара-положенні до U, можна отримати, наприклад поминаючи зі сполуки XXII, де R 3, R4 Υ-Ζ, n та Τ визначено вище, a G - гідроген, хлор, бром, або група -COOR9, де R9 визначено вище, а потім будь-яким способом синтезу, представленим схемою 3. В цій послідовності сполуку XXV, в якій А - оксиген, a R1, R3, R4, Y-Z, G, Т, m та n визначено вище, a U оксиген чи сульфур, отримують, наприклад, піддаючи сполуку XXII дії такої основи, як гідрид натрію чи калію, а потім реакцією зі сполукою XXIV, яка виробляється промислово чи її легко синтезувати, в якій R1 визначено вище, а М, коли А оксиген, - хлор чи бром, або алкіл- чи арилсульфонатна група, у такому придатному органічному розчиннику, як бензол, тетрагідрофуран або Ν,Ν-диметилформамід при 0-25°С протягом 3-24 годин (стадія 6). Сполуку XXV, в якій А - сульфур, отримують, наприклад, реакцією сполуки XXIII в якій R3, R4, G та n визначено вище, а ТfO - трифлуорметансульфонатна група, зі сполукою XXIV, в якій Μ - група SH (тіол) і яка виробляється промислово чи її легко синтезувати, у присутності такої основи, як гідроксид калію чи метоксид або етоксид натрію, у такому придатному розчиннику, як етанол, метанол, диметилсульфоксид або Ν,Ν-диметилформамід при 0-25°С протягом 4-24 годин (стадія 7). Сполуку XXV, в якій А - метиленова група, отримують реакцією сполуки XXIII в якій R3, R4, G та n визначено вище, зі сполукою XXIV, в якій Μ - група MgBr, у присутності каталітичної кількості солі купруму(І) у такому придатному розчиннику, як етиловий етер або тетрагідрофуран при температурі від 0°С до кипіння розчинника протягом 2-24 годин (стадія 7). Сполуку XXIV, в якій Μ - гр упа MgBr, легко синтезувати з промислового броміду та магнію способом отримання реактиву Грин'яру. Сполуку XXIII отримують зі сполуки XXII реакцією з трифлуорметансульфоновим ангідридом у присутності піридину чи тріетиламіну у метиленхлориді при -10-25°С протягом 4-24 годин (стадія 5). Сполуку Vllla отримують зі сполуки XXV, в якій G - COOR9, (стадія 8) лужним гідролізом, як при виготовленні І, в якому D - СООН, з V. Сполуку Vllla можна отримати зі сполуки XXV, в якій G - гідроген, реакцією Вілсмейера-Хаака, а потім окисненням отриманого альдегіду XXVI до карбонової кислоти, наприклад, реактивом Джонса. Сполуку XXVI отримують зі сполуки XXV реакцією з оксихлоридом фосфору у Ν,Ν-диметилформаміді або Nметилформаміді при 25-100°С протягом 1-24 годин (стадія 9). Обробкою XXVI тріоксидом хрому у присутності сульфатної кислоти та води у такому придатному розчиннику, як ацетон при 0-25°С протягом 424 годин можна отримати сполуку VІlla (стадія 10). Сполуку VІlla можна також отримати зі сполуки XXV, в якій G - хлор чи бром, заміщенням галогену нітрильною групою реакцією Розенмунда-Ван Брауна, а потім гідролізом нітрилу до карбонової кислоти. Сполуку XXVII отримують зі сполуки XXV, в якій G - хлор чи бром, та ціаніду купруму(І) у такому придатному висококиплячому розчиннику, як N-метилпіролідон при 150-230°С протягом 2-18 годин (стадія 11). Сполуку XXVII, в якій А - оксиген, інакше отримують, змінюючи порядок стадій 6 та 11. Наприкінці, сполуку VІlla можна отримати зі сполуки XXVII лужним гідролізом у присутності гідроксиду натрію чи калію у такому придатному розчиннику, як етанол, діоксан або тетрагідрофуран при температурі від 25°С до кипіння розчинника протягом 2-24 годин (стадія12). Вихідну сполуку формули Vlllb тобто загальної формули VIII, в якій В - бензозлитий гетероцикл a R3, R4, Y-Z та Τ визначено вище, U - оксиген чи сульфур, а гр упа СООН приєднана до бензозлитого гетероциклу у положенні 7, отримують, наприклад, зі сполуки XXVIII в якій G - хлор чи бром, а потім синтезом, описаним для виготовлення VІlla, виходячи з XXV згідно зі стадіями 11 та 12. Сполуку XXVIII можна отримати зі сполуки XXIX, в якій R3, R4, Y-Z, Τ та n визначено вище, U - оксиген чи сульфур, a G - хлор чи бром, одним з синтезів, описаних для виготовлення XXV, виходячи з XXII. Вихідну сполуку формули Vlllc, тобто загальної формули VIII, в якій В - бензозлитий гетероцикл U - атом нітрогену, заміщений групами, в яких А і Τ - простий зв'язок, Υ-Ζ - -СН=СН-, R1, R3 , R4 , A, m та n визначено вище, a R3 – С1-4алкіл, який приєднано до гетероциклу у положенні 3, отримують, наприклад, послідовністю синтезів наведених схемою 4. в якій сполуку XXXI можна отримати естерифікацією промислової сполуки XXX (стадія 13). Починаючи з XXXI сполуку XXXII можна отримати (стадія 14) формілуван-ням реакцією Вілсмейера-Хаака. Сполуку XXXIV можна отримати N-алкілуванням сполуки XXXII сполукою XXXIII, яка виробляється промислово чи її легко синтезувати, в якій Q - така гарна здатна до відщеплення група, як хлор чи бром, або алкіл- чи арилсульфонатна, у присутності такої основи, як т-бутоксид калію, у такому придатному розчиннику, як Ν,Ν-диметилформамід при 25-100°С протягом 4-24 годин (стадія 15). Сполуку XXXV, в якій R3 - метил, отримують відновленням формільної групи сполуки XXXIV (стадія 16). Вказане перетворення можна провести, наприклад, з ціаноборогідридом натрію у присутності йодиду цинку у придатному розчиннику при 25-90°С протягом 1-18 годин. Сполуку XXXV, в якій R3 – С1-4алкіл, який не є метилом, отримують реакцією Віттіга з придатною сіллю фосфонію, а потім відновленням отриманого олефіну гідрогенолізом в атмосфері водню у присутності паладійового каталізатору у придатному розчиннику (стадія 16). Сполуку Vlllc можна отримати, починаючи з XXXV (стадія 17), лужним гідролізом, як при виготовленні сполуки І, в якій D - СООН, починаючи з V. Вихідну сполуку формули Vllld, тобто загальної формули VIII, в якій В - бензозлитий гетероцикл де U - група NR5, Τ - карбонільнагрупа, а Υ-Ζ - -СН=СН-, R3 - гідроген, R5 – С1-4алкіл, a R1, R2, X, m та n визначено вище, можна отримати за схемою синтезу 5. В цій послідовності реакцій сполуку XXXVI можна легко отримати реакцією промислової кислоти Мелдрума з сульфідом карбону, а потім метилуванням метиліодидом згідно зі способом, описаним у літературі. Сполуку XXXVIII можна легко отримати реакцією сполуки XXXVI з реактивом Грин'яра XXXVII, виготовленим, починаючи з відповідного броміду способом, прийнятим для виготовлення магнійорганічних сполук, згідно з описаним способом виготовлення XXV з А=СН 2, починаючи з XXIII (стадія 18). Реакцією XXXVIII зі сполукою XXXIX можна виготовити 4-хінолін XL (стадія 19). Сполуку XU отримують Nалкілуванням сполуки XL у присутності такої придатної основи, як гідрид натрію чи калію у такому придатному розчиннику, як Ν,Ν-диметилформамід чи бензол при 0-100°С протягом 4-24 годин (стадія 20). Лужним гідролізом сполуки XLI вищеописаним, наприклад, при виготовленні І з D=COOH, починаючи з V, способом, можна виготовити сполуку VIlld (стадія 21). Вихідну сполуку формули Vllle, тобто загальної формули VIII, в якій В - феніл, який заміщено у будь-якому з вільних положень R 6, можна отримати з промислової, або її легко синтезувати, сполуки XLII. де R6 та n визначено вище, а К може бути G або формілом (К=СНО ), одним з використаних для виготовлення VІlla, починаючи з XXII, способів синтезу. Конкретніше, коли n=0, сполуку Vllle можна виготовити двостадійним способом. Перша стадія включає реакцію промислової, або її легко синтезувати, сполуки XLII, в якій n=0, a k=COOR 9, зі сполукою XXIV, в якій М=ОН , у загальних умовах реакції Міцунобу; тобто реакцією XLII (в якій n=0) з XXIV (в якій М=ОН ) у присутності діетилазодикарбоксилату та три фенілфосфіну у такому придатному розчиннику, як тетрагідрофуран, при кімнатній температурі протягом 24-72 годин. Інакше, замість реакції Міцунобу можна провести О-алкілування реакцією Уільямсона, піддаючи сполуку XLII, в якій n=0, a k=COOR9, дії такої основи, як гідроксид чи карбонат металу, а потім реакцією з XXIV, в якій Μ - хлор чи бром, або алкіл- чи арилсульфонатна група, у такому придатному розчиннику, як Ν,Ν-диметилформамід при 0-100°С протягом 2-24 годин. В другій стадії сполуку Vllle отримують гідролізом отриманого у попередній стадії естеру описаним способом виготовлення І, в якій D=COOH, виходячи з V. Вихідні сполуки XI та XIX можна отримати способом, що наведено схемою 6. В цій послідовності реакцій сполуку XLIII можна отримати відновленням сполуки VIII, наприклад, алюмогідридом літію або бораном у такому інертному розчиннику, як етиловий етер чи тетрагідрофуран при температурі від 25°С до кипіння розчинника протягом 2-24 годин (стадія 22). Сполуку XI, в якій X - алкілчи арилсульфонатна група, виготовляють, ви ходячи зі сполуки XLIII, реакцією з алкіл- чи арилсульфонатхлоридом, наприклад мезил- чи тозилхлоримом, використовуючи як розчинник піридин, або у присутності тріетиламіну у такому придатному розчиннику, як хлороформ чи дихлорметан при -20-25°С протягом 8-24 годин (стадія 23). Сполуку XIX можна отримати оксидуванням сполуки XLIII широко описаним у лі тературі способом, наприклад, реакцією з хлорхроматом піридинію чи діоксидом мангану у такому інертному розчиннику, як дихлорметан при кімнатній температурі протягом 2-24 годин (стадія 24). Інакше сполуку XIX, в якій А - оксиген, можна отримати реакцією XLII, в якій Ζ - СНО (форміл), зі сполукою XXIV, описаним способом виготовлення Vllle, з XXIV та ХLII. Вихідну сполуку XL VII, тобто загальної формули XIV, в якій Ε - COOR9, можна виготовити способом синтезу, наведеним на схемі 7. В цій послідовності реакцій сполука XLIV, в якій В та N позначено вище, А - оксиген чи сульфур, a R10 придатна гідроксил- чи або тіол-протектуюча група, наприклад, коли В - феніл, n=0, a R10 може бути метилом, реагує зі сполукою XVIII (стадія 26). Відщеплення протектуючої гр упи R10 з XLVI (стадія 27) дає сполуку XLVII. Коли В - феніл, n=0, a R 10 метил, вказане перетворення здійснюють обробкою трибромідом бору у такому розчиннику, як етиловий етер чи дихлорметан протягом4-24 годин при температурі від -40°С до кімнатної. Вихідну сполуку XLIV, коли вона не є промисловою, можна виготовити з промислових сполук звичайними способами синтезу. Наприклад, хлорсульфонільну груп у можна одержати заміщенням відповідної солі діазонію газуватим діоксидом сульфуру описаним у літературі способом (Cornish E.J. et al., J. Pharm. Pharmac., 18 65 (1966)). Сіль діазонію можна отримати з відповідного ароматичного аміну, виготовленого, коли його не виробляють промислово, з відповідної карбонової кислоти перебудовою Куртіюса ацилазидів згідно з описаним у літературі способом (Campiani G. et al., J. Org. Chem., 58 7665 (1993)). Вихідну сполуку ХХІІа тобто загальної формули XXII, в якій Τ – СН2, Υ-Ζ - СН2СН2, U – оксиген G -гідроген, а n=1, можна отримати з промислового 2-гідроксіацетофенону описаним у літературі способом. Отже, сполуку ХХІІа з гідроксиметильною групою у положенні 2 дигідробензопіранового кільця можна виготовити способом, що описано, наприклад, Augstein J. et al., J. Med. Chem., 11 844 (1968) та Urban F.J. et al., J. Heterocyclic Chem., 29 431 (1991). Сполуку ХХІІа з гідроксиметильною групою у положенні 3 дигідробензопіранового кільця можна виготовити способом, що описано, наприклад, Okumura К. et al., Chem. Pharm. Bull., 22 331 (1974). Сполуку ХХІІа з гідроксиметильною групою у положенні 4 дигідробензопіранового кільця можна виготовити способом, що описано, наприклад, Solladie G. et al., Synthesis, 569 (1991). Вихідну сполуку ХХІІb тобто загальної формули XXII, в якій Τ - простий зв'язок, Υ-Ζ - СН2СН2, U - оксиген, G - COOR9, а n=1, з гідроксиметильною групою у положенні 2 дигідробензофуранового кільця можна отримати з придатного промислового естеру 4-гідроксибензойної кислоти описаним у літературі способом (Eggler J.F. et at., патент США 4703052). Вихідну сполуку ХХІІс, тобто загальної формули XXII, в якій Τ - простий зв'язок, Υ-Ζ – СН2СН2, U оксиген, G - бром чи хлор, а n=1, з гідроксиметильною групою у положенні 3 дигідробензофуранового кільця можна отримати, піддаючи сполуку XL VIII дії придатного гідриду металу, наприклад, борогідриду натрію у такому розчиннику, як метанол, етанол чи тетрагідрофуран у присутності каталітичної кількості води при температурі від 20°С до кипіння розчинника протягом 3-24 годин (стадія 28). Сполуку XL VIII можна виготовити описаним у літературі способом (Boyle E.A. et al., J. Med. Chem., 29 894 (1986)). Вихідну сполуку XXIId тобто загальної формули XXII, в якій Τ - простий зв'язок, Υ-Ζ - СН=СН, U - оксиген, G - бром чи хлор, а n=1, можна отримати описаним у літературі способом або подібним перетворенням описаних у літературі продуктів. Так, сполуку XXIId з гідроксиметильною групою у положенні 2 бензофуранового кільця можна отримати, наприклад, способом, що описано у Dann О. et al., Liebigs. Ann. Chem., 1836 (1982). Сполуку XXIId з гідроксиметильною групою у положенні 3 бензофуранового кільця можна отримати в умовах, що описано для стадії 28, відновленням придатного естеру бензофуран-3-карбонової кислоти описаним у літературі способом (Mustafa Α., Chem. Heterocycl. Compd., Weissberger-Taylor Eds., John Wiley & Sons, N.Y., 1974, vol. 29, 114-117). Вихідну сполуку XXIX можна отримати одним з вищеописаних способів виготовлення сполуки XXII з промислових або таких, що легко синтезувати подібними способами, сполук. Вихідну сполуку IX, в якій R7 - гідроген, можна отримати, наприклад, представленим схемою 8 способом. Вихідну сполуку XXI можна отримати, починаючи зі сполуки XVIII, в якій R7 -гідроген, реакцією спочатку з нітритом натрію у суміші концентрованої сульфатної кислоти та води при - 10-10°С протягом 20хв.-2 годин, а потім обробкою реакційної суміші йодидом калію у присутності порошку міді при 75°С протягом 2 годин. Сполуки IX та XVIII, в яких R7 - метил, можна отримати з відповідної сполуки, в якій R 7 - гідроген, подібними до моноалкілування первинних амінів способами, що описано у літературі (Johnstone R.A.W. etel., J. Chem. Soc. C, 2223 (1969)). Вихідну сполуку XII можна отримати описаним у літературі способом (Нuan F.C. et al., J. Med. Chem., 34 1704 (1991)). Сполуки згідно з винаходом виявляють помітну антагоністичну активність по відношенню до дії лейкотрієнів та гарну біоактивність при пероральному застосуванні, а тому мають антизапальні та антіалергічні властивості, що робить їх корисними при лікуванні хвороб, до яких залучено ці медіатори. Тому вказані сполуки можна використовувати у терапії людини для попередження та лікування алергічних ринітів, бронхіальної астми, таких реакцій гіперчутливості, як алергічний кон'юнктивіт, таких різних запальних станів, як ревматоїдні артрити, остеоартрити, тендиніти, бурсити, псоріаз та споріднені запалення. Сполуки згідно з винаходом можна також застосовувати при лікуванні таких захворювань серцевосудинної системи, як серцева ішемія, інфаркт міокарду, коронарний спазм, серцева анафілаксія, церебральна водянка та ендотоксичний шок. Призначені для використання у терапії сполуки згідно з винаходом уводять у фармацевтичні композиції, використовуючи звичайну те хніку, розкриту, наприклад, у Remington's Pharmaceutical Science Handbook, Mack Pub. Co., N.Y. USA. Приклади таких композицій включають капсули, таблетки, сиропи тощо, що містять 1-1000мг активного компоненту на одиничну дозу. Нижченаведені приклади ілюструють виготовлення сполук згідно з винаходом. Приклад 1 8-[2-(бензилоксиметил)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 1А Етил[4-оксо-4Н-бензопіран-2-карбоксилат] 21,9мл 2,68М розчину етоксиду натрію в етанолі повільно додавали до розчину 1,76мл (14,7ммоль) 2гідроксіацетофенону та 3,98мл (29,4ммоль) діетилоксалату у суміші 20мл сухого етилового етеру та 20мл абсолютного етанолу. Суміш 3 години перемішували під зворотним холодильником, розбавляли 40мл етилового етеру, додавали 25мл 1М НСІ та тричі по 40мл екстрагували етиловим етером. Об'єднану етерну фазу сушили та видаляли розчинник під зниженим тиском. Отриманій залишок розчиняли у 60мл абсолютного етанолу та додавали 0,380мл концентрованої соляної кислоти, залишали на 1 годину перемішува тися при 75°С, а потім мливам 50мл води у суміш і тричі по 50мл екстрагували її етилацетатом. Органічну фазу послідовно промивали насиченим розчином гідрокарбонату натрію та насиченим розчином хлориду натрію, сушили і видаляли розчинник під зниженим тиском. Отриманій сирий продукт перекристалізовували з етилового етеру, одержавши 2,660г (83%) потрібного продукту. 1 Н ЯМР (300МГц, CDCI3) d 1,41 (т, 3Н); 4,43 (к, 2Н); 7,08 (с, 1Н); 7,42 (т, 1Н); 7,59 (д, 1Н); 7,71 (т, 1Н); 8,16 (дд, 1Н). 1Б Етил[2-хроманкарбоксилат] До розчину 2,0г (9,17ммоль) етил[4-оксо-4Н-бензопіран-2-карбоксилату] в 60мл метанолу, 25мл хлороформу та 20мл льодяної оцтової кислоти додали 10% паладію на активованому вугіллі і суміш 24 гоодини перемішували при кімнатній температурі в атмосфері водню, відфільтровували каталізатор і випарювали фільтрат досуха. Залишок розчиняли в етиловому етері, послідовно промивали насиченим розчином гідрокарбонату натрію та насиченим розчином хлориду натрію, сушили і видаляли розчинник під зниженим тиском, одержавши 1,575г (84%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,38 (т, 3Н); 2,01-2,29 (вс, 2Н); 2,78 (м, 2Н); 4,21 (к, 2Н); 4,69 (дд, 1Н); 6,82 (т, 1Н); 6,90 (д, 1Н); 7,01 (т, 1Н); 7,09 (т, 1Н). 1В 2-хроманметанол До розчину 1,575г (7,6 ммоль) етил[2-хроманкарбоксилату] у суміші 75мл тетрагідрофурану та 2мл води додали маленькими порціями 0,686г (18,2ммоль) борогідриду натрію і суміш 48 годин перемішували при кімнатній температурі, охолоджували до -10°С, додавали 47мл ацетону і 0,5 години перемішували при кімнатній температурі. Додавали 100мл води і екстрагували дихлорметаном. Органічну фазу сушили і видаляли розчинник під зниженим тиском, одержавши 1,218г (97%) потрібного продукту. 1 Н ЯМР (300МГц, CDCI3) d 1,87 (м, 1Н); 1,94 (м, 1Н); 2,18 (шс, 1Н); 2,76 (м, 1Н); 2,90 (м, 1Н); 3,76 (дд, 1Н); 3,85 (дд, 1Н); 4,13 (м, 1Н); 6,84 (вс, 1Н); 7,07 (вс, 2Н). 1Г 2-(бензилоксиметил)хроман До суспензії 0,711г (17,8ммоль) 60% дисперсії гідриду натрію у мінеральному маслі, попередньо промитої сухим петролейним етером, у 30мл сухого N.N-диметилформаміду під інертною атмосферою додали 1,218г (7,43ммоль) 2-хроманметанолу у 15мл Ν,Ν-диметилформаміду і суміш 1 годину перемішували при кімнатній температурі, потім додавали розчин 2,12мл (17,8ммоль) бензилброміду у 20мл Ν,Ν-диметилформаміду і кілька кристалів іодиду тетрабутиламонію та 18 годин перемішували при кімнатній температурі. Додавали 10мл води і видаляли розчинник під зниженим тиском. Одержаний залишок розподіляли між 70мл води та 70мл етилового етеру, фази розділили і водну тричі по 70мл екстрагували етиловим етером. Об'єднану органічну фазу сушили і видаляли розчинник під зниженим тиском, одержавши сирий продукт, який очищали флеш-хроматографією на колонці з силікагелем, елююючи петролейним/етиловим етером (9:1), отримавши 1,569г (83%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,85 (м, 1Н); 2,04 (м, 1Н); 2,74 (м, 1Н); 2,87 (м, 1Н); 3,61 (дд, 1Н); 3,71 (дд, 1Н); 4,21 (м, 1Н); 6,79-6,85 (вс, 2Н); 7,07-7,10 (вс, 2Н); 7,25-7,36 (вс, 5Н). 1Д 2-(бензилоксиметил)-6-хроманкарбальдегід До 1,14мл (9,26ммоль) N-диметилформаніліду під інертною атмосферою повільно додали 0,863мл (9,26ммоль) оксихлориду фосфору і перемішували суміш 30 хвилин при кімнатній температурі, потім, перемішуючи при 65°С, протягом 1,5 години додавали 1,569г (6,18ммоль) 2-(бензилоксиметил)хроману, розбавляли 30мл дихлорметану, додавали 20мл 15% розчину ацетату натрію, фази розділили і органічну послідовно промивали 1М розчином соляної кислоти та насиченим розчином хлориду натрію, сушили і видаляли розчинник під зниженим тиском, залишок очищали флеш-хроматографією на колонці з силікагелем, елююючи гексаном/етилацеатом (10:1), отримавши 0,921г (53%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,92 (м, 1Н); 2,04 (м, 1Н); 2,89 (м, 2Н); 3,70 (дд, 1Н); 3,76 (дд, 1Н); 4,38 (м, 1Н); 4,68 (с, 2Н); 6,98 (д, 1Н); 7,32-7,41 (вс, 5Н); 7,64 (вс, 2Н); 9,87 (с, 1Н). 1E 2-(бензилоксиметил)-6-хроманкарбонова кислота До розчину 0,921г (3,27ммоль) 2-(бензилоксиметил)-6-хроманкарбальдегіду у 5мл ацетону додали при 0°С реактив Джонса, що містив 0,326г (3,27ммоль) триоксиду хрому, 0,95мл води та 0,27мл концентрованої сульфатної кислоти і перемішували суміш 18 годин при кімнатній температурі, потім додали 10мл ізопропанолу та 50мл води і тричі по 30мл екстрагували етиловим етером, органічну фазу сушили і видаляли розчинник під зниженим тиском, залишок очищали хроматографією на колонці з силікагелем, елююючи гексаном/етилацеатом (7:3), отримавши 0,580г (60%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,87 (м, 1Н); 2,08 (м, 1Н); 2,84 (м, 2Н); 3,65 (дд, 1Н); 3,72 (дд, 1Н); 4,29 (м, 1Н); 4,62 (с, 2Н); 6,88 (д, 1Н); 7,32-7,40 (вс, 5Н); 7,82 (вс, 2Н). 1Є 4-бромфенілацетат До розчину 25г (145ммоль) 4-бромфенолу у 100мл хлороформу додали при 0°С 20,1мл тріетиламіну та 16,4мл оцтового ангідриду, перемішуючи суміш 2 години при кімнатній температурі, промивали 0,2М розчином соляної кислоти, сушили і видаляли розчинник під зниженим тиском, отримавши 100% безбарвного масла потрібного продукту. 1Ж 5-бром-2-гідроксіацетофенон Суміш 31,3г (145ммоль) 4-бромфенілацетату та 47,3г АІСІ 3 гріли 120°С 2 години, дали охолодитися до 50° та обережно додали суміш 70г льоду та 15мл концентрованої соляної кислоти, нагріли до 50°, отримавши гомогенний розчин. Після охолодження до кімнатної температури чотири рази по 100мл екстрагували етилацетатом, органічну фазу сушили і видаляли розчинник під зниженим тиском, залишок очищали хроматографією на колонці з силікагелем, елююючи гексаном/хлороформом (9:1), отримавши 23,7г (76%) потрібного продукту. 1 Н ЯМР (300 МГц, CDCI3) d 2,56 (с, 3Н); 6,78 (д, 1Н); 7,43 (дд, 5Н); 7,72 (д 1Н); 12,10 (с, 1Н). 1З 5-бром-2-гідрокси-3-нітроацетофенон До розчину 23,7г (110ммоль) 5-бром-2-гідроксіацетофенону у 90мл терахлориду карбону додали 17,2мл концентрованої нітратної кислоти і перемішували суміш 50 хвилин при 75°С, а потім охолодили до кімнатної температури, відфільтр ували осад, промили його холодним терахлоридом карбону і після сушки у вакуумі одержали 20,9г (73%) твердого світложовтого потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 2,73 (с, 3Н); 8,14 (д, 1Н); 8,31 (д, 1Н); 12,92 (с, 1Н). 1І 3-аміно-2-гідроксіацетофенон Способом, описаним у п.Б, ви ходячи з 5-бром-2-гідрокси-3-нітроацетофенону, розчиненого у метанолі/хлороформі (9:1) потрібну сполуку отримали з кількісним виходом як гідробромід. 1 Н ЯМР (300мГц, CD3OD) d 2,72 (с, 3Н); 7,13 (т, 1Н); 7,69 (дд, 1Н); 8,08 (дд, 1Н). 1И N-(3-ацетил-2-гідроксифеніл)-2-(бензилоксиметил)хроман-6-карбоксамід Суспензію 0,700г (2,35ммоль) 2-(бензилоксиметил)хроман-6-карбонової кислоти у 5,98мл оксалілхлориду нагрівали 35 хвилин при 75°С, надлишок оксалілхлориду випаровували струмом азоту і розчиняли залишок у мінімальній кількості сухого метиленхлориду. Цей розчин при 0°С під інертною атмосферою додали до розчину 0,550г (2,37ммоль) 3-аміно-2-гідроксіацетофенону, 7мл піридину та 40мл сухого метиленхлориду і суміш 18 годин перемішували при кімнатній температурі, потім розбавляли 40мл метиленхлориду, послідовно промивали 1М розчином соляної кислоти та насиченим розчином хлориду натрію, сушили і видаляли розчинник під зниженим тиском, залишок очищали флеш-хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом при зростаючій полярності, при вмісті хлороформу 40% отримали 0,732г (72%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,92 (м, 1Н); 2,14 (м, 1Н); 2,70 (с, 3Н); 2,93 (м, 2Н); 3,70 (дд, 1Н); 3,78 (дд, 1Н); 4,33 (м, 1Н); 4,62 (с, 2Н); 7,00 (м, 2Н); 7,30-7,42 (вс, 5Н); 7,51 (д, 1Н); 7,70 (вс, 2Н); 8,09 (с, 1Н); 8,80 (д, 1Н); 13,01 (с, 1Н). IК Етил{8-[2-(бензилоксиметил)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбоксилат} Способом, описаним у п.А, ви ходячи з N-(3-ацетил-2-гідроксифеніл)-2-(бензилоксиметил)хроман-6карбоксаміду та діетилоксалату отримали потрібну сполуку, яку очищали гарячою перекристалізацією з етилацетату з ви ходом 66%. 1 Н ЯМР (300мГц, CDCI3) d 1,47 (т, 3Н); 1,90 (м, 1Н); 2,11 (м, 1Н); 2,89 (м, 2Н); 3,67 (дд, 1Н); 3,75 (дд, 1Н); 4,32 (м, 1Н); 4,49 (к, 2Н); 4,65 (с, 2Н); 6,95 (д, 1Н); 7,15 (с, 1Н); 7,30-7,40 (вс, 5Н); 7,47 (т, 1Н); 7,78 (д, 1Н); 7,88 (дд, 1Н); 8,74 (с, 1Н); 8,93 (дд, 1Н). 1Л 8-[2-(бензилоксиметил)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота До суспензії 0,240г (0,47ммоль) етил{8-[2-(бензилоксиметил)хроман-6-карбоксамідо]-4-оксо-4Н-1бензопіран-2-карбоксилату} у суміші 15мл метанолу та 15мл тетрагідрофурану 0,510мл 1М NaOH і суміш 1,5 години перемішували при кімнатній температурі, потім сушили досуха і суспендували залишок у воді з додаванням 0,2Мсоляної кислоти до рН 4-5. Тверду фаз у відфільтровували промивали метанолом та сушили пентоксидом фосфору під вакуумом, отримавши 0,221г (97%) білої твердої потрібної сполуки, яка розкладається вище 283°С. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,82(м, 1Н); 2,12 (м, 1Н); 2,85 (м, 2Н); 3,62 (дд, 1Н); 3,67 (дд, 1Н); 4,23 (м, 1Н); 4,57 (с, 2Н); 6,85 (д, 1Н); 7,01 (с, 1Н); 7,20-7,30 (вс, 5Н); 7,38 (т, 1Н); 7,69 (м, 2Н); 7,83 (дд, 1Н); 8,48 (дд, 1Н). Приклад 2 N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(бензилоксиметил)хроман-6карбоксамід 2А Етил{6-бром-8-нітро-4-оксо-4Н-1-бензопіран-2-карбоксилат} Способом, описаним у прикладі 1А, виходячи з 5-бром-2-гідрокси-3-нітроацетофенону та діетилоксалату отримали потрібну сполуку, яку очи щали перекристалізацією з суміші тетрагідрофурану з етанолом з виходом 77%. 1 Н ЯМР (300мГц, CDCI3) d 1,45 (т, 3Н); 4,49 (к, 2Н); 7,21 (с, 1Н); 8,48 (д, 1Н); 8,58 (д, 1Н). 2Б Етил{8-нітро-4-оксо-4Н-бензопіран-2-карбоксилат} Суміш 5,0г (14,6ммоль) етил{6-бром-8-нітро-4-оксо-4Н-1-бензопіран-2-карбоксилату}, 0,541г 10% паладію на активованому вугіллі, 7,90мл мурашиної кислоти та 42мл Ν,Ν-диметилформаміду перемішували в інертній атмосфері при 145°С 5,75 години, дали охолодитися та відфільтрували каталізатор, промивши його Ν,Ν-диметилформамідом, випарили фільтрат досуха і залишок очищали хроматографією на колонці з силікагелем, елююючи гексаном/хлороформом (85:15), отримавши 2,109г (55%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,46 (т, 3Н); 4,50 (к, 2Н); 7,21 (с, 1Н); 7,61 (т, 1Η); 8,41 (дд, 1Н); 8,49 (д, 1Н). 2В 8-нітро-4-оксо-4Н-бензопіран-2-карбоксамід Газуватий аміак 30 хвилин пропускали у розчин 2,109г (8,02ммоль) етил{8-нітро-4-оксо-4Н-бензопіран2-карбоксилату} у 50мл абсолютного етанолу та 50мл безводного тетрагідрофурану, випарили доcyxa і залишок суспендували у 20мл концентрованої соляної кислоти, перемішуючи 4 години при кімнатній температурі, потім розбавляли водою, тверду фазу відфільтрували, промили кілька разів водою та сушили у вакуумі над пентаоксидом фосфору, отримавши 1,515г (81%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 7,01 (с, 1Н); 7,75 (т, 1Н); 8,01 (шс, 1Н); 8,37 (шс, 1Н); 8,43 (дд, 1Н); 8,61 (дд, 1Н). 2Г 8-нітро-4-оксо-4Н-1-бензопіран-2-карбонітрил До 40мл Ν,Ν-диметилформаміду при 0°С повільно додали 2,86мл оксихлориду фосфору і перемішували суміш 35 хвилин при кімнатній температурі, потім додали 1,515г (6,47ммоль) 8-нітро-4-оксо4Н-бензопіран-2-карбоксаміду і перемішували суміш 18 годин при кімнатній температурі, потім виливали у 100мл суміші льоду з водою і 4 рази по 40мл екстрагували етилацетатом, сушили і видаляли розчинник під зниженим тиском, залишок очищали флеш-хроматографією на колонці з силікагелем, елююючи гексаном/хлороформом (7:3), отримавши 1,094г (78%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 7,01 (с, 1Н); 7,70 (т, 1Н); 8,38 (дд,. 1Н); 8,56 (дд, 1Н). 2Д 8-нітро-4-оксо-2-{5Н-1-тетразоліл)4Н-1-бензопіран Суміш 1,094г (5,06ммоль) 8-нітро-4-оксо-4Н-бензопіран-2-карбонітрилу, 1,638г (25,3ммоль) азиду натрію, 1,349г (25,3ммоль) хлориду амонію та 50мл сухого Ν,Ν-диметилформаміду при 100°С перемішували 1,25 години, потім охолоджували до кімнатної температури і виливали у 50мл 1М соляної кислоти, осад відфільтровували і суспендували у 12мл концентрованої соляної кислоти, перемішували 2,5 години при кімнатній температурі, розбавляли 50мл води і 4 рази по 30мл екстрагували етилацетатом, органічну фазу сушили і видаляли розчинник під зниженим тиском, отримавши 0,896г (69%) потрібного продукту. 1 Н ЯМР (300мГц, ДМСО) d 7,21 (с, 1Н); 7,73 (т, 1Н); 8,41 (дд, 1Н); 8,55 (дд, 1Н). 2Е 8-аміно-4-оксо-2-(5Н-1-тетразоліл )4Н-1-бензопіран Способом, описаним у прикладі 1Б, виходячи з 0,896г (3,46ммоль) 8-нітро-4-оксо-2-(5Н-1-тетразоліл)4Н1-бензопірану та 91мг 5% паладію на активованому вугіллі у суміші 20мл хлороформу, 65мл метанолу та 2мл концентрованої соляної кислоти отримали потрібну сполуку як гідрохлорид з кількісним виходом. 1 Н ЯМР (300мГц, CD3OD) d 7,25 (с, 1Н); 7,62 (т, 1Н); 7,94 (д, 1Н); 8,14 (д, 1Н). 2Є N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(бензилоксиметил)хроман-6-карбоксамід Способом, описаним у прикладі 1И, виходячи з 8-аміно-4-оксо-2-(5Н-1-тетразоліл)4Н-1-бензопірану та 2-(бензилоксиметил)хроман-6-карбонової кислоти отримали білу тверду потрібну сполуку з т.пл. 214-216°С, яку очищали перекристалізацією з метанолу з виходом 57%. 1Н ЯМР (300мГц, CD3OD/CDCI3) d 1,82 (м, 1Н); 2,12 (м, 1Н); 2,85 (м, 2Н); 3,62 (дд, 1Н); 3,67 (дд, 1Н); 4,23 (м, 1Н); 4,50 (с, 2Н); 6,89 (д, 1Н); 7,18 (с, 1Н); 7,20-7,34 (вс, 5Н); 7,44 (т, 1Н); 7,72 (дд, 2Н); 7,87 (дд, 1Н); 8,59 (дд, 1Н); 8,80 (шс, 1Н). Приклад 3 8-[2-(3-фенілпропіл)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 3А 2-хроманметил(трифлуорметансульфонат) Суміш 0,765г (4,67ммоль) 2-хроманметанолу та 1,05мл піридину у 25мл сухого метиленхлориду змішували при 0°С під інертною атмосферою з 1,10мл (6,53ммоль) трифлуорметансульфоновим ангідридом і 18 годин перемішували при 0°С, потім розбавляли 20мл метиленхлориду, додавали 25мл води і тричі по 30мл екстрагували метиленхлоридом. Поєднані органічні фази промивали 1Н НСІ, 5% NаНСО3 та насиченим розчином NaCI, сушили і видаляли розчинник під зниженим тиском, залишок очищали флешхроматографією на колонці з силікагелем, елююючи гексаном/етилацетатом (9:1) отримавши 1,381г (82%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,90 (м, 1Н); 2,05 (м, 1Н); 2,82 (м, 1Н); 2,93 (м, 1Н), 4,33 (м; 1Н); 4,64 (д, 2Н); 6,86 (м, 2Н); 7,07 (м, 2Н). 3Б 2-(3-фенілпропіл)хроман До суспензії 0,304г (12,6ммоль) магнію у 5мл сухого тетрагідрофурану з кристалами йоду краплями в інертній атмосфері додавали розчин 1,72мл (12,6ммоль) 2-брометилбензолу у 12мл сухого тетрагідрофурану і витримували при кімнатній температурі 2,5 години, після чого послідовно додавали розчин 163мг (0,79ммоль) СuВr·(СН3)2S у 2мл тетрагідрофурану та розчин 1,381г (4,67ммоль) 2хроманметил(трифлуорметансульфонату) у 5мл тетрагідрофурану перемішували 2,5 години при 0°С, потім повільно виливали у суміш 25мл метиленхлориду та 20мл насиченого розчину хлориду амонію. Фази розділяли і органічну 4 рази по 25мл екстрагували метиленхлоридом. Поєднані органічні фази сушили і видаляли розчинник під зниженим тиском, залишок очищали хроматографією на колонці з силікагелем, елююючи гексаном/ метиленхлоридом (9:1) отримавши 0,990г (85%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,60-2,00 (вс, 6Н); 2,67 (т, 2Н); 2,70-2,88 (вс, 2Н); 3,98 (м, 1Н); 6,80 (м, 2Н); 7,03 (м, 2Н); 7,17-7,28 (вс, 5Н). 3В 2-(3-фенілпропіл)-6-хроманкарбальдегід Способом, описаним у прикладі 1Д, виходячи з 2-(3-фенілпропіл)хроману отримали потрібну сполуку з виходом 66%. 1 Н ЯМР (300мГц, CDCI3) d 1,60-2,00 (вс, 6Н); 2,68 (т, 2Н); 2,82 (м, 2Н); 4,08 (м, 1Н); 6,88 (д, 1Н); 7,18 (м, ЗН); 7,26 (м, 2Н); 7,60 (м, 2Н); 9,81 (с, 1Н). 3Г 2-(3-фенілпропіл)-6-хроманкарбонова кислота Способом, описаним у прикладі 1Е, виходячи з 2-(3-фенілпропіл)хроманкарбальдегіду отримали потрібну сполуку з ви ходом 66%. 1 Н ЯМР (300мГц, CDCI3) d 1,70-2,10 (вс, 6Н); 2,73 (т, 2Н); 2,88 (м, 2Н); 4,12 (м, 1Н); 6,87 (д, 1Н); 7,20 (м, ЗН); 7,31 (м, 2Н); 7,88 (м, 2Н). 3Д N-(3-ацетил-2-гідроксифеніл)-2-(3-фенілпропіл)хроман-6-карбоксамід Способом, описаним у прикладі 1И, виходячи з 2-(3-фенілпропіл)хроманкарбонової кислоти та 3-аміно2-гідроксіацетофенону отримали потрібну сполуку з виходом 45%. 1 Н ЯМР (300мГц, CDCI3) d 1,65-2,10 (вс, 6Н); 2,70 (с, 3Н); 2,73 (м, 2Н); 2,88 (м, 2Н); 4,10 (м, 1Н); 6,89 (д, 1Н); 6,99 (т, 1Н); 7,20-7,35 (вс, 5Н); 7,51 (д, 1Н); 7,68 (м, 2Н); 8,58 (шс, 1Н); 8,79 (д, 1Н); 13,01 (с, 1Н). 3Е Етил{8-[2-(3-фенілпропіл)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбоксилат} Способом, описаним у прикладі 1А, ви ходячи з N-(3-ацетил-2-гідроксифеніл)-2-(3-фенілпропіл)хроман6-карбоксаміду та діетилоксалату отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи хлороформом з виходом 47%. 1 Н ЯМР (300мГц, CDCI3) d 1,48 (т, 3Н); 1,65-2,10 (вс, 6Н); 2,71 (т, 23Η); 2,89 (м, 2Н); 4,10 (м, 1Н); 4,50 (к, 2Н); 6,90 (д, 1Н); 7,17 (с, 1Н); 7,20-7,35 (вс, 5Н); 7,48 (т, 1Н); 7,79 (д, 1Н); 7,88 (дд, 1Н); 8,74 (с, 1Н); 8,93 (дд, 1Н). 3Є 8-[2-(3-фенілпропіл)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота Способом, описаним у прикладі 1Л, виходячи з етил{8-[2-(3-фенілпропіл)хроман-6-карбоксамідо]-4-оксо4Н-1-бензопіран-2-карбоксилату} отримали білу тверду потрібну сполуку з т.пл. 325-326°С з виходом 80%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,65-2,10 (вс, 6Н); 2,73 (м, 2Н); 2,90 (м, 2Н); 4,10 (м, 1Н); 6,89 (д, 1Н); 7,09 (с, 1Н); 7,20-7,35 (вс, 5Н); 7,47 (т, 1Н); 7,77 (м, 2Н); 7,92 (дд, 1Н); 8,56 (дд, 1Н). Приклад 4 N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)хроман-6-карбоксамід Способом, описаним у прикладі 1И, виходячи з 8-аміно-4-оксо-2-(5Н-1-тетразоліл)-4Н-1-бензопірану та 2-(3-феніллропіл)хроман-6-карбонової кислоти отримали білу тверду потрібну сполуку, яка розкладається вище 370°С, яку очищали перекристалізацією з метанолу з виходом 65%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,65-2,10 (вс, 6Н); 2,71 (т, 2Н); 2,90 (м, 2Н); 4,11 (м, 1Н); 6,89 (д, 1Н); 7,15-7,35 (вс, 6Н); 7,49 (т, 1Н); 7,79 (м, 2Н); 7,95 (д, 1Н); 8,60 (д, 1Н). Приклад 5 8-[2-(бензилоксиметил)бензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 5А (4-бром-2-форміл)фенілоксіацетонітрил До суміші 5г (24,8ммоль) 5-бромсаліцилового альдегіду, 3,78г (24,8ммоль) карбонату калію та 70мл Ν,Ν-диметилформаміду додали розчин 1,87г (24,8ммоль) хлорацетонітрилу у 10мл Ν,Ν-диметилформаміду, потім каталітичну кількість йодиду калію і перемішували суміш 1,5 години при 80°С, додавали 50мл води і 4 рази по 75мл екстрагували етилацетатом, поєднані органічні фази сушили і видаляли розчинник під зниженим тиском, отримавши 5,126г (98%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 4,93 (с, 2Н); 7,01 (д, 1Н); 7,73 (дд, 1Н); 8,00 (д, 1Н). 5Б 5-бром-2-бензофуранкарбонова кислота Суміш 5,11г (21,3ммоль) (4-бром-2-форміл)фенілоксіацетонітрилу, 6,0г гідроксиду калію та 250мл абсолютного етанолу гріли 24 години під зворотним холодильником, додавали 50мл води та підкислювали 1М соляною кислотою, а потім видаляли летючі продукти під зниженим тиском і водний залишок 4 рази по 100мл екстрагували етилацетатом, поєднані органічні фази сушили і видаляли розчинник під зниженим тиском, отримавши 98% жовтого твердого потрібного продукту з т.пл. 249-252°С. 1 Н ЯМР (300мГц, CD3OD) d 7,50 (м, 3Н); 7,80 (с, 1Н). 5В Етил(5-бром-2-бензофуранкарбоксилат) До розчину 5,01г (20,8ммоль) 5-бром-2-бензофуранкарбонової кислоти у 150мл абсолютного етанолу додали 15мл концентрованої сульфатної кислоти і гріли 2 години під зворотним холодильником, потім видаляли летючі продукти під зниженим тиском і залишок нейтралізували насиченим розчином гідрокарбонату натрію та 4 рази по 100мл екстрагували етиловим етером, суміш сушили і видаляли розчинник під зниженим тиском, отримавши 5,19г (93%) білого твердого потрібного продукту з т.пл. 58-60°С. 1 Н ЯМР (300мГц, CDCI3) d 1,34 (т, 3Н); 4,35 (к, 2Н); 7,39 (м, 2Н): 7,71 (д, 1Н). 5Г (5-бром-2-бензофураніл)метанол До розчину 2,20г (8,19ммоль) етил(5-бром-2-бензофуранкарбоксилату) у 75мл тетрагідрофурану додали 1,24г борогідриду натрію та кілька краплин води і гріли з перемішуванням 18 годин під зворотним холодильником, потім додавали кілька крапель концентрованої НСІ і видаляли летючі продукти, а залишок розбавляли водою та 4 рази по 75мл екстрагували етиловим етером, суміш сушили і видаляли розчинник під зниженим тиском, отримавши сирий продукт, який очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (60:40), отримавши 1,19г (64%) білого твердого потрібного продукту з т.пл. 101-103°С. 1 Н ЯМР (300мГц, CDCI3) d 2,10 (шс, 1Н); 4,76 (с, 2Н); 6,60 (с, 1Н); 7,33 (м, 2Н); 7,66 (с, 1Н). 5Д 2-(гідроксиметил)бензофуран-5-карбонітрил Розчин 1,19г (5,24ммоль) (5-бром-2-бензофураніл)метанолу, 0,470г (5,25ммоль) ціаніду купруму(І) та 15мл N-метипіролідинону гріли з перемішуванням 3,5 години при 200°С, потім виливали у розчин 6г етилендіаміну та 80мл води і 3 рази по 75мл екстрагували етилацетатом. Органічну фазу сушили і видаляли розчинник під зниженим тиском, отримавши сирий продукт, який очищали хроматографією на колонці з силікагелем, елююючи н-гексаном/етилацетатом зі зростаючою полярністю, отримавши 0,671г (74%) жовтого твердого продукту з т.пл. 113-114°С. 1 Н ЯМР (300мГц, CDCI3) d 4,82 (с, 2Н); 6,74 (с, 1Н); 7,54 (м, 2Н); 7,87 (с, 1Н). 5Е 2-(бензилоксиметил)бензофуран-5-карбонітрил 0,990г (5,04ммоль) 20% дисперсії гідриду калію у мінеральному маслі, попередньо промитої декантуванням сухим гексаном, а потім ресуспендованої у 25мл сухого бензолу, під інертною атмосферою при 0°С додали до розчину 0,671г (3,89ммоль) 2-(гідроксиметил)бензофуран-5-карбонітрилу у 10мл бензолу і суміш 15 хвилин перемішували при кімнатній температурі, потім додавали 0,825мл бензилброміду каталітичну кількість йодиду тетрабутиламонію та 4 години перемішували при кімнатній температурі. Додавали 50мл води і 4 рази по 50мл екстрагували етилацетатом. Органічну фазу сушили і видаляли розчинник під зниженим тиском, одержавши сирий продукт, який очищали флеш-хроматографією на колонці з силікагелем, елююючи н-гексаном/етилацетатом зі зростаючою полярністю, отримавши 1,087г (82%) продукту як жовтува ту олію. 1 Н ЯМР (300мГц, CDCI3) d 4,54 (с, 2Н); 4,55 (с, 2Н); 6,66 (с, 1Н); 7,28 (м, 5Н); 7,45 (с, 2Н); 7,79 (с, 1Н). 5Є 2-(бензилоксиметил)бензофуран 5-карбонова кислота До розчину 1,087г (4,13ммоль) 2-(бензилоксиметил)бензофуран-5-карбонітрилу у 150мл етанолу додали 55мл 35% NaOH і гріли 3 години під зворотним холодильником, підкислювали 1М НСІ, потім видаляли летючі продукти і залишок 4 рази по 100мл екстрагували етилацетатом, органічну фазу сушили і видаляли розчинник під зниженим тиском, отримавши 1,165г (кількісний вихід) білого твердого потрібного продукту з т.пл. 129-132°С. 1 Н ЯМР (300мГц, CDCI3) d 4,67 (с, 2Н); 6,81 (с, 1Н); 7,40 (м, 5Н); 7,56 (д, 1Н); 8,12 (д, 1Н); 8,41 (с, 1Н). 5Ж N-(3-ацетил-2-гідроксифент)-2-(бензилоксиметил)бензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 2-(бензилоксиметил)бензофуран-5-карбонової кислоти та 3-аміно2-гідроксіацетофенону отримали жовтувату тверду сполуку з т.пл. 92-94°С, яку потім очищали хроматографічно на колонці з силікагелем з виходом 98%. 1 Н ЯМР (300мГц, CDCI3) d 2,58 (с, 3Н); 4,60 (с, 4Н); 6,74 (д, 1Н); 6,91 (т, 1Η); 7,34 (м, 5Н); 7,41 (д, 1Н); 7,51 (д, 1Н); 7,82 (д, 1Н); 8,10 (д, 1Н); 8,63 (с, 1Н); 8,73 (д, 1Н). 5З 8-[2-(бензилоксиметил)бензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота Способом з прикладу 1Α, входячи з N-(3-ацетил-2-гідроксифеніл)-2-(бензилоксиметил)бензофуран-5карбокоаміду та діетилоксалату виготовили етил{8-[2-(бензилоксиметил)бензофуран-5-карбоксамідо]-4оксо-4Н-1-бензопіран-2-карбоксилат}, який далі гідролізували способом з прикладу 1Л, отримавши білу тверду потрібну сполуку з т.пл. 215-218°С, з виходом 98%. 1 Н ЯМР (300мГц, ДМСО) d 4,61 (с, 2Н); 4,72 (с, 2Н); 6,97 (с, 1Н); 7,11 (с, 1Н); 7,38 (м, 5Н); 7,57 (т, 1Н); 7,76 (д, 1Н); 7,93 (д, 1Н); 8,02 (д, 1Н); 8,09 (д, 1Н); 8,38 (с, 1Н). Приклад 6 8-(2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2карбонова кислота 6А Етил(4-алілоксибензоат) До суміші 10г (60,2ммоль) етил(4-гідроксибензоату) та 8,32г (60,2ммоль) карбонату калію у 20мл ацетону додали 7,22мл (66,2ммоль) алілброміду і гріли 18 годин під зворотним холодильником, відфільтровували карбонат калію і видаляли розчинник під зниженим тиском, отримавши 12,3г (99%) сирого продукту, що містив тільки потрібну сполуку. 1 Н ЯМР (300мГц, CDCI3) d 1,36 (т, 3Н); 4,32 (к, 2Н); 4,54 (д, 2Н); 5,28 (дд, 1Н); 5,40 (дд, 1Н); 6,03 (м, 1Н); 6,90 (д, 2Н); 7,98 (д, 2Н). 6Б Етил[4-аліл-4-гідроксибензоат) Суміш 10г (48,5ммоль) етил(4-алілоксибензоату) та 20мл Ν,Ν-диметиланіліну гріли 48 годин з перемішуванням при 200°С, розбавляли 150мл етилацетату та промивали 1М НСІ. Після сушки та видалення розчинника, отримавши сирий продукт, який очищали хроматографією на колонці з силікагелем, елююючи н-гексаном/етилацетатом (95:5), отримавши 6,85г (69%) продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,37 (т, 3Н); 3,45 (д, 2Н); 4,35 (к, 2Н); 5,14 (д, 2Н); 6,02 (м, 1Н); 6,89 (д, 1Н); 7,81 (дд, 1Н); 7,83 (с, 1Н). 6В Етил(2-гідроксиметил-2,3-дигідробензофуран-5-карбоксилат) До розчину 6,74г (32,7ммоль) етил(4-аліл-4-гідроксибензоату) у 105мл хлороформу додавали 11,40г (66,1ммоль) м-хлорбензойної кислоти і гріли 4 години під зворотним холодильником з перемішуванням. Після видалення розчинника, отриманий сирий продукт розчиняли в етилацетаті та промивали 1М NaOH. Після сушки та видалення розчинника сирий продукт очищали хроматографією на колонці з силікагелем, елююючи н-гексаном/егилацетатом (90:10), отримавши 5,95г (82%) продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,35 (т, 3Н); 3,02 (дд, 1Н); 3,20 (дд, 1Н); 3,74 (дд, 1Н); 3,84 (дд, 1Н); 4,29 (κ, 2Η); 4,95 (м, 1Н); 6,69 (д, 1Н); 7,78 (с, 1Н); 7,79 (д, 1Н). 6Г Етил (2-бензил оксиметил-2,3-дипдробензофуран-2-карбоксилат) Способом з прикладу 1Г, виходячи з етил[2-гідроксиметил-2,3-дигідробензофуран-5-карбоксилату) та бензилброміду отримали потрібну сполуку, яку очищали хроматографічно на колонці з силікагелем, елююючи н-гексаном/етилацетатом (95:5), з виходом 65%. 1 Н ЯМР (300мГц, CDCI3) d 1,32 (т, 3Н): 2,93 (дд, 1Н); 3,13 (дд, 1Н); 3,55 (дд, 1Н); 3,59 (дд, 1Н); 4,27 (κ, 2Η); 4,51 (дд, 1Н); 4,94 (м, 1Н); 6,75 (д, 1Н); 7,19-7,27 (вс, 5Н); 7,78 (с, 1Н); 7,85 (дд, 1Н). 6Д 2-бензилоксиметил-2,3-дигідробензофуран-2-карбонова кислота До розчину 1,62г (5,47ммоль) етил(2-бензилоксиметил-2,3-дигідробензофуран-2-карбоксилату) у 70мл метанолу додали 54,7мл 1М розчину гідроксиду літію і гріли 3 години під зворотним холодильником з перемішуванням. Після нейтралізації 1М НСІ і випаровування метанолу під зниженим тиском, отриманий сирий продукт суспендували у 20мл води та 4 рази по 25мл екстрагували етилацетатом. Після сушки органічної фази та видалення розчинника 1,436г потрібного продукту очищали перекристалізацією з метанолу, ви хід 82%. 1 Н ЯМР (300мГц, CDCI3) d 3,02 (дд, 1Н); 3,26 (дд, 1Н); 3,65 (дд, 1Н); 3,68 (дд, 1Н); 4,69(дд, 1Н); 5,05 (м, 1Н); 6,82 (д, 1Н); 7,22-7,33 (вс, 5Н); 7,90 (с, 1Н); 7,94 (д, 1Н). 6Е N-(3-ацетил-2-гідроксифеніл)-2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 2-(бензилоксиметил-2,3-дигіробензофуран-5-карбонової кислоти та 3-аміно-2-гідроксіацетофенону отримані жовтувату тверду сполуку з т.пл. 103-105°С, яку очищали хроматографічно на колонці з силікагелем з виходом 74%. 1 Н ЯМР (300мГц, CDCI3) d 2,64 (с, 3Н); 3,06 (дд, 1Н); 3,31 (дд, 1Н); 3,66 (дд, 1Н); 3,70 (дд, 1Н); 4,61 (дд, 1Н); 5,06 (м, 1Н); 6,86 (д, 1Н); 6,85 (т, 1Н); 7,26-7,34 (вс, 5Н); 7,46 (д, 1Н); 7,72 (д, 1Н); 7,74 (с, 1Н); 8,58 (с, 1Н); 8,74 (д, 1Н); 12,96 (с, 1Н). 6Є Етил[8-(2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2карбоксилат] Способом з прикладу 1А, ви ходячи з N-(3-ацетил-2-пдроксифент)-2-бензилоксиметил-2,3дигідробензофуран-5-карбоксаміду та діетилоксалату отримали жовту тверду потрібну сполуку з т.пл. 166168°С, яку очищали перекристалізацією з етанолу, вихід 73%. 1 Н ЯМР (300мГц, CDCI3) d 1,47 (т, 3Н); 3,12 (дд, 1Н); 3,36 (дд, 1Н); 3,70 (дд, 1Н); 3,73 (дд, 1Н); 4,50 (к, 2Н); 4,63 (дд, 2Н); 5,11 (м, 1Н); 6,91 (д, 1Н); 7,15 (с, 1Н); 7,30-7,38 (вс, 5Н); 7,47 (т, 1Н); 7,79 (д, 1Н); 7,87 (с, 1Н); 7,88 (д, 1Н); 8,73 (с, 1Н); 8,92 (д, 1Н). 6Ж 8-(2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2-карбонова кислота Способом з прикладу 1Л, виходячи з етил[8-(2-бензилоксиметил-2,3-дигідробензофуран-5карбоксамідо)-4-оксо-4Н-1-бензопіран-2-карбоксилату] отримали жовту тверду потрібну сполуку з т.пл. 184188°С, вихід 60%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 3,12 (дд, 1Н); 3,36 (дд, 1Н); 3,70 (дд, 1Н); 3,73 (дд, 1Н); 4,63 (с, 2Н); 5,11 (м, 1Н); 6,91 (д, 1Н); 7,10 (с, 1Н); 7,30-7,38 (вс, 5Н); 7,49 (т, 1Н); 7,82 (д, 1Н); 7,85 (с, 1Н); 7,90 (дд, 1Н); 8,73 (дд, 1Н). Приклад 7 N-[4-okco-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-бензилоксиметил-2,3дигідробензофуран-5-карбоксамід 7А N-[4-оксо-2-карбамоїл-4H-1-бензопіран-8-іл]-2-бензилоксиметил-2,3-дигідробензофуран-5карбоксамід Газуватий аміак 30 хвилин пропускали у розчин 0,528г (1,06ммоль) етил[8-(2-бензилоксиметил-2,3дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2-карбоксилату] у 25мл метанолу та 25мл безводного тетрагідрофурану, випарили досуха і залишок розчинили у 15мл суміші (1:1) метанолу та тетрагідрофурану і додали 0,5мл концентрованої соляної кислоти, нагрівали 1,5 години, під зворотним холодильником, розчинник випаровували під зниженим тиском. Сирий продукт суспендували у воді, тверду фазу відфільтр ували, промили кілька разів водою та сушили у вакуумі над пентаоксидом фосфору, отримавши 0,527г (кількісний вихід) потрібного продукту. 1 Н ЯМР (300мГц, ДМСО) d 3,08 (дд, 1Н); 3,36 (дд, 1Н); 3,70 (м, 2Н); 4,57 (с. 2Н); 5,12 (м, 1Н); 6,84 (с, 1Н); 6,92 (д, 1Н); 7,28-7,38 (вс, 5Н); 7,53 (т, 1Н): 7,83-7,89 (вс, 4Н); 8,24 (шс, 1Н); 8,32 (д, 1Н); 8,65 (шс, 1Н). 7Б N-[4-оксо-2-цізно-4Н-1-бензопіран-8-іл]-2-бензилоксиметил-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 2Г, виходячи з N-[4-оксо-2-карбамоїл-4Н-1-бензопіран-8-іл]-2-бензилоксиметил2,3-дигідробензофуран-5-карбоксаміду отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом зі зростаючою полярністю, вихід 82%. 1 Н ЯМР (300мГц, CDCI3) d 3,12 (дд, 1Н); 3,35 (дд, 1Н); 3,71 (м, 2Н); 4,64 (дд, 2Н); 5,10 (м, 1Н); 6,85 (с, 1Н); 6,92 (д, 1Н); 7,28-7,35 (вс, 5Н); 7,50 (т, 1Н); 7,73 (д, 1Н); 7,77 (с, 1Н); 7,88 (дд, 1Н); 8,30 (с, 1Н); 8,83 (д, 1Н). 7В N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-бензилоксиметил-2,3-дигідробензофуран-5карбоксамід Суміш 0,300г (0,66ммоль) N-[4-оксо-2-ціано-4Н-1-бензопіран-8-іл]-2-бензилоксиметил-2,3дигідробензофуран-5-карбоксаміду, 0,129г (1,99ммоль) азиду натрію, 0,107г (1,99ммоль) хлориду амонію та 10мл сухого Ν,Ν-диметилформаміду перемішували при 100°С 1,25 години, охолоджували і виливали у 10мл 1Н соляної кислоти, осад відфільтровували, отримавши 0,111г білої твердої потрібної сполуки з т.пл. 200202°С, яку очищали перекристалізацією з суміші метанолу з метиленхлоридом, вихід 68%. 1 Н ЯМР (300мГц, CDCI3) 3,09 (дд, 1Н); 3,37 (дд, 1Н); 3,70 (м, 2Н); 3,73 (дд, 1Н); 4,58 (с, 2Н); 5,13 (м, 1Н); 6,94 (д, 1Н); 7,14 (с, 1Н); 7,28-7,35 (вс, 5Н); 7,57 (т, 1Н); 7,87-7,95 (м, 3Н); 8,73(дд, 1Н); 10,00 (с, 1Н). Приклад 8 8-[2-(3-фенілпропіл)хроман-6-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 8А Етил12-трифлуорметансульфонілоксиметил-2,3-дигідробензофуран-2-карбоксилат) Способом з прикладу 3А, ви ходячи з етил(2-гідроксимвтил-2,3-дигідробензофуран-5-карбоксилату) та бензилброміду отримали потрібну сполуку, ви хід 88%. 1 Н ЯМР (300мГц, CDCI3) d 1,38 (т, 3Н); 3,07 (дд, 1Н); 3,44 (дд, 1Н); 4,34 (κ, 2Η); 4,60 (дд, 1Н); 4,67 (дд, 1Н); 5,17 (м, 1Н); 6,84 (д, 1Н); 7,90 (с, 1Н); 7,91 (дд, 1Н). 8Б Етил[2-(3-фенілпропіл)-2,3-дигідробензофуран-2-карбоксилат] Способом з прикладу 3Б, ви ходячи з 2-брометилбензолу та етил(2трифлуорметансульфонілоксиметил-2,3-дигідробензофуран-5-карбоксилату) отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи н-гексаном/етилацетатом (95:5), вихід 88%. 1 Н ЯМР (300мГц, CDCI3) d 1,31 (т, 3Н); 1,60-1,83 (м, 4Н); 2,60 (т, 2Н); 2,73 (дд, 1Н); 3,15 (дд, 1Н); 4,29 (к, 2Н); 4,74 (м, 1Н); 6,70 (д, 1Н); 7,10-7,29 (вс, 5Н); 7,80 (с, 1Н); 7,82 (д, 1Н). 8В 2-(3-фенілпропіл)-2,3-дигідробензофуран-2-карбонова кислота Способом з прикладу 6Д, виходячи з етил[2-(3-фенілпропіл)-2,3-дигідробензофуран-2-карбоксилату] отримали потрібну сполуку, ви хід 98%. 1 Н ЯМР (300мГц, CD3OD) d 1,60-1,85 (м, 4Н); 2,62 (т, 2Н); 2,76 (дд, 1Н); 3,21 (дд, 1Н); 4,78 (м, 1Н); 6,65 (д, 1Н); 7,10-7,29 (вс, 5Н); 7,81 (с, 1Н). 8Г N-(3-ацетил-2-гідроксифеніл)-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 2-(3-фенілпропіл)-2,3-дигідробензофуран-2-карбонової кислоти та 3-аміно-2-гідроксіацетофенону отримали потрібну сполуку, вихід 60%. 1 Н ЯМР (300мГц, CD3OD) d 1,60-1,85 (м, 4Н); 2,55 (с, 3Н); 2,63 (т, 2Η); 2,80 (дд, 1Н); 3,22 (дд, 1Н); 4,79 (м, 1Н); 6,71 (д, 1Н); 6,86 (т, 1Н); 7,11-7,25 (вс, 5Н); 7,38 (д, 1Н); 7,62 (д, 1Н); 7,64 (с, 1Н); 8,36 (с, 1Н); 8,66 (д, 1Н). 8Д Етил{8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбоксилат} Способом з прикладу 1Α, ви ходячи з діетилоксалату та N-(3-ацетил-2-гідроксифеніл)-2-(3-фенілпропіл)2,3-дигідробензофуран-5-карбоксаміду отримали потрібну сполуку, яку очищали перекристалізацією з гарячого етанолу, вихід 67%. 1 Н ЯМР (300мГц, CDCI3) d 1,31 (т, 3Н); 1,60-1,83 (м, 4Н); 2,60 (т, 2Н); 2,73 (дд, 1Н); 3,15 (дд, 1Н); 4,29 (κ, 2Η); 4,74 (м, 1Н); 6,70 (д, 1Н); 7,10-7,29 (вс, 5Н); 7,80 (с, 1Н); 7,82 (д, 1Н). 8Е 8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота Способом з прикладу 1Л, виходячи з етил{8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]4-оксо-4Н-1-бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку з т.пл. 184-185°С, яку очищали виварюванням у метанолі, вихід 68%. 1 Н ЯМР (300мГц, ДМСО) d 1,60-1,85 (м, 4Н); 2,68 (т, 2Η); 2,91 (дд, 1Н); 3,38 (дд, 1Н); 4,95 (м, 1Н); 6,88 (д, 1Н); 6,94 (с, 1Н); 7,15-7,32 (вс, 5Н); 7,54 (т, 1Н); 7,83 (дд, 1Н); 7,88 (м, 2Н); 8,07 (дд, 1Н); 10,01 (с, 1Н). Приклад 9 N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3дигідробензофуран-5-карбоксамід 9А N-[4-оксо-2-карбамоїл-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 7А, ви ходячи з етил{8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]4-оксо-4Н-1-бензопіран-2-карбоксилату} та бензилброміду отримали потрібну сполуку, ви хід кількісний. 1 Н ЯМР (300мГц, ДМСО) d 1,65-1,85 (м, 4Н); 2,68 (т, 2Η); 2,91 (дд, 1Н); 3,38 (дд, 1Н); 4,95 (м, 1Н); 6,85 (с, 1Н); 6,88 (д, 1Н); 7,15-7,32 (вс, 5Н); 7,55 (т, 1Н); 7,82-7,95 (м, 3Н); 8,24 (шс, 1Н); 8,30 (д, 1Н); 8,75 (шс, 1Н). 9Б N-[4-оксо-2-ціано-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 2Г, виходячи з N-[4-оксо-2-карбамоїл-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3дигідробензофуран-5-карбоксаміду отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним/етиловим етером зі зростаючою полярністю, вихід 55%. 1 Н ЯМР (300мГц, CDCI3) d 1,70-1,95 (м, 4Н); 2,71 (т, 2Н); 2,91 (дд, 1Н); 3,38 (дд, 1Н); 4,95 (м, 1Н); 6,85 (с, 1Н); 6,88 (д, 1Н); 7,15-7,32 (вс, 5Н); 7,55 (т, 1Н); 7,82-7,95 (м, 3Н); 8,24 (шс, 1Н); 8,30 (д, 1Н); 8,75 (шс, 1Н). 9В N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3-дигідробензофуран-5карбоксамід Способом з прикладу 7В, виходячи з N-[4-оксо-2-ціано-4Н-1-бензопіран-8-іл]-2-(3-фенілпропіл)-2,3дигідробензофуран-5-карбоксаміду отримали жовтувату тверду потрібну сполуку з т.пл. 234-235°С, яку очищали перекристалізацією з суміші метанолу та метиленхлориду, вихід 61%. 1 Н ЯМР (300мГц, ДМСО) d 1,65-1,85 (м, 4Н); 2,66 (т, 2Н); 2,92 (дд, 1Н); 3,39 (дд, 1Н); 4,96 (м, 1Н); 6,90 (д, 1Н); 7,14 (с, 1Н); 7,15-7,32 (вс, 5Н); 7,564 (т, 1Η); 7,87 (дд, 1Н); 7,90 (д, 1Н); 7,92 (с, 1Н); 8,24 (дд, 1Н); 9,98 (с, 1Н). Приклад 10 8-(2-бензилтіометил-2,3-дигідробензофуран-5-карбоксамідо)-4-оксо-4Н-1-бензопіран-2карбонова кислота 10А Етил[2-бензилтіометил-2,3-дигідробензофуран-2-карбоксилат] До розчину 0,992мл (8,47ммоль) бензилмеркаптану у 10мл абсолютного етанолу додали в інертній атмосфері розчин 0,712г (12,72ммоль) гідроксиду калію у 10мл абсолютного етанолу і суміш 15 хвилин перемішували при кімнатній температурі, додавали розчин 3,00г (8,47ммоль) етил[2трифлуорметансульфонілоксиметил-2,3-дигідробензофуран-5-карбоксилату) у 15мл абсолютного етанолу і 24 години перемішували при кімнатній температурі, потім летючі продукти випарювали під зниженим тиском, залишок розподіляли між 50мл води та 50мл етилацетату і водну фазу тричі по 40мл екстрагували етилацетатом. Органічні фази поєднували, сушили і видаляли розчинник під зниженим тиском, одержавши 2,810г (кількісний вихід) потрібного продукту як темне масло. 1 Н ЯМР (300мГц, CDCI3) d 1,34 (т, 3Н); 2,68 (дд, 1Н); 2,77 (дд, 1Η); 2,98 (дд, 1Н); 3,25 (дд, 1Н); 3,78 (с, 2Н); 4,31 (к, 2Н); 4,92 (м, 1Н); 6,76 (д, 1Н); 7,19-7,27 (вс, 5Н); 7,82 (с, 1Н); 7,86 (дд, 1Н). 10Б Етил[2-бензилтіометил-2,3-дигідробензофуран-2-карбоксилат] До розчину 2,70г (8,53ммоль) етил[2-бензилтіометил-2,3-дигідробензофуран-2-карбоксилату] у 100мл етанолу додали 42,6мл 1М розчину гідроксиду калію і 3 години гріли під зворотним холодильником, потім етанол випарювали під зниженим тиском, залишок суспендували у 30мл води 4 рази по 30мл екстрагували етилацетатом. Органічні фази сушили і видаляли розчинник під зниженим тиском, одержавши 2,172г (85%) коричневого твердого потрібного продукту з т.пл. 125-127°С. 1 Н ЯМР (300мГц, CDCI3) d 2,70 (дд, 1Н); 2,81 (дд, 1Н); 3,02 (дд, 1Н); 3,32 (дд, 1Н); 3,79 (с, 2Н); 4,98 (м, 1Н); 6,80 (д, 1Н); 7,20-7,27 (вс, 5Н); 7,89 (с, 1Н); 7,97 (д, 1Н). 10В N-(3-ацетил-2-пдроксифеніл)-2-бензилтіометил-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 2-бензилтіометил-2,3-дигідробензофуран-2-карбонової кислоти та 3-аміно-2-гідроксиацетофенону отримали жовту тверду потрібну сполуку з т.пл. 119-121°С, яку очищали хроматографією на колонці з силікагелем, елююючи н-гексаном/етилацетатом (9:1), вихід 86%. 1 Н ЯМР (300мГц, CDCI3) d 2,61 (с, 3Н); 2,68 (дд, 1Н); 2,80 (дд, 1Н); 3,06 (дд, 1Н); 3,34 (дд, 1Н); 3,79 (с, 3Н); 4,98 (м, 1Н); 6,80 (д, 1Н); 7,20-7,27 (вс, 5Н); 7,46 (д, 1Н); 7,72 (д, 1Н); 7,73 (с, 1Н); 8,53 (с, 1Н); 8,74 (д, 1Н). 10Г Етил{8-[2-бензилтіометил-2,3-дигідробензофуран-5-карбаксамідо]-4-оксо-4Н-1-бензопіран-2карбоксилат} Способом з прикладу 1А, виходячи з діетилоксалату та N-(3-ацетил-2-гідроксифеніл)-2-бензилтіометил2,3-дигідробензофуран-5-карбоксаміду отримали світложовту тверду потрібну сполуку з т.пл. 175-177°С, яку очищали хроматографією на колонці з силікагелем, елююючи хлороформом, вихід 81%. 1 Н ЯМР (300мГц, CDCI3) d 1,47 (т, 3Н); 2,72 (дд, 1Н); 2,34 (дд, 1Н); 3,09 (дд, 1Н); 3,38 (дд, 1Н); 3,80 (с, 3Н); 4,49 (к, 2Н); 4,99 (м, 1Н); 6,85 (д, 1Н); 7,12 (с, 1Н); 7,21-7,35 (вс, 5Н); 7,43 (т, 1Н); 7,76 (д, 1Н); 7,80 (с, 1Н); 7,85 (д, 1Н); 8,70 (с, 1Н); 8,89 (д, 1Н). 10Д 8-[2-бензилтіометил-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбонова кислота Способом з прикладу 1Л, виходячи з етил{8-[2-бензилтіометил-2,3-дигідробензофуран-5-карбоксамідо]4-оксо-4Н-1-бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку з т.пл. 122-125°С, вихід 81%. 1 Н ЯМР (300мГц, ДМСО) d 2,80 (д, 2Н); 3,05 (дд, 1Н); 3,20 (дд, 1Н); 3,85 (с, 3Н); 5,08 (м, 1Н); 6,91 (с, 1Н); 6,92 (д, 1Н); 7,2 (м, 1Н); 7,34 (д, 4Н); 7,54 (т, 1Н); 7,86 (д, 1Н); 7,88 (д, 1Н); 7 ,90 (с, 1Н); 8,08 (дд, 1Н); 10,04 (с, 1Н). Приклад 11 8-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1б9нзопіран-2-карбонова кислота 11A Етил[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-2-карбоксилат] Способом з прикладу 1Г, виходячи з етил(2-гідроксиметил-2,3-дигідробензофуран-5-карбоксилату) та 4'-флуорбензилброміду отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи н-гексаном/етилацетатом (95:5), вихід 68%. 1 Н ЯМР (300мГц, CDCI3) d 1,34 (т, 3Н); 2,99 (дд, 1Н); 3,23 (дд, 1Н); 3,62 (дд, 1Н); 3,68 (дд, 1Н); 4,30 (к, 2Н); 4,52 (дд, 2Н); 5,03 (м, 1Н); 6,79 (д, 1Н); 7,00 (т, 2Η); 7,26 (дд, 2Н); 7,83 (с, 1Н); 7,87 (дд, 1Н). 11Б 2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-2-карбонова кислота Способом з прикладу 6Д, виходячи з етил[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-2карбоксилату] отримали потрібну сполуку, яку очищали перекристалізацією з метанолу, ви хід 94%. 1 Н ЯМР (300мГц, CDCI3) d 3,01 (дд, 1Н); 3,27 (дд, 1Н); 3,65 (м, 2Н); 4,58 (дд, 2Н); 5,05 (м, 1Н); 6,81 (д, 1Н); 7,00 (т, 2Н); 7,27 (дд, 2Н); 7,86 (с, 1Н); 7,92 (дд, 1Н); 12,20 (шир.сигн., 1Н). 11В N-(3-ацетил-2-гідроксифеніл)-2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-2карбонової кислоти отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи н-гексаном/хлороформом (1:1), вихід 81%. 1 Н ЯМР (300мГц, CDCI3) d 2,60 (с, 3Н); 3,05 (дд, 1Н); 3,30 (дд, 1Н); 3,65 (м, 2Н); 4,58 (дд, 1Н); 5,10 (м, 1Н); 6,88 (д, 1Н); 7,01 (т, 2Н); 7,27 (м, 2Н); 7,43 (д, 1Н); 7,71 (д, 1Н); 7,73 (с, 1Н); 8,51 (с, 1Н); 8,71 (д, 1Н) 12,96 (с, 1Н). 11Г Етил{8-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1бензопіран-2-карбоксилат} Способом з прикладу і А, ви ходячи з діетилоксалату та N-(3-ацетил-2-гідроксифеніл)-2-(4'флуорбензилоксиметил)-2,3-дигідробонзофуран-5-карбоксаміду отримали світложовту тверду потрібну сполуку з т.пл. 175-177°С. яку очищали хроматографією на колонці з силікагелем, елююючи нгексаном/хлороформом (1:2), вихід 53%. 1 Н ЯМР (300мГц, CDCI3) d 1,46 (т, 3Н); 3,10 (дд, 1Н); 3,35 (дд, 1Н); 3,70 (м, 2Н); 4.49 (к, 2Н); 4,58 (дд, 1Н); 5,10 (м, 1Н); 6,88 (д, 1Н); 7,01 (т, 2Н); 7,13 (с, 1Н); 7,30 (м, 2Н); 7,44 (т, 1Н); 7,77 (дд, 1Н); 7,83 (с, 1Н); 7,87 (д, 1Н); 8,71 (с, 1Н); 8,90 (д, 1Н). 11Д 8-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота Способом з прикладу 1Л, виходячи з етил{8-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку з т.пл. 195197°С, яку очищали перекристалізацією з метанолу. 1 Н ЯМР (300мГц, ДМСО) d 3,10 (дд, 1Н); 3,37 (дд, 1Н); ); 3,68 (д, 2Н); 4,56 (с, 2Н); 5,12 (м, 1Н); 6,95 (с, 1Н); 7,17 (т, 2Н); 7,38 (т, 2Н); 7,54 (т, 1Н); 7,88 (вс, 3Н); 8,08 (дд, 1Н); 10,03 (с, 1Н). Приклад 12 N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-2-(4'-флуорбензилоксиметил)-2,3дигідробензофуран-5-карбоксамід 12А N-[4-оксо-2-карбамот-4Н-1-бензопіран-8-іл]-2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5карбоксамід До розчину 1,219г (2,36ммоль) етил{8-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбоксилату} у 100мл сухого тетрагідрофурану при -20°С додали 12мл приблизно 4М насиченого розчину аміаку у метанолі, перемішували при 0°С 4 години і видалили розчинник, отримавши 1,158г (кількісний вихід) потрібної сполуки. 1 Н ЯМР (300мГц, ДМСО) d 3,09 (дд, 1Н); 3,35 (дд, 1Н); ); 3,67 (с, 2Н); 4,56 (с, 2Н); 5,11 (м, 1Н); 6,92 (д, 1Н); 7,18 (т, 2Н); 7,38 (т, 2Н); 7,53 (т, 1Н); 7,84 (вс, 3Н); 8,25 (шс, 1H); 8,38 (д, 1Н); 8,60 (шс, 1Н); 10,25 (с, 1Н). 12Б N-[4-оксо-2-ціано-4H-1-бензопіран-8-іл]-2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5карбоксамід Способом з прикладу 2Г, реакцією N-[4-оксо-2-карбамоїл-4Н-1-бензопіран-8-іл]-2-(4’флуорбензилоксиметил)-2,3-дипдробензофуран-5-карбоксаміду з оксихлоридом фосфору у Ν,Νдиметилформаміді при 0°С отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом(1:1), вихід 77%. 1 Н 1Н ЯМР (300мГц, CDCI3) d 3,10 (дд, 1Н); 3,33 (дд, 1Н); 3,70 (м, 2Н); 4,59 (дд, 2Н); 5,10 (м, 1Н); 6,82 (с, 1Н); 6,89 (д, 1Н); 7,02 (т, 2Н); 7,38 (м, 2Н); 7,48 (т, 1Н); 7,72 (дд, 1Н); 7,78 (с, 1Н); 7,88 (д, 1Н); 8,35 (с, 1Н); 8,79 (д, 1Н). 12B N-[4-оксо-2-(1Н-5-тетразоліл) 4Н-1-бензопіран-8-іл]-2-(4'-флуорбензилоксиметил)-2,3дигідробензофуран-5-карбоксамід Способом з прикладу 7В, виходячи з N-[4-оксо-2-ціан-4Н-1-бензопіран-8-іл]-2-(4'флуорбензилоксиметил)-2,3-дигідробензофуран-5-карбоксаміду отримали білу тверду потрібну сполуку з т.пл. 229-232°С, яку очищали виварюванням з етиловим етером, вихід 77%. 1 1 Н Н Я МР (300мГц, ДМСО) d 3,12 (дд, 1Н); 3,40 (дд, 1Н); 3,72 (д, 2Н); 4,60 (дд, 2Н); 5,12 (м, 1Н); 6,93 (д, 1Н); 7,05 (т, 2Н); 7,25 (с, 1Н); 7,33 (м, 2Н); 7,52 (т, 1Н); 7,89 (д, 1Н); 7,92 (с, 1Н); 7,96 (дд, 1Н); 8,73 (д, 1Н); 10,05 (с, 1Н). Приклад 13 8-[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1бензопіран-2-карбонова кислота 13А Метил(3-хлор-4-гідроксибензоат) Способом з прикладу 5В, виходячи з 3-хлор-4-гідроксибензойної кислоти отримали потрібну сполуку, вихід 87%. 1 Н ЯМР (300мГц, CDCI3) d 1,39 (т, 3Н); 4,37 (к, 2Н); 7,04 (д, 1Н); 7,89 (дд, 2Н); 8,06 (д, 1Н). 13Б Етил(4-алілокси-3-хлорбензоат) Способом з прикладу 6А, ви ходячи· з етил(3-хлор-4-гідроксибензоату) отримали потрібну сполуку, ви хід 91%. 1 Н ЯМР (300мГц, CDCI3) d 1,39 (т, 3Н); 4,37 (к, 2Н); 4,69 (д, 2Н); 5,35 (дд, 1Н); 5,49 (дд, 1Н); 6,07 (м, 1Н); 6,94 (д, 2Н); 7,91 (дд, 2Н); 8,07 (д, 1Н). 13В Етил(3-аліл-5-хлор-4-гідроксибензоат) Способом з прикладу 6Б, виходячи з етил(4-алілокси-3-хлорбензоату) отримали потрібну сполуку, яку очищали перегонкою під зниженим тиском (0,2торр), вихід кількісний. 1 Н ЯМР (300мГц, CDCI3) d 1,38 (т, 3Н); 3,45 (д, 2Н); 4,35 (к, 2Н); 5,09 (д, 1Н); 5,14 (д, 1Н); 6,01 (м, 1Н); 7,76 (д, 1Н); 7,92 (д, 1Н). 13Г Етил(7-хлор-2-гідроксиметил-2,3-дигідробензофуран-5-карбоксилат) Способом з прикладу 6В, ви ходячи з етил(3-аліл-5-хлор-4-гідроксибензоату) отримали потрібну сполуку, ви хід 80%. 1 НН ЯМР (300мГц, CDCI3) d 1,37 (т, 3Н); 3,19 (дд, 2Н); 3,33 (дд, 2Н); 3,78 (дд, 2Н); 3,97 (дд, 2Н); 4,33 (к, 2Н); 5,09 (м, 1Н); 7,74 (д, 1Н); 7,85 (д, 1Н). 13Д Етил(7-хлор-2-трифлуорметансульфонілоксиметил-2,3-дигідробензофуран-5-карбоксилат) Способом з прикладу 3А, виходячи з етил(7-хлор-2-гідроксиметил-2,3-дигідробензофуран-5карбоксилату) отримали потрібну сполуку, вихід кількісний. 1 Н ЯМР (300мГц, CDCI3) d 1,38 (т, 3Н); 3,20 (дд, 2Н); 3,53 (дд, 2Н); 4,33 (κ, 2Н); 4,67 (дд, 1Н); 4,77 (дд, 1Н); 5,28 (м, 1Н); 7,76 (д, 1Н); 7,88 (д, 1Н). 13Е Етил[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксилат] Способом з прикладу 3Б, виходячи з етил(7-хлор-2-трифлуорметансульфонілоксиметил-2,3дигідробензофуран-5-карбоксилату) отримали потрібну сполуку, яку очи щали хроматографією на колонці з силікагелем, елююючи петролейним етером/етилацетатом (95:5), вихід 58%. 1 Н ЯМР (300мГц, CDCI3) d 1,36 (т, 3Н); 1,70-1,92 (м, 4Н); 2,68 (т, 2Н); 2,91 (дд, 1Н); 3,34 (дд 2Н); 4,32 (к, 2Н); 4,95 (м, 1Н); 7,15-7,30 (вс, 5Н); 7,71 (д, 1Н); 7,86 (д, 1Н). 13Є 2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонова кислота Способам з прикладу 3Б, ви ходячи з етил[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5карбоксилату] отримали потрібну сполуку, ви хід 92%. 1 Н ЯМР (300мГц, CDCI3) d 1,70-1,92 (м, 4Н); 2,70 (т, 2Η); 2,95 (дд, 1Н); 3,40 (дд, 2Н); 4,99 (м, 1Н); 7,157,30 (вс, 5Н); 7,73 (д, 1Н); 7,83 (д, 1Н). 13Ж N-(3-ацетил-2-гідроксифеніл)-7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 7-хлор-2-(3-фенілпропіл)-2,3-дилдробензофуран-5-карбонової кислоти отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (1:1), вихід 84%. 1 Н ЯМР (300мГц, CDCI3) d 1,60-1,88 (м, 4Н); 2,50 (с, 3Н); 2,63 (т, 2Н); 2,82 (дд, 1Н); 3,24 (дд, 2Н); 4,84 (м, 1Н); 6,79 (т, 1Н); 7,11-7,25 (вс, 5Н); 7,29 (д, 1Н); 7,45 (д, 1Н); 7,63 (д, 1Н); 8,38 (с, 1Н); 8,58 (д, 1Н). 13З Етил{8-[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбоксилан} Способом з прикладу 1А, виходячи з діетилоксалату та N-(3-ацетил-2-гідроксифеніл)-7-хлор-2-(3фенілпропіл)-2,3-дигідробензофуран-5-карбоксаміду отримали потрібну сполуку, яку очи щали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом зі зростаючою полярністю, вихід 57%. 1 НН ЯМР (300мГц, CDCI3) d 1,47 (т, 3Н); 1,76-1,96 (м, 4Н); 2,72 (т, 2Η); 3,01 (дд, 1Н); 3,44 (дд, 1Н); 4,51 (к, 2Н); 5,03 (м, 1Н); 7,16 (с, 1Н); 7,19-7,33 (вс, 5Н); 7,47 (т, 1Н); 7,71 (с, 1Н); 7,79 (с, 1Н); 7,89 (дд, 1Н); 8,66 (с, 1Н); 8,88 (дд, 1Н). 13І 8-[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота Способом з прикладу 1Л, виходячи з етил{8-[7-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбоксилату} отримали білу тверду потрібну сполуку з т.пл. 224225°С, яку очищали хроматографією на колонці з силікагелем, елююючи метанолом/хлороформом (2:98), вихід 54%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,75-1,95 (м, 4Н); 2,73 (т, 2Н); 3,02 (дд, 1Н); 3,46 (дд, 1Н); 5,04 (м, 1Н); 7,15 (с, 1Н); 7,19-7,32 (вс, 5Н); 7,50 (т, 1Н); 7,74 (д, 1Н); 7,85 (д, 1Н); 7,94 (д, 1Н); 8,53 (дд, 1Н). Приклад 14 8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-6-флуор-4-оксо-4Н-1бензопіран-2-карбонооа кислота 14А 4-флуорфенілацетат Способом з прикладу 1Є, ви ходячи з 4-флуорфенолу отримали потрібну сполуку як безбарвне масло, вихід 94%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 2,29 (с, 3Н); 7,06 (д, 4Н). 14Б 5-флуор-2-пдроксіацетофенон Способом з прикладу 11Н, виходячи з 4-флуорфенілацетату отримали білу тверду потрібну сполуку з т.пл. 55-58°С, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (9:1), вихід 78%. 1 Н ЯМР (300мГц, CDCI3) dδ 2,62 (с, 3Н); 6,95 (дд, 1Н); 7,22 (дт, 4Н); 7,40 (дд, 1Н); 11,98 (с, 1Н). Способом з прикладу 13, виходячи з 4-флуорфенілацетату отримали жовту тверду потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (1:1), вихід 52%. 1 Н ЯМР (300мГц, CDCI3) d 2,72 (с, 3Н); 7,81 (дд, 1Н); 7,96 (д, 1Н); 12,62 (с, 1Н). 14Г 3-аміно-5-флуор-2-гідроксіацетофенон Способом, з прикладу 1Б, виходячи з 5-флуор-2-гідрокси-3-нітроацетофенону, розчиненого у метанолі/хлороформі (9:1) потрібну сполуку отримали з кількісним виходом. 1 Н ЯМР (300мГц, CD3OD) d 2,55 (с, 3Н); 6,68 (дд, 1Н); 7,84 (дд, 1Н). 14Д N-(3-ацетил-5-флуор-2-гідроксифеніл)-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонової кислоти та 3-аміно-5-флуор-2-гідроксіацетофенону отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (1:1),вихід 79%. 1 Н ЯМР (300мГц, CDCI3) d 1,70-1,95 (м, 4Н); 2,58 (с, 3Н); 2,70 (т, 2Η); 2,892 (дд, 1Н); 3,31 (дд, 2Н); 4,79 (м, 1Н); 6,72 (д, 1Н); 7,11-7,25 (вс, 5Н); 7,29 (д, 1Н); 7,40 (д, 1Η);·7,62 (д, 1Н); 7,65 (с, 1Н); 8,19 (с, 1Н); 8,66 (д, 1Н). 14Е Етил{8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-6-флуор-4-оксо-4Н-1-бензопіран2-карбоксилат} Способом з прикладу 1А, ви ходячи з діетилоксалату та N-(3-ацетил-5-флуор-2-гідроксифеніл)-2-(3фенілпропіл)-2,3-дигідробензофуран-5-карбоксаміду отримали потрібну сполуку, яку очи щали перекристалізацією з етанолу, ви хід 55%. 1 Н ЯМР (300МГц, CDCI3) d 1,48 (т, 3Н); 1,70-1,92 (м, 4Н); 2,79 (т, 2Н); 2,90 (дд, 1Н); 3,32 (дд, 1Н); 4,48 (к, 2Н); 4,90 (м, 1Н); 6,80 (д, 1Н); 7,08 (с, 1Н): 7,18-7,32 (вс, 5Н); 7,42 (дд, 1Н); 7,69 (дд, 1Н); 7,77 (С, 1Н); 8,70 (дд, 1Н); 8,71 (с, 1Н). 14Є 8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо|-6-флуор-4-оксо-4Н-1-бензопіран-2карбонова кислота Способом з прикладу 1Л, виходячи з етил{8-[2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]6-флуор-4-оксо-4Н-1-бензопіран-2-карбоксилату} отримали білу тверду потрібну сполук у з т.пл. 183-185°С, яку очищали хроматографією на колонці з силікагелем, елююючи метанолом/хлороформом (5:95), вихід 66%. 1 Н ЯМР (300мГц, ДМСО) d 1,65-1,85 (м, 4Н); 2,64 (т 2Η); 2,87 (дд, 1Н); 3,31 (дд, 1Н); 4,91 (м, 1Н); 6,83 (д, 1Н); 6,87 (с, 1Н); 7,15-7,32 (вс, 5Н); 7,49 (дд, 1Н); 7,80 (д, 1Н); 7,82(с, 1Н); 8,14 (дд, 1Н); 10,17 (с, 1Н). Приклад 15 8-[4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1бензопіран-2-карбонова кислота 15А 4-алілокси-2-хлорбензонітрил Способом з прикладу 6А, ви ходячи з 2-хлор-4-гідроксибензонітрилу отримали білу потрібну сполуку з т.пл. 50-52°С, вихід 98%. 1 Н ЯМР (300мГц, CDCI3) d 4,59 (д, 2Н); 5,35 (дд, 1Н); 5,40 (дд, 1Н); 6,00 (м, 1Н); 6,88(дд,2Н); 7,03 (д,2Н); 7,59 (д). 15Б 5-аліл-2-хлор-4-гідроксибензонітрил та 3-аліл-2-хлор-4-гідроксибензонітрил Способом з прикладу 6Б, ви ходячи з 4-алілокси-2-хлорбензонітрилу отримали суміш 5-аліл-2-хлор-4гідроксибензонітрилу та 3-аліл-2-хлор-4-гідроксибензонітрилу, яку розділяли хроматографією на колонці з силікагелем, елююючи петролейним етером/етиловим етером (8:2), отримали 5-аліл-2-хлор-4гідроксибензонітрил, вихід 39%, а елююючи петролейним етером/етиловим етером (6:4) ), отримали 3-аліл2-хлор-4-гідроксибензонітрил, вихід 51%. 1 Н ЯМР (300мГц, ізомер 5, CDCI3) d 3,39 (д, 5,12-5,28 (м, 2Н); 5,98 (м, 1Н); 7,03 (с, 2Н);7,44(с, 1Н). 1 Н ЯМР (300мГц, ізомер 3, CDCI3) d 3,61 (д, 5,07-5,18 (м, 2Н); 5,95 (м, 1Н); 6,86 (д, 1Н); 7,46 (д, 1Н). 15В 4-хлор-2-гідроксиметил-2,3-дигідробензофуран-5-карбонітрил Способом з прикладу 6В, виходячи з 3-аліл-2-хлор-4-гідроксибензонітрилу отримали потрібну сполуку, вихід 92%. 1 Н ЯМР (300мГц, CDCI3) d 3,14 (дд, 1Н); 3,32 (дд, 1Н); 3,79 (дд, 1Н); 3,92 (дд, 1Н); 5,08 (м, 1Н); 6,72 (д, 1Н); 7,41 (д, 1Н). 15Г 4-хлор-2-трифлуорметансульфонілоксиметил-2,3-дигідробензофуран-5-карбонітрил Способом з прикладу 3А, ви ходячи з 4-хлор-2-гідроксиметил-2,3-дигідробензофуран-5-карбонітрилу отримали потрібну сполуку, ви хід 64%. 1 Н ЯМР (300мГц, CDCI3) d 3,19 (дд, 2Н); 3,50 (дд, 2Н); 4,68 (дд, 1Н); 4,70 (дд, 1Н); 5,30 (м, 1Н); 6,91 (д, 1Н); 7,50 (д, 1Н). 15Д 4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонітрил Способом з прикладу 3Б, виходячи з 4-хлор-2-трифлуорметансульфонілоксиметил-2,3дигідробензофуран-5-карбонітрилу та 2-брометилбензолу отримали потрібну сполуку, яку очи щали хроматографією на колонці з силікагелем, елююючи петролейним етером/етиловим етером (95:5), вихід 68%. 1 Н ЯМР (300мГц, CDCI3) d 1,65-1,90 (м, 4Н); 2,68 (т, 2Η); 2,87 (дд, 1Н); 3,12 (дд, 2Н); 4,92 (м, 1Н); 6,69 (д, 1Н); 7,14-7,32 (вс, 5Н); 7,40 (д, 1Н). 15Е 4-хлор-2-(3-фенілпропіл)-2,3-дипдробензофуран-5-карбонова кислота Способом з прикладу 5Є, виходячи з 4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонітрилу отримали потрібну сполуку, ви хід 89%. 1 Н ЯМР (300мГц, CDCI3) d 1,65-1,90 (м, 4Н); 2,70 (т, 2Η); 2,91 (дд, 1Н); 3,38 (дд, 2Н); 4,93 (м, 1Н); 6,69 (д, 1Н); 7,14-7,32 (вс, 5Н); 7,98 (д, 1Н). 15Є N-(3-ацетил-2-гідроксифеніл)-4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонової кислоти та 3-аміно-2-гідроксіацетофенону отримали потрібну сполуку, ви хід 93%. 1 Н ЯМР (300мГц, CDCI3) d 1,60-1,85 (м 4Н); 2,60 (с, 3Н); 2,65 (т, 2Н); 2,90 (дд, 1Н); 3,32 (дд, 2Н): 4,88 (м, 1Н); 6,71 (д, 1Н); 6,92 (т, 1Н); 7,15-7,30 (вс, 5Н); 7,43 (д, 1Н); 7,67 (д, 1Н); 8,75 (д, 1Н); 8,80 (с, 1Н); 12,92 (с, 1Н). 15Ж Етил{8-[4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран2-карбоксилат} Способом з прикладу 1А, виходячи з діетилоксалату та N-(3-ацетил-2-гідроксифеніл)-4-хлор-2-(3фенілпропіл)-2,3-дигідробензофуран-5-карбоксаміду отримали потрібну сполуку, яку очи щали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом 4:6, вихід 61%. 1 Н ЯМР (300мГц, CDCI3) d 1,40 (т, 3Н); 1,70-1,92 (м, 4Н); 2,68 (т, 2Н); 2,91 (дд, 1Н); 3,35 (дд, 1Н); 4,42 (κ, 2Η); 4,92 (м, 1Н); 6,72 (д, 1Н); 7,10 (с, 1Н); 7,15-7,32 (вс, 5Н); 7,40 (т, 1Н); 7,85 (дд, 1Н); 7,90 (д, 1Н); 8,93 (д, 1Н); 9,42 (с, 1Н). 15З 8-[4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота Способом з прикладу 1Л, виходячи з етил{8-[4-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбоксилату} отримали жовтувату тверду потрібну сполуку, що розкладається вище 265°С, вихід 81%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,65-1,92 (м, 4Н); 2,70 (т, 2Η); 2,94 (дд, 1Н); 3,41 (дд, 1Н); 4,92 (м, 1Н); 6,75 (д, 1Н); 7,11 (с, 1Н); 7,15-7,35 (вс, 5Н); 7,48 (м, 2Н); 7,94 (д, 1Н); 8,79 (д, 1Н). Приклад 16 8-[6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1бензопіран-2-карбонова кислота 16А 6-хлор-2-гідроксиметил-2,3-дигідробензофуран-5-карбонітрил Сіособом з прикладу 6В, виходячи з 5-аліл-2-хлор-4-гідроксибензонітрилу отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом 1:4, вихід 79%. 1 Н ЯМР (300мГц, CDCI3) d 3,10 (дд, 1Н); 3,29 (дд, 1Н); 3,77 (дд, 1Н); 3,92 (дд, 1Н); 5,08 (м, 1Н); 6,88 (д, 1Н); 7,41 (с, 1Н). 16Б 6-хлор-2-трифлуорметансульфонілоксиметил-2,3-дигідробензофуран-5-карбонітрил Способом з прикладу 3А, ви ходячи з 6-хлор-2-гідроксиметил-2,3-дигідробензофуран-5-карбонітрилу отримали потрібну сполуку, ви хід 76%. 1 Н ЯМР (300мГц, CDCI3) d 3,13 (дд, 2Н); 3,49 (дд, 2Н); 4,68 (дд. 1Н); 4,69 (дд, 1Н); 5,30 (м, 1Н); 6,93 (с, 1Н); 7,44 (с, 1Н). 16В 6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонітрил Способом з прикладу 3Б, виходячи з 6-хлор-2-трифлуорметансульфонілоксиметил-2,3дигідробензофуран-5-карбонітрилу та 2-брометилбензолу отримали потрібну сполуку, яку очи щали хроматографією на колонці з силікагелем, елююючи петролейним етером/етиловим етером (9:1), вихід 20%. 1 Н ЯМР (300мГц, CDCI3) d 1,65-1,90 (м, 4Н); 2,66 (т, 2Н); 2,78 (дд, 1Н); 3,23 (дд, 2Н); 4,89 (м, 1Н); 6,78 (д, 1Н); 7,14-7,30 (вс, 5Н). 16Г 6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонова кислота Способом з прикладу 5Є, виходячи з 6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбонітрилу отримали потрібну сполуку, ви хід 77%. 1 Н ЯМР (300мГц, CDCI3) d 1,65-1,90 (м, 4Н); 2,62 (м, 3Н); 3,07 (м, 1Н); 4,76 (м, 1Н); 6,68 (с, 1Н); 7,14-7,32 (вс, 5Н); 7,71 (с, 1Н). 16Д N-(3-ацетил-2-пдроксифеніл)-6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамід Способом з прикладу 1И, виходячи з 6-хлор-2-(3-фенілпроліл)-2,3-дигідробензофуран-5-карбонової кислоти та 3-аміно-2-гідроксіацетофенону отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи гексаном/етилацетатом (1:1), вихід 42%. 1 Н ЯМР (300мГц, CDCI3) d 1,60-1,85 (м, 4Н); 2,56 (с, 3Н); 2,63 (т, 2Η); 2,74 (дд, 1Н); 3,18 (дд, 2Н); 4,80 (м, 1Н); 6,72 (д, 1Н); 6,87 (т, 1Н); 7,15-7,30 (вс, 5Н); 7,38 (дд, 1Н); 7,59 (с, 1Н); 8,71 (д, 1Н); 8,86 (с, 1Н); 12,92 (с, 1Н). 16Е Етил{8-[6-хлор-2-(3-фенілпропіл)2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбоксилат} Способом з прикладу 1А, виходячи з діетилоксалату та N-(3-ацетил-2-гідроксифеніл)-6-хлор-2-(3фенілпропіл)-2,3-дигідробензофуран-5-карбоксаміду отримали потрібну сполуку, яку очи щали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом 4:6, вихід 75%. 1 Н ЯМР (300мГц, CDCI3) d 1,42 (т, 3Н); 1,70-1,92 (м, 4Н); 2,68 (т, 2Н); 2,85 (дд, 1Н); 3,29 (дд, 1Н); 4,45 (к, 2Н); 4,92 (м, 1Н); 6,81 (с, 1Н); 7,12 (с, 1Н); 7,15-7,32 (вс, 5Н); 7,43 (т, 1Н); 7,85 (дд, 1Н); 7,86 (с, 1Н); 8,93 (д, 1Н); 9,52 (с, 1Н). 16Є 8-[6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5-карбоксамідо]-4-оксо-4Н-1-бензопіран-2карбонова кислота Способом з прикладу 1Л, виходячи з етил-{8-[6-хлор-2-(3-фенілпропіл)-2,3-дигідробензофуран-5карбоксамідо]-4-оксо-4Н-1-бензопіран-2-карбоксилату} отримали жовтувату тверду потрібну сполуку, що розкладається вище 265°С, вихід 78%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,65-1,92 (м, 4Н); 2,70 (т, 2Н); 2,80 (дд, 1Н); 3,22 (дд, 1Н); 4,80 (м, 1Н); 6,73 (с, 1Н); 7,11 (с, 1Н); 7,15-7,35 (вс, 5Н); 7,42 (т, 1Н); 7,65 (с, 1Н); 7,86 (дд, 1Н); 8,81 (д, 1Н). Приклад 17 N-[4-оксо-2-(1Н-5-тетразоліл)-4Н-1-бензопіран-8-іл]-1-(4-фенілбутил)-3-метиліндол-5карбоксамід 17А Метил(індол-5-карбоксилат) Способом з прикладу 13А, виходячи з індол-5-карбонової кислоти отримали потрібну сполуку, ви хід 92%. 1 Н ЯМР (300мГц, CDCI3) d 3,98 (с, 3Н); 6,64 (т, 1Н); 7,26 (т, 1Н); 7,40 (д, 1Н); 7,91 (дд, 1Н); 8,43 (с, 1Н); 8,53 (шс, 1Н). 17Б Метил(3-форміліндол-5-карбоксилат) Способом з прикладу 13Д, виходячи з метил(індол-5-карбоксилату) отримали потрібну сполуку, ви хід 90%. 1 Н ЯМР (300мГц, CDCI3) d 3,90 (с, 3Н); 6,63 (д, 1Н); 7,90 (д, 1Н); 8,45 (с, 1Н); 8,80 (с, 1Н); 10,00 (с, 1Н); 12,46 (шс, 1Н). 17В Метил[1-(4-фенілбутил)-3-форміліндол-5-карбоксилат] До розчину 2,234г (11,0ммоль) метил(3-форміліндол-5-карбоксилату) та 1,259г (11,2ммоль) т-бутоксиду калію у 50мл сухого Ν,Ν-диметилформаміду додали 2,385г (11,2ммоль) 1-бром-4-фенілбутану і суміш 18 годин перемішували при кімнатній температурі, потім розчинник випарювали під зниженим тиском, залишок розподіляли між 50мл насиченого NaCl та 50мл хлороформу і водну фазу тричі по 50мл екстрагували хлороформом. Органічні фази поєднували, сушили і видаляли розчинник під зниженим тиском, одержавши сирий продукт, який очищали хроматографією на колонці з силікагелем, елююючи гексаном/етилацетагом (7:3), одержавши 2,847г (87%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,66 (м, 2Н); 1,91 (м, 2Н); 2,64 (т, 2Н); 3,93 (с, 3Н); 4,16 (т, 2Н); 7,11 (д, 2Н); 7,19 (м, 1Н); 7,25 (д, 2Н); 7,33 (д, 1Н); 7,70 (с, 1Н); 8,00 (дд, 1Н); 8,99 (с, 1Н); 9,98 (с, 1Н). 17Г Метил[1-(4-фенілбутил)-3-метиліндол-5-карбоксилат] До розчину 0,600г (1,79ммоль) метил(3-форміліндол-5-карбоксилату) у 50мл сухого дихлорметану послідовно додали 0,857г (2,69ммоль) йодиду цинку та 0,843г (13,41ммоль) борогідриду натрію і cyміш 1,5 години перемішували при 85°С, потім профільтрували крізь броунмілерит, промивши фільтрат 200мл дихлорметану, розчинник випарювали під зниженим тиском, одержавши сирий продукт, який очищали хроматографією на колонці з силікагелем, елююючи гексаном/етилацетатом (98:2), одержавши 459мг (80%) потрібного продукту. 1 НН ЯМР (300мГц, CDCI3) d 1,59 (м, 2Н); 1,80 (м, 2Н); 2,32 (с, 3Н); 2,58 (т, 2Η); 3,91 (с, 3Н); 4,00 (т, 2Н); 6,84 (с, 1Н); 7,08 (д, 2Н); 7,17 (м, 1Н); 7,20-7,27 (м, 3Н); 7,87 (дд, 1Н); 8,34 (д, 1Н). 17Д 1-(4-фенілбутил)-3-метиліндол-5-карбонова кислота Способом з прикладу 6Д, виходячи з метил(3-метиліндол-5-карбоксилату), одержали потрібний продукт, вихід кількісний. 1 Н ЯМР (300мГц, CDCI3) d 1,60 (м, 2Н); 1,80 (м, 2Н); 2,34 (с, 3Н); 2,59 (т, 2Η); 4,02 (т, 2Η); 6,86 (с, 1Н); 7,10 (д, 2Н); 7,18 (д, 1Н); 7,22-7,26 (м, 3Н); 7,97 (дд, 1Н); 8,45 (д, 1Н). 17Е N-[4-оксо-2-(1Н-5-тетразол1л)-4Н-1-бензопіран-8-іл]-1-(4-фенiлбутил)-3-метиліндол-5-карбоксамід Способом з прикладу 1И, виходячи з 1-(4-фенілбутил)-3-метиліндол-5-карбонової кислоти та 8-аміно-4оксо-2-(5-1Н-тетразоліл)-4Н-1-бензопірану отримали жовту тверду потрібну сполуку з т.пл. 186-187°С, яку очищали перекристалізацією з метанолу, вихід 54%. 1 Н ЯМР (300мГц, CDCI3) d 1,53 (м, 2Н); 1,78 (м, 2Н); 2,35 (с, 3Н); 2,59 (т, 2Н); 4,21 (т, 2Н); 6,86 (с, 1Н); 7,13-7,18 (вс, 4Н); 7,23-7,29 (вс, 3Н); 7,57 (м, 2Н); 7,83 (дд, 1Н); 8,87 (дд, 1Н); 8,33 (с, 1Н); 8,38 (д, 1Н); 10,05 (с, 1Н). Приклад 18 8-[[4-(4-фенілбутокси)феніл]метилокси]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 18А Метил(4-(4-фенілбутокси)бензоат] До суміші 3г (19,7ммоль) метил(4-гідроксибензоату), 7,74г (29,6ммоль) трифеніл фосфіну та 3,04мл (19,7ммоль) фенілбутанолу у 110мл безводного тетрагідрофурану додали 4,65мл (29,67ммоль) діетилазидокарбоксилату і перемішували 36 годин при кімнатній температурі, додавали 500мл етилового етеру і залишали кристалізуватися при 0°С. Осад відфільтровували, фільтрат промивали послідовно 0,2М соляною кислотою, 5% гідрокарбонатом натрію та насиченим хлоридом натрію, сушили і видаляли розчинник під зниженим тиском, залишок очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом зі зростаючою полярністю, отримавши 3,856г (70%) потрібного продукту. 1 НН ЯМР (300мГц, CDCI3) d 1,82 (м, 4Н); 2,69 (т, 2Η); 3,87 (с, 3Н); 4,00 (т, 2Η); 6,88 (д, 2Н); 7,18-7,31 (вс, 5Н); 7,98 (д, 2Н). 18Б 4-(4-фенілбутокси)бензойна кислота Способом з прикладу 10Б, виходячи з метил[4-[4-фенілбутокси)бензоату] отримали потрібний продукт, що очищали виварюванням у етиловому етері, ви хід 92%. 1 Н ЯМР (300мГц, CDCI3) d 1,81 (м, 4Н); 2,68 (т, 2Н); 4,01 (т, 2Н); 6,90 (д, 2Н); 7,16-7,31 (вс, 5Н); 7,97 (д, 2Н). 18В 4-(4-фенілбутокси)бензиловий спирт До суспензії 0,309г (7,62ммоль) алюмогідриду літію у 65мл безводного тетрагідрофурану під інертною атмосферою додали розчин 1,03г (3,81ммоль) 4-(4-фенілбутокси)бензойної кислоти у 20мл сухого етилового етеру і суміш 2 години перемішували при кімнатній температурі, потім додавали насичений розчин хлориду натрію, і водну фазу тричі по 50мл екстрагували етилацетатом. Органічні фази поєднували, сушили і видаляли розчинник під зниженим тиском, одержавши сирий продукт, який очищали виварюванням в етиловому етері, екстракт випарювали під зниженим тиском, отримавши 0,556г (57%) погрібного продукту 1 Н ЯМР (300мГц, CDCI3) d 1,79 (м, 4Н); 2,65 (т, 2Н); 3,92 (т, 2Н); 4,54 (с, 2Н); 6,85 (д, 2Н); 7,13-7,28 (вс, 7Н). 18Г 4-(4- фенілбутокси)бензилхлорид До розчину 0,556г (2,17ммоль) 4-(4-фенілбутокси)бензилового спирту у 10мл хлороформу додали 0,288мл і 24 години перемішували при кімнатній температурі, потім випарювали досуха під зниженим тиском, отримавши 0,595г (кількісний вихід) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,76 (м, 4Н); 2,64 (т, 2Н); 3,89 (т, 2Н); 4,49 (с, 2Н); 6,81 (д,2Н); 7,13-7,28 (вс, 7Н). 18Д 2-(2,3-диметоксифеніл)етан-2-он До розчину 10,0г (60,2ммоль) 2,3-диметоксибензальдегіду у 100мл сухого етилового етеру додали при 0°С 35мл 3М розчину броміду метилмагнію у етиловому етері і суміш 0,5 години перемішували при 0°С, потім додавали етиловий етер та насичений розчин хлориду амонію, і водну фазу екстрагували етиловим етером. Органічні екстракти сушили і видаляли розчинник під зниженим тиском, отримавши 10,06г (92%) потрібного продукту 1 Н ЯМР (300мГц, CDCI3) d 1,45 (д, 3Н); 3,02 (шс, 1Н); 3,83 (с, 3Н); 4,54 (с, 2Н); 5,12 (м, 1Н); 6,81 (дд, 1Н); 6,96-7,06 (вс, 2Н). 18Е 2',3'-диметоксіацетофенон До розчину 24,76г дихромату калію, 124мл води та 12мл концентрованої сульфатної додали 10,06г (55,3ммоль) 2-(2,3-диметоксифеніл)етан-2-олу і перемішували суміш 18 годин при кімнатній температурі, потім екстрагували етиловим етером, двічі промивали 150мл 5% карбонату калію та один раз 100мл насиченого розчину хлориду натрію, сушили і видаляли розчинник під зниженим тиском, залишок очищали дистиляцією під високим вакуумом. При тиску 0,3торр та 85°С було перегнано 6,47г (65%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 2,62 (с, 3Н); 3,88 (с, 3Н); 3,90 (с, 3Н); 7,05-7,10 (вс, 2Н);7,21 (дд, 1Н). 18Є 2',3'-дигідроксіацетофенон До розчину 4,85г (26,9ммоль) 2',3'-диметоксіацетофенону у 100мл дихлорметану додали при -70°С 68мл 1М розчину триброміду бору у ди хлорметані і суміш залишали холодною, 2,5 години перемішуючи при кімнатній температурі, потім додавали 70мл метанолу перемішували 1 годину і випарювали досуха. Залишок розчиняли у 250мл етилацетату, промивали 30мл 2% гідрокарбонату натрію, сушили і видаляли розчинник, отримавши сирий продукт, який очищали перекристалізацією з метанолу, одержавши 3,10г (76%) жовтого твердого потрібного продукту 1 Н ЯМР (300мГц, CDCI3) d 2,61 (с, 3Н); 7,05-6,77 (вс, 2Н); 7,02 (дд, 1Н); 7,36 (дд, 1Н). 18Ж Етил(8-гідрокси-4оксо-4Н-1-бензопіран-2-карбоксилат) Способом з прикладу 1А, ви ходячи з 2',3’-дигідроксіацетофенону отримали потрібну сполуку, ви хід 83%. 1 НН ЯМР (300мГц, CDCI3) d 1,47 (т, 3Н); 4,52 (к, 2Н); 7,10 (с, 1Н); 7,30 (м, 2Н); 7,61 (дд, 1Н). 18З Етил{-[[4-(4-фенілбутокси)феніл]метилокси]-4-оксо-4Н-1-бензопіран-2-карбоксилат} До розчину 0,330г (2,39ммоль) карбонату калію у 15мл сухого Ν,Ν-диметилформаміду додали 0,520г (2,39ммоль) етил(8-гідрокси-4оксо-4Н-1-бензопіран-2-карбоксилату) і 10 хвилин перемішували при кімнатній температурі, потім додавали 0,595г (2,17ммоль) 4-(4-фенілбутокси)бензилхлориду і перемішували 18 годин при 60°С, потім додавали 25мл води, тричі по 50мл екстрагували етиловим етером, сушили і видаляли розчинник під зниженим тиском, отримавши залишок, який очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (7:3), отримавши 0,740г (70%) потрібного продукту, вихід 66%. 1 Н ЯМР (300мГц, CDCI3) d 1,40 (т, 3Н); 1,80 (м, 4Н); 2,66 (т, 2Н); 3,95 (т, 2Н); 4,41 (к, 2Н); 5,16 (с, 2Н); 6,89 (д, 2Н); 7,09 (с, 1Н); 7,16-7,29 (вс, 7Н); 7,40 (д, 2Н); 7,69 (дд, 1Н). 18И 8-[[4-(4-фенілбутокси)феніл]метилокси]-4-оксо-4Н-1-бензопіран-2-каобонова кислота Способом з прикладу 1Л, ви ходячи з етил{-[[4-(4-фенілбутокси)феніл]метилокси]-4-оксо-4Н-1бензопіран-2-карбоксилату}отримали світложовту напівтверду потрібну речовину, вихід 83%. 1 Н ЯМР (300мГц, CD3OD) d 1,78 (м, 4Н); 2,66 (шт, 2Н); 3,95 (шт, 2Н); 5,20 (с, 2Н); 6,87 (д, 2Н); 7,10 (с, 1Н); 7,14-7,34 (вс, 7Н); 7,40 (д, 2Н); 7,69 (дд, 1Н). Приклад 19 8-[[4-(4-фенілбутокси)феніл]сульфоніламіно]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 19А N-(3-ацетил-2-гідроксифеніл)-4-метоксибензолсульфонамід До розчину 1,282г (5,52ммоль) гідроброміду 3'-аміно-2'-гідроксіацетофенону у 25мл піридину додали при 0°С розчин 1,18г (5,71ммоль) 4-метоксибензолсульфонілхлориду у мінімальній кількості піридину і суміш 18 годин перемішували при кімнатній температурі, потім висушивали досуха і розчиняли у дихлорметані, промивали 1М НСІ, сушили і видаляли розчинник під зниженим тиском, отримавши 1,479г (81%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 2,58 (с, 3Н) 3,80 (с, 3Н); 6,85 (д, 2Н); 6,86 (т, 1Н); 7,11 (с, 1Н); 7,45 (д, 1Н); 7,72 (д, 2Н); 7,77 (д, 1Н); 12,59 (с, 1Н). 19Б Етил-{8-[(4-метоксифеніл)сульфоніламіно]-4-оксо-4Н-1-бензопіран-2-карбоксилат} Способом з прикладу 1А, виходячи з N-(3-ацетил-2-гідроксифеніл)-4-метоксибензолсульфонаміду та діетилоксалату отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (4:6), вихід 90%. 1 Н ЯМР (300мГц, CDCI3) d 1,43 (т, 3Н); 3,74 (с, 3Н); 4,45 (к, 2Н); 6,77 (д, 2Н); 6,99 (с, 1Н); 7,34 (дд, 1Н); 7,71 (д, 2Н); 7,80 дд, 1Н); 7,88 (д, 1Н); 8,66 (с, 1Н). 19В Етил-{8-[(4-гідроксифеніл)сульфоніламіно]-4-оксо-4Н-1-бензопіран-2-карбоксилат} Способом з прикладу 18Є, виходячи з етил-{8-[(4-метоксифеніл)сульфоніламіно]-4-оксо-4Н-1бензопіран-2-карбоксилату} отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (25:75), вихід 67%. 1 Н ЯМР (300МГц, CDCI3) d 1,43 (т, 3Н); 4,47 (к, 2Н); 6,80 (д, 2Н); 6,99 (с, 1Н); 7,24 (с, 1Н); 7,38 (с, 1Н); 7,61 (д, 2Н); 7,85 (д, 1Н); 7,96 (д, 1Н); 12,51 (с, 1Н). 19Г 8-[[4-(4-фенілбутокси)феніл]сульфоніламіно]-4-оксо-4Н-1-бензопіран-2-карбонова кислота До розчину 0,200г (0,26ммоль) етил-{8-[(4-гідроксифеніл)сульфоніламіно]-4-оксо-4Н-1-бензопіран-2карбоксилату} у 3мл ДМФ додали 0,194мл (0,26ммоль) 5,3М розчину метоксиду натрію у метанолі і суміш 2 години перемішували при 50°С, охолоджували до 0°С, додавали 0,057г, (0,26ммоль) 1-бром-4-фенілбутану і розчин 2 години перемішували при 50°С і 18 годин при кімнатній температурі, потім висушували досуха і розподіляли у суміші вода-етилацетат (1:1), тричі по 25мл екстрагували етилацетатом, промивали 0,2М НСІ, сушили і видаляли розчинник, отримавши сирий продукт, який очищали хроматографією на колонці з силікагелем, елююючи метанолом/хлороформом зі зростаючою полярністю, отримавши 0,070г (54%) потрібного продукту. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,76 (м, 4Н); 2,65 (шт, 2Н); 3,95 (шт, 2Н); 6,83 (д, 2Н);6,99(с, 1Н); 7,147,25 (вс, 5Н); 7,42 (т, 1Н); 7,68 (д, 2Н); 7,87 (д, 1Н); 7,97 (д, 1Н). Приклад20 4-оксо-8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4Н-1-бензопіран-2-карбонова кислота 20А 2'-гідроксі-3'-іодацетофенон До суспензії 2,5г (10,8ммоль) гідроброміду 3'-аміно-2'-гідроксіацетофенону у 10мл води додали при 0°С 0,70мл концентрованої сульфатної кислоти, а потім 0,783г (11,3ммоль) нітриту натрію у 1,5мл води і суміш 20 хвилин перемішували при 0°С, потім додавали 0,20мл концентрованої сульфатної кислоти і виливали у охолоджений до 0°С розчин 2,2г йодиду калію у 2мл води. Додавали 11мг порошку міді на кілька хвилин перемішували суміш 2 години при 75°С, потім давали охолодитися до кімнатної температури, тричі по 50мл екстрагували хлороформом, органічну фазу промивали 5% розчином тіосульфату натрію, сушили і видаляли розчинник під зниженим тиском, залишок очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (6:4), отримавши 1,95г (69%) потрібної сполуки. 1 Н ЯМР (300мГц, CDCI3) d 2,64 (с, 3Н); 6,69 (т, 1Н); 7,71 (д, 1Н); 7,90 (д, 1Н}; 13,15 (с, 1Н). 20Б 4-(4-фенілбутокси)бензальдегід Способом з прикладу 18А, ви ходячи з 4-гідроксибензальдегіду та 4-феніл-1-бутанолу отримали потрібну сполуку, ви хід 63%. 1 Н ЯМР (300мГц, CDCI3) d 1,80 (м, 4Н); 2,66 (т, 3Н); 4,00 (т, 2Н); 6,93 (д, 2Н); 7,15 (вс, 5Н); 7,78 (д, 2Н); 9,83 (с, 1Н). 20В 4-(4-фенілбутокси)стирол До розчину 4,98г (13,9ммоль) броміду метилтрифенілфосфонію у 130мл безводного тетрагідрофурану при 0°С під інертною атмосферою додали 8,69мл 1,6М розчину бутиллітію у гексані і 2 години перемішували при 0°С, потім додали 2,5г (9,84ммоль) 4-(4-фенілбутокси)бензальдегіду у 10мл тетрагідрофурану і 36 годин перемішували при кімнатній температурі, потім обережно додавали 20мл води і 4 рази по 50мл екстрагували етиловим етером., органічні фази сушили і видаляли розчинник під зниженим тиском, сирий продукт очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/етиловим етером (95:5), отримавши 4,20г (62%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,78 (м, 1Н); 2,67 (шт, 2Н); 3,95 (шт, 2Н); 5,10 (д, 1Н); 5,58 (д, 1Н); 6,64 (дд, 1Н); 6,82 (д, 2Н); 7,17-7,33 (вс, 7Н). 20Г 3'-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-2'-гідроксіацетофенон 0,742г (2,92ммоль) 4-(4-фенілбутокси)стиролу, 0,612г (2,33ммоль) 2'-гідроксі-3'-йодацетофенону, 0,408мл (3,01ммоль) тріетиламіна та 0,014г (0,06ммоль) ацетату паладію(ІІ) у 15мл ацетонітрилу перемішували 24 години при 100°С, потім додали 15мл води і 4 рази по 30мл екстрагували етиловим етером, органічні фази сушили і видаляли розчинник під зниженим тиском, залишок очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/етиловим етером (9:1), отримавши 0,633г (70%) потрібного продукту. 1 Н ЯМР (300МГц, CDCI3) d 1,79 (м, 4Н); 2,62 (с, 3Н); 2,68 (шт, 2Н); 3,95 (шт, 2Н); 6,85 (д, 2Н); 6,86 (т, 1Н); 7,08-7,36 (вс, 7Н) 7,45 (д, 2Н); 7,59 (дд, 1Н); 7,73 (дд, 1Н); 12,51 (с, 1Н). 20Д Етил-{4-оксо-8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4Н-1-бензопіран-2-карбоксилат} Способом з прикладу 1А, виходячи з 3'-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-2'гідроксіацетофенону та діетилоксалату отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (6:4), вихід 66%. 1 Н ЯМР (300мГц, CDCI3) d 1,41 (т, 3Н); 1,80 (м, 4Н); 2,65 (шт, 2Н); 3,95 (шт, 2Н); 4,39 (к, 2Н); 6,85 (д, 2Н); 7,03 (с, 1Н); 7,17-7,32 (вс, 8Н); 7,44 (д, 2Н); 7,77 (дд, 1Н); 7,93 (дд, 1Н). 20Е 4-оксо-8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4Н-1-бензопіран-2-карбонова кислота Способом з прикладу 1Л, виходячи з етил-{4-оксо-8-[(Е)-2-[4-{4-фенілбутокси)феніл]етен-1-іл]-4Н-1бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку з т.пл. 159-161°С, вихід 78%. 1 Н ЯМР (300мГц, ДМСО) d 1,74 (шм, 4Н); 2,65 (шт, 2Н); 4,03 (шт, 2Н); 6,94 (с, 1Н); 6,99 (д, 2Н); 7,17-7,32 (вс, 5Н); 7,40 (д, 1Н); 7,52 (т, 1Н); 7,54 (д, 2Н); 7,67 (д, 1Н); 7,92 (дд, 1Н); 8,13 (дд, 1Н). Приклад21 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл]-4Н-1-бензопіран 21А 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбоксамід Способом з прикладу 12А, ви ходячи з етил-{4-оксо-8-[(Е)-2-[4-(4-феніл'бутокси)феніл]етен-1-іл]-4Н-1бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку, ви хід 83%. 1 Н ЯМР (300мГц, ДМСО) d 1,73 (шм, 4Н); 2,65 (шт, 2Н); 4,03 (шт, 2Н); 6,91 (с, 1Н); 6,99 (д, 2Н); 7,17-7,32 (вс, 5Н); 7,49 (д, 1Н); 7,51 (т, 1Н); 7,70 (д, 2Н); 7,72 (д, 1Н); 7,93 (д, 1Н); 8,21 (д, 1Н); 8,28 (шс, 1Н); 8,53 (шс, 1Н). 21Б 8-[-(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонітрил Способом з прикладу 2Г, реакцією 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран2-карбоксаміду з оксохлоридом фосфор у при 0°С протягом 0,5 годин отримали потрібну сполуку, ви хід 97%. 1 Н ЯМР (300мГц, CDCI3) d 1,80 (шм, 4H); 2,67 (шт, 2Н); 3,93 (шт., 2Н); 6,70 (с, 1Н); 6,85 (д, 2Н); 7,08-7,30 (вс, 7Н); 7,38 (т, 1Н); 7,43 (д, 2Н); 7,91 (д, 1Н); 7,98 (д, 1Н). 21В 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл|-4Н-1-бензопіран Способом з прикладу 7В, починаючи з 8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]-4-оксо-4Н-1бензопіран-2-карбонітрилу отримали жовту тверду потрібну сполуку з т.пл. 191,4-192,1°С, вихід 95%. 1 Н ЯМР (300мГц, ДМСО) d 1,74 (шм, 4Н); 2,66 (шт, 2Н); 4,03 (шт, 2Н); 7,01 (д, 2Н); 7,12с, 1Н); 7,18-7,32 (вс, 5Н); 7,53 (т, 1Н); 7,61 (с, 2Н); 7,65 (д, 2Н); 7,95 (дд, 1Н); 8,19 (дд, 1Н). Приклад 22 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 22А 4-(4-флуорфеніл)-1-бутанол До суспензії 10,2г (76,5ммоль) трихлориду алюмінію у 250мл дихлорметану додали при 0°С 13,2г (153ммоль) комплексу борану з т-бутиламіном і суміш 15 хвилин перемішували при 0°С, потім додавали 5г (25,5ммоль) 3-(4-флуорбензоїл)лропіонової кислоти і перемішували суміш 24 години при кімнатній температурі, потім повільно доливали 75мл 0,2М НСІ і тричі по 100мл екстрагували етилацетатом, поєднану органічну фазу промивали 0,2М НСІ та насиченим хлоридом натрію розчином, сушили і видаляли розчинник під зниженим тиском, залишок очищали хроматографією на колонці з силікагелем, елююючи гексаном/етилацетатом (8:2), отримавши 2,70г (63%) безбарвного масла потрібної сполуки. 1 Н ЯМР (300мГц, CDCI3) d 1,59 (м, 4Н); 2,58 (т, 2Н); 3,60 (т, 2Н); 6,90-7,12 (м, 5Н). 22Б 4-[4-(4-флуорфеніл)бутокси]бензальдегід Способом з прикладу 18А, ви ходячи з 4-гідроксибензальдегіду та 4-(4-флуорфеніл)-1-бутанолу отримали потрібну сполуку, ви хід 43%. 1 Н ЯМР (300мГц, CDCI3) d 1,80(м, 4Н); 2,65 (т, 2Н); 4,03 (т, 211); 6,95 (м, 3Н); 7,12 (м, 2Н); 7,81 (д. 2Н); 9,85 (с, 1Н). 22В 4-[4-(4-флуорфеніл)бутокси]стирол Способом з прикладу 20В, ви ходячи з 4-(4-(4-флуорфеніл)бутокси]бензальдепду отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/етиловим етером (98:2), вихід 58%. 1 Н ЯМР (300мГц, CDCI3) d 1,75 (м, 4Н); 2,56 (т, 2Н); 3,87 (т, 2Н); 5,06 (дд, 1Н); 5,56 (дд, 1Н); 6,60 (м, 3Н); 6,91 (м, 2Н); 7,05 (м, 2Н); 7,26 (м, 2Н). 22Г 3'-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-2'-гідроксіацетофенон Способом з прикладу 20Г, виходячи з 4-[4-(4-флуор феніл)бутокси]стиролу отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/етиловим етером (95:5), вихід 70%. 1 Н ЯМР (300мГц, CDCI3) d 1,78 (м, 4Н); 2,63 (т, 2Н); 3,95 (т, 2Н); 6,84-6,99 (вс, 5Н); 7,14 (м, 3Н); 7,34 (д, 1Н); 7,45 (д, 2Н); 7,62 (д, 1Н); 7,75 (д, 1Н); 12,55 (с, 1Н). 22Д Етил-{8-[(Е)-2-[4-[4-(4-флуор феніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбоксилат} Способом з прикладу 1А, виходячи з 3'-[(E)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-2'гідроксіацетофенону та діетилоксалату отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, елююючи петролейним етером/хлороформом (8:2), вихід 65%. 1 Н ЯМР (300мГц, CDCI3) d 1,42 (т, 3Н); 1,79 (м, 4Н); 2,65 (шт, 2Н); 3,97 (шт, 2Н); 4,42 (к, 2Н); 6,87 (д, 2Н); 6,95 (т, 2Η); 7,05 (с, 1Н); ); 7,13 (т, 2Η); 7,28 (д, 1Н); 7,33 (шс, 2Н); 7,46 (д, 2Н); 7,81 (д, 1Н); 7,97 (д, 1Н). 22Е 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота Способом з прикладу 1Л, виходячи з етил-{8-[(Е)-2-(4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо4Н-1-бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку з т.пл. 161- 162°С, яку очищали перекристалізацією з метанолу, вихід 71%. 1 Н ЯМР (300мГц. ДМСО) d 1,73 (м, 4Н); 2,65 (шт, 2H); 4,04 (шт. 2Н); 6,96 (с, 1Н); 7,01 (д, 2Н); 7,11 (т, 2Н); 7,27 (т, 2Н); 7,43 (д, 1Н); 7,53 (м, 3Н); 7,68 (д, 1Н); 7,94 (д, 1Н); 8,15 (д, 1Н). Приклад 23 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл]-4Н-1бензопіран 23А 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбоксамід Способом з прикладу 12А, реакцією амінолізу етил-{4-оксо-8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]4Н-1-бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку, ви хід 93%. 1 Н ЯМР (300мГц, ДМСО) d 1,75 (шм, 4Н); 2,67 (шт, 2Н); 4,06 (шт, 2Н); 6,93 (с, 1Н); 7,01 (д, 2Н); 7,13 (т, 2Н); 7,29 (т, 2Н); 7,50 (д, 1Н); 7,56 (т, 1Н); 7,71 (д, 2Н); 7,76 (д, 1Н); 7,98 (дд, 1Н); 8,25 (дд, 1Н); 8,28 (шс, 1Н); 8,55 (шс, 1Н). 23Б 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонітрил Способом з прикладу 2Г, реакцією 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н-1бензопіран-2-карбоксаміду з оксохлоридом фосфору при 0°С протягом 0,5 годин отримали потрібну сполуку, ви хід 95%. 1 Н ЯМР (300мГц, CDCI3) d 1,82 (шм, 4Н); 2,68 (шт, 2Н); 4,01 (шт, 2Н); 6,81 (с, 1Н); 6,90-7,52 (вс, 11Н); 8,02 (т, 2Н). 23В 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-2-(5-1Н-тетразоліл]-4Н-1-бензопіран Способом з прикладу 7В, починаючи з 8-[(Е)-2-[4-[4-(4-флуорфеніл)бутокси]феніл]етен-1-іл]-4-оксо-4Н1-бензопіран-2-карбонітрилу отримали жовту тверду потрібну сполуку з т.пл. 173,6-174,7°С, яку очищали перекристалізацією з метанолу, вихід 83%. 1 Н ЯМР (300мГц, ДМСО) d 1,74 (шм, 4Н); 2,66 (шт, 2Н); 4,03 (шт, 2Н); 7,01 (д, 2Н); 7,13 (м, 3Н); 7,27 (м, 2Н); 7,53 (т, 1Н); 7,61 (с, 2Н); 7,61 (с, 2Н); 7,65 (д, 2Н); 7,95 (дд, 1Н); 8,19 (дд, 1Н). Приклад 24 8-[(Е)-2-[4-(4-фенілбутокси)-2-флуорфеніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота 24А 2-флуор-4-гідроксибензойна кислота Способом з прикладу 5Є, ви ходячи з 2-флуор-4-гідроксибинзоніірилу отримали потрібний продукт, ви хід кількісний. 1 Н ЯМР (300мГц. CDCI3) d 6,61 (дд, 1 Η); 6,69 (дд, 1Н); 7,87 (т, 1Н); 12,51 (с, 1Н). 24Б Метил(2-флуор-4-гідроксибензоат) Способом з прикладу 5В, виходячи з 2-флуор-4-гідроксибензойиої кислоти отримали потрібний продукт, вихід (86%). 1 Н ЯМР (300мГц, CD3OD) d 6,61 (дд. 1Н); 3,83 (с, 3Н); 6,55 (дд, 1Н); 6,65 (дд, 1Н); 7,80 (т, 1Н); 12,35 (с, 1Н). 24В Метил(4-фенілбутокси-2-флуор-бензоат) Способом з прикладу 18А, виходячи з метил(2-флуор-4-гідроксибензоату) та 4-феніл-1-бутанолу, отримали потрібний продукт, який очищали хроматографією на колонці з силікагелем, елююючи гексаном/етилацетатом (95:5), вихід (97%). 1 Н ЯМР (300мГц, CDCI3) d 1,80 (м, 4Н); 2,67 (т, 2Η); 3,87 (с, 3Н); 3,96 (т, 2Η); 6,58 (дд, 1Н); 6,67 (дд, 1Н); 6,96 (с, 1Н); 7,01 (д, 2Н); 7,17-7,29 (м, 5Н); 7,87 (т, 1Η). 22Г 4-(4-фенілбутокси)-2-флуорбензиловий спирт Способом з прикладу 18А, виходячи з метил(4-фенілбутокси-2-флуор-бензоату), отримали потрібний продукт, вихід кількісний. 1 Н ЯМР (300мГц, CD3OD) d 1,69 (м, 4Н); 2,57 (т, 2Н); 3,81 (т, 2Н); 4,59 (с, 2Н); 6,57 (дд, 1Н); 6,64 (дд, 1Н); 7,09-7,24 (м, 5Н); 7,28 (т, 1Η). 24Д 4-(4-фенілбутокси)-2-флуорбензальдегід До розчину 1,38г (5,03ммоль) 4-(4-фенілбутокси)-2-флуорбензилового спирту у 50мл дихлорметану додали 1,63г (7,54ммоль) хлорхромату піридинію і суміш 1 годину перемішували при кімнатній температурі, потім профільтрували крізь броун-мілерит, промили дихлорметаном, розчинник висушили та випарили під зниженим тиском, одержавши сирий продукт, який очищали хроматографією на колонці з силікагелем, елююючи дихлорметаном, одержавши 1,02г (74%) потрібного продукту. 1 Н ЯМР (300мГц, CDCI3) d 1,59 (м, 2Н); 1,80 (м, 2Н); 2,32 (с, 3Н); 2,58 (т, 2Η); 3,91 (с, 3Н); 6,84 (с, 1Н); 7,08 (д, 2Н); 7,17 (м, 1Н); 7,20-7,27 (м, 3Н); 7,87 (дд, 1Н); 8,34 (д, 1Н); 3,81 (т, 2Η); 24Е 4-(4-фенілбутокси)-2-флуорстирол Способом з прикладу 20В, виходячи з 4-(4-фенілбутокси)-2-флуорбензальдегіду та солі метилтрифенілфосфонію, одержали потрібний продукт, який очищали хроматографією на колонці з силікагелем, елююючи гексаном/етилацетатом (1:1), вихід (65%). 1 Н ЯМР (300мГц, CDCI3) d 1,78 (м, 2Н); 1,80 (м, 2Н); 2,32 (с, 3Н); 2,58 (т, 2Н); 6,84 (с, 1Н); 7,08 (д, 2Н); 7,17 (м, 1Н); 7,20-7,27 (м, 3Н); 7,87 (дд, 1Н); 8,34 (д, 1Н); 3,81 (т, 2Н). 1 Н ЯМР (300мГц, CD3OD) d 1,78 (м, 4Н): 2,66 (т, 2Н); 3,90 (т, 2Н); 4,59 (с, 2Н); 5,21 (дд, 1Н); 5,65 (дд, 1Н); 6,55 (дд, 1Н); 6,62 (дд, 1Н); 6,78 (дд, 1Н); 7,17-7,31 (м, 5Н); 7,35 (т, 1Н). 24Є 3'-[(Е)-2-[4-(4-фенілбутокси)-2-флуорфеніл]етен-1-іл]-2'-гідроксіацетофенон Способом з прикладу 20Г, виходячи з 4-(4-фенілбутокси)-2-флуорстиролу та 2'-гідроксі-3'йодацетофенону отримали потрібну сполуку, яку очищали флеш-хроматографією на колонці з силікагелем, елююючи петролейним етером/етилацетатом (95:5), вихід 67%. 1 Н ЯМР (300мГц, CDCI3) d 1,78 (м, 4Н); 2,59 (с, 3Н); 2,66 ( , 2Η); 3,91 ( 2Η); 6,56 (дд, 1Н); 6,64 (дд, 1Н); 6,86 (т, 1Н); 7,17-7,30 (м, 6Н); 7,40 (д, 1Н); 7,53 (т, 1Н); 7,59 (дд, 1Н);7,74(дд, 1Н); 12,88 (с, 1Н). 24Ж Етил-{8-[(Е)-2-[4-(4-фенілбутокси)-2-флуорфеніл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбоксилат} Способом з прикладу 1А, ви ходячи з 3'-[(Е)-2-[4-(4-фенілбутокси)-2-флуорфеніл]етен-1-іл]-2'гідроксіацетофенону та діетилоксалату отримали потрібну сполуку, яку очищали хроматографією на колонці з силікагелем, вихід кількісний. 1 Н ЯМР (300мГц, CDCI3) d 1,40 (т, 3Н); 1,79 (м, 4Н); 2,66 (т, 2Η); 3,91 (т, 2Η); 4,40 (к, 2Н): 6,57 (дд, 2Н); 6,64 (дд, 2Н); 7,02 (с, 1Н); 7,17-7,32 (м, 6Н); 7,37 (д, 2Н); 7,46 (т, 1Н); 7,78 (д, 1Н): 7,95 (д, 1Н). 24З 8-[(Е)-2-[4-(4-фенілбутокси)-2-флуорфеніл]ет9н-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонова кислота Способом з прикладу 1Л, виходячи з етил-{8-|(Е)-2-[4-(4-фекілбутокси)-2-флуор феніл]етен-1-іл]-4-оксо4Н-1-бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку з т.пл. 73,4-73,5°С, яку очищали перекристалізацією з метанолу, вихід 52%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 1,81 (шм, 4Н); 2,69 (шт, 2Н); 3,95 (шт, 2Н); 6,60 (д, 1Н); 6,69 (д, 2Н); 7,17-7,32 (м, 6Н); 7,41 (т, 1Н); 7,52 (с, 2Н); 7,58 (т, 1Н); 7,94 (д, 1Н); 8,06 (д, 1Н). Приклад25 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-4Н-1бензопіран-2-карбонова кислота 25А 2-(4'-флуорбензилоксиметил)-5-пдроксиметил-2,3-дигідробензофуран Способом з прикладу 18В, виходячи з 7,00г (23,2ммоль) етил-{2-(4'-флуорбензилоксиметил)-5гідроксиметил-2,3-дигідробензофуран-2-карбоксилату}, 3,51г (92,6ммоль) LіAIH4 та 300мл сухого етилового етеру отримали потрібну сполуку, вихід 83%. 1 Н ЯМР (300мГц, CDCI3) d 2,90 (дд, 1Н); 3,08 (шс, 1Н); 3,14 (дд, 1Н); 3,55 (дд, 1Н); 3,61 (дд, 1Н); 4,44 (с, 2Н); 4,50 (дд, 2Н); 4,90 (м, 1Н); 6,70 (д, 1Н); 6,98 (м, 3Н); 7,08 (с, 1Н); 7,26 (м, 2Н). 25Б 2-(4'-флуорбензилоксиметил)-5-форміл-2,3-дигідробензофуран Способом з прикладу 18В, .виходячи з 7,00г (23,2ммоль) 2-(4'-флуорбензилоксиметил)-5-гідроксиметил2,3-дигідробензофурану о трималипотрібну сполуку, ви хід 72%. 1 Н ЯМР (300мГц, CDCI3) d 3,06 (дд, 1Н); 3,30 (дд, 1Н); 4,56 (д, 2Н); 4,44 (с, 2Н); 5,09 (м, 1Н); 6,89 (д, 1Н); 7,01 (т, 2Н); 7,27 (м, 2Н); 7,67 (д, 1Н); 7,71 (с, 1Н); 9,82 (с, 1Н). 25В 2-(4'-флуорбензилоксиметил)-5-вініл-2,3-дигідробензофуран Способом з прикладу 20В, виходячи з 7,00г (23,2ммоль) 2-(4'-флуорбензилоксиметил)-5-форміл-2,3дигідробензофурану отримали потрібну сполуку, яку очищали флеш-хроматографією на колонці з силікагелем, елююючи петролейним етером/етилацетатом (95:5), вихід 58%. 1 Н ЯМР (300мГц. CDCI3) d 2,98 (дд, 1Н); 3,21 (дд, 1Н); 4,58 (дд, 1Н); 4,66 (дд, 1Н); 4,52 (д, 1Н); 4,56 (д, 1Н); 4,95 (м, 2Н); 5,06 (д, 1Н); 5,55 (д, 1Н); 6,62 (дд, 1Н); 6,73 (д, 1Н); 7,00 (т, 2Н); 7,12 (дд, 1Н); 7,23-7,29 (м, 3Н). 25Г 3'-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-2'-гідроксіацетофенон Способом з прикладу 20Г, виходячи з 2-(4'-флуорбензилоксиметил)-5-вініл-2,3-дигідробензофурану та 2'-гідроксі-3'-йодацетофенону отримали потрібну сполуку, яку очи щали флеш-хроматографією на колонці з силікагелем, елююючи петролейним етером/етилацетатом (85:15), вихід 63%. 1 Н ЯМР (300мГц, CDCI3) d 2,58 (с, 3Н); 2,96 (дд, 1Н); 3,22 (дд, 1Н); 3,63 (м, 2Н); 4,50 (д, 1Н); 4,56 (д, 1Н); 4,96 (м, 1Н); 6,76 (д, 1Н); 6,85 (т, 1Н); 6,99 (т, 2Н); 7,08 (д, 1Н); 7,22-7,32 (м, 4Н); 7,37 (с, 1Н); 7,57 (д, 1Н); 7,70 (д, 1Н); 12,88 (с, 1Н). 25Д Етил-{8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-4Н-1бензопіран-2-карбоксилат} Способом з прикладу 1А, ви ходячи з 3'-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5іл]етен-1-іл]-2'-гідроксіацетофенону та діетилоксалату отримали потрібну сполуку, ви хід кількісний. 1 Н ЯМР (300мГц, CDCI3) d 1,43 (т, 3Н); 3,01 (дд, 1Н); 3,26 (дд, 1Н); 3,66 (м, 2Н); 4,42 (κ, 2Η); 4,53 (д, 1Н); 4,58 (д, 1Н); 6,78 (д, 1Н); 7,01 (м, 3Н); 7,27-7,38 (м, 7Н); 7,81 (дд, 2Н); 7,96 (дд, 1Н). 25Е 8-[(Е)-2-[2-(4'-флуорбензилоксйметил)-2,3-дипдробензофуран-5-іл]етен-1-іл]-4-оксо-4Н-1бензопіран-2-карбонова кислота Способом з прикладу 1Л, виходячи з етил-{8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3дигідробензофуран-5-іл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбоксилату} о тримали жовту тверду потрібну сполуку з т.пл. 203,6-205,4°С, яку очищали виварюванням у етиловому етері, ви хід 53%. 1 Н ЯМР (300мГц, CD3OD/CDCI3) d 3,03 (дд, 1Н); 3,31 (дд, 1Н); 3,69 (м, 2Н); 4,55 (д, 1Н); 4,60 (д, 1Н); 5,02 (м, 1Н); 6,79 (д, 1Н); 7,03 (т, 2Η); 7,14 (с, 1Н); 7,32 (м, 3Н); 7,38-7,45 (м, 4Н); 7,92 (дд, 1Н); 8,01 (дд, 1Н). Приклад26 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-2-(5-1Нтетразоліл]-4Н-1-бензопіран 26А 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензрфуран-5-1л]етен-1-іл]-4-оксо-4Н-1бензопіран-2-карбоксамід Способом з прикладу 12А, реакцією амінолізу етил-{4-оксо-8-[(Е)-2-[4-(4-фенілбутокси)феніл]етен-1-іл]4Н-1-бензопіран-2-карбоксилату} отримали жовту тверду потрібну сполуку, ви хід 83%. 1 Н ЯМР (300мГц, ДМСО) d 3,02 (дд, 1Н); 3,31 (дд, 1Н); 3,67 (м, 2Н); 4,55 (с, 2Н); 5,04 (м, 1Н); 6,81 (д, 1Н); 6,93 (с, 1Н); 7,17 (т, 2Н); 7,35-7,53 (м, 5Н); 7,65-7,72 (м, 2Η); 7,94 (д, 1Н); 8,17 (д, 1Н); 8,28 (шс, 1Н); 8,53 (шс, 1Н). 26Б 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дипдробензофуран-5-іл]етен-1-іл]-4-оксо-4Н-1бензопіран-2-карбонітрил Способом з прикладу 2Г, реакцією 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5іл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбоксаміду з оксихлоридом фосфору при 0°С протягом 0,5 годин отримали потрібну сполуку, ви хід 76%. 1 Н ЯМР (300мГц, CDCI3) d 3,05 (дд, 1Н); 3,33 (дд, 1Н); 3,67 (м, 2Н); 4,55 (д, 1Н); 4,61 (д, 1Н); 5,03 (м, 1Н); 6,80 (с, 1Н); 6,82 (д, 1Н); 7,03 (т, 2Η); 7,16 (д, 1Н); 7,26-7,33 (м, 4Н); 7,42-7,45 (м, 2Н); 7,98 (д, 1Н); 8,02 (д, 1Н). 26В 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5-іл]етен-1-іл]-4-оксо-2-(5-1Нтетразоліл]-4Н-1-бензопіран Способом з прикладу 7В, починаючи з 8-[(Е)-2-[2-(4'-флуорбензилоксиметил)-2,3-дигідробензофуран-5іл]етен-1-іл]-4-оксо-4Н-1-бензопіран-2-карбонітрилу отримали жовту тверду потрібну сполуку з т.пл. 137,5140,8°С, яку очищали перекристалізацією спочатку з пентану/хлороформу, потім - з бензолу, ви хід 42%. 1 Н ЯМР (300мГц, ДМСО) d 3,05 (дд, 1Н); 3,33 (дд, 1Н); 3,67 (м, 2Н); 4,55 (с, 2Н); 5,04 (м, 1Н); 6,84 (д, 1Н); 7,11 (с, 1Н); 7,18 (т, 2Н); 7,35-7,40 (м, 2Н); 7,45 (д, 1Н); 7,52 (т, 1Н); 7,54-7,61 (м, 3Н); 7,94 (д, 1Н); 8,17 (д, 1Н). Тести на біологічну активність. Антагоністичну дію на LTD4 сполук згідно з винаходом визначали способом інгібування рецепторів зв'язування [3H]-LTD 4 на мембранах легенів морських свинок. Тест на інгібування рецепторів зв'язування [3Н]-LTD4 на мембранах легенів морських свинок. Мембрани легенів морських свинок, що мають рецептори зв'язування [3H]-LTD 4, очищали способом, описаним у Mong et al. Prostaglandins, 1984, 28, 805. 150мг/мл цих очищених мембран додавали до інкубаційної суміші з вмістом 10мМ буфер у PIPES (піперазин-N,N-біс(2-етансульфоновз кислота) (рН 7,4), 10мМ СаСІ2, 10мМ МgСІ2, 2мМ цистеїн у, 2мМ гліцину, 0,5мМ [3H]-LTD 4 (4700-6400ГБк/моль) та різних концентрацій тестуємих продуктів у кінцевому об'ємі 310мл. Реакційну суміш інкубували 30 хвилин при 25°С. Зв'язаний з мембраною радіоліганд відділяли від вільного розбавленням 4мл промивочного буферу (10мМ ТРИС, рН 7,4, та 100мΜ NaCI) при 0°С і фільтруванням через фільтри Whatman GF/B, використовуючи пристрій Brandel Cell Hatvester. Фільтри 4 рази промивали загальним об'ємом буферу 16мл при 0°С. Радіоактивність фільтру визначали рідинною сцинтиляцією. Специфічне зв'язування визначено як різниця між загальним зв'язуванням [3Н]-LTD4 та неспецифічним зв'язуванням, визначеним у присутності 1mΜ [3H]-LTD 4. Отримані результати конкурентного тестування аналізували обчислювальною програмою з визначенням константи інгібування кожної сполуки (Кі), використовуючи вирівнювання Ченга-Прусова (Cheng et al. Biochem. Pharmacol. 1973, 22, 3094). Кi=IК50/(1+[L]/КД) де ІК50 - концентрація сполуки, що витісняє 50% зв'язаного радіоліганда, [L] - концентрація вільного [3H]LTD4, а КД - константа дисоціації LTD4, отримана незалежним шляхом з використанням Скатчард-аналізу. Вибрані сполуки загальної формули І дають в описаному тесті величини Кі 0,1-1000нM. Активність деяких сполук представлено у таблиці. Таблиця 1 Сполука з прикладу № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Кі інгібування рецепторів зв'язування [3H]-LTD 4 154±34 12,0±4 5,6±0,5 2,3±0,2 24,0±3 6,0±2,1 1,88±0,2 1,73±0,2 1,1±0,2 9,0+0,8 1,9±0,04 0,39±0,1 9,3±3 4,2±1,1 102±48 169±24 1200±440 174±43 6,0±1,0 6,2±1,3 0,5±0,2 6,0±3 0,39±0,1 22,3±0,1 1,25±0,3 0,46±0,1
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzopyran derivatives and a method for the preparation thereof
Назва патенту російськоюПроизводные бензопирана и способ их получения
МПК / Мітки
МПК: A61P 29/00, A61P 37/00, A61P 17/06, A61K 31/353, A61P 11/02, A61K 31/35, A61P 11/00, C07D 311/58, A61P 9/10, C07D 407/12, A61P 19/00, A61P 25/00, C07D 405/04, A61P 9/00, A61P 37/08, A61K 31/00, A61P 27/14, C07D 311/54, A61K 31/41, A61P 43/00, A61P 11/06, C07D 405/14, C07D 407/06, C07D 311/24, A61P 17/00, A61P 27/00, C07D 405/12, A61K 31/352
Мітки: бензопірану, спосіб, похідні, одержання
Код посилання
<a href="https://ua.patents.su/29-65535-pokhidni-benzopiranu-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні бензопірану та спосіб їх одержання</a>