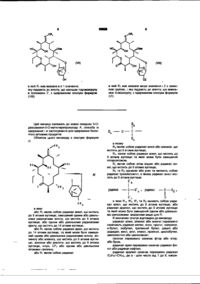
Похідні 5-о-дезозамініл-6-о-метилеритроноліду а, спосіб їх одержання, проміжні сполуки та спосіб одержання похідних еритроміцину
Формула / Реферат
1. Похідні 5-O-дезозамініл-6-О-метилеритроноліду А загальної формули (І):
в якій R1 є радикалом формули:
,
в якому
Ra є алкілом або алкокси, що містять до 8 атомів вуглецю,
Rb є алкілом, який містить до 8 атомів вуглецю та який може бути заміщений гетероатомом,
Rс є атомом водню або алкілом, що містить до 8 атомів вуглецю,
R2 та R3 однакові і є триалкілсилілом, в якому алкіл містить до 8 атомів вуглецю.
2. Сполуки за п. 1 формули (I), в яких Ra, Rb та Rс є метилом.
3. Сполуки за п. 1 формули (І), в яких R2 та R3 є триметилсилілом.
4. Сполука за п. 1 формули (І), яка є 9-О-(1-метокси-1-метилетил)оксимом 3-О-дe(2,6_дидeoкcи-3-C-мeтил-3-О-мeтил--L-pибoгeкcoпipaнoзил)-2'О, 3-О-біс(триметилсиліл)-6-О-метилеритроміцину.
5. Спосіб одержання похідних 5-О-дезозамініл-6-О-метилеритроноліду А загальної формули (І) згідно з будь яким з пунктів 1-4, який відрізняється тим, що сполуку формули (II):
(ІІ)
піддають дії агента, що захищає оксим у положенні 9, з одержанням сполуки формули (ІІІ):
в якій R1 має вказане в п. 1 значення,
яку піддають дії агента, що захищає гідроксигрупу в положенні 3 та в положенні 2', з одержанням сполуки формули (IV):
в якій R1, R2 та R3 мають вказані в п. 1 значення,
яку обробляють агентом, що метилює гідроксигрупу в 6 положенні, з одержанням відповідної сполуки формули (І).
6. Спосіб за пунктом 5, який відрізняється тим, що метилювання сполуки формули (IV) здійснюють за допомогою метилйодиду в присутності основи.
7. Похідні еритроміцину загальної формули (ІІІ):
в якій R1 має вказане в п. 1 значення, як проміжні сполуки для одержання сполук згідно з пп. 1-4.
8. Похідні еритроміцину загальної формули (IV):
в якій R1, R2 та R3 мають вказані в п. 1 значення, як проміжні сполуки для одержання сполук згідно з пп. 1-4.
9. Сполука згідно з п. 7, яка являє собою:
9-O-(1-метокси-1-метилетил)оксим 3-O-де(2,6-дидеокси-3-С-метил-3-O-метил--L-рибогексопіранозил)еритроміцину;
10. Сполука згідно з п. 8, яка являє собою:
9-O-(1-метокси-1-метилетил)оксим 3-O-де(2,6-дидеокси-3-С-метил-3-O-метил--L-рибогексопіранозил)-2'O, 3-O-біс(триметилсиліл)еритроміцину.
11. Спосіб одержання похідних еритроміцину загальної формули (VI):
в якій Z є захисною групою, такою як залишок карбонової кислоти, що містить до 8 атомів вуглецю, триалкілсиліл, трет-бутил та трифенілметил, який відрізняється тим, що сполуку формули (І) піддають таким перетворенням:
- вивільнюють оксим в положенні 9,
- вивільнюють гідроксигрупу в положенні 3 та 2',
- захищають гідроксигрупу в положенні 2'.
12. Спосіб згідно з пунктом 11, який відрізняється тим, що на сполуку формули (І) діють мурашиною кислотою в присутності бісульфіту натрію або метабісульфіту натрію, з одержанням сполуки формули (V):
яку піддають дії агенту, що захищає гідроксигрупу в положенні 2', з одержанням сполуки формули (VI).
13. Спосіб згідно з пунктом 11, який відрізняється тим, що сполуку формули (І) піддають дії агента, що вивільнює гідроксигрупу в положенні 3 та в положенні 2', з одержанням сполуки формули (VII):
в якій R1 має вказане в п. 1 значення,
яку піддають дії агенту, що захищає гідроксигрупу в положенні 2', з одержанням сполуки формули (VIII):
в якій R1 має вказане вище значення і Z є захисною групою, і яку піддають дії агента, що вивільнює 9-оксогрупу, з одержанням сполуки формули (VI).
Текст
1. Похідні 5-О-дезозамініл-6-О-метилеритроноліду А загальної формули (І): R2 та R3 однакові і є триалкілсилілом, в якому алкіл містить до 8 атомів вуглецю. 2. Сполуки за п.1 формули (І), в яких Ra, Rb та Rc є метилом. 3. Сполуки за п.1 формули (І), в яких R2 та R3 є триметилсилілом. 4. Сполука за п.1 формули (І), яка є 9-О-(1метокси-1-метилетил)оксимом З-Оде(2,6-дидеокси-3-С-метил-3-О-метил- a -Lрибогексопіранозил)-2'0, 3-О-біс(триметилсиліл)6-О-метилеритроміцину. 5. Спосіб одержання похідних 5-О-дезозамініл-6О-метилеритроноліду А загальної формули (І) згідно з будь яким з пунктів 1 - 4, який відрізняється тим, що сполуку формули (II): N CM О ОМе О ) в якій Ri є радикалом формули: в якому Ra є алкілом або алкокси, що містять до 8 атомів вуглецю, Rb є алкілом, який містить до 8 атомів вуглецю та який може бути заміщений гетероатомом, Rc є атомом водню або алкілом, що містить до 8 атомів вуглецю, (И) піддають дії агента, що захищає оксим у положенні 9, з одержанням сполуки формули (III): 00 CM CD CO Ю 53628 в якій R-i має вказане в п 1 значення, яку піддають дії агента, що захищає пдроксигрупу в положенні 3 та в положенні 2', з одержанням сполуки формули (IV) (IV) в якій R-i, R2 та R3 мають вказані в п 1 значення, як проміжні сполуки для одержання сполук згідно з пп 1 - 4 9 Сполука згідно з п 7, яка являє собою 9-О-(1 -метокси-1 -метилетил)оксим 3-О-де(2,6дидеокси-3-С-метил-З-О-метил- a -Lрибогексопіранозил)еритромщину, 10 Сполука згідно з п 8, яка являє собою 9-О-(1 -метокси-1 -метилетил)оксим 3-О-де(2,6дидеокси-3-С-метил-З-О-метил- a -Lрибогексопіранозил)-2'О, 3-0біс(триметилсиліл)еритромщину 11 Спосіб одержання похідних еритроміцину загальної формули (VI) ОМв в якій R-i, R2 та R3 мають вказані в п 1 значення, яку обробляють агентом, що метилює пдроксигрупу в 6 положенні, з одержанням відповідної сполуки формули (І) 6 Спосіб за пунктом 5, який відрізняється тим, що метилювання сполуки формули (IV) здійснюють за допомогою метилйодиду в присутності основи 7 ПОХІДНІ еритроміцину загальної формули (III) (III) (VI) в якій Z є захисною групою, такою як залишок карбонової кислоти, що містить до 8 атомів вуглецю, триалкілсиліл, трет-бутил та трифенілметил, який відрізняється тим, що сполуку формули (І) піддають таким перетворенням - вивільнюють оксим в положенні 9, - вивільнюють пдроксигрупу в положенні 3 та 2і, - захищають пдроксигрупу в положенні 2' 12 Спосіб згідно з пунктом 11, який відрізняється тим, що на сполуку формули (І) діють мурашиною кислотою в присутності бісульфіту натрію або метабісульфіту натрію, з одержанням сполуки формули (V) в якій Ri має вказане в п 1 значення, як проміжні сполуки для одержання сполук згідно з пп 1 - 4 8 ПОХІДНІ еритроміцину загальної формули (IV) 00 яку піддають ди агенту, що захищає пдроксигрупу в положенні 2', з одержанням сполуки формули (VI) 13 Спосіб згідно з пунктом 11, який відрізняється тим, що сполуку формули (І) піддають ди агента, що вивільнює пдроксигрупу в положенні 3 та в положенні 2', з одержанням сполуки формули (VII) (VII) (VIII) н в якій Ri має вказане в п 1 значення, яку піддають дії агенту, що захищає гідроксигрупу в положенні 2', з одержанням сполуки формули (VIII) Цей винахід належить до нових похідних 5-0дезозамініл-6-О-метилеритроноліду А, способу їх одержання і їх застосування для одержання біологічно активних продуктів Об'єктом цього винаходу є сполуки формули /І/ ПІ в якій Ri має вказане вище значення і Z є захисною групою, і яку піддають ди агента, що вивільнює 9-оксогрупу, з одержанням сполуки формули (VI) в якому Ra являє собою радикал алкіл або алкокси, що містить до 8 атомів вуглецю, Rb, являє собою радикал алкіл, що містить до 8 атомів вуглецю та який може бути заміщений гетероатомом, Rc являє собою атом водню або радикал алкіл, що містить до 8 атомів вуглецю, R2 та R3 однакові або різні та являють собою радикал триалкілсилш, в якому радикал алкіл містить до 8 атомів вуглецю радикал — С —В'. он в яких або Ri являє собою радикал алкіл, що містить до 8 атомів вуглецю, заміщений одним або декількома радикалами алкілу, що містять до 8 атомів вуглецю, або одним або декількома радикалами арилу, що містять до 14 атомів вуглецю, або Ri являє собою радикал арил, що містить до 14 атомів вуглецю, та який може бути заміщений одним або декількома радикалами алкілу, алненілу або алкінілу, що містять до 6 атомів вуглецю, алкокси або алкштю, що містять до 8 атомів вуглецю, нітро, CF3 або одним або декількома атомами галогену, або Ri являє собою радикал радикал •в. З' „ О в яких R а , R'b, R'c та Rd являють собою радикал алкіл, що містить до 8 атомів вуглецю, або радикал аралкіл, що містить до 8 атомів вуглецю та який може бути заміщений одним або декількома замісниками вказаними вище для Ri В визначені сполук ВІДПОВІДНО ДО винаходу радикал алкіл, алкеніл або алкініл переважно означають радикал метил, етил, пропіл, ізопропіл, н-бутил, ізобутил, третинний бутил, децил або додецил, ВІНІЛ, аліл, етиніл, пропініл, циклобутил, циклопентил або циклогексил, галоген переважно означає фтор або хлор, або бром, радикал арил переважно означає радикал феніл або радикал нафтил, радикал аралкіл означає переважно радикал /СбН5/-/СН2/а, де а - ціле число від 1 до 6, напри 7 53628 клад, число 1, 2, 3 або 4, радикал аралкш може відрізняється тим, що сполуку формули /II/ бути, наприклад, радикалом бензил, в разі необок хідності, заміщеним, або радикалом тритил, радикал алкокси переважно означає радикал метокси, етокси, пропілокси, ізопропілокси, нбутилокси, ізобутилокси, третинний бутилокси, нпентилокси, ізопентилокси, вторинний пентилокси, третинний пентилокси, неопентилокси, нгексилокси, вторинний гексилокси, третинний гексил окси, радикал алкілтю може приймати такі ж самі значення замінюючи атом кисню на атом сірки, наприклад метилтю, етилтю Крім того атом сірки може бути окисленим і являти собою, наприклад, метилсульфініл, метилсульфоніл Сполуки ВІДПОВІДНО до винаходу можуть бути використані для одержання сполук формули /VI/, ЛІ/ он піддають дм агента блокування оксиму в положеннг 9, щоб одержати сполуку формули Ш /VI/ '0 0Z в яких Z являє собою атом водню або захисну групу, таку як залишок карбонової кислоти, що містить до 8 атомів вуглецю, радикал триалкілсиліл або третинний бутил Сполуки формули /VI/ описані та заявлені в заявці на європейський патент № 0 487 411 як проміжні продукти використовувані, зокрема, для одержання антибіотичних продуктів Більш конкретно, об'єктом цього винаходу є сполуки формули /І/, в яких Ri являє собою радикал ЛІІ/ ОН в якій Ri має указане вище значення, яку піддають ди агента блокування гідроксилу в положенні 3 та/або 2', ДЛЯ одержання сполуки формули /IV/ В а R, 0—С в якому Ra, Rb та Rc мають указані вище значення, зокрема, сполуки, в яких Ra, Rb та Rc означають радикал метил, а також сполуш формули /І/, в яких R2 та R3 означають обидва радикал триалкілсиліл, зокрема, сполуки, в яких R2 та R3 означають радикал триметилсиліл Більш конкретним об'єктом винаходу є сполука формули /І/, одержання якої наводиться нижче в експериментальній частині Об'єктом цього винаходу є також спосіб одержання сполук формули /І/, описаних вище, який /IV/ О Н 53628 в якій Ri, R2 та R3 мають указані вище значення, яку піддають дії агента метилування гідроксилу в положенні 6 з одержанням відповідної сполуки формули /І/ Сполука формули /II/, яка використовується як вихідний продукт, являє собою відомий продукт описаний авторами Mahieu та Coll, в журналі J Med Chem , 17/9/, 953 - 956 /1974/ В переважному варіанті здійснення способу 10 /VII/ ВІДПОВІДНО до винаходу оксим в положенні 9 захищають в формі кеталю, тюкеталю, груПИ 3-ОН та 2'-ОН блокують групами триметилсилілу, метилування здійснюють за допомогою метил йодиду в присутності основи, наприклад, гідроксиду калію, гідроксиду натрію, гідриду, такого як гідрид натрію, третинного бутилату лужного металу, такого як наприклад третинного бутилату калію, або ж в присутності 1,5-діазабіцикло[4,3,0]нон5-єну або 1,8-діазабщикло[5,4,0]ундец-7-єну Об'єктом цього винаходу є нові ХІМІЧНІ продукти формули /III/ та формули /IV/ одержані при здійсненні способу ВІДПОВІДНО до винаходу Більш конкретно, винахід належить до продуктів формули /III/ та формули /IV/, спосіб одержання яких наведений в експериментальній частині Винахід належить також до застосування сполук формули /І/, яке полягає в тому, що сполуку формули /І/ піддають таким операціям вивільнення оксиму в положенні 9, вивільнення гідроксилу в положенні 3 та 2і, захист гідроксилу в положенні 2' Зокрема, цей винахід стосується застосування, яке полягає в тому, що сполуку формули /І/ піддають дії мурашиної кислоти в присутності бісульфіту натрію або метабісульфіту натрію, щоб одержати безпосередньо сполуку формули /V/ 0Z в якій Z являє собою захисну групу, таку як залишок карбонової кислоти, що містить до 8 атомів вуглецю, або радикал триалкілсиліл, третинний бутил або трифенілметил Винахід також стосується застосування, яке відрізняється тим, що сполуку формули /І/ піддають ди агента вивільнення гідроксилу в положеннях 3 та 2', щоб одержати сполуку формули /VII/ /VII/ в якій Ri має указане вище значення, яку піддають ди захисного агента групи ОН в положенні 2', щоб одержати сполуку формули /VIII/ // V • О яку піддають дії захисного агента гідроксилу в положенні 2', щоб одержати сполуку формули /VI/: 02 /VIII/ 11 53628 12 в якій Ri має указане вище значення, a Z дукту Вихід 92,9% означає захисну групу, визначену вище, яку підРезультати аналізу дають ди агента вивільнення групи 9-оксо, щоб ЯМР /CD CI3, 300МГц/ одержати відповідну сполуку формули /VI/ 0,12-0,16 OTMS, 0,84 hi СНз-СН2, 1,16 /х2/ 1,38 - 1,45 - 1,47 - 1,00 - 1,25 СН3-СН , 2,23 Id N/Me/2, 2,47 /м/ Н'з, 2,71 /м/ Н 2 та Н10, 3,16 /дд/ Н'2, 3,22 Id ОМе, 3,45 /м/1 Н'5, 3,58 /д/ Н5, 3,66 1 Н 8 - > Е , 3,66/с/ Нц,3,98/дл/ Нз, 4,2/дд/ Н -,, 5,14/дд/ Ніз, 1,90 Id- 3,10 -4,44 ОН Стадія С 9-О-/1-метокси-1-метилетил/оксим 3-О-де-/2,6-дидеокси-3-С-метил-3-О-метил-альфаІ_-рибо-гексопіранозил/-2',3-О-біс/триметилсиліл/ 6-О-метилеритроьацину /VI/ Перемішують 1,24г продукту, одержаного на попередній стадії, 8,7мл суміші даметилсульфоксиду/тетрапдрафурану 1/1, 190мкл метилйодиду, 161мг порошкоподібного 90%-го гідроксиду калію на протязі 2 годин при навколишній температурі Додають Юмл AcOEt та Юмл 0,5М розчину мононатрієвого фосфату Після декактування та реекстрагування в AcOEt провівають органічну фазу за 02 допомогою 5мл води, висушують її над Na2SO4 та в якій Z має указане вище значення концентрують фільтрат при зниженому тиску Наступні приклади ілюструють винахід не обОдержують 1,2г цільового продукту Вихід 95% межуючи його Результати аналізу Приклад 1 ЯМР /CD CI3, 300МГц/ 9-0-/1 -метокси-1-метилетил/оксим З-О-де/2,6можлива структура, локалізують при 0,11 та дидеокеи-3-С-метил-3-О-метил-альфа-І_-рибо0,20 групи SiMe3, 0,84 111 , СН3-СН2, 0,95 /д/ - 0,97 гексопіранозил/-2\ З-О-біс/триметилсиліл/6-O/д/-1,14/д/- 1,17/д/х 2 СНз-СН, 1,18-1,35метилеритромщину 1,40 - 1,48 СНз-СН , 2,22 Id N/Me/2, 2,46 /м/ Н'з, Стадія А 9-0-/1-метокси-1-метилетил/оксим 32,61 /кл/ Ню, 2,72 /дк/ , Н2, 3,01 Id ОМе, 3,13 О-де/2,-6-дидеокси-3-С-метил-3-О-метил-альфа-і_/дд/ Н'5, 3,22 /с/ ОМе ланцюг, 3,45 їм/ Н'5, - 3,70 рибо-гексопіранозил/-еритроміцину Н8 -• Е, ~ 3,68 /м/ 2Н /Нз, Hs/, 3,79 /ел/ 1Н -» Нц, Перемішують на протязі півгодини при кімнат4,24/д/ Н'і, 5,15/дд/ Ніз, 3,29 та 4,52 ОН ній температурі 8,14г 9-оксиму З-О-де/2,6Застосування 1 2'-О-ацєтил-3-О-де/2,6дидеокси-3-С-метил-3-О-метил-альфа-і_-рибодидеокси-З-С-метил-З-О-метил-альфа-Ьрибогексапіранозил/еритромщину, 81,5мл метиленхлогексопіранозил/6-О-метилеритромщин риду, 9,65мл 2-метоксипропену та 2,44г 98%-го Стадія А 3-О-де/2,6-дидеокси-3-С-метил-3-Охлорпдрату піридинію Додають 80мл насиченого метил-альфа-І_-рибо-гексопіранозил/ 6-О-метилрозчину ЫаНСОз, переміщують 3 хвилини Деканеритромщин тують органічну фазу, яку промивають за допомоПеремішують суміш з 513мг продукту з пригою 50мл солоної води Повторно екстрагують кладу 1, 5мл етанол/вода 1/1, 42 мг бісульфіту водні фази за допомогою 50мл СН2СІ2 Висушують натрію, 115мкл мурашиної кислоти на протязі піворганічну фазу над Na2SO4 та випарюють розчингодини при температурі кипіння зі зворотним холоник при зменшеному тиску Дістають 9и цільового дильником Після охолодження до навколишньої продукту Вихід 98,5% температури додають 5мл насиченого розчину Результати аналізу ЫаНСОз Перемішують суміш на протязі 5 хвилин, ЯМР /CD CI3, 300МГц/ потім екстрагують ДВІЧІ за допомогою AcOEt Про0,84 /т/ СН3-СН2, 1,07 /д/ - 1,09 /д/ - 1,23 /д/ мивають екстраговані фази за допомогою 5мл 1,26 /д/х2 СНз-СН, 2,25 Id N/Me/2, 2,48 /м/ Н'3) насиченого розчину NaCI Висушують органічну 2,64 /дк/ Н2, 2,72 /кл/ Н 10 , 3,22 /с/ ОМе, ~ 3,25 фазу над Na2SO4 та випарюють розчинник в вакуН'2, 3,51 /д/ Н5, 3,58 /дл/ Нз, 3,68 /ел/ Ни, ~ 3,50 умі Одержують 180мг цільового продукту, після /м/ Н'5, ~ 3,62 /м/ Н 8 -> Е, 4,41 /д/ Н'і, 5,23 /дд/ хроматографії на дюксиді кремнію з елюентом Ніз, 2,36 - 4,48 - 5,58 , Н рухливі AcOEt 95/МеОН 3/ГЕА 2 Вихід 48% Стадія В і 9-0-/1-метокси-1-метилетил/оксим Результати аналізу, 3-0-де-/2,6-дидеокси-3-С-метил-3-0-метил-альфаЯМР /CD СІз, 250МГц/ І_-рибо-гексопіранозил/-2',3-ОСпектр ідентичний даним з літератури 5,17 біс/триметилсиліл/еритроміцину /д/ Ніз, 4,38 /д/ Н'і 3,93 /ся/ Н рухливі, 3,85 /с/ Перемішують суміш з 6,62г продукту, одержаНц, 3,68 /с/ Н5, 3,54 - 3,62 їм/ Н3, Н'5, 3,24 /м/ ного на попередній стадії, 66мл СН2СІ2, 2,95мл NН'2, 2,98/с/ Оме, 2,25/с/ N/Me/2, 1,37-1,31 триметилсилілімідазолу, 1,7мл триметилсилілхло1,27- 1,25- 1,21 -1,18-1,14-1,11 СН3-СН, 0,83 риду на протязі 45 хвилин при навколишній темпеhi CH3-CH2 ратурі Додають 50мл насиченого розчину Стадія В 2'-О-ацетил-3-О-де/2,6-дидеокси-3ЫаНСОз Декантують органічну фазу, яку промиС-метил-З-С-метил-альфа-Ьрибо-гексопіранозил/ вають за допомогою 40мл СН2СІ2 Висушують ор6-О-метилеритроміцин ганічну фазу над Na2SO4 та випарюють розчинник Продукт одержаний на попередній стадії підпри зниженому тиску Дістають 7,5г цільового про 13 53628 14 дають дії оцтового ангідриду та одержують цільоВисушують органічну фазу над сульфатом натрію, вий продукт потім випарюють розчинник при зниженому тиску Одержаний залишок обробляють за допомогою Застосування 2 2'-О-ацетил-3-О-де/2,6-диде4,25мл ізопропілового ефіру, потім 14,9мл гептану окси-3-С-метил-3-О-метил-альфа-І_-рибоПісля перемішування на протязі 5 хвилин залишок гексопіранозил/6-О-метилеритроміцин зневоднюють, потім промивають гептаном Після Стадія А 9-0-/1 -метокси-1-метилетил/оксим висушування дістають 1,72г цільового продукту 3-О-де/2,-6-дидеокси-3-С-метил-3-О-метил-альфа/безбарвні кристали/ Т пл = 200°С Вихід 74,7% L-рибо-гексопіранозил/б-О-метилеритромщину До суміші з 2,75г продукту з прикладу 1 та Результати аналізу 5,5мл тетрапдрофурану додають швидко та при ЯМР /CD CI3, 300МГц/ навколишній температурі 8,25мл одномолярного 0,83 hi СНз-СН2, 0,92 /д/ - 0,97 /д/ - 1,17 /д/ розчину фториду тетрабутиламонію в тетрапдро1,28 /д/ - 1,30 /д/ СНз-СН, 1,18 - 1,29 - 1,40 - 1,47 фурані, потім перемішують на протязі 45 хвилин СНз-С, 2,06 Id OAc, 2,26 Id N/Me/2, 2,59 /кл/ Потім додають суміш з 15мл етилацетату та 15мл Ню, 2,69 їм/ Н'з та Н2, 2,95 /с/ ОМе в положенні льодяної води Після декантування реекстрагують 6, 3,22 Id ОМе ланцюг, ~ 3,47 Н3, Н 8 та Н'5, 3,73 органічну фазу за допомогою Змл води Додають /д/ Н5, 3,79 /сл/ Нц, 4,60 /д/ Н'і, 4,77 /дд/ Н'2і до водної фази 0,82мл концентрованого гідрокси5,23 /дд/ Н13, 1,72 /д/ - 3,32 - 4,63 Н рухливі ду амонію Екстрагують водну фазу етилацетатом Стадія С 2'-О-ацетил-3-О-де/2,6-дидеокси-3Промивають органічну фазу за допомогою Змл С-метил-3-О-метил-адьфа-і_-рибо-гексопіранозил/ насиченого водного розчину хлориду натрію, потім 6-О-метилеритромицин висушують и над сульфатом натрію та випарюють Суміш з 180мг продукту одержаного на поперозчинник при зниженому тиску Дістають 2,17г редній стадії, 1,8мл етанол/вода 1/1, 23мкл 98%цільового продукту Вихід 95,7% ноі мурашиної кислоти, 180мг бісульфіту натрію Результати аналізу перемішують на протязі 3-х з половиною годин при ЯМР /CD СІ3, 300МГц/ температурі кипіння зі зворотним холодильником 0,84 111 CH3-CH2, 0,97 /д/ - 1,10 /д/ - 1,18 /д/ Охолоджують при навколишній температурі та 1,24 /д/ - 1,26 /д/ СНз-СН, 1,20 - 1 40 /х 2/ - 1,48 додають 1,8мл насиченого розчину бікарбонату СНз-С, 2,26/с/ N/Me/2, 2,13 /кл/ Н4, 2,48 /м/ Н'3, натрію Потім, ПІСЛЯ 3-Х ХВИЛИН перемішування, 2,66 Н 10 та Н2, 2,98 /с/ ОМе в положенні 6, 3,22 екстрагують 2 рази СН2СІ2 Промивають органічну /с/ ОМе ланцюг, ~ 3,26 Н'2, ~ 3,54 Н 3 та Н'5, 3,68 фазу за допомогою 2мл насиченого водного розId - 3,83 /д/ Н5 та Нц, ~ 3,73 /м/ Н8 -> Е, 4,38 /д/, чину NaCI Висушують органічну фазу над сульH'L 5,23 /дд/ Ніз фатом натрію, випарюють розчинник при зниженому тиску Після очищення залишку шляхом Стадія В 9-О-/1-метокси-1-метилетил/оксим хроматографії на дюксиді кремнію, елююючи ети2'-О-ацетил-3-О-де/2,6-дидеокси-3-С-метил-3-Олацетатом, який містить 2% тетрапдрофурану, метил-альфа-І_-рибо-гексопіранозил/ 6-Одістають 43мг цільового продукту Вихід 27% метилерктроміцину Результати аналізу Суміш з 2,17г продукту приготованого на по14 передній стадії, 22мл СН2СІ2, ЗЭОмкл оцтового -ОН ~ 3626 см 1 /макс/ ангідриду перемішують на протязі півтори години 3500 см 1 при навколишній температурі Додають 22мл на=0 1735 с м 1 сиченого розчину бікарбонату натрію Промивають 1689 см"1 органічну фазу за допомогою Юмл солоної води Реекстрагують водні фази за допомогою СН2СІ2 ТОВ "Міжнародний науковий комітет' вул Артема 77, м Київ 04050 Україна (044)236 - 47 - 24
ДивитисяДодаткова інформація
Назва патенту англійською5-о-deozaminyl -6-о-methylerythronolide a derivatives, a process for preparation thereof, intermediate compounds and a process for erythromycine derivatives preparation
Назва патенту російськоюПроизводные 5-о-дезозаминил-6-о-метилеритронолида а, способ их получения, промежуточные соединения и способ получения производных эритромицина
МПК / Мітки
МПК: C07H 17/08
Мітки: 5-о-дезозамініл-6-о-метилеритроноліду, похідні, спосіб, еритроміцину, одержання, сполуки, похідних, проміжні
Код посилання
<a href="https://ua.patents.su/8-53628-pokhidni-5-o-dezozaminil-6-o-metileritronolidu-a-sposib-kh-oderzhannya-promizhni-spoluki-ta-sposib-oderzhannya-pokhidnikh-eritromicinu.html" target="_blank" rel="follow" title="База патентів України">Похідні 5-о-дезозамініл-6-о-метилеритроноліду а, спосіб їх одержання, проміжні сполуки та спосіб одержання похідних еритроміцину</a>
Попередній патент: Залізобетонний блок для захисної споруди
Наступний патент: Гербіцидна суміш з синергічним ефектом та спосіб боротьби з небажаною рослинністю
Випадковий патент: Спосіб розробки надто зближених пластів в умовах слабких вміcних порід