2-(піридин-2-іл)піримідинові сполуки та їх застосування для боротьби зі шкідливими грибами
Номер патенту: 83314
Опубліковано: 25.06.2008
Автори: Блеттнер Карстен, Швьоглер Аня, Штратманн Зігфрид, Хюнгер Удо, Штірль Райнхард, Мюллер Бернд, Ретер Ян, Гроте Томас, Грамменос Вассіліос, Кьоле Харальд, Шівек Франк, Шьофль Ульріх, Шефер Петер, Райнхаймер Йоахим, Шерер Маріа, Гевер Маркус
Формула / Реферат
1. 2-(піридин-2-іл)піримідинові сполуки загальної формули І
 , (І)
, (І)
у якій
k являє собою 0, 1, 2 або 3;
m являє собою 0, 1, 2, 3, 4 або 5;
n являє собою 1, 2, 3, 4 або 5;
R1 незалежно один від іншого являють собою галоген, ОН, CN, NO2, С1-С4-алкіл, С1-С4-галоалкіл, С1-С4-алкоксигрупу, С1-С4-галоалкоксигрупу, С2-С4-алкеніл, С2-С4-алкініл, С3-С8-циклоалкіл, С1-С4-алкоксі-С1-С4-алкіл, аміногрупу, феноксигрупу, яка є незаміщеною або може бути заміщеною за допомогою галогену або С1-С4-алкілу, NHR, NR2, C(Ra)=N-ORb, S(=O)PA1 або С(=О)А2, де р, R, Ra, Rb, А1 та А2 приймають наступні значення:
R являє собою С1-С4-алкіл або С1-С4-алкілкарбоніл,
Ra являє собою водень або С1-С4-алкіл,
Rb являє собою С1-С4-алкіл, С3-С4-алкеніл або С3-С4-алкініл,
р являє собою 0, 1 або 2,
А1 являє собою С1-С4-алкіл, або, якщо р дорівнює 2, також може являти собою NH2, С1-С4-алкіламіногрупу або ді-(С1-С4-алкіл)аміногрупу, та
А2 являє собою водень, гідроксигрупу, С1-С4-алкіл, С1-С4-алкіламіногрупу, ді-(С1-С4-алкіл)аміногрупу, С2-С4-алкеніл, С1-С4-алкоксигрупу або С1-С4-галоалкоксигрупу;
або два радикали R1, прикріплені до суміжних атомів вуглецю, разом можуть також утворювати групу -O-Alk-O, де Alk являє собою лінійний або розгалужений С1-С4-алкілен, у якому 1, 2, 3 або 4 атоми водню можуть бути замінені на галоген;
R2 являє собою С1-С4-галоалкіл, С1-С4-алкоксигрупу, С1-С4-галоалкоксигрупу, гідроксигрупу, галоген, CN або NO2; де R2 також може являти собою водень або С1-С4-алкіл, якщо виконується принаймні одна з наступних умов:
n являє собою 3, 4 або 5,
k являє собою 1, 2 або 3, та
R3 являє собою С1-С4-алкіл;
та сільськогосподарські прийнятні солі сполук формули І.
2. Сполуки формули І за п. 1, у яких R2 являє собою С1-С4-галоалкіл, С1-С4-алкоксигрупу, С1-С4-галоалкоксигрупу, галоген, CN або NO2.
3. Сполуки формули І за п. 2, у яких R2 являє собою С1-С4-алкоксигрупу, С1-С4-галоалкоксигрупу або галоген.
4. Сполуки формули І за будь-яким з пп. 2 або 3, у яких n являє собою 1, 2 або 3.
5. Сполуки формули І за будь-яким з пп. 1-4, у яких n являє собою 3, 4 або 5 та особливо 3.
6. Сполуки формули І за будь-яким з попередніх пунктів, у яких m являє собою 0, 1, 2 або 3.
7. Сполуки формули І за будь-яким з попередніх пунктів, у яких R1 являє собою галоген, CN, С1-С4-алкіл, С1-С4-галоалкіл, С1-С4-алкокси або С1-С4-галоалкоксигрупу.
8. Сполуки формули І за будь-яким з пп. 1-6, у яких один з радикалів R1 являє собою групу C(Ra)=N-ORb.
9. Сполуки формули І за будь-яким попередніх пунктів, у яких група
 ,
,
у якій # являє собою місце зв'язування з піридиновим кільцем, являє собою радикал формули Р
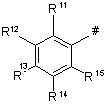 , (Р)
, (Р)
у якій
R11 являє собою водень, фтор, хлор, СН3, ОСН3, OCHF2, OCF3 або CF3;
R12, R14 незалежно один від одного являють собою атом водню, хлор, фтор, СН3, ОСН3, OCHF2, OCF3 або CF3, де один з радикалів R12 та R14 також може являти собою NO2, С(О)СН3 або СООСН3;
R13 являє собою водень, фтор, хлор, ціано, ОН, СНО, NO2, NH2, метиламіно, диметиламіно, діетиламіно, С1-С4-алкіл, С3-С8-циклоалкіл, С1-С4-алкокси, С1-С4-алкілтіо, С1-С4-галоалкіл, С1-С4-галоалкокси, СО(А2), у якій А2 являє собою С1-С4-алкіл або С1-С4-алкоксигрупу, або групу C(Ra)=NORb, у якій Ra являє собою водень або метил та Rb являє собою С1-С4-алкіл, пропаргіл або аліл, або R12 та R13 разом утворюють групу О-СН2-О; та
R15 являє собою водень, фтор, хлор або С1-С4-алкіл.
10. Сполуки формули І за п. 9, у яких принаймні один з радикалів R11, R12, R13, R14 або R15 не являє собою водень.
11. Застосування сполуки загальної формули І за будь-яким попередніх пунктів та її сільськогосподарсько прийнятних солей для боротьби з патогенними грибами рослин.
12. Агент, прийнятний для боротьби зі шкідливими грибами, що включає твердий або рідкий носій та сполуку формули І за будь-яким з пп. 1-10 та/або її сільськогосподарсько прийнятну сіль.
13. Спосіб боротьби з патогенними грибами рослин, у якому гриби або матеріали, посіви, ґрунт або насіння, які необхідно захистити від грибкової гнилі, обробляють ефективною кількістю сполуки формули І за будь-яким з пп. 1-10 та/або її сільськогосподарсько прийнятною сіллю.
Текст
1. 2-(піридин-2-іл)піримідинові сполуки загальної формули І R2 C2 2 (19) 1 3 83314 4 9. Сполуки формули І за будь-яким попередніх галоалкокси, СО(А2), у якій А2 являє собою С1-С4пунктів, у яких група алкіл або С1-С4-алкоксигрупу, або групу C(Ra)=NORb, у якій Ra являє собою водень або # метил та Rb являє собою С1-С4-алкіл, пропаргіл (R1) m або аліл, або R12 та R13 разом утворюють групу ОСН2-О; та , R15 являє собою водень, фтор, хлор або С1-С4у якій # являє собою місце зв'язування з піридиноалкіл. вим кільцем, являє собою радикал формули Р 10. Сполуки формули І за п. 9, у яких принаймні R 11 один з радикалів R11, R12, R13, R14 або R15 не являє собою водень. # R12 11. Застосування сполуки загальної формули І за (Р) будь-яким попередніх пунктів та її сільськогоспо13 дарсько прийнятних солей для боротьби з патоR R 15 генними грибами рослин. R 14 12. Агент, прийнятний для боротьби зі шкідливими , грибами, що включає твердий або рідкий носій та у якій сполуку формули І за будь-яким з пп. 1-10 та/або її R11 являє собою водень, фтор, хлор, СН3, ОСН3, сільськогосподарсько прийнятну сіль. OCHF2, OCF3 або CF3; 13. Спосіб боротьби з патогенними грибами росR12, R14 незалежно один від одного являють собою лин, у якому гриби або матеріали, посіви, ґрунт атом водню, хлор, фтор, СН3, ОСН3, OCHF2, OCF3 або насіння, які необхідно захистити від грибкової або CF3, де один з радикалів R12 та R14 також могнилі, обробляють ефективною кількістю сполуки же являти собою NO2, С(О)СН3 або СООСН3; 13 формули І за будь-яким з пп. 1-10 та/або її сільсьR являє собою водень, фтор, хлор, ціано, ОН, когосподарсько прийнятною сіллю. СНО, NO2, NH2, метиламіно, диметиламіно, діетиламіно, С1-С4-алкіл, С3-С8-циклоалкіл, С1-С4алкокси, С1-С4-алкілтіо, С1-С4-галоалкіл, С1-С4 Даний винахід відноситься до 2-(піридин-2іл)піримідинів та до їх застосування для боротьби зі шкідливими грибами, а також до композицій захисту врожаю, що включають такі сполуки як ефективний компонент. [ЕР-А 234104] описує 2-(піридин-2іл)піримідини, які мають алкільну групу у 6положенні піридинового радикалу та які можуть мати сконденсоване насичене 5- або 6-членне кільце у 3,4-положенні піримідинового кільця. Сполуки є прийнятними для боротьби з фітопатогенними грибами (шкідливі гриби). [US 4,873,248] розкриває 2-(піридин-2іл)піримідини, що мають фунгіцидну дію, які несуть необов'язково заміщене фенільне кільце у 4положенні піримідинового кільця. [ЕР-А 259139] описує 2-(піридин-2іл)піримідини формули А у якій а являє собою 0, 1, 2, 3, 4 або 5, Rd являє собою галоген, нижчий алкіл, нижчу алкокси групу або галоалкіл, R та Rc незалежно один від іншого являють собою атом водню або С1-С4алкіл, Rd являє собою водень або нижчий алкіл, Re являє собою водень, нижчий алкіл або галоген або разом з Rd являє собою пропан-1,3-дііл або бутан1,4-дііл та R* являє собою, серед інших, водень, алкіл, нижчу алкокси групу або нижчу алкілтіо групу. Що стосується їх фунгіцидної дії, деякі з 2(піридин-2-іл)піримідинів, відомі з попереднього рівня техніки, є незадовільними, або вони мають небажані властивості, такі як погана сумісність з корисними рослинами. Відповідно, метою даного винаходу є забезпечення нових сполук, що мають покращену фунгіцидну активність та/або кращу сумісність з корисними рослинами. Неочікувано, ця мета досягається за допомогою 2-(піридин-2-іл)піримідинових сполук формули І у якій: k являє собою 0, 1, 2 або 3; m являє собою 0, 1, 2, 3, 4 або 5; n являє собою 1, 2, 3, 4 або 5; R1 незалежно один від іншого являють собою галоген, ОН, CN, NO2, С1-С4-алкіл, С1-С4галоалкіл, С1-С4-алкокси групу, С1-С4-галоалкокси групу, С2-С4-алкеніл, С2-С4-алкініл, С3-С8циклоалкіл, С1-С4-алкокси-С1-С4-алкіл, аміно групу, фенокси групу, яка є необов'язково заміщеною за допомогою галогену або С1-С4-алкілу, NHR, NR2, 5 83314 6 прийнятні катіони являють собою в основному іони C(Ra)=N-ORb, S(=O)pA1 або С(О)А2, де р, R, Ra, Rb, лужних металів, переважно натрію та калію, лужА1 та А2 приймають значення, представлені нижче: ноземельних металів, переважно кальцію, магнію R являє собою С1-С4-алкіл або С1-С4та барію, та перехідних металів, переважно маралкілкарбоніл, ганцю, міді, цинку та заліза, і також іон амонію, Ra являє собою водень або С1-С4-алкіл, який, при бажанні, може нести від одного до чотиRb являє собою С1-С4-алкіл, С3-С4-алкеніл або рьох С1-С4-алкільних замісників та/або один феніС3-С4-алкініл, льний або бензильний замісник, переважно діізопp являє собою 0, 1 або 2, ропіламоній, тетраметиламоній, тетрабутиламоній, А1 являє собою С1-С4-алкіл або для p=2 також триметилбензиламоній, більш того, фосфонієві ΝΗ2, С1-С4-алкіламіно групу або ди-(С1-С4іони, сульфонієві іони, переважно три(С1-С4алкіл)аміно групу, та алкіл)сульфоніум, та сульфоксонієві іони, переваА2 являє собою водень, гідроксил, С1-С4-алкіл, жно три(С1-С4-алкіл)сульфоксоніум. С1-С4-алкіламіно групу, ди-(С1-С4-алкіл)аміно груАніони прийнятних солей приєднання кислоти пу, С1-С4-алкеніл, С1-С4-алкокси групу або С1-С4являють собою в основному хлорид, бромід, фтогалоалкокси групу; рид, гідросульфат, сульфат, дигідрофосфат, гідабо два радикали R1, прикріплені до суміжних рофосфат, фосфат, нітрат, бікарбонат, карбонат, атомів вуглецю, разом можуть також утворювати гексафторсилікат, гексафторфосфат, бензоат, і групу -O-Alk-O-, де Alk являє собою лінійний або також аніони С1-С4-алканових кислот, таких як перозгалужений С1-С4-алкілен та де 1,2, 3 або 4 атореважно форміат, ацетат, пропіонат та бутират. мів водню можуть бути також замінені на галоген; Вони можуть бути утворені шляхом введення у R2 являє собою С1-С4-галоалкіл, С1-С4-алкокси реакцію сполуки І з кислотою відповідного аніону, групу, С1-С4-галоалкокси групу, гідроксил, галоген, переважно соляної кислоти, бромистоводневої CN або NO2; де R2 також може являти собою вокислоти, сірчаної кислоти, фосфорної кислоти або день або С1-С4-алкіл, якщо виконується принаймні азотної кислоти. одна з трьох наступних умов: У визначеннях змінних, представлених у фор- n являє собою 3, 4 або 5, мулах вище, використовують колективні терміни, - k являє собою 1, 2 або З, які в основному являють собою типові представ- для m¹0 принаймні один з радикалів R1 явники зазначених замісників. Термін Сn-Сm позначає ляє собою радикал, що відрізняється від галогену, кількість атомів вуглецю у заміснику або залишку С1-С4-алкілу, С1-С4-алкокси групи та С1-С4заміснику, можливих у коленому випадку: галоалкілу; та галоген: фтор, хлор, бром та йод; R3 являє собою С1-С4-алкіл; алкіл та всі алкільні залишки в алкокси, алкокта за допомогою сільськогосподарськи прийнсиалкіл, алкіламіно та діалкіламіно групі: насичені ятних солей сполук І. лінійні або розгалужені вуглеводневі радикали, що Тому, даний винахід забезпечує 2-(піридин-2мають 1-4 атоми вуглецю, наприклад, С1-С4-алкіл, іл)піримідини формули І та їх сільськогосподарсьтакий як метил, етил, пропіл, 1-метилетил, бутил, ки прийнятні солі. 1-метилпропіл, 2-метилпропіл, 1,1-диметилетил; Більш того, даний винахід забезпечує застосугалоалкіл: лінійні або розгалужені алкільні грування 2-(піридин-2-іл)піримідинів формули І та їх пи, що мають 1-4 атоми вуглецю (як зазначено сільськогосподарськи прийнятних солей для боровище), де деякі або всі з атомів водню у цих групах тьби з фітопатогенними грибами (= шкідливими можуть бути заміщені за допомогою атомів галогрибами), і також спосіб боротьби з фітопатогенгену, як зазначено вище, та зокрема за допомогою ними грибами, який включає обробку грибів або фтору або хлору, зокрема С1-С2-галоалкіл, такий матеріалів, рослин, ґрунту або насіння для захисту як хлорметил, бромметил, дихлорметил, трихлорвід ураження грибами за допомогою ефективної метил, фторметил, дифторметил, трифторметил, кількості сполуки формули І та/або за допомогою хлорфторметил, дихлорфторметил, хлордифторсільськогосподарськи прийнятної солі сполуки І. метил, 1-хлоретил, 1-брометил, 1-фторетил, 2Крім того, даний винахід забезпечує композифторетил, 2,2-дифторетил, 2,2,2-трифторетил, 2цію для боротьби зі шкідливими грибами, де ці хлор-2-фторетил, 2-хлор-2,2-дифторетил, 2,2композиції включають принаймні одну 2-(піридиндихлор-2-фторетил, 2,2,2-трихлоретил, пентафто2-іл)піримідинову сполуку формули І та/або її сільретил та 1,1,1-трифторпроп-2-іл; ськогосподарськи прийнятну сіль та принаймні алкеніл: мононасичені лінійні або розгалужені один рідкий або твердий носій. вуглеводневі групи, що мають 2-4 або 3 -4 атоми В залежності від моделі заміщення, сполуки вуглецю та один подвійний зв'язок у будь-якому формули І та їх таутомери можуть мати один або положенні, наприклад етеніл, 1-пропеніл, 2більше центрів хіральності, у випадку яких вони пропеніл, 1-метилетеніл, 1-бутеніл, 2-бутеніл, 3присутні у вигляді чистих енантіомерів або чистих бутеніл, 1-метил-1-пропеніл, 2-метил-1-пропеніл, діастереомерів або у вигляді енантіомерних або 1-метил-2-пропеніл, 2-метил-2-пропеніл; діастереомерних сумішей. Даний винахід забезпеалкініл: лінійні або розгалужені вуглеводневі чує як чисті енантіомери або чисті діастереомери, групи, що мають 2-4 або 3-4 атоми вуглецю та потак і їх суміші. трійний зв'язок у будь-якому положенні, наприПрийнятні сільськогосподарсько корисні солі клад, етиніл, 1-пропініл, 2-пропініл, 1-бутиніл, 2являють собою, головним чином, солі тих катіонів бутиніл, 3-бутиніл, 1-метил-2-пропініл; або солі приєднання кислоти тих кислот, катіони та циклоалкіл: моноциклічні насичені вуглеводаніони, відповідно, яких не мають несприятливого неві групи, що мають 3-8, переважно до 6, вуглеефекту на фунгіцидну дію сполук І. Таким чином, 7 83314 8 k являє собою 0, 1 або 2, особливо 0. Якщо k цевих кільцевих членів, такі як циклопропіл, циквідрізняється від 0, радикал(и) R3 може(уть) бути лобутил, циклопентил та циклогексил; розташований (і) у будь-якому положенні насичеалкіламіно: алкільна група, прикріплена через ного сконденсованого кільця. У особливо кращому NH групу, у якій алкіл являє собою один з зазначевтіленні, k являє собою 0. У додатковому кращому них вище алкільних радикалів, що мають 1-4 атовтіленні, k являє собою 2. У цьому втіленні, два ми вуглецю, така як метиламіно, етиламіно, нрадикали R3 переважно розташовані на одному пропіламіно, ізопропіламіно, н-бутиламіно група та атомі вуглецю. подібні; R1 являє собою галоген, зокрема фтор, хлор діалкіламіно: радикал формули N(алкіл)2, у або бром, ціано групу, ОН, СНО, NO2, NH2, метилякому алкіл являє собою один з зазначених вище аміно групу, диметиламіно групу, діетиламіно груалкільних радикалів, що мають 1-4 атоми вуглецю, пу, С1-С4-алкіл, зокрема метил, ізопропіл або третнаприклад, така як диметиламіно, діетиламіно, бутил, С3-С8-циклоалкіл, особливо циклопропіл, метилетиламіно, N-метил-N-пропіламіно група та циклопентил або циклогексил, С1-С4-алкокси груподібні; пу, головним чином, ОСН3, С1-С4-алкілтіо групу, С1-С4-алкокси: алкільна група, яка прикріплена особливо метилтіо групу або етилтіо групу, С1-С4через атом кисню та має 1-4 атоми вуглецю, нагалоалкіл, зокрема С1-С2-фторалкіл, особливо приклад, така як метокси, етокси, н-пропокси, 1CF3, С1-С4-галоалкокси групу, головним чином, метилетокси, бутокси, 1-метилпропокси, 2OCHF2 або OCF3, або групу СО(А2), де А2 являє метилпропокси або 1,1-диметилетокси група; собою С1-С4-алкокси групу, особливо ОСН3, або С1-С4-галоалкокси: С1-С4-алкокси радикал, як С1-С4-алкіл, особливо метил. Перевага також відзазначено вище, який частково або повністю задається тим сполукам, у яких один з радикалів R1 міщений за допомогою груп, таких як фтор, хлор, являє собою групу C(Ra)=NORb, у якій Ra та Rb бром та/або йод, переважно за допомогою фтору, приймають значення, представлені вище, та у якій тобто, наприклад, такий як OCH2F, OCHF2, OCF3, Ra являє собою в основному Η або СН3 та Rb явОСH2СІ, ОСНСI 2, ОССІ 3, хлорфтормеіокси, дихлоляє собою в основному С1-С4-алкіл, пропаргіл або рфторметокси, хлордифторметокси, 2-фторетокси, аліл. 2-хлоретокси, 2-брометокси група, 2-йодетокси Особливо переважно R1 вибирають з числа група, 2,2-дифторетокси, 2,2,2-трифторетокси, 2галогенів, зокрема F або СІ, CN, С1-С4-алкілу, в хлор-2-фторетокси, 2-хлор-2,2-дифторетокси, 2,2основному, такого як метил, ізопропіл або третдихлор-2-фторетокси, 2,2,2-трихлоретокси, OC2F5, бутил, С1-С4-галоалкіл, в основному С1-С22-фторпропокси, 3-фторпропокси, 2,2фторалкіл, особливо трифторметил, С1-С4-алкокси дифторпропокси, 2,3-дифторпропокси, 2група, зокрема метокси група, етокси група, ізохлорпропокси, 3-хлорпропокси, 2,3пропілокси група, С1-С4-алкілтіо група, наприклад, дихлорпропокси, 2-бромпропокси, 3така як метилтіо група, або С1-С4-галоалкокси грубромпропокси, 3,3,3-трифторпропокси, 3,3,3па, зокрема OCF3 або OCHF2 або один з радикалів трихлорпропокси група, OCH2-C2F5, OCF2-C2F5, 1являє собою групу C(Ra)=NO-Rb або групу С(О)-А2. (СН2F)-2-фторетокси, 1-(СН2СI)-2-хлоретокси, 1Особливо кращі радикали R1 вибирають з гру(СН2Вг)-2-брометокси, 4-фторбутокси, 4пи, що включає метил, F, СІ, метокси, трифтормехлорбутокси, 4-бромбутокси або нонафторбутокси тил та CN. Також особливо кращі радикали вибигрупа, рають з групи, що включає CH(=NOCH3), алкілeн: лінійний насичений вуглеводневий C(CH3)(=N-OCH3), C(CH3 )(=N-OC2H5), С(О)СН3 та ланцюг, що має 2-6 та зокрема 2-4 атоми вуглецю, СО2СН3. такий як етан-1,2-дііл, пропан-1,3-дііл, бутан-1,4R2 являє собою С1-С4-галоалкіл, переважно дііл, пентан-1,5-дііл або гексан-1,6-дііл. С1-С2-фторалкіл та особливо трифторметил, С1Перше втілення даного винаходу відноситься С4-алкокси групу, С1-С4-галоалкокси групу, галодо сполук, у яких n являє собою 3, 4 або 5 та в ген, CN або ΝΟ2, в основному С 1-С4-алкокси групу, основному 3 або 4, R2 являє собою водень, С1-С4особливо метокси групу або етокси групу, С1-С4алкіл, С1-С4-галоалкіл, С1-С4-алкокси групу, С1-С4галоалкокси групу, зокрема трифторметокси групу галоалкокси групу, гідроксил, галоген, CN або ΝΟ2 або дифторметокси групу, або галоген, особливо та інші змінні приймають значення, показані вище, F, СІ або Вг. зокрема значення, показані нижче, які вважаються Перевага також віддається тим сполукам фокращими. рмули І, у яких n = 3, 4 або 5, у яких R2 являє соДруге втілення даного винаходу відноситься бою водень або зокрема С1-С4-алкіл та особливо до сполук, у яких n являє собою 1 або 2 та в оснокраще метил або етил. вному 2, R2 являє собою С1-С4-галоалкіл, С1-С4Перевага також віддається тим сполукам фоалкокси групу, С1-С4-галоалкокси групу, гідроксил, рмули І, у яких k = 1, 2 або 3 та особливо 2, у яких галоген, CN або ΝΟ2 та інші змінні приймають знаR2 являє собою водень або зокрема С1-С4-алкіл та чення, показані вище, зокрема значення, показані особливо краще метил або етил. нижче, які вважаються кращими. R3 являє собою метил або ізопропіл. З метою застосовувати як фунгіцидів, переваСеред сполук формули І, особлива перевага га віддається тим сполукам формули І, у яких віддається тим сполукам, у яких фенільна група, змінні m, n, k, R1, R2 та R3 незалежно одна від друзаміщена за допомогою (R1)m, являє собою групу гої та зокрема у комбінації приймають значення, формули Ρ показані нижче. m являє собою 0 або ціле число 1, 2 або 3; n являє собою 1,2 або 3, особливо 2 або 3; 9 у якій # являє собою точку прикріплення до піридинового кільця та R11, R12, R13, R14 та R15 приймають значення, описані для R1, зокрема значення, представлені як кращі або особливо кращі. У кращому втіленні, принаймні один та особливо 1, 2, або 3 з радикалів R11, R12, R13, R14 та R15 відрізняються від атому водню. У іншому кращому втіленні, всі радикали R11, R12, R13, R14 та R15 являють собою водень. Зокрема: R11 являє собою водень, фтор, хлор, СН3, ОСН3, OCHF2, OCF3 або CF3; R12, R14 незалежно один від іншого являють собою атом водню, хлор, фтор, СН3, ОСН3, OCHF2, OCF3 або CF3, де один з радикалів R12 та R14 може також являти собою NO2, С(О)СН3 або СООСН3; зокрема R12 та R14 являють собою водень, фтор, метил або трифторметил; R13 являє собою водень, фтор, хлор, ціано групу, ОН, СНО, NO2, NH2, метиламіно групу, диметиламіно групу, діетиламіно групу, С1-С4алкіл, особливо СН3, С2Н5, СН(СН3)2 , С3-С8-циклоалкіл, особливо циклопропіл, циклопентил або циклогексил, С1-С4-алкокси групу, особливо ОСН3, С1-С4алкілтіо групу, особливо метилтіо групу або етилтіо групу, С1-С4-галоалкіл, особливо CF3, С1-С4галоалкокси групу, особливо OCHF2 або OCF3, або СО(А2), у яких А2 являє собою С1-С4-алкіл, особливо метил або С1-С4-алкокси групу, особливо ОСН3, або R12 та R13 разом утворюють групу ОСН2-О; та R15 являє собою водень, фтор, хлор або С1-С4алкіл, особливо СН3, зокрема водень або фтор. Перевага також віддається тим сполукам, у яких R12 або R13 являють собою групу C(Ra)=NORb, у якій Ra та Rb приймають значення, представлені вище, зокрема значення, представлені як кращі. Якщо більше ніж один з радикалів R11, R12, R13, 14 R або R1 не являє собою водень, переважно тільки один з радикалів, що не являє собою водень, не являє собою галоген або метил. Особливо, якщо один з радикалів R11, R12, R13, R14 або R15 не являє собою водень, галоген або метил, інші радикали, що залишилися, R11, R12, R13, R14 , R15 вибирають з групи, що включає галоген та водень. Приклади радикалів Ρ являють собою в основному ті, у яких R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному рядку таблиці А: 83314 10 11 83314 12 значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 1: Сполуки формули Іа, у яких R2 являє собою метокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 2: Сполуки формули Іа, у яких R2 являє собою етокси групу та R11, R12, R13, R14 та R15 разомприймають значення, представлені у одному з рядків 2144 таблиці А. Таблиця 3: Сполуки формули Іа, у яких R2 являє собою ізопропілокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 4: Сполуки формули Іа, у яких R2 являє собою трет-бутилокси групу та R11, R12, R13, R1 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 5: Сполуки формули Іа, у яких R2 являє собою трифторметокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 6: Сполуки формули Іа, у яких R2 являє собою дифторметокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 7: Сполуки формули Іа, у яких R2 являє собою CN та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 8: Сполуки формули Іа, у яких R2 являє собою нітро групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. Таблиця 9: Особливо краще втілення даного винаходу Сполуки формули Іа, у яких R2 являє собою включає сполуки формули Іа ОН та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 2-144 таблиці А. 15 Додаткове особливо краще втілення даного винаходу включає сполуки формули Іb у якій R11, R12, R13, R14 та R15 приймають значення, представлені вище та особливо значення, зазначені як кращі, та R2 приймає значення, представлені вище, які відрізняються від Η та С1-С4алкілу, та являє собою зокрема С1-С4-алкокси групу, особливо метокси групу, етокси групу, ізопропілокси групу, трет-бутилокси групу, С1-С2фторалкілокси групу, особливо дифторметокси групу або трифторметокси групу, CN, NO2 або ОН. Приклади цих сполук включають сполуки формули Іа, представлені у таблицях 1-9, показаних нижче, у яких R11, R12, R13, R14 та R15 разом приймають у якій R11, R12, R13, R14 та R15 приймають значення, представлені вище та особливо значення, зазначені як кращі, та R2 приймає значення, представлені вище, та являє собою зокрема С1-С4алкіл, особливо метил, етил, н-пропіл, ізопропіл, нбутил, 2-бутил або трет-бутил, С1-С4-алкокси гру 13 83314 14 Таблиця 21: пу, особливо метокси, етокси, ізопропілокси або Сполуки формули Ib, у яких R2 являє собою трет-бутилокси групу, С1-С2-фторалкіл, особливо трифторметокси групу та R11, R12, R13, R14 та R15 трифторметил або пентафторетил, С1-С2разом приймають значення, представлені у однофторалкілокси групу, особливо дифторметокси му з рядків 1-144 таблиці А. або трифторметокси групу, галоген, особливо Таблиця 22: фтор, хлор або бром, CN, NO2 або ОН. Приклади Сполуки формули Іb, у яких R2 являє собою цих сполук включають сполуки формули Іb, преддифторметокси групу та R11, R12, R13, R14 та R15 ставлені у таблицях 10-30, показаних нижче, у разом приймають значення, представлені у однояких R11, R12, R13, R14 та R15 разом приймають знаму з рядків 1-144 таблиці А. чення, представлені у одному з рядків 1-144 табТаблиця 23: лиці А. Сполуки формули Іb, у яких R2 являє собою Таблиця 10: трифторметил та R11, R12, R13, R14 та R15 разом Сполуки формули Іb, у яких R2 являє собою приймають значення, представлені у одному з метил та R11, R12, R13, R14 та R15 разом приймають рядків 1-144 таблиці А. значення, представлені у одному з рядків 1-144 Таблиця 24: таблиці А. Сполуки формули Іb, у яких R являє собою Таблиця 11: пентафторетил та R11, R12, R13, R14 та R15 разом Сполуки формули Іb, у яких R2 являє собою приймають значення, представлені у одному з етил та R11, R12, R13, R14 та R15 разом приймають рядків 1-144 таблиці А. значення, представлені у одному з рядків 1-144 Таблиця 25: таблиці А. Сполуки формули Іb, у яких R2 являє собою Таблиця 12: фтор та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іb, у яких R2 являє собою нзначення, представлені у одному з рядків 1-144 пропіл та R11, R12, R13, R14 та R15 разом приймають таблиці А. значення, представлені у одному з рядків 1-144 Таблиця 26: таблиці А. Сполуки формули Іb, у яких R2 являє собою Таблиця 13: хлор та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Ib, у яких R2 являє собою значення, представлені у одному з рядків 1-144 ізопропіл та R11, R12, R13, R14 та R15 разом притаблиці А. ймають значення, представлені у одному з рядків Таблиця 27: 1-144 таблиці А. Сполуки формули Іb, у яких R2 являє собою Таблиця 14: 2 бром та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іb, у яких R являє собою н11 12 13 14 15 значення, представлені у одному з рядків 1-144 бутил та R , R , R , R та R разом приймають таблиці А. значення, представлені у одному з рядків 1-144 Таблиця 28: таблиці А. Сполуки формули Іb, у яких R2 являє собою Таблиця 15: 2 CN та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іb, у яких R являє собою 211 12 13 14 15 значення, представлені у одному з рядків 1-144 бутил та R , R , R , R та R разом приймають таблиці А. значення, представлені у одному з рядків 1-144 Таблиця 29: таблиці А. Сполуки формули Ib, у яких R2 являє собою Таблиця 16: NO2 та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іb, у яких R являє собою 11 12 1 14 15 значення, представлені у одному з рядків 1-144 трет-бутил та R , R , R , R та R разом притаблиці А. ймають значення, представлені у одному з рядків Таблиця 30: 1-144 таблиці А. Сполуки формули Іb, у яких R2 являє собою Таблиця 17: 2 ОН та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іb, у яких R являє собою значення, представлені у одному з рядків 1-144 метокси групу та R11, R12, R13, R14 та R15 разом таблиці А. приймають значення, представлені у одному з Додаткове особливо краще втілення даного рядків 1-144 таблиці А. винаходу включає сполуки формули Іс Таблиця 18: Сполуки формули Іb, у яких R2 являє собою етокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 таблиці А. Таблиця 19: Сполуки формули Іb, у яких R2 являє собою ізопропілокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 таблиці А. Таблиця 20: у якій R11, R12, R13, R14 та R15 приймають знаСполуки формули Іb, у яких R2 являє собою чення, представлені вище та зокрема значення, трет-бутилокси групу та R11, R12, R13, R14 та R15 описані як кращі, та R2 приймає значення, предразом приймають значення, представлені у одноставлені вище, які не являють собою Η та С1-С4му з рядків 1-144 таблиці А. 15 83314 16 алкіл, та являє собою в основному С1-С4-алкокси у якій R11, R12, R13, R14 та R15 приймають знагрупу, особливо метокси, етокси, ізопропілокси, чення, представлені вище та зокрема значення, трет-бутилокси, С1-С2-фторалкілокси групу, особописані як кращі, та R2 приймає значення, предливо дифторметокси або трифторметокси групу, ставлені вище, та являє собою зокрема С1-С4CN, NO2 або ОН. Приклади цих сполук включають алкіл, особливо метил, етил, н-пропіл, ізопропіл, нсполуки формули Іс, представлені у таблицях 31бутил, 2-бутил або трет-бутил, С1-С4-алкокси гру39, показаних нижче, у яких R11, R12, R13, R14 та R15 пу, особливо метокси, етокси, ізопропілокси або разом приймають значення, представлені у однотрет-бутилокси групу, С1-С2-фторалкіл, особливо му з рядків 2-144 таблиці А трифторметил або пентафторетил, С1-С2Таблиця 31: фторалкілокси групу, особливо дифторметокси Сполуки формули Іс, у яких R2 являє собою або трифторметокси групу, галоген, особливо метокси групу та R11, R12, R13, R14 та R15 разом фтор, хлор або бром, CN, NO2 або ОН. Приклади приймають значення, представлені у одному з цих сполук включають сполуки формули Id, предрядків 2-144 таблиці А. ставлені у таблицях 40-60, показаних нижче, у Таблиця 32: яких R11, R12, R13, R14 та R15 разом приймають зна2 Сполуки формули Іс, у яких R являє собою чення, представлені у одному з рядків 1-144 табетокси групу та R11, R12, R13, R14 та R15 разом прилиці А. ймають значення, представлені у одному з рядків Таблиця 40· 2-144 таблиці А. Сполуки формули Id, у яких R2 являє собою Таблиця 33: метил та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іс, у яких R2 являє собою значення, представлені у одному з рядків 1-144 ізопропілокси групу та R11, R12, R13, R14 та R15 ратаблиці А. зом приймають значення, представлені у одному з Таблиця 41: рядків 2-144 таблиці А. Сполуки формули Id, у яких R2 являє собою Таблиця 34: етил та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іс, у яких R2 являє собою значення, представлені у одному з рядків 1-144 трет-бутилокси групу та R11, R12, R13, R14 та R15 таблиці А. разом приймають значення, представлені у одноТаблиця 42: му з рядків 2-144 таблиці А. Сполуки формули Id, у яких R2 являє собою нТаблиця 35: пропіл та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іс, у яких R2 являє собою значення, представлені у одному з рядків 1-144 трифторметокси групу та R11, R12, R13, R14 та R15 таблиці А. разом приймають значення, представлені у одноТаблиця 43: му з рядків 2-144 таблиці А. Сполуки формули Id, у яких R2 являє собою Таблиця 36: ізопропіл та R11, R12, R13, R14 та R15 разом приСполуки формули Іс, у яких R2 являє собою ймають значення, представлені у одному з рядків дифторметокси групу та R11, R12, R13, R14 та R15 1-144 таблиці А. разом приймають значення, представлені у одноТаблиця 44: му з рядків 2-144 таблиці А. Сполуки формули Id, у яких R2 являє собою нТаблиця 37: бутил та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іс, у яких R2 являє собою значення, представлені у одному з рядків 1-144 CN та R11, R12, R13, R14 та R15 разом приймають таблиці А. значення, представлені у одному з рядків 2-144 Таблиця 45: таблиці А. Сполуки формули Id, у яких R2 являє собою 2Таблиця 38: бутил та R11, R12, R13, R14 та R15 разом приймають Сполуки формули Іс, у яких R2 являє собою нізначення, представлені у одному з рядків 1-144 тро групу та R11, R12, R13, R14 та R15 разом притаблиці А. ймають значення, представлені у одному з рядків Таблиця 46: 2-144 таблиці А. Сполуки формули Id, у яких R2 являє собою Таблиця 39: трет-бутил та R11, R12, R13, R14 та R15 разом при2 Сполуки формули Іс, у яких R являє собою ймають значення, представлені у одному з рядків ОН та R11, R12, R13, R14 та R15 разом приймають 1-144 таблиці А. значення, представлені у одному з рядків 2-144 Таблиця 47: таблиці А. Сполуки формули Id, у яких R2 являє собою Додаткове особливо краще втілення даного метокси групу та R11, R12, R13, R14 та R15 разом винаходу включає сполуки формули Id приймають значення, представлені у одному з рядків 1-144 таблиці А. Таблиця 48: Сполуки формули Id, у яких R2 являє собою етокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 таблиці А. Таблиця 49: Сполуки формули Id, у яких R2 являє собою ізопропілокси групу та R11, R12, R13, R14 та R15 ра 17 83314 18 зом приймають значення, представлені у одному з рядків 1-144 таблиці А. Таблиця 50: Сполуки формули Id, у яких R2 являє собою трет-бутилокси групу та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 таблиці А. Таблиця 51: Сполуки формули Id, у яких R2 являє собою трифторметокси групу та R11, R12, R13, R14 та R15 у якій R11, R12, R13, R14 та R15 приймають знаразом приймають значення, представлені у одночення, представлені вище та зокрема значення, му з рядків 1-144 таблиці А. описані як кращі, та R2 приймає значення, предТаблиця 52: ставлені вище та являє собою зокрема С1-С4Сполуки формули Id, у яких R2 являє собою 11 12 13 14 15 алкіл, особливо метил, етил, н-пропіл, ізопропіл, ндифторметокси групу та R , R , R , R та R бутил, 2-бутил або трет-бутил, С1-С4-алкокси груразом приймають значення, представлені у однопу, особливо метокси, етокси, ізопропілокси або му з рядків 1-144 таблиці А. трет-бутилокси групу, С1-С2-фторалкіл, особливо Таблиця 53. трифторметил або пентафторетил, С1-С22 Сполуки формули Id, у яких R являє собою фторалкілокси групу, особливо дифторметокси трифторметил та R11, R12, R13, R14 та R15 разом або трифторметокси групу, галоген, особливо приймають значення, представлені у одному з фтор, хлор або бром, CN, NO2 або ОН. Приклади рядків 1-144 таблиці А. цих сполук включають сполуки формули Іе, предТаблиця 54: 2 ставлені у таблицях 61-81, показаних нижче, у Сполуки формули Id, у яких R являє собою яких R11, R12, R13, R14 та R15 разом приймають знапентафторетил та R11, R12, R13, R14 та R15 разом чення, представлені у одному з рядків 1-144 табприймають значення, представлені у одному з лиці А. рядків 1-144 таблиці А. Таблиця 61: Таблиця 55: 2 Сполуки формули Іе, у яких R2 являє собою Сполуки формули Id, у яких R являє собою метил та R11, R12, R13, R14 та R15 разом приймають 11 12 13 14 15 фтор та R , R , R , R та R разом приймають значення, представлені у одному з рядків 1-144 значення, представлені у одному з рядків 1-144 таблиці А. таблиці А. Таблиця 62: Таблиця 56: Сполуки формули Іе, у яких R2 являє собою 2 Сполуки формули Id, у яких R являє собою етил та R11, R12, R13, R14 та R15 разом приймають хлор та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 значення, представлені у одному з рядків 1-144 таблиці А. таблиці А. Таблиця 63: Таблиця 57: Сполуки формули Іе, у яких R2 являє собою н2 Сполуки формули Id, у яких R являє собою пропіл та R11, R12, R13, R14 та R15 разом приймають бром та Ru, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 значення, представлені у одному з рядків 1-144 таблиці А. таблиці А. Таблиця 64: Таблиця 58: Сполуки формули Іе, у яких R2 являє собою 2 Сполуки формули Id, у яких R являє собою ізопропіл та R11, R12, R13, R14 та R15 разом приCN та R11, R12, R13, R14 та R15 разом приймають ймають значення, представлені у одному з рядків значення, представлені у одному з рядків 1-144 1-144 таблиці А. таблиці А. Таблиця 65: Таблиця 59: Сполуки формули Іе, у яких R2 являє собою нСполуки формули Id, у яких R2 являє собою бутил та R11, R12, R13, R14 та R15 разом приймають NCh та Ru, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 значення, представлені у одному з рядків 1-144 таблиці А. таблиці А. Таблиця 66: Таблиця 60: Сполуки формули Іе, у яких R2 являє собою 2Сполуки формули Id, у яких R2 являє собою бутил та R11, R12, R13, R14 та R15 разом приймають ОН та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 значення, представлені у одному з рядків 1-144 таблиці А. таблиці А. Таблиця 67: Додаткове особливо краще втілення даного Сполуки формули Іе, у яких R2 являє собою винаходу включає сполуки формули Іе, трет-бутил та R11, R12, R13, R14 та R15 разом приймають значення, представлені у одному з рядків 1-144 таблиці А. Таблиця 68: Сполуки формули Іе, у яких R2 являє собою метокси групу та R11, R12, R13, R14 та R15 разом 19 83314 20 приймають значення, представлені у одному з приймають значення, представлені у одному з рядків 1-144 таблиці А. рядків 1-144 таблиці А. Таблиця 69: Таблиця 76: Сполуки формули Іе, у яких R2 являє собою Сполуки формули Іе, у яких R2 являє собою 11 12 13 14 15 етокси групу та R , R , R , R та R разом прифтор та R11, R12, R13, R14 та R15 разом приймають ймають значення, представлені у одному з рядків значення, представлені у одному з рядків 1-144 1-144 таблиці А. таблиці А. Таблиця 70: Таблиця 77: Сполуки формули Іе, у яких R2 являє собою Сполуки формули Іе, у яких R2 являє собою 11 12 13 14 15 ізопропілокси групу та R , R , R , R та R рахлор та R11, R12, R13, R14 та R15 разом приймають зом приймають значення, представлені у одному з значення, представлені у одному з рядків 1-144 рядків 1-144 таблиці А. таблиці А. Таблиця 71: Таблиця 78: Сполуки формули Іе, у яких R2 являє собою Сполуки формули Іе, у яких R2 являє собою 11 12 13 14 15 трет-бутилокси групу та R , R , R , R та R бром та R11, R12, R13, R14 та R15 разом приймають разом приймають значення, представлені у однозначення, представлені у одному з рядків 1-144 му з рядків 1-144 таблиці А. таблиці А. Таблиця 72: Таблиця 79: Сполуки формули Іе, у яких R2 являє собою Сполуки формули Іе, у яких R2 являє собою трифторметокси групу та R11, R12, R13, R14 та R15 CN та R11, R12, R13, R14 та R15 разом приймають разом приймають значення, представлені у однозначення, представлені у одному з рядків 1-144 му з рядків 1-144 таблиці А. таблиці А. Таблиця 73: Таблиця 80: Сполуки формули Іе, у яких R2 являє собою Сполуки формули Іе, у яких R2 являє собою дифторметокси групу та R11, R12, R13, R14 та R15 NO2 та R11, R12, R13, R14 та R15 разом приймають разом приймають значення, представлені у однозначення, представлені у одному з рядків 1-144 му з рядків 1-144 таблиці А. таблиці А. Таблиця 74: Таблиця 81: Сполуки формули Іе, у яких R являє собою Сполуки формули Іе, у яких R2 являє собою трифторметил та R11, R12, R13, R14 та R15 разом ОН та R11, R12, R13, R14 та R15 разом приймають приймають значення, представлені у одному з значення, представлені у одному з рядків 1-144 рядків 1-144 таблиці А. таблиці А. Таблиця 75: Сполуки формули І згідно з винаходом можуть Сполуки формули Іе, у яких R являє собою бути одержані, наприклад, відповідно до способу, пентафторетил та Ru, R12, R13, R14 та R15 разом показаного у схемі 1: У схемі 1, R1, R3, m, n та k приймають значення, представлені вище. R2a являє собою Н, С1-С4 алкіл, С1-С4-галоалкіл, галоген, С1-С4-алкокси групу, С1-С4-галоалкокси групу, NO2 або ОН. R являє 21 83314 22 дення у реакцію сполуки IV з триалкілсиліл ціанісобою Η або С1-С4-алкіл або, разом з додатковими дом, таким як триметилсиліл ціанід, у присутності молекулами llа, утворює ангідрид фенілборної Ν,Ν-диметилхлорформаміду. Альтернативно, ніткислоти. R1 являє собою С1-С4-алкіл та зокрема рил V може бути одержаний з 2-фенілпіридин Nметил. оксиду IV шляхом наступної реакції з диметилНа першій стадії і), 2-бромпіридин вводять у сульфатом та потім з іонами ціаніду, наприклад, з реакцію з похідною фенілборної кислоти формули ціанідом натрію або ціанідом калію, аналогічно до llа в умовах сполучення Сузукі (Suzuki), тобто у способу, описаного у [Tetrahedron (1985), 4947]. присутності каталізатору з металічної платини та 2-Ціано-6-фенілпіридинову сполуку, одержану зокрема у присутності паладієвого каталізатору, в у стадії ііі), формули V, потім, у стадії iν), перетвоумовах реакції, відомих per se, як описано, наприрюють за способом, описаним у [US 4,873,248], у клад, у [Асе. Chem. Res. 15 (1982), 178-184, Chem. амідиніум гідрохлорид формули VI. Перетворення Rev. 95 (1995), 2457-2483 та літературі, процитопроводять шляхом наступної обробки алкоксидом ваній у них, і також у J. Org. Chem. 68 (2003), лужного металу, таким як метоксид натрію або 9412]. Прийнятні каталізатори включають зокрема етоксид натрію, та наступної реакції з амоній хлотетракіс(трифенілфосфін)паладій(0), ридом. Замість гідрохлоридів, можна також застобіс(трифенілфосфін)паладію(ll) хлорид, совувати гідроброміди, ацетати, сульфати або біс(ацетонітрил)паладію(ll) хлорид, [1,1'форміати у наступній стадії ν). біс(дифенілфосфін)фероцен]паладію(ll) хлоОтриманий амідиніум гідрохлорид формули VI рид/дихлорметановий комплекс, біс[1,2далі, у стадії ν), вводять у реакцію з діалкіламінобіс(дифенїлфосфін)етан]паладій(0) та [1,4метиленциклоалканоном формули VII (енамінобіс(дифенілфосфін)-бутан]паладій(ll) хлорид. Кількетон VII) у присутності основи, переважно алкоккість каталізатору становить зазвичай від 0,1 до сиду лужного металу, такого як метоксид натрію 10моль%. або етоксид натрію. Реакція може бути проведена Отриманий 2-фенілпіридин формули III далі, у аналогічно до відомих способів для введення у стадії іі), перетворюють шляхом обробки за допореакцію амідиніум гідрохлоридів з енаміномогою перкислоти в умовах, відомих per se, у 2кетонами, як описано, наприклад, у [J. Heterocycl. фенілпіридин N-оксид формули IV. Перетворення Chem. 20 (1983), 649-653]. сполуки III у сполуку IV може бути виконане аналоЗамість енаміно-кетонів VII, можна також загічно до відомих способів, наприклад, шляхом обробки сполуки III пероксидом водню у органічній стосовувати, у стадії ν), b-оксоацеталі формули кислоті, такій як мурашина кислота, оцтова кислоVlla та, хлороцтова кислота або трифтороцтова кислота [дивись, наприклад, J. Org. Chem. 55 (1990), 738-741 та Organic Synthesis, Collect. том IV (1963), 655-656], або шляхом введення у реакцію сполуки III з органічною перкислотою, такою як метаперхлорбензойна кислота, у інертному розчиннику, такому як, наприклад, галогенований вуглеводень, такий як дихлорметан або дихлоретан [дивись, У формулі Vlla, R" являє собою С1-С4-алкіл та наприклад, Synthetic Commun. 22 (18) (1992), 2645; зокрема метил або етил. Реакція сполуки VI зі J. Med. Chem. (1998), 2146]. Перетворення сполуки сполукою Vila може бути проведена аналогічно до III у сполуку IV може бути виконане аналогічно до способу (а), описаного у [ЕР-А 259139], який вклюспособів, описаних [К.В. Scharpless (J. Org. Chem. чений у даний опис шляхом посилання. Діалкіламінометиленциклоалканони формули 63 (5) (1998), 7740)] шляхом введення у реакцію сполуки III з пероксидом водню у галогенованих VII відомі або можуть бути одержані аналогічно до відомих способів [дивись, наприклад, WO вуглеводнях, таких як дихлорметан або дихлоретан, у присутності каталітичних кількостей (напри2001/087845, Tetrahedron 50 (7) (1994), 2255-2264; клад, 5% за масою) сполук peнію(VII), таких як меSynthetic Communications 28.(10) (1998), 1743-1753 тилтриоксореній (H3CReO3). або Tetrahedron Letters 27_(23) (1986), 2567-70]. bПеретворення 2-фенілпіридин N-оксиду форОксоацеталі формули Vlla також відомі, напримули IV у нітрил V у стадії ііі) може бути виконане, клад, з [ЕР 259139], або можуть бути одержані наприклад, за допомогою модифікованої реакції комерційним шляхом. Рейсерта-Хенца (Reissert-Henze) аналогічно до Альтернативно, сполуки формули І можуть буспособів, описаних у [J. Org. Chem. 48 (1983), 1375 ти одержані шляхом синтезу, показаним у Схемі 2: та J. Org. Chem. 55 (1990), 738-741], шляхом вве 23 83314 24 У Схемі 2, R, R’, R1, R3, m, n та k приймають значення, представлені вище. R2a являє собою Н, С1-С4-алкіл або С1-С4-галоалкіл. Hal являє собою бром або хлор. Що стосується умов реакції для стадії vi), застосовують ті умови реакції, що зазначені для стадії iv) у Схемі 1. Що стосується умов реакції для стадії vii), застосовують ті умови реакції, що зазначені для стадії ν) у Схемі 1. Що стосується умов реакції для стадії viii), застосовують ті умови реакції, що зазначені для стадії і) у Схемі 1. Ціанопіридини формули VII відомі, наприклад, з [US 2003/087940, WO 2004/026305, WO 01/057046 та Bioorg. Med. Chem. Lett. (2003), 1571-1574], або вони можуть бути одержані за допомогою відомих способів одержання. Сполуки формули VII можуть бути одержані, зокрема, за способом, показаним у схемі 3. У Схемі 3, R, R1 та m приймають значення, представлені вище. R2a являє собою С1-С4-алкіл, С1-С4-галоалкіл, галоген, С1-С4-алкокси групу, С1С4-галоалкокси групу або NO2. Hal та Hal* незалежно один від іншого являють собою хлор або бром, де Hal* також може являти собою йод. Перетворення 2-галопіридину X у 2ціанопіридин XI у стадії іх) досягається шляхом стандартних способів органічної хімії шляхом введення у реакцію сполуки X з ціанідними іонами, наприклад, з ціанідом натрію або ціанідом калію [дивись ЕР-А 97460, приклад одержання 1], ціані дом міді (І) [дивись ЕР-А 34917, приклад одержання 3] або тетраметилсилілціанідом. Отриману сполуку XI далі, аналогічно способам, проілюстрованим у Схемі 1, стадія іі), перетворюють у піридин N-оксид XII (стадія х). Сполуку XII далі, у стадії хі), вводять у реакцію з галогенуючим агентом, таким як РОСI 3 або РОВr3, що приводить до одержання відповідної сполуки VII. Для введення у реакцію сполуки XII у стадії іх), галогенуючий агент в основному використовують у надлишку, розраховуючи за стехіометрією реакції. Реакція може бути проведена у інертному органічному розчиннику та 25 83314 26 часто її проводять за відсутності розчиннику, у значених вище, або у присутності цьому випадку галогенуючий агент далі в основтріс(ацетилацетонато)заліза (llІ) [дивись ному діє як розчинник. Температура реакції зазвиTetrahedron Lett. (2002), 3547], якщо прийнятно, у чай знаходиться у інтервалі від 20°С до темперазлегка модифікованих умовах, де каталізатор затури кипіння галогенуючого агенту. Сполука VII звичай використовують у кількості від 0,2 до далі може бути перетворена, за способом, показа8моль%, зокрема від 0,5 до 5моль%, у перерахунним у Схемі 2, у сполуку І. Альтернативно, сполука ку на сполуку Гріньяра llb, яку сполучають. ОсобVII може бути спочатку введена у реакцію з фенілливо кращий каталізатор являє собою [1,4борною кислотою, за способами, показаними у біс(дифенілфосфін)-бутан]паладій(ll) хлорид. Ці Схемі 1, стадія і) або Схемі 2, стадія viii), що приреакції в основному проводять при температурах у водить до одержання сполук формули V, які потім, інтервалі від -40 до + 120°С та зокрема у інтервалі відповідно до стадій iv) та ν) Схеми 1, перетворювід 20 до 100°С. Ці реакції в основному проводять ють у сполуку формули І у відповідності з винахоу інертному апротонному органічному розчиннику, дом. переважно такому як ефір та в особливості цикліЗамість борної кислоти (похідних) llа, також чний ефір, такий як тетрагідрофуран, або у суміші можна використовувати феніл-Гріньярові сполуки різних апротонних інертних розчинників, де переформули llb у Схемі 1, стадія і), Схемі 2, стадія viii) важно один з розчинників являє собою циклічний та Схемі 3, стадія хіі). ефір, такий як тетрагідрофуран. Приклади таких сумішей являють собою тетрагідрофуран/Nметилпіролідон, тетрагідрофуран/толуол або ксилол, тетрагідрофуран/діоксан, тетрагідрофуран/Ν,Ν-диметилпропіленсечовина (DMPU), а також тетрагідрофуран/сульфолан. У формулі llb, R1 та m приймають значення, Додатковий шлях одержання сполук формули представлені вище. Hal* являє собою хлор, бром І, де R2=Н, алкіл, алкокси групу або зокрема CN, або йод. Реакцію сполучення у Схемі 1, стадія і), проілюстрований у Схемі 4. Схемі 2, стадія viii) та Схемі 3, стадія хіі) далі виконують у присутності паладієвих каталізаторів, за У Схемі 4, n, R3 та k приймають значення, представлені вище. R2b являє собою Н, С1-С4алкіл або С1-С4-алкокси групу та зокрема CN. Hal* являє собою хлор, бром або, в основному, йод. Одержання сполуки Гріньяра XIV з 2-галопіридину XIII може бути виконане за способами, відомими per se, як описано, наприклад, у [Synlett (1998), 1359]. Наступне сполучення сполуки XIV з 2хлорпіримідиновою сполукою XV у стадії xiv) проводять аналогічно до сполучення сполуки Гріньяра llb, яке вже проілюстровано. Це сполучення переважно проводять у присутності каталізатору з перехідного металу групи 8-10 (у відповідності з IUРАС 1989), зокрема, такого як паладієвий, нікелевий або залізний каталізатор. Що стосується каталізатору, посилання зроблене на каталізатори, які зазначені вище. Цю реакцію проводять у розчиннику, що звичайно використовується для цієї цілі, наприклад, такому як ефір, наприклад, діетиловий ефір, діоксан, тетрагідрофуран, ароматичний вуглеводень, такий як толуол або ксилоли, або апротонний амід, лактам або сечовина, така як N-метилпіролідон або диметилпропіленсечовина, або у сумішах цих розчинників, зокрема сумішах, що містять принаймні один ефір. Температури реакції в основному знаходяться у інтервалі від -40 до +120°С та зокрема у інтервалі від 20 до 100°С. За додатковою інформацією звертайтеся до способів, описаних у [J. Am. Chem. Soc. 124 (2002), 13856, Chem. Pharm. Bull. (1983), 4533 та Chem. Pharm. Bull. (1984), 2005], які можуть бути 27 83314 28 - Bipolaris- та Drechslera вид на зернових кульвикористані аналогічним способом для сполучення турах, рисі та газонній траві, сполуки XIV зі сполукою XV. - Blumeria graminis (борошниста роса) на зерОтриману сполуку XVI далі, у стадії xv), перенових культурах, творюють у N-оксид XVII. Що стосується стадії xv), - Botrytis cinerea (сіра гниль) на полуниці, овопосилання зроблене на те, що описано для стадії чах, декоративних рослинах та виноградних лозах, іі) у Схемі 1 або стадії х) у Схемі 3. Потім, у стадії - Erysiphe cichoracearum та Sphaerotheca xvi), цей N-оксид XVII, аналогічно до стадії хі) у fuliginea на гарбузах, Схемі 3, вводять у реакцію з галогенуючим аген- Fusanum та Verticillium вид на різних рослитом, таким як РОСІ 3 або РОВr3, що приводить до нах, одержання 2-гало сполуки IX зі Схеми 2. Цю спо- Mycosphaerella вид на зернових культурах, луку далі, за допомогою способу, проілюстрованобананах та арахісі, го у Схемі 2, стадія viii), вводять у реакцію зі спо- Phytophlhora mfestans на томатах га картоплі, лукою фенілборної кислоти llа або відповідною - Plasmopara viticola на виноградних лозах, сполукою Гріньяра llb, що приводить до одержання - Podosphaera leucotricha на яблуках, сполуки формули І. - Pseudocercosporella herpotrichoides на пшеСполуки формули XV є відомими або можуть ниці та ячмені, бути одержані за способами органічної хімії, відо- Pseudoperonospora вид на хмелі та огірках, мими per se [дивись, наприклад, US 6040448, WO - Рuссіnіа вид на зернових культурах, 99/21850 та Chem. Pharm. Bull (1983), 2254]. - Pyricularia oryzae на рисі, Реакційні суміші, одержані за способами, про- Rhizoctonia вид на бавовні, рисі та газонній ілюстрованими у Схемах 1-4, обробляють загальтраві, но відомим способом, наприклад, шляхом змішу- Septoria tritici та Stagnospora nodorum на вання з водою, розділення фаз та, якщо пшениці, прийнятно, хроматографічного очищення сирих - Uncinula necator на виноградних лозах, продуктів. Деякі з проміжних сполук та кінцевих - Ustilago вид на зернових культурах та цукропродуктів отримують у формі безбарвних або злевій тростині, та гка коричневих в'язких масел, які можуть бути - Venturia вид (парша) на яблуках та грушах. очищені або звільнені від летких компонентів в Сполуки І є також прийнятними для боротьби умовах зниженого тиску та при помірно піднятій зі шкідливими грибами, такими як Paecilomyces температурі. Якщо проміжні сполуки та кінцеві variotii, у захисті матеріалів (наприклад, таких як продукти отримують у вигляді твердих речовин, дерево, папір, дисперсії фарб, волокна або тканиочищення також може бути виконане за допомони) та у захисті продуктів, які зберігають. гою перекристалізації або відстоювання. Сполуки І використовують шляхом обробки Якщо окремі сполуки І не можуть бути одергрибів або рослин, насіння, матеріалів або грунту жані за допомогою шляхів, описаних вище, вони для захисту від ураження грибами за допомогою можуть бути одержані шляхом дериватизації інших фунгіцидно ефективної кількості активних сполук. сполук І. Застосування може бути виконане як перед, так і Якщо синтез приводить до одержання сумішей після інфікування грибами матеріалів, рослин або ізомерів, у розділення в основному немає необхіднасіння. ності, так як у деяких випадках окремі ізомери моФунгіцидні композиції в основному включають жуть бути взаємно перетворені в процесі обробки від 0,1 до 95%, переважно від 0,5 та 90%, за мадля застосування або в процесі застосування (насою активної сполуки. приклад, під дією світла, кислот або основ). Такі При використанні у захисті рослин, кількості, перетворення також можуть відбуватися після защо застосовуються, в залежності від бажаного стосування, наприклад, у обробці рослин у обробефекту, становлять від 0,01 до 2,0кг активної споленій рослині, або у шкідливих грибах, з якими луки на гектар (га). борються. При обробці насіння в основному необхідні кіСполуки І є прийнятними як фунгіциди. Вони лькості активної сполуки від 0,001 до 0,1г, перевавирізняються надзвичайною ефективністю проти жно від 0,01 до 0,05г, на кілограм насіння. широкого спектру фітопатогенних грибів, особливо При використанні у захисті матеріалів або проти класів Ascomycetes, Deuteromycetes, продуктів, що зберігають, кількість активної сполуOomycetes та Basidiomycetes. Деякі з них є систеки, яку застосовують, залежить від виду області матично ефективними та вони можуть бути викозастосування та від бажаного ефекту. Кількості, ристані у захисті рослин як листові та ґрунтові фущо звичайно застосовують у захисті матеріалів, нгіциди. становлять, наприклад, від 0,001г до 2кг, переважВони є особливо важливими у боротьбі з вено від 0,005г до 1кг, активної сполуки на кубічний ликою кількістю грибів на різних культурних рослиметр обробленого матеріалу. нах, таких як пшениця, жито, ячмінь, овес, рис, Сполуки І можуть бути перетворені у звичайно кукурудза, трава, банани, бавовна, соя, кофе, цукзастосовувані композиції, наприклад, такі як розрова тростина, виноградні лози, фрукти та декорачини, емульсії, суспензії, пудри, порошки, пасти та тивні рослини, та овочі, такі як огірки, бобові росгранули. Форма застосування залежить від певної лини, помідори, картопля та гарбузи, та на насінні цілі; у кожному випадку, вона повинна забезпечуцих рослин. вати тонкодисперсне та рівномірне розподілення Вони є особливо прийнятними для боротьби з сполуки у відповідності з винаходом. наступними хворобами рослин: - Alternaria вид на фруктах та овочах, 29 83314 30 Композиції одержують відомим способом, наГранули, наприклад, покриті гранули, імпрегприклад, шляхом розведення активної сполуки за новані гранули та гомогенні гранули, можуть бути допомогою розчинників та/або носіїв, при бажанні, одержані шляхом прикріплення активних сполук до використовуючи емульгуючі агенти та диспергуючі твердих носіїв. Приклади твердих носіїв включаагенти. Розчинники /допоміжні речовини, які є приють мінеральні землі, такі як силікагелі, силікати, йнятними, головним чином, включають такі як: тальк, каолін, атаклей, вапняк, вапно, крейда, бо- вода, ароматичні розчинники (наприклад, такі люс, лес, глина, доломіт, діатомова земля, кальяк Solvesso продукти, ксилол), парафіни (наприцію сульфат, магнію сульфат, магнію оксид, грунклад, мінеральні фракції), спирти (наприклад, такі тові синтетичні матеріали, добрива, такі як, як метанол, бутанол, пентанол, бензиловий наприклад, амоній сульфат, амоній фосфат, амоспирт), кетони (наприклад, такі як циклогексанон, ній нітрат, сечовини, та продукти рослинного погама-бутиролактон). піролідони (NMP, NOP), ацеходження, такі як борошно зі злакових рослин, тати (гліколю диацетат), гліколі, диметиламіди борошно з деревної кори, деревне борошно та жирних кислот, жирні кислоти та складні ефіри борошно з горіхової шкаралупи, целюлозні порошжирних кислот. В принципі, також можуть застосоки та інші тверді носії. вуватися суміші розчинників. В основному, композиції включають від 0,01 до - носії, такі як ґрунтові природні мінерали (на95% за масою, переважно від 0,1 до 90% за маприклад, такі як каоліни, глини, тальк, крейда) та сою, активної сполуки. Активні сполуки використоґрунтові синтетичні мінерали (наприклад, високо вують з чистотою від 90% до 100%, переважно від диспергований кремнезем, силікати); емульгуючі 95% до 100% (відповідно до спектру ЯМР). агенти, такі як неіонні та аніонні емульгуючі агенти Приклади композицій включають продукти для (наприклад, такі як поліоксиетиленові ефіри жиррозведення водою, наприклад, такі як: них спиртів, алкілсульфонати та арилсульфонати) А водорозчинні концентрати (SL) та диспергуючі агенти, такі як лігнінсульфітні від10 частин за масою сполуки у відповідності з працьовані луги та метилцелюлоза. даним винаходом розчиняють у воді або у водоЯк поверхнево-активні речовини придатні лурозчинному розчиннику. Альтернативно, додають жні, лужноземельні, амонієві солі таких як: лігнозволожуючі агенти або інші допоміжні агенти. Аксульфонієва кислота, нафталінсульфонієва кислотивну сполуку розчиняється при розведенні водою; та, фенолсульфонієва кислота, дибутилВ диспергуємі концентрати (DC) нафталінсульфонієва кислота, алкіларилсульфо20 частин за масою сполуки у відповідності з нати, алкілсульфати, алкілсульфонати, сульфати даним винаходом розчиняють у циклогексаноні з спиртів жирного ряду, жирні кислоти та сульфатододаванням диспергуючого агенту, наприклад, вані глікольефіри спиртів жирного ряду, більш того полівінілпіролідон. Розведення водою приводить продукти конденсації сульфонованого нафталіну до одержання дисперсії; або похідних нафталіну з формальдегідом, продуС емульгіруємі концентрати (ЕС) кти конденсації нафталіну або нафталін15 частин за масою сполуки у відповідності з сульфонової кислоти з фенолом та формальдегіданим винаходом розчиняють у ксилолі з додадом, поліоксіетиленоктилфенольні ефіри, етоксиванням кальцію додецилбензолсульфонат та етольовані ізооктилфенол, октилфенол, нонілфенол, ксилату касторового масла (у кожному випадку алкілфеніл- полігліколеві ефіри, трибутилфенілпо5%). Розведення водою приводить до одержання лігліколевий ефір, тристеарилфеніл- полігліколеемульсії; вий ефір, алкіларилполіефірні спирти, конденсати D емульсії (EW, ЕО) окису етилену/спирту жирного ряду та спирту, ето40 частин за масою сполуки у відповідності з ксильована касторова олія, поліоксиетиленалкілоданим винаходом розчиняють у ксилолі з додаві ефіри, етоксильований поліоксипропілен, поліванням кальцію додецилбензолсульфонат та етоглікольефірний ацетат лаурилових спиртів, складні ксилату касторового масла (у кожному випадку ефіри сорбіту, лігнінсульфітні відпрацьовані луги 5%). Цю суміш вводять у воду за допомогою емуабо метилцелюлоза. льгуючої машини (Ultraturax) та перетворюють у Прийнятними для одержання розчинів, які могомогенну емульсію. Розведення водою приводить жуть бути безпосередньо розпилені, емульсій, до одержання емульсії; паст або масляних дисперсій є фракції мінеральΕ суспензії (SC, OD) ного масла з від середньої до високої точкою киУ шаровому млині з безперервним перемішупіння, такі як керосин або дизельне паливо, більш ванням, 20 частин за масою сполуки у відповіднотого, кам'яновугільні масла та масла рослинного сті з даним винаходом подрібнюють з додаванням або тваринного походження, аліфатичні, циклічні диспергуючих агентів, зволожуючих агентів та вота ароматичні вуглеводні, наприклад, такі як толуди або органічного розчиннику з одержанням тонол, ксилол, парафін, тетрагідронафталін, алкільокодисперсної суспензії активної сполуки. Розвевані нафталіни або їх похідні, метанол, етанол, дення водою приводить до одержання стійкої пропанол, бутанол, циклогексанол, циклогексанон, суспензії активної сполуки; ізофорон, сильно полярні розчинники, наприклад, F водо-диспергуємі гранули та водорозчинні диметилсульфоксид, N-метилпіролідон та вода. гранули (WG, SG) Порошки, матеріали для розсіювання та про50 частин за масою сполуки у відповідності з дукти для розпилювання можуть бути одержані даним винаходом ретельно подрібнюють з додашляхом змішування або одночасного подрібнюванням диспергуючих агентів та зволожуючих агевання активних речовин з твердим носієм. нтів та перетворюють у водо-диспергуємі або водорозчинні гранули за допомогою технічних 31 83314 32 засобів (наприклад, таких як екструзія, скрубер з носно широких межах. В основному, вони становрозпилюючим зрошенням, псевдозріджений шар). лять від 0,0001 до 10%, переважно від 0,01 до 1%. Розведення водою приводить до одержання стійАктивні сполуки також можуть бути успішно кої дисперсії або розчину активної сполуки; використані у наднизько-об'ємному процесі (ULV), G водо-диспергуємі порошки та водорозчинні за допомогою якого можливо використовувати порошки (WP, SP) композиції, що включають понад 95% за масою 75 частин за масою сполуки у відповідності з активної сполуки, або навіть використовувати акданим винаходом подрібнюють у ротортивну сполуку без допоміжних речовин. статорному млині з додаванням диспергуючих Різні типи масел, зволожуючих агентів, допоагентів, зволожуючих агентів та силікагелю. Розміжних речовин, гербіцидів, фунгіцидів, інших песведення водою приводить до одержання стійкої тицидів, або бактерицидних агентів можуть бути дисперсії або розчину активної сполуки; додані до активних сполук, якщо прийнятно, не а також продукти, які необхідно застосовувати перед безпосереднім застосуванням (перемішунерозведеними, наприклад, такі як: вання у резервуарі). Ці агенти можуть бути змішані Η порошки, що розпилюються (DP) з агентами відповідно до винаходу у масовому 5 частин за масою сполуки у відповідності з співвідношенні від 1:10 до 10:1. даним винаходом тонкодисперсно подрібнюють та Композиції відповідно до винаходу, у формі гомогенно змішують з 95 % тонко подрібненого застосування як фунгіциди, також можуть бути каоліну. Це приводить до одержання продуктів, що присутніми разом з іншими активними сполуками, розпилюються; наприклад, з гербіцидами, інсектицидами, регуляІ гранули (GR, FG, GG, MG) торами росту, фунгіцидами або ще з добривами. 0,5 частини за масою сполуки у відповідності з Змішування сполук І або композицій, що містять їх, даним винаходом тонкодисперсно подрібнюють та у форму застосування як фунгіциди з іншими фунзмішують з 95,5% носіїв. Найбільш розповсюджегіцидами приводить у багатьох випадках до розними способами є екструзія, сушіння розпиленням ширення фунгіцидного спектру активності, яку або псевдозріджений шар. Це приводить до одеродержують. жання гранул, які призначені для застосування Наступний перелік фунгіцидів, у поєднанні з нерозведеними; якими можуть бути використані сполуки у відповідJ ULV розчини (UL) ності з винаходом, наведений для ілюстрації мож10 частин за масою сполуки у відповідності з ливих комбінації, але не обмежує їх: даним винаходом розчиняють у органічному роз- ацилаланіни, такі як беналаксил, металаксил, чиннику, наприклад, такому як ксилол. Це привоофурац, оксадиксил, дить до одержання продукту, який призначений - похідні аміну, такі як альдіморф, додин, додля застосування нерозведеним. деморф, фенпропіморф, фенпропідин, гуазатин, Активні сполуки можуть бути використані самі іміноктадин, спіроксамін, тридеморф, по собі, у формі їх композицій або форм застосу- анілінопіримідини, такі як піриметаніл, мепавання, одержаних з них, наприклад, у формі безніпірим або ципродиніл, посередньо розпилюємих розчинів, порошків, су- антибіотики, такі як циклогексімід, грізеофуспензій або дисперсій, емульсій, масляних львін, касугаміцин, натаміцин, поліоксин або стредисперсій, паст, продуктів, що розпилюються, маптоміцин, теріалів для розсіювання, або гранул, за допомо- азоли, такі як бітертанол, бромоконазол, цигою розбризкування, розпилення, опудрювання, проконазол, діфеноконазол, динітроконазол, епокрозсіювання або розливання. Форми застосування сіконазол, фенбуконазол. флуквінконазол, флузіповністю залежать від намічених цілей; даний вилазол, гексаконазол, імазаліл, метконазол, нахід повинен забезпечити у кожному випадку міклобутаніл, пенконазол, пропіконазол, прохлонайкраще можливе розподілення активних сполук раз, протіоконазол, тебуконазол, триадімефон, відповідно до винаходу. триадіменол, трифлумізол, тритіконазол, Водні форми застосування можуть бути одер- дикарбоксіміди, такі як іпродіон, міклозолін, жані з концентратів емульсії, паст або порошків, процимідон, вінклозолін, що змочуються, (порошки, що розбризкуються, - дитіокарбамати, такі як фербам, набам, мамасляні дисперсії) шляхом додавання води. Для неб, манкозеб, метам, метирам, пропінеб, полікаодержання емульсій, паст або масляних дисперрбамат, тирам, зирам, зинеб, сій, речовини, самі по собі або розчинені у маслі - гетероциклічні сполуки, такі як анілазин, беабо розчиннику, можуть бути гомогенізовано у воді номіл, боскалід, карбендазим, карбоксин, оксикарза допомогою зволожуючого агенту, речовини для боксин, ціазофамід, дазомет, дитіанон, фамоксапідвищення клейкості, диспергуючого агенту або дон, фенамідон, фенаримол, фуберідазол, емульгуючого агенту. Альтернативно, можливо флутоланіл, фураметпір, ізопротіолан, мепроніл, одержати концентрати, що складаються з активної нуарімол, пробеназол, проквіназид, пірифенокс, речовини, зволожуючого агенту, речовини для піроквілон, квіноксифен, силтіофам, тіабендазол, підвищення клейкості, диспергуючого агенту або тифлузамід, тіофанат-метил, тіадиніл, трициклаемульгуючого агенту та, якщо прийнятно, розчинзол, трифорин, нику або масла, та такі концентрати придатні для - мідні фунгіциди, такі як бордоська рідина, розведення водою. ацетат міді, оксихлорид міді, основний сульфат Концентрати активної сполуки у готових до заміді, стосування препаратах можуть змінюватися у від- похідні нітрофенілу, такі як бінапакрил, динокап, динобутон, нітрофтал-ізопропіл, 33 83314 34 - фенілпіроли, такі як фенпіклоніл або флудіово, та цю суміш перемішують при 5°С впродовж 2 ксоніл, годин та при 23°С впродовж 18 годин. Розчинник - сірка, видаляють та залишок далі хроматографують на - інші фунгіциди, такі як ацибензолар-S -метил, силікагелі, використовуючи суміш циклогекбентіавалікарб, карпропамід, хлороталоніл, цифсан/MtBE (1:1), яка приводить до одержання 25г луфенамід, цимоксаніл, дикломезин, диклоцимет, продукту. діетофенкарб, едифенфос, етабоксам, фенгексатемп, плав.: 163-165°С. 1 мід, фентін ацетат, феноксаніл, ферімзон, флуаH-ЯМР (d,CDCI 3): 2,0 (s); 7,1-7,6 (m); 8,3 (m). зинам, фозетил, фозетил-алюміній, іпровалікарб, 1.3 5-метил-6-фенілпіридин-2-карбонітрил гексахлорбензол, метрафенон, пенцикурон, про14,9г (150ммоль) триметилсиліл-ціаніду додапамокарб, фталід, толклофос-метил, квінтозен, ють до розчину 25г (118,2ммоль) сполуки, одержазоксамід, ної у прикладі 1.2, у 150мл дихлорметану, та цю - стробілурини, такі як азоксистробін, димоксисуміш перемішують при кімнатній температурі стробін, флуоксастробін, крезоксим-метил, метовпродовж 30 хвилин. Розчин 16,2г (150ммоль) диміностробін, орисастробін, пікоксистробін, піраклометилкарбамоїл хлориду далі додають протягом стробін або трифлоксистробін, 45 хвилин, та цю суміш перемішують при 23°С - похідні сульфенової кислоти, такі як каптавпродовж 18 годин. 70мл води та 40мл 1N водного фол, каптан, дихлофлуанід, фолпет, толілфлуанід, розчину гідроксиду натрію обережно додають до - цинаміди та аналогічні сполуки, такі як димереакційного розчину. Далі рН доводять до 8, викотоморф, флуметовер або флуморф. ристовуючи твердий карбонат натрію. Органічну Приклади синтезу фазу відділяють, промивають за допомогою води Процедури, описані у прикладах синтезу, пота сушать. Видалення розчиннику приводить до казаних нижче, використовують для одержання одержання, після хроматографії на силікагелі, видодаткових сполук шляхом відповідної модифікації користовуючи суміш циклогексан /MtBE (3:2), 19,9г вихідних сполук. Таким чином, одержані сполуки заглавної сполуки у вигляді масла. 1 перераховані у таблицях, показаних нижче, разом H-ЯМР (d,CDCI 3): 2,45 (s); 7,4-7,8 (m) з фізичними даними. 1.4 5-метил-6-фенілпіридин-2-карбоксамідин У прикладах використані наступні абревіатури: гідрохлорид темп, плав.: температура плавлення; 2,34г 30% розчину метоксиду натрію у метаMtBE: метил-трет-бутиловий ефір; нолі додають до розчину 5,0г (26ммоль) 5-метилEtOH: етанол. 6-фенілпіридин-2-карбонітрилу з прикладу 1.3 у Наступні абревіатури використані у зв'язку з 65мл метанолу, та цю суміш перемішують при даними 1H-ЯМР: 23°С протягом 7 годин. Далі додають 1,5г амоній s: синглет; d: дуплет; t: триплет; т: мультиплет хлориду, та цю суміш перемішують при 23°С проПриклад 1: 2-(5-метил-6-фенілпіридин-2-іл)тягом ще 8 годин. Після видалення розчиннику, 6,7,8,9-тетрагідро-5Н-циклогепта-піримідин додають MtBE та продукт відфільтровують, що приводить до одержання 5,4г заглавної сполуки у вигляді жовтуватої твердої речовини. 1 H-ЯМР (d, DMSO): 7,5 (m); 7,7 (m); 8,2 (m); 8,3 (m); 9,6 (m). 1.5 2-(5-метил-6-фенілпіридин-2-іл)-6,7,8,9тетрагідро-5Н-циклогепта-піримідин 1,3г метоксиду натрію (30% розчин у метанолі) додають до розчину 1,5г (6,1ммоль) сполуки, одержаної у прикладі 1.4, у 30мл метанолу. Через 30 1.1 3-метил-2-фенілпіридин хвилин, додають 1,2г (7,3ммоль) 2-диметиламіно2,1г (17,2ммоль) феніл борної кислоти та 4,3г метиленциклогептанону [що одержують відповідно карбонату калію у 20мл води поступово додають до Tetrahedron Letters (1986), 2567], та цю суміш до розчину 2,0г (11,6ммоль) 2-бром-3нагрівають при зрошенні впродовж 2 годин. Реакметилпіридину у 80мл тетрагідрофурану. Після ційний розчин далі розподіляють між водою та додавання 300мг тетраMtBE. Органічну фазу відділяють. Розчинник викїс(трифенілфосфін)паладію(0), суміш перемішудаляють в умовах зниженого тиску та залишок ють при зрошенні впродовж 8 годин. Реакційний хроматографують на силікагелі, використовуючи розчин виливають у суміш вода-лід та екстрагують суміш циклогексан /MtBE (1:1). Це приводить до за допомогою MtBE. Об'єднані органічні фази суодержання 0,72г заглавної сполуки. шать, розчинник видаляють в умовах зниженого темп, плав.: 151-154°С тиску та залишок хроматографують на силікагелі, Приклад 2: 4-[3-метил-6-(5,6,7,8використовуючи суміш циклогексан/MtBE (9:1). Це тетрагідрохіназолін-2-іл)піридин-2-іл]бензальдегід приводить до одержання 0,8г продукту. 1 H-ЯМР (d, CDCI 3): 2,5 (s); 7,2 (m); 7,35-7,6 (m) та 8,5 (m) 1.2 3-метил-2-фенілпіридин N-оксид 25г (147,7ммоль) 3-метил-2-фенілпіридину спочатку завантажують у 150мл дихлорметану При 5°С, 51,6г (294ммоль) 3хлорпероксибензойної кислоти додають поступо 35 2.1 6-бром-5-метилпіридин-2-карбоксамщин гідрохлорид 2,2г 30 % розчину метоксиду натрію у метанолі додають до 4,90г (25ммоль) 6-бром-5метилпіридин-2-карбонітрилу [що одержують відповідно до US 2003/0087940 ΑΙ або Bioorg. Med. Chem. Lett. (2003), 1571-1574] у 60мл метанолу, та цю суміш перемішують при 23°С впродовж 7 годин. Потім додають 1,5г амоній хлориду, та цю суміш перемішують при 23°С протягом ще 8 годин. Після видалення розчиннику, до залишку додають MtBE та тверду речовину відфільтровують. Це приводить до одержання 4,2г заглавної сполуки у вигляді білої твердої речовини, яку вводять у наступну реакцію без додаткового очищення. 2.2 2-(6-бром-5-метилпіридин-2-іл)-5,6,7,8тетрагідрохіназолін 3,6г метоксиду натрію (30% розчин у метанолі) додають до розчину 4,2г (7ммоль) сполуки, одержаної у прикладі 2.1, у 100мл метанолу. Через 30 хвилин, додають 3,1г (20ммоль) 2-диметиламінометиленциклогексанону [одержаного, наприклад, відповідно до Tetrahedron 50(7) (1994), 2255-64; Synthetic Communications 28(10) (1998), 1743-1753 або Tetrahedron Letters 27(23) (1986), 2567-70], та цю суміш нагрівають при зрошенні впродовж 2 годин. Реакційний розчин потім розподіляють між водою та MtBE. Органічну фазу відділяють, розчинник видаляють в умовах зниженого тиску та залишок хроматографують на силікагелі, використовуючи суміш циклогексан/MtBE (1:1). Це приводить до одержання 2,2г заглавної сполуки. 1 H-ЯМР (d,CDCI 3): 1,8-2,0 (m); 2,5 (s); 2,8 (m); 3,0 (m) 2.3 4-[3-метил-6-(5,6,7,8-тетрагідрохіназолін-2іл)піридин-2-іл]бензальдегід 0,24г 4-формілфенілборної кислоти та 0,2г карбонату натрію у 3мл води поступово додають до розчину 0,2г сполуки, одержаної у прикладі 2.2, у 20мл етиленглікольдиметилового ефіру. Після додавання приблизно 50мг тетракіс(трифенілфосфін)паладію(0), цю суміш перемішують при зрошенні впродовж 9 годин. Потім додають додаткові 0,2г 4-формілфеніл борної кислоти, та цю суміш залишають взаємодіяти при зрошенні впродовж ще 10 годин. Реакційний розчин далі розподіляють між водою та MtBE. Органічну фазу відділяють, розчинник видаляють в умовах зниженого тиску та залишок хроматографують на силікагелі, використовуючи суміш циклогексан/MtBE (1:1). Це приводить до одержання 35мг заглавної сполуки з темп. плав. 151-154°С. 1 H-ЯМР (d,CDCI 3): 1,8-2,0 (m, 4 Η); 2,4 (s, 3H); 2,8 (m, 2H); 3,0 (m, 2H); 7,8 (m, 3H); 8,0 (m, 2Н); 8,4 (m, 1Н); 8,6 (s, 1H); 10,1 (s, 1H). Приклад 3: 2-(5-метокси-6-фенілшридин-2-іл)5,6,7,8-тетрагідрохіназолін 83314 36 3.1 5-метокси-6-фенілпіридин-2-карбонітрил 2,1г 3-метокси-2-фенілпіридину [що одержують відповідно до Bulletin de la Societe Chimique de France (1974), 1112-16] спочатку завантажують у 60мл дихлорметану. При 5°С, повільно додають 2,4г 3-хлорпероксибензойної кислоти, та цю суміш перемішують при 5°С впродовж 2 годин та при 23°С впродовж 18 годин. Розчинник видаляють та залишок далі хроматографують на силікагелі, використовуючи метил трет-бутиловий ефір (MtBE), що приводить до одержання 1,4г 3-метокси-2фенілпіридин N-оксиду у вигляді сирого продукту у формі масла. Сирий продукт розчиняють у 80мл дихлорметану, та додають краплями 0,9г триметилсиліл ціаніду впродовж 5 хвилин та цю суміш перемішують при 23°С протягом 30 хвилин. Впродовж періоду 45 хвилин, далі краплями додають розчин 0,95г диметилкарбамоїл хлориду у 10 мл дихлорметану, та цю суміш перемішують при 23°С впродовж 18 годин. 40мл води та 10мл 1N водного розчину гідроксиду натрію обережно додають до реакційного розчину. Далі рН доводять до 8, використовуючи твердий карбонат натрію, та органічну фазу відділяють, промивають за допомогою води та сушать. Видалення розчиннику приводить до одержання, після хроматографування на силікагелі, використовуючи суміш циклогексан/MtBE (3:2), 0,2г 5-метокси-6-фенілпіридин-2-карбонітрилу у вигляді масла. 1 H-ЯМР (d,CDCI 3): 3,9 (s); 7,5 (m); 7,7 (m) та 7,9 (m). 3.2 2-(5-метокси-6-фенілпіридин-2-іл)-5,6,7,8тетрагідрохіназолін Заглавна сполука може бути одержана аналогічно до стадій 1.4 та 1.5 прикладу 1, використовуючи замість 2диметиламінометиленциклогептанону відповідний гексанон. Приклад 4: 2-(5-хлор-6-фенілпіридин-2-іл)5,6,7,8-тетрагідрохіназолін 4.1 2-бром-2-хлорпіридин 60мл 33% розчину бромистого водню у оцтовій кислоті додають до 6,3г 2,3-дихлорпіридину у 50мл оцтової кислоти, та цю суміш нагрівають при зрошенні впродовж 8 годин. Потім додають ще 42мл розчину бромистого водню. Через 6 годин, реакція закінчилася. Реакційний розчин виливають 37 83314 38 лоти, та цю суміш перемішують при 5°С впродовж у суміш вода-лід та екстрагують за допомогою 2 годин та при 23°С впродовж 18 годин. Після виметиленхлориду. Об'єднані органічні фази промидалення розчиннику, залишок хроматографують вають за допомогою води та сушать, та розчинник на силікагелі, використовуючи MtBE, що приводить видаляють в умовах зниженого тиску. Це приводо одержання 0,8г 2-ціано-5-метилпіридин 1дить до одержання 8,7г продукту у формі масла. 1 оксиду. H-ЯМР (d,CDCI 3): 7,2 (m); 7,8 (m) та 8,3 (m). 0,8г 2-ціано-5-метилпіридин 1-оксид, разом з 4.2 3-хлор-2-фенілпіридин 25мл оксихлориду фосфору, нагрівають при зро2,35г фенілборної кислоти та 4,8г карбонату шенні протягом 5 годин. Після закінчення реакції, натрію у 30мл води додають поступово до розчину надлишок оксихлориду фосфору видаляють в 2,5г 2-бром-3-метоксипіридину у 80мл тетрагідроумовах зниженого тиску. Залишок переносять у фурану. Після додавання 300мг тетраметиленхлорид, додають, з охолодженням льокіс(трифенілфосфін)паладію (0), цю суміш передом, до води та доводять до рН 12, використовуюмішують при зрошенні впродовж 8 годин. Потім чи 3N водний розчин гідроксиду натрію. Органічну додають додаткові 2г фенілборної кислоти, 2г карфазу відділяють та сушать, та розчинник видалябонату натрію та 100мг тетрають в умовах зниженого тиску. Це приводить до кіс(трифенілфосфін)паладію (0), та цю суміш наодержання 0,8г продукту. грівають при зрошенні впродовж ще 6 годин. 1 H-ЯМР (d,CDCI 3): 2,4 (s); 7,6 (m) та 7,7 (m). Реакційний розчин виливають у суміш вода-лід та 5.2 2-(6-хлор-5-метилпіридин-2-іл)-5,6,7,8екстрагують за допомогою MtBE. Об'єднані органітетрагідрохіназолін чні фази сушать, розчинник видаляють в умовах Аналогічно до прикладу 1.4, 6-хлор-5зниженого тиску та залишок хроматографують на метилпіридин-2-карбонітрил перетворюють у 6силікагелі, використовуючи суміш циклогекбром-5-метилпіридин-2-карбоксамідин гідрохлосан/MtBE (9:1). Це приводить до одержання 2,2г рид. Аналогічно до прикладу 2.2, далі використопродукту у формі масла. 1 вують його для одержання 2-(6-хлор-5H-ЯМР (d,CDCI3): 7,3 (m); 7,5 (m); 7,8 (m) та метилпіридин-2-іл)-5,6,7,8-тетрагідрохіназоліну. 8,6 (m). 1 H-ЯМР (d,CDCI 3): 8,5 (s); 8,3 (m); 7,7 (m); 3,0 4.3 3-хлор-2-фенілпіридин 1-оксид (m); 2,8 (m); 2,4 (s); 1,8-2,0 (m). 2,2г 3-хлор-2-фенілпіридину спочатку заван5.3 2-(6-бром-5-метилшридин-2-іл)-5,6,7,8тажують у 80мл дихлорметану. При 5°С, до цієї тетрагідрохіназолін суміші повільно додають 3,0г 38мл 33% розчину гідро-броміду у оцтовій кисхлорпероксибензойної кислоти, та цю суміш перелоті додають до 1г 2-(6-хлор-5-метилпіридин-2-іл)мішують при 5°С впродовж 2 годин та при 23°С 5,6,7,8-тетрагідрохіназоліну у 8мл оцтової кислоти, впродовж 18 годин. Розчинник видаляють та зата цю суміш нагрівають при зрошенні впродовж 10 лишок далі хроматографують на силікагелі, викогодин. Реакційний розчин розбавляють водою, ристовуючи MtBE, що приводить до одержання доводять до рН 9, використовуючи З N водний 1,9г продукту у формі масла. 1 розчин гідроксиду натрію, та екстрагують за допоН-ЯМР (d,CDCI 3): 7,2 (m); 7,4-7,6 (m) та 8,3 могою MtBE. Об'єднані органічні фази промивають (m). за допомогою води та сушать, та розчинник вида4.4 5-хлор-6-фенілпіридин-2-карбонітрил ляють в умовах зниженого тиску. Це приводить до 0,74г диметил-сульфату додають до 1,2г 3одержання 0,9г продукту. хлор-2-фенілпіридин 1-оксиду у 5мл DMF, та цю темп. плав.: 125-128°С суміш залишають взаємодіяти при 60°С впродовж 5.4 4-[3-метил-6-(5,6,7,8-тетрагідрохіназолін-27 годин. Після охолодження до 23°С, цей розчин іл)піридин-2-іл]бензонітрил додають краплями до 0,38г ціаніду калію у 10мл Заглавну сполуку одержують аналогічно до DMF та перемішують при 23°С впродовж 18 годин. прикладу 2.3 шляхом введення у реакцію 2-(6Цю суміш далі розподіляють між MtBE та водою, бром-5-метилпіридин-2-іл)-5,6,7,8органічну фазу сушать, розчинник видаляють в тетрагідрохіназоліну з 4-ціано-феніл-борною кисумовах зниженого тиску та залишок хроматогралотою. фують на силікагелі, використовуючи суміш циклотемп, плав.: 178-182°С Приклади одержання гексан /MtBE (3:2). Це приводить до одержання вихідних матеріалів: 0,30г продукту. 1 Приклад одержання 1: 2-(4-фторфеніл)-3H-ЯМР (d,CDCI3): 7,5 (m); 7,6 (m); 7,7 (m) та метилпіридин 7,9 (m). 0,70г [1,44.5 2-(5-хлор-6-фенілпіридин-2-іл)-5,6,7,8біс(дифенілфосфіно)бутан]паладію(II) хлорид дотетрагідрохіназолін дають до розчину 20,0г 2-бром-З-метилпіридину у Заглавна сполука може бути одержана анало200мл тетрагідрофурану. Через 10 хвилин, додагічно до стадій 1.4 та 1.5 прикладу 1, використовують краплями 128мл 2 молярного розчину 4ючи замість 2фторфеніл-магній броміду у тетрагідрофурані, та диметиламінометиленциклогептанону відповідний цю суміш нагрівають при зрошенні впродовж 5 гексанон. годин. Після додавання ще 30мл розчину 4Приклад 5: 4-[3-метил-6-(5,6,7,8фторфенілмагній броміду, реакційний розчин, чететрагідрохіназолін-2-іл)піридин-2-іл]бензонітрил рез 1 годину, додають з охолодженням льодом до 5.1 6-хлор-5-метилпіридин-2-карбонітрил водного розчину амоній хлориду та екстрагують за 2,3г 5-метилпіридин-2-карбонітрилу спочатку допомогою етилацетату. Об'єднані органічні фази завантажують у 80мл дихлорметану. При 5°С, посушать, розчинник видаляють в умовах зниженого вільно додають 5,4г 3-хлорпероксибензойної кис 39 83314 40 мішують при 5°С впродовж 2 годин та при 23°С тиску та залишок хроматографують на силікагелі, впродовж 18 годин. Після видалення розчиннику, використовуючи суміш циклогексан/MtBE (9:1). Це залишок хроматографують на силікагелі, викорисприводить до одержання 17,8г 2-(4-фторфеніл)-3товуючи суміш MtBE/EtOH (5:2), що приводить до метилпіридину у вигляді масла. одержання 0,75г продукту. Приклад одержання 2: 2-(6-хлор-51 метилпіридин-2-іл)-5,6,7,8-тетрагідрохіназолін H-ЯМР (d,CDCI3): 8,6 (s); 8,2 (s); 7,5 (m); 7,1 а) 5-метилпіридин-2-карбоксамідин гідрохло(m); 3,0 (m); 2,8 (m); 2,4 (m); 1,7-1,9 (m). рид d) 2-(6-хлор-5-метилпіридин-2-іл)-5,6,7,8Цю сполуку одержують з 2-ціано-5тетрагідрохіназолін метилпіридину в умовах, наведених для прикладу 0,75г 2-(5-метилпіридин-2-іл)-5,6,7,81.4. тетрагідрохіназоліну, разом з 10мл оксихлориду 1 фосфору, нагрівають при зрошенні впродовж 10 H-ЯМР (d, DMSO): 2,4 (m); 7,9 (m); 8,3 (m); 8,6 годин. Після закінчення реакції, надлишок оксих(m). лориду фосфору видаляють в умовах зниженого b) 2-(5-метилпіридин-2-іл)-5,6,7,8тиску. Залишок переносять у метиленхлорид та, тетрагідрохіназолін при охолодженні льодом, додають до води. ОргаЦю сполуку одержують з 2-метилпіридин-2нічну фазу відділяють та сушать, та розчинник карбоксамідин гідрохлориду в умовах, наведених видаляють в умовах зниженого тиску. Залишок для прикладу 2.2. 1 хроматографують на силікагелі, використовуючи H-ЯМР (d,CDCI 3): 1,9 (m); 2,4 (s); 2,7 (m); 3,0 суміш циклогексан/MtBE (4:1). Це приводить до (m); 7,6 (m); 8,4 (m); 8,5 (m); 8,7 (m). одержання 80мг продукту. c) 2-(5-метил-1-оксипіридин-2-іл)-5,6,7,8Сполуки формули І, представлені у таблиці В, тетрагідрохіназолін показаній нижче, одержують шляхом процедур, 1,0г 2-(5-метилпіридин-2-іл)-5,6,7,8представлених вище. тетрагідрохіназоліну спочатку вносять у 10мл дихлорметану. При 5°С, поступово додають 1,4г 3хлорпероксибензойної кислоти, та цю суміш пере 41 83314 42 43 83314 44 45 83314 46 47 83314 48 49 83314 50 51 83314 52 53 83314 54 *Префікси показують відповідне положення заміснику(ів) Дослідження фунгіцидної активності: Для прикладів застосування 1-5 активні сполуки одержують окремо як вихідний розчин з 0,25% за масою активної сполуки у ацетоні або DMSO. 1% за масою емульгатору WettolÒ EM 31 (зволожуючий агент, що має емульгуючу та диспергуючу дію, на основі етоксильованих алкілфе нолів) додають до цього розчину, та розчин розбавляють водою до бажаної концентрації. Для прикладів застосування 6-9, активні сполуки одержують як вихідний розчин, що включає 25мг активної сполуки, який доводять до 10мл, використовуючи суміш ацетону та/або DMSO та емульгатору UniperolÒ EL (зволожуючий агент, що має емульгуючу та диспергуючу дію, на основі 55 83314 56 етоксильованих алкілфенолів) у об'ємному співднів, ступінь ураження грибами визначають візувідношенні розчинник/емульгатор 99:1. Далі цей ально за площею ураженого листя. розчин доводять до 100мл, використовуючи воду. У цьому дослідженні, рослини, які обробили Цей вихідний розчин розбавляють за допомогою за допомогою 250ррm активної сполуки з приклаописаної суміші розчинник/емульгатор/вода до ду 7, були тільки злегка уражені (20%), в той час концентрації активної сполуки, даній нижче. як необроблені рослини були уражені на 90%. Приклад застосування 1 - Активність проти Рослини, які, з метою порівняння, обробили у тих ранньої гнилі, викликаної Alternaria solani же самих умовах за допомогою 2-(5-метил-6-(4Листя рослин томатів сорту "Goldene фторфеніл)піридин-2-іл)-5,6,7,8Prinzessin" обприскують до точки стоку за допотетрагідрохіназоліну [сполуки відповідно до ЕР-А могою водної суспензії, що має концентрацію 259139] показали ураження на 80%. активних сполук, зазначену нижче. На наступний Приклад застосування 4 - Активність проти день, оброблені рослини заражують суспензією пероноспорозу (несправжня борошниста роса) спор Alternaria solani у 2% водному біосолодововиноградних лоз, викликаного Plasmopara viticola му розчині, що має густину 0,17x106спор/мл. ДоЛистя посаджених у горщики виноградних сліджувані рослини далі поміщають у насичену лоз обприскують до точки стоку за допомогою водяною парою камеру при температурах від 20 водної суспензії, що має концентрацію активних до 22°С. Через 5 днів, рання гниль на необробсполук, зазначену нижче. На наступний день, лених, але уражених рослинах розповсюдилася нижній бік листочків інокулюють водною спорангідо такого ступеню, що зараження могло бути виєвою суспензією Plasmopara viticola. Далі рослизначено візуально. ни спочатку поміщають у насичену водяною паУ цьому дослідженні, рослини, які обробили рою камеру на 48 годин та потім у теплицю при за допомогою 250ррm активних сполук з приклатемпературах від 20 до 30°С. Через цей проміжок дів 1, 6, 7, 9 та 11, не показали ніякого зараженчасу, для промотування спорангієвого ураження, ня, в той час як необроблені рослини були урарослини знову поміщають у насичену водяною жені на 90%. Рослини, які, для порівняння, парою камеру на 16 годин. Далі визначають стуобробили у тих же самих умовах за допомогою 2пінь розвинення ураження на нижньому боці лис(5-метил-6-(4-фторфеніл)піридин-2-іл)-5,6,7,8тя. тетрагідрохіназоліну [сполука відповідно до ЕР-А У цьому дослідженні, рослини, які обробили 259139], показали ураження на 80%. за допомогою 63ррm активної сполуки з прикладу Приклад застосування 2 - Активність проти 7, не показали ніякого зараження, в той час як сірої гнилі на листі болгарського перцю, викликанеоброблені рослини були уражені на 90%. Росної Botrytis cinerea, із захисним застосуванням лини, які, з метою порівняння, обробили у тих же Листя болгарського перцю сорту "Neusiedler самих умовах за допомогою 2-(5-метил-6-(4Ideal Elite", після появи 2-3 добре розвинених фторфеніл)піридин-2-іл)-5,6,7,8листків, обприскують до точки стоку за допомотетрагідрохіназоліну [сполуки відповідно до ЕР-А гою водної суспензії, що має концентрацію актив259139] показали ураження на 70%. них сполук, зазначену нижче. На наступний день, Приклад застосування 5 - Лікуюча активність оброблені рослини інокулюють за допомогою проти бурої іржі пшениці, викликаної Риссіпіа водної суспензії спор Botrytis cinerea у 2% водноrecondita му біосолодовому розчині, що має густину Листя посаджених у горщики саджанців пше1,7x106спор/мл. Потім рослини поміщають у каниці сорту "Kanzler" інокулюють суспензією спор меру зі штучним кліматом при температурах від бурої іржі {Рuссіnіа recondita). Потім горщики по22 до 24°С та при високій атмосферній вологості. міщають у камеру при високій атмосферній волоЧерез 5 днів, ступінь ураження грибами визначагості (90-95%) та 20-22°С на 24 години. Протягом ють візуально за площею ураженого листя. цього часу, спори проростають та проросткові У цьому дослідженні, рослини, які обробили трубочки проникають у тканину листя. На наступза допомогою 250ррm активних сполук з прикланий день, уражені рослини обприскують до точки дів 6, 7 та 11, не показали ніякого зараження, в стоку за допомогою водної суспензії, що має контой час як необроблені рослини були уражені на центрацію активних сполук, зазначену нижче. 90%. Суспензію або емульсію одержують як описано Приклад застосування 3 - Активність проти вище. Після того, як висохло покриття, нанесене мілдью (несправжня борошниста роса) пшениці, обприскуванням, досліджувані рослини культивикликаної Erysiphe [syn. Blumeria] graminis forma вують у теплиці при температурах від 20 до 22°С specialis. tritici та при 65-70% відносній атмосферній вологості Листя посаджених у горщики саджанців пшевпродовж 7 днів. Далі визначають ступінь розвиниці сорту "Kanzler" обприскують до точки стоку нення іржавих грибів на листі. за допомогою водної суспензії, що має концентУ цьому дослідженні, рослини, які обробили рацію активних сполук, зазначену нижче. Через за допомогою 250ррm активної сполуки з прикла24 години після того, як висохло покриття, нанеду 9, показали тільки невелике ураження (20% сене обприскуванням, листя опудрюють спорами ураження), в той час як необроблені рослини мілдью пшениці {Erysiphe [syn. Blumeria] graminis були уражені на 90%. Рослини, які, з метою поріforma specialis. tritici). Потім рослини поміщають у вняння, обробили у тих же самих умовах за дотеплицю при температурах від 20 до 24°С та при помогою 2-(5-метил-6-(4-фторфеніл)піридин-260-90% відносній атмосферній вологості. Через 7 іл)-5,6,7,8-тетрагідрохіназоліну [сполуки відповідно до ЕР-А 259139] показали ураження на 50%. 57 83314 58 Приклад застосування 6 - Активність проти Приклад застосування 8 - Активність проти ранньої гнилі, викликаної Altemaria solani сірої гнилі на листі болгарського перцю, викликаЛистя посаджених у горщики рослин томатів ної Botrytis cinerea, захисне застосування сорту "Goldene Konigin" обприскують до точки Листя болгарського перцю сорту "Neusiedler стоку за допомогою водної суспензії, що має конIdeal Elite", після появи 2-3 добре розвинених центрацію активних сполук, зазначену нижче. На листків, обприскують до точки стоку за допомонаступний день, листя інфікують водною суспенгою водної суспензії, що має концентрацію активзією спор Altemaria solani у 2% біосолодовому них сполук, зазначену нижче. На наступний день, розчині, що має густину 1,7x106спор/мл. Потім оброблені рослини інокулюють за допомогою рослини поміщають у насичену водяною парою водної суспензії спор Botrytis cinerea, що включає камеру на при температурах від 22 до 24°С. Че1,7x106спор/мл у 2% водному біосолодовомурез 5 днів, хвороба на необроблених рослинах розчині. Потім досліджувані рослини поміщають у розвилася до такого ступеню, що ураження могло темну камеру зі штучним кліматом при темперабути визначено візуально. турах від 22 до 24°С та при високій атмосферній У цьому дослідженні, рослини, які обробили вологості. Через 5 днів, ступінь ураження грибаза допомогою 63ррm активних сполук з прикладів ми визначають візуально у % за площею ураже9, 13, 16, 17, 18, 72, 73, 74, 75, 76, 78, 79, 82, 84, ного листя. 85, 86, 87, 88, 89, 90, 91, 92, 93 та 95, показали У цьому дослідженні, рослини, які обробили ураження не менше ніж на 20%, в той час як неза допомогою 63 ррт активних сполук з прикладів оброблені рослини були уражені на 90%. 4, 26, 80, 83 та 94, показали ураження не менше Приклад застосування 7 - Активність проти ніж на 20%, в той час як необроблені рослини сітчастої плямистості ячменю, викликаної були уражені на 90%. Pyrenophora teres, з 1 денним захисним застосуПриклад застосування 9 - Активність проти ванням фітофторозу на томатах, викликаного Листя посаджених у горщики саджанців ячPhytophthora infestans, із захисною обробкою меню обприскують до точки стоку за допомогою Листя посаджених у горщики рослин томатів водної суспензії, що має концентрацію активних обприскують до точки стоку за допомогою водної сполук, зазначену нижче. Через 24 години після суспензії, що має концентрацію активної сполуки, того, як висохло покриття, нанесене обприскузазначену нижче. На наступний день, листя інфіванням, рослини інокулюють водною суспензією кують водною спорангієвою суспензією спор Pyrenophora [syn. Drechslera] teres, збудниPhytophthora infestans. Потім рослини поміщають ком сітчастої плямистості. Далі досліджувані росу насичену водяною парою камеру при темпералини поміщають у теплицю при температурах від турах від 18 до 20°С. Через 6 днів, фітофтороз на 20 до 24°С та 95-100% відносній атмосферній необроблених, але інфікованих, контрольних ровологості. Через 6 днів, ступінь розвинення хвослинах розвився до такого ступеню, що ураження роби визначають візуально у % за площею урамогло бути визначено візуально у %. женого листя. У цьому дослідженні, рослини, які обробили У цьому дослідженні, рослини, які обробили за допомогою 63ррm активних сполук з прикладів за допомогою 63 ррт активних сполук з прикладів 98, 117, 118, 119,120, 122,124, 125, 126, 127, 128, 4, 9, 13, 16, 17, 18, 21, 23, 26, 27, 72, 73, 74, 75, 129,130, 133, 134,135,136,138, 139, 141, 142, 143, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 144, 145, 146, 147, 150, 151, 152, 156, 157 та 159, 90, 91, 92, 93, 94, 95, 96, 98, 102, 105, 119, 120, показали ураження не менше ніж на 20 %, в той 121, 122, 124,126, 127, 128,136, 137, 138, 139, час як необроблені рослини були уражені на 143, 146, 151, 157 та 159, показали ураження не 90%. менше ніж 20%, в той час як необроблені рослини були уражені на 90 %. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською2-(pyridin-2-yl)-pyrimidines and their use for controlling pathogenic fungi
Автори англійськоюGrammenos, Wassilios, Grammenos Wassilios, Grammenos Vasssilios, Grote Thomas, Blettner Carsten, Gewehr Markus, Huenger Udo, Mueller Bernd, Rheinheimer Joachim, Schaefer Peter, Schieweck Frank, Schwoegler Anja, Schoefl Ulrich, Kohlei Harald, Strathmann Siegfried, Scherer Maria, Stierl Reinhard, Rether Jan
Назва патенту російською2-(пиридин-2-ил)пиримидиновые соединения и их применение для борьбы с вредными грибами
Автори російськоюГрамменос Вассилиос, Гроте Томас, Блеттнер Карстен, Гевер Маркус, Хюнгер Удо, Мюллер Бернд, Райнхаймер Йоахим, Шефер Петер, Шивек Франк, Швеглер Аня, Шьофль Ульрих, Штратманн Зигфрид, Шерер Мариа, Штирль Райнхард, Ретер Ян
МПК / Мітки
МПК: A01N 43/54, A01P 3/00, C07D 401/04
Мітки: боротьби, сполуки, застосування, грибами, 2-(піридин-2-іл)піримідинові, шкідливими
Код посилання
<a href="https://ua.patents.su/29-83314-2-piridin-2-ilpirimidinovi-spoluki-ta-kh-zastosuvannya-dlya-borotbi-zi-shkidlivimi-gribami.html" target="_blank" rel="follow" title="База патентів України">2-(піридин-2-іл)піримідинові сполуки та їх застосування для боротьби зі шкідливими грибами</a>
Попередній патент: Полімерний склад для захисту від корозії металевих поверхонь
Наступний патент: Спосіб виготовлення виробу з наскрізним отвором
Випадковий патент: Помповий замковий пристрій феодосьєвих підвищеної секретності з відповідним ключем












