Застосування бензоконденсованих гетероциклічних сульфамідних похідних для зняття болю
Формула / Реферат
1. Спосіб зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки формули (І):
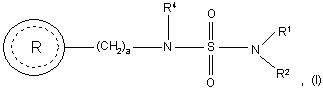
де
кожен R1 і R2 незалежно вибраний з групи, яка складається з водню і нижчого алкілу;
R4 вибраний із групи, яка складається з водню і нижчого алкілу;
а є цілим числом від 1 до 2;
 вибраний із групи, яка складається з:
вибраний із групи, яка складається з:
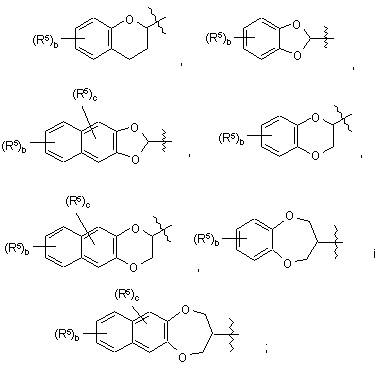
де b є цілим числом від 0 до 4; і де
с є цілим числом від 0 до 2;
кожен R5 незалежно вибраний із групи, яка складається з галогену, нижчого алкілу і нітро;
за умови, що, коли  являє собою
являє собою 
або 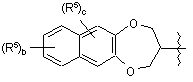 ; то тоді а дорівнює 1;
; то тоді а дорівнює 1;
або її фармацевтично прийнятної солі.
2. Спосіб за п. 1, де
кожен R1 і R2 незалежно вибраний з групи, яка складається з водню і нижчого алкілу;
R4 вибраний із групи, яка складається з водню і нижчого алкілу;
а є цілим числом від 1 до 2;
 вибраний із групи, яка складається з
вибраний із групи, яка складається з

де b є цілим числом від 0 до 2; і де
с є цілим числом від 0 до 2;
кожен R5 незалежно вибраний із групи, яка складається з галогену, нижчого алкілу і нітро;
за умови, що, коли  являє собою
являє собою 
або 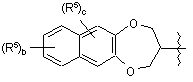 ; то тоді а дорівнює 1;
; то тоді а дорівнює 1;
або вибраний з їх фармацевтично прийнятної солі.
3. Спосіб за п. 2, де
кожен R1 і R2 незалежно вибраний із групи, яка складається з водню і нижчого алкілу;
R вибраний із групи, яка складається з водню і нижчого алкілу;
а є цілим числом від 1 до 2;
 вибраний із групи, яка складається з
вибраний із групи, яка складається з
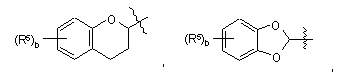
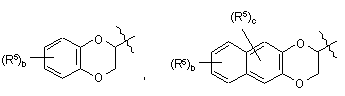 і
і
 ;
;
де b є цілим числом від 0 до 2; і де
с дорівнює 0;
кожен R5 незалежно вибраний із групи, яка складається з галогену, нижчого алкілу і нітро;
за умови, що, коли є
є  , то тоді а дорівнює 1;
, то тоді а дорівнює 1;
або вибраний з їх фармацевтично прийнятної солі.
4. Спосіб за п. 3, де
кожен R1 і R2 незалежно вибраний із групи, яка складається з водню і нижчого алкілу;
R4 вибраний із групи, яка складається з водню і метилу; а є цілим числом від 1 до 2;
 вибраний із групи, яка складається з 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(бензо[1,3]-діоксолілу), 2-(3,4-дигідро-2Н-бензо[1,4]-діоксепінілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(6-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-фторо-2,3-дигідробензо[1,4]-діоксинілу), 2-(хроманілу), 2-(5-фторо-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-хлорбензо[1,3]-діоксолілу), 2-(7-нітро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-метил-2,3-дигідробензо[1,4]-діоксинілу), 2-(5-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-бромо-2,3-дигідробензо[1,4]-діоксинілу), 2-(6,7-дихлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(8-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(2,3-дигідронафто[2,3-b][1,4]-діоксинілу) і 2-(4-метилбензо[1,3]-діоксолілу);
вибраний із групи, яка складається з 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(бензо[1,3]-діоксолілу), 2-(3,4-дигідро-2Н-бензо[1,4]-діоксепінілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(6-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-фторо-2,3-дигідробензо[1,4]-діоксинілу), 2-(хроманілу), 2-(5-фторо-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-хлорбензо[1,3]-діоксолілу), 2-(7-нітро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-метил-2,3-дигідробензо[1,4]-діоксинілу), 2-(5-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-бромо-2,3-дигідробензо[1,4]-діоксинілу), 2-(6,7-дихлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(8-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(2,3-дигідронафто[2,3-b][1,4]-діоксинілу) і 2-(4-метилбензо[1,3]-діоксолілу);
за умови, що, коли  є 2-(3,4-дигідро-2Н-бензо[1,4]-діоксепініл)ом, то тоді
є 2-(3,4-дигідро-2Н-бензо[1,4]-діоксепініл)ом, то тоді
а дорівнює 1;
або вибраний з їх фармацевтично прийнятної солі.
5. Спосіб за п. 4, де
кожен R1 і R2 незалежно вибраний із групи, яка складається з водню і метилу;
R4 вибраний із групи, яка складається з водню і метилу;
а є цілим числом від 1 до 2;
 вибраний із групи, яка складається з 2-(бензо[1,3]-діоксолілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(6-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-метил-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-бромо-2,3-дигідробензо[1,4]-діоксинілу) і 2-(6,7-дихлоро-2,3-дигідробензо[1,4]-діоксинілу);
вибраний із групи, яка складається з 2-(бензо[1,3]-діоксолілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(6-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-метил-2,3-дигідробензо[1,4]-діоксинілу), 2-(6-бромо-2,3-дигідробензо[1,4]-діоксинілу) і 2-(6,7-дихлоро-2,3-дигідробензо[1,4]-діоксинілу);
або вибраний з їх фармацевтично прийнятної солі.
6. Спосіб за п. 1, де сполука формули (І) вибрана з групи, яка складається з (2S)-(-)-R-(6-хлоро-2,3-дигідробеизо[1,4]-діоксин-2-ілметил)-сульфаміду;
або вибраний з їх фармацевтично прийнятної солі.
7. Спосіб зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки, вибраної з групи, яка складається з (2S)-(-)-N-(6-хлоро-2,3-дигідробензо[1,4]-діоксин-2-ілметил)-сульфаміду; і
її фармацевтично прийнятної солі.
8. Спосіб за п. 1, де біль являє собою гострий біль або хронічний біль.
9. Спосіб за п. 1, де біль являє собою запальний біль.
10. Спосіб за п. 1, де біль являє собою невропатичний біль.
11. Спосіб за п. 10, де невропатичний біль являє собою діабетичну невропатію.
12. Спосіб за п. 7, де біль являє собою гострий біль або хронічний біль.
13. Спосіб за п. 7, де біль являє собою запальний біль.
14. Спосіб за п. 7, де біль являє собою невропатичний біль.
15. Спосіб за п. 14, де невропатичний біль являє собою діабетичну невропатію.
16. Спосіб зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки формули (II):
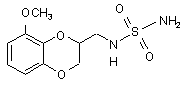 (ІІ)
(ІІ)
або її фармацевтично прийнятної солі.
17. Спосіб за п. 16, де біль являє собою гострий біль або хронічний біль.
18. Спосіб за п. 16, де біль являє собою запальний біль.
19. Спосіб за п. 16, де біль являє собою невропатичний біль.
Текст
1. Спосіб зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки формули (І): 3 94079 4 а є цілим числом від 1 до 2; (R5)c O (R5)b або R ; то тоді а ; O дорівнює 1; або її фармацевтично прийнятної солі. 2. Спосіб за п. 1, де кожен R1 і R2 незалежно вибраний з групи, яка складається з водню і нижчого алкілу; R4 вибраний із групи, яка складається з водню і нижчого алкілу; а є цілим числом від 1 до 2; R вибраний із групи, яка складається з O O (R5)b (R )b O O O (R5) (R5)b , O b O O O O i i O ; , де b є цілим числом від 0 до 2; і де с дорівнює 0; кожен R5 незалежно вибраний із групи, яка складається з галогену, нижчого алкілу і нітро; , (R5)b , b , O , O O O O (R55)b (R )b (R5)c (R5) , (R5)c O O O , за (R5)c умови, що, коли R є O O O , O (R5) O (R5)b (R5)b i c O (R5) b ; O де b є цілим числом від 0 до 2; і де с є цілим числом від 0 до 2; кожен R5 незалежно вибраний із групи, яка складається з галогену, нижчого алкілу і нітро; (R5)b , то тоді а дорівнює 1; O або вибраний з їх фармацевтично прийнятної солі. 4. Спосіб за п. 3, де кожен R1 і R2 незалежно вибраний із групи, яка складається з водню і нижчого алкілу; R4 вибраний із групи, яка складається з водню і метилу; а є цілим числом від 1 до 2; R R за умови, що, коли (R5)b O (R5)c O або (R5)b O вибраний із групи, яка складається з являє собою O ; то тоді а ; дорівнює 1; або вибраний з їх фармацевтично прийнятної солі. 3. Спосіб за п. 2, де кожен R1 і R2 незалежно вибраний із групи, яка складається з водню і нижчого алкілу; R вибраний із групи, яка складається з водню і нижчого алкілу; , (R5)c (R5)5 b (R5)b , O O , O (R5)b O (R,5)b (R5)b і вибраний із групи, яка складається з O (R5)b O 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(бензо[1,3]діоксолілу), 2-(3,4-дигідро-2Н-бензо[1,4]діоксепінілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(6-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(6фторо-2,3-дигідробензо[1,4]-діоксинілу), 2(хроманілу), 2-(5-фторо-2,3-дигідробензо[1,4]діоксинілу), 2-(7-хлоро-2,3-дигідробензо[1,4]діоксинілу), 2-(6-хлорбензо[1,3]-діоксолілу), 2-(7нітро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-метил2,3-дигідробензо[1,4]-діоксинілу), 2-(5-хлоро-2,3дигідробензо[1,4]-діоксинілу), 2-(6-бромо-2,3дигідробензо[1,4]-діоксинілу), 2-(6,7-дихлоро-2,3дигідробензо[1,4]-діоксинілу), 2-(8-хлоро-2,3дигідробензо[1,4]-діоксинілу), 2-(2,3дигідронафто[2,3-b][1,4]-діоксинілу) і 2-(4метилбензо[1,3]-діоксолілу); 5 за умови, що, коли 94079 R є 2-(3,4-дигідро 2Н-бензо[1,4]-діоксепініл)ом, то тоді а дорівнює 1; або вибраний з їх фармацевтично прийнятної солі. 5. Спосіб за п. 4, де кожен R1 і R2 незалежно вибраний із групи, яка складається з водню і метилу; R4 вибраний із групи, яка складається з водню і метилу; а є цілим числом від 1 до 2; R вибраний із групи, яка складається з 2-(бензо[1,3]-діоксолілу), 2-(2,3-дигідробензо[1,4]діоксинілу), 2-(2,3-дигідробензо[1,4]-діоксинілу), 2(6-хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7хлоро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7метил-2,3-дигідробензо[1,4]-діоксинілу), 2-(6бромо-2,3-дигідробензо[1,4]-діоксинілу) і 2-(6,7дихлоро-2,3-дигідробензо[1,4]-діоксинілу); або вибраний з їх фармацевтично прийнятної солі. 6. Спосіб за п. 1, де сполука формули (І) вибрана з групи, яка складається з (2S)-(-)-R-(6-хлоро-2,3дигідробензо[1,4]-діоксин-2-ілметил)-сульфаміду; або вибраний з їх фармацевтично прийнятної солі. 7. Спосіб зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки, вибраної з групи, яка складається з (2S)-(-)-N-(6-хлоро-2,3-дигідробензо[1,4]діоксин-2-ілметил)-сульфаміду; і Дана заявка вимагає пріоритет попередньої заявки США 60/751686, поданої 19 грудня 2005, і попередньої заявки США 60/773812, поданої 15 лютого 2006, які включені в даний документ як посилання в повному об'ємі. Даний винахід спрямований на застосування бензоконденсованих гетероциклічних сульфамідних похідних для зняття гострих, хронічних, запальних і/або невропатичних болів. Біль звичайно визначається як неприємний сенсорний і емоційний досвід, пов'язаний з фактичним або потенційним ушкодженням тканини (Wileman L, Advances in pain management, Scrip Report, 2000). Гострий біль являє собою фізіологічну відповідь на несприятливий хімічний, тепловий або механічний стимул, який може бути пов'язаний з хірургією, травмою або гострою хворобою. Зазначені стани включають, без обмеження, постоперативний біль, спортивні травми, синдром зап'ястного каналу, опіки, скелетно-м'язові розтягнення і напруження, м'язово-сухожильне напруження, шийно-плечові болючі синдроми, диспепсію, виразку шлунка, виразку дванадцятипалої кишки, нирковокам'янну кольку, біль у жовчному міхурі, жовчнокам'яну кольку, дисменорею, ендо 6 її фармацевтично прийнятної солі. 8. Спосіб за п. 1, де біль являє собою гострий біль або хронічний біль. 9. Спосіб за п. 1, де біль являє собою запальний біль. 10. Спосіб за п. 1, де біль являє собою невропатичний біль. 11. Спосіб за п. 10, де невропатичний біль являє собою діабетичну невропатію. 12. Спосіб за п. 7, де біль являє собою гострий біль або хронічний біль. 13. Спосіб за п. 7, де біль являє собою запальний біль. 14. Спосіб за п. 7, де біль являє собою невропатичний біль. 15. Спосіб за п. 14, де невропатичний біль являє собою діабетичну невропатію. 16. Спосіб зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки формули (II): O OCH3 NH2 S O N O , (II) H O (ІІ) або її фармацевтично прийнятної солі. 17. Спосіб за п. 16, де біль являє собою гострий біль або хронічний біль. 18. Спосіб за п. 16, де біль являє собою запальний біль. 19. Спосіб за п. 16, де біль являє собою невропатичний біль. метріоз, родовий біль, ревматологічний біль, головний біль або зубний біль. Хронічний біль являє собою хворобливий стан за межами звичайної травми або звичайної причини захворювання і може бути наслідком запалення або важких, прогресуючих, хворобливих стадій захворювання. Різні типи хронічного болю включають, крім інших, головний біль, мігрень, невралгію трійчастого нерва, синдром скроневонижньощелепного суглоба, фіброміалгічний синдром, остеоартрит, ревматоїдний артрит, біль у кістах при остеоартриті, остеопорозі, метастазах у кості або біль невідомого походження, подагру, фіброзит, міофасціальний біль, компресійні синдроми верхньої апертури грудної клітки, біль у верхньому відділі хребта або біль у нижньому відділі хребта (де болі у хребті виникають в результаті системного, регіонарного або первинного захворювання хребта (радикулопатії)), тазовий біль, серцевий грудний біль, не-серцевий грудний біль, біль, пов'язаний з ушкодженням спинного мозку, центральний постінсультний біль, біль при раку, біль при СНІДі, біль при серпоподібноклітинній анемії або геріатричний біль. Невропатичний біль визначається як біль, викликаний оберантним соматосенсорним процесин 7 94079 гом у периферичній або центральній нервовій системі, і включає хворобливу діабетичну периферичну невропатію, постгерпетичну невралгію, невралгію трійчастого нерва, постінсультний біль, біль, пов'язаний з розсіяним склерозом, біль, пов'язаний з невропатіями, наприклад, при ідіопатичній або посттравматичній невропатії і мононевриті, ВІЛасоційований невропатичний біль, невропатичний біль, пов'язаний з раком, невропатичний біль, пов'язаний із зап'ястним каналом, біль, пов'язаний з ушкодженням спинного мозку, комплексний регіонарний болючий синдром, невропатичний біль, пов'язаний з фіброміалгією, поперековий і шийний біль, рефлекторну симпатичну дистрофію, фантомний болючий синдром і інші болючі синдроми, пов'язані з хронічними й ослабленими станами. У даній галузі техніки зберігається потреба в забезпеченні ефективного лікування болю. Даний винахід належить до способу зняття болю, що включає введення суб'єкту, який потре де b є цілим числом від 0 до 4; і де с є цілим числом від 0 до 2; кожен R5 незалежно вибраний із групи, яка складається з галогену, нижчого алкілу і нітро; за умови, що коли являє собою або 8 бує цього, терапевтично ефективної кількості сполуки формули (І): де кожен R1 і R2 незалежно вибраний із групи, яка складається з водню і нижчого алкілу; R4 вибраний із групи, яка складається з водню і нижчого алкілу; а є цілим числом від 1 до 2; вибраний із групи, яка складається з: то тоді а дорівнює 1; або її фармацевтично прийнятної солі. Даний винахід також належить до способу зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки формули (II): 9 або її фармацевтично прийнятної солі. Прикладом винаходу є спосіб зняття болю, де біль вибраний із групи, яка складається з гострого болю або хронічного болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості будь-якої з сполук або фармацевтичних композицій, описаних вище. Також прикладом винаходу є спосіб зняття болю, де біль являє собою запальний біль, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості кожної з сполук або фармацевтичних композицій, описаних вище. Також прикладом винаходу є спосіб зняття болю, де біль являє собою невропатичний біль, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості кожної з сполук або фармацевтичних композицій, описаних вище. Даний винахід також належить до способів зняття болю, що включає одночасне введення суб'єкту, який потребує цього, щонайменше одного знеболюючого агента і сполуки формули (І) або формули (II), як описано в даному описі. Даний винахід належить до способу зняття болю, що включає введення суб'єкту, який потребує цього, терапевтично ефективної кількості сполуки формули (І): або її фармацевтично прийнятної солі, де a, R1, R2 і R4 визначені вище. Даний винахід також належить до способів зняття болю, що включає спільну терапію щонайменше з одним знеболюючим агентом і сполукою формули (І) або формули (II), як описано в даному описі. Використовуваний у даному описі термін «біль» повинний включати гострий, хронічний, запальний і невропатичний біль (переважно діабетичну невропатію). Крім того, біль може бути центрально-опосередкованим, периферичноопосередкованим, викликаним ушкодженням структурної тканини, викликаним ушкодженням м'якої тканини або викликаним прогресуючою хворобою. Будь-який центрально-опосередкований, периферично-опосередкований, викликаний ушкодженням структурної тканини, викликаний ушкодженням м'якої тканини або викликаний прогресуючою хворобою біль може бути гострим або хронічним. Якщо не зазначено інше, використовуваний в даному описі «біль» повинний включати запальний 94079 10 біль, центрально-опосередкований біль, периферично-опосередкований біль, вісцеральний біль, структурний біль, біль при раку, біль, пов'язаний з ушкодженням м'якої тканини, біль, пов'язаний із прогресуючою хворобою, невропатичний біль, гострий біль при важкому пораненні, гострий біль при травмі, гострий біль при хірургічній операції, головний біль, зубний біль, біль у спині (переважно в нижніх відділах хребта), хронічний біль при невропатичних станах і хронічному болі при постінсультних станах. У варіанті здійснення даного винаходу пропонується спосіб зняття болю, де біль є гострим болем. В іншому варіанті здійснення даного винаходу пропонується спосіб зняття болю, де біль є хронічним болем. В іншому варіанті здійснення даного винаходу пропонується спосіб зняття болю, де біль є невропатичним болем, більш переважно діабетичною невропатією. У ще одному варіанті здійснення даного винаходу пропонується спосіб зняття болю, де біль є запальним болем. В одному з варіантів здійснення біль вибраний із групи, яка складається з остеоартриту, ревматоїдного артриту, фіброміалгії, головного болю, зубного болю, опіку, сонячного опіку, укусу тварин (такого як укус собаки, укус кішки, укус змії, укус павука, укус комахи і т. п.), неврогенного сечового міхура, доброякісної гіперплазії передміхурової залози, інтерстиціального циститу, риніту, контактного дерматиту/гіперчутливості, сверблячки, екземи, фарингіту, мукозиту, ентериту, целюліту, каузалгії, невриту сідничного нерву, невралгії нижньощелепного суглобу, периферичного невриту, поліневриту, фантомного болю, фантомного болю в ампутованих кінцівках, постопераційної непрохідності кишечнику, холециститу, болючого синдрому після мамектомії, невропатичного болю ротової порожнини, болю Шарко, симпатичної рефлекторної дистрофії, синдрому Гійєна-Барре, невралгії латерального шкірного нерва стегна, синдрому печіння порожнини рота, постгерпетичної невралгії, невралгії трійчастого нерва, периферичної невропатії, двосторонньої периферичної невропатії, діабетичної невропатії, постгерпетичної невралгії, невралгії трійчастого нерва, оптичних невритів, постгарячкового невриту, мігруючого невриту, сегментарного невриту, невриту Гомбо, нейроніту, шийно-плечової невралгії, черепної невралгії, колінної невралгії, невралгії язикоглоткового нерву, мігренозної невралгії, ідіопатичної невралгії, міжреберної невралгії, грудної невралгії, Мортоновської метатарзальної невралгії, носовійчастої невралгії, потиличної невралгії, обмеженого хворобливого набряку шкіри, невралгії Сладера, невралгії крилопіднебінного вузла, надочноямкової невралгії, невралгії відіана, запальної хвороби кишечнику, синдрому подразненого кишечнику, родового акту, пологів, менструальних болів, раку, болю в спині, болю в нижніх відділах хребта і болю при синдромі зап'ястного каналу. Гострий біль включає біль, викликаний важким пораненням, травмою, хворобою або хірургічною операцією (наприклад, операцією з розкриттям грудної клітки (включаючи операцію на відкритому серці або шунтування)). Гострий біль також вклю 11 чає, без обмеження, головний біль, постопераційний біль, нирковокам'янну кольку, біль у жовчному міхурі, жовчнокам'яну кольку, родовий біль, ревматологічний біль, зубний біль або біль, викликаний спортивно-медичними травмами, синдромом зап'ястного каналу, опіками, скелетно-м'язовими розтягненнями і напруженнями, м'язовосухожильним напруженням, біль при шийноплечових синдромах, диспепсію, виразку шлунка, виразку дванадцятипалої кишки, дисменорею або ендометріоз. Хронічний біль включає біль, викликаний запальним захворюванням, остеоартритом, ревматоїдним артритом або такий, що є наслідком захворювання, важкого поранення або травми. Хронічний біль також включає, без обмеження, головний біль, біль у верхніх відділах хребта або біль у нижніх відділах хребта (обрані з болю в спині, що є наслідком системного, регіонарного або первинного захворювання хребта (обраного з радикулопатії)), біль у кістах (обраний з болю в кістах, обумовлений остеоартритом, остеопорозом, метастазами в кістковій тканині або невідомого походження), тазовий біль, біль, пов'язаний з ушкодженням спинного мозку, серцевий грудний біль, не-серцевий грудний біль, центральний постінсультний біль, міофасціальний біль, біль при раку, біль при СНІДі, біль при серпоподібноклітинній анемії, геріатричний біль, або біль, викликаний головним болем, мігренню, невралгією трійчастого нерва, синдром скронево-нижньощелепного суглоба, фіброміалгічний синдром, остеоартрит, ревматоїдний артрит, подагру, фіброзит або компресійні синдроми верхньої апертури грудної клітки. Невропатичний біль включає біль, що є наслідком хронічних або ослаблених станів або порушень. Хронічні або ослаблені стани або порушення, які можуть привести до невропатичного болю, включають, крім інших, хворобливу діабетичну периферичну невропатію, постгерпетичну невралгію, невралгію трійчастого нерва, постінсультний біль, біль, пов'язаний з розсіяним склерозом, біль, пов'язаний з невропатіями, наприклад, при ідіопатичній або посттравматичній невропатії і мононевриті, ВІЛ-асоційований невропатичний біль, невропатичний біль, пов'язаний з раком, невропатичний біль, пов'язаний із зап'ястним каналом, біль, пов'язаний з ушкодженням спинного мозку, комплексний регіонарний болючий синдром, невропатичний біль, пов'язаний з фіброміалгією, поперековий і шийний біль, рефлекторну симпатичну дистрофію, фантомний болючий синдром і інші болючі синдроми, пов'язані з хронічними й ослабленими станами. Використовуваний у даному описі термін «знеболюючий агент» повинний означати будьякий фармацевтичний агент, що забезпечує полегшення болю і включає, без обмеження, опіоїди і їхні похідні, нестероїдні протизапальні агенти, Тайленол-подібні сполуки, сполуки-донори NO, ТРАМАДОЛ і Трамадол-подібні сполуки, а також антидепресанти, такі як амітриптилін. Переважно, знеболюючий агент є ТРАМАДОЛ або Тайленол. Прийнятні приклади включають, без обмеження, Ацетамінофен; Альфентанілу Гідрохлорид; 94079 12 Амінобензоат калію; Амінобензоат натрію; Анідоксим; Анілеридин; Анілеридину Гідрохлорид; Анілопаму Гідрохлорид; Аніролак; Антипірин; Аспірин; Беноксапрофен; Бензидаміну Гідрохлорид; Біцифадину Гідрохлорид; Брифентанілу Гідрохлорид; Бромадоліну Малеат; Бромфенак натрію; Бупренорфіну Гідрохлорид; Бутацетин; Бутиксират; Буторфанол; Буторфанолу Тартрат; Карбамазепін; Карбаспірин кальцію; Карбіфену Гідрохлорид; Карфентанілу Цитрат; Ципрефадолу Сукцинат; Цирамадол; Цирамадолу Гідрохлорид; Клоніксерил; Клоніксин; Кодеїн; Кодеїну Фосфат; Кодеїну Сульфат; Конорфону Гідрохлорид; Циклазоцин; Дексоксадролу Гідрохлорид; Декспемедолак; Дезоцин; Дифлюнізал; Дигідрокодеїну Бітартрат; Димефадан; Дипірон; Докспікоміну Гідрохлорид; Дриніден; Енадоліну Гідрохлорид; Епіризол; Ерготаміну Тартрат; Етоксазену Гідрохлорид; Етофенамат; Евгенол; Фенопрофен; Фенопрофен кальцію; Фентанілу Цитрат; Флоктафенін; Флуфенізал; Флюніксин; Флюніксин Меглюмін; Флупіртину Малеат; Флупроквазон; Флурадоліну Гідрохлорид; Флурбіпрофен; Гідроморфону Гідрохлорид; Ібуфенак; Індопрофен; Кетазоцин; Кеторфанол; Кеторолаку Трометамін; Летиміду Гідрохлорид; Левометадилу Ацетат; Левометадилу Ацетат Гідрохлорид; Левонантрадолу Гідрохлорид; Леворфанолу Тартрат; Лофемізолу Гідрохлорид; Лофентанілу Оксалат; Лорцинадол; Ломоксикам; Саліцилат магнію; Мефенамінова кислота; Менабітану Гідрохлорид; Меперидину Гідрохлорид; Мептазинолу Гідрохлорид; Метадону Гідрохлорид; Метадил Ацетат; Метофолін; Метотримепразин; Меткефаміду Ацетат; Мімбану Гідрохлорид; Мірфентанілу Гідрохлорид; Моліназон; Морфіну Сульфат; Моксазоцин; Набітану Гідрохлорид; Налбуфіну Гідрохлорид; Налмексону Гідрохлорид; Намоксират; Нантрадолу Гідрохлорид; Напроксен; Напроксен натрію; Напроксол; Нефопама Гідрохлорид; Нексеридину Гідрохлорид; Норациметадолу Гідрохлорид; Окфентанілу Гідрохлорид; Октазамід; Олваніл; Оксеторону Фумарат; Оксикодон; Оксикодону Гідрохлорид; Оксикодону Терефталат; Оксиморфону Гідрохлорид; Пемедолак; Пентаморфон; Пентазоцин; Пентазоцину Гідрохлорид; Пентазоцину Лактат; Феназопіридину Гідрохлорид; Фенірамідолу Гідрохлорид; Піценадолу Гідрохлорид; Пінадолін; Пірфенідон; Піроксикам Оламін; Правадоліну Малеат; Продилідину Гідрохлорид; Профадолу Гідрохлорид; Пропіраму Фумарат; Пропоксифену Гідрохлорид; Пропоксифену Напсилат; Проксазол; Проксазолу Цитрат; Проксорфану Тартрат; Піроліфену Гідрохлорид; Реміфентанілу Гідрохлорид; Салколекс; Салетаміду Малеат; Саліциламід; Саліцилат Меглюмін; Салсалат; Саліцилат натрію; Спірадоліну Мезилат; Суфентаніл; Суфентанілу Цитрат; Талметацин; Талніфлумат; Талозалат; Тазадолену Сукцинат; Тебуфелон; Тетридамін; Тифурак натрію; Тилідин Гідрохлорид; Тіопінак; Тоназоцину Мезилат; Трамадолу Гідрохлорид; Трефентанілу Гідрохлорид; Троламін; Верадоліну Гідрохлорид; Верилопаму Гідрохлорид; Волазоцин; Ксорфанолу Мезилат; Ксилазину Гідрохлорид; Зеназоцину Мезилат; Зомепірак Натрію і Зукапсаїцин. 13 Додатково анальгетик може бути комбінованим продуктом, включаючи, без обмеження, ФІОРИЦЕТ (Novartis) або ЕСПК (Forests), або їх дженерики (комбінацію ацетамінофену, буталбіталу і кофеїну), ФІОРИНАЛ або його дженерики (комбінацію аспірину, буталбіталу і кофеїну, Novartis), МІГПРИВ або його дженерики (комбінацію аспірину і метоклопраміду; Sanofi-Synthelabo), МИДРИН/МИДРИД або його дженерики (комбінацію ацетамінофену і дихлоралфеназону; Carnick), ПАРAMAKC (Sanofi-Synthelabo) або МІГРЕНЕРТОН (Dolorgiet), або їх дженерики (комбінацію парацетамолу і метоклопраміду), ВІКОДИН (Abbott) або його дженерики (комбінацію ацетамінофену і гідрокодону), СТАДОЛ HC (буторфанол у формі назального спрею; Bristol-Myers Squibb), ЛОНАРИД (Boehringer Ingelheim) або МІГРАЛІВ (Pfizer) або їх дженерики (комбінацію парацетамолу і кодеїну), і т. п. Використовуваний у даному описі термін «суб'єкт» належить до тварини, переважно ссавця, найбільш переважно людини, що була об'єктом терапії, спостереження або експерименту. Використовуваний у даному описі термін «терапевтично ефективна кількість» позначає ту кількість активної речовини або фармацевтичного агенту, яка виявляє біологічну або лікувальну відповідь у системі тканин, тварині або людині, що визначається дослідником, ветеринаром, лікарем або іншим клініцистом і включає полегшення симптомів захворювання або порушення, підданих терапії. У випадках, коли даний винахід спрямований на спільну терапію або комбіновану терапію, включаючи введення однієї або більше сполук формули (І) або формули (II), а також одного або більше знеболюючих агентів, «терапевтично ефективна кількість» повинна означати таку дозу комбінації агентів, узятих разом, при якій загальний вплив забезпечує бажаний біологічний або лікувальний ефект. Наприклад, терапевтично ефективна кількість при спільній терапії, що включає введення сполуки формули (І) або формули (II) і щонайменше одного знеболюючого агента, є кількістю сполуки формули (І) або формули (II) і кількістю знеболюючого агента, які при одночасному або послідовному введенні чинять комбіновану дію, яка є терапевтично ефективною. Крім того, фахівець, кваліфікований у даній галузі техніки, оцінить, що у випадку спільної терапії з терапевтично ефективною кількістю, як у прикладі вище, кількості сполуки формули (І) або формули (II) і/або кількість знеболюючого агента, уведені окремо, можуть бути або можуть не бути терапевтично ефективними. Використовувані в даному описі терміни «спільна терапія» і «комбінована терапія» повинні означати лікування суб'єкта, який потребує цього, здійснюване за допомогою введення однієї або більше сполук формули (І) або формули (II) у комбінації з одним або більше знеболюючими агента 94079 14 ми, де сполука (сполуки) формули (І) або формули (II) і знеболюючий агент (агенти) уводять будьякими прийнятними способами, одночасно, послідовно, окремо або в одній фармацевтичної композиції. Коли сполука (сполуки) формули (І) або формули (II) і знеболюючий агент (агенти) вводять у роздільних лікарських формах, кількість дозувань, яку вводять за день для кожної сполуки, може бути однаковою або різною. Сполука (сполуки) формули (І) або формули (II) і знеболюючий агент (агенти) можна вводити однаковими або різними шляхами введення. Приклади прийнятних способів введення включають, без обмеження, пероральний, внутрішньовенний (в/в), внутрішньом'язовий (в/м), підшкірний (п/ш), трансдермальний і ректальний. Сполуки можна також уводити безпосередньо в нервову систему, включаючи, крім інших, інтрацеребральний, інтравентрикулярний, інтрацеребровентрикулярний, інтратекальний, інтрацистернальний, інтраспінальний і/або периспінальний шляхи введення при доставці за допомогою інтракраніальних або інтравертебральних голок і/або катетерів з або без насосних пристроїв. Сполука (сполуки) формули (І) або формули (II) і знеболюючий агент (агенти) можна вводити в одночасному або перемінному режимах, в один і той же або різний час протягом курсу терапії, одночасно в роздільних або єдиних формах. У варіанті здійснення даного винаходу R1 вибраний із групи, яка складається з водню і метилу. В іншому варіанті здійснення даного винаходу R2 вибраний із групи, яка складається з водню і метилу. У ще одному варіанті здійснення даного винаходу кожен R1 і R2 являє собою водень або кожен R1 і R2 являє собою метил. У варіанті здійснення даного винаходу -(СН2)а вибраний із групи, яка складається з -CH2- і -CH2CH2-. В іншому варіанті здійснення даного винаходу -(СН2)а являє собою -CH2-. У варіанті здійснення даного винаходу R4 вибраний із групи, яка складається з водню і метилу, переважно R4 являє собою водень. У варіанті здійснення даного винаходу а дорівнює 1. У варіанті здійснення даного винаходу b є цілим числом від 0 до 2. В іншому варіанті здійснення даного винаходу с є цілим числом від 0 до 2. В іншому варіанті здійснення даного винаходу b є цілим числом від 0 до 1. B іншому варіанті здійснення даного винаходу с є цілим числом від 0 до 1. У ще одному варіанті здійснення даного винаходу сума b і с дорівнює цілому числу від 0 до 2, переважно цілому числу від 0 до 1. У ще одному варіанті здійснення даного винаходу b є цілим числом від 0 до 2, а с дорівнює 0. У варіанті здійснення даного винаходу вибраний із групи, яка складається з: 15 В іншому варіанті здійснення даного винаходу В одному з варіантів здійснення даного винаходу вибраний із групи, яка складається з 2-(2,3-дигідро-бензо[1,4]-діоксинілу), 2-(бензо[1,3]діоксолілу), 3-(3,4-дигідро-бензо[1,4]-діоксепінілу), 2-(6-хлоро-2,3-дигідро-бензо[1,4]-діоксинілу), 2-(6фторо-2,3-дигідробензо[1,4]-діоксинілу), 2(хроманілу), 2-(5-фторо-2,3-дигідробензо[1,4]діоксинілу), 2-(7-хлоро-2,3-дигідробензо[1,4]діоксинілу), 2-(6-хлоробензо[1,3]-діоксолілу), 2-(7нітро-2,3-дигідробензо[1,4]-діоксинілу), 2-(7-метил2,3-дигідробензо[1,4]-діоксинілу), 2-(5-хлоро-2,3дигідробензо[1,4]-діоксинілу), 2-(6-бромо-2,3дигідро-бензо[1,4]-діоксинілу), 2-(6,7-дихлор-2,3дигідро-бензо[1,4]-діоксинілу), 2-(8-хлоро-2,3дигідробензо[1,4]-діоксинілу), 2-(2,3дигідронафто[2,3-b][1,4]-діоксинілу) і 2-(4метилбензо[1,3]-діоксолілу). В іншому варіанті здійснення даного винаходу вибраний із групи, яка складається з 2(бензо[1,3]-діоксолілу), 2-(2,3-дигідробензо[1,4]діоксинілу), 2-(6-хлоро-2,3-дигідро-бензо[1,4]діоксинілу), 2-(7-хлоро-2,3-дигідробензо[1,4]діоксинілу), 2-(7-метил-2,3-дигідробензо[1,4]діоксинілу), 2-(6-бромо-2,3-дигідробензо[1,4]діоксинілу) і 2-(6,7-дихлоро-2,3-дигідробензо[1,4]діоксинілу). В іншому варіанті здійснення даного винаходу вибраний із групи, яка склада ється з 2-(2,3-дигідробензо[1,4]-діоксинілу), 2-(7метил-2,3-дигідробензо[1,4]-діоксинілу) і 2-(6бромо-2,3-дигідро-бензо[1,4]-діоксинілу). 94079 16 вибраний із групи, яка складається з: У варіанті здійснення даного винаходу R5 вибраний із групи, яка складається з галогену і нижчого алкілу. В іншому варіанті здійснення даного винаходу R5 вибраний із хлору, фтору, брому і метилу. У варіанті здійснення даного винаходу, стерео-центр сполуки формули (І) знаходиться в Sконфігурації. В іншому варіанті здійснення даного винаходу, стерео-центр сполуки формули (І) знаходиться в R-конфігурації. У варіанті здійснення даного винаходу сполука формули (І) присутня у вигляді енантіомерно збагаченої суміші, де % енантіомерного збагачення (% ез) вищий, ніж приблизно 75%, переважно вищий, ніж приблизно 90%, більш переважно вищий, ніж приблизно 95%, найбільше переважно вищий, ніж приблизно 98%. Додаткові варіанти здійснення даного винаходу включають варіанти здійснення, в яких замісники, вибрані для однієї або більше перемінних, визначених у даному описі (тобто R1, R2, R3, R4, X-Y і А) незалежно вибрані, щоб бути будь-яким індивідуальним замісником або будь-якою підгрупою замісників, вибраних з повного списку, як визначено в даному описі. Типові сполуки за даним винаходом приведені в таблиці 1 нижче. Додаткові сполуки за даним винаходом приведені в таблиці 3. У таблицях 1 і 2 нижча колонка, названа «стерео» визначає стереоконфігурацію атома вуглецю в гетероциклі, приєднаного до зв'язку, позначеним зірочкою. Коли будь-яке позначення не приведене, сполука була отримана у вигляді суміші стереоконфігурацій. Коли приведене позначення «R» або «S», стереоконфігурація була основана на енантіомерно збагаченому стартовому матеріалі. 17 94079 18 19 Використовуваний у даному описі «галоген», якщо не зазначено інше, означає хлор, бром, фтор і йод. Використовуваний у даному описі термін «алкіл», якщо не зазначено інше, використовуваний або окремо, або як частина заміщуючої групи, включає лінійні і розгалужені ланцюги. Наприклад, алкільні радикали включають метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил і т. п. Якщо не зазначено інше, позначення «нижчий» при використанні з алкілом означає вуглецевий ланцюг з 1-4 атомами вуглецю. Використовуваний у даному описі «алкокси», якщо не зазначено інше, повинний позначати кисневмісний ефірний радикал з вищеописаних алкільних груп з лінійними або розгалуженими ланцюгами. Наприклад, метокси, етокси, н-пропокси, втор-бутокси, трет-бутокси, н-гексилокси і т. п. Використовуваний у даному описі символ «*» повинний позначати присутність стереогенного центру. Коли конкретна група є «заміщеною» (наприклад, алкілом, арилом і т. д.), то дана група може мати один або декілька замісників, переважно від одного до п'яти замісників, більш переважно від одного до трьох замісників, найбільш переважно від одного до двох замісників, незалежно вибраних зі списку замісників. У відношенні замісників термін «незалежно» означає, що коли може бути присутній більше ніж один із зазначених замісників, такі замісники можуть бути однаковими або різними. Відповідно до стандартної номенклатури, використовуваної по всьому опису даного винаходу, спочатку описується термінальна частина обумовленого ланцюга, а потім суміжної функціональної групи в напрямку до крапки приєднання. Таким чином, наприклад, «феніл-алкіл-аміно-карбонілалкільний» замісник відповідає групі формули: 94079 20 Скорочення, використовувані в описі, особливо в Схемах і Прикладах, наступні: ДЦК = Дициклогексилкарбодіімід ДХЕ = Дихлоретан ДХМ = Дихлорметан ДІПЕА або ДІЕА = Діізопропілетиламін ДМФА = N,N-Диметилформамід ДМСО = Диметилсульфоксид ЕДК = Етилкарбодіімід Et3N або TEA = Триетиламін Et2O = Діетиловий ефір EA або EtOAc = етилацетат EtOH = Етанол ІПС = 2-пропанол Гепт = Гептан ГБТ = 1-Гідроксибензотриазол ВЕРХ = Високоефективна рідинна хроматографія ЛАГ = Алюмогідрид літію M або MeOH = Метанол ЯМР = Ядерний Магнітний Резонанс Pd-C = паладієвий каталізатор на вугіллі ОФ ВЕРХ - Обернено-фазова високоефективна рідинна хроматографія KT або кт = кімнатна температура TEA = Триетиламін ТФО = Трифтороцтова кислота ТГФ = Тетрагідрофуран ТШХ = Тонкошарова хроматографія Коли сполуки згідно з даним винаходом мають щонайменше один хіральний центр, вони відповідно можуть існувати у вигляді енантіомерів. Коли 21 сполуки володіють двома або більше хіральними центрами, вони додатково можуть існувати у вигляді діастереомерів. Варто розуміти, що всі зазначені ізомери і їх суміші включені в обсяг даного винаходу. Крім того, деякі з кристалічних форм сполук можуть існувати у вигляді поліморфних модифікацій, і, як передбачається, повинні бути включені в даний винахід. Крім того, деякі зі сполук можуть утворювати сольвати з водою (тобто, гідрати) або зі звичайними органічними розчинниками, при цьому зазначені сольвати, як передбачається, також повинні бути включені в обсяг даного винаходу. З метою застосування в медицині солі сполук даного винаходу належать до нетоксичних «фармацевтично прийнятних солей». Однак інші солі можуть використовуватися при отриманні сполук згідно з даним винаходом або їх фармацевтично прийнятних солей. Прийнятні фармацевтично прийнятні солі сполук включають солі приєднання кислот, які можуть бути отримані, наприклад, при змішуванні розчину сполуки з розчином фармацевтично прийнятної кислоти, такої як соляна кислота, сірчана кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота, вугільна або кислота фосфорна кислота. Крім того, коли сполуки за даним винаходом несуть кислотну групу, їх прийнятні фармацевтично прийнятні солі можуть включати солі лужних металів, наприклад, солі натрію або калію; солі лужноземельних металів, наприклад, солі кальцію або магнію; а також солі, утворені з прийнятними органічними лігандами, наприклад, солі четвертинного амонію. Таким чином, приклади фармацевтично прийнятних солей включають: ацетат, бензолсульфонат, бензоат, бікарбонат, бісульфат, бітартрат, борат, бромід, едетат кальцію, камсилат, карбонат, хлорид, клавуланат, цитрат, дигідрохлорид, едетат, едисилат, естолат, езилат, фумарат, глюцептат, глюконат, глутамат, гліколіларсанілат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізотіонат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезилат, метилбромід, метилнітрат, метилсульфат, мукат, напсилат, нітрат, амонієву сіль Nметилглюкаміну, олеат, памоат (ембонат), пальмітат, пантотенат, фосфат/дифосфат, полігалактуронат, саліцилат, стеарат, сульфат, основний ацетат, сукцинат, танат, тартрат, теоклат, тозилат, триетіодид і валерат. 94079 22 Приклади кислот і основ, що можуть використовуватися в отриманні фармацевтично прийнятних солей, включають наступні: кислоти, включаючи оцтову кислоту, 2,2дихлороцтову кислоту, ацетильовані амінокислоти, адипінову кислоту, альгінову кислоту, аскорбінову кислоту, L-аспарагінову кислоту, бензолсульфонову кислоту, бензойну кислоту, 4ацетамідобензойну кислоту, (+)-камфорну кислоту, камфорсульфонову кислоту, (+)-(1L)-камфор-10сульфонову кислоту, капринову кислоту, капронову кислоту, каприлову кислоту, коричну кислоту, лимонну кислоту, цикламову кислоту, додецилсірчану кислоту, етан-1,2-дисульфонову кислоту, етансульфонову кислоту, 2гідроксіетансульфонову кислоту, мурашину кислоту, фумарову кислоту, галактарову кислоту, гентизинову кислоту, глюкогептонову кислоту, Dглюконову кислоту, D-глюкуронову кислоту, Lглутамінову кислоту, -оксоглутарову кислоту, гліколеву кислоту, гіпурову кислоту, бромоводневу кислоту, хлороводневу кислоту, (+)-L-молочну кислоту, ()-DL-молочну кислоту, лактобіонову кислоту, малеїнову кислоту, (-)-L-яблучну кислоту, малонову кислоту, (±)-DL-мигдальну кислоту, метансульфонову кислоту, нафталін-2сульфонову кислоту, нафталін-1,5-дисульфонову кислоту, 1-гідрокси-2-нафтенову кислоту, нікотинову кислоту, азотну кислоту, олеїнову кислоту, оротову кислоту, щавлеву кислоту, пальмітинову кислоту, памову кислоту, фосфорну кислоту, Lпіроглутамінову кислоту, саліцилову кислоту, 4аміносаліцилову кислоту, себацинову кислоту, стеаринову кислоту, бурштинову кислоту, сірчану кислоту, дубильну кислоту, (+)-L-винну кислоту, тіоціанову кислоту, n-толуолсульфонову кислоту й ундециленову кислоту; і основи, включаючи аміак, L-аргінін, бенетамін, бензатин, гідроксид кальцію, холін, деанол, діетаноламін, діетиламін, 2-(діетиламіно)етанол, етаноламін, етилендіамін, N-метил-глюкамін, гідрабамін, 1Н-імідазол, L-лізин, гідроксид магнію, 4-(2гідроксіетил)-морфолін, піперазин, гідроксид калію, 1-(2-гідроксіетил)-піролідин, вторинний амін, гідроксид натрію, триетаноламін, трометамін і гідроксид цинку. Сполуки формули (І) можуть бути отримані відповідно до способу, представленому на Схемі 1. 23 Схема 1 Таким чином, прийнятним чином заміщена сполука формули (X), відома сполука або сполука, отримана відомими способами, реагує із сульфамідом, відомою сполукою, де сульфамід переважно присутній у кількості в діапазоні приблизно від 2 до приблизно 5 еквівалентів в органічному розчиннику, такому як ТГФ, діоксан і т. п., переважно при підвищеній температурі в діапазоні приблизно від 50°C до приблизно 100°С, більш переважно приблизно при температурі дефлегмації, що приводить до відповідної сполуки формули (Ia). Альтернативно, заміщена прийнятним чином сполука формули (X), відома сполука або сполука, отримана відомими способами, реагує з заміщеною сполукою формули (XI), відомою сполукою або сполукою, отриманою відомими способами, у присутності основи, такої як TEA, ДІПЕА, піридин і Схема 2 Таким чином, прийнятним чином заміщена сполука формули (XII), відома сполука або сполука, отримана відомими способами (наприклад, як описано в Схемі 3 вище), реагує з NH4OH, відомою сполукою, необов'язково в органічному розчиннику, такому як ацетонітрил і т. п., що приводить до відповідної сполуки формули (XIII). Сполука формули (XIII) реагує з правильно підібраним відновлювальним агентом, таким як ЛАГ і т. п., в органічному розчиннику, такому як ТГФ, діетиловий ефір і т. п., що приводить до відповідної сполуки формули (Xa). 94079 24 т. п., в органічному розчиннику, такому як ДМФА, ДМСО і т. п., що приводить до відповідної сполуки формули (І). Сполуки формули (X), де бою являє со , можуть бути отри мані відповідно до способу, представленому на Схемі 2. Сполуки формули (X), де вибраний з , можуть бути отримані відповідно до способу, представленому на Схемі 3. 25 Схема 3 Таким чином, заміщена прийнятним чином сполука формули (XIV), відома сполука або сполука, отримана відомими способами, реагує з NH4OH, у присутності зшивного агенту, такого як ДЦК і т. п., необов'язково в органічному розчиннику, такому як ацетонітрил і т. п., що приводить до відповідної сполуки формули (XV). Сполука формули (XV) реагує з правильно підібраним відновлювальним агентом, таким як ЛАГ і т. п., в органічному розчиннику, такому як ТГФ, діетиловий ефір і т. п., що приводить до відповідної сполуки формули (Xb). Схема 4 Таким чином, заміщена прийнятним чином сполука формули (XVI), де J1 є прийнятною відхідною групою, такою як Br, Cl, І, тозил, мезил, трифліл і т. п., відома сполука або сполука, отримана відомими способами (наприклад, активацією відповідної сполуки, де J1 являє собою ВІН), реагує з ціанідом, таким як ціанід калію, ціанід натрію і т. п., у органічному розчиннику, такому як ДМСО, ДМФА, ТГФ і т. п., що приводить до відповідної сполуки формули (XVII). Сполуку формули (XVII) відновлюють відповідно до відомих способів, наприклад, реакцією з прийнятним відновлювальним агентом, таким як ЛАГ, боран і т. п., що приводить до відповідної 94079 26 Сполуки формули (X), де вибраний з і де а дорівнює 2, можуть бути отримані відповідно до способу, представленому на Схемі 4. сполуки формули (Xc). Сполуки формули (X), де вибраний з і де а дорівнює 1, можуть бути отримані відповідно до способу, представленому на Схемі 5. 27 94079 28 Схема 5 Таким чином, прийнятним способом заміщена сполука формули (XVIII), відома сполука або сполука, отримана відомими способами, активують відповідно до відомого способу, що приводить до відповідної сполуки формули (XIX), де J являє собою прийнятну відхідну групу, таку як тозилат, Cl, Br, І, мезилат, трифлат і т. п. Сполука формули (XIX) реагує з фталімідною сіллю, такою як фталімід калію, фталімід натрію і т. п., в органічному розчиннику, такому як ДМФА, ДМСО, ацетонітрил і т. п., переважно при підвищеній температурі в діапазоні від 50°C до приблизно 200°С, більш переважно приблизно при температурі дефлегмації, що приводить до відповід відповідної сполуки формули (XX). Сполука формули (XX) реагує з N2H4, відомою сполукою, в органічному розчиннику, такому як етанол, метанол і т. п., переважно при підвищеній температурі в діапазоні від приблизно 50°C до приблизно 100°С, більш переважно приблизно при температурі дефлегмації і т. п., що приводить до відповідної сполуки формули (Xd). Фахівець, кваліфікований у даній галузі техніки, буде розуміти, що сполуки формули (X), де можуть бути отримані відомими способами або, наприклад, відповідно до способів, представлених на Схемах 2-5 вище, вибираючи і заміщуючи відповідні нафтил-конденсовані сполуки для бензоконденсованих вихідних матеріалів. Фахівець, кваліфікований у даній галузі техніки, також буде розуміти, що коли необхідно єдиний енантіомер сполуки формули (X) (або суміш енантіомерів, де один енантіомер є збагаченим), вищезгадані способи, описані в Схемах 1-5, можуть бути застосовані за допомогою заміщення відповідного єдиного енантіомеру (або суміші енантіомерів, де один енантіомер є збагаченим) для відпові дного вихідного матеріалу. Фахівець, кваліфікований у даній галузі техніки, буде розуміти, що стадія реакції даного винаходу може бути проведена в різних розчинниках або системах розчинників, зазначена стадія реакції може також бути проведена в суміші прийнятних розчинників або систем розчинників. Коли способи отримання сполук відповідно до винаходу дають суміші стереоізомерів, то зазначені ізомери можуть бути поділені звичайними способами, такими як препаративна хроматографія. Сполуки можуть бути отримані в рацемічній формі, або окремі енантіомери можуть бути отри вибраний з 29 мані енантіоселективним синтезом або за допомогою виділення. Сполуки можуть, наприклад, бути поділені на складаючі їх енантіомери стандартними способами, такими як утворення діастереомірних пар шляхом утворення солі з оптично активною кислотою, такою як (-)-ди-n-толуоїл-D-винна кислота і/або (+)-ди-n-толуоїл-L-винна кислота, з наступною фракційною кристалізацією і регенерацією вільної основи. Сполуки можуть також бути поділені за допомогою утворення діастереомірних складних ефірів або амідів, з наступним хроматографічним роділенням і видаленням хіральної допоміжної сполуки. Як альтернатива, сполуки можуть бути поділені з використанням хіральної ВЕРХ-колонки. При здійсненні кожного зі способів отримання сполук за даним винаходом може бути необхідним і/або бажаним захистити чутливі або реакційноздатні здатні групи на кожній з відповідних молекул. Це може бути досягнуто за допомогою звичайних захисних груп, таких як описані в Protective Groups in Organic Chemistry, ed. J. F. W. McOmie, Plenum Press, 1973; і Т. W. Greene & P. G. M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Захисні групи можуть бути вилучені в одній зі зручних наступних стадій, використовуючи способи, відомі з рівня техніки. Даний винахід додатково включає фармацевтичні композиції, що містять одну або більше сполук формули (І) з фармацевтично прийнятним носієм. Фармацевтичні композиції, що містять як активний компонент одну або більше сполук винаходу, описаних у даному описі, можуть бути отримані ретельним змішуванням сполуки або сполук з фармацевтичним носієм відповідно до стандартних методик складання фармацевтичних композицій. Носій може мати великий діапазон форм в залежності від бажаного шляху введення (наприклад, перорального, парентерального). Таким чином, у випадку рідких препаратів для перорального застосування, таких як суспензії, еліксири і розчини, прийнятні носії і добавки включають воду, гліколі, олії, спирти, ароматизатори, консерванти, стабілізатори, барвники і т. п.; у випадку твердих препаратів для перорального застосування, таких як порошки, капсули і таблетки, прийнятні носії і добавки включають крохмалі, цукри, розріджувачі, гранульовані агенти, ковзні речовини, зв'язувальні речовини, дезінтегруючі добавки і т. п. Тверді препарати для перорального застосування можуть бути також покриті такими речовинами як цукри або покриті ентеро-солюбільним покриттям, щоб змінити основну ділянку абсорбції. У випадку парентерального введення носій звичайно буде складатися зі стерильної води, при цьому з метою підвищення розчинності або для консервації можуть бути додані інші компоненти. Суспензії або розчини для ін'єкцій можуть бути також приготовлені з використанням водяних носіїв поряд з відповідними добавками. Для приготування фармацевтичних композицій за даним винаходом одну або більше сполук за даним винаходом як активний компонент ретельно перемішують з фармацевтичним носієм відповідно до звичайних методик складання фармацевтичних 94079 30 композицій, де зазначений носій може мати великий діапазон форм в залежності від форми препарату, необхідної для введення, наприклад, пероральної або парентеральної, такої як внутрішньом'язова. У ході готування композицій у лікарській формі для перорального застосування може використовуватися кожний зі стандартних фармацевтичних носіїв. Таким чином, у випадку рідких препаратів для перорального застосування, таких як, наприклад, суспензії, еліксири і розчини, прийнятні носії і добавки включають воду, гліколі, олії, спирти, ароматизатори, консерванти, барвники і т. п.; у випадку твердих препаратів для перорального застосування, таких як, наприклад, порошки, капсули, каплети, желатинові капсули і таблетки, прийнятні носії і добавки включають крохмалі, цукри, розріджувачі, гранульовані агенти, ковзні речовини, зв'язувальні речовини, дезінтегруючі добавки і т. п. Завдяки легкості введення таблетки і капсули являють собою найбільш вигідну лікарську форму для перорального застосування, і в даному випадку, мабуть, застосовуються тверді фармацевтичні носії. Якщо необхідно, таблетки можуть бути покритим цукром або ентеросолюбільним покриттям за допомогою стандартних методик. У випадку препаратів для парентерального застосування носій звичайно буде включати стерильну воду, хоча можуть бути включені інші компоненти, призначені, наприклад, для підвищення розчинності або консервації. Також можуть бути приготовлені суспензії для ін'єкцій, при цьому можуть використовуватися прийнятні рідкі носії, суспендуючі добавки і т. п. Фармацевтичні композиції в даному описі будуть містити таку кількість активного компоненту, у розрахунку на лікарську форму, наприклад, таблетку, капсулу, порошок, ін'єкцію, чайну ложку і т. п., яку необхідно для доставки ефективної дози, як описано вище. Фармацевтичні композиції в даному описі будуть містити, у розрахунку на лікарську форму, наприклад, таблетку, капсулу, порошок, ін'єкцію, свічку, чайну ложку і т. п., приблизно від 0,1-1000 мг і зможуть прийматися в дозуванні приблизно від 0,01-200,0 мг/кг/день, переважно від приблизно 0,1 до 100 мг/кг/день, більш переважно приблизно від 0,5-50 мг/кг/день, більш переважно приблизно від 1,0-25,0 мг/кг/ день або у будь-якому зазначеному діапазоні. Дозування, однак, можуть бути різні в залежності від потреби пацієнтів, тяжкості захворювання, яке лікують, і застосовуваної сполуки. Може використовуватися або щоденне введення або постперіодичне дозування. Переважно зазначені сполуки знаходяться в стандартних лікарських формах, таких як таблетки, пігулки, капсули, порошки, гранули, стерильні розчини для парентерального введення або суспензії, дозовані аерозолі або рідкі спреї, краплі, ампули, автоінжекторні пристрої або свічі; для перорального, парентерального, інтраназального, сублінгвального або ректального введення, або для введення за допомогою інгаляції або вдмухування. Як альтернатива композиція може бути присутньою у формі, прийнятній для щотижневого або щомісячного введення; наприклад, нерозчинна сіль активної сполуки, така як деканоат, може 31 бути прийнятною для забезпечення препарату пролонгованої дії для внутрішньом'язової ін'єкції. Для приготування твердих композицій, таких як таблетки, основний активний компонент змішують з фармацевтичним носієм, наприклад зі звичайними компонентами таблетування, такими як кукурудзяний крохмаль, лактоза, цукроза, сорбіт, тальк, стеаринова кислота, стеарат магнію, фосфат дикальцію або камеді, а також з іншими фармацевтичними розріджувачами, наприклад водою, що дозволяє отримати тверду попередню композицію, що містить гомогенну суміш сполуки за даним винаходом або її фармацевтично прийнятної солі. Коли зазначені попередні композиції згадуються як гомогенні, це означає, що активний компонент рівномірно диспергований по всьому об'єму композиції, і в такий спосіб композиція може бути легко поділена на рівноефективні лікарські форми, такі як таблетки, пігулки і капсули. Потім зазначену тверду попередню композицію поділяють на стандартні лікарські форми вищеописаного типу, що містять від 0,1 до приблизно 1000 мг активного компонента даного винаходу. Таблетки або пігулки нової композиції можуть бути покриті або складені іншим способом, що забезпечує лікарську форму, яка володіє перевагою пролонгованої дії. Наприклад, таблетка або пігулка можуть включати внутрішній і зовнішній компоненти дозування, причому останній є присутній у формі оболонки зверху основи. Зазначені два компоненти можуть бути розділені ентеро-солюбільним шаром, який служить для запобігання розпаду в шлунку і дозволяє внутрішньому компоненту проходити у вихідному вигляді в дванадцятипалу кишку або забезпечує затримку вивільнення. Для зазначених ентеросолюбільних шарів або покриттів можуть використовуватися різні матеріали, що включають ряд полімерних кислот і такі матеріали як шелак, цетиловий спирт і ацетат целюлози. Рідкі форми для перорального введення або ін'єкцій, в які можуть бути включені нові сполуки за даним винаходом, включають водяні розчини, ароматизовані сиропи, водяні або масляні суспензії й ароматизовані емульсії з харчовими оліями, такими як бавовняна олія, кунжутна олія, кокосова олія або арахісове масло, а також еліксири і подібні фармацевтичні носії. Прийнятні диспергуючі або суспендуючі добавки для водяних суспензій включають синтетичні і натуральні камеді, такі як трагакантова камедь, гуміарабік, альгінат, декстран, натрієва сіль карбоксиметилцелюлози, метилцелюлоза, полівінілпіролідон або желатин. Спосіб лікування депресії, описаний у даному винаході, може також здійснюватися з використанням фармацевтичної композиції, що включає кожну зі сполук, визначених у даному описі, і фармацевтично прийнятний носій. Фармацевтична композиція може містити приблизно від 0,1 до 1000 мг, переважно приблизно 50-500 мг сполуки, і може бути складена в будь-якій формі, прийнятній для вибраного способу введення. Носії включають необхідні й інертні фармацевтичні наповнювачі, включаючи, без обмеження, зв'язувальні речовини, суспендуючі добавки, ковзні речовини, ароматизатори, підсолоджувачі, консерванти, барвники і 94079 32 покриття. Композиції, прийнятні для перорального введення, включають тверді форми, такі як пігулки, таблетки, каплети, капсули (кожна форма включає композиції негайного вивільнення, з регульованим часом вивільнення й уповільненим вивільненням), гранули і порошки, а також рідкі форми, такі як розчини, сиропи, еліксири, емульсії і суспензії. Форми, застосовувані для парентерального введення, включають стерильні розчини, емульсії і суспензії. Переважно, сполуки за даним винаходом можна вводити в єдиній щоденній дозі, або повна щоденна доза може бути введена в роздільних дозах, два, три або чотири рази на день. Крім того, сполуки за даним винаходом можна вводити в інтраназальній формі за допомогою місцевого застосування прийнятних інтраназальних носіїв, або за допомогою трансдермальних пластирів, відомих середнім фахівцям у даній галузі техніки. При введенні у формі трансдермальної системи доставки, введення дози, безумовно, буде здійснюватися безупинно, а не періодично, протягом всього режиму дозування. Наприклад, для перорального введення у формі таблетки або капсули, активний компонент лікарського засобу може бути об'єднаний з нетоксичним фармацевтично прийнятним інертним носієм для перорального застосування, таким як етанол, гліцерин, вода і т. п. Крім того, коли бажано або необхідно, у суміш можуть бути також включені прийнятні зв'язувальні речовини, ковзні речовини, дезінтегруючі добавки і барвники. Прийнятні зв'язувальні речовини включають, без обмеження, крохмаль, желатин, натуральний цукор, такий як глюкоза або бета-лактоза, цукристі речовини кукурудзи, натуральні і синтетичні камеді, такі як гуміарабік, трагакант або олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію і т. п. Дезінтегратори включають, крім інших, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь і т. п. У рідкі форми звичайно додають суспендуючі або диспергуючі добавки, такі як синтетичні і натуральні камеді, наприклад, трагакант, гуміарабік, метилцелюлозу і т. п. Для парентерального введення кращими є стерильні суспензії і розчини. Ізотонічні препарати, що звичайно містять прийнятні консерванти, застосовуються у випадках, коли переважно внутрішньовенне введення. Сполуки за даним винаходом можна вводити в складі кожної з попередніх композицій і відповідно до режимів дозування, встановлених в рівні техніки, у всіх випадках, коли потрібно лікування депресії. Щоденна доза продуктів може варіювати в широкому діапазоні від 0,01 до 200 мг/кг для дорослої людини на день. У випадку перорального введення сполуки переважно забезпечуються у формі таблеток, що містять 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250, 500 і 1000 міліграмів активного компонента для симптоматичного регулювання дозування підданого лікуванню пацієнта. Ефективна кількість препарату звичайно знаходиться на рівні дозування приблизно від 0,01 мг/кг до приблизно 200 мг/кг 33 маси тіла на день. Переважно діапазон дозування складає від, приблизно 0,1, до, приблизно, 100,0 мг/кг маси тіла на день, більш переважно, приблизно, від 0,5 мг/кг до, приблизно 50 мг/кг, більш переважно від, приблизно 1,0, до, приблизно, 25,0 мг/кг маси тіла на день. Сполуки можна вводити в режимі 1-4 рази на день. Оптимальні дози, що вводяться, можуть бути легко визначені фахівцями, кваліфікованими в даній галузі техніки, і варіюють в залежності від конкретної використовуваної сполуки, способу введення, концентрації препарату і поліпшення протягом захворювання. Крім того, фактори, пов'язані з конкретним пацієнтом, підданим лікуванню, які включають вік пацієнта, вагу, режим харчування і час введення, приводять до необхідності корекції дозувань. Фахівець, кваліфікований у даній галузі техніки, буде розуміти, що й іспити in vivo, і in vitro з використанням прийнятних, відомих і загальноприйнятих клітинних і/або тваринних моделей дозволяють прогнозувати здатність випробовуваної сполуки при лікуванні або профілактиці даного порушення. Фахівець, кваліфікований у даній галузі техніки, також буде розуміти, що клінічні іспити на людях, включаючи первинні іспити на людині, іспити з підбору дози й іспити на ефективність, у здорових пацієнтів і/або страждаючих від даного порушення, можуть бути проведені відповідно до способів, відомих у клінічній і медичній галузях. Наступні приклади викладені з метою допомоги при розумінні винаходу, і не призначені і не повинні розглядатися, як обмежуючі будь-яким чином винахід, викладений у формулі, яка слідує далі. Приклад 1 ((3,4-дигідро-2Н-бензо[b]|1,4]-діоксепін-3іл)метилсульфамід (Сполука №3) Пірокатехін (5,09 г, 46,2 ммоль) і карбонат калію змішували в ацетонітрилі і нагрівали з дефлегмацією протягом однієї години. Потім додавали 2хлорметил-3-хлор-1-пропен (5,78 г, 46,2 ммоль), і реакцію продовжували з дефлегмацією протягом 24 годин. Розчин охолоджували до кімнатної температури і фільтрували. Фільтрат випаровували, а залишок розріджували у воді й екстрагували діетиловим ефіром (3 рази). Об'єднаний органічний розчин сушили над MgSO4 і концентрували. Хроматографічне очищення (2% діетиловий ефір у гексані) приводило до отримання 3-метилен-3,4дигідро-2Н-бензо[b][1,4]-діоксепіну у вигляді безбарвної олії. MS(ESI): 163,2 (М+Н+) 1 H ЯМР (300 МГц, CDCl3), 6,94 (м, 4Н), 5,07 (с, 2Н), 4,76 (с, 4Н). 3-метилен-3,4-дигідро-2Н-бензо[b][1,4]діоксепін (5,00 г, 30,8 ммоль) розчиняли в сухому 94079 34 ТГФ (100 мл). Боран-ТГФ (1,0 M в ТГФ, 10,3 мл) додавали при 0°С. Реакційну суміш перемішували при KT протягом 5 годин. Потім додавали аміносульфонову кислоту (6,97 г, 61,6 ммоль). Реакційну суміш нагрівали з дефлегмацією протягом ночі. Реакційну суміш охолоджували до кімнатної температури і додавали водяний розчин гідроксиду натрію (3,0 М, 100 мл). Розчин екстрагували етилацетатом (3x100 мл). Об'єднаний органічний розчин сушили над MgSO4. Розчин концентрували під вакуумом і очищували за допомогою хроматографії (2-8% метанолу в дихлорметані), у результаті чого отримували ((3,4-дигідро-2Н-бензо[b][1,4]діоксепін-3-іл)метил)аміну у вигляді безбарвної олії. MS(ESI): 180,1 (М+Н+) 1 H ЯМР (300 МГц, ДМСО), 6,92 (м, 4Н), 4,21 (м, 2Н), 4,07 (м, 2Н), 3,33 (широкий, 2Н), 3,16 (д, J = 4 Гц, 1Н), 2,72 (д, J = 4 Гц, 1H), 2,30 (м, 1H). ((3,4-Дигідро-2Н-бензо[b][1,4]-діоксепін-3іл)метил)амін (2,90 г, 16,2 ммоль) і сульфамід (3,11 г, 32,4 ммоль) змішували в сухому діоксані (60 мл) і нагрівали з дефлегмацією протягом ночі. Потім додавали хлороформ, а осад видаляли фільтруванням. Фільтрат концентрували у вакуумі й очищували за допомогою хроматографії (2-8% ацетону в дихлорметані), у результаті чого отримували зазначену в заголовку сполуку у вигляді не зовсім білої твердої речовини. 258,8 (М+H+) 1 H ЯМР (300 МГц, ДМСО), 6,92 (м, 4Н), 6,71 (широкий, 1Н), 6,59 (широкий, 2Н), 4,19 (м, 2Н), 4,04 (м, 2Н), 3,00 (м, 2Н), 2,39 (м, 1Н). Приклад 2 N-(2.3-Дигідро-бензо[1,4]-діоксин-2ілметил)сульфамід (Сполука №1) Рацемічний 2,3-дигідро-1,4-бензодіоксин-2ілметиламін (4,4 г, 26 ммоль) і сульфамід (5,1 г, 53 ммоль) змішували в 1,4-діоксані (100 мл) і нагрівали з дефлегмацією протягом 2 год. Реакційну суміш охолоджували до кімнатної температури, після чого невелику кількість твердої речовини відфільтровували і видаляли. Фільтрат випаровували у вакуумі, а залишок очищували за допомогою колонкової флеш-хроматографії (ДХМ:метанол - 10:1), з отриманням білої твердої речовини. Тверду речовину перекристалізовували в ДХМ, з отриманням зазначеної в заголовку сполуки у вигляді білої твердої речовини. Т. п.: 97,5-98,5°С Елементний Аналіз: Розрахунковий склад: С, 44,25; Н, 4,95; N, 11,47; S, 13,13 Отриманий склад: С, 44,28; Н, 4,66; N, 11,21; S, 13,15 1 H ЯМР (ДМСО d6) 6,85 (м, 4Н), 6,68 (широкий с, 3Н, NH), 4,28 (м, 2Н), 3,97 (дд, J = 6,9, 11,4 Гц, 1Н), 3,20 (м, 1Н), 3,10 (м, 1Н). Приклад 3 (Бензо[1,3]-діоксол-2-ілметил)сульфамід (Сполука №2) 35 Пірокатехін (10,26 г, 93,2 ммоль), метоксид натрію (25% по масі в метанолі, 40,3 г, 186 ммоль) і метил дихлорацетат (13,3 г, 93,2 ммоль) змішували в безводному метанолі (100 мл). Розчин нагрівали з дефлегмацією протягом ночі. Потім реакційну суміш охолоджували до кімнатної температури, підкислювали шляхом додавання концентрованої соляної кислоти, а потім концентрували у вакуумі до об'єму приблизно 50 мл. Додавали воду, після чого суміш екстрагували діетиловим ефіром (3x100 мл). Об'єднаний органічний розчин сушили над MgSO4, концентрували до отримання коричневого твердого залишку й очищували за допомогою хроматографії (2% етилацетат у гексані), з отриманням метилового ефіру бензо[1,3]-діоксол-2-карбонової кислоти у вигляді безбарвної олії. MS(ESI): 195,10 (М+Н+). 1 H ЯМР (300 МГц, CDCl3), 6,89 (широкий, 4Н), 6,29 (с, 1H), 4,34 (кв, J = 7 Гц, 2Н), 1,33 (т, J = 7 Гц, 3Н). До метилового ефіру бензо[1,3]-діоксол-2карбонової кислоти (7,21 г, 40,0 ммоль) додавали гідроксид амонію (29% у воді, 10 мл) і достатню кількість ацетонітрилу для отримання гомогенної суміші (~5 мл). Розчин перемішували протягом двох годин при кімнатній температурі, а потім додавали дистильовану воду. Амід бензо[1,3]діоксол-2-карбонової кислоти, що випав у вигляді білого осаду, відділяли фільтруванням і використовували без подальшого очищення. MS(ESI): 160,00 (М+Н+). 1 H ЯМР (300 МГц, ДМСО), 7,99 (с, широкий, 1Н), 7,72 (с, широкий, 1Н), 6,94 (м, 2Н) 6,86 (м, 2Н), 6,30 (с, 1Н). Амід бензо[1,3]-діоксол-2-карбонової кислоти (5,44 г, 32,9 ммоль) розчиняли в тетрагідрофурані (ТГФ, 100 мл). До розчину при кімнатній температурі повільно додавали алюмогідрид літію (ЛАГ, 1M В ТГФ, 39,5 мл, 39,5 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 24 годин. Потім з метою гідролізу надлишку ЛАГ додавали дистильовану воду. Додавали водяний розчин гідроксиду натрію (3,0 М, 100 мл), після чого розчин екстрагували етилацетатом (3x100 мл). Об'єднаний органічний розчин промивали водою і сушили над MgSO4. Розчинник випаровували з отриманням С-бензо[1,3]-діоксол-2-ілметиламін у вигляді безбарвної олії. MS (ESI): 152,1 (М+Н+). 1 H ЯМР (300 МГц, CDCl3), 6,87 (м, 4Н), 6,09 (т, J = 4 Гц, 1Н), 3,13 (д, J = 4 Гц, 2H) С-Бензо[1,3]-діоксол-2-іл-метиламін (2,94 г, 19,4 ммоль) і сульфамід (3,74 г, 38,9 ммоль) змішували в сухому діоксані (50 мл), після чого отриманий розчин нагрівали з дефлегмацією протягом ночі. Реакційну суміш концентрували, а залишок очищували хроматографією (2-10% ацетону в ди 94079 36 хлорметані), з отриманням зазначеної в заголовку сполуки у вигляді білої твердої речовини. MS(ESI): 230,0 (М+Н+). 1 H ЯМР (300 МГц, CDCl3), 6,87 (м, 4Н), 6,25 (т, J = 4 Гц, 1Н), 4,79 (широкий, 1Н), 4,62 (широкий, 1Н), 3,64 (д, J = 4 Гц, 2Н). Приклад 4 (2S)-(-)-N-(2,3-Дигідро-бензо[1,4]-діоксин-2ілметил)-сульфамід (Сполука №4) Пірокатехін (13,2 г, 0,12 моль) і карбонат калію (16,6 г, 0,12 моль) змішували в ДМФА (250 мл), після чого додавали (2R)-гліцидилтозилат (22,8 г, 0,10 моль) і перемішували реакційну суміш при 60C протягом 24 год. Реакційну суміш охолоджували до кімнатної температури, розріджували крижаною водою (1 л) і екстрагували діетиловим ефіром (4 рази). Об'єднаний органічний розчин промивали 3 рази 10%-им розчином карбонату калію, одноразово водою, одноразово підсоленою водою і випаровували у вакуумі, з отриманням білої твердої речовини, очищеної колонковою флеш-хроматографією (ДХМ:метанол - 50:1), з отриманням ((2S)-2,3-дигідро-бензо[1,4]-діоксин-2іл)-метанолу у вигляді твердої речовини. Отриману тверду речовина (13,3 г, 68 ммоль) розчиняли в піридині (85 мл), охолодженому до 0°С, додавали n-толуолсульфонілхлорид (13,0 г, 68 ммоль), після чого реакційну суміш перемішували при кімнатній температурі протягом 20 год. Реакційну суміш розріджували діетиловим ефіром (1 л) і 1H HCl (1,2 л). Органічний шар виділяли і промивали 2 рази 1H HCl (500 мл), 4 рази водою (150 мл), одноразово підсоленою водою, сушили (MgSO4) і випаровували у вакуумі, з отриманням білої твердої речовини, очищеною за допомогою колонкової флеш-хроматографії (Гептан:ЕА - 2:1) з отриманням (2S)-2,3-дигідро-бензо[1,4]-діоксин-2іл-метилового ефіру толуол-4-сульфонової кислоти у вигляді білої твердої речовини. Білу тверду речовину змішували з фталімідом калію (14,4 г, 78 ммоль) у ДМФА (250 мл) і нагрівали з дефлегмацією протягом 1 год, охолоджували до кімнатної температури і виливали отриману суміш у енергійно перемішувану воду (1,5 л), і перемішували 30 хв. Білу тверду речовину відфільтровували і промивали кілька разів водою, 2%-им розчином NaOH, а потім знову водою, а потім сушили на повітрі з отриманням (2S)-2-(2,-3-дигідробензо[1,4]-діоксин-2-ілметил)-ізоіндол-1,3-діону у вигляді білої порошкоподібної речовини. Отриману білу порошкоподібну речовину змішували з гідразином (2,75 г, 86 ммоль) у EtOH (225 мл), після чого нагрівали з дефлегмацією протягом 2 год, а потім охолоджували до кімнатної температури, додавали 1H HCl до р 1,0 і перемішували протягом 15 хв. Отриманий білий осад 37 відфільтровували і промивали додатковою кількістю EtOH (осад видаляли), після чого фільтрат випаровували у вакуумі, а залишок розділяли між діетиловим ефіром і водяним розчином NaOH. Ефірний розчин сушили (Na2SO4) і випаровували у вакуумі, отримавши як продукт світло-жовту олію. Отриману олію очищували за допомогою колонкової флеш-хроматографії (ДХМ:МеОН - 10:1), з отриманням олії. Частина отриманої олії (4.82 г, 29 ммоль) у 2-пропанолі (250 мл) оброблювали 1H HCl (30 мл) і нагрівали на паровій бані до отримання гомогенного розчину, а потім охолоджували до кімнатної температури. Через 3 год суміш охолоджували на льоді протягом 2 год. Білий пластівчастий осад (відповідна сіль HCl (2S)-C-(2,3дигідро-бензо[1,4]-діоксин-2-іл)-метиламіну) відфільтровували, а потім перекристалізовували з 2пропанолу, з отриманням білої твердої речовини. []D = -69,6 (с = 1,06,EtOH) Отриману білу тверду речовину розділяли між ДХМ і розведеним розчином NaOH, після чого ДХМ сушили (NaSO4) і випаровували у вакуумі з отриманням (2S)-С-(2,3-дигідро-бензо[1,4]-діоксин2-іл)-метиламіну у вигляді олієподібної речовини. []D = -57,8 (с = 1,40, CHCl3) Отриману олієподібну речовину (2,1 г, 12,7 ммоль) і сульфамід (2,44 г, 25,4 ммоль) нагрівали з дефлегмацією в діоксані (75 мл) протягом 2 год, неочищений продукт очищували за допомогою колонкової флеш-хроматографії (ДХМ:МеОН 10:1) з отриманням білої твердої речовини, яку перекристалізовували з ДХМ, з отриманням у вигляді білої кристалічної речовини зазначеної в заголовку сполуки. т. п. 102-103°C [] D = -45,1° (с = 1,05, М); 1 H ЯМР (DMSO d6) 6,86 (м, 4Н), 6,81 (широкий с, 3Н, NH), 4,3 (м, 2Н), 3,97 (дд, J = 6,9, 11,4 Гц, 1H), 3,20 (дд, J = 5,5, 13,7 Гц, 1H), 3,10 (дд, J = 6,9, 13,7 Гц, 1H). Елементний аналіз: Розрахунковий склад: С, 44,25; Н, 4,95; N, 11,47; S, 13,13 Отриманий склад: С, 44,20; Н, 4,69; N, 11,40; S, 13,22. Приклад 5 N-(2,3-Дигідро-бензо[1,4]-діоксин-2-ілметил)N’,N’-диметилсульфамід (Сполука №6) Рацемічний 2,3-дигідро-1,4-бенздіоксин-2ілметиламін (8,25 г, 5,0 ммоль) і триетиламін (1,52 г, 15 ммоль) змішували в ДМФА (10 мл) і охолоджували в крижаній бані в міру додавання диметилсульфамоїлхлориду (1,44 г, 10 ммоль). Потім реакційну суміш перемішували протягом 3 годин з постійним охолоджуванням. Реакційну суміш розділяли між етилацетатом і водою, після чого етилацетатний розчин промивали підсоленою водою, 94079 38 сушили (MgSO4) і випаровували у вакуумі, з отриманням олієподібної речовини. Отриману олієподібну речовину очищували за допомогою колонкової флеш-хроматографії (етилацетат:гептан - 1:1), з отриманням білої твердої речовини, яку перекристалізовували (етилацетат/гексан), з отриманням у вигляді білої пластівчастої речовини зазначеної в заголовку сполуки. т. п. 76-78C MS 273 (MH+) Елементний аналіз: Розрахунковий склад: С, 48,52; Н, 5,92; N, 10,29; S, 11,78 Отриманий склад: С, 48,63; Н, 5,62; N, 10,20; S, 11,90 1 H ЯМР (CDCl3) 6,87 (м, 4Н), 4,59 (широкий м, 1Н, NH), 4,35 (м, 1H), 4,27 (дд, J = 2,3, 11,4 Гц, 1Н), 4,04 (дд, J = 7,0, 11,4, 1Н), 3,36 (м, 2Н), 2,82 (с, 6Н). Приклад 6 N-(2,3-Дигідро-бензо[1,4]-діоксин-2-ілметил)-Nметилсульфамід (Сполука №7) Рацемічний 2,3-дигідро-1,4-бенздіоксин-2ілметиламін (825 мг, 5 ммоль) розчиняли в етилформіаті (15 мл), нагрівали протягом 30 хвилин, після чого випаровували у вакуумі, з отриманням N-(2,3-дигідро-бензо[1,4]-діоксин-2-ілметил)формаміду у вигляді олієподібної речовини. Отриману олієподібну речовину в діетиловому ефірі (25 мл) оброблювали 1M розчином ЛАГ у ТГФ (9,0 мл, 9,0 ммоль) при 0C і перемішували протягом 5 год при кімнатній температурі. Реакційну суміш охолоджували на крижаній бані і розріджували водою (0,50 мл), після чого додавали 3H NaOH (0,50 мл) і воду (0,50 мл). Потім суміш перемішували при кімнатній температурі протягом 1 год. Осад відфільтровували, і фільтрат випаровували у вакуумі, з отриманням залишку, який розділяли між 1H HCl і діетиловим ефіром. Водну фазу нейтралізовували 1H NaOH і екстрагували діетиловим ефіром. Органічну фазу сушили (MgSO4) і випаровували у вакуумі з отриманням (2,3-дигідро-бензо[1,4]-діоксин-2ілметил)-метиламіну у вигляді олієподібної речовини. MS 180 (MH+) 1 H ЯМР (CDCl3) 6,85 (м, 4Н), 4,30 (м, 2Н), 4,02 (дд, J = 7,9, 11,6 Гц, 1Н), 2,85 (м, 2Н), 2,50 (с, 3H) Отриману олієподібну речовину (380 мг, 2,1 ммоль) і сульфамід (820 мг, 8,5 ммоль) змішували в діоксані (15 мл), нагрівали з дефлегмацією протягом 1,5 год і випаровували у вакуумі з отриманням неочищеного залишку. Залишок очищували за допомогою колонкової хроматографії (етилацетат/гептан 1:1), після чого отриману тверду речовину перекристалізовували з етилацетату/гексану з отриманням у вигляді білої твердої речовини 39 зазначеної в заголовку сполуки. т. п. 97-98°С MS 257 (M-1) Елементний Аналіз: Розрахунковий склад: С, 46,50; H, 5,46; N, 10,85; S, 12,41 Отриманий склад: С, 46,48; Н, 5,65; N, 10,90; S, 12,07 1 H ЯМР (CDCl3) 6,86 (м, 4H), 4,52 (широкий с, 2H), 4,46 (м, 1H), 4,29 (дд, J = 2,3, 11,5 Гц, 1H), 4,05 (дд, J = 6,5, 11,5 Гц, 1H), 3,51 (дд, J = 6,7, 14,9 Гц, 1H), 3,40 (дд, J = 5,9, 14,9 Гц, 1H), 2,99 (с, 3Н). Приклад 7 (2S)-(-)-N-(6-хлоро-2,3-дигідро-бензо[1,4]діоксин-2-ілметил)-сульфамід (Сполука №8) Відповідно до методики, представленої в прикладі 4 вище, у реакції брав участь 4-хлоркатехін, у результаті чого отримували суміш (2S)-С-(7хлоро-2,3-дигідро-бензо[1,4]-діоксин-2-іл)метиламіну і (2S)-С-(6-хлоро-2,3-дигідробензо[1,4]-діоксин-2-іл)-метиламіну (приблизно в співвідношенні 3:1 6-хлоро:7-хлоро ізомерів, за даними ОФ ВЕРХ). Отриману суміш розчиняли в 2-пропанолі (100 мл) і додавали 1H розчин HCl у діетиловому ефірі до отримання рН = 1,0. Гідрохлорид, що випав в осад, відфільтровували (2,65 г) і перекристалізовували з метанолу/ІПС, з отриманням білих кристалів. Отримані білі кристали розділяли між ДХМ і розведеним розчином NaOH. ДХМ сушили і випаровували у вакуумі, з отриманням очищеного (2S)С-(6-хлоро-2,3-дигідро-бензо[1,4]-діоксин-2-іл)метиламіну у вигляді олієподібної речовини. []D = -67,8 (с = 1,51, CHCl3) Отриману олієподібну речовину (7,75 ммоль) і сульфамід (1,50 г, 15,5 ммоль) змішували в діоксані (50 мл) і нагрівали з дефлегмацією протягом 2,0 год, після чого суміш охолоджували до кімнатної температури і випаровували у вакуумі з отриманням твердого залишку. Продукт очищували на флеш-колонці, використовуючи ДХМ/метанол 20:1, з отриманням у вигляді білої твердої речовини зазначену в заголовку сполуку. MS 277 (M-1) []D = -59,9° (с =1,11, M) 1 H ЯМР (CDCl3) 6,90 (д, J = 2,2 Гц, 1Н), 6,81 (м, 2Н), 4,76 (м, 1H), 4,55 (с, 2Н), 4,40 (м, 1H), 4,29 (дд, J = 2,4, 11,5 Гц, 1H), 4,05 (дд, J = 7,1, 11,5 Гц, 1H), 3,45 (м, 2Н) Елементний Аналіз: Розрахунковий склад: С, 38,78; Н, 3,98; N, 10,05 Отриманий склад: С, 38,80; Н, 3,67; N, 9,99. Фільтрати кристалізованого гідрохлориду (2S)С-(6-хлоро-2,3-дигідро-бензо[1,4]-діоксин-2-іл)метиламіну, отриманого вище, виділяли (співвід 94079 40 ношення 6-хлоро:7-хлоро ізомерів приблизно 1:1) і випаровували у вакуумі з отриманням сухого залишку, який розділяли між ДХМ (200 мл) і розведеним розчином NaOH (0,5 М, 50 мл). Розчин у ДХМ промивали один раз підсоленою водою, сушили (Na2SO4) і випаровували у вакуумі з отриманням олієподібної речовини, яку очищували за допомогою обернено-фазової ВЕРХ (10-50% ацетонітрилу з 0,16% ТФО у воді і 0,20% ТФО) з отриманням як продукту (2S)-С-(7-хлоро-2,3-дигідробензо[1,4]-діоксин-2-іл)-метиламіну в залишку. Отриманий залишок змішували із сульфамідом (0,90 г, 9,4 ммоль) у діоксані (25 мл) і нагрівали з дефлегмацією протягом 2,5 год, після чого охолоджували до кімнатної температури і випаровували у вакуумі з отриманням олієподібної речовини. Олієподібну речовину очищували за допомогою колонкової флеш-хроматографії з використанням ДХМ/метанол - 10:1, з отриманням (2S)-(-)-N-(7-хлоро-2,3-дигідро-бензо[1,4]-діоксин2-ілметил)-сульфаміду у вигляді білої твердої речовини. MS 277 (M-1) 1 H ЯМР (CDCl3/CD3OD) 6,88 (д, J = 0,7 Гц, 1Н), 6,81 (м, 2Н), 4,37 (м, 1Н), 4,30 (дд, J = 2,3, 11,6 Гц, 1Н), 4,04 (дд, J = 7,0, 11,6 Гц, 1H), 3,38 (м, 2Н). Приклад 8 Хроман-2-ілметилсульфамід (Сполука №10) Хроман-2-карбонову кислоту (4,5 г, 25 ммоль) і ГБТ (3,86 г, 25 ммоль) змішували в ДХМ (40 мл) і ДМФА (10 мл). Диметиламінопропілетилкарбодіімід (ЕДК, 4,84 г, 25 ммоль) додавали при кімнатній температурі, після чого реакційну суміш перемішували протягом 30 хв. Потім додавали гідроксид амонію (2,26 мл, 33,4 ммоль) і перемішували реакційну суміш протягом 16 год. Реакційну суміш розріджували ДХМ (50 мл) і водою (50 мл), після чого рН суміші доводили за допомогою 1H HCl до приблизно рН = 3,0. ДХМ відділяли, після чого водну фазу двічі екстрагували ДХМ. Об'єднану ДХМ фазу сушили (Na2SO4) і випаровували у вакуумі з отриманням олієподібної речовини, яку очищували за допомогою колонкової флешхроматографії (етилацетат) з отриманням олієподібної речовини. Отриману олієподібну речовину (5,35 г, 30 ммоль) у ТГФ (90 мл) перемішували з 1M розчином ЛАГ у ТГФ (36 мл, 36 ммоль), після чого реакційну суміш перемішували при кімнатній температурі протягом 20 год. Потім реакційну суміш розріджували водою, перемішували протягом 2 годин, отриманий розчин декантували, сушили (Na2SO4) і випаровували у вакуумі з отриманням С-хроман-2-іл-метиламіну у вигляді олієподібного аміну. Олієподібний амін (1,63 г, 10 ммоль) і сульфамід (1,92 г, 20 ммоль) змішували в діоксані (50 мл) 41 і нагрівали з дефлегмацією протягом 2 год. Потім розчин охолоджували і випаровували у вакуумі з отриманням олієподібної речовини, яку очищували за допомогою колонкової хроматографії (ДХМ:метанол 10:1), з отриманням білої твердої речовини. Отриману тверду речовину перекристалізовували з етилацетату/гексану з отриманням хроман-2-ілметилсульфаміду у вигляді білої твердої речовини. т. п. 100-101C MS 241 (M-1) Елементний аналіз: Розрахунковий склад: С, 49,57; Н, 5,82; N, 11,56; S, 13,23 Отриманий склад: С, 49,57; Н, 5,80; N, 11,75; S, 13,33. Приклад 9 2-(2,3-Дигідро-бензо[1,4]-діоксин-2-іл)етилсульфамід (Сполука №16) Ціанід калію (2,05 г, 31,5 ммоль) додавали до 2-бромметил-(2,3-дигідробензо[1,4]-діоксину) (6,87 г, 30 ммоль) у ДМСО (90 мл) і перемішували при температурі навколишнього середовища протягом 20 год. Потім реакційну суміш розріджували водою (250 мл) і двічі екстрагували діетиловим ефіром. Діетиловий ефір промивали водою, потім двічі промивали підсоленою водою, сушили (Na2SO4) і випаровували у вакуумі з отриманням 2ціанометил-(2,3-дигідробензо[1,4]-діоксину) у вигляді білої твердої речовини. 1 H ЯМР (CDCl3) 6,89 (м, 4Н), 4,50 (м, 1H), 4,31 (дд, J = 2,3, 11,5 Гц, 1Н), 4,08 (дд, J = 6,2, 11,6 Гц, 1Н), 2,78 (д, J = 6,1, Гц, 2Н). 2-Ціанометил-(2,3-дигідробензо[1,4]-діоксин) розчиняли в ТГФ (50 мл), після чого додавали 1M розчин BH3 у ТГФ (80 мл, 80 ммоль) і нагрівали реакційну суміш з дефлегмацією протягом 5 год, а потім перемішували при температурі навколишнього середовища протягом 16 год. При охолодженні на крижаній бані, рН доводили до 1,0 за допомогою 2H HCl. Потім реакційну суміш перемішували протягом 1 год при кімнатній температурі, після чого випаровували у вакуумі з отриманням олієподібної речовини. Олієподібну речовину розділяли між 3H NaOH і діетиловим ефіром, ефірний розчин промивали підсоленою водою, сушили (Na2SO4) і випаровували у вакуумі з отриманням неочищеного 2-(2,3-дигідробензо[ 1,4]-діоксин-2іл)етил аміну. MS (М+Н)+ 180. Неочищений 2-(2,3-дигідробензо[1,4]-діоксин2-іл) етиламін у діоксані (100 мл) змішували із сульфамідом (3,0 г, 31 ммоль) і нагрівали з дефлегмацією протягом 2 год. Потім розчин охолоджували і випаровували у вакуумі з отриманням жовтогарячого залишку, який очищували за допомогою колонкової хроматографії (ДХМ:МеОН 10:1) з отриманням білої твердої речовини. Тверду 94079 42 речовину перекристалізовували з ДХМ з отриманням у вигляді твердої речовини зазначеної в заголовку сполуки. MS (M-1) 257 Т. п. 101-103C (різн.) 1 H ЯМР (CDCl3): 6,86 (м, 4Н), 4,70 (м, 1Н), 4,52 (з, 2Н), 4,30 (м, 2H), 3,94 (дд, J = 7,4, 11,3 Гц, 1Н), 3,43 (дд, J = 6,4, 12,9 Гц, 2H), 1,94 (дд, J = 6,5, 12,9, 2H). Елементний Аналіз: Отриманий: С, 46,48; Н, 5,60; N, 10,81; S, 12,41 Розрахунковий: С, 46,50; Н, 5,46; N, 10,85; S, 12,41 Приклад 10 (2S)-(-)-N-(6,7-дихлоро-2,3-дигідро-бензо[ 1,4]діоксин-2-іл-метил)-сульфамід (Сполука №29) 4,5-Дихлорокатехол (8,6 г, 48 ммоль) і карбонат калію (6,64 г, 48 ммоль) перемішували в ДМФА (200 мл). Потім додавали (2R)-гліцидилтозилат (9,12 г, 40 ммоль), після чого реакційну суміш перемішували при 60C протягом 24 год. Реакційну суміш охолоджували до кімнатної температури, а потім розріджували крижаною водою (600 мл) і екстрагували діетиловим ефіром (4 рази). Об'єднаний органічний розчин промивали 3 рази 10%им розчином карбонату калію, двічі підсоленою водою, сушили (MgSO4) і випаровували у вакуумі з отриманням в'язкої олієподібної речовини, що представляє собою (2S)-2-(6,7-дихлоро-2,3дигідро-бензо[1,4]-діоксин)метанол. Олієподібний (2S)-2-(6,7-дихлоро-2,3-дигідробензо[1,4]-діоксин)-метанол (6,4 г, 27 ммоль) розчиняли в піридині (50 мл), охолодженому до 0C. Потім додавали n-толуолсульфонілхлорид (5,2 г, 27 ммоль), після чого реакційну суміш перемішували при кімнатній температурі протягом 20 год. Реакційну суміш розріджували діетиловим ефіром і 1H HCl (750 мл), після чого органічний шар відділяли і промивали 2 рази 1H HCl (250 мл), один раз водою (150 мл), двічі підсоленою водою, сушили (MgSO4) і випаровували у вакуумі з отриманням (2S)-6,7-дихлоро-2,3-дигідро-бензо[1,4]-діоксин-2іл-метилового ефіру толуол-4-сульфонової кислоти у вигляді світло-жовтої твердої речовини. 1 H ЯМР (CDCl3): 7,79 (д, J = 8,3 Гц, 2Н), 7,36 (д, J = 8,0 Гц, 2Н), 6,94 (с, 1H), 6,83 (с, 1Н), 4,37 (м, 1Н), 4,2 (м, 3Н), 4,03 (дд, J = 6,3, 11,7 Гц, 1H), 2,47 (с, 3Н). (2S)-6,7-Дихлоро-2,3-дигідро-бензо[1,4]діоксин-2-іл-метиловий ефір толуол-4сульфонової кислоти (8,0 г, 20,5 ммоль) змішували з фталімідом калію (6,1 г, 33 ммоль) у ДМФА (75 мл) і нагрівали з дефлегмацією протягом 1 год, після чого охолоджували до кімнатної температури і вливали у енергійно перемішувану воду (0,5 л), а потім перемішували 30 хв. Білий осад відфільтровували і промивали кілька разів водою, 2% 43 им розчином NaOH, і знову водою, а потім сушили на повітрі з отриманням (2S)-2-(6,7-дихлоро-2,3дигідро-бензо[1,4]-діоксин-2-ілметил)-ізоіндол-1,3діону (6,0 г, 80 %) у вигляді білої порошкоподібної речовини. Білу порошкоподібну речовину змішували з гідразином (1,06 г, 33 ммоль) у EtOH (80 мл) і нагрівали з дефлегмацією протягом 2 год, а потім охолоджували до кімнатної температури. Потім додавали 1H HCl, доводячи рН реакційної суміші до 1,0, після чого реакційну суміш перемішували протягом 15 хв. Білий осад відфільтровували і промивали додатковою кількістю EtOH (осад видаляли), після чого фільтрат випаровували у вакуумі з отриманням залишку, який потім розділяли між діетиловим ефіром і водяним розчином NaOH. Ефірний розчин сушили (Na2SO4) і випаровували у вакуумі з отриманням в'язкої олієподібної речовини, що представляє собою (2S)-2-амінометил-(6,7дихлоро-2,3-дигідро-бензо[1,4]-діоксин). 1 H ЯМР (CDCl3): 6,98 (с, 1H), 6,96 (с, 1H), 4,25 (дд, J = 2,0, 11,2 Гц, 1Н), 4,15 (м, 1Н), 4,0 (м, 1Н), 2,97 (д, J = 5,5 Гц, 2Н). Частина отриманої олієподібної речовини (3,8 г, 16 ммоль) і сульфаміди (3,1 г, 32,4 ммоль) нагрівали з дефлегмацією в діоксані (100 мл) протягом 2 год, і отриманий у результаті неочищений продукт очищували за допомогою колонкової флешхроматографії (ДХМ:МеОН 20:1), з отриманням у вигляді білої твердої речовини зазначеної в заголовку сполуки, яку потім перекристалізовували з етилацетату/гексану, з отриманням зазначеної в заголовку сполуки у вигляді білої кристалічної речовини. MS [M-H]- 311,0 Т.п. 119-121C []D =-53,4° (с =1,17, M) 1 H ЯМР (DMSO d6): 7,22 (с, 1H), 7,20 (с, 1H), 6,91 (широкий с, 1Н), 6,68 (широкий с, 2Н), 4,35 (м, 2Н), 4,05 (дд, J = 6,5, 11,5 Гц, 1H), 3,15 (м, 2Н). Елементний Аналіз: Отриманий: С, 34,52; Н, 3,22; N, 8,95; Cl, 22,64; S, 10,24 Розрахунковий: С, 34,64; Н, 2,68; N, 8,87; Cl, 22,94; S, 10,35. Приклад 11 (2S)-(-)-N-(7-аміно-2,3-Дигідро-бензо[1,4]діоксин-2-ілметил)-сульфамід (Сполука №36) (2S)-(-)-N-(2,3-дигідро-7-нітро-бензо[1,4]діоксин-2-ілметил)-сульфамід (1,2 г, 4,15 ммоль) отримували з 4-нітрокатехіну відповідно до методики, представленої в прикладі 4. Потім (2S)-(-)-N(2,3-дигідро-7-нітро-бензо[1,4]-діоксин-2-іл-метил)сульфамід змішували з 10%-им розчином Pd/C у метанолі (120 мл) і струшували в атмосфері водню (268,9 кпа (39 фунтів/кв. дюйм)) при кімнатній тем 94079 44 пературі протягом 3 год. Тверді частинки відфільтровували і промивали 10%-им M в ДХМ, після чого фільтрат випаровували у вакуумі з отриманням неочищеного продукту. Неочищений продукт розчиняли в 0,2H HCl (25 мл), заморожували і ліофілізовували з отриманням зазначеної в заголовку сполуки у вигляді білої пластівчастої речовини, у формі відповідного гідрохлориду. MS (М+Н)+ 260 1 H ЯМР (ДМСО d6): 10,2 (широкий с, 3Н), 6,86 (м, 1Н), 6,85 (с, 1H), 6,74 (дд, J = 2,5, 8,4 Гц, 1H), 4,22 (м, 2Н), 3,88 (дд, J = 6,7, 11,4 Гц, 1Н), 3,04 (м, 2Н) Приклад 12 (2S)-(-)-N-(7-метил-2,3-дигідро-бензо[1,4|діоксин-2-ілметил)-сульфамід (Сполука №19) Зазначену в заголовку сполуку отримували відповідно до методики, описаної в прикладі 4 вище, з використанням як вихідної сполуки 4метилкатехіну, з отриманням білої твердої речовини, яку перекристалізовували з етилацетату/гексану, з отриманням у вигляді білої твердої речовини зазначеної в заголовку сполуки. MS [M-H] 257 1 H ЯМР (CDCl3): 6,76 (м, 1Н), 6,66 (м, 2Н), 4,80 (м, 1H), 4,57 (широкий с, 1H), 4,40 (м, 1H), 4,28 (м, 1Н), 4,03 (дд, J = 6,9, 11,4 Гц, 1Н), 3,45 (м, 2Н), 2,25 (с, 3Н). Елементний Аналіз: Розрахунковий: С, 46,50; Н, 5,46; N, 10,85; S, 12,41 Отриманий: С, 46,65; Н, 5,60; N, 10,84; S, 12,61. Приклад 13 Формаліновий дослід на мишах (NINDS) Формаліновий тест на мишах являє собою модель гострих і хронічних захворювань, призначену для оцінки здатності тестованої сполуки до зняття болю. У формаліновому тесті на мишах 0,5%-ий формалін вводили п/ш у підошовну область задньої лапки дорослих самців миші з метою викликати болючу відповідь, опосередковану запаленням. Біль виражався у вилизуванні області введення в бімодальному режимі - гострій і хронічній фазі. Гостра фаза виявлялася негайно і тривала приблизно 20 хв після ін'єкції, виражаючись у прямому збудженні нервових волокон. Вилизування відновлялося приблизно через 10 хв (~20 хв після ін'єкції), тривало 10-15 хв і являло собою хронічну фазу, яка, відповідно до висунутої гіпотези, викликана вивільненням медіаторів запалення, таких як цитокіни. Активність у гострій фазі формалінового тесту є індикатором гострого болю, який, як думають, пов'язаний з периферичними нервовими шляхами. Активність у хронічній фазі формалінового тесту 45 показова для централізації і підвищення чутливості до болю у вищих нервових шляхах і, як було показано, добре корелює з ефективністю в моделі хронічного спазму Беннетта, що є моделлю невропатичного болю, і клінічною ефективністю для хронічного невропатичного болю (Vissers і ін., 2003). Сполуку №8 оцінювали у формаліновому тесті на мишах, як описано вище. Сполуку №8 вводили в дозуванні 110 мг/кг, в/ч за 15 хв до ін'єкції формаліну, що, як спостерігали, значно зменшувало відповіді в гострій і хронічній фазах. Для гострої фази зменшення склало 52% від контролю (р
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of benzo-fused heterocycle sulfamide derivatives for the treatment of pain
Автори англійськоюSmith-Swintosky, Virginia L., Reitz, Allen B.
Назва патенту російськоюПрименение бензоконденсированных гетероциклических сульфамидных производных для снятия боли
Автори російськоюСмит-Свинтоски Вирджиния Л., Рейтц Аллен Б.
МПК / Мітки
МПК: A61K 31/357, A61K 31/352, A61K 31/353, A61P 29/00
Мітки: сульфамідних, зняття, застосування, бензоконденсованих, болю, гетероциклічних, похідних
Код посилання
<a href="https://ua.patents.su/29-94079-zastosuvannya-benzokondensovanikh-geterociklichnikh-sulfamidnikh-pokhidnikh-dlya-znyattya-bolyu.html" target="_blank" rel="follow" title="База патентів України">Застосування бензоконденсованих гетероциклічних сульфамідних похідних для зняття болю</a>
Попередній патент: Застосування похідних сульфаміду, які включають гетероцикл, конденсований з бензольним кільцем, для лікування депресії
Наступний патент: Ациклічно-заміщені похідні фуропіримідину та їх застосування для лікування серцево-судинних захворювань
Випадковий патент: Спосіб одержання кристалічного гексагідрату натрійдіамонійфосфату












