Спосіб окислення хлориду заліза (іі)
Номер патенту: 18496
Опубліковано: 25.12.1997
Автори: Галла-Бобик Світлана Василівна, Бузаш Володимир Михайлович, Галла Василь Юрійович
Формула / Реферат
Способ окисления хлорида железа (II) в соленокислой среде продувкой воздуха через его раствор в присутствии кислородных соединений азота в четырех последовательно расположенных реакторах с подачей исходного раствора в последний реактор и выдерживанием раствора в каждом реакторе с подачей кислородных соединений азота в первый реактор при поддержании в нем повышенной температуры в присутствии воздуха, контактирование газовоздушной смеси, выходящей из последнего реактора с исходным раствором в хемоабсорбере, отличающийся тем, что температуру окисления в первом реакторе поддерживают в интервале 45 - 80°C, подачу всего количества расходуемого воздуха осуществляют через первый реактор при мольном отношении и время контактирования воздуха с обрабатываемым раствором в каждом из четырех реакторов - 35 - 60мин, а газовоздушную смесь, выходящую из хемоабсорбера, предварительно пропускают через водный раствор карбамида в присутствии кислорода воздуха.
Текст
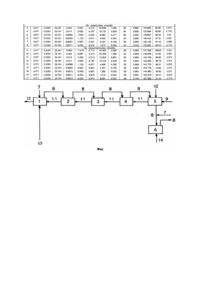
Изобретение относится к способам химического окисления хлорида железа (II) до хлорида железа (III) в солянокислых растворах кислородом воздуха, используя в качестве катализатора систему, состоящую из нитрозильных комплексов железа и монооксида азота, и может быть использовано для химической регенерации отработанных травильных растворов о производстве плат печатного монтажа металлов и сплавов; в водоподготовка - для очистки воды от соединений железа; в производстве коагулянтов для обработки сточных вод на очистных сооружениях; для подачи растворимых и нерастворимых соединений железа (III). Целью изобретения является упрощение процесса за счет устранения стадии рециркуляции окисляемого продукта, увеличение степени хемоабсорбции нитрозных газов и хлористого водорода и повышение экологической безопасности при сохранении выхода готового продукта. На чертеже (фиг.) изображена схема, реализующая предлагаемый способ. На схеме представлены реакторы 1 - 4, хемоабсорбер 5, нейтрализатор газовоздушной смеси 6, трубопровод 7 для подачи воздуха, трубопровод 8 для ввода и вывода газовоздушной смеси, трубопровод 9 для подачи хлористого железа, трубопровод 10 для подачи соляной кислоты, трубопровод 11 для перемещения окисляемого раствора, трубопровод 12 для отвода раствора хлорида железа (III), трубопровод 13 для подачи нитратсодержащего раствора, трубопровод 14 для подачи водного раствора мочевины. Пример 1. В каждый из четырех реакторов 1 4, соединенных между собой трубопроводами для ввода и вывода жидкости и газообразных продуктов, загружают по 75л раствора, содержащего по 0,2303кмоль хлорида железа (II), подкисленного эквимолярным количеством концентрированной (36,32%) соляной кислоты, взятой в количестве 0,2303кмоль (19,636 литра). Хемоабсорбер 5 заполняют исходным солянокислым раствором хлорида железа (II) в количестве 750л, содержащим 392,51кг хлорида железа (II) (2,303кмоль) и 196,36л (2,303кмоль) 36,23% - ной соляной кислоты. При этом весьма существенно, чтобы объем исходного раствора в хемоабсорбере 5 превышал суммарный объем окисляемого раствора, находящегося в реакторах 1 - 4 в два раза и более. Процесс окисления хлорида железа (II) протекает следующим образом. В реактор 1 по трубопроводу 7 подают воздух на продувку. Одновременно при этом осуществляют подвод тепла к реактору 1 и в течение 10мин доводят температуру окисляемого раствора до 85°C. По достижении температуры реакционной смеси 45°C небольшими порциями подают нитрат-ионы в количестве 50 ± 6% от расчетного количества, необходимого для формирования каталитической системы, используемой для окисления раствора хлорида железа (II) в реакторах 1 - 4 (300л раствора). По окончании ввода нитрат-ионов, содержащийся в реакторах 1 - 4 солянокислый раствор хлорида железа (II) продувают воздухом в течение 35 минут. После этого прекращают подачу воздуха на продувку, отключают нагрев реактора 1, готовый раствор хлорида железа (III) перемешивают по трубопроводу 12 из реактора 1 потребителю. В освобожденный реактор 1 по трубопроводу 11 подают окисляемый раствор из реактора 2, в реактор 2 - из реактора 3, в реактор 3 - из реактора 4, в реактор 4 - из хемоабсорбера 5, в хемоабсорбер подают 75л раствора, содержащего 29,251кг (0,2303кмоль) хлорида железа (II) и 19,636л (0,2303кмоль) 36,23% - ной соляной кислоты. Пример 2. Приготовленную как указано в примере 1 реакционную смесь нагревают в реакторе 1 до 75°C в течение 10 минут. Одновременно при этом при достижении температуры 45°C небольшими порциями вводят в реактор 1 нитрат-ионы в количестве 32 ± 6% от расчетного количества, необходимого для формирования каталитической системы, используемой для окисления первых 300л раствора хлорида железа (II). Одновременно с началом подвода тепла к реакционной системе в реакторе 1 подают воздух на продувку реакторов 1 - 4. Длительность продувки - 40 минут. Все остальные операции по окислению хлорида железа (II) осуществляют как описано в примере 1. Пример 3. Вся последовательность операций по окислению хлорида железа (II) - как описано в примере 2. Количество расходуемых нитрат-ионов составляет 12 ± 6% от расчетного для окисления 300л раствора хлорида железа (II). Температура реакционной смеси - 65°C, время продувки воздухом растворов реакторов 1 - 4 - 45мин. Пример 4. Вся последовательность операций по окислению хлорида железа (II) - как описано в примере 2. Расходуемое количество нитрат-ионов от расчетного количества, необходимого для окисления 300л раствора хлорида железа (II). Температура реакционной смеси - 55°C, время продувки реакторов 1 - 4 воздухом - 55 минут. При окислении первой порции 300л раствора хлорида железа (II) расход нитрат-ионов составляет 3,775 - 1,133л 57% - ной азотной кислоты. Окисление последующих порций (по 300л каждая) раствора хлорида железа (II) в вышеуказанном режиме приводит к постепенному насыщению окисляемого раствора компонентами каталитической системы. При этом расход нитратионов постепенно снижается от 3,775 - 1,133л 57% - ной азотной кислоты в первой порции (отвечающее молярному соотношению к десятой пятнадцатой порции (по 300л каждая). В табл.1 представлен выход хлорида железа (III) в % от теоретического в зависимости от температуры раствора в реакторе 1; в табл.2 выход хлорида железа (III) от соотношения и времени продувки окисляемого раствора воздухом; в табл.3 - сравнительные данные, полученные по известному способу и по предложенному, а также представлена зависимость выхода хлорида железа (III) от соотношения и времени продувки раствора хлорида железа (II) воздухом, Объем раствора хлорида железа (II) в одном реакторе 75л, в одной партии - 300л, температура в реакторе 65°C; Согласно изобретению в первом реакторе поддерживают температуру 45 - 80°C (85°C) с подачей всего количества воздуха в первый реактор, очистку газовоздушной смеси от кислородных соединений азота и хлористого водорода осуществляют путем контактирования ее с подкисленным водным раствором мочевины в присутствии кислорода воздуха, что позволяет обезвредить в случае проскока следовых количеств оксидов азота газовоздушную смесь а также довести (снизить) уровень рекомендуемых нитратсодержащих соединений до количества, обеспечивающего молярное соотношение: а окисляемый раствор хлорида железа (II) выдерживают в каждом из реакторов в течение 35 - 45 (50) минут. Выполнение этих требований ведет к некоторому снижению температуры во всех реакторах, что, с одной стороны, снижает скорость процесса окисления хлорида железа (II). Однако, при более низких температурах улучшаются условия хемосорбции кислородных соединений азота, кислорода и хлористого водорода. А увеличение в окисляемом растворе концентрации компонентов каталитической системы где и кислорода с избытком компенсирует снижение скорости процесса окисления хлорида железа (II) от понижения температуры реакционной смеси. Причем этот выигрыш оказался настолько существенным, что стало возможным отказаться от рециркуляции окисляемого раствора. Вследствие этого температура раствора в третьем, и особенно, в четвертом реакторах только незначительно отличается от комнатной. В свою очередь, это обстоятельство позволяет поддерживать температур у в хемоабсорбере на 20 - 25°C ниже, нежели в известном способе. Все это вместе взятое обеспечивает минимальный унос кислородных соединений азота и хлористого водорода из реакторов и хемоабсорбера и позволяет снизить расход вышеуказанных реагентов. Контактирование же выходящей из хемоабсорбера газовоздушной смеси с водным раствором мочевины в присутствии кислорода воздуха позволяет полностью исключить попадание последних в воздушное пространство. В результате этого предложенный способ окисления хлорида железа (II) отвечает самым жестким требованиям экологической безопасности.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for oxidation of ferric chloride (іі)
Автори англійськоюHalla Vasyl Yuriiovych, Buzash Volodymyr Mykhailovych, Halla-Bobyk Svitlana Vasylivna
Назва патенту російськоюСпособ окисления хлорида железа (іі)
Автори російськоюГалла Василий Юрьевич, Бузаш Владимир Михайлович, Галла-Бобик Светлана Васильевна
МПК / Мітки
МПК: C01G 49/10, C01B 9/00
Мітки: заліза, іі, спосіб, окислення, хлориду
Код посилання
<a href="https://ua.patents.su/3-18496-sposib-okislennya-khloridu-zaliza-ii.html" target="_blank" rel="follow" title="База патентів України">Спосіб окислення хлориду заліза (іі)</a>
Попередній патент: Спосіб одержання кольорових зображень на бавовняній тканині
Наступний патент: Спосіб виготовлення прямонакальних стержневих катодів
Випадковий патент: Пристрій для термообробки циліндричних довгомірних виробів