Спосіб визначення активності білоксинтетичної системи клітин крові
Номер патенту: 25765
Опубліковано: 30.10.1998
Автори: Богомаз Тетяна Петрівна, Грицаєнко Юрій Михайлович, Фролов Олександр Кирилович, Федотов Євген Рудольфович
Формула / Реферат
Способ определения активности белоксинтетической системы клеток крови, включающий забор крови, приготовление мазков, фиксацию, обработку акридиновым оранжевым в цитратно-фосфатном буфере, облучение в спектре возбуждения 436нм, измерение интенсивности люминесценции в условных единицах одновременно клеток крови и фона при длине волны 640нм, отличающийся тем, что дополнительно на той же длине волны определяют интенсивность люминесценции фона и по разности интенсивности люминесценции в условных единицах клеток с фоном и фона определяют активность белоксинтетической системы клетки.
Текст
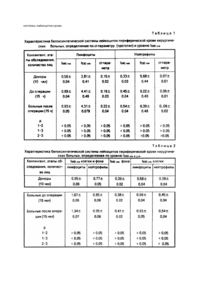
Изобретение относится к биологии к медицине, а именно к иммунологическим методам исследования и касается оптимизации люминесцентного микроскопирования с использованием акридинового оранжевого (АО) для определения активности белоксинтетической системы клеток крови. Известен способ определения функциональной активности клеток, флуорохромированных АО (Зеленин А.В. Люминесцентная цитохимия нуклеиновых кислот. - М.: Наука, 1967), который заключается в приготовлении мазков крови, мазков - отпечатков органов, фиксировании в смеси Карнуа, флуорохромировании АО в цитратно-фосфатном буфере при pH = 4,2, люминесцировании при длине волны 530нм и 640нм и определении aпараметра: отношение интенсивности люминесценции клеток, выраженное в условных единицах (у.е.), в максимуме 640нм (I640нм у.е.) к интенсивности люминесценции в максимуме 530нм (I530нм y.e) - I640нм у.е./I 530нм у.е. . Ме тод основан на двуволновой природе АО. Его мономеры в фиксированных клетках вступают в ассоциации с двуцепочными нуклеиновыми кислотами (НК), к которым относятся дезоксирибонуклеиновая кислота (ДНК) и отдельные участки в функциональной укладке молекул рибонуклеиновых кислот (РНК). Димеры АО соединяются с одноцепочными НК, включающими в основном, РНК и отдельные участки ДНК в стадии метаболической активности (редубликации и транскрипции). Также известен модифицированный способ (прототип) определения белоксинтетической интенсивности лимфоцитов крови (Завгородняя Е.Г., Шахмордонов М.З., Исаева Н.П. Модифицированный метод определения функциональной активности пимфоцитов крови с использованием акридинового оранжевого // Клиническая лабораторная диагностика. - 1993. №2. - С.75 - 76), состоящий в приготовлении мазков крови, фиксировании их в смеси равных количеств этилового спирта и ацетона, флуорохромировании АО на фосфатно-солевом буфере при pH = 4,2 и определении a-параметра (I640нм у.е./I 530нм у.е.). Однако известные способы определения белоксинтетической активности клеток по aпараметру мало пригодны для характеристики циркулирующих клеток крови. Циркулирующие клетки крови: лимфоциты, моноциты, гранулоцити, в отличие от клеток оседлых тканей, например, миэлоидных, лимфоидных тканей, вышли из митотического цикла и находятся в G0 стадии жизненного цикла. В этот период синтез НК находится на минимальном уровне, а ДНК в ядре максимально конденсируется (нарастает двуцепочность). Поэтому активность белоксинтетической системы лейкоцитов определяется, в основном, количеством наработанных еще в миэлоидных и лимфоидных органах РНК, Сделанный вывод подтверждается нашими данными о слабой и недостоверной популяционной вариации I530нм у.е. (двуцепочные НК, в основном, ДНК), тогда как I640нм у.е. (в основном РНК) колеблется в широких пределах (см. таблицы). В этой связи a-параметр не дает однозначной характеристики функциональной активности конкретной клетки крови. Он является отношением интенсивности люминесценции при максимуме 640нм к интенсивности люминесценции при максимуме 530нм и может быть низким при высоких значениях I640нм и I530нм , высоким при низких их значениях и одинаковым у клеток с различной I640нм и I530нм . Кроме того, согласно прототипу, измерение люминесценции клеток проводят вместе с фоном, что завышает результаты собственной люминесценции клеток, т.к. фон имеет собственную люминесценцию. Слабая информативность a-параметра о белоксинтетической функции клеток крови объясняется еще и тем, что лейкоциты различаются по степени дифференцировки. Так, сегментоядерные лейкоциты (нейтрофилы, эозинофилы, базофилы) попадают в кровь на конечных стадиях дифференцировки, тогда как циркулирующие лимфоциты в этом отношении гетерогенны. Большая их часть может после встречи с антигеном и митогеном вступать в митотический цикл, в котором увеличивается доля одноцепочных НК (флуоресцируют при I640нм ). В зрелых гранулоцитах, в которых синтетические процессы НК минимальны, усиливается конденсация ДНК и РНК, в результате чего доля двуцепочных НК, следовательно, интенсивность люминесценции при I530нм , увеличивается и становится значительно выше таковой по сравнению с лимфоцитами (см. таблицу), хо тя плоидность хромосом (ДНК) тех и других клеток одинакова. Лимфоциты периферической крови, в отличие от сегментоядерных лейкоцитов, различаются по степени дифференцировки и функциональной активности их белоксинтетической системы. Но вариации I530нм их ядер также происходят в узких пределах за счет наступившей конденсации ДНК, которая наблюдается в G0 - периоде жизненного цикла лимфоцитов. Метаболическая активность ДНК (редубликация, транскрипция), приводящая к появлению однонитчатых НК, происходила в короткий период времени при иммуногенезе еще в лимфоидных органах. В то же время продукты этой транскрипционной активности - разные виды РНК (информационная, транспортная, рибосомальная), сохраняются в ядре и особенно в цитоплазме клетки значительно дольше, включая и циркулирующие лимфоциты крови. Данный факт объясняет причины значительно меньшей вариации I530нм по сравнению с I640нм . Поэтому все вариации a-параметра в клетках крови, отражающие их белоксинтетическую активность, происходят за счет уровня I640нм . Следовательно, при изучении функциональной активности белоксинтетической системы в клетках периферической крови достаточно и объективней анализировать I640нм вместо a-параметра. Признаками, общими с существенными признаками прототипа являются: забор крови, приготовление мазков, их фиксация, обработка акридиновым оранжевым в цитратно-фосфатном буфере, облучение в спектре возбуждения 436нм, измерение интенсивности люминесценции в условных единицах одновременно клеток крови и фона при длине волны 640нм. Признаки, отличные от прототипа: измерение интенсивности люминесценции фона в условных единицах при длине волны 640нм, вычисление разности интенсивности люминесценции клеток крови и фона в условных единицах. В основу изобретения поставлена задача повышения точности, объективности, оперативности и экономичности оценки состояния белоксинтетической системы лейкоцитов периферической крови путем измерения интенсивности люминесценции лимфоцитов, обработанных АО при длине волны 640нм и определения разности интенсивности люминесценции в условных единицах клеток крови с фоном и фона, что позволяет обеспечить определение активности белоксинтетической системы лейкоцитов крови. Способ осуществляют следующим образом: проводят забор крови из пальца или вены в пробирки с антикоагулянтом, приготавливают мазки, фиксируют и х в смеси абсолютного этилового спирта и ацетона в отношении 1 : 1, фиксированные препараты проводят через спирты понижающей концентрации 96° - 15мин, 60° - 10мин, 30° - 5мин, ополаскивают в дистиллированной воде, инкубируют в цитратнофосфа тном буфере pH = 6,0, обрабатывают 10мин в растворе АО 1 : 25000 на том же буфере, дважды отмывают в нем от непрореагировавшего АО по 2мин, накрывают покровным стеклом и окантовывают 30% раствором полистирола от высыхания препарата, облучают в спектре возбуждения 436нм, определяют интенсивность люминесценции 640нм в условных единицах клеток с фоном, определяют интенсивность люминесценции 640нм в условных единицах фона, по разности интенсивности люминесценции клеток с фоном и фона определяют активность белоксинтетической системы клеток крови. Измерение люминесценции проводят в 100 клетках, набирая их в 5 - ти местах мазка. В этих же местах определяют и фоновые значения I640нм у.е. Белоксинтетическую активность каждой клетки определяют вычитанием средних фоновых значений I640нм у.е. от I640нм у.е. исследуемой клетки и фона. Пример конкретного выполнения. Обследовано 15 хирургических больных, оперированных по поводу опухолей головного мозга различной локации. Обследование проводили до операции и сразу после ее окончания. Группой сравнения служили 10 доноров крови, сходные с больными возрастом. Препараты готовили по описанному выше способу, уровень люминесценции определяли на микроспектрофлуориметре - 2 (МСФ-2). Данные люминесценции согласно прототипу и заявляемому способу представлены в табл.1 и 2 соответственно. Из табл.1 (прототип) видно, что даже после сильного антигенного и стрессорного воздействия на организм, которым сопровождается операция, a-параметр в лейкоцитах крови не достигает достоверных различий после операции у обследованных больных, а также при сравнении данного показателя у доноров, вследствие отсутствия сдвигов I 530нм до и после операции. Значительные сдвиги показателей люминесценции происходили только в спектре 640нм. Поэтому определение ее интенсивности для характеристики функционального состояния клеток кроши согласно заявляемому способу представлено в табл.2. В нейтрофилах различие данного показателя достигали критических значений только между донорами и больными после операции. Однако небольшое увеличение I640нм в нейтрофилах больных после операции по сравнению с исходным уровнем не достигли уровня значимости (0,045 ± 0,04 и 0,54 ± 0,04у.е. p > 0,05). Это и понятно, так как нейтрофилы находятся на конечной стадии дифференцировки, вкоторых для выполнения их функций уже наработаны специфические структуры и ве щества во время предшествующей активности белоксинтетической системы клетки в миэлоидных органах. Высокие и достоверные изменения интенсивности люминесценции происходят в лимфоцитах только в спектре 640нм (однонитчатые НК). Лимфоциты являются иммунокомпетентными клетками, которые активируются антигенами и аутогенами, превращаясь в эффекторные и регуляторные клетки. В циркулирующи х лимфоцитах крови накапливаются однонитчатые НК (в основном РНК) во время предшествующего иммуногенеза в лимфоидных органах. В ходе операции происходит повреждение структуры тканей, накапливаются аутоантигены. Морфогенетическая, гомеостатическая функция лимфоцитов направлена на устранение клеточного детрита и регуляции процессов репаративной регенерации. В них активируе тся белоксинтетическая система, сопровождающаяся накоплением однонитчатых НК (I640нм положительна), в результате чего I640нм в конце операции значительно повышается. Поэтому уровень сдвига I640нм в лимфоцитах, является показателем активности в них белоксинтетической системы, а, следовательно, и их иммунологической активности. Данные табл.2 также подтверждают наш вывод о том, что статистически стабильный уровень I530нм в периферических клетках крови связан с конденсацией хроматина (ДНК) ядра. Деконденсация хроматина сопровождается появлением одноцепочных участков ДНК и синтезом РНК. Однако она наблюдается при активации белоксинтетической системы клеток, находящихся еще в миэлоидных и лимфоидных органах. Деконденсация ДНК является кратковременным процессом. В мигрировавших в периферическую кровь лейкоцитах хроматин ядра опять конденсируется, так как клетки выходят из митотического цикла и находятся в G0 стадии. Поэтому I530нм , отражающая степень конденсации НК и появление их двуцепочных структур довольно стабильный показатель для данного типа клеток периферической крови и не может отражать степень предшествующей активации белоксинтетической системы в кроветворных и лимфоидных органах. Однако функциональным следом этой активности является накопление в клетках в периферической крови однонитчатых НК в основном РНК, люминесцирующи х в спектре 640нм, которые сохраняются в циркулирующи х лимфоцитах крови, легко доступных для анализа при взятии крови на анализ. Следовательно, наиболее объективным показателем динамики интенсивности люминесценции периферических клеток крови, обработанных АО, является уровень I640нм , который отражает активность белоксинтетической системы лейкоцитов крови.
ДивитисяДодаткова інформація
Автори англійськоюFrolov Oleksandr Kyrylovych, Fedotov Yevhen Rudolfovych, Grytsaenko Yurii Mykhailovych
Автори російськоюФролов Александр Кириллович, Федотов Евгений Рудольфович, Грицаенко Юрий Михайлович
МПК / Мітки
МПК: G01N 33/48, G01N 1/28, G01N 21/64
Мітки: спосіб, клітин, визначення, крові, білоксинтетичної, активності, системі
Код посилання
<a href="https://ua.patents.su/3-25765-sposib-viznachennya-aktivnosti-biloksintetichno-sistemi-klitin-krovi.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення активності білоксинтетичної системи клітин крові</a>
Попередній патент: Спосіб перетворення сигналів і пристрій для його здійснення
Наступний патент: Пристрій для спінення бісерного полістиролу
Випадковий патент: Електрообігрівач