Спосіб одержання s(-)-3-арил-1-метил-3-трифторометил-3н-піролізинів
Номер патенту: 37018
Опубліковано: 10.11.2008
Автори: Вовк Михайло Володимирович, Сукач Володимир Андрійович, Головач Наталія Михайлівна
Формула / Реферат
Спосіб одержання S(-)-3-apил-1-метил-3-трифторометил-3H-піролізинів загальної формули:
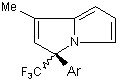 ,
,
де Аr =Ph, 4-FC6H4, 4-MeC6H4, 4-MeOC6H4,
який відрізняється тим, що S(-)-4-аміно-4-арил-5,5,5-трифторопентан-2-они піддають взаємодії з 1,5-диметокситетрагідрофураном при кип'ятінні в оцтовій кислоті з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання S(-)-3-apил-1-метил-3трифторометил-3H-піролізинів загальної формули: 2 3 37018 трифторопентан-2-они піддають взаємодії з 1,5димет-окситетрагідрофураном при кип'ятінні в оцтовій кислоті. Цільові продукти виділяють з реак ційної суміші стандартними методами. Виходи складають 67-89%, оптична чистота 72-87%. F3C F3C Ar 4 Me NH2 O + 1200C OMe O OMe -2MeOH Ar Me N Me O N F3C Ar де Аr=Ph, 4-FC 6H4, 4-MeC6H4, 4-MeOC 6H 4 Запропонований синтетичний варіант є втіленням препаративного підходу до хіральних 3Hпіролізинів, які можуть знайти застосування як «будівельні блоки» в синтезі трифторометилвмісних аналогів природних сполук, а також у вигляді похідних можуть бути випробувані як фармацевтичні препарати. Метод є ефективним для одержання похідних 3H-піролізину високої оптичної чистоти на основі доступних хіральних синтонів - S(-)4-аміно-4-арил5,5,5-трифторопентан-2-онів [10], оскільки в процесі перетворення не зачіпляється хіральний атом вуглецю, а тому незмінною залишається абсолютна конфігурація кінцевих продуктів. Отриманий результат не був заздалегідь передбачуваним, оскільки понижена основність аміногрупи в ви хідних амінокетонах, обумовлена як акцепторним характером трифторометильної групи, так і стеричним впливом арильного замісника, могла бути перешкодою у взаємодії з 1,5диметокси-тетрагідрофураном [11], що повинно було приводити до проміжних 4-(N-піроло)-4-арил5,5,5-трифторопентанонів. Насправді ж виділення цільових продуктів засвідчує, що в процесі реакції має місце анелювання нового пірольного циклу до уже наявного пірольного ядра. При цьому варто зазначити, що такий процес відбувається у відносно м'яких умовах (кип'ятіння в оцтовій кислоті впродовж 0.5год), що вигідно відрізняє знайдену реакцію від процесу електрофільної циклізації 1ацетоацетил-3-феніліндолу в бензопіролізин-3-он, яка реалізується тільки в середовищі поліфосфорної кислоти [12,13]. Індивідуальність та склад синтезованих продуктів доказані методами хроматомас-спектрометрії, будова - ІЧ, Я МР1Н, 19F та 13С спектроскопії, а оптичні властивості - вимірюванням кутів питомого обертання. Корисна модель ілюструється загальним способом отримання S(-)-3-арил-1-метил-3трифторометил-3Н-піролізинів і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання S(-)-3-apил-1метил-3-трифторометил-3Н-піролізинів. До розчину 0.0016 моль S(-)4-аміно-4-арил5,5,5-трифторопентан-2-ону в 10мл оцтової кислоти додавали 0.21г (0.0016 моль) 1,5диметокситетрагідрофурану і кип'ятили впродовж 30-40хв. Розчинник упарювали, залишок промивали водою (2x20мл) та екстрагували діетиловим етером (2x10мл). Органічний шар сушили над безводним Na2SO4, відфільтровували і упарювали Приклад 1 S(-)-1-Метил-3-(трифторометил)-3-феніл-3Нпіролізин Вихід 89%, в'язке масло. Спектр ЯМР 1Н, δ, м.д.: 2.10 с (3Н, СН3), 6.03с (1Н, СН), 6.10с (1Н, СН), 6.40с (1Н, СН), 7.01с (1Н, СН), 7.32-7.39м (5Наром.). Спектр ЯМР 19F, δ, м.д.: -75.01с. Спектр ЯМР 13С, δ, м.д.: 12.49 (CH 3-С1) 73.8кв (С3, J=30.1Гц), 99.21(С6), 113.34(С7), 118.20(С2), 124.7кв (CF3, J=283.6Гц), 124.92(С5), 126.65(С4'), 128.63(С2',С6'), 128.87(С3',С5'), 134.06(С1), 1’ 8 20 134.87(C ), 142.30(C ). Rf =0.70. [α]D = -345.83 (с=1.8, МеОН). Знайдено, %: С 68.56; Н 4.64; N5.48. C15H12F 3N. Вирахувано, %: С 68.44; Н4.59; N5.32. Приклад 2 S(-)-1-Метил-3-(трифторометил)-3-(4фторофеніл)-3Н-піролізин Вихід 83 %, в'язке масло. Спектр ЯМР 1Н, 5,м.д.: 2.11с (3Н, СН3), 6.00с (1Н, СН), 6.11с (1Н, СН), 6.41с (1Н, СН), 6.99с (1H, СН), 7.07т (2Н, аром, J=8.5Гц), 7.31т (2Н, аром., J=8.5Гц). Спектр ЯМР 19 F, δ, м.д.: -75.14с, -114.162с. Спектр ЯМР 13 С, δ, м.д.: 12.46(СН3-С1), 73.3кв (С3, J=31.4Гц), 99.47(С6), 113.63(С7), 115.68(С3' ), 115.94(С5' ), 118.01(С5), 124.6кв (CF3, J=284.1Гц), 124.84(С2), 128.67(С2' ,С6' ), 129.95(С1), 135.94(С1’), 142.26(С8), 163.7 д (С4' , JC-F=248.9Гц). Rf=0.80. [α]D20= -338.27 (с=1.6, МеОН). Знайдено, %: С64.18; Н4.14; N5.08. C16H14F 3NO. Вирахувано, %: С64.06; Н3.94; N4.98. Приклад 3 S(-)-1-Метил-3-(4-метилфеніл)-3(трифторометил)-3Н-піролізин Вихід 67 %, в'язке масло. Спектр ЯМР 1Н, δ, м.д.: 2.09с (3Н, СН3), 2.35с (3Н, СН3), 6.02с (1H, СН), 6.09с (1Н, СН), 6.40с (1Н, СН), 7.01с (1Н, СН), 7.15-7.23м (4Наром.). Спектр ЯМР 19F, δ, м.д.: -75.14с. Спектр ЯМР 13С, δ, м.д.: 12.50 (СН3-С1), 21.02 (СН3-С4’), 73.6кв (С3, J=30.1Гц), 99.09(С6), 113.23(С7), 118.14(С2), 124.7кв (CF3, J=284.1Гц), 125.17(С5), 126.55(С2' ,С6' ), 129.57(С3' ,С5' ), 131.03(С1), 1’ 4' 8 135.53(С ), 138.59(С ), 142.29 (С ). Rf =0.78. [α]D20= -292.97 (с=0.26, МеОН). Знайдено, %: С69.66; Н5.24; N5.19. C16H14F3N. Вирахуваного: С69.30; Н5.09; N5.05. Приклад 4 S(-)-1-Метил-3-(4-метоксифеніл-)3(трифторометил)-3Н-піролізин 5 37018 Вихід 89%, в'язке масло. Спектр ЯМР 1Н, δ, м.д.: 2.09с (3Н, СН3), 3.80с (3Н, СН3О), 6.02с (1H, СН), 6.08с (1H, СН), 6.39с (1Н, СН), 6.91д (2Н,аром., J=8.0 Гц), 7.00с (1Н, СН), 7.27д (2Н, аром., J=8.0Гц). Спектр ЯМР 19F, δ, м.д.: -75.34с. Спектр ЯМР 13С, δ, м.д.: 12.48 (СН3-С1), 55.31 (СН3О-С4' ), 73.40кв (С3, J=30.1Гц), 55.31(С6), 99.08(С7), 113.25(С2), 114.23(С3' ,С5' ), 118.04(С5), 124.7кв (CF3, J=282.9Гц), 125.17(С1), 2' 6' 1’ 8 127.99(С ,С ), 135.43(C ), 142.26(C ), 159.74(C4' ). Rf =0.79. [α]D20= -417.20 (с=0.33, МеОН). Знайдено, %: С65.67; Н4.94; N4.88. C16H14F 3NO. Вирахувано, %: С65.52; Н4.81; N4.78. Література l. Flitsch W., Jones G. Advances in Heterocyclic Chemistry, Katritzky A.R., Boulton A.J., Eds. Academic Press, New York, 1984.- Vol.37.- P. 1-66. 2. Машковский М.Д. Лекарственные средства. Т.2. Москва, Новая волна, 2000.- С.439. 3. Nakatsubo F., Cocuzza A.J., Keeley D.E., Kishi Y. Synthetic studies toward Mitomicins. 1. Total synthesis of Deiminomitomycin A // J. Amer. Chem. Soc-1977.- Vol.99, №14.- P.4835-4836. 4. Nakatsubo F., Fukuyama Т., Cocuzza A.J., Kishi Y. Synthetic studies toward Mitomicins. 2. Total synthesis of dl-Porfiromycin // J. Amer. Chem. Soc1977.- Vol.99, №24.- P.8115-8116. 5. Fukuyama Т., Yang L. Total synthesis of Mitomycins via Isomitomycin A // J. Amer. Chem. Soc- 1987.- Vol.109, №25.- P.7881-7882. 6. Shaw K.J., Luli J.R., Rapoport H. Rotes to Mitomycins. Chirospesific synthesis of Комп’ютерна в ерстка О. Рябко 6 Aziridinomitosenes // J. Org. Chem.- 1985.Vol.50,№23.- P.4515-4523. 7. Rebek J.J., Shaber S.H., Shue Y-K., Gernet J.C., Zimmerman S. Total synthesis of Mitosene // J. Org. Chem.- 1984.- Vol.49,№26.- P.5164-5174. 8. Schweizer E.E., Light K.,K. Reactions of phosphorus compound. X. Preparation of pyrrolizine compounds from allyland substituted allyltriphenylphosphonium salts// J. Org. Chem.1966.- Vol.31, №9.- P.2912-2915. 9. Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications. Eds. R.Filler, Y.Kobayashi, L.M.Yagupolski. Amsterdam.: Elseiver, 1993. 10. Sukach V.A., Golovach N.M., Pirozhenko V.V., Rusanov E.B., Vo vk M.V. Convenient enantioselective synthesis of β-trifluoromethyl- βaminoketones by organocatalytic asymmetric Mannich reaction of trifluoromethyl ketimines with acetone // Tetrahedron: Assymetry.- 2008.- Vol.19.P.761-764. 11. Josey A.D., Jenner E.L. N-Functionally substituted pyrroles // J. Org. Chem.- 1962.Vol.27,№7.- P.2466-2470. 12. Franke U., Roder E. 1,7-Zyklisierung von Acetoacetylindolen // Arch. Pharm.-1976.Vol.309,№3.- P.185-189. 13. Franke U., Wirthlin Т., Roder E. 1,2Zyclisierungs reaktionen on indoloderivater. 6. Zur dimerisierung von 1-methyl-8-phenyl-3H-pyrrolo-[l,2a]indol-3-on//Arch. Pharm.- 1976.- Vol.309,№H._ p.937-939. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of s(-)-3-aryl-1-methyl-3-trifluoromethyl-3h-pyrolyzines
Автори англійськоюVovk Mykhailo Volodymyrovych, Sukach Volodymyr Andriiovych, Holovach Natalia Mykhailivna
Назва патенту російськоюСпособ получения s(-)-3-арил-1-метил-3-трифторометил-3н-пиролизинов
Автори російськоюВовк Михаил Владимирович, Сукач Владимир Андреевич, Головач Наталия Михайловна
МПК / Мітки
МПК: C07B 53/00, C07D 209/00
Мітки: спосіб, s(-)-3-арил-1-метил-3-трифторометил-3н-піролізинів, одержання
Код посилання
<a href="https://ua.patents.su/3-37018-sposib-oderzhannya-s-3-aril-1-metil-3-triftorometil-3n-piroliziniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання s(-)-3-арил-1-метил-3-трифторометил-3н-піролізинів</a>
Попередній патент: Гідроциклонний апарат
Наступний патент: Пристрій надвисокочастотної електротерапії







