Спосіб одержання s(-)-1,4-діарил-4-трифторометил-6-метил-3,4-дигідропіримідин-2(1н)-онів
Номер патенту: 34965
Опубліковано: 26.08.2008
Автори: Вовк Михайло Володимирович, Сукач Володимир Андрійович, Головач Наталія Михайлівна
Формула / Реферат
Спосіб одержання S(-)-1,4-діарил-4-трифторометил-6-метил-3,4-дигідропіримідин-2(1Н)-онів загальної формули:
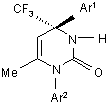 ,
,
де Аr1 = Ph, 4-MeC6H4, 4-FC6H4,
Ar2 = 4-FC6H4, 4-СlС6Н4, 4-трет.-ВuС6H4, 3-CF3C6H4,
3,4-С12С6Н3, 3-С1-4-Ме-С6Н3,
який відрізняється тим, що S(+)-4-аміно-4-арил-5,5,5-трифторпентан-2-онів вводять в реакцію з арилізоціанами при нагріванні в апротонному розчиннику при 80 °С, а отримані N-арил-N'-[(1-арил-3-оксо-1-трифторометил)бутил]сечовини піддають нагріванню в оцтовій кислоті при 115-120 °С з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання S(-)-1,4-діарил-4трифторометил-6-метил-3,4-дигідропіримідин2(1Н)-онів загальної формули: 2 3 34965 4 синтетичних методів. В основі першого з них леЗадачею корисної моделі є спосіб отримання жить конденсація 1,1-диметил-3нових оптично активних похідних 1,4-діарил-4оксобутилізоціанату з анілінами [5]. Вагомим нетрифторометил-6-метил-3,4-дигідрошримідин-2доліком способу є використання високотоксичного онів загальної формули: фосгену для синтезу 1,1-диметил-3Ar1 CF3 оксобутилізоціанату з відповідного аміну. Недоліком другого підходу, який ґрунтується на відновH N ленні 1,4,6-тризаміщених піримідин-2-онів магнійабо літійорганічними сполуками є утворення поруч N Me O з цільовими сполуками ізомерних 1-арил-4,6,6тризаміщених 3,4-дигідропіримідин-2(1Н)-онів [6]. Ar2 В третьому з описаних методів [7] важкодоступний де Аr1=Ph , 4-MeC 6H4, 4-FC 6H4 перхлорат 1-феніл-4(2-метилпентанон-4-ілAr2=4-FC 6H4, 4-ClC6H4, 4- mреm.-BuC6H4, 32)тетразолію при нагріванні в диметилсульфоксиді CF3C6H4, поруч з 4,4-дигідро-4,4,6-триметил-13,4- C1 2C6H3, 3-Cl-4-Me-C 6H3 фенілпіримідин-2(1Н)-оном утворює 3,4,5,6Спосіб отримання сполук, які заявляються, тетрагідро-4,4-диметил-1-феніл-6полягає в тому, що S(+)-4-аміно-4-діарил-5,5,5метилінденпіримідин-2(1Н)-он у спів-відношенні трифторопентан-2-они піддають взаємодії з арилі6:1. Описані методи, окрім наведених суттєвих зоціанатами при нагріванні в апро тонному розсинтетичних обмежень, не дають можливості чиннику при 80°С, а отримані N-арил-N’-[(1-арил-3отримувати оптично активні дигідропіримідини, оксо-1-трифторометил)бутил]сечовини нагрівають зокрема, і з трифторометильною групою в полов оцтовій кислоті при 115-120°С. Цільові продукти женні 4, що може значно розширити спектр фарвиділяють з реакційної суміші стандартними метомакологічних властивостей цільових продуктів. дами. Виходи складають 85-97%, оптична чистот а 66-88%. O CF3 Ar1 NH2 Me + Ar2 N O 800 C Ar 1 C F3 O CF3 120 0C Ar1 HN O HN Me N O Ar2 Ar 2 де Аr1=Ph , 4-MeC 6H4, 4-FC 6H4 Ar2=4-FC 6H4, 4-СlС6Н4, 4-mреm.-ВuС6Н4, 3CF3C6H4, 3,4- Сl2С6Н3, 3-Сl-4-Ме-С6Н3 Запропонований спосіб є реалізацією нового підходу до нерацемічних сполук, які можуть знайти практичне застосування як фармацевтичні препарати, оскільки, як нещодавно було встановлено Sенантіомери 3,4-дигідропіримідин-2-онів виявляють набагато вищу фармакологічну активність, порівняно з рацемічною формою [8]. Метод є е фективним для отримання похідних 3,4-дигідропіримідин-2-онів високої оптичної чистоти на основі доступних хіральних син тонів - S (+)-4-аміно-4-арил-5,5,5-трифторопентан-2-онів [9], що в свою чергу вирішує проблему синтезу цільових сполук в потрібних як для випробовування, так і для впровадження об’ємах. Зазначимо, що спосіб розділення рацемічних 3,4-дигідропіримідин-2-онів за допомогою високоефективної рідинної хроматографії з використанням хіральних стаціонарних фаз [8, 10] дає змогу одержувати тільки мікрокількості енантіомерів. Отриманий результат не був заздалегідь передбаченим, оскільки, завдяки пониженій нуклеофільності аміногрупи в вихідних амінокетонах, обумовленій впливом акцепторної трифторметильної групи, не вдається здійснити її карбамоїлювання такими високоелектрофільними реагентами як алкілізоціанатами та арилізоціанатами. Сам перебіг процесу циклоконденсації S(+)-4аміно-4-діарил-5,5,5-трифторопентан-2-онів з арилізоціанатами є двохстадійним і на першому етапі характеризується утворенням S(-)-N-apил-N’-[(lapил-3-оксо-1-трифторометил)бутил]сечовин, які при нагріванні в кислому середовищі дають цільові S(-)-3,4-дигідропіримідин-2-они. Обидва типи перетворень не зачіпають хірального вуглецевого центра, а тому незмінною залишається абсолютна конфігурація як проміжних, так і кінцевих продуктів. Методом спектроскопії ЯМР 19F з використанням хіральних зсуваючи х реагентів встановлено, що при цьому також не знижується їх оптична чистота. Індивідуальність та склад синтезованих проміжних та цільових продуктів доведені результатами хроматомас-спектрометрії, будова -ІЧ, ЯМР 1 H, 19F та 13С спектрами, а оптичні властивості вимірюванням кутів питомого обертання. Корисна модель ілюструється загальним способом отримання S(-)-N-apил-N’-[(1-арил-3-оксо-1трифторометил)бутил]сечовин та S(-)-4-аміно-4діарил-5,5,5-трифторопентан-2-онів і фізикохімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання S(-)-N-apил-N’[(1-apил-3-оксо-1-трифторометил)бутил]сечовин. До розчину 0,02 моль S(+)-4-аміно-4-арил5,5,5-трифторопентан-2-ону в 40мл сухого бензолу або толуолу додавали 0,02 моль арилізоціанату і нагрівали при 80°С впродовж 5 годин, утворений 5 34965 6 осад відфільтровували і кристалізували із суміші 17Гц,), 3.80д (1H, СН2, J = 16.5Гц), 6.30с (1Н, NH), бензол - гексан, 1:2. В разі 4-хлорфенілізоціанату 6.90-7.06м (2Наром.), 7.20с (1H, NH), 7.27-7.47м та 3,4-дихлорфенілізоціанату отримані сполуки (6Наром.), Спектр ЯМР 19F (CDCl3, м.д.): - 75.18. використовували для подальшого перетворення [a]D20=-46.52 (с = 0.44; МеОН). без додаткового очищення. Знайдено, %: С 57.57; Н 4.49; N 7.09. Приклад 1 C19H18F 3N2O 2Cl. Вирахувано, %: С 57.22; Н 4.55; S(-)-N-(4-Фторофеніл)-N’-[3-оксо-1-феніл-lN7.02. (трифторометил)бyтил]сечовина. Вихід 60%, т.пл. Приклад 6 168°С. Спектр ЯМР 1Н (CDCl3, м.д.): 2.18с (3Н, S(-)-N-(3-Хлоро-4-метилфеніл)-N-[3-оксо-1СН3), 3.48д (1Н, СН2, J=17Гц,), 3.81д (1Н, СН2, феніл-1-(трифторо-метил)бутил]сечовина. Вихід J=17Гц,), 6.23с (1Н, NH), 6.87с (1H, NH), 6.87-6.98м 74.6%, т.пл. 166°С. Спектр ЯМР 1Н (D MSO-d6, (2Hаром.), 7.18-7.21м (2Наром.), 7.34-7.40м м.д.): 2.12с (3Н, СН3), 2.24с (3Н, СН3), 3.65д (1Н, (5Наром.), 7.45д (2Наром., J=7.5Гц). Спектр ЯМР СН2, J = 16.5Гц), 4.03д (1Н, СН2, J = 16Гц), 6.9319 F (CDC13, м.д.): - 75.45. Спектр ЯМР 13С (CDCl3, 7.00м (2Наром., NH), 7.12-7.21м (3Наром.), 7.56м.д.): 31.75(СН3), 43.97(СН2), 63.16кв (С1, 7.61м (3Наром.), 8.84с (1Н, NH). Спектр ЯМР 19F J=27.6Гц), 115.62, 115.79, 122.94, 126.17, 128.62, (DMSO-d6, м.д.): -75.87; -114.79. [a]D20=-18.98 (с = 128.68, 134.04, 136.47 (аром.), 127.65кв (CF3, 0.43; МеОН). Знайдено, %: С 54.49; Н 4.19; N 6.59. J=287.9Гц), 154.85 (С=О ), 205.21 (С=О ). [a]D20=C19H17F4N2 O2Cl. Вирахуваного: С 54.75; Н 4.11; N 7.54 (с=0.66; МеОН). Знайдено, %: С 58.48; Н 4.24; 6.72. N 7.77. C18H16F 4N2O 2. Вирахуваного: С 58.70; Н Приклад 7 4.38; N 7.61. S(-)-N-(4-трет.-.Бутилфеніл)-N’-[3-оксо-1Приклад 2 феніл-1-(трифторо-метил)бутил]сечовина. Вихід S(-)-N-(4-Фторофеніл)-N’-[3-оксо-1-феніл-170.5%, т.пл. 95°С. Спектр ЯМР 1Н (DMSO-d6, м.д.): (трифторометил)бут-ил]сечовина. Вихід 75%, т.пл. 1.25с (3Н, СН3), 2.12с (3Н, СН3), 3.65 д (1Н, СН2, J 178°С. Спектр ЯМР 1Н (CDCl3, м.д.): 2.19с (3Н, = 16.5Гц), 4.06 д (1Н, СН2, J = 16Гц), 6.93-7.00м СН3), 3.51д (1Н, СН2, J=17,5Гц,), 3.76д (1Н, СН2, (2Наром., NH), 7.12-7.21м (3Наром.), 7.56-7.61м J=17,5Гц,), 6.38с (1Н, NH), 7.18с (1Hаром, J = (3Наром.), 8.84с (1Н, NH). Спектр ЯМР 19F (DMSO8.5Гц.), 7.27-7.55м (7Hаром.). Спектр ЯМР 19F d6, м.д.): -75.87; -114.79. [a]D20=-10.33 (с = 0.92; 20 (CDC13, м.д.): - 75.43. [a]D =-37.69 (с = 0.26; МеМеОН). Знайдено, %: С 62.29; Н 5.13; N 6.51. ОН). Знайдено, %: С 56.47; Н 4.14; N 7.57. C22H23F 4N2O 2. Вирахуваного: С 62.55; Н 5.25; N C18H16F 3N2O 2Cl. Вирахуваного: С 56.19; Н 4.19; N 6.63. 7.28. Загальний спосіб одержання S(-)-1,4-діарил-4Приклад 3 трифторметил-6-метил-3,4-дигідропіримідин-2-онів S(-)-N-(3,4-Дихлорофенілфеніл)-N’-[3-оксо-1Розчин 0,001 моль S(-)-N-[-арил-N-[(1-арил-3феніл-1-(трифтороме-тил)бутил]сечовина. Вихід оксо-1-трифторо-метил)бутил]сечовини в 10мл 80%, т.пл. 165°С. Спектр ЯМР 1Н (CDCl3, м.д.): оцтової кислоти кип’ятили впродовж 4год, розчин2.26с (3Н, СН3), 3.56д (1Н, СН2, J = 16.5Гц), 3.78д ник упарювали, до залишку додавали 5мл води, (1Н, СН2, J = 16.5Гц), 6.42с (1Н, NH), 6.95д твердий продукт відфільтровували, сушили на (1Hаром., J = 9Гц), 7.18д (1Hаром., J = 8.5Гц), 7.38повітрі і кристалізували із суміші метанол - вода, 7.49м (6Наром.), 7.55с (1H, NH). Спектр ЯМР 19F 2:3. (CDC13, м.д.): - 75.43. [a]D20=-47.55 (с = 1.2; МеОН). Приклад 8 Знайдено, %: С 51.77; Н 3.49; N 6.57. S(-)-1-(4-Фторофеніл)-6-метил-4-феніл-4C18H15F 3N2O 2C12 . Вирахуваного: С 51.57; Н 3.61; N (трифторометил)-3,4-дигідропіримідин-2(1H)-он. 6.68. Вихід 88%, т.пл. 149°С. Спектр ЯМР 1Н (CDCl3, Приклад 4. м.д.): 1.63с (3Н, СН3), 5.00с (1Н, NH), 5.85 с (1Н, S(-)-N-[3-Оксо-1-феніл-1NH), 7.07-7.10м (2Наром.), 7.17с (1Hаром.), 7.39(трифторометил)бутил]-N’-[-3-трифторо7.43м (3Наром.), 7.58д (2Наром., J = 7Гц). Спектр метил)феніл]сечовина. Вихід 81%, т.пл. 149°С. ЯМР 19 F (CDCl3, м.д.): -79.67; -114.02. Спектр ЯМР 1 13 Спектр ЯМР Н (CDCl3, м.д.): 2.25с (3Н, СН3), 3.52д С (CDCl3): 20.45 (СН3), 63.16кв (С4, J = 30.18Гц,), (1H, СН2, J = 17.5Гц), 3.78д (1Н, CH2, J = 16Гц), 96.28 (С5), 116.01, 116.19, , 125.93, 128.77, 128.90, 6.29с (1H, NH), 7.20-7.36м (7Наром.), 7.49 131.29, 133.17 (Саром.), 125.13кв (CF3, J = (3Наром.), 7.87с (1H, NH). Спектр ЯМР 19 F (CDCl3, 286.7Гц), 138.23 (С6), 152.61 (С2), 162.27д (C-F 13 м.д.): - 61.77, - 75.45. Спектр ЯМР С (CDCl3, м.д.): аром., J = 248.94Гц). [a]D20=-151.3 (с = 1.31; Ме1 31.83 (СН3), 43.75 (СН2), 63.19кв (С , J = 27.6Гц), ОН). Знайдено, %: С 61.95; Н 4.11; N 7.59. 116.17, 119.58, 122.63, 126.28, 128.36, 128.63, C18H14F 4N2O. Вирахуваного: С 61.72; Н 4.03; N7.80. 128.77, 129.37, 136.33, 139.20 (Саром.), 123.56кв Приклад 9 (CF3, J = 286.8Гц), 123.84кв (CF3, J = 244.5Гц), S(-)-1-(4-Хлорофеніл-6-метил-4-феніл-4131.18кв (CapoM. - CF3, J = 32.6Гц), 154.22 (С=О), (трифторометил)-3,4-дигідропіримідин-2(1Н)-он. 205.52 (С=О). [a]D20=-3.28 (с = 0.10; МеОН). ЗнайВихід 88% , т.пл. >250°С. Спектр ЯМР 1Н (CDCl3, дено, %: С 54.78; Н 3.99; N 6.58. C19H16F6N2 O2. м.д.): 1.64с (3Н, СН3), 5.02с (1Н, NH), 6.17с (1Н, Вирахуваного: С 54.55; Н 3.85; N 6.69. NH), 7.15с (2Н аром.), 7.40-7.43м (5Наром.), 7.57с Приклад 5 (2Наром.). Спектр ЯМР 19F (CDCl3, м.д.): -79.72. S(-)-N-(3-Хлоро-4-метилфеніл)-N’-[3-оксо-1Спектр ЯМР 13С (CDC13): 20.45 (СН3), 63.18кв (С4, феніл-1-(трифторо-метил)бутил]сечовина. Вихід J = 28.9Гц), 96.45 (С5), 125.11кв (CF3, J = 287.9Гц), 1 62%, т.пл. 142°С. Спектр ЯМР Н (CDCl3, м.д.): 125.92, 125.93, 128.80, 128.92, 129.40, 130.92, 2.20с (3Н, СН3), 2.24с (3Н, СН3), 3.53д (1H, СН2, J = 134.38, 135.79 (Саром.), 137.99 (С6), 152.39 (С2). 7 34965 8 S(-)-1-(3,4-дихлорофеніл)-6-метил-4-(4[a]D20=-101.76 (с = 0.55, МеОН). Знайдено, %: С метилфеніл)-4-(трифторо-метил)-3,459.24; Н 4.01; N 7.51. C18H14F 3C1N2O. Вирахуваного: С 58.95; Н 3.85; N 7.34. дигідропіримідин-2(1H)-он. Вихід 75%, т.пл. 190°С. Спектр ЯМР 1Н (DMSO-d6, м.д.): 1.62с (3Н, СН3), Приклад 10 2.32с (3Н, СН3), 5.30с (1Н, NH), 7.20-7.27м S(-)-1-(3,4-Дихлорофеніл)-6-метил-4-феніл-4(3Наром.), 7.55-7.68м (4Наром.), 8.73с (1Н, NH). (трифторометил)-3,4-дигідропіримідин-2(1Н)-он. Спектр ЯМР 19F (DMSO-d6, м.д.): -77.86. Спектр Вихід 81%, т.пл. 92°С. Спектр ЯМР 1Н (CDCl3, м.д.): 1.67 с (3Н, СН3), 5.03с (1Н, NH), 5.85с (1Н, ЯМР 13С (DMSO-d6, м.д. ): 19.65 (СН3), 20.49 (СН3), 62.21kb (С4, J = 28.9Гц), 95.44 (С5), 126.25, 128.95, NH), 7.03-7.10м (1Hаром.), 7.34-7.56м (7Наром.). 19 130.24, 130.52, 130.78, 131.02, 131.97, 135.13, Спектр ЯМР F (CDCl3, м.д.): -79.65. Спектр ЯМР 13 137.15, 137.46 (Саром.), 125.12кв (CF3, J = С (D MSO-d6 , м.д.): 19.64 (СН3), 62.47кв (С4, J = 26.4Гц), 125.01кв (CF3, J = 271.6.Гц), 126.32, 276.6Гц), 137.78 (С6), 151.64 (С2). [a]D20=-18.12 (с = 128.37, 128.42, 130.22, 130.52, 130.80, 131.08, 0.46; МеОН). Знайдено, %: С 55.19; Н 3.47; N 6.54. 131.85, 137.30, 137.43 (Саром.), 138.06 (С6), 151.60 C19H15F 3C12N2O. Вирахуваного: С 54.96; Н 3.64; N 6.75. (С2). [a]D20=-158.76 (с = 0.43; МеОН). Знайдено, %: Приклад 15 С 54.14; Н 3.11; N 6.71. C18H13F3Cl2N2 O. ВирахуваS(-)-1-(3-Хлоро-4-метилфеніл)-4-(4ного: С 53.89; Н 3.27; N 6.98. метилфеніл)-6-метил-4-(трифторо-метил)-3,4Приклад 11 дигідропіримідин-2(1Н)-он. Вихід 91%, т.пл. 82°С. S(-)-6-Метил-4-феніл-4-(трифторометил)-1-[3Спектр ЯМР 1Н (CDCl3, м.д.): 1.66с (3Н, СН3), 2.38с (трифторометил)-феніл]-3,4-дигідропіримідин1 (3Н, СН3), 5.01с (1H, NH), 5.89с (1Н, NH), 7.09д 2(1Н)-он. Вихід 79%, т.пл. 132°С. Спектр ЯМР Н (1Hаром., J = 8.4Гц), 7.26 д (3Наром., J = 7.5Гц), (CDCl3, м.д.): 1.64с (3Н, СН3), 5.05с (1Н, NH), 5.82с 7.44д (2Наром., J = 7.8Гц), 7.50д (1Hаром., J = (1Н, NH), 7.41-7.58м (8Н, аром.), 7.65д (1Н, J = 8.4Гц). Спектр ЯМР 19F (CDCl3, м.д.): -79.96, 7.5Гц, аром.). Спектр ЯМР 19F (CDCl3, м.д.): -63.77; 13 114.10. Спектр ЯМР 13С (CDCl3, м.д. ): 19.68 (СН3), -79.64. Спектр ЯМР С (CDCl3): 20.45 (СН3), 4 5 20.39 (СН3), 62.84кв (С4, J = 28.9Гц), 95.97 (С5), 63.12кв (С , J = 28.9Гц), 96.91 (С ), 125.36, 125.88, 115.80, 127.80, 128.05, 130.07, 131.17, 134.01, 126.66, 128.88, 128.97, 129.73, 133.17, 137.66, 134.59, 135.74, 136.74 (Саром.), 124.98кв (CF3, J = 137.85, 137.89 (Саром.), 124.61 кв (CF3, J = 245.2 286.7Гц), 138.30 (С6), 152.48 (С2), 162.73 (Саром. Гц ), 131.78кв (Саром- CF3, J = 32.6Гц), 125.41кв 6 2 20 F, J = 248.9Гц), [a]D20=-106.6 (с = 0.36; МеОН). (CF3, J = 272.8Гц), 137.89 (С ), 152.11 (С ). [a]D =Знайдено, %: С 65.39; Н 5.47; N 6.74. C22H21F 4N2O. 157.6 (с = 0.15; МеОН). Знайдено, %: С 57.26; Н 3.43; N 6.88. C18H13F3Cl2N2 O. Вирахуваного: С Вирахуваного: С 65.18; Н 5.22; N6.91. Приклад 16 53.89; Н 3.27; N 7.00. S(-)-4-(4-трет.-Бутилфеніл)-6-метил-1-(4Приклад 12 метилфеніл)-4-(трифторо-метил)-3,4S(-)-1-[(3-Хлоро-4-метил)феніл]-6-метил-4дигідропіримідин-2(1Н)-он. Вихід 91%, т.пл. 197°С. феніл-4-(трифторо-метил)-3,4-дигідропіримідин2(1Н)-он. Вихід 71, т.пл. 75°С. Спектр ЯМР 1Н Спектр ЯМР 1Н (CDCl3, м.д.): 1.32с (9Н, трет.-Вu), 1.63с (3Н, СН3), 4.93с (1H, NH), 5.72с (1Н, NH), (CDCl3, м.д.): 1.66с (3Н, СН3), 2.39с (3Н, СН3), 7.09-7.15м (4Наром.), 7.40д (2Наром., J = 8.1Гц), 5.02с (1Н, NH), 6.49с (1Н, NH), 7.36с (1Н аром.), 7.56д (3Наром., J = 4.2Гц). Спектр ЯМР 19F (CDCl3, 7.22-7.28м (2Наром.), 7.39-7.46м (3Наром.), 7.57д 19 м.д.): -79.91; - 114.24. Спектр ЯМР 13С (CDCl3, м.д. (2Наром., J = 7.5Гц). Спектр ЯМР F (CDCl3, м.д.): 13 -79.75. Спектр ЯМР С (CDCl3, м.д.): 19.75 (СН3), ): 20.45 (СН3), 31.34 (3СН3), 34.69[С(СН3)], 62.83кв (С4, J = 31.4Гц), 95.48 (С5), 115.64, 115.82, 126.09, 20.75 (СН3), 63.20кв (С4, J = 28.9Гц), 96.35 (С5), , 128.07, 128.84, 134.22, 134.40 (Саром.), 125.09кв 125.90, 127.82, 128.77, 128.91, 130.10, 131.19, (CF3, J = 286.7Гц), 138.99 (С6), 151.36 (С2) 162.69 134.62, 135.79, 136.73, 138.01 (Саром.), 125.07кв 6 2 20 (Саром. -F, J = 248.9Гц). [a]D20=-103.3 (c = 0.32; (CF3, J = 286.7Гц), 138.06 (С ), 152.73 (С ). [a]D =MeOH). Знайдено, %: С 57.45; H 3.67; N 6.84. 90.73 (с = 0.23; МеОН). Знайдено, %: С 57.46; Н C19H15F 4N2ClO. Вирахуваного: С 57.23; Н 3.79; N 3.53; N 6.84. C19H15F4ClN2O. Вирахувано, %: С 7.02. 57.23; Н 3.79; N 7.03. Література Приклад 13 1. Карре CO. Biologically active S(-)-1-(4-Хлорофеніл)-6-метил-4-(4dihydropyrimidones of the Biginelly-type - a literature метилфеніл)-4-(трифторометил)-3,4survey// Eur. J. Med. Chem. - 2000. - Vol.35, №12. дигідропіримідин-2(1Н)-он. Вихід 75%, т.пл. 190°С. P.1043-1052. Спектр ЯМР 1Н (DMSO-d6, м.д.): 1.63с (3Н, СН3), 2. Atwal K.S., Swanson B.N., Under S.E., Floyd 2.38с (3Н, СН3), 4.99с (1Н, NH), 5.71с (1H, NH), D.M., Moreland S., Hedberg A., O’ Reilly B.C. 7.16д (2Наром., J = 7.5Гц), 7.26 д (2Наром., J = Dihydropyrimidine calcium channol blockers. 3.38Гц), 7.39 д (2Наром., J = 8Гц), 7.43д (2Наром., J = Carbamoyl-4-aryl-l,2,3,4-tetrahydro-6-methyl-58Гц). Спектр ЯМР 19F (CDCl3, м.д.): -79.92. Спектр pyrimidinecarboxylic acid esters as orally effective ЯМР 13С (DMSO-d6, м.д. ): 19.74 (СН3), 20.49 (СН3), antihypertensive agents// J. Med. Chem. - 1991. 62.18кв (С4, J = 28.9Гц), 95.25 (С5), 126.24, , 128.79, Vol.34, №2. - P.806-811. 128.97, 131.58, 132.41, 135.23, 136.44, 137.50 (Са3. Rovn yak G.C., Atwal K.S., Hedberg A., Kimball ром.), 127.50кв (CF3, J = 285.4Гц), 137.77 (С6), S.D., Moreland S., Gouyoutas J.Z., O’ Reilly B.C., 151.64 (С2). [a]D20= -124.17 (с = 1; МеОН). ЗнайдеSchwatz J., Molley M.F. Digidropyrimidine calcium но, %: С 60.16; Н 4.33; N 7.54. C19H16F3C1N2O. Виchannol blockers. 4. Basic 3-substituted-4-aryl-l,4рахуваного: С 59.93; Н 4.24; N 7.36. dihydropyrimidine-5-carboxyc acid esters. Potent Приклад 14 9 34965 10 antihypertensive agents// J. Med. Chem. - 1992. Disubstituted Tetrazolium salts// Polish J.Chem. Vol.35, №17. - P.3254-3263 . 2001. - Vol. - P.253-264. 4. Nagarathnam D., Miao S.W., Lagu В., Chiu G., 8. Blockburn C, Guan В., Brown J., Cullis C, Fang J., Dhar T.G.M., Zhang J., Tyagarajan S., Condon S. M., Jenkins T. J., Peluso S., Ye Y., Marzabadi M.R., Zhang F., Woug W.C., Sun W., Tian Gimero R. E., Punreddy S., Sun Y., Wu H., Hubbard D., Wetzel J. M., Forray C, Chang R. S. L., Broten T. В., Kaushik V., Tummino P., Sancketti P., Sun D. Yu., P., Ranson R. W., Schort T.W., Chen Т. В., O! Malley Daniels Т., Tozzo E., Balani S. K., Raman P. S., Kling P., Shenk K., Bendersky R., Harrell СМ., Identification and characterization of 4-aryl-3,4Vyas К. P., Gluckowski С Design and synthesis of dihydropyrimidin -2(1H)-ones as inhibitors of the fatty acid transporter FATP4// Bioorg. Med. Chem. Lett novel a-1a adrenoreceptor Selective Autaggonists. 1. 2006. - Vol.16. - P.3504-3509. Structure-activity Relationship in 9. Sukach V.A., Golovach N.M., Pirozhenko V.V., Dihydropyrimidinones// J. Med. Chem. - 1999. Vol.42, №23. - P.4764-4777. Rusanov E.B., Vo vk M.V. Convenient 5. Lantzsch R., D. Arlt. Hersellung und enantioselective synthesis of b-trifluoromethyl-bReactionen vou l,l-dimetleyl-3-oxobytyl-isocyanot// aminoketones by organocatalytic asymmetric Synthesis. - 1977. - P.756-757. Mannich reaction of trifluoromethyl ketimines with 6. Kashima C, Katoh A., Yokota Y., Omote Y. acetone// Tetrahedron: Assemetry. - 2008. - Vol.19. Reaction of Pyrimidin-2(1H)-ones and -thiones with P.761-764. organometallic compounds. Regioselective 10. Kleidernigg О.Р., Карре С.О., Separation of Preparation of Digidropyrimidin-2(lH)-ones and enantiomers of 4-aryldihydropyrimidin-2(1H)-ones by thiones.// J.Chem.Soc. Perkin Trans 1. - 1981. direct enantioselecctive HPLC. A critical comparison P.489-492. of chiral stationary phases// Tetragedron: Assymetry. 7. Voitekhovich S.V., Gaponik P. N., L yakhov - 1997, - Vol.8, №12. - P.2057-2067. A.S., Ivashkevich O. A. Synthesis and Transformation of 1-Monosubstituted Tetrazoles to Pyrimidones, Benzoxa zoles and Quinazolidinones Through 1,4 Комп’ютерна в ерстка В. Мацело Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of s(-)-1,4-diaryl-4-trifluoromethyl-6-methyl-3,4-dihydropyrimidine-2(1н)-ones
Автори англійськоюVovk Mykhailo Volodymyrovych, Sukach Volodymyr Andriiovych, Holovach Natalia Mykhailivna
Назва патенту російськоюСпособ получения s(-)-1,4-диарил-4-трифторометил-6-метил-3,4-дигидропиримидин-2(1н)-онов
Автори російськоюВовк Михаил Владимирович, Сукач Владимир Андреевич, Головач Наталия Михайловна
МПК / Мітки
МПК: C07D 239/00, C07B 53/00
Мітки: s(-)-1,4-діарил-4-трифторометил-6-метил-3,4-дигідропіримідин-2(1н)-онів, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/5-34965-sposib-oderzhannya-s-14-diaril-4-triftorometil-6-metil-34-digidropirimidin-21n-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання s(-)-1,4-діарил-4-трифторометил-6-метил-3,4-дигідропіримідин-2(1н)-онів</a>
Попередній патент: Однокаскадний електронний баласт
Наступний патент: Система подання альтернативного палива в камеру згоряння теплового двигуна
Випадковий патент: Спосіб комбінованої ендолімфатичної терапії гострого панкреатиту









