Спосіб одержання пробіотику з аерококів
Формула / Реферат
1. Кристалічна поліморфна модифікація аналога епотилону формули І
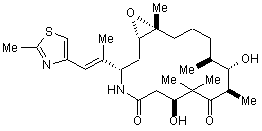 , І
, І
котра являє собою Форму А, яка характеризується приблизно такими параметрами елементарної комірки:
розміри комірки
![]()
![]()
![]()
об'єм = 2701(4) A3
просторова група
Р212121 орторомбічна
молекули/елементарна комірка
4
густина (розрах.) (г/см3)
1,247
температура плавлення
182-185°С (розкладення) і
характеристичні піки на дебаєграмі із значеннями два тета (![]()
![]() при 22°С) 5,69; 6,76; 8,38; 11,43; 12,74; 13,62; 14,35; 15,09; 15,66; 16,43; 17,16; 17,66; 18,31; 19,03; 19,54; 20,57; 21,06; 21,29; 22,31; 23,02; 23,66; 24,18; 24,98; 25,50; 26,23; 26,46; 27,59; 28,89; 29,58; 30,32; 31,08 та 31,52, або
при 22°С) 5,69; 6,76; 8,38; 11,43; 12,74; 13,62; 14,35; 15,09; 15,66; 16,43; 17,16; 17,66; 18,31; 19,03; 19,54; 20,57; 21,06; 21,29; 22,31; 23,02; 23,66; 24,18; 24,98; 25,50; 26,23; 26,46; 27,59; 28,89; 29,58; 30,32; 31,08 та 31,52, або
Форму В, яка характеризується
приблизно такими параметрами елементарної комірки:
розміри комірки
![]()
![]()
![]()
об'єм = 2835(1) A3
просторова група
Р212121 орторомбічна
молекули/елементарна комірка
4
густина (розрах.) (г/см3)
1,187
температура плавлення
191-199°С (розкладення) і
характеристичні піки на дебаєграмі із значеннями два тета (![]()
![]() при 22°С) 6,17; 10,72; 12,33; 14,17; 14,93; 15,88; 16,17; 17,11; 17,98; 19,01; 19,61; 20,38; 21,55; 21,73; 22,48; 23,34; 23,93; 24,78; 25,15; 25,90; 26,63; 27,59; 28,66; 29,55; 30,49 та 31,22.
при 22°С) 6,17; 10,72; 12,33; 14,17; 14,93; 15,88; 16,17; 17,11; 17,98; 19,01; 19,61; 20,38; 21,55; 21,73; 22,48; 23,34; 23,93; 24,78; 25,15; 25,90; 26,63; 27,59; 28,66; 29,55; 30,49 та 31,22.
2. Кристалічна поліморфна модифікація аналога епотилону формули І
 , І
, І
котра являє собою Форму А, яка характеризується переважно такою дебаєграмою, як показано на фіг. 1, і переважно таким спектром комбінаційного розсіювання (раманівський спектр), як показано на фіг. 5, або Форму В, яка характеризується переважно такою дебаєграмою, як показано на фіг. 2, і переважно таким спектром комбінаційного розсіювання (раманівський спектр), як показано на фіг. 6.
3. Кристалічна поліморфна модифікація аналога епотилону формули І
 , І
, І
котра являє собою Форму А, яка характеризується тим, що її розчинність у воді дорівнює 0,1254, розчинність у 3%-ому водному розчині полісорбату 80 дорівнює 0,2511, температура плавлення з розкладенням становить 182-185°С і теплота розчинення дорівнює 20,6 кдж/мол, або Форму В, яка характеризується тим, що її розчинність у воді дорівнює 0,1907, розчинність у 3%-ому водному розчині полісорбату 80 дорівнює 0,5799, температура плавлення з розкладенням становить 191-199°С і теплота розчинення дорівнює 9,86 кдж/мол.
4. Кристалічна поліморфна модифікація за будь-яким з пп. 1, 2 або 3, яка відрізняється тим, що зазначена поліморфна модифікація являє собою Форму А.
5. Кристалічна поліморфна модифікація за будь-яким з пп. 1, 2 або 3, яка відрізняється тим, що зазначена поліморфна модифікація являє собою Форму В.
6. Кристалічна речовина, яка являє собою суміш Форми А та Форми В за будь-яким з пп. 1, 2 або 3.
7. Спосіб одержання кристалічної поліморфної модифікації, котра являє собою Форму А аналога епотилону формули І за п. 1, в якому проводять нагрівання суспензії зазначеного аналога формули І у приблизно 8-16 мл етилацетату на один грам зазначеного аналога до температури приблизно 75°С, витримування суспензії при цій температурі протягом однієї години, додавання циклогексану в приблизному відношенні до етилацетату 1:2-2:2, природне охолодження суміші до кімнатної температури з перемішуванням впродовж близько 12-96 годин, подальше охолодження до температури приблизно 5°С впродовж двох годин і виділення з реакційної суміші кристалічної Форми А.
8. Спосіб за п. 7, який відрізняється тим, що циклогексан додають у кількісному співвідношенні з етилацетатом, застосовуваним для одержання зазначеної суспензії, рівному 1:2.
9. Спосіб за п. 7, який відрізняється тим, що зазначену суспензію зазначеного аналога формули І в етилацетаті нагрівають до температури приблизно 75°С, уводять у цю суспензію зародкові кристали і суміш витримують впродовж близько 30 хвилин, після чого при температурі суміші близько 70°С додають зазначену кількість циклогексану, суміш охолоджують до кімнатної температури, перемішуючи протягом 18 годин, суміш додатково охолоджують до приблизно 5°С впродовж приблизно двох годин і виділяють з неї кристалічну Форму А.
10. Спосіб за п. 7, який відрізняється тим, що зазначену суспензію зазначеного аналога формули І в етилацетаті нагрівають до температури приблизно 75°С принаймні впродовж однієї години до утворення розчину, зазначений розчин охолоджують впродовж близько двох годин до температури приблизно 50°С, додаючи зазначені зародкові кристали у той момент, коли температура дорівнює близько 60°С, розчин охолоджують до температури приблизно 30°С впродовж приблизно трьох годин, після чого температуру розчину знижують до -10°С впродовж приблизно трьох годин, причому протягом однієї години з цих трьох годин до реакційної суміші по краплинах додають зазначену кількість циклогексану, витримують одержану суміш при температурі -10°С впродовж приблизно однієї години і виділяють з неї кристалічну Форму А.
11. Спосіб одержання кристалічної поліморфної модифікації, котра являє собою Форму В аналога епотилону формули 1 за п. 1, в якому проводять нагрівання суспензії зазначеного аналога формули І у приблизно 40-50 мл етилацетату на один грам зазначеного аналога до температури приблизно 75°С-80°С, витримування суспензії при цій температурі впродовж приблизно однієї години до одержання розчину, витримування при цій температурі впродовж близько 30 хвилин, охолодження розчину впродовж приблизно двох годин до 30°С, подальше зниження температури розчину до -10°С впродовж приблизно однієї години, при цьому протягом тридцяти хвилин до реакційної суміші по краплинах додають циклогексан у приблизному кількісному відношенні до етилацетату 1:2-2:2, витримування одержаної суміші при температурі -10°С впродовж приблизно двох годин і виділення з реакційної суміші кристалічної Форми В.
12. Спосіб за п. 11, який відрізняється тим, що зазначену суспензію зазначеного аналога формули І в етилацетаті нагрівають до температури приблизно 78°С з утворенням розчину, розчин охолоджують до температури приблизно 10°C впродовж приблизно двох годин, додають зародкові кристали у той момент, коли температура дорівнює 10°С, розчин далі охолоджують до -10°С впродовж приблизно двох годин, при цьому протягом тридцяти хвилин до реакційної суміші по краплинах додають зазначену кількість циклогексану, витримують одержану суміш при -10°С впродовж приблизно двох годин і виділяють з неї кристалічну Форму В.
13. Спосіб одержання кристалічної поліморфної модифікації, котра являє собою Форму В аналога епотилону формули І за п. 1, в якому проводять нагрівання суспензії зазначеного аналога формули І у толуолі в кількості близько 10-20 мл на один грам зазначеного аналога до температури приблизно 75°С-80°С, витримування реакційної суміші при цій температурі впродовж близько 30 хвилин, охолодження суміші до температури приблизно 20°С, перемішування при цій температурі впродовж приблизно 18 годин і виділення із суміші кристалічної Форми В.
14. Фармацевтична композиція, яка містить як активний компонент ефективну кількість кристалічної поліморфної модифікації за будь-яким з пп. 1, 2 або 3 і принаймні один прийнятний фармацевтичний носій, наповнювач або розріджувач.
15. Фармацевтична композиція за п. 14, яка відрізняється тим, що зазначена кристалічна поліморфна модифікація являє собою Форму А.
16. Фармацевтична композиція за п. 14, яка відрізняється тим, що зазначена кристалічна поліморфна модифікація являє собою Форму В.
17. Фармацевтична композиція за п. 14, яка відрізняється тим, що зазначена кристалічна поліморфна модифікація являє собою суміш Форми А та Форми В.
18. Спосіб лікування раку або інших проліферативних захворювань, в якому вводять в організм ссавця, що потребує лікування, ефективну кількість кристалічної поліморфної модифікації за будь-яким з пп. 1, 2 або 3.
19. Спосіб за п. 18, який відрізняється тим, що зазначена кристалічна поліморфна модифікація являє собою Форму А.
20. Спосіб за п. 18, який відрізняється тим, що зазначена кристалічна поліморфна модифікація являє собою Форму В.
21. Спосіб за п. 18, який відрізняється тим, що кристалічну поліморфну модифікацію вводять парентеральним шляхом.
Текст
1 Спосіб одержання пробютику з аерококів, що включає вирощування виробничого штаму культури аерококів на живильному середовищі у пробірках з м'ясо-пептоновим агаром при температурі 36±1°С, бактерюскопічний та бактеріологічний контроль чистоти культури, розлив препарату у ємності, наступну люфілізацію у вакуумсушильних апаратах і герметизацію, який відрізняється тим, що вирощування проводять в декі лька етапів, причому на першому етапі вирощують першу генерацію штаму культури аерококів, переважно Aerococcus vindans 167, протягом 1 8 - 4 8 годин, на другому етапі вирощують наступну маткову генерацію протягом 1 8 - 4 8 годин, на третьому етапі маткову культуру засівають в матраци з казеїновим агаром, який містить 10мг/мл глюкози, 20 - 50мкг/мл грамурину, 1 - 5мкг/мл етонію, і протягом 1 8 - 4 8 годин вирощують виробничу культуру, а по закінченні строку інкубації здійснюють змив мікробної маси в асептичних умовах додаванням водного розчину стабілізатора 2 Спосіб за п 1, який відрізняється тим, що в усіх живильних середовищах перед засівом культур аерококів рН доводять до значення 6,8 - 8,0 Винахід відноситься до мікробіологи, а саме, до способу одержання лікувально-профілактичних бактеріальних препаратів з аерококів Відомий спосіб одержання біопрепарату для лікування і профілактики захворювань слизових оболонок і шкірних покривів (1), що полягає у вирощуванні культури аерококів на живильному середовищі при наступних умовах Оптимум температурного росту (36 ± 1)°С На м'ясо-пептоновому бульйоні штам зростає, утворюючи поверхневу зону Оптимальний ріст аерококів спостерігається через 24 години при (36 ± 1)°С на м'ясо-пептоновому агарі Склад середовища для культивування штаму такий Агар мікробіологічний ГОСТ 1 7206-84 22мл Глюкоза ГОСТ 603 8-79 40г Пептон сухий ферментативний для бактеріологічного призначення ГОСТ 13805-76 10г Вода дистильована ГОСТ 6709-72 1л Для приготування середовища дистильовану воду змішують з пептоном та агаром Суміш витримують 20 - ЗО хвилин при кімнатній температурі для набухання агару, і кип'ятять 1 5 - 2 0 хвилин до його повного розплавлення Далі 30%-розчином оцтової кислоти встановлюють рН 3,8 Після го динного відстоювання середовище декантують через ватно-марлевий фільтр і додають глюкозу, після чого стерилізують при температурі (110 ± 1)°С на протязі ЗО хвилин На живильному середовищі виростають колони діаметром 0,5 - 2,0мм у вигляді плоских безбарвних дисків По закінченні строку інкубації здійснюють змив мікробної маси у асептичних умовах шляхом додавання водного розчину стабілізатора Мікробну суспензію збирають у бутель і проводять бактерюскопічний та бактеріологічний контроль чистоти культури Препарат розливають по 1 або 2 дози в ампули типа ШП-5-НС-1 або ШП-5-НС-3 по Ост 64-2485-85 або по 25 - ЗО доз у пляшки (ОСТ 10782-85) ємністю 250мл, люфілізують у вакуум-сушильних апаратах і герметизують Одна доза (1мл) містить не менш 2 - Ю 4 життєздатних аерококів Основним недоліком прототипу є мала концентрація клітин аерококів у процесі культивування за рахунок вирощування біомаси аерококів на пептоново-глюкозному агарі, який має низьке значення Рн = 3,8 живильного середовища В основу винаходу поставлено задачу створити спосіб одержання пробютику з аерококів з підвищеним виходом клітин аерококів Задача винаходу вирішується тим, що у відо О со го ю 53301 мому способі одержання пробютику з аерококів, що включає вирощування виробничого штаму культури аерококів на живильному середовищі у пробірках з м'ясо-пептоновим агаром при температурі 36 ± 1°С, бактерюскопічний та бактеріологічний контроль чистоти культури, розлив препарату у ємності, наступну люфілізацію у вакуум - сушильних апаратах і герметизацію, згідно винаходу, вирощування проводять в декілька етапів, причому на першому етапі вирощують першу генерацію штаму культури аерококів, переважно, Aerococcus vindans 167, на протязі 1 8 - 4 8 годин, на другому етапі вирощують наступну маткову генерацію на протязі 1 8 - 4 8 годин, на третьому етапі маткова культуру засівають в матраци з казеїновим агаром, який містить 10мг/мл глюкози, 20 - 50мкг/мл грамуршу, 1 - 5мкг/мл етонію, і на протязі 1 8 - 4 8 годин вирощують виробничу культуру, а по закінченні строку інкубації здійснюють змив мікробної маси в асептичних умовах додаванням водного розчину стабілізатора Дослідницьким шляхом було встановлено, що найбільший вихід клітин культур аерококів відбувається тоді, коли в усіх живильних середовищах перед засівом культур аерококів значення рН становить 6,8 - 8,0 Винахід пояснюється схемою /див фіг/, на якої зображено етапи одержання пробютику з аерококів На перших 2-х етапах одержується маткова культура На першому етапі вирощується перша генерація Aerococcus vindans 167 в пробірках з м'ясопептоновим агаром при (36 ± 1)°С на протязі 18 48 годин На другому етапі з неї вирощується маткова генерація штаму культури аерококів, переважно, Aerococcus vindans 167, в пробірках з м'ясопептоновим агаром при (36 ± 1)°С на протязі 18 48 годин На третьому етапі маткова культура засівається в матраци з казеїновим агаром, який містить 10мг/мл глюкози, 20 - 50мкг/мл грамуршу, 1 5мкг/мл етонію, і вирощується при (36 ± 1)°С на протязі 18-48 годин По закінченні строку інкубації здійснюють змив мікробної маси в асептичних умовах шляхом додавання водного розчину стабілізатора Мікробну суспензію збирають у бутель і проводять бактерюскопічний та бактеріологічний контроль чистоти культури Препарат розливають по 1 або 2 дози в ампули типа ШП-5-НС-1 або ШП-5-НС-3 по Ост 64-2485-85 або по 25 - ЗО доз у пляшки (ОСТ 10782-85) ємністю 250мл, люфілізують у вакуум-сушильних апаратах і герметизують Одна доза (1мл) містить не менш 2 - Ю 8 життєздатних аерококів Абактерш являє собою висушені ліофільно живі вегетативні клітини бактерій, стабілізатор - желатин і сахарозу, сухі компоненти живильного середовища і біологічно активні речовини, що продукуються штамом, - антиоксидантні ферменти, амінокислоти, лізоцим, антибіотики, екзополісахариди, лектатооксидазу Препарат розчинюється протягом двох хвилин при періодичному потрушуванні пляшки або ампули після додавання розчинника (кип'ячена або дистильована вода, 0,9%-розчин хлориду натрію) із розрахунку 1 мл розчинника на одну ампулу препарату, 5мл розчинника на одну пляшку ємністю 10мл, 50мл розчинника на одну пляшку ємністю 50мл При розчиненні утворюється непрозора гомогенна суспензія, після чого визначається концентрація клітин у 1мл суспензії В найкращому варіанті здійснення в усіх живильних середовищах перед засівом культур штамів рН доводять до 6,8 - 8,0 Приклад 1 На першому етапі вирощували першу генерацію Aerococcus vindans 167 в пробірках з м'ясопептоновим агаром при температурі 36 ± 1°С на протязі 18 годин На другому етапі вирощували маткову генерацію Aerococcus vindans 167 в пробірках з м'ясопептоновим агаром при температурі 36 ± 1°С на протязі ЗО годин На третьому етапі маткову культуру 2-і генерації Aerococcus vindans 167 засівали в матраци з казеїновим агаром, який містив 10мг/мл глюкози, 20 - 50мкг/мл грамуршу, 1 - 5мкг/мл етонію, і вирощували при температурі 36 ± 1°С на протязі ЗО годин Значення рН в усіх середовищах перед засівом Aerococcus vindans 167 доводили до 6,8 По закінченні строку інкубації змивали мікробну масу в асептичних умовах шляхом додавання водного розчину стабілізатора Мікробну суспензію збирали у бутель і проводили бактерюскопічний та бактеріологічний контроль чистоти культури Препарат розливали по 1 або 2 дози в ампули типа ШП-5-НС-1, люфілізували у вакуум - сушильних апаратах і герметизували Приклад 2 На першому етапі вирощували першу генерацію Aerococcus vindans 167 в пробірках з м'ясопептоновим агаром при (36 ± 1)°С на протязі 24 годин На другому етапі вирощували маткову генерацію Aerococcus vindans 167 в пробірках з м'ясопептоновим агаром при (36 ± 1)°С на протязі 24 годин На третьому етапі маткову культуру 2-і генерації Aerococcus vindans 167 засівали в матраци з казеїновим агаром, який містив 10мг/мл глюкози, 20 - 50мкг/мл грамуршу, 1 - 5мкг/мл етонію і вирощували при (36 ± 1)°С на протязі 24 годин Значення рН в усіх середовищах перед засівом Aerococcus vindans 167 становило 7,4 По закінченні строку інкубації здійснювали змив мікробної маси в асептичних умовах шляхом додавання водного розчину стабілізатора Мікробну суспензію збирали у бутель і проводили бактерюскопічний та бактеріологічний контроль чистоти культури Препарат розливали по 5 - ЗО доз у пляшки (ОСТ 10782-85) ємністю 10 - 250мл, люфілізували у вакуум-сушильних апаратах і герметизували Приклад З На першому етапі вирощували першу генерацію Aerococcus vindans 167 в пробірках з м'ясопептоновим агаром при (36 ± 1)°С на протязі 48 годин На другому етапі вирощували маткову генерацію Aerococcus vindans 167 в пробірках з м'ясо 53301 пептоновим агаром при (36 ± 1)°С на протязі 48 парату, 5мл розчинника на одну пляшку ємністю годин 10мл, 50мл розчинника на одну пляшку ємністю 50мл При розчиненні утворюється непрозора гоНа третьому етапі маткову культуру 2-і генемогенна суспензія, після чого визначається концерації Aerococcus viridans 167 засівали в матраци з нтрація клітин в 1мл суспензії казеїновим агаром, який містив 10мг/мл глюкози, 20 - 50мкг/мл грамуршу, 1 - 5мкг/мл етонію, і виУ таблиці наведено дані о накопиченні клітин рощували при (36 ± 1)°С на протязі 48 годин Aerococcus viridans 167 при різних значеннях рН живильних середовищ в 1 мл суспензії АЗначення рН в усіх середовищах перед засібактерину вом Aerococcus viridans 167 становило 8,0 По закінченні строку інкубації здійснювали змив мікробної маси в асептичних умовах шляхом додавання Таблиця водного розчину стабілізатора Мікробну суспензію збирали у бутель і проводили бактерюскопічний та Накопичення клітин Aerococcus viridans 167 при бактеріологічний контроль чистоти культури різних значеннях рН середовища в 1 мл суспензії Препарат розливали по 1 або 2 дози в ампули А-бактерину ШП-5-НС-3 по Ост 64-2-485-85, люфілізували у вакуум-сушильних апаратах і герметизували КІЛЬКІСТЬ КЛІТИН Aerococcus viridans Кожна доза (1 мл) отриманого препарату 167 на 1 мл суспензії А-бактерину /незалежно від прикладу здійснення/ містить не Назва штаму при різних значеннях рН середоменш 2 - Ю 8 життєздатних аерококів А-бактерш вища являє собою висушені ліофільно живі вегетативні 3,8 6,8 7,4 8,0 клітини бактерій, стабілізатор - желатин і сахарозу, Aerococcus 4 8 8 2 10 2 10 3,2 10 2,2 108 сухі компоненти живильного середовища і біологіviridans 167 чно активні речовини, що продукуються штамом, антиоксидантні ферменти, амінокислоти, лізоцим, Джерела інформації антибіотики, екзополісахариди, лектатооксидазу 1 Біопрепарат для лікування і профілактики заПрепарат розчинюється протягом двох хвилин хворювань слизових оболонок і шкірних покривів при періодичному потрушуванні пляшки або ампу№98126882 від 15 12 2000р Надруковано "Проли після додавання розчинника (кип'ячена або мислова власність Офіційний бюлетень" №7, дистильована вода, 0,9%-розчин хлориду натрію) 2000р із розрахунку 1 мл розчинника на одну ампулу преМЛА {рН 6,8-8,0) у пробірках лзофілізований промисловий штам Aerococcus vindans І 67 (Зб±І)°С,24-48г. 1-ї генерації МПА (рН 6,8-8,0} у пробірка* Н-і генерації вирощування Агар казеїновий (рИ 6,8-8,0} матраш (36±1)°С,24.48г Зросла мікробна маса на казеїновому агарі сахарозо-желатинове середовище ФІг. ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for producing probiotic of aerococs
Автори англійськоюKremenchutskyi Hennadii Mykolaiovych
Назва патенту російськоюСпособ получения пробиотика из аэрококов
Автори російськоюКременчугский Геннадий Николаевич
МПК / Мітки
МПК: C12N 1/20, C12R 1/01, A61K 35/74
Мітки: спосіб, одержання, пробіотику, аерококів
Код посилання
<a href="https://ua.patents.su/3-53301-sposib-oderzhannya-probiotiku-z-aerokokiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання пробіотику з аерококів</a>
Попередній патент: Система поверхнево-активних речовин, спосіб її одержання та пестицидна композиція
Наступний патент: Стереокамера і пристрій для кріплення стереослайдів
Випадковий патент: Спосіб отримання матеріалу для сорбційних фільтрів







