Каталізатор для фосфорилювання с=х сполук
Номер патенту: 54008
Опубліковано: 25.10.2010
Автори: Колодяжна Анастасія Олегівна, Колодяжна Ольга Олегівна, Колодяжний Олег Іванович
Формула / Реферат
Каталізатор для фосфорилювання С=Х сполук, що являє собою піколіній перхлорат структурної формули:
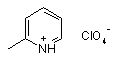 ,
,
який застосовують як каталізатор приєднання третинних фосфітів до С=Х зв'язків із забезпеченням енергійної реакції між реагентами, яка завершується утворенням відповідного фосфонату з високим хімічним виходом та високою чистотою.
Текст
Каталізатор для фосфорилювання С=Х сполук, що являє собою піколіній перхлорат структурної формули: 2 3 До 0.1 моля піколіну в 100 мол води при охолодженні до 0 °С додають 0.011 моля 40 %-ного розчину хлорної кислоти. Потім воду на половину упарюють і охолоджують до 0 °С. Відфільтровують кристалічний піколіній перхлорат, що виділився з розчину. Піколіній перхлорат має такі властивості: Безкольорова кристалічна речовина, що не має запаху, Т. топл. 41-43 °С, яка добре розчинна у воді та спирті, помірно розчинна в хлороформі і хлористому метилені, нерозчинна у гексані, діетиловому етері і етилацетаті. Приклад 2. Синтез діетил (2Е)-гідрокси-3діметил-2,6-октадіенилфосфонату. До 0.01 моля триетилфосфіту і 0.01 моля альдегіду в 3 молях хлористого метилену при 0 °С додають 0.011 моля піколіній перхлорату і залишають при 20 °С на 1 год. Потім відфільтровують реакційну суміш, залишок упарюють у вакуумі водоструминного насоса і витримують у вакуумі 0.01 мм рт. ст. при 80 °С протягом 0.5 год. Вихід 80 %, т. кип. 135 °С (0.08 мм рт. ст.). Спектр ЯМР 1Н (CDC13), , м.ч. (J, Гц): 1.28 т (JHH 7, СН3); 1.29 т (JHH 7, СН3); 1.61 с (3Н, СН3); 1.69 с (3Н, СН3); 2.1 ш (4Н, СН2); 4.12 м (4Н, ОСН2) 4.52 дд (1H, JHH 9, JHP 9); 5.12 ш (1H, СН=С); 5.36 ш (1H, СН=С). Спектр ЯМР 31Р (CDC13), , м. ч.: Р 24.19. Знайдено Р,%: 10.69. С14Н27О4Р. Обчислено Р,%: 10.67. Приклад 3. Синтез діетил 4гідрокси(тетрагідро-2, діметил-2-піран-4ил)фосфонат. До 0.01 моля триетилфосфіту і 0.01 моля альдегіду в 3 мол хлористого метилену при 0°С додають 0.011 моля піколіній перхлорату і залишають при т. кімн. на 1 год. Потім відфільтровують реакційну суміш, залишок упарюють у вакуумі водоструминного насоса й витримують у вакуумі 0.01 мм рт. ст. при 80 °С протягом 1 год. Продукт очищають перегонкою у вакуумі. Вихід 80 %, т. кип 130-135 °С (0.08 мм рт. ст.), т. топл. 72-75 °С. Спектр ЯМР 1Н (CDC13), , м.ч. (J, Гц): 1.19 с [3Н, (СН3)2С]; 1,43 с [3Н, (СН3)2С]; 1.64-19 м (4Н, СН2); 3.65 м (2Н СН2О); 3.95 ш (1Н, ОН); 3.65 м (1Н, СН2); 4.05 м (1Н, СН2); 4.15 д.д (4Н, J 7, J 8, СН3СН2О). Спектр ЯМР 13С (CDCl3), , м.ч. (J, Гц): 16.45 с (СН3СН2); 24.29 с (СН2); 31.09 с (СН3); 32.61 с (СН3); 39.87 с (СН2); 56.1 д (J 12.5, РССН2); 62.8 д (J 8.5, ОСН2); 63.0 д (J 7.5, СН2); 70 д (J 183.5, PC); 70.57 с (СМе2). Спектр ЯМР 31Р (CDCl3), , м. ч.: Р 23.6. Знайдено,%: Р 11.63. С11Н23О5Р. Обчислено,%: Р 11.63. Приклад 4. Синтез 1,1-Біс(діетилфосфоно) (2E)-гідрокси-3, діметил-2,6-октадіен. Суміш кетофосфонату (0.01 моля), триалкілфосфіту (0.01 моля) і піколіній перхлорату (0.01 моля) в 3 мл хлористого метилену перемішують протягом 6 годин. Потім розчинник упарюють, залишок розчиняють в 5 мол ефіру (або ТГФ), відфільтровують, упарюють і залишок очищають хроматографією на колонці з силікагелем. Вихід 65 %, масло. Спектр ЯМР 1Н (CDCl3), , м.ч. (J, Гц): 1.27 т (6Н, J 7, СН3); 1.28 т (6Н, J 7, СН3); 1.6 с (3Н, СН3); 1.63 с (3Н, СН3); 1.8 д (3Н, JHH 8, СН3); 2.0 м (4Н, СН2); 4.21 м (8Н, ОСН2); 4.8 м (1Н, СН=); 5.1 т (1H, JHH 7, СН=). Спектр ЯМР 31Р (CDCl3), , м. ч.: Р 23.3. Знайдено, 54008 4 %: С 50.45; Н 8.41; Р 14.50. C18H36O7P2. Обчислено, %: С 50.70; Н 8.51; Р 14.53. Приклад 5. Синтез діетил феніл [(бензил)аміно]метилфосфонату. До охолодженого до 0 °С розчину 0.01 моля триалкілфосфіту і 0.01 моля основи Шифа в 3 мол хлористого метилену додають 0.01 моля піколіній перхлорату при перемішуванні. Перемішують при 0 °С 30 хвилин, потім підвищують температуру до кімнатної і залишають при перемішуванні на 12 год. Відфільтровують, упарюють розчинник, залишок розчиняють в гексані, відфільтровують, знову упарюють, переганяють у вакуумі. Вихід 70 %. Т. кип. 150 °С (0.08 мм рт. ст.). Спектр ЯМР 31Р (CDCl3), , м. ч. Р : 24. Приклад 6. Синтез діметил феніл [1метил[(бензіл)аміно]метилфосфонату. До охолодженого до 0 °С розчину 0.01 моля триалкілфосфіту і 0.01 моля основи Шифа в 3 мл хлористого метилену додають 0.01 моля піколіній перхлорату при перемішуванні. Перемішують при 0 °С 30 хвилин, потім підвищують температуру до кімнатної і залишають при перемішуванні на 12 год. Відфільтровують, упарюють розчинник, залишок розчинили в гексані, відфільтровують, упарюють. Вихід 70 %. т. топл. 60 °С. Спектр ЯМР 1Н (CDCl3), , м.ч. (J, Гц): 1.4 д (3Н, J 7, СН3), 3.51 м (1Н, NH), 3.79 д (3Н, J 11.8, СН3), 3.83 д (3Н, J 10.1, СН3), 5.2 д (1Н, J 24, РСН), 6.8-7.28 (5Н, м, С6Н5), 7.3 д (2Н, J 8.5), 7.5 д (J 8.5, 2Н, С6Н5). Спектр ЯМР 13С (CDCl3), d, м ч. (J, Гц): 16 д (СН3); 56.1 д (2JPC 7.0, ОСН3), 56.2 д, (2JPC 6.8, ОСН3), 57.2 д (1JPC 150, СН), 114.3 с (СН), 120.0 с (СН), 128.2 д (3JPC 5.8, СН), 128.4 д (3JPC 3.1, СН), 130.1 с (СН), 131.2 с, 140.0 с, 146.6 д (2JPC 14.5). Спектр ЯМР 31Р (CDCl3), , м. ч.: Р: 24. Приклад 7. Синтез діетил (1феніл)етилфосфонату. До охолодженого до 0 °С розчину 0.01 моля триетилфосфіту і 0.01 моля нітростиролу в 3 мол хлористого метилену додають 0.01 моля піколіній перхлорату при перемішуванні. Перемішують при 0 °С 30 хвилин, потім підвищують температуру до кімнатної й залишають при перемішуванні на 6 год. Відфільтровують деяку кількість осаду, упарюють розчинник, залишок перекристалізовують з ацетонітрилу. Вихід 70 %. Т. топл. 65 °С (гексан). Знайдено: Р 10.78 %: C12H18NO5P. Обчислено: Р 10.78 %. Приклад 8. Синтез діетил (пропіламіно)карбонілфосфонату. Змішують 0.01 моля триетилфосфіту, 0.01 моля пропілізоціанату і 0.01 моля піколіній перхлорату. Через 2 години реакційну суміш розбавляють ефіром і відфільтровують. Упарюють розчинник, залишок переганяють у вакуумі. Вихід 90 %, т. кип. 100-110 °С (0.08 мм рт. ст.). Спектр ЯМР 1Н (CDCl3), , м ч. (J, Гц): 0.87 т (3Н, J 7.5, СН3); 1.3 т (6Н, J 7, СН3СН2О); 1.51 м (2Н, СН3СН2СН2); 3,2 к (4Н, J 7, NCH2); 4.15 м (4Н, СН2О): 7.34 ш (1H, NH). Спектр ЯМР 13С (CDCl3), , м ч. (J, Гц): 11.2 д (J 8 ССС); 16.15 д (J 15, СН3СО); 22.6 с (CCCN); 40.98 с (CN), 64.15 д (J 8, ОС); 165 д (JPC 221, PC). Спектр ЯМР 31Р (CDCl3), , м. ч.: Р: 0.71. Знайдено, % N 6.28; Р 13.88. C8H18NO4P. Обчислено, % N 6.28; Р 13.88. Приклад 9. Діетил (алліламіно)тіокарбонілфосфонат. Змішують 0.01 моля три 5 54008 етилфосфіту, 0.01 моля пропілізоціанату і 0.01 моля піколіній перхлорату. Через 2 години реакційну суміш розбавляють ефіром і фільтрують. Упарюють розчинник, залишок переганяють у вакуумі. Вихід 80 %, т. кип. 120 °С (0.08 мм рт. ст.). Жовтувата рідина. Спектр ЯМР 1Н (CDCl3), , м ч. (J, Гц): 1.36 т (6Н, СН3СН2); 4.08-4.3 м (6Н, OCH2+NCH2); 5.27 дд (1Н, J 6, J 1, С=СН2); 5.31 дд (1Н, J 12.5, J 1, С=СН2); 5.91 ддт (1Н, J 17, J 10.2, J 6, СН2СН=С); 9.27 ш (1H, NH). Спектр ЯМР 13C (CDCl3), , м ч. (J, Гц): 16.24 д (J 10, ССО); 42.4 д (J 9, CN); 63 д (J 6, РОС); 119 с (С=СН); 130.7 с (СН2=С); 193 д (J 155, PC). Спектр ЯМР 31Р (CDCl3), , м. ч.: Р -1.7. Знайдено, %: N 5.88; Р 13.37. C8H16NO3PS. Обчислено, %: N 5.90; Р 13.05. Приведені приклади 1-9 свідчать, що запропонований каталізатор дає можливість одержувати фосфонати будь-якої будови з високими виходами продуктів у відсутності розчинника при кімнатній температурі, зменшити затрати реагентів на проведення процесу і спрощує процес, оскільки каталізатор піколіній перхлорат проявляє високу каталітичну активність в реакціях фосфорилювання С=Х сполук. Одержані фосфонати є потенційно біологічно активними речовинами, багато представників яких використовуються як антибіотики, гербіциди, антибактеріальні препарати, біорегулятори, гербіциди, фунгіциди ті ін. Джерела інформації: 1. Heydari, A.; Karimian, A.; Ipaktschi, J. Tetrahedron Lett. 1998, Vol.39, P. 6729. Комп’ютерна верстка Л.Литвиненко 6 2. Azizi, N.; Saidi, M. R. Eur. J. Org. Chem. 2003, P. 4630. 3. Chandrasekhar, S.; Prakash, S. J.; Jagadeshwar, V.; Narsihmulu, Ch.Tetrahedron Lett. 2001, Vol. 42, P. 5561. 4. Ranu, B. C; Hajra, A.; Jana, U. Org. Lett. 1999, Vol. 1, P. 1141. 5. Akiyama, Т.; Sanada, M.; Fuchibe, K. Synlett 2003, P. 1463. 6. Bhagat, S.; Chakraborty, A. K. J. Org. Chem. 2007, Vol. 72, P. 1263. 7. Reddy, Y. Т.; Reddy, P. N.; Kumar, B. S.; Rajput, P.; Sreenivasulu, N.; Rajitha, B. Phosphorous, Sulphur, Silicon Relat. Elem. 2007, Vol. 182, P. 161. 8. Heydari, A.; Arefi, A. Catal. Commun. 2007, Vol. 8, P. 1023. 9. Gosh, R.; Maiti, S.; Chakraborty, A.; Maiti, D. K. J. Моl. Catal. A: Chem. 2004, Vol. 210, P. 53. 10. Schlemminger, I.; Willecke, A.; Maison, W.; Koch, R.; Lutzen, A.; Martens, J. J. Chem. Soc., Perkin Trans. 1, 2001, P. 2804. 11. Laschat, S.; Kunz, H. Synthesis 1992, P. 90. 12. Manjula, A.; Rao, V.; Neelakanthan, P. Synth. Commun. 2003, Vol. 33, P. 2963. 13. Yager, K. M; Taylor, С M; Smith, A. B. J. Am. Chem. Soc. 1994, Vol. 116, P. 9377. 14. Simoni, D.; Invidiata, F. P.; Manferdini, M; Lampronti, I.; Rondanin, R.; Roberti, M.; Pollini, G. P. Tetrahedron Lett. 1998, Vol. 39, P. 7615. 15. Klepacz, A.; Zwierzak, A. Tetrahedron Lett. 2002, Vol. 43, P. 1079. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCatalyst for the phosphorylation of c=x compounds
Автори англійськоюKolodiazhnyi Oleh Ivanovych, Kolodiazhna Olha Olehivna, Kolodiazhna Anastasia Olehivna
Назва патенту російськоюКатализатор для фосфорилирования с=х соединений
Автори російськоюКолодяжный Олег Иванович, Колодяжная Ольга Олеговна, Колодяжная Анастасия Олеговна
МПК / Мітки
МПК: C07C 27/00
Мітки: с=х, каталізатор, сполук, фосфорилювання
Код посилання
<a href="https://ua.patents.su/3-54008-katalizator-dlya-fosforilyuvannya-skh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Каталізатор для фосфорилювання с=х сполук</a>
Попередній патент: Спосіб лікування первинної дисплазії кульшового суглоба
Наступний патент: П’єзопривід
Випадковий патент: Сигаретна пачка







