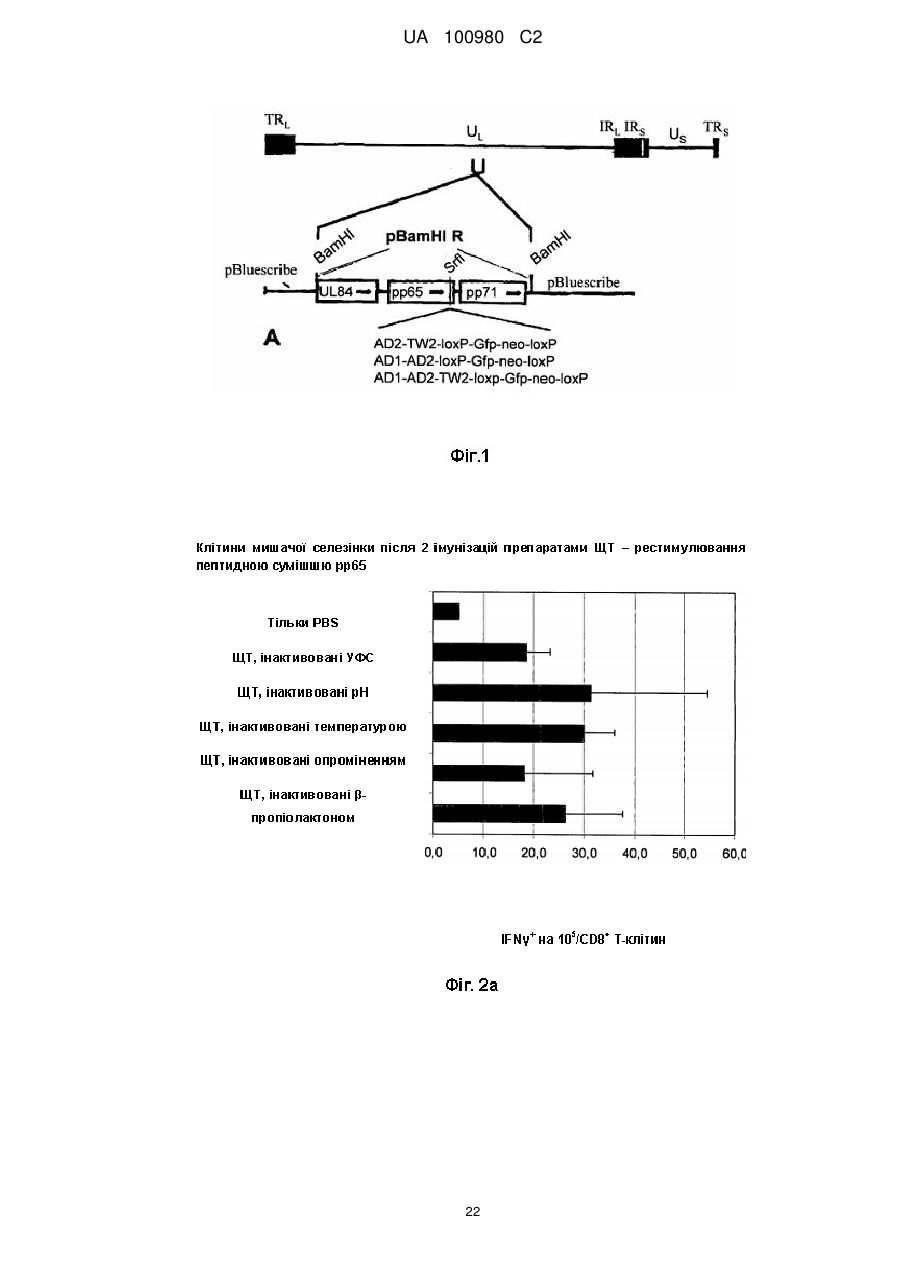
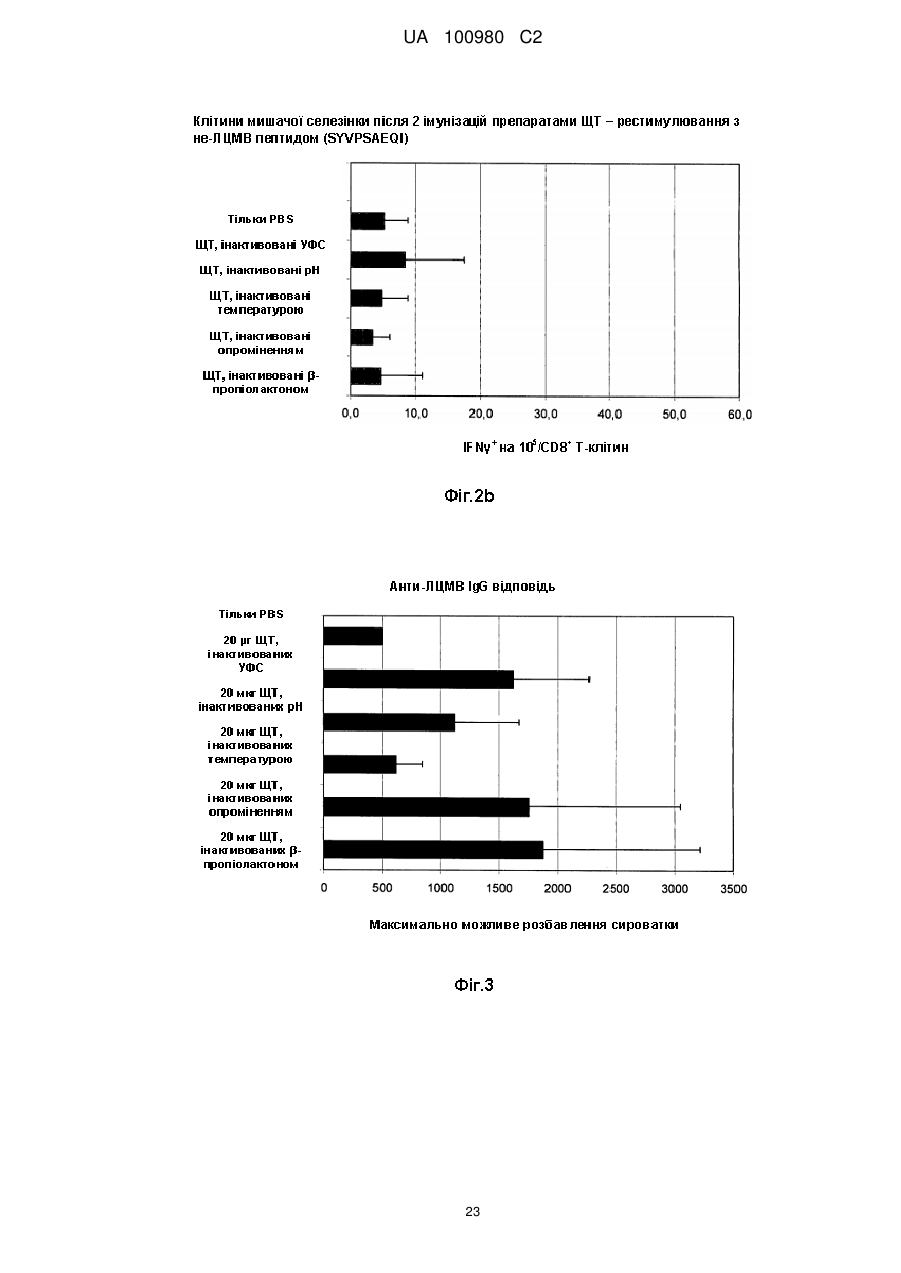
Композиція, що включає частинки людського цитомегаловірусу (лцмв)
Формула / Реферат
1. Композиція, що включає агент, вибраний із групи, що включає ЛЦМВ віріони, ЛЦМВ щільні тіла й ЛЦМВ НІОЧ, яка відрізняється тим, що композиція здатна до індукування імунної реакції, хоча віріони, НІОЧ та/або щільні тіла є нефузіогенними.
2. Композиція за п. 1, де імунною реакцією є антиген-специфічна CD8+ відповідь.
3. Композиція за будь-яким з пунктів 1-2, де імунною реакцією є антиген-специфічна цитотоксична Т-клітинна відповідь.
4. Композиція за будь-яким з пунктів 1-3, де імунною реакцією є антиген-специфічна CD8+, цитотоксична Т-клітинна відповідь.
5. Композиція за будь-яким з пунктів 1-4, де імунною реакцією є антиген-специфічна гуморальна імунна відповідь, переважно імунною реакцією є антиген-специфічна гуморальна імунна відповідь, причому антитіла є нейтралізуючими антитілами.
6. Композиція за будь-яким з пунктів 1-5, де імунною реакцією є антиген-специфічна CD4+ Т-хелперна відповідь.
7. Композиція за будь-яким з пунктів 1-6, де антигеном є ЛЦМВ антиген, причому ЛЦМВ антиген переважно вибраний із групи, що включає рр65 антиген, похідні рр65 антигену, рр28 й рр28 похідні, рр150 й рр150 похідні, gВ і похідні gВ, gН й gН похідні, і безпосередньо ранні антигени і їх похідні, глікопротеїни й похідні глікопротеїну, переважно ЛЦМВ глікопротеїни і похідні ЛЦМВ глікопротеїну, причому глікопротеїнами є переважно gМ і gМ похідні або gN і gN похідні.
8. Композиція за будь-яким з пунктів 1-7, де агент є інактивованим.
9. Композиція за будь-яким з пунктів 1-8, де композиція є фармацевтичною композицією або діагностичною композицією.
10. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва медикаменту, переважно для індукування імунної реакції проти одного або декількох антигенів ЛЦМВ.
11. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому композиція та/або агент піддані інактивуванню, для виробництва медикаменту для індукування імунної реакції, переважно імунної реакції проти одного або декількох антигенів ЛЦМВ.
12. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва вакцини.
13. Застосування за п. 12, де композиція та/або агент піддані інактивуванню.
14. Застосування за будь-яким з пунктів 12 та 13, де імунною реакцією є антиген-специфічна CD8+ відповідь.
15. Застосування за будь-яким з пунктів 12-14, де імунною реакцією є антиген-специфічна цитотоксична Т-клітинна відповідь.
16. Застосування за будь-яким з пунктів 12-15, де імунною реакцією є антиген-специфічна CD8+, цитотоксична Т-клітинна відповідь.
17. Застосування за будь-яким з пунктів 12-16, де імунною реакцією є антиген-специфічна гуморальна імунна відповідь, переважно імунною реакцією є антиген-специфічна гуморальна імунна відповідь, причому антитіла є нейтралізуючими антитілами.
18. Композиція за будь-яким з пунктів 12-17, де імунною реакцією є антиген-специфічна CD4+ Т-хелперна відповідь.
19. Застосування за будь-яким з пунктів 12-18, де антигеном є ЛЦМВ антиген, причому ЛЦМВ антиген переважно вибраний із групи, що включає рр65 антиген, похідні рр65 антигену, рр28 й рр28 похідні, рр150 й рр150 похідні, gВ і похідні gВ, gН й gН похідні, і безпосередньо ранні антигени і їх похідні, глікопротеїни й похідні глікопротеїну, переважноЛЦМВ глікопротеїни і похідні ЛЦМВ глікопротеїну, причому глікопротеїнами є переважно gМ і gМ похідні або gN і gN похідні.
20. Застосування за будь-яким з пунктів 12-19, де вакцина призначена для лікування та/або профілактики ЛЦМВ інфекції.
21. Застосування за будь-яким з пунктів 12-20, де вакцина призначена для лікування та/або профілактики захворювання, викликаного ЛЦМВ, у донорів трансплантатів та/або реціпієнтів трансплантатів.
22. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва діагностичного агента.
23. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому композиція та/або агент піддані інактивуванню, для виробництва діагностичного агента.
24. Спосіб виробництва композиції за будь-яким з пунктів 1-9, що включає стадії:
a) забезпечення агента, вибраного із групи, що включає ЛЦМВ віріони, ЛЦМВ НІОЧ і щільні тіла ЛЦМВ;
b) обробку агента для надання йому нефузіогенності, причому згадуваний агент є усе ще здатним до індукування імунної реакції.
25. Спосіб за пунктом 24, де обробка на стадії b) є одним або будь-якою комбінацією засобів, вибраних із групи, що включає УФ обробку, опромінення високою енергією, обробку низьким рН, термообробку й обробку з агентами перехресного зшивання.
26. Спосіб за пунктом 25, де УФ-обробкою є обробка УФС, причому довжина хвилі становить приблизно 100 нм - 280 нм, або УФ-довгохвильова обробка.
27. Спосіб за будь-яким з пунктів 25 та 26, де УФ-обробку використовують в діапазоні доз від 100 до 2000 мДж/см2, переважно від 100 до 1000 мДж/см2 і більш переважно від 150 до 900 мДж/см2.
28. Спосіб за будь-яким з пунктів 25-27, у якому перед, одночасно або після УФ-обробки агент піддають опроміненню гамма-променями.
29. Спосіб за пунктом 25, в якому опромінення високою енергією є опроміненням гамма-променями.
30. Спосіб за пунктом 29, в якому гамма-випромінювання у сполученні з гамма-опроміненням здійснюють в межах діапазону доз приблизно від 15-70 кГр, більш переважно 20-65 кГр і найбільш переважно 20-60 кГр.
31. Спосіб за пунктом 25, де обробкою є обробка низьким рН, і обробка низьким рН включає експозицію агента щодо рН від приблизно 0 до 5, переважно 1-4,5 і більш переважно 2-4,5.
32. Спосіб за пунктом 31, у якому агент піддають обробці низьким рН протягом приблизно 0,5-24 годин, переважно 0,5-12 годин і більш переважно 0,5-6 годин.
33. Спосіб за будь-яким з пунктів 31 та 32, в якому агент піддають обробці низьким рН при температурі приблизно 1-50 °С, переважно 1-45 °С і більш переважно 1-40 °С.
34. Спосіб за пунктом 25, в якому термообробка включає інкубування агента при температурі між 37,5 °С і 65 °С, переважно при температурі між 37,5 і 60 °С і більш переважно при температурі між 37,5 і 56 °С.
35. Спосіб за пунктом 34, в якому агент інкубують протягом періоду між 5 сек. і 36 год., переважно між 5 сек. і 30 год. і більш переважно між 5 сек. і 24 год.
36. Спосіб за пунктом 25, в якому обробкою є обробка з одним або декількома агентами перехресного зшивання, й причому агент перехресного зшивання, кожен і незалежно, вибраний із групи, що включає лактони, етоксиди та альдегіди.
37. Спосіб за пунктом 36, в якому агентом перехресного зшивання є b-пропіолактон.
38. Спосіб за пунктом 36, в якому агентом перехресного зшивання є оксид етилену.
39. Спосіб за пунктом 36, в якому агентом перехресного зшивання є формальдегід.
40. Спосіб за будь-яким з пунктів 36-39, в якому агент піддають дії агента перехресного зшивання з концентрацією агента перехресного зшивання і більш переважно b-пропіолактону, у середовищі, що містить агент в концентрації між 0,01 й 10 % (об/об), переважно між 0,05 й 10 % (об/об) і більш переважно між 0,05 й 7,5 % (об/об).
41. Спосіб за будь-яким з пунктів 36-40, в якому агент інкубують з агентом перехресного зшивання, переважно з b-пропіолактоном, протягом періоду між 1 хвилиною та 72 год., переважно між 1 хвилиною та 48 год. і більш переважно між 1 хвилиною та 24 год.
42. Спосіб за будь-яким з пунктів 36-41, в якому агент інкубують при температурі між приблизно 1 °С і приблизно 60 °С, переважно при температурі між приблизно 1 °С і 50 °С, більш переважно при температурі між приблизно 1 °С і 40 °С.
Текст
Реферат: Винахід належить до композиції, що включає агент, вибраний з віріонів цитомегаловірусу людини – ЛЦМВ (hCMV), щільних тілець (DB) ЛЦМВ або неінфекційних частинок НІОЧ (NIEPs) UA 100980 C2 (12) UA 100980 C2 ЛЦМВ, яка здатна до індукування імунної реакції, хоча вказані агенти є нефузіогенними. Винахід також належить до застосування даного агента, який є нефузіогенним, для виробництва медикаменту для індукування імунної реакції проти одного або декількох антигенів ЛЦМВ або для виробництва вакцини. UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 Представлений винахід відноситься до композиції, що включає агент, причому такий агент вибраний із групи, що включає ЛЦМВ віріони, ЛЦМВ щільні тіла й ЛЦМВ НІОЧ, застосування таких композицій і способу одержання такої композиції. Людський цитомегаловірус (ЛЦМВ), β-герпевірус, є убіквітарним патогеном. В імунокомпетентних персон ЛЦМВ інфекція є звичайно непоміченою, що проявляється самими помірними і неспецифічними симптомами. На відміну від цього, у певних групах ризику, наприклад, в імуносупресивних пацієнтів, таких як пацієнти із СНІД або реціпієнти трансплантатів і після пренатальної інфекції, ЛЦМВ інфекція має серйозні прояви. Існують доступні хіміотерапевтичні засоби для лікування ЛЦМВ інфекції. Успіх противірусної хіміотерапії ЛЦМВ інфекції обмежений, зокрема, токсичністю медикаментів і розвитком резистентних варіантів вірусу при пролонгованому лікуванні. Крім того, профілактичне або терапевтичне застосування противірусних гіперімунних сироваток мало достовірно тільки обмежену ефективність. Робота над розвитком вакцини проти ЛЦМВ велася багато років. Так, були зроблені спроби з ослабленими (атенуйованими) живими вакцинами індукувати бажаний іммунітет. Однак, ця вакцина, як виявилося, мала тільки обмежену ефективність. Причиною цього може бути, серед іншого, обмежена життєздатність таких атенуйованих вірусів на людях і штамо-специфічні варіації в антигенності. Внаслідок недостатнього індукування перманентного імунітету, застосування живої вакцини повинно бути розцінене критично; дефіцит знань про патогенетичні механізми ЛЦМВ інфекції і ризик реактивування вакцинного штаму після імуносупресії змушує розглядати застосування живої вакцини принаймні сумнівним у цих клінічних ситуаціях. Щоб уникнути цих ризиків, стратегії недавно переважно проводилися у напрямку розвитку субодиничних вакцин проти ЛЦМВ, які містять протеїни вірусної оболонки, синтезовані в різних системах експресії. Такі оболонкові протеїни, особливо глікопротеїни gB та gH, є істотними антигенами-мішенями для нейтралізуючих антитіл проти ЛЦМВ. Нейтралізуючі антитіла здатні запобігти інфекції. Було можливо як на експериментальних тваринах, так і в клінічних дослідженнях індукувати такі нейтралізуючі антитіла з gB субодиничною вакциною. Однак, у людей гуморальна імунна відповідь, індукована таким чином, як виявилося, була нетривалою і не прийнятною для запобігання інфекції у всіх випадках. Широке застосування субодиничних вакцин, які базуються винятково на gB ЛЦМВ, є шкідливим. Як припускається, причинами обмеженої ефективності таких антигенних препаратів, у свою чергу, є штамо-специфічні варіації в імунній реакції, дефіцит індукування адекватної клітинної імунної реакції та структурні обмеження використовуваного антигену, антигенні детермінанти (епітопи) якого у деяких випадках, як відомо, є конформаційно-залежними. Тому, на основі цього досвіду, вимоги щодо ефективної й широко застосовуваної вакцини проти ЛЦМВ, є наступні: (1) тривале індукування нейтралізуючих антитіл, які захищають від ЛЦМВ інфекції штамо-перекриваючим способом. Це вимагає ефективного індукування так називаної "хелперної відповіді" (CD4-позитивні Т-лімфоцити) проти ЛЦМВ, що допомагає дозріванню антитіло-секретувальним В-лімфоцитам. (2) Індукування утворення цитотоксичних Т-клітин проти ЛЦМВ. Лімфоцити цього типу мають першорядну важливість для завершення ЛЦМВ інфекції, що мала місце й обмеження поширення вірусу в організмі. (3) Зменшення побічних ефектів вакциною. Ризик, що міг би відбутися від вакцинації життєздатним вірусом, у якого, згідно з останніми даними, буде здатність щодо встановлення латентності після імуносупресії, не може бути оцінений. Тому, ціль повинна полягати в тому, щоб одержати нежиттєздатний вірусний антиген у якості вакцини. Вакцина такого типу описана в міжнародній заявці WO 00/53729. Хоча цей вид вакцин - звичайно корисний, повинна бути відповідність високим стандартам в термінах редукування залишкової інфективності такого виду вірусних частинок через можливу присутність залишкових інфекційних ЛЦМВ віріонів. Тому, проблема, що лежить в основі представленого винаходу, полягала в тому, щоб забезпечити композицію, яка включає частинки людського цитомегаловірусу (ЛЦМВ), і більш конкретно, віріони ЛЦМВ та/або щільні тіла ЛЦМВ, які не мають залишкової інфективності, зокрема, ніякої залишкової інфективності у дослідженні, як описано тут. Подальша проблема, що лежить в основі представленого винаходу, полягає в тому, щоб охопити види частинок ЛЦМВ, що є неінфекційними, але забезпечують антиген-специфічну CD8 + цитотоксичну Т-клітинну відповідь. Подальша проблема, що лежить в основі представленого винаходу, полягає в тому, щоб охопити види частинок ЛЦМВ, що є неінфекційними, але забезпечують антиген-специфічну імунну реакцію, причому така імунна реакція включає антитіла проти антигену, переважно нейтралізуючи антитіла проти антигену. Ці й інші проблеми вирішені змістом незалежних пунктів формули. Переважні варіанти 1 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 реалізації можуть бути взяті із залежних пунктів формули. Більш конкретно, проблема, що лежить в основі представленого винаходу, вирішена в першому аспекті композицією, яка включає агент, вибраний із групи, що містить ЛЦМВ віріони, ЛЦМВ щільні тіла й ЛЦМВ НІОЧ, причому композиція здатна до індукування імунної реакції, хоча віріони, НІОЧ та/або щільні тіла є нефузіогенними. У варіанті реалізації агент є неінфекційним. Проблема, що лежить в основі представленого винаходу, вирішена в другому аспекті композицією, яка включає агент, вибраний із групи, що містить ЛЦМВ віріони, ЛЦМВ щільні тіла й ЛЦМВ НІОЧ, причому композиція здатна до індукування імунної реакції, хоча віріони, НІОЧ та/або щільні тіла є нефузіогенними, при цьому композицію одержують способом, що включає стадії: a) забезпечення одного або декількох агентів; b) обробка агента (ів), щоб надати їм є нефузіогенності і зберегти здатність до стимулювання імунної реакції. У варіанті реалізації агент є неінфекційним. У варіанті реалізації першого й другого аспекту імунна реакція - антиген-специфічна CD8 + відповідь. У варіанті реалізації першого й другого аспекту імунна реакція - антиген-специфічна цитотоксична Т-клітинна відповідь. У варіанті реалізації першого й другого аспекту імунна реакція - антиген-специфічна CD8 +, цитотоксична Т-клітинна відповідь. У варіанті реалізації першого й другого аспекту імунна реакція - антиген-специфічна гуморальна імунна відповідь, переважно імунна реакція - антиген-специфічна гуморальна імунна відповідь, причому антитіла є нейтралізуючими антитілами. У варіанті реалізації першого й другого аспекту імунна реакція - антиген-специфічна CD4 + Т-хелперна відповідь. У варіанті реалізації першого й другого аспекту антиген - ЛЦМВ антиген, причому ЛЦМВ антиген переважно вибраний із групи, що включає pp65 антиген, похідні pp65 антигену, pp28 й pp28 похідні, pp150 й pp150 похідні, gB і похідні gB, gH й gH похідні, і безпосередньо ранні антигени і їх похідні, глікопротеїни й похідні глікопротеїну, переважно ЛЦМВ глікопротеїни і похідні ЛЦМВ глікопротеїну, причому глікопротеїни - переважно gM i gM похідні або gN i gN похідні. У межах групи безпосередньо ранніх антигенів, особливо переважний - безпосередньо ранній антиген-1 (БР-1). У варіанті реалізації першого й другого аспекту агент - інактивований. У варіанті реалізації першого й другого аспекту композиція - фармацевтична композиція або діагностична композиція. Проблема, що лежить в основі представленого винаходу, вирішена в третьому аспекті використанням агента, причому агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва медикаментів, переважно для індукування імунної реакції проти одного або декількох антигенів ЛЦМВ. Проблема, що лежить в основі представленого винаходу, вирішена в четвертому аспекті використанням агента, причому агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, переважно композиції, визначеної у третьому аспекті, причому композиція та/або агент піддані інактивуванню, для виробництва медикаментів для індукування імунної реакції, переважно проти одного або декількох антигенів ЛЦМВ. Проблема, що лежить в основі представленого винаходу, вирішена в п'ятому аспекті використанням агента, причому агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва вакцини. Проблема, що лежить в основі представленого винаходу, вирішена в шостому аспекті використанням агента, причому агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, переважно композиції, визначеної у третьому аспекті, причому композиція та/або агент піддані інактивуванню, для виробництва вакцини. У варіанті реалізації третього й четвертого аспекту, імунна реакція - антиген-специфічна CD8 + відповідь. У варіантах реалізації третього - шостого аспектів імунна реакція - антиген-специфічна 2 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 цитотоксична Т-клітинна відповідь. У варіантах реалізації третього - шостого аспектів імунна реакція - антиген-специфічна CD8 +, цитотоксична Т-клітинна відповідь. У варіантах реалізації третього - шостого аспектів імунна реакція - антиген-специфічна гуморальна імунна відповідь, переважно імунна реакція - антиген-специфічна гуморальна імунна відповідь, причому антитіла є нейтралізуючими антитілами. У варіантах реалізації третього - шостого аспектів імунна реакція - антиген-специфічна CD4 + Т-хелперна відповідь. У варіантах реалізації третього - шостого аспектів, антиген - ЛЦМВ антиген, причому ЛЦМВ антиген переважно вибраний із групи, що включає pp65 антиген, похідні pp65 антигену, pp28 й pp28 похідні, pp150 й pp150 похідні, gB і похідні gB, gH й gH похідні, і безпосередньо ранні антигени і їх похідні, глікопротеїни й похідні глікопротеїну, переважно ЛЦМВ глікопротеїни і похідні ЛЦМВ глікопротеїну, причому глікопротеїни - переважно gM i gM похідні або gN i gN похідні. У варіанті реалізації п'ятого й шостого аспекту вакцина призначена для лікування та/або запобігання ЛЦМВ інфекції. У варіанті реалізації п'ятого й шостого аспекту вакцина призначена для лікування та/або профілактики захворювання, викликаного ЛЦМВ у донора трансплантату та/або реціпієнта трансплантату. Проблема, що лежить в основі представленого винаходу, вирішена в сьомому аспекті використанням агента, причому агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва діагностичного агента. Проблема, що лежить в основі представленого винаходу, вирішена у восьмому аспекті використанням агента, причому агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому композиція та/або агент піддані інактивуванню, для виробництва діагностичного агента. Проблема, що лежить в основі представленого винаходу, вирішена в дев'ятому аспекті способом виробництва композиції, як визначено в першому й другому аспекті, що включає стадії: a) забезпечення агента, вибраного із групи, що включає ЛЦМВ віріони, ЛЦМВ НІОЧ і щільні тіла ЛЦМВ; b) обробка агента для надання йому нефузіогенності при збереженні здатності до індукування імунної реакції. У варіанті реалізації дев'ятого аспекту обробка на стадії b) є одним або будь-якою комбінацією способів, вибраних із групи, що включає УФ обробку, опромінення високою енергією, обробка низьким рН, термообробку й обробку з агентами перехресного зшивання. У переважному варіанті реалізації дев'ятого аспекту УФ-обробка - обробка УФ С (обробка УФ-променями спектру С), причому довжина хвилі становить приблизно 100 нм - 280 нм або УФ довгохвильова обробка. Саме в межах представленого винаходу замість використання УФ C для інактивування, також може використовуватися довгохвильова УФ обробка. У такому випадку довгохвильова УФ обробка використовується разом з фотореактивним агентом, що активізується згадуваним довгохвильовим УФ. У варіанті реалізації такий фотореактивний агент - атомосален, що використовується разом з УФ A (УФ-променями спектру А), 4'-амінометил-4,5',8триметилпсорален, що використовується разом з УФ A, і диметилметиленовий синій, що використовується разом з УФ A й УФ B (УФ-променями спектру В), відповідно. У варіанті реалізації дев'ятого аспекту, при УФ-обробці використовуть діапазон доз від 2 приблизно 100 до приблизно в 2000 мJ/cм , переважно від приблизно 100 приблизно до 1000 2 2 мJ/cм , і більш переважно, від приблизно 150 приблизно до 900 мJ/cм . У варіанті реалізації дев'ятого аспекту перед, одночасно або після УФ обробки агент піддають опроміненню гамма-променями. У переважному варіанті реалізації дев'ятого аспекту опромінення високою енергією є опроміненням гамма-променями. В додатковому переважному варіанті реалізації дев'ятого аспекту гамма випромінювання у сполученні з гамма опроміненням проводять в межах діапазону доз від приблизно 15 приблизно до 70 KGy, більш переважно приблизно 20 приблизно до 65 KGy і більш переважно приблизно 20 приблизно до 60 KGy. 3 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 У варіанті реалізації дев'ятого аспекту обробка є обробкою низьким рН, і обробка низьким рН включає експозицію агента шодо pН від приблизно 0 до 5, переважно 1-4,5 і більш переважно 2-4,5. У переважному варіанті реалізації дев'ятого аспекту агент піддають обробці низьким рН від приблизно 0,5 до 24 годин, переважно приблизно від 0,5 до 12 годин і більш переважно – від приблизно 0,5 до 6 годин. У варіанті реалізації дев'ятого аспекту агент піддають обробці низьким рН при приблизно 150 °C, переважно при приблизно 1-45 °C і більш переважно при приблизно 1-40 °C. У варіанті реалізації дев'ятого аспекту термообробка включає інкубування агента при температурі між приблизно 37,5 °C і приблизно 65 °C, переважно при температурі між приблизно 37,5 і приблизно 60 °C і більш переважно, при температурі між приблизно 37,5 і приблизно 56 °C. У переважному варіанті реалізації дев'ятого аспекту агент інкубували протягом періоду приблизно між 5 сек. й приблизно 36 год., переважно приблизно між 5 сек. й приблизно 30 год., і більш переважно, приблизно між 5 сек. й приблизно 24 год. У варіанті реалізації дев'ятого аспекту обробка є обробкою одним або декількома агентами перехресного зшивання й причому агент перехресного зшивання, кожен і незалежно, вибраний із групи, що включає лактони, етоксиди й альдегіди. У варіанті реалізації дев'ятого аспекту агентом перехресного зшивання є β-пропіолактон. У варіанті реалізації дев'ятого аспекту агентом перехресного зшивання є оксид етилену. У варіанті реалізації дев'ятого аспекту агентом перехресного зшивання є формальдегід. У варіанті реалізації дев'ятого аспекту агент піддають дії агенту перехресного зшивання з концентрацією агента перехресного зшивання й, більш переважно - β-пропіолактону, у середовищі, що містить агент, між приблизно 0,05 і приблизно 10 % (об/об), переважно між приблизно 0,05 і приблизно 10 % (об/об), і більш переважно, між приблизно 0,05 і приблизно 7,5 % (об/об). У варіанті реалізації дев'ятого аспекту агент інкубують з агентом перехресного зшивання й, переважно - β-пропіолактоном. протягом періоду приблизно між 1 хвилиною й приблизно 72 год., переважно приблизно між 1 хвилиною й приблизно 48 год., і більш переважно приблизно між 1 хвилиною й приблизно 24 год. У варіанті реалізації дев'ятого аспекту агент інкубували при температурі між приблизно 1 °C і приблизно 60 °C, переважно при температурі між приблизно 1 °C і приблизно 50 °C, більш переважно при температурі між приблизно 1 °C і приблизно 40 °C. Відповідно до попереднього рівня техніки вважається, що частинки людського цитомегаловірусу (ЛЦМВ), щоб генерувати антиген-специфічну CD8 + цитотоксичну Т-клітинну відповідь на вірусні антигени й інфіковані вірусом клітини, повинні злитися з мембраною клітини-мішені (Pepperl й інші 2000 J Virol 74:6132-6146). Це злиття вважають передумовою, щоб спрямувати вірусні антигени в напрямку MHC (major histocompatibility complex - головний комплекс гістосумісності) класу І процесингу і представлення антигена, або безпосередньо після входження в клітини або зразу за внутрішньоклітинною транскрипцією й трансляцією вірусних протеїнів (Pepperl й інші 2000 J Virol 74:6132-6146). Представлення антигену через шлях MHC класу І у свою чергу є передумовою для імунної системи щодо можливості встановити або виявити (індукувати) антиген-специфічну CD8+, цитотоксичну T-клітинну відповідь на вірусні антигени й інфіковані вірусом клітини. Винахідники виявили, що частинки людського цитомегаловірусу (ЛЦМВ), які більше не є фузіогенними, залишаються здатними до індукування такого виду антиген-специфічної CD8 +, цитотоксичної T-клітинної відповіді на вірусні антигени й інфіковані вірусом клітини. Це стосується, зокрема, частинок ЛЦМВ, які були або оброблялися, або були утворені шляхом застосування одного або кількох засобів і способів, відповідно, описаних тут для будь-якої інактивації й процедури інактивування або у зв'язку з ними, відповідно. Це перше відкриття представленого винаходу є настільки несподіваним відносно попереднього рівня техніки, що така фузіогенність частинок ЛЦМВ, як вважали, була передумовою для цього виду T-клітинної відповіді, як описано вище. Така нефузіогенність може бути одержана шляхом застосування до частинок ЛЦМВ засобів і способів, що в основному, традиційно відомі у галузі інактивування ЛЦМВ або зменшення інфективності ЛЦМВ і частинок ЛЦМВ, переважно тих засобів й способів, описаних тут, які також згадуються як засоби й способи, відповідно, описані тут для процедур інактивування й інактивацією або у зв'язку з ними. Ці засоби й способи інактивації або інактивування, відповідно, використовуються й здійснюються в тій мірі, в якій згадувана нефузіогенність надана або передана таким частинкам ЛЦМВ. 4 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 Друге відкриття, що лежить в основі представленого винаходу, пов'язане із одержанням частинок ЛЦМВ або композицій, що включають такі частинки людського цитомегаловірусу (ЛЦМВ), які не мають інфективності, переважно не мають залишкової інфективності, причому згадувані частинки людського цитомегаловірусу (ЛЦМВ) і композиції, що включають їх, одержували, застосовуючи будь-який із засобів і способів, відповідно, розкритих тут у зв'язку з першим аспектом представленого винаходу, починаючи із частинок ЛЦМВ або композицій, що містили частинки ЛЦМВ, і крім того. містили інфекційні частинки людського цитомегаловірусу (ЛЦМВ) й зокрема віріони ЛЦМВ. Також цей вид частинок ЛЦМВ, як несподівано було виявлено, був прийнятний, щоб індукувати імунну реакцію, як описано тут, зокрема, антиген-специфічну CD8 + цитотоксичну Т-клітинну відповідь, антиген-специфічну гуморальну імунну відповідь, причому гуморальна імунна відповідь - переважно відповідь, що забезпечується антигенспецифічними нейтралізуючими антитілами, і антиген-специфічною CD4 + Т-хелперною відповіддю. Серед фахівців у даній галузі загальновідомо, що індукування антиген-специфічних гуморальних імунних відповідей і антиген-специфічних CD8 + цитотоксичних T-клітинних відповідей, відповідно, вимагає генерування антиген-специфічних CD4+T-хелперів. Тому, в представленому винаході генерація антиген-специфічних CD4+T-хелперів підтверджується pp65-специфічними CD8+цитотоксичними T-клітинними відповідями і генерацією антитіл, зокрема, нейтралізуючих антитіл, специфічних щодо антигенів ЛЦМВ. Отже, частинки людського цитомегаловірусу (ЛЦМВ), які одержали обробку, щоб інактивувати залишкову інфективність ЛЦМВ і надати матеріалу нефузіогенності, зберігають здатність індукувати антиген-cпецифічну CD4+T-хелперну відповідь. Як переважно використовується тут, термін "відсутність залишкової інфективності" означає, що ніяка інфекційна частинка й зокрема, ніяка інфекційна частинка ЛЦМВ не можуть бути виявлені у зразку або композиції, що включає частинки людського цитомегаловірусу (ЛЦМВ), використовуючи тестування інфективності, більш переважно, тестування інфективності, як описано тут. Інакше кажучи, композиція або препарат, що містить один або декілька щільних тіл ЛЦМВ, віріонів ЛЦМВ та/або ЛЦМВ НІОЧ, є композицією або препаратом, відповідно, у якому ніякі інфекційні ЛЦМВ або частинки ЛЦМВ не можуть бути виявлені в тестуванні інфективності. Фахівцем у даній галузі буде визнано, чи буде встановлена межа виявлення і якщо так, то до якого ступеня, тобто, скільки таких частинок ЛЦМВ присутні у відповідній композиції й препараті, відповідно. Як переважно використовується тут термін частинки людського цитомегаловірусу (ЛЦМВ) включає - ЛЦМВ віріони, ЛЦМВ щільні тіла й ЛЦМВ НІОЧ. Як переважно використовуються тут віріони ЛЦМВ це інфекційні вірусні частинки, які складаються з мембрани, оболонки й капсиду, що містять вірусну ДНК. Як переважно використовуються тут ЛЦМВ щільні тіла (ЩТ) є неінфекційними частинками ЛЦМВ, які мають дефіцит капсиду ЛЦМВ і ДНК ЛЦМВ, але включають мембрану й оболонку. Як переважно використовуються тут ЛЦМВ НІОЧ це неінфекційні оболонкові частинки ЛЦМВ (ЛЦМВ), які мають дефіцит у ДНК, але включають мембрану, капсулу вірусу й оболонку. Як переважно використовується тут, термін щільні тіла включає як нерекомбінантні, так і рекомбінантні щільні тіла. Рекомбінантні щільні тіла переважно експресують один або кілька гетерологічних антигенів. Як переважно використовується тут термін НІОЧ включає й нерекомбінантні і рекомбінантні НІОЧ. Рекомбінантні НІОЧ переважно експресують один або кілька гетерологічних антигенів. Як переважно використовується тут термін віріони включають і нерекомбінантні ген і рекомбінантні віріони. Рекомбінантні віріони переважно експресують один або кілька гетерологічних антигенів. Як переважно використовується тут термін гетерологічний антиген це антиген, що експресований у різному експресійному середовищі. В одному з варіантів реалізації такий різне середовище експресії є середовищем, в якому антиген є антигеном, що не є властивим відповідному дикому типу щільних тіл, НІОЧ й віріонів. Більш конкретно, гетерологічний антиген це переважно антиген, який є внутрішнім компонентом частинки ЛЦМВ, що включає, але не обмежується ним, неструктурний антиген ЛЦМВ або антиген гетерологічного організму, переважно гетерологічного патогену. В додатковому варіанті реалізації такий різне середовище це середовище, що відрізняється від середовища дикого типу, у якому промотор, який контролює експресію антигену, відрізняється від промотора, що контролює експресію антигену в дикому типі щільних тіл, НІОЧ й віріонів. В додатковому варіанті реалізації різне середовище складається з різної трансляційної системи або трансляційного фону, де експресується антиген, котрий, знову, відрізняється від системи дикого типу або фону дикого типу. Більш конкретно, 5 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 щільні тіла дикого типу це ЛЦМВ щільні тіла дикого типу, дикий тип НІОЧ є диким типом ЛЦМВ НІОЧ, і дикий тип віріонів це дикий тип віріонів ЛЦМВ. Як переважно використовується тут, дикий тип означає штам або штам, який здатний до утворення щільних тіл, переважно за умов клітинної культури in vitro. Такий дикий тип або штам дикого типу є переважно Ad169 й Towne. Буде визнано, що будь-яке твердження, варіанти реалізації, особливість або перевага, описані тут у зв'язку із частинками ЛЦМВ, є також й зокрема застосовними до щільних тіл ЛЦМВ й ЛЦМВ НІОЧ і більш конкретно, застосовними до щільних тіл ЛЦМВ. Як переважно використовується тут термін фузіогенність визначає здатність вірусних і субвірусних частинок, таких як ЛЦМВ, з'єднуватися з клітинами-мішенями шляхом злиття вірусної й субвірусної мембрани частинки, відповідно, із клітинною мембраною клітини-мішені. Такі вірусні й субвірусні частинки, відповідно, згадуються як "фузіогенні"; в той час як такі вірусні й субвірусні частинки, відповідно, які не здатні зливатися з клітинами-мішенями, згадуються як нефузіогенні. Базуючись на відкритті даних винахідників, а саме, що такі частинки ЛЦМВ, які включають, але не обмежується наступними: віріони ЛЦМВ, ЛЦМВ щільні тіла й ЛЦМВ НІОЧ, які оброблюються або були обробленими для інактивування їх залишкової ЛЦМВ інфективності, але все ще залишаються здатними ефективно індукувати антиген-специфічну CD8+, цитотоксичну T-клітинну відповідь на вірусні антигени, незважаючи на доведену втрату фузіогенності, засоби і способи інактивування інфективності ЛЦМВ і більш конкретно, інактивування залишкової ЛЦМВ інфективності засобами й за умов, відповідно, які супроводжуються втратою фузіогенності, можуть застосовуватися щодо препаратів і композицій, що містять частинки ЛЦМВ, відповідно, щоб одержати як безпечну вакцину ЛЦМВ, так і антиген-специфічну CD8 + цитотоксичну T-клітинну відповідь. Частинки людського цитомегаловірусу (ЛЦМВ), які утворюють вихідний матеріал для генерування частинок ЛЦМВ і композицій, що включають їх, відповідно, кожні як суб'єкт представленого винаходу, є переважно вірусними частинками, які вивільняються після інфікування клітин ссавців ЛЦМВ. Такі частинки людського цитомегаловірусу (ЛЦМВ), які використовуються як вихідний матеріал, оточені ліпідною мембраною, що дозволяє зливатися частинкам з певними клітинами ссавця так, щоб їхній вміст увійшов в цитоплазму клітин, хоча, відповідно до першого аспекту представленого винаходу, такі частинки, отримані після піддавання їх дії засобів і способів, відповідно, описаним тут у зв'язку з прийнятністю для інактивування, є нефузіогенними. Незалежно від цього, мембрана частинок ЛЦМВ містить вірусні глікопротеїни, які представляють головні антигени для вірус-нейтралізуючих антитіл. Крім того, вони містять вірусний антиген pp65 (ppUL83), що є дуже імуногенною мішенню для Тхелперів і є істотним антигеном для індукування цитотоксичних Т-лімфоцитів (ЦТЛ) проти ЛЦМВ. Вид імунної реакції, індукованої частинками ЛЦМВ й особливо віріонами ЛЦМВ, ЛЦМВ НІОЧ та/або щільними тілами ЛЦМВ, і композиціями, що включають їх, відповідно, кожний відповідно до представленого винаходу, незалежно від шляху введення, є Т-хелперною відповіддю типу Th1. Через цю особливість, частинки ЛЦМВ й особливо віріони ЛЦМВ, ЛЦМВ щільні тіла та/або ЛЦМВ НІОЧ, і композиції, що включають принаймні один з них, відповідно, є прийнятними у якості вакцин проти ЛЦМВ. Фахівцем у даній галузі буде визнано, що частинки людського цитомегаловірусу (ЛЦМВ) представленого винаходу й будь-яка композиція, що включає їх, можуть використовуватися для одержання медикаментів, що використовується для лікування та/або профілактики захворювання, переважно такого захворювання, як те, що залучає ЛЦМВ у якості причинного або опортуністичного агента. У переважному варіанті реалізації медикамент - вакцина. Конкретна група суб'єктів, переважно ссавцевих суб'єктів і більш переважно, людських суб'єктів, для лікування та/або профілактики яких такий медикамент застосовується відповідно до представленого винаходу, є суб'єктами, які страждають від захворювання, викликаного ЛЦМВ, або мають ризик його розвитку, причому такі суб'єкти є донорами трансплантату та/або реціпієнтами трансплантату. Фахівцем у даній галузі також буде визнано, що присутні частинки людського цитомегаловірусу (ЛЦМВ) й будь-яка композиція, що включає їх, можуть використовуватися для одержання діагностичного агента. Більш переважно, такий діагностичний агент призначений для діагностики захворювання, що залучає ЛЦМВ у якості причинного або опортуністичного агента. Нарешті, частинки людського цитомегаловірусу (ЛЦМВ) можуть використовуватися для генерування або у виробництві медикаменту або діагностичного агента, причому медикамент й 6 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 діагностичний агент є одним з агентів, вибраним із групи, що включає антитіла, аптамери й шпігельмери, причому агент є спрямованим, переважно конкретно спрямований проти одного або декількох частинок ЛЦМВ представленого винаходу. Генерація таких антитіл, аптамерів й шпігельмерів відома фахівцям у даній галузі. Виробництво антитіла, специфічного для частинок ЛЦМВ представленого винаходу, відомо фахівцю в даній галузі й, наприклад, описане в Harlow, E., and Lane, D., „„Antibodies: A Laboratory Manual, ‟‟ Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988). Переважно, моноклональні антитіла, які можуть використовуватися у зв'язку з представленим винаходом, можуть бути одержані відповідно до протоколу Cesar й Milstein і подальших розробок на основі цього. Антитіла, які використовується тут, включають, але не обмежуютьсяними, повні антитіла, фрагменти антитіла або похідні, такі як Fab фрагменти, Fc фрагменти й прості антитіла, поки вони є прийнятними й здатними до з'язування із частинками ЛЦМВ представленого винаходу. Крім моноклональных антитіл можуть бути використані та/або одержані також поліклональні антитіла. Генерація поліклональних антитіл також відома фахівцю в даній галузі й, наприклад, описана в Harlow, E., and Lane, D., „„Antibodies: A Laboratory Manual, ‟‟ Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988). Переважно, антитіла, використовувані в терапевтичних цілях, є гуманізованими або людськими антитілами, як визначено вище. Антитіла, які можуть використовуватися відповідно до представленого винаходу, можуть мати один або кілька маркерів або міток. Такі маркери або мітки можуть бути корисними, щоб виявити антитіло в його діагностичному застосуванні або в його терапевтичному застосуванні. Переважно маркери й мітки вибрані із групи, що включає авідин, стрептавідин, біотин, золото і флуоресцеїн, і використовуються, наприклад, у способах ELISA. Ці й подальші маркери так само як і способи, наприклад, описані в Harlow, E., and Lane, D., „„Antibodies: A Laboratory Manual, ‟‟ Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, (1988). Також у межах представленого винаходу є те, що мітка або маркер показують додаткову функцію крім виявлення, таку як взаємодія з іншими молекулами. Така взаємодія може бути, наприклад, специфічною взаємодією з іншими сполуками. Ці інші сполуки можуть бути або як такі, що властиві системі, у якій застосовується антитіло, такій як організм людини або тварини, або як препарат, який аналізується з використанням відповідного антитіла. Відповідні маркери можуть, наприклад, бути біотином або флуоресцеїном з певними партнерами цієї взаємодії, такими як авідин й стрептавідин, і т.п., що присутні на відповідній сполуці або структурі, щоб взаємодіяти з маркованим або міченим таким способом антитілом. Аптамерами як суб'єктом представленого винаходу є D-нуклеїнові кислоти, які є або одноланцюговими або дволанцюговими і, котрі специфічно взаємодіють із молекулою-мішенню. Виробництво або вибір аптамерів, наприклад, описане в європейському патенті EP 0 533 838. В основному реалізуються наступні стадії. Спочатку одержують суміш нуклеїнових кислот, тобто, потенційних аптамерів, в якій кожна нуклеїнова кислота зазвичай містить сегмент декількох, переважно принаймні восьми послідовних рандомізованих нуклеотидів. Цю суміш послідовно піддають контактуванню із молекулою-мішенню, причому нуклеїнова(і) кислота(и) зв'язується з молекулою-мішенню, на основі збільшеної афінності щодо мішені або з більшою силою, у порівнянні із сумішшю кандидата. Зв'язану нуклеїнову(і) кислоту(и) потім відокремлюють від залишку суміші. Довільно, одержану(і) таким чином нуклеїнову(і) кислоту(и) ампліфікують, використовуючи, наприклад, полімеразну ланцюгову реакцію. Ці стадії можуть бути повторені, кілька разів даючи наприкінці суміш, що має збільшене співвідношення нуклеїнових кислот, які специфічно зв'язуються з мішенню, з яких потім довільно вибрана заключна зв'язувальна нуклеїнова кислота. Ці специфічно зв'язувальні нуклеїнові кислоти відносяться до аптамерів. Очевидно, що в будь-якій стадії способу для генерування або ідентифікації зразків аптамерів, суміш індивідуальних нуклеїнових кислот може бути взята, щоб визначити їх послідовність використовуючи стандартні способи. Саме в межах представленого винаходу аптамери можуть бути стабілізовані таким чином як, наприклад, введення визначених хімічних груп, які відомі фахівцю в галузі виробництва аптамерів. Така модифікація може, наприклад, відбуватися при введенні аміногрупи в 2‟-положення цукрового фрагменту нуклеотидів. Аптамери у цей час використовуються як терапевтичні агенти. Однак, також у межах представленого винаходу є те, що таким чином вибрані або одержані аптамери можуть використовуватися для підтвердження цілі та/або як головна субстанція для розробки медикаментів, переважно медикаментів на основі маленьких молекул. Це фактично одержано конкурентним тестуванням, причому специфічна взаємодія між молекулою-мішенню й аптамером інгібується досліджуваним препаратом, причому при заміні аптамеру в комплексі мішені і аптамеру, можна припустити, що відповідний досліджуваний препарат забезпечує специфічне інгібування взаємодії між мішенню й аптамером, і якщо взаємодія є специфічною, згадуваний досліджуваний кандидат, принаймні 7 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 в принципі, буде прийнятним для блокування мішені і, таким чином, зменшить її біологічну доступність або активність у відповідній системі, що включає таку мішень. Одержана таким чином маленька молекула може потім піддаватисґ додатковій дериватизації і модифікації, щоб оптимізувати її фізичні, хімічні, біологічні та/або медичні характеристики, такі як токсичність, специфічність, здатність до розкладання мікроорганізмами й біодоступність. Генерування або виробництво шпігельмерів, що можуть бути використані або генеровані відповідно до представленого винаходу з використанням частинок людського цитомегаловірусу (ЛЦМВ) представленого винаходу, базуються на подібному принципі. Виробництво шпігельмерів описане в міжнародній заявці на патент WO 98/08856. Шпігельмери це Lнуклеїнові кислоти, що означає, що вони складаються з L-нуклеотидів, на відміну від аптамерів, які складаються з D-нуклеотидів. Шпігельмери характеруються фактом наявності дуже високої стабільності у біологічній системі й, порівняно з аптамерами, специфічно взаємодіють із молекулою-мішенню, проти якої вони спрямовані. З метою генерування шпігельмерів, була створена гетерологічна популяція D-нуклеїнових-кислот, і цю популяцію піддавали контактуванню з оптичним антиподом молекули-мішені, у цьому випадку, наприклад з Dенантіомером, природнім L-енантіомером частинок ЛЦМВ представленого винаходу. Потім такі D-нуклеїнові кислоти, які не взаємодіють із оптичним антиподом молекули-мішені, відокремлювали. Однак, такі D-нуклеїнові кислоти, які взаємодіяли з оптичним антиподом молекули-мішені, були відокремлені, довільно визначені та/або впорядковані, і потім відповідні L-нуклеїнові кислоти синтезували на основі інформації послідовності нуклеїнової кислоти, отриманої від D-нуклеїнових-кислот. Такі L-нуклеїнові кислоти, що ідентичні в одиницях послідовності з вищезгаданими D-нуклеїновими кислотами, які взаємодіють з оптичним антиподом молекули-мішені, будуть специфічно взаємодіяти із природною молекулою-мішенню, а не з їх оптичним антиподом. Подібно способу генерування аптамерів, також можливо повторити різні стадії кілька разів й, таким чином, збагатити ті нуклеїнові кислоти, які специфічно взаємодіють з оптичним антиподом молекули-мішені. Саме в межах представленого винаходу такий медикамент й діагностикум можуть використовуватися для лікування, профілактики й діагностики, відповідно, кожного й будь-якого із цих захворювань і станів, наведених тут у зв'язку з застосуванням частинок ЛЦМВ представленого винаходу. Фахівцем у даній галузібуде зрозуміло, що частинки людського цитомегаловірусу (ЛЦМВ) представленого винаходу можуть також використовуватися як медикаменти й вакцини для лікування та/або профілактики тих захворювань, що лікуються шляхом індукування імунної реакції проти антигену, а згадуваний антиген є експресованим частинками ЛЦМВ представленого винаходу. Саме в межах представленого винаходу такий антиген є гомологічним або гетерологічним, особливо щодо згадуваної частинки людського цитомегаловірусу (ЛЦМВ). Способи визначення. чи є здатною частинка ЛЦМВ й, зокрема, віріон ЛЦМВ та/або щільне тіло ЛЦМВ і композиція, що включає принаймні одне з них, відповідно, до індукування імунної реакції, у той час як частинки, віріони та/або щільні тіла, що є переважно нефузіогенними, є очевидними для фахівців у даній галузі, принаймні у світлі представленого винаходу. Деякі з відповідних тестів описані тут, зокрема в розділі їх прикладів. Для забезпечення імунної реакції, частинки людського цитомегаловірусу (ЛЦМВ) представленого винаходу повинні містити або забезпечувати відповідні антигени для індукування антиген-специфічних антитіл, переважно нейтралізуючих антитіл, і для стимулювання хелперів (TH-лімфоцити) і цитотоксичних Т-клітин (ЦТЛ). У принципі, антигени ЛЦМВ, які є прийнятними, щоб виявити імунну реакцію, переважно в людині, є зокрема одним з нижченаведених, хоча фахівець у даній галузі, визнає, що інші антигени ЛЦМВ можуть також бути активними в тій же мірі (Sylwester AW, JEM Vol. 202, September 5 2005, p.673-685). Антигени ЛЦМВ, що розпізнаються CD4+T клітинами, переважно вибрані із групи, що включає UL55 (gB), UL83 (pp65), UL86, UL99 (pp28), UL122 (IE2), UL36, UL48, UL32 (pp150), UL113, IRS-1, UL123 (IE1), UL25, UL141, UL52, UL82 (pp71), US22, UL75 (gН), US23, UL69, US26, UL44 (pp50), UL16, US3, US18, UL78, UL18, UL17, TRL14, UL100, UL45, UL145, UL154, UL43, UL152, UL144, UL24, UL4 (gp48), UL49, UL102 й UL87. Більш переважно, антигени, що підлягають реакціїї CD4+T- клітин, вибрані із групи, що включає UL55, UL83, UL86, UL99, UL153 й UL32. Антигени ЛЦМВ, що розпізнаються CD8+T клітинами, переважно вибрані із групи, що включає UL48, UL83 (pp65), UL123 (IE1), UL122 (IE2), US32, UL28, US29, US3, UL32 (pp150), UL55 (gB), UL94, UL69, UL105, UL82 (pp71), UL99 (pp28), UL154, UL44 (pp50), UL86, UL33, UL49, US1, UL150, UL34, US30, TRL14, IRS-1, UL36, UL37, UL75 (gН), UL45, UL153, UL116 й UL54. 8 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 Більш переважно, антигени, що підлягають реакції CD8+T- клітин, вибрані із групи, що включає UL123, UL83, UL122, UL28, UL48, US3, UL151, UL82, UL94, US29, UL99, UL103, US32, US24 й UL36. Нейтралізуючі антитіла, відповідно до поточного стану знань, після того, як ЛЦМВ інфекція сформувалася, є винятково проти вірусних оболонкових протеїнів і особливо проти gB глікопротеїнів, gН, gM й gN (Shen й інші, Вакцина 20, 2007). TH-клітини утворюються головним чином проти оболонкових протеїнів вірусу, і особливо проти так званого pp65 (ppUL83), gН і gB (Sylwester й ін., J. Exp.Medicine Vol. 202, 2005). Більш конкретно, pp65 є істотним антигеном для індукування ЦТЛ проти ЛЦМВ. Присутність рр65 має місце не тільки, як звичайно після de novo синтезування клітинами у зв'язку з молекулами MHC класу I; вони також можуть бути введені в MHC І напрямку представлення, так називане "екзогенне завантаження". Згадувані антигени є есенціальними компонентами частинок ЛЦМВ представленого винаходу й більш конкретно, щільних тіл ЛЦМВ й ЛЦМВ НІОЧ, кожних з представленого винаходу. Більш конкретно, щільні тіла (ЩТ) є структурами, які видимі під електронним мікроскопом. Самий широко розповсюджений протеїн (маса) у ЩТ є оболонковим протеїном pp65. ЩТ є порівнівнювані з живими вірусними частинками, що забезпечені клітинною ліпідною мембраною, яка може розглядатися як оболонка, модифікована вірусними глікопротеїнами. Вірусні глікопротеїни перебувають дуже ймовірно в природній конформації в цій оболонці. Оскільки ЩТ не містять вірусну ДНК і вірусний капсид, вони є неінфекційними. Вони можуть бути сконцентровані у великій кількості із супернатанту клітинної культури встановленими способами. Наступні варіанти реалізації описані з посиланням на pp65. Однак, буде матися на увазі, що, у принципі, ті ж самі міркування можуть застосовуватися до інших антигенів, що прийнятні для здійснення представленого винаходу, та/або антигенів, описаних тут безпосередньо або посиланням. В додатковому варіанті реалізації розкриті й описані частинки людського цитомегаловірусу (ЛЦМВ), які містять протеїн злиття, що включає в одній частині одну або більше секцій вірусного Т-клітинного антигену pp65 (ppUL83) або нативний протеїн, а в іншій частині - одну або більше секцій одного або більше інших протеїнів. Це дозволяє оптимізувати антигенність частинок ЛЦМВ, тому що цей протеїн злиття присутній у великій кількості в частинках. Додатково відомо, що експресія антигенів клітинної й гуморальної імунної реакції в одній молекулі може чітко збільшити антигенність. Різні секції pp65 й інших протеїнів можуть бути злиті разом безпосередньо, але це також можливо, наприклад, для лінкерних послідовностей, які не є природним компонентом одного із залучених протеїнів, присутніх між різними секціями. Послідовності цього типу можуть виникнути через клонування або бути введені навмисно, щоб впливати на властивості антигену. Однак, протеїн злиття переважно не містить чужорідних послідовностей, які не є компонентом однієї із клітин, що зливаються. У таких варіантах реалізації протеїн злиття складається з однієї або більше частин pp65 й однієї або більше частин одного або більше інших протеїнів. Це стосується всіх варіантів реалізації, згаданих надалі, що нативний pp65 або одна або кілька його частин можуть бути присутніми у протеїні злиття. Твердження "протеїн злиття (що складається) з pp65", не для цілей цієї заявки, повинне розумітися як обмеження нативного pp65. "Частина" або "секція" протеїну, присутнього в протеїні злиття, включає принаймні 6, переважно принаймні 8, найбільше переважно принаймні 9, 15 або 20 послідовних амінокислот протеїну, з якого вони виділені. Переважні варіанти реалізації включають протеїн злиття pp65 (ppUL83) і одну або більше нейтралізуючих епітопів вірусних глікопротеїнів gB або gН. Частинки цього типу можуть бути одержані як зображено на фіг. 1. Протеїн злиття може входити через антиген-специфічний канал, глікопрпотеїн-специфічні В-клітини, які у свою чергу здатні представити антигенні детермінанти обох глікопротеїнів та pp65 у контексті класу MHC II. Крім того, для частин протеїну злиття також можливо бути представленими професійними антиген-презентувальними клітинами (AПК) у контексті класу II MHC. В обох випадках результатом є ефективне стимулювання реакції TH як до pp65, так і до вірусних глікопротеїнів. Ці позитивні CD4 TH-клітини здатні стимулювати глікопротеїн-специфічні В-клітини, які представляють пептиди pp65 і вірусні глікопротеїни у контексті класу II MHC, для утворення антитіл, зокрема, нейтралізувальних антитіл, причому антитіла спрямовані в одному варіанті реалізації до гомологічного антигену, а в іншому варіанті реалізації до гетерологічного антигену. Крім того, частинки цього типу можуть, подібно інфекційним віріонам, проникати в клітини, а пептиди pp65 можуть бути введені екзогенним завантаженням у напрямку MHC класу І. Це забезпечує, особливо для 9 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 інактивованих вакцин, стимулювання реакції ЦТЛ на ЛЦМВ. В додатковому переважному варіанті реалізації частинки людського цитомегаловірусу (ЛЦМВ) містять протеїн злиття, що складається з pp65 й однієї або більше частин іншого протеїну ЛЦМВ, протеїну IE1 (ppUL123). Частини протеїну IE1, які повинні бути присутні, зокрема, є тими, проти яких цитотоксичні Т-клітини утворюються у людей під час природної інфекції. Пептиди протеїну IE1 у деяких випадках представлені різними молекулами класу I MHC, ніж пептиди pp65. Доповнення таких додаткових "ЦТЛ епітопів" з IE1 призначено гарантувати, що після імунізації вакциновані суб'єкти, які експресує різні молекули MHC класу I, здатні генерувати ЦТЛ проти ЛЦМВ у настільки ж всебічній манері, наскільки можливо. В додатковому переважному варіанті реалізації частинки людського цитомегаловірусу (ЛЦМВ) містять протеїн злиття, що складається з pp65, з одного або більше нейтралізуючих епітопів глікопротеїнів ЛЦМВ й одного або більше антигенних детермінант (епітопів) ЦТЛ IE1. Злиття pp65 з нейтралізуючими епітопами й антигенними детермінантами (епітопами) ЦТЛ призначене гарантувати можливість одночасного утворення нейтралізуючих антитіл й ЦТЛ вакцинованими суб'єктами в настільки ж всебічній манері, наскільки це можливо, тобто максимальним числом людей, які відрізняються паттерном MHC класу І. В додатковому переважному варіанті реалізації частинки людського цитомегаловірусу (ЛЦМВ) містять протеїн злиття pp65 й одну або більше антигенних детермінант іншого людського патогену. Прийнятні частини інших людських патогенів це антигени, проти яких нейтралізуючі антитіла утворюються у людей. Можливо через злиття таких "нейтралізуючих антигенів" з Т-клітинним антигеном pp65 очікувати відзначене підсилення імунної реакції, тобто гуморальної імунної реакції, у порівнянні з застосуванням ізольованого "нейтралізуючого антигену". Прикладами таких "нейтралізуючих антигенів", які повинні бути згадані, є поверхневі протеїни вірусу гепатиту В (від регіону HBsAG), вірусу гепатиту С (наприклад E2), вірусів імунодефіциту людини (ВІЛ, від Env регіону), вірусу грипу (гемаглютинін, нейрамінідаза, нуклеопротеїн) або інші вірусні патогени. Крім того, прийнятними людськими патогенами є бактерії, такі як Haemophilus influenzae, Bordetella pertussis, Mycobacterium tuberculosis, Neisseria meningitidis й інші. Нарешті, антигени від еукаріотичних патогенів, таких як плазмодії (малярія) могли бути злиті з pp65. Такі антигени або протеїни злиття також згадуються тут як похідні антигену, а протеїну злиття, що діє як антиген, який включає повну довжину або частинку pp65, також згадується тут як похідне рр65 антигену. В додатковому переважному варіанті реалізації частинки людського цитомегаловірусу (ЛЦМВ) містять протеїн злиття, що складається з pp65 й однієї або більшої кількості частин протеїнів або пептидів, причому дія pp65 можуть діяти як каркас для згадуваних протеїнів і пептидів, відповідно, інших патогенів, проти яких ЦТЛ утворюються у людей на природну інфекцію із цими патогенами. Прикладами таких епітопів ЦТЛ, які можуть бути згадані, є частини протеїнів ВІЛ-1, HBV, HCV або вірусу грипу. Призначення такої процедури полягає в тому, щоб використати унікальні імуногенні властивості ЩТ для того, щоб генерувати захисні ЦТЛ, тобто цитотоксичні Т-лімфоцити, переважно CD8 + цитотоксичні Т-клітини, проти гетерологічних патогенів у людей. В додатковому переважному варіанті реалізації частинки людського цитомегаловірусу (ЛЦМВ) містять протеїн злиття, що складається з pp65, з одного або більше нейтралізуючих епітопів гетерологічного патогену й одного або більше епітопів ЦТЛ того ж самого патогену. Це злиття призначене, щоб гарантувати, що вакциновані суб'єкти здатні утворити захисні антитіла й ЦТЛ проти цього патогену. Винахід додатково відноситься до частинок ЛЦМВ, що містять принаймні два різні глікопротеїни, які є варіантами того ж самого глікопротеїну від різних штамів ЛЦМВ. Переважні варіанти реалізації містять рівно два варіанти, один варіант, що відповідає штаму Towne ЛЦМВ, і інший варіант, що відповідає Штаму Ad169 ЛЦМВ. Переважні варіанти реалізації містять gB глікопротеїн обох штамів Towne і Ad169. Ці два протеїни можуть бути введені з ідентичною ефективністю в мембрану рекомбінантних щільних тіл інфікованої клітини. Такі рекомбінантні щільні тіла є прийнятними для індукування не тільки штамо-перехресної, але також і штамо-специфічної нейтралізуючої імунної реакції щодо двох прототипів штамів ЛЦМВ. Саме в межах представленого винаходу, крім антигенів дикого типу, тобто, таких, які представлені в диких штамах ЛЦМВ або нерекомбінантних антигенів, їх похідні можуть використовуватися в здійсненні представленого винаходу. Термін похідна, як використовується тут у зв'язку з антигеном, переважно відноситься до антигену, який є рекомбінантним антигеном. Рекомбінантний антиген це антиген, у варіанті реалізації, який порівняно з усіченим по всій довжині антигеном, включає одну або декілька амінокислотних варіацій, що мають ту ж 10 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 саму довжину, як антигени дикого типу або включають додаткові амінокислотні залишки. Саме в межах представленого винаходу додаткові амінокислотні залишки можуть бути додані до усіченої форми антигену або форми, що включає одну або декілька амінокислотних варіацій. Таке усікання може бути виконане до такого ступеня, що антигенна характеристика такого усіченого антигену усе ще існує. В іншому варіанті реалізації рекомбінантний антиген включає, окрім антигену повної довжини або усіченого антигену, додатковий фрагмент. Такий додатковий фрагмент переважно отриманий з антигену вірусу, причому такий вірус відрізняється від ЛЦМВ, антигену мікроорганізму, переважно патогенного мікроорганізму, або антигену не мікроорганізму, що є патогеном. Переважно патогенний мікроорганізм це мікроорганізм, патогенний щодо ссавців і більш конкретно, людей, і патоген це патоген, що є патогенним щодо ссавців і більш конкретно, людей. Додатковий фрагмент може бути антигеном повної довжини або усіченим. У варіанті реалізації додатковий фрагмент є принятним, щоб індукувати одну або декілька імунних реакцій, описаних тут. В додатковому варіанті реалізації похідна антигену це гетерологічний антиген. В ще одному додатковому варіанті реалізації похідна антигену це гетерологічний антиген, як переважно визначено тут. Переважно, імунна реакція, що може бути індукована частинками ЛЦМВ у їхніх різноманітних формах, є принаймні однією з наступних: антиген-специфічна CD8+T-клітинна відповідь, антиген-специфічна цитотоксична Т-клітинна відповідь, антиген-специфічна CD8 + цитотоксична Т-клітинна відповідь, антиген-специфічна гуморальна імунна відповідь, причому, переважно, антитіла такої гуморальної імунної реакції є нейтралізуючими антитілами, антиген-специфічна CD4 + Т-хелперна відповідь. Віріони та/або щільні тіла ЛЦМВ особливо корисні у здійсненні представленого винаходу можуть бути одержані, як описано в міжнародній заявці на патент WO 00/53729. Фахівцем у даній галузі буде визнано, що різні варіації, описані тут для інактивування, також відомі в даній галузі й можуть бути застосовані до представленого винаходу. Представлений винахід тепер додатково проілюстрований відповідно до фігур і прикладів, з яких подальші особливості, варіанти реалізації й переваги можуть бути взяті, причому Фіг. 1 показує стратегію генерування рекомбінантних ЩТ, які містять протеїн злиття з гомологічними або гетерологічними антигенами; Фіг. 2 показує CD8+ цитотоксичну Т-клітинну відповідь на препарат ЩТ, оброблений за різними методиками інактивування при рестимулюванні pp65 пептидною сумішшю (Фіг. 2a) і з не-ЛЦМВ пептидом (Фіг. 2b); Фіг. 3 показує анти-ЛЦМВ IgG відповідь на препарат ЩТ, оброблений різними процедурами інактивування; Фіг. 4 показує CD8 + цитотоксичну Т-клітинну відповідь на препарат ЩТ, оброблений за двома різними методиками інактивування при рестимулюванні pp65 пептидною сумішшю (Фіг. 4a) і не-ЛЦМВ пептидом (Фіг. 4b); Фіг. 5 показує анти-ЛЦМВ Ig відповідь на препарат ЩТ, оброблений двома різними процедурами інактивування; Фіг. 6 показує CD8 + цитотоксичну Т-клітинну відповідь на препарати ЩТ, які були або оброблені, щоб інактивувати залишкову інфективність і надати їм нефузіогенності (напівдинамічне опромінення УФС), або, які не одержували такої обробки. Рестимулювання з pp65 пептидною сумішшю (Фіг. 6a) і з не-ЛЦМВ пептидом (Фіг. 6b); Фіг. 7-12 є мікрофотографіями, що показують результат тестування фузіогенності, причому частинки людського цитомегаловірусу (ЛЦМВ), перевірені на фузіогенність, були піддані різним способам інактивування; і Фіг. 13-19 є мікрофотографіями, що показують результат тестування інфективності, причому частинки людського цитомегаловірусу (ЛЦМВ), перевірені на фузіогенність, були піддані різним способам інактивування. Приклад 1: Матеріали і способи В подальшому окреслюється схема різних матеріалів і способів, які використовувалися в здійсненні представленого винаходу, або які будуть корисні для фахівця в даній галузі, який практикує представлений винахід. Коротше кажучи, препарати ЩТ ЛЦМВ одержали обробку, щоб інактивувати залишкову інфективність ЛЦМВ і надати матеріалу нефузіогенності. Потім були проведені чотири різних головних типи досліджень з інактивованим матеріалом. Була проаналізована здатність індукувати антиген-специфічну CD8+ цитотоксичну Т-клітинну відповідь у мишей. Була проаналізована здатність індукувати специфічні анти-ЛЦМВ антитіла. Була проаналізована інфективність обробленого матеріалу ЩТ щодо інактивування залишкової інфективності. Була проаналізована фузіогенність інактивованого матеріалу. 60 11 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 1. Інактивування залишкової інфективності ЛЦМВ Використовувалися різні способи у зв'язку з представленим винаходом, щоб інактивувати залишкову інфективність ЛЦМВ у композиціях, що містять віріони ЛЦМВ та/або щільні тіла ЛЦМВ. 1.1 Напівдинамічна УФС обробка 300 мкл аліквот препаратів ЩТ (0,2 мг протеїну/мл PBS) були опромінені протягом 5 хвилин при повільному струшуванні в 24–лункових планшетах культури клітин при опроміненні УФС зверху (254 нм; доза УФС 720 мДж/cм ²; УФС опромінення: Schütt Osram HNS 11 ват). 1.2 Опромінення гамма-променями Аліквоти 675 мкл препаратів ЩТ (0,2 мг протеїну/мл) у 2 мл скляних пробірках одержали 52 кГр гамма опроміненням на сухому льоді. Після процесу інактивування матеріал був заморожений при – 80 °C для наступного аналізу. 1.3 Низький pН 1,15 мл препаратів ЩТ (0,2 мг протеїну/мл) були змішані з 100 мМ цитрату натрію з рН 4,5 і були інкубовані при 30 °C протягом 60 хв. Потім матеріал гранулювали ультрацентрифугуванням (45 хвилин, SW 50,1 ротор) і ресуспендували у 1,1 мл PBS для наступного аналізу (Зберігання при – 80 °C). 1.4 Термообробка 1,15 мл препаратів ЩТ (0,2 мг протеїну/мл) були інкубовані при 56 °C протягом 30 хв. Після процесу інактивування матеріал був заморожений при – 80 °C для наступного аналізу. 1.5 β-Пропіолактон (БПЛ) 1,15 мл зразка (0,2 мг протеїну/мл) змішували з 10 мл 50 мМ Tris/HCl рН 8,0 й 0,24 мл свіжоодержаного 10 % розчину БПЛ в 50-мМ Tris/HCl рН 8,0 (0,21 % об/об кінцева концентрація БПЛ). Зразки культивували протягом 60 хвилин при 30 °C.Потім матеріал гранулювали ультрацентрифугуванням (45 хвилин, SW 50,1 ротор) і ресуспендували у 1,1 мл PBS для наступного аналізу (Зберігання при – 80 °C). 1.6 Динамічна обробка УФС з наступним опроміненням гамма-променями Частинки ЛЦМВ, що містяться в супернатанті клітинної культури (середовище без барвника), одержали динамічну дозу УФС 200 мДж/cм² з використанням приладу UVivatec Lab (виробника BTS Bayer Technology Services, D–51368 Leverkusen, Germany). Доза при 254 нм була розрахована відповідно до листа обчислення від BTS. Потім препаратами ЩТ заповнювали скляні пробірки й опромінювали 23,8 кГр гамма-променями на сухому льоді. Зберігання при – 80 °C для наступного аналізу. 2. Тестування здатності ЛЦМВ віріонів і щільних тіл ЛЦМВ щодо індукування антигенспецифічної CD8 + цитотоксичної Т-клітинної відповіді у мишей Короткий огляд: Миші будуть імунізовані матеріалом ЩТ, який обробляли, щоб інактивувати залишкову інфективність ЛЦМВ. Миші будуть умертвлені і селезінки будуть вилучені. Потім суспензія генетично однорідних клітин селезінки буде одержана й еритроцити будуть піддані лізису. Потім, залишкові клітини селезінки будуть поміщені в клітинну культуру й інкубовані з певними пептидами. Пізніше, клітини селезінки будуть проаналізовані на кількість IFNγ позитивних CD8+T клітин. Пептиди, специфічні щодо антигену ЛЦМВ pp65, будуть повторно стимулювати клітини селезінки, оскільки вони продукуються у мишей, імунізованих pp65, що містилися у ЩТ. У цьому дослідженні CD8 позитивні цитотоксичні T-клітини (що містяться в суспензії клітин селезінки), які є специфічними щодо pp65, будуть продукувати IFNγ. Обробка клітин селезінки нерелевантним не-ЛЦМВ пептидом служить негативним контролем. Обробка нерелевантним не-ЛЦМВ пептидом не повинна привести до індукування IFNγ позитивних CD8 + цитотоксичних Т-клітин, оскільки миші не були імунізовані цим антигеном раніше. Аналіз IFNγ продукуючих CD8+T цитотоксичних клітин буде виконаний за допомогою потокової цитометрії (FACS). 2.1 Імунізація мишей 8-Тижневі мишачі самки BALB/c були імунізовані п/ш 20 мкг препаратом ЩТ. Після 3 тижнів вони одержали ревакцинацію п/ш 20 мкг препаратом ЩТ. Після 2 тижнів тварини були умертвлені для аналізу pp65-специфічної реакції ЦТЛ, для аналізу антиген-специфічних CD4 + T-хелперів, для аналізу ЛЦМВ-специфічної гуморальної імунної реакції й для аналізу ЛЦМВнейтралізуючої імунної реакції. 2.2 Рестимулювання pp65 специфічних ЦТЛ у селезінці миші 2.2.1. Одержання клітин селезінки - підігрів усіх необхідних буферів до 37 °C - взяття селезінки 12 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 - розміщення 100 мкм Falcon Nylon сита у 50 мл пробірці Falcon, видавлювання селезінки через сито для одержання однорідної суспензії клітин, ополіскування з 10 мл PBS/1 %FCS - центрифугування (250-300 г) при 1400 об/хв, 5 хвилин, 20 °C - відкидання супернатанту, повторне ресуспендування осаду в 10 мл еритроцитарнолізисному буфері (37 °C) - інкубування 3 хвилини при кімнатній температурі (КТ) - центрифугування (250-300 г) при 1400 об/хв, 4 хвилини, 20 °C - промивання осаду з 10 мл PBS/1 % FCS; центрифугування при 1400 об/хв 4 хвилини, 20 °C; повторне ресуспендування із 10 мл PBS/1 % FCS і видалення скупчення сполучної тканини - взяття аліквоти, щоб визначити концентрацію клітини (застосування 1:10 розчину для визначення) - центрифугування (250-300 г) при 1400 об/хв, 4 хвилини, 20 °C - ресуспендування осаду в Сlick's RPMI/повне середовище, врегулювання концентрації до 1,5 × 107 клітин/мл - 4 паралельні лунки (100 мкл клітинної суспензії на лунку) на необхідний тип рестимулювання (чотирикратно) 2.2.2 Пептиди 2.2.2.1 Для рестимулювання з ЛЦМВ pp65 специфічними пептидами Реактив: PepMix pp65 ЛЦМВA, від JPT Peptide Technologies GmbН, 10115 Berlin; pp65 (ЛЦМВA) # P06725, 1 пробірка = 25 мкг пептиду; суміш 138 пептидів (15 mers, перехресних 11); зберігання вихідного продукту 400 мкг/мл в ДМСО аналітичного сорту (збережений при-20 °C); одержання робочого вихідного продукту 2 µг/мл. 2.2.2.2 Для рестимулювання з нерелевантним (гетерологічним) контрольним пептидом Реактив: гетерологічні нонамерні контрольні пептиди. Наприклад, для мишей BALB/c Kd зв'язувальний малярійний пептид (SYVPSAEQI); зберігання вихідного продукту 1 мг/мл у ДМСО (збережений при -20 °C); одержання робочого вихідного продукту 2 мкг/мл. 2.2.3 Брефельдин A Одержання вихідного продукту Брефельдину А (Brefeldin А) (Sigma # B-7651) 10 мг/мл у ДМСО; одержання робочого розчину 20 мкг/мл у Click's RPMI/повне середовище (5 мкг/мл кінцева концентрація у рестимулювальній лунці). Брефельдин А блокує транспорт Гольджи, таким чином інгібуючи секрецію одержаних цитокинів. Цитокіни залишаються внутрішньоклітинними при обробці Брефельдином А так, що цитокін-продукувальні клітини, можуть бути виявлені, використовуючи внутрішньоклітинні способи фарбування. 2.2.4 PMA / Іономіцин PMA (Форбол, 12-міристат 13-ацетат), Sigma # P8139; одержання вихідного матеріалу 1мг/мл у ДМСО; одержання робочого розчину 0,4 мкг/мл у Click's RPMI/повне середовище (0,05 µг PMA/мл у рестимуляційній лунці). Іономіцин, Sigma # I0634; одержання вихідного матеріалу 1мг/мл у ДМСО; одержання робочого розчину 4 мкг/мл у Click's RPMI/повне середовище (0,5 мкг PMA/мл у рестимуляційній лунці). PMA й іономіцин поліклонально стимулюють Т-клітини. Це служить позитивним контролем у дослідженні, щоб переконатися, що якість клітини й процедури внутрішньоклітинного фарбування були оптимальні. 2.2.5 Click's RPMI/повне середовище 10,81 г порошку Click's RPMI (+ L-глутамін / -NaHCO3) від AppliChem # A2504. + 1,175 грамів NaHCO3 Додавання 1 л з дистильованою водою стерильна фільтрація + Глутамін 2 мМ + PenStrep-100 Од/мл пеніциліну, 100 мкг/мл стрептоміцину + 5 % ембріональна теляча сироватка (FCS), Invitrogen/Gibco # 10106-185, -6 + З-Меркаптоетанол 4 × 10 М. + Буфер Hepes 10 мМ, Invitrogen/Gibco # 15630-049, 2.2.6 Встановлення рестимулювання - На селезінку й пептид, використовуваний для рестимулювання, капають 100 мкл суспензії клітин селезінки в 4 лунки 96-лункового круглодонного планшету, в кожну (заключна 6 концентрація 1,5 × 10 клітин на лунку) - додавання 50 мкл робочого розчину пептиду або 25 мкл PMA / 25 мкл робочого розчину іономіцину 13 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 - додавання 50 мкл Брефельдину А (20 мкг/мл) - інкубування 4 год. при 37 °C (5 % CO2) перед аналізом FACS 2.3 Позитивні CD8 (CD8 +) T-клітини /внутрішньоклітинне фарбування IFNγ для FACS аналізу День 1: - пристосування фіксаційного буфера до кімнатної температури (КТ) - центрифугування 96-лункового круглодонного планшету, що містить встановлене рестимулювання (1400 об.хв./4хв./4 °C/з відцентровим гальмом; 250-300 г). - Пул гранул паралельних інкубувань (чотирикратних) з 90 мкл буфера А (PBS+0,5 % (ваг./об.) BSA+0,1 % (ваг./об.) NaN3) переносили в нові 96-лункові круглодонні планшети. Повторне ополіскування з 90 мкл, щоб одержати всі залишкові клітини з встановленого рестимулювання 180 мкл загального об'єму на встановлений тип. - Центрифугування нової пластини - додавання 120 мкл супернатанту гібрідоми (2,4G2) на лунку, змішування й інкубування 15 хвилин при 4 °C - центрифугування пластини + видалення супернатанту - додавання 100 мкл анти-мишачих CD8.PE (розчинених 1:200 у буфері A) суспендування осаду інкубування 20 хвилин, 4 °C. - після періоду інкубування - додавання 100 мкл буфера A - центрифугування пластини й двократне промивання з 150 мкл буфера А /центрифугування - додавання 150 мкл фіксаційного буфера (1 % параформальдегід у PBS) до осаду, ресуспендування ( інкубування 15 хвилин при кімнатній температурі (у темряві) - центрифугування пластини ресуспендування осаду з 150 мкл буфера A - пластина може бути збережена при 4 °C, протягом однієї або двох ночей перед продовженням внутрішньоклітинного фарбування День 2: - центрифугування пластини ре-суспендування з 150 мкл буфера B на лунку інкубування 15 хвилин при кімнатній температурі (в темряві) - центрифугування 50 мкл/лунку анти-IFN(. FITC, (1:200 розчинений у буфері B) ресуспендування і культивування 30 хвилин при кімнатній температурі (у темряві) - додавання 100 мкл буферу B (PBS+0,5 % (ваг./об.) BSA+0,5 % (ваг./об.) Сапоніну + 0,05 % (ваг./об.) NaN3), центрифугування. - трикратне промивання з 150 мкл буфера В на лунку - ресуспендування клітин в 150 мкл буфера А на лунку й перенесення в FACS-пробірки - ресуспендування залишкових клітин знову у 150 мкл буфера A й депонування в ту ж саму FACS-пробірку - аналіз 60,000 CD8+T клітин на зразок потоковою цитометрією. Інші Реактиви 100 мкм сита Falcon Nylon (Falcon Cat # 352360). Антимишачий CD8a PE кон'югат, 0,2 мг/мл; Сat # 553033; BD Biosciences. Щурячий антимишачий IFNy FITC кон'югований, 0,1 мг; щурячий IgG1; Клон XMG 1,2, Сat # 554411; BD Biosciences. Параформальдегід EM сорту, Сat # 00380-250; 250 мг Polysciences Europe. Сапонін (із кори Quillaja), Sigma # S-2149; 25 г; Гемолітичний буфер Одержання вихідного розчину NH4Cl, 0,16 М. Одержання вихідного розчину Tris 0,17 М. Змішування 4,5 л вихідного NH4Cl й 0,5 л вихідного Tris, перемішування протягом 1 години, потім доведення до pН 7,2. Автоклавування. 2,4 G2 супернатанта гібрідома Анти-Fcγ рецептор FcRII; супернатант культури, приблизно від 4-денної культури (щільні клітини). Анти-Fcγ рецептор FcRII повинен запобігти неспецифічному зв'язуванню антитіл, використовуваних для фарбування CD8 й IFNγ щодо клітинних рецепторів Fc. Неспецифічне зв'язування антитіл, використовуваних для фарбування, повинно привести до помилкових позитивних сигналів. 2,4G2 гібридома, доступна від ATCC. Фіксаційний буфер 1 % Параформальдегід у PBS: 1 г. параформальдегіду у 100 мл PBS [зважування під хімічним ковпаком]; нагрівання 1 годину при 70°до розчинення; зберігання при 4 °C. 3. ELISA для визначення анти-ЛЦМВ IgG відповіді у мишей 14 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 Матеріал: SERION ELISA класичний IgG ЦМВ (Clindia); смуги, покриті лізатом ЛЦМВ, готові до використання (ESR109G) Зразок: мишача сироватка (див. 2.1) Методика: - Сироватка Додавання 100 мкл розбавленої сироватки (в PBS/T) у кожну лунку, наприклад 1:125; 1:250; 1:500; 1:1000; 1:2000; 1:4000 й 1:8000 Інкубування протягом 1 години при 37 °C без струшування - Промивання: Зливання розчину атитіл в раковину. Промивання пластин, обполіскуючи лунки 5x з 200 мкл промивного буфера, кожний. Після третьої стадії промивання - видалення залишкової рідини шляхом м'якого постукування чашкою лицьовою стороною донизу на шарі декількох паперових рушників. - AK/HRP: Додавання АК антимишачого IgG HRP кон'югату, розчиненого в 1:1000 PBS/T 100 µл/лунку, інкубування протягом 1 години при 37 °C без струшування - Промивання: Повторення стадії 2 - Фарбування: Одержання фарбувального безпосередньо перед застосуванням: 1 мг OPD/мл Субстратний буфер + 1 мкл /мл H2O2 (наприклад, розчинення 11 мг OPD/11 мл субстратного буфера, додавання 11 мкл H 2O2), Додавання фарбувальної рідини 100 мкл/лунку, інкубування при кімнатній температурі в темряві протягом10-15' - Зупинення Додавання 50 мкл зупинювального розчину і вимірювання на зчитувачі ELISA при 492 нм. Реактиви PBSТ PBS з 0,05 % (об/об) Твін 20 Субстратний буфер 0,1 М KH2PO4 рН 6,0 Зупинювальний розчин 1 N H2SO4 (= 0,5 М H2SO4) Субстрат (OPD) O-Фенілендіамін, кристалічний; Sigma P-2903 H2O2 30 % Антитіло поліклональний кролячий антимишиний Ig G HRP кон'югат, DAKO (1,3 г/л), #P0260 4. Тестування фузіогенності частинок ЛЦМВ Ціль цього тестування полягає в тому, щоб перевірити, чи залишаються частинки людського цитомегаловірусу (ЛЦМВ) здатними з'єднатися зі специфічною клітиною- мішенню, такою як фібробласти людини MRC5. Було проаналізовано, чи може ЛЦМВ pp65 протеїн бути введений у відповідні клітини-мішені. Це здійснювали імунофлуоресцентною мікроскопією (анти-pp65; зелене флуоресцентне забарвлення в ядрі). Внаслідок злиття ЩТ з фібробластом, pp65 протеїн вивільнився у цитоплазму клітини-мішені. Оскільки pp65 транспортується в ядро, це виявлено забарвленням з використанням імунної мітки. У частинках ЛЦМВ, які не злиті з ЛЦМВнегативними клітинами-мішенями, оболонковий протеїн pp65 розташований у частинках ЛЦМВ. Він не присутній в межах клітин-мішеней. Навпаки, у клітинах, які з'єдналися із частинками ЛЦМВ, буде зелене флуоресцентне забарвлення, що вказує на присутність pp65 у ядрі клітин. Протокол тестування фузіогенності: - Переміщення 100 мкл людських фібробластних клітин MRC5 (ATCC, # ATCC-CCL-171) із діючої культури у свіжу культуру (1 × 105 клітин/мл культурального середовища; 37 °C, 5 % CO2; чотири однакових екземпляри; 96 лункові пластини). - Інкубування протягом ночі при 37 °C - Видалення 70 мкл середовища із кожної лунки й додавання 5 мкл зразка, що буде протестований на фузіогенність - Після 1 год. додавання 70 мкл середовища й культивування протягом 24 год. - Видалення супернатанту з клітин (96 лунковий планшет) - Додавання 200 мкл/лунку 96 % етанолу й інкубування 20 хвилин при кімнатній температурі - 4-Кратне промивання з 150 мкл PBS/0,1 % Тритон X100 на лунку - Блокування з 50 мкл SN2.4G2 на лунку протягом 15 хвилин при кімнатній температурі - Видалення супернатанту з клітин - Додавання первинного антитіла (50 мкл/лунку): анти-pp65, 1:100 розчинення в PBS, #C8A023M. - Інкубування протягом 1 год. при 37 °C - Трикратне промивання з 150 мкл PBS / 0,1 % Тритон X-100 на лунку. - 50 мкл/лунку: додавання вторинного антитіла + Еванс синій (2. Ab 1:50/Еванс синій1:25 у PBS), # E0413, і культивування протягом 30 хвилин при 37 °C. 15 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Чотирикратне промивання з 150 мкл PBS / 0,1 % Тритон X100 на лунку - Додавання 50 мкл/лунку Стрептавідин/FITC (1:100 у PBS), Beckman Coulter, #PN IM 0307. - Інкубування протягом 15 хвилин при 4 °C. - Трикратне промивання з 150 мкл PBS / 0,1 % Тритон X100 на лунку. - Додавання 150 мкл PBS на лунку (без TX100) і зберігання при 4 °C в загорненому у алюмінієву фольгу вигляді (захист від світла) до аналізу флуоресцентною мікроскопією. - Аналіз за допомогою флуоресцентної мікроскопії. Первинне антитіло: Щоб показати фузіогенність: анти-pp65, клон 1-L-11 асцитичної миші, Biodesign, Сat # C8A023M, 1мг/мл; застосували розбавленим 1:100 у PBS. Вторинне антитіло: Поліклональний кролячий антимишиний Ig / Біотинильований кролячий F (ab') 2 Dako, # E0413, (0,79 г/л); застосовували розбавленим 1:50 у PBS. Еванс синій: Fluka # 46160 - розбавляють до 0,5 % у PBS й використовують розбавленим 1:25 у PBS. Стрептавідин-DTAF (Strep/FITC) Beckman Coulter, #PN IM 0307 (1,8 мг/мл); застосовували розбавленим 1:100 у PBS. PBS/0,1 % Тритон X-100 (для промивання). Супернатантна Гібридома SN2.4G2 Анти-Fcγ Рецептор FcRII; супернатант культури від усієї 4-денної культури (щільні клітини). Анти-Fcγ рецептор FcRII повинен запобігти неспецифічному зв'язуванню антитіл, використовуваних для фарбування CD8 й IFNγ з клітинними рецепторами Fc. Неспецифічне зв'язування антитіл, використовуваних для фарбування, привело б до помилкових позитивних сигналів. 2.4G2 гібридома доступна від ATCC. Середовище: МЕМ з 10 % FCS 2 мМ Глутаміну Гентаміцин 50 мг/мл 1мМ МЕМ натрій-піруват 1x NEAA (замінні амінокислоти) 5. Тестування інфективності частинок ЛЦМВ Тестування інфективності використовується, щоб встановити ефективну вірусну інактивацію. У цьому дослідженні фібробластні клітини культивовані або разом з інфекційним (позитивний контроль) або інактивованим (неінфекційним) вірусом, що міститься в зразках. Наступне AEC (= 3-Аміно-9-етилкарбазол) фарбування є імуногістохімічним тестуванням, що візуалізує цільові протеїни. У цьому випадку, моноклональне антитіло миші є цільовим проти ЛЦМВ IEA (безпосередньо ранній антиген), вірусний протеїн, що з'являється незабаром після інфікування клітини IEA, досягає піка інтенсивності за 48 годин і зберігається під час усього циклу ЛЦМВ інфекції. Вторинне антитіло - антимишаче поліклональне антитіло, кон'юговане з HRP (пероксидаза хрону). Незв'язаний кон'югат промивали і додавали хромогенний субстрат (AEC). Цей субстрат гідролізувався зв'язаним кон'югованим ферментом і продукував нерозчинний кінцевий продукт червоного кольору, який може спостерігатися візуально мікроскопією. Оскільки IEA - ядерний протеїн, клітини, які були інфіковані ЛЦМВ, можуть бути ідентифіковані фарбуванням їхніх ядер. Об'єкт посилання служить тільки контролем для процедури фарбування. Даний зразок розцінений як неінфекційний, оскільки ядра клітин є незабарвленими у відповідних лунках. Протокол для тестування інфективності - Переміщення 100 мкл людських фібробластних клітин MRC5 (ATCC, #CCL-171) із діючої культури у свіжу культуру (1 × 105 клітин/мл культурального середовища; 37 °C, 5 % CO2; чотири однакових екземпляри; 96 лункові пластини). - Після 24 годин додають 100 мкл розбавленого матеріалу, що буде протестований на інфективність до 100 мкл клітин (наприклад, у Таб. 2: А 1:200 розбавлення об'єкту посилання або 0,3 мкг протеїну тестових об'єктів, відповідно) - Інкубування протягом 48 годин при 37 °C - Видалення супернатанту ЛЦМВ після 48 годин - Промивання клітин з 150 мкл PBS /лунку, кожну - Фіксація клітин 96 % етанолом (200 мкл /лунку) протягом 20 хвилин при кімнатній температурі - Двократне промивання з PBS (150 мкл /лунку) 16 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Додавання первинного антитіла, спрямованого щодо ІЕ антигену (αЛЦМВ IEA, Argene; #11003), розбавленого 1:100 у PBS (50 мкл /лунку) - Інкубування протягом 60 хвилин при 37 °C; в обгорненому пластмасовою обгорткою вигляді у вологій камері (інкубаторі) - Промивання 3 x із PBS/0,1 % Тритон X100, 150 мкл /лунку, кожний. - Додавання вторинного антитіла: антимишача пероксидаза (наприклад, Dako P0260) розбавлена 1:500 у PBS (50 мкл /лунку) - Інкубування протягом 60 хвилин при 37 °C; в обгорненому пластмасовою обгорткою вигляді у вологій камері (інкубатор) - Промивання 3 x із PBS/0,1 % Тритон X100, 150 мкл /лунку, кожний. - Фарбування: AEC-вихідний матеріал розбавляли 1:20 в ацетатному буфері, 2 x фільтрували через паперовий фільтр, який попередньо змочували ацетатним буфером. - Безпосередньо перед процедурою фарбування додають 1:1000 H2O2 (30 %) - Від цього фарбувального розчину додають 100 мкл/лунку - Інкубування рівно 1 год. при 37 °C у темряві (інкубатор) - Промивання з 2xPBS, 150 мкл /лунку, кожний - Для мікроскопії додають 1xPBS (150 мкл /лунку); зберігають при 4 °C. Інфіковані ядра будуть яскраво червоними. Вихідний матеріал АЕС: 400 мг АЕС (= 3-Аміно-9-етилкарбазол; Sigma; # A6926) розбавляють до 100 мл DMF (Диметилформамід; Roth; #6251,1); одержання аліквоти - 2 мл і зберігання при температурі 20 °C. Ацетатний буфер: 13,6 г ацетату натрію x 3 H2O + крижана оцтова кислота 2,88 мл + H2O до 1000 мл, коригування рН до 4,9. Середовище: МЕМ з 10 % FCS 2мМ Глутаміну Гентаміцину 50 мг/мл 1мМ МЕМ піруват-натрій 1x NEAA (замінні амінокислоти) Приклад 2 Результати Результати pp65 специфічної CD8 + ЦТЛ відповіді Таким чином, показано, що оброблені препарати ЩТ для інактивування залишкової інфективності ЛЦМВ і надання препаратам ЩТ нефузіогенності, залишаються здатними індукувати pp65 специфічну CD8 + цитотоксичну Т-клітинну відповідь у мишей (Фіг. 2 й 4). Оброблені зразки були нефузіогенними, як зображено на Фіг. 7-12, та як показано в Таб. 2 неінфекційними. Як було показано, оброблені препарати ЩТ для інактивування залишкової інфективності ЛЦМВ і надання препаратам ЩТ нефузіогенності були однаково імуногенними, як і необроблені препарати ЛЦМВ (Фіг. 6). Це було доведено pp65-специфічною CD8 + цитотоксичною Тклітинною відповіддю на ЛЦМВ у мишей. Фіг. 2 показує результати у мишей Balb/C, які були імунізовані матеріалом ЩТ, який обробляли для інактивуваня залишкової інфективності і надання нефузіогенності, як наведено в 2 Прикладі 1: УФС (720 мДж/cм ), низький pН, висока температура, опромінення гаммапроменями (52 кГр) і ß-пропioлактон, відповідно. Вісь X вказує кількість CD8 + цитотоксичних Т5 клітин, що продукують IFNγ на 10 CD8+T клітин. У цьому дослідженні CD8 позитивні цитотоксичні T-клітини (що містяться в суспензії клітин селезінки), які є специфічними щодо pp65, будуть продукувати IFNγ (Фіг. 2a). Обробка клітин селезінки гетерологічним не-ЛЦМВ пептидом служить негативним контролем для рестимулювання (Фіг. 2b). Результати показують, що навіть препарати ЩТ, які обробляють для інактивування залишкової інфективності, залишаються здатними індукувати CD8+ цитотоксичну Т-клітинну відповідь, специфічну щодо pp65 ЛЦМВ. Миші, імунізовані з PBS фактично не показали продукування IFNγ CD8+T клітинами. Фіг. 4 показує результати мишей Balb/C, які були імунізовані матеріалом ЩТ, який обробляли для інактивуваня залишкової інфективності і надання нефузіогенності, як наведено у Прикладі 1: або тільки опромінення УФС, або динамічне УФС і наступне опромінення гаммапроменями (23,8 кГр). Вісь X вказує кількість CD8 + цитотоксичних Т-клітин, що продукують IFNγ 5 на 10 CD8+T клітин. У цьому дослідженні CD8 позитивні цитотоксичні T-клітини (що містяться в 17 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 суспензії клітин селезінки), які є специфічними щодо pp65, будуть продукувати IFNγ (Фіг. 4a). Обробка клітин селезінки гетерологічним не-ЛЦМВ пептидом служить негативним контролем для рестимулювання (Фіг. 4b). Результати показують, що навіть препарати ЩТ, оброблені комбінуванням двох процедур опромінення, залишаються здатними індукувати CD8 + цитотоксичну Т-клітинну відповідь, специфічну щодо pp65 ЛЦМВ. Миші, імунізовані PBS, фактично не показали продукування IFNγ CD8+T клітинами. Фіг. 6 показує результати мишей Balb/C, які були імунізовані матеріалом ЩТ. Матеріал або обробляли для інактивуваня залишкової інфективності і надання нефузіогенності (напівдинамічне опромінення УФС), або матеріал не одержував такої обробки. 5 Вісь X вказує кількість CD8 + цитотоксичних Т-клітин, що продукують IFNγ на 10 CD8+T клітин. У цьому дослідженні CD8 позитивні цитотоксичні T-клітини (що містяться в суспензії клітин селезінки), які є специфічними щодо pp65, будуть продукувати IFNγ (Фіг. 6a). Обробка клітин селезінки гетерологічним не-ЛЦМВ пептидом служить негативним контролем для рестимулювання (Фіг. 6b). Результати показують, що оброблені препарати ЩТ для інактивування залишкової інфективності ЛЦМВ і надання нефузіогенності, були однаково імуногенними, як і необроблені препарати ЛЦМВ. Це було оцінено pp65-специфічною CD8 + цитотоксичною Т-клітинною відповіддю щодо ЛЦМВ у мишей. Миші, імунізовані з PBS фактично не показали продукування IFNγ CD8+T клітинами. Результати анти-ЛЦМВ IgG відповіді Таким чином, це показує, що оброблені препарати ЩТ для інактивування залишкової інфективності ЛЦМВ і надання нефузіогенності, залишалися здатними індукувати специфічну анти-ЛЦМВ IgG відповідь (Фіг. 3 й 5). Зразки були нефузіогенними, як позначено на Фіг. 7-12 і неінфекційними, як показано в Таб. 2. Фіг. 3 показує результати мишей Balb/C, які були імунізовані матеріалом ЩТ, який обробляли для інактивуваня залишкової інфективності і надання нефузіогенності, як наведено у 2 Прикладі 1: УФС (720 мДж/cм ), низький pН, висока температура, опромінення гаммапроменями (52 кГр) і ß-пропioлактон, відповідно. Вище максимальне розбавлення сироватки, що все ще залишається здатною індукувати сигнал тестування, індукувало більш сильну антиЛЦМВ відповідь. Результати показують, що навіть препарати ЩТ, оброблені комбінуванням двох процедур опромінення, залишаються здатними індукувати специфічну анти-ЛЦМВ IgG відповідь. Фіг. 5 показує результати мишей Balb/C, які були імунізовані матеріалом ЩТ, який обробляли для інактивуваня залишкової інфективності і надання нефузіогенності, як наведено у Прикладі 1: або тільки опромінення УФС, або динамічне УФС і наступне опромінення гаммапроменями (23,8 кГр). Вище максимальне розбавлення сироватки, що все ще залишається здатною індукувати сигнал тестування, індукувало більш сильну анти-ЛЦМВ відповідь. Результати показують, що навіть препарати ЩТ, оброблені комбінуванням двох процедур опромінення, залишаються здатними індукувати специфічну анти-ЛЦМВ Ig G відповідь. Результати тестування фузіогенності. Таким чином результати показують, що інактивовані препарати ЩТ, застосовувані для демонстрування pp65 специфічної CD8 + цитотоксичної Т-клітинної відповіді (Фіг. 2 й 4), так само як індукування певних анти-ЛЦМВ антитіл (Фіг. 3 й 5), були нефузіогенними; і, як показано в Таб. 2, були неінфекційними. Зразки обробляли, як наведено у Прикладі 1. Неспецифічне зелене забарвлення в зразку P4 відбувалося внаслідок артефакту. Результат типового тестування інфективності Таким чином результати показують, що оброблені препарати ЩТ для інактивування залишкової інфективності ЛЦМВ і надання нефузіогенності, були неінфекційними. Однак, ці зразки залишалися імуногенними, як оцінено їхньою здатністю індукувати позитивну цитотоксичну Т-клітинну відповідь CD8, специфічну щодо антигену pp65 ЛЦМВ (Фіг. 2 й 4) і як оцінено їхньою здатністю індукувати специфічний анти-ЛЦМВ IgG (Фіг. 3 й 5). Клітини, культивовані тільки із середовищем, служили негативним контролем. Тільки не інактивований об'єкт посилання міг індукувати червоне забарвлення ядра, тобто був інфекційним. Зразки обробляли, як наведено у Прикладі 1. 18 UA 100980 C2 Таблиця 2: Тип зразка Напівдинамічне опромінення УФС 2 (5 хв, 720 мДж/cм ) рН 4,5 протягом 60 хвилин при 30 °C 30 хвилин при 56 °C опромінення гаммапроменями (52 кГр) β-пропіолактон (0,21 % БПЛ, 60 хвилин при 30 °C) Динамічне УФС (200 2 мДж/cм ) і опромінення гамма-променями (23,8 кГр) Об'єкт посилання: Неінактивовані віріони ЛЦМВ Ad169 Тільки середовище 5 Графічна документація Кількість застосовуваного Інфекційні відповідних забарвлених протеїну або початкове частинки (ЛЦМВ) ядер клітин, зображених розбавлення /мл на 0,3 мкг протеїну Фіг. 13 0 0,3 мкг протеїну Фіг. 14 0 0,3 мкг протеїну Фіг. 15 0 0,3 мкг протеїну Фіг. 16 0 0,3 мкг протеїну Фіг. 17 0 0,3 мкг протеїну Зображення відсутнє; результат задокументований 0 1:200 Фіг. 18 6,82e6 Н/A Фіг. 19 0 Особливості представленого винаходу, розкриті в описі, формулі винаходу та/або фігурах, можуть й окремо, або у будь-якій їх комбінації бути матеріалом для реалізації винаходу у різних його формах. 19 UA 100980 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Композиція, що включає агент, вибраний із групи, що включає ЛЦМВ віріони, ЛЦМВ щільні тіла й ЛЦМВ НІОЧ, яка відрізняється тим, що композиція здатна до індукування імунної реакції, хоча віріони, НІОЧ та/або щільні тіла є нефузіогенними. 2. Композиція за п. 1, де імунною реакцією є антиген-специфічна CD8+ відповідь. 3. Композиція за будь-яким з пунктів 1-2, де імунною реакцією є антиген-специфічна цитотоксична Т-клітинна відповідь. 4. Композиція за будь-яким з пунктів 1-3, де імунною реакцією є антиген-специфічна CD8+, цитотоксична Т-клітинна відповідь. 5. Композиція за будь-яким з пунктів 1-4, де імунною реакцією є антиген-специфічна гуморальна імунна відповідь, переважно імунною реакцією є антиген-специфічна гуморальна імунна відповідь, причому антитіла є нейтралізуючими антитілами. 6. Композиція за будь-яким з пунктів 1-5, де імунною реакцією є антиген-специфічна CD4+ Тхелперна відповідь. 7. Композиція за будь-яким з пунктів 1-6, де антигеном є ЛЦМВ антиген, причому ЛЦМВ антиген переважно вибраний із групи, що включає рр65 антиген, похідні рр65 антигену, рр28 й рр28 похідні, рр150 й рр150 похідні, gВ і похідні gВ, gН й gН похідні, і безпосередньо ранні антигени і їх похідні, глікопротеїни й похідні глікопротеїну, переважно ЛЦМВ глікопротеїни і похідні ЛЦМВ глікопротеїну, причому глікопротеїнами є переважно gМ і gМ похідні або gN і gN похідні. 8. Композиція за будь-яким з пунктів 1-7, де агент є інактивованим. 9. Композиція за будь-яким з пунктів 1-8, де композиція є фармацевтичною композицією або діагностичною композицією. 10. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва медикаменту, переважно для індукування імунної реакції проти одного або декількох антигенів ЛЦМВ. 11. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому композиція та/або агент піддані інактивуванню, для виробництва медикаменту для індукування імунної реакції, переважно імунної реакції проти одного або декількох антигенів ЛЦМВ. 12. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва вакцини. 13. Застосування за п. 12, де композиція та/або агент піддані інактивуванню. 14. Застосування за будь-яким з пунктів 12 та 13, де імунною реакцією є антиген-специфічна CD8+ відповідь. 15. Застосування за будь-яким з пунктів 12-14, де імунною реакцією є антиген-специфічна цитотоксична Т-клітинна відповідь. 16. Застосування за будь-яким з пунктів 12-15, де імунною реакцією є антиген-специфічна CD8+, цитотоксична Т-клітинна відповідь. 17. Застосування за будь-яким з пунктів 12-16, де імунною реакцією є антиген-специфічна гуморальна імунна відповідь, переважно імунною реакцією є антиген-специфічна гуморальна імунна відповідь, причому антитіла є нейтралізуючими антитілами. 18. Композиція за будь-яким з пунктів 12-17, де імунною реакцією є антиген-специфічна CD4+ Тхелперна відповідь. 19. Застосування за будь-яким з пунктів 12-18, де антигеном є ЛЦМВ антиген, причому ЛЦМВ антиген переважно вибраний із групи, що включає рр65 антиген, похідні рр65 антигену, рр28 й рр28 похідні, рр150 й рр150 похідні, gВ і похідні gВ, gН й gН похідні, і безпосередньо ранні антигени і їх похідні, глікопротеїни й похідні глікопротеїну, переважно ЛЦМВ глікопротеїни і похідні ЛЦМВ глікопротеїну, причому глікопротеїнами є переважно gМ і gМ похідні або gN і gN похідні. 20. Застосування за будь-яким з пунктів 12-19, де вакцина призначена для лікування та/або профілактики ЛЦМВ інфекції. 21. Застосування за будь-яким з пунктів 12-20, де вакцина призначена для лікування та/або профілактики захворювання, викликаного ЛЦМВ, у донорів трансплантатів та/або реціпієнтів трансплантатів. 22. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому агент є нефузіогенним, для виробництва діагностичного агента. 20 UA 100980 C2 5 10 15 20 25 30 35 40 45 50 23. Застосування агента, де агент вибраний із групи, що включає віріон ЛЦМВ, ЛЦМВ щільне тіло й ЛЦМВ НІОЧ, або композиції, що включає такий агент, причому композиція та/або агент піддані інактивуванню, для виробництва діагностичного агента. 24. Спосіб виробництва композиції за будь-яким з пунктів 1-9, що включає стадії: a) забезпечення агента, вибраного із групи, що включає ЛЦМВ віріони, ЛЦМВ НІОЧ і щільні тіла ЛЦМВ; b) обробку агента для надання йому нефузіогенності, причому згадуваний агент є усе ще здатним до індукування імунної реакції. 25. Спосіб за пунктом 24, де обробка на стадії b) є одним або будь-якою комбінацією засобів, вибраних із групи, що включає УФ обробку, опромінення високою енергією, обробку низьким рН, термообробку й обробку з агентами перехресного зшивання. 26. Спосіб за пунктом 25, де УФ-обробкою є обробка УФС, причому довжина хвилі становить приблизно 100 нм - 280 нм, або УФ-довгохвильова обробка. 27. Спосіб за будь-яким з пунктів 25 та 26, де УФ-обробку використовують в діапазоні доз від 2 2 100 до 2000 мДж/см , переважно від 100 до 1000 мДж/см і більш переважно від 150 до 900 2 мДж/см . 28. Спосіб за будь-яким з пунктів 25-27, у якому перед, одночасно або після УФ-обробки агент піддають опроміненню гамма-променями. 29. Спосіб за пунктом 25, в якому опромінення високою енергією є опроміненням гаммапроменями. 30. Спосіб за пунктом 29, в якому гамма-випромінювання у сполученні з гамма-опроміненням здійснюють в межах діапазону доз приблизно від 15-70 кГр, більш переважно 20-65 кГр і найбільш переважно 20-60 кГр. 31. Спосіб за пунктом 25, де обробкою є обробка низьким рН, і обробка низьким рН включає експозицію агента щодо рН від приблизно 0 до 5, переважно 1-4,5 і більш переважно 2-4,5. 32. Спосіб за пунктом 31, у якому агент піддають обробці низьким рН протягом приблизно 0,5-24 годин, переважно 0,5-12 годин і більш переважно 0,5-6 годин. 33. Спосіб за будь-яким з пунктів 31 та 32, в якому агент піддають обробці низьким рН при температурі приблизно 1-50 °С, переважно 1-45 °С і більш переважно 1-40 °С. 34. Спосіб за пунктом 25, в якому термообробка включає інкубування агента при температурі між 37,5 °С і 65 °С, переважно при температурі між 37,5 і 60 °С і більш переважно при температурі між 37,5 і 56 °С. 35. Спосіб за пунктом 34, в якому агент інкубують протягом періоду між 5 сек. і 36 год., переважно між 5 сек. і 30 год. і більш переважно між 5 сек. і 24 год. 36. Спосіб за пунктом 25, в якому обробкою є обробка з одним або декількома агентами перехресного зшивання, й причому агент перехресного зшивання, кожен і незалежно, вибраний із групи, що включає лактони, етоксиди та альдегіди. 37. Спосіб за пунктом 36, в якому агентом перехресного зшивання є -пропіолактон. 38. Спосіб за пунктом 36, в якому агентом перехресного зшивання є оксид етилену. 39. Спосіб за пунктом 36, в якому агентом перехресного зшивання є формальдегід. 40. Спосіб за будь-яким з пунктів 36-39, в якому агентпіддають дії агента перехресного зшивання з концентрацією агента перехресного зшивання і більш переважно -пропіолактону, у середовищі, що містить агент в концентрації між 0,01 й 10 % (об/об), переважно між 0,05 й 10 % (об/об) і більш переважно між 0,05 й 7,5 % (об/об). 41. Спосіб за будь-яким з пунктів 36-40, в якому агент інкубують з агентом перехресного зшивання, переважно з -пропіолактоном, протягом періоду між 1 хвилиною та 72 год., переважно між 1 хвилиною та 48 год. і більш переважно між 1 хвилиною та 24 год. 42. Спосіб за будь-яким з пунктів 36-41, в якому агент інкубують при температурі між приблизно 1 °С і приблизно 60 °С, переважно при температурі між приблизно 1 °С і 50 °С, більш переважно при температурі між приблизно 1 °С і 40 °С. 21 UA 100980 C2 22 UA 100980 C2 23 UA 100980 C2 24 UA 100980 C2 25 UA 100980 C2 26 UA 100980 C2 27 UA 100980 C2 Комп‟ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition containing hcmv particles
Автори англійськоюGrode, Leander
Назва патенту російськоюКомпозиция, включающая частички человеческого цитомегаловируса
Автори російськоюГроде Леандер
МПК / Мітки
МПК: A61P 31/22, A61K 39/245
Мітки: включає, лцмв, композиція, частинки, людського, цитомегаловірусу
Код посилання
<a href="https://ua.patents.su/30-100980-kompoziciya-shho-vklyuchaeh-chastinki-lyudskogo-citomegalovirusu-lcmv.html" target="_blank" rel="follow" title="База патентів України">Композиція, що включає частинки людського цитомегаловірусу (лцмв)</a>
Попередній патент: Застосування піридопіримідинонових інгібіторів рі3к альфа для лікування раку
Наступний патент: Тверда самонаклеювальна композиція для очищення поверхні
Випадковий патент: Спосіб та пристрій для зняття відтисків при зубному протезуванні