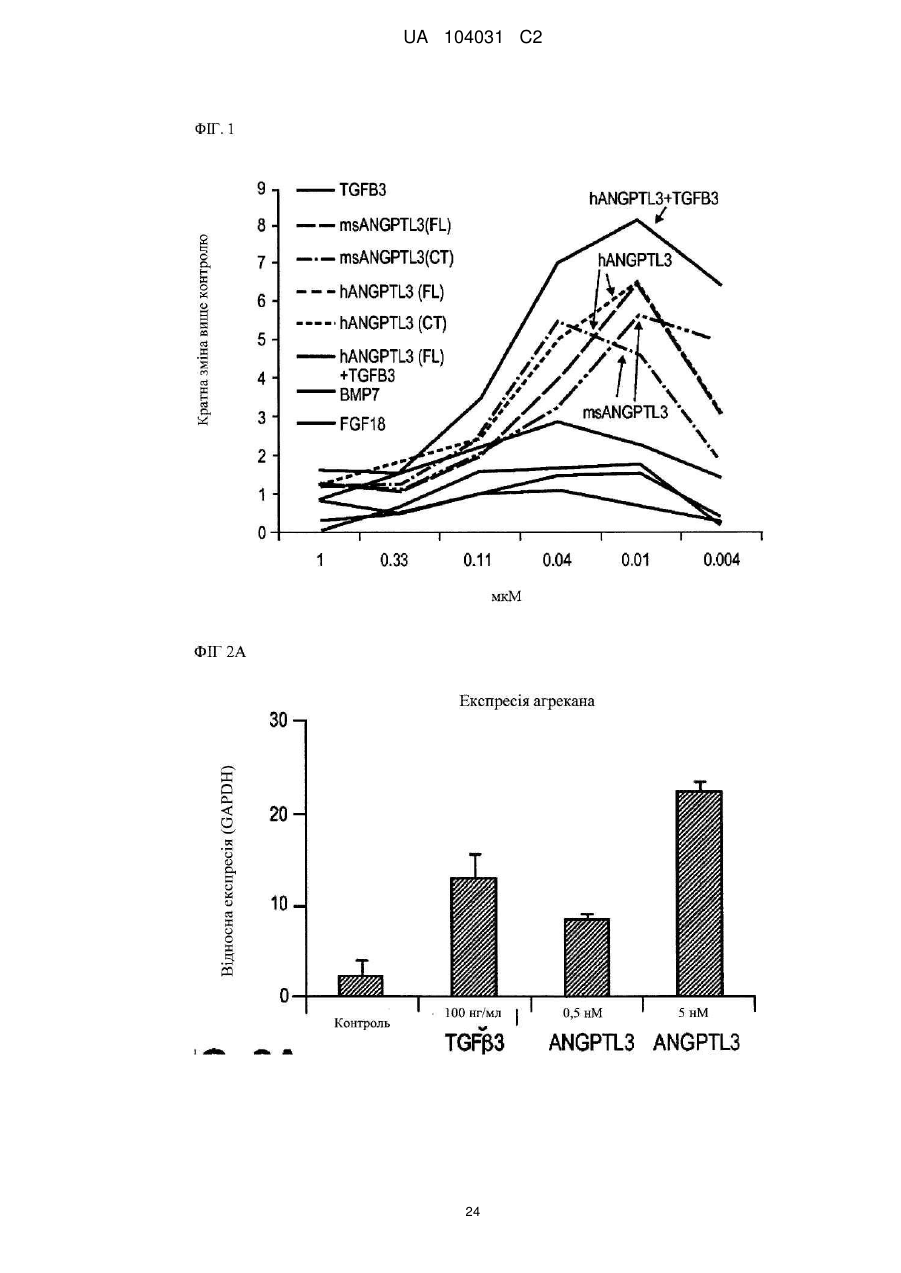
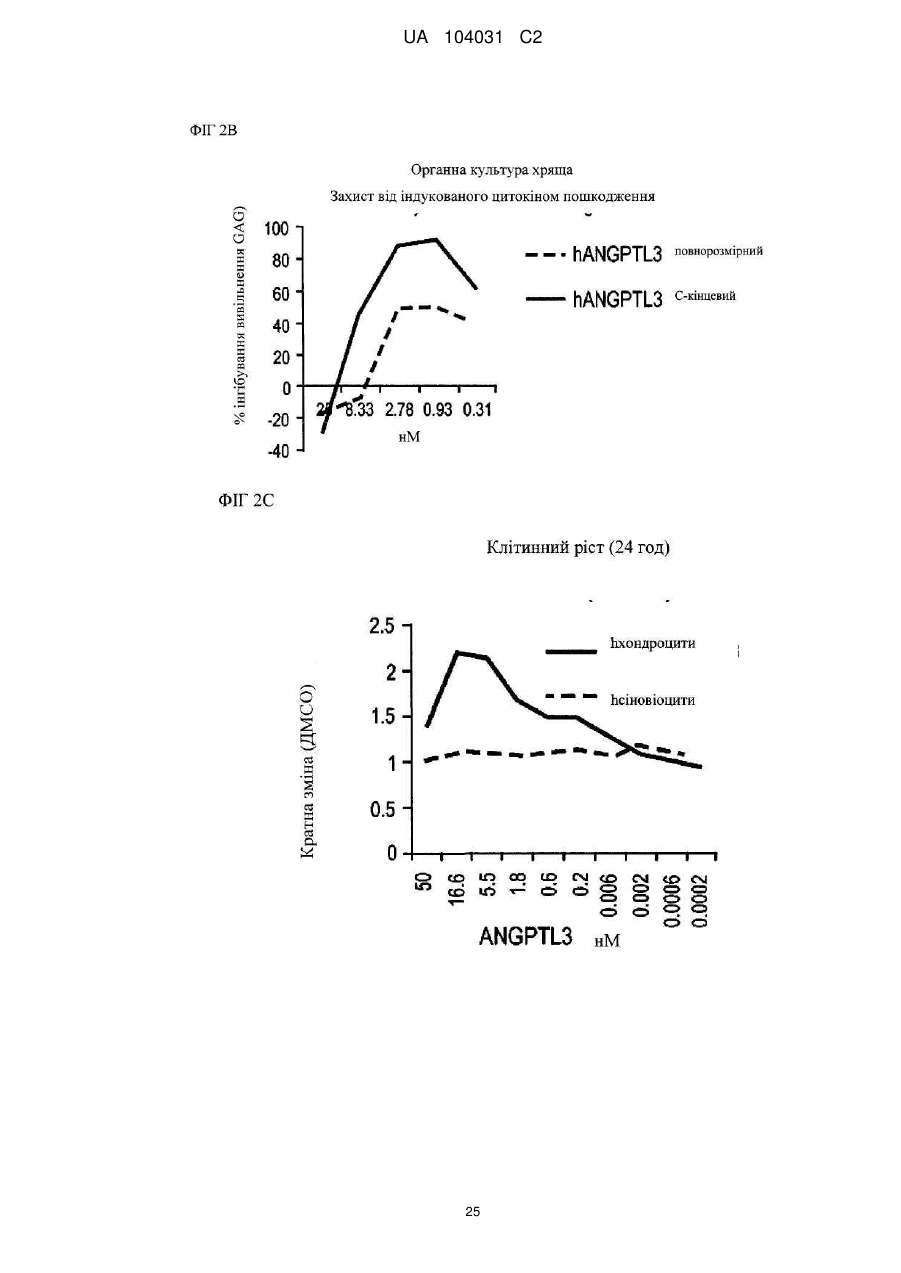
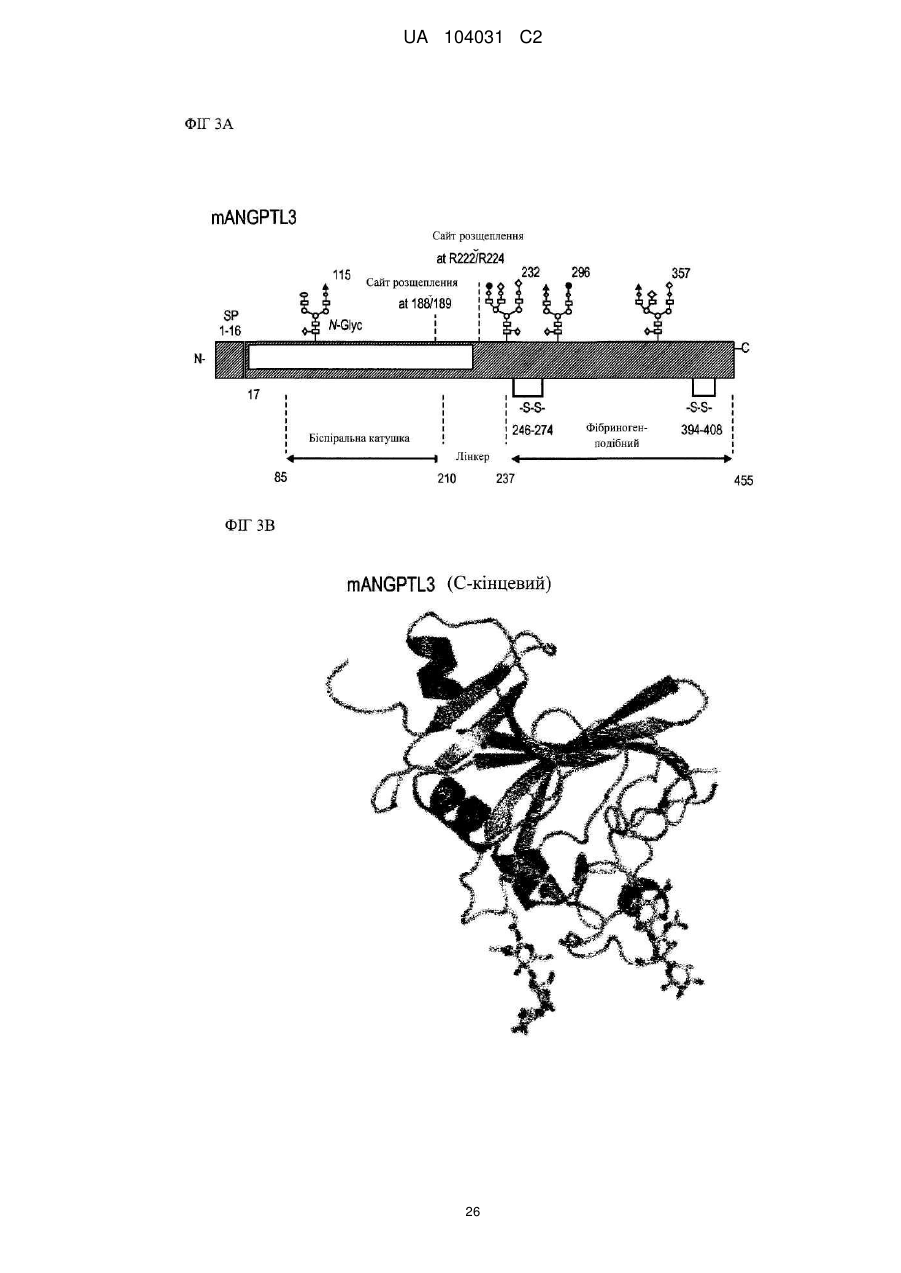
Диференціація мезенхімальних стовбурових клітин
Формула / Реферат
1. Поліпептид для застосування у способі полегшення або запобігання артриту або ураження суглоба у ссавця, де поліпептид вибраний з:
(а) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NO:1 або 25;
(b) поліпептиду, що містить амінокислотну послідовність з SEQ ID NO:1 або 25;
(c) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NOs:2, 3, 4, 26, 27, або 28;
(d) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:2, 3, 4, 26, 27, або 28;
(e) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NOs:5, 9, 13, 17, або 21; або
(f) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:5, 9, 13, 17, або 21,
причому вказаний поліпептид має хондрогенну активність.
2. Поліпептид за п. 1, який відрізняється тим, що поліпептид є пегильованим.
3. Поліпептид за п. 1 або 2, який відрізняється тим, що поліпептид злитий з людським сироватковим альбуміном (HSA), константною ділянкою важкого ланцюга імуноглобулінів (Fc), полігістидином, глутатіон S трансферазою (GST), тіоредоксином, білком А, білком G, або мальтозо-зв'язуючим білком (МВР).
4. Поліпептид за будь-яким з пп. 1-3, який відрізняється тим, що поліпептид містить 1, 2, 3, 4 або більше неприродних амінокислот.
5. Поліпептид за будь яким з пп 1-4, який відрізняється тим, що (а) пацієнт має артрит або ураження суглоба, або (b) пацієнт не має артриту або ураження суглоба, але належить до групи ризику розвитку артриту або ураження суглоба.
6. Поліпептид за будь-яким з пп 1-5, який відрізняється тим, що:
(а) поліпептид складається з амінокислотної послідовності з SEQ ID NO:1 або 25; або
(b) поліпептид складається з амінокислотної послідовності з SEQ ID NOs:2, 3, 4, 26, 27 або 28; або
(с) поліпептид складається з амінокислотної послідовності з SEQ ID NOs:5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 або 24; та
при цьому вказаний поліпептид має хондрогенну активність.
7. Поліпептид за будь-яким з пп 1-6, який відрізняється тим, що: (а) що артрит вибраний з групи, що складається з остеоартрозу, травматичного артриту і аутоімунного артриту; та/або (b) ссавцем є людина, собака або кішка; або (с) композиція додатково включає гіалуронову кислоту.
8. Застосування поліпептиду, вибраного з:
(а) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NO:1 або 25;
(b) поліпептиду, що містить амінокислотну послідовність з SEQ ID NO:1 або 25;
(c) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NOs:2, 3, 4, 26, 27 або 28;
(d) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:2, 3, 4, 26, 27 або 28;
(e) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NOs:5, 9, 13, 17 або 21; або
(f) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:5, 9, 13, 17 або 21,
у виробництві лікарського засобу для полегшення або запобігання артриту або ураження суглоба у ссавця, де вказаний поліпептид має хондрогенну активність.
9. Застосування за п. 8, у якому поліпептид є пегильованим.
10. Застосування за будь-яким з пп 8-9, у якому поліпептид злитий з людським сироватковим альбуміном (HSA), константною ділянкою важкого ланцюга імуноглобулінів (Fc), полігістидином, глутатіон S трансферазою (GST), тіоредоксином, білком А, білком G, або мальтозо-зв'язуючим білком (МВР).
11. Застосування за будь-яким з пп. 8-10, у якому поліпептид містить 1, 2, 3, 4 або більше неприродних амінокислот.
12. Застосування за будь-яким з пп. 8-11, у якому: (а) пацієнт має артрит або ураження суглоба, або (b) пацієнт не має артриту або ураження суглоба, але належить до групи ризику розвитку артриту або ураження суглобу.
13. Застосування за будь-яким з пп. 8-12, у якому:
(а) поліпептид складається з амінокислотної послідовності з SEQ ID NO:1 або 25; або
(b) поліпептид складається з амінокислотної послідовності з SEQ ID NOs:2, 3, 4, 26, 27 або 28; або
(с) поліпептид складається з амінокислотної послідовності з SEQ ID NOs: 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 або 24; та
при цьому вказаний поліпептид має хондрогенну активність.
14. Застосування за будь-яким з пп. 8-13, у якому: (а) артрит вибраний з групи, що складається з остеоартрозу, травматичного артриту і аутоімунного артриту; та/або (b) ссавцем є людина, собака або кішка; або (с) композиція додатково включає гіалуронову кислоту.
15. Спосіб in vitro індукування диференціації мезенхімальних стовбурових клітин в хондроцити, де спосіб включає контактування мезенхімальних стовбурових клітин з ефективною кількістю поліпептиду, що містить амінокислотну послідовність, яка має принаймні 95 % ідентичність з SEQ ID NO:1 або 25, де вказаний поліпептид має хондрогенну активність.
16. Спосіб за п. 15, який відрізняється тим, що поліпептид є пегильованим.
17. Спосіб за будь-яким з пп. 15-16, який відрізняється тим, що поліпептид злитий з людським сироватковим альбуміном (HSA), константною ділянкою важкого ланцюга імуноглобулінів (Fc), полігістидином, глутатіон S трансферазою (GST), тіоредоксином, білком А, білком G, або мальтозо-зв'язуючим білком (МВР).
18. Спосіб за будь-яким з пп. 15-17, який відрізняється тим, що поліпептид містить 1, 2, 3, 4 або більше неприродних амінокислот.
19. Спосіб за будь-яким з пп. 15-18, який відрізняється тим, що:
(а) поліпептид включає амінокислотну послідовність SEQ ID NO:1 або 25;
(b) амінокислотна послідовність має принаймні 95 % ідентичність з SEQ ID NOs:2, 3, 4, 26, 27 або 28;
(с) амінокислотна послідовність включає SEQ ID NOs:2, 3, 4, 26, 27 або 28;
(d) амінокислотна послідовність має принаймні 95 % ідентичність з SEQ ID NOs:5, 9, 13, 17 або 21; або
(e) амінокислотна послідовність включає SEQ ID NOs: 5,9, 13, 17 або 21; та
при цьому вказаний поліпептид має хондрогенну активність.
20. Поліпептид для застосування у способі індукування виробництва хрящової тканини або відновлення хрящової тканини у ссавця, де спосіб включає контактування мезенхімальних стовбурових клітин з ефективною кількістю поліпептиду, що містить амінокислотну послідовність, яка має принаймні 95 % ідентичність з SEQ ID NO:1 або 25, де вказаний поліпептид має хондрогенну активність.
21. Поліпептид за п. 20, який відрізняється тим, що поліпептид є пегильованим.
22. Поліпептид за будь-яким з пп. 20-21, який відрізняється тим, що поліпептид злитий з людським сироватковим альбуміном (HSA), константною ділянкою важкого ланцюга імуноглобулінів (Fc), полігістидином, глутатіон S трансферазою (GST), тіоредоксином, білком А, білком G або мальтозо-зв'язуючим білком (МВР).
23. Поліпептид за будь-яким з пп. 20-22, який відрізняється тим, що поліпептид містить 1, 2, 3, 4 або більше неприродних амінокислот.
24. Поліпептид за будь-яким з пп. 20-23, який відрізняється тим, що ссавцем є людина, собака або кішка.
25. Поліпептид за будь-яким з пп. 20-24, який відрізняється тим, що:
(а) поліпептид включає амінокислотну послідовність SEQ ID NO:1 або 25;
(b) амінокислотна послідовність має принаймні 95 % ідентичність з SEQ ID NOs:2, 3, 4, 26, 27, або 28;
(с) амінокислотна послідовність включає SEQ ID NOs:2, 3, 4, 26, 27, або 28;
(d) амінокислотна послідовність має принаймні 95 % ідентичність з SEQ ID NOs:5, 9, 13, 17 або 21; або
(e) амінокислотна послідовність включає SEQ ID NOs:5, 9, 13, 17 або 21; та
при цьому вказаний поліпептид має хондрогенну активність.
26. Фармацевтична композиція для внутрішньосуглобової доставки, яка відрізняється тим, що композиція включає фармацевтично ефективну кількість поліпептиду, вибраного з:
(а) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NOs:2, 3, 4, 26, 27 або 28;
(b) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:2, 3, 4, 26, 27 або 28;
(c) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NOs:5, 9, 13, 17 або 21; або
(d) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22 або 23,
при цьому вказаний поліпептид має хондрогенну активність.
27. Композиція за п. 26, яка відрізняється тим, що поліпептид є пегильованим.
28. Композиція за п. 27, яка відрізняється тим, що поліпептид злитий з людським сироватковим альбуміном (HSA), константною ділянкою важкого ланцюга імуноглобулінів (Fc), полігістидином, глутатіон S трансферазою (GST), тіоредоксином, білком А, білком G, або мальтозо-зв'язуючим білком (МВР).
29. Композиція за будь-яким з пп. 26-28, яка відрізняється тим, що поліпептид містить 1, 2, 3, 4 або більше неприродних амінокислот.
30. Композиція за будь-яким з пп. 26-29, яка відрізняється тим, що додатково включає гіалуронову кислоту.
31. Поліпептид, вибраний з:
(а) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:2, 3, 26, або 27;
(b) поліпептиду, що містить амінокислотну послідовність, що має принаймні 95 % ідентичність з SEQ ID NOs:5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22 або 23;
(c) поліпептиду, що містить варіант Angptl3 амінокислотної послідовності, в основному ідентичний з SEQ ID NOs:5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22 або 23; або
(d) поліпептиду, що містить амінокислотну послідовність з SEQ ID NOs:5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22 або 23,
для застосування у терапії, причому вказаний поліпептид має хондрогенну активність.
Текст
Реферат: Винахід належить до поліпептиду, його застосування у виробництві лікарського засобу для полегшення або запобігання артриту або ураженню суглоба у ссавця, де вказаний поліпептид має хондрогенну активність, до способу in vitro індукування диференціації мезенхімальних стовбурових клітин в хондроцити, до фармацевичної композиції, що містить поліпептид. UA 104031 C2 (12) UA 104031 C2 UA 104031 C2 5 10 15 20 25 30 35 40 45 50 55 Перехресні посилання Ця заявка заявляє пріоритет попередньої заявки США 35 USC § 1,119 (е) № 61/225 293, поданої 14 липня 2009 року, зміст якої включений авторами в якості посилання в повному обсязі. Рівень техніки Остеоартрит (ОА) є найбільш поширеним захворюванням опорно-рухового апарату. Близько 40 мільйонів американців на даний час страждають на це захворювання, і це число, за прогнозами, збільшиться до 60 млн. протягом наступних двадцяти років, внаслідок старіння населення і збільшення тривалості життя, що робить це порушення четвертою за значимістю причиною інвалідності. ОА характеризується повільним дегенеративним руйнуванням суглобу, в тому числі і суглобового хряща (що містить клітини і матрицю, які виробляють змащуючу речовину і амортизацію для суглоба) і субхондральну кістку, що лежать в основі суглобового хряща. Сучасні методи терапії ОА включають полегшення болю за допомогою пероральних НПЗПЗ або селективних інгібіторів циклооксигенази 2 (ЦОГ-2), внутрішньосуглобових (IA) ін'єкцій таких засобів, як кортикостероїди і гіалуронан, і хірургічні підходи. Мезенхімальні стовбурові клітини (МСК) присутні у суглобовому хрящі дорослих і при їх виділенні можуть бути запрограмовані in vitro для проходження диференціації до хондроцитів та інших мезенхімальних клітин. Частково, цей процес регулюється факторами росту (TGFβs, BMP), умовами в сироватці і міжклітинними контактами. Короткий опис винаходу Даний винахід пропонує способи для полегшення або запобігання артриту або ураження суглобів у ссавців. У деяких варіантах спосіб включає введення в суглоб ссавців композиції, що містить ефективну кількість поліпептиду, що включає амінокислотну послідовність, що має принаймні 95 % ідентичність до SEQ ID NO: 1 або 25, тим самим полегшуючи або запобігаючи розвитку артриту або ураження суглобів у ссавців. У деяких варіантах втілення особа має артрит або ураження суглоба. У деяких варіантах втілення особа не має артриту або ураження суглобу, але належить до групи ризику їх розвитку. У деяких варіантах втілення поліпептид містить SEQ ID NO: 1 або 25. У деяких варіантах втілення амінокислотна послідовність, має принаймні 95 % ідентичність до SEQ ID NO 2, 3, 4, 26, 27 або 28. У деяких варіантах втілення амінокислотна послідовність включає SEQ ID NO: 2, 3, 4, 26, 27 або 28. У деяких варіантах втілення амінокислотна послідовність не менше ніж на 80 % ідентична будь-якій з SEQ ID NO: 5-24. У деяких варіантах втілення амінокислотна послідовність включає в себе будь-яку з SEQ ID NO: 5-24. У деяких варіантах втілення артрит вибирається з групи, що складається з остеоартрозу, травматичного артриту і аутоімунного артриту. У деяких варіантах втілення ссавець - людина. У деяких варіантах втілення композиція додатково містить гіалуронову кислоту. Даний винахід також пропонує методи індукування диференціації мезенхімальних стовбурових клітин в хондроцити, які утворюють хрящову тканину. У деяких варіантах втілення спосіб включає контактування мезенхімальних стовбурових клітин з достатньою кількістю поліпептиду, що містить амінокислотну послідовність, яка має принаймні 95 % ідентичність з SEQ ID NO: 1 або 25, щоб викликати диференціацію стовбурових клітин в хондроцити. У деяких варіантах втілення спосіб проводиться in vitro. У деяких варіантах втілення спосіб проводиться in vivo, і стовбурові клітини присутні у ссавців. У деяких варіантах втілення ссавець - людина. У деяких варіантах втілення поліпептид містить SEQ ID NO: 1 або 25. У деяких варіантах втілення амінокислотна послідовність має, принаймні, 95 % ідентичність з SEQ ID NO: 2, 3, 4, 26, 27 або 28. У деяких варіантах втілення амінокислотна послідовність включає SEQ ID NO: 2, 3, 4, 26, 27 або 28. У деяких варіантах втілення амінокислотна послідовність не менше ніж на 80 % ідентична будь-якій з SEQ ID NO: 5-24. У деяких варіантах втілення амінокислотна послідовність включає в себе будь-яку з SEQ ID NO: 5-24. Даний винахід також пропонує фармацевтичні композиції для внутрішньосуглобової доставки і системної доставки. У деяких варіантах втілення композиція, що містить фармацевтично ефективну кількість поліпептиду, що включає амінокислотну послідовність, яка має принаймні 95 % ідентичність з SEQ ID NO: 1 або 25. У деяких варіантах втілення композиція додатково містить гіалуронову кислоту. У деяких варіантах втілення поліпептид містить SEQ ID NO: 1 або 25. 1 UA 104031 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах втілення ідентичність амінокислотної послідовності до SEQ ID NOS 2, 3, 4, 26, 27 або 28 становить, принаймні, 95 %. У деяких варіантах втілення амінокислотна послідовність включає SEQ ID NO: 2, 3, 4, 26, 27 або 28. У деяких варіантах втілення амінокислотна послідовність не менше ніж на 80 % ідентична будь-якій з SEQ ID NO: 5-24. У деяких варіантах втілення амінокислотна послідовність включає в себе будь-яку з SEQ ID NO: 5-24. Додаткові можливості, переваги і варіанти здійснення винаходу можуть бути викладені або очевидні з розгляду наступного докладного опису і формули винаходу. Крім того, слід розуміти, що як вище зазначений короткий опис винаходу, так і подальший детальний опис є прикладами і призначені для забезпечення подальших пояснень, без обмеження обсягу винаходу. Визначення Терміни "пептидоміметик" і "міметик" відносяться до синтетичної хімічної сполуки, яка має по суті ті ж структурні та функціональні характеристики поліпептида, що зустрічається або не зустрічається в природі (наприклад, ANGPTL3). Аналоги пептидів широко використовуються у фармацевтичній промисловості у якості непептидних препаратів з властивостями, що є аналогічними властивостям шаблонного пептиду. Ці типи непептидної солуки називаються "пептидними міметиками" або "пептидоміметиками" (Fauchere, J. Adv. Drug Res. 15:29 (1986); Veber and Freidinger TINS p. 392 (1985); і Evans et al. J. Med. Chem. 30:1229 (1987), які включені авторами шляхом посилання). Пептидні міметики, які структурно схожі на терапевтично корисні пептиди, можуть бути використані для отримання еквівалентного або вдосконаленого терапевтичного або профілактичного ефекту. Як правило, пептидоміметики структурно схожі на парадигмальний поліпептид (тобто, поліпептид, який має біологічну або фармакологічну активність), наприклад, той, що виявлений в поліпептиді, що розглядається, але містить один або кілька пептидних зв'язків, необов'язково заміщених на зв'язок, вибраний з групи, що складається, наприклад, з CH2NH-, -CH2S-, -СН2-СН2-, -CH=CH- (цис-і транс-), -COCH2-, -CH (OH) CH2- і -CH2SO-. Міметик може або повністю складатися з синтетичних, неприродних аналогів амінокислот, або, бути химерною молекулою з частково природних пептидних амінокислот і частково не-природних аналогів амінокислот. Міметик також може включати будьяку кількість природних амінокислотних консервативних замін до тих пір, поки такі заміни також не суттєво змінюють структуру та/або активність міметика. Наприклад, композиція міметика знаходиться в межах обсягу винаходу, якщо він в змозі виконувати принаймні один вид активності поліпептиду, що розглядається. Терміни "поліпептид", "пептид" і "білок" використовуються авторами як синоніми для позначення полімеру з амінокислотних залишків. Умови поширюються і на амінокислотні полімери, в яких один або кілька амінокислотних залишків - штучні хімічні міметики відповідної природної амінокислоти, а також на природні амінокислотні полімери і полімери амінокислот, що не зустрічаються в природі. Термін "амінокислота" означає природні і синтетичні амінокислоти, а також амінокислотні аналоги і амінокислотні міметики, які функціонують таким чином, що схожі з природними амінокислотами. Природні амінокислоти – амінокислоти, що кодуються генетичним кодом, а також амінокислоти, які пізніше модифікуються, наприклад, гідроксипролін, γ- карбоксиглутамат, і О-фосфосерин. Амінокислотні аналоги належить до сполук, які мають ту ж основну хімічну структуру, що й природні амінокислоти, тобто α-вуглець, який зв'язаний з воднем, карбоксильною групою, аміногрупою та R-групою, наприклад, гомосерин, норлейцин, метіонін сульфоксид, метіонінметил сульфоній. Такі аналоги містять модифіковані R групи (наприклад, норлейцин) або модифікований пептидний каркас, але зберігають ту ж саму базову хімічну структуру, що й природні амінокислоти. Природно закодовані амінокислоти включають 20 відомих амінокислот (аланін, аргінін, аспарагін, аспарагінова кислота, цистеїн, глутамін, глутамінова кислота, гліцин, гістидин, ізолейцин, лейцин, лізин, метіонін, фенілаланін, пролін, серин, треонін, триптофан, тирозин і валін) і піролізин і селеноцистеїн. Термін "консервативно модифіковані варіанти" відноситься як до амінокислот, так і до нуклеїнових кислот. Що стосується конкретних послідовностей нуклеїнових кислот, консервативно модифіковані варіанти відносяться до тих нуклеїнових кислот, які кодують ідентичні або по суті ідентичні амінокислотні послідовності, або у випадку, коли нуклеїнова кислота не кодує амінокислотну послідовність, до по суті ідентичних послідовностей. Через виродженість генетичного коду, велика кількість функціонально ідентичних нуклеїнових кислот кодують будь-який білок. Наприклад, кодони GCA, GCC, GCG і GCU - всі кодують амінокислоту аланін. Таким чином, в кожному положенні, в якому аланін визначається кодоном, кодон може бути замінений на будь-який з відповідних описаних кодонів без зміни закодованого поліпептиду. Такі зміни нуклеїнових кислот являють собою "тихі варіації", які є одним з видів консервативно модифікуючих варіацій. Кожна послідовність нуклеїнових кислот, зазначена 2 UA 104031 C2 5 10 15 20 25 30 35 40 45 50 55 60 авторами, яка кодує поліпептид, також описує кожну можливу тиху варіацію нуклеїнової кислоти. Фахівець в даній галузі визначить, що кожен кодон в нуклеїновій кислоті (окрім AUG, який, зазвичай, є єдиним кодоном для метіоніну, і TGG, який, зазвичай, є єдиними кодоном триптофану) може бути модифікований для отримання функціонально ідентичної молекули. Відповідно, кожна тиха варіація нуклеїнової кислоти, яка кодує поліпептид, мається на увазі в кожній описаної послідовності. Що стосується амінокислотних послідовностей, фахівець в даній галузі визначить, що окремі заміни, делеції або доповнення до послідовності нуклеїнової кислоти, пептиду, поліпептиду або білка, які змінюють, додають або видаляють одну амінокислоту або невеликий відсоток амінокислот в закодованій послідовності, являють собою "консервативно модифікований варіант", де зміна призводить до заміни амінокислоти на хімічно подібну амінокислоту. Таблиці консервативних замін, що надають функціонально аналогічні амінокислоти, добре відомі в даній галузі. Такі консервативно модифіковані варіанти є доповненням і не виключають поліморфні варіанти, міжвидові гомологи, і алелі даного винаходу. Наступні вісім груп, кожна з яких містить амінокислоти, які є консервативними замінами одна для одної: 1) Аланін (А), гліцин (G), 2) Аспарагінова кислота (D), глутамінова кислота (Е), 3) Аспарагін (N), глютамін (Q), 4) Аргініну (R), лізин (K), 5) Ізолейцин (I), лейцин (L), метіонін (М), валін (V); 6) Фенілаланін (F), тирозин (Y), триптофан (W); 7) Серін (S), треонін (T), і 8) Цистеїн (С), метіонін (М) (див., наприклад, Creighton, Proteins (1984)). "Відсоток ідентичності послідовності" визначається шляхом порівняння двох оптимально вирівняних послідовностей у вікні порівнянні, в якому частина полінуклеотидної послідовності у вікні порівняння може містити доповнення або делеції (тобто, прогалини) в порівнянні з референтною послідовністю (наприклад, поліпептиду винаходу), яка не містить доповнень або делецій, для оптимального вирівнювання двох послідовностей. Відсоток розраховується шляхом визначення кількості положень, в яких ідентична основа нуклеїнової кислоти або амінокислотний залишок зустрічається в обох послідовностях для отримання кількості збіглих положень, шляхом поділу кількості збіглих положень на загальну кількість положень у вікні порівняння і множення результату на 100 для отримання відсотку ідентичності послідовності. Терміни "ідентичний" або відсоток "ідентичності", в контексті двох або більше нуклеїнових кислот або поліпептидних послідовностей, відносяться до двох або більше послідовностей або підпослідовностей, що є одними й тими ж послідовностями. Дві послідовності "практично однакові", якщо дві послідовності мають певний відсоток залишків амінокислот або нуклеотидів, що є однаковими (тобто, 60 % ідентичності, необов'язково 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, або 95 % ідентичності упродовж певної ділянки, або, якщо не вказано, упродовж всієї послідовності), при порівнянні і вирівнюванні для максимальної відповідності у вікні порівняння, чи визначеній ділянці, що вимірюється за допомогою одного з таких алгоритмів порівняння послідовності або ручним вирівнюванням та візуальним оглядом. Винахід забезпечує поліпептиди, які по суті ідентичні поліпептидам, відповідно, що наводять авторами у якості прикладів (наприклад, будь-яка з SEQ ID NO: 1-28), а також їх використання, у тому числі, але не обмежуючись, використання для лікування або профілактики артриту або суглоба. При бажанні, ідентичність існує в ділянці, довжина якої, принаймні, приблизно 50 нуклеотидів, або, більш бажано в ділянці, довжина якої становить від 100 до 500 або 1000 або більше нуклеотидів, або всю довжину референтної послідовності. При порівнянні послідовностей, як правило, одна послідовність діє у якості референтної послідовності, з якою порівнюються тестові послідовності. При використанні алгоритму порівняння послідовностей, тестові та референтні послідовності вводяться в комп'ютер, позначаються координати підпослідовності, при необхідності, і позначають параметри програми алгоритму послідовності. Можуть бути використані параметри програми за замовчуванням, або можуть бути призначені альтернативні параметри. Алгоритм порівняння послідовностей потім обчислює відсоток ідентичності послідовності тестових послідовностей щодо референтної послідовності, на основі параметрів програми. Термін "вікно порівняння", що використовується авторами, включає в себе посилання на сегмент будь-якої кількості суміжних положень, що вибираються з групи, яка складається з від 20 до 600, як правило, від приблизно 50 до приблизно 200, більш переважно приблизно від 100 до приблизно 150, в якому послідовність, можна порівняти з референтною послідовністю 3 UA 104031 C2 5 10 15 20 25 30 35 40 45 50 55 однакової кількості суміжних положень після оптимального вирівнювання двох послідовностей. Методи вирівнювання послідовностей для порівняння добре відомі в даній галузі. Оптимальне вирівнювання послідовностей для порівняння можна проводити, наприклад, за допомогою локального алгоритму гомології Smith and Waterman (1970) Adv. Appl. Math. 2:482c, за допомогою алгоритму вирівнювання гомології Needleman and Wunsch (1970) J. Mol. Biol. 48:443, шляхом пошуку методу подібності Pearson and Lipman (1988) Proc. Nat'l. Acad. Sci. USA 85:2444, шляхом комп'ютеризованої реалізації цих алгоритмів (GAP, BESTFIT, FASTA і TFASTA у Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI), або шляхом ручного вирівнювання і візуальної перевірки (див., наприклад, Ausubel et al., Current Protocols in Molecular Biology (доповнення 1995 р.)). Два приклади алгоритмів, які підходять для визначення відсотка ідентичності послідовність і подібності послідовність - алгоритми BLAST і BLAST 2,0, які описані в Altschul et al. (1977) Nuc. Acids Res. 25:3389-3402, and Altschul et al. (1990) J. Mol. Biol. 215:403-410, відповідно. Програмне забезпечення для проведення аналізів BLAST наявне через Національний центр біотехнологічної інформації. Цей алгоритм передбачає в першу чергу виявлення пар послідовність з високим балом (HSPs) шляхом виявлення коротких слів довжини W у послідовності запиту, які або відповідають або задовольняють деякий позитивний Т-значний поріг, при вирівнюванні зі словом тієї ж довжини в базi даних послідовностей. T називається порогом оцінки сусіднього слова (Altschul і співавт. Вище). Ці початкові сусідні слова виступають в якості насіння для початку пошуків, щоб знайти більше HSPs, що їх містять. Потрапляння слів поширюються в обох напрямках по кожній послідовності до тих пір, поки може бути збільшена кумулятивна оцінка вирівнювання. Сукупні оцінки розраховуються з використанням, для нуклеотидних послідовностей, параметрів M (висока оцінка для пари відповідних залишків; завжди> 0) і N (штрафна оцінка для невідповідних залишків, завжди
ДивитисяДодаткова інформація
Назва патенту англійськоюMesenchymal stem cell differentiation
Автори англійськоюJohnson, Kristen, Jennings, Lori, Schultz, Peter
Автори російськоюДжонсон Кристен, Дженнингс Лори, Шульц Питер
МПК / Мітки
МПК: C12N 5/00, A61K 38/18, A61K 38/00, A61P 19/00, C12N 5/02
Мітки: диференціація, стовбурових, клітин, мезенхімальних
Код посилання
<a href="https://ua.patents.su/30-104031-diferenciaciya-mezenkhimalnikh-stovburovikh-klitin.html" target="_blank" rel="follow" title="База патентів України">Диференціація мезенхімальних стовбурових клітин</a>
Попередній патент: Керамічний пігмент сірий
Наступний патент: Сумісні з культурними рослинами гербіцидні композиції, що містять гербіциди і сафенери
Випадковий патент: Спосіб діагностики розвитку остеопорозу