Фармацевтична композиція пролонгованого вивільнення морфолінію [(5-метил-1н-1,2,4-триазол-3-іл)тіо]ацетату
Номер патенту: 111566
Опубліковано: 10.05.2016
Автори: Глуменко Олена Миколаївна, Кравчук Жанна Миколаївна, Шведський Сергій Олегович, Сапсай Ірина Віталіївна
Формула / Реферат
1. Фармацевтична композиція пролонгованого вивільнення, що містить активний інгредієнт та щонайменше один полімерний матрицеутворюючий агент, вибраний з поліетиленоксиду з молекулярною вагою в діапазоні від 100000 до 10000000 дальтон та гідроксипропілметилцелюлоз з номінальною в'язкістю в діапазоні від 3 до 100000 mPa·s, в комбінації з однією або більше фармацевтично прийнятними допоміжними речовинами, яка відрізняється тим, що активний інгредієнт представлений морфолінієвою сіллю тіазотної кислоти з розміром частинок не більше 500 мкм, а активний інгредієнт та матрицеутворюючий полімер містяться у співвідношенні 1:0,2-1,9.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що активний інгредієнт та матрицеутворюючий полімер містяться у співвідношенні 1:0,4-1,6.
3. Фармацевтична композиція за пп. 1-2, яка відрізняється тим, що містить морфолінієву сіль тіазотної кислоти з розміром частинок не більше 100 мкм.
4. Фармацевтична композиція за будь-яким з пп. 1-3, яка відрізняється тим, що містить:
і) 30-60 % за вагою морфолінієвої солі тіазотної кислоти;
іі) 15-65 % за вагою щонайменше одного матрицеутворюючого полімеру, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз;
ііі) 0,25-5 % за вагою змащувальних агентів або лубрикантів;
iv) 0,1-1 % за вагою агентів, що покращують текучість, або глідантів;
v) 2-15 % за вагою додаткових наповнювачів відносно загальної ваги композиції.
5. Фармацевтична композиція за будь-яким з пп. 1-4, яка відрізняється тим, що містить:
і) 40-50 % за вагою морфолінієвої солі тіазотної кислоти;
іі) 30-60 % за вагою щонайменше одного матрицеутворюючого полімеру, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз;
ііі) 0,25-2 % за вагою змащувальних агентів або лубрикантів;
iv) 0,1-0,5 % за вагою агентів, що покращують текучість, або глідантів;
v) 2-5 % за вагою додаткових наповнювачів відносно загальної ваги композиції.
6. Фармацевтична композиція за будь-яким з пп. 1-5, яка відрізняється тим, що містить:
і) 46,34 % за вагою морфолінієвої солі тіазотної кислоти;
іі) 50 % за вагою поліетиленоксиду;
ііі) 0,5 % за вагою магнію стеарату;
iv) 0,2 % за вагою кремнію діоксиду колоїдного безводного;
v) 2,96 % за вагою целюлози мікрокристалічної відносно загальної ваги композиції.
7. Фармацевтична композиція за будь-яким з пп. 1-6, яка відрізняється тим, що додатково містить суміш для плівкового покриття.
8. Фармацевтична композиція за будь-яким з пп. 1-7, яка відрізняється тим, що представлена у формі таблеток чи таблеток з плівковим покриттям.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що кожна таблетка містить від 340 мг до 420 мг морфолінієвої солі тіазотної кислоти, більш переважно від 370 мг до 390 мг.
10. Фармацевтична композиція за будь-яким з пп. 8-9, яка відрізняється тим, що кожна таблетка має вагу в діапазоні від 760 мг до 930 мг, більш переважно від 835 мг до 855 мг.
11. Фармацевтична композиція за будь-яким з пп. 8-10, яка відрізняється тим, що стираність таблеток-ядер (без оболонки) складає не більше 1 %, переважно не більше 0,1 %, ще більш переважно не більше 0,05 %.
12. Фармацевтична композиція за будь-яким з пп. 8-11, яка відрізняється тим, що стійкість до роздавлювання таблеток-ядер (без оболонки) знаходиться в діапазоні від 200 до 320 ньютонів, більш переважно від 230 до 295 ньютонів.
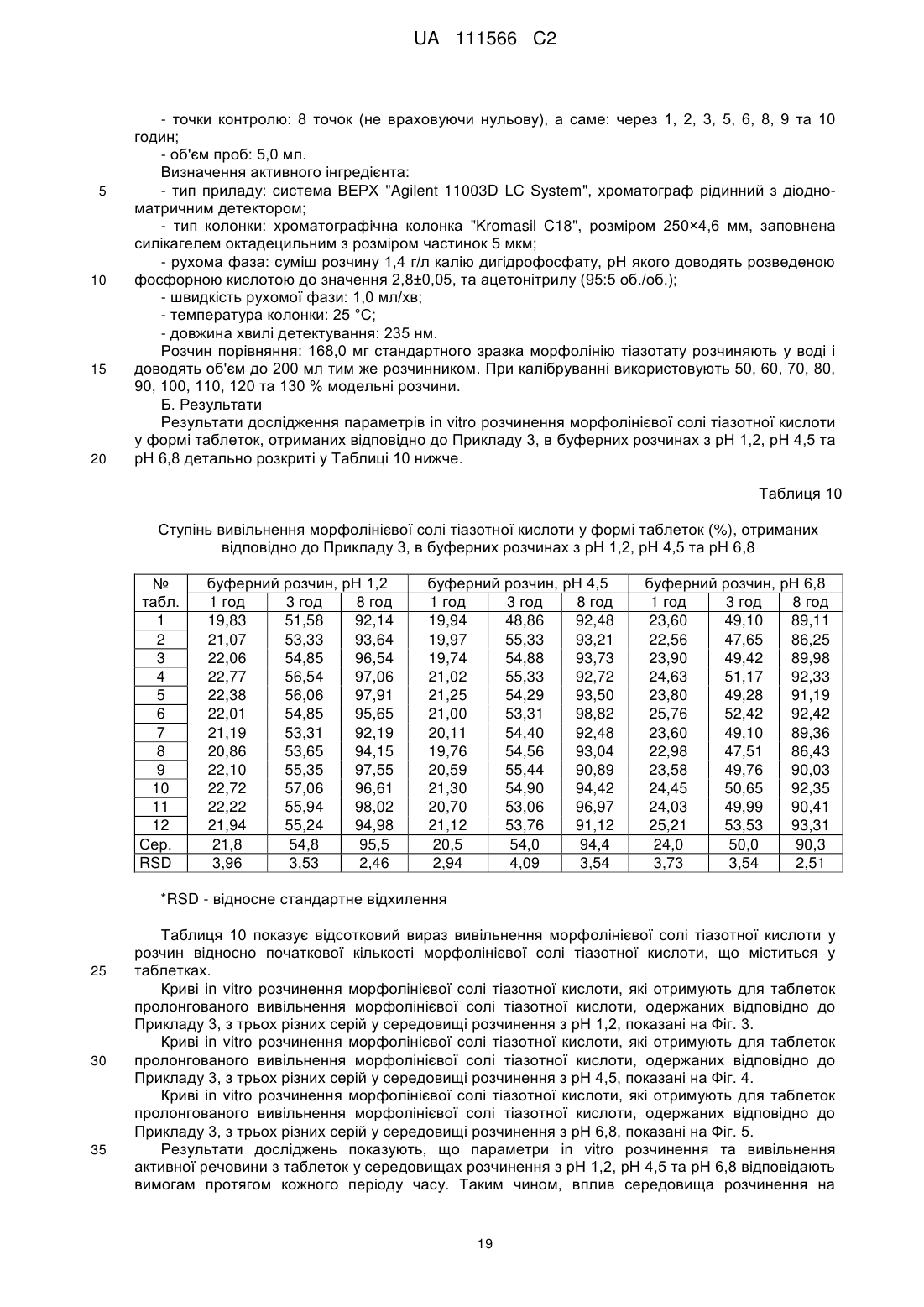
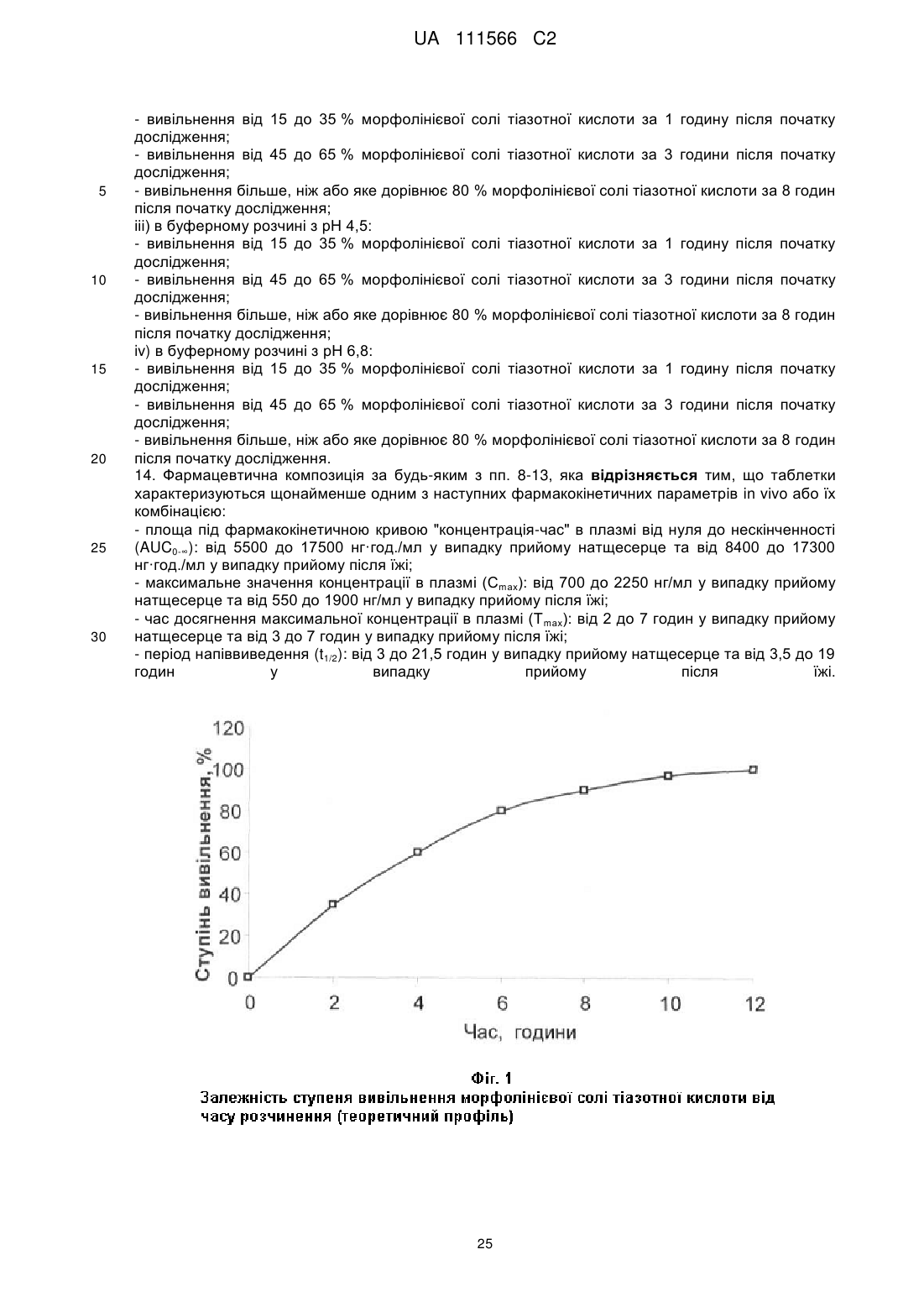
13. Фармацевтична композиція за будь-яким з пп. 8-12, яка відрізняється тим, що таблетки мають наступні параметри in vitro розчинення морфолінієвої солі тіазотної кислоти:
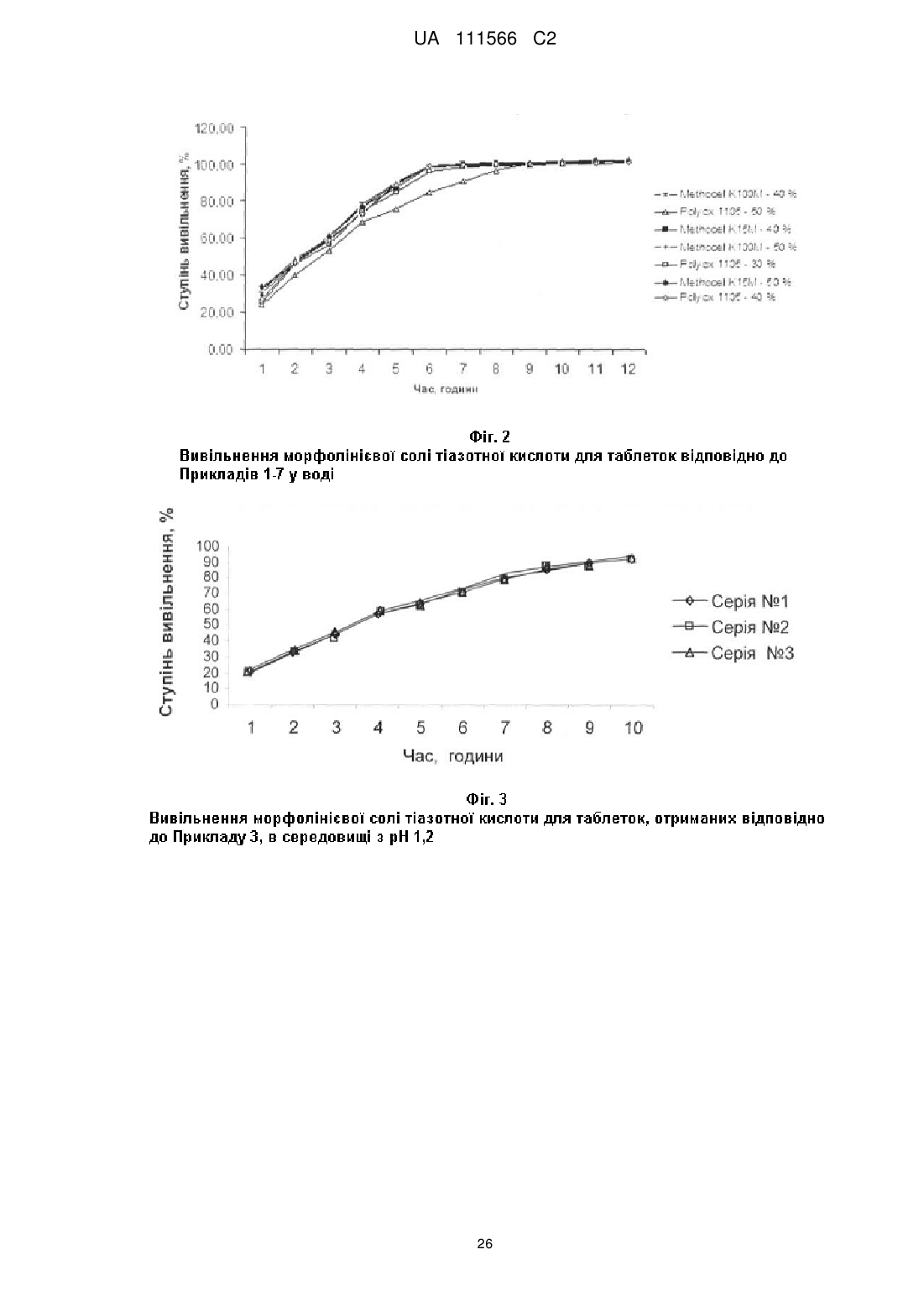
і) у воді:
- вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження;
- вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження;
- вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження;
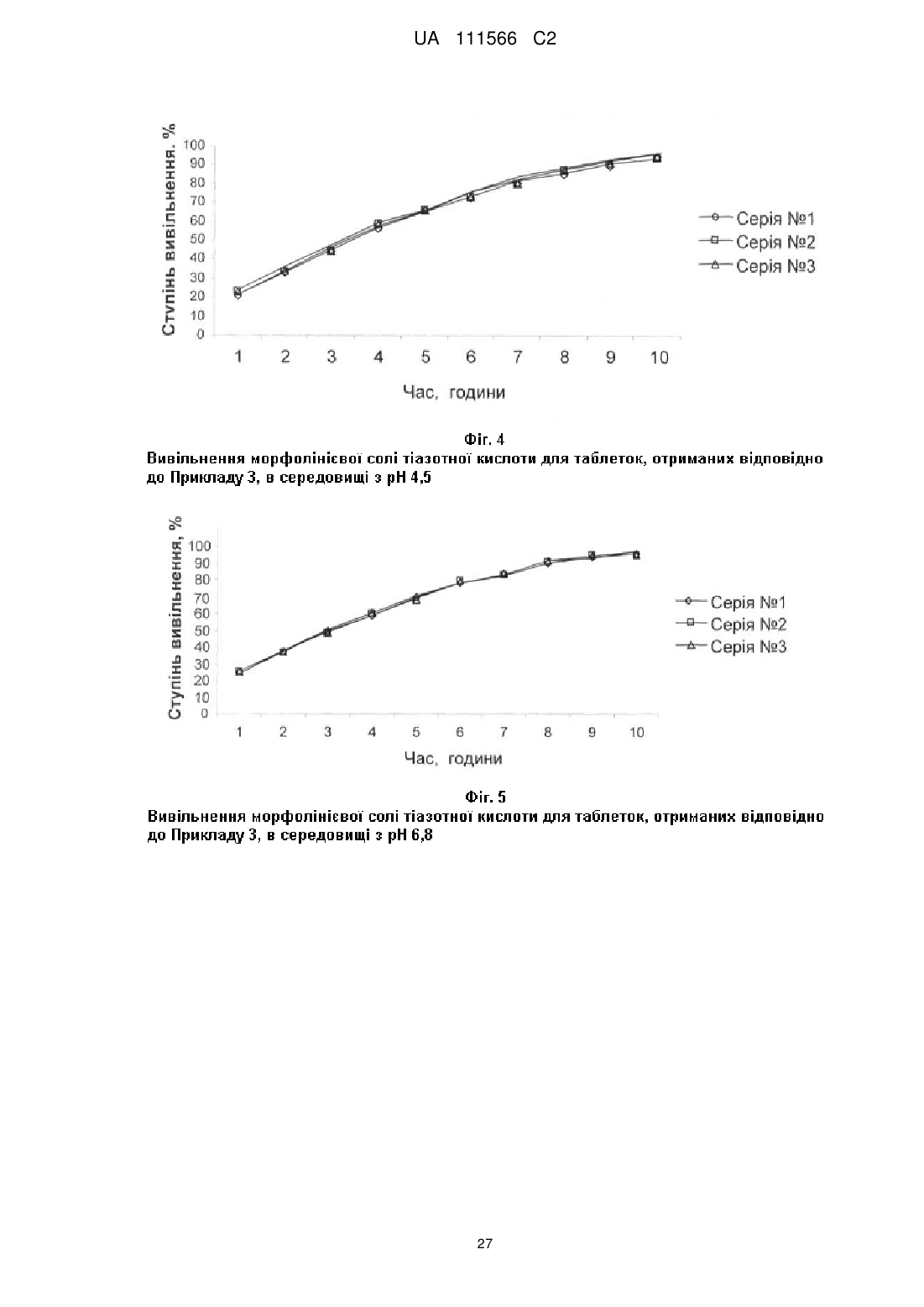
іі) в буферному розчині з рН 1,2:
- вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження;
- вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження;
- вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження;
ііі) в буферному розчині з рН 4,5:
- вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження;
- вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження;
- вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження;
iv) в буферному розчині з рН 6,8:
- вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження;
- вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження;
- вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження.
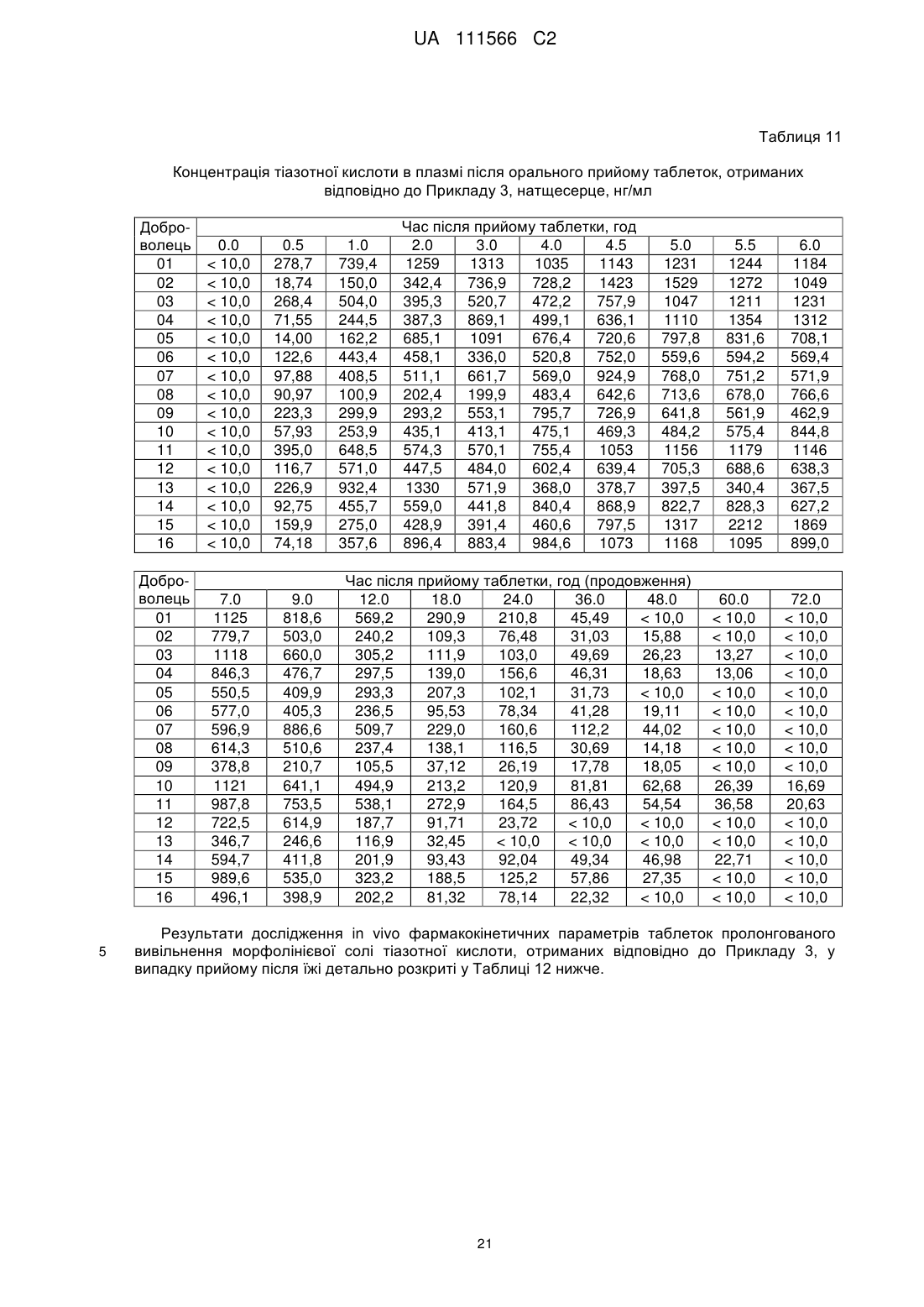
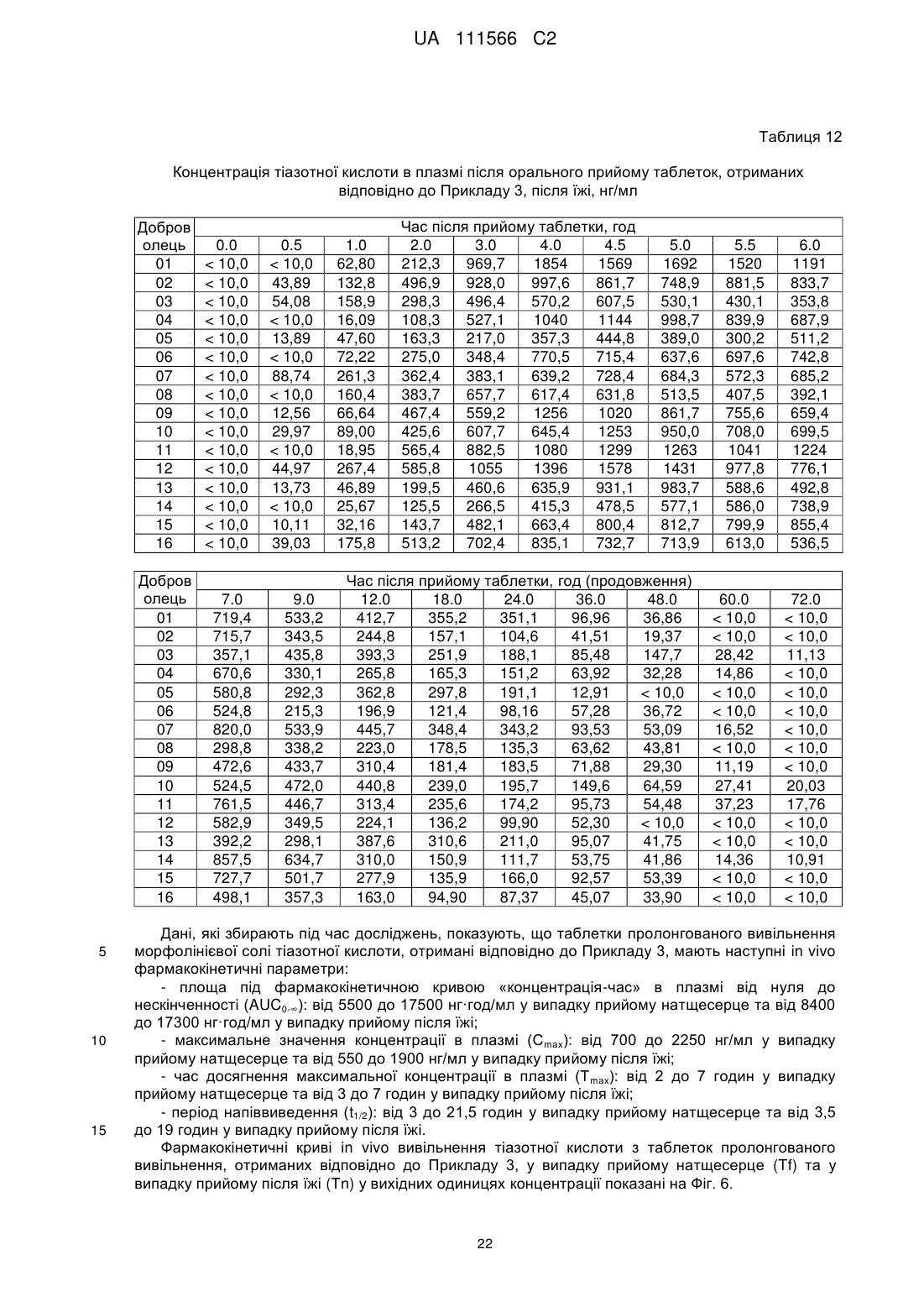
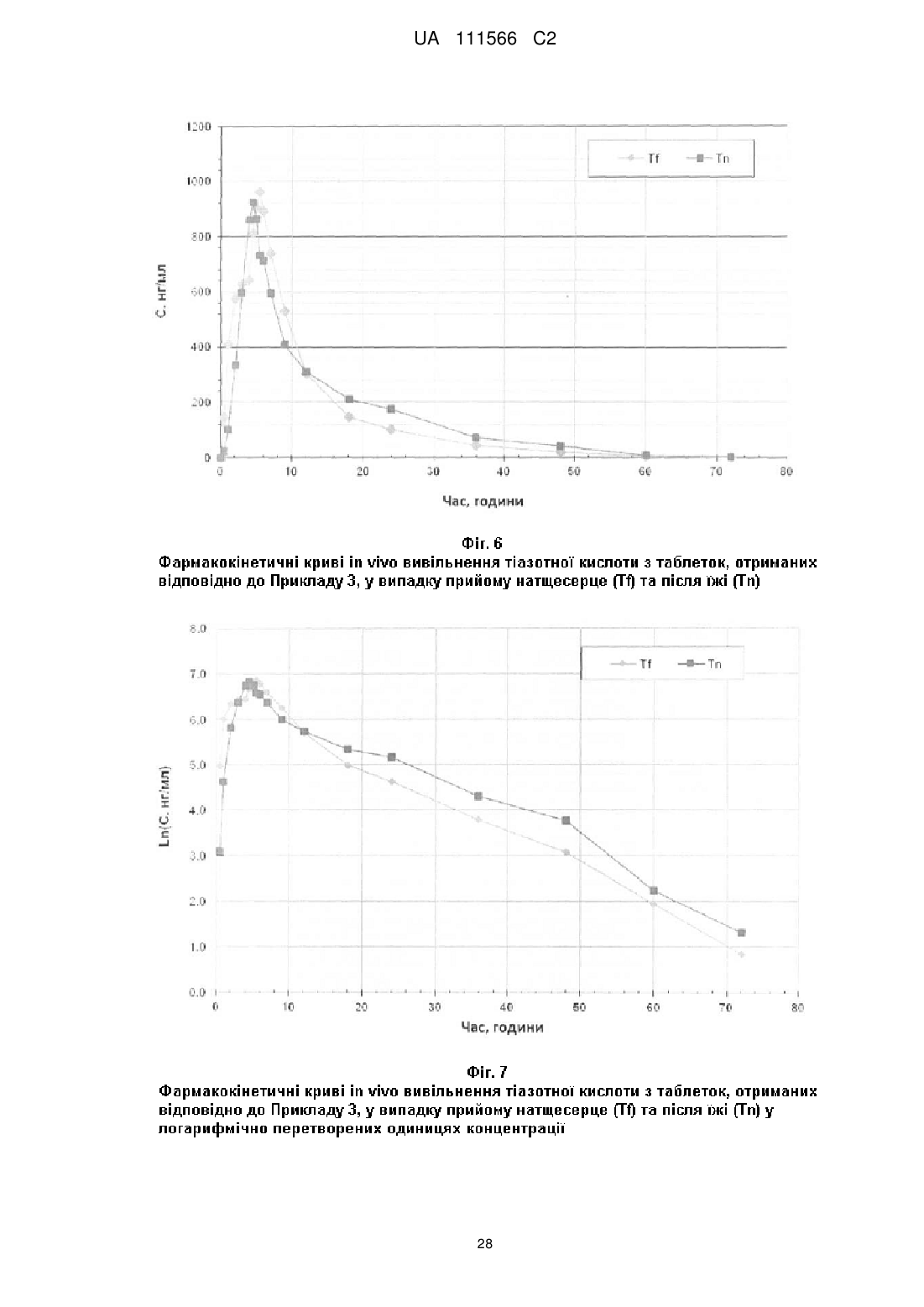
14. Фармацевтична композиція за будь-яким з пп. 8-13, яка відрізняється тим, що таблетки характеризуються щонайменше одним з наступних фармакокінетичних параметрів in vivo або їх комбінацією:
- площа під фармакокінетичною кривою "концентрація-час" в плазмі від нуля до нескінченності (AUC0-∞): від 5500 до 17500 нг·год./мл у випадку прийому натщесерце та від 8400 до 17300 нг·год./мл у випадку прийому після їжі;
- максимальне значення концентрації в плазмі (Сmах): від 700 до 2250 нг/мл у випадку прийому натщесерце та від 550 до 1900 нг/мл у випадку прийому після їжі;
- час досягнення максимальної концентрації в плазмі (Тmах): від 2 до 7 годин у випадку прийому натщесерце та від 3 до 7 годин у випадку прийому після їжі;
- період напіввиведення (t1/2): від 3 до 21,5 годин у випадку прийому натщесерце та від 3,5 до 19 годин у випадку прийому після їжі.
Текст
Реферат: Винахід стосується фармацевтичної композиції пролонгованого вивільнення, що містить активний інгредієнт та щонайменше один полімерний матрицеутворюючий агент, вибраний з поліетиленоксиду з молекулярною вагою в діапазоні від 100000 до 10000000 дальтон та гідроксипропілметилцелюлоз з номінальною в'язкістю в діапазоні від 3 до 100000 mPa·s, в комбінації з однією або більше фармацевтично прийнятними допоміжними речовинами, причому активний інгредієнт представлений морфолінієвою сіллю тіазотної кислоти з розміром частинок не більше 500 мкм, а активний інгредієнт та матрицеутворюючий полімер містяться у співвідношенні 1:0,2-1,9. UA 111566 C2 (12) UA 111566 C2 UA 111566 C2 5 Винахід належить до фармацевтичних композицій пролонгованого вивільнення активного інгредієнта морфолінію [(5-метил-1Н-1,2,4-триазол-3-іл)тіо)]ацетату (морфолінієвої солі тіазотної кислоти) та може бути використаний як проти ішемічний засіб. Активний інгредієнт морфолінію [(5-метил-1Н-1,2,4-триазол-3-іл)тіо)]ацетат (морфолінієва сіль тіазотної кислоти, морфолінію тіазотат) є похідним 1,2,4-триазолів та має наступну формулу: HN +H N 2 10 15 20 25 30 35 40 45 50 55 O H3C N N S COO . Способи отримання морфолінієвої солі тіазотної кислоти описані в патентах України UА 57476, UA 100355 та UA 102809. Морфолінієва сіль тіазотної кислоти є представником групи засобів, що впливають на серцево-судинну систему. Фармакологічний ефект морфолінієвої солі тіазотної кислоти зумовлений протиішемічною, мембраностабілізуючою, антиоксидантною та імуностимулюючою дією. Вплив препарату реалізується за рахунок посилення компенсаторної активації анаеробного гліколізу і активації процесів окислення в циклі Кребса зі збереженням резервів АТФ. Наявність в структурі молекули морфолінієвої солі тіазотної кислоти тіольної групи, якій притаманні окислювально-відновні властивості, та третинного азоту, який зв'язує надлишок іонів водню, зумовлює активацію антиоксидантної системи. Сильні відновлювальні властивості тіольної групи викликають реакцію з активними формами кисню та ліпідними радикалами. Реактивація антирадикальних ферментів - супероксиддисмутази, каталази та глутатіонпероксидази запобігає ініціації активних форм кисню. Дія морфолінієвої солі тіазотної кислоти викликає гальмування процесів окиснення ліпідів в ішемізованих ділянках міокарда, зменшення чутливості міокарда до катехоламінів, запобігає прогресивному пригніченню скоротливої функції серця, стабілізацію та зменшення відповідно зон некрозу та ішемії міокарда. Поліпшення реологічних властивостей крові відбувається за рахунок активації фібринолітичної системи. Поліпшення процесів метаболізму міокарда, підвищення його скоротливої здатності, сприяння нормалізації серцевого ритму дозволяють рекомендувати препарати морфолінієвої солі тіазотної кислоти для лікування пацієнтів з різноманітними формами ішемічної хвороби серця. Паралельно з використанням препарату в кардіології, через високі гепатопротекторні властивості морфолінієву сіль тіазотної кислоти призначають для лікування захворювань печінки та інших внутрішніх органів. Препарат запобігає руйнуванню гепатоцитів, понижує ступінь жирової інфільтрації та поширення центролобулярних некрозів печінки, сприяє процесам репаративної регенерації гепатоцитів, нормалізує в них білковий, вуглеводневий, ліпідний та пігментний обміни. Збільшує швидкість синтезу та виділення жовчі, нормалізує її хімічний склад. Лікарські засоби, що містять морфолінієву сіль тіазотної кислоти як активний фармацевтичний інгредієнт, випускаються у формі таблеток негайного вивільнення, у формі розчину для ін'єкцій, крапель та мазей. У вітчизняній лікарській практиці використовується лікарський засіб негайного вивільнення ® ТІОТРИАЗОЛІН , таблетки по 200 мг № 10 в блістері, виробництва ПАТ «Київмедпрепарат» (Україна) [Реєстраційне посвідчення UA/5819/01/01, з 15.12.2011 по 15.12.2016; Наказ МОЗ № 528 від 29.07.2014]. Відповідно до інструкції для медичного застосування лікарського засобу ® ТІОТРИАЗОЛІН , таблетки по 200 мг, при стенокардії напруги і спокою, інфаркті міокарда, постінфарктному кардіосклерозі лікарський засіб слід приймати по 100-200 мг 3-4 рази на добу протягом 20-30 днів. Після прийому орально препарат швидко всмоктується, максимальна концентрація в плазмі крові спостерігається через 1,6 години після однократного прийому дози 200 мг. Період напіввиведення складає 7,86 годин, абсолютна біодоступність - 53 %. Із подібними фармакокінетичними характеристиками лікарського засобу із негайнимвивільненням діючої речовини не вдається досягти протиішемічного ефекту в передранкові та ранкові години, що є вкрай важливим для цільової групи пацієнтів, оскільки такі патологічні стани як стенокардія та інфаркт міокарда характеризуються циркадністю (ризик зростає у ранні вранішні години) [Willich S.N. et al., 2004; Комаров Ф.И., Рапорт С.И., 2000]. Тому у попередньому рівні техніки існує потреба у нових фармацевтичних композиціях морфолінієвої солі тіазотної кислоти, які забезпечували б протиішемічну дію в передранкові та ранкові години з метою медикаментозного захисту цільової групи пацієнтів і поліпшення 1 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 60 комплаєнтності існуючої лікарської форми (зменшення кратності прийому), що може бути досягнуто за рахунок пролонгованого вивільнення діючої речовини із лікарської форми. Оскільки відомості про композиції з пролонгованим вивільненням морфолінієвої солі тіазотної кислоти заявнику невідомі, аналогами запропонованого рішення є композиції пролонгованого вивільнення подібних протиішемічних препаратів. Традиційно для лікування ішемічної хвороби серця застосовують антиангінальні засоби, наприклад нітрати, бета-адреноблокатори, антагоністи кальцію, блокатори ангіотензинперетворюючого ферменту, блокатори рецептора ангіотензину, інгібітори вазопептидаз та інші. Ці препарати підтримують гемодинамічні параметри серця, проте не здатні вплинути на ефективність використання кисню серцевим м'язом. Тому перспективним є інший напрямок терапії, направлений на біохімічний захист клітин міокарда від наслідків ішемії шляхом цілеспрямованого впливу на окремі ланки метаболічного ланцюга. У клінічній практиці застосовується кілька препаратів цієї групи, найбільш поширеними серед яких є триметазидин, мексидол, мельдоній, екзогенний фосфокреатин та морфолінієва сіль тіазотної кислоти. З рівня техніки відомі композиції пролонгованого вивільнення мексидолу [ЕР 2241310 А2, UA 96137, RU 2519723], триметазидину [ЕР 1108424 , GE U20121704 (аналог UA 66235 U), UA 71064 U, UA 92170, UA 94980, UA 52043 U] та мельдонію [UA 98018]. Найбільш близькою до субстанції морфолінієвої солі тіазотної кислоти за механізмом дії та розчинністю є субстанція мексидолу. Мексидол є інгібітором вільнорадикальних процесів, має антиоксидантні властивості та добре виражену антигіпоксичну дію, тобто посилює стійкість тканин до нестачі кисню. Вплив мексидолу реалізується за рахунок посилення компенсаторної активації анаеробного гліколізу, зменшення пригнічення окислювальних процесів в циклі Кребса в умовах гіпоксії, збільшує вміст АТФ та креатинфосфату, активує енергосинтезуючу функцію мітохондрій. Мексидол інгібує перекисне окисне ліпідів, модулює активність мембраноасоційованих ферментів (кальційнезалежної фосфодіестерази, аденілатциклази, ацетилхолінестерази), рецепторних комплексів (бензодіазепінового, гамма-аміномасляного, ацетилхолінового), посилюючи їх здатність зв'язування з лігандами, покращує транспорт медіаторів та синаптичну передачу. З рівня техніки відомо кілька композицій пролонгованого вивільнення мексидолу. На практиці виявилося важко виготовити таблетку, яка має придатне сполучення пролонгованого вивільнення та зручності і економічності отримання, у якій міститься лікарський засіб, що має високу розчинність [Khan M.Z.I., 1995], як у випадку морфолінієвої солі тіазотної кислоти та мексидолу. Це пов'язано з тим, що прості матричні полімери не здатні надовго затримати вивільнення високорозчинних субстанцій внаслідок їх швидкого вимивання з матриці. Висока розчинність активного фармацевтичного інгредієнта у воді призводить до вибухоподібного вивільнення значної кількості лікарського засобу за короткий період часу при контакті з середовищем до того, як встановиться бажана швидкість вивільнення [Maderuelo С., Zarzuelo Α., Lanao J.M., 2011; Huang X., Brazel C.S., 2001]. Складність отримання форм пролонгованого вивільнення на основі монолітних матричних систем для високорозчинних субстанцій зумовлена вибухоподібним ефектом на початку вивільнення, відсутністю контролю координації у часі процесів релаксації полімеру та розчинення і дифузії лікарського засобу, складністю досягнення компенсації зростання дифузійного шляху [Pillay V., Fassini R., 2000]. Окрім того, відмічаються технологічні труднощі при виробництві пролонгованих форм для високорозчинних діючих речовин [Follonier N., Doelker E., Cole Ε.Τ., 1994], пов'язані з високим рівнем пористості матричних лікарських форм, отриманих методом прямого пресування [Maderuelo С., Zarzuelo Α., Lanao J.M., 2011; Huang X., Brazel C.S., 2001]. Наприклад, показано, що на профіль вивільнення високорозчинних субстанцій з матричних пролонгованих форм впливає, окрім інших параметрів, також і швидкість пресування [Nokhodchi Α., Ford J.L., Rowe P.H., Rubinstein Μ.Η., 1996]. Тому найчастіше отримання форм пролонгованого вивільнення високорозчинних субстанцій вимагає розробки складних фармацевтичних композицій або застосування багатостадійних затратних методів виробництва готових лікарських форм. У публікації UA 96137 описана фармацевтична композиція пролонгованого вивільнення мексидолу, що являє собою пероральну множинну дозовану форму, одиниця дози якої містить мексидол у кількості 30,0-70,0 мас. %, похідні целюлози та поліакрилові смоли як модифікатор вивільнення у кількості 1,0-20,0 мас. %, мікрокристалічну целюлозу як наповнювач у кількості 20,0-50,0 мас. % та ковзкі речовини. Дозована форма виповнена у формі таблетки або капсули, яка містить множинну кількість маленьких щільних сфероїдів без оболонки та з оболонкою для досягнення швидкої дії та для підтримки терапевтично активної концентрації у плазмі протягом принаймні 12 годин. Перша група сфероїдів (швидкорозчинні) містить мексидол, мікрокристалічну целюлозу, аеросил, стеарат магнію, гідроксипропілцелюлозу. Склад сфероїдів 2 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 підібраний так, що мексидол повністю вивільняється протягом 0,5-2 год. У другій групі сфероїд має ядро, яке містить мексидол та допоміжні речовини, та полімерну оболонку, складену з рНчутливих та/або рН-незалежних полімерів, та етилцелюлозу. Полімерна оболонка може містити пластифікатори, наповнювачі, пігменти та водорозчинні полімерні матеріали, які будуть регулювати вивільнення мексидолу протягом 8-12 годин. Третя група сфероїдів являє собою матричний сфероїд, що містить мексидол, полімерну матрицю та допоміжні речовини, за необхідності покритий полімерною оболонкою. Вивільнення мексидолу з третьої групи сфероїдів відбувається рівномірно за 5-14 годин. Сфероїди отримують шляхом сферонізації вологого екструдату, що містить мексидол та допоміжні речовини, з подальшим висушуванням та покриттям відповідним типом оболонки. Для кожної групи сфероїдів визначають профіль розчинення та розраховують необхідне співвідношення сфероїдів у капсулі або таблетці для досягнення необхідного профілю розчинення готової лікарської форми. Недоліком даної композиції є складність отримання лікарської форми та потреба у специфічному обладнанні, яке в промисловості використовується рідко. Найближчою до композиції, що заявляється, є фармацевтична композиція пролонгованого вивільнення мексидолу, описана у заявці на патент ЕР 2241310 А2. Композиція містить мексидол (емоксипін) та модифікатор вивільнення, вибраний з групи, що включає гідроксипропілметилцелюлозу, низькозаміщену гідроксипропілцелюлозу, етилцелюлозу, метилцелюлозу, ацетобутират целюлози, поліетиленоксид, гліцерил бегенат, кополімер вінілацетату та кротонової кислоти, кополімер малеїнового ангідриду та метилвінілестеру, кополімер ефірів акрилової та метакрилової кислот, шелак, воски, зеїн, солі альгінатів та комплексні солі альгінової кислоти. Композицію отримують методом вологої грануляції. Недоліком даного рішення є складність підбору модифікаторів вивільнення та інших допоміжних речовин для отримання придатної композиції, а також готового лікарського засобу на їх основі, та відсутність практичних рекомендацій в матеріалах заявки щодо забезпечення необхідного профілю вивільнення активного фармацевтичного інгредієнта для композицій на основі різних типів полімерів. Незважаючи на широкий спектр полімерів, перерахованих у формулі, матеріали заявки містять приклади отримання лікарських форм лише на основі трьох полімерів гідроксипропілметилцелюлози, етилцелюлози та натрію альгінату. Очевидно, що використання полімеру іншого типу може вимагати корекції його відсоткового вмісту та підбору параметрів отримання таблетки, а матеріали заявки не містять жодних відомостей про вплив якісного та кількісного складу компонентів композиції на профіль вивільнення активної речовини. Окрім того, запропонований в заявці спосіб отримання готового лікарського засобу не є оптимальним з точки зору простоти та економічності. В основу винаходу поставлено задачу створення нових фармацевтичних композицій пролонгованого вивільнення активного інгредієнта морфолінію [(5-метил-1Н-1,2,4-триазол-3іл)тіо)]ацетату (морфолінієвої солі тіазотної кислоти) шляхом підбору складу компонентів, які забезпечують отримання твердої лікарської форми з прийнятними фармакотехнологічними характеристиками простим та недорогим способом сухого пресування. Несподівано було виявлено, що тверді лікарські форми пролонгованого вивільнення морфолінієвої солі тіазотної кислоти з прийнятними фармакотехнологічними характеристиками, включаючи in vitro параметри вивільнення активного інгредієнта та in vivo фармакокінетичні параметри, можуть бути отримані простим способом сухого пресування суміші активного інгредієнта та ексципієнтів, не вимагаючи стадії грануляції, сухої чи мокрої, і стадії екструзії, або, альтернативно, інжекції під тиском, у випадку використання як матриць поліетиленоксиду або гідроксипропілметилцелюлоз. Можливість отримання твердих лікарських форм пролонгованого вивільнення морфолінієвої солі тіазотної кислоти способом сухого пресування досягається за рахунок підбору оптимального поєднання діючої речовини та матричної системи пролонгованого вивільнення. Даний винахід стосується твердої фармацевтичної композиції пролонгованого вивільнення, яка містить активний інгредієнт морфолінію [(5-метил-1Н-1,2,4-триазол-3-іл)тіо)]ацетат (морфолінієву сіль тіазотної кислоти) в поєднанні з щонайменше одним матрицеутворюючим агентом (полімером), вибраним з поліетиленоксиду та гідроксипропілметилцелюлоз, в комбінації з однією або більше фармацевтично прийнятними допоміжними речовинами. Відповідно до даного винаходу, було показано, що комбінація морфолінієвої солі тіазотної кислоти з щонайменше одним матрицеутворюючим агентом (полімером), вибраним з поліетиленоксиду та гідроксипропілметилцелюлоз, однією або більше фармацевтично прийнятними допоміжними речовинами робить можливим одержання твердої фармацевтичної композиції з прийнятними фармакотехнологічними характеристиками, включаючи in vitro 3 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 параметри вивільнення активного інгредієнта та in vivo фармакокінетичні параметри, методом прямого пресування. Тверда фармацевтична композиція відповідно до даного винаходу належить до монолітних (матричних) систем. Основу монолітної системи складає гідрофільна матриця, здатна до набухання та біодеградації, в даному випадку представлена щонайменше одним матрицеутворюючим агентом - поліетиленоксидом або гідроксипропілметилцелюлозою. Поліетиленоксид - це неіонний гомополімерний етиленоксид з молекулярною вагою переважно в діапазоні 100000-10000000 дальтон (Да), що використовується в фармацевтичній технології як зв'язуюча речовина при виробництві таблеток. Поліетиленоксид з високою молекулярною вагою уповільнює вивільнення діючих речовин та використовується в якості гідрофільної матриці для препаратів з проміжним та пролонгованим вивільненням діючої речовини. Основними показниками, що впливають на здатність поліетиленоксиду уповільнювати вивільнення лікарської речовини, є молекулярна вага та здатність до набухання. Гідроксипропілметилцелюлоза - це частково О-метил-заміщена та О-(2-гідроксипропіл)заміщена целюлоза. Кілька грейдів гідроксипропілметилцелюлоз мають здатність затримувати вивільнення діючої речовини, а тому використовуються в фармацевтичній технології в якості матриць для забезпечення пролонгованого вивільнення. Основними показниками, що впливають на здатність гідроксипропілметилцелюлоз уповільнювати вивільнення лікарської речовини, є в'язкість та ступінь заміщення целюлози ефірами. Таблетка лікарського засобу модифікованого вивільнення на основі гідрофільної матриці при потраплянні до верхнього відділу травного тракту поглинає воду, практично повністю перетворюючись в гель. Вивільнення діючої речовини з матриці відбувається за рахунок дифузії активної речовини через шар гелю та за рахунок поступового розчинення гелю. Таблетка просувається до нижньої частини травного тракту, її поверхня починає піддаватись ерозії, що супроводжується поступовим вивільненням діючої речовини. В результаті досягається пролонговане вивільнення. Було показано, що для виготовлення твердих фармацевтичних композицій відповідно до даного винаходу, які мають хороші характеристики щодо пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, оптимальні результати були одержані при використанні щонайменше одного поліетиленоксиду, який має молекулярну вагу від 100000 до 10000000 Да, більш переважно від 500000 до 10000000 Да, або щонайменше однієї гідроксипропілметилцелюлози, що має номінальну в'язкість в діапазоні від 3 до 100000 mPa·s. З метою прикладу можуть бути використані поліетиленоксиди, які мають молекулярну вагу від 700000 до 1100000 Да, наприклад близько 900000 Да, та гідроксипропілметилцелюлози, які мають номінальну в'язкість від 15000 до 100000 mPa·s, наприклад, близько 17700 mPa·s чи 100000 mPa·s. Тверда фармацевтична композиція відповідно до даного винаходу містить морфолінію тіазотат та щонайменше один матрицеутворюючий полімер, вибраний з поліетиленоксиду та гідроксипропілметилцелюлоз, у співвідношенні 1:0,2-1,9. Коли вміст матрицеутворюючого агента (полімеру), вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз, складає менше 20 % від вмісту морфолінієвої солі тіазотної кислоти, активний інгредієнт вивільняється швидко та, беручи до уваги короткий період його півжиття в організмі, швидко виводиться з організму, не забезпечуючи досягнення постійного рівня морфолінієвої солі тіазотної кислоти в крові. Коли вміст матрицеутворюючого полімеру перевищує 190 % від вмісту діючої речовини, вивільнення морфолінієвої солі тіазотної кислоти уповільнюється настільки, що концентрація активного інгредієнта в плазмі є недостатньою, аби досягти оптимальної терапевтичної ефективності. Переважно, тверда фармацевтична композиція відповідно до даного винаходу містить морфолінію тіазотат та щонайменше один матрицеутворюючий полімер, вибраний з поліетиленоксиду та гідроксипропілметилцелюлоз, у співвідношенні 1:0,4-1,6. З метою прикладу, фармацевтична композиція пролонгованого вивільнення морфолінієвої солі тіазотної кислоти може містити морфолінію тіазотат та поліетиленоксид у співвідношенні 1:0,58-0,72, 1:0,78-0,95 та 1:0,98-1,2 чи морфолінію тіазотат та щонайменше одну гідроксипропілметилцелюлозу, вибрану з гідроксипропілметилцелюлоз різного ступеня в'язкості, у співвідношенні 1:0,78-0,95 та 1:0,98-1,2. Тверда фармацевтична композиція пролонгованого вивільнення морфолінієвої солі тіазотної кислоти відповідно до даного винаходу містить від 15 до 65 % за вагою щонайменше одного матрицеутворюючого полімеру, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз, відносно загальної ваги згаданої композиції. 4 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до переважного втілення твердої фармацевтичної композиції відповідно до даного винаходу, ця композиція містить від 30 до 60 % за вагою матрицеутворюючого агента (полімеру), вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз, відносно загальної ваги композиції. З метою прикладу, фармацевтична композиція пролонгованого вивільнення морфолінієвої солі тіазотної кислоти може містити 30, 40 або 50 % поліетиленоксиду чи 40 або 50 % гідроксипропілметилцелюлоз різного ступеня в'язкості. Тверда фармацевтична композиція відповідно до даного винаходу може також містити в доповнення до активного інгредієнта, поєднаного з щонайменше одним матрицеутворюючим агентом (полімером), вибраним з поліетиленоксиду та гідроксипропілметилцелюлоз, додатково одну і більше допоміжних речовин. Переважно, композиція може містити (необов'язково) один або більше змащувальний агент або лубрикант, один або більше додатковий наповнювач, один або більше агент, що покращує текучість, або глідант, та інші. Змащувальні агенти або лубриканти переважно вибирають із стеарату магнію, стеарату кальцію, стеарату цинку, тальку, стеарину фумарату натрію, силікату магнію, силікату кальцію, трьохосновного кальцій фосфату, стеаринової кислоти, бензоату натрію, гідрогенізованих рослинних олій, гліцерил бегенату, легких мінеральних олій, поліетиленгліколю та інших. Додаткові наповнювачі переважно вибирають з мікрокристалічної целюлози, полівінілпіролідону, співполімеру полівінілпіролідон-вінілацетату, гуміарабіку, гідроколоїдів, декстринів, желатину, глюкози, гуарової кислоти, крохмалю, прежелатинізованого крохмалю, мальтози, мальтодекстрину, їх сумішей та інших. Агенти, що покращують текучість, або гліданти, переважно вибирають з діоксиду кремнію, колоїдного кремнезему, силікату магнію, силікату кальцію, тальку та інших. Винахід стосується твердої фармацевтичної композиції пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, що включає: і) 30-60 % за вагою морфолінієвої солі тіазотної кислоти; іі) 15-65 % за вагою щонайменше одного матрицеутворюючого полімеру, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз; ііі) 0,25-5 % за вагою змащувальних агентів або лубрикантів; iv) 0,1-1 % за вагою агентів, що покращують текучість, або глідантів; v) 2-15 % за вагою додаткових наповнювачів відносно загальної ваги композиції. Більш переважно, винахід стосується твердої фармацевтичної композиції пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, що включає: і) 40-50 % за вагою морфолінієвої солі тіазотної кислоти; іі) 30-60 % за вагою щонайменше одного матрицеутворюючого полімеру, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз; ііі) 0,25-2 % за вагою змащувальних агентів або лубрикантів; iv) 0,1-0,5 % за вагою агентів, що покращують текучість, або глідантів; v) 2-5 % за вагою додаткових наповнювачів відносно загальної ваги композиції. Перевага надається використанню магнію стеарату як змащувального агента або лубриканта. Перевага надається використанню кремнію діоксиду як агента, що покращує текучість, або гліданта. Перевага надається використанню целюлози мікрокристалічної як додаткового наповнювача. Додатково тверда фармацевтична композиція може містити один або більше барвників та одну чи більше суміш для покриття. Як показано в Прикладах, відповідно до переважного втілення, тверда фармацевтична композиція пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, відрізняється тим, що включає: і) 46,34 % за вагою морфолінієвої солі тіазотної кислоти; іі) 50 % за вагою поліетиленоксиду; ііі) 0,5 % за вагою магнію стеарату; iv) 0,2 % за вагою кремнію діоксиду колоїдного безводного; v) 2,96 % за вагою целюлози мікрокристалічної відносно загальної ваги композиції. При виготовленні фармацевтичної композиції відповідно до даного винаходу, що має хороші характеристики щодо пролонгованого вивільнення діючої речовини, перевага надається використанню порошку морфолінієвої солі тіазотної кислоти з розміром частинок менше 500 мкм, більш переважно менше 100 мкм. Використання субстанції морфолінієвої солі тіазотної кислоти з розміром частинок більше 500 мкм призводить до отримання незадовільних 5 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 результатів кінетики вивільнення діючої речовини через утворення пор в таблетках, що, в свою чергу, призводить до швидкого проникнення води в таблетку та неконтрольованого невідтворюваного вивільнення активної речовини. Тверда фармацевтична композиція відповідно до даного винаходу переважно знаходиться у формі таблеток. За допомогою підбору комбінації діючої речовини та ексципієнтів з оптимальними фармакотехнологічними характеристиками, що містяться у фармацевтичній композиції за даним винаходом, кінцевий склад у формі таблеток може бути отриманий методом прямого пресування. Переважно кожна таблетка містить 340-420 мг морфолінієвої солі тіазотної кислоти, більш переважно 370-390 мг, ще більш переважно 380 мг; Переважно, кожна таблетка має вагу в діапазоні 760-930 мг, більш переважно 835-855 мг, ще більш переважно 845 мг. За допомогою нової комбінації активного фармацевтичного інгредієнта і ексципієнтів твердої фармацевтичної композиції даного винаходу можливо одержати таблетки, які мають стійкість до роздавлювання таблеток-ядер (без оболонки) в діапазоні від 200 до 320 ньютонів, більш переважно від 230 до 295 ньютонів. Подібним чином, за допомогою використання твердої фармацевтичної композиції даного винаходу можливо одержати таблетки, які мають стираність таблеток-ядер (без оболонки) не більше 1 %, переважно не більше 0,1 %, ще більш переважно не більше 0,05 %. Таблетки, які можуть бути отримані, використовуючи тверду фармацевтичну композицію даного винаходу, мають задовільні параметри in vitro розчинення, а також фармакокінетичні параметри in vivo для морфолінієвої солі тіазотної кислоти, враховуючи бажану мету пролонгованого вивільнення активного інгредієнта для забезпечення високої терапевтичної ефективності. В ході фармацевтичної розробки був запропонований наступний можливий профіль вивільнення діючої речовини морфолінієвої солі тіазотної кислоти від часу вивільнення (теоретичний профіль вивільнення морфолінієвої солі тіазотної кислоти): - за 1 годину в розчин повинно перейти 15-35 % морфолінієвої солі тіазотної кислоти; - за 3 години в розчин повинно перейти 45-65 % морфолінієвої солі тіазотної кислоти; - за 8 годин в розчин повинно перейти більше 80 % морфолінієвої солі тіазотної кислоти. Теоретичний профіль розраховувався так, щоб із таблеток пролонгованого вивільнення, що містять 380 мг морфолінієвої солі тіазотної кислоти, 115,92 мг морфолінію тіазотату вивільнялося як із таблеток негайного вивільнення до досягнення максимальної концентрації на 4,5 години, а далі вивільнялося по 24,02 мг/год для пролонгації вивільнення. Теоретичний профіль вивільнення морфолінієвої солі тіазотної кислоти для таблеток пролонгованого вивільнення зображено на Фіг. 1. За допомогою твердої фармацевтичної композиції даного винаходу можливо отримати таблетки, що мають наступні параметри in vitro розчинення морфолінієвої солі тіазотної кислоти: і) у воді: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; іі) в буферному розчині з рН 1,2: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; ііі) в буферному розчині з рН 4,5: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; 6 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 60 - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; iv) в буферному розчині з рН 6,8: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження. Таким чином, вплив середовища розчинення на кінетику вивільнення діючої речовини відсутній. За допомогою твердої фармацевтичної композиції даного винаходу можливо отримати таблетки морфолінієвої солі тіазотної кислоти, що характеризуються щонайменше одним з наступних фармакокінетичних параметрів in vivo або їх комбінацією: - площа під фармакокінетичною кривою «концентрація-час» в плазмі від нуля до нескінченності (AUC0-∞): від 5500 до 17500 нг·год/мл у випадку прийому натщесерце та від 8400 до 17300 нг·год/мл у випадку прийому після їжі; - максимальне значення концентрації в плазмі (Сmах): від 700 до 2250 нг/мл у випадку прийому натщесерце та від 550 до 1900 нг/мл у випадку прийому після їжі; - час досягнення максимальної концентрації в плазмі (Т mах): від 2 до 7 годин у випадку прийому натщесерце та від 3 до 7 годин у випадку прийому після їжі; - період напіввиведення (t1/2): від 3 до 21,5 годин у випадку прийому натщесерце та від 3,5 до 19 годин у випадку прийому після їжі. Спосіб одержання таблеток для пролонгованого вивільнення морфолінієвої солі тіазотної кислоти включає стадії подрібнення діючої речовини (необов'язково), просіювання сировини, отримання сухої суміші морфолінієвої солі тіазотної кислоти з щонайменше одним матрицеутворюючим агентом, вибраним з поліетиленоксиду та гідроксипропілметилцелюлоз, та іншими фармацевтично прийнятними ексципієнтами, та стадію отримання таблеток стисненням суміші, отриманої на попередній стадії. Більш конкретно, спосіб одержання таблеток для пролонгованого вивільнення морфолінієвої солі тіазотної кислоти включає наступні стадії, але не обмежується наведеними прикладами: A. Подрібнення субстанції морфолінієвої солі тіазотної кислоти (необов'язково). Б. Просіювання сировини. B. Приготування маси для таблетування: і) отримання тритураційної суміші з наступних складових: - щонайменше одного агента, що покращує текучість; - щонайменше одного додаткового наповнювача, що відрізняється від поліетиленоксиду та гідроксипропілметилцелюлози; іі) додавання до тритураційної суміші, отриманої на попередній стадії (і): - морфолінієвої солі тіазотної кислоти; - щонайменше одного матрицеутворюючого агента, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз; ііі) додавання до суміші, отриманої на попередній стадії (іі): - щонайменше одного змащувального агента. Г. Одержання таблеток сухим стисненням суміші, яку отримують на стадії В. Д. Нанесення плівкового покриття та знепилювання (необов'язково). У переважному втіленні спосіб одержання таблеток для пролонгованого вивільнення морфолінієвої солі тіазотної кислоти включає наступні стадії: A. Подрібнення субстанції морфолінієвої солі тіазотної кислоти (необов'язково). Б. Просіювання сировини. B. Приготування маси для таблетування: і) отримання тритураційної суміші з наступних складових: - кремнію діоксиду колоїдного безводного; - целюлози мікрокристалічної; іі) додавання до тритураційної суміші, отриманої на попередній стадії (і): - морфолінієвої солі тіазотної кислоти; - щонайменше одного поліетиленоксиду або гідроксипропілметилцелюлози; ііі) додавання до суміші, отриманої на попередній стадії (іі): - магнію стеарату. 7 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 Г. Одержання таблеток сухим стисненням суміші, яку отримують на стадії В. Д. Нанесення плівкового покриття та знепилювання (необов'язково). Винахід стосується також таблетки для пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, яку одержують будь-яким вищезазначеним способом, яка відрізняється тим, що має наступні характеристики: і) містить від 340 мг до 420 мг морфолінієвої солі тіазотної кислоти, більш переважно від 370 мг до 390 мг, ще більш переважно 380 мг; іі) вага знаходиться в діапазоні 760-930 мг, більш переважно 835-855 мг, ще більш переважно 845 мг; ііі) стійкість до роздавлювання таблеток-ядер знаходиться в діапазоні від 200 до 320 ньютонів, більш переважно від 230 до 295 ньютонів. iv) стираність таблеток-ядер (без оболонки) складає не більше 1 %, переважно не більше 0,1 %, ще більш переважно не більше 0,05 %. Таблетка для пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, яку отримують відповідно до одного з вищеописаних способів, головним чином відрізняється тим, що вона має наступні параметри in vitro розчинення морфолінієвої солі тіазотної кислоти: і) у воді: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; іі) в буферному розчині з рН 1,2: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; ііі) в буферному розчині з рН 4,5: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; iv) в буферному розчині з рН 6,8: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження. Таблетка для пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, яку отримують відповідно до одного з вищеописаних способів, головним чином відрізняється тим, що вона характеризується щонайменше одним з наступних фармакокінетичних параметрів in vivo або їх комбінацією: - площа під фармакокінетичною кривою «концентрація-час» в плазмі від нуля до нескінченності (AUC0-∞): від 5500 до 17500 нг·год/мл у випадку прийому натщесерце та від 8400 до 17300 нг·год/мл у випадку прийому після їжі; - максимальне значення концентрації в плазмі (Сmах): від 700 до 2250 нг/мл у випадку прийому натщесерце та від 550 до 1900 нг/мл у випадку прийому після їжі; - час досягнення максимальної концентрації в плазмі (Тmах): від 2 до 7 годин у випадку прийому натщесерце та від 3 до 7 годин у випадку прийому після їжі; - період напіввиведення (t1/2): від 3 до 21,5 годин у випадку прийому натщесерце та від 3,5 до 19 годин у випадку прийому після їжі. Загалом, таблетки відповідно до даного винаходу є таблетками, вкритими плівковою оболонкою. Однак у деяких втіленнях плівкове покриття може бути відсутнім за умови, що 8 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 фармакокінетичні характеристики залишаться незмінними, особливо параметри in vitro розчинення морфолінієвої солі тіазотної кислоти. Винахід проілюстрований кресленнями і прикладами, наведеними нижче. На Фіг. 1 показано теоретичний профіль вивільнення морфолінієвої солі тіазотної кислоти для таблеток пролонгованого вивільнення. Ордината показує відсотковий вираз вивільнення морфолінієвої солі тіазотної кислоти у розчин відносно початкової кількості морфолінієвої солі тіазотної кислоти, що міститься у таблетках. Абсциса відображає час розчинення, виражений у годинах. На Фіг. 2 показано криві in vitro розчинення композицій пролонгованого вивільнення морфолінієвої солі тіазотної кислоти у формі таблеток, одержаних відповідно до Прикладів 1-7, у воді. Ордината показує відсотковий вираз вивільнення морфолінієвої солі тіазотної кислоти у розчин відносно початкової кількості морфолінієвої солі тіазотної кислоти, що міститься у таблетках. Абсциса відображає час розчинення , виражений у годинах. На Фіг. 3 показано криві in vitro розчинення морфолінієвої солі тіазотної кислоти, які отримують для таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, одержаних відповідно до Прикладу 3, з трьох різних серій у середовищі розчинення з рН 1,2. Ордината показує відсотковий вираз вивільнення морфолінієвої солі тіазотної кислоти у розчин відносно початкової кількості морфолінієвої солі тіазотної кислоти, що міститься у таблетках. Абсциса відображає час розчинення, виражений у годинах. На Фіг. 4 показано криві in vitro розчинення морфолінієвої солі тіазотної кислоти, які отримують для таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, одержаних відповідно до Прикладу 3, з трьох різних серій у середовищі розчинення з рН 4,5. Ордината показує відсотковий вираз вивільнення морфолінієвої солі тіазотної кислоти у розчин відносно початкової кількості морфолінієвої солі тіазотної кислоти, що міститься у таблетках. Абсциса відображає час розчинення, виражений у годинах. На Фіг. 5 показано криві in vitro розчинення морфолінієвої солі тіазотної кислоти, які отримують для таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, одержаних відповідно до Прикладу 3, з трьох різних серій у середовищі розчинення з рН 6,8. Ордината показує відсотковий вираз вивільнення морфолінієвої солі тіазотної кислоти у розчин відносно початкової кількості морфолінієвої солі тіазотної кислоти, що міститься у таблетках. Абсциса відображає час розчинення, виражений у годинах. На Фіг. 6 показано усереднені фармакокінетичні криві (для 16 добровольців) in vivo вивільнення тіазотної кислоти з таблеток пролонгованого вивільнення, одержаних відповідно до Прикладу 3, у випадку прийому натщесерце (Tf) та у випадку прийому після їжі (Τn) у вихідних одиницях концентрації. Ордината показує концентрацію тіазотної кислоти в плазмі у вихідних одиницях концентрації. Абсциса відображає час після орального введення таблетки, виражений у годинах. На Фіг. 7 показано усереднені фармакокінетичні криві (для 16 добровольців) in vivo вивільнення тіазотної кислоти з таблеток пролонгованого вивільнення, одержаних відповідно до Прикладу 3, у випадку прийому натщесерце (Тf) та у випадку прийому після їжі (Τn) в логарифмічно перетворених одиницях концентрації. Ордината показує концентрацію тіазотної кислоти в плазмі у логарифмічно перетворених одиницях концентрації. Абсциса відображає час після орального введення таблетки, виражений у годинах. Приклади Приклад 1: Спосіб отримання фармацевтичної композиції пролонгованого вивільнення, яка містить морфолінієву сіль тіазотної кислоти, складу № 1. А. Опис виробничого процесу Операція 1. Подрібнення субстанції морфолінію тіазотату. Операцію подрібнення субстанції морфолінію тіазотату проводили з використанням лабораторної ручної фарфорової ступки за температури повітря 21 °С та вологості 35 % із досягненням розміру частинок діючої речовини менше 250 мкм. 9 UA 111566 C2 5 10 15 20 25 30 Операція 2. Просіювання сировини. Операцію просіювання сировини проводили з використанням лабораторного сита FRITCH (TEST SIEVE) з діаметром отворів сит 0,5 мм за температури повітря 19 °С та вологості 41 %. Просіювали наступні субстанції: морфолінію тіазотат, поліетиленоксид POLYOX™ 1105, целюлозу мікрокристалічну МС-102 та магнію стеарат. Операція 3. Зважування інгредієнтів. Відважування сировини проводили на лабораторних вагах марки AND FX-3200, запобігаючи пилоутворенню та після попереднього калібрування вагів за розрахунком: морфолінію тіазотату - 46,61 г, поліетиленоксиду POLYOX™ 1105-30,00 г, целюлози мікрокристалічної МС-102 - 22,69 г, кремнію діоксиду колоїдного безводного (аеросилу) - 0,20 г, магнію стеарату - 0,50 г. Операція 4. Сухе змішування інгредієнтів. Після відважування відповідної кількості сировини та завантаження її в ємність проводили стадію сухого змішування, причому спочатку змішували кремнію діоксид колоїдний безводний та целюлозу мікрокристалічну з утворенням тритураційної суміші, потім до них додавали морфолінію тіазотат та поліетиленоксид POLYOX™ 1105. Операція 5. Обпудрювання. Операцію обпудрювання маси для таблетування здійснювали вручну, в закритій ємності шляхом додавання відповідної кількості магнію стеарату та перемішування протягом 5 хвилин. Операція 6. Таблетування. Операцію таблетування здійснювали за температури повітря 23 °С та вологості 40 % за допомогою роторного таблеткового преса ERWEKA TRB-10 з пуансонами овальної форми, з двоопуклою поверхнею, без риски та без фаски. Встановлювали наступні параметри таблетування: сила пресування - більше 35 кН, сила виштовхування - 120 Н. Операція 7. Нанесення плівкового покриття. Операцію нанесення плівкового покриття проводили за температури повітря 21 °С та вологості 35 % з використанням наступного обладнання: установка для нанесення плівкового покриття LHC 25/30/36 фірми "Lodige", підвісна мішалка Rolymix RX-OS, ваги AND FX-3200. Технологічний процес нанесення плівкового покриття складається із наступних фаз: отримання таблеток-ядер (таблеток без оболонки) і розчину для нанесення плівкового покриття, попередній нагрів установки для нанесення плівкового покриття, нанесення плівкового покриття, сушіння та вивантаження. Б. Склад препарату Відповідно до цього прикладу, фармацевтична композиція може містити морфолінію тіазотат та поліетиленоксид у співвідношенні 1:0,58-0,72. Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в таблиці 1 нижче. 35 Таблиця 1 Склад таблеток пролонгованого вивільнення морфолінію тіазотату за Прикладом 1 Найменування компонентів Вміст, мг Склад, № 1 Морфолінію тіазотат (розмір частинок - менше 380,00 250 мкм) Поліетиленоксид POLYOX™ 1105 246,00 Целюлоза мікрокристалічна (МС-102) 188,27 Кремнію діоксид колоїдний безводний (аеросил) 1,64 Магнію стеарат 4,10 Вага таблетки-ядра 820 Суміш для покриття (Opadry II 33G28707 White) 25,00 Вага таблетки (вкритої оболонкою) 845 40 Вміст, % Розрахунок на одну серію, г 46,34 46,61 30,00 22,96 0,20 0,50 100 3,00 30,00 22,69 0,20 0,50 100 3,00 103 Приклад 2: Спосіб отримання фармацевтичної композиції пролонгованого вивільнення, яка містить морфолінієву сіль тіазотної кислоти, складу № 2. А. Опис виробничого процесу Операція 1. Просіювання сировини. Операцію просіювання сировини проводили з використанням лабораторного сита FRITCH (TEST SIEVE) з діаметром отворів сит 0,5 мм за температури повітря 19 °С та вологості 38 %. Просіювали наступні субстанції: морфолінію тіазотат, поліетиленоксид POLYOX™ 1105, целюлозу мікрокристалічну МС-102 та магнію стеарат. 10 UA 111566 C2 5 10 15 20 25 Операція 2. Зважування інгредієнтів. Відважування сировини проводили на лабораторних вагах марки AND FX-3200, запобігаючи пилоутворенню та після попереднього калібрування вагів за розрахунком: морфолінію тіазотату - 46,61 г, поліетиленоксиду POLYOX™ 1105-40,00 г, целюлози мікрокристалічної МС-102 - 12,69 г, кремнію діоксиду колоїдного безводного (аеросилу) - 0,20 г, магнію стеарату - 0,50 г. Операція 3. Сухе змішування інгредієнтів. Після відважування відповідної кількості сировини та завантаження її в ємність проводили стадію сухого змішування, причому спочатку змішували кремнію діоксид колоїдний безводний та целюлозу мікрокристалічну з утворенням тритураційної суміші, потім до них додавали морфолінію тіазотат та поліетиленоксид POLYOX™ 1105. Операція 4. Обпудрювання. Операцію обпудрювання маси для таблетування здійснювали вручну, в закритій ємності шляхом додавання відповідної кількості магнію стеарату та перемішування протягом 5 хвилин. Операція 5. Таблетування. Операцію таблетування здійснювали за температури повітря 21 °С та вологості 39 % за допомогою роторного таблеткового преса ERWEKA TRB-10 з пуансонами овальної форми, з двоопуклою поверхнею, без риски та без фаски. Встановлювали наступні параметри таблетування: сила пресування - більше 35 кН, сила виштовхування - 120 Η. Операція 6. Нанесення плівкового покриття. Операцію нанесення плівкового покриття проводили за температури повітря 22 °С та вологості 38 % з використанням наступного обладнання: установка для нанесення плівкового покриття LHC 25/30/36 фірми "Lodige", підвісна мішалка Rolymix RX-OS, ваги AND FX-3200. Технологічний процес нанесення плівкового покриття складається із наступних фаз: отримання таблеток-ядер і розчину для нанесення плівкового покриття, попередній нагрів установки для нанесення плівкового покриття, нанесення плівкового покриття, сушіння та вивантаження. Б. Склад препарату Відповідно до цього прикладу, фармацевтична композиція може містити морфолінію тіазотат та поліетиленоксид у співвідношенні 1:0,78-0,95. Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в таблиці 2 нижче. 30 Таблиця 2 Склад таблеток пролонгованого вивільнення морфолінію тіазотату за Прикладом 2 Найменування компонентів Склад № 2 Морфолінію тіазотат (розмір частинок - менше 500 мкм) Поліетиленоксид POLYOX™ 1105 Целюлоза мікрокристалічна (МС-102) Кремнію діоксид колоїдний безводний (аеросил) Магнію стеарат Вага таблетки-ядра Суміш для покриття (Opadry II 33G28707 White) Вага таблетки (вкритої оболонкою) 35 40 Вміст, % Розрахунок на одну серію, г 380,00 46,34 46,61 328,00 106,27 1,64 4,10 820 25,00 845 40,00 12,96 0,20 0,50 100 3,00 40,00 12,69 0,20 0,50 100 3,00 103 Вміст, мг Приклад 3: Спосіб отримання фармацевтичної композиції пролонгованого вивільнення, яка містить морфолінієву сіль тіазотної кислоти, складу № 3. А. Опис виробничого процесу Операція 1. Подрібнення субстанції морфолінію тіазотату. Операцію подрібнення субстанції морфолінію тіазотату проводили з використанням лабораторного млинка за температури повітря 19 °С та вологості 35 % із досягненням розміру частинок діючої речовини менше 100 мкм. Операція 2. Просіювання сировини. Операцію просіювання сировини проводили з використанням лабораторного сита FRITCH (TEST SIEVE) з діаметром отворів сит 0,5 мм за температури повітря 21 °С та вологості 37 %. Просіювали наступні субстанції: морфолінію тіазотат, поліетиленоксид POLYOX™ 1105, целюлозу мікрокристалічну МС-102 та магнію стеарат. 11 UA 111566 C2 5 10 15 20 25 Операція 3. Зважування інгредієнтів. Відважування сировини проводили на лабораторних вагах марки AND FX-3200, запобігаючи пилоутворенню та після попереднього калібрування вагів за розрахунком: морфолінію тіазотату - 46,34 г, поліетиленоксиду POLYOX™ 1105-50,00 г, целюлози мікрокристалічної МС-102 - 2,96 г, кремнію діоксиду колоїдного безводного (аеросилу) - 0,20 г, магнію стеарату - 0,50 г. Операція 4. Сухе змішування інгредієнтів. Після відважування відповідної кількості сировини та завантаження її в ємність проводили стадію сухого змішування, причому спочатку змішували кремнію діоксид колоїдний безводний та целюлозу мікрокристалічну з утворенням тритураційної суміші, потім до них додавали морфолінію тіазотат та поліетиленоксид POLYOX™ 1105. Операція 5. Обпудрювання. Операцію обпудрювання маси для таблетування здійснювали вручну, в закритій ємності шляхом додавання відповідної кількості магнію стеарату та перемішування протягом 5 хвилин. Операція 6. Таблетування. Операцію таблетування здійснювали за температури повітря 20 °С та вологості 36 % за допомогою роторного таблеткового преса ERWEKA TRB-10 з пуансонами овальної форми, з двоопуклою поверхнею, без риски та без фаски. Встановлювали наступні параметри таблетування: сила пресування - більше 35 кН, сила виштовхування - 120 Η. Операція 7. Нанесення плівкового покриття. Операцію нанесення плівкового покриття проводили за температури повітря 22 °С та вологості 38 % з використанням наступного обладнання: установка для нанесення плівкового покриття LHC 25/30/36 фірми "Lodige", підвісна мішалка Rolymix RX-OS, ваги AND FX-3200. Технологічний процес нанесення плівкового покриття складається із наступних фаз: отримання таблеток-ядер і розчину для нанесення плівкового покриття, попередній нагрів установки для нанесення плівкового покриття, нанесення плівкового покриття, сушіння та вивантаження. Б. Склад препарату Відповідно до цього прикладу, фармацевтична композиція може містити морфолінію тіазотат та поліетиленоксид у співвідношенні 1:0,98-1,20. Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в таблиці 3 нижче. 30 Таблиця 3 Склад таблеток пролонгованого вивільнення морфолінію тіазотату за Прикладом 3 Найменування компонентів Склад № 3 Морфолінію тіазотат (розмір частинок - менше 100 мкм) Поліетиленоксид POLYOX™ 1105 Целюлоза мікрокристалічна (МС-102) Кремнію діоксид колоїдний безводний (аеросил) Магнію стеарат Вага таблетки-ядра Суміш для покриття (Opadry II 33G28707 White) Вага таблетки (вкритої оболонкою) 35 40 45 Вміст, % Розрахунок на одну серію, г 380,00 46,34 46,34 410,00 24,27 1,64 4,10 820 25,00 845 50,00 2,96 0,20 0,50 100 3,00 50,00 2,96 0,20 0,50 100 3,00 103 Вміст, мг Приклад 4: Спосіб отримання фармацевтичної композиції пролонгованого вивільнення, яка містить морфолінієву сіль тіазотної кислоти, складу № 4. А. Опис виробничого процесу Операція 1. Подрібнення субстанції морфолінію тіазотату. Операцію подрібнення субстанції морфолінію тіазотату проводили з використанням лабораторного млинка за температури повітря 21 °С та вологості 32 % із досягненням розміру частинок діючої речовини менше 100 мкм. Операція 2. Просіювання сировини. Операцію просіювання сировини проводили з використанням лабораторного сита FRITCH (TEST SIEVE) з діаметром отворів сит 0,5 мм за температури повітря 19 °С та вологості 41 %. Просіювали наступні субстанції: морфолінію тіазотат, гідроксипропілметилцелюлозу Methocel K100M, целюлозу мікрокристалічну МС-102 та магнію стеарат. Операція 3. Зважування інгредієнтів. Відважування сировини проводили на лабораторних вагах марки AND FX-3200, запобігаючи пилоутворенню та після попереднього калібрування 12 UA 111566 C2 5 10 15 20 25 вагів за розрахунком: морфолінію тіазотату - 46,61 г, гідроксипропілметилцелюлози Methocel К100М - 40,00 г, целюлози мікрокристалічної МС-102 - 12,69 г, кремнію діоксиду колоїдного безводного (аеросилу) - 0,20 г, магнію стеарату - 0,50 г. Операція 4. Сухе змішування інгредієнтів. Після відважування відповідної кількості сировини та завантаження її в ємність проводили стадію сухого змішування, причому спочатку змішували кремнію діоксид колоїдний безводний та целюлозу мікрокристалічну з утворенням тритураційної суміші, потім до них додавали морфолінію тіазотат та гідроксипропілметилцелюлозу Methocel K100M. Операція 5. Обпудрювання. Операцію обпудрювання маси для таблетування здійснювали вручну, в закритій ємності шляхом додавання відповідної кількості магнію стеарату та перемішування протягом 5 хвилин. Операція 6. Таблетування. Операцію таблетування здійснювали за температури повітря 21 °С та вологості 32 % за допомогою роторного таблеткового преса ERWEKA TRB-10 з пуансонами овальної форми, з двоопуклою поверхнею, без риски та без фаски. Встановлювали наступні параметри таблетування: сила пресування - більше 35 кН, сила виштовхування - 120 Η. Операція 7. Нанесення плівкового покриття. Операцію нанесення плівкового покриття проводили за температури повітря 22 °С та вологості 38 % з використанням наступного обладнання: установка для нанесення плівкового покриття LHC 25/30/36 фірми "Lodige", підвісна мішалка Rolymix RX-OS, ваги AND FX-3200. Технологічний процес нанесення плівкового покриття складається із наступних фаз: отримання таблеток-ядер і розчину для нанесення плівкового покриття, попередній нагрів установки для нанесення плівкового покриття, нанесення плівкового покриття, сушіння та вивантаження. Б. Склад препарату Відповідно до цього прикладу, фармацевтична композиція може містити морфолінію тіазотат та гіпромелозу у співвідношенні 1:0,78-0,95. Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в таблиці 4 нижче. Таблиця 4 Склад таблеток пролонгованого вивільнення морфолінію тіазотату за Прикладом 4 Найменування компонентів Вміст, % Розрахунок на одну серію, г 380,00 46,34 46,61 328,00 106,27 1,64 4,10 820 25,00 845 40,00 12,96 0,20 0,50 100 3,00 40,00 12,69 0,20 0,50 100 3,00 103 Вміст, мг Склад № 4 Морфолінію тіазотат (розмір частинок - менше 100 мкм) Methocel K100M (гіпромелоза) Целюлоза мікрокристалічна (МС-102) Кремнію діоксид колоїдний безводний (аеросил) Магнію стеарат Вага таблетки-ядра Суміш для покриття (Opadry II 33G28707 White) Вага таблетки (вкритої оболонкою) 30 35 40 45 Приклад 5: Спосіб отримання фармацевтичної композиції пролонгованого вивільнення, яка містить морфолінієву сіль тіазотної кислоти, складу № 5. А. Опис виробничого процесу Операція 1. Подрібнення субстанції морфолінію тіазотату. Операцію подрібнення субстанції морфолінію тіазотату проводили з використанням лабораторної ручної фарфорової ступки за температури повітря 20 °С та вологості 33 % із досягненням розміру частинок діючої речовини менше 250 мкм. Операція 2. Просіювання сировини. Операцію просіювання сировини проводили з використанням лабораторного сита FRITCH (TEST SIEVE) з діаметром отворів сит 0,5 мм за температури повітря 19 °С та вологості 41 %. Просіювали наступні субстанції: морфолінію тіазотат, гідроксипропілметилцелюлозу Methocel K100M, целюлозу мікрокристалічну МС-102 та магнію стеарат. Операція 3. Зважування інгредієнтів. Відважування сировини проводили на лабораторних вагах марки AND FX-3200, запобігаючи пилоутворенню та після попереднього калібрування вагів за розрахунком: морфолінію тіазотату - 46,34 г, гідроксипропілметилцелюлози Methocel 13 UA 111566 C2 5 10 15 20 25 K100M - 50,00 г, целюлози мікрокристалічної МС-102 - 2,96 г, кремнію діоксиду колоїдного безводного (аеросилу) - 0,20 г, магнію стеарату - 0,50 г. Операція 4. Сухе змішування інгредієнтів. Після відважування відповідної кількості сировини та завантаження її в ємність проводили стадію сухого змішування, причому спочатку змішували кремнію діоксид колоїдний безводний та целюлозу мікрокристалічну з утворенням тритураційної суміші, потім до них додавали морфолінію тіазотат та гідроксипропілметилцелюлозу Methocel K100M. Операція 5. Обпудрювання. Операцію обпудрювання маси для таблетування здійснювали вручну, в закритій ємності шляхом додавання відповідної кількості магнію стеарату та перемішування протягом 5 хвилин. Операція 6. Таблетування. Операцію таблетування здійснювали за температури повітря 22 °С та вологості 42 % за допомогою роторного таблеткового преса ERWEKA TRB-10 з пуансонами овальної форми, з двоопуклою поверхнею, без риски та без фаски. Встановлювали наступні параметри таблетування: сила пресування - більше 35 кН, сила виштовхування - 120 Η. Операція 7. Нанесення плівкового покриття. Операцію нанесення плівкового покриття проводили за температури повітря 21 °С та вологості 35 % з використанням наступного обладнання: установка для нанесення плівкового покриття LHC 25/30/36 фірми "Lodige", підвісна мішалка Rolymix RX-OS, ваги AND FX-3200. Технологічний процес нанесення плівкового покриття складається із наступних фаз: отримання таблеток-ядер і розчину для нанесення плівкового покриття, попередній нагрів установки для нанесення плівкового покриття, нанесення плівкового покриття, сушіння та вивантаження. Б. Склад препарату Відповідно до цього прикладу, фармацевтична композиція може містити морфолінію тіазотат та гіпромелозу у співвідношенні 1:0,98-1,20. Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в таблиці 5 нижче. Таблиця 5 Склад таблеток пролонгованого вивільнення морфолінію тіазотату за Прикладом 5 Найменування компонентів Вміст, мг Склад № 5 Морфолінію тіазотат (розмір частинок - менше 380,00 250 мкм) Methocel K100M (гіпромелоза) 410,00 Целюлоза мікрокристалічна (МС-102) 24,27 Кремнію діоксид колоїдний безводний (аеросил) 1,64 Магнію стеарат 4,10 Вага таблетки-ядра 820 Суміш для покриття (Opadry II 33G28707 White) 25,00 Вага таблетки (вкритої оболонкою) 845 30 35 40 Вміст, % Розрахунок на одну серію, г 46,34 46,34 50,00 2,96 0,20 0,50 100 3,00 50,00 2,96 0,20 0,50 100 3,00 103 Приклад 6: Спосіб отримання фармацевтичної композиції пролонгованого вивільнення, яка містить морфолінієву сіль тіазотної кислоти, складу № 6 А. Опис виробничого процесу Операція 1. Подрібнення субстанції морфолінію тіазотату. Операцію подрібнення субстанції морфолінію тіазотату проводили з використанням лабораторної ручної фарфорової ступки за температури повітря 22 °С та вологості 41 % із досягненням розміру частинок діючої речовини менше 250 мкм. Операція 2. Просіювання сировини. Операцію просіювання сировини проводили з використанням лабораторного сита FRITCH (TEST SIEVE) з діаметром отворів сит 0,5 мм за температури повітря 19 °С та вологості 38 %. Просіювали наступні субстанції: морфолінію тіазотат, гідроксипропілметилцелюлозу Methocel K15M, целюлозу мікрокристалічну МС-102 та магнію стеарат. Операція 3. Зважування інгредієнтів. Відважування сировини проводили на лабораторних вагах марки AND FX-3200, запобігаючи пилоутворенню та після попереднього калібрування вагів за розрахунком: морфолінію тіазотату - 46,61 г, гідроксипропілметилцелюлози Methocel 14 UA 111566 C2 5 10 15 20 25 K15M - 40,00 г, целюлози мікрокристалічної МС-102 - 12,69 г, кремнію діоксиду колоїдного безводного (аеросилу) - 0,20 г, магнію стеарату - 0,50 г. Операція 4. Сухе змішування інгредієнтів. Після відважування відповідної кількості сировини та завантаження її в ємність проводили стадію сухого змішування, причому спочатку змішували кремнію діоксид колоїдний безводний та целюлозу мікрокристалічну з утворенням тритураційної суміші, потім до них додавали морфолінію тіазотат та гідроксипропілметилцелюлозу Methocel K15M. Операція 5. Обпудрювання. Операцію обпудрювання маси для таблетування здійснювали вручну, в закритій ємності шляхом додавання відповідної кількості магнію стеарату та перемішування протягом 5 хвилин. Операція 6. Таблетування. Операцію таблетування здійснювали за температури повітря 20 °С та вологості 35 % за допомогою роторного таблеткового преса ERWEKA TRB-10 з пуансонами овальної форми, з двоопуклою поверхнею, без риски та без фаски. Встановлювали наступні параметри таблетування: сила пресування - більше 35 кН, сила виштовхування - 120 Н. Операція 7. Нанесення плівкового покриття. Операцію нанесення плівкового покриття проводили за температури повітря 22 °С та вологості 38 % з використанням наступного обладнання: установка для нанесення плівкового покриття LHC 25/30/36 фірми "Lodige", підвісна мішалка Rolymix RX-OS, ваги AND FX-3200. Технологічний процес нанесення плівкового покриття складається із наступних фаз: отримання таблеток-ядер і розчину для нанесення плівкового покриття, попередній нагрів установки для нанесення плівкового покриття, нанесення плівкового покриття, сушіння та вивантаження. Б. Склад препарату Відповідно до цього прикладу, фармацевтична композиція може містити морфолінію тіазотат та гіпромелозу у співвідношенні 1:0,78-0,95. Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в таблиці 6 нижче. Таблиця 6 Склад таблеток пролонгованого вивільнення морфолінію тіазотату за Прикладом 6 Найменування компонентів Вміст, мг Склад № 6 Морфолінію тіазотат (розмір частинок - менше 380,00 250 мкм) Methocel K15M (гіпромелоза) 328,00 Целюлоза мікрокристалічна (МС-102) 106,27 Кремнію діоксид колоїдний безводний (аеросил) 1,64 Магнію стеарат 4,10 Вага таблетки-ядра 820 Суміш для покриття (Opadry II 33G28707 White) 25,00 Вага таблетки (вкритої оболонкою) 845 30 35 40 Вміст, % Розрахунок на одну серію, г 46,34 46,61 40,00 12,96 0,20 0,50 100 3,00 40,00 12,69 0,20 0,50 100 3,00 103 Приклад 7: Спосіб отримання фармацевтичної композиції пролонгованого вивільнення, яка містить морфолінієву сіль тіазотної кислоти, складу № 7. А. Опис виробничого процесу Операція 1. Просіювання сировини. Операцію просіювання сировини проводили з використанням лабораторного сита FRITCH (TEST SIEVE) з діаметром отворів сит 0,5 мм за температури повітря 21 °С та вологості 32 %. Просіювали наступні субстанції: морфолінію тіазотат, гідроксипропілметилцелюлозу Methocel K15M, целюлозу мікрокристалічну МС-102 та магнію стеарат. Операція 2. Зважування інгредієнтів. Відважування сировини проводили на лабораторних вагах марки AND FX-3200, запобігаючи пилоутворенню та після попереднього калібрування вагів за розрахунком: морфолінію тіазотату - 46,34 г, гідроксипропілметилцелюлози Methocel K15M - 50,00 г, целюлози мікрокристалічної МС-102 - 2,96 г, кремнію діоксиду колоїдного безводного (аеросилу) - 0,20 г, магнію стеарату -0,50 г. Операція 3. Сухе змішування інгредієнтів. Після відважування відповідної кількості сировини та завантаження її в ємність проводили стадію сухого змішування, причому спочатку змішували 15 UA 111566 C2 5 10 15 20 кремнію діоксид колоїдний безводний та целюлозу мікрокристалічну з утворенням тритураційної суміші, потім до них додавали морфолінію тіазотат та гідроксипропілметилцелюлозу Methocel K15M. Операція 4. Обпудрювання. Операцію обпудрювання маси для таблетування здійснювали вручну, в закритій ємності шляхом додавання відповідної кількості магнію стеарату та перемішування протягом 5 хвилин. Операція 5. Таблетування. Операцію таблетування здійснювали за температури повітря 22 °С та вологості 37 % за допомогою роторного таблеткового преса ERWEKA TRB-10 з пуансонами овальної форми, з двоопуклою поверхнею, без риски та без фаски. Встановлювали наступні параметри таблетування: сила пресування - більше 35 кН, сила виштовхування - 120 Н. Операція 6. Нанесення плівкового покриття. Операцію нанесення плівкового покриття проводили за температури повітря 21 °С та вологості 35 % з використанням наступного обладнання: установка для нанесення плівкового покриття LHC 25/30/36 фірми "Lodige", підвісна мішалка Rolymix RX-OS, ваги AND FX-3200. Технологічний процес нанесення плівкового покриття складається із наступних фаз: отримання таблеток-ядер і розчину для нанесення плівкового покриття, попередній нагрів установки для нанесення плівкового покриття, нанесення плівкового покриття, сушіння та вивантаження. Б. Склад препарату Відповідно до цього прикладу, фармацевтична композиція може містити морфолінію тіазотат та гіпромелозу у співвідношенні 1:0,98-1,20. Якісний і кількісний склад кінцевої композиції відносно активного інгредієнта і наповнювачів детально викладено в таблиці 7 нижче. Таблиця 7 Склад таблеток пролонгованого вивільнення морфолінію тіазотату за Прикладом 7 Найменування компонентів Вміст, мг Склад № 7 Морфолінію тіазотат (розмір частинок - менше 380,00 500 мкм) Methocel K15M (гіпромелоза) 410,00 Целюлоза мікрокристалічна (МС-102) 24,27 Кремнію діоксид колоїдний безводний (аеросил) 1,64 Магнію стеарат 4,10 Вага таблетки-ядра 820 Суміш для покриття (Opadry II 33G28707 White) 25,00 Вага таблетки (вкритої оболонкою) 845 Вміст, % Розрахунок на одну серію, г 46,34 46,34 50,00 2,96 0,20 0,50 100 3,00 50,00 2,96 0,20 0,50 100 3,00 103 25 30 Приклад 8: Фармакотехнологічні характеристики таблеток пролонгованого вивільнення, що містять морфолінієву сіль тіазотної кислоти, отриманих відповідно до прикладів № 1-7. А. Методи Різні методи аналізу фармакотехнологічних характеристик композицій пролонгованого вивільнення морфолінієвої солі тіазотної кислоти у формі таблеток, отриманих відповідно до Прикладів 1-7, детально розкриті у Таблиці 8 нижче. 16 UA 111566 C2 Таблиця 8 № Параметри перевірки Посилання 1 Зовнішній вигляд 2 3 4 Середня маса таблетки-ядра, мг Висота таблетки-ядра, мм Діаметр таблетки-ядра, мм Стійкість до роздавлювання ДФУ, 2.9.8 таблетки-ядра, Η Стираність таблетки-ядра, % ДФУ, 2.9.7 Однорідність маси таблеток, ДФУ, 2.9.5 вкритих плівковою оболонкою ДФУ, 2.9.3, In vitro розчинення у воді (у % Протокол йде вивільненого АФІ) нижче 5 6 7 8 5 10 15 20 25 30 Вимоги Таблетки, вкриті плівковою оболонкою білого кольору, овальної форми з двоопуклою поверхнею, краї рівні, покриття рівномірне, одного кольору 820 мг ± 5 % 7,2 мм ± 0,3 % 8×18 Не менше 100 Н Не більше 1 % 845 мг ± 5 % 15-35 % за 1 год 45-65 % за 3 год > 80 % за 8 год Дослідження показника «Стійкість до роздавлювання таблетки-ядра» проводилися з використанням комбінованого приладу для визначення твердості таблеток Multicheck V. Дослідження показника «Стираність таблетки-ядра» проводилися з використанням приладу для визначення стиранності таблеток TDR 100 ERWEKA. Дослідження показника «In vitro розчинення у воді» (у % вивільненого АФІ) проводили за наведеною нижче методикою. Спосіб in vitro розчинення: - тип приладу: прилад з лопаттю PHARMA-TEST PTWS 1200; - середовище розчинення: вода; - об'єм середовища розчинення: 900 мл; - швидкість обертання лопаті: 50 обертів/хвилину; - температура середовища розчинення: 37±0,5 °С; - точки контролю: 8 точок (не враховуючи нульову), а саме: через 1, 2, 3, 5, 6, 8, 9 та 10 годин; - об'єм проб: 5,0 мл; Визначення активного інгредієнта: - тип приладу: система ВЕРХ "Agilent 11003D LC System", хроматограф рідинний з діодноматричним детектором; - тип колонки: хроматографічна колонка "Kromasil С18", розміром 250×4,6 мм, заповнена силікагелем октадецильним з розміром частинок 5 мкм; - рухома фаза: суміш розчину 1,4 г/л калію дигідрофосфату, рН якого доводять розведеною фосфорною кислотою до значення 2,8±0,05, та ацетонітрилу (95:5 об./об.); - швидкість рухомої фази: 1,0 мл/хв; температура колонки: 25 °С; - довжина хвилі детектування: 235 нм. Розчин порівняння: 168,0 мг стандартного зразка морфолінію тіазотату розчиняють воді і доводять об'єм до 200 мл тим же розчинником. При калібруванні використовують 50, 60, 70, 80, 90, 100, 110, 120 та 130 % модельні розчини. Б. Результати Результати аналізу фармакотехнологічних характеристик композицій пролонгованого вивільнення морфолінієвої солі тіазотної кислоти у формі таблеток, отриманих відповідно до Прикладів 1-7, детально розкриті у Таблиці 9 нижче. 17 UA 111566 C2 Таблиця 9 № Параметри перевірки Вимоги Результат Склад № №3 №4 №5 №1 1 2 3 4 5 6 7 5 10 15 20 25 30 Середня маса таблетки-ядра, мг Висота таблеткиядра, мм Діаметр таблеткиядра, мм Стійкість до роздавлювання таблетки-ядра, Η Стираність таблеткиядра, % Однорідність маси таблеток, вкритих плівковою оболонкою №2 №6 №7 820 мг ± 5 % 809,7 816,7 807,8 817,5 816,9 811,9 804,3 7,2 мм ± 0,3 % 7,02 7,26 7,01 7,27 7,25 7,26 7,20 8×18 мм 8×18 8×18 8×18 8×18 8×18 8×18 8×18 Не менше 100 Н 281 233 295 238 251 227 237 Не більше 1 0,038 % 0,032 0,029 0,039 0,029 0,049 0,045 845 мг ± 5 % 848,3 845,7 846,1 843,7 850,1 848,1 844,9 25,44 27,08 23,09 29,79 32,45 31,65 33,66 56,03 58,37 52,10 59,02 59,87 59,72 60,49 97,89 99,14 95,50 98,43 98,56 99,25 99,97 15-35 % за 1 год In vitro розчинення у 45-65 % за 3 воді (у % год вивільненого АФІ) > 80 % за 8 год Результати перевірок, які проводять на таблетках, що взяті як зразки продукту, є задовільними: - зовнішній вигляд таблеток відповідає вимогам; - середня вага таблеток-ядер і однорідність ваги таблеток, вкритих плівковою оболонкою, відповідають вимогам; - висота та діаметр таблеток-ядер відповідають вимогам; - стираність таблеток-ядер набагато менше 1 %; - стійкість до роздавлювання таблеток-ядер набагато більше 100 ньютонів; - показники in vitro розчинення та вивільнення активної речовини з таблеток у воді відповідають вимогам протягом кожного періоду часу. Порівняння параметрів in vitro розчинення композицій пролонгованого вивільнення морфолінієвої солі тіазотної кислоти у формі таблеток, отриманих відповідно до Прикладів 1-7, у воді, детально розкритих у Таблиці 9 вище, показане на Фіг. 2. Склади № 1-3 містять як матрицеутворюючий агент поліетиленоксид, склади № 4-7 - гідроксипропілметилцелюлози різної в'язкості, відповідно до Прикладів 1-7. Результати порівняння показують наступне: - параметри in vitro розчинення морфолінієвої солі тіазотної кислоти у формі таблеток, отриманих відповідно до Прикладів 1-7, відповідають заданим критеріям протягом кожного періоду часу, що робить можливим одержання форм з пролонгованим вивільненням морфолінієвої солі тіазотної кислоти відповідно до даного винаходу; - параметри in vitro розчинення морфолінієвої солі тіазотної кислоти у формі таблеток складу № 3 є найбільш оптимальними, тому склад відповідно до Прикладу 3 може бути прийнятий за переважне втілення даного винаходу. Приклад 9: Дослідження параметрів in vitro розчинення морфолінієвої солі тіазотної кислоти для таблеток пролонгованого вивільнення, отриманих відповідно до Прикладу 3, в буферних розчинах з рН 1,2, рН 4,5 та рН 6,8. А. Методи Спосіб in vitro розчинення: - тип приладу: прилад з лопаттю PHARMA-TEST PTWS 1200; - середовище розчинення: розчин кислоти хлористоводневої, рН 1,2; ацетатний буферний розчин, рН 4,5; фосфатний буферний розчин, рН 6,8; - об'єм середовища розчинення: 900 мл; швидкість обертання лопаті: 50 обертів/хвилину; - температура середовища розчинення: 37±0,5 °С; - кількість досліджуваних проб: 12; 18 UA 111566 C2 5 10 15 20 - точки контролю: 8 точок (не враховуючи нульову), а саме: через 1, 2, 3, 5, 6, 8, 9 та 10 годин; - об'єм проб: 5,0 мл. Визначення активного інгредієнта: - тип приладу: система ВЕРХ "Agilent 11003D LC System", хроматограф рідинний з діодноматричним детектором; - тип колонки: хроматографічна колонка "Kromasil C18", розміром 250×4,6 мм, заповнена силікагелем октадецильним з розміром частинок 5 мкм; - рухома фаза: суміш розчину 1,4 г/л калію дигідрофосфату, рН якого доводять розведеною фосфорною кислотою до значення 2,8±0,05, та ацетонітрилу (95:5 об./об.); - швидкість рухомої фази: 1,0 мл/хв; - температура колонки: 25 °С; - довжина хвилі детектування: 235 нм. Розчин порівняння: 168,0 мг стандартного зразка морфолінію тіазотату розчиняють у воді і доводять об'єм до 200 мл тим же розчинником. При калібруванні використовують 50, 60, 70, 80, 90, 100, 110, 120 та 130 % модельні розчини. Б. Результати Результати дослідження параметрів in vitro розчинення морфолінієвої солі тіазотної кислоти у формі таблеток, отриманих відповідно до Прикладу 3, в буферних розчинах з рН 1,2, рН 4,5 та рН 6,8 детально розкриті у Таблиці 10 нижче. Таблиця 10 Ступінь вивільнення морфолінієвої солі тіазотної кислоти у формі таблеток (%), отриманих відповідно до Прикладу 3, в буферних розчинах з рН 1,2, рН 4,5 та рН 6,8 № табл. 1 2 3 4 5 6 7 8 9 10 11 12 Сер. RSD буферний розчин, рН 1,2 1 год 3 год 8 год 19,83 51,58 92,14 21,07 53,33 93,64 22,06 54,85 96,54 22,77 56,54 97,06 22,38 56,06 97,91 22,01 54,85 95,65 21,19 53,31 92,19 20,86 53,65 94,15 22,10 55,35 97,55 22,72 57,06 96,61 22,22 55,94 98,02 21,94 55,24 94,98 21,8 54,8 95,5 3,96 3,53 2,46 буферний розчин, рН 4,5 1 год 3 год 8 год 19,94 48,86 92,48 19,97 55,33 93,21 19,74 54,88 93,73 21,02 55,33 92,72 21,25 54,29 93,50 21,00 53,31 98,82 20,11 54,40 92,48 19,76 54,56 93,04 20,59 55,44 90,89 21,30 54,90 94,42 20,70 53,06 96,97 21,12 53,76 91,12 20,5 54,0 94,4 2,94 4,09 3,54 буферний розчин, рН 6,8 1 год 3 год 8 год 23,60 49,10 89,11 22,56 47,65 86,25 23,90 49,42 89,98 24,63 51,17 92,33 23,80 49,28 91,19 25,76 52,42 92,42 23,60 49,10 89,36 22,98 47,51 86,43 23,58 49,76 90,03 24,45 50,65 92,35 24,03 49,99 90,41 25,21 53,53 93,31 24,0 50,0 90,3 3,73 3,54 2,51 *RSD - відносне стандартне відхилення 25 30 35 Таблиця 10 показує відсотковий вираз вивільнення морфолінієвої солі тіазотної кислоти у розчин відносно початкової кількості морфолінієвої солі тіазотної кислоти, що міститься у таблетках. Криві in vitro розчинення морфолінієвої солі тіазотної кислоти, які отримують для таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, одержаних відповідно до Прикладу 3, з трьох різних серій у середовищі розчинення з рН 1,2, показані на Фіг. 3. Криві in vitro розчинення морфолінієвої солі тіазотної кислоти, які отримують для таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, одержаних відповідно до Прикладу 3, з трьох різних серій у середовищі розчинення з рН 4,5, показані на Фіг. 4. Криві in vitro розчинення морфолінієвої солі тіазотної кислоти, які отримують для таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, одержаних відповідно до Прикладу 3, з трьох різних серій у середовищі розчинення з рН 6,8, показані на Фіг. 5. Результати досліджень показують, що параметри in vitro розчинення та вивільнення активної речовини з таблеток у середовищах розчинення з рН 1,2, рН 4,5 та рН 6,8 відповідають вимогам протягом кожного періоду часу. Таким чином, вплив середовища розчинення на 19 UA 111566 C2 5 10 15 20 25 30 35 40 кінетику вивільнення діючої речовини відсутній. Незначне прискорення вивільнення морфолінієвої солі тіазотної кислоти в середовищі розчинення з рН 6,8 зумовлене підвищеною розчинністю основного компонента матриці поліетиленоксиду в розчинах, що містять фосфатіони, а тому не повинне інтерпретуватися як рН-залежність. Приклад 10: Дослідження параметрів in vivo розчинення морфолінієвої солі тіазотної кислоти для таблеток пролонгованого вивільнення, отриманих відповідно до Прикладу 3. У цьому прикладі досліджують in vivo фармакокінетичні параметри таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, які одержують відповідно до Прикладу 3. А. Спосіб аналізу in vivo фармакокінетичних даних Оцінюють концентрацію тіазотної кислоти після введення таблеток, отриманих відповідно до Прикладу 3 даного винаходу, які містять 380 мг активного інгредієнта. Визначають наступні фармакокінетичні параметри: - площу під фармакокінетичною кривою «концентрація-час» в плазмі від нуля до нескінченності (AUC0-∞) у випадку прийому натщесерце та у випадку прийому після їжі; - максимальне значення концентрації в плазмі (Сmах) у випадку прийому натщесерце та у випадку прийому після їжі; - час досягнення максимальної концентрації в плазмі (Т mах) у випадку прийому натщесерце та у випадку прийому після їжі; - період напіввиведення (t1/2) у випадку прийому натщесерце та у випадку прийому після їжі. Це дослідження проводять як відкрите з двома періодами дослідження по вивченню фармакокінетики лікарського засобу при введенні здоровим добровольцям його однократної дози натщесерце та після прийому їжі. Дослідження проводять на 16 здорових добровольцях чоловічої та жіночої статі віком від 24 до 49 років. Досліджуваний препарат складається з таблеток модифікованого вивільнення, що містять 380 мг морфолінієвої солі тіазотної кислоти, як описано в Прикладі 3 даної заявки на видачу патенту. Суб'єкти отримують єдину оральну дозу 380 мг морфолінієвої солі тіазотної кислоти (1 таблетка пролонгованого вивільнення) на один період дослідження. Для того, щоб виконати дослідження, було відібрано 608 зразків крові - по 38 у кожного з 16 добровольців. За один період дослідження у кожного добровольця відбирають 19 зразків крові, більш конкретно перед оральним введенням таблетки досліджуваного складу, отриманої відповідно до Прикладу 3 даного винаходу, та у проміжки часу 0,5, 1, 2, 3, 4, 4,5, 5, 5,5, 6, 7, 9, 12, 18, 24, 36, 48, 60 та 72 години після орального введення таблетки. Концентрацію тіазотної кислоти, виражену в нг/мл, вимірюють в кожному з взятих зразків крові. Статистичний аналіз параметрів AUC0-∞, Cmax, Tmax та t1/2 включає дисперсійний аналіз з наступним логарифмічним перетворенням даних (з використанням натурального логарифму). Середнє квадратичне відхилення та коефіцієнт варіації підраховують для кожного параметра. Б. Результати Результати дослідження in vivo фармакокінетичних параметрів таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, отриманих відповідно до Прикладу 3, у випадку прийому натщесерце детально розкриті у Таблиці 11 нижче. 20 UA 111566 C2 Таблиця 11 Концентрація тіазотної кислоти в плазмі після орального прийому таблеток, отриманих відповідно до Прикладу 3, натщесерце, нг/мл Доброволець 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 Доброволець 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 5 0.0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 7.0 1125 779,7 1118 846,3 550,5 577,0 596,9 614,3 378,8 1121 987,8 722,5 346,7 594,7 989,6 496,1 0.5 278,7 18,74 268,4 71,55 14,00 122,6 97,88 90,97 223,3 57,93 395,0 116,7 226,9 92,75 159,9 74,18 9.0 818,6 503,0 660,0 476,7 409,9 405,3 886,6 510,6 210,7 641,1 753,5 614,9 246,6 411,8 535,0 398,9 1.0 739,4 150,0 504,0 244,5 162,2 443,4 408,5 100,9 299,9 253,9 648,5 571,0 932,4 455,7 275,0 357,6 Час після прийому таблетки, год 2.0 3.0 4.0 4.5 1259 1313 1035 1143 342,4 736,9 728,2 1423 395,3 520,7 472,2 757,9 387,3 869,1 499,1 636,1 685,1 1091 676,4 720,6 458,1 336,0 520,8 752,0 511,1 661,7 569,0 924,9 202,4 199,9 483,4 642,6 293,2 553,1 795,7 726,9 435,1 413,1 475,1 469,3 574,3 570,1 755,4 1053 447,5 484,0 602,4 639,4 1330 571,9 368,0 378,7 559,0 441,8 840,4 868,9 428,9 391,4 460,6 797,5 896,4 883,4 984,6 1073 5.0 1231 1529 1047 1110 797,8 559,6 768,0 713,6 641,8 484,2 1156 705,3 397,5 822,7 1317 1168 Час після прийому таблетки, год (продовження) 12.0 18.0 24.0 36.0 48.0 569,2 290,9 210,8 45,49 < 10,0 240,2 109,3 76,48 31,03 15,88 305,2 111,9 103,0 49,69 26,23 297,5 139,0 156,6 46,31 18,63 293,3 207,3 102,1 31,73 < 10,0 236,5 95,53 78,34 41,28 19,11 509,7 229,0 160,6 112,2 44,02 237,4 138,1 116,5 30,69 14,18 105,5 37,12 26,19 17,78 18,05 494,9 213,2 120,9 81,81 62,68 538,1 272,9 164,5 86,43 54,54 187,7 91,71 23,72 < 10,0 < 10,0 116,9 32,45 < 10,0 < 10,0 < 10,0 201,9 93,43 92,04 49,34 46,98 323,2 188,5 125,2 57,86 27,35 202,2 81,32 78,14 22,32 < 10,0 5.5 1244 1272 1211 1354 831,6 594,2 751,2 678,0 561,9 575,4 1179 688,6 340,4 828,3 2212 1095 60.0 < 10,0 < 10,0 13,27 13,06 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 26,39 36,58 < 10,0 < 10,0 22,71 < 10,0 < 10,0 6.0 1184 1049 1231 1312 708,1 569,4 571,9 766,6 462,9 844,8 1146 638,3 367,5 627,2 1869 899,0 72.0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 16,69 20,63 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 Результати дослідження in vivo фармакокінетичних параметрів таблеток пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, отриманих відповідно до Прикладу 3, у випадку прийому після їжі детально розкриті у Таблиці 12 нижче. 21 UA 111566 C2 Таблиця 12 Концентрація тіазотної кислоти в плазмі після орального прийому таблеток, отриманих відповідно до Прикладу 3, після їжі, нг/мл Добров олець 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 Добров олець 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 5 10 15 0.0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 7.0 719,4 715,7 357,1 670,6 580,8 524,8 820,0 298,8 472,6 524,5 761,5 582,9 392,2 857,5 727,7 498,1 0.5 < 10,0 43,89 54,08 < 10,0 13,89 < 10,0 88,74 < 10,0 12,56 29,97 < 10,0 44,97 13,73 < 10,0 10,11 39,03 9.0 533,2 343,5 435,8 330,1 292,3 215,3 533,9 338,2 433,7 472,0 446,7 349,5 298,1 634,7 501,7 357,3 1.0 62,80 132,8 158,9 16,09 47,60 72,22 261,3 160,4 66,64 89,00 18,95 267,4 46,89 25,67 32,16 175,8 Час після прийому таблетки, год 2.0 3.0 4.0 4.5 212,3 969,7 1854 1569 496,9 928,0 997,6 861,7 298,3 496,4 570,2 607,5 108,3 527,1 1040 1144 163,3 217,0 357,3 444,8 275,0 348,4 770,5 715,4 362,4 383,1 639,2 728,4 383,7 657,7 617,4 631,8 467,4 559,2 1256 1020 425,6 607,7 645,4 1253 565,4 882,5 1080 1299 585,8 1055 1396 1578 199,5 460,6 635,9 931,1 125,5 266,5 415,3478,5 143,7 482,1 663,4 800,4 513,2 702,4 835,1 732,7 5.0 1692 748,9 530,1 998,7 389,0 637,6 684,3 513,5 861,7 950,0 1263 1431 983,7 577,1 812,7 713,9 Час після прийому таблетки, год (продовження) 12.0 18.0 24.0 36.0 48.0 412,7 355,2 351,1 96,96 36,86 244,8 157,1 104,6 41,51 19,37 393,3 251,9 188,1 85,48 147,7 265,8 165,3 151,2 63,92 32,28 362,8 297,8 191,1 12,91 < 10,0 196,9 121,4 98,16 57,28 36,72 445,7 348,4 343,2 93,53 53,09 223,0 178,5 135,3 63,62 43,81 310,4 181,4 183,5 71,88 29,30 440,8 239,0 195,7 149,6 64,59 313,4 235,6 174,2 95,73 54,48 224,1 136,2 99,90 52,30 < 10,0 387,6 310,6 211,0 95,07 41,75 310,0 150,9 111,7 53,75 41,86 277,9 135,9 166,0 92,57 53,39 163,0 94,90 87,37 45,07 33,90 5.5 1520 881,5 430,1 839,9 300,2 697,6 572,3 407,5 755,6 708,0 1041 977,8 588,6 586,0 799,9 613,0 60.0 < 10,0 < 10,0 28,42 14,86 < 10,0 < 10,0 16,52 < 10,0 11,19 27,41 37,23 < 10,0 < 10,0 14,36 < 10,0 < 10,0 6.0 1191 833,7 353,8 687,9 511,2 742,8 685,2 392,1 659,4 699,5 1224 776,1 492,8 738,9 855,4 536,5 72.0 < 10,0 < 10,0 11,13 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 < 10,0 20,03 17,76 < 10,0 < 10,0 10,91 < 10,0 < 10,0 Дані, які збирають під час досліджень, показують, що таблетки пролонгованого вивільнення морфолінієвої солі тіазотної кислоти, отримані відповідно до Прикладу 3, мають наступні in vivo фармакокінетичні параметри: - площа під фармакокінетичною кривою «концентрація-час» в плазмі від нуля до нескінченності (AUC0-∞): від 5500 до 17500 нг·год/мл у випадку прийому натщесерце та від 8400 до 17300 нг·год/мл у випадку прийому після їжі; - максимальне значення концентрації в плазмі (Сmах): від 700 до 2250 нг/мл у випадку прийому натщесерце та від 550 до 1900 нг/мл у випадку прийому після їжі; - час досягнення максимальної концентрації в плазмі (Т mах): від 2 до 7 годин у випадку прийому натщесерце та від 3 до 7 годин у випадку прийому після їжі; - період напіввиведення (t1/2): від 3 до 21,5 годин у випадку прийому натщесерце та від 3,5 до 19 годин у випадку прийому після їжі. Фармакокінетичні криві in vivo вивільнення тіазотної кислоти з таблеток пролонгованого вивільнення, отриманих відповідно до Прикладу 3, у випадку прийому натщесерце (Tf) та у випадку прийому після їжі (Τn) у вихідних одиницях концентрації показані на Фіг. 6. 22 UA 111566 C2 5 10 15 20 25 30 35 40 45 50 55 Фармакокінетичні криві in vivo вивільнення тіазотної кислоти з таблеток пролонгованого вивільнення, отриманих відповідно до Прикладу 3, у випадку прийому натщесерце (Tf) та у випадку прийому після їжі (Τn) в логарифмічно перетворених одиницях концентрації показані на Фіг. 7. Враховуючи вищенаведені дані, можна стверджувати, що винахід, що заявляється, вирішує поставлену задачу щодо створення нових фармацевтичних композицій морфолінієвої солі тіазотної кислоти, які забезпечують пролонговане вивільнення діючої речовини, мають прийнятні фармакотехнологічні характеристики та можуть бути одержані відповідно до простого і недорогого способу сухого пресування. Перелік використаних джерел: 1. Follonier N., Doelker E., Cole Ε.Τ. Evaluation of Hot-Melt Extrusion as a New Technique for the Production of Polymer-Based Pellets for Sustained Release Capsules Containing High Loading of Freely Soluble Drugs // Drug Dev. Ind. Pharm. - 1994. - Vol. 20 (8). - P. 1323-1339. 2. Huang X., Brazel C.S. On the Importance and Mechanics of Burst Release in Matrix-Controlled Drug Delivery Systems // J. Control. Release. - 2001. - Vol. 73 (2-3). - P. 121-136. 3. Khan M.Z.I. Recent trends and Progress in Sustained or Controlled Oral Delivery of Some Water Soluble Drugs: Morphine Salts, Diltiazetan and Captopril // Drug Dev. Ind. Pharm. - 1995. - Vol. 29 (1). - P. 1037-1070. 4. Maderuelo C., Zarzuelo Α., Lanao J.M. Critical Factors in the Release of Drugs from Sustained Release Hydrophilic Matrices // J. Control. Release. - 2011. - Vol. 154. - P. 2-19. 5. Nokhodchi Α., Ford J.L., Rowe P.H., Rubinstein M.H. The Effects of Compression Rate and Force on the Compaction Properties of Different Viscosity Grades of Hydroxypropylmethylcellulose //1996. - Int. J. Pharm. Vol. 129 (1-2). - P. 21-31. 6. Pillay V., Fassini R.A New Approach for Constant Rate Delivery of Highly Soluble Bioactives from a Simple Monolithic System // J. Control. Release. - 2000. - Vol. 67. - P. 67-78. 7. Willich S.N., Kulig M., Muller-Nordhorn J. European Survey on Circadian Variation of Angina Pectoris (ESCVA) in Treated Patients // Herz. - 2004. - Vol. 29 (7). - P. 665-72. 8. Комаров Ф.И., Рапопорт С.И. Хронобиология и хрономедицина. - М.: «Триада-Х», 2000. 488 с. ® 9. Інструкція для медичного застосування препарату ТІОТРИАЗОЛІН , таблетки по 200 мг № 10 в блістері, виробництва ПАТ «Київмедпрепарат», Україна (Затверджена наказом МОЗ № 528 від 29.07.2014, реєстраційне посвідчення UA/5819/01/01). 10. Заявка на патент Європейської патентної організації ЕР 2241310 А2; МПК А61K 9/20 (2006.01), А61K 9/28 (2006.01), А61K 31/44 (2006.01); Modified Release Formulations of Emoxypine / заявник: Sanovel Ilас Sanayi ve Ticaret A.S.; подано 16.04.2010, опубл. 20.10.2010, бюл. 2010/42. 11. Патент Російської Федерації на винахід RU 2519723; МПК А61К 31/732 (2006.01), А61K 31/734 (2006.01), А61K 31/74 (2006.01), А61K 9/22 (2006.01); Композиция для приготовления обладающей пролонгированным действием лекарственной формы / патентовласник: ООО «Колетекс». - № 2012144920/15, заявл. 23.10.2012, опубл. 20.06.2014, бюл. № 17. 12. Патент України на винахід UA 57476; МПК C07D 413/12 (2006.01); Спосіб одержання морфолінію 3-метил-1,2,4-триазоліл-5-тіоацетату / патентовласник: ТОВ «Науково-виробниче об'єднання «Фарматрон», Інститут монокристалів НАН України. - № 2002108557, заявл. 29.10.2002, опубл. 17.01.2005, бюл. № 1. 13. Патент України на винахід UA 96137; МПК А61K 9/22 (2006.01), А61K 9/48 (2006.01), А61K 9/26 (2006.01), А61K 9/30 (2006.01), А61K 31/4425 (2006.01), А61K 47/38 (2006.01), А61Р 9/00 (2011.01), А61Р 25/28 (2006.01); Лікарська форма з модифікованим вивільненням 3гідрокси-6-метил-2-етилпіридину сукцинату (мексидол) та спосіб її виготовлення / патентовласник: ТОВ «Науково-виробнича фірма «Мікрохім». - № а200805779, заявл. 05.05.2008, опубл. 10.10.2011, бюл. № 19. 14. Патент України на винахід UA 100355; МПК C07D 413/12 (2006.01), C07D 249/12 (2006.01), C07D 295/037 (2006.01), C07D 403/12 (2006.01); Спосіб отримання морфолінію 3метил-1,2,4-триазоліл-5-тіоацетату / патентовласник: ТОВ «Науково-виробниче об'єднання «Фарматрон». - № а201211317, заявл. 01.10.2012, опубл. 10.12.2012, бюл. № 23. 15. Патент України на винахід UA 102809; МПК C07D 249/12 (2006.01), C07D 295/037 (2006.01), C07D 413/02 (2006.01); Спосіб отримання морфолінію 3-метил-1,2,4-триазоліл-5тіоацетату / патентовласник: ПАТ «Київмедпрепарат», АТВТ «Галичфарм». - № а201302144, заявл. 20.02.2013, опубл. 12.08.2013, бюл. № 15. 23 UA 111566 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 1. Фармацевтична композиція пролонгованого вивільнення, що містить активний інгредієнт та щонайменше один полімерний матрицеутворюючий агент, вибраний з поліетиленоксиду з молекулярною вагою в діапазоні від 100000 до 10000000 дальтон та гідроксипропілметилцелюлоз з номінальною в'язкістю в діапазоні від 3 до 100000 mPa·s, в комбінації з однією або більше фармацевтично прийнятними допоміжними речовинами, яка відрізняється тим, що активний інгредієнт представлений морфолінієвою сіллю тіазотної кислоти з розміром частинок не більше 500 мкм, а активний інгредієнт та матрицеутворюючий полімер містяться у співвідношенні 1:0,2-1,9. 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що активний інгредієнт та матрицеутворюючий полімер містяться у співвідношенні 1:0,4-1,6. 3. Фармацевтична композиція за пп. 1-2, яка відрізняється тим, що містить морфолінієву сіль тіазотної кислоти з розміром частинок не більше 100 мкм. 4. Фармацевтична композиція за будь-яким з пп. 1-3, яка відрізняється тим, що містить: і) 30-60 % за вагою морфолінієвої солі тіазотної кислоти; іі) 15-65 % за вагою щонайменше одного матрицеутворюючого полімеру, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз; ііі) 0,25-5 % за вагою змащувальних агентів або лубрикантів; iv) 0,1-1 % за вагою агентів, що покращують текучість, або глідантів; v) 2-15 % за вагою додаткових наповнювачів відносно загальної ваги композиції. 5. Фармацевтична композиція за будь-яким з пп. 1-4, яка відрізняється тим, що містить: і) 40-50 % за вагою морфолінієвої солі тіазотної кислоти; іі) 30-60 % за вагою щонайменше одного матрицеутворюючого полімеру, вибраного з поліетиленоксиду та гідроксипропілметилцелюлоз; ііі) 0,25-2 % за вагою змащувальних агентів або лубрикантів; iv) 0,1-0,5 % за вагою агентів, що покращують текучість, або глідантів; v) 2-5 % за вагою додаткових наповнювачів відносно загальної ваги композиції. 6. Фармацевтична композиція за будь-яким з пп. 1-5, яка відрізняється тим, що містить: і) 46,34 % за вагою морфолінієвої солі тіазотної кислоти; іі) 50 % за вагою поліетиленоксиду; ііі) 0,5 % за вагою магнію стеарату; iv) 0,2 % за вагою кремнію діоксиду колоїдного безводного; v) 2,96 % за вагою целюлози мікрокристалічної відносно загальної ваги композиції. 7. Фармацевтична композиція за будь-яким з пп. 1-6, яка відрізняється тим, що додатково містить суміш для плівкового покриття. 8. Фармацевтична композиція за будь-яким з пп. 1-7, яка відрізняється тим, що представлена у формі таблеток чи таблеток з плівковим покриттям. 9. Фармацевтична композиція за п. 8, яка відрізняється тим, що кожна таблетка містить від 340 мг до 420 мг морфолінієвої солі тіазотної кислоти, більш переважно від 370 мг до 390 мг. 10. Фармацевтична композиція за будь-яким з пп. 8-9, яка відрізняється тим, що кожна таблетка має вагу в діапазоні від 760 мг до 930 мг, більш переважно від 835 мг до 855 мг. 11. Фармацевтична композиція за будь-яким з пп. 8-10, яка відрізняється тим, що стираність таблеток-ядер (без оболонки) складає не більше 1 %, переважно не більше 0,1 %, ще більш переважно не більше 0,05 %. 12. Фармацевтична композиція за будь-яким з пп. 8-11, яка відрізняється тим, що стійкість до роздавлювання таблеток-ядер (без оболонки) знаходиться в діапазоні від 200 до 320 ньютонів, більш переважно від 230 до 295 ньютонів. 13. Фармацевтична композиція за будь-яким з пп. 8-12, яка відрізняється тим, що таблетки мають наступні параметри in vitro розчинення морфолінієвої солі тіазотної кислоти: і) у воді: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; іі) в буферному розчині з рН 1,2: 24 UA 111566 C2 5 10 15 20 25 30 - вивільнення від 15 до35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; ііі) в буферному розчині з рН 4,5: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження; iv) в буферному розчині з рН 6,8: - вивільнення від 15 до 35 % морфолінієвої солі тіазотної кислоти за 1 годину після початку дослідження; - вивільнення від 45 до 65 % морфолінієвої солі тіазотної кислоти за 3 години після початку дослідження; - вивільнення більше, ніж або яке дорівнює 80 % морфолінієвої солі тіазотної кислоти за 8 годин після початку дослідження. 14. Фармацевтична композиція за будь-яким з пп. 8-13, яка відрізняється тим, що таблетки характеризуються щонайменше одним з наступних фармакокінетичних параметрів in vivo або їх комбінацією: - площа під фармакокінетичною кривою "концентрація-час" в плазмі від нуля до нескінченності (AUC0-∞): від 5500 до 17500 нг·год./мл у випадку прийому натщесерце та від 8400 до 17300 нг·год./мл у випадку прийому після їжі; - максимальне значення концентрації в плазмі (Сmах): від 700 до 2250 нг/мл у випадку прийому натщесерце та від 550 до 1900 нг/мл у випадку прийому після їжі; - час досягнення максимальної концентрації в плазмі (Т mах): від 2 до 7 годин у випадку прийому натщесерце та від 3 до 7 годин у випадку прийому після їжі; - період напіввиведення (t1/2): від 3 до 21,5 годин у випадку прийому натщесерце та від 3,5 до 19 годин у випадку прийому після їжі. 25 UA 111566 C2 26 UA 111566 C2 27 UA 111566 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition of extended release of morpholinium [(5-methyl-1h-1,2,4-triasol-3-yl)thio]acetate
Автори англійськоюSapsai Iryna Vitaliivna, Hlumenko Olena Mykolaivna, Kravchuk Zhanna Mykolaivna, Shvedskyi Serhii Olehovych
Назва патенту російськоюФармацевтическая композиция пролонгированного высвобождения морфолиния 5-метил-1н-1,2,4-триазол-3-ил)тио]ацетата
Автори російськоюСапсай Ирина Витальевна, Глуменко Елена Николаевна, Кравчук Жанна Николаевна, Шведский Сергей Олегович
МПК / Мітки
МПК: A61P 9/10, A61K 9/26, A61K 31/4196
Мітки: фармацевтична, пролонгованого, 5-метил-1н-1,2,4-триазол-3-іл)тіо]ацетату, морфолінію, вивільнення, композиція
Код посилання
<a href="https://ua.patents.su/31-111566-farmacevtichna-kompoziciya-prolongovanogo-vivilnennya-morfoliniyu-5-metil-1n-124-triazol-3-iltioacetatu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція пролонгованого вивільнення морфолінію [(5-метил-1н-1,2,4-триазол-3-іл)тіо]ацетату</a>
Попередній патент: Спосіб виробництва деревної плити, забезпеченої декоративним шаром
Наступний патент: Пристрій для вибору оптимальних рішень
Випадковий патент: Спосіб виготовлення тиглів, посудин, труб та профільованих виробів з тугоплавких матеріалів з монокристалічною, полікристалічною та певною структурою