Металопротеїназні олігопептиди та їх терапевтичне застосування
Номер патенту: 111840
Опубліковано: 24.06.2016
Автори: Рат Маттіас, Румі Вахід М., Нєдзвєцкі Александра
Формула / Реферат
1. Спосіб одержання фармацевтичної композиції, що включає:
ідентифікацію олігопептидної послідовності для матриксної металопротеїнази, експресованої при конкретному захворюванні, при цьому олігопептидна послідовність матриксної металопротеїнази являє собою щонайменше одну з SEQ ID NO: 2-21 та їх комбінацію, та при цьому конкретне захворювання являє собою щонайменше одне з новоутворень, особливо раку, запальної хвороби, хвороби коронарних артерій, оклюзійного серцево-судинного захворювання, дегенеративного захворювання та інфекційного захворювання;
синтезування ідентифікованої олігопептидної послідовності для матриксної металопротеїнази;
складання терапевтично ефективної кількості лікувальної композиції з використанням ідентифікованої олігопептидної послідовності матриксної металопротеїнази; та
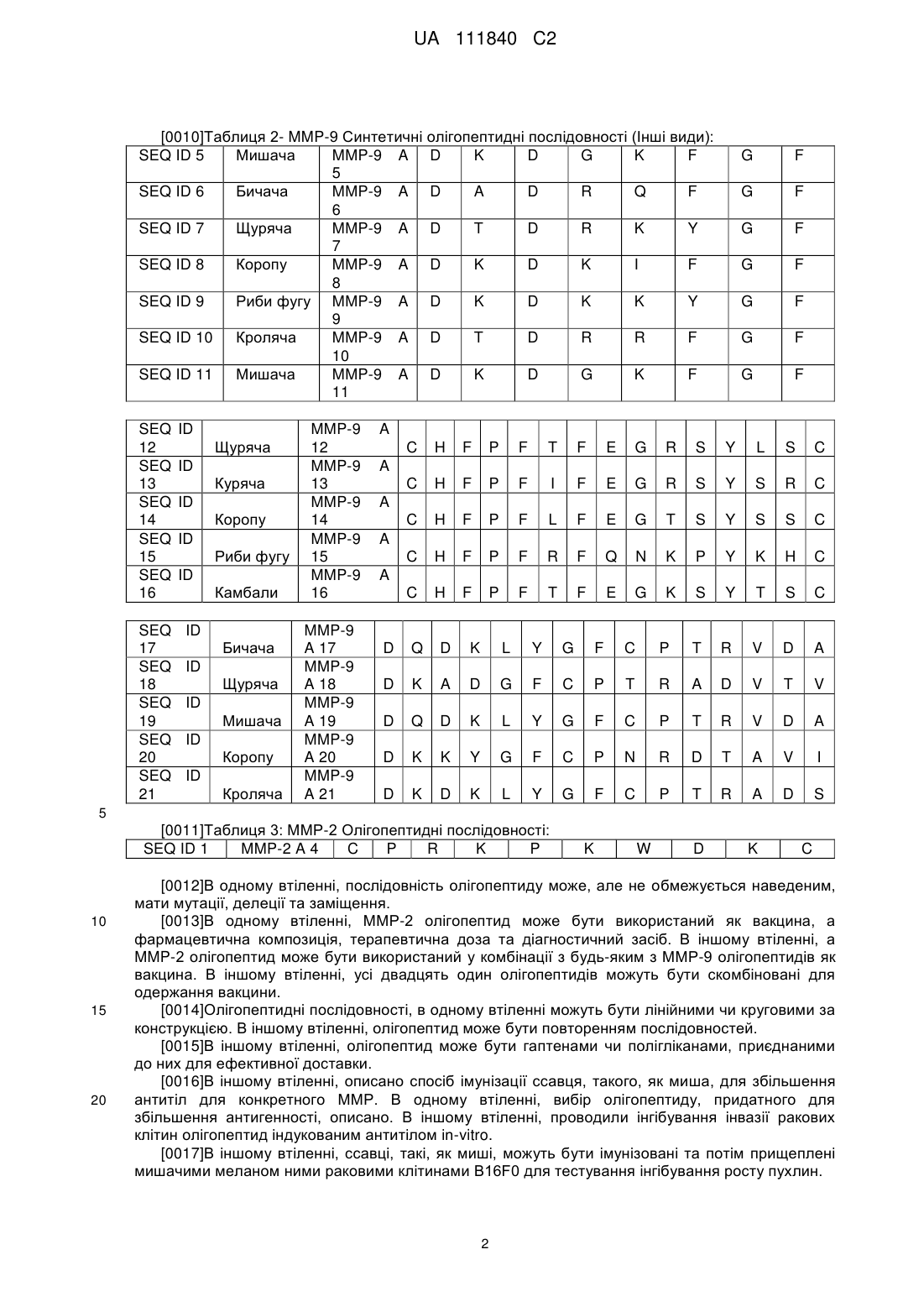
одержання фармацевтичної композиції шляхом використання лікувальної композиції для лікування ссавця, що має конкретне захворювання, яке проявляє надлишкову експресію матриксної металопротеїнази.
2. Спосіб за п. 1, який відрізняється тим, що олігопептидна послідовність матриксної металопротеїнази являє собою щонайменше одну з SEQ ID NO: 2-4.
3. Спосіб за п. 1 або 2, який відрізняється тим, що фармацевтична композиція являє собою вакцину.
4. Спосіб за одним з попередніх пунктів, який відрізняється тим, що фармацевтична композиція має бути введена із застосуванням щонайменше одного з неінвазивної пероральної, місцевої, ентеральної, трансмукозальної, направленої доставки, доставки уповільненого вивільнення та парентерального способу.
5. Фармацевтична композиція, що містить:
матриксний металопротеїназний олігопептид, де матриксний металопротеїназний олігопептид являє собою щонайменше одну з SEQ ID NO: 2-21 та їх комбінацію, особливо щонайменше одну з SEQ ID NO: 2-4; та
фармацевтично прийнятний ексципієнт.
6. Фармацевтична композиція за п. 5, що додатково містить:
ад'ювант,
добавку для підвищення хімічної стабільності,
фосфатний буферний сольовий розчин, та
гаптен для підвищення іммуногенності композиції.
7. Фармацевтична композиція за п. 5 або 6, яка відрізняється тим, що матриксний металопротеїназний олігопептид має щонайменше одну з лінійної та кругової форм.
8. Спосіб одержання фармацевтичного препарату, що включає:
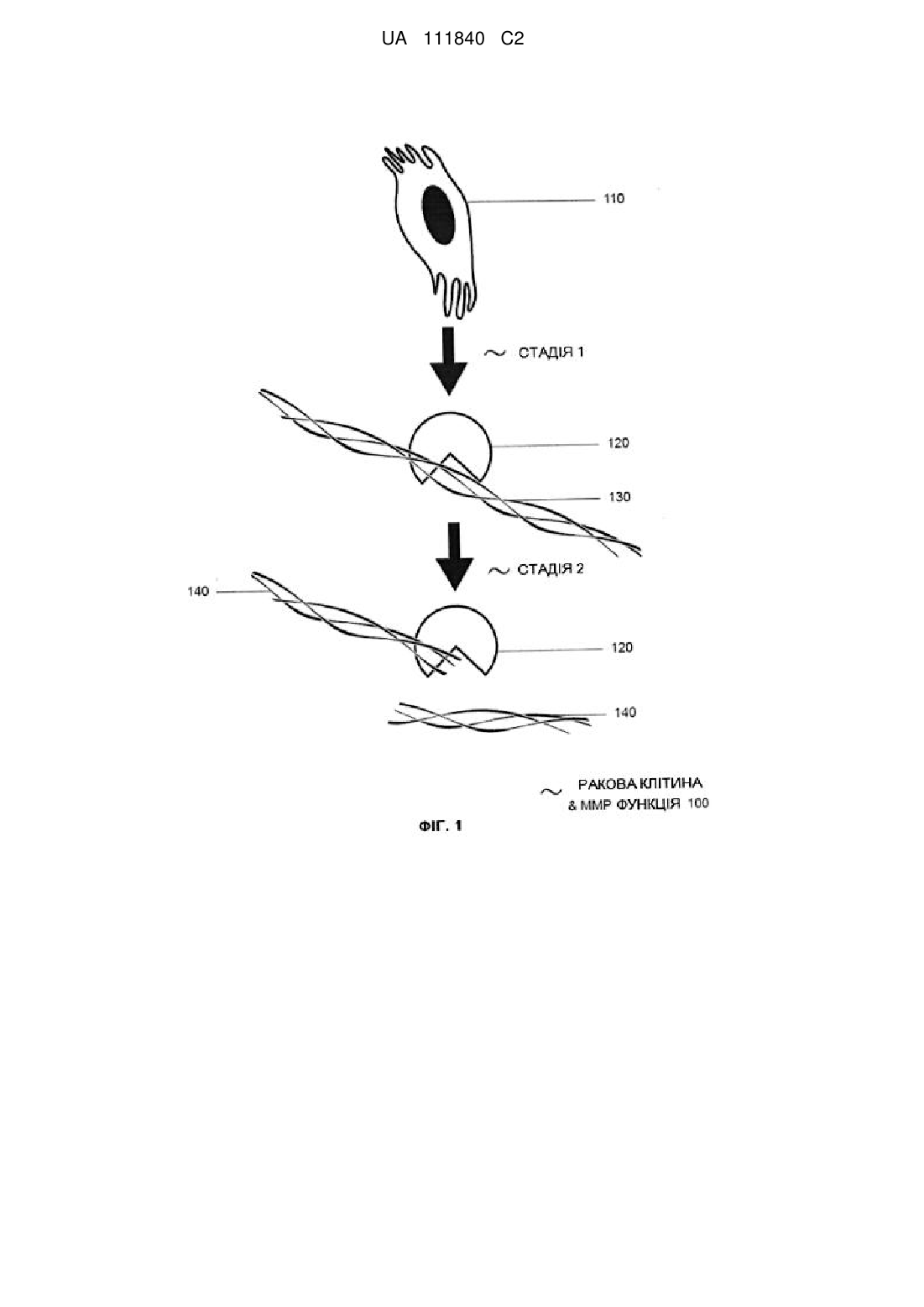
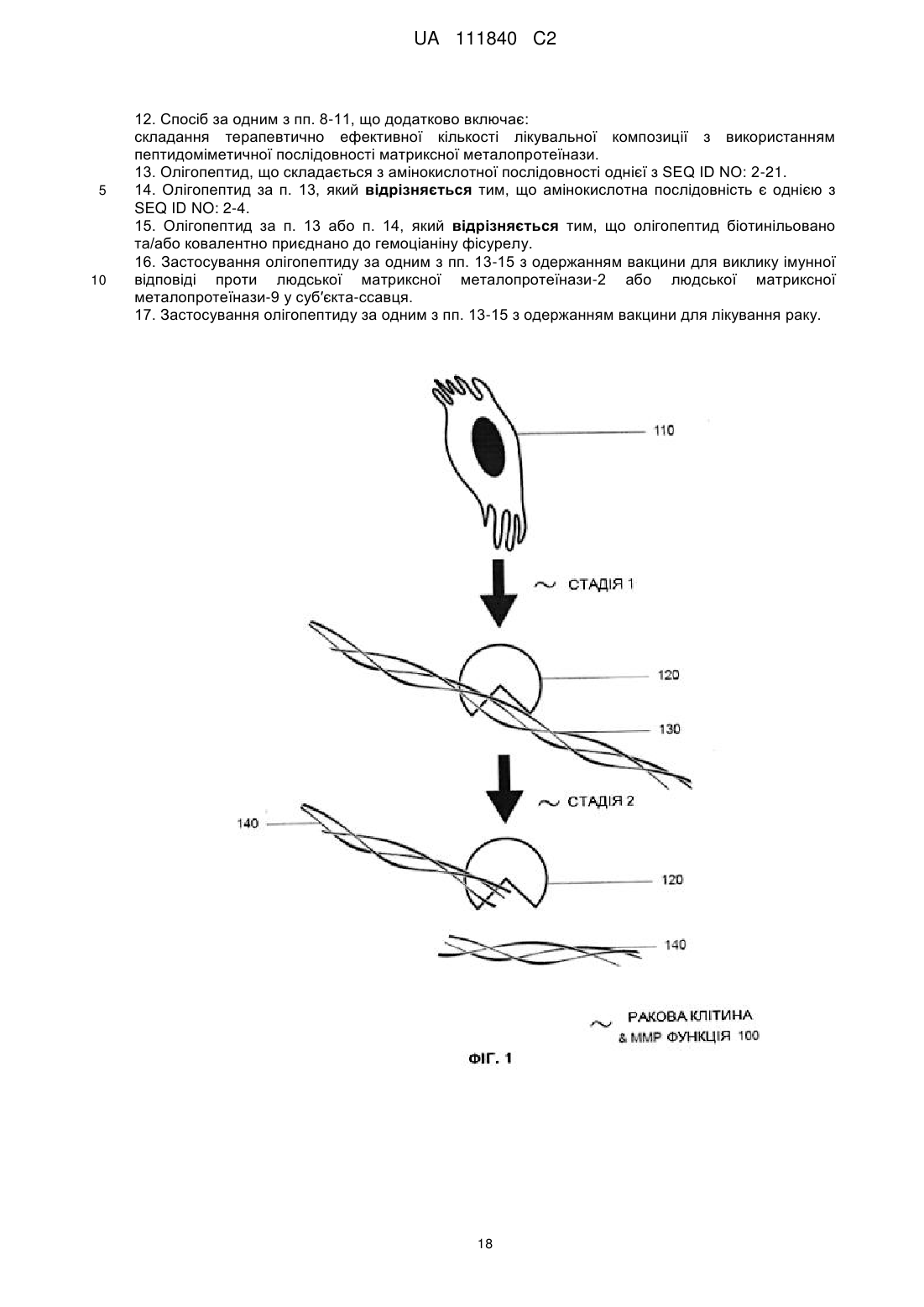
ex vivo вимірювання рівня експресії матриксної металопротеїнази у конкретних видів, що мають конкретні захворювання, при цьому олігопептидна послідовність матриксної металопротеїнази являє собою щонайменше одну з SEQ ID NO: 2-21 та їх комбінацію, особливо щонайменше одну з SEQ ID NO: 2-4, та при цьому конкретне захворювання являє собою щонайменше одне з новоутворень, особливо раку, запальної хвороби, хвороби коронарних артерій, оклюзійного серцево-судинного захворювання, дегенеративного захворювання та інфекційного захворювання;
ідентифікацію олігопептидної послідовності для матриксної металопротеїнази при конкретному захворюванні для визначення композиції для лікування;
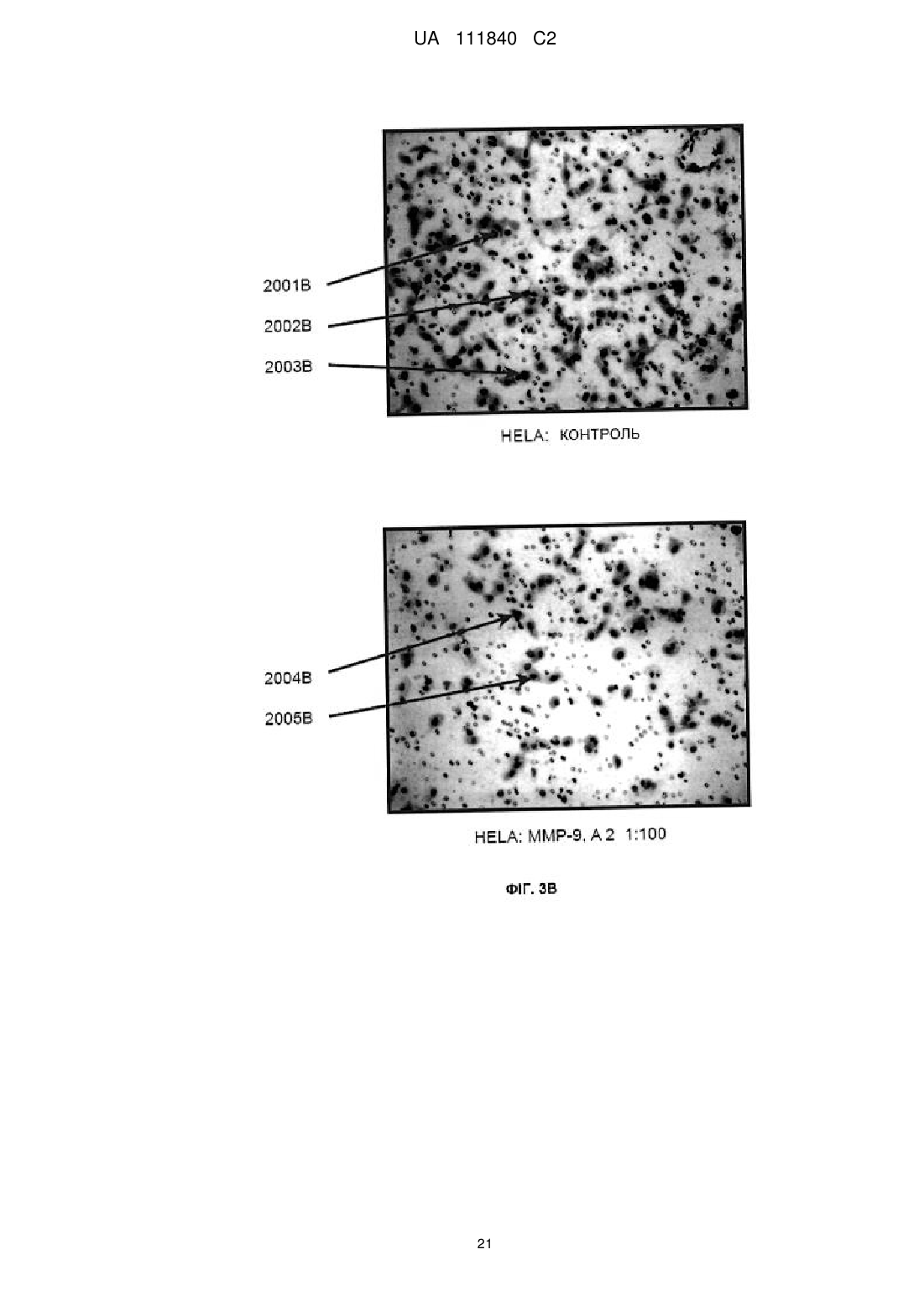
синтезування ідентифікованої олігопептидної послідовності матриксної металопротеїнази,
складання лікувальної композиції для одержання терапевтично ефективної кількості олігопептидної послідовності матриксної металопротеїнази; та
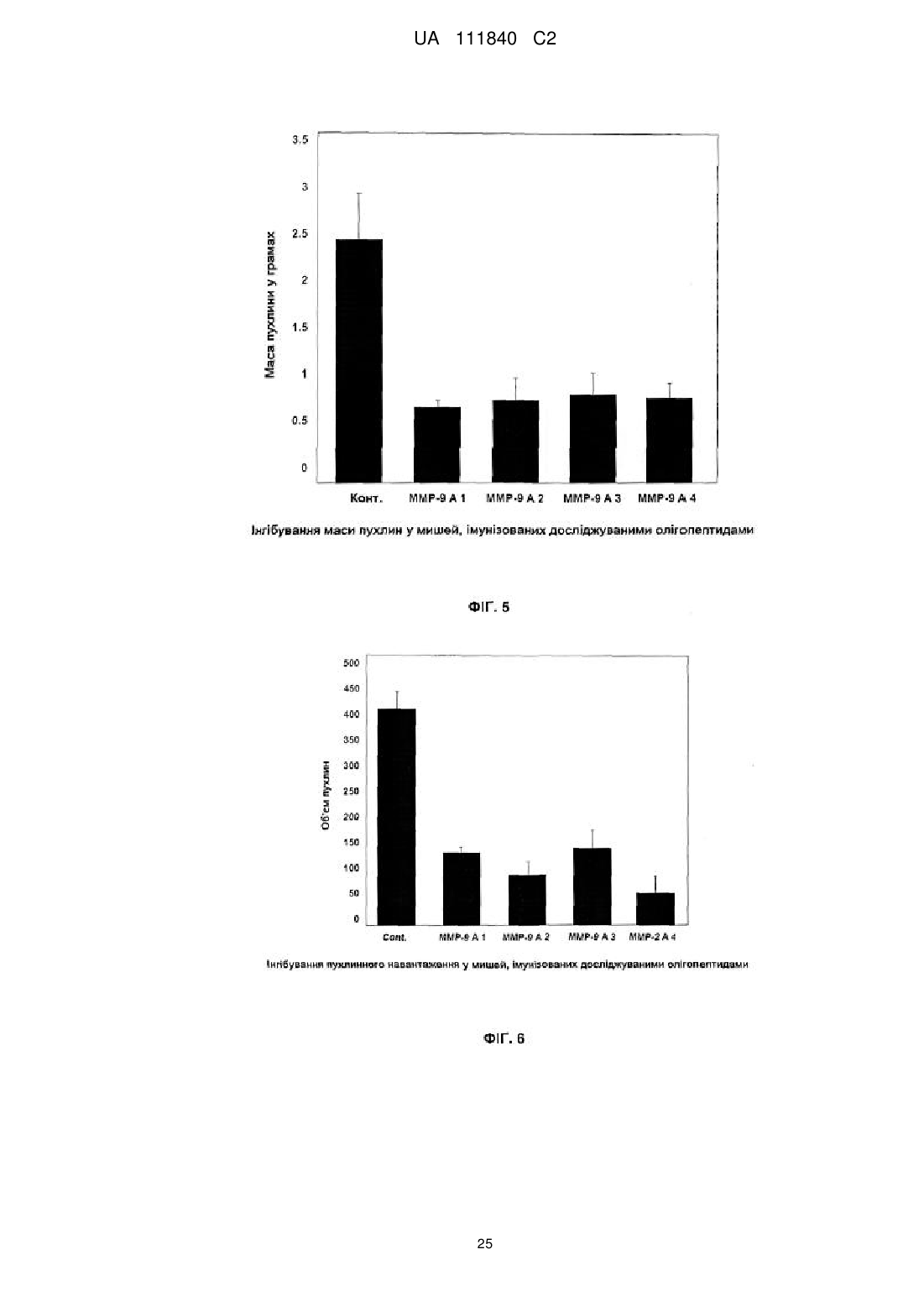
одержання фармацевтичного препарату з використанням лікувальної композиції для впорскування лікувальної композиції як вакцини конкретним видам для лікування конкретного захворювання, що має надлишкову експресію матриксної металопротеїнази.
9. Спосіб за п. 8, який відрізняється тим, що конкретні види являють собою щонайменше одного зі ссавців та не ссавців.
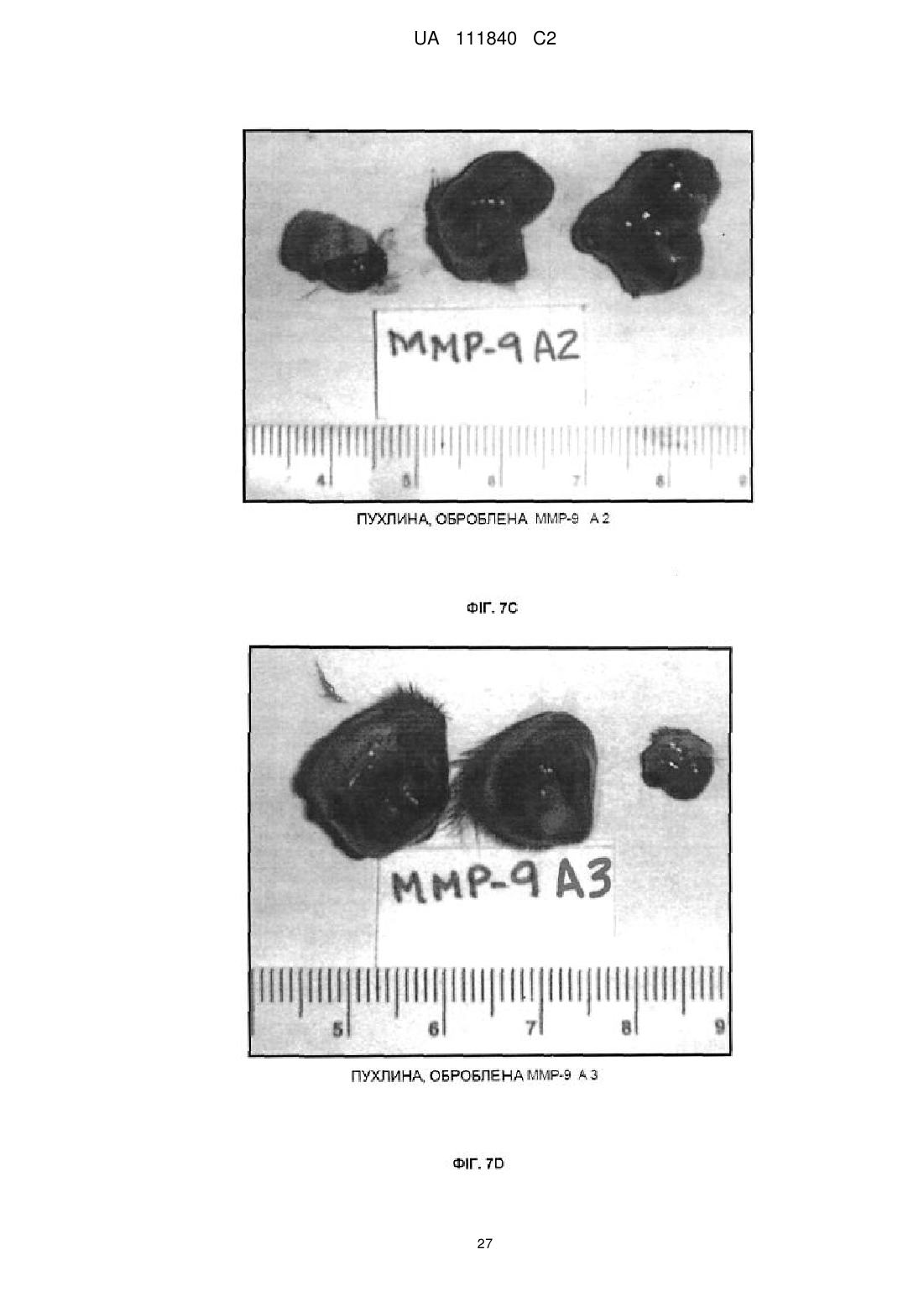
10. Спосіб за п. 8 або п. 9, який відрізняється тим, що фармацевтичний препарат має бути впорскнутий безпосередньо у пухлину.
11. Спосіб за одним з пп. 8-10, що додатково включає:
сполучення послідовності матриксної металопротеїнази з гаптеном для підсилення імунної відповіді як вакцини.
12. Спосіб за одним з пп. 8-11, що додатково включає:
складання терапевтично ефективної кількості лікувальної композиції з використанням пептидоміметичної послідовності матриксної металопротеїнази.
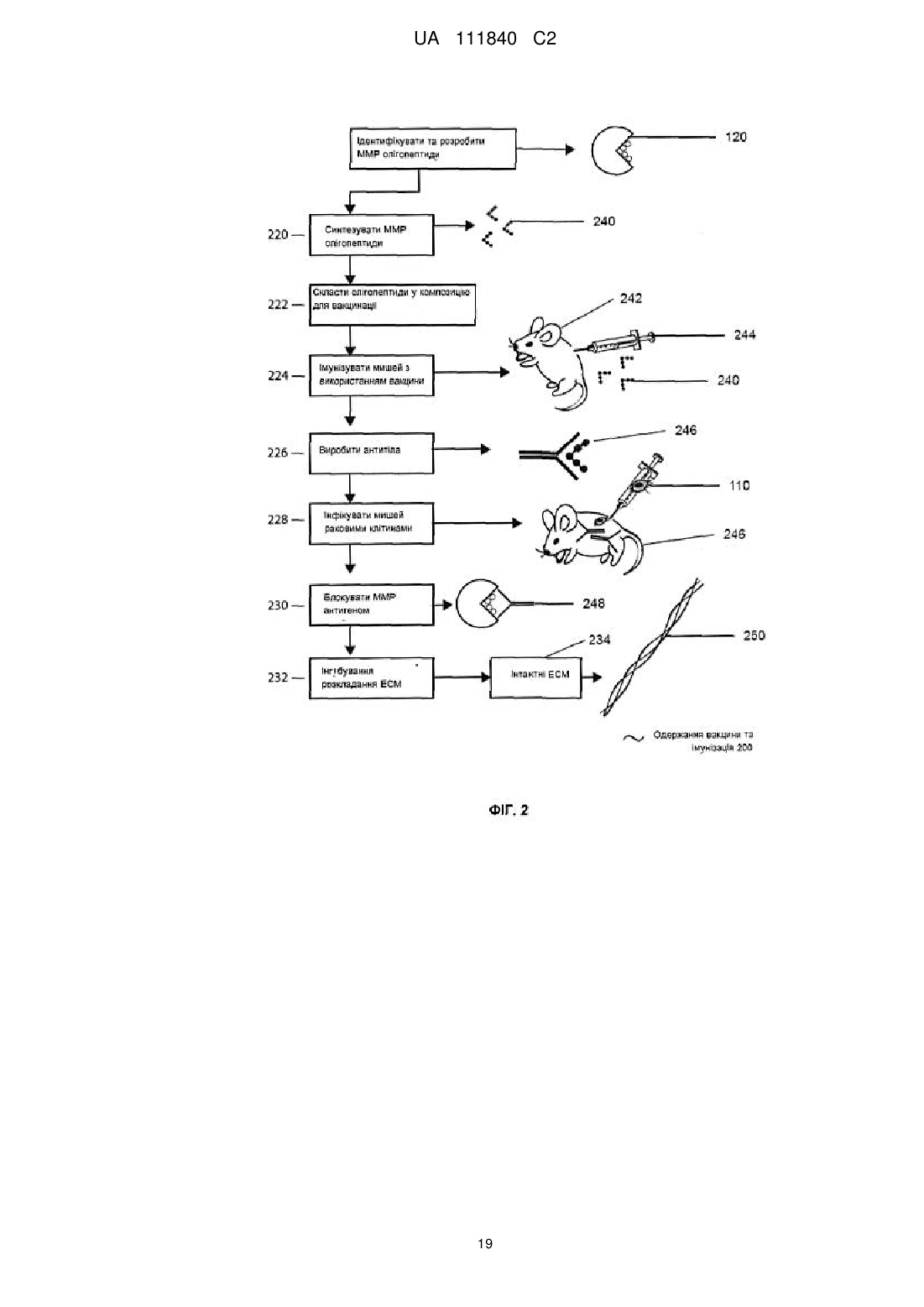
13. Олігопептид, що складається з амінокислотної послідовності однієї з SEQ ID NO: 2-21.
14. Олігопептид за п. 13, який відрізняється тим, що амінокислотна послідовність є однією з SEQ ID NO: 2-4.
15. Олігопептид за п. 13 або п. 14, який відрізняється тим, що олігопептид біотинільовано та/або ковалентно приєднано до гемоціаніну фісурелу.
16. Застосування олігопептиду за одним з пп. 13-15 з одержанням вакцини для виклику імунної відповіді проти людської матриксної металопротеїнази-2 або людської матриксної металопротеїнази-9 у суб′єкта-ссавця.
17. Застосування олігопептиду за одним з пп. 13-15 з одержанням вакцини для лікування раку.
Текст
Реферат: Винахід належить до способу одержання фармацевтичної композиції, що включає ідентифікацію олігопептидної послідовності для матриксної металопротеїнази, експресованої при захворюванні, вибраному з групи новоутворень, особливо раку, запальної хвороби, хвороби коронарних артерій, оклюзійного серцево-судинного захворювання, дегенеративного захворювання та інфекційного захворювання. Також винахід належить до фармацевтичного препарату, що включає заявлену композицію, та самого олігопептиду, та його застосування для одержання вакцини. UA 111840 C2 (12) UA 111840 C2 UA 111840 C2 5 10 15 20 25 30 35 40 ПЕРЕХРЕСНЕ ПОСИЛАННЯ НА РОДИННУ ЗАЯВКУ [0001]Дана заявка заявкою, що частково продовжує, та заявляє пріоритет заявки США го 13/012769, поданої 24 січня 2011 р., що розглядається одночасно. Опис цієї заявки цим включено повністю шляхом посилання для усіх її доктрин. Ця заявка містить перелік послідовностей, що був наданий як ASCII файл під назвою RIPLLC018003CIP1sequence_ST25, дата створення 7/5/2011, та розмір тексту ASCII у байтах становить 6 kb. ГАЛУЗЬ ВИНАХОДУ [0002]Даний винахід загалом відноситься до розробки та синтезу нових металопротеїназних олігопептидних послідовностей для застосування як терапевтичних агентів для лікування захворювань, пов’язаних з позаклітинним матриксом. Більш конкретно, даний винахід відноситься до застосування металопротеїназного олігопептиду різних видів як вакцини, фармацевтичної композиції, терапевтичної дози та як засобу діагностики для лікування раку. РІВЕНЬ ТЕХНІКИ [0003]Матриксні металопротеїнази являють собою сімейство цинк-залежних нейтральних ендопептидаз, що відіграють важливу роль в пухлинному ангіогенезі, реструктуризації тканини та міграції клітин. При раку, рівні деяких MMP’s ненормально підвищені, що дозволяє раковим клітинам розкладати позаклітинний матрикс (ECM), проходити у судинну базальну мембрану та давати метастази у віддалені сайти. Велика кількість патологічних станів пов'язана з підвищеною активністю металопротеїназ (MMP's), зокрема MMP-2 та MMP-9. Ці протеази здатні дигестувати колаген та інші білки позаклітинного матриксу (ECM) як попередній стан для розповсюдження хвороби. Таким чином, існує необхідність у терапевтичному агенті для ефективного блокування цих MMP’s від дигестування ECM, таким чином блокуючи розповсюдження раку та інших хвороб. [0004]Профілактика та лікування метастазів являє собою основну проблему у терапії раку на сьогодні. Доступне на даний час лікування є токсичним неспецифічним та непередбаченим для хвороб, на які дії білок ECM. Існує необхідність у терапевтичному агенті для ефективного блокування молекул MMP від дігестування ECM, таким чином попереджаючи розкладання ECM та розповсюдження хвороб. СТИСЛИЙ ОПИС ВИНАХОДУ [0005]Ця заявка розкриває послідовність та композицію MMP олігопептиду та спосіб застосування MMP олігопептиду як вакцини, фармацевтичної композиції, терапевтичної дози та діагностичного засобу для лікування пов’язаних з ECM хвороб. [0006]В одному втіленні, олігопептидні аналоги MMP-9 та MMP-2 послідовностей розробляли та синтезували. В іншому втіленні, ці олігопептиди аналізували на їх здатність інгібувати інвазію ракових клітин in-vitro з використанням специфічних клітинних ліній. [0007]В іншому втіленні, олігопептидні аналоги MMP-9 MMP-2 аналізували на їх ефективність щодо пригнічення росту пухлин in-vivo у мишей. [0008]В одному втіленні, такі олігопептидні послідовності використовували для одержання вакцини. В іншому втіленні, лікувальна доза може бути розроблена для особи, що страждає від раку, та містить SEQ ID 1-21 аналоги синтетичного олігопептиду. [0009]Таблиця 1- MMP- 9 Синтетичні олігопептидні послідовності (Людські): SEQ ID 2 MMP-9 C H F P F I F E G R S Y S A C A1 SEQ ID 3 MMP-9 D T D D R F G F A2 SEQ ID 4 MMP-9 D R D K L F G F C P T R A D S A3 1 UA 111840 C2 [0010]Таблиця 2- MMP-9 Синтетичні олігопептидні послідовності (Інші види): SEQ ID 5 Мишача MMP-9 A D K D G K F 5 SEQ ID 6 Бичача MMP-9 A D A D R Q F 6 SEQ ID 7 Щуряча MMP-9 A D T D R K Y 7 SEQ ID 8 Коропу MMP-9 A D K D K I F 8 SEQ ID 9 Риби фугу MMP-9 A D K D K K Y 9 SEQ ID 10 Кроляча MMP-9 A D T D R R F 10 SEQ ID 11 Мишача MMP-9 A D K D G K F 11 SEQ 12 SEQ 13 SEQ 14 SEQ 15 SEQ 16 SEQ 17 SEQ 18 SEQ 19 SEQ 20 SEQ 21 ID Щуряча ID Куряча ID Коропу ID Риби фугу ID Камбали ID Бичача ID Щуряча ID Мишача ID Коропу ID Кроляча MMP-9 12 MMP-9 13 MMP-9 14 MMP-9 15 MMP-9 16 MMP-9 A 17 MMP-9 A 18 MMP-9 A 19 MMP-9 A 20 MMP-9 A 21 G F G F G F G F G F G F G F A C H F P F T F E G R S Y L S C C H F P F I F E G R S Y S R C C H F P F L F E G T S Y S S C C H F P F R F Q N K P Y K H C C H F P F T F E G K S Y T S C A A A A D Q D K L Y G F C P T R V D A D K A D G F C P T R A D V T V D Q D K L Y G F C P T R V D A D K K Y G F C P N R D T A V I D K D K L Y G F C P T R A D S 5 [0011]Таблиця 3: MMP-2 Олігопептидні послідовності: SEQ ID 1 MMP-2 A 4 C P R K P 10 15 20 K W D K C [0012]В одному втіленні, послідовність олігопептиду може, але не обмежується наведеним, мати мутації, делеції та заміщення. [0013]В одному втіленні, MMP-2 олігопептид може бути використаний як вакцина, a фармацевтична композиція, терапевтична доза та діагностичний засіб. В іншому втіленні, a MMP-2 олігопептид може бути використаний у комбінації з будь-яким з MMP-9 олігопептидів як вакцина. В іншому втіленні, усі двадцять один олігопептидів можуть бути скомбіновані для одержання вакцини. [0014]Олігопептидні послідовності, в одному втіленні можуть бути лінійними чи круговими за конструкцією. В іншому втіленні, олігопептид може бути повторенням послідовностей. [0015]В іншому втіленні, олігопептид може бути гаптенами чи полігліканами, приєднаними до них для ефективної доставки. [0016]В іншому втіленні, описано спосіб імунізації ссавця, такого, як миша, для збільшення антитіл для конкретного MMP. В одному втіленні, вибір олігопептиду, придатного для збільшення антигенності, описано. В іншому втіленні, проводили інгібування інвазії ракових клітин олігопептид індукованим антитілом in-vitro. [0017]В іншому втіленні, ссавці, такі, як миші, можуть бути імунізовані та потім прищеплені мишачими меланом ними раковими клітинами B16F0 для тестування інгібування росту пухлин. 2 UA 111840 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0018]В одному втіленні, імунізація ссавців може не обмежуватися раком, але може включати усе лікування на основі розкладання ECM. В іншому втіленні, вакцинація може бути проведена однократно або повторно шляхом вимірювання антитіл, специфічних до олігопептиду, який вприскували. В одному втіленні, специфічні види можуть бути ссавцеві та/або не ссавцеві. [0019]В одному втіленні, композиція олігопептиду як вакцина та лікувальна доза містить олігопептиди, що містять SEQ ID 1-21 окремо чи їх комбінацію. [0020]В одному втіленні, терапевтично ефективна кількість може бути надана, не обмежуючись цим, шляхом вприскування. Інші втілення можуть включати пероральні, місцеві, трансмукозальні, інгаляційні композиції та композиції направленої доставки та уповільненого вивільнення. Лікувальна доза може містити терапевтично ефективні та фармацевтично прийнятні комбінації. [0021]Композиція, спосіб та лікування, описані у цій заявці, можуть бути втілені будь-якими засобами для досягнення різних аспектів та можуть бути виконані у формі, придатній для ссавця. Інші ознаки будуть очевидними з креслень, що додаються, та з детального опису, що наведено нижче. СТИСЛИЙ ОПИС КРЕСЛЕНЬ [0022]Приклади втілень проілюстровано шляхом прикладу, а не обмеження фігур на кресленнях, що додаються, на яких подібні посилання вказують на подібні елементи, та на яких: [0023]Фігура 1 ілюструє рівень техніки MMP’s дигестування ECM під час хворобливого стану. [0024]Фігура 2 являє собою спосіб лікування ссавця із застосуванням вакцини. [0025]Фігура 3 A-D демонструє вигляд експерименту інвазії Matrigel HeLa контрольні клітини, а також HeLa ракові клітини шийки матки та вплив іммунної сироватки з матриксного металопротеїназного олігопептиду MMP-9 A 1-3 та MMP-2 A 4. [0026]Фігура 4 ілюструє масу миші перед та після лікування. [0027]Фігура 5 ілюструє вплив імунізації з використанням матриксної металопептидази MMP9 A1-3 та MMP-2 A 4 на інгібування росту4 пухлин лінії клітин меланоми B16FO ксенотрансплантата у самців C57BL/6 мишей. [0028]Фігура 6 являє собою зображення одержаної в результаті маси пухлинного навантаження (довжина та ширина) на самцях C57BL/6 мишей перед та після лікування ксенотрансплантатом меланоми. [0029]Фігура 7 A-E являє собою зображення росту пухлин при контрольному та пухлинному інгібуванні у імунізованих мишей. [0030]Фігура 8 демонструє зображення сайтів зв’язування для різних пептидоміметиків у MMP молекулі. [0031]Інші ознаки даних втілень будуть очевидними з креслень, що додаються, та з детального опису, наведеного нижче. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ [0032]Декілька послідовностей та способів імунізації, лікування та зменшення розміру пухлини з використанням матриксного металопротеїназного олігопептиду як вакцини описані у цій заявці. Хоча ці втілення були описані з посиланням на конкретні приклади втілень, буде очевидно, що різні модифікації та зміни можуть бути виконані для таких втілень, не виходячи за більш широку суть та обсяг різних втілень. [0033]Ракові клітини продукують вищі рівні матриксних металопротеїназ (MMP's), зокрема MMP-9 та MMP-9. Ці ферменти здатні дигестувати з'єднувальні тканини позаклітинного матриксу (ECM) навколо ракових клітин. MMP’s зв’язує ECM через специфічні сайти зв’язування. Блокування цих сайтів зв’язування у MMP’s попереджує зв’язування MMP’s з ECM. Інгібування ECM розпаду попереджає прогресію раку та зменшує розмір пухлин. У даному винаході було ідентифіковано декілька потенційних сайтів зв’язування у MMP-9 та MMP-2. Фігура 1 описує ракові клітини 110 що продукують MMP's 120 (стадія 1). MMP's 120 зв’язує специфічні сайти зв’язування при ECM 130 (стадія 2). Стадія 3 на фігурі 1 демонструє MMP's 120 дигестування ECM 140. [0034]Фігура 2 пояснює даний винахід на стадіях продукування вакцини та імунізації 200. Ідентифікацію та конструювання MMP's проводили 210 з використанням MMP послідовностей. Олігопептиди синтезовані 220 та представляли синтетичними олігопептидами 240. Олігопептиди композиції для вакцинації являють собою 222. Антитіла продукуються так, як показано на 226. Мишей 242 імунізовали 224 з використанням вакцини шприцем 240. Олігопептиди можуть бути конкретної довжини. Деякі перестановки та комбінації послідовностей були проаналізовані. Даний винахід описує послідовності, показані у параграфі [0008] як MMP-9 A1-3 та 5-21 та MMP-2 A 4. Перед відбором цих двадцяти однієї послідовності 3 UA 111840 C2 5 10 15 20 25 30 35 40 45 50 як потенційних олігопептидів, було ідентифіковано декілька потенційних сайтів зв’язування MMP-9 та MMP-2. Усього вісім олігопептидів було синтезовано та проаналізовано з використанням клітинної лінії фібросаркоми HT-1080 та клітинної лінії раку шийки матки DoTC-2. Тільки вибрані послідовності були відібрані для додаткового експерименту. MMP-9 A1-3 та 5-21 та MMP-2 A 4 синтезували у лінійному та круговому форматі. Багато модифікацій для цих послідовностей також проводили в одному втіленні. Модифікації являли собою заміщення одного чи більше амінокислотних залишків на N-кінці, C-кінці та обох C та N кінцях, заміщення амінокислотних залишків базувалося на однакових заряді та полярності, не враховуючи заряду та полярності, пропускаючи амінокислоти на C та N кінці, пропускаючи тільки на C- кінці та тільки на N- кінці. [0035]В іншому втіленні, заміщення та пропуск можуть бути проведені одночасно. Олігопептиди можуть бути додатково модифіковані шляхом повторення послідовностей та комбінації більш ніж однієї SEQ ID 1-3, 5-21 MMP-9 A1-3 та 5-21 та SEQ ID 1, MMP-2 A 4 для продукування та складання вакцини. Пептидоміметик для MMP’s може бути використаний для блокування сайту зв’язування надлишково експресованих MMP при специфічних хворобах. [0036]В одному втіленні, олігопептид може бути використаний як регулятор зворотного зв’язку для специфічного попередження чи зменшення швидкості синтезу MMP-9 та MMP-2 продукування на клітинному рівн. В одному втіленні процес блокування та інгібування ECM розпаду відбувається антигенами продукованими при вакцинації мишей. [0037]В іншому втіленні, синтезовані олігопептиди були біотинільовані на N-кінці з використанням двадцяти одного вугільного спейсера за допомогою Genscript (Pitcataway, NJ 08554 USA) та кон'югували з KLH білком. В експерименті, проведеному для мишей, тварин доставляли, імунізували, індукували в них пухлини та спостерігали ефективність лікування олігопептид-індукованою імунотерапією. [0038]Вприскування одержували з використанням 100 мкл l KLH кон'югованих біотинільованих пептидів та 100 мкл повного ад'юванта Фройнда (Sigma, St. Louis, MO). [0039]Самців C57BL/6 6-тижневих мишей 6 після народження придбавали у Simonsen Laboratories, Gilroy, CA та тримали у мікроізоляторних клітках в умовах без патогенів при 12годин світла/12 годин темряви розкладі протягом тижня. За усіма тваринами доглядали відповідно до формально встановленої інструкції щодо доглядання та використання експериментальних тварин. Після витримування протягом тижня, мишей (n=5/група) імунізували шляхом інтраперітонеального вприскування у день 0, та повного ад’юванта Фройнда (Sigma) у день 7, 14 та 28. Проби крові аналізували на імунну відповідь стандартним тестом Elisa з використанням пластин мікротитратора. Повторні вприскування синтетичних пептидів у мишей викликали імунну відповідь до специфічних окремих пептидів. Різні розведення випробували та приклади випробуваних розведень являють собою 1:100, 1:1000 та 1:10000. [0040]Кон'югація пептидів [0041]Усі SEQ ID 1-4 пептиди ковалентно кон'югували до білка гемоціаніна фісурелла (KLH). У типовому експерименті 1 мг пептиду, 4 мг KLH розчиняли у 5 мл 0,01 M NaHCO 3 та 2 мкл глутарового альдегіду та перемішували протягом усієї ночі. У кінці 100 мкл 1M гліцин етилового естера до фінальної концентрації 0,1 M та залишали на 30 хвилин при кімнатній температурі. Потім осаджували 4-5 об. холодного ацетону при -70 C протягом 30 хвилин. Потім швидко нагрівали при кімнатній температурі та гранулювали при 10,000g протягом 10 хвилин. Гранулу розчиняли в 1 мл 0,1M NaHCO3 та зберігали при -20° C. [0042]Аналіз анти пептидної імунної відповіді [0043]Пластини мікротитру покривали індивідуальним пептидом в 100 мкл/лунка 5 мкг в мM карбонатному буфер, pH 9,5 протягом 20 годин при 20° C. Після промивання, лунки інкубували послідовним розведенням мишачої сироватки в РBS/0,5% BSA, Tween 20 (зв'язувальний буфер, BB). Після промивання, лунку інкубували 100 мкл/лунка кролячим антимишачим IgG поліклональним антитілом, кон'югованим з пероксидазою хрону (HRP) у BB протягом 30 хвилин o при 37 C. Після промивання, титр антипептидного мишачого IgG визначали кольоровою реакцією з TMB субстрат ним розчином при 450нм. [0044]При 1:100 розведенні, інтенсивність імунної відповіді перевищувала SEQ ID 2 до 4 MMP-9 A 1-3 та була значно меншою ніж SEQ ID 1, MMP-2 A 21 як показано у Таблиці 4 нижче. 55 4 UA 111840 C2 [0045]ТАБЛИЦЯ 4: 5 10 15 20 [0046]Олігопептидна терапевтично ефективна кількість може бути введена ссавцеві багатьма різними шляхами та може не обмежуватися вприскуваннями. Різні способи введення добре відомі з рівня техніки та деякі зі способів описано нижче. [0047] "Специфічні види" для лікування способом, що розглядається, можуть означати людську чи нелюдську тварину, наприклад, мишей, сільськогосподарських тварин, приматів та хребетних. [0048]Конкретні захворювання, які були б хворобами-мішенями лікування з використанням MMP олігопептідних послідовностей та/або пептидоміметиків являють собою пухлинні захворювання, запальні захворювання, хвороби коронарних артерій, оклюзійні серцево-судинні захворювання, дегенеративні захворювання та інфекційні захворювання. Деякі приклади пухлинних захворювань можуть являти собою, але не обмежуючись наведеним, рак, лімфому, лейкемію, і пухлину мозку. Деякі приклади запальних захворювань можуть являти собою, але не обмежуючись наведеним, артрит, астма, атеросклероз, хворобу Крона, коліт, дерматит, червоний вовчак і т. д. Деякі приклади інфекційних захворювань можуть включати, але не обмежуючись наведеним, бактеріальні, вірусні, грибкові, мікоплазмові, певні генетичні захворювання та інші інфекції. У цій заявці, були виявлені сигнальні олігопептіди у 5 UA 111840 C2 5 10 15 20 25 30 35 40 45 50 55 селективному білку MMP, що опосередковують ключову патологічну функцію білка MMP, а саме дигестію з’єднувальних тканин, що є необхідною умовою для міграції і метастазів ракових клітин. Олігопептіди були синтезовані, впорскнуті тваринам і антитіла були збільшені. Розмір пухлини був значно знижений шляхом використання цих олігопептід-збільшуючих вакцин. Ступінь ефективності можна побачити з рівнів титрів викликаних MMP олігопептідною вакциною, що доводить, що вакцини були дуже ефективні. [0049]Одним з традиційних способів вибору підвищення природної антигенності олігопептидної послідовності(ей) даного білка є невелика зміна амінокислотної послідовності у даному олігопептиді, тобто, шляхом заміщень, делецій, інерцій тощо, окремих амінокислот. SEQ ID 5- 21 ідентифікували та розробляли таким чином, що вона відповідає гідрофобності, гідрофільності та електричному заряду амінокислотних олігопептидних послідовностей SEQ ID 1-3 (MMP). Це також підтримує сигнальні характеристики та функціональність як епітопу. Оскільки ці олігопептиди дуже схожі на SEQ ID 1-3 (MMP), вони можуть бути використані як вакцина для зменшення росту пухлин. Ця заявка представляє ці послідовності к потенційного кандидата для розробки вакцин для лікування раку. SEQ ID's 5-21 може підвищувати терапевтичну ефективність для імунізації перехресних видів шляхом підсилення природної антигенності незалежно від того, чи були використані алюванти. [0050]Лікарські композиції, придатні для цих маршрутів введення, що можуть бути придатні для таких маршрутів введення, можуть бути одержані шляхом додавання одного чи більше фармакологічно прийнятних носіїв до агента та потім обробки суміші шляхом звичайного процесу, відомого фахівцю у цій галузі. Маршрут введення включає, але не обмежується наведеним, неінвазивну пероральну, місцеву (наприклад трансдермальну), ентеральну, трансмукозальну направлену доставку, доставку уповільненого вивільнення, вивільнення із затриманням, імпульсне вивільнення та парентеральні способи. Пероральне введення можу бути виконано як у вологому, так і у сухому стані. [0051]Композиції, придатні для перорального введення можуть бути у вигляді капсул, саше, пігулок, таблеток, лепешек (з використанням ароматизованої основи, зазвичай сахарози, та гуміарабіку чи трагаканту), порошків, гранул, або у вигляді розчину або суспензії у водній або неводному середовищі або у вигляді рідкої емульсії типу масло-в-воді або вода-в-маслі, або у вигляді еліксиру або сиропу, або як пастилки (з використанням інертною основи, такої як желатин та гліцерин, або сахароза та гуміарабік), кожен з яких містить задану кількість композиції, що розглядається, як активного інгредієнта. Композиція, що розглядається, може бути також введена у вигляді болюсу, лікарської кашки або пасти. [0052]Коли одержують твердий пероральний лікарський продукт, олігопептидна послідовність MMP та/або пептидоміметик MMP's змішують з ексципієнтом (та, якщо необхідно, однією чи більше добавками, такими, як зв'язуюче, розпушувач, змащувальний агент, барвник, підсолоджувач, та ароматизатор), та одержану у результаті суміш обробляють звичайним способом, таким чином одержуючи твердий пероральний лікарський продукт, такий, як таблетки, покриті таблетки, гранули, порошки чи капсули. Добавки можуть бути такими, що зазвичай використовують у рівні техніки. Приклади ексципієнтів включають лактат, сахарозу, хлорид натрію, глюкозу, крохмаль, карбонат кальцію, каолін, мікрокристалічну целюлозу і кремнієву кислоту; приклади зв'язуючих включають воду, етанол, пропанол, простий сироп, розчин глюкози, розчин крохмалю, скраплений желатин , карбоксиметилцеллюлозу, гідроксипропілцелюлозу, гідроксіпропілкрахмал, метилцелюлозу, етилцелюлозу, шелак, фосфат кальцію і полівінілпіролідон; приклади розпушувача включають сухий крохмаль, аргінат натрію, порошкоподібний агар, гідрокарбонат натрію, карбонат кальцію, лаурилсульфат натрію, стеарат моногліцерил, і лактозу; приклади змащувальних речовин включають очищений тальк, солі стеаринової кислоти, буру і поліетиленгліколь; та приклади підсолоджуючих речовин включають сахарозу, апельсинову кірку, лимонну кислоту і винну кислоту. [0053]При використанні рідкого лікарського препарату для перорального введення, олігопептідну послідовність ММР та/або пептидоміметики ММР змішують з добавками, такими як підсолоджувач, буфер, стабілізатор, або коригенти, і отриману суміш обробляють за допомогою звичайного способу, в результаті чого одержують пероральний рідкий лікарський продукт, такий, як розчин для внутрішніх хвороб, сироп або еліксир. Приклади підсолоджувачів включають ванілін; приклади буфера включають цитрат натрію, а приклади стабілізатора включають трагакант, аравійську камедь і желатин. [0054]Для цілей трансдермального (наприклад, місцевого) введення розбавлені стерильні, водні або частково водні розчини (зазвичай від близько 0,1% до 5% концентрації), в іншому випадку, аналогічні наведеним вище парентеральним розчинам, можуть бути одержані. 6 UA 111840 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0055]Композиції для ректального або вагінального введення можуть бути представлені у вигляді супозиторіїв, які можуть бути отримані змішуванням розглянутої композиції з одним або декількома придатними не подразнюючими носіями, включаючи, наприклад, масло какао, поліетиленгліколь, віск для супозиторіїв або саліцилат і , які є твердими при кімнатній температурі, але стають рідкими при температурі тіла і, отже, будуть плавитися у відповідні порожнини тіла і звільнювати інкапсульовані сполуки і композиції. Композиції, придатні для вагінального введення, що також включають вагінальні супозиторії, тампони, креми, гелі, пасти, піни або спреї, містять такі носії, які відомі в даній галузі техніки як придатні. [0056]Частина направленої доставки може бути додана до системи розширеного вивільнення за допомогою накладання шару негайного вивільнення у верхній частині основи розширеного вивільнення, використання процесів покриття або стиснення або в системі з множиною блоків, таких як капсули, що містять підложки розширеного і негайного вивільнення. [0057]При використанні відносно фармацевтичної композиції або іншого матеріалу, термін "уповільненого вивільнення" є визнаним у рівні техніки. Наприклад, терапевтична композиція, яка вивільняє речовини з часом, може демонструвати стійкі характеристики вивільнення, на відміну від введення болюсного типу, в якому всю кількість речовини роблять біологічно доступною відразу. Наприклад, у конкретного втіленнях, при контакті з рідинами організму, включаючи кров, спинномозкову рідину, секреції слизу, лімфу і т. п., один або більше з фармацевтично прийнятних наповнювачів можуть зазнавати поступовий або уповільнений розклад (наприклад, шляхом гідролізу) з одночасним вивільненням будь-якого матеріалу, включеного у нього, наприклад, терапевтичні та/або біологічно активні солі та/або композиції, для уповільненого або тривалого періоду (порівняно з вивільненням з болюсу). Таке вивільнення може призвести до тривалої доставки терапевтично ефективні кількості будь-якого з терапевтичних агентів, описаних у цій заявці. [0058]В даний час зусилля в галузі доставки ліків включають розробку направленої доставки, де препарат діє тільки в цільовій ділянці тіла (наприклад, в ракових тканинах) і препаратів пролонгованої дії, в яких лікарський препарат вивільняється протягом певного періоду часу контрольованим чином з композиції. Види уповільненого вивільнення включають ліпосоми, наповнені ліками біорозкладані мікросфери і полімерні кон'югати лікарських засобів. [0059]Композиції уповільненого вивільнення для перорального застосування одержують шляхом нанесення на тверду лікарську форму з плівкою з полімеру, який не розчиняється у кислому середовищі шлунка, але розчинний у нейтральному середовищі тонкого кишечника. Дозування уповільненого вивільнення можна одержувати, наприклад, шляхом нанесення препарату або композиції, що містить ліки, вибраним матеріалом покриття. Композиція, що містить ліки, може бути придатною для включення в капсулу, таблетку для використання як внутрішньої основи в "покритій серцевині" лікарської форми, або множині, пігулок, частинок або гранул, що містять лікарський засіб, для включення в будь-якому таблетку або капсулу. Переважні матеріали покриттів включають біорозкладані, що поступово гідролізуються, поступово водорозчинні та/або такі, що ферментативно розкладаються, полімери, і можуть бути звичайними "кишковими" полімерами. Кишкові полімери, як буде зрозуміло фахівцям в даній галузі, стають розчинними при більш високому рН середовища нижче шлунково-кишкового тракту або повільно руйнуються у міру того, як лікарська форма проходить через шлунковокишковий тракт, у той час як полімери, що ферментативно розкладаються, розкладаються під дією бактеріальних ферментів, присутніх у нижній частині шлунково-кишкового тракту, особливо в товстій кишці. Альтернативно, таблетка уповільненого вивільнення може бути одержана шляхом диспергування препарату в матриці з придатного матеріалу, такого, як гідрофільний полімер або жирна сполука. Придатні гідрофільні полімери включають, але не обмежуються наведеним, полімери або кополімери целюлози, естер целюлози, акрилову кислоту, метакрилову кислоту, метилакрилат, етилакрилат, і вініл або такі, що ферментативно розкладаються, полімери або кополімери, як описано вище. Ці гідрофільні полімери є особливо корисними для забезпечення матриці уповільненого вивільнення. Жирні сполуки для використання в якості матеріалу матриці, включають, але не обмежуються наведеним, воски (наприклад, карнаубський віск) і тристеарат гліцерину. Як тільки активний інгредієнт змішаний з матеріалом матриці, суміш може бути спресована в таблетки. [0060]Дозування імпульсного вивільнення є таким, що імітує кілька профілів дозування без повторного дозування і зазвичай дозволяє щонайменше дворазове зниження частоти прийому порівняно з препаратом, представленим у вигляді звичайної лікарській формі (наприклад, у вигляді розчину або лікарського засобу швидкого вивільнення, звичайної твердої лікарської форми). Профіль імпульсного вивільнення характеризується періодом, відсутності вивільнення (затримки) або зменшеного вивільнення з наступним швидким вивільненням ліків. 7 UA 111840 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0061]Вирази "парентеральне введення" і "парентерально", використовувані в даному описі, відносяться до способів введення, відмінних від ентерального і місцевого введення, такі як ін'єкції, і включають, без обмеження, внутрішньовенні, внутрішньом'язові, внутрішньоплевральні, внутрішньосудинні, інтраперікардіальні, внутрішньоартеріальні, інтратекальні, внутрікапсульні , внутрішньоочні, внутрішньосерцеві, інтрадермальні, внутрішньочеревні, трахеальні, підшкірні, субкутикулярні, внутрішньосуглобні, субкапсулярні, субарахноїдальні, інтраспінальні та внурішньохребетні ін'єкції та інфузії. [0062]Деякі фармацевтичні композиції, розкриті у цій заявці, придатні для парентерального введення та включають одну або більше композицій, які розглядають, в комбінації з одним або більше фармацевтична прийнятними стерильними ізотонічними водними або неводними розчинами, дисперсіями, суспензіями або емульсіями, або стерильними порошками, які можуть бути відновлені в стерильні розчини або дисперсії для ін’єкцій безпосередньо перед використанням, та які можуть містити антиоксиданти, буфери, бактеріостатичні фактори, розчинені речовини, які надають композиції ізотонічність в крові передбачуваного реципієнта або суспендуючі агенти або агенти згущення. [0063]Коли отримують продукт для впорскування, олігопептідну послідовність ММР та/або пептидоміметики ММР змішують з добавкою, такою, як регулятор рН, буфер, стабілізатор, ізотонічний агент або агент місцевої анестезії і отриману суміш обробляють за допомогою звичайного способу, в результаті чого отримують розчин для ін'єкцій для підшкірної ін'єкції, внутрішньом'язової ін'єкції або внутрішньовенної ін'єкції. Приклади регулятора рН і буфера включають цитрат натрію, ацетат натрію і фосфат натрію; приклади стабілізатора включають піросульфіт натрію, EDTA, тіогліколевої кислоти і тіомолочну кислоту; приклади місцевих анестетиків включають гідрохлорид прокаїну і лідокаїн гідрохлорид; та приклади ізотонічності включають хлорид натрію і глюкозу. [0064]Ад'юванти використовуються для посилення імунної відповіді. Різні типи ад'ювантів доступні. В якості ад'ювантів в даній заявці використані гаптени. Ад'юванти Фрейнда також можуть бути використані для отримання імуногенів вода-в-маслі. Антигени в емульсіях вода-вмаслі стимулююють високі і тривалі антитіла, які можуть бути віднесені до антигенів повільного вивільнення. Антигени (переважно у фізіологічному розчині) зазвичай змішують з рівним об'ємом ад'юванта для утворення емульсії. [0065]Вираз "фармацевтично прийнятний" визнаний у рівні техніки. У певних втіленнях, цей термін включає композиції, полімери й інші матеріали та/або лікарські форми, які знаходяться в межах обсягу медичної точки зору, придатні для використання в контакті з тканинами ссавців, людини і тварин без надмірної токсичності, роздратування, алергічної реакції або інших проблем або ускладнень, що відповідають розумним співвідношенням користь/ризик. [0066]Вираз "фармацевтично прийнятний носій" визнаний у рівні техніки, і включає, наприклад, фармацевтично прийнятні матеріали, композиції або основи, такі, як рідкий або твердий наповнювач, розріджувач, розчинник або інкапсулюючий матеріал, що беруть участь у реалізації і транспортування будь-якої розгляданої композиції, від одного органу або частини тіла до іншого органу, або частини тіла. Кожен носій має бути "прийнятним" в сенсі сумісності з іншими інгредієнтами розгляданої композиції і не шкідливим для пацієнта. У певних втіленнях, фармацевтично прийнятний носій є апірогенним. Деякі приклади речовин, які можуть слугувати в якості фармацевтично прийнятних носіїв включають: (1) цукри, такі як лактоза, глюкоза й сахароза, (2) крохмалі, такі як кукурудзяний крохмаль і картопляний крохмаль, (3) целюлозу і її похідні, такі, як натрій карбоксиметилцелюлоза, етилцелюлоза і ацетат целюлози; (4) порошкоподібний трагакант; (5) солод; (6) желатин; (7) тальк; (8) масло какао і віск для супозиторіїв; (9) масла, такі як арахісове масло, бавовняне масло, соняшникова олія, кунжутне масло, оливкова олія, кукурудзяна олія та соєва олія; (10) гліколі, такі як пропіленгліколь; (11) поліоли, такі як гліцерин, сорбіт, маніт і поліетиленгліколь; (12) естери, такі як етилолеат і етіллаурат; (13) агар; (14) буферні агенти, такі як гідроксид магнію і гідроксид алюмінію; (15) альгінова кислота, (16) апірогенна вода; (17) ізотонічний сольовий розчин; (18) розчині Рінгера; (19) етиловий спирт; (20) фосфатні буферні розчини, а також (21) інші нетоксичні сумісні речовини, використовувані у фармацевтичних препаратах. [0067]У певних втіленнях, фармацевтичні композиції описані у цій заявці, сформульовані таким чином, що зазначені композиції будуть доставлені ссавцеві у терапевтично ефектівній кількості, як частина профілактичного, превентивного або терапевтичного лікування. [0068]У певних втіленнях, дозування олігопептідної композиції, яка може мати назву терапевтичної композиції за даним винаходом, може бути визначено шляхом посилання на концентрації в плазмі терапевтичної композиції або інших інкапсульованих матеріалів. Наприклад, проби крові можуть бути перевірені на їх імунну відповідь на відповідні олігопептіди. 8 UA 111840 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0069]Терапевтичні композиції, представлені у цій заявці, можна вводити суб'єкту, потребуючому лікування, за допомогою різних звичайних способів введення, у тому числі перорально, місцево, парентерально, наприклад, внутрішньовенно, підшкірно або інтрамедулярно. Додатково, терапевтичні композиції можуть бути введені інтраназально, як ректальний супозиторій, або за допомогою "флеш" формулювання, тобто, дозволяючи лікам розчинятися у ротовій порожнині без необхідності використовувати воду. Крім того, композиції можуть бути введені суб'єкту, потребуючому лікування, за допомогою лікарських форм контрольованого вивільнення, сайт-специфічної доставки ліків, трансдермальної доставки препарату, патч-(активно/пасивно) опосередкованої доставки ліків, шляхом стереотаксичної ін'єкції, або у вигляді наночастинок. [0070]Виражаючись у термінах концентрації, активний інгредієнт може бути присутнім в терапевтичних композиціях за даним винаходом для використання локалізованих під шкірою, інтраназально, фарінголарінгеально, бронхіально, вагінально, ректально, або очно. [0071]Для використання в якості аерозолі, активні інгредієнти можуть бути упаковані в контейнері під тиском аерозолю разом з газоподібним або скрапленим пропеллентом, таким, як дихлордифторметан, диоксид вуглецю, азот, пропан тощо, із звичайними ад'ювантамі, такими як розчинники і агенти змащування, як може бути необхідно або бажано. [0072]Найбільш поширені способи введення також включають переважні через слизову (носову, буккально/сублінгвально, вагінально, очно і ректально) і шляхом інгаляції. [0073]Додатково, у певних втіленнях, розглядані у цій заявці композиції можуть бути ліофілізовані або піддані іншим відповідним методам сушіння, таким як сушка розпиленням. Ця композиція може бути введена один раз або може бути розділена на декілька менших доз, що підлягають введенню через різні інтервали часу, в залежності частково від швидкості вивільнення композиції і бажаної дози. [0074]Композиції, використовувані в методах, представлених у цій заявці, включають придатні для перорального, назального, місцевого (включаючи буккальне та сублингвальне), ректальне, вагінальне, аерозольне та/або парентеральне введення. Композиції можуть бути зручно представлені у вигляді стандартної дози і можуть бути одержані будь-якими способами, добре відомими в області фармації. Кількості розглянутої композиції, які може бути об'єднані з матеріалом-носієм для отримання стандартної дози, можуть варіювати залежно від суб'єкта, якого лікують, і конкретного способу введення. [0075]Терапевтично прийнятна кількість, описана у цій заявці, може бути введена в інгаляційних або аерозольних композиціях. Інгаляційні або аерозольні композиції можуть містити один або більше агентів, таких як ад'ювант, діагностичні агенти, візуалізуючі агенти або терапевтичні агенти, використовувані в інгаляційної терапії. Остаточний склад аерозолю може містити наприклад 0,005-90% мас/мас, наприклад 0,005-50%, 0,005-5% мас/мас, або 0,01-1,0% мас/мас, медикаменту відносно загальної маси композиції. [0076]Приклади придатних водних і неводних носіїв, які можуть бути використані в фармацевтичних композиціях, включають воду, етанол, поліоли (наприклад, гліцерин, пропіленгліколь, поліетиленгліколь і т. п.) і придатні їх суміші, рослинні олії, такі як оливкове масло і органічні естери для впорскування, такі як етилолеат. Належну текучість можна підтримувати, наприклад, шляхом використанням матеріалів покриття, такого як лецитин, шляхом підтримання необхідного розміру часток у випадку дисперсій та використанням поверхнево-активних речовин. [0077]Терапевтичної прийнятні дози можуть бути об'єднані з іншими лікарськими засобами і можуть розглядатися як комбінований препарат. [0078]На фігурі 2, одержані антитіла 241 перевіряють за допомогою ELISA. Інокуляцію мишей (228) виконували з використанням різних ракових клітин 246 шляхом ін'єкції. Блок MMP's 230 антигеном 248 спостерігали. Інтактні ECM 234, показані як 250 шляхом інгібування ECM розкладання 232 були показані у in vivo та in vitro дослідженнях, як показано вище та нижче. [0079]Ракові клітинні лінії та культури [0080]Клітини людського раку шийки матки (Hela) та мишачої меланоми B16FO, одержані від ATCC (American Type Culture Collection, Rockville, MD) зберігали у середовищі Ігла, модифікованому за Дульбекко з додаванням 10% ембріональної бичачої сироватки та антибіотиків. Застосовані середовища та сироватку одержували від ATCC, та антибіотики (пеніцилін та стрептоміцин) одержували від Gibco BRL, Long Island, NY. [0081]Інвазія Matrigel [0082]Дослідження інвазії проводили з використанням Matrigel (Becton Dickinson) вставок у планшети на 24 лунки. Суспендували у середовищі, що містило анти-сироватку від експериментально імунізованих мишей у 1: 100 розведенні, клітини людського раку шийки матки 9 UA 111840 C2 5 10 15 20 25 30 35 HeLa висівали у вставці у лунці. Лунка мала людське термальне фібробласт не праймерне середовище як хемотакстант. Планшети зі вставками потім інкубували у культуральному інкубаторі, при рівновазі 95% повітря та 5% CO2 протягом 24 годин. Після інкубації, середовища зі стінок відкидали. Клітини на верхній поверхні вставок обережно зішкрібали за допомогою вовняних шкребків. Клітини, що проходили через мембрану Matrigel, забарвлювали гематоксиліном та еозином (H&E) та візуально підраховували під мікроскопом. [0083]Інгібування порівнювали з контрольним. Фігури 3A- 3D демонструють різні металопротеїназні олігопептиди та їх ефективність. Існує багато клітин, що проходять через Matrigel порівняно із MMP-9 A1-3 та MMP-2 A4 клітинами, підданими дії. Наприклад, на фігурі 3A, клітини під номерами 1001A-1003A є більшими за кількістю порівняно з MMP-9 A1 обробленими клітинами 1004 A-1005A. Аналогічні результати одержано для MMP-9 2-3 та MMP2 A4 у наступних фігурах. [0084]Описані у цій заявці in vivo дослідження дали деякі цікаві результати у вигляді маси мишей, маси пухлини, досліджень пухлинного навантаження та ефективності різних олігопептідів, використаних в терапевтично ефектівній кількості для інгібування ECM дигестування або руйнування. ий [0085]Після дозування мишей, на 45 день, у мишей випускали кров через очний прокол та кров збирали у 2-мл мікроцентрифужну пробірку. Після тестування імунної відповіді на окремі 6 пептиди, мишей у кожній групі інокулювали підшкірно 0,5x10 у 0,2 мл PBS. Після ін'єкції, мишей повертали у клітки та давали звичайну мишачу харчову дієту Purina. Через двадцять один тиждень, мишей умертвляли та їх пухлини висікали. Розміри (довжина та ширина) пухлин вимірювали з використанням цифрового калібру та пухлинне навантаження розраховували з використанням такої формули: 0,5xдовжина x ширина. [0086]Маса тварин значно не змінювалася перед та після лікування, як показано на фігурі 4. Фігура 5 демонструє терапевтичний ефект імунізації усіх матриксних металопротеїназних олігопептидів на масу пухлин. Фігура 6 демонструє значний ефект на об'єм пухлин порівняно із контрольними пухлинами, додатково підтверджуючи ефективність способу лікування. Фігура 7 A- E візуально демонструє деякі з розрізаних та виявлених пухлин. Цілком очевидним є значне зменшення розмірів. В одному з MMP-9 A 3 одна з пухлин цілком зникла. Фігура 8 демонструє тривимірну структуру молекули MMP. Фігура також описує ділянку молекули, що надає MMP-9 A1, MMP-9 A2 та MMP-9 A3 можливість мати тривимірну структуру. Пептидоміметики цих MMP можуть бути розроблені, виходячи зі структури, для інгібування MMP експресії та попередження метастазів. [0087]Додатково, буде оцінено, що різні послідовності, процеси імунізації, та способи лікування, описані у цій заявці, можуть бути втіленні з використанням засобів для досягнення різних комбінацій терапевтичного дозування та способів доставки для лікування конкретної хвороби. Відповідно, опис та креслення повинні вважатися скоріш ілюстративними, ніж мати обмежувальний сенс. 10 UA 111840 C2 11 UA 111840 C2 12 UA 111840 C2 13 UA 111840 C2 14 UA 111840 C2 15 UA 111840 C2 16 UA 111840 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Спосіб одержання фармацевтичної композиції, що включає: ідентифікацію олігопептидної послідовності для матриксної металопротеїнази, експресованої при конкретному захворюванні, при цьому олігопептидна послідовність матриксної металопротеїнази являє собою щонайменше одну з SEQ ID NO: 2-21 та їх комбінацію, та при цьому конкретне захворювання являє собою щонайменше одне з новоутворень, особливо раку, запальної хвороби, хвороби коронарних артерій, оклюзійного серцево-судинного захворювання, дегенеративного захворювання та інфекційного захворювання; синтезування ідентифікованої олігопептидної послідовності для матриксної металопротеїнази; складання терапевтично ефективної кількості лікувальної композиції з використанням ідентифікованої олігопептидної послідовності матриксної металопротеїнази; та одержання фармацевтичної композиції шляхом використання лікувальної композиції для лікування ссавця, що має конкретне захворювання, яке проявляє надлишкову експресію матриксної металопротеїнази. 2. Спосіб за п. 1, який відрізняється тим, що олігопептидна послідовність матриксної металопротеїнази являє собою щонайменше одну з SEQ ID NO: 2-4. 3. Спосіб за п. 1 або 2, який відрізняється тим, що фармацевтична композиція являє собою вакцину. 4. Спосіб за одним з попередніх пунктів, який відрізняється тим, що фармацевтична композиція має бути введена із застосуванням щонайменше одного з неінвазивної пероральної, місцевої, ентеральної, трансмукозальної, направленої доставки, доставки уповільненого вивільнення та парентерального способу. 5. Фармацевтична композиція, що містить: матриксний металопротеїназний олігопептид, де матриксний металопротеїназний олігопептид являє собою щонайменше одну з SEQ ID NO: 2-21 та їх комбінацію, особливо щонайменше одну з SEQ ID NO: 2-4; та фармацевтично прийнятний ексципієнт. 6. Фармацевтична композиція за п. 5, що додатково містить: ад'ювант, добавку для підвищення хімічної стабільності, фосфатний буферний сольовий розчин, та гаптен для підвищення іммуногенності композиції. 7. Фармацевтична композиція за п. 5 або 6, яка відрізняється тим, що матриксний металопротеїназний олігопептид має щонайменше одну з лінійної та кругової форм. 8. Спосіб одержання фармацевтичного препарату, що включає: ex vivo вимірювання рівня експресії матриксної металопротеїнази у конкретних видів, що мають конкретні захворювання, при цьому олігопептидна послідовність матриксної металопротеїнази являє собою щонайменше одну з SEQ ID NO: 2-21 та їх комбінацію, особливо щонайменше одну з SEQ ID NO: 2-4, та при цьому конкретне захворювання являє собою щонайменше одне з новоутворень, особливо раку, запальної хвороби, хвороби коронарних артерій, оклюзійного серцево-судинного захворювання, дегенеративного захворювання та інфекційного захворювання; ідентифікацію олігопептидної послідовності для матриксної металопротеїнази при конкретному захворюванні для визначення композиції для лікування; синтезування ідентифікованої олігопептидної послідовності матриксної металопротеїнази, складання лікувальної композиції для одержання терапевтично ефективної кількості олігопептидної послідовності матриксної металопротеїнази; та одержання фармацевтичного препарату з використанням лікувальної композиції для впорскування лікувальної композиції як вакцини конкретним видам для лікування конкретного захворювання, що має надлишкову експресію матриксної металопротеїнази. 9. Спосіб за п. 8, який відрізняється тим, що конкретні види являють собою щонайменше одного зі ссавців та не ссавців. 10. Спосіб за п. 8 або п. 9, який відрізняється тим, що фармацевтичний препарат має бути впорскнутий безпосередньо у пухлину. 11. Спосіб за одним з пп. 8-10, що додатково включає: сполучення послідовності матриксної металопротеїнази з гаптеном для підсилення імунної відповіді як вакцини. 17 UA 111840 C2 5 10 12. Спосіб за одним з пп. 8-11, що додатково включає: складання терапевтично ефективної кількості лікувальної композиції з використанням пептидоміметичної послідовності матриксної металопротеїнази. 13. Олігопептид, що складається з амінокислотної послідовності однієї з SEQ ID NO: 2-21. 14. Олігопептид за п. 13, який відрізняється тим, що амінокислотна послідовність є однією з SEQ ID NO: 2-4. 15. Олігопептид за п. 13 або п. 14, який відрізняється тим, що олігопептид біотинільовано та/або ковалентно приєднано до гемоціаніну фісурелу. 16. Застосування олігопептиду за одним з пп. 13-15 з одержанням вакцини для виклику імунної відповіді проти людської матриксної металопротеїнази-2 або людської матриксної металопротеїнази-9 у суб′єкта-ссавця. 17. Застосування олігопептиду за одним з пп. 13-15 з одержанням вакцини для лікування раку. 18 UA 111840 C2 19 UA 111840 C2 20 UA 111840 C2 21 UA 111840 C2 22 UA 111840 C2 23 UA 111840 C2 24 UA 111840 C2 25 UA 111840 C2 26 UA 111840 C2 27 UA 111840 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMetalloproteinase oligopeptides and their therapeutic use
Автори англійськоюRath, Matthias, Niedzwiecki, Aleksandra, Roomi, Waheed M.
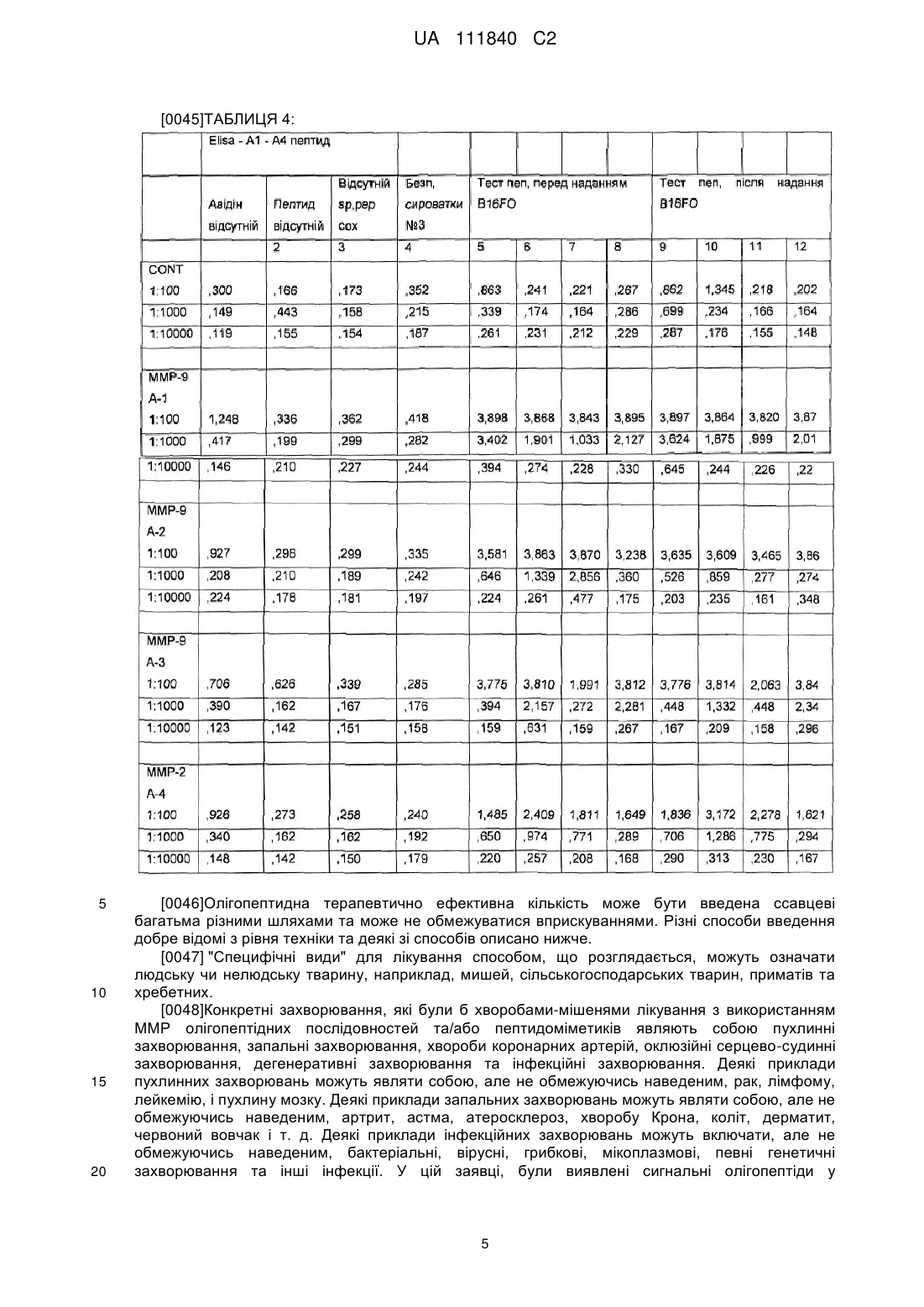
Автори російськоюРат Маттиас, Недзвецки Александра, Руми Вахид М.
МПК / Мітки
МПК: A61K 9/08, A61P 35/00, A61K 9/02, C07K 7/04, A61K 38/48, C12N 9/64
Мітки: застосування, терапевтичне, олігопептиди, металопротеїназні
Код посилання
<a href="https://ua.patents.su/31-111840-metaloprotenazni-oligopeptidi-ta-kh-terapevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Металопротеїназні олігопептиди та їх терапевтичне застосування</a>
Наступний патент: Сполуки бензотіазолу та їх фармацевтичне застосування
Випадковий патент: Трипровідний газовий пальник