Токсиген і спосіб його застосування
Номер патенту: 112405
Опубліковано: 12.09.2016
Автори: Семпсон Кімберлі С., Макналті Брайен, Томсо Деніел Дж., Агарвал Шруті, Кемпбелл Кріс
Формула / Реферат
1. Виділена або рекомбінантна молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, вибрану з групи, що складається з:
a) нуклеотидної послідовності SEQ ID NO: 36, 206, 207, 282 та 283;
b) нуклеотидної послідовності, яка має щонайменше 95% ідентичність послідовності з нуклеотидною послідовністю SEQ ID NO: 36, 206, 207, 282 та 283, де вказана нуклеотидна послідовність кодує поліпептид, що має пестицидну активність;
a) нуклеотидної послідовності, що кодує поліпептид, який містить амінокислотну послідовність SEQ ID NO: 96; і,
d) нуклеотидної послідовності, що кодує поліпептид, який має щонайменше 95% ідентичність амінокислотної послідовності з амінокислотною послідовністю SEQ ID NO: 96, де вказаний поліпептид має пестицидну активність.
2. Виділена або рекомбінантна молекула нуклеїнової кислоти за пунктом 1, де вказана нуклеотидна послідовність сконструйована для експресії в рослині.
3. Вектор, який містить молекулу нуклеїнової кислоти за пунктом 1.
4. Вектор за пунктом 3, який додатково містить молекулу нуклеїнової кислоти, яка кодує гетерологічний поліпептид.
5. Клітина-хазяїн, яка є рослинною клітиною, що містить вектор за пунктом 3.
6. Трансгенна рослина, яка містить клітину-хазяїна за пунктом 5.
7. Трансгенна рослина за пунктом 6, де вказану рослину вибирають з групи, що складається з маїсу, сорго, пшениці, капусти, соняшнику, томату, хрестоцвітих, перців, картоплі, бавовнику, рису, соєвих бобів, цукрового буряку, цукрової тростини, тютюну, ячменя і олійного рапсу.
8. Виділений поліпептид з пестицидною активністю, вибраний з групи, що складається з:
a) поліпептиду, що містить амінокислотну послідовність SEQ ID NO: 96;
b) поліпептиду, що містить амінокислотну послідовність, яка має щонайменше 95% ідентичність послідовності з амінокислотною послідовністю SEQ ID NO: 96, де вказаний поліпептид має пестицидну активність;
c) поліпептид, кодований нуклеотидною послідовністю, будь-якою з SEO ID NO: 36, 206, 207, 282 та 283; і
d) поліпептид, кодований нуклеотидною послідовністю, яка має щонайменше 95% ідентичність з нуклеотидною послідовністю, будь-якою з SEQ ID NO: 36, 206, 207, 282 та 283, де вказаний поліпептид має пестицидну активність.
9. Поліпептид за пунктом 8, який додатково містить гетерологічні амінокислотні послідовності.
10. Композиція, яка містить поліпептид за пунктом 8.
11. Композиція за пунктом 10, де вказану композицію вибирають з групи, що складається з порошку, пилоподібного препарату, таблеток, гранул, аерозолю, емульсії, колоїдних часток і розчину.
12. Композиція за пунктом 10, де вказану композицію готують шляхом десикації, ліофілізації, гомогенізації, екстракції, фільтрації, центрифугування, седиментації або концентрування культури клітин Bacillus thuringiensis.
13. Композиція за пунктом 10, яка містить від приблизно 1 % до приблизно 99 % за масою вказаного поліпептиду.
14. Поліпептид за пунктом 8 для застосування у контролюванні популяції лускокрилих або твердокрилих шкідників, шляхом контактування вказаної популяції з пестицидно ефективною кількістю поліпептиду за пунктом 8.
15. Поліпептид за пунктом 8 для застосування у знищенні лускокрилого або твердокрилого шкідника, шляхом контактування вказаного шкідника з пестицидно ефективною кількістю поліпептиду за пунктом 8 або згодовування вказаному шкіднику ефективної кількості цього поліпептиду.
16. Спосіб одержання поліпептиду з пестицидною активністю, що включає культивування клітини-хазяїна за пунктом 5 в умовах, в яких експресується молекула нуклеїнової кислоти, що кодує вказаний поліпептид.
17. Рослина, що має стабільно включену в її геном конструкцію ДНК, яка містить нуклеотидну послідовність, що кодує білок, який має пестицидну активність, де вказану нуклеотидну послідовність вибирають з групи, що складається з:
a) нуклеотидної послідовності, будь-якої з SEQ ID NO: 36, 206, 207, 282 та 283;
b) нуклеотидної послідовності, яка має щонайменше 95% ідентичність послідовності з нуклеотидною послідовністю, будь-якою з SEQ ID NO: 36, 206, 207, 282 та 283, де вказана нуклеотидна послідовність кодує поліпептид, що має пестицидну активність;
c) нуклеотидної послідовності, що кодує поліпептид, який містить амінокислотну послідовність SEQ ID NO: 96; і
d) нуклеотидної послідовності, що кодує поліпептид, який має щонайменше 95% ідентичність амінокислотної послідовності з амінокислотною послідовністю SEQ ID NO: 96, де вказаний поліпептид має пестицидну активність;
в якій вказана нуклеотидна послідовність функціонально зв'язана з промотором, що запускає експресію кодуючої послідовності в рослинній клітині.
18. Трансгенне насіння рослини за пунктом 17, яке має стабільно включену конструкцію ДНК за пунктом 1.
19. Спосіб захисту рослини від комахи-шкідника, який включає введення у вказану рослину або її клітину щонайменше одного вектора експресії, який містить нуклеотидну послідовність, що кодує пестицидний поліпептид, де вказану нуклеотидну послідовність вибирають з групи, що складається з:
a) нуклеотидної послідовності, будь-якої з SEQ ID NO: 36, 206, 207, 282 та 283;
b) нуклеотидної послідовності, яка має щонайменше 95% ідентичність послідовності з нуклеотидною послідовністю, будь-якою з SEQ ID NO: 36, 206, 207, 282 та 283, де вказана нуклеотидна послідовність кодує поліпептид, що має пестицидну активність;
c) нуклеотидної послідовності, кодуючої поліпептид, який містить амінокислотну послідовність, будь-яку з SEQ ID NO: 96; і
d) нуклеотидної послідовності, що кодує поліпептид, який має щонайменше 95% ідентичність з амінокислотною послідовністю будь-якої з SEQ ID NO: 96, де вказаний поліпептид має пестицидну активність.
20. Спосіб за пунктом 19, де вказана рослина продукує пестицидний поліпептид, який має пестицидну активність проти лускокрилого або твердокрилого шкідника.
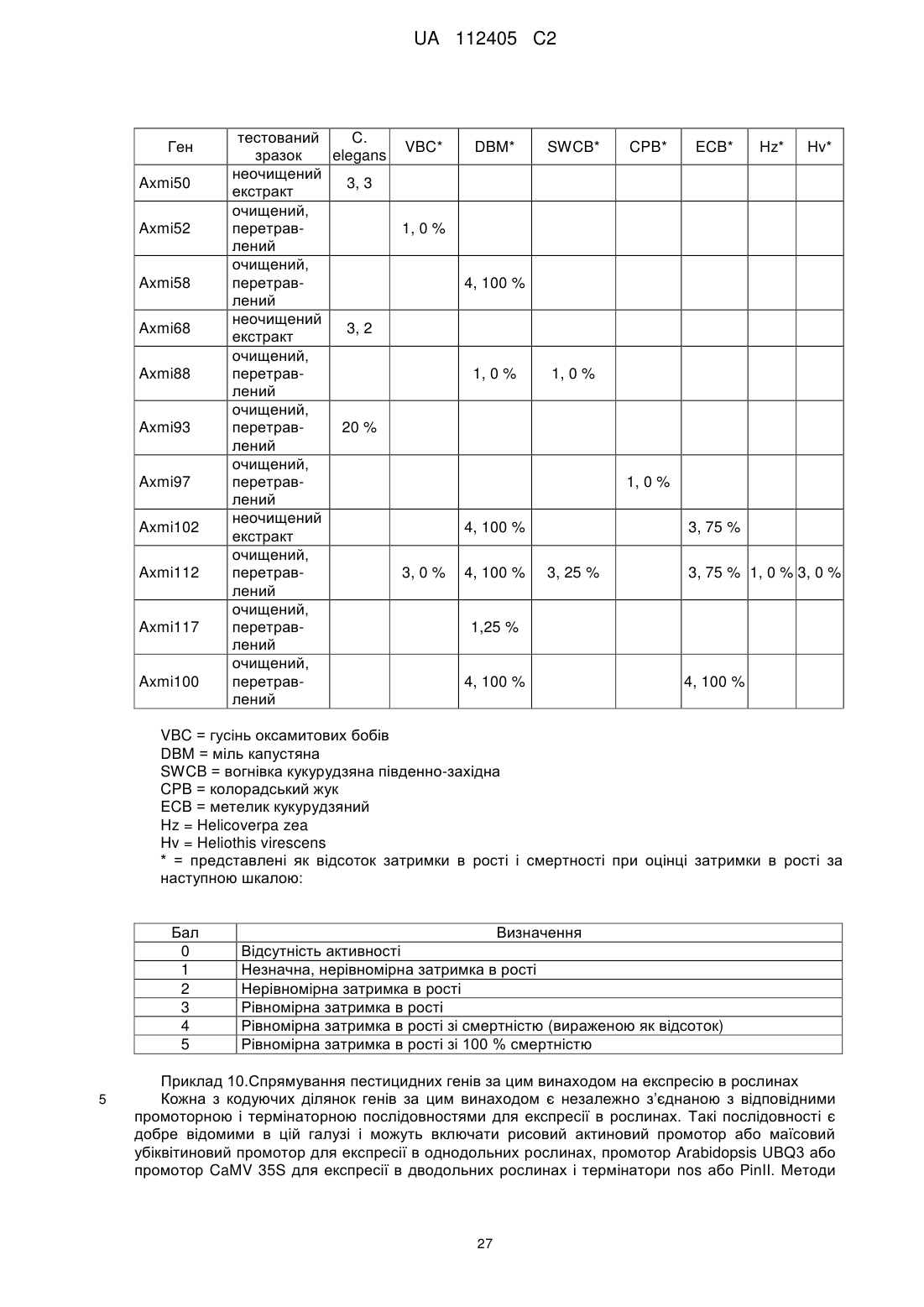
Текст
Реферат: Винахід належить до виділеної молекули нуклеїнової кислоти дельта-ендотоксину, до амінокислотної послідовності, що відповідає такому полінуклеотиду, композиції, що містить зазначені послідовності, а також до способу надання пестицидної активності бактеріям, рослинам, рослинним клітинам, тканинам і насінню за допомогою використання зазначених послідовностей. UA 112405 C2 (12) UA 112405 C2 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Цей винахід стосується галузі молекулярної біології. Пропонуються нові гени, які кодують пестицидні білки. Такі білки і послідовності нуклеїнових кислот, що кодують їх, використовуються при розробці рецептур пестицидів і при отриманні трансгенних рослин, резистентних до шкідників. Рівень знань Bacillus thuringiensis – це грампозитивна спороутворююча ґрунтова бактерія, яка характеризується здатністю продукувати кристалічні включення, що є специфічно токсичними для певних рядів і видів комах, але нешкідливими для рослин або інших організмів, проти яких вони не націлені. Це обумовило застосування композицій, що включають Bacillus thuringiensis або його інсектицидні білки, в якості прийнятних для оточуючого середовища інсектицидів для боротьби з сільськогосподарськими шкідниками комахами або комахами-переносниками різноманітних хвороб, що вражають людину і тварин. Кристалічні (Cry) білки (дельта-ендотоксини) від Bacillus thuringiensis володіють сильною інсектицидною активністю головним чином проти личинок Lepidopteran, Dipteran і Coleopteran. Ці білки демонстрували активність проти рядів комах-шкідників Hymenoptera, Homoptera, Phthiraptera, Mallophaga і Acari, а також проти інших рядів безхребетних, таких як Nemathelminthes, Platyhelminthes і Sarcomastigorphora (Feitelson (1993) The Bacillus Thuringiensis family tree. В книзі Advanced Engineered Pesticides, Marcel Dekker, Inc., New York, N.Y.). Ці білки спочатку були класифіковані як CryI–CryV на основі головним чином їх інсектицидної активності. Головними класами були Lepidoptera-специфічні (I), Lepidoptera- і Diptera-специфічні (II), Coleoptera-специфічні (III), Diptera-специфічні (IV) і нематода-специфічні (V) і (VI). Далі їх було класифіковано на підродини; більш тісно споріднені білки в межах кожної родини отримали підрозділові літери, такі як Cry1A, Cry1B, Cry1C і т.д. Ще більш тісно споріднені білки в межах кожного підрозділу отримали такі назви, як Cry1C1, Cry1C2 і т.д. Не так давно для генів Cry була запропонована нова номенклатура, заснована швидше на гомології амінокислотних послідовностей, ніж на специфічності щодо комахи-мішені (Crickmore et al. (1998) Microbiol. Mol. Biol. Rev. 62:807-813). В цій новій класифікації кожному токсину присвоєна унікальна назва, що включає первинний ранг (арабська цифра), вторинний ранг (велика літера), третинний ранг (мала літера) і четвертинний ранг (ще одна арабська цифра). В новій класифікації римські цифри було замінено на арабські цифри в первинному рангу. Білки з менш ніж 45 % ідентичністю послідовностей мають різні первинні ранги, а критеріями для вторинного і третинного рангів є 78 % і 95 %, відповідно. Кристалічний білок не демонструє інсектицидної активності, доки він не буде всмоктаний і солюбілізований в шлунку комахи. Всмоктаний протоксин гідролізується протеазами в травному тракті комахи до активної токсичної молекули (Höfte & Whiteley (1989) Microbiol. Rev. 53:242255). Цей токсин зв’язується з апікальними рецепторами щіткової кайми в шлунку личинок і входить в апікальну мембрану, створюючи іонні канали або пори, що призводить до загибелі личинки. Дельта-ендотоксини загалом мають п’ять збережених доменів послідовностей і три збережені структурні домени (дивись, наприклад, de Maagd et al. (2001) Trends Genetics 17:193199). Перший збережений структурний домен складається з семи альфа спіралей і є задіяний у входженні у мембрану і утворенні пор. Домен ІІ складається з трьох бета-листків, розміщених в конфігурації грецького ключа, а домен ІІІ складається з двох антипаралельних бета-листків в утворенні, що нагадує рулет (de Maagd et al., 2001, supra). Домени ІІ і ІІІ є задіяними в розпізнаванні і зв’язуванні рецептору і тому вважаються детермінантами специфічності токсину. Інтенсивне застосування інсектицидів на основі B. thuringiensis вже призвело до підвищення резистентності в польових популяціях попільниці Plutella xylostella (Ferré & Van Rie (2002) Annu. Rev. Entomol. 47:501-533). Найпоширенішим механізмом резистентності є зменшення зв’язування цього токсину зі специфічним до нього рецептором (рецепторами) шлунку. Це може викликати також перехресну резистентність до інших токсинів, які поділяють той самий рецептор (Ferré & Van Rie (2002)). Сутність винаходу Пропонуються композиції і способи для надання стійкості до комах-шкідників бактеріям, рослинам, клітинам, тканинам і насінню рослин. Композиції включають молекули нуклеїнової кислоти, що кодують послідовності для поліпептидів дельта-ендотоксинів, вектори, що містять ці молекули нуклеїнової кислоти, і клітини-хазяї, що містять ці вектори. Композиції включають також поліпептидні послідовності ендотоксину і антитіла до цих поліпептидів. Такі нуклеотидні послідовності можуть застосовуватись в конструкціях ДНК або касетах експресії для трансформації і експресії в організмах, включаючи мікроорганізми і рослини. Нуклеотидні або 1 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотні послідовності можуть бути синтетичними послідовностями, які були створені для експресії в організмі, включаючи, але не обмежуючись ними, мікроорганізм або рослину. Композиції включають також трансформовані бактерії, рослини, клітини, тканини і насіння рослин. Зокрема, пропонуються виділені молекули нуклеїнових кислот, що відповідають послідовностям нуклеїнових кислот дельта-ендотоксинів. Додатково, охоплюються амінокислотні послідовності, які відповідають цим полінуклеотидам. Зокрема, даний винахід пропонує виділену молекулу нуклеїнової кислоти, що містить нуклеотидну послідовність, кодуючу амінокислотну послідовність, показану в будь-якій послідовності з SEQ ID №№: 61-121 і 133-141, або нуклеотидну послідовність, наведену в будь-якій послідовності з SEQ ID №№: 1-60 і 124-132, а також їх варіанти і фрагменти. Охоплюються також нуклеотидні послідовності, що є комплементарними до нуклеотидної послідовності за цим винаходом або гібридизованими до нуклеотидної послідовності за цим винаходом. Композиції і способи за цим винаходом є призначеними для отримання організмів з резистентністю до пестицидів, конкретно бактерій і рослин. Ці організми і композиції, що походять від них, є бажаними для застосування у сільському господарстві. Композиції за цим винаходом можуть також бути використаними для створення змінених або поліпшених білків дельта-ендотоксинів, що мають пестицидну активність, або для виявлення присутності білків або нуклеїнових кислот дельта-ендотоксинів в продуктах або організмах. Докладний опис винаходу Даний винахід стосується композицій і способів для регуляції стійкості до шкідників в організмах, зокрема в рослинах або в клітинах рослин. Ці способи передбачають трансформацію організмів за допомогою нуклеотидної послідовності, що кодує білок дельтаендотоксину за цим винаходом. Зокрема, нуклеотидні послідовності за цим винаходом можуть бути використані для отримання рослин і мікроорганізмів, що володіють пестицидною активністю. Відповідно, пропонуються трансформовані бактерії, рослини, клітини рослин, тканини рослин і насіння. Композиції є нуклеїновими кислотами і білками дельта-ендотоксинів Bacillus thuringiensis. Такі послідовності знаходять застосування в конструюванні векторів експресії для наступної трансформації в організми, що становлять інтерес, в якості зондів для виділення інших генів ендотоксинів, а також для створення змінених пестицидних білків за допомогою методів, відомих в цій галузі, таких як перестановка доменів або перестановка в ДНК (перестановка послідовностей в межах гену з наступною рекомбінацією цього сегменту в інтактну ДНК). Такі білки знаходять застосування в контролюванні або знищенні популяцій шкідників лускокрилих, твердокрилих і нематод, а також для отримання композицій з пестицидною активністю. «Дельта-ендотоксин» означає токсин від Bacillus thuringiensis, який має токсичну активність проти одного або більше шкідників, включаючи, але не обмежуючись ними, представників рядів Lepidoptera, Diptera і Coleoptera або представників Nematoda phylum, або білок, який має гомологію з таким токсином. В певних випадках білки дельта-ендотоксинів виділялись з інших організмів, включаючи Clostridium bifermentans і Paenibacillus popilliae. Білки дельтаендотоксинів включають амінокислотні послідовності, виведені від описаних тут нуклеотидних послідовностей повної довжини, і амінокислотні послідовності, що є коротшими, ніж послідовності повної довжини, через застосування іншого, розміщеного далі сайту ініціації транскрипції або через обробку, яка дає коротший білок, що має пестицидну активність. Обробка може здійснюватись в організмі, де цей білок експресується, або в шкідникові після поїдання цього білку. Дельта-ендотоксини включають білки, ідентифіковані як cry1–cry43, cyt1 і cyt2, а також Cytподібний токсин. Наразі відомо понад 250 видів дельта-ендотоксинів з широким спектром специфічності і токсичності. Для широкого переліку дивись Crickmore et al. (1998), Microbiol. Mol. Biol. Rev. 62:807-813, а для регулярних поновлень дивись Crickmore et al. (2003) “Bacillus thuringiensis toxin nomenclature,” на сайті www.biols.susx.ac.uk/Home/Neil_Crickmore/Bt/index. Тут пропонуються нові виділені нуклеотидні послідовності, які забезпечують пестицидну активність. Також пропонуються амінокислотні послідовності білків дельта-ендотоксинів. Білок, отриманий в результаті трансляції цього гену, дозволяє клітинам контролювати або вбивати шкідників, які поїдають його. Виділені молекули нуклеїнової кислоти та їх варіанти і фрагменти Один аспект даного винаходу стосується виділених або рекомбінантних молекул нуклеїнової кислоти, які містять нуклеотидні послідовності, кодуючі білки дельта-ендотоксинів, і поліпептиди або їх біологічно активні частини, а також молекули нуклеїнової кислоти, що є достатніми в якості гібридизаційних зондів для ідентифікації кодуючих дельта-ендотоксини нуклеїнових 2 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислот. Як він тут використовується, термін «молекула нуклеїнової кислоти» включає молекули ДНК (наприклад, рекомбінантної ДНК, кДНК або геномної ДНК) і молекули РНК (наприклад, мРНК), а також аналоги ДНК і РНК, генеровані з використанням нуклеотидних аналогів. Така молекула нуклеїнової кислоти може бути однонитчастою або двонитчастою, але переважно двонитчастою ДНК. «Виділена» або «очищена» молекула нуклеїнової кислоти або білку, або її біологічно активна частина є суттєво вільними від іншого клітинного матеріалу або культурального середовища, коли отримуються рекомбінантними методами, або суттєво вільними від хімічних попередників або інших хімічних сполук, коли синтезуються хімічним шляхом. Переважно, «виділена» нуклеїнова кислота є вільною від послідовностей (переважно послідовностей, що кодують білок), які природно фланкують цю нуклеїнову кислоту (тобто, послідовностей, розміщених на кінцях 5′ і 3′ нуклеїнової кислоти) в геномній ДНК організму, від якого походить ця нуклеїнова кислота. Для цілей даного винаходу термін «виділені», коли він відноситься до молекул нуклеїнової кислоти, виключає виділені хромосоми. Наприклад, в різних варіантах здійснення виділена молекула нуклеїнової кислоти, кодуюча дельта-ендотоксин, може містити менше ніж приблизно 5 кб, 4 кб, 3 кб, 2 кб, 1 кб, 0,5 кб або 0,1 кб нуклеотидних послідовностей, які природно фланкують цю нуклеїнову кислоту в геномній ДНК клітини, з якої походить ця нуклеїнова кислота. Білок дельта-ендотоксину, який є суттєво вільним від клітинного матеріалу, включає препарати білку, які мають менше ніж приблизно 30 %, 20 %, 10 % або 5 % (від сухої ваги) білку не дельта-ендотоксину (який тут називають також «контамінуючим білком»). Нуклеотидні послідовності, кодуючі білки за цим винаходом, включають послідовності, наведені в послідовностях SEQ ID №№: 1-60 і 124-132, а також їх варіанти, фрагменти і комплементи. Під «комплементом» розуміється нуклеотидна послідовність, що є достатньо комплементарною для даної нуклеотидної послідовності, так що вона може гібридизуватись до даної нуклеотидної послідовності, тим самим утворюючи стабільний дуплекс. Відповідні амінокислотні послідовності для білку дельта-ендотоксину, кодованого цією нуклеотидною послідовністю, наведені в послідовностях SEQ ID №№: 61-121 і 133-141. Молекули нуклеїнової кислоти, що є фрагментами тих нуклеотидних послідовностей, які кодують дельта-ендотоксин, також охоплюються даним винаходом. Під «фрагментом» розуміється частина нуклеотидної послідовності, кодуючої білок дельта-ендотоксину. Фрагмент нуклеотидної послідовності може кодувати біологічно активну частину білку дельта-ендотоксину або він може бути фрагментом, який може бути використаний як гібридизаційний зонд або праймер ПЛР при застосуванні методів, які будуть описані далі. Молекули нуклеїнової кислоти, що є фрагментами нуклеотидної послідовності дельта-ендотоксину, включають щонайменше приблизно 50, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1050, 1100, 1150, 1200, 1250, 1300, 1350, 1400, 1450, 1500, 1550, 1600, 1650, 1700, 1750, 1800, 1850, 1900, 1950, 2000, 2050, 2100, 2150, 2200, 2250, 2300, 2350, 2400, 2450, 2500, 2550, 2600, 2650, 2700, 2750, 2800, 2850, 2900, 2950, 3000, 3050, 3100, 3150, 3200, 3250, 3300, 3350 стичних нуклеотидів або до тієї кількості нуклеотидів, яка присутня в описаній тут нуклеотидній послідовності повної довжини, кодуючій дельта-ендотоксин, залежно від задуманого застосування. Під «стичними» нуклеотидами розуміються нуклеотидні залишки, що є безпосередньо суміжними один до одного. Фрагменти нуклеотидних послідовностей за цим винаходом будуть кодувати білкові фрагменти, які зберігають біологічну активність білку дельта-ендотоксину і, відповідно, зберігають пестицидну активність. Під «зберігає активність» розуміється, що фрагмент буде мати щонайменше приблизно 30 %, щонайменше приблизно 50 %, щонайменше приблизно 70 %, 80 %, 90 %, 95 % або більше пестицидної активності білку дельта-ендотоксину. Методи для визначення пестицидної активності є добре відомими в цій галузі. Дивись, наприклад, Czapla & Lang (1990) J. Econ. Entomol. 83:2480-2485; Andrews et al. (1988) Biochem. J. 252:199206; Marrone et al. (1985) J. of Economic Entomology 78:290-293; і патент США № 5,743,477, які всі включено в цей опис за посиланням у всій їх повноті. Фрагмент нуклеотидної послідовності, кодуючої дельта-ендотоксин, який кодує біологічно активну частину білку за цим винаходом, буде кодувати щонайменше приблизно 15, 25, 30, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100 стичних амінокислот або до загальної кількості амінокислот, присутньої в білку дельта-ендотоксину повної довжини за цим винаходом. Кращі білки дельта-ендотоксинів за цим винаходом кодуються нуклеотидною послідовністю, достатньо ідентичною нуклеотидній послідовності SEQ ID №№: 1-60 і 124-132. Під «достатньо ідентичною» розуміється амінокислотна або нуклеотидна послідовність, яка має щонайменше приблизно 60 % або 65 % ідентичності послідовності, приблизно 70 % або 75 % ідентичності послідовності, приблизно 80 % або 85 % ідентичності послідовності, приблизно 90 %, 91 %, 3 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або більше ідентичності послідовності, порівняно з еталонною послідовністю, що визначається за допомогою однієї з програм зіставлення, описаних тут, з використанням стандартних параметрів. Спеціалісту в цій галузі має бути зрозумілим, що ці цифри можуть бути відповідно відрегульовані, щоб визначити відповідну ідентичність білків, кодованих двома нуклеотидними послідовностями, з урахуванням дегенерації кодонів, подібності амінокислот, положення рамки зчитування і т.п. Щоб визначити відсоток ідентичності двох амінокислотних послідовностей або двох нуклеїнових кислот, ці послідовності зіставляються для цілей оптимального порівняння. Відсоток ідентичності між двома послідовностями є функцією кількості ідентичних позицій, які поділяються цими послідовностями (тобто, ідентичність послідовності = кількість ідентичних позицій/загальна кількість позицій (наприклад, позицій, що накладаються) х 100). В одному варіанті здійснення ці дві послідовності мають однакову довжину. В іншому варіанті здійснення порівняння здійснюється по всій еталонній послідовності (наприклад, повністю по одній з послідовностей SEQ ID №№: 1-60 і 124-132 або повністю по одній з послідовностей SEQ ID №№: 61-121 і 133-141). Відсоток ідентичності між двома послідовностями може бути визначений з використанням методик, подібних до тих, що будуть описані далі, з допущенням пропусків або без них. При обчисленні відсотку ідентичності типово підраховуються точні збіги. Визначення відсотку ідентичності між двома послідовностями може здійснюватись з використанням математичного алгоритму. Не обмежуючим прикладом математичного алгоритму, використовуваного для порівняння двох послідовностей, є алгоритм Karlin & Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264, модифікований як в Karlin & Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Цей алгоритм є включеним в програми BLASTN і BLASTX Altschul et al. (1990) J. Mol. Biol. 215:403. Пошуки нуклеотидів BLAST (основний інструмент пошуку локального зіставлення) можуть здійснюватись за допомогою програми BLASTN, бал = 100, довжина слова = 12, щоб отримати нуклеотидні послідовності, гомологічні подібним до дельтаендотоксину молекулам нуклеїнової кислоти за цим винаходом. Пошуки білків BLAST можуть здійснюватись за допомогою програми BLASTX, бал = 50, довжина слова = 3, щоб отримати амінокислотні послідовності, гомологічні молекулам білку дельта-ендотоксину за цим винаходом. Щоб отримати зіставлення з пропусками для цілей порівняння, може бути використаний інструмент BLAST з пропусками – Gapped BLAST (в BLAST 2.0), як описано у Altschul et al. (1997) Nucleic Acids Res. 25:3389. Як варіант, може бути використаний інструмент PSI-Blast для здійснення ітеративного пошуку, який виявляє віддалені спорідненості між молекулами. Дивись Altschul et al. (1997) supra. В разі застосування програм BLAST, Gapped BLAST і PSI-Blast можуть використовуватись параметри за умовчанням відповідних програм (наприклад, BLASTX і BLASTN). Зіставлення може здійснюватись також вручну методом підбору. Іншим не обмежуючим прикладом математичного алгоритму, використовуваного для порівняння послідовностей, є алгоритм ClustalW (Higgins et al. (1994) Nucleic Acids Res. 22:46734680). ClustalW порівнює послідовності і зіставляє повністю амінокислотну або ДНК послідовність, а отже може забезпечити дані щодо збереження послідовності всієї амінокислотної послідовності. Алгоритм ClustalW використовується в кількох пакетах програмного забезпечення для аналізу ДНК / амінокислот, що є у продажу, таких як модуль ALIGNX пакету програм Vector NTI Program Suite (Invitrogen Corporation, Carlsbad, CA). Після зіставлення амінокислотних послідовностей за допомогою алгоритму ClustalW можна оцінити відсоток ідентичності амінокислот. Не обмежуючим прикладом програмного забезпечення, використовуваного для аналізу зіставлень ClustalW, є GENEDOC™. GENEDOC™ (Karl Nicholas) дозволяє оцінювати подібність амінокислот (чи ДНК) і ідентичність між певною кількістю білків. Ще одним не обмежуючим прикладом математичного алгоритму, використовуваного для порівняння послідовностей, є алгоритм Myers & Miller (1988) CABIOS 4:11-17. Цей алгоритм включено до програми ALIGN (версія 2.0), яка є частиною пакету програмного забезпечення GCG Wisconsin Genetics Software Package, Версія 10 (яку можна придбати у Accelrys, Inc., 9685 Scranton Rd., San Diego, CA, США). В разі застосування програми ALIGN для порівняння амінокислотних послідовностей можна скористатись таблицею ваги залишків РАМ120, штрафом за довжину пропуску 12 і штрафом за пропуск 4. Коли інше не зазначається, програма GAP Версія 10, яка використовує алгоритм Needleman & Wunsch (1970) J. Mol. Biol. 48(3):443-453, буде застосовуватись для визначення ідентичності або подібності послідовностей з використанням наступних параметрів: % ідентичності і % подібності для нуклеотидної послідовності з вагою пропуску в послідовності 50, вагою довжини 3 і матрицею замін (при вирівнюванні біологічних послідовностей) nwsgapdna.cmp; % ідентичності або % подібності для амінокислотної послідовності з вагою пропуску в 4 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності 8, вагою довжини 2 і програмою замін амінокислот BLOSUM62. Можуть використовуватись також еквівалентні програми. Під «еквівалентною програмою» розуміється будь-яка програма порівняння послідовностей, яка, для будь-яких двох даних послідовностей, генерує зіставлення, яке має ідентичні збіги нуклеотидних залишків і ідентичний відсоток тотожності послідовностей у порівнянні з відповідним зіставленням, генерованим програмою GAP Версія 10. Даний винахід охоплює також варіантні молекули нуклеїнової кислоти. «Варіанти» нуклеотидних послідовностей, кодуючих дельта-ендотоксин, включають ті послідовності, які кодують описані тут білки дельта-ендотоксину, але які відрізняються консервативно внаслідок дегенерації генетичного коду, а також ті, що є суттєво ідентичними, як зазначалось раніше. Алельні варіанти природного походження можна ідентифікувати за допомогою добре відомих методів молекулярної біології, таких як полімеразна ланцюгова реакція (ПЛР) і методи гібридизації, про які йтиметься далі. Варіантні нуклеотидні послідовності включають також нуклеотидні послідовності, отримані синтетичним шляхом, які були генеровані, наприклад, з використанням спрямованого на сайт мутагенезу, але які все ще кодують білки дельта-ендотоксинів, описані в даному винаході, про які йтиметься далі. Охоплювані даним винаходом варіантні білки є біологічно активними, тобто вони продовжують володіти бажаною біологічною активністю нативного білку – зберігають пестицидну активність. Під «зберігають активність» розуміється, що такий варіант буде мати щонайменше приблизно 30 %, щонайменше приблизно 50 %, щонайменше приблизно 70 % або щонайменше приблизно 80 % пестицидної активності нативного білку. Методи визначення пестицидної активності є добре відомими в цій галузі. Дивись, наприклад, Czapla & Lang (1990) J. Econ. Entomol. 83: 24802485; Andrews et al. (1988) Biochem. J. 252:199-206; Marrone et al. (1985) J. of Economic Entomology 78:290-293; і патент США № 5,743,477, які всі включено в цей опис за посиланням у всій їх повноті. Спеціалісту в цій галузі має бути зрозумілим також, що зміни можуть вноситись мутацією нуклеотидних послідовностей за цим винаходом, які приводять до змін в амінокислотній послідовності кодованих білків дельта-ендотоксинів без зміни біологічної активності цих білків. Відповідно, варіантні виділені молекули нуклеїнової кислоти можуть бути створені шляхом введення одного або більше нуклеотидних заміщень, добавок або делецій у відповідну нуклеотидну послідовність, описану тут, так що одне або більше амінокислотних заміщень, добавок або делецій вводяться в даний кодований білок. Мутації можуть вводитись стандартними методами, такими як спрямований на сайт мутагенез і мутагенез, опосередкований ПЛР. Такі варіантні нуклеотидні послідовності також охоплюються даним винаходом. Наприклад, консервативні амінокислотні заміщення можуть бути здійснені в одному або більше, наперед визначених, замінних амінокислотних залишків. «Замінний» амінокислотний залишок є залишком, який може бути змінений від послідовності дикого типу білку дельтаендотоксину без зміни біологічної активності, тоді як «незамінний» амінокислотний залишок є необхідним для біологічної активності. «Консервативне амінокислотне заміщення» є таким, коли амінокислотний залишок заміщується амінокислотним залишком, який має подібний боковий ланцюг. Родини амінокислотних залишків, які мають подібні бокові ланцюги, були визначені в цій галузі. Ці родини включають амінокислоти з основними боковими ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними боковими ланцюгами (наприклад, аспарагінова кислота, глютамінова кислота), незміненими полярними боковими ланцюгами (наприклад, гліцин, аспарагін, глютамін, серин, треонін, тирозин, цистеїн), неполярними боковими ланцюгами (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін, триптофан), бетарозгалуженими боковими ланцюгами (наприклад, треонін, валін, ізолейцин) і ароматичними боковими ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). Дельта-ендотоксини загалом мають п’ять доменів збережених послідовностей і три збережені структурні домени (дивись, наприклад, de Maagd et al. (2001) Trends Genetics 17:193199). Перший збережений структурний домен складається з семи альфа спіралей і є задіяним в інсерції мембрани і утворенні пор. Домен ІІ складається з трьох бета-листків, розміщених в конфігурації грецького ключа, а домен ІІІ складається з двох антипаралельних бета-листків у вигляді рулету (de Maagd et al., 2001, supra). Домени ІІ і ІІІ є задіяними в розпізнаванні і зв’язуванні рецептору і тому вважаються детермінантами специфічності до токсину. Амінокислотні заміщення можуть здійснюватись на не збережених ділянках, які зберігають функцію. Загалом, такі заміщення не робились би ради збережених амінокислотних залишків або ради амінокислотних залишків, що знаходяться в межах збереженого мотиву, де такі залишки є суттєвими для активності білку. Приклади залишків, які є збереженими і які можуть бути суттєвими для активності білку, включають, наприклад, залишки, що є ідентичними для 5 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 всіх білків, які містяться в зіставленні амінокислотних послідовностей за даним винаходом і відомих послідовностей дельта-ендотоксинів. Приклади залишків, які є збереженими, але можуть дозволяти консервативні амінокислотні заміщення і все ще зберігати активність, включають, наприклад, залишки, які мають тільки консервативні заміщення між всіма білками, які містяться в зіставленні амінокислотних послідовностей за даним винаходом і відомих послідовностей дельта-ендотоксинів. Однак спеціалісту в цій галузі має бути зрозумілим, що функціональні варіанти можуть мати незначні збережені або не збережені зміни в збережених залишках. Альтернативно, варіантні нуклеотидні послідовності можуть бути отримані шляхом введення мутацій випадково по всій кодуючій послідовності або по її частині, наприклад шляхом насичуючого мутагенезу, а отримані мутанти можуть бути піддані скринінгу на здатність забезпечувати активність дельта-ендотоксину, щоб ідентифікувати мутантів, які зберігають активність. Після мутагенезу такий кодований білок може бути експресованим рекомбінантно, а активність цього білка може визначатись за допомогою стандартних методик аналізу. За допомогою таких методів, як ПЛР, гібридизація і т.п., можна ідентифікувати послідовності відповідних дельта-ендотоксинів – такі послідовності мають суттєву ідентичність з послідовностями за цим винаходом. Дивись, наприклад, Sambrook & Russell (2001) Molecular Cloning: A Laboratory Manual. (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY) та Innis, et al. (1990) PCR Protocols: A Guide to Methods and Applications (Academic Press, NY). При застосуванні методу гібридизації всі частини нуклеотидної послідовності дельтаендотоксину можуть бути використані для скринінгу кДНК або геномних бібліотек. Методи для конструювання таких кДНК і геномних бібліотек є загальновідомими в цій галузі і розглядаються в книзі Sambrook & Russell, 2001, supra. Так звані гібридизаційні зонди можуть бути фрагментами геномної ДНК, фрагментами кДНК, фрагментами РНК або іншими 32 олігонуклеотидами і можуть мітитись групою, що легко виявляється, такою як P, або будь-яким іншим маркером, таким як радіоізотопи, флуоресцентна сполука, фермент або кофактор ферменту. Зонди для гібридизації можна отримати шляхом мічення синтетичних олігонуклеотидів на основі відомої, кодуючої дельта-ендотоксин нуклеотидної послідовності, описаної тут. Додатково можуть бути використані вироджені праймери, розроблені на основі збережених нуклеотидів або амінокислотних залишків в цій нуклеотидній послідовності або кодованої амінокислотної послідовності. Зонд типово містить ділянку нуклеотидної послідовності, яка гібридизується у строгих умовах до щонайменше приблизно 12, щонайменше приблизно 25, щонайменше приблизно 50, 75, 100, 125, 150, 175, 200, 250, 300, 350 або 400 послідовних нуклеотидів кодуючої дельта-ендотоксин нуклеотидної послідовності за цим винаходом або її фрагменту або варіанту. Методи для приготування зондів для гібридизації є загальновідомими в цій галузі і описуються в книзі Sambrook & Russell, 2001, supra, включеної в даний опис за посиланням. Наприклад, вся послідовність дельта-ендотоксину, описана тут, або одна або більше її частин можуть бути використані в якості зонду, здатного специфічно гібридизуватись до відповідних послідовностей, подібних до послідовності дельта-ендотоксину, та інформаційних РНК. Для забезпечення специфічної гібридизації в різноманітних умовах такі зонди включають послідовності, що є унікальними і переважно мають щонайменше приблизно 10 нуклеотидів у довжину або щонайменше приблизно 20 нуклеотидів у довжину. Такі зонди можуть використовуватись для ампліфікації відповідних послідовностей дельта-ендотоксину від обраного організму за допомогою ПЛР. Ця методика може використовуватись для виділення додаткових кодуючих послідовностей від бажаного організму або в якості діагностичного аналізу для визначення присутності кодуючих послідовностей в організмі. Методи гібридизації включають гібридизаційний скринінг висіяних ДНК бібліотек (бляшок або колоній; дивись, наприклад, Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York). Гібридизація таких послідовностей може здійснюватись в строгих умовах. Під «строгими умовами» або «строгими умовами гібридизації» розуміються такі умови, в яких зонд буде гібридизуватись до своєї мішені-послідовності помітно більшою мірою, ніж до інших послідовностей (наприклад, щонайменше 2-кратно порівняно з фоновим рівнем). Строгі умови залежать від послідовності і будуть різними за різних обставин. Шляхом контролювання строгості умов гібридизації та/або промивки можна ідентифікувати цільові послідовності, що є на 100 % комплементарними до даного зонду (гомологічне зондування). Як варіант, умови строгості можуть регулюватись так, щоб дозволити певну невідповідність в послідовностях, так що буде виявлятись нижча ступінь подібності (гетерологічне зондування). Загалом, зонд має менше ніж приблизно 1000 нуклеотидів у довжину, переважно менше ніж 500 нуклеотидів у 6 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 довжину. Типово, строгі умови будуть такими, за яких концентрація солі становить менше ніж приблизно 1,5 М іону Na, типово від приблизно 0,01 до 1,0 М іону Na (чи іншої солі) при рН від 0 7,0 до 8,3 і температурі щонайменше близько 30 С для коротких зондів (наприклад, від 10 до 50 0 нуклеотидів) і щонайменше близько 60 С для довгих зондів (наприклад, більше 50 нуклеотидів). Строгі умови можна забезпечити також шляхом додавання дестабілізуючих агентів, таких як формамід. Показові умови низької строгості включають гібридизацію з використанням буферного розчину 30-35 % формаміду, 1 M NaCl, 1 % SDS (натрію додецилсульфат) при 37°C і промивки в 1X–2X SSC (20X SSC = 3,0 M NaCl/0,3 M тринатрію цитрат) при температурі від 50 до 55°C. Показові умови помірної строгості включають гібридизацію в 40–45 % формаміду, 1,0 M NaCl, 1 % SDS при 37°C і промивку в 0,5X–1X SSC при температурі від 55 до 60°C. Показові умови високої строгості включають гібридизацію в 50 % формаміду, 1 M NaCl, 1 % SDS при 37°C, і промивку в 0,1X SSC при температурі від 60 до 65°C. Факультативно, буфери для промивки можуть містити від приблизно 0,1 % до приблизно 1 % SDS. Тривалість гібридизації загалом становить менше ніж приблизно 24 години, звичайно від приблизно 4 до приблизно 12 годин. Специфічність типово є функцією промивок після гібридизації, при цьому критичними факторами є іонна сила і температура кінцевого промивного розчину. Для гібридів ДНК-ДНК Tm можна приблизно визначити з рівняння Meinkoth & Wahl (1984) Anal. Biochem. 138:267-284: Tm = 81,5°C + 16,6 (log M) + 0,41 (%GC) – 0,61 (% форм) - 500/L; де M є молярність одновалентних катіонів, %GC – це відсоток нуклеотидів гуанозину і цитокіну в ДНК, % форм – це відсоток формаміду в гібридизаційному розчині, а L – це довжина гібриду в парах основ. Tm є температурою (при визначених іонній силі і рН), при якій 50 % комплементарної цільової 0 послідовності гібридизуються з бездоганно підібраним зондом. Tm знижується приблизно на 1 С на кожний 1 % розходження; отже, Tm, умови гібридизації та/або промивки можна регулювати так, щоб гібридизувати послідовності бажаної ідентичності. Наприклад, коли потрібні 0 послідовності з ідентичністю 90 % і більше, Tm можна знизити на 10 С. Загалом, строгі умови 0 вибираються так, щоб температура була на 5 С нижча, ніж температура плавлення (Tm) для конкретної послідовності і її комплементу при даних іонній силі і рН. Однак дуже строгі умови можуть використовувати гібридизацію та/або промивку при температурі, на 1, 2, 3 або 4°C нижчій, ніж термальна точка плавлення (Tm); помірно строгі умови можуть використовувати гібридизацію та/або промивку при температурі, на 6, 7, 8, 9 або 10°C нижчій, ніж термальна точка плавлення (Tm); умови низької строгості можуть використовувати гібридизацію та/або промивку при температурі, на 11, 12, 13, 14, 15 або 20°C нижчій, ніж термальна точка плавлення (Tm). Маючи це рівняння, композиції для гібридизації та/або промивки і бажану Tm, як буде зрозумілим спеціалістам в цій галузі, можна вважати, що варіації в строгості розчинів для гібридизації та/або промивки є описаними в своїй суті. Коли бажаний ступінь розходження 0 0 приводить до Tm, нижчої ніж 45 С (водний розчин) або 32 С (розчин формаміду), краще підвищити концентрацію SSC так, щоб можна було використати більш високу температуру. Докладні рекомендації щодо гібридизації нуклеїнових кислот містяться в наступних джерелах: Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology—Hybridization with Nucleic Acid Probes, Part I, Chapter 2 (Elsevier, New York); Ausubel et al., eds. (1995) Current Protocols in Molecular Biology, Chapter 2 (Greene Publishing and Wiley-Interscience, New York). Дивись Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York). Виділені білки та їх варіанти і фрагменти Білки дельта-ендотоксинів також охоплюються даним винаходом. Під «білком дельтаендотоксину» розуміється білок, який має амінокислотну послідовність, наведену в SEQ ID №№: 61-121 і 133-141. Пропонуються також їх фрагменти, біологічно активні частини і варіанти, які можуть бути використані для здійснення способів за цим винаходом. «Фрагменти» або «біологічно активні частини» включають поліпептидні фрагменти, що містять амінокислотні послідовності, достатньо ідентичні амінокислотній послідовності, наведеній в будь-якій з послідовностей SEQ ID №№: 61-121 і 133-141, і демонструють пестицидну активність. Біологічно активною частиною білку дельта-ендотоксину може бути поліпептид, що має, наприклад, 10, 25, 50, 100 або більше амінокислот в довжину. Такі біологічно активні частини можуть бути отримані рекомбінантними методами і піддані тестуванню щодо пестицидної активності. Методи визначення пестицидної активності є відомими в цій галузі. Дивись, наприклад, Czapla & Lang (1990) J. Econ. Entomol. 83:2480-2485; Andrews et al. (1988) Biochem. J. 252:199-206; Marrone et al. (1985) J. of Economic Entomology 78:290-293; і патент США № 5,743,477, які всі включені в цей опис за посиланням у всій їх 7 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 повноті. Як він тут використовується, фрагмент містить щонайменше 8 стичних амінокислот послідовності SEQ ID №№: 61-121 і 133-141. Однак даний винахід охоплює і інші фрагменти, такі як будь-який фрагмент білку, більший ніж приблизно 10, 20, 30, 50, 100, 150, 200, 250, 300, 350, 400, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150, 1200, 1250 або 1300 амінокислот. Під «варіантами» розуміються білки або поліпептиди, що мають амінокислотну послідовність, яка щонайменше приблизно на 60 %, 65 %, приблизно на 70 %, 75 %, приблизно на 80 %, 85 %, приблизно на 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % є ідентичною амінокислотній послідовності, наведеній в будь-якій з послідовностей SEQ ID №№: 61-121 і 133-141. Варіанти включають також поліпептиди, кодовані молекулою нуклеїнової кислоти, яка гібридизується до молекули нуклеїнової кислоти з послідовністю SEQ ID №№: 1-60 і 124-132 або до її комплементу в строгих умовах. Варіанти включають поліпептиди, які відрізняються амінокислотною послідовністю внаслідок мутагенезу. Варіантні білки, охоплювані даним винаходом, є біологічно активними, тобто вони продовжують володіти бажаною біологічною активністю нативного білку – зберігають пестицидну активність. Методи визначення пестицидної активності є відомими в цій галузі. Дивись, наприклад, Czapla & Lang (1990) J. Econ. Entomol. 83:2480-2485; Andrews et al. (1988) Biochem. J. 252:199-206; Marrone et al. (1985) J. of Economic Entomology 78:290-293; і патент США № 5,743,477, які всі включені в цей опис за посиланням у всій їх повноті. Бактеріальні гени, такі як гени axmi за цим винаходом, доволі часто володіють певною кількістю кодонів ініціації метіоніну поблизу до відкритої рамки зчитування. Часто ініціація трансляції на одному або більше з цих стартових кодонів буде приводити до створення функціонального білку. Ці стартові кодони можуть включати кодони ATG. Однак такі бактерії, як Bacillus sp., розпізнають також кодон GTG як стартовий кодон, і білки, які ініціюють трансляцію в кодонах GTG, містять метіонін на місці першої амінокислоти. Більш того, не часто вдається визначити a priori, які з цих кодонів природно застосовуються в цій бактерії. Отже, має бути зрозумілим, що застосування одного з альтернативних метіонінових кодонів також може привести до генерації білків дельта-ендотоксинів, які кодують пестицидну активність. Ці білки дельта-ендотоксинів охоплюються даним винаходом і можуть бути використані в способах за цим винаходом. Антитіла до поліпептидів за цим винаходом або до їх варіантів або фрагментів також охоплюються даним винаходом. Методи отримання антитіл є добре відомими в цій галузі (дивись, наприклад, Harlow & Lane (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY; патент США № 4,196,265). Змінені або поліпшені варіанти Відомо, що послідовності ДНК дельта-ендотоксину можуть бути зміненими різними методами і що ці зміни можуть дати послідовності ДНК, кодуючі білки з амінокислотними послідовностями, відмінними від тих, що кодовані дельта-ендотоксином за цим винаходом. Цей білок може бути змінений різними способами, включаючи амінокислотні заміщення, делеції, усічення і вставки однієї або більше амінокислот з послідовностями SEQ ID №№: 61-121 і 133141, включаючи приблизно до 2, приблизно до 3, приблизно до 4, приблизно до 5, приблизно до 6, приблизно до 7,приблизно до 8, приблизно до 9, приблизно до 10, приблизно до 15, приблизно до 20, приблизно до 25, приблизно до 30, приблизно до 35, приблизно до 40, приблизно до 45, приблизно до 50, приблизно до 55, приблизно до 60, приблизно до 65, приблизно до 70, приблизно до 75, приблизно до 80, приблизно до 85, приблизно до 90, приблизно до 100, приблизно до 105, приблизно до 110, приблизно до 115, приблизно до 120, приблизно до 125, приблизно до 130 або більше амінокислотних заміщень, делецій або вставок. Методи для здійснення таких маніпуляцій є загальновідомими в цій галузі. Наприклад, варіанти амінокислотної послідовності білку дельта-ендотоксину можна отримати за допомогою мутацій в ДНК. Це можна здійснити також однією з кількох форм мутагенезу та/або спрямованого розвитку. В певних аспектах ці зміни, закодовані в амінокислотній послідовності, не будуть суттєво впливати на функцію білку. Такі варіанти будуть володіти бажаною пестицидною активністю. Однак має бути зрозумілим, що здатність дельта-ендотоксину забезпечувати пестицидну активність можна поліпшити шляхом застосування таких методик на композиціях за цим винаходом. Наприклад, можна скористатись експресією дельта-ендотоксину в клітинах-хазяях, які демонструють високу частоту помилкового включення основи під час реплікації ДНК, такої як XL-1 Red (Stratagene). Після розмноження в таких штамах можна виділити ДНК дельта-ендотоксину (наприклад, шляхом отримання плазмідної ДНК або шляхом ампліфікації за допомогою ПЛР і клонування результуючого ПЛР фрагменту у вектор), культивувати мутації дельта-ендотоксину в немутагенному штамі та ідентифікувати мутовані 8 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 гени дельта-ендотоксину з пестицидною активністю, наприклад за допомогою тестування на пестицидну активність. Загалом, такий білок змішується і застосовується в фідинг-аналізах. Дивись, наприклад, Marrone et al. (1985) J. of Economic Entomology 78:290-293. Такі аналізи можуть передбачати контактування рослин з одним або більше шкідників і визначення здатності цієї рослини виживати та/або викликати загибель цих шкідників. Приклади мутацій, які мають своїм результатом посилену токсичність, можна знайти у Schnepf et al. (1998) Microbiol. Mol. Biol. Rev. 62:775-806. Як варіант, зміни можуть вноситись в білкову послідовність багатьох білків на N-кінці або Скінці ланцюга без суттєвого впливу на активність. Це може включати вставки, делеції або зміни, які вносяться сучасними молекулярними методами, такими як ПЛР, включаючи ПЛР ампліфікації, які змінюють або подовжують кодуючу білок послідовність шляхом включення амінокислотних кодуючих послідовностей в олігонуклеотиди, використовувані в ПЛР ампліфікації. Альтернативно, такі додані білкові послідовності можуть включати повні послідовності, кодуючі білок, такі як широко використовувані в цій галузі для здійснення злиття білків. Такі злиті білки часто застосовуються для того, щоб (1) збільшити експресію білку, що становить інтерес; (2) ввести домен зв’язування, ферментативну активність або епітоп для забезпечення очистки білку, виявлення білку або інших експериментальних застосувань, відомих в цій галузі; (3) реалізувати цільову секрецію або трансляцію білку в субклітинну органелу, таку як периплазматичний простір грамнегативних бактерій, або ендоплазматичний ретикулум евкаріотичних клітин, причому останнє часто приводить до глікозилювання білку. Варіантні нуклеотидні і амінокислотні послідовності за цим винаходом охоплюють також послідовності, отримані з застосуванням мутагенних і рекомбіногенних методик, таких як перестановка в ДНК (перестановка послідовностей в межах гену з наступною рекомбінацією цього сегменту в інтактну ДНК). Така методика дозволяє застосовувати одну або більше різних кодуючих ділянок білку дельта-ендотоксину для створення нового білку дельта-ендотоксину, що володіє бажаними властивостями. У такий спосіб генеруються бібліотеки рекомбінантних полінуклеотидів з популяції полінуклеотидів зі спорідненими послідовностями, які містять ділянки, що мають суттєву ідентичність послідовностей і можуть бути гомологічно рекомбінованими in vitro або in vivo. Наприклад, за допомогою такого підходу мотиви послідовностей, кодуючих домен, що становить інтерес, можуть бути переставлені між геном дельта-ендотоксину за цим винаходом і іншими відомими генами дельта-ендотоксину, щоб отримати новий ген, кодуючий білок з поліпшеною бажаною властивістю, такою як посилена інсектицидна активність. Стратегії щодо таких перестановок в ДНК є відомими в цій галузі. Дивись, наприклад, Stemmer (1994) Proc. Natl. Acad. Sci. USA 91:10747-10751; Stemmer (1994) Nature 370:389-391; Crameri et al. (1997) Nature Biotech. 15:436-438; Moore et al. (1997) J. Mol. Biol. 272:336-347; Zhang et al. (1997) Proc. Natl. Acad. Sci. USA 94:4504-4509; Crameri et al. (1998) Nature 391:288-291; і патенти США №№ 5,605,793 і 5,837,458. Обмін або перестановка доменів є іншим механізмом для створення змінених білків дельтаендотоксину. Домени ІІ і ІІІ можуть обмінюватись між білками дельта-ендотоксинів, приводячи до утворення гібридних або химерних токсинів з поліпшеною пестицидною активністю або розширеним спектром мішеней. Методи для створення рекомбінантних білків і їх тестування на пестицидну активність є добре відомими в цій галузі (дивись, наприклад, Naimov et al. (2001) Appl. Environ. Microbiol. 67:5328-5330; de Maagd et al. (1996) Appl. Environ. Microbiol. 62:15371543; Ge et al. (1991) J. Biol. Chem. 266:17954-17958; Schnepf et al. (1990) J. Biol. Chem. 265:20923-20930; Rang et al. 91999) Appl. Environ. Microbiol. 65:2918-2925). Вектори Послідовність дельта-ендотоксину за цим винаходом може пропонуватись у формі касети експресії для експресії в рослині, що становить інтерес. Під «рослинною касетою експресії» розуміється конструкція ДНК, яка здатна забезпечити експресію білку з відкритої рамки зчитування в рослинній клітині. Типово, він містить промотор і кодуючу послідовність. Часто такі конструкції будуть містити також не трансльовану ділянку 3′. Такі конструкції можуть містити «сигнальну послідовність» або «лідерну послідовність», щоб забезпечити ко-трансляційний або пост-трансляційний транспорт потрібного пептиду до певних внутрішньоклітинних структур, таких як хлоропласт (чи інша пластида), ендоплазматичний ретикулум або апарат Гольджі. Під «сигнальною послідовністю» розуміється послідовність, щодо якої відомо або яка підозрюється в тому, що вона забезпечує ко-трансляційний або пост-трансляційний транспорт пептиду через клітинну мембрану. В евкаріотах це типово передбачає секрецію в апарат Гольджі, з певним результуючим глікозилюванням. Під «лідерною послідовністю» розуміється будь-яка послідовність, яка після трансляції дає амінокислотну послідовність, достатню для запуску ко-трансляційного транспорту пептидного ланцюга в субклітинну органелу. Отже, це 9 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 передбачає націленість лідерних послідовностей на транспорт та/або глікозилювання шляхом проходження в ендоплазматичний ретикулум, проходження у вакуолі, пластиди, включаючи хлоропласти, мітохондрії і т.п. Під «вектором трансформації рослини» розуміється молекула ДНК, яка є необхідною для ефективної трансформації рослинної клітини. Така молекула може складатись з однієї або більше рослинних касет експресії і може бути організованою в більше ніж одну «векторну» молекулу ДНК. Наприклад, бінарні вектори є векторами трансформації рослини, які використовують два нестичні вектори ДНК для кодування всіх необхідних діючих в cis- і transположеннях функцій для трансформації рослинних клітин (Hellens & Mullineaux (2000) Trends in Plant Science 5:446-451). «Вектор» стосується конструкції нуклеїнової кислоти, призначеної для перенесення між різними клітинами-хазяями. «Вектор експресії» стосується вектору, який має здатність включати, інтегрувати і експресувати гетерологічні послідовності або фрагменти ДНК в чужорідну клітину. Така касета буде включати регуляторні послідовності 5′ і 3′, функціонально зв’язані з послідовністю за цим винаходом. «Функціонально зв’язаний» означає наявність функціонального зв’язку між промотором і другою послідовністю, в якій послідовність промотору ініціює і опосередковує транскрипцію послідовності ДНК, що відповідає цій другій послідовності. Загалом, функціональний зв’язок означає, що послідовності зв’язаних нуклеїнових кислот є стичними і, коли необхідно з’єднати кодуючі ділянки двох білків, стичними і в тій самій рамці зчитування. Такі касети можуть додатково містити щонайменше один додатковий ген, який має бути ко-трансформованим в організм. Як варіант, такий додатковий ген (гени) може передбачатись на певній кількості касет експресії. «Промотор» стосується послідовності нуклеїнових кислот, яка функціонує, щоб спрямовувати транскрипцію розміщеної далі кодуючої послідовності. Промотор, разом з іншими транскрипційними і трансляційними регуляторними послідовностями нуклеїнових кислот (які називають також «контрольними послідовностями»), є необхідним для експресії послідовності ДНК, що становить інтерес. Така касета експресії забезпечується великою кількістю рестрикційних сайтів для вставляння послідовності дельта-ендотоксину, яка має знаходитись під транскрипційною регуляцією регуляторних ділянок. Касета експресії буде включати в напрямку транскрипції 5′-3′ ділянку ініціації транскрипції і трансляції (тобто, промотор), послідовність ДНК за цим винаходом і ділянку закінчення транскрипції і трансляції (тобто, ділянку термінації), функціональну в рослинах. Промотор може бути нативним або аналогічним, або чужорідним, або гетерологічним для рослини-хазяїна та/або для послідовності ДНК за цим винаходом. До того ж, промотор може бути природною послідовністю чи, альтернативно, синтетичною послідовністю. Коли промотор є «нативним» або «гомологічним» для рослини-хазяїна, має розумітись, що цей промотор знайдений в нативній рослині, в яку він вводиться. Коли промотор є «чужорідним» або «гетерологічним» для послідовності ДНК за цим винаходом, має розумітись, що цей промотор не є нативним або таким, що трапляється у природі, промотором для функціонально зв’язаної послідовності ДНК за цим винаходом. Ділянка термінації може бути нативною з ділянкою ініціації транскрипції, може бути нативною з функціонально зв’язаною послідовністю ДНК, що становить інтерес, може бути нативною з рослиною-хазяїном або може бути отриманою з іншого джерела (наприклад, чужорідного або гетерологічного для промотору, послідовності ДНК, що становить інтерес, рослини-хазяїна або будь-якої їх комбінації). Придатні ділянки термінації можуть бути отримані з Ті-плазміди A. tumefaciens, такі як ділянки термінації октопін синтази і нопалін синтази. Дивись також Guerineau et al. (1991) Mol. Gen. Genet. 262:141-144; Proudfoot (1991) Cell 64:671-674; Sanfacon et al. (1991) Genes Dev. 5:141-149; Mogen et al. (1990) Plant Cell 2:1261-1272; Munroe et al. (1990) Gene 91:151-158; Ballas et al. (1989) Nucleic Acids Res. 17:7891-7903; та Joshi et al. (1987) Nucleic Acid Res. 15:9627-9639. Коли це слушно, такий ген (гени) можна оптимізувати для підвищеної експресії в трансформованій клітині-хазяїні. Тобто, гени можуть синтезуватись з використанням кращих кодонів клітини-хазяїна для поліпшеної експресії або вони можуть синтезуватись з використанням кодонів з частотою, якій віддає перевагу хазяїн. Загалом, вміст GC гену буде збільшуватись. Дивись, наприклад, Campbell & Gowri (1990) Plant Physiol. 92:1-11 щодо обговорення використання кодонів, якому віддає перевагу хазяїн. В цій галузі є відомими методи для синтезування генів, яким віддає перевагу рослина. Дивись, наприклад, патенти США №№ 5,380,831 і 5,436,391, а також Murray et al. (1989) Nucleic Acids Res. 17:477-498, які включені в цей опис за посиланням. В одному варіанті здійснення дельта-ендотоксин є націленим на хлоропласт для експресії. У 10 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 такий спосіб, коли дельта-ендотоксин вводиться в хлоропласт непрямо, касета експресії буде додатково містити нуклеїнову кислоту, кодуючу транзитний пептид, щоб спрямовувати дельтаендотоксин до хлоропластів. Такі транзитні пептиди є відомими в цій галузі. Дивись, наприклад, Von Heijne et al. (1991) Plant Mol. Biol. Rep. 9:104-126; Clark et al. (1989) J. Biol. Chem. 264:1754417550; Della-Cioppa et al. (1987) Plant Physiol. 84:965-968; Romer et al. (1993) Biochem. Biophys. Res. Commun. 196:1414-1421; та Shah et al. (1986) Science 233:478-481. Ген дельта-ендотоксину, щоб бути націленим на хлоропласт, може бути оптимізованим для експресії в хлоропласті, щоб врахувати відмінності у використанні кодонів між рослинним ядром і цією органелою. У такий спосіб нуклеїнові кислоти, що становлять інтерес, можуть бути синтезовані з застосуванням кодонів, які віддають перевагу хлоропласту. Дивись, наприклад, патент США № 5,380,831, який включено в даний опис за посиланням. Трансформація рослин Способи за цим винаходом передбачають введення нуклеотидної конструкції в рослину. Під «введенням» розуміється доставка нуклеотидної конструкції до рослини у такий спосіб, щоб ця конструкція отримала доступ до внутрішнього простору клітини даної рослини. Способи за цим винаходом не вимагають використання якогось конкретного методу для введення нуклеотидної конструкції в рослину, а вимагають тільки того, щоб нуклеотидна конструкція отримала доступ до внутрішнього простору щонайменше однієї клітини даної рослини. Методи для введення нуклеотидних конструкцій в рослини є відомими в цій галузі, включаючи, але не обмежуючись ними, методи стабільної трансформації, методи тимчасової трансформації і методи, опосередковані вірусом. Під «рослиною» розуміються цілі рослини, органи рослини (наприклад, листя, стовбури, корінці і т.п.), насіння, рослинні клітини, пагони, зародки і потомство рослин. Рослинні клітини можуть бути диференційованими або недиференційованими (наприклад, калюс, клітини в суспензійній культурі, протопласти, клітини листка, клітини корінця, клітини флоеми, пилок). «Трансгенні рослини», або «трансформовані рослини», або «стабільно трансформовані» рослини, або клітини, або тканини – ці терміни стосуються рослин, в яких є екзогенні послідовності нуклеїнових кислот або фрагменти ДНК, включені або інтегровані в рослинну клітину. Ці послідовності нуклеїнових кислот включають ті, що є екзогенними або не присутніми в нетрансформованій рослинній клітині, а також ті, що можуть бути ендогенними або присутніми в нетрансформованій рослинній клітині. «Гетерологічні» загалом стосується послідовностей нуклеїнових кислот, які не є ендогенними для даної клітини або частини нативного геному, в яких вони є присутніми, а були додані до цієї клітини шляхом інфекції, трансфекції, мікроін’єкції, електропорації, мікропроекції і т.п. Трансформація рослинних клітин може здійснюватись одним з кількох методів, відомих в цій галузі. Ген дельта-ендотоксину за цим винаходом можна модифікувати для досягнення або посилення експресії в рослинних клітинах. Типово, конструкція, яка експресує такий білок, мала б містити промотор, щоб запустити транскрипцію гену, а також не трансльовану ділянку 3′, щоб забезпечити термінацію транскрипції і поліаденілювання. Організація такої конструкції є добре відомою в цій галузі. В певних випадках може бути корисним конструювати цей ген таким, щоб результуючий пептид секретувався або якось по-іншому проявлявся в рослинній клітині. Наприклад, цей ген можна сконструювати так, щоб він містив сигнальний пептид для перенесення цього пептиду в ендоплазматичний ретикулум. Можна також сконструювати рослинну касету експресії так, щоб вона містила інтрон і щоб для експресії була необхідною обробка цього інтрону мРНК. Типово, ця «рослинна касета експресії» буде вводитись у «вектор трансформації рослини». Цей вектор трансформації рослини може складатись з одного або більше ДНК векторів, необхідних для досягнення трансформації рослини. Наприклад, загальною практикою в цій галузі є застосування векторів трансформації рослини, які складаються з більше ніж одного стичних сегментів ДНК. Такі вектори часто називають в цій галузі «бінарними векторами». Бінарні вектори, як і вектори з хелперними плазмідами, найчастіше використовуються для опосередкованої Agrobacterium трансформації, коли розмір і складність сегментів ДНК, необхідних для досягнення ефективної трансформації, є достатньо значними, і перевагу дає поділ функцій між окремими молекулами ДНК. Бінарні вектори типово містять плазмідний вектор, який, в свою чергу, містить діючі в cis-положенні послідовності, необхідні для переносу Т-ДНК (такого як лівий край і правий край), селективний маркер, який створюють так, щоб він був здатним до експресії в рослинній клітині, і «ген, що становить інтерес» (ген, який створюють так, щоб він був здатним до експресії в рослинній клітині, з якої бажано створити трансгенні рослини). Присутніми на цьому плазмідному векторі є також послідовності, необхідні для бактеріальної реплікації. Послідовності, діючі в cis-положенні, розміщуються у такий спосіб, щоб 11 UA 112405 C2 5 10 1520 25 30 35 40 45 50 55 60 забезпечити ефективне перенесення в рослинні клітини і експресію в них. Наприклад, ген селективного маркеру і дельта-ендотоксин розміщуються між лівим і правим краями. Часто другий плазмідний вектор містить фактори, діючі в trans-положенні, які опосередковують перенесення Т-ДНК від Agrobacterium до рослинних клітин. Ця плазміда часто містить функції вірулентності (гени Vir), що робить можливим інфікування рослинних клітин бактерією Agrobacterium і перенесення ДНК шляхом відщеплення по крайових послідовностях і опосередковане vir перенесення ДНК, як має бути зрозумілим спеціалістам в цій галузі (Hellens & Mullineaux (2000) Trends in Plant Science 5:446-451). Для трансформації рослин можуть використовуватись кілька типів штамів Agrobacterium (наприклад, LBA4404, GV3101, EHA101, EHA105 і т.д.). Другий плазмідний вектор не є необхідним для трансформації рослин іншими методами, такими як мікропроекція, мікроін’єкція, електропорація, метод з застосуванням поліетилен гліколю і т.п. Загалом, методи трансформації рослин передбачають перенесення гетерологічної ДНК в намічені рослинні клітини (наприклад, недозрілі або дозрілі зародки, суспензійні культури, недиференційований калюс, протопласти і т.п.) з наступним застосуванням максимального граничного рівня відповідної селекції (залежно від гену селективного маркеру) для виділення трансформованих рослинних клітин з маси нетрансформованих клітин. Експлантати типово переносяться у свіжу порцію того самого середовища і культивуються рутинним способом. Згодом трансформовані клітини диференціюються у ростки після перенесення на середовище для регенерації, доповнене максимальним граничним рівнем селективного агенту. Ростки потім переносять в селективне середовище для укорінення, щоб отримати укорінені ростки або саджанці. Ці трансгенні саджанці потім виростають у зрілу рослину і дають фертильне насіння (дивись, наприклад, Hiei et al. (1994) The Plant Journal 6:271-282; Ishida et al. (1996) Nature Biotechnology 14:745-750). Експлантати типово переносять у свіжу порцію того самого середовища і культивують рутинним способом. Загальний опис методик і методів отримання трансгенних рослин можна знайти у Ayres & Park (1994) Critical Reviews in Plant Science 13:219239 та Bommineni & Jauhar (1997) Maydica 42:107-120. Оскільки трансформований матеріал містить багато клітин, в будь-якій порції підданого обробці цільового калюсу, або тканини, або групи клітин присутні як трансформовані, так і нетрансформовані клітини. Здатність вбивати нетрансформовані клітини і забезпечувати трансформованим клітинам можливість проліферації дозволяє отримувати культуру трансформованих клітин. Часто здатність видаляти нетрансформовані клітини є обмеженням для швидкого виділення трансформованих рослинних клітин і успішної генерації трансгенних рослин. Протоколи трансформації, як і протоколи для введення нуклеотидних послідовностей в рослини, можуть змінюватись в залежності від типу рослини або рослинної клітини, тобто однодольні вони або дводольні, наміченої для трансформації. Отримання трансгенних рослин може здійснюватись одним з кількох методів, включаючи, але не обмежуючись ними, мікроін’єкцію, електропорацію, пряме перенесення гену, введення гетерологічної ДНК бактерією Agrobacterium в рослинні клітини (Agrobacterium-опосередкована трансформація), бомбардування рослинних клітин гетерологічною чужорідною ДНК, нанесеною на частки, балістичне прискорення часток, трансформацію під дією струменя аерозолю (опублікована патентна заявка США № 20010026941; патент США № 4,945,050; міжнародна публікація № WO 91/00915; опублікована патентна заявка США № 2002015066), трансформація Lec1 та різні інші методи – прямі і опосередковані, без застосування часток – перенесення ДНК. Методи для трансформації хлоропластів є відомими в цій галузі. Дивись, наприклад, Svab et al. (1990) Proc. Natl. Acad. Sci. USA 87:8526-8530; Svab & Maliga (1993) Proc. Natl. Acad. Sci. USA 90:913-917; Svab & Maliga (1993) EMBO J. 12:601-606. Ці методи базуються на використанні генної пушки для доставки ДНК, що містить селективний маркер, і націлюванні цієї ДНК на пластидний геном через гомологічну рекомбінацію. Додатково, трансформація пластиди може здійснюватись шляхом трансактивації мовчазного трансгену, що походить від пластиди, переважною тканинною експресією полімерази ядерної кодованої і пластид-спрямованої РНК. Таку систему було описано в McBride et al. (1994) Proc. Natl. Acad. Sci. USA 91:7301-7305. Після інтеграції гетерологічної чужорідної ДНК в рослинні клітини застосовують максимальний граничний рівень відповідної селекції в середовищі, щоб вбити нетрансформовані клітини та виділити і забезпечити проліферацію припустимо трансформованих клітин, які виживають після такої селекційної обробки, шляхом їх періодичного перенесення у свіже середовище. Такий безперервний пасаж і зараження з відповідною селекцією забезпечують ідентифікацію і проліферацію клітин, які трансформовані плазмідним вектором. Потім можна скористатись молекулярними і біохімічними методами, щоб підтвердити присутність інтегрованого гетерологічного гену, що становить інтерес, в геномі 12 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 даної трансгенної рослини. Клітини, які було трансформовано, можуть вирощуватись в рослини у відповідності до звичайних методів. Дивись, наприклад, McCormick et al. (1986) Plant Cell Reports 5:81-84. Ці рослини можуть потім вирощуватись і запилятись тим самим трансформованим штамом або іншими штамами, і отриманий гібрид буде мати конститутивну експресію бажаної фенотипової характеристики, яку було ідентифіковано. Можуть бути вирощені два або більше поколінь, щоб гарантувати, що експресія бажаної фенотипової характеристики стабільно підтримується і унаслідується, після чого збирають насіння, щоб підтвердити, що експресії бажаної фенотипової характеристики досягнуто. У такий спосіб даний винахід забезпечує трансформоване насіння (яке називають також «трансгенним насінням»), що має нуклеотидну конструкцію за цим винаходом, наприклад касету експресії за цим винаходом, стабільно включену в його геном. Оцінка трансформації рослин Після введення гетерологічної чужорідної ДНК в рослинні клітини трансформацію або інтеграцію гетерологічного гену в геном рослини підтверджують різними методами, такими як аналіз нуклеїнових кислот, білків і метаболітів, асоційованих з таким інтегрованим геном. Аналіз з використанням ПЛР є швидким методом для скринінгу трансформованих клітин, тканини або ростків на присутність інкорпорованого гену на ранній стадії до пересадки у ґрунт (Sambrook & Russell (2001) Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). ПЛР здійснюється із застосуванням олігонуклеотидних праймерів, специфічних для гену, що становить інтерес, або векторного фону Agrobacterium і т.п. Трансформацію рослин можна підтвердити за допомогою Саузерн-блотингу геномної ДНК (Sambrook & Russell, 2001, supra). Загалом, молекули ДНК видаляють з трансформанту, обробляють відповідними рестрикційними ферментами, розділяють на невеликі фрагменти в агарозному гелі і переносять на мембрану з нітроцелюлози або нейлону. Цю мембрану або 32 «блот» потім зондують, наприклад міченим радіоактивним P фрагментом цільової ДНК, щоб підтвердити інтеграцію введеного гену в геном рослини у відповідності до стандартних методів (Sambrook & Russell, 2001, supra). У випадку Нозерн-блотингу РНК виділяють зі специфічних тканин трансформанту, фракціонують у формальдегідному агарозному гелі і переносять на нейлоновий фільтр у відповідності до стандартних методик, які звичайно використовуються в цій галузі (Sambrook & Russell, 2001, supra). Потім експресію РНК, кодованої дельта-ендотоксином, тестують шляхом гібридизації фільтру до радіоактивного зонду, отриманого з дельта-ендотоксину, методами, відомими в цій галузі (Sambrook & Russell, 2001, supra). Вестерн блотинг, біохімічні аналізи і т.п. можуть здійснюватись на трансгенних рослинах, щоб підтвердити присутність білку, кодованого геном дельта-ендотоксину, стандартними методами (Sambrook & Russell, 2001, supra) з використанням антитіл, які зв’язуються з одним або більше епітопів, наявних на білку дельта-ендотоксину. Пестицидна активність в рослинах У відповідності до іншого аспекту цього винаходу, можна створювати трансгенні рослини, що експресують дельта-ендотоксин, який володіє пестицидною активністю. Описані вище для прикладу методи можуть бути використані для створення трансгенних рослин, але спосіб, у який генеруються клітини трансгенних рослин, не є вирішальним для даного винаходу. На розсуд експериментатора можуть використовуватись методи, відомі або описані в спеціальній літературі, такі як трансформація, опосередкована Agrobacterium, біолістична (біологічна і балістична) трансформація і методи без застосування часточок. Рослини, що експресують дельта-ендотоксин, можуть бути виділені методами, описаними в літературі, наприклад шляхом трансформації калюсу і регенерації фертильних рослин з такого трансгенного калюсу. В такому процесі будь-який ген може використовуватись в якості селективного маркеру, якщо його експресія в рослинних клітинах забезпечує здатність ідентифікувати або відбирати трансформовані клітини. Було розроблено низку маркерів для використання з рослинними клітинами, таких як резистентність до хлорамфеніколу, аміноглікозиду G418, гідроміцину і т.п. Інші гени, які кодують продукт, задіяний в метаболізмі хлоропласту, також можуть бути використані в якості селективних маркерів. Наприклад, гени, які забезпечують резистентність до рослинних гербіцидів, таких як гліфозат, бромоксиніл або імідазолінон, можуть знайти конкретне застосування. Про такі гени вже повідомлялось (Stalker et al. (1985) J. Biol. Chem. 263:6310-6314 (ген нітрілази, який визначає резистентність до бромоксинілу); та Sathasivan et al. (1990) Nucl. Acids Res. 18:2188 (ген резистентності до імідазолінону AHAS). До того ж, гени, про які тут 13 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 йдеться, використовуються як маркери для оцінки трансформації бактеріальних або рослинних клітин. Методи для визначення присутності трансгену в рослині, органі рослини (наприклад, листі, стовбурах, корінцях і т.п.), насінні, рослинній клітині, паростку, зародку або її потомстві є добре відомими в цій галузі. В одному варіанті здійснення присутність трансгену виявляється шляхом тестування на пестицидну активність. Фертильні рослини, що експресують дельта-ендотоксин, можуть тестуватись на пестицидну активність, і рослини, які демонструють оптимальну активність, відбираються для подальшої селекції. В цій галузі існують методи для оцінки пестицидної активності. Загалом, цей білок змішується і використовується у фідинг-аналізах (тобто таких, які передбачають годівлю). Дивись, наприклад, Marrone et al. (1985) J. of Economic Entomology 78:290-293. Цей винахід може бути використаний для трансформації будь-якого виду рослин, включаючи, але не обмежуючись ними, однодольні і дводольні рослини. Приклади рослин, що становлять інтерес, включають, не обмежуючись ними, кукурудзу (маїс), сорго, пшеницю, соняшник, томат, хрестоцвіті, перці, картоплю, бавовник, рис, соєві боби, цукровий буряк, цукрову тростину, тютюн, ячмінь, олійний рапс, Brassica sp., люцерну, жито, просо, сафлор, арахіс, батат, маніок, каву, кокосовий горіх, ананас, цитрусові, какао, чай, банани, авокадо, фіги, гуаву, манго, оливи, папайю, кеш’ю, макадамію, мигдаль, овес, овочі, декоративні рослини і хвойні. Овочі включають, не обмежуючись ними, томати, салат-латук, зелену квасолю, лімську квасолю, горох і представників роду Curcumis, таких як огірок, канталупа і мускусна диня. Декоративні рослини включають, не обмежуючись ними, азалію, гортензію, гібіскус, рози, тюльпани, нарциси, петунії, гвоздику, пуансетію (молочай найкрасивіший) і хризантему. Переважно, рослини за цим винаходом є сільськогосподарськими культурами (наприклад, маїс, сорго, пшениця, соняшник, томат, хрестоцвіті, перці, картопля, бавовник, рис, соєві боби, цукровий буряк, цукрова тростина, тютюн, ячмінь, олійний рапс і т.п.). Застосування для контролю шкідників Загальні методи для застосування штамів, що містять нуклеотидну послідовність за цим винаходом або її варіант, в контролі пестицидів або в створенні інших організмів як пестицидних агентів є відомими в цій галузі. Дивись, наприклад, патент США № 5,039,523 і EP 0480762A2. Штами Bacillus, що містять нуклеотидну послідовність за цим винаходом або її варіант, або мікроорганізми, які були генетично змінені, щоб містити пестицидний ген і білок, можуть бути використані для захисту сільськогосподарських культур і продуктів від шкідників. У відповідності до одного аспекту цього винаходу, цільні, тобто не піддані лізису, клітини токсин (пестицид)продукуючого організму обробляються реактивами, які пролонгують активність токсину, продукованого в клітині, коли ця клітина опиняється в оточенні шкідника-мішені. Як варіант, пестицид продукується шляхом введення гену дельта-ендотоксину в клітинухазяїна. Експресія гену дельта-ендотоксину приводить, прямо або непрямо, до внутрішньоклітинної продукції і підтримання пестициду. У відповідності до одного аспекту цього винаходу, ці клітини потім піддають обробці в умовах, які пролонгують активність токсину, продукованого в клітині, коли ця клітина опиняється в оточенні шкідника-мішені. Результуючий продукт зберігає токсичність цього токсину. Такі природно інкапсульовані пестициди можуть потім вводитись в різні рецептури у відповідності до звичайних методик застосування в середовищі існування шкідника-мішені, тобто в ґрунті, воді і листі рослин. Дивись, наприклад, публікацію EPA 0192319 і посилання, наведені в ній. Як варіант, клітини, що експресують ген за цим винаходом, можуть вводитись в різні рецептури так, щоб забезпечувалось застосування результуючого матеріалу як пестициду. Пестицидні композиції Активні інгредієнти за цим винаходом звичайно застосовуються у формі композицій і можуть вноситись на сільськогосподарські угіддя або наноситись на рослини, які обробляються, одночасно або послідовно з іншими сполуками. Цими сполуками можуть бути добрива, гербіциди, кріопротектори, сурфактанти, детергенти, пестицидні мила, неактивні олії, полімери та/або препарати-носії з уповільненим вивільненням або такі, що піддаються біологічному розкладанню, щоб забезпечити довгострокову дію на оброблену ділянку після єдиного внесення такого препарату. Вони можуть бути також селективними гербіцидами, хімічними інсектицидами, віруцидними засобами, мікробіцидами, амебіцидами, пестицидами, фунгіцидами, бактеріоцидами, нематоцидами, молюскіцидами або сумішами з кількох таких препаратів, якщо це бажано, разом з додатковими, прийнятними з сільськогосподарської точки зору носіями, сурфактантами або ад’ювантами, що полегшують внесення і звичайно використовуються в приготуванні препаратів. Придатні носії і ад’юванти можуть бути твердими або рідкими, і вони відповідають тим речовинам, які звичайно використовуються в технології приготування 14 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 препаратів, наприклад природним або регенерованим мінеральним речовинам, розчинникам, диспергаторам, агентам для зволоження, агентам для підвищення липкості, зв’язувальним речовинам або добривам. Подібно до цього, препарати можуть готуватись як їстівні «принади» або їм може надаватись форма «пастки» для шкідників, щоб пестицидний препарат поїдався або попадав всередину шкідника-мішені. Методи нанесення активного інгредієнту за цим винаходом або агрохімічної композиції за цим винаходом, яка містить щонайменше один з пестицидних білків, продукованих бактеріальними штамами за цим винаходом, включають нанесення на листя, покриття насіння і внесення у ґрунт. Кількість нанесень і частота нанесення залежать від інтенсивності зараження відповідним шкідником. Композиція може бути приготовлена як порошок, пилоподібний препарат, таблетки, гранули, аерозоль, емульсія, колоїдні частки, розчин і т.п., для чого використовуються такі звичайні методи, як десикація, ліофілізація, гомогенізація, екстракція, фільтрація, центрифугування, седиментація або концентрування культури клітин, що містять потрібний поліпептид. У всіх таких композиціях, що містять щонайменше один такий пестицидний поліпептид, цей поліпептид може бути присутнім в концентрації від приблизно 1 % до приблизно 99 % за вагою. Знищувати або зменшувати чисельність лускокрилих, твердокрилих і нематодних шкідників на даній ділянці можна способами за цим винаходом, або композиції за цим винаходом можна профілактично вносити на ділянці, щоб попередити зараження уразливим шкідником. Переважно, такий шкідник поїдає пестицидно ефективну кількість або контактує з пестицидно ефективною кількістю поліпептиду. Під «пестицидно ефективною кількістю» розуміється кількість пестициду, здатна викликати загибель щонайменше одного шкідника або відчутно зменшити ріст, харчування або нормальний фізіологічний розвиток шкідника. Ця кількість може коливатись в залежності від таких чинників, як, наприклад, конкретні шкідники-мішені, які мають контролюватись, конкретна територія, місцезнаходження, рослина, сільськогосподарська культура або земельна ділянка, яка має оброблятись, умови оточуючого середовища, а також спосіб, частота, концентрація, стабільність і кількість пестицидно ефективної поліпептидної композиції, що вноситься. Препарати також можуть бути різними в залежності від кліматичних умов, міркувань щодо захисту оточуючого середовища та/або частоти внесення та/або тяжкості зараження шкідниками. Описані пестицидні композиції можуть готуватись шляхом сполучення суспензії бактеріальних клітин, кристалів та/або спор або виділеного білкового компоненту з бажаним носієм, прийнятним для застосування у сільському господарстві. Такі композиції можуть готуватись перед введенням у відповідний засіб, такий як ліофілізований, висушений виморожуванням, дегідратований, або у водний носій, середовище або придатний розріджувач, такий як сольовий розчин або інший буфер. Готові композиції можуть мати вигляд пилоподібного або гранульованого матеріалу або суспензії в олії (рослинній або мінеральній) або воді, або емульсії олія / вода, або як порошок, що змочується, або в комбінації з будь-яким іншим матеріалом-носієм, придатним для застосування у сільському господарстві. Придатні для застосування у сільському господарстві носії можуть бути твердими або рідкими і є добре відомими в цій галузі. Термін «носій, придатний для застосування у сільському господарстві» охоплює всі ад’юванти, інертні компоненти, диспергатори, підсилювачі липучості, зв’язувальні речовини і т.п., які звичайно використовуються у виробництві пестицидів; вони є добре відомими спеціалістам в галузі приготування пестицидних препаратів. Такі препарати можуть змішуватись з одним або більше твердих або рідких ад’ювантів і готуватись різними методами, наприклад змішуванням, гомогенізацією та/або розмелюванням пестицидної композиції з відповідними ад’ювантами із застосуванням звичайних методик приготування. Придатні препарати і способи внесення описані в патенті США № 6,468,523, який включено в даний опис за посиланням. «Шкідник» включає, не обмежуючись ними, комах, грибів, бактерій, нематод, кліщів, іксодових кліщів і т.п. Шкідливі комахи включають комах, вибраних з рядів Coleoptera, Diptera, Hymenoptera, Lepidoptera, Mallophaga, Homoptera, Hemiptera, Orthroptera, Thysanoptera, Dermaptera, Isoptera, Anoplura, Siphonaptera, Trichoptera etc., особливо Coleoptera, Lepidoptera і Diptera. Ряд Coleoptera включає підряди Adephaga і Polyphaga. Підряд Adephaga включає надродини Caraboidea і Gyrinoidea, тоді як підряд Polyphaga включає надродини Hydrophiloidea, Staphylinoidea, Cantharoidea, Cleroidea, Elateroidea, Dascilloidea, Dryopoidea, Byrrhoidea, Cucujoidea, Meloidea, Mordelloidea, Tenebrionoidea, Bostrichoidea, Scarabaeoidea, Cerambycoidea, Chrysomeloidea і Curculionoidea. Надродина Caraboidea включає родини Cicindelidae, Carabidae і Dytiscidae. Надродина Gyrinoidea включає родину Gyrinidae. Надродина Hydrophiloidea включає 15 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 родину Hydrophilidae. Надродина Staphylinoidea включає родини Silphidae і Staphylinidae. Надродина Cantharoidea включає родини Cantharidae і Lampyridae. Надродина Cleroidea включає родини Cleridae і Dermestidae. Надродина Elateroidea включає родини Elateridae і Buprestidae. Надродина Cucujoidea включає родину Coccinellidae. Надродина Meloidea включає родину Meloidae. Надродина Tenebrionoidea включає родину Tenebrionidae. Надродина Scarabaeoidea включає родини Passalidae and Scarabaeidae. Надродина Cerambycoidea включає родину Cerambycidae. Надродина Chrysomeloidea включає родину Chrysomelidae. Надродина Curculionoidea включає родини Curculionidae і Scolytidae. Ряд Diptera включає підряди Nematocera, Brachycera і Cyclorrhapha. Підряд Nematocera включає родини Tipulidae, Psychodidae, Culicidae, Ceratopogonidae, Chironomidae, Simuliidae, Bibionidae і Cecidomyiidae. Підряд Brachycera включає родини Stratiomyidae, Tabanidae, Therevidae, Asilidae, Mydidae, Bombyliidae і Dolichopodidae. Підряд Cyclorrhapha включає розділи Aschiza і Aschiza. Розділ Aschiza включає родини Phoridae, Syrphidae і Conopidae. Розділ Aschiza включає підрозділи Acalyptratae і Calyptratae. Підрозділ Acalyptratae включає родини Otitidae, Tephritidae, Agromyzidae і Drosophilidae. Підрозділ Calyptratae включає родини Hippoboscidae, Oestridae, Tachinidae, Anthomyiidae, Muscidae, Calliphoridae і Sarcophagidae. Ряд Lepidoptera включає родини Papilionidae, Pieridae, Lycaenidae, Nymphalidae, Danaidae, Satyridae, Hesperiidae, Sphingidae, Saturniidae, Geometridae, Arctiidae, Noctuidae, Lymantriidae, Sesiidae і Tineidae. Нематоди включають паразитичних нематод, таких як бульбові нематоди, гетеродериди і нематоди, що викликають ураження, включаючи Heterodera spp., Meloidogyne spp. і Globodera spp.; зокрема представників гетеродерид, включаючи, але не обмежуючись ними, Heterodera glycines (нематода соєвих бобів); Heterodera schachtii (бурякова нематода); Heterodera avenae (злакова нематода); а також Globodera rostochiensis і Globodera pailida (картопляні нематоди). Нематоди, що викликають ураження, включають Pratylenchus spp. Комахи-шкідники за цим винаходом для основних сільськогосподарських культур включають: Маїс: Ostrinia nubilalis, метелик кукурудзяний; Agrotis ipsilon, совка іпсилон; Helicoverpa zea, совка бавовникова; Spodoptera frugiperda, совка трав’яна; Diatraea grandiosella, вогнівка кукурудзяна південно-західна; Elasmopalpus lignosellus, малий точильник стебел кукурудзи; Diatraea saccharalis, точильник цукрової тростини; Diabrotica virgifera, західний кукурудзяний жук; Diabrotica longicornis barberi, північний кукурудзяний жук; Diabrotica undecimpunctata howardi, південний кукурудзяний жук; Melanotus spp., дротяники; Cyclocephala borealis, північний ряжений хрущ (личинка хруща); Cyclocephala immaculata, південний ряжений хрущ (личинка хруща); Popillia japonica, хрущик японський; Chaetocnema pulicaria, блішка кукурудзяна; Sphenophorus maidis, довгоносик кукурудзяний; Rhopalosiphum maidis, тля кукурудзяна листяна; Anuraphis maidiradicis, тля кукурудзяна корінцева; Blissus leucopterus leucopterus, клоп-черепашка пшеничний північноамериканський; Melanoplus femurrubrum, червононогий коник; Melanoplus sanguinipes, кобилка мексиканська; Hylemya platura, личинка мухи росткової; Agromyza parvicornis, кукурудзяна міль пістрява; Anaphothrips obscrurus, трипс злаковий; Solenopsis milesta, мураха-злодій; Tetranychus urticae, звичайний павутинний кліщ; Сорго: Chilo partellus, сорговий точильник; Spodoptera frugiperda, совка трав’яна; Helicoverpa zea, черв’як коробочний; Elasmopalpus lignosellus, малий точильник стебел; Feltia subterranea, зернова совка; Phyllophaga crinita, личинка хруща; Eleodes, Conoderus і Aeolus spp., дротяники; Oulema melanopus, п’явиця червоногруда; Chaetocnema pulicaria, жук-блошка; Sphenophorus maidis, довгоносик кукурудзяний; Rhopalosiphum maidis; тля соргова листова; Sipha flava, жовта тля цукрової тростини; Blissus leucopterus leucopterus, клоп-черепашка пшеничний північноамериканський; Contarinia sorghicola, галиця соргова; Tetranychus cinnabarinus, червоний павутинний кліщ; Tetranychus urticae, звичайний павутинний кліщ; Пшениця: Pseudaletia unipunctata, черв’як-легіонер; Spodoptera frugiperda, совка трав’яна; Elasmopalpus lignosellus, малий точильник стебел; Agrotis orthogonia, совка прямокутна; Elasmopalpus lignosellus, малий точильник стебел; Oulema melanopus, п’явиця червоногруда; Hypera punctata, слоник листяний бобовий; Diabrotica undecimpunctata howardi, блошка 11-точкова Говарда; російська пшенична тля; Schizaphis graminum, тля злакова звичайна; Macrosiphum avenae, тля злакова; Melanoplus femurrubrum, червононогий коник; Melanoplus differentialis, кобилка відмінна; Melanoplus sanguinipes, кобилка мексиканська; Mayetiola destructor, гессенська мушка; Sitodiplosis mosellana, галиця злакова; Meromyza americana, личинка американської меромізи; Hylemya coarctata, муха озима; Frankliniella fusca, тютюновий трипс; Cephus cinctus, стебловий пиляльщик хлібний; Aceria tulipae, цибулинний кліщ тюльпанів; Соняшник: Suleima helianthana, листоверка брунькова соняшникова; Homoeosoma electellum, вогнівка соняшникова; zygogramma exclamationis, совка соняшникова оклична; Bothyrus gibbosus, жук морквяний; 16 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 Neolasioptera murtfeldtiana, галиця соняшникова; Бавовник: Heliothis virescens, бавовникова совка; Helicoverpa zea, черв’як коробочний; Spodoptera exigua, совка мала; Pectinophora gossypiella, черв’як коробочний рожевий; Anthonomus grandis, довгоносик бавовниковий; Aphis gossypii, тля бавовникова; Pseudatomoscelis seriatus, блошка бавовникова; Trialeurodes abutilonea, смугаста білокрилка; Lygus lineolaris, клоп трав’яний; Melanoplus femurrubrum, червононогий коник; Melanoplus differentialis, кобилка відмінна; Thrips tabaci, трипс тютюновий; Franklinkiella fusca, трипс тютюновий; Tetranychus cinnabarinus, червоний павутинний кліщ; Tetranychus urticae, звичайний павутинний кліщ; Рис: Diatraea saccharalis, точильник цукрової тростини; Spodoptera frugiperda, совка трав’яна; Helicoverpa zea, черв’як коробочний; Colaspis brunnea, листоверка виноградна; Lissorhoptrus oryzophilus, довгоносик рисовий водний; Sitophilus oryzae, довгоносик рисовий; Nephotettix nigropictus, рисова цикадка; Blissus leucopterus leucopterus, клоп-черепашка пшеничний північноамериканський; Acrosternum hilare, зелений щитник; Соєві боби: Pseudoplusia includens, п’ядениця соєвих бобів; Anticarsia gemmatalis, гусениця оксамитових бобів; Plathypena scabra, зелена гусениця вогнівки; Ostrinia nubilalis, метелик кукурудзяний; Agrotis ipsilon, совка іпсилон; Spodoptera exigua, мала совка; Heliothis virescens, бавовникова совка; Helicoverpa zea, коробочний черв’як; Epilachna varivestis, зернівка бобова мексиканська; Myzus persicae, тля персикова зелена; Empoasca fabae, цикадка картопляна; Acrosternum hilare, тля злакова звичайна; Melanoplus femurrubrum, червононогий коник; Melanoplus differentialis, кобилка відмінна; Hylemya platura, личинка мухи росткової; Sericothrips variabilis, трипси соєвих бобів; Thrips tabaci, трипс тютюновий; Tetranychus turkestani, кліщик павутинний атлантичний; Tetranychus urticae, звичайний павутинний кліщ; Ячмінь: Ostrinia nubilalis, метелик кукурудзяний; Agrotis ipsilon, совка-іпсилон; Schizaphis graminum, тля злакова звичайна; Blissus leucopterus leucopterus, клоп-черепашка пшеничний північноамериканський; Acrosternum hilare, зелений щитник; Euschistus servus, бурий щитник; Delia platura, личинка мухи росткової; Mayetiola destructor, мушка гессенська; Petrobia latens, кліщик пшеничний; Олійний рапс: Brevicoryne brassicae, тля капустяна; Phyllotreta cruciferae, земляні блошки; Mamestra configurata, черв’як-легіонер Берта; Plutella xylostella, міль капустяна; Delia ssp., безногі личинки корінцеві. Методи підвищення виходу рослинної біомаси Пропонуються методи для підвищення виходу рослин. Ці методи передбачають введення в рослину або рослинну клітину полінуклеотиду, який місить описану тут пестицидну послідовність. Як визначено тут, «вихід» рослини стосується якості та/або кількості біомаси, продукованої рослиною. Під «біомасою» розуміється будь-який рослинний продукт, що піддається вимірюванню. Зростання виходу біомаси означає зростання виробництва будь-якого рослинного продукту. Збільшення виходу рослинної біомаси має кілька практичних застосувань. Наприклад, збільшення біомаси листя рослини може збільшити врожайність листяних овочів для споживання людиною або тваринами, До того ж, збільшення біомаси листя може використовуватись для збільшення виробництва фармацевтичних і промислових продуктів рослинного походження. Збільшення виходу може означати будь-яке статистично достовірне зростання, включаючи, але без обмеження, щонайменше 1 % зростання, щонайменше 3 % зростання, щонайменше 5 % зростання, щонайменше 10 % зростання, щонайменше 20 % зростання, щонайменше 30 % зростання, щонайменше 50 % зростання, щонайменше 70 % зростання, щонайменше 100 % або більше зростання виходу у порівнянні з рослиною, яка не експресує пестицидної послідовності. В конкретних методах вихід рослинної біомаси збільшується як результат поліпшеної стійкості до шкідників рослини, яка експресує описаний тут пестицидний білок. Експресія пестицидного білку має своїм результатом знижену здатність шкідника заражати або поїдати рослину, чим поліпшує вихід рослинної біомаси. Наступні приклади пропонуються тільки для ілюстрації і жодним чином для обмеження. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Приклад 1. Відкриття нових пестицидних генів у Bacillus thuringiensis Нові пестицидні гени були ідентифіковані в бактеріальних штамах, наведених в Таблиці 1, з використанням наступних етапів: - Отримання екстрахромосомної ДНК зі штаму, який містить плазміди, де типово знаходяться гени дельта-ендотоксину. - Механічна фрагментація екстрахромосомної ДНК для отримання невеликих фрагментів з певним розподілом розмірів. - Клонування фрагментів екстрахромосомної ДНК від ~2 Кб до ~10 Кб. - Вирощування ~1500 клонів екстрахромосомної ДНК. - Часткове секвенування цих 1500 клонів з використанням праймерів, специфічних для 17 UA 112405 C2 5 вектору клонування (кінцеві зчитки). - Ідентифікація припустимих генів токсину через аналіз гомології з використанням підходу MiDAS (як описано в патентній публікації США № 20040014091, яку включено в даний опис за посиланням у всій її повноті). - Надання кінцевого вигляду послідовності (прогулянка вздовж послідовності) для клонів, що містять фрагменти припустимих генів токсину, що становлять інтерес. Таблиця 1. Перелік нових генів, виділених з Bacillus thuringiensis Ген Штам axmi046 2 axmi048 3 axmi050 4 axmi051 5 axmi052 axmi053 axmi054 axmi055 axmi056 axmi057 axmi058 axmi059 axmi060 axmi061 axmi067 1 ATX13026 ATX13026 ATX21049 ATX21049 ATX21049 ATX21049 ATX21049 ATX12976 ATX12976 ATX13058 ATX13058 ATX13058 ATX13058 ATX13058 ATX12974 axmi069 ATX12997 axmi071 axmi072 axmi073 axmi074 axmi075 axmi087 axmi088 axmi093 ATX12982 ATX12982 ATX16042 ATX12993 ATX12997 ATX13030 ATX13039 ATX13058 Аміно- Відсоток ідентичності Нуклеотидна кислотна з найближчою Найближча відома SEQ ID №: SEQ ID відомою послідовність №: послідовністю 1 61 54,30 % Cry4Aa1 2 62 56,4 % Cry4Ba1 3 63 17,9 % Cry21Ba1 4 64 21,3 % Cry35Ac1 5 65 19,70 % Cry35Aa1 6 66 21,9 % Cry35Ac1 7 67 20,1 % Cry35Ac1 8 68 42,0 % Cry32Ca1 9 69 (гомологія до N-кінця) BinA/BinB 10 70 73,1 % Cry32Da1 11 71 26,8 % Cry6Ba1 12 72 56,0 % Cry32Aa1 13 73 54,6 % Cry32Aa1 14 74 29,2 % Cry45Aa1 15 75 36,3 % Cry32Da1 Певна гомологія N17 77 Cry32Ca1 кінця 18 78 22,9 % Cry21Ba1 19 79 16,4 % Mtx2 20 80 15,3 % Mtx2 21 81 43,8 % Cry21Ba1 22 82 30,4 % Cry32Da1 27 87 71,0 % Cry8Aa1 28 88 26,2 % Cry21Ba1 31 91 56,1 % Cry32Aa1 1 Потенційна ко-активність, коли експресується або парується з іншим Axmi0014 або Axmi008 2 Потенційна ко-активність, коли експресується або парується з іншим Axmi0014 або Axmi009 3 Домен N-кінця гомологічний каталітичному домену С фосфоліпази 4 Потенційна ко-активність, коли експресується або парується з іншим Axmi0052 5 Потенційна ко-активність, коли експресується або парується з іншим Axmi0051 10 15 токсином, таким як токсином, таким як токсином, таким як токсином, таким як Приклад 2. Відкриття нових пестицидних генів у Bacillus thuringiensis Нові пестицидні гени були ідентифіковані в бактеріальних штамах, наведених в Таблиці 2, з використанням підходу MiDAS (як описано в патентній публікації США № 20040014091, яку включено в даний опис за посиланням у всій її повноті) із застосуванням наступних етапів: - Отримання екстрахромосомної ДНК зі штаму. Екстрахромосомна ДНК містить суміш певної частини або всього наступного: плазміди різного розміру; фагові хромосоми; фрагменти геномної ДНК, не відділені за протоколом очистки; інші не охарактеризовані екстрахромосомні молекули. 18 UA 112405 C2 5 - Механічна або ферментативна фрагментація екстрахромосомної ДНК для отримання невеликих фрагментів з певним розподілом розмірів. - Секвенування фрагментованої ДНК. - Ідентифікація припустимих генів токсину через гомологію та/або інші обчислювальні аналізи. - При необхідності, надання кінцевого вигляду послідовності (прогулянка вздовж послідовності) гену, що становить інтерес, з використанням однієї з кількох стратегій ПЛР або клонування (наприклад, TAIL-PCR). Таблиця 2. Перелік нових генів, виділених з Bacillus thuringiensis Відсоток ідентичності з Нуклеотидна Аміно-кислотна найближчою SEQ ID №: SEQ ID №: відомою послідовністю 23 83 36,7 % 24 84 39,9 % Ген Штам axmi079 axmi080 ATX12974 ATX12974 axmi081 ATX12974 25 85 68 % axmi082 axmi091 axmi092 axmi096 axmi097 axmi098 ATX13056 ATX13053 ATX13053 ATX13007 ATX13007 ATX13007 26 29 30 32 33 34 86 89 90 92 93 94 axmi099 ATX13007 35 95 47,8 % 35,3 % 74,4 % 29,6 % 29,3 % 56 % 69 % 61 % 60 % 45 % 45 % axmi100 ATX12990 36 96 axmi101 ATX13035 37 97 axmi102 ATX13056 38 98 axmi103 ATX13056 39 99 axmi104 ATX13058 40 100 axmi107 ATX13007 41 101 axmi108 ATX12984 42 102 19 77 % 76 % 74 % 72 % 65 % 62 % 60 % 58 % 86 % 65 % 58 % 56 % 64 % 58 % 56 % 52 % 19,3 % 18,3 % 17,1 % 17,1 % 35 % 34 % 90 % 25 % Найближча відома послідовність Cry32Da1 Cry42Aa1 Orf3, описана як ‘C-кінець половина білку Cry’ Cry32Da1 Cry8Ba1 Cry39Orf2 Cry32Da1 Cry32Da1 Cry41Ab1 axmi081 axmi067 axmi079 axmi075 Cry32Ca1 Cry9Ca1 Cry9Ea1 axmi002 Cry9Bb1 Cry7Ba1 axmi037 axmi029 Cry7Ab2 axmi082 axmi093 axmi059 Cry32Aa1 axmi082 Cry32Da1 axmi093 axmi059 axmi020 Cry21Ba1 Cry5Ba1 Cry44Aa Vip1Aa2 Vip1Da1 Cry45Aa1 Cry23Aa1 UA 112405 C2 Ген Штам axmi109 axmi110 axmi111 axmi112 ATX12984 ATX12984 ATX12984 ATX12987 axmi114 ATX14903 axmi116 ATX12975 axmi117 ATX13029 axmi118 ATX12989 axmi119 ATX13029 axmi120 ATX13034 axmi121 ATX13034 axmi122 ATX13034 axmi123 ATX12989 axmi124 ATX9387 axmi125 7 ATX13029 Відсоток ідентичності з Нуклеотидна Аміно-кислотна найближчою SEQ ID №: SEQ ID №: відомою послідовністю 43 103 38 % 44 104 43 % 45 105 34 % 46 106 96 % 85,8 % 85,8 % 47 107 56,7 % 57,2 % 56,3 % 53,5 % 53,2 % 53,1 % 48 108 53 % 52,3 % 50,3 % 92,2 % 109 49 48,2 % 110 47,1 % 25,3 % 50 111 22,2 % 28,8 % 27,8 % 51 112 27,5 % 26,5 % 26,2 % 50 % 49,5 % 52 113 49,1 % 53 114 47,8 % 54 115 47,8 % 47 % 45,8 % 51,1 % 55 116 47,9 % 23,1 % 22,8 % 56 117 22,1 % 21,4 % 26,7 % 22,7 % 57 118 21,8 % 19 % 57,6 % 29,1 % 28,4 % 27,1 % 58 119 26,5 % 26,1 % 25,6 % 24,4 % 38,4 % 36,7 % 59 120 31,3 % 31 % 20 Найближча відома послідовність Cry45Aa1 Cry32Aa1 Cry41Ab1 Cry1Ab axmi043 axmi028 axmi037 Cry7Ca1 Cry7Ab2 Cry7Ba1 axmi114 axmi028 axmi043 Cry7Ca1 Cry7Ab1 Cry22Ba1 Cry22Aa1 Cry22Ab1 axmi011 Mtx2 axmi027 axmi066 Cry2Ae1 axmi076 Cry18Aa1 Cry8Aa1 axmi087 Cry8Bb1 Cry8Bc1 Cry8Da1 Cry8Ba1 Cry8Ca1 axmi013 Mtx3 axmi013 Mtx2 Mtx3 axmi095 Cry33Aa1 Cry23Aa1 Cry15Aa1 axmi061 axmi088 axmi040 axmi049 Cry5Ab1 Cry21Ba1 Cry12Aa1 axmi074 axmi031 Cry10Aa1 Cry10Aa2 axmi007 axmi006 UA 112405 C2 Ген Штам 8 ATX13029 axmi127 axmi129 axmi164 axmi151 axmi161 axmi183 axmi132 axmi138 axmi137 ATX13034 ATX13015 ATX22201 ATX12998 ATX12998 ATX14775 ATX13029 ATX13027 ATX9387 axmi126 Відсоток ідентичності з Нуклеотидна Аміно-кислотна найближчою SEQ ID №: SEQ ID №: відомою послідовністю 82,6 % 81,5 % 80,9 % 80,9 % 60 121 80,5 % 79,2 % 75,3 % 65 % 64,1 % 124 133 58 % 125 134 63 % 126 135 77 % 127 136 61 % 128 137 52 % 129 138 69 % 130 139 55 % 131 140 47 % 132 141 61 % 1 5 10 15 20 25 30 35 Найближча відома послідовність axmi047 axmi084 axmi086 axmi090 axmi046 axmi048 axmi092 Cry4Ba1 Cry4Aa1 Cry8Da1 Cry8Aa1 Cry8Aa1 Cry7Ba Cry7Ca1 Cry9Eb1 Cry4Ba Cry41Aa1 Axmi075 Цей ген є N-термінальною частиною розщепленого гену cry і є спареним в своєму нативному контексті з Axmi126, який представляє С-термінальну частину розщепленої пари cry. Ці гени можуть діяти як ко-токсини і можуть демонструвати посилену, нову або змінену активність, коли ко-експресуються або зливаються. Проміжна ділянка між Axmi125 і розміщеним далі Axmi126 наведена в послідовності SEQ ID №:122. 2 Цей ген є С-термінальною частиною розщепленого гену cry і є спареним в своєму нативному контексті з Axmi125, який представляє N-термінальну частину розщепленої пари cry. Ці гени можуть діяти як ко-токсини і можуть демонструвати посилену, нову або змінену активність, коли ко-експресуються або зливаються. Приклад 3. Відкриття нового гену токсину Axmi068 у Bacillus thuringiensis, штам ATX13046 Штам, кодуючий axmi068, було ідентифіковано наступним чином: - Інформацію щодо послідовності від відомих або підозрюваних генів токсину було використано для забезпечення зіставлення, що представляє збережені і частково збережені послідовності ДНК в межах групи (родини) токсинів. - Були розроблені праймери полімеразної ланцюгової реакції (ПЛР), щоб вибірково ампліфікувати одного або більше представників родини токсинів на основі зіставленої послідовності. - ДНК, виділену з бактеріальних штамів, було піддано скринінгу за допомогою ПЛР, щоб ідентифікувати штами, які містять припустиму гомологи з родиною цільового гену. - Продукти ПЛР було піддано секвенуванню, щоб відібрати штам, який містить ген, що становить інтерес. Повну послідовність цього гену було ідентифіковано з відібраного штаму з використанням підходу MiDAS геноміки (патентна публікація США № 20040014091) наступним чином: - Отримання екстрахромосомної ДНК з відібраного штаму. Екстрахромосомна ДНК містить суміш певної частини або всього з наступного: плазміди різного розміру; фагові хромосоми; фрагменти геномної ДНК, не відділені за протоколом очистки; інші не охарактеризовані екстрахромосомні молекули. - Механічна або ферментативна фрагментація екстрахромосомної ДНК для отримання невеликих фрагментів з певним розподілом розмірів. - Клонування фрагментів екстрахромосомної ДНК в плазмідний вектор. - Вирощування і очистка клонованих фрагментів екстрахромосомної ДНК. - Часткове секвенування цих клонів. - Ідентифікація припустимих генів токсину через гомологію та/або з використанням інших обчислювальних аналізів. - При необхідності, надання кінцевого вигляду послідовності (прогулянка вздовж послідовності) клонів, що містять послідовність припустимих генів токсину, який становить 21 UA 112405 C2 5 10 15 20 інтерес. - Нуклеотидну послідовність для axmi068 наведено в SEQ ID №:16, а амінокислотну послідовність для AXMI068 наведено в SEQ ID №:76. Характеристики гену і білку Довжина гену, пар основ ДНК: 1791 Довжина білку, амінокислотних залишків: 597 Оцінна молекулярна вага білку, Да: 66495 Відомі гомологи і відповідний відсоток ідентичності: Cry1Id1; 71,4 % Приклад 4. Експресія в Bacillus Описаний тут інсектицидний ген ампліфікується з використанням ПЛР, а продукт ПЛР клонується у вектор експресії Bacillus рАХ916 або інший придатний вектор методами, добре відомими в цій галузі. Результуючий штам Bacillus, який містить цей вектор з геном axmi, культивується на звичайному живильному середовищі, такому як середовище CYS (10 г/л Бакто-казитону; 3 г/л дріжджового екстракту; 6 г/л KH2PO4; 14 г/л K2HPO4; 0,5 мМ MgSO4; 0,05 мМ MnCl2; 0,05 мМ FeSO4), доки мікроскопічне дослідження не виявить утворення спор. Зразки після відповідної підготовки тестувались на активність в біопробах. Приклад 5. Конструювання синтетичних послідовностей У відповідності до одного аспекту цього винаходу, було створено синтетичні послідовності axmi. Ці синтетичні послідовності мають послідовність ДНК, змінену по відношенню до материнської послідовності, і кодують білок, що є колінеарним з материнським білком АХМІ, якому він відповідає, але у якого відсутній С-термінальний «кристалічний домен», що є присутнім у багатьох білків дельта-ендотоксинів. Синтетичні гени представлені в Таблиці 3. Таблиця 3 Назва гену дикого типу axmi050 axmi051 axmi052 axmi053 axmi054 axmi055 axmi056 axmi057 axmi058 axmi059 axmi060 axmi061 axmi067 axmi069 axmi071 Назва синтетичного гену axmi050bv01 axmi050bv02 axmi051bv01 axmi051bv02 axmi052bv01 axmi052bv02 axmi053bv01 axmi053bv02 axmi054bv01 axmi054bv02 axmi055bv01 axmi055bv02 axmi056bv01 axmi056bv02 axmi057bv01 axmi057bv02 axmi058bv01 axmi058bv02 axmi059_1bv01 axmi059_1bv02 axmi059_2bv01 axmi059_2bv02 axmi060bv01 axmi060bv02 axmi061bv01 axmi061bv02 axmi067bv01 axmi067bv02 axmi069bv01 axmi069bv02 axmi071bv01 axmi071bv02 22 SEQ ID №: 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 UA 112405 C2 Назва гену дикого типу axmi072 axmi073 axmi074 axmi075 axmi079 axmi080 axmi082 axmi087 axmi088 axmi091 axmi093 axmi096 axmi097 axmi098 axmi100 axmi101 axmi102 axmi103 axmi104 axmi107 axmi108 axmi109 axmi110 axmi111 axmi112 Назва синтетичного гену axmi072bv01 axmi072bv02 axmi073bv01 axmi073bv02 axmi074bv01 axmi074bv02 axmi075bv01 axmi075bv02 axmi079bv01 axmi079bv02 axmi080bv01 axmi080bv02 axmi082bv01 axmi082bv02 axmi087_1bv01 axmi087_1bv02 axmi087_2bv01 axmi087_2bv02 axmi088bv01 axmi088bv02 axmi091bv01 axmi091bv02 axmi093bv01 axmi093bv02 axmi096bv01 axmi096bv02 axmi097_1bv01 axmi097_1bv02 axmi097_2bv01 axmi097_2bv02 axmi098bv01 axmi098bv02 axmi100bv01 axmi100bv02 optaxmi100v01 optaxmi100v02 axmi101_1bv01 axmi101_1bv02 axmi101_2bv01 axmi101_2bv02 axmi102bv01 axmi102bv02 axmi103bv01 axmi103bv02 axmi104bv01 axmi104bv02 axmi107bv01 axmi107bv02 axmi108bv01 axmi108bv02 axmi109bv01 axmi109bv02 axmi110bv01 axmi110bv02 axmi111bv01 axmi111bv02 axmi112bv01 23 SEQ ID №: 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 282 283 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 UA 112405 C2 Назва гену дикого типу axmi114 axmi116 axmi117 axmi118 axmi119 axmi120 axmi121 axmi122 axmi123 axmi124 axmi125 axmi127 axmi129 axmi137 axmi138 axmi151 axmi161 axmi164 axmi183 Назва синтетичного гену axmi112bv02 axmi114bv01 axmi114bv02 axmi116bv01 axmi116bv02 axmi117bv01 axmi117bv02 axmi118bv01 axmi118bv02 axmi119bv01 axmi119bv02 axmi120_1bv01 axmi120_1bv02 axmi120_2bv01 axmi120_2bv02 axmi121bv01 axmi121bv02 axmi122bv01 axmi122bv02 axmi123bv01 axmi123bv02 axmi124bv01 axmi124bv02 axmi125bv01 axmi125bv02 axmi127_1bv01 axmi127_1bv02 axmi127_2bv01 axmi127_2bv02 axmi129_1bv01 axmi129_1bv02 axmi129_2bv01 axmi129_2bv02 axmi137bv01 axmi137bv02 axmi138bv01 axmi138bv02 axmi151_1bv01 axmi151_1bv02 axmi151_2bv01 axmi151_2bv02 axmi161_1bv01 axmi161_1bv02 axmi161_2bv01 axmi161_2bv02 axmi164_1bv01 axmi164_1bv02 axmi164_2bv01 axmi164_2bv02 axmi183_2bv01 axmi183_2bv02 axmi183bv01 axmi183bv02 SEQ ID №: 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 У відповідності до іншого аспекту даного винаходу, розробляються модифіковані версії синтетичних генів, так щоб результуючий пептид був націленим на рослинну органелу, таку як ендоплазматичний ретикулум або апопласт. Пептидні послідовності, про які відомо, що вони 24 UA 112405 C2 5 10 15 20 25 30 35 40 45 50 55 60 забезпечують націлювання злитих білків на рослинні органели, є відомими в цій галузі. Наприклад, N-термінальна ділянка гену кислої фосфатази від білого люпину Lupinus albus (Genebank ID GI:14276838; Miller et al. (2001) Plant Physiology 127: 594-606), як відомо в цій галузі, має своїм результатом націлювання ендоплазматичного ретикулуму гетерологічних білків. Коли результуючий злитий білок містить також послідовність ендоплазматичного ретикулуму, яка має пептид N-кінець-лізин-аспарагінова кислота-глутамінова кислота-лейцин (тобто, мотив «KDEL» (SEQ ID №: 123)) на С-кінці, то такий злитий білок буде націленим на ендоплазматичний ретикулум. Коли злитий білок не має на С-кінці послідовності для націлювання на ендоплазматичний ретикулум, він буде націлюватись на ендоплазматичний ретикулум, але в кінці кінців буде секвестрований в апопласт. Приклад 6. Експресія axmi100 у E. coli і Bacillus Повну ORF (відкрита рамка зчитування) гену дикого типу axmi100 (3,45 кб, які кодують білок довжиною 1156 амінокислот) було клоновано у вектор експресії E. coli на pRSF1b (щоб отримати pAX5445) і вектор Bacillus на основі pAX916 (щоб отримати pAX5444). Результуючі клони були підтверджені рестрикційним аналізом і, насамкінець, повним секвенуванням клонованого гену. Для експресії в E. coli, BL21*DE3 було трансформовано з використанням pAX5445. Єдину колонію було перенесено в середовище Лурія-Бертані, доповнене канаміцином, де її 0 вирощували впродовж ночі при 37 С. Наступного дня свіже середовище засіяли в дублікаті 1 % 0 культурою, що росла впродовж ночі, і дали рости впродовж ночі при 37 С до логарифмічної фази. Потім культури індукували 1 мМ IPTG (ізопропилтіогактозид – високоактивний індуктор ферменту бета-галактозидази лактозного оперону E. coli, що не метаболізується) впродовж 3 0 0 годин при 37 С або впродовж ночі при 20 С. Кожний конгломерат клітин суспендували в 50 мМ натрій-карбонатного буферу з рН 10,5, доповненому 1 мМ DTT (дитіотреїтол) і обробили ультразвуком. Аналіз за допомогою SDS-PAGE (електрофорез в поліакриламідному гелі в присутності додецилсульфату натрію) виявив експресію 130-кД білку, що відповідає Axmi100. Для експресії в Bacillus, Bacillus thuringiensis було трансформовано з використанням pAX5444, і єдину колонію вирощували в середовищі CYS-glu впродовж 3 днів до утворення спор. Конгломерат клітин екстрагували 50 мМ натрій-карбонатного буферу з рН 10,5, доповненому 1 мМ DTT. Розчинна фракція демонструвала присутність 130-кД білку Axmi100, разом з кількома полосами білків з меншою молекулярною вагою, обумовлених обробкою Axmi100. Обробка Axmi100 трипсином дала полоси двох різних білків – біля 65 кД і 55 кД. Приклад 7. Біопроба Axmi100 Приготування зразків: Вільні від клітин екстракти з клітин, що експресують Axmi100, типово ресуспендували в 50 мМ натрій-карбонатного буферу з рН 10,5, типово з включенням 1 мМ DTT в якості відновлювального агенту. Для тестування з використанням біопроби готувались зразки з трипсином і без нього. Загальне уявлення про методологію біопроби: В 24-лункові планшети для тканинної культури (Corning) влили по 1 мл багатовидового живильного середовища (Bio-Serv) і дали йому стверднути. Після отвердіння на поверхню середовища в кожній лунці поміщали 40 мкл білкового зразка і давали просочитись / висохнути при кімнатній температурі. В залежності від експерименту в кожну лунку додавали яєчну масу ЕСВ, десять новонароджених личинок або одну новонароджену личинку. Планшети закривали 0 газопроникними мембранами (Research Products International) та інкубували при 25 С і 90 % відносній вологості. Через п’ять або сім днів (в залежності від експерименту) результат оцінювали візуально, порівнюючи тільки з буфером або з контрольним нетрансформованим екстрактом. Сильна активність АХМІ-100 спостерігалась щодо метелика кукурудзяного і тютюнової листоверки брунькоїда. Активність щодо совки-іпсилон спостерігалась при високих концентраціях білку. Певна активність при високих концентраціях спостерігалась також по відношенню до гусені оксамитових бобів, але активність до совки-іпсилон і гусені оксамитових бобів була менш вираженою і більш варіабельною, ніж до інших тестованих комах. Обробка Axmi100 трипсином дала дві різні білкові полоси – біля 65 кД і 55 кД – і очевидно не була необхідною для активності АХМІ-100. Приклад 8. Додаткові проби на пестицидну активність Здатність пестицидного білку діяти як пестицид на шкідника часто оцінюється низкою способів. Один з них, добре відомий в цій галузі, полягає у виконанні фідинг-аналізу (аналізу з годівлею). В такому фідинг-аналізі шкідника піддають дії зразка, що містить тестові сполуки, або дії контрольного зразка. Часто це здійснюється шляхом нанесення матеріалу, що тестується, 25 UA 112405 C2 5 10 15 20 25 30 35 40 або відповідного розведення такого матеріалу на матеріал, який шкідник буде поїдати, такий як штучний корм. Матеріал, що тестується, може бути рідким, твердим або суспензією. Матеріал, що тестується, може наноситись на поверхню, після чого йому дають висохнути. Як варіант, матеріал, що тестується, може змішуватись з розплавленим штучним кормом, а потім поміщатись в камеру, в якій проводиться проба. Такою камерою може бути склянка, чашка або лунка титраційного мікропланшету. Проби для сисних шкідників (наприклад, тлі) можуть передбачати виділення тестового матеріалу з комахи шляхом дифузійного розділення. Ідеально, щоб матеріал могли проколоти призначені для ссання елементи рота сисної комахи, щоб дозволити поїдання тестового матеріалу. Часто тестовий матеріал змішується з таким харчовим стимулятором, як сахароза, щоб забезпечити поїдання тестової сполуки. Інші типи аналізу можуть включати мікроін’єкцію тестового матеріалу в рот або шлунок шкідника, а також створення трансгенних рослин з наступним тестом на здатність шкідника кормитись на трансгенній рослині. Тестування рослини може передбачати виділення тих частин рослини, які звичайно поїдаються, наприклад невеличкі кліточки можуть прикріплятись до листка або вся рослина (рослини) може поміщатись в клітку з комахами. Інші методи і підходи до аналізу пестицидної активності є відомими в цій галузі, і їх можна знайти в книзі Robertson, J. L. & H. K. Preisler. 1992. Pesticide bioassays with arthropods. CRC, Boca Raton, FL. Як варіант, такі аналізи звичайно описуються в журналах «Arthropod Management Tests» і «Journal of Economic Entomology» або обговорюються з членами Ентомологічного товариства Америки (ESA). Приклад 9. Біопроба Axmi079 і Axmi082 Експресія і очистка гену - Ділянки ДНК, кодуючі домени токсинів Axmi079 і Axmi082, були окремо клоновані у вектор експресії E. coli pMAL-C4x після гену malE, кодуючого білок зв’язування мальтози (МВР). Ці злиття в межах рамки забезпечили експресію злитих білків MBP-Axmi у E. coli. - Для експресії у E. coli BL21*DE3 було трансформовано індивідуальними плазмідами. Єдину колонію було перенесено в живильне середовище Лурія-Бертані, доповнене карбеніциліном і глюкозою, де її вирощували впродовж ночі при 370С. Наступного дня свіже середовище засіяли 1 % культурою, що росла впродовж ночі, і давали рости впродовж ночі при 370С до логарифмічної фази. Потім культури індукували 0,3 мМ IPTG впродовж ночі при 200С. Кожний конгломерат клітин суспендували в 20 мМ буферу Tris-Cl, рН 7,4 + 200 мМ NaCl + 1 мМ DTT + інгібітори протеази і обробили ультразвуком. Аналіз за допомогою SDS-PAGE (електрофорез в поліакриламідному гелі в присутності додецилсульфату натрію) виявив експресію злитих білків. - Всі вільні від клітин екстракти поганялись через амілазну колонку, приєднану до FPLC (установка для рідинної експрес-хроматографії білків), для афінної очистки злитих білків MBPaxmi. Зв’язаний злитий білок вимивався з полімерного носія 10-мМ розчином мальтози. Потім очищені злиті білки розщеплялись фактором Ха або трипсином для видалення N-термінального маркеру МВР з білку Axmi. Розщеплення і розчинність цих білків визначались за допомогою SDS-PAGE. Біопроби на комахах - Розщеплені білки тестувались в пробах на комахах з використанням відповідного контролю. 5-денне зчитування планшетів показало наступну активність цих білків. 45 Білок Axmi Axmi079 Axmi082 Злитий білок MBP-Axmi, розщеплений за допомогою Фактор Xa, трипсин Фактор Xa, трипсин Результати додаткових біопроб на комахах: 26 Активність щодо комах Міль капустяна Міль капустяна UA 112405 C2 Ген Axmi50 Axmi52 Axmi58 Axmi68 Axmi88 Axmi93 Axmi97 Axmi102 Axmi112 Axmi117 Axmi100 тестований C. VBC* зразок elegans неочищений 3, 3 екстракт очищений, перетрав1, 0 % лений очищений, перетравлений неочищений 3, 2 екстракт очищений, перетравлений очищений, перетрав20 % лений очищений, перетравлений неочищений екстракт очищений, перетрав3, 0 % лений очищений, перетравлений очищений, перетравлений DBM* SWCB* CPB* ECB* Hz* Hv* 4, 100 % 1, 0 % 1, 0 % 1, 0 % 4, 100 % 4, 100 % 3, 75 % 3, 25 % 3, 75 % 1, 0 % 3, 0 % 1,25 % 4, 100 % 4, 100 % VBC = гусінь оксамитових бобів DBM = міль капустяна SWCB = вогнівка кукурудзяна південно-західна CPB = колорадський жук ECB = метелик кукурудзяний Hz = Helicoverpa zea Hv = Heliothis virescens * = представлені як відсоток затримки в рості і смертності при оцінці затримки в рості за наступною шкалою: Бал 0 1 2 3 4 5 5 Визначення Відсутність активності Незначна, нерівномірна затримка в рості Нерівномірна затримка в рості Рівномірна затримка в рості Рівномірна затримка в рості зі смертністю (вираженою як відсоток) Рівномірна затримка в рості зі 100 % смертністю Приклад 10.Спрямування пестицидних генів за цим винаходом на експресію в рослинах Кожна з кодуючих ділянок генів за цим винаходом є незалежно з’єднаною з відповідними промоторною і термінаторною послідовностями для експресії в рослинах. Такі послідовності є добре відомими в цій галузі і можуть включати рисовий актиновий промотор або маїсовий убіквітиновий промотор для експресії в однодольних рослинах, промотор Arabidopsis UBQ3 або промотор CaMV 35S для експресії в дводольних рослинах і термінатори nos або PinII. Методи 27 UA 112405 C2 5 10 15 20 25 30 35 40 45 для отримання і підтвердження конструкцій промотор-ген-термінатор також є добре відомими в цій галузі. Приклад 11. Трансформація генів за цим винаходом в рослинних клітинах, опосередкована Agrobacterium Суцвіття збирають через 8-12 днів після запилення. Від них відділяють зародки і ті з них, які мають розмір 0,8-1,5 мм, використовуються для трансформації. Зародки поміщають щитком 0 догори на відповідне інкубаційне середовище і інкубують впродовж ночі при 25 С у темноті. Однак немає необхідності per se інкубувати зародки впродовж ночі. Зародки контактують зі штамом Agrobacterium, що містить відповідні вектори для опосередкованого Ті плазмідою перенесення, впродовж 5-10 хвилин, після чого їх переносять на середовище для ко-культивації 0 на 3 дні (25 С у темноті). Після ко-культивації експлантати переносять в середовище для 0 періоду відновлення на п’ять днів (25 С у темноті). Експлантати інкубують в селективному середовищі до восьми тижнів – в залежності від природи і параметрів того конкретного відбору, який застосовується. Після періоду відбору результуючий калюс переносять в середовище для дозрівання зародку, доки буде спостерігатись формування зрілих соматичних зародків. Після цього зрілі соматичні зародки встановлюють під слабке освітлення, і процес регенерації починається, як відомо в цій галузі. Результуючим росткам дають укорінитись на середовищі для укорінення і переносять отримані рослини в тепличні горщечки, де вони розводяться як трансгенні рослини. Приклад 12. Трансформація клітин маїсу під дією пестицидних генів за цим винаходом Суцвіття маїсу збирають через 8-12 днів після запилення. Від них відділяють зародки і ті з них, які мають розмір 0,8-1,5 мм, використовуються для трансформації. Ембріони поміщають щитком догори на відповідне інкубаційне середовище, таке як середовище DN62A5S (3,98 г/л N6 солей; 1 мл/л (1000x вихідний матеріал) N6 вітамінів; 800 мг/л L-аспарагіну; 100 мг/л міоінозитолу; 1,4 г/л L-проліну; 100 мг/л казамінових кислот; 50 г/л сахарози; 1 мл/л (1 мг/мл 0 вихідний матеріал) 2,4-D), і інкубують впродовж ночі при 25 С у темноті. Результуючі експлантати переносять в коміркові квадрати (30-40 на планшет), пересаджують на осмотичне середовище на 30-45 хвилин, а потім переносять на снувальний планшет (дивись, наприклад, публікацію РСТ № WO/0138514 і патент США № 5,240,842). Конструкції ДНК, призначені для того, щоб експресувати гени за цим винаходом в рослинних клітинах, активували в рослинній тканині з використанням прискорювача струменю аерозолю і умов, суттєво таких, як описані в публікації РСТ № WO/0138514. Після активування зародки інкубують впродовж 30 хвилин на осмотичному середовищі, потім переносять на інкубаційне 0 середовище і інкубують впродовж ночі при 25 С в темноті. Щоб уникнути невиправданого ушкодження активованих експлантатів, їх інкубують щонайменше 24 години перед перенесенням в відновлювальне середовище. Потім зародки розміщують на середовищі для 0 відновного періоду на 5 днів при 25 С в темноті, після чого переносять в селекційне середовище. Експлантати інкубують в селективному середовищі до восьми тижнів – в залежності від природи і параметрів того конкретного відбору, який застосовується. Після періоду відбору результуючий калюс переносять в середовище для дозрівання зародків, доки буде спостерігатись формування зрілих соматичних зародків. Після цього зрілі соматичні зародки встановлюють під слабке освітленням, і процес регенерації починається, як відомо в цій галузі. Результуючим росткам дають укорінитись на середовищі для укорінення і переносять отримані рослини в тепличні горщечки, де вони розводяться як трансгенні рослини. Матеріали Середовище DN62A5S Компоненти На один літр Chu'S N6 Базальна суміш 3,98 г/л солей (Прод. № C 416) Chu’s N6 Розчин вітамінів 1 мл/л (1000x вихідний матеріал) (Прод. № C 149) L-аспарагін 800 мг/л Міо-ізітол 100 мг/л L-пролін 1.4 г/л Касамінокислоти 100 мг/л Сахароза 50 г/л 2,4-D (Прод. № D-7299) 1 мл/л (1 мг/мл вихідний матеріал) Джерело Phytotechnology Labs Phytotechnology Labs Phytotechnology Labs Sigma Phytotechnology Labs Fisher Scientific Phytotechnology Labs Sigma Далі, рН розчину регулюють до 5,8 з використанням 1N KOH/1N KCl, додають Gelrite (Sigma) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюToxin genes and methods for their use
Автори російськоюAgarwal, Shruti, Campbell, Chris, Mcnulty, Brian, Sampson, Kimberly, S., Tomso, Daniel, J.
МПК / Мітки
МПК: C07K 14/325, C12N 15/82
Мітки: застосування, спосіб, токсиген
Код посилання
<a href="https://ua.patents.su/316-112405-toksigen-i-sposib-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Токсиген і спосіб його застосування</a>