Третинні похідні 8-гідроксихінолін-7-карбоксаміду та їх застосування
Номер патенту: 107949
Опубліковано: 10.03.2015
Автори: Гагльярді Стефанія, Дель Сордо Сімоне, Майлланд Федеріко, Легора Мікела
Формула / Реферат
1. Сполука загальної формули (І) або її фармацевтично прийнятна сіль
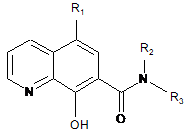 , (I)
, (I)
в якій R2 і R3 незалежно один від одного вибирають з:
a) -С1-С6-алкілу, за умови, що R2 і R3 не є обидва метилом,
b) -(СН2)n-арилу, 4-галогенбензилу або 4-галогенфенілу,
c) -(СН2)n-циклоалкілу,
d) -(СН2)n-гетероциклу,
e) -(CH2)n-OR6,
f) -(CH2)n-CN,
g) -(CH2)n-NR4R5,
h) взятих разом з атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з кисню та сірки, або
і) взятих разом із атомом азоту, до якого вони прикріплені, для утворення: (і) 5-8-членного гетеромоноциклу, конденсованого з одним або двома насиченими або ненасиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, що складається із азоту, кисню та сірки; або (іі) галоген- та/або гідроксизаміщеного дигідрохіноліну;
де R4 і R5 незалежно один від одного вибирають з:
a) -Н,
b) -С1-С6-алкілу,
c) -(СН2)n-арилу,
d) -(СН2)n-циклоалкілу,
e) -(СН2)n-гетероциклу,
f) -(CH2)n-OR6,
g) -(CH2)n-CN,
h) взятих разом із атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки, або
j) взятих разом із атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, конденсованого з одним або двома насиченими або ненасиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; або де R6 вибирають з:
a) -Н,
b) -С1-С6-алкілу,
c) -(СН2)n-арилу,
d) -(СН2)n-циклоалкілу або
e) -(СН2)n-гетероциклу;
і де n є ціле число від 0 до 6.
2. Сполука за п. 1, в якій R2 і R3, незалежно один від одного, вибирають з:
a) -С1-С6-алкілу, за умови, що R2 і R3 не є обидва метилом,
b) -(СН2)n-арилу, 4-галогенбензилу або 4-галогенфенілу,
c) -(СН2)n-циклоалкілу,
d) -(СН2)n-гетероциклу,
e) -(CH2)n-OR6,
f) -(CH2)n-CN,
g) взятих разом із атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з кисню та сірки, або
h) взятих разом із атомом азоту, до якого вони прикріплені, для утворення: (і) 5-8-членного гетеромоноциклу, конденсованого з одним або двома ненасиченими або насиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; або (іі) галоген- та/або гідроксизаміщеного дигідрохіноліну; та/або де R6 означає Н.
3. Сполука за п. 1, в якій R2 і R3 незалежно один від одного вибирають з:
a) -С1-С6-алкілу, за умови, що R2 і R3 не є обидва метилом,
b) -(СН2)n-арилу, 4-галогенбензилу або 4-галогенфенілу, або
c) взятих разом із атомом азоту, до якого вони прикріплені, для утворення: (і) 5-8-членного гетеромоноциклу, конденсованого з одним або двома ненасиченими або насиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; або (іі) галоген- та/або гідроксизаміщеного дигідрохіноліну.
4. Сполука за п. 1, в якій R2 і R3 взяті разом із атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, конденсованого з одним або двома ненасиченими або насиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки.
5. Сполука за п. 1, в якій n є цілим числом від 0 до 2.
6. Сполука, яку вибирають із групи, що складається з:
8-гідрокси-N-метил-N-(4-(2-фенілпропан-2-іл)бензил)хінолін-2-карбоксаміду;
N-бензил-8-гідрокси-N-метилхінолін-7-карбоксаміду;
(8-гідроксихінолін-7-іл)(ізоіндолін-2-іл)метанону;
(8-гідроксихінолін-7-іл)(морфолін)метанону;
(8-гідроксихінолін-7-іл)(піперидин-1-іл)метанону;
8-гідрокси-N-метил-N-фенетилхінолін-7-карбоксаміду;
(8-гідроксихінолін-7-іл)(індолін-1-іл)метанону;
N-(фуран-2-ілметил)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
(3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
N-(4-бромбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
8-гідрокси-N-(4-метоксифеніл)-N-метилхінолін-7-карбоксаміду;
(6,7-диметокси-3,4-дигідроізохінолін-2(1Н)-іл)(8-гідроксихінолін-7-іл)метанону;
8-гідрокси-N-метил-N-(тетрагідро-2Н-піран-4-іл)хінолін-7-карбоксаміду;
8-гідрокси-N-метил-N-фенілхінолін-7-карбоксаміду;
N-(4-хлорфеніл)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
N-етил-8-гідрокси-N-фенілхінолін-7-карбоксаміду;
N-циклогексил-8-гідрокси-N-метилхінолін-7-карбоксаміду;
8-гідрокси-N-метил-N-(1-метилпіперидин-4-іл)хінолін-7-карбоксаміду;
8-гідрокси-N-метил-N-(1-метилпіролідин-3-іл)хінолін-7-карбоксаміду;
N-(2-ціаноетил)-N-(фуран-2-ілметил)-8-гідроксихінолін-7-карбоксаміду;
N-(2-ціаноетил)-8-гідрокси-N-((тетрагідрофуран-2-іл)метил)хінолін-7-карбоксаміду;
N-етил-8-гідрокси-N-метилхінолін-7-карбоксаміду;
8-гідрокси-N-метил-N-пропілхінолін-7-карбоксаміду;
(3,4-дигідроізохінолін-2(1Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(5-броміндолін-1-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(6-метокси-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(8-гідроксихінолін-7-іл)(5-нітроіндолін-1-іл)метанону;
8-гідрокси-N-феніл-N-пропілхінолін-7-карбоксаміду;
(8-гідроксихінолін-7-іл)(октагідрохінолін-1(2Н)-іл)метанону;
N-(4-фторбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
N-(3-бромбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
(8-гідроксихінолін-7-іл)(4-(трифторметил)піперидин-1-іл)метанону;
(4-терт-бутилпіперидин-1-іл)(8-гідроксихінолін-7-іл)метанону;
(S)-8-гідрокси-N-метил-N-(1-фенілетил)хінолін-7-карбоксаміду;
N-бензил-8-гідрокси-N-(2-гідроксіетил)хінолін-7-карбоксаміду;
(3,3-диметилпіперидин-1-іл)(8-гідроксихінолін-7-іл)метанону;
N-(2-бромбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
(8-гідроксихінолін-7-іл)(4-фенілпіперидин-1-іл)метанону;
((4аS,8S,8аR)-8-гідроксіоктагідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(2-метилпіперидин-1-іл)метанону;
(8-гідроксихінолін-7-іл)(2-фенілпіперидин-1-іл)метанону;
(1,1-діоксотіоморфолін-4-іл)-(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(4-метилпіперидин-1-іл)метанону;
(R)-8-гідрокси-N-(1-фенілетил)хінолін-7-карбоксаміду;
(8-гідроксихінолін-7-іл)(2-метилпіролідин-1-іл)метанону;
(2,5-диметилпіролідин-1-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(3-фенілпіролідин-1-іл)метанону;
(3-(диметиламіно)піролідин-1-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(3-метилпіперидин-1-іл)метанону;
(8-гідроксихінолін-7-іл)(піролідин-1-іл)метанону;
(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(6-метил-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(8-гідроксихінолін-7-іл)(6-нітроіндолін-1-іл)метанону;
(8-гідроксихінолін-7-іл)(7-(трифторметил)-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(5-бром-8-гідроксихінолін-7-іл)(ізоіндолін-2-іл)метанону;
(гексагідро-1Н-ізоіндол-2(3Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(2-метил-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(8-гідроксихінолін-7-іл)(3-метил-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(8-гідроксихінолін-7-іл)(4-метил-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(8-фтор-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(6-ізопропіл-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(6-хлор-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(7-метил-3,4-дигідрохінолін-1(2Н)-іл)метанону;
(6-бром-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(8-гідроксихінолін-7-іл)(октагідроізохінолін-2(1Н)-іл)метанону;
N-(4-бромфеніл)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
(декагідро-1Н-карбазол-9(9аН)-іл)(8-гідроксихінолін-7-іл)метанону;
N-(4-хлорбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду;
(5,7-дифтор-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(7-фтор-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(5-фтор-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(6-фтор-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(5-хлор-8-гідрокси-3,4-дигідрохінолін-1(2Н)-іл)(8-гідроксихінолін-7-іл)метанону;
(2Н-бензо[b][1,4]оксазин-4(3Н)-іл)(8-гідроксихінолін-7-іл)метанону.
7. Сполука формули
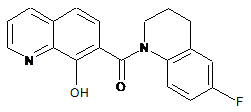 .
.
8. Сполука за будь-яким із пп. 1-7 для застосування як лікарського засобу.
9. Сполука за будь-яким із пп. 1-7 для застосування як протигрибкового засобу.
10. Сполука за будь-яким із пп. 1-7 для застосування в лікуванні та/або профілактиці грибкових інфекцій.
11. Сполука для застосування за п. 10, в якій згадану грибкову інфекцію вибирають з Tricophyton Rubrum, Tricophyton Mentagrophytes, Aspergillus Niger, Scopulariopsis Brevicaulis або Candida, таких як Candida Albicans або Candida Glabrata.
12. Сполука для застосування за п. 10, в якій реципієнтом згаданого лікування або профілактики є ссавець, переважно людина.
13. Фармацевтична композиція, яка містить принаймні одну сполуку за одним із пп. 1-7 разом із принаймні одним фармацевтично прийнятним носієм, наповнювачем та/або допоміжною речовиною.
Текст
Реферат: Представлений винахід стосується третинних похідних 8-гідроксихінолін-7-карбоксаміду загальної формули (І) та їх фармацевтично прийнятних солей UA 107949 C2 (12) UA 107949 C2 R1 R2 (I) N N R3 OH O Дані сполуки є прийнятними як протигрибкові засоби, зокрема, дані сполуки випробовували проти Tricophyton Rubrum, Tricophyton Mentagrophytes, Aspergillus Niger та Scopulariopsis Brevicaulis. Дані сполуки є також активними проти грибів роду Candida, таких як Candida Albicans і Candida Glabrata. UA 107949 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід забезпечує нові третинні похідні 8-гідроксихінолін-7-карбоксаміду та їх фармацевтично прийнятні солі, які використовують як протигрибкові засоби, і спосіб їх одержання. Зокрема, ці сполуки було випробувано проти Триcophyton Rubrum, Триcophyton Mentagrophytes, Aspergillus Niger та Scopulariopsis Brevicaulis. Багато із цих сполук є також активними проти видів Candida, таких як Candida Albicans та Candida Glabrata. Попередній рівень техніки Патогенні гриби можна поділити на дві категорії: гриби, які здатні індукувати захворювання у нормальних суб'єктів, та менш інвазивні гриби, які здатні спричинити захворювання лише у критично хворих хазяїв. За останні два десятиліття спостерігали значне збільшення випадків інвазивних умовно-патогенних грибкових інфекцій і пов'язаної з ними захворюваності та смертності. Це здебільшого пов'язано зі значними досягненнями в сучасній медицині, які підвищили виживаність критичних пацієнтів, таких як ті, що перебувають у відділеннях інтенсивної терапії (ВІТ) із внутрішньосудинними та сечовими катетерами, загальним парентеральним харчуванням та гемодіалізом або приєднані до систем дихання. Вид Candida звичайно спричиняє нозокомійні (лікарняні) інфекції кровотоку у пацієнтів, що перебувають у ВІТ. У Великій Британії кількість випадків госпіталізації пацієнтів з кандидемією становить близько 3 на 100 000 ліжко-днів, і 40-52 % з усіх випадків мають місце в реанімаційному відділенні (Schelenz S., J. Antimicrob. Chemother. 2008; 61, Suppl 1, 31-34). Цей вид мікозу часто пов'язаний зі значною захворюваністю та смертністю. Відсоток відповідної смертності становить близько 38 %, хоча він може коливатися від 5 до 71 %. Останніми роками мало місце збільшення випадків інвазивного аспергільозу легенів у пацієнтів, прийнятих до ВІТ. Поширеність захворювання коливається від 0,3 до 5,8 % при загальному рівні смертності понад 80 % (Trof R. J. et al, Intensive Care Med., 2007; 33, 1694-1703). Критично хворі пацієнти мають ризик розвитку розладів в імунорегуляції під час їхнього перебування у ВІТ, що робить їх більш уразливими до грибкових інфекцій. Були описані такі фактори ризику, як хронічне обструктивне захворювання легенів, тривале застосування стероїдів, прогресивна хвороба печінки, хронічна замісна терапія нирок, стан після врятування від утоплення і цукровий діабет. Також мало місце різке збільшення кількості пацієнтів з ослабленим імунітетом, особливо в сфері трансплантації солідних органів та кісткового мозку, аутоімунних синдромів, синдрому надбаного імунодефіциту (СНІД) та онкології. Близько у 40 % населення з трансплантованим кістковим мозком розвивається інвазивна грибкова інфекція (Khan S. A., Wingard J. R., Natl. Cancer Inst. Monogr. 2001; 29, 31-36). Види Candida і Aspergillus є найпоширенішими патогенами, що відповідають за нозокомійний (лікарняний) поверхневий та інвазивний мікози у пацієнтів з гематологічними злоякісними утвореннями і трансплантованим кістковим мозком. У цих пацієнтів смертність, пов'язана із системним кандидозом, є дуже високою (50-90 %). Відносно трансплантації солідних органів, інфекційні ускладнення найчастіше трапляються у пацієнтів із трансплантованими легенями. На додаток до імуносупресорного режиму, підвищена чутливість здебільшого пов'язана з постійним зазнаванням впливу зовнішнього середовища. Паралельно до інтенсивності імуносупресорного лікування інвазивна грибкова інфекція може виникнути впродовж перших днів після хірургічної операції, причому її частота є найвищою у перші два місяці й зменшується через 6 місяців, але вона може виникнути також через роки після трансплантації (Hamacher J. et al, Eur. Respir. J., 1999; 13, 180-186). Інвазивні грибкові інфекції також часто трапляються при трансплантації інших видів солідних органів, таких як трансплантати нирок та печінки, щодо яких повідомляли про кількість випадків від 5 до 50 % (Dictar M. O. et al, Med Mycol., 2000; 38 Suppl. 1, 251-258). Мікози є однією з основних причин захворюваності пацієнтів зі СНІД, і кількість випадків та серйозність цих інфекцій підвищуються при прогресуванні захворювання та наступному ослабленні опосередкованого T-лімфоцитами імунітету. Число випадків різних мікозів тісно пов'язано з ендемічними умовно-патогенними грибами, присутніми в зоні місця їх перебування. Загалом, найпоширенішими мікозами, що уражають пацієнтів зі СНІД, є гістоплазмоз, бластомікоз, кокцидіоїдомікоз та паракокцидіомікоз (Sarosi G. A., Davies S. F., West J. Med., 1996; 164, 335-340). Інфекції Candida слизової оболонки є також надзвичайно поширеними. У нормальних пацієнтів усі ці мікози звичайно є такими, що минають без лікування, але у пацієнтів з пригніченим імунітетом вони стають дуже інвазивними, що спричиняє їхнє прогресування та широке розповсюдження. Більше того, останніми роками стало очевидним збільшення випадків мікозу, спричиненого організмами, стійкими до поточного лікування. Це явище є особливо очевидним для грибкових інфекцій, спричинених Candida albicans і флуконазолом та іншими азолами (Basтерт J. et al, Int. 1 UA 107949 C2 5 10 15 20 25 30 35 40 45 50 55 60 J. Antimicrob. Agents, 2001; 17, 81-91). Наявні нині протигрибкові ліки не є повністю задовільними через обмежений спектр їхньої дії та серйозні побічні ефекти, пов'язані з їх використанням. Наприклад, поліенові ліки амфотерицин B є активними проти Aspergillus, Zygomycete та інших пліснявих грибів, і внаслідок їхньої токсичності дозволене дозування для лікування інвазивного мікозу становить 3-5 мг/кг на добу. У пацієнтів із дуже ослабленим імунітетом з інвазивним аспергильозом ліпосомний інкапсульований амфотерицин B, введений щоденно у дозі 3 мг/кг, мав сприятливу реакцію у 50 % пацієнтів і 12-тижневий коефіцієнт виживаності 72 % (Cornely O. A. et al, Clin. Infect. Dis., 2007; 44, 1289-1297). Ці ліки індукували нефротоксичність та гіпокаліємію у 14-16 % пацієнтів. При щоденному введенні у дозі 10 мг/кг амфотерицин B не забезпечував будь-яких додаткових переваг і спричиняв більш високі рівні нефротоксичності (31 %). Азоли, запроваджені у другій половині 1970-х років, є блокаторами синтезу ергостерину. Застосування ліків, що належать до цього сімейства, обмежене вузьким спектром їхньої активності. Вориконазол, наприклад, є більш активним, ніж амфотерицин B, для лікування інвазивного аспергильозу, але не має будь-якої активності проти зігоміцет (Johnson L. B., Kauffman C. A., Clin. Infect. Dis., 2003, 36, 630-637). Застосування азолів також обмежене спричиненням декількох побічних ефектів. Азоли взаємодіють з ферментами ссавців p450, що спричиняє втручання до метаболізму інших ліків і, додатково, деякі азоли, такі як кетоконазол, здатні блокувати серцевий калієвий канал Kv1.5, спричиняючи подовження періоду Q-T і тремтіння-мерехтіння шлуночків (Dumaine R., Roy M. L., Brown A. M., J. Pharmacol. Exp. Ther., 1998; 286, 727-735). Аліламіни, такі як тербінафін, прив'язуються до скваленепоксидази та інгібують її, спричиняючи блокування синтезу ергостерину. Ці ліки є дуже потужними проти Dermatophytes, тоді як їхня активність проти виду Candida є дуже низькою. У деяких випадках після лікування аліламінами мають місце серйозні побічні шкірні реакції. Нещодавно проведене міжнародне дослідження методом випадок-контроль (euroSCAR) (Sidoroff A. et al, Br. J. Dermatol., 2007; 15, 989-996) виявило, що системне лікування тербінафіном має міцний зв'язок із розвитком гострого генералізованого екзантематозного пустольозу (ГГЕП). Це захворювання характеризується швидкою появою багатьох стерильних, нефолікулярних пустулів, що звичайно супроводжується лейкоцитозом і жаром. ГГЕП звичайно пов'язують із лікуванням пацієнта певними ліками і вважають, що він має зв'язок із зміненою активністю Т-лімфоцитів. Лікування тербінафіном також може індукувати дерматоміозит, серйозне аутоімунне захворювання сполучних тканин, яке характеризується еритемою, м'язовою слабкістю та інтерстиційним фіброзом легенів (Magro C. M. et al, J. Cutan. Pathol., 2008; 35, 74-81). Крім того, як і множина протигрибкових препаратів, тербінафін може спричиняти серйозні ушкодження печінки (Perveze Z. et al, Liver Transpl., 2007; 13, 162-164). Гризеофульвін є бензофураном, що його було запроваджено у 1960 році для лікування дерматофітних інфекцій. Ця сполука індукує свою фунгістатичну активність шляхом втручання до вироблення мікротрубочок. Гризеофульвін проявляє обмежену активність у лікуванні оніхомікозів і часто спричиняє серйозні побічні ефекти, такі як нудота, діарея, головний біль, запаморочення свідомості та утома (Korting H. C. et al, Antimicrob. Agents Chemother., 1993; 37, 2064-2068), наслідком чого може бути припинення лікування. Очевидно, що два N-гідроксипіридони, циклопіроксоламін та октопірокс, здебільшого діють шляхом хелування багатовалентних катіонів, спричиняючи інгібування залежних від металу ферментів. Їх застосовують проти різних грибкових інфекцій, але це застосування обмежене місцевим лікуванням. Ехінокандини (каспофунгін, мікафунгін, анідулафунгін) є напівсинтетичними ліпопептидами і являють собою антимікотичні ліки, що їх було запроваджено зовсім нещодавно. Вони діють шляхом неконкурентного інгібування β-(1-3)-D-глюкансинтази, ферменту, що є важливим для підтримання стінок клітин, і їх здебільшого використовують для внутрішньовенного лікування інвазивного кандидозу та аспергільозу. Вони є фунгіцидними проти дріжджів, але лише фунгістатичними проти міцелійних грибів; крім того, вони є досить неактивними проти диморфних грибів, таких як Blastomyces і Histoplasma. Ехінокандини звичайно легко переносяться, але дослідження розмноження тварин показали їхній несприятливий вплив на плід. З цієї причини Управління США з контролю за якістю харчових продуктів і лікарських засобів відносить ехінокандини до категорії С як небезпечні для вагітності (http://www.fda.gov/medwatch/SAFETY/2004/mar_PI/Cancidas_PI.pdf; http://www.fda.gov/medwatch/safety/2007/Aug_PI/Mycамін_PI.pdf). У заявці EP1375486 розкритий загальний і дуже широкий клас сполук з інгібіторною 2 UA 107949 C2 5 10 15 20 25 30 35 40 активністю інтегрази ВІЛ. Цей широкий загальний клас включає похідні 8-гідроксихіноліну, заміщені широким спектром замісників, наприклад, карбоксамідними групами у положенні 7. Жодна із конкретних сполук, розкритих у цьому документі, не є структурно подібною до сполук за цим винаходом. У заявці EP1541558 розкритий загальний і дуже широкий клас сполук з інгібіторною активністю інтегрази ВІЛ. По суті, конкретні сполуки, розкриті у цьому документі, завжди містять замісник на піридиловому кільці і переважно є 3-(4-фторбензил)-8-гідроксихінолінами. Жодна із конкретних сполук, розкритих у цьому документі, не є структурно подібною до сполук за цим винаходом. У міжнародній заявці WO98/11073 (US6310211) розкритий загальний клас противірусних сполук з інгібіторною активністю інтегрази ВІЛ. Жодна із конкретних сполук, розкритих у цьому документі, не є структурно подібною до сполук за цим винаходом. У міжнародній заявці WO02/30426 розкритий загальний клас сполук з інгібіторною активністю інтегрази ВІЛ. По суті, більшість конкретних сполук, розкритих у цьому документі, мають нафтидриніловий залишок. Жодна із конкретних сполук, розкритих у цьому документі, не є структурно подібною до сполук за цим винаходом. У міжнародній заявці WO02/30930 розкритий загальний і дуже широкий клас сполук з інгібіторною активністю інтегрази ВІЛ. Жодна із конкретних сполук, розкритих у цьому документі, не є структурно подібною до сполук за цим винаходом. У заявках US0326330 і US0326328 розкриті фунгіцидні композиції, що містять комбінацію двох фунгіцидів, одним з яких є хінолінова або цинолінова сполука. Жодна із конкретних сполук, розкритих у цьому документі, не є структурно подібною до сполук за цим винаходом. У міжнародній заявці WO96/32015 розкриті синергійні фунгіцидні сполуки, одержані з похідних хіноліну та інгібіторів цитохромного комплексу III. Жодна із конкретних сполук, розкритих у цьому документі, не є структурно подібною до сполук за цим винаходом. У заявці US6194413 розкриті похідні піколіноїлу, про які повідомляли, що вони є придатними для лікування вірусних, грибкових або бактерійних інфекцій. У заявці EP1669348 розкриті протигрибкові засоби, визначені дуже широкою формулою, що включає певні вторинні аміди. З описаного вище є очевидним, що клінічна потреба в ефективних протигрибкових ліках значно зросла за останні декілька років. На жаль, наявні нині ліки не є задовільними через вузький спектр їхньої дії, фармакокінетичні властивості та серйозні побічні ефекти. Опис винаходу Цей винахід, зокрема, забезпечує сполуки загальної формули (I), наділені потужною протигрибковою активністю, де R1 означає: a) -H, b) -F, c) -Cl, d) -Br, e) -NO2, f) -CF3, 3 UA 107949 C2 5 10 15 20 25 30 35 40 45 50 55 60 g) -C1-C6 алкіл, h) -(X)-NR4R5, i) -CN, j) -(Y)-R6, k) -(CH2)n-арил, необов'язково заміщений, або l) -(CH2)n-гетероцикліл, необов'язково заміщений; де X означає: a) -(CH2)n-, b) -(SO2)-, c) -(C=O)- або d) -(N-C=O)-; де Y означає: a) -O-, b) -S-, c) -(SO2)-, d) -(SO3)-, e) -(C=O)-, f) -(CO2)-, g) -(CH2O)- або h) -(NHSO2)-; де R2 і R3 незалежно один від одного вибирають з: a) -C1-C6 алкілу, за умови, що R2 і R3 не є обидва метилом, b) -(CH2)n-арилу, необов'язково заміщеного, c) -(CH2)n-циклоалкілу, необов'язково заміщеного, d) -(CH2)n-гетероциклу, необов'язково заміщеного, e) -(CH2)n-OR6, f) -(CH2)n-CN, g) -(CH2)n-NR4R5, h) взятих разом з атомом азоту, до якого вони прикріплені, для утворення необов'язково заміщеного 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з кисню та сірки, або i) взятих разом з атомом азоту, до якого вони прикріплені, для утворення необов'язково заміщеного 5-8-членного гетеромоноциклу, конденсованого з одним або двома необов'язково заміщеними насиченими або ненасиченими кільцями або з іншими гетероциклами, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; де R4 і R5 незалежно один від одного вибирають з: a) -H, b) -C1-C6 алкілу, c) -(CH2)n-арилу, необов'язково заміщеного, d) -(CH2)n-циклоалкілу, необов'язково заміщеного, e) -(CH2)n-гетероциклу, необов'язково заміщеного, f) -(CH2)n-OR6, g) -(CH2)n-CN, h) взятих разом з атомом азоту, до якого вони прикріплені, для утворення необов'язково заміщеного 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки, або j) взятих разом з атомом азоту, до якого вони прикріплені, для утворення необов'язково заміщеного 5-8-членного гетеромоноциклу, конденсованого з одним або двома необов'язково заміщеними насиченими або ненасиченими кільцями або з іншими необов'язково заміщеними гетероциклами, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; де R6 означає: a) -H, b) -C1-C6 алкіл, c) -(CH2)n-арил, необов'язково заміщений, d) -(CH2)n-циклоалкіл, необов'язково заміщений, або e) -(CH2)n-гетероцикл, необов'язково заміщений; де n є ціле число від 0 до 6; або їхні фармацевтично прийнятні солі та похідні. Використаний тут термін "C1-C6 алкіл" означає лінійні алкільні групи або алкільні групи з 4 UA 107949 C2 5 10 15 20 25 30 35 40 45 50 55 60 розгалуженим ланцюгом, що мають від 1 до 6 атомів вуглецю, і включає всі гексильні та пентильні ізомери алкілу, а також n-, ізо-, сек- і t-бутил, n- та ізопропіл, етил та метил. Термін "циклоалкіл" означає циклічне кільце алкану, вибраного з циклопропілу, циклобутилу, циклопентилу, циклогексилу, циклогептилу та циклооктилу. Термін "арил" стосується ароматичних моно- та полікарбоциклічних кільцевих систем, в яких окремі карбоциклічні кільця в багатокільцевих системах можуть бути конденсовані або прикріплені одне до одного за допомогою одного зв'язку. Підходящими арильними групами є, але це не є обмеженням, феніл, нафтил та біфеніл. Термін "гетероцикл" (та його варіанти, такі як "гетероциклічний") у широкому розумінні стосується моноциклічних кілець з 4-8 членами, біциклічних кільцевих систем з 7-12 членами або 11-16-членної трициклічної кільцевої системи, будь-яке з кілець якої є насиченим або ненасиченим і яка складається з атомів вуглецю та одного або більше гетероатомів, вибраних з N, O і S, і в якій гетероатоми азоту та сірки можуть бути необов'язково окислені, а гетероатом азоту може бути необов'язково кватернізований. Гетероциклічне кільце може бути прикріплене до будь-якого гетероатому або атому вуглецю, за умови, що таке прикріплення спричиняє утворення стійкої структури. Якщо гетероциклічне кільце має замісників, розуміють, що ці замісники можуть бути прикріплені до будь-якого атому в кільці, гетероатому або атому вуглецю, за умови одержання стійкої хімічної структури. Термін "гетеромоноцикл" (та його варіанти, такі як "гетеромоноциклічний") стосується моноциклічного кільця з 4-8-членами, яке є насиченим або ненасиченим і складається з атомів вуглецю та одного або більше гетероатомів, вибраних з N, O та S, і в якому гетероатоми азоту та сірки можуть бути необов'язково окислені, а атом азоту може бути необов'язково кватернізований. Гетероциклічне кільце може бути прикріплене до будь-якого гетероатому або атому вуглецю, за умови, що таке прикріплення спричиняє утворення стійкої структури. Якщо гетероциклічне кільце є ароматичним гетероциклічним кільцем, його може бути визначено як "гетероароматичне кільце". Якщо чітко не вказано інакше, "ненасичене" кільце є частково або повністю ненасиченим кільцем. Наприклад, "ненасичений моноциклічний C6 карбоцикл" стосується циклогексену, циклогексадієну та бензолу. Термін "заміщений" включає моно- та полізаміщення названим замісником настільки, наскільки таке одиничне та множинне заміщення є хімічно допустимим. Наприклад, карбоцикл або гетероцикл, заміщений більше ніж одним замісником, може мати множину замісників на одному і тому самому кільцевому атомі настільки, наскільки це хімічно дозволено. Кільцевий атом сірки в насиченому гетероциклі може, наприклад, звичайно бути заміщений однією (S(=O)-) або двома оксогрупами (-SO2-). Термін "фармацевтично прийнятні солі або похідні" стосується тих солей або похідних, які мають біологічну ефективність та властивості материнської сполуки і які не є біологічно або іншим чином небажаними. До таких солей відносяться солі з неорганічними або органічними кислотами, як, наприклад, гідробромідна, гідрохлоридна, сульфатна, фосфатна, натрієва солі, магнезійна сіль; до таких похідних відносяться складні ефіри, прості ефіри та N-оксиди. Сполуки за цим винаходом та їхні фармацевтично прийнятні солі або похідні можуть мати асиметричні центри і можуть зустрічатися, за винятком випадків, коли про це прямо вказано, як суміші стереоізомерів або у вигляді окремих діастереомерів, або енантіомерів, причому всі ізомерні форми входять до обсягу цього винаходу. Фраза "фармацевтично прийнятний", що її використовують відносно композицій, які містять сполуки за винаходом, стосується молекулярних одиниць та інших інгредієнтів таких композицій, які фізіологічно переносяться і звичайно не спричиняють небажаних реакцій при введенні тварині, такій як ссавець (наприклад, людина). Використаний тут термін "фармацевтично прийнятний" переважно означає дозволений регуляторним органом, таким як Управління США з контролю за якістю харчових продуктів та ліків або Європейське агентство з оцінювання лікарських засобів, або вказаний в американській чи європейській фармакопеї чи іншій загальновизнаній фармакопеї для застосування ссавцям і, більш конкретно, людям. Переважно у формулі (I): R1 означає: a) -H, b) -Br або c) -NO2; R2 і R3 незалежно один від одного вибирають з: a) -C1-C6 алкілу, за умови, що R2 і R3 не є обидва метилом, b) -(CH2)n-арилу, необов'язково заміщеного, 5 UA 107949 C2 5 10 15 20 25 30 35 40 45 50 55 60 c) -(CH2)n-циклоалкілу, необов'язково заміщеного, d) -(CH2)n-гетероциклу, необов'язково заміщеного, e) -(CH2)n-OR6, f) -(CH2)n-CN, g) взятих разом з атомом азоту, до якого вони прикріплені, для утворення необов'язково заміщеного 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з кисню та сірки, або h) взятих разом з атомом азоту, до якого вони прикріплені, для утворення необов'язково заміщеного 5-8-членного гетеромоноциклу, конденсованого з одним або двома необов'язково заміщеними ненасиченими або насиченими кільцями або з іншими гетероциклами, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; R6 означає H; та/або n є ціле число від 0 до 6, переважно від 0 до 2. Крім того, переважно у формулі (I): R1 означає H; R2 і R3 відрізняються від H і незалежно означають: a) -C1-C6 алкіл, за умови, що R2 і R3 разом не є метил, b) -(CH2)n-арил, необов'язково заміщений, або c) взяті разом з атомом азоту, до якого вони прикріплені, для утворення необов'язково заміщеного 5-8-членного гетеромоноциклу, конденсованого з одним або двома необов'язково заміщеними ненасиченими або насиченими кільцями або з іншими гетероциклами, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; та/або n є ціле число від 0 до 6, переважно від 0 до 2. Відповідно до втілення винаходу, якому надають перевагу, R2 відрізняється від R3. Сполуки за винаходом, яким надають перевагу, включають, але це не є обмеженням, сполуки, вибрані з групи, що складається з: 8-гідрокси-N-метил-N-(4-(2-фенілпропан-2-іл)бензил)хінолін-2-карбоксаміду; N-бензил-8-гідрокси-N-метилхінолін-7-карбоксаміду; (8-гідроксихінолін-7-іл)(ізоіндолін-2-іл)метанону; (8-гідроксихінолін-7-іл)(морфолін)метанону; (8-гідроксихінолін-7-іл)(піперидин-1-іл)метанону; 8-гідрокси-N-метил-N-фенетилхінолін-7-карбоксаміду; (8-гідроксихінолін-7-іл)(індолін-1-іл)метанону; N-(фуран-2-ілметил)-8-гідрокси-N-метилхінолін-7-карбоксаміду; (3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону; N-(4-бромбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду; 8-гідрокси-N-(4-метоксифеніл)-N-метилхінолін-7-карбоксаміду; (6,7-диметокси-3,4-дигідроізохінолін-2(1H)-іл)(8-гідроксихінолін-7-іл)метанону; 8-гідрокси-N-метил-N-(тетрагідро-2H-піран-4-іл)хінолін-7-карбоксаміду; 8-гідрокси-N-метил-N-фенілхінолін-7-карбоксаміду; N-(4-хлорфеніл)-8-гідрокси-N-метилхінолін-7-карбоксаміду; N-етил-8-гідрокси-N-фенілхінолін-7-карбоксаміду; N-циклогексил-8-гідрокси-N-метилхінолін-7-карбоксаміду; 8-гідрокси-N-метил-N-(1-метилпіперидин-4-іл)хінолін-7-карбоксаміду; 8-гідрокси-N-метил-N-(1-метилпіролідин-3-іл)хінолін-7-карбоксаміду; N-(2-ціаноетил)-N-(фуран-2-ілметил)-8-гідроксихінолін-7-карбоксаміду; N-(2-ціаноетил)-8-гідрокси-N-((тетрагідрофуран-2-іл)метил)хінолін-7-карбоксаміду; N-етил-8-гідрокси-N-метилхінолін-7-карбоксаміду; 8-гідрокси-N-метил-N-пропілхінолін-7-карбоксаміду; (3,4-дигідроізохінолін-2(1H)-іл)(8-гідроксихінолін-7-іл)метанону; (5-броміндолін-1-іл)(8-гідроксихінолін-7-іл)метанону; (8-гідроксихінолін-7-іл)(6-метокси-3,4-дигідрохінолін-1(2H)-іл)метанону; (8-гідроксихінолін-7-іл)(5-нітроіндолін-1-іл)метанону; 8-гідрокси-N-феніл-N-пропілхінолін-7-карбоксаміду; (8-гідроксихінолін-7-іл)(октагідрохінолін-1(2H)-іл)метанону; N-(4-фторбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду; N-(3-бромбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду; (8-гідроксихінолін-7-іл)(4-(трифторметил)піперидин-1-іл)метанону; (4-терт-бутилпіперидин-1-іл)(8-гідроксихінолін-7-іл)метанону; (S)-8-гідрокси-N-метил-N-(1-фенілетил)хінолін-7-карбоксаміду; 6 UA 107949 C2 5 10 15 20 25 30 35 40 45 50 N-бензил-8-гідрокси-N-(2-гідроксіетил)хінолін-7-карбоксаміду; (3,3-диметилпіперидин-1-іл)(8-гідроксихінолін-7-іл)метанону; N-(2-бромбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду; (8-гідроксихінолін-7-іл)(4-фенілпіперидин-1-іл)метанону; ((4aS, 8S, 8aR)-8-гідрокси-октагідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону; (8-гідроксихінолін-7-іл)(2-метилпіперидин-1-іл)метанону; (8-гідроксихінолін-7-іл)(2-фенілпіперидин-1-іл)метанону; (1,1-діоксо-тіоморфолін-4-іл)-(8-гідрокси-хінолін-7-іл)-метанону; (8-гідроксихінолін-7-іл)(4-метилпіперидин-1-іл)метанону; (R)-8-гідрокси-N-(1-фенілетил)хінолін-7-карбоксаміду; (8-гідроксихінолін-7-іл)(2-метилпіролідин-1-іл)метанону; (2,5-диметилпіролідин-1-іл)(8-гідроксихінолін-7-іл)метанону; (8-гідроксихінолін-7-іл)(3-фенілпіролідин-1-іл)метанону; (3-(диметиламін)піролідин-1-іл)(8-гідроксихінолін-7-іл)метанону; (8-гідроксихінолін-7-іл)(3-метилпіперидин-1-іл)метанону; (8-гідроксихінолін-7-іл)(піролідин-1-іл)метанону; (1,4-діокса-8-аза-спіро[4.5]дец-8-іл)-(8-гідрокси-хінолін-7-іл)-метанону; (8-гідроксихінолін-7-іл)(6-метил-3,4-дигідрохінолін-1(2H)-іл)метанону; (8-гідроксихінолін-7-іл)(6-нітроіндолін-1-іл)метанону; (8-гідроксихінолін-7-іл)(7-(трифторметил)-3,4-дигідрохінолін-1(2H)-іл)метанону; (5-бром-8-гідроксихінолін-7-іл)(ізоіндолін-2-іл)метанону; (гексагідро-1H-ізоіндол-2(3H)-іл)(8-гідроксихінолін-7-іл)метанону; (8-гідроксихінолін-7-іл)(2-метил-3,4-дигідрохінолін-1(2H)-іл)метанону; (8-гідроксихінолін-7-іл)(3-метил-3,4-дигідрохінолін-1(2H)-іл)метанону; (8-гідроксихінолін-7-іл)(4-метил-3,4-дигідрохінолін-1(2H)-іл)метанону; (8-фтор-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону; (8-гідроксихінолін-7-іл)(6-ізопропіл-3,4-дигідрохінолін-1(2H)-іл)метанону; (6-хлор-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону; (8-гідроксихінолін-7-іл)(7-метил-3,4-дигідрохінолін-1(2H)-іл)метанону; (6-бром-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону; (2H-бензо[b][1,4]оксазин-4(3H)-іл)(8-гідроксихінолін-7-іл)метанону. У втіленні, якому надають особливу перевагу, сполуки за цим винаходом вибирають з: (8-гідроксихінолін-7-іл)(ізоіндолін-2-іл)метанону (Приклад 10); (8-гідроксихінолін-7-іл)(октагідроізохінолін-2(1H)-іл)метанону (Приклад 6); N-(4-бромфеніл)-8-гідрокси-N-метилхінолін-7-карбоксаміду (Приклад 29); (декагідро-1H-карбазол-9(9aH)-іл)(8-гідроксихінолін-7-іл)метанону (Приклад 49); N-(4-хлорбензил)-8-гідрокси-N-метилхінолін-7-карбоксаміду (Приклад 56); (5,7-дифтор-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону (Приклад 70); (7-фтор-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону (Приклад 61); (5-фтор-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону (Приклад 71); (6-фтор-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону (Приклад 72); (5-хлор-8-гідрокси-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанону (Приклад 73); (2H-бензо[b][1,4]оксазин-4(3H)-іл)(8-гідроксихінолін-7-іл)метанону (Приклад 74). Сполуки за цим винаходом можуть бути одержані сполучанням підходящих 8гідроксихінолін-7-карбонових кислот 1-1 (або похідних кислоти, таких як галіди або складні ефіри кислоти) з відповідними амінами 1-2, як представлено наведеною нижче загальною схемою 1: Схема 1 Альтернативно, гідроксильна група карбонової кислоти може бути захищена (як описано у Bioorg.Med.Chem., 14, 2006, 5742-5755 або Synthesis, 12, 1997, 1425-1428 або DE540842) перед 7 UA 107949 C2 5 10 15 20 25 30 35 здійсненням сполучання з аміном і звільнена від захисту на кінцевій стадії. Способи сполучання карбонових кислот з амінами для утворення карбоксамідів є добре відомими у цій галузі. Наприклад, підходящі способи описані Jerry March, Advanced Organic th Chemistry, 4 edition, John Wiley & Sons, 1992, стор. 417-425. Способи захисту та зняття захисту ароматичних гідроксильних груп є добре відомими у цій галузі. Захисними групами маніпулюють відповідно до стандартних способів органічного синтезу (Green T.W. and Wuts P.G.M. (1991) Protecting Groups in Organic Synthesis, John Wiley et Sons). Схеми 2-3 нижче ілюструють та розкривають хімічний склад, зображений на схемі 1. Схема 2 Коли A означає Br, карбонову кислоту 2-1 (що її одержують у Приготуванні 4 нижче) одержували реагуванням наявної у продажу 8-гідроксихінолін-7-карбонової кислоти з одним еквівалентом брому в оцтовій кислоті (міжнародна публікація WO98/11073, опублікована 19 березня 1998 р.). Коли A означає F або Cl, карбонові кислоти 2-1 можуть бути одержані з відповідних наявних у продажу вихідних матеріалів 5-гало-8-гідроксихінолінів із застосуванням способів, описаних у міжнародній публікації WO98/11073, опублікованій 19 березня 1998 р. Коли A означає NO2, карбонову кислоту 2-1 одержували реагуванням відповідного етилового складного ефіру із сумішшю HNO 3 і H2SO4 з подальшим лужним гідролізом. Альтернативно, карбонову кислоту 2-1 з A=NO2 одержували реагуванням 3-амін-2-гідрокси-5нітробензойної кислоти з пропеналом у 6Н HCl. Сполуки загальної формули 1-2 Схеми 1 є наявними у продажу або були одержані із використанням традиційних процедур синтезу, добре відомих спеціалістові у цій галузі. Коли 1-2 були тетрагідрохінолінами (3-2), не доступними у продажу, їх одержували відновленням відповідних хінолінів 3-1 із застосуванням традиційних процедур синтезу, таких як з оксидом платини та H2 або із Zn та хлористоводневою кислотою. Схема 3 Одержання підходящих заміщених, відсутніх у продажу хінолінів 3-1 здійснювали із застосуванням традиційних процедур синтезу, які не описані більш докладно. У цих реакціях також можливо застосовувати варіанти, які самі по собі відомі спеціалістові із середнім рівнем знань у цій галузі. Для спеціаліста у цій галузі буде очевидним, що описані процедури синтезу є суто показовими за своєю природою і що спеціалістові із середнім рівнем знань в органічній хімії відомі альтернативні способи синтезу. Наведені далі приклади слугують лише для ілюстрування винаходу та його здійснення на практиці. Ці приклади не мають розглядатися як обмеження обсягу або духу винаходу. 8 UA 107949 C2 5 10 15 Експериментальний розділ 1. Хімічний синтез Якщо не вказано інакше, всі вихідні реактиви були наявні у продажу і їх використовували без попереднього очищення. Сполуки за цим винаходом можна легко одержати із використанням традиційної процедури синтезу. В цих реакціях також можливо застосовувати варіанти, які відомі спеціалістові із середнім рівнем знань у цій галузі, але не описані більш докладно. Крім того, інші способи одержання сполук за цим винаходом будуть явно очевидними спеціалістові у цій галузі з урахуванням наведених далі схем реакцій та прикладів. Якщо не вказано інакше, всі змінні величини є такими, як визначено вище. У разі наведення посилання на застосування "аналогічної" процедури, що буде зрозумілим для спеціаліста у цій галузі, така процедура може містити незначну зміну, наприклад, відносно температури реакції, кількості реактиву/розчинника, часу реакції, умов обробки або умов хроматографічного очищення. Використані у цьому описі скорочення, особливо в таблицях та прикладах, підсумовані в Таблиці 1. Таблиця 1 НЕРХ (Надзвичайно ефективна рідинна хроматографія) МС-РХ (Мас-спектр рідинної хроматографії) ВЕРХ (Високоефективна рідинна хроматографія) CH3CN (ацетонітрил) мкм (мікрони) ммоль (мілімолі) psi (фунт на квадратний дюйм) КТ (кімнатна температура) ЕТФС (екстрагування твердої фази силікагелем) ДХМ (дихлорметан) K2CO3 (карбонат калію) Na2SO4 (сульфат натрію) Et2O (діетилефір) EtOAc (етилацетат) TEA (тріетиламін) i-PrOH (ізопропіловий спирт) ДМСО (диметилсульфоксид) EDC.HCl (1-(3-диметиламінпропіл)-3-етилкарбодііміду гідрохлорид)) 20 25 30 35 Rt (час утримування у хвилинах) ІЕР (Іонізація електророзпилюванням) хв. (хвилини) год. (години) мкл (мікролітри) ТФК (Трифтороцтова кислота) Pd/C (паладій на вуглеці) МХ (мікрохвильовий) HOBt (1-гідроксибензотріазол) ТГФ (тетрагідрофуран) ДІПЕА (N, N-діізопропілетиламін) NaOH (гідроксид натрію) LiAlH4 (алюмогідрид літію) NaBH4 (борогідрид натрію) HCl (соляна кислота) MeOH (метанол) ОУК (одиниця, що утворює колонію) Якщо не вказано інакше, всі температури виражені у C (градусах Цельсію) або K (Кельвіна). 1 Спектр протонного ядерного магнітного резонансу ( H-ЯМР) реєстрували на приладі Брукер (Brucker) 300 МГц. Хімічні зсуви виражали у частинах на мільйон (ч./млн, δ частин). У зразках розщеплення описували видимі множинності та позначали як s (синглет), d (дублет), t (триплет), q (квартет), quint (квінтет), sxt (секстет), m (мультиплет), br. s (широкий синглет). МС-РХ реєстрували за таких умов: - Метод A-C: УЕРХ за допомогою Приладу для роботи зі зразками і Детектора на фотодіодній матриці 2996 (Waters), з'єднаних з одноквадрупольним мас-спектрометром ZQ (Waters). Інтерфейс ZQ: позитивний режим ІЕР. Повне сканування від 102 до 900 аом. Капіляр 3,2 В, конус 25 В, екстрактор 3 В, РЧ 0,3 В, температура джерела 115 °C, температура десольватації 350 °C, потік газу 800 л/год., конус 100 л/год. Колонка Aquity УЕРХ-BEH C18 (50 × 2,1 мм, 1,7 мкм). Швидкість потоку 0,6 мл/хв., колонка при 40 °C, упорскування 2 мкл. Мобільні фази: фаза A = вода/CH3CN 95/5+0,1 % ТФК, фаза B = вода/CH3CN=5/95+0,1 % ТФК. - Метод A: 0-0,25 хв. (A: 95 %, B: 5 %), 3,30 хв. (A: 0 %, B: 100 %), 3,30-4,00 (A: 0 %, B: 100 %), 4,10 хв. (A: 95 %, B: 5 %), 4,10-5,00 хв. (A: 95 %, B: 5 %). -Метод B: 0-1,00 хв. (A: 100 %, B: 0 %), 1,50 хв, (A: 95 %, B: 5 %), 3,50 хв, (A: 0 %, B: 100 %), 3,50-4,00 (A: 0 %, B: 100 %), 4,10 хв, (A: 100 %, B: 0 %), 4,10-5,00 хв, (A: 100 %, B: 0 %). - Метод C: 0-0,50 хв, (A: 95 %, B: 5 %), 6,00 хв, (A: 0 %, B: 100 %), 6,00-7,00 (A: 0 %, B: 100 %), 7,10 хв, (A: 95 %, B: 5 %), 7,10-8,50 хв, (A: 95 %, B: 5 %), - Метод D: насос ВЕРХ Waters 1525 (Waters) і Детектор на фотодіодній матриці 2996 (Waters), з'єднані з одноквадрупольним мас-спектрометром ZQ (Waters). Інтерфейс ZQ: позитивний режим ІЕР. Повне сканування від 102 до 900 аом. Капіляр 3,2 В, конус 25 В, 9 UA 107949 C2 5 10 15 20 25 30 35 40 45 50 екстрактор 3 В, РЧ 0,3 В, температура джерела 115 °C, температура десольватації 350 °C, потік газу 600 л/год., конус 100 л/год. Колонка X-bridge C18 (50 × 2,1 мм, 3,5 мкм). Швидкість потоку 0,4 мл/хв., колонка при 40 °C, упорскування 5 мкл. Мобільні фази: фаза A = вода/CH3CN 95/5+NH3 pH 9,5, фаза B = вода/CH3CN=5/95+NH3 pH 9,5. 0-1,00 хв. (A: 95 %, B: 5 %), 7,50 хв. (A: 0 %, B: 100 %), 7,50-8,50 хв. (A: 0 %, B: 100 %), 8,60 хв. (A: 95 %, B: 5 %), 8,60-9,60 хв. (A: 95 %, B: 5 %). - Метод E: УЕРХ за допомогою Приладу для роботи зі зразками і Детектора на фотодіодній матриці 2996 (Waters), з'єднаних з одноквадрупольним мас-спектрометром ZQ (Waters). Інтерфейс ZQ: позитивний режим ІЕР. Повне сканування від 100 до 600 аом. Капіляр 3,25 В, конус 26 В, екстрактор 3 В, температура джерела 120 °C, температура десольватації 400 °C, потік газу 800 л/год., конус 100 л/год. Колонка Aquity УЕРХ-BEH C18 (50 × 2,1 мм, 1,7 мкм). Швидкість потоку 0,5 мл/хв., колонка при 40 °C, упорскування 2 мкл. Мобільні фази: фаза A = вода/CH3CN 95/5+0,1 % ТФК, фаза B = вода/CH3CN=5/95+0,1 % ТФК. 0 хв. (A: 95 %, B: 5 %), 0,30 хв. (A: 92 %, B: 8 %), 1,50 хв. (A: 0 %, B: 100 %), 1,50-2,00 хв. (A: 0 %, B: 100 %). - Метод F: насос ВЕРХ Waters 1525 (Waters) і Детектор на фотодіодній матриці 2996 (Waters), з'єднані з одноквадрупольним мас-спектрометром ZQ (Waters). Інтерфейс ZQ: позитивний режим ІЕР. Повне сканування від 102 до 900 аом. Капіляр 3,2 В, конус 25 В, екстрактор 3 В, РЧ 0,3 В, температура джерела 115 °C, температура десольватації 350 °C, потік газу 600 л/год., конус 100 л/год. Колонка Synergy C18 (20 × 2,0 мм, 2,5 мкм). Швидкість потоку 0,7 мл/хв., упорскування 2 мкл. Мобільні фази: фаза A = вода/CH3CN 95/5 + ТФК 0,1 %, фаза B = вода/CH3CN=5/95 + ТФК 0,1 %. 0-0,25 хв. (A: 95 %, B: 5 %), 3,50 хв, (A: 0 %, B: 100 %), 3,504,50 хв, (A: 0 %, B: 100 %), 4,60 хв, (A: 95 %, B: 5 %), 4,60-6,00 хв, (A: 95 %, B: 5 %). Програмне забезпечення, колонки та умови, що їх використовували для очищення препаративною ВЕРХ Програмне забезпечення Shimadzu CLASS-VP 1.0.0.1 Колонка Застосовували колонку препаративна колонка Waters Symmetry Prep C18 з такими розмірами: внутрішній діаметр – 19 мм на довжину 300 мм. Розмір часток стаціонарної фази становив 7 мкм. Розчинники A. Водний розчинник = вода/CH3CN 90/10+0,05 % ТФК. B. Органічний розчинник = CH3CN/водаr 90/10+0,05 % ТФК. Розчинник для промивання голкою = i-PrOH. Спосіб Застосовували лише один спосіб (5-100 % B); він мав швидкість потоку 20 мл/хв. і 35хвилинний робочий цикл, що складався з 28-хвилинного градієнту з подальшою 7-хвилинною стадією промивання колонки та повторного врівноважування. Одержання 1: N-Метил-1-(4-(2-фенілпропан-2-іл)феніл)метанаміну гідрохлорид Стадія A: 4-(2-фенілпропан-2-іл)бензальдегід Суспензію пропан-2,2-діїлдибензену (3,93 г, 20 ммоль) та 1-аза-трицикло[3.3.1.1*3,7*]декану (2,80 г, 20 ммоль) у ТФК (35 мл) нагрівали при температурі 100 °C впродовж 16 год. Реакційну суміш залишили охолоджуватись до КТ, вилили в холодну воду і зробили лужною (pH=9) твердим K2CO3. Водний розчин екстрагували Et2O (3 × 250 мл), і відокремлені органічні речовини висушили над Na2SO4, відфільтрували та концентрували при зниженому тиску. Осад очистили флеш-хроматографією (силікагель, петролейний ефір:EtOAc 95:5) з одержанням вказаної у заголовку сполуки (3,47 г, 15,46 ммоль). 1 H-ЯМР (CDCl3) δ: 10,00 (s, 1H); 7,81 (m, 2H); 7,42 (m, 2H); 7,14-7,38 (m, 5H); 1,74 (s, 6H). Стадія B: N-метил-1-(4-(2-фенілпропан-2-іл)феніл)метанаміну гідрохлорид 10M розчин метиламіну в етанолі (4 мл, 40 ммоль) додали до розчину 4-(2-фенілпропан-2іл)бензальдегіду (2,24 г, 10 ммоль) за Одержанням 1 в абсолютному етанолі (30 мл), і одержану суміш збовтували при КТ, під азотом впродовж ночі. Реакційну суміш потім відфільтрували крізь 10 UA 107949 C2 5 10 15 20 25 30 35 40 прокладку ЦЕЛІТУ, і рідини концентрували при зниженому тиску. Осад розчинили у сухому метанолі (25 мл) і обробили порціями при температурі 0 °C NaBH4 (456 мг, 12 ммоль). Після завершення додавання реакційну суміш нагрівали до 40 °C впродовж 1 години, а потім збовтували при КТ, під азотом, впродовж ночі. Реакційну суміш погасили H 2O і концентрували при зниженому тиску. Осад поділили між H2O і Et2O, і відокремлені органічні речовини висушили над Na2SO4, відфільтрували та концентрували до сухості. Потім осад розчинили в абсолютному етанолі, додали 4Н розчин HCl в діоксані (4 мл), і суміш збовтували при КТ впродовж ночі. Суміш концентрували при зниженому тиску, і одержаний осад розтерли в порошок за допомогою iPrOH з одержанням вказаної у заголовку сполуки (1,71 г, 7,15 ммоль). 1 H-ЯМР (ДМСО-d6) δ: 9,25 (br, s, 2H); 7,44 (m, 2H); 7,10-7,36 (m, 7H); 4,04 (t, 2H); 2,51-2,57 (m, 3H); 1,65 (s, 6H). Одержання 2: 8-Гідроксихінолін-7-карбонілхлорид Тіонілхлорид (906 мг, 7,61 ммоль) додали краплями до холодного розчину 8-гідроксихінолін7-карбонової кислоти (1,2 г, 6,34 ммоль) у сухому ДХМ (18 мл). Реакційну суміш залишили нагріватися до КТ, а потім збовтували під азотом впродовж 4 год. Реакційну суміш потім концентрували до сухості з одержанням вказаної у заголовку сполуки (1,3 г, 6.26 ммоль), яку використовували на наступних стадіях без додаткового очищення. Одержання 3: Октагідро-1H-ізоіндол Стадія A: Гексагідро-1H-ізоіндол-1,3(2H)-діон Розчин (3aR, 7aS)-3a, 4,7,7a-тетрагідро-1H-ізоіндол-1,3(2H)-діону (3,0 г, 19,9 ммоль) і 10 %2 ного Pd/C (300 мг) в MeOH (100 мл) струшували в атмосфері H 2 (300 ф/дюйм ) в апараті Parr впродовж 24 год. Реакційну суміш відфільтрували, і рідини концентрували до сухості з одержанням вказаної у заголовку сполуки (2,6 г, 16,99 ммоль), яку використовували без додаткого очищення, у вигляді білого порошку. 1 H-ЯМР (CDCl3) δ: 8,16 (br, s, 1H); 2,73-3,05 (m, 2H); 1,64-1,98 (m, 4H), 1,40-1,64 (m, 4H). Стадія B: Октагідро-1H-ізоіндол Розчин гексагідро-1H-ізоіндол-1,3(2H)-діону (1,0 г, 6,5 ммоль) у сухому ТГФ (14 мл) додали краплями до збовтаної суспензії LiAlH4 у сухому ТГФ (6 мл) у такій пропорції, щоб розчинник помірно нагрівався зі зворотним холодильником. Одержану реакційну суміш нагрівали зі зворотним холодильником впродовж 20 год., а потім залишили охолоджуватись до КТ. Реакційну суміш охолодили за допомогою крижаної ванни, і послідовно додали H 2O (1 мл), 20 %-ний водний розчин NaOH (2,5 мл) і H2O (2 мл). Суміш відфільтрували і видалии ТГФ при зниженому тиску. Водну фазу екстрагували за допомогою Et2O, і відокремлені органічні речовини висушили над Na2SO4, відфільтрували та концентрували до сухості з одержанням вказаної у заголовку сполуки (690 мг, 5,52 ммоль) у вигляді білого порошку, який використовували на наступній стадії без додаткового очищення. + + МС-РХ м/з (ІЕР ): 126,1 (MH ), Rt=0,80 хв. (спосіб E). Одержання 4: 11 UA 107949 C2 5 10 15 20 25 5-Бром-8-гідроксихінолін-7-карбонова кислота Бром (819,8 мг, 5,13 ммоль) додали краплями до суспензії 8-гідроксихінолін-7-карбонової кислоти (970 мг, 5,13 ммоль) в кристалізованій оцтовій кислоті (24 мл). Реакційну суміш нагрівали зі зворотним холодильником впродовж 1 год., залишили охолоджуватися до 50 °C і вилили у крижану воду. Утворену жовту тверду речовину відфільтрували крізь воронку Бакнера (Buckner), промили H2O та висушили у вакуумі з одержанням вказаної у заголовку сполуки (1,20 г, 4,51 ммоль) у вигляді світло-коричневої твердої речовини, яку використовували на наступній стадії без додаткового очищення. 1 H-ЯМР (ДМСО-d6) δ: 9,90 (dd, 1H); 8,58 (dd, 2H); 8,12 (s, 1H); 7,90 (dd, 1H). Приклад 1: 8-Гідрокси-N-метил-N-(4-(2-фенілпропан-2-іл)бензил)хінолін-2-карбоксамід TEA (42 мг, 0,42 ммоль), EDC.HCl (80 мг, 0,42 ммоль), HOBt (57 мг, 0,418 ммоль) і N-метил1-(4-(2-фенілпропан-2-іл)феніл)метанамін (50 мг, 0,21 ммоль) з Приготування 1 послідовно додали до суспензії 8-гідроксихінолін-7-карбонової кислоти (48 мг, 0,25 ммоль) у ДХМ (2,5 мл). Одержану реакційну суміш збовтували при КТ впродовж ночі. Суміш погасили H 2O і потім тричі екстрагували ДХМ. Відокремлені органічні речовини висушили над Na 2SO4, відфільтрували та концентрували при зниженому тиску. Осад очистили флеш-хроматографією (силікагель, ДХМ:MeOH 95:5) з одержанням вказаної у заголовку сполуки (39 мг, 0,1 ммоль) у вигляді сірої + + твердої речовини. МС-РХ м/з (ІЕР ): 411,2 (MH ), Rt=2,42 хв. (Спосіб A). 1 H-ЯМР (ДМСО-d6, 353K) δ: 8,89 (dd, 1H); 8,33 (dd, 1H); 7,59 (dd, 1H); 7,35-7,50 (m, 2H); 7,117,32 (m, 9H); 4,60 (s, 2H); 2,88 (s, 3H); 1,66 (s, 6H). Відповідно до процедур, аналогічних до описаної вище, одержали додаткові сполуки за цим винаходом (Таблиця 2). 12 UA 107949 C2 Таблиця 2 H-ЯМР (ДМСО-d6) Метод МС-РХ Rt [MH ] (+Na2CO3) δ: 8,48 (d, 1H); 7,97 (d, 1H); 6,78-7,73 (m, 7H); 6,49 (d, 1H); 4,64 (br. s, 2H); 2,89 (br. s, 3H) A 1,53; 293 δ: 10,26 (br. s, 1H); 8,91 (dd, 1H); 8,37 (dd, 1H); 7,62 (dd, 1H); 7,47 (d, 1H); 7,39 (d, 1H); 3,61 (br. s, 4H); 3,28 (br. s, 4H) A 0,76; 259,1 δ: 10,12 (br. s, 1H); 8,90 (dd, 1H); 8,36 (dd, 1H); 7,61 (dd, 1H); 7,45 (d, 1H); 7,35 (d, 1H); 3,27 (br. s, 4H); 1,121,98 (m, 6H) A 1,20; 257,2 δ: 10,04 (br. s, 1H); 8,658,95 (m, 1H); 8,06-8,35 (m, 1H); 7,44-7,72 (m, 1H); 7,027,35 (m, 7H); 3,37 (s, 3H) Пр. A 1,34; 279,1 1 Хімічна назва 2 N-Бензил-8-гідрокси-N-метилхінолін-7карбоксамід 3 (8-Гідроксихінолін-7-іл) (морфолін)метанон 4 (8-Гідроксихінолін-7-іл) іл)метанон (піперидин-1 5 + 8-Гідрокси-N-метил-N-(тетрагідро-2Hпіран-4-іл)хінолін-7-карбоксамід Приклад 6: 5 10 15 (8-Гідроксихінолін-7-іл)(октагідроізохінолін-2(1H)-іл)метанон Розчин 8-гідроксихінолін-7-карбоніл хлориду за Приготуванням 2 (70 мг, 0,35 ммоль) і декагідроізохіноліну (62,6 мг, 0,45 ммоль) у ТГФ (8 мл) і ДІПЕА (259 мг, 2,0 ммоль) збовтували та нагрівали до 50 °C впродовж ночі. Реакційну суміш концентрували при зниженому тиску і осад поділили між ДХМ і H2O. Відокремлені органічні речовини висушили над Na 2SO4, відфільтрували та концентрували при зниженому тиску. Осад очистили флеш-хроматографією (силікагель, ДХМ:MeOH 98:2), а потім препаративною ВЕРХ. Фракції із вмістом продукту поєднали, зробили основними насиченим водним розчином гідрокарбонату натрію і видалили CH3CN при зниженому тиску. Водну фазу екстрагували ДХМ, і відокремлені органічні речовини висушили над Na2SO4, відфільтрували та концентрували до сухості з одержанням вказаної у заголовку сполуки (49 мг, 0,16 ммоль) у вигляді не зовсім білої речовини. + + МС-РХ м/з (ІЕР ): 311,2 (MH ), Rt=2,64-2,73 хв. (Спосіб C). 1 H-ЯМР (ДМСО-d6, 353K) δ: 8,89 (dd, 1H); 8,33 (dd, 1H); 7,59 (dd, 1H); 7,44 (d, 1H); 7,35 (d, 1H); 3,56-4,22 (m, 2H); 3,24 (dd, 1H); 3,16 (ddd, 1H); 1,02-2,12 (m, 12H). Відповідно до процедур, аналогічних до описаної вище, одержали додаткові сполуки за цим 13 UA 107949 C2 винаходом (Таблиця 3). Таблиця 3 Пр. 1 Хімічна назва 7 8-гідрокси-N-метил-Nфенетилхінолін-7-карбоксамід 8 (8-гідроксихінолін-7-іл)(індолін-1іл)метанон 9 N-(Фуран-2-ілметил)-8-гідрокси-Nметилхінолін-7-карбоксамід H-ЯМР (ДМСО-d6) Метод МС-РХ + Rt; [MH ] δ: 8,90 (dd, 1H); 8,33 (dd, 1H); 7,59 (dd, 1H); 7,41 (d, 1H), A 6,77-7,34 (m, 6H); 3,61 (t, 2H); 2,95 (s, 3H); 2,89 (dd, 2H) 1,56; 307,1 (353K) δ: 8,93 (dd, 1H); 8,38 (dd, 1H); 7,81 (br. s, 1H); 7,63 (dd, 1H); 7,52 (d, 1H); 7,48 (d, A 1H); 7,19-7,33 (m, 1H); 7,097,20 (m, 1H); 7,03 (td, 1H); 4,01 (t, 2H), 3,11 (t, 2H) 1,56; 291,1 (353K) δ: 8,90 (dd, 1H); 8,35 (dd, 1H); 7,61 (dd, 1H); 7,55 (dd, 1H); 7,46 (d, 1H); 7,37 (d, A 1H); 6,41 (dd, 1H); 6,33 (d, 1H); 4,61 (s, 2H); 2,94 (s, 3H) 1,28; 283,1 Приклад 10: 5 10 15 20 (8-Гідроксихінолін-7-іл)(ізоіндолін-2-іл)метанон Суміш 8-гідроксихінолін-7-карбонової кислоти (189 мг, 1,0 ммоль) і ди(1H-імідазол-1іл)метанону (162,2 мг, 1,0 ммоль) у ТГФ (10 мл) нагрівали зі зворотним холодильником впродовж 4 год. під азотом. Реакційну суміш залишили охолоджуватись до КТ і додали ізоіндолін (95,3 мг, 0,80 ммоль). Одержану суміш збовтували при КТ впродовж 3 годин і потім залишилися стояти при КТ впродовж ночі. Реакційну суміш потім погасили H 2O та водним насиченим розчином гідрокарбонату натрію і двічі екстрагували ДХМ. Відокремлені органічні речовини висушили над Na2SO4, відфільтрували та концентрували при зниженому тиску. Осад очистили картриджем ЕТФС (2 г, ДХМ до ДХМ:MeOH 99:1) з одержанням вказаної у заголовку сполуки (123 мг, 0,42 ммоль) у вигляді світло-коричневої твердої речовини. + + МС-РХ м/з (ІЕР ): 291,2 (MH ), Rt=3,47 хв. (Метод C) 1 H-ЯМР (ДМСО-d6) δ: 8,98 (dd, 1H); 8,54 (dd, 1H); 7,74 (dd, 1H); 7,58 (m, 1H); 7,53 (m, 1H); 7,38-7,47 (m, 1H); 7,17-7,37 (m, 3H); 4,90 (s, 2H); 4,69 (s, 2H). Відповідно до процедур, аналогічних до описаної вище, одержали додаткові сполуки за цим винаходом (Таблиця 4). 14 UA 107949 C2 Таблиця 4 Пр. Rt; + [MH ] A 1,55; 305,2 (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,53 (m, 2H); 7,36-7,49 (m, 2H); 7,31 (m, 2H); 4,62 (s, 2H); 2,89 (s, 3H) A 1,86; 370,95 (353K) δ: 8,81 (dd, 1H); 8,22 (dd, 1H); 7,52 (dd, 1H); 7,237,33 (m, 2H); 7,19 (m, 2H); 6,74 (m, 2H); 3,65 (s, 3H); 3,34 (s, 3H) A 1,38; 309,1 A 1,42; 365,1 δ: 10,04 (br, s, 1H); 8,65-8,95 (m, 1H); 8,06-8,35 (m, 1H); 7,44-7,72 (m, 1H); 7,02-7,35 (m, 7H); 3,37 (s, 3H) 11 (3,4-Дигідрохінолін-1(2H)-іл) гідроксихінолін-7-іл)метанон A 1,34; 279,1 δ: 10,09 (br, s, 1H); 8,83 (dd, 1H); 8,18-8,38 (m, 1H); 7,55 (dd, 1H); 7,14-7,42 (m, 6H); 3,36 (s, 3H) A 1,61; 313,1 H ЯМР (ДМСО-d6) δ: 8,86 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,42 (s, 2H), 7,06-7,34 (m, 2H); 6,74-7,05 (m, 2H); 3,74 (t, 2H); 2,82 (t, (8- 2H); 1,81-2,09 (m, 2H) 12 N-(4-Бромбензил)-8-гідрокси-Nметилхінолін-7-карбоксамід 13 8-Гідрокси-N-(4-метоксифеніл)-Nметилхінолін-7-карбоксамід 14 Метод МСРХ 1 Хімічна назва (353K) δ: 8,91 (dd, 1H); 8,36 (dd, 1H); 7,61 (dd, 1H); 7,47 (d, 1H); 7,39 (d, 1H); 6,75 (s, 2H); 4,63 (s, 2H); 3,75 (s, 3H); (6,7-Диметокси-3,4-дигідроізохінолін3,72 (s, 3H); 3,63-3,71 (m, 2(1H)-іл)(8-гідроксихінолін-72H); 2,75-2,83 (m, 2H) іл)метанон 15 8-Гідрокси-N-метил-N-фенілхінолін-7карбоксамід 16 N-(4-Хлорфеніл)-8-гідрокси-Nметилхінолін-7-карбоксамід 15 UA 107949 C2 Продовження таблиці 4 δ: 10,01 (br. s, 1H); 8,80 (d, 1H); 8,22 (d, 1H); 7,52 (dd, 1H); 7,02-7,35 (m, 7H); 3,723,99 (m, 2H); 1,12 (t, 3H) A 1,52; 293,2 (353K) δ: 8,89 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,45 (d, 1H); 7,32 (d, 1H); 3,88 (br, s, 1H); 2,85 (s, 3H); 1,42-1,90 (m, 8H); 0,76-1,37 (m, 2H) A 1,57; 285,2 (353K) δ: 8,90 (dd, 1H); 8,35 (dd, 1H); 7,60 (dd, 1H); 7,46 (d, 1H); 7,33 (d, 1H); 3,86 (br, s, 1H); 2,86 (s, 3H); 2,75-2,84 (m, 2H); 2,14 (s, 3H); 1,732,06 (m, 4H); 1,49-1,73 (m, 2H) A 0,85; 300,2 δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,32 (d, 1H); 4,63 (br. s, 1H); 2,95 (s, 3H); 2,61-2,81 (m, 2H); 2,46 (dd, 1H); 2,24 (s, 3H); 2,14-2,24 (m, 1H); 1,942,13 (m, 1H); 1,69-1,96 (m, 1H) A 0,81; 286,2 (353K) δ: 8,91 (dd, 1H); 8,35 (dd, 1H); 7,61 (dd, 1H); 7,55 (d, 1H); 7,46 (d, 1H); 7,38 (d, 1H); 6,40 (dd, 1H); 6,34 (br. s, 1H); 4,66 (s, 2H); 3,66 (t, 2H); 2,73 (t, 2H) 17 A 1,30; 322,1 N-Етил-8-гідрокси-N-фенілхінолін-7карбоксамід 18 N-Циклогексил-8-гідрокси-Nметилхінолін-7-карбоксамід 19 8-Гідрокси-N-метил-N-(1метилпіперидин-4-іл)хінолін-7карбоксамід 20 8-Гідрокси-N-метил-N-(1метилпіролідин-3-іл)хінолін-7карбоксамід 21 N-(2-Ціаноетил)-N-(фуран-2-ілметил)8-гідроксихінолін-7-карбоксамід 16 UA 107949 C2 Продовження таблиці 4 δ: 8,91 (dd, 1H); 8,35 (dd, 1H); 7,61 (dd, 1H); 7,48 (d, 1H); 7,37 (d, 1H); 3,94-4,18 (m, 1H); 3,52-3,84 (m, 5H); 3,293,48 (m, 1H); 2,81 (t, 2H); 1,64-1,96 (m, 3H); 1,44 (br. s, 1H) A 1,50; 326,0 (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,34 (d, 1H); 3,40 (q, 2H); 2,95 (s, 3H); 1,13 (t, 3H) A 0,96; 231,1 (353K) δ: 9,59 (br. s, 1H); 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,34 (d, 1H); 3,35 (t, 2H); 2,95 (s, 3H); 1,60 (sxt, 2H); 0,85 (t, 3H) A 1,18; 245,1 (353K) δ: 8,92 (dd, 1H); 8,36 (dd, 1H); 7,62 (dd, 1H); 7,48 (d, 1H); 7,40 (d, 1H); 7,04-7,23 (m, 4H); 4,72 (s, 2H); 3,71 (t, 2H); 2,89 (t, 2H) A 1,48; 305,2 δ: 10,50 (br. s, 1H); 8,94 (dd, 1H); 8,41 (dd, 1H); 8,12 (br. s, 1H); 7,66 (dd, 1H); 7,53 (d, 1H); 7,49 (d, 1H); 7,44-7,49 (5-Броміндолін-1-іл)(8-гідроксихінолін- (m, 1H); 7,42 (br. s, 1H); 3,834,16 (m, 2H); 3,11 (t, 2H) 7-іл)метанон A 1,83; 370,8 A 1,57; 335,2 22 N-(2-Ціаноетил)-8-гідрокси-N((тетрагідрофуран-2-іл)метил)хінолін7-карбоксамід 23 N-Етил-8-гідрокси-N-метилхінолін-7карбоксамід 24 8-Гідрокси-N-метил-N-пропілхінолін7-карбоксамід 25 (3,4-Дигідроізохінолін-2(1H)-іл)(8гідроксихінолін-7-іл)метанон 26 27 δ: 8,87 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,43 (d, 1H); 7,39 (d, 1H); 7,17 (d, 1H); 6,74 (d, 1H); 6,47 (dd, 1H); 3,703,81 (m, 2H); 3,68 (s, 3H); (8-Гідроксихінолін-7-іл) (6-метокси- 2,82 (t, 2H); 1,88-2,08 (m, 2H) 3,4-дигідрохінолін-1(2H)-іл)метанон гідрохлорид 17 UA 107949 C2 Продовження таблиці 4 δ: 10,66 (s, 1H); 8,95 (dd, 1H); 8,43 (dd, 1H); 8,16 (s, 3H); 7,67 (dd, 1H); 7,55 (d, 1H); 7,52 (d, 1H); 4,09 (t, 2H); 3,21 (t, 2H) A 1,68; 336,1 δ: 10,11 (br. s, 1H); 8,83 (dd, 1H); 8,27 (dd, 1H); 7,56 (dd, 1H); 7,26-7,47 (m, 4 H); 7,21 (m, 2H); 3,36 (s, 3H) A 1,65; 359,0 30 (353K) δ: 8,80 (dd, 1H); 8,21 (dd, 1H); 7,51 (dd, 1H); 7,28 (d, 1H); 7,24 (d, 1H); 7,21-7,28 (m, 2H); 7,13-7,21 (m, 2H); 7,04-7,11 (m, 1H); 3,71-3,94 (m, 2H); 1,59 (sxt, 2H); 0,92 (t, 8-Гідрокси-N-феніл-N-пропілхінолін-7- 3H) карбоксамід A 1,72; 307,2 31 (353K) δ: 8,89 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,45 (d, 1H); 7,32 (d, 1H); 4,03-4,48 (m, 1H); 3,56-3,99 (m, 1H); 2,98 (t, 1H); 1,63-2,03 (m, 5H); 0,93-1,63 (m, 8H) A 1,73; 311,3 (353K) δ: 8,90 (dd, 1H); 8,35 (dd, 1H); 7,60 (dd, 1H); 7,47 (d, 1H); 7,41 (d, 1H); 7,39 (m, 2H); 7,02-7,24 (m, 2H); 4,64 (s, 2H); 2,89 (s, 3H) A 1,57; 311,2 (353K) δ: 8,91 (dd, 1H); 8,35 (dd, 1H); 7,61 (dd, 1H); 7,53 (br, s, 1H); 7,47 (d, 1H); 7,47 (dt, 1H); 7,40 (d, 1H); 7,347,40 (m, 1H); 7,32 (t, 1H); 4,66 (s, 2H); 2,91 (s, 3H) A 1,77; 371,1 (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,46 (d, 1H); 7,38 (d, 1H); 4,03-4,24 (m, 2H); 2,93-3,08 (m, 2H); 2,54-2,69 (m, 1H); 1,88 (d, 2H); 1,52 (m, 2H) A 1,51; 325,2 28 (8-Гідроксихінолін-7-іл)(5нітроіндолін-1-іл)метанон 29 N-(4-Бромфеніл)-8-гідрокси-Nметилхінолін-7-карбоксамід (8-Гідроксихінолін-7іл)(октагідрохінолін-1(2H)-іл)метанон 32 N-(4-Фторбензил)-8-гідрокси-Nметилхінолін-7-карбоксамід 33 N-(3-Бромбензил)-8-гідрокси-Nметилхінолін-7-карбоксамід 34 (8-Гідроксихінолін-7-іл)(4(трифторметил)піперидин-1-іл) метанон 18 UA 107949 C2 Продовження таблиці 4 (353K) δ: 8,89 (dd, 1H); 8,33 (dd, 1H); 7,59 (dd, 1H); 7,44 (d, 1H); 7,35 (d, 1H); 4,07-4,19 (m, 2H); 2,77-2,92 (m, 2H); 1,55-1,82 (m, 2H); 1,12-1,39 (8- (m, 3H); 0,88 (s, 9H) A 1,89; 313,3 (353K) δ: 8,90 (dd, 1H); 8,35 (dd, 1H); 7,60 (dd, 1H); 7,48 (d, 1H); 7,22-7,44 (m, 6H); 5,54 (br. s, 1H); 2,68 (s, 3H); 1,60 (d, 3H) A 1,64; 307,2 (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,46 (d, 1H); 7,41 (d, 1H); 7,13-7,38 (m, 5H); 4,73 (s, 2H); 3,51 (t, 2H); 3,37 (t, 2H) A 1,33; 323,2 (353K) δ: 8,89 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,35 (d, 1H); 3,32-3,49 (m, 2H); 3,24 (s, 2H); 1,501,68 (m, 2H); 1,36-1,50 (m, 2H) 0,92 (s, 6H) A 1,54; 285,3 A 1,84; 371,2 N-(2-Бромбензил)-8-гідрокси-Nметилхінолін-7-карбоксамід (353K) δ: 8,91 (dd, 1H); 8,34 (dd, 1H); 7,59-7,66 (m, 1H); 7,61 (dd, 1H); 7,48-7,55 (m, 1H); 7,46 (d, 1H); 7,42 (d, 1H); 7,38-7,46 (m, 1H); 7,24 (td, 1H); 4,74 (s, 2H); 2,95 (s, 3H) A 1,85; 333,3 (8-Гідроксихінолін-7-іл)(4фенілпіперидин-1-іл)метанон (353K) δ: 8,90 (dd, 1H); 8,35 (dd, 1H); 7,60 (dd, 1H); 7,47 (d, 1H); 7,41 (d, 1H); 7,24-7,36 (m, 4H); 7,14-7,24 (m, 1H); 4,13-4,26 (m, 2H); 3,01-3,13 (m, 2H); 2,85 (tt, 1H); 1,781,97 (m, 2H); 1,53-1,78 (m, 2H) 35 (4-Терт-бутилпіперидин-1-іл) гідроксихінолін-7-іл)метанон 36 (S)-8-Гідрокси-N-метил-N-(1фенілетил)хінолін-7-карбоксамід 37 N-Бензил-8-гідрокси-N-(2гідроксіетил)хінолін-7-карбоксамід 38 (3,3-Диметилпіперидин-1-іл)(8гідроксихінолін-7-іл)метанон 39 40 19 UA 107949 C2 Продовження таблиці 4 41 δ: 10,03 (br. s, 1H); 8,90 (dd, 1H); 8,36 (dd, 1H); 7,61 (dd, 1H); 7,45 (d, 1H); 7,34 (d, 1H); 4,60-4,90 (m, 1H); 4,07-4,57 (m, 1H); 3,72-3,90 (m, 1H); ((4aS, 8S, 8aR)-8-Гідрокси- 3,41-3,67 (m, 1H); 2,09-2,24 (m, 1H); 0,70-1,95 (m, 10H) октагідрохінолін-1(2H)-іл)(8гідроксихінолін-7-іл)метанон 42 (8-Гідроксихінолін-7-іл)(2метилпіперидин-1-іл)метанон 43 (8-Гідроксихінолін-7-іл)(2фенілпіперидин-1-іл)метанон 44 (1,1-Діоксо-тіоморфолін-4-іл)-(8гідрокси-хінолін-7-іл)-метанон 45 (8-Гідроксихінолін-7-іл)-(4метилпіперидин-1-іл)метанон A 1,46; 327,3 (353K) δ: 8,89 (dd, 1H); 8,33 (dd, 1H); 7,59 (dd, 1H); 7,45 (d, 1H); 7,33 (d, 1H); 4,29-4,58 (m, 1H); 3,80-3,93 (m, 1H); 3,03 (td, 1H); 1,33-1,80 (m, 6H); 1,22 (d, 3H) A 1,43; 271,2 (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,46 (d, 1H); 7,35-7,44 (m, 5H); 7,15-7,32 (m, 1H); 5,60-5,67 (m, 1H); 3,67-4,02 (m, 1H); 2,89-3,05 (m, 1H); 2,32-2,47 (m, 1H); 1,91-2,11 (m, 1H); 1,39-1,72 (m, 4H) A 1,98; 333,3 δ: 10,48 (br. s, 1H); 8,93 (dd, 1H); 8,39 (dd, 1H); 7,64 (dd, 1H); 7,50 (d, 1H); 7,47 (d, 1H); 4,11 (br. s, 2H); 3,68 (br. s, 2H); 3,22 (br. s, 4H) A 1,24; 307,2 (353K) δ: 8,89 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,35 (d, 1H); 4,00 (d, 2H); 2,95 (ddd, 2H); 1,51-1,82 (m, 3H); 1,05-1,26 (m, 2H); 0,96 (d, 3H) A 1,45; 271,2 20 UA 107949 C2 Продовження таблиці 4 (R)-8-Гідрокси-N-(1фенілетил)хінолін-7-карбоксамід 47 (8-Гідроксихінолін-7-іл)(2метилпіролідин-1-іл)метанон 48 (2,5-Диметилпіролідин-1-іл)(8гідроксихінолін-7-іл)метанон 49 A 1,73; 307,3 (353K) δ: 8,89 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,42 (q, 2H); 4,03-4,28 (m, 1H); 3,30-3,58 (m, 2H); 2,09 (dq, 1H); 1,74-2,01 (m, 2H); 1,60 (dddd, 1H); 1,16 (d, 3H) A 1,21; 257,2 (353K) δ: 8,89 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,46 (d, 1H); 7,35 (d, 1H); 3,94-4,25 (m, 2H); 1,94-2,25 (m, 2H); 1,48-1,78 (m, 2H); 1,16 (d, 6H) A 1,39; 271,2 δ: 10,05 (br, s, 1H); 8,90 (dd, 1H); 8,36 (dd, 1H); 7,60 (dd, 1H); 7,44 (d, 1H); 7,32 (d, 1H); 3,06-3,25 (m, 2H); 0,51-2,16 (m, 18H) 46 (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,48 (d, 1H); 7,41 (d, 1H); 7,33-7,42 (m, 5H); 7,22-7,32 (m, 1H); 5,55 (br, s, 1H); 2,68 (s, 3H); 1,60 (d, 3H) A 2,30 351,2 A 1,83; 319,2 B 0,75; 286,3 (Декагідро-1H-карбазол-9(9aH)-іл)(8гідроксихінолін-7-іл)метанон 50 (8-Гідроксихінолін-7-іл)(3фенілпіролідин-1-іл)метанон 51 (3-(Диметиламін)піролідин-1-іл)(8гідроксихінолін-7-іл)метанон (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (s, 2H); 7,14-7,38 (m, 5H); 3,80-4,03 (m, 1H); 3,63-3,77 (m, 1H); 3,53-3,66 (m, 1H); 3,34-3,55 (m, 2H); 2,20-2,42 (m, 1H); 1,93-2,18 (m, 1H) (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,41 (d, 1H); 3,54-3,77 (m, 2H); 3,38-3,52 (m, 1H); 3,29 (dd, 1H); 2,75-2,91 (m, 1H); 2,17 (s, 6H); 1,97-2,12 (m, 1H); 1,79 (m, 1H) 21 UA 107949 C2 Продовження таблиці 4 53 1,40; 271,2 A 1,01; 243,2 (353K) δ: 8,90 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,46 (d, 1H); 7,38 (d, 1H); 3,93 (s, 4H); 3,49-3,68 (m, 4H); 1,631,79 (m, 4H) A 1,08; 315,2 (353K) δ: 8,86 (dd, 1H); 8,31 (dd, 1H); 7,58 (dd, 1H); 7,41 (d, 1H); 7,39 (d, 1H); 7,13 (d, 1H); 6,90-7,02 (m, 1H); 6,586,78 (m, 1H); 3,67-3,86 (m, 2H); 2,75-2,85 (m, 2H); 2,19 (s, 3H); 1,99 (m, 2H) A 1,81; 327,2 (353K) δ: 8,90 (dd, 1H); 8,35 (dd, 1H); 7,60 (dd, 1H); 7,47 (d, 1H); 7,41 (d, 1H); 7,33-7,42 (m, 4H); 4,65 (s, 2H); 2,90 (s, 3H) A 1,81; 319,2 δ: 10,61 (br. s, 1H); 8,88-9,01 (m, 2H); 8,43 (dd, 1H); 7,788,08 (m, 1H); 7,68 (m, 1H); 7,47-7,60 (m, 3H); 3,95-4,22 (m, 2H); 3,16-3,28 (m, 2H) (8-Гідроксихінолін-7-іл)(3метилпіперидин-1-іл)метанон A (353K) δ: 8,90 (dd, 1H); 8,33 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,41 (d, 1H); 3,34-3,64 (m, 4H); 1,71-2,04 (m, 4H) 52 (353K) δ: 8,89 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,45 (d, 1H); 7,35 (d, 1H); 3,70-4,04 (m, 2H); 2,98 (ddd, 1H); 2,69 (dd, 1H); 1,75-1,88 (m, 1H); 1,59-1,75 (m, 2H); 1,40-1,59 (m, 1H); 1,09-1,27 (m, 1H); 0,86 (d, 3H) A 1,65; 336,1 (8-Гідроксихінолін-7-іл)(піролідин-1іл)метанон 54 (1,4-Діокса-8-аза-спіро[4.5]дец-8-іл)(8-гідрокси-хінолін-7-іл)-метанон 55 (8-Гідроксихінолін-7-іл)(6-метил-3,4дигідрохінолін-1(2H)-іл)метанон 56 N-(4-Хлорбензил)-8-гідрокси-Nметилхінолін-7-карбоксамід 57 (8-Гідроксихінолін-7-іл)(6нітроіндолін-1-іл)метанон 22 UA 107949 C2 Продовження таблиці 4 58 (8-Гідроксихінолін-7-іл)(7(трифторметил)-3,4-дигідрохінолін1(2H)-іл)метанон 59 (Гексагідро-1H-ізоіндол-2(3H)-іл)(8гідроксихінолін-7-іл)метанон δ: 10,25 (br. s, 1H); 8,87 (dd, 1H); 8,36 (dd, 1H); 7,61 (dd, 1H); 7,65 (br. s, 1H); 7,43-7,53 (m, 2H); 7,36-7,43 (m, 1H); 7,24-7,34 (m, 1H); 3,77 (t, 2H); 2,90 (t, 2H); 1,98 (quin, 2H) A 2,03; 373,1 δ: 10,28 (br. s, 1H); 8,91 (dd, 1H); 8,36 (dd, 1H); 7,62 (dd, 1H); 7,45 (d, 1H); 7,39 (d, 1H); 3,32-3,57 (m, 3H); 3,07-3,22 (m, 1H); 2,06-2,32 (m, 2H); 1,27-1,60 (m, 8H) A 1,62; 297,3 Приклад 60: 5 10 15 20 (5-Бром-8-гідроксихінолін-7-іл)(ізоіндолін-2-іл)метанон Суміш 5-бром-8-гідроксихінолін-7-карбонової кислоти за Приготуванням 4 (150 мг, 0,56 ммоль) і ди(1H-імідазол-1-іл)метанон (90,7 мг, 0,56 ммоль) у ТГФ (10 мл) нагрівали зі зворотним холодильником впродовж 3 год. під азотом. Реакційну суміш залишили охолоджуватись до КТ і додали ізоіндолін (53 мг, 0,45 ммоль). Одержану суміш збовтували при КТ впродовж ночі. Реакційну суміш потім погасили H2O і водним насиченим розчином гідрокарбонату натрію і двічі екстрагували ДХМ. Відокремлені органічні речовини висушили над Na 2SO4, відфільтрували та концентрували при зниженому тиску. Осад очистили картриджем ЕТФС (2 г, ДХМ до ДХМ:MeOH 99:1) з одержанням вказаної у заголовку сполуки (39,1 мг, 0,11 ммоль) у вигляді світлокоричневої твердої речовини. + + МС-РХ м/з (ІЕР ): 369,09 (MH ), Rt=2,21 хв. (Метод A) 1 H-ЯМР (ДМСО-d6) δ: 10,80 (br, s, 1H); 8,96-9,07 (m, 1H); 8,45-8,54 (m, 1H); 7,76-7,87 (m, 2H); 7,42 (d, 1H); 7,18-7,37 (m, 3H); 4,88 (s, 2H); 4,71 (s, 2H). Приклад 61: (7-Фтор-3,4-дигідрохінолін-1(2H)-іл)(8-гідроксихінолін-7-іл)метанон Суміш 8-гідроксихінолін-7-карбонової кислоти (100 мг, 0,53 ммоль) і ди(1H-імідазол-1іл)метанону (86 мг, 0,53 ммоль) у ТГФ (6 мл) нагрівали зі зворотним холодильником впродовж 4 год. під азотом. Реакційну суміш залишили охолоджуватись до КТ, і додали 7-фтор-1,2,3,4 23 UA 107949 C2 5 10 15 тетрагідрохіноліну гідрохлорид (84,4 мг, 0,45 ммоль) і TEA (0,062 мл, 0,45 ммоль). Одержану суміш нагрівали у мікрохвильовій печі при температурі 120 °C впродовж 90 хв., а потім при температурі 140 °C впродовж 2 год. Реакційну суміш потім погасили H 2O і водним насиченим розчином гідрокарбонату натрію і двічі екстрагували ДХМ. Відокремлені органічні речовини висушили над Na2SO4, відфільтрували та концентрували при зниженому тиску. Осад очистили препаративною ВЕРХ. Фракції із вмістом продукту поєднали, зробили основними насиченим водним розчином гідрокарбонату натрію і видалили CH3CN при зниженому тиску. Водну фазу екстрагували ДХМ, і відокремлені органічні речовини висушили над Na 2SO4, відфільтрували та концентрували до сухості з одержанням вказаної у заголовку сполуки (19 мг, 0,06 ммоль) у вигляді не зовсім білої твердої речовини. + + МС-РХ м/з (ІЕР ): 323,1 (MH ), Rt=1,78 хв. (Метод A) 1 H-ЯМР (ДМСО-d6) δ: 8,88 (dd, 1H); 8,36 (dd, 1H); 7,61 (dd, 1H); 7,47 (d, 1H); 7,43 (d, 1H); 7,257,36 (m, 1H); 7,20 (dd, 1H); 6,85 (td, 1H); 3,62-3,78 (m, 2H); 2,80 (t, 2H); 1,93 (m, 2H). Відповідно до процедур, аналогічних до описаної вище, одержали додаткові сполуки за цим винаходом (Таблиця 5). Таблиця 5 Пр. H ЯМР (ДМСО-d6) Метод МС-РХ Rt; + [MH ] δ: 10,00 (br. s, 1H); 8,84 (dd, 1H); 8,31 (dd, 1H); 7,57 (dd, 1H); 7,36 (s, 2H); 7,16 (d, 1H); 6,89-7,04 (m, 1H); 6,867,06 (m, 1H); 6,81 (br. s, 1H); 4,57-4,72 (m, 1H); 2,59-2,86 (m, 2H); 2,30-2,46 (m, 1H); 1,38-1,61 (m, 1H); 1,14 (d, 3H) A 1,73; 319,1 δ: 10,16 (br. s, 1H); 8,87 (dd, 1H); 8,35 (dd, 1H); 7,60 (dd, 1H); 7,43 (s, 2H); 7,28 (br. s, 1H); 7,06-7,22 (m, 1H); 6,777,06 (m, 2H); 3,81-4,01 (m, 1H); 3,25 (dd, 1H); 2,95 (dd, 1H); 2,48 (dd, 1H); 1,99-2,25 (m, 1H); 0,99 (d, 3H) A 1,81; 319,1 1 Хімічна назва 62 (8-Гідроксихінолін-7-іл)(2-метил-3,4дигідрохінолін-1(2H)-іл)метанон 63 (8-Гідроксихінолін-7-іл)(3-метил-3,4дигідрохінолін-1(2H)-іл)метанон 24 UA 107949 C2 Продовження таблиці 5 64 (8-Гідроксихінолін-7-іл)(4-метил-3,4дигідрохінолін-1(2H)-іл)метанон 65 (8-Фтор-3,4-дигідрохінолін-1(2H)-іл)(8гідроксихінолін-7-іл)метанон 66 (8-Гідроксихінолін-7-іл)(6-ізопропіл-3,4дигідрохінолін-1(2H)-іл)метанон 67 (6-Хлор-3,4-дигідрохінолін-1(2H)-іл)(8гідроксихінолін-7-іл)метанон 68 (8-Гідроксихінолін-7-іл)(7-метил-3,4дигідрохінолін-1(2H)-іл)метанон δ: 10,11 (br. s, 1H); 8,86 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,42 (s, 2H), 7,07-7,34 (m, 2H); 6,92-7,07 (m, 1H); 6,71-6,92 (m, 1H); 3,59-3,87 (m, 2H); 2,85-3,08 (m, 1H); 2,01-2,24 (m, 1H); 1,60 (m, 1H); 1,33 (d, 3H) C 2,65; 319,1 δ: 10,15 (br. s, 1H); 8,86 (dd, 1H); 8,34 (dd, 1H); 7,60 (dd, 1H); 7,44 (d, 1H); 7,40 (d, 1H); 6,97-7,21 (m, 2H); 6,736,97 (m, 1H); 3,73 (br. s, 2H); 2,85 (t, 2H); 1,82-2,09 (m, 2H) A 1,63; 323,1 (353K) δ: 8,86 (dd, 1H); 8,31 (dd, 1H); 7,58 (dd, 1H); 7,40 (s, 2H); 7,27 (d, 1H); 7,02 (d, 1H); 6,79 (dd, 1H); 3,66-3,79 (m, 2H); 2,76-2,90 (m, 3H); 1,98 (dq, 2H); 1,16 (d, 6H) A 2,12; 347,1 δ: 10,19 (br. s, 1H); 8,87 (dd, 1H); 8,35 (dd, 1H); 7,61 (dd, 1H); 7,47 (d, 1H); 7,43 (d, 1H); 7,07-7,39 (m, 2H); 6,94 (d, 1H); 3,73 (t, 2H); 2,82 (t, 2H); 1,95 (m, 2H) C 2,87; 338,95 δ: 8,86 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,41 (s, 2H); 7,20 (br. s, 1H); 7,03 (d, 1H); 6,80 (d, 1H); 3,69 (t, 2H); 2,68-2,87 (m, 2H); 2,02 (br. s, 3H); 1,92 (m, 2H) A 1,78; 319,1 25 UA 107949 C2 Продовження таблиці 5 δ: 8,86 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,32-7,51 (m, 3H); 7,13-7,32 (m, 1H); 6,88-7,13 (m, 1H); 3,73 (t, 2H); 2,82 (t, 2H); 1,85-2,06 (m, 2H) A 1,99; 341,1 A 1,82; 323,1 δ: 8,85 (dd, 1H); 8,34 (dd, 1H); 7,59 (dd, 1H); 7,44 (d, 1H); 7,23-7,43 (m, 2H); 7,02 (dd, 1H); 6,56-6,88 (m, 1H); 3,59-3,86 (m, 2H); 2,83 (t, 2H); 1,86-2,07 (m, 2H) A 2,60; 323,1 δ: 8,82 (dd, 1H); 8,29 (dd, 1H); 7,56 (dd, 1H); 7,44 (d, 1H); 7,32 (d, 1H); 6,97 (d, 1H); 6,45 (d, 1H); 3,47-3,79 (m, 2H); 2,83 (t, 2H); 1,842,16 (m, 2H) A 1,71; 355 δ: 10,37 (br. s, 1H); 8,90 (dd, 1H); 8,38 (dd, 1H); 7,63 (dd, 1H); 7,54 (br. s, 1H); 7,52 (m, 1H); 7,48 (d, 1H); 6,94-7,06 (m, 1H); 6,90 (dd, 1H); 6,75 (br. s, 1H); 4,31 (t, 2H); 3,83 (br. s, 2H) 70 2,03; 382,96 δ: 10,23 (br. s, 1H); 8,87 (dd, 1H); 8,35 (dd, 1H); 7,60 (dd, 1H); 7,47 (d, 1H); 7,43 (d, 1H); 7,16 (br. s, 1H); 6,897,00 (m, 1H); 6,75-6,89 (m, 1H); 3,65-3,85 (m, 2H); 2,80 (t, 2H); 1,90-2,07 (m, 2H) (6-Бром-3,4-дигідрохінолін-1(2H)-іл)(8гідроксихінолін-7-іл)метанон A δ: 8,89 (dd, 1H); 8,37 (dd, 1H); 7,62 (dd, 1H); 7,50 (d, 1H); 7,46 (d, 1H); 7,09-7,34 (m, 1H); 6,93 (td, 1H); 3,503,82 (m, 2H); 2,68-2,82 (m, 2H); 1,89-2,01 (m, 2H) 69 F 1,42; 306,9 (5,7-Дифтор-3,4-дигідрохінолін-1(2H)іл)(8-гідроксихінолін-7-іл) метанон 71 (5-Фтор-3,4-дигідрохінолін-1(2H)-іл)(8гідроксихінолін-7-іл)метанон 72 (6-Фтор-3,4-дигідрохінолін-1(2H)-іл)(8гідроксихінолін-7-іл)метанон 73 (5-Хлор-8-гідрокси-3,4-дигідрохінолін1(2H)-іл)(8-гідроксихінолін-7-іл)метанон 74 (2H-Бензо[b][1,4]оксазин-4(3H)-іл)(8гідроксихінолін-7-іл)метанон 5 2. Перевіряння активності: Методи та результати Організми, що їх використовували для перевіряння протигрибкової активності Trichophyton Rubrum (ATCC 28188, PBI International); Trichophyton Mentagrophytes (ATCC 9533, PBI International); Aspergillus Niger (ATCC 16404, PBI International); Scopulariopsis 26 UA 107949 C2 5 10 15 20 25 30 Brevicaulis (ATCC 36840, DSMZ); Candida Albicans (ATCC 90028, PBI International); Candida Glabrata (ATCC 90030, DSMZ). Одержання та зберігання Штами одержували з ліофілізованих ампул або ліофілізованих гранул. Відокремлення суспензій здійснювали на картопляному агарі з декстрозою (КАД) для перевіряння чистоти штамів. Потім відбувалося масивне зростання штамів з висіюванням штрихом суспензій мікробів на планшети з КАД. Інкубування проводили при 30 °C впродовж 48-72 годин (дріжджі Candida) та 7-10 днів (міцелійні гриби). Колонії дріжджів і конідії міцелійних грибів зібрали за допомогою 3-5 мл середовища RPMI 1640+50 % гліцерину, і аліквоти заморозили при -80 °C. Перевіряння протигрибковї чутливості Визначали мінімальну інгібувальну концентрацію (МІК) сполук за допомогою тесту чутливості мікророзрідженням поживного середовища із використанням методу, розробленого за згодою Національного комітету зі стандартів для клінічних лабораторій (NCCLS) (National Committee for Clinical Laboratory Standards. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts; Approved standard-Second Edition M27-A2. 2002; Том 22, №15) (National Committee for Clinical Laboratory Standards. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Filamentous Fungi; Approved standard M38-A. 2002; Том 22, №16). Дослідження проводили у середовищі RPMI 1640 із середовищем L-глютаміну, забуференим до рівня pH 7 за допомогою 0,165M 3-(N-морфолін)пропансульфонової кислоти (МПС) і 10M NaOH із додаванням 18 г глюкози/л. Випробування проводили із використанням 965 лункових стерильних планшетів (розмір інокуляту 1 × 10 ОУК/мл). Вихідні розчини сполук одержали із розрахунку 12,8 мг/мл у 100 %-ному ДМСО. Одержали групу подвійних розчинів у планшеті із використанням середовища RPMI 1640. Кінцеві концентрації коливалися від 0,125 до 128 мкл/мл в 1 %-ному ДМСО. МІК визначали як найнижчу концентрацію протигрибкового засобу, що запобігає будь-якому видимому росту, і її визначали після 48 год. інкубування для дріжджів (35 °C) і після п'яти днів інкубування для міцелійних грибів (35 °C). Результати Значення МІК для сполук, яким надавали найбільшу перевагу, обчислені як середнє геометричне значень, одержаних у двох окремих експериментах, наведені у Таблиці 6. Таблиця 6 Пр 10 6 29 49 56 70 61 71 72 73 74 35 Trycophyton Rubrum ATCC 28188 1,00 1,41 2,00 0,71 2,00 1,00 1,00 1,00 1 2 1 Трicophyton Mentagrophytes ATCC 9533 2,00 1,41 1,00 1,41 1,00 2,00 2,00 2,00 2 2 1,41 Aspergillus Niger ATCC 16404 0,25 0,50 0,13 0,25 0,71 0,25 0,25 0,25 0,25 0,125 0,18 Scopulariopsis Brevicaulis ATCC 36840 2,00 1,41 2,00 1,00 2,00 1,00 0,71 0,71 0,50 4 0,71 Candida Candida Albicans Glabrata ATCC 90028 ATCC 90030 2,00 2,00 1,41 2,00 4,00 4,00 2,00 2,83 1,41 2,00 2,00 1,00 2,00 2,00 2,00 2,83 2 2 2 1 2 2 ФОРМУЛА ВИНАХОДУ 1. Сполука загальної формули (І) або її фармацевтично прийнятна сіль 27 UA 107949 C2 R1 R2 N R3 OH 5 10 15 20 25 30 35 40 45 50 (I) N O в якій R2 і R3 незалежно один від одного вибирають з: a) -С1-С6-алкілу, за умови, що R2 і R3 не є обидва метилом, b) -(СН2)n-арилу, 4-галогенбензилу або 4-галогенфенілу, c) -(СН2)n-циклоалкілу, d) -(СН2)n-гетероциклу, e) -(CH2)n-OR6, f) -(CH2)n-CN, g) -(CH2)n-NR4R5, h) взятих разом з атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з кисню та сірки, або і) взятих разом із атомом азоту, до якого вони прикріплені, для утворення: (і) 5-8-членного гетеромоноциклу, конденсованого з одним або двома насиченими або ненасиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, що складається із азоту, кисню та сірки; або (іі) галоген- та/або гідроксизаміщеного дигідрохіноліну; де R4 і R5 незалежно один від одного вибирають з: a) -Н, b) -С1-С6-алкілу, c) -(СН2)n-арилу, d) -(СН2)n-циклоалкілу, e) -(СН2)n-гетероциклу, f) -(CH2)n-OR6, g) -(CH2)n-CN, h) взятих разом із атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки, або j) взятих разом із атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, конденсованого з одним або двома насиченими або ненасиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, що складається з азоту, кисню та сірки; або де R6 вибирають з: a) -Н, b) -С1-С6-алкілу, c) -(СН2)n-арилу, d) -(СН2)n-циклоалкілу або e) -(СН2)n-гетероциклу; і де n є ціле число від 0 до 6. 2. Сполука за п. 1, в якій R2 і R3, незалежно один від одного, вибирають з: a) -С1-С6-алкілу, за умови, що R2 і R3 не є обидва метилом, b) -(СН2)n-арилу, 4-галогенбензилу або 4-галогенфенілу, c) -(СН2)n-циклоалкілу, d) -(СН2)n-гетероциклу, e) -(CH2)n-OR6, f) -(CH2)n-CN, g) взятих разом із атомом азоту, до якого вони прикріплені, для утворення 5-8-членного гетеромоноциклу, що містить від одного до трьох гетероатомів, вибраних із групи, що складається з кисню та сірки, або h) взятих разом із атомом азоту, до якого вони прикріплені, для утворення: (і) 5-8-членного гетеромоноциклу, конденсованого з одним або двома ненасиченими або насиченими кільцями або з іншими гетероциклами, що містять від одного до трьох гетероатомів, вибраних із групи, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNew tertiary 8-hydroxyquinoline-7-carboxamide derivatives and uses thereof
Автори англійськоюGagliardi, Stefania, Del Sordo, Simone, Mailland, Federico, Legora, Michela
Автори російськоюГагльярди Стефания, Дель Сордо Симоне, Майлланд Федерико, Легора Микела
МПК / Мітки
МПК: C07D 215/48, C07D 407/12, C07D 401/12, C07D 491/113, A61K 31/4709, C07D 417/06, C07D 407/06, A61P 31/10, C07D 401/06
Мітки: похідні, 8-гідроксихінолін-7-карбоксаміду, застосування, третинні
Код посилання
<a href="https://ua.patents.su/32-107949-tretinni-pokhidni-8-gidroksikhinolin-7-karboksamidu-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Третинні похідні 8-гідроксихінолін-7-карбоксаміду та їх застосування</a>
Попередній патент: Установка для подання пожежогасильної речовини у зону пожежі
Наступний патент: Гетероароматичні похідні арилтриазолу як інгібітори ферменту pde10a
Випадковий патент: Чоловічі труси (плавки)












