Синтетична проміжна сполука похідного оксазолу і спосіб її одержання
Номер патенту: 108092
Опубліковано: 25.03.2015
Автори: Фудзіта Нобухіса, Уцумі Наото, Ямамото Акіхіро, Огасавара Сін, Акі Сіндзі, Сінхама Коіті
Формула / Реферат
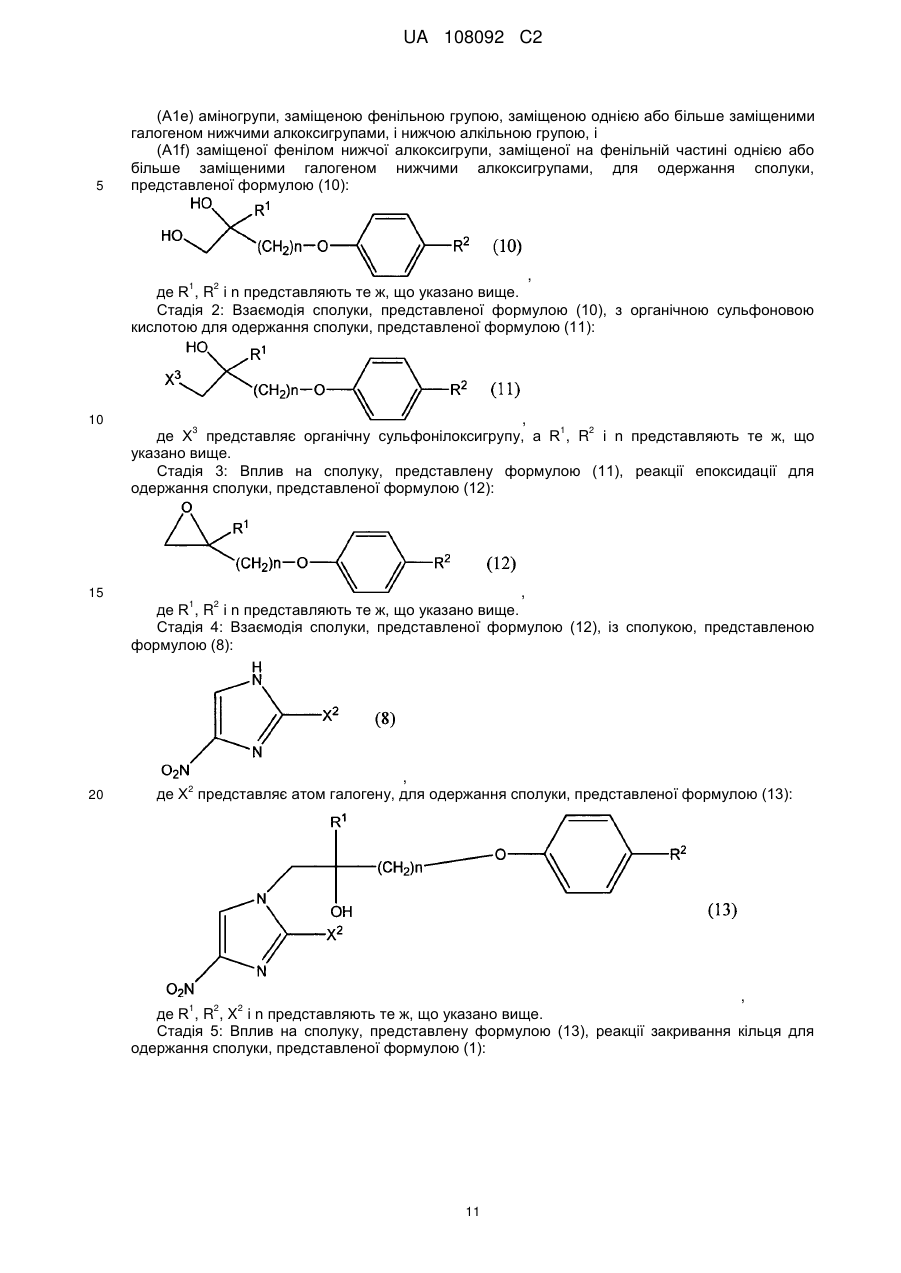
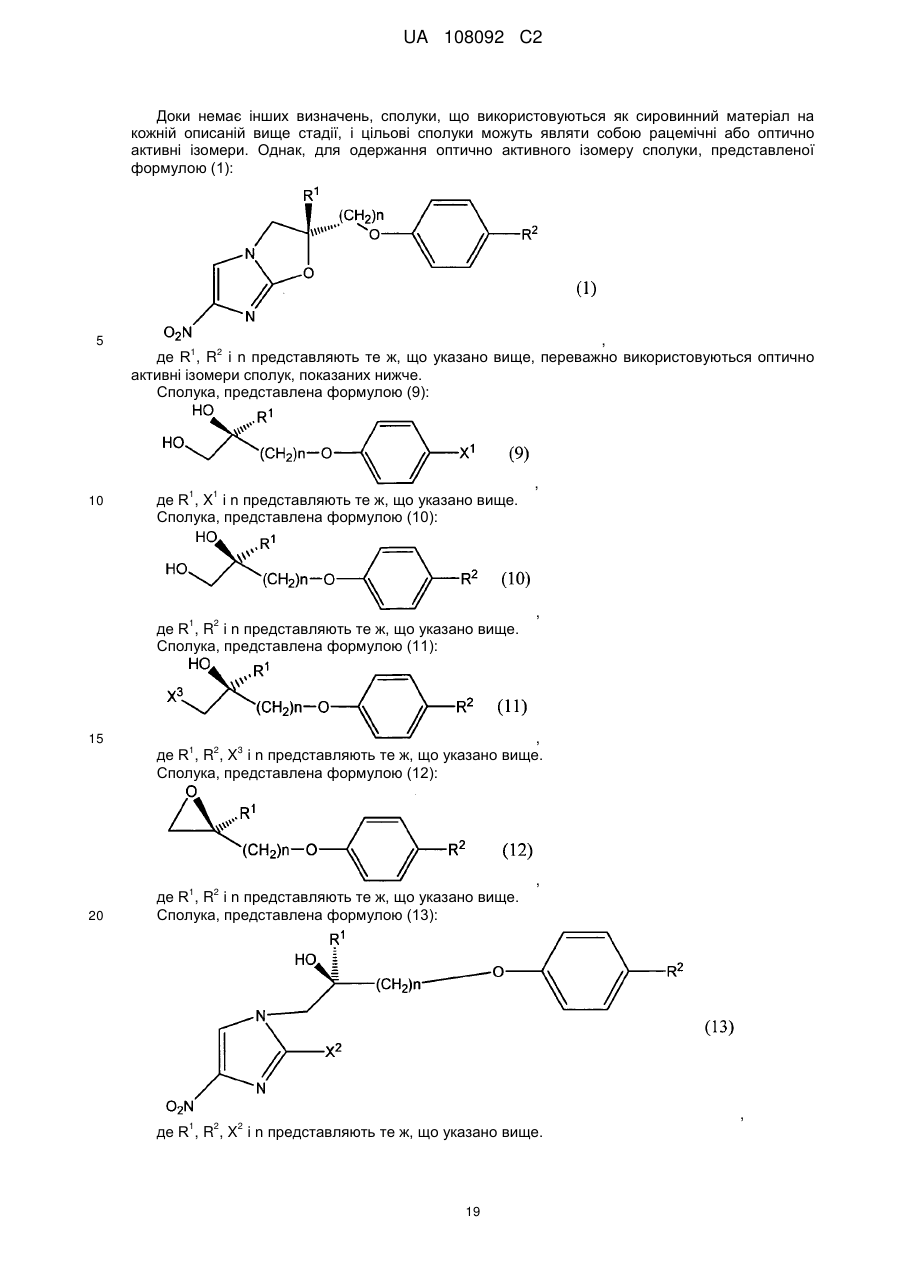
1. Сполука, представлена формулою (11):
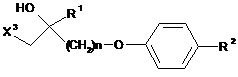 , (11)
, (11)
де R1 представляє атом водню або нижчу алкільну групу;
R2 представляє 1-піперидильну групу, заміщену в положенні 4 замісником, вибраним з
(A1a) феноксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси,
(A1b) заміщеної феноксигрупи нижчого алкілу, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами,
(А1с) заміщеної фенілом нижчої алкокси нижчої алкільної групи, заміщеної на фенільній частині галогеном,
(A1d) заміщеної фенілом нижчої алкільної групи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами,
(A1e) аміногрупи, заміщеної фенільною групою, заміщеною однією або більше заміщеними галогеном нижчими алкоксигрупами, і нижчою алкільною групою, і
(A1f) заміщеної фенілом нижчої алкоксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами; і
n представляє ціле число від 1 до 6; і
X3 представляє органічну сульфонілоксигрупу.
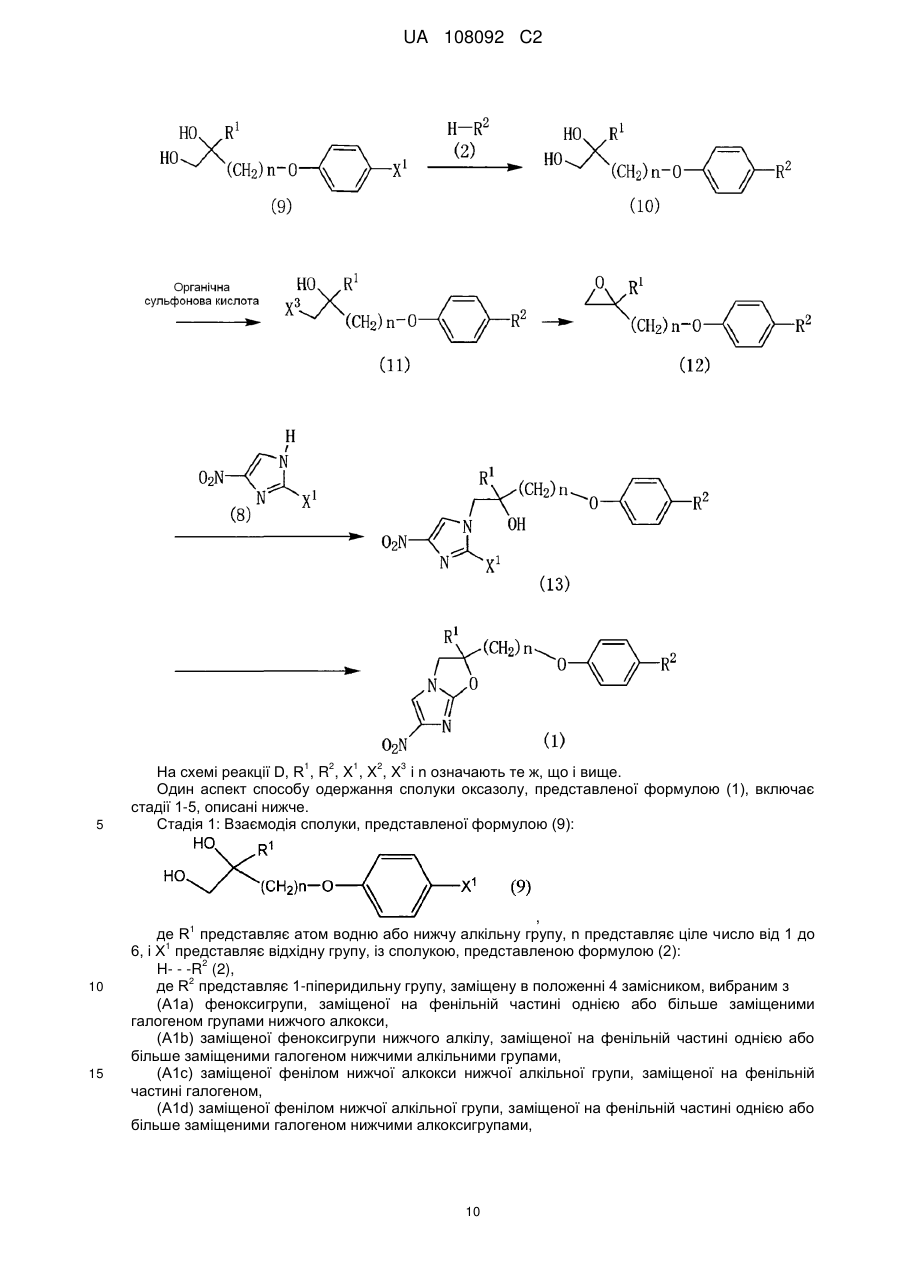
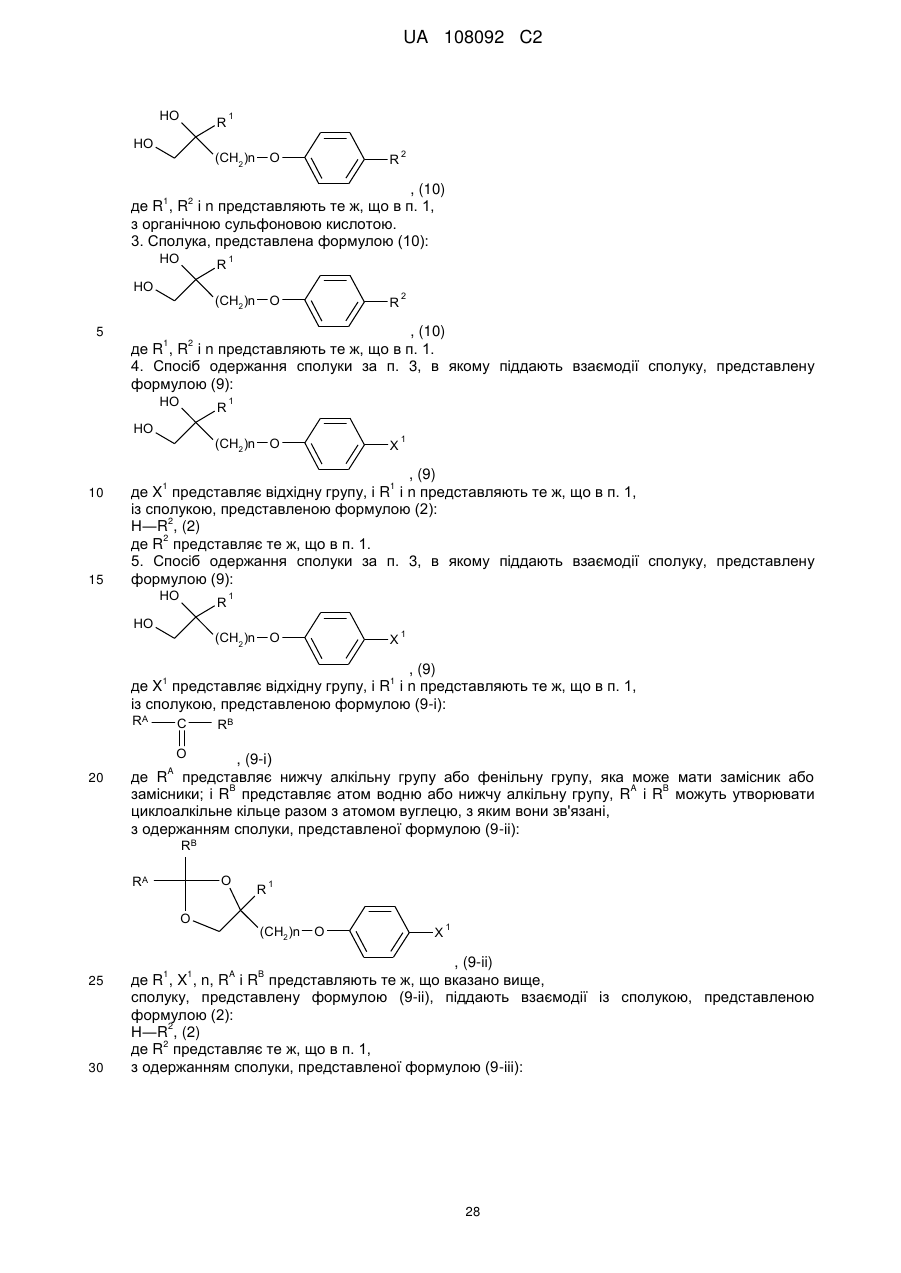
2. Спосіб одержання сполуки за п. 1, в якому піддають взаємодії сполуку, представлену формулою (10):
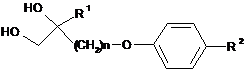 , (10)
, (10)
де R1, R2 і n представляють те ж, що в п. 1,
з органічною сульфоновою кислотою.
3. Сполука, представлена формулою (10):
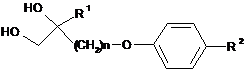 , (10)
, (10)
де R1, R2 і n представляють те ж, що в п. 1.
4. Спосіб одержання сполуки за п. 3, в якому піддають взаємодії сполуку, представлену формулою (9):
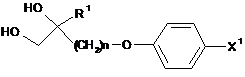 , (9)
, (9)
де X1 представляє відхідну групу, і R1 і n представляють те ж, що в п. 1,
із сполукою, представленою формулою (2):
Н―R2, (2)
де R2 представляє те ж, що в п. 1.
5. Спосіб одержання сполуки за п. 3, в якому піддають взаємодії сполуку, представлену формулою (9):
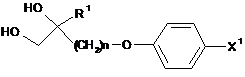 , (9)
, (9)
де X1 представляє відхідну групу, і R1 і n представляють те ж, що в п. 1,
із сполукою, представленою формулою (9-і):
![]() , (9-і)
, (9-і)
де RA представляє нижчу алкільну групу або фенільну групу, яка може мати замісник або замісники; і RB представляє атом водню або нижчу алкільну групу, RA і RB можуть утворювати циклоалкільне кільце разом з атомом вуглецю, з яким вони зв'язані,
з одержанням сполуки, представленої формулою (9-іі):
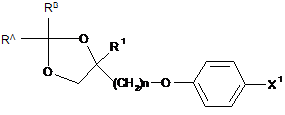 , (9-ii)
, (9-ii)
де R1, X1, n, RA і RB представляють те ж, що вказано вище,
сполуку, представлену формулою (9-іі), піддають взаємодії із сполукою, представленою формулою (2):
Н―R2, (2)
де R2 представляє те ж, що в п. 1,
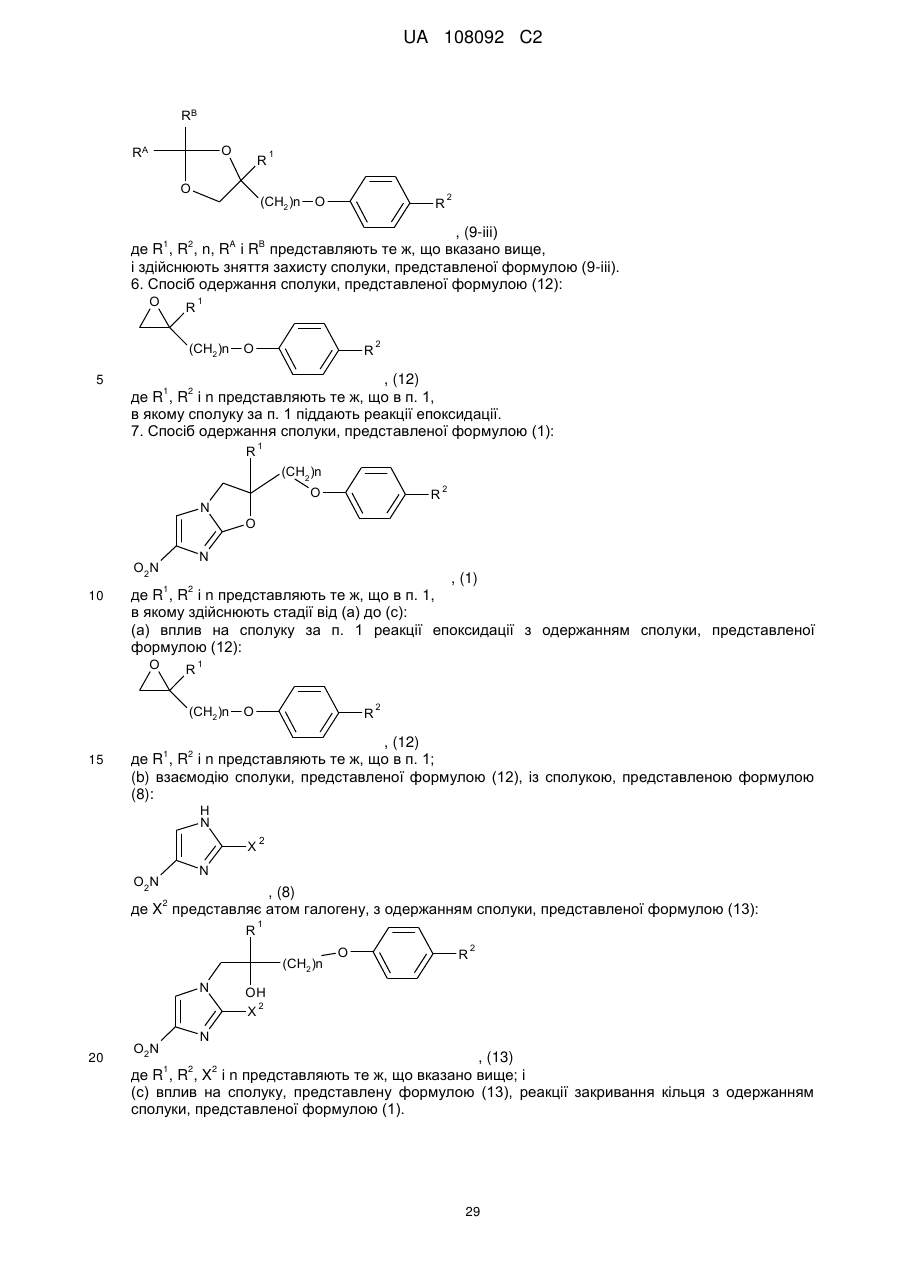
з одержанням сполуки, представленої формулою (9-ііі):
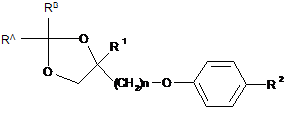 , (9-ііі)
, (9-ііі)
де R1, R2, n, RA і RB представляють те ж, що вказано вище,
і здійснюють зняття захисту сполуки, представленої формулою (9-ііі).
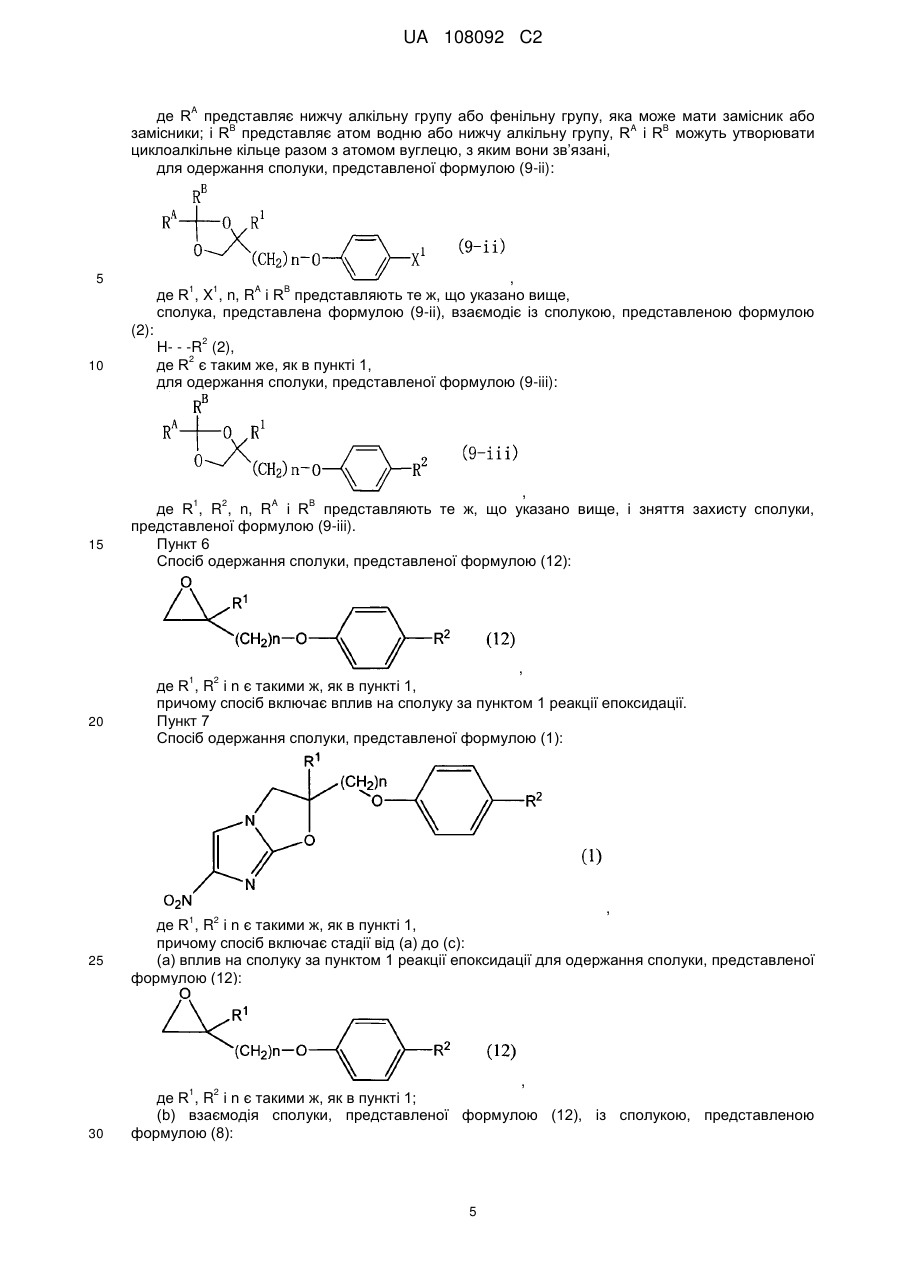
6. Спосіб одержання сполуки, представленої формулою (12):
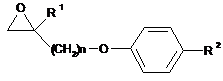 , (12)
, (12)
де R1, R2 і n представляють те ж, що в п. 1,
в якому сполуку за п. 1 піддають реакції епоксидації.
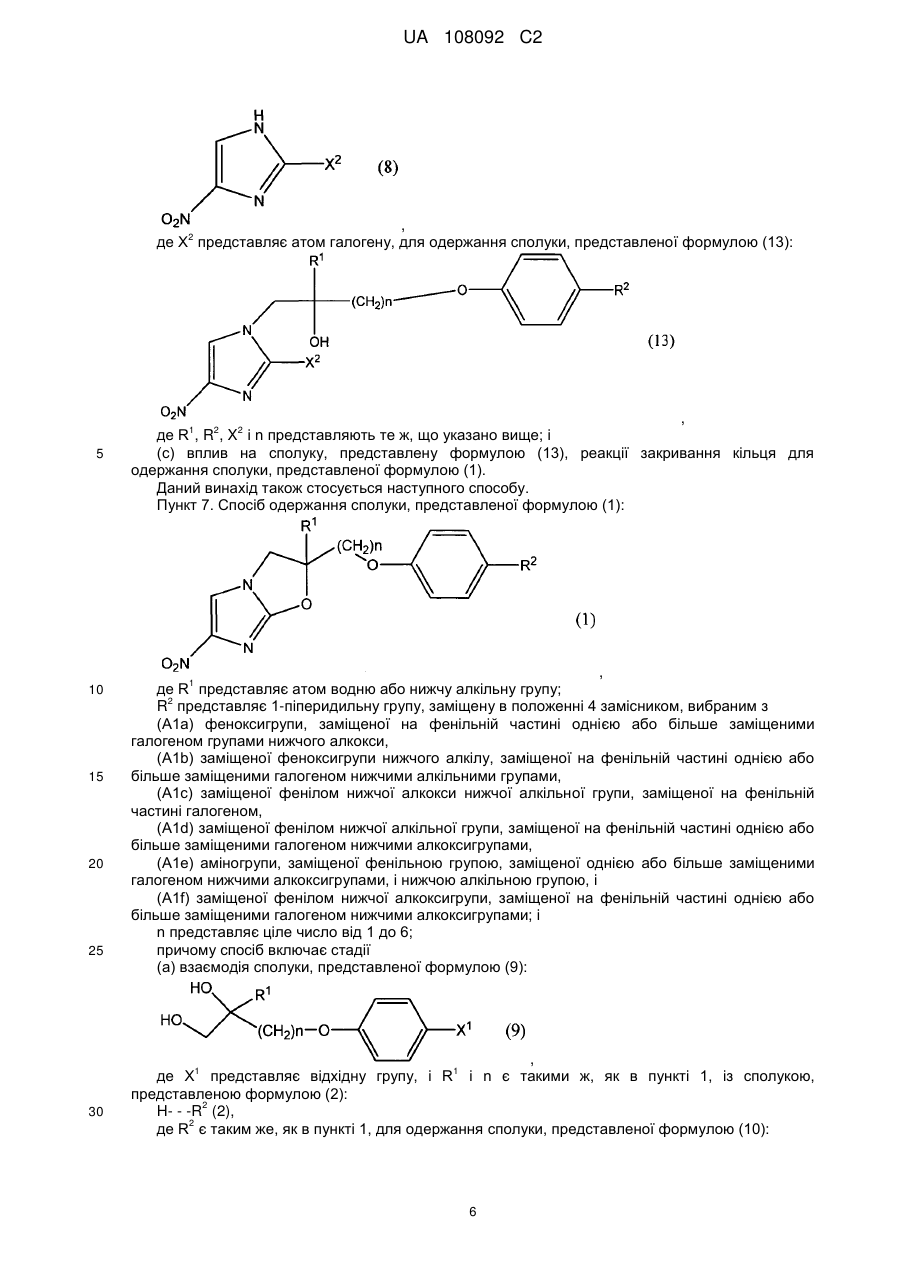
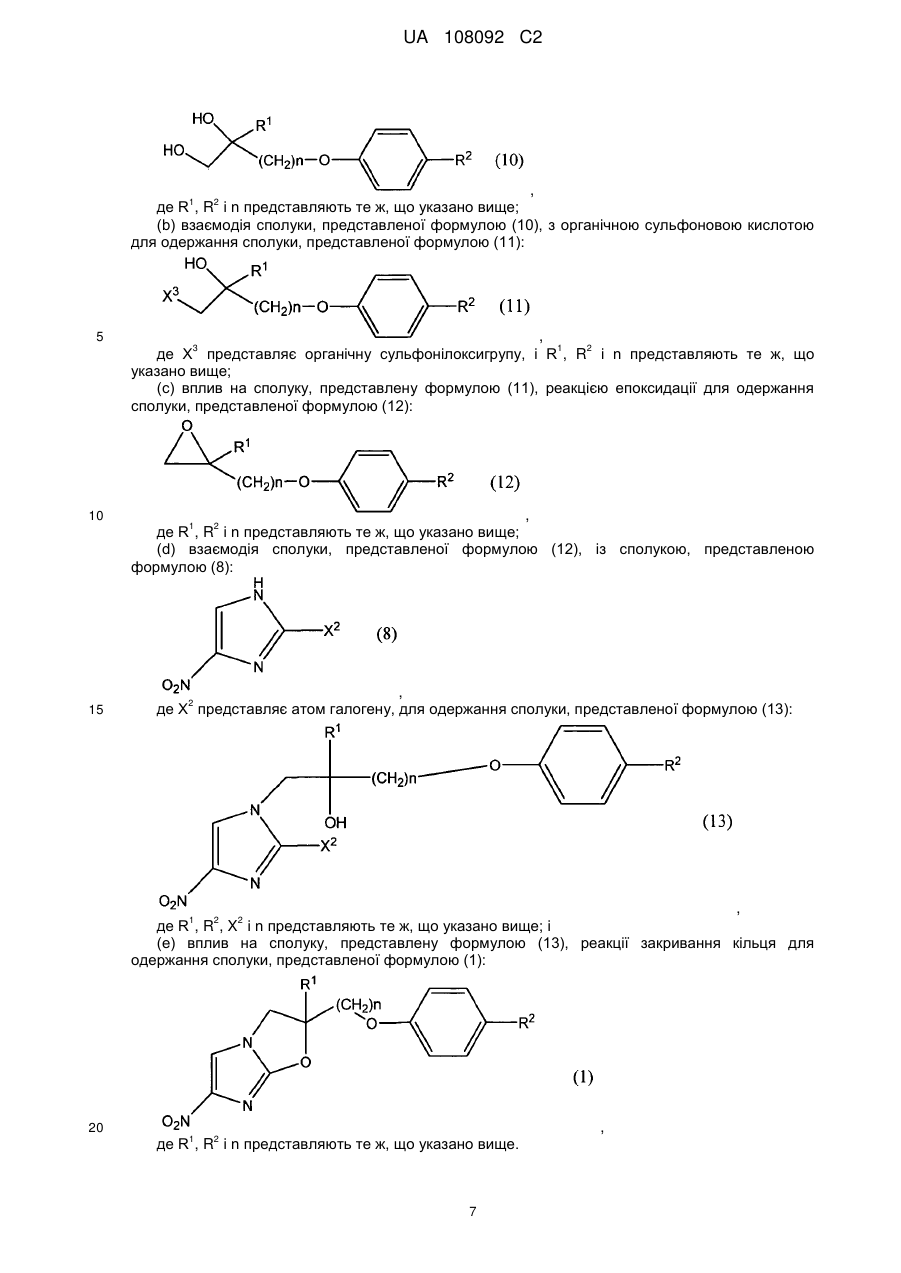
7. Спосіб одержання сполуки, представленої формулою (1):
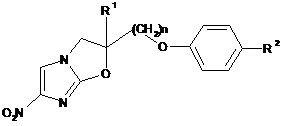 , (1)
, (1)
де R1, R2 і n представляють те ж, що в п. 1,
в якому здійснюють стадії від (а) до (с):
(а) вплив на сполуку за п. 1 реакції епоксидації з одержанням сполуки, представленої формулою (12):
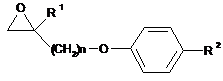 , (12)
, (12)
де R1, R2 і n представляють те ж, що в п. 1;
(b) взаємодію сполуки, представленої формулою (12), із сполукою, представленою формулою (8):
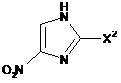 , (8)
, (8)
де X2 представляє атом галогену, з одержанням сполуки, представленої формулою (13):
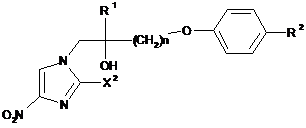 , (13)
, (13)
де R1, R2, X2 і n представляють те ж, що вказано вище; і
(c) вплив на сполуку, представлену формулою (13), реакції закривання кільця з одержанням сполуки, представленої формулою (1).
Текст
Реферат: Задачею даного винаходу є розробка способу одержання сполуки оксазолу з високим виходом. Дана задача може бути досягнута використанням сполуки, представленої формулою (11): HO X R 1 3 (CH2)n O R 2 , (11) 1 2 де R представляє атом водню або нижчу алкільну групу; R представляє 1-піперидильну групу, заміщену в положенні 4 замісником, вибраним з (A1a) феноксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, (A1b) заміщеної феноксигрупи нижчого алкілу, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами, (А1с) заміщеної фенілом нижчої алкокси нижчої алкільної групи, заміщеної на фенільній частині галогеном, (A1d) заміщеної фенілом нижчої алкільної групи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами, (A1e) аміногрупи, заміщеної фенільною групою, заміщеною однією або більше заміщеними галогеном нижчими алкоксигрупами, і нижчою алкільною групою, і (A1f) заміщеної фенілом нижчої алкоксигрупи, заміщеної на фенільній частині однією або більше UA 108092 C2 (12) UA 108092 C2 заміщеними галогеном нижчими алкоксигрупами; n представляє ціле число від 1 до 6; і X представляє органічну сульфонілоксигрупу. 3 UA 108092 C2 5 Галузь техніки, до якої належить винахід Даний винахід стосується синтетичної проміжної сполуки похідного оксазолу і способу її одержання. Попередній рівень техніки Сполуку 2,3-дигідроімідазо[2,1-b]оксазол, представлену нижче формулою (1), або її сіль застосовують як протитуберкульозний засіб (патентна література 1, 2 і 3). 1 25 У формулі (1), R представляє атом водню або групу нижчого алкілу; 2 R представляє 1-піперидильну групу, заміщену в положенні 4 замісником, вибраним з (А1a) феноксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, (А1b) заміщеної феноксигрупи нижчого алкілу, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами, (А1c) заміщеної фенілом нижчої алкокси нижчої алкільної групи, заміщеної на фенільній частині галогеном, (A1d) заміщеної фенілом нижчої алкільної групи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами, (А1e) аміногрупи, заміщеної фенільною групою, заміщеної однією або більше заміщеними галогеном нижчими алкоксигрупами, і нижчою алкільною групою, і (А1f) заміщеної фенілом нижчої алкоксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами; і n представляє ціле число від 1 до 6. Вказані патентні джерела розкривають представлені нижче схеми реакції А і В як способи одержання вказаної вище сполуки 2,3-дигідроімідазо[2,1-b]оксазолу. Схема реакції А: 30 , 1 2 де R представляє атом водню або нижчу алкільну групу; R представляє заміщену 1 піперидильну групу або заміщену піперазинільну групу; і X представляє атом галогену або нітрогрупу. Схема реакції В: 10 15 20 1 UA 108092 C2 2 де X представляє галоген або групу, що викликає реакцію заміщення, подібну реакції 1 2 1 галогену; n представляє ціле число від 1 до 6; і R , R і X означають те ж, що в схемі реакції А. Сполука оксазолу, представлена формулою (1a): 5 10 , тобто 2-метил-6-нітро-2-{4-[4-(4-трифторметоксифенокси)піперидин-1-іл]феноксиметил}-2,3дигідроімідазо[2,1-b]оксазол (далі ця сполука може просто називатися «Сполукою 1a»), одержують, наприклад, способом, показаним нижче в схемі реакції С (патентне джерело 3). У даному описі термін «сполука оксазолу» означає похідне оксазолу, яка включає сполуки, що містять оксазольне кільце або оксазолінове кільце (дигідрооксазольне кільце) в молекулі. Схема реакції С: 2 UA 108092 C2 5 10 15 20 25 Однак, вказані вище способи є незадовільними з точки зору виходу цільової сполуки. Наприклад, спосіб схеми реакції С забезпечує можливість одержання цільової сполуки оксазолу (1a) із сполуки (2a) при низькому виході, що становить лише 35,9%. Тому, бажані альтернативні способи одержання сполуки промислово переважним чином. Список посилань Патентна література PTL 1: WO 2004/033463 PTL 2: WO 2004/035547 PTL 3: WO 2008/140090 Короткий виклад суті винаходу Технічна проблема Метою винаходу є одержання нової синтетичної проміжної сполуки, яка може використовуватися для одержання сполуки оксазолу, представленої формулою (1), включаючи сполуку (1a), при високому виході і з високою чистотою (зокрема, високою оптичною чистотою) і спосіб одержання синтетичної проміжної сполуки. Розв'язання проблеми Заявники провели обширні дослідження для досягнення вказаної вище мети і виявили, що цільова сполука оксазолу, представлена формулою (1), може бути одержана з високим виходом і високою чистотою шляхом використання описаної нижче сполуки як синтетично проміжної сполуки і способу одержання з використанням синтетичної проміжної сполуки. Даний винахід був здійснений відповідно до цих даних. Конкретніше, даний винахід стосується наступних аспектів і їм подібним. Пункт 1 Сполука, представлена формулою (11): , 3 UA 108092 C2 1 5 10 15 20 де R представляє атом водню або нижчу алкільну групу; 2 R представляє 1-піперидильну групу, заміщену в положенні 4 замісником, вибраним з (А1a) феноксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, (А1b) заміщеної феноксигрупи нижчого алкілу, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами, (А1c) заміщеної фенілом нижчої алкокси нижчої алкільної групи, заміщеної на фенільній частині галогеном, (A1d) заміщеної фенілом нижчої алкільної групи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами, (А1e) аміногрупи, заміщеної фенільною групою, заміщеної однією або більше заміщеними галогеном нижчими алкоксигрупами, і нижчою алкільною групою, і (А1f) заміщеної фенілом нижчої алкоксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами; і n представляє ціле число від 1 до 6; і 3 X представляє органічну сульфонілоксигрупу. Пункт 2 Спосіб одержання сполуки за пунктом 1, причому спосіб включає взаємодію сполуки, представленої формулою (10): 1 , 2 де R , R і n є такими же, як в п. 1, з органічною сульфоновою кислотою. Пункт 3 Сполука, представлена формулою (10): 25 , 1 2 де R , R і n є такими ж, як в пункті 1. Пункт 4 Спосіб одержання сполуки за пунктом 3, причому спосіб включає взаємодію сполуки, представленої формулою (9): 30 , 1 1 де X представляє відхідну групу, і R і n є такими же, як в пункті 1, із сполукою, представленою формулою (2): 2 H- - -R (2), 2 де R є таким же, як в пункті 1. Пункт 5 Спосіб одержання сполуки за пунктом 3, причому спосіб включає взаємодію сполуки, представленої формулою (9): 35 40 , 1 1 де X представляє відхідну групу, і R і n є такими же, як в пункті 1, із сполукою, представленою формулою (9-i): , 4 UA 108092 C2 A де R представляє нижчу алкільну групу або фенільну групу, яка може мати замісник або B A B замісники; і R представляє атом водню або нижчу алкільну групу, R і R можуть утворювати циклоалкільне кільце разом з атомом вуглецю, з яким вони зв’язані, для одержання сполуки, представленої формулою (9-ii): , 1 1 A B де R , X , n, R і R представляють те ж, що указано вище, сполука, представлена формулою (9-ii), взаємодіє із сполукою, представленою формулою 5 (2): 10 15 20 25 30 2 H- - -R (2), 2 де R є таким же, як в пункті 1, для одержання сполуки, представленої формулою (9-iii): , 1 2 A B де R , R , n, R і R представляють те ж, що указано вище, і зняття захисту сполуки, представленої формулою (9-iii). Пункт 6 Спосіб одержання сполуки, представленої формулою (12): , 1 2 де R , R і n є такими ж, як в пункті 1, причому спосіб включає вплив на сполуку за пунктом 1 реакції епоксидації. Пункт 7 Спосіб одержання сполуки, представленої формулою (1): , 1 2 де R , R і n є такими ж, як в пункті 1, причому спосіб включає стадії від (a) до (с): (a) вплив на сполуку за пунктом 1 реакції епоксидації для одержання сполуки, представленої формулою (12): , 1 2 де R , R і n є такими ж, як в пункті 1; (b) взаємодія сполуки, представленої формулою (12), із сполукою, представленою формулою (8): 5 UA 108092 C2 , 2 де X представляє атом галогену, для одержання сполуки, представленої формулою (13): 5 10 15 20 25 30 , 1 2 2 де R , R , X і n представляють те ж, що указано вище; і (с) вплив на сполуку, представлену формулою (13), реакції закривання кільця для одержання сполуки, представленої формулою (1). Даний винахід також стосується наступного способу. Пункт 7. Спосіб одержання сполуки, представленої формулою (1): , 1 де R представляє атом водню або нижчу алкільну групу; 2 R представляє 1-піперидильну групу, заміщену в положенні 4 замісником, вибраним з (А1a) феноксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, (А1b) заміщеної феноксигрупи нижчого алкілу, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами, (А1c) заміщеної фенілом нижчої алкокси нижчої алкільної групи, заміщеної на фенільній частині галогеном, (A1d) заміщеної фенілом нижчої алкільної групи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами, (А1e) аміногрупи, заміщеної фенільною групою, заміщеної однією або більше заміщеними галогеном нижчими алкоксигрупами, і нижчою алкільною групою, і (А1f) заміщеної фенілом нижчої алкоксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами; і n представляє ціле число від 1 до 6; причому спосіб включає стадії (a) взаємодія сполуки, представленої формулою (9): , 1 1 де X представляє відхідну групу, і R і n є такими ж, як в пункті 1, із сполукою, представленою формулою (2): 2 H- - -R (2), 2 де R є таким же, як в пункті 1, для одержання сполуки, представленої формулою (10): 6 UA 108092 C2 , 1 2 де R , R і n представляють те ж, що указано вище; (b) взаємодія сполуки, представленої формулою (10), з органічною сульфоновою кислотою для одержання сполуки, представленої формулою (11): 5 , 3 1 2 де X представляє органічну сульфонілоксигрупу, і R , R і n представляють те ж, що указано вище; (с) вплив на сполуку, представлену формулою (11), реакцією епоксидації для одержання сполуки, представленої формулою (12): 10 , 1 2 де R , R і n представляють те ж, що указано вище; (d) взаємодія сполуки, представленої формулою (12), із сполукою, представленою формулою (8): 15 , 2 де X представляє атом галогену, для одержання сполуки, представленої формулою (13): , 1 2 2 де R , R , X і n представляють те ж, що указано вище; і (е) вплив на сполуку, представлену формулою (13), реакції закривання кільця для одержання сполуки, представленої формулою (1): 20 1 , 2 де R , R і n представляють те ж, що указано вище. 7 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 Кожний термін, використаний в даному описі, конкретно являє собою наступне. У даному описі, термін «кімнатна температура» означає температуру, наприклад, в межах діапазону від 10°С до 35°С. Термін «в положенні 4» 1-піперидильної групи означає положення, показане нижче цифрою 4, що загалом зрозуміло середнім фахівцям в даній галузі техніки. Кожна група, представлена в даному описі, являє собою конкретно наступне. Атоми галогену (або галоген) включають атом фтору, атом хлору, атом брому і атом йоду. Групи нижчого алкокси включають, наприклад, лінійні або розгалужені алкоксигрупи, що мають 1-6 атомів вуглецю (переважно, 1-4 атоми вуглецю). Конкретніше, вони включають метокси, етокси, н-пропокси, ізопропокси, н-бутокси, ізобутокси, трет-бутокси, втор-бутокси, нпентилокси, 1-етилпропокси, ізопентилокси, неопентилокси, н-гексилокси, 1,2,2триметилпропокси, 3,3-диметилбутокси, 2-етилбутокси, ізогексилокси і 3-метилпентилокси групи. Заміщені галогеном групи нижчого алкокси включають групи нижчого алкокси, як указано вище, заміщені 1-7, переважно, 1-3 атомами галогену. Конкретніше, вони включають фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси, трихлорметокси, брометокси, диброметокси, дихлорфторметокси, 2,2,2-трифторетокси, пентафторетокси, 2хлоретокси, 3,3,3-трифторпропокси, гептафторпропокси, гептафторізопропокси, 3хлорпропокси, 2-хлорпропокси, 3-бромпропокси, 4,4,4-трифторбутокси, 4,4,4,3,3пентафторбутокси, 4-хлорбутокси, 4-бромбутокси, 2-хлорбутокси, 5,5,5-трифторпентилокси, 5хлорпентилокси, 6,6,6-трифоргексилокси і 6-хлоргексилокси групи. Феноксигрупи, заміщені на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, включають, наприклад, феноксигрупи, заміщені на фенільній частині однією або більше заміщеними 1-3 (переважно, 1) галогенами групами нижчого алкокси, як указано вище. Нижчі алкільні групи включають лінійні або розгалужені алкільні групи, що мають 1-6 атомів вуглецю (переважно, 1-4 атоми вуглецю). Конкретніше, вони включають метильну, етильну, нпропільну, ізопропільну, н-бутильну, ізобутильну, трет-бутильну, втор-бутильну, н-пентильну, 1етилпропільну, ізопентильну, неопентильну, н-гексильну, 1,2,2-триметилпропільну, 3,3диметилбутильну, 2-етилбутильну, ізогексильну і 3-метилпентильну групи. Заміщені галогеном нижчі алкільні групи включають нижчі алкільні групи, як указано вище, заміщені 1-7, переважно, 1-3 атомами галогену. Конкретніше, вони включають фторметильну, дифторметильну, трифторметильну, хлорметильну, дихлорметильну, трихлорметильну, бромметильну, дибромметильну, дихлорфторметильну, 2,2-дифторетильну, 2,2,2трифторетильну, пентафторетильну, 2-фторетильну, 2-хлоретильну, 3,3,3-трифторпропільну, гептафторпропільну, 2,2,3,3,3-пентафторпропільну, гептафторізопропільну, 3-хлорпропільну, 2хлорпропільну, 3-бромпропільну, 4,4,4-трифторбутильну, 4,4,4,3,3-пентафторбутильну, 4хлорбутильну, 4-бромбутильну, 2-хлорбутильну, 5,5,5-трифторпентильну, 5-хлорпентильну, 6,6,6-трифторгексильну і 6-хлоргексильну групи. Фенокси-заміщені нижчі алкільні групи ілюструються нижчими алкільними групами, вказаними вище, заміщеними однією феноксигрупою. Конкретніше, вони включають феноксиметильну, 2-феноксіетильну, 1-феноксіетильну, 2-феноксіетильну, 2-фенокси-1метилетильну, 2-фенокси-1-етилетильну, 3-феноксипропільну і 4-феноксибутильну групи. Фенокси-заміщені нижчі алкільні групи, заміщені на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами, включають, наприклад, фенокси-заміщені нижчі алкільні групи, вказані вище, заміщені 1-3 (переважно, 1) заміщеними галогеном нижчими алькільними групами, як указано вище. Групи нижчого алкокси-нижчого алкілу ілюструються нижчими алькільними групами, як указано вище, заміщеними однією групою нижчого алкокси, як указано вище. Конкретніше, вони включають метоксиметильну, 2-метоксіетильну, 1-етоксіетильну, 2-етоксіетильну, 2ізобутоксіетильну, 2,2-диметоксіетильну, 2-метокси-1-метилетильну, 2-метокси-1-етилетильну, 3-метоксипропільну, 3-етоксипропільну, 3-ізобутоксипропільну, 3-н-бутоксипропільну, 4-нпропоксибутильну, 1-метил-3-ізобутоксипропільну, 1,1-диметил-2-н-пентилоксіетильну, 5-нгексилоксипентильну, 6-метоксигексильну, 1-етоксіізопропільну і 2-метил-3-метоксипропільну групи. 8 UA 108092 C2 5 10 15 20 25 30 35 40 Феніл-заміщені групи нижчого алкокси-нижчого алкілу ілюструються вказаними вище групами нижчого алкокси-нижчого алкілу, заміщеними однією фенільною групою на групі нижчого алкокси. Конкретніше, вони включають бензилоксиметильну, (2-фенілетокси)метильну, (1-фенілетокси)метильну, 3-(3-фенілпропокси)пропільну, 4-(4-фенілбутокси)бутильну, 5-(5фенілпентилокси)пентильну, 6-(6-фенілгексилокси)гексильну, 1,1-диметил-(2фенілетокси)етильну, 2-метил-3-(3-фенілпропокси)пропільну, 2-бензилоксіетильну, 1бензилоксіетильну, 3-бензилоксипропільну, 4-бензилоксибутильну, 5-бензилоксипентильну і 6бензилоксигексильну групи. Феніл-заміщені групи нижчого алкокси-нижчого алкілу, заміщені на фенільній частині галогеном, включають, наприклад, вказані вище феніл-заміщені групи (нижчого алкокси)(нижчого алкілу), що мають 1-7, переважніше, 1-3 атоми галогену. Феніл-заміщені нижчі алкільні групи ілюструються вказаними вище нижчими алкільними групами, заміщеними однією фенільною групою. Конкретніше, вони включають бензильну, 1фенілетильну, 2-фенілетильну, 1-метил-1-фенілетильну, 1,1-диметил-2-фенілетильну, 1,1диметил-3-фенілпропільну, 3-фенілпропільну і 4-фенілбутильну групи. Феніл-заміщені нижчі алкільні групи, заміщені на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, включають, наприклад, вказані вище фенілзаміщені нижчі алкільні групи, заміщені 1-3 (переважно, 1) вказаними вище заміщеними галогеном групами нижчого алкокси. Фенільні групи, заміщені однією або більше заміщеними галогеном групами нижчого алкокси, включають, наприклад, фенільні групи, заміщені 1-3 (переважно, 1) вказаними вище заміщеними галогеном групами нижчого алкокси. Фенільні групи, заміщені однією або більше заміщеними галогеном групами нижчого алкокси, включають, наприклад, фенільні групи, заміщені 1-3 (переважно, 1) заміщеними галогеном групами нижчого алкокси. Аміногрупи, заміщені фенільною групою, заміщеною однією або більше заміщеними галогеном групами нижчого алкокси і нижчими алкільними групами, включають, наприклад, аміногрупи, заміщені однією фенільною групою, заміщеною однією або більше заміщеними галогеном групами нижчого алкокси, як указано вище, і однією нижчою алкільною групою, як указано вище. Феніл-заміщені групи нижчого алкокси ілюструються вказаними вище нижчими алкільними групами, заміщеними однією фенільною групою. Конкретніше, вони включають бензилокси, 1фенілетокси, 2-фенілетокси, 1-метил-1-фенілетокси, 1,1-диметил-2-фенілетокси, 1,1-диметил-3фенілпропокси, 3-фенілпропокси і 4-фенілбутокси групи. Феніл-заміщені групи нижчого алкокси, заміщені на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, включають, наприклад, вказані вище фенілзаміщені групи нижчого алкокси, заміщені 1-3 (переважно, 1) вказаними вище заміщеними галогеном групами нижчого алкокси. Нижче пояснюється спосіб одержання сполуки оксазолу, представленої формулою (1), яка є одним аспектом даного винаходу. Цим поясненням можна також зрозуміти інші аспекти. Спосіб одержання сполуки оксазолу, представленої формулою (1) за даним винаходом, схематично ілюструється наступною схемою реакції D. Схема реакції D: 9 UA 108092 C2 1 5 10 15 2 1 2 3 На схемі реакції D, R , R , X , X , X і n означають те ж, що і вище. Один аспект способу одержання сполуки оксазолу, представленої формулою (1), включає стадії 1-5, описані нижче. Стадія 1: Взаємодія сполуки, представленої формулою (9): , 1 де R представляє атом водню або нижчу алкільну групу, n представляє ціле число від 1 до 1 6, і X представляє відхідну групу, із сполукою, представленою формулою (2): 2 H- - -R (2), 2 де R представляє 1-піперидильну групу, заміщену в положенні 4 замісником, вибраним з (А1a) феноксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, (А1b) заміщеної феноксигрупи нижчого алкілу, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами, (А1c) заміщеної фенілом нижчої алкокси нижчої алкільної групи, заміщеної на фенільній частині галогеном, (A1d) заміщеної фенілом нижчої алкільної групи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами, 10 UA 108092 C2 5 (А1e) аміногрупи, заміщеною фенільною групою, заміщеною однією або більше заміщеними галогеном нижчими алкоксигрупами, і нижчою алкільною групою, і (А1f) заміщеної фенілом нижчої алкоксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами, для одержання сполуки, представленої формулою (10): , 1 2 де R , R і n представляють те ж, що указано вище. Стадія 2: Взаємодія сполуки, представленої формулою (10), з органічною сульфоновою кислотою для одержання сполуки, представленої формулою (11): 10 , 3 1 2 де X представляє органічну сульфонілоксигрупу, а R , R і n представляють те ж, що указано вище. Стадія 3: Вплив на сполуку, представлену формулою (11), реакції епоксидації для одержання сполуки, представленої формулою (12): 15 , 1 2 де R , R і n представляють те ж, що указано вище. Стадія 4: Взаємодія сполуки, представленої формулою (12), із сполукою, представленою формулою (8): 20 , 2 де X представляє атом галогену, для одержання сполуки, представленої формулою (13): , 1 2 2 де R , R , X і n представляють те ж, що указано вище. Стадія 5: Вплив на сполуку, представлену формулою (13), реакції закривання кільця для одержання сполуки, представленої формулою (1): 11 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 , 1 2 де R , R і n представляють те ж, що указано вище. Кожна стадія детально пояснюється нижче. Стадія 1 Сполуку, представлену формулою (10), одержують взаємодією сполуки, представленої формулою (9), із сполукою, представленою формулою (2). 1 Приклади відхідних груп, представлених X в формулі (9), включають атом галогену, незаміщену або заміщену галогеном групу нижчого алкансульфонілокси, заміщену або незаміщену арилсульфонілоксигрупу і тому подібні. Серед них, переважний атом галогену. Незаміщені або заміщені галогеном групи нижчого алкансульфонілокси конкретно ілюструються лінійними або розгалуженими групами алкансульфонілокси, що мають 1-6 атоми вуглецю, такими як метансульфонілокси, етансульфонілокси, н-пропансульфонілокси, ізопропансульфонілокси, н-бутансульфонілокси, трет-бутансульфонілокси, нпентансульфонілокси, н-гексансульфонілокси, трифторметансульфонілокси і 2,2,2трифторетансульфонілоксигрупи. Заміщені або незаміщені арилсульфонілоксигрупи включають, наприклад, фенілсульфонілокси і нафтилсульфонілоксигрупи, кожна з яких може мати на бензольному кільці 1-3 замісника, вибраних з групи, що складається з лінійних або розгалужених алкільних груп, що мають 1-6 атомів вуглецю, лінійних або розгалужених алкоксигруп, що мають 1-6 атомів вуглецю, нітрогруп і атомів галогену. Фенілсульфонілоксигрупи, які можуть мати замісник або замісники, конкретно ілюструються фенілсульфонілокси, 4-метилфенілсульфонілокси, 2метилфенілсульфонілокси, 4-нітрофенілсульфонілокси, 4-метоксифенілсульфонілокси, 2нітрофенілсульфонілокси і 3-хлорфенілсульфонілоксигрупами. Нафтилсульфонілоксигрупи конкретно ілюструються -нафтилсульфонілокси і -нафтилсульфонілоксигрупами. Реакція сполуки, представленої формулою (2), із сполукою, представленою формулою (9), виконується без розчинника або в інертному розчиннику в присутності сполуки перехідного металу і ліганду і в присутності основної сполуки або за її відсутності. На даній стадії, суттєве використання перехідного металу і ліганду. Вони об'єднуються і додаються як каталізатор до реакційної системи. Що стосується способу додавання, то перехідний метал і ліганд можуть додаватися до реакційної системи окремо, або їх комплекс може додаватися до системи. Приклади сполук перехідних металів включають сполуки, що містять елементи від 8 до 11 групи. Їх переважні приклади включають сполуки нікелю, сполуки паладію і сполуки міді. Серед них, найбільш переважними є сполуки паладію. Сполуки паладію конкретно не обмежуються, і їх приклади включають сполуки тривалентного паладію, такі як тетрагідрат натрію гексахлорпаладієвої (IV) кислоти і калієва сіль гексахлорпаладієвої (IV) кислоти; сполуки двовалентного паладію, такі як хлорид паладію(II), бромід паладію(II), ацетат паладію(II), ацетилацетонат паладію(II), дихлорбіс(бензонітрил)паладію(II), дихлорбіс(трифенілфосфін)паладію(II) і дихлор(циклоокта-1,5-дієн)паладію(II); сполуки паладію з нульовою валентністю, такі як тріс(дибензиліденацетон)дипаладій(0), комплекс тріс(дибензиліденацетон)дипаладію(0) з хлороформом і тетракіс(трифенілфосфін)паладій(0); і тому подібні. Серед них, переважні тріс(дибензиліденацетон)дипаладій(0) і комплекс тріс(дибензиліденацетон)дипаладію(0) з хлороформом. Приклади лігандів включають фосфіни, N-гетероциклічні карбени і тому подібні. Фосфіни конкретно не обмежуються, і їх приклади включають монодентатфосфіни, такі як триізопропілфосфін, три-трет-бутилфосфін, трифенілфосфін, три-о-толілфосфін, 2-(ди-третбутилфосфін)біфеніл, 2-ди-трет-бутилфосфін-2'-(N,N-диметиламіно)біфеніл, 2-ди-третбутилфосфін-2'-метилбіфеніл, 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл, 2(дициклогексилфосфін)біфеніл, 2-ди-трет-бутилфосфін-1,1'-бінафтил, 2'-дициклогексилфосфін2,6-диметокси-3-сульфонат-1,1'-біфенілгідрату натрієва сіль, 2-(дициклогексилфосфін)-2'-(N,N 12 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 диметиламіно)біфеніл, 2-дициклогексилфосфін-2',6'-ди-і-пропокси-1,1'-біфеніл, 2дициклогексилфосфін-2'-метилбіфеніл, 2-(дициклогексилфосфін)-2',4',6'-триізопропіл-1,1'біфеніл, 2-дифенілфосфін-2'-(N,-диметиламіно)біфеніл, 5-(ди-трет-бутилфосфін)-1',3',5'трифеніл-1'H-[1,4']-біпіразол, 2-(ди-трет-бутилфосфін)-1-феніл-1H-пірол, і 2-(ди-третбутилфосфін)-1-феніл-1H-індол; бідентатфосфіни, такі як 1,2-біс(дифенілфосфін)бензол, 2,2'біс(дифенілфосфін)-1,1'-бінафтил, 4,5-біс(дифенілфосфін)-9,9-диметилксантен, 1,2біс(дифенілфосфін)етан, 1,3-біс(дифенілфосфін)пропан і 1,1-(дифенілфосфін)фероцен. Серед них, більш переважними є 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл, 5-(ди-третбутилфосфін)-1',3',5'-трифеніл-1'H-[1,4']-біпіразол, 2-ди-трет-бутилфосфін-2'-(N,Nдиметиламіно)біфеніл, 2-(дициклогексилфосфін)біфеніл і 2-(ди-трет-бутилфосфін)-1-феніл-1Hпірол, а найбільш переважним є 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл. N-гетероциклічні карбени конкретно не обмежуються, і їх приклади включають 1,3-(біс(2,6діізопропілфеніл)імідазоліній хлорид, 1,3-(біс(2,6-діізопропілфеніл)імідазолій хлорид, 1,3(біс(2,4,6-триметилфеніл)імідазоліній хлорид, 1,3-(біс(2,4,6-триметилфеніл)імідазолій хлорид і тому подібні. Приклади комплексів сполук перехідних металів і лігандів включають паладієві комплекси. Паладієві комплекси конкретно не обмежуються, і їх приклади включають нафтохінон-[1,3біс(діізопропілфеніл)імідазол-2-іліден]паладій(0), нафтохінон-[1,3-біс(мезитил)імідазол-2іліден]паладій(0), алілхлор-[1,3-біс(діізопропілфеніл)імідазол-2-іліден]паладій(II), алілхлор-[1,3біс(мезитил)імідазол-2-іліден]паладій(II), алілхлор-[1,3-біс(діізопропілфеніл)імідазол-2імідазолідиніліден]паладій(II), фенілалілхлор-[1,3-біс(діізопропілфеніл)-2-іліден]паладій(II), фенілалілхлор-[1,3-біс(діізопропілфеніл)-2-імідазолідиніліден]паладій(II), димер дихлор-[1,3біс(діізопропілфеніл)імідазол-2-іліден]паладію(II), дихлор-(1,2біса(дифенілфосфін)фероценіл)паладій(II), дихлорбіс(трициклогексилфосфін)паладій(II), дихлор-(1,5-циклооктадієн)паладій (II) і тому подібні. Інертні розчинники включають один або змішані розчинники, наприклад, воду; ефірні розчинники, такі як діоксан, тетрагідрофуран, простий діетиловий ефір, простий диметиловий ефір діетиленгліколю і простий диметиловий ефір етиленгліколю; розчинники у вигляді аліфатичних вуглеводнів, такі як гексан і гептан; розчинники у вигляді ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники у вигляді нижчих спиртів, такі як метанол, етанол, ізопропанол і трет-бутанол; кетонові розчинники, такі як ацетон і метилетилкетон; і полярні розчинники, такі як N,N-диметилформамід (DMF), диметилсульфоксид (DMSO), триамід гексаметилфосфорної кислоти і ацетонітрил. Переважні розчинники у вигляді ароматичних вуглеводнів. Як основні сполуки, можуть використовуватися різноманітні відомі сполуки, які включають, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію і гідроксид літію; карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію і карбонат літію; гідрокарбонати лужних металів, такі як гідрокарбонат літію, гідрокарбонат натрію і гідрокарбонат калію; лужні метали, такі як натрій і калій; неорганічні основи, такі як амід натрію, гідрид натрію і гідрид калію; алкоксиди лужних металів, такі як метоксид натрію, етоксид натрію, метоксид калію і етоксид калію, трет-бутоксид літію, трет-бутоксид натрію, трет-бутоксид калію; і органічні основи, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, триметиламін, диметиланілін, Nметилморфолін, 1,5-діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU) і 1,4-діазабіцикло[2.2.2]актан (DABCO). Вказані основні сполуки використовуються окремо або у вигляді суміші двох або більше. Більш переважними прикладами є алкоксиди лужних металів, такі як метоксид натрію, етоксид натрію, метоксид калію, етоксид калію, трет-бутоксид літію, трет-бутоксид натрію і третбутоксид калію; і гідроксиди лужних металів, такі як гідроксид натрію і гідроксид калію, або змішана основа з трибутиламіну і гідроксиду калію. Використовувана кількість сполуки перехідного металу становить звичайно від 0,0001 до 1 моль, переважно, від 0,001 до 0,1 моль на моль сполуки, представленої формулою (2). Використовувана кількість ліганду становить звичайно від 0,00005 до 10 моль, переважно, від 0,001 до 0,4 моль на моль сполуки, представленої формулою (2). Крім того, використовувана кількість ліганду становить звичайно від 0,5 до 10 моль, переважно, від 1 до 4 моль на моль сполуки перехідного металу. Використовувана кількість основної сполуки становить звичайно від 0,5 до 10 моль, переважно, від 0,5 до 6 моль на моль сполуки, представленої формулою (2). Описана вище реакція може виконуватися при нормальному тиску; в атмосфері інертного газу, такого як азот або аргон; або під підвищеним тиском. 13 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполука, представлена формулою (9), використовується в кількості щонайменше 0,5 моль, переважно, приблизно від 0,5 до 5 моль на моль сполуки, представленої формулою (2). Реакційна температура описаної вище реакції становить звичайно від кімнатної температури до 200°С, переважно, від кімнатної температури до 150°С. Час реакції становить звичайно від 1 до 30 годин. Стадія 2 Сполуку, представлену формулою (11), одержують взаємодією сполуки, представленої формулою (1), з органічною сульфоновою кислотою. Реакція сполуки, представленої формулою (10), з органічною сульфоновою кислотою виконується без розчинника або в інертному розчиннику; і в присутності основної сполуки, або в її відсутність. Приклади органічних сульфонових кислот включають метансульфонову кислоту, паратолуолсульфонову кислоту, трифторметансульфонову кислоту, нітробензолсульфонову кислоту (орто-, мета-, пара-), 2,4,6-триметилбензолсульфонову кислоту і 2,4,6триізопропілбензолсульфонову кислоту. Органічні сульфонові кислоти переважно використовуються в формі галогеніду кислоти (переважніше, хлориду). 3 Органічна сульфонілоксигрупа, представлена X , являє собою групу, що походить з органічної сульфонової кислоти. Приклади органічних сульфонілоксигруп включають метансульфонілокси (мезилокси), паратолуолсульфонілокси (тозилокси), трифторметансульфонілокси, нітробензолсульфонілокси (орто-, мета-, пара-), 2,4,6триметилбензолсульфонілокси і 2,4,6-триізопропілбензолсульфонілокси. Інертні розчинники включають одиночні або змішані розчинники, наприклад, воду; розчинники у вигляді простого ефіру, такі як діоксан, тетрагідрофуран, простий циклопентилметиловий ефір, простий діетиловий ефір, простий диметиловий ефір діетиленгліколю і простий диметиловий ефір етиленгліколю; розчинники у вигляді складного ефіру, такі як метилацетат, етилацетат, ізопропілацетат і трет-бутилацетат; розчинники у вигляді аліфатичних вуглеводнів, такі як гексан і гептан; розчинники у вигляді ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники у вигляді нижчих спиртів, такі як метанол, етанол, ізопропанол і трет-бутанол; кеотонові розчинники, такі як ацетон і метилетилкетон; і полярні розчинники, такі як N,N-диметилформамід (DMF), диметилсульфоксид (DMSO), триамід гексаметилфосфорної кислоти і ацетонітрил. Переважними є простий циклопентилметиловий ефір, етилацетат і N,N-диметилформамід (DMF). Як основні сполуки, можуть використовуватися різноманітні з відомих сполук, які включають, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію і гідроксид літію; карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію і карбонат літію; гідрокарбонати лужних металів, такі як гідрокарбонат літію, гідрокарбонат натрію і гідрокарбонат калію; лужні метали, такі як натрій і калій; неорганічні основи, такі як амід натрію, гідрид натрію і гідрид калію; алкоксиди лужних металів, такі як метоксид натрію, етоксид натрію, метоксид калію, етоксид калію, трет-бутоксид літію, трет-бутоксид натрію, трет-бутоксид калію; і органічні основи, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, триметиламін, диметиланілін, Nметилморфолін, 1,5-діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU) і 1,4-діазабіцикло[2.2.2]октан (DABCO). Вказані основні сполуки використовуються окремо або у вигляді суміші двох або більше. Основна сполука звичайно використовується в кількості від 0,5 до 10 моль, переважно, від 0,5 до 6 моль на моль сполуки, представленої формулою (10). Сульфонова кислота звичайно використовується в кількості щонайменше 0,5 моль, переважно, приблизно від 0,5 до 5 моль на моль сполуки, представленої формулою (10). Реакційна температура описаної вище реакції становить звичайно від -20°С до 100°С, переважно, від -10°С до кімнатної температури. Час реакції становить звичайно від 15 хвилин до 30 годин. Стадія 3 Сполуку, представлену формулою (12), одержують, піддаючи сполуку, представлену формулою (11), реакції епоксидації. Реакція епоксидації виконується без розчинника або в інертному розчиннику; і в присутності основної сполуки або за її відсутності. Інертні розчинники включають окремі або змішані розчинники, наприклад, воду; розчинники у вигляді простого ефіру, такі як діоксан, тетрагідрофуран, простий циклопентилметиловий ефір, простий діетиловий ефір, простий диметиловий ефір діетиленгліколю і простий 14 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 диметиловий ефір етиленгліколю; розчинники у вигляді складного ефіру, такі як метилацетат, етилацетат, ізопропілацетат і трет-бутилацетат; розчинники у вигляді аліфатичних вуглеводнів, такі як гексан і гептан; розчинники у вигляді ароматичних вуглеводнів, такі як бензол, толуол і ксилол; розчинники у вигляді нижчих спиртів, такі як метанол, етанол, ізопропанол і третбутанол; кетонові розчинники, такі як ацетон і метилетилкетон; і полярні розчинники, такі як N,Nдиметилформамід (DMF), диметилсульфоксид (DMSO), триамід гексаметилфосфорної кислоти і ацетонітрил. Переважними є простий циклопентилметиловий ефір, метанол і N,Nдиметилформамід (DMF). Як основні сполуки, можуть використовуватися різноманітні з відомих сполук, які включають, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, гідроксид калію, гідроксид цезію і гідроксид літію; карбонати лужних металів, такі як карбонат натрію, карбонат калію, карбонат цезію і карбонат літію; гідрокарбонати лужних металів, такі як гідрокарбонат літію, гідрокарбонат натрію і гідрокарбонат калію; лужні метали, такі як натрій і калій; неорганічні основи, такі як амід натрію, гідрид натрію і гідрид калію; алкоксиди лужних металів, такі як метоксид натрію, етоксид натрію, метоксид калію, етоксид калію, трет-бутоксид літію, трет-бутоксид натрію, трет-бутоксид калію; і органічні основи, такі як триетиламін, трипропіламін, піридин, хінолін, піперидин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, триметиламін, диметиланілін, Nметилморфолін, 1,5-діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU) і 1,4-діазабіцикло[2.2.2]октан (DABCO). Вказані основні сполуки використовуються окремо або у вигляді суміші двох або більше. Основна сполука звичайно використовується в кількості від 0,5 до 10 моль, переважно, від 0,5 до 6 моль на моль сполуки, представленої формулою (11). Реакційна температура описаної вище реакції становить звичайно від -20°С до 100°С, переважно, від 0°С до кімнатної температури. Час реакції становить звичайно від 15 хвилин до 30 годин. Описана вище реакція може виконуватися в присутності каталізатора фазового перенесення. Використовувані каталізатори фазового перенесення включають солі четвертинного амонію, заміщені замісником або замісниками, вибраним з групи, що складається з лінійних або розгалужених алкільних груп, що мають від 1 до 18 атомів вуглецю феніл-нижчих алкільних груп і фенільних груп, таких як хлорид тетрабутиламонію, бромід тетрабутиламонію, фторид тетрабутиламонію, йодид тетрабутиламонію, гідроксид тетрабутиламонію, гідросульфат тетрабутиламонію, хлорид трибутилметиламонію, хлорид трибутилбензиламонію, хлорид тетрапентиламонію, бромід тетрапентиламонію, хлорид тетрагексиламонію, хлорид бензилдиметилоктиламонію, хлорид метилтригексиламонію, хлорид бензилдиметилокстадеканіламонію, хлорид метилтридеканіламонію, хлорид бензилтрипропіламонію, хлорид бензилтриетиламонію, хлорид пентилтриетиламонію, хлорид тетраетиламонію і хлорид тетраметиламонію; солі фосфонію, заміщені лінійними або розгалуженими алкільними групами, що мають 1-18 атомів вуглецю, такими як хлорид тетрабутилфосфонію; і солі піридинію, заміщені лінійними або розгалуженими алкільними групами, що мають 1-18 атомів вуглецю, такими як хлорид 1-додеканілпіридинію. У цьому випадку, реакція переважно виконується у воді або в змішаному розчині води і органічного розчинника, що змішується з водою (бензолу, толуолу, ксилолу, метиленхлориду, 1,2-дихлоретану і т. д.). Каталізатор фазового перенесення звичайно використовується в кількості від 0,01 до 0,5 моль, переважно, від 0,2 до 0,3 моль на моль сполуки, представленої формулою (11). Стадія 4 Сполуку, представлену формулою (13), одержують взаємодією епокси-сполуки, представленої формулою (12), із сполукою 4-нітроімідазолу, представленою формулою (8). Сполука, представлена формулою (12), звичайно використовується в кількості від 0,5 до 5 моль, переважно, від 0,5 до 3 моль на моль сполуки, представленої формулою (8). Як основні сполуки можуть використовуватися різноманітні відомі основні сполуки, які включають, наприклад, неорганічні основи, такі як гідриди металів, нижчі алкоксиди, гідроксиди, карбонати і гідрокарбонати лужних металів, і органічні основи, такі як ацетати. Гідриди металів конкретно ілюструються гідридом натрію і гідридом калію. Нижчі алкоксиди лужних металів конкретно ілюструються метоксидом натрію, етоксидом натрію і трет-бутоксидом калію. Гідроксиди конкретно ілюструються гідроксидом натрію і гідроксидом калію. Карбонати конкретно ілюструються карбонатом натрію і карбонатом калію. Гідрокарбонати конкретно ілюструються гідрокарбонатом натрію і гідрокарбонатом калію. Неорганічні основи, в доповнення до вказаних вище, також включають аміди натрію. 15 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ацетати конкретно ілюструються ацетатом натрію і ацетатом калію. Органічні солі, в доповнення до вказаних вище, конкретно ілюструються триетиламіном, триметиламіном, діізопропілетиламіном, піридин, диметиланіліном, 1-метилпіролідином, N-метилморфоліном, 1,5-діазабіцикло[4.3.0]ноненом-5 (DBN), 1,8-діазабіцикло[5.4.0]ундеценом-7 (DBU) і 1,4діазабіцикло[2.2.2]октаном (DABCO). Основна сполука звичайно використовується в кількості від 0,1 до 2 моль, переважно, від 0,1 до 1 моль, переважніше, від 0,1 до 0,5 моль на моль сполуки, представленої формулою (8). Реакція сполуки, представленої формулою (12), і сполуки, представленої формулою (8), виконується звичайно у придатному розчиннику. Як розчинники можуть використовуватися різноманітні відомі розчинники. Переважні розчинники, які не інгібують реакцію. Приклади таких розчинників включають апротонні полярні розчинники, такі як диметилформамід (DMF), диметилсульфоксид (DMSO) і ацетонітрил; кетонові розчинники, такі як ацетон і метилетилкетон; вуглеводневі розчинники, такі як бензол, толуол, ксилол, тетралін і рідкий парафін; спиртові розчинники, такі як метанол, етанол, ізопропанол, н-бутанол і трет-бутанол; розчинники у вигляді простого ефіру, такі як тетрагідрофуран (THF), простий циклопентилметиловий ефір, діоксан, простий діізопропіловий ефір, простий діетиловий ефір і диглім; розчинники у вигляді складного ефіру, такі як метилацетат, етилацетат, ізопропілацетат і трет-бутилацетат; і їх суміші. Ці розчинники можуть містити воду. Взаємодія сполуки, представленої формулою (12), із сполукою, представленою формулою (8), виконують, наприклад, розчиненням сполуки, представленої формулою (8), в реакційному розчиннику, додаванням основної сполуки до розчину при температурі охолоджування льодом або при кімнатній температурі (наприклад, 30°С) при перемішуванні, перемішуванням суміші при температурі від кімнатної до 80°С протягом періоду від 30 хвилин до 1 години, потім додаванням сполуки, представленої формулою (12), і продовженням перемішування суміші звичайно при температурі від кімнатної до 100°С, переважно, при температурі від 50°С до 100°С протягом періоду від 30 хвилин до 60 годин, переважно, протягом від 1 до 50 годин. Сполука, представлена формулою (8), являє собою відому сполуку, або сполуку, яка може бути легко одержана відповідно до відомого способу. Стадія 5 Сполуку, представлену формулою (1), одержують, піддаючи сполуку, представлену формулою (13), реакції закривання кільця. Реакцію закривання кільця виконують розчиненням сполуки, представленої формулою (13), яку одержують на стадії 4, в реакційному розчиннику, і додаванням до неї основної сполуки і перемішуванням суміші. Як реакційні розчинники і основні сполуки, можна використовувати такі ж реакційні розчинники і основні сполуки, як ті, які використовують на стадії 4. Основну сполуку звичайно використовують в кількості від 1 до надмірної кількості, переважно, від 1 до 5 моль, переважніше, від 1 до 2 моль на моль сполуки, представленої формулою (13). Реакційна температура реакції закривання кільця становить звичайно від 0°С до 150°С, переважно, від 0°С до кімнатної температури. Час реакції звичайно становить від 30 хвилин до 48 годин, переважно, від 1 до 24 годин, переважніше, від 1 до 12 годин. Реакційна суміш може використовуватися при подальшій реакції закривання кільця без виділення сполуки, представленої формулою (13), яку одержують на стадії (4). Цільова сполука, представлена формулою (1), може бути також одержана, наприклад, взаємодією сполуки, представленої формулою (12), із сполукою, представленою формулою (8), при температурі від кімнатної до 100°С, потім додаванням основної сполуки до реакційної суміші і подальшим перемішуванням суміші при температурі від 0°С до 100°С, або взаємодією сполуки, представленої формулою (12), сполукою, представленою формулою (8), при температурі від кімнатної до 100°С, потім конденсацією реакційної суміші, розчиненням залишку в розчиннику з високою точкою кипіння, додаванням основної сполуки до одержаного розчину, і далі перемішуванням розчину при температурі від 0°С до 100°С. Цільова сполука, представлена формулою (1), може бути також одержана використанням від 0,9 до 2 моль основної сполуки на моль сполуки, представленої формулою (8), при взаємодії сполуки, представленої формулою (12), і сполуки, представленої формулою (8); і перемішуванням реакційної суміші при температурі від 50°С до 100°С з тим, щоб виконати в одному способі взаємодію між сполукою, представленою формулою (12), і сполукою, представленою формулою (8), а також реакцію закривання кільця сполуки, представленої формулою (13), одержаної описаною вище реакцією. 16 UA 108092 C2 Сполука, представлена формулою (10), в представленій вище схемі реакції D, може бути одержана із сполуки, представленої формулою (9), з використанням способу, показаного нижче в схемі реакції Е. Схема реакції Е 5 10 15 20 25 30 35 40 1 2 1 A У представлених вище формулах, R , R , X і n представляють те ж, що указано вище; R представляє нижчу алкільну групу або фенільну групу, яка може мати замісник або замісники; і B A B R представляє атом водню або нижчу алкільну групу. R і R можуть утворювати циклоалкільне кільце разом з атомом вуглецю, з яким вони зв’язані. У схемі реакції Е, сполука, представлена формулою (9), взаємодіє із сполукою, представленою формулою (9-i), для одержання сполуки, представленої формулою (9-ii). У подальшому, сполука, представлена формулою (9-ii), взаємодіє із сполукою, представленою формулою (2), для одержання сполуки, представленої формулою (9-iii). Потім, сполуку, представлену формулою (9-iii), піддають зняттю захисту для одержання сполуки, представленої формулою (10). A B Приклади нижчих алкільних груп, представлених R і R , включають вказані вище нижчі алкільні групи. Приклади замісників в фенільній групі, яка може мати замісник або замісники, A представлені R , включають вказані вище нижчі алкоксигрупи. Переважно, від 1 до 3 таких замісників присутні на фенільному кільці. A B Приклади циклоалкільних кілець, які можуть бути утворені R і R разом з атомом вуглецю, з яким вони зв’язані, включають циклопентанове кільце, циклогексанове кільце, циклогептанове кільце і тому подібні. Приклади сполук, представлених формулою (9-i), включають ацетон, бензальдегід, пметоксибензальдегід, 2,4-диметоксибензальдегід, циклопентанон, циклогексанон, циклогептанон і тому подібні. При взаємодії сполуки, представленої формулою (9), із сполукою, представленою формулою (9-i), сполуку, представлену формулою (9-i), загалом використовують в кількості від 1 до 200 моль, а переважно, від 1 до 100 моль на моль сполуки, представленої формулою (9). Взаємодія сполуки, представленої формулою (9), із сполукою, представленою формулою (9i), виконують у придатному розчиннику і в присутності придатного кислотного каталізатора. Як розчинники можуть використовуватися широка різноманітність відомих розчинників, і переважно використовують розчинники, які не інгібують реакцію. Приклади розчинників включають апротонні полярні розчинники, такі як диметилформамід (DMF), диметилсульфоксид (DMSO) і ацетонітрил; вуглеводневі розчинники, такі як бензол, толуол, ксилол, тетралін, гексан, пентан і рідкий парафін; розчинники у вигляді простого ефіру, такі як тетрагідрофуран (THF), діоксан, простий діізопропіловий ефір, простий діетиловий ефір і диглім; розчинники у вигляді складного ефіру, такі як метилацетат, етилацетат, ізопропілацетат і трет-бутилацетат; галогеновані вуглеводневі розчинники, такі як дихлорметан і 1,2-дихлоретан; і їх суміші. Також можна використовувати кетонові розчинники, такі як ацетон, метилетилкетон і циклогексанон. Приклади каталізаторів включають неорганічні кислоти, такі як хлористоводнева кислота, бромистоводнева кислота і сірчана кислота; органічні кислоти, такі як бензолсульфонова кислота, п-толуолсульфонова кислота, камфорсульфонова кислота і оцтова кислота; солі амонію, такі як хлорид амонію, гексафторантимонат піридинію; і кислоти Льюїса, такі як 17 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 BF3(OC2H5)2, тетрахлорид титану і трифлат скандію. Ці кислотні каталізатори можуть використовуватися в звичайній каталітичній кількості. Зокрема, каталізатор загалом використовується в кількості від 0,01 до 1 моль, а переважно, від 0,01 до 2 моль на моль сполуки, представленої формулою (9). Реакцію загалом виконують при 0-200°С, а переважно, при температурі від кімнатної до 150°С; і вона загалом завершується через проміжок часу від приблизно 30 хвилин до приблизно 72 годин. Дві гідроксигрупи сполуки, представленої формулою (9), захищаються описаною вище реакцією. Подальшу взаємодію сполуки, представленої формулою (9-ii), із сполукою, представленою формулою (2), проводять в таких же умовах як умови для взаємодії сполуки, представленої формулою (9) із сполукою, представленою формулою (2), описані вище. При знятті захисту одержаної таким чином сполуки, представленої формулою (9-iii), можуть використовуватися різні відомі умови взаємодії для видалення захисної групи із захищеної гідроксигрупи. Наприклад, зняття захисту сполуки, представленої формулою (9-iii), переважно виконують у придатному розчиннику і в присутності кислоти. Приклади розчинників, що використовуються при даному знятті захисту, включають ті, які використовуються при взаємодії сполуки, представленої формулою (9), із сполукою, представленою формулою (9-i), описаної вище. Приклади кислот включають неорганічні кислоти, такі як хлористоводнева кислота, бромистоводнева кислота і сірчана кислота; органічні кислоти, такі як бензолсульфонова кислота, п-толуолсульфонова кислота, камфорсульфонова кислота і оцтова кислота; і солі амонію, такі як хлорид амонію і гексафторантимонат піридинію. Кислоту звичайно використовують в кількості від 0,01 до 1 моль, а переважно, від 0,01 до 0,2 моль на моль сполуки, представленої формулою (9-iii). Реакцію загалом проводять при 0-200°С, а переважно, при температурі від кімнатної до 150°С; і вона загалом завершується через проміжок часу приблизно від 30 хвилин до 24 годин. Сполуки, що використовуються як сировинний матеріал, і призначені сполуки в кожній з представлених вище формул реакцій, які включають сполуки за даним винаходом, можуть бути представлені в формі вільних сполук або солей. Приклади таких солей включають фармакологічно прийнятні солі, одержані з неорганічних основ, органічних основ, неорганічних кислот і органічних кислот. Солі неорганічних основ включають, наприклад, солі металів, такі як солі лужних металів (наприклад, солі літію, солі натрію і солі калію) і солі лужноземельних металів (наприклад, солі кальцію і солі магнію), солі амонію, карбонати лужних металів (наприклад, карбонат літію, карбонат калію, карбонат натрію і карбонат цезію), гідрокарбонати лужних металів (наприклад, гідрокарбонат літію, гідрокарбонат натрію і гідрокарбонат калію), і гідроксиди лужних металів (наприклад, гідроксид літію, гідроксид натрію, гідроксид калію і гідроксид цезію). Солі органічних основ включають, наприклад, солі тріс(нижчого)алкіламіну (наприклад, триметиламін, триетиламін і N-етилдіізопропіламін), піридин, хінолін, піперидин, імідазол, піколін, диметиламінопіридин, диметиланілін, N-(нижчий)алкілморфолін (наприклад, Nметилморфолін) 1,5-діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU) і 1,4-діазабіцикло[2.2.2]октан (DABCO). Солі неорганічних кислот включають, наприклад, гідрохлориди, гідроброміди, гідройодиди, сульфати, нітрати і фосфати. Солі органічних кислот включають, наприклад, форміати, ацетати, пропіонати, оксалати, малонати, сукцинати, фумарати, малеати, лактати, малати, цитрати, тартрати, карбонати, пікрати, метансульфонати, етансульфонати, п-толуолсульфонати і глутамати. Крім того, сполуки, які використовуються як сировинний матеріал, і призначені сполуки в кожній з представлених вище формул реакцій, які включають сполуки за даним винаходом, можуть бути представлені в формі сольватів (наприклад, гідрати і етанолати). Переважні сольвати включають гідрати. Кожна цільова сполука, одержана на кожній з описаних вище стадій, може бути виділена і очищена з реакційної суміші, наприклад, відділенням неочищеного продукту реакції за допомогою операцій виділення, таких як фільтрація, конденсація і екстракція, після охолоджування реакційної суміші і впливу на продукт реакції звичайних операцій очищення, таких як колонкова хроматографія і перекристалізація. З іншого боку, сполуки, одержані на кожній стадії, можуть також використовуватися як сировинні матеріали на наступній стадії в формі реакційних сумішей самих по собі, не піддаючи їх виділенню. 18 UA 108092 C2 Доки немає інших визначень, сполуки, що використовуються як сировинний матеріал на кожній описаній вище стадії, і цільові сполуки можуть являти собою рацемічні або оптично активні ізомери. Однак, для одержання оптично активного ізомеру сполуки, представленої формулою (1): 5 , 1 2 де R , R і n представляють те ж, що указано вище, переважно використовуються оптично активні ізомери сполук, показаних нижче. Сполука, представлена формулою (9): 1 , 1 1 10 2 де R , X і n представляють те ж, що указано вище. Сполука, представлена формулою (10): , де R , R і n представляють те ж, що указано вище. Сполука, представлена формулою (11): 15 , 1 2 3 де R , R , X і n представляють те ж, що указано вище. Сполука, представлена формулою (12): 1 20 1 2 , 2 де R , R і n представляють те ж, що указано вище. Сполука, представлена формулою (13): , 2 де R , R , X і n представляють те ж, що указано вище. 19 UA 108092 C2 5 10 15 20 25 30 35 40 45 Використання сполуки, представленої формулою (9) на стадії 1, дає можливість оптично активним ізомерам сполук, представлених формулами (1) і (10)-(13), зберігати їх конфігурації на кожній стадії, одержуючи цільову сполуку з високою оптичною чистотою. Сприятливі ефекти винаходу Даний винахід забезпечує можливість одержання сполуки, представленої формулою (1), із сполуки, представленої формулою (2), з високим виходом. Відповідно до даного винаходу, коли оптично активний ізомер використовується як сполука, що використовується як сировинний матеріал, оптично активний ізомер сполуки, представленої формулою (1), може бути одержаний з високою оптичною чистотою. Відповідно до досліджень, проведених заявниками, це, ймовірно, пов’язано з причиною, описаною нижче; однак об'єм даного винаходу не обмежується цим. Раніше відомі способи включають стадію, на якій феноксидна сполука R-Ns починає нуклеофільну атаку, як показано нижче в формулі реакції. На цій стадії, феноксид атакує ділянку, показану стрілкою «шлях А» в сполуці R-Ns для одержання цільового R-енантіомеру. Однак феноксид також атакує ділянку, показану стрілкою «шлях В», спричиняючи одержання Sенантіомеру як побічного продукту. Це зменшує оптичну чистоту одержаного в результаті продукту. Навпаки, спосіб за даним винаходом не включає стадію, яка спричиняє зменшення оптичної чистоти; тому спосіб за даним винаходом перевершує відомі способи в цьому відношенні. Опис варіантів здійснення Далі, даний винахід детально пояснюється з посиланням на приклади. Доки немає інших визначень, абревіатури, що використовуються нижче, мають значення, звичайне зрозуміле середнім фахівцям в даній галузі техніки. Наприклад, абревіатури, показані нижче, мають наступні значення. с: синглет, д: дублет, т: триплет, кв: квартет, м: мультиплет, пд: подвійний дублет, пт: подвійний триплет, ушир: уширений aq.: водний розчин MeOH: Метанол Посилальний приклад 1 Одержання 2-[(4-бромфенокси)метил]-2-метилоксирану 4-Бромфенол (80 г, 462 моль), 2-(хлорметил)-2-метилоксиран (400 мл) і карбонат калію (95,86 г, 693 моль) змішували і давали можливість взаємодіяти при 100°С протягом 4 годин. Після завершення реакції, суміш концентрували під зниженим тиском. До неї додавали етилацетат (200 мл) і воду (400 мл) з подальшою екстракцією. Водний шар екстрагували етилацетатом (200 мл). Органічний шар потім двічі промивали водою (200 мл). Потім органічний шар концентрували під зниженим тиском для видалення етилацетату. Потім, додавали толуол, і одержану суміш концентрували під зниженим тиском, одержуючи 120 г неочищеного продукту. 1 Н-ЯМР (300 МГц, CDCl3) м. ч.: 1,47 (3H, с), 2,73 (1H, д, J=4,8 Гц), 2,86 (1H, д, J=4,8 Гц), 3,90 (1H, д, J=10,7 Гц), 4,02 (1H, д, J=10,7 Гц), 6,80 (2H, пд, J=6,9, 2,3 Гц), 7,37 (2H, пд, J=6,9, 2,3 Гц). Приклад 1 Одержання (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діолу Суміш -металілового спирту (90,0 г, 1,25 моль), D-(-)-діізопропілтартрату (17,53 г, 75,0 моль), молекулярних сит (MS-4A, 45,0 г) і дегідрованого толуолу (900 мл) перемішували при 20 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 18°C. До суміші додавали тетраізопропоксид титану (17,7 г, 62,4 моль) з подальшим перемішуванням при температурі від -16 до -18°С протягом 0,5 години. Потім, до неї по краплинах додавали 80% кумілгідропероксид (404 г (загальна кількість), 2,12 моль) при температурі від -16 до -18°С протягом періоду 2 години, з подальшим перемішуванням при 10°С протягом 5 годин. До нього додавали диметилсульфоксид (95,7 г, 1,225 моль) при 11-13°С протягом періоду 0,7 години. Одержану суміш перемішували при кімнатній температурі протягом 6 годин і давали можливість відстоятися протягом ночі. Після додавання целіту (18,0 г) і проведення перемішування протягом 0,5 години, реакційну суміш піддавали фільтрації, одержуючи розчин в толуолі (S)-2-метилгліцидилового спирту. До одержаного таким чином розчину толуолу додавали 4-бромфенол (108 г, 624 моль) і 25% водний розчин гідроксиду натрію (110 г), з подальшим перемішуванням при 40°С протягом 9 годин. Після охолоджування реакційної суміші до кімнатної температури, до неї додавали активоване вугілля (9,0 г) і целіт (45,0 г). Потім реакційну суміш перемішували протягом 0,5 години і піддавали фільтрації. Шар толуолу промивали водою, і потім толуол і куміловий спирт відганяли під зниженим тиском. До концентрованого залишку додавали толуол (162 мл) з подальшим нагріванням до 70°С для розчинення концентрованого залишку. Одержаний розчин охолоджували до кімнатної температури протягом періоду 5 годин. До розчину додавали гексан (162 мл) з подальшим перемішуванням протягом 5 годин. Осаджені білі кристали збирали фільтрацією і потім промивали змішаним розчинником (90 мл) гексану і толуолу (суміш гексан/толуол 3/1). Кристали сушили повітродувкою при 50°С, одержуючи 123,8 г цільового продукту (вихід: 76,1% на основі 4-бромфенолу). Точка плавлення: 90°С Оптична чистота: 92,2%е.і. (енантіомерного надлишку) 1 Н-ЯМР (300 МГц, CDCl3) м. ч.: 1,30 (c, 3H), 2,08 (т, J=5,5 Гц, 1H), 2,62 (c, 1H), 3,58 (пд, J=11,2 Гц, JJ=6,1 Гц, 1H), 3,72 (пд, J=8,5 Гц, 2H), 3,90 (кв, J=8,5 Гц, 2H), 6,81 (пт, J=9,1 Гц, JJ=2,3 Гц, 2H), 7,39 (пт, J=9,1 Гц, JJ=2,2 Гц, 2H). Приклад 2 Одержання 3-(4-бромфенокси)-2-метилпропан-1,2-діолу Суміш -металілового спирту (10 г, 139 моль) і дигідрат вольфрамату натрію (92 мг, 0,28 моль) перемішували при кімнатній температурі, і до неї по краплинах додавали 35% розчин пероксиду водню (17,3 г, 153 моль) протягом періоду 5 хвилин. Суміш нагрівали до 40°С і перемішували протягом 7 годин. До половини кількості одержаної реакційної суміші (70 моль, на основі -металілового спирту) додавали карбонат калію (9,6 г, 69 моль) і 4-бромфенол (7,9 г, 46 моль), з подальшим перемішуванням при 60°С протягом 2,5 годин. Після додавання толуолу (30 мл), суміш нагрівали, промивали водою при температурі приблизно 60°С і потім охолоджували льодом. Осаджені кристали збирали фільтрацією, промивали толуолом (5 мл) і потім сушили під зниженим тиском, одержуючи 9,8 г 3-(4-бромфенокси)-2-метилпропан-1,2-діол (вихід: 82% (на основі 4-бромфенолу)). Приклад 3 Одержання 3-(4-бромфенокси)-2-метилпропан-1,2-діолу 2-[(4-бромфенокси)метил]-2-метилоксиран (72,9 г, 300 моль), ацетон (360 мл), воду (180 мл) і сірчану кислоту (7,3 мл) змішували і перемішували при 60°С протягом 1 години. Після охолоджування, суміш концентрували під зниженим тиском. До концентрованого залишку додавали етилацетат (360 мл) і насичений розчин бікарбонату натрію, з подальшою екстракцією. Потім, шар етилацетату сушили над безводним сульфатом натрію. До одержаного неочищеного продукту додавали етилацетат (102 мл) і нагрівали для розчинення неочищеного продукту. Одержаний розчин охолоджували до кімнатної температури і потім до нього додавали гексан (204 мл) з подальшим перемішуванням при температурі 10°С або менше протягом 1 години. Осаджені кристали збирали фільтрацією і потім промивали сумішшю етилацетату (24 мл) і гексану (48 мл). Одержані кристали сушили під зниженим тиском, одержуючи 44,0 г цільового продукту (вихід: 56%). Приклад 4 Одержання (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[4(трифторметокси)фенокси]піперидину Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (87,96 г, 336,9 моль, оптична чистота 92,2%е.і.), 4-[4-(трифторметокси)фенокси]піперидин (80 г, 306,2 моль), тріс(дибензиліденацетон)дипаладій(0) (Pd2dba3, 701 мг, 0,77 моль), 2-ди-трет-бутилфосфін2',4'6'-триізопропіл-1,1'-біфеніл (780 мг, 1,84 моль), трет-бутоксид натрію (33,85 г, 352,2 моль) і толуолу (240 мл) з подальшим перемішуванням в атмосфері аргону при 70°С протягом 6 годин. Після охолоджування, до реакційної суміші додавали водний розчин хлориду амонію з 21 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 подальшою екстракцією толуолом. Потім, органічний шар відганяли під зниженим тиском, одержуючи неочищений продукт (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діол. 1 Н-ЯМР (300 МГц, CDCl3) м. ч.: 1,28 (3H, c), 1,88-2,03 (2H, м), 2,03-2,19 (2H, м), 2,22 (1H, ушир. с), 2,75 (1H, ушир. с), 2,92-3,05 (2H, м), 3,30-3,45 (2H, м), 3,57 (1H, д, J=11,2 Гц), 3,73 (1H, д, J=11,2 Гц), 3,86 (1H, д, J=9,0 Гц), 3,93 (1H, д, J=9,0 Гц), 4,36-4,48 (1H, м), 6,78-6,98 (6H, м), 7,13 (2H, д, J=9,3 Гц). До одержаного неочищеного продукту додавали етилацетат (810 мл) і триетиламін (62 г, 612 моль). До нього додавали метансульфоніл хлорид (40,3 г, 351,8 моль) при охолоджуванні льодом доти, доки вихідні матеріали не ставали такими, що не виявляються, з подальшим перемішуванням протягом 20 хвилин. Після завершення реакції, до змішаного розчину додавали воду з подальшою екстракцією етилацетатом. Шар етилацетату промивали водою і потім відганяли під зниженим тиском, одержуючи неочищений продукт (S)-2-гідрокси-2-метил-3(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропілметансульфонат. 1 Н-ЯМР (300 МГц, CDCl3) м. ч.: 1,37 (3H, c), 1,98-2,05 (2H, м), 2,05-2,19 (2H, м), 2,63 (1H, c), 2,93-3,07 (2H, м), 3,03 (3H, c), 3,32-3,43 (2H, м), 3,85 (1H, д, J=9,2 Гц), 3,90 (1H, д, J=9,2 Гц), 4,27 (2H, c), 4,38-4,47 (1H, м), 6,81-6,97 (6H, м), 7,14 (2H, д, J=10,0 Гц). До неочищеного продукту додавали метанол (954 мл) і карбонат калію (84,7 г, 612 моль). Одержану суміш перемішували протягом 30 хвилин при температурі від 0°С до кімнатної температури. Реакційну суміш відганяли під зниженим тиском і потім до неї додавали толуол і воду. Шар толуолу промивали водою і відганяли під зниженим тиском. До одержаного залишку додавали ізопропанол (520 мл) і воду (130 мл) і нагрівали для розчинення залишку. Одержаний розчин охолоджували для одержання осаджених кристалів. Одержані таким чином осаджені кристали збирали фільтрацією і сушили, одержуючи 98,5 г (R)-1-{4-[(2,3-епокси-2метилпропокси)феніл]-4-[4-(трифторметокси)фенокси]піперидину (вихід: 76,2 %). Оптична чистота: 94,32% е.і. 1 Н-ЯМР (300 МГц, CDCl3) м. ч.: 1,48 (3H, c), 1,9-2,1 (4H, м), 2,72 (1H, д, J=5 Гц), 2,86 (1H, д, J=5 Гц), 2,9-3,1 (2H, м), 3,3-3,5 (2H, м), 3,91 (1H, д, J=10 Гц), 3,98 (1H, д, J=10 Гц), 4,3-4,5 (1H, м), 6,8-7,0 (6H, м), 7,14 (2H, д, J=9 Гц). Приклад 5 Одержання 4-[(4-бромфенокси)метил]-2,2,4-триметил-1,3-діоксану Змішували 3-(4-бромфенокси)-2-метилпропан-1,2-діол (261 мг, 1,00 моль), ацетон (77 мг, 1,3 моль), тетрагідрофуран (5 мл) і комплекс простого діетилового ефіру з трифторидом бору (3 краплини). Суміш перемішували при кімнатній температурі протягом 67 годин, і до неї додавали ацетон (102 мг, 1,76 моль) з подальшим перемішуванням протягом 2 годин. До реакційної суміші додавали карбонат натрію, етилацетат і воду для проведення екстракції. Органічний шар двічі промивали сольовим розчином. Залишок одержували концентрацією органічного шару під зниженим тиском, і залишок піддавали хроматографічному очищенню (метиленхлорид) з використанням силікагелю, одержуючи 121 мг цільової сполуки (вихід: 40%). Властивість: безбарвний маслянистий продукт 1 Н-ЯМР (CDCl3) м. ч.: 1,43 (9H, c), 3,74 (1H, д, J=8,6 Гц), 3,78 (1H, д, J=8,6 Гц), 3,84 (1H, д, J=8,8 Гц), 4,11 (1H, д, J=8,8 Гц), 6,78 (2H, д, J=9,0 Гц), 7,36 (2H, д, J=9,0 Гц). Приклад 6 Одержання 4-[(4-бромфенокси)метил]-2,2,4-триметил-1,3-діоксолану Змішували 3-(4-бромфенокси)-2-метилпропан-1,2-діол (261 мг, 1,00 моль), ацетон (10 мл) і комплекс простого діетилового ефіру з трифторидом бору (3 краплини). Потім суміш перемішували при кімнатній температурі протягом 14 годин. Залишок одержували концентруванням суміші під зниженим тиском, і до неї додавали етилацетат і воду з подальшою екстракцією. Органічний шар двічі промивали сольовим розчином. Залишок одержували концентрацією органічного шару під зниженим тиском, і одержаний залишок потім піддавали хроматографічному очищенню (метиленхлорид) з використанням силікагелю, одержуючи 183 мг цільової сполуки (вихід: 61%). Властивість: безбарвний маслянистий продукт 1 Н-ЯМР (CDCl3) м. ч.: 1,43 (9H, c), 3,75 (1H, д, J=8,6 Гц), 3,78 (1H, д, J=8,6 Гц), 3,85 (1H, д, J=8,8 Гц), 4,11 (1H, д, J=8,8 Гц), 6,79 (2H, д, J=9,1 Гц), 7,37 (2H, д, J=9,1 Гц). Приклад 7 Одержання 4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3-діоксолан-4іл)метокси]феніл}піперидину Змішували 4-[(4-бромфенокси)метил]-2,2,4-триметил-1,3-діоксолан (156 мг, 0,518 моль), 4[4-(трифторметокси)фенокси]піперидин (135 мг, 0,517 моль), ацетат паладію (1,2 мг, 0,0053 22 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 моль), тетрафенілборат три-трет-бутилфосфіну (2,7 мг, 0,0052 моль), трет-бутоксид натрію (55 мг, 0,57 моль) і толуолу (2 мл) і перемішували при кип’ятінні в посудині із зворотним холодильником протягом 2 годин. До реакційної суміші додавали етилацетат і воду з подальшою екстракцією. Органічний шар двічі промивали водою. Залишок одержували концентрацією органічного шару під зниженим тиском, і одержаний залишок потім піддавали хроматографічному очищенню (метиленхлорид) з використанням силікагелю, одержуючи 232 мг цільової сполуки (вихід: 93%). Властивість: світло-жовтий маслянистий продукт 1 Н-ЯМР (CDCl3) м. ч.: 1,43 (9H, c), 1,9-2,0 (2H, м), 2,1-2,2 (2H, м), 2,9-3,1 (2H, м), 3,3-3,4 (2H, м), 3,75 (1H, д, J=8,7 Гц), 3,78 (1H, д, J=8,7 Гц), 3,84 (1H, д, J=8,8 Гц), 4,13 (1H, д, J=8,8 Гц), 4,44,5 (1H, м), 6,84 (2H, д, J=9,2 Гц), 6,9-7,0 (4H, м), 7,14 (2H, д, J=9,2 Гц). Приклад 8 Одержання 2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан1,2-діолу Змішували 4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3-діоксолан-4іл)метокси]феніл}піперидин (223 мг, 0,463 моль), етанол (10 мл) і концентровану хлористоводневу кислоту (2 мл) і перемішували при кімнатній температурі протягом 14 годин. До реакційної суміші додавали воду з подальшою нейтралізацією карбонатом натрію. До суміші додавали етилацетат для проведення екстракції. Органічний шар три рази промивали водою. Органічний шар концентрували під зниженим тиском, одержуючи 196 мг (вихід: 96%) цільової сполуки. Властивість: Білий кристал 1 Н-ЯМР (CDCl3) м. ч.: 1,27 (3H, c), 1,9-2,0 (2H, м), 2,1-2,2 (2H, м), 2,4 (1H, ушир. с), 2,8 (1H, ушир. с), 2,9-3,1 (2H, м), 3,3-3,4 (2H, м), 3,56 (1H, д, J=11,2 Гц), 3,71 (1H, д, J=11,2 Гц), 3,85 (1H, д, J=9,1 Гц), 3,91 (1H, д, J=9,1 Гц), 4,4-4,5 (1H, м), 6,85 (2H, д, J=9,2 Гц), 6,9-7,0 (4H, м), 7,13 (2H, д, J=9,2 Гц). Приклад 9 Одержання (R)-2-метил-6-нітро-2-{4-[4-(4-трифторметоксифенокси)піперидин-1іл]феноксиметил}-2,3-дигідроімідазо[2,1-b]оксазолу Змішували (R)-1-[4-{2,3-епокси-2-метилпропокси)феніл]-4-[4(трифторметокси)фенокси]піперидин (10,0 г, 23,6 моль, оптична чистота 94,3%е.і.), 2-хлор-4нітроімідазол (4,0 г, 27,2 моль), ацетат натрію (0,4 г, 4,9 моль) і трет-бутилацетат (10 мл) і перемішували при 100°С протягом 3,5 годин. До реакційної суміші додавали метанол (70 мл) і потім до нього по краплинах додавали 25% водний розчин гідроксиду натрію (6,3 г, 39,4 моль) при охолоджуванні льодом. Одержану суміш перемішували при 0°С протягом 1,5 годин, і далі перемішували приблизно при кімнатній температурі протягом 40 хвилин. До неї додавали воду (15 мл) і етилацетат (5 мл), і суміш перемішували при 45-55°С протягом 1 години. Суміш охолоджували до кімнатної температури, і осаджені кристали збирали фільтрацією. Осаджені кристали в подальшому промивали метанолом (30 мл) і водою (40 мл). До одержаних кристалів додавали метанол (100 мл) з подальшим перемішуванням в умовах кип’ятіння в посудині із зворотним холодильником протягом 30 хвилин. Суміш охолоджували до кімнатної температури. Кристали потім збирали фільтрацією і промивали метанолом (30 мл). Одержані кристали сушили під зниженим тиском, одержуючи 9,3 г цільового продукту (вихід: 73%). Оптична чистота: 99,4% е.і. Приклад 10 Одержання 3-(4-хлорфенокси)-2-метилпропан-1,2-діолу Суміш -металілового спирту (50 г, 693 моль) і дигідрату вольфрамату натрію (460 мг, 1,4 моль) перемішували при кімнатній температурі. До неї по краплинах додавали 30% розчин пероксиду водню (86,5 г, 763 моль) протягом періоду 5 хвилин. Суміш нагрівали до 40°С і перемішували протягом 9 годин. До одержаної реакційної суміші додавали карбонат калію (79,7 г, 576 моль) і 4-хлорфенол (52,4 г, 407 моль) з подальшим перемішуванням при 70°С протягом 1 години. Після додавання толуолу (390 мл), суміш нагрівали і потім промивали водою при температурі приблизно 60°С. Реакційну суміш охолоджували льодом, і потім осаджені кристали збирали фільтрацією. Одержані кристали сушили під зниженим тиском, одержуючи 60,0 г 3-(4хлорфенокси)-2-метилпропан-1,2-діолу (вихід: 68% (на основі 4-хлорфенолу)). 1 Н-ЯМР (300 МГц, CDCl3) м. ч.: 1,29 (3H, c), 2,29 (1H, ушир.т, J=5,9 Гц), 2,74 (1H, c), 3,57 (1H, пд, J=11,1, 5,9 Гц), 6,79-6,90 (2H, м), 7,19-7,30 (2H, м). Приклад 11 Одержання 2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан1,2-діолу 23 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 Змішували 3-(4-хлорфенокси)-2-метилпропан-1,2-діол (190,7 мг, 0,88 моль), 4-[4(трифторметокси)фенокси]піперидин (208,9 мг, 0,8 моль), Pd2dba3 (1,8 мг, 0,002 моль), 2-дитрет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл (3,4 мг, 0,008 моль), трет-бутоксид натрію (76,9 мг, 0,8 моль) і толуолу (0,6 мл). Суміш перемішували в атмосфері аргону при 110°С протягом 3 годин. Підтверджували, що був одержаний 2-метил-3-(4-{4-[4(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2-діол при частоті інверсії 91% з використанням UPLC (надефективної рідинної хроматографії). Умови аналізу (UPLC): Детектор: Детектор поглинання ультрафіолетового випромінювання (довжина хвиль вимірювання: 220 нм) Колонка: ACQUITY UPLC BEH C18 (2,1 мм (внутрішній діаметр) 50 мм, 1,7 мкм), що випускається компанією WATERS Температура колонки: 50°С Рухома фаза: 0,1 M HCOONH4 вода/MeOH Умови градієнта: Відношення 0,1 M HCOONH4 вода/MeOH лінійно змінювалося від 70/30 до 20/80 за 3 хвилини. Приклад 12 Одержання солі (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діол-п-толуолсульфонової кислоти Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (20,0кг, 76,6 моль), 4-[4(трифторметокси)фенокси]піперидин (22,0 кг, 84,3 моль), тріс(дибензиліденацетон)дипаладій(0) (175 г, 0,19 моль), 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл (195 г, 0,46 моль), трет-бутоксид натрію (8,46 кг, 88,0 моль) і толуолу (240 мл) з подальшим перемішуванням в атмосфері аргону при 70°С протягом 3 годин. Після охолоджування, до реакційної суміші додавали водний розчин хлориду амонію з подальшою екстракцією толуолом. У неї вливали ізопропанол і до неї додавали моногідрат п-толуолсульфонової кислоти (16,0 кг, 84,1 моль) з подальшим перемішуванням. Одержані таким чином осаджені кристали збирали фільтрацією і сушили, одержуючи 40,3 кг солі (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діол-п-толуолсульфонової кислоти (вихід: 85,7%). Приклад 13 Одержання (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[4(трифторметокси)фенокси]піперидину Змішували сіль (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діол-п-толуолсульфонової кислоти (9 кг, 14,7 моль), простий циклопентилметиловий ефір (9 л) і триетиламін (4,2 кг, 41,1 моль). Потім до суміші по краплинах додавали метансульфонілхлорид (1,9 кг, 16,8 моль) при температурі 5°С або менше. Після завершення реакції, до суміші додавали 25% водний розчин гідроксиду натрію (9 л) з подальшим перемішуванням при температурі приблизно 40°С протягом 90 хвилин. До реакційної суміші додавали толуол і воду. Шар толуолу промивали водою і потім відганяли під зниженим тиском. До одержаного залишку додавали 70% ізопропанол (63 л) з подальшим нагріванням для розчинення залишку. Після охолоджування, осаджені кристали збирали фільтрацією і сушили, одержуючи 5,4 кг (R)-1-[4-(2,3-епокси-2-метилпропокси)феніл]-4-[4(трифторметоксифенокси]піперидину (вихід: 86,7%). Приклад 14 Одержання (R)-2-мети-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (2,0 г, 7,7 моль), 4-[4(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)дипаладій(0) (0,141 г, 0,15 моль), 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл (0,157 г, 0,37 моль), гідроксид калію (0,864 г, 15,4 моль), трибутиламін (5 мл) і ксилол (46 мл) з подальшим перемішуванням в атмосфері азоту при 80°С протягом 6 годин. З використанням ВЕРХ, було підтверджено, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діол з частотою інверсії 96%. Приклад 15 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (2,0 г, 7,7 моль), 4-[4(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)діапаладій(0) (0,141 г, 0,15 моль), 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл (0,157 г, 0,37 моль), фосфат калію (1,88 г, 8,86 моль) і толуолу (46 мл) з подальшим перемішуванням в атмосфері 24 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 азоту при 80°С протягом 21 годин. З використанням ВЕРХ було підтверджено, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2діол з частотою інверсії 52%. Приклад 16 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (2,0 г, 7,7 моль), 4-[4(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)дипаладій(0) (0,141 г, 0,15 моль), 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл (0,157 г, 0,37 моль), гідроксид натрію (0,354 г, 8,86 моль) і толуолу (46 мл) з подальшим перемішуванням в атмосфері азоту при 80°С протягом 14 годин. З використанням ВЕРХ, підтверджували, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл)фенокси)пропан-1,2діол з частотою інверсії 93%. Приклад 17 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (2,0 г, 7,7 моль), 4-[4(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)дипаладій(0) (0,141 г, 0,15 моль), 2-ди-трет-бутилфосфін-2',4',6'-триізопропіл-1,1'-біфеніл (0,637 г, 0,15 моль), карбонат цезію (2,885 г, 8,86 моль) і толуолу (46 мл) з подальшим перемішуванням в атмосфері азоту при 80°С протягом 14 годин. Використовуючи ВЕРХ, було підтверджено, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2діол з частотою інверсії 79%. Приклад 18 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (2,0 г, 7,7 моль), 4-[4(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)дипаладій(0) (0,141 г, 0,15 моль), 2-ди-трет-бутилфосфін-2'-(N,N-диметиламінобіфеніл (0,126 г, 0,37 моль), гідроксид калію (0,864 г, 15,4 моль), трибутиламін (5 мл) і ксилол (46 мл) з подальшим перемішуванням в атмосфері азоту при 80°С протягом 21 годин. З використанням ВЕРХ, було підтверджено, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діол з частотою інверсії 99%. Приклад 19 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (2,0 г, 7,7 моль), 4-[4(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)дипаладій(0) (0,141 г, 0,15 моль), 2-ди-трет-бутилфосфін-2'-(N,N-діетиламіно)біфеніл (0,126 г, 0,37 моль), гідроксид натрію (0,354 г, 8,86 моль) і толуолу (46 мл) з подальшим перемішуванням в атмосфері азоту при 80°С протягом 14 годин. Використовуючи ВЕРХ, підтверджували, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2діол з частотою інверсії 85%. Приклад 20 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (275 мг, 1,05 моль), 4-[4(трифторметокси)фенокси]піперидин (250 мг, 0,96 моль), тріс(дибензиліденацетон)дипаладій(0) (4,4 мг, 0,0048 моль), 5-(ди-трет-бутилфосфін-1'-3'-5'-трифеніл-1'H-[1,4']-біпіразол (5,8 мг, 0,011 моль), трет-бутоксид натрію (106 г, 1,10 моль) і толуолу (0,75 мл) з подальшим перемішуванням в атмосфері азоту при 100°С протягом 2 годин. Використовуючи ВЕРХ, підтверджували, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2діол з частотою інверсії 99%. Приклад 21 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (275 мг, 1,05 моль), 4-[4(трифторметокси)фенокси]піперидин (250 мг, 0,96 моль), тріс(дибензиліденацетон)дипаладій(0) (4,4 мг, 0,0048 моль), 2-(ди-трет-бутилфосфін-1-феніл-1H-пірол (3,3 мг, 0,011 моль), третбутоксид натрію (106 г, 1,10 моль) і толуолу (0,75 мл) з подальшим перемішуванням в 25 UA 108092 C2 5 10 15 20 25 30 35 40 45 50 55 60 атмосфері азоту при 100°С протягом 2 годин. Використовуючи ВЕРХ, підтверджували, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2діол з частотою інверсії 93%. Приклад 22 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (275 мг, 1,05 моль), 4-[4(трифторметокси)фенокси]піперидин (250 мг, 0,96 моль), тріс(дибензиліденацетон)дипаладій(0) (4,4 мг, 0,0048 моль), 2-(ди-трет-бутилфосфін)-1-феніл-1H-індол (3,9 мг, 0,011 моль), третбутоксид натрію (106 г, 1,10 моль) і толуолу (0,75 мл) з подальшим перемішуванням в атмосфері азоту при 100°С протягом 2 годин. Використовуючи ВЕРХ, підтверджували, що був одержаний (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2діол з частотою інверсії 89%. Приклад 23 Одержання (R)-2-метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1іл}фенокси)пропан-1,2-діолу Змішували (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (275 мг, 1,05 моль), 4-[4(трифторметокси)фенокси]піперидин (250 мг, 0,96 моль), тріс(дибензиліденацетон)дипаладій(0) (4,4 мг, 0,0048 моль), 2-(ди-трет-бутилфосфін-1,1'-бінафтил (4,6 мг, 0,011 моль), трет-бутоксид натрію (106 г, 1,10 моль) і толуолу (0,75 мл) з подальшим перемішуванням в атмосфері азоту при 100°С протягом 2 годин. Використовуючи ВЕРХ, підтверджували, що був одержаний (R)-2метил-3-(4-{4-[4-(трифторметокси)фенокси]піперидин-1-іл}фенокси)пропан-1,2-діол з частотою інверсії 96%. Приклад 24 Одержання (S)-4-(4-бромфенокси)метил-2,2,4-триметил-1,3-діоксолану (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діол (25 г, 0,1 моль) і п-толуолсульфонову кислоту (0,91 г, 4,8 моль) розчиняли в ацетоні (300 г) з подальшим перемішуванням при кип’ятінні в посудині із зворотним холодильником протягом 5,5 годин. Хід реакції контролювали TLC (тонкошаровою хроматографією). Утворювану воду видаляли азеотропічною відгонкою 300 г розчинника під атмосферним тиском і 300 г ацетону додавали у час реакції. Після завершення реакції, розчинник видаляли під зниженим тиском, і одержаний концентрований залишок розчиняли в ізопропілацетаті (250 мл). Одержаний таким чином органічний шар промивали 1M водним розчином гідроксиду натрію (100 мл). Потім, органічний шар концентрували і сушили, одержуючи 25 г (S)-4-(4-бромфенокси)метил-2,2,4-триметил-1,3-діоксолану (вихід: 82%). Приклад 25 Одержання (S)-4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3-діоксолан-4іл)метокси]феніл}піперидину Змішували (S)-4-(4-бромфенокси)метил-2,2,4-триметил-1,3-діоксолану (2,32 г, 7,7 моль), 4[4-(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)дипаладій(0) (0,141 г, 0,15 моль), 2-дициклогексилфосфін-2'-(N,N-диметиламіно)біфеніл (0,145 г, 0,37 моль), гідроксид калію (0,864 г, 15,4 моль), трибутиламін (5 мл) і ксилол (46 мл) з подальшим перемішуванням в атмосфері азоту при 80°С протягом 8 годин. При використанні ВЕРХ, було підтверджено, що був одержаний (S)-4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3діоксолан-4-іл)метокси]феніл}піперидин з частотою інверсії 99%. Приклад 26 Одержання (S)-4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3-діоксолан-4іл)метокси]феніл}піперидину Змішували (S)-4-((4-бромфенокси)метил)-2,2,4-триметил-1,3-діоксолан (2,32 г, 7,7 моль), 4[4-(трифторметокси)фенокси]піперидин (2,0 г, 7,7 моль), тріс(дибензиліденацетон)дипаладій(0) (0,141 г, 0,15 моль), 2-дициклогексилфосфін-1,1'-біфеніл (0,130 г, 0,37 моль), гідроксид калію (0,864 г, 15,4 моль), трибутиламін (5 мл) і ксилол (46 мл) з подальшим перемішуванням в атмосфері азоту при 80°С протягом 8 годин. При використанні ВЕРХ, було підтверджено, що одержаний (S)-4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3-діоксолан-4іл)метокси]феніл}піперидин з частотою інверсії 99%. Приклад 27 Одержання (S)-4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3-діоксолан-4іл)метокси]феніл}піперидину Змішували (S)-4-((4-бромфенокси)метил)-2,2,4-триметил-1,3-діоксолан (287 мг, 1 моль), 4-[4(трифторметокси)фенокси]піперидин (261 мг, 1 моль), ацетат паладію(II) (2,2 мг, 0,01 моль), 2дициклогексилфосфін-2',6'-диметокси-1,1'-біфеніл (12,3 мг, 0,03 моль), трет-бутоксид натрію 26 UA 108092 C2 5 10 15 20 25 30 (106 мг, 1,1 моль) і толуолу (1,3 мл) з подальшим перемішуванням при кип’ятінні в посудині із зворотним холодильником в атмосфері азоту протягом 8 годин. При використанні ЯМР, було підтверджено, що одержаний (S)-4-[4-(трифторметокси)фенокси]-1-{4-[(2,2,4-триметил-1,3діоксолан-4-іл)метокси]феніл}піперидин з частотою інверсії 99% або більше. Приклад 28 Одержання (R)-3-(4-бромфенокси)-2-метилпропан-1,2-діолу Суміш -металілового спирту (90,0 г, 1,25 моль), D-(-)-діізопропілтартрату (17,5 г, 74,8 моль), молекулярних сит 4A (45,0 г) і дегідрованого толуолу (450 мл) перемішували в атмосфері азоту при -20°C. До неї додавали тетраізопропоксид титану (17,7 г, 62,4 моль) протягом періоду 5 хвилин з подальшим перемішуванням протягом 0,5 години. Потім до неї по краплинах додавали 80% кумену гідропероксиду (309 г, 1,62 моль) при температурі від -20 до -15°С протягом періоду 2 годин, з подальшим перемішуванням при -10°С протягом 3 годин. До суміші по краплинах додавали диметилсульфоксид (59,2 г, 748 моль) при температурі від 20 до 35°С а протягом періоду 0,5 години. Одержану суміш перемішували при 30-40°С протягом 3 годин. Суміші давали можливість охолодитися і потім відстоятися протягом ночі. Після додавання целіту (18 г), суміш піддавали фільтрації, одержуючи розчин (S)-2-метилгліцидилового спирту в толуолі. До одержаного таким чином розчину в толуолі додавали 4-бромфенол (127 г, 734 моль) і 10% водний розчин гідроксиду натрію (176 г, 440 моль) з подальшим перемішуванням при 55°С протягом 5 годин. Суміші давали можливість охолодитися і потім відстоятися протягом ночі. Після охолоджування суміші до 12°С, до неї додавали 10% розбавлену сірчану кислоту (2,17 н, 423 мл) з подальшим перемішуванням протягом 0,2 години. Шар толуолу відділяли і потім промивали 5% водним розчином гідроксиду натрію (178 мл), 5% сольовим розчином (128 мл, 3 рази) і водою (128 мл, двічі). Потім, толуол і куміловий спирт (куміловий спирт: Bp від 60 до 65°С/2 мм рт. ст.) видаляли з органічного шару відгонкою під зниженим тиском. Залишок охолоджували до 70°С і до нього додавали толуол (191 мл). Одержану суміш охолоджували до 5°С. Осаджені кристали збирали фільтрацією і потім промивали охолодженим толуолом (95 мл). Одержані таким чином кристали сушили повітродувкою, одержуючи 154,0 г (R)-3-(4бромфенокси)-2-метилпропан-1,2-діолу (вихід: 80,3%, на основі 4-бромфенолу). Оптична чистота: 88,6% е.і. Точка плавлення: 87-89°С. ФОРМУЛА ВИНАХОДУ 1. Сполука, представлена формулою (11): HO X 35 40 45 50 R 1 3 (CH2)n O R 2 , (11) 1 де R представляє атом водню або нижчу алкільну групу; 2 R представляє 1-піперидильну групу, заміщену в положенні 4 замісником, вибраним з (A1a) феноксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном групами нижчого алкокси, (A1b) заміщеної феноксигрупи нижчого алкілу, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкільними групами, (А1с) заміщеної фенілом нижчої алкокси нижчої алкільної групи, заміщеної на фенільній частині галогеном, (A1d) заміщеної фенілом нижчої алкільної групи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами, (A1e) аміногрупи, заміщеної фенільною групою, заміщеною однією або більше заміщеними галогеном нижчими алкоксигрупами, і нижчою алкільною групою, і (A1f) заміщеної фенілом нижчої алкоксигрупи, заміщеної на фенільній частині однією або більше заміщеними галогеном нижчими алкоксигрупами; і n представляє ціле число від 1 до 6; і 3 X представляє органічну сульфонілоксигрупу. 2. Спосіб одержання сполуки за п. 1, в якому піддають взаємодії сполуку, представлену формулою (10): 27 UA 108092 C2 HO R HO 1 (CH2)n O R 2 , (10) 1 2 де R , R і n представляють те ж, що в п. 1, з органічною сульфоновою кислотою. 3. Сполука, представлена формулою (10): HO R HO 5 (CH2)n R HO 15 O R 2 , (10) 1 2 де R , R і n представляють те ж, що в п. 1. 4. Спосіб одержання сполуки за п. 3, в якому піддають взаємодії сполуку, представлену формулою (9): HO 10 1 1 (CH2)n O X 1 , (9) 1 1 де X представляє відхідну групу, і R і n представляють те ж, що в п. 1, із сполукою, представленою формулою (2): 2 Н―R , (2) 2 де R представляє те ж, що в п. 1. 5. Спосіб одержання сполуки за п. 3, в якому піддають взаємодії сполуку, представлену формулою (9): HO R HO 1 (CH2)n O X 1 , (9) 1 1 де X представляє відхідну групу, і R і n представляють те ж, що в п. 1, із сполукою, представленою формулою (9-і): RA C RB O 20 , (9-і) де R представляє нижчу алкільну групу або фенільну групу, яка може мати замісник або B A B замісники; і R представляє атом водню або нижчу алкільну групу, R і R можуть утворювати циклоалкільне кільце разом з атомом вуглецю, з яким вони зв'язані, з одержанням сполуки, представленої формулою (9-іі): A RB O RA O 25 30 R 1 (CH2)n O X 1 , (9-ii) 1 1 A B де R , X , n, R і R представляють те ж, що вказано вище, сполуку, представлену формулою (9-іі), піддають взаємодії із сполукою, представленою формулою (2): 2 Н―R , (2) 2 де R представляє те ж, що в п. 1, з одержанням сполуки, представленої формулою (9-ііі): 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthetic intermediate of oxazole compound and method for producing the same
Автори англійськоюYamamoto, Akihiro, Shinhama, Koichi, Fujita, Nobuhisa, Aki, Shinji, Ogasawara, Shin, Utsumi, Naoto
Автори російськоюЯмамото Акихиро, Синхама Коити, Фудзита Нобухиса, Аки Синдзи, Огасавара Син, Уцуми Наото
МПК / Мітки
МПК: C07D 498/04, C07D 211/46, C07D 405/12
Мітки: проміжна, синтетична, сполука, похідного, оксазолу, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/32-108092-sintetichna-promizhna-spoluka-pokhidnogo-oksazolu-i-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Синтетична проміжна сполука похідного оксазолу і спосіб її одержання</a>
Попередній патент: Сталь, плоский сталевий продукт, сталевий конструктивний елемент і спосіб виготовлення сталевого конструктивного елемента
Наступний патент: Загороджувальний бар’єр для залізничних переїздів
Випадковий патент: Паропроникна туфля