Спосіб одержання анілінових сполук, проміжна сполука та її застосування
Формула / Реферат
1. Спосіб одержання анілінової похідної формули
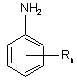 , I
, I
в якій
n означає ціле число від 1 до 5, а
R означає водневий атом, алкіл, гідроксіалкіл, алкіламіно-, діалкіламіногрупу, алкеніл, алкініл, алкокси, алкілтіо, феніл, нафтил, фенокси, фенілтіо, атом галогену, гідроксил, меркаптогрупу, карбоксил, сульфо-, нітро-, нітрозо-, гідроксиламіногрупу або гетероцикліл, або,
якщо n означає число більше 1, то два розташовані поруч один з одним залишки R можуть разом також означати кільце,
реакцією нітросполуки формули
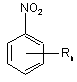 , II
, II
у якій n і R мають такі ж значення, як вказані вище, з гідразином при підвищеній температурі в середовищі розчинника, при здійсненні якого як розчинник використовують водну основу.
2. Сполука 3-метил-7-нітро-3Н-ізобензофуран-1-он.
3. Застосування 3-метил-7-нітро-3Н-ізобензофуран-1-ону при приготуванні гербіциду ізобензофуранонового типу.
Текст
1. Спосіб одержання анілінової похідної формули 2 3 75598 4 кси, алкілтіо, феніл, нафтил, фенокси, фенілтіо, чені ізомери. Поняття "гідроксил (-ОН)", "меркаптоатом галогену, аміногрупу, гідроксил, меркаптог(-SH)", "сульфогрупа (-SO3H)" і "карбоксил (рупу, карбоксил, сульфо-, нітро-, нітрозо-, гідрокСО2Н)" у кожному випадку поширюються також на силаміногрупу або гетероцикліл, їх сольові форми, наприклад на залишки солей реакцією нітросполук формули лужних металів, лужноземельних металів і амонію. Термін "гетероцикліл" у кращому варіанті розуміють як такий, що означає насичене або ненасичене кільце, яке включає від 4 до 8 членів, що містить принаймні один гетероатом, вибраний з атомів азоту, сірки і кисню. Його прикладами слуу якій n і R мають такі ж значення, як вказані, з жать піридил, фураніл, тіофураніл, оксетаніл, тіагідразином при підвищеній температурі в середозиніл, морфолініл, піперазиніл, піридазиніл, піравищі розчинника і виділенням сполук формули І, зиніл, тіопіраніл, піразоліл, піримідиніл, тіазиніл, при здійсненні якого як розчинник використовують ізофураніл, піраніл, піперидил, піколініл, тіадіазоводну основу. лініл, тієтаніл, триазоліл, оксазоланіл, тіоланіл, Для сполук формули І кращим значенням n є азепініл, тіазоліл, ізотіазоліл, імідазоліл і піроліл. ціле число від 1 до 3, а переважним значенням n є Гідразин може бути використаний як такий 2. Було встановлено, що особливо прийнятні й або, що переважно, у формі його гідрату. Перевагу особливу цінність представляють ті сполуки форвіддають застосуванню від 1,4 до 3 молів, перевамули І, які містять карбоксильні або сульфогрупи жно від 1,6 до 2 молів, гідразинової сполуки на або залишки їх солей. Особливо ефективною вимоль нітросполуки. явилася, зокрема, сполука формули І, яка містить У кращому варіанті вираз "підвищена темпекарбоксильну групу в орто-положенні і гідроксіалратура" означає температурний інтервал від 30 до кільну групу, особливо групу СН3СН(ОН), у мета150°С. Особливо переважно здійснювати процес в положенні (3-є положення). Нітросполука формули інтервалі від 70 до 100°С, оскільки для підтриманII, що відповідає цій сполуці, знаходиться у водноня реакційних температур понад 100°С потрібно му розчині в залежній від рН гідролітичній рівновастворення підвищеного тиску. зі з відповідною циклічною, лактоновою формою 3Придатною водною основою є переважно водметил-7-нітро-3Н-ізобензофуран-1-ону. Ця останний розчин гідроксиду лужного металу, гідроксиду ня сполука, яка може бути також отримана, наприлужноземельного металу, карбонату лужного меклад, відновленням 2-нітро-6-ацетилбензойної талу або карбонату лужноземельного металу. кислоти, відомої з [робіт Horii і ін., Yakugaku Прийнятні також органічні аміни, наприклад алкіZasshi, 1954, 466, і Baker і ін. J.Org.Chem. 1952, 17 лендіаміни, уротропін і хінуклідин. Перевагу від164], з використанням боргідриду натрію, є новою, дають використанню від 0,5 до 5 молів, переважно тому вона також складає об'єкт даного винаходу. від 1 до 2 молів, основи на моль нітросполуки. Цю сполуку також можна ефективно використовуЯкщо нітросполука формули II як замісники уже вати при приготуванні гербіцидів ізобензофураномістить кислотні групи, на кожну кислотну групу нового типу. потрібно додатковий моль основи. Звичайно сполуки формул І і II, які містять Основна перевага способу відповідно до виприлеглі один до одного замісники, здатні разом находу полягає в тому, що його можна здійснюваутворювати (при об'єднанні) кільце, наприклад ти у великому, промисловому масштабі. Звичайно карбоксильна група в орто-положенні і гідроксіалпроцес здійснюють введенням сполуки формули II кільна група в мета-положенні, знаходяться у воду воду і додаванням основи. Після нагрівання ному розчині в залежній від рН рівновазі з відповіутвореної суміші до необхідної реакційної темпедною циклічною формою, наприклад з лактоновою ратури в неї дозують гідразин або гідразингідрат. формою, 5-членною кільцевою лактоновою форСпосіб відповідно до винаходу можна здійснюмою, зокрема у вигляді 7-аміно-3-метил-3Нвати проведенням або безперервного, або переізобензофуран-1-ону, особливо легко утворюються ривчастого (небезперервного, періодичного) пров кислому розчині. Як правило із збільшенням роцесу, причому перевагу віддають переривчастому зміру кільця тенденція до утворення циклів послапроцесу. У кращому варіанті як переривчастий, так блюється, причому 6- і 7-членні кільця звичайно і безперервний реакційні процеси проводять у поутворюються менш легко, ніж 5-членні кільця. судині змішування або в каскаді посудин змішуТаким чином, спосіб відповідно до винаходу вання. охоплює також одержання сполук формули І тих Процес виділення анілінових похідних залециклічних форм, у яких два замісники R мають жить від будови і природи конкретної сполуки, його утворене при об'єднанні кільце. проводять, коли це доречно, після підкислення Кращі алкільні радикали, наведені як значення реакційної суміші додаванням, наприклад, соляної R, містять від 1 до 4 вуглецевих атомів кожний; кислоти до рН в інтервалі від 1 до 9, переважно від ними є, наприклад, метил, етил, пропіл, бутил і їх 5 до 8, шляхом або кристалізації, або, якщо при розгалужені ізомери. Кращі алкокси, алкілтіо- і кімнатній температурі продуктом є рідина, екстрагідроксіалкільні радикали дериватизують із згадакції органічним розчинником, наприклад толуолом. них алкільних радикалів. Кращі алкенільні й алкініЗвичайно вихід виділеного анілінового похідльні радикали R містять від 2 до 4 вуглецевих ного знаходиться в інтервалі від 80 до 100%. Хіміатомів кожний; ними є, наприклад, етеніл, пропечний вихід у реакційній суміші звичайно перевищує ніл, етиніл, пропініл, і їх розгалужені ізомери, а 97%. також бутеніл, бутиніл і їх розгалужені і диненасиПеред відомим у даній галузі техніки способом 5 75598 6 запропонований відповідно до винаходу спосіб гідроксіетил)бензойної кислоти (натрієва сіль, має наступні переваги: 1моль) при температурі від 0 до 3°С діазотують у його можна здійснювати у великому, промис3,75моля соляної кислоти (32%-на) з використанловому масштабі, ням 1,05моля розчину нітриту натрію (40%-ний). перебіг реакції можна значною мірою регулюПотім цей розчин діазопродукту з перемішуванням вати шляхом дозованого додавання, що з погляду при 50°С впродовж 60хв дозують у суміш 500мл безпеки є перевагою, води, 666г розчину гідроксиду натрію (30%-ний, на відміну від процесу в етанолі як розчиннику 5молів) і 176г етилксантогенату калію (1,1моля). реакція відбувається швидко і дуже селективно, При 50°С з використанням 32%-ної соляної кислоколи вихідними є сполуки формули II, особлити рН реакційної суміші доводять до 3; у вигляді во ті, у яких R означає сульфо- або карбоксильну масла виділяється проміжний 7-меркапто-3-метилгрупу, або залишок відповідної солі, у формі вод3Н-ізобензофуран-1-он, який відокремлюють від ного розчину, що можливо, наприклад, у випадку водної фази. При 70°С цей проміжний продукт проведення безперервного процесу, ці сполуки дозують у суміш 1,0моля 2-хлор-4,6можна відновлювати безпосередньо шляхом додиметоксипіримідину з 1,05моля карбонату калію в давання основи разом з гідразином, 1600мл ацетонітрилу і перемішують протягом від 4 результатом його здійснення є продукти з видо 6год, до завершення перетворення. У реакційну ходом до 100%, суміш додають 700мл води і водний сольовий розйого можна здійснювати в багатоцільовому чин виділяють з органічної фази, що містить 7апараті. [(4,6-диметоксипіримідин-2-іл)тіол]-3Анілінові похідні формули І, отримані відповідметилфталіду. В органічну фазу додають 700мл но до винаходу, використовують, зокрема, як проводи і суміш охолоджують до кімнатної температуміжні продукти при приготуванні гербіцидів ізобенри. 7-[(4,6-диметоксипіримідин-2-іл)тіол]-3-метилзофуранонового типу. 3Н-ізобензофуран-1-он, що випадає в осад у крисВинахід додатково проілюстрований наступталічній формі, відфільтровують і промивають ними прикладами. 300мл ізопропанолу. Після сушіння під вакуумом Приклад 1. Одержання 2-аміно-6-(1при 70°С 7-[(4,6-диметоксипіримідин-2-іл)тіол]-3гідроксіетил)бензойної кислоти (натрієва сіль) метил-3Н-ізобензофуран-1-он одержують з вихо0,75моля водного розчину гідроксиду натрію дом 70% від теоретичного в перерахунку на натрі(30%-ний) вводять у водний розчин 0,5моля 2єву сіль 2-аміно-6-(1-гідроксіетил)бензойної кислонітро-6-(1-гідроксіетил)бензойної кислоти (натрієва ти при ступені чистоти 98% (за методом РХ). сіль) і при температурі від 90 до 95°С впродовж Приклад 4. Одержання 3-метил-7-нітро-3Н1год дозують 50г гідразингідрату (1,0моля). При ізобензофуран-1-ону температурі від 90 до 95°С перемішування здійс10,0г (48ммолів) 2-нітро-6-ацетилбензойної нюють протягом від 4 до 6год, до повного переткислоти [див. роботи Horii і ін., Yakugaku Zasshi, ворення нітросполуки, а після виділення з 97%1954, 466, і Baker і ін., J.Org.Chem. 1952, 17, 164] ним виходом від теоретичного в перерахунку на 2при 40°С розчиняють у 50мл 2н. розчину гідроксиацетил-6-нітробензойну кислоту (РХ аналіз) одерду натрію й обробляють додаванням порціями жують 2-аміно-6-(1-гідроксіетил)бензойну кислоту. 1,87г (48ммолів) боргідриду натрію. Через 40хв Приклад 2. Одержання 2-аміно-4реакційну суміш, яку попередньо охолоджують, хлорбензойної кислоти підкисляють, а кристали, які випадають в осад, У 1-літрову тефлонову посудину з мішалкою відфільтровуть і сушать під вакуумом. Продукт вводять 201,5г 4-хлор-2-нітробензойної кислоти включає 8,4г утвореної суміші 82% 2-нітро-6-(1(1моль) у 500мл води і при перемішуванні дозують гідроксіетил)бензойної кислоти; 1Н-ЯМР (ДМСО3моля водного розчину гідроксиду натрію (30%О6): 8,00част./млн, m, 2H; 7,68част./млн, t, 1H; ний). Реакційну суміш нагрівають і при температурі 5,6част./млн, b, ОН; 4,92част./млн, q, 1H; від 90 до 95°С впродовж 60хв дозують 100г гідра1,32част./млн, d, 3H; і 18% 3-метил-7-нітро-3Н1 зингідрату (2моля). Перемішування здійснюють ізобензофуран-1-ону; H-ЯМР (ДМСО-D6): протягом від 3 до 4год, до повного перетворення 8,02част./млн, m, 2H; 7,68част./млн, t, 1H; 4-хлор-2-нітробензойної кислоти в 2-аміно-45,80част./млн, q, 1H; 1,62част./млн, d, 3H. Потім хлорбензойну кислоту. Потім з використанням сокислу водну фазу також екстрагують етилацеталяної кислоти (32%-на) рН реакційної суміші довотом, об'єднують з отриманими за вищевикладеним дять до 6, осаджуючи в кристалічній формі амінокристалами, ретельно сушать над сульфатом магбензойну кислоту. Суспензію кристалів нію і випарюванням концентрують до повного виохолоджують до кімнатної температури, фільтрусихання. У такий спосіб одержують 9,14г (вихід: ють, продукт промивають водою і сушать під ваку98,6%) 3-метил-7-нітрофталіду (3-метил-7-нітро1 умом. Одержують 166г 2-аміно-4-хлорбензойної 3Н-ізобензофуран-1-он); H-ЯМР (CDCl3): кислоти з 99%-ним вмістом основної речовини (за 7,92част./млн, d, 1H; 7,88част./млн, t, 1H; методом РХ), що відповідає 96%-ному виходу від 7,72част./млн, d, 1H; 5,63част./млн, q, 1Н; теоретичного в перерахунку на 4-хлор-21,72част./млн, d, 3Н. нітробензойну кислоту. Приклад 5. Одержання 7-аміно-3-метил-3НПриклад 3. Одержання 7-[(4,6ізобензофуран-1-ону диметоксипіримідин-2-іл)тіол]-3-метил-3H2,37г (12,2ммоля) 3-метил-7-нітро-3Нізобензофуран-1-ону ізобензофуран-1-ону (із Прикладу 4) витримують у У 2,5-літровій колбі для сульфанування 50%5мл 30%-ного розчину гідроксиду натрію ний водний розчин 2-аміно-6-(1(49ммолів) при 90°С впродовж 1год, до можливості 7 75598 8 продемонструвати за допомогою ТРХ (рухома фадженої реакційної суміші доводять до 2 і екстрагуза: етилацетат/гексан у співвідношенні 3:1 плюс 1 ють етилацетатом. Одержують 1,8г (вихід: 90,4%) крапля мурашиної кислоти) майже кількісне утвосирого 7-аміно-3-метил-3Н-ізобензофуран-1-ону; 1 рення 2-нітро-6-(1-гідроксіетил)бензойної кислоти. H-ЯМР (CDCl3): 7,37част./млн, t, 1H; Потім повільно, по краплях додають 1,2мл 6,63част./млн, d, 1H; 6,61част./млн, d, 1Н; (24,5ммоля) гідразингідрату і температуру підтри5,44част./млн, q, 1H; 5,22част./млн, b, 2Н; мують протягом наступних 4год. Потім рН охоло1,58част./млн, d, 3Н. Комп’ютерна верстка М. Ломалова Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of aniline compounds, intermediate compound and use thereof
Назва патенту російськоюСпособ получения анилиновых соединений, промежуточное соединение и его применение
МПК / Мітки
МПК: C07C 209/36, C07D 307/88
Мітки: спосіб, анілінових, застосування, одержання, сполук, сполука, проміжна
Код посилання
<a href="https://ua.patents.su/4-75598-sposib-oderzhannya-anilinovikh-spoluk-promizhna-spoluka-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання анілінових сполук, проміжна сполука та її застосування</a>
Попередній патент: Спосіб одержання 4-форміл-пара-терфенілу
Наступний патент: Спосіб одержання трансгенної рослини (варіанти) та її нащадків, здатних експресувати d-ендотоксини bacillus thuringiensis
Випадковий патент: Спосіб обробки отворів підшипників ковзання з високолегованих композитів для поліграфічних машин








