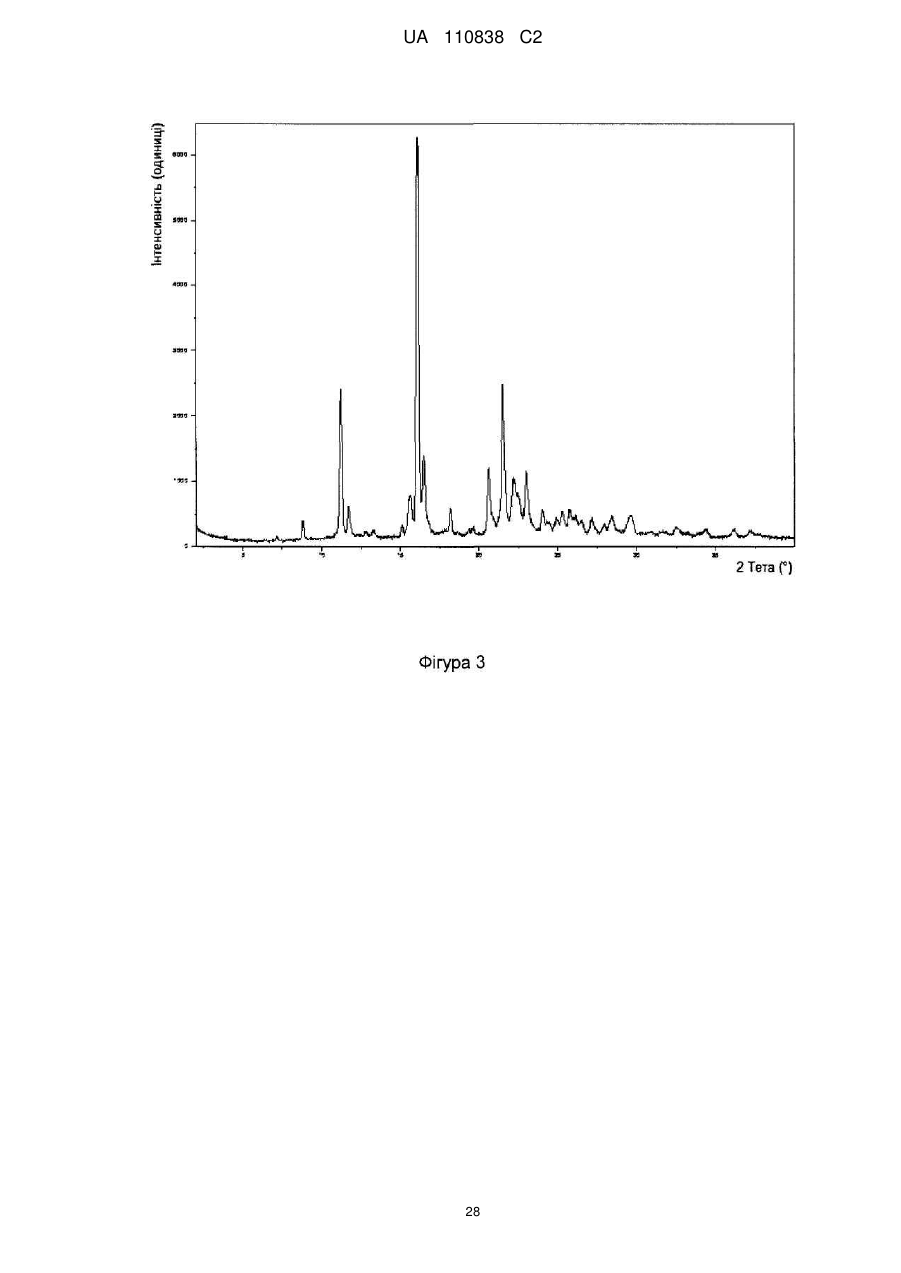
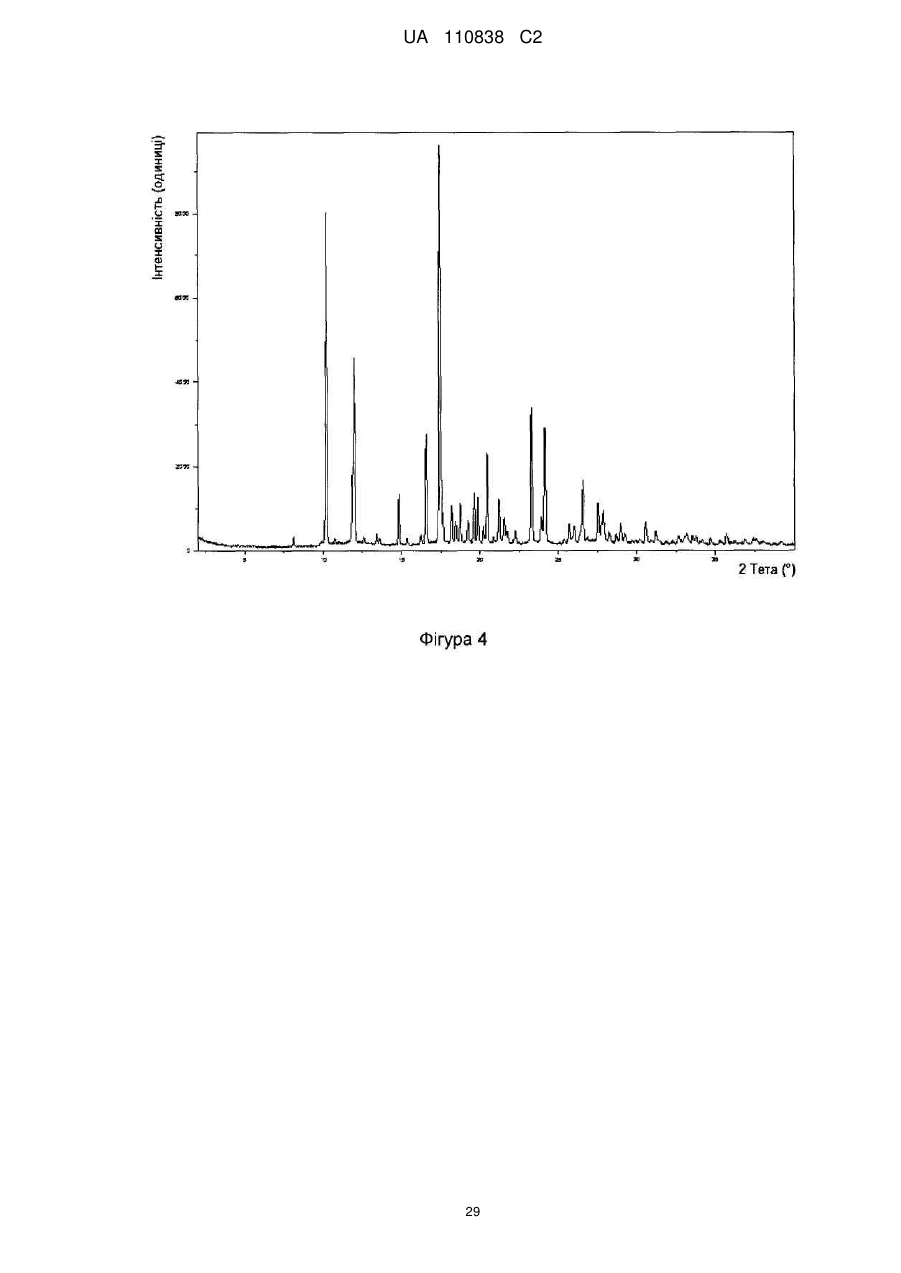
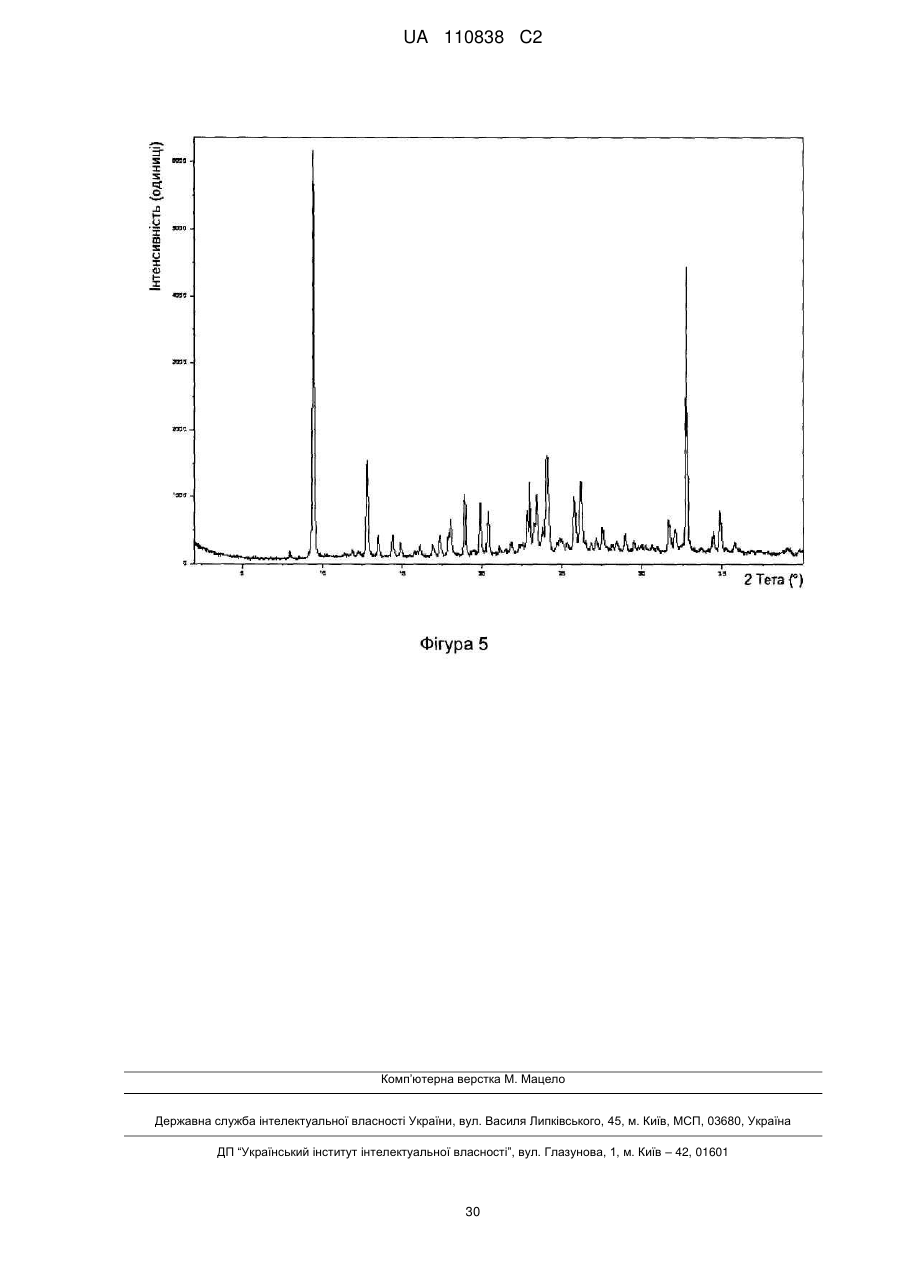
4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2н-піран-4-іл)-1н-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол та його застосування як інгібітора бромодомену
Номер патенту: 110838
Опубліковано: 25.02.2016
Автори: Джонс Кетрін Луіз, Демон Емманюель Юбер, Вотсон Роберт Дж.
Формула / Реферат
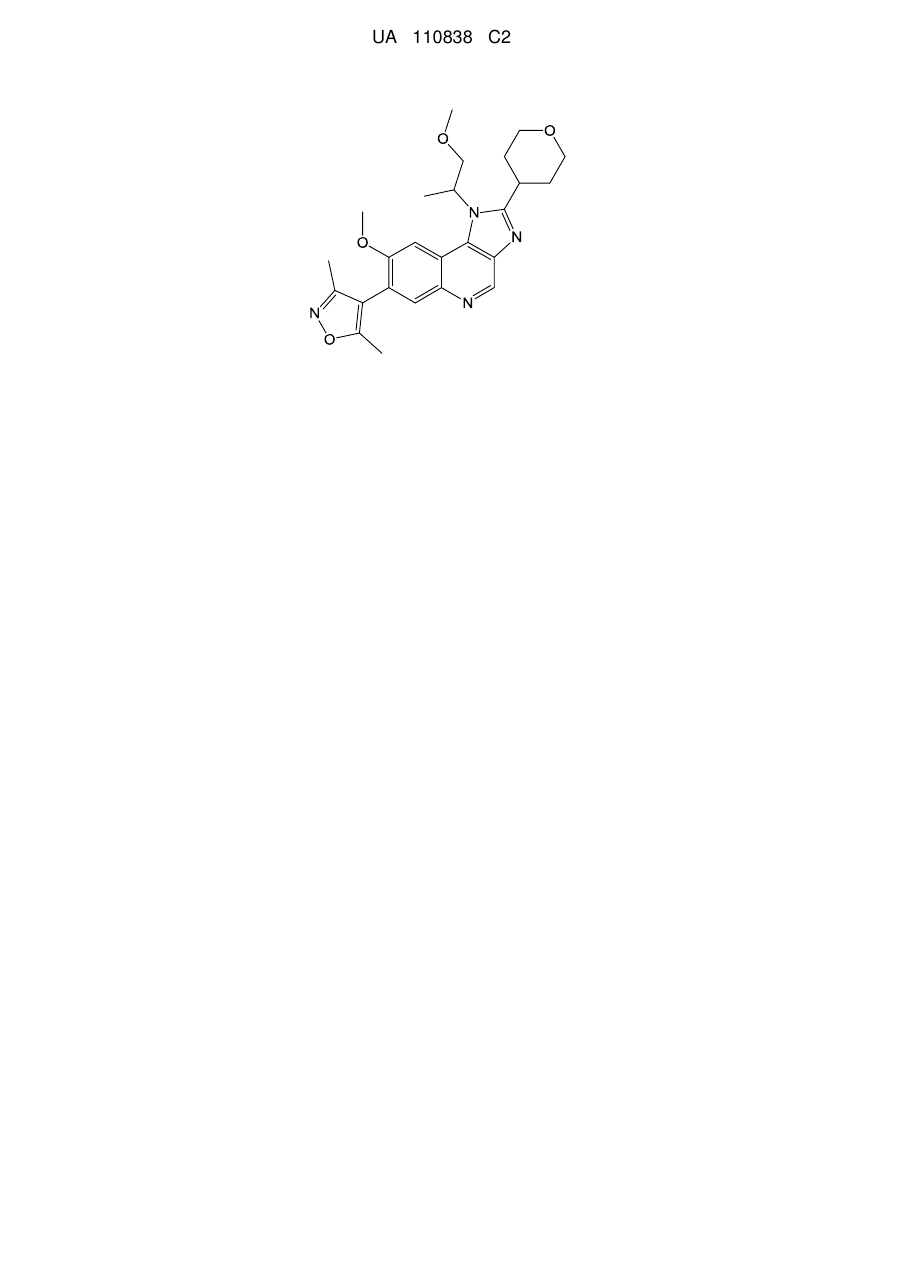
1. Сполука формули (І), яка являє собою 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2Н-піран-4-іл)-1Н-імідазо[4,5-с]хінолін-7-іл)-3,5-диметилізоксазол
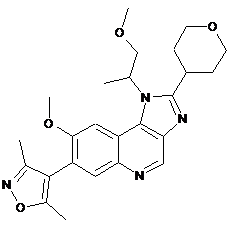 , (I)
, (I)
або її сіль.
2. Сполука формули (ІА), яка являє собою 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2Н-піран-4-іл)-1Н-імідазо[4,5-с]хінолін-7-іл)-3,5-диметилізоксазол
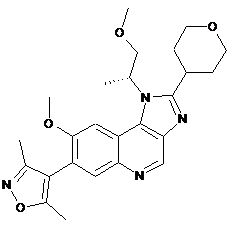 , (IA)
, (IA)
або її сіль.
3. Сполука формули (IB), яка являє собою 4-(8-метокси-1-((S)-1-метоксипропан-2-іл)-2-(тетрагідро-2Н-піран-4-іл)-1Н-імідазо[4,5-с]хінолін-7-іл)-3,5-диметилізоксазол
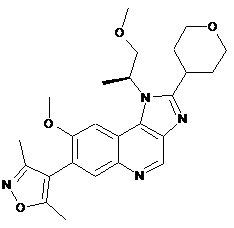 , (IB)
, (IB)
або її сіль.
4. Сполука за будь-яким одним з пунктів 1-3 або її фармацевтично прийнятна сіль.
5. Фармацевтична композиція, яка містить сполуку або її фармацевтично прийнятну сіль за пунктом 4 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів.
6. Комбінований фармацевтичний продукт, який містить сполуку або її фармацевтично прийнятну сіль за пунктом 4 разом з одним або більше інших терапевтично активних агентів.
7. Сполука або її фармацевтично прийнятна сіль за пунктом 4 для застосування в терапії.
8. Сполука або її фармацевтично прийнятна сіль за пунктом 4 для застосування в лікуванні захворювань або станів, для яких є показаним інгібітор бромодомену.
9. Сполука за пунктом 8, де захворювання або стан є хронічним аутоімунним та/або запальним станом.
10. Сполука за пунктом 8, де захворювання або стан є раком.
11. Застосування сполуки або її фармацевтично прийнятної солі за пунктом 4 у виробництві лікарського засобу для лікування захворювань або станів, для яких є показаним інгібітор бромодомену.
12. Спосіб лікування захворювання або стану, для яких є показаним інгібітор бромодомену, у суб'єкта, що цього потребує, за яким суб'єкту вводять терапевтично ефективну кількість сполуки або її фармацевтично прийнятної солі за пунктом 4.
13. Спосіб лікування за пунктом 12, де захворювання або стан є хронічним аутоімунним та/або запальним станом.
14. Спосіб лікування за пунктом 12, де захворювання або стан є раком.
15. Спосіб лікування за будь-яким одним з пунктів 12-14, в якому суб'єктом є людина.
Текст
Реферат: Нові хінолінові сполуки формули (І), фармацевтичні композиції, які містять такі сполуки, та їх застосування в терапії як інгібіторів бромодомену. UA 110838 C2 (12) UA 110838 C2 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Представлений винахід стосується нових сполук, фармацевтичних композицій, що містять такі сполуки та їх застосування в терапії. Передумови створення винаходу Геноми еукаріотичних організмів є високо організованими в ядрі клітини. Довгі нитки дуплексної ДНК обгорнуті навколо октамеру з гістонових протеїнів (де найбільше, як правило, містить дві копії гістонів H2A, H2B H3 та H4) з утворенням нуклеосоми. Дану одиницю основи потім додатково стискають за рахунок агрегації та складання нуклеосом, щоб сформувати високо конденсовану структури хроматину. Діапазон різних станів конденсації є можливим, та щільність цієї структури змінюється під час клітинного циклу, будучи найбільш компактною під час процесу клітинного поділу. Структура хроматину відіграє важливу роль у регуляції транскрипції гену, яка не може відбуватися ефективно з високо конденсованим хроматином. Структура хроматину контролюється за допомогою серії посттрансляційних модифікацій гістонових протеїнів, зокрема гістонів H3 та H4, та найбільш часто в межах гістонових кінцевих сигментів, які виходять за межі структури ядра нуклеосоми. Дані модифікації включають ацетилювання, метилювання, фосфорилювання, убіквітинилювання, сумоїлювання. Дані епігенетичні мітки є записаними та зруйнованими за допомогою специфічних ферментів, які розміщують мітки на конкретних залишках в межах гістонових кінцевих сигментів, тим самим формуючи епігенетичний код, який потім інтерпретують, застосовуючи клітину, що дозволяє гену специфічне регулювання структури хроматину і, тим самим, транскрипцію. Ацетилювання гістонів, як правило, найбільше асоціюється з активацією транскрипції гену, так як модифікація послаблює взаємодію ДНК та октамерів гістонів шляхом зміни електростатичності. На додаток до даної фізичної зміни, специфічні протеїни зв'язуються з ацетильованими залишками лізину в межах гістонів, щоб зчитувати епігенетичний код. Бромодомени є малими (~110 амінокислот) різними доменами всередині протеїнів, які зазвичай зв'язуються з ацетильованими залишками лізину, але не виключно у контексті гістонів. Існує родина з близько 50 протеїнів, які відомі як такі, що містять бромодомени, та у них є ряд функцій всередині клітині. BET родина бромодомену, яка містить протеїни, складається з 4 протеїнів (BRD2, BRD3, BRD4 та BRD-t), які містять тандемні бромодомени, здатні зв'язуватися з двома ацетильованими залишками лізину в безпосередній близькості, збільшуючи специфічність взаємодії. Повідомляється, що BRD2 та BRD3 асоціюються з гістонами по всій довжині генів, що активно транскрибуються, та можуть бути залучені в полегшене транскрипційне подовження (Leroy et al, Mol. Cell. 2008 30(1):51-60), в той час як BRD4 з'являється, щоб бути включеним в рекрутинг PTEF-β комплексу до індуцибельних генів, де в результаті одержують фосфорилювання РНК-полімерази та підвищену транскрипцію на виході (Hargreaves et al, Cell, 2009 138(1): 129-145). Крім того, було повідомлено, що BRD4 або BRD3 можуть зливатися з NUT (ядерний протеїн в сім'янику), утворюючи нові злиті онкогени, BRD4-NUT або BRD3-NUT, у високо злоякісній формі епітеліальних новоутворень (French et al. Cancer Research, 2003, 63, 304-307 and French et al. Journal of Clinical Oncology, 2004, 22 (20), 4135-4139). Дані передбачають, що злиті протеїни BRD-NUT роблять внесок в канцерогенез (Oncogene, 2008, 27, 2237-2242). BRD-t єдиним чином експресуються в яєчках та яєчниках. Повідомляється, що всі члени родини мають деяку функцію в контролюванні або виконанні аспектів клітинного циклу, та було показано, що залишаються в комплексі з хромосомами під час клітинного поділу – передбачаючи роль у збереженні епігенетичної пам'яті. Крім того, деякі віруси використовують дані протеїни, щоб зв'язувати їх геноми з хроматином клітини-господаря, як частину процесу реплікації вірусу (You et al Cell, 2004 117(3):349-60). заявка на патентн Японії JP2008-156311 розкриває похідні бензімідазолу, які, як кажуть, є агентом, що зв'язує BRD2 бромодомен, який має корисність по відношенню до вірусної інфекції/проліферації. Заявка на патент WO2009/084693 A1 розкриває серію похідних тієнотриазолодіазепієну, які, як зазначається, інгібують зв'язування між ацетильованим гистоном та бромодоменом, що містить протеїн, який, як зазначається, є корисним як протираковий агент. Заявка на патент WO2011/054846 розкриває серію похідних хіноліну, які інгібують зв'язування ВЕТ родини бромодоменів з ацетильованими залишками лізину. Знайдено нові сполуки, які інгібують зв'язування бромодоменів з їх когнатними ацетильованими протеїнами, більш конкретно з класом сполук, які інгібують зв'язування BET родини бромодоменів в ацетильованими залишками лізіну. Такі сполуки надалі називатимуться "інгібіторами бромодомену". Суть винаходу 1 UA 110838 C2 В першому аспекті представленого винаходу, передбачається сполука формули (I) або її сіль, більш конкретно сполука формули (I) або її фармацевтично прийнятна сіль 5 10 15 20 25 30 35 40 (I). В другому аспекті представленого винаходу, передбачається фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятна сіль та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. В третьому аспекті представленого винаходу, передбачається сполука формули (I), або її фармацевтично прийнятна сіль для застосування в терапії, зокрема, в лікуванні захворювань або станів, для яких є показаним інгібітор бромодомену. В четвертому аспекті представленого винаходу, передбачається спосіб лікування захворювання або стану, для яких є показаним інгібітор бромодомену, у суб'єкта, що цього потребує, який включає введення терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. В п'ятому аспекті представленого винаходу, передбачається застосування сполуки формули (I), або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування захворювань або станів, для яких є показаним інгібітор бромодомену. Короткий опис креслень Фігура 1: Показує порошкову рентгенівську дифрактограму кристалічної форми 4-(8-метокси1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу (безводна форма 1). Фігура 2: Показує порошкову рентгенівську дифрактограму кристалічної форми у 4-(8метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)3,5-диметилізоксазолу (безводна форма 2). Фігура 3: Показує порошкову рентгенівську дифрактограму кристалічної форми 4-(8-метокси1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу (безводна форма 3). Фігура 4: Показує порошкову рентгенівську дифрактограму кристалічної форми 4-(8-метокси1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу (гідрат). Фігура 5: Показує порошкову рентгенівську дифрактограму кристалічної форми 4-(8-метокси1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу гідрохлориду (гідрохлорид). Детальний опис винаходу Представлений винахід стосується сполуки формули (I), яка є 4-(8-метокси-1-(1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолом (I) або її сіллю. 2 UA 110838 C2 5 10 15 Сполука формули (I) містить хіральний атом такий, що оптичні ізомери, наприклад, енантіомери можуть утворюватися. Відповідно, представлений винахід охоплює всі ізомери сполуки формули (I), які виділяють або у вигляді індивідуальних ізомерів, таких як по суті вільних від іншого ізомеру (тобто, чисті), або у вигляді сумішей (тобто, рацемати та рацемічні суміші). Індивідуальний ізомер, виділений таким чином, щоб бути по суті вільним від іншого ізомеру (тобто, чистий), можуть виділяти так, що присутнім є менше, ніж 10 %, зокрема, менше, ніж приблизно 1 %, наприклад, менше, ніж близько 0,1 % іншого ізомеру. Розділення ізомерів може бути досягнуто, використовуючи традиційні способи, відомі кваліфікованому фахівцю в даній галузі з рівня техніки, наприклад, використовуючи фракційну кристалізацію, хроматографію або ВЕРХ. В одному втіленні передбачається сполука формули (IA), яка є 4-(8-метокси-1-((R)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолом (IA) або його сіллю. В наступному втіленні передбачається сполука формули (IB), яка є 4-(8-метокси-1-((S)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолом 20 25 30 35 40 (IB) або його сіллю. Слід прийняти до уваги, що сполуки формули (IA) та формули (Ib), входять в обсяг сполуки формули (I). Як використовується в даному документі, якщо не вказано інше, то посилання на сполуку формули (I) також включає посилання на сполуку формули (IA) і сполуку формули (IВ). Слід прийняти до уваги, що представлений винахід охоплює сполуки формули (I) у вигляді вільної основи та у вигляді їх солей, наприклад, у вигляді фармацевтично прийнятної солі. В одному втіленні винахід стосується сполуки формули (I) у формі вільної основи. В одному втіленні винахід стосується сполуки формули (I) або її фармацевтично прийнятної солі. Завдяки їх потенційно можливому застосуванню в медицині солі сполук формули (I) є переважно фармацевтично прийнятними. Відповідні фармацевтично прийнятні солі можуть включати кислотно-адитивні солі. Для огляду відповідних фармацевтично прийнятних солей, дивись, Berge et al., J. Pharm. Sci., 66:1-19, (1977). Як правило, фармацевтично прийнятна сіль можуть бути легко отримана шляхом використання бажаної кислоти або основи в залежності від обставин. Отриману в результаті сіль можна осадити з розчину та зібрати фільтруванням або можна виділити шляхом випарювання розчинника. Фармацевтично прийнятна кислотно-адитивна сіль може утворюватися за реакцією сполуки формули (I) з відповідною неорганічною або органічною кислотою (такою як, гідробромідна, гідрохлоридна, сульфатна, нітратна, фосфорна, бурштинова, малеїнова, оцтова, пропіонова, фумарова, лимонна, винна, молочна, бензойна, саліцилова, глутамінова, аспарагінова, птолуолсульфонова, бензолсульфонова, метансульфонова, етансульфонова, нафталінсульфонова, така як 2-нафталінсульфонова, або гексанова кислота), необов'язково в 3 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятному розчиннику, такому як органічний розчинник, щоб одержати сіль, яку зазвичай виділяють, наприклад, шляхом кристалізації та фільтрації, або шляхом випарювання з наступним розтиранням. Фармацевтично прийнятна кислотно-адитивна сіль сполуки формули (I) може містити або бути, наприклад, гідробромідом, гідрохлоридом, сульфатом, нітратом, фосфатом, сукцинатом, малеатом, ацетатом, пропіонатом, фумаратом, цитратом, тартратом, лактатом, бензоатом, саліцилатом, глутаматом, аспартатом, п-толуолсульфонатом, бензолсульфонатом, метансульфонатом, етансульфонатом, нафталінсульфонатом (наприклад, 2-нафталінсульфонатом) або гексаноатом. В конкретному втіленні фармацевтично прийнятна кислотно-адитивна сіль сполуки формули (I) може містити або бути гідрохлоридною, сульфатною, малеатною, фумаратною, цитратною, п-толуолсульфонатною, бензолсульфонатною або метансульфонатною сіллю. У конкретному втіленні передбачається сполука формули (IA) у вигляді гідрохлоридної солі. Інші нефармацевтично прийнятні солі, наприклад форміати, оксалати або трифлуорацетати, можуть бути використані, наприклад, при виділенні сполук формули (I), та є включеними в обсяг даного винаходу. Винахід включає в свій обсяг всі можливі стехіометричні та нестехіометричні форми солей сполук формули (I). Слід прийняти до уваги, що багато органічних сполук можуть утворювати комплекси з розчинниками, в яких вони взаємодіють або з яких вони осаджуються або кристалізуються. Дані комплекси відомі як "сольвати". Наприклад, комплекс з водою відомий як "гідрат". Розчинники з високими температурами кипіння та/або здатні утворювати водневі зв'язки, такі як вода, ксилол, N-метілпіролідинон, метанол та етанол можуть бути використані для утворення сольватів. Способи ідентифікації сольватів включають, але не обмежуються цим, ЯМР та мікроаналіз. Сольвати сполук формули (I) є включеними в обсяг винаходу. Винахід включає в свій обсяг всі можливі стехіометричні і нестехіометричні форми сольватів сполук формули (I). Винахід охоплює всі проліки сполуки формули (I) або її фармацевтично прийнятної солі, які при введенні реципієнту здатні давати (безпосередньо чи опосередковано) сполуку формули (I) або її фармацевтично прийнятну сіль, або її активний метаболіт або її залишок. Такі похідні впізнаються кваліфікованим фахівцем в даній галузі, без зайвого експериментування. Однак, th посилання роблять на вчення Burger's Medicinal Chemistry and Drug Discovery, 5 Edition, Vol 1: Principles and Practice, яка включена в даному документі як посилання до ступеню вивчення таких похідних. Сполуки формули (I) можуть знаходитись в кристалічній або аморфній формі. Крім того, деякі з кристалічних форм сполук формули (I) можуть існувати як поліморфи, які включені в обсяг представленого винаходу. Поліморфні форми сполук формули (I) можуть бути охарактеризовані та диференційовані, використовуючи ряд звичайних аналітичних способів, включаючи, але не обмежуючись цим, рентгенівські порошкові дифрактограми (XRPD), інфрачервоні (ІЧ) спектри, спектри комбінаційного розсіювання, диференціальну скануючу калориметрію (ДСК), термогравіметричний аналіз (ТГА) та твердотільний ядерний магнітний резонанс (ТТ-ЯМР). Встановлено, що сполука формули (IA), тобто 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол, у вигляді вільної основи існує в кількох різних кристалічних формах, а саме, безводних формах 1, 2 і 3 та гідратованій формі 1. Такі кристалічні форми можуть бути отримані, використовуючи способи, описані в даному документі. Таким чином, в одному втіленні, передбачається кристалічна форма 4-(8-метокси-1-((R)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу (безводна форма 1), яка характеризується, головним чином, порошковою рентгенівською дифрактограмою (XRPD), як показано на фігурі 1, де порошкова рентгенівська дифрактограма виражена в значеннях кутів 2-тета та отримана на дифрактометрі з використанням мідного Kα-випромінювання використовуючи спосіб, описаний в даному документі. Порошкова рентгенівська дифрактограма безводної форми 1 показує характеристичні піки кутів 2-тета, як зазначено в таблиці 1 прикладу 9. В наступному втіленні, передбачається кристалічна форма 4-(8-метокси-1-((R)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу (безводна форма 2), яка характеризується, головним чином, порошковою рентгенівською дифрактограмою (XRPD), як показано на фігурі 2, де порошкова рентгенівська дифрактограма виражена в значеннях кутів 2-тета та отримана на дифрактометрі з використанням мідного Kα-випромінювання, використовуючи спосіб, описаний в даному 4 UA 110838 C2 5 10 15 20 25 30 35 40 документі. Порошкова рентгенівська дифрактограма безводної форми 2 показує характеристичні піки кутів 2-тета, як зазначено в таблиці 1 прикладу 9. В наступному втіленні, передбачається кристалічна форма 4-(8-метокси-1-((R)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу (безводна форма 3), яка характеризується, головним чином, порошковою рентгенівською дифрактограмою (XRPD), як показано на фігурі 3, де порошкова рентгенівська дифрактограма виражена в значеннях кутів 2-тета та отримана на дифрактометрі з використанням мідного Kα-випромінювання, використовуючи спосіб, описаний в даному документі. Порошкова рентгенівська дифрактограма безводної форми 3 показує характеристичні піки кутів 2-тета, як зазначено в таблиці 1 прикладу 9. В наступному втіленні, передбачається кристалічна форма 4-(8-метокси-1-((R)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу (гідрат), яка характеризується, головним чином, порошковою рентгенівською дифрактограмою (XRPD), як показано на фігурі 4, де порошкова рентгенівська дифрактограма виражена в значеннях кутів 2-тета та отримана на дифрактометрі з використанням мідного Kαвипромінювання, використовуючи спосіб, описаний в даному документі. Порошкова рентгенівська дифрактограма гідрату показує характеристичні піки кутів 2-тета, як зазначено в таблиці 1 прикладу 9. Крім того, винахід передбачає сполуку формули (IA), тобто 4-(8-метокси-1-((R)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу гідрохлорид в кристалічній формі. Така кристалічна форма може бути отримана, використовуючи способи, описані в даному документі. В наступному втіленні, передбачається кристалічна форма 4-(8-метокси-1-((R)-1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазолу гідрохлориду (гідрохлоридна форма 1), яка характеризується, головним чином, порошковою рентгенівською дифрактограмою (XRPD), як показано на фігурі 5, де порошкова рентгенівська дифрактограма виражена в значеннях кутів 2-тета та отримана на дифрактометрі з використанням мідного Kα-випромінювання, використовуючи способи, описані в даному документі. Порошкова рентгенівська дифрактограма даної форми показує характеристичні піки кутів 2-тета, як зазначено в таблиці 1 прикладу 9. З зазаначеного вище слід прийняти до уваги, що включеними в обсяг винаходу є сольвати, ізомери та поліморфні форми сполук формули (I) та їх солей. Сполуки формули (I) або їх солі можуть бути отримані різними способами, в тому числі стандартної хімії. Ілюстративні загальні способи синтезу, викладені нижче, та потім в прикладах отримують конкретні сполуки формули (I) та їх фармацевтично прийнятні солі. Сполуку формули (I) можуть отримувати зі сполуки формули (II), наприклад, шляхом нагрівання сполуки формули (II) в оцтовій кислоті або з п-толуолсульфоновою кислотою в толуолі (II). Сполука формули (II) можуть отримувати за реакцією сполуки формули (III) (III) 5 UA 110838 C2 зі сполукою формули (IV) або його активованою похідною 5 10 (IV). Прийнятною активованою похідною сполуки формули (IV) є хлорангідрид кислоти. Реакцію між сполукою формули (III) та сполукою формули (IV) можуть проводити в прийнятному органічному розчиннику, необов'язково в присутності основи. Коли сполука формули (I) є сумішшю ізомерів сполуки формули (IA) та формули (IB) можуть одержувати зі сполуки формули (I), використовуючи прийнятні способи розділення, які є добре відомими кваліфікованому фахівцю в даній галузі з рівня техніки, такі як ті, що описані в даному документі. Альтернативно, сполуки формули (IA) та (IB) можуть одержувати шляхом процедури хіральної синтазу. Як ілюстрація, сполуку формули (IA) можуть одержувати за способом, представленим на схемі 1. Схема 1 1. 2,5M BuLi 2. B(Oi-Pr) 3 SnCl 2 2H 2O, EtOH 3. Pd(dppf) 2Cl 2 HCl ~130 °C MeCN, K 2CO 3 ~85 °C LiOH, MeOH/H 2O LiOH, H 2O H 2O, ДМФ DPPA / A?IAA AOI 1) ДХМ, К2СО3 2) i-PrOAc HCl 15 6 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 Кваліфікованому фахівцю в даній галузі слід прийняти до уваги, що прийнятним може бути захист однієї або більше функціональних груп сполук, описаних вище. Приклади захисних груп та засобів для їх видалення можна знайти в T.W. Greene "Protective Groups in Organic Synthesis" (4th edition, J. Wiley and Sons, 2006). Прийнятні амінні захисні групи включають ацил (наприклад, ацетил, карбамат (наприклад, 2',2',2'-трихлоретоксикарбоніл, бензилоксикарбоніл або третбутоксикарбоніл) та арилалкіл (наприклад, бензил), які можуть видаляти шляхом гідролізу (наприклад, з використанням кислоти, такої як гідрохлоридна кислота в діоксані або трифлуороцтова кислоти в дихлорметані) або шляхом відновлення (наприклад, гідрогеноліз бензильної або бензилоксикарбонільної групи або відновним видаленням 2',2',2'трихлоретоксикарбонільної групи з використанням цинку в оцтовій кислоті) при необхідності. Інші прийнятні амінні захисні групи включають трифлуорацетил (-COCF3), який можуть видаляти шляхом гідролізу, що каталізується основою. Слід прийняти до уваги, що в будь-якому зі шляхів, описаних вище, визначений порядок стадій синтезу, за допомогою яких різні групи та фрагменти вводяться в молекулу, можуть бути змінений. Це буде знаходитись в межах кваліфікації фахівця в даній галузі, щоб забезпечити те, що групи або фрагменти, введені в одній стадії процесу не залежатимуть від наступних перетворень та реакцій, та щоб вибрати порядок стадій синтезу, відповідно. Певні проміжні сполуки, описані вище, формують ще один аспект винаходу. Сполуки формули (I) та їх солі є інгібіторами бромодоменів, та, таким чином, як вважають, мають потенційну корисність в лікуванні захворювань або станів, для яких є показаним інгібітор бромодомену. Крім того, сполуки формули (I) та їх фармацевтично прийнятні солі (такі як сполука формули (IA) або її фармацевтично прийнятна сіль) можуть мати одну або більше ADMET (всмоктування, розподіл, метаболізм, виведення та токсичність) властивості, що робить її особливо прийнятною. Таким чином, представлений винахід передбачає сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в терапії. В одному втіленні передбачається сполука формули (IA) або її фармацевтично прийнятна сіль для застосування в терапії. Сполука формули (I) або її фармацевтично прийнятна сіль можуть застосовувати в лікуванні захворювань або станів, для яких є показаним інгібітор бромодомену. Таким чином, представлений винахід передбачає сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні будь-яких захворювань або станів, для яких є показаним інгібітор бромодомену. В одному втіленні передбачається сполука формули (IA) або її фармацевтично прийнятна сіль для застосування в лікуванні будь-яких захворювань або станів, яких є показаним інгібітор бромодомену. В іншому втілені передбачається сполука формули (I) (наприклад, сполука формули (1А)) або її фармацевтично прийнятна сіль для застосування в лікуванні хронічних аутоімунних та/або запальних станів. В наступному втіленні передбачається сполука формули (I) (наприклад, сполука формули (1A)) або її фармацевтично прийнятна сіль для застосування в лікуванні раку. Крім того, передбачається застосування сполуки формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування захворювань або станів, для яких є показаним інгібітор бромодомену. В одному втіленні передбачається застосування сполуки формули (IA) або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування захворювань або станів, для яких є показаним інгібітор бромодомену. Крім того, передбачається спосіб лікування захворювання або стану, для яких є показаним інгібітор бромодомену, у суб'єкта, що цього потребує, який включає введення терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. В одному втіленні передбачається спосіб лікування захворювання або стану, для яких є показаним інгібітор бромодомену, у суб'єкта, що цього потребує, який включає введення терапевтично ефективної кількості сполуки формули (IA) або її фармацевтично прийнятної солі. Відповідно, суб'єктом, що потребує цього, є ссавець, зокрема людина. Як використовується в даному документі, термін "ефективна кількість" означає таку кількість лікарського засобу або фармацевтичного агенту, яка викликатиме біологічну або медичну відповідь у тканини, системи або суб'єкта (наприклад, людини), яка досліджується, наприклад, дослідником або лікарем. Крім того, термін "терапевтично ефективна кількість" означає будь-яку кількість яка, в порівнянні з відповідним суб'єктом, який не отримував такої кількості, в результаті призводить до покращеного лікування, одуження, попередження або полегшення захворювання, розладу або побічного ефекту, або зниженні швидкості поширення захворювання або розладу. Термін, крім того, включаєв межах свого обсягу кількості, ефективні для підвищення нормальної фізіологічної функції. 7 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вважається, що інгібітори бромодомену є корисними в лікуванні різних захворювань або станів, пов'язаних із системними або тканинними запаленнями, запальними реакціями на інфекцію або гіпоксію, клітинною активацією та проліферацією, ліпідним обміном, фіброзом, та в попередженні та лікуванні вірусних інфекцій. Інгібітори бромодомену можуть бути корисними в лікуванні широкого спектру хронічних аутоімунних і запальних захворювань, таких як ревматоїдний артрит, остеоартрит, гостра подагра, псоріаз, системний червоний вовчак, розсіяний склероз, запальне захворювання кишечнику (хвороба Крона та виразковий коліт), астма, хронічне обструктивне захворювання дихальних шляхів, пневмонія, міокардит, перикардит, міозит, екзема, дерматит (включаючи атопічний дерматит), алопеція, вітіліго, бульозні шкірні захворювання, нефрит, васкуліт, атеросклероз, хвороба Альцгеймера, депресія, синдром Шегрена, сіалоденіт, оклюзію центральної вени сітківки, розгалужена оклюзія вен сітківки, синдром Ірвіна-Гасса (після катаракти та після операцій), пігментний ретиніт, парспланіт, шротоподібна ретино хоріоідопатія, епіретинальна мембрана, кістозний набряк макули, телеангіектазія ідіопатична парафовеолярна, тракційна макулопатія, вітреомакулярні тракційні синдроми, відшарування сітківки, нейроретиніт, ідіопатичний набряк жовтої плями, ретиніт, сухість очей (кератокон'юктивіт SICCA), весняний кератокон'юнктивіт, атопічний кератокон'юнктивіт, увеїт (такий як, передній увеїт, пан увеїт, задній увеїт, увеїт, пов'язаний з набряком макули), склерит, діабетична ретинопатія, діабетичний набряк макули, дистрофія макули, пов'язана з віком, гепатит, панкреатит, первинний біліарний цироз, склерозуючий холангіт, хвороба Аддісона, гіпофізит, тиреоїдит, діабет типу I та гостре відторгнення пересаджених органів. Інгібітори бромодомену можуть бути корисними в лікуванні широкого спектру гострих запальних станів, таких як гостра подагріа, гігантських клітинний артеріїт, нефрит, включаючи вовчаковий нефрит, васкуліт з ураженням органів, таких як гломерулонефрит, васкуліт, включаючи гігантський клітинний артеріїт, гранулематоз Вегенера, вузликовий поліартеріїт, хвороба Бехчета, хвороба Кавасакі, артеріїт Такаясу, гангренозна піодермія, васкуліт з ураженням органів та гострим відторгненням трансплантованих органів. Інгібітори бромодомену можуть бути корисними в лікуванні захворювань або станів, які включають запальні реакції на інфекції бактеріями, вірусами, грибами, паразитами або їх токсини, такі як сепсис, синдром сепсису, септичний шок, ендотоксемія, синдром системної запальної реакції (SIRS), синдром поліорганної дисфункції, синдром токсичного шоку, гостре пошкодження легенів, ARDS (респіраторний дистрес-синдром у дорослих), гостра ниркова недостатність, блискавичний гепатит, опіки, гострий панкреатит, післяопераційні синдроми, саркоїдоз, реакції Херксхеймера, енцефаліт, мієліт, менінгіт, малярія та SIRS пов'язаний з вірусними інфекціями, такими як грип, оперізуючий лишай, простий герпес і коронавірус. Інгібітори бромодомену можуть бути корисні в лікуванні станів, пов'язаних з ішемічнореперфузійним пошкодженням, таким як інфаркт міокарду, судинно-мозкова ішемія (інсульт), гострі коронарні синдроми; нирковим реперфузійним пошкодженням, трансплантацією органів, аортокоронарним обхідним шунтуванням, процедурами в умовах штучного кровообігу, легеневою, нирковою, печінковою, шлунково-кишковаю емболією або периферичною емболією кінцівок. Інгібітори бромодомену можуть бути корисними в лікуванні розладів ліпідного обміну через регуляцію APO-A1, таких як гіперхолестеринемія, атеросклероз і хвороба Альцгеймера. Інгібітори бромодомену можуть бути корисними в лікуванні фіброзних станів, таких як ідіопатичний легеневий фіброз, фіброз нирок, післяопераційний стеноз, утворення келоїдного рубця, склеродермія (включаючи кільцевидну склеродермію) та серцевий фіброз. Інгібітори бромодомену можуть бути корисними в лікуванні вірусних інфекцій, таких як вірус герпесу, вірус папіломи людини, аденовірус та віспа, та інші ДНК віруси. Інгібітори бромодомену можуть бути корисними в лікуванні раку, включаючи гематологічний рак (такий як, лейкемія, лімфома та множинна мієлома), епітеліальний рак, вкючаючи карциноми легень, молочної залози та товстої кишки, проміжні карциноми, мезенхімальні, печінкові, ниркові та неврологічні пухлини. Інгібітори бромодомену можуть бути корисними в лікуванні одного або більше видів раку, вибраних з раку мозку (гліоми), гліобластоми, синдрому Банаяна-Зонана, хвороби Каудена, хвороби Лермітта-Дюкло, раку молочної залози, запальнийого раку молочної залози, колоректального раку, пухлини Вільма, саркоми Юінга, рабдоміосаркоми, епендімоми, медуллобластоми, раку товстої кишки, раку голови та шиї, раку нирки, раку легенів, раку печінки, меланоми, плоскоклітинного раку, раку яєчника, раку підшлункової залози, раку простати, саркомного раку, остеосаркоми, гігантсько-клітинної пухлини кістки, раку щитовидної залози, лімфобластної Т-клітинної лейкемії, хронічної мієлогенної лейкемії, хронічної 8 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 лімфоцитарної лейкемії, лейкоз ворсисто–клітинної лейкемії, гострої лімфобластної лейкемії, гострої мієлогенної лейкемії, хронічної нейтрофільної лейкемії, гострої лімфобластної Тклітинної лейкемії, плазмоцитоми, імунобластної великоклітинної лейкемії, лейкемії з клітин мантії, множинної мієломи, мегакаріобласного лейкозу, гострого мегакаріоцітарного лейкозу, промієлоцитарної лейкемії, лейкемії змішаного походження, ерітролейкозу, злоякісної лімфоми, ходжкінської лімфоми, неходжкінської лімфоми, лімфобластної Т-клітинної лімфоми, лімфоми Беркітта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротеліальної залози, раку вульви, раку шийки матки, раку ендометрію, раку нирки, мезотелиоми, раку стравоходу, раку слинної залози, печінково-клітинного раку, раку шлунка, назофоренгіального раку, раку щоки, раку ротової порожнини, раку ЖКТ (шлунково-кишкова стромальна пухлина) та раку яєчка. В одному втіленні рак представляє собою лейкоз, наприклад лейкоз вибраний з гострого моноцитарного лейкозу, гострого мієлогенного лейкозу, хронічного мієлогенного лейкозу, хронічного лімфоцитарного лейкозу та лейкемії змішаного походження (MLL). В іншому втіленні рак представляє собою NUT-середньостінну карциному. В іншому втіленні рак представляє собою множинну мієлому. В іншому втіленні рак представляє собою рак легенів, такий як дрібноклітинний рак легені (SCLC). В іншому втіленні рак представляє собою нейробластому. В іншому втіленні рак представляє собою лімфому Беркітта. В іншому втіленні рак представляє собою рак шийки матки. В іншому втіленні рак представляє собою рак стравоходу. В іншому втіленні рак представляє собою рак яєчників. В іншому втіленні рак представляє собою рак молочної залози. В іншому втіленні рак представляє собою рак товстої та прямої кишок. В одному втіленні захворювання або стан, для яких є показаним інгібітор бромодомену вибирають із захворювань, пов'язаних з синдромом системної запальної реакції, таким як сепсис, опіки, панкреатит, обширна травма, кровотеча та ішемія. У даному втілені інгібітор бромодомену повинен вводитись в момент діагностики для зниження захворюваності: SIRS, настання шоку, синдром поліорганної дисфункції, який включає в себе початок гострого ушкодження легенів, ARDS, гостре ниркове, печінкове, серцеве або шлунково-кишкове ушкодження та смертність. В іншому втіленні інгібітор бромодомену повинен вводитись до хірургічних або інших процедур, пов'язаних з високим ризиком сепсису, кровотечі, великого ушкодження тканин, SIRS або MODS (синдром поліорганної дисфункції). У конкретному втіленні захворювання або стан, для яких є показаним інгібітор бромодомену, представляють собою сепсис, синдром сепсису, септичний шок і ендотоксикоз. В іншому втіленні інгібітор бромодомену є показаним для лікування гострого або хронічного панкреатиту. В іншому втіленні бромодомен є показаним для лікування опіків. В одному втіленні захворювання або стан, для яких є показаним інгібітор бромодомену, вибирають з простих герпесних інфекцій та реактивацій, герпесної лихоманки, інфекцій оперізуючого лишаю та реактивацій, вітряної віспи, оперізуючого герпесу, вірусу папіломи людини, вірусу імунодефіциту людини (ВІЛ), неоплазії шийки матки, аденовірусних інфекцій, включаючи гостре респіраторне захворювання, поксвірусні інфекції, такі як коров'яча віспа та віспа, та вірусу африканської чуми свиней. В одному конкретному втіленні інгібітор бромодомену є показаним для лікування інфекцій вірусу папіломи людини шкіри або епітелію шийки матки. В одному втіленні інгібітор бромодомену є показаним для лікування латентної ВІЛінфекції. Як використовується в даному документі посилання на "лікування" конкретного захворювання або стану включає запобігання або профілактику такого захворювання або стану. Термін "захворювання або стани, для яких є показаним інгібітор бромодомену", є призначеним для включення кожного з або всіх з зазначених вище захворювань або станів. Крім того, винахід передбачає спосіб інгібування бромодомену, який включає контактування бромодомену зі сполукою формули (I) або її фармацевтично прийнятною сіллю. Хоча, існує можливість, що для застосування в терапії, сполуку формули (I), а також її фармацевтично прийнятні солі, можуть вводити у вигляді необробленої хімічної речовини, зазвичай активний інгредієнт присутній у вигляді фармацевтичної композиції. Представлений винахід, таким чином, передбачає в додатковому аспекті фармацевтичну композицію, що містить сполуку формули (I) або її фармацевтично прийнятну сіль, та один або більше фармацевтично прийнятні носії, розріджувачі або наповнювачі. В одному втіленні передбачається фармацевтична композиція, що містить сполуку формули (IA) або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятні носії, розріджувачі або наповнювачі. Сполуки формули (I) та фармацевтично прийнятні солі є такими як описано вище. Носій(ї), розріджувач(и) або наповнювач(и) повинні бути прийнятними в сенсі сумісності з іншими інгредієнтами композиції та не шкідливими для їх реципієнта. У 9 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідності з іншим аспектом винаходу також передбачається процес виробництва фармацевтичної композиції, який включає змішування сполуки формули (I), або її фармацевтично прийнятної солі, з одним або більше фармацевтично прийнятними носіями, розріджувачами або наповнювачами. Фармацевтичну композицію можуть застосовувати в лікуванні будь-якого зі станів, описаних в даному документі. Оскільки сполуки формули (I) є призначеними для застосування в фармацевтичних композиціях, буде легко зрозуміти, що кожна з них переважно використовується по суті в чистій формі, наприклад, щонайменше, 85 % чистоти, особливо, щонайменше, 98 % чистоти (% за масою по відношенню до маси основи). Фармацевтичні композиції можуть бути представлені у формі одиничних доз, що містять попередньо визначену кількість активного інгредієнта на одиничну дозу. Переважні одиничні дозовані композиції є такими, що містять денну дозу або суб-дозу або її відповідну частину від активного інгредієнта. Тому такі одиничні дози можуть бути введені більше, ніж один раз на день. Переважні одиничні дозовані композиції є такими, що містять денну дозу або суб-дозу (для введення більш ніж один раз на день), як зазначено вище в даному документі, або її відповідну частину від активного інгредієнта. Фармацевтичні композиції можуть бути адаптованими для введення будь-яким прийнятним способом, наприклад пероральним (включаючи буккальний або сублінгвальний), ректальним, інгаляційним, інтраназальним, місцевим (включаючи буккальний, сублінгвальний або трансдермальний), очним (включаючи місцевий, внутрішньоочний, субкон'юнктивальний, епісклеральний, субтеноновий), вагінальним або парентеральним (включаючи підшкірний, внутрішньом'язовий, внутрішньовенний або внутрішньошкірний) способом. Такі композиції можуть бути отримані будь-яким способом, відомим в галузі фармації з рівня техніки, наприклад, шляхом введення в сукупність активного інгредієнта з носієм(ями) або наповнювачем(ами). В одному втіленні фармацевтична композиція є адаптованою для парентерального введення, зокрема, внутрішньовенного введення. В одному втіленні фармацевтична композиція є адаптованою для перорального введення. В одному втіленні фармацевтична композиція є адаптованою для місцевого введення. Фармацевтичні композиції, адаптовані для парентерального введення, включають водні та неводні стерильні ін'єкційні розчини, які можуть містити антиоксиданти, буфери, бактеріостатичні та розчинені речовини, які роблять композицію ізотонічної з кров'ю передбачуваного реципієнта; та водні й неводні стерильні суспензії, які можуть включати суспендуючі агенти та загущуючі агенти. Композиції можуть бути представлені в одинично дозованих або в багатодозових контейнерах, наприклад, герметичних ампулах та флаконах, і можуть зберігатися в висушеному при заморозці (ліофілізованому) стані, що вимагає тільки додавання стерильного рідкого носію, наприклад води для ін'єкцій, безпосередньо перед використанням. Приготовлені для негайного прийому ін'єкційні розчини й суспензії можуть бути виготовлені зі стерильних порошків, гранул і таблеток. Фармацевтичні композиції, адаптовані для перорального введення, можуть бути представлені у вигляді дискретних одиниць, таких як капсули або таблетки; порошки або гранули; розчини або суспензії у водних або неводних рідинах; їстівні піни або креми, або масло-в-воді рідкі емульсії або вода-в-олії рідкі емульсії. Наприклад, для перорального введення у вигляді таблетки або капсули активний лікарський компонент може бути поєднаний з пероральним, нетоксичним фармацевтично прийнятним інертним носієм, таким як етанол, гліцерин, вода тощо. Порошки, прийнятні для включення в таблетки або капсули можуть бути отримані шляхом відновлення сполуки з прийнятним дрібним розміром (наприклад, шляхом мікронізаціі) та перемішування з аналогічно отриманим фармацевтичним носієм, таким як їстівний карбогідрат, наприклад, крохмаль або маніт. Ароматизатор, консервант, диспергуючий агент та барвник можуть також бути присутніми. Капсули можуть бути виготовлені шляхом приготування порошкової суміші, як описано вище, та заповнення утвореним желатинових оболонок. Ковзкі речовини та змащувальні речовини, такі як колоїдний діоксид силіцію, тальк, стеарат магнію, стеарат кальцію або твердий поліетиленгліколь, можуть додавати до порошкової суміші перед процесом наповнення. Розпушуючий або солюбілізуючий агент, такий як агар-агар, карбонат кальцію або карбонат натрію також можуть додавати для покращення доступності лікарського засобу, коли капсулу вводять всередину. Більше того, коли є бажаним або необхідним, прийнятні зв'язуючі, ковзкі, змащувальні речовини, підсолоджувачі, ароматизатори, дезінтегруючі агенти та забарвлюючі агенти також можуть бути включеними в суміш. Прийнятні зв'язуючі речовини включають крохмаль, желатин, 10 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 природні цукри, такі як глюкоза або бета-лактоза, кукурудзяні підсолоджувачі, природні та синтетичні камеді, такі як аравійська камедь, трагакант або альгінат натрію, карбоксиметилцелюлоза, поліетиленгліколь, воски тощо. Змащувальні речовини, які застосовують в даних дозованих формах, включають олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію тощо. Розпушувачі включають крохмаль, метилцеллюлозу, агар, бентоніт, ксантанову камедь тощо. Таблетки є сформульованими, наприклад, шляхом приготування порошкової суміші, гранулювання або брикетування, додавання змащувального агенту та розпушувача, та пресування у таблетки. Порошкову суміш готують шляхом змішування сполуки, яка є прийнятно тонко подрібненою, з розріджувачем або основою, як описано вище, та, необов'язково, зі зв'язуючою речовиною, такою як карбоксиметилцелюлоза, алігінат, желатин або полівінілпіролідон, розчином інгібітору, такого як парафін, прискорювачем розсмоктування, таким як четвертинної солі, та/або агентом поглинання, таким як бентоніт, каолін або дикальцию фосфат. Порошкову суміш можуть гранулювати шляхом змочування зі зв'язуючою речовиною, такою як сироп, крохмальний клейстер, гуміарабіка акації або розчини целюлозних або полімерних матеріалів, та пропускання через сито. Як альтернатива до грануляції, порошкову суміш можуть запускати до таблеткової машини, та результатом є неповністю сформовані кулі, які розбивають на гранули. Гранули можуть бути змащені, щоб запобігти прилипанню до матриць формування таблетки шляхом додавання стеаринової кислоти, стеарату, тальку або мінеральної олії. Змащену суміш далі пресують в таблетки. Сполуки формули (I) та їх фармацевтично прийнятні солі, також можуть бути поєднані з високо сипучим інертним носієм та пресують в таблетках безпосередньо, без проходження стадій гранулювання або брикетування. Прозоре або непрозоре захисне покриття, що складається з герметизуючого шару шелаку, може забезпечуватися покриттям з цукру або полімерного матеріалу та поліруюче покриття воском. В дані покриття можуть додавати барвники, щоб розрізняти різні одиничні дозування. Пероральні рідини, такі як розчин, сиропи та еліксири можуть бути приготовлені в дозованій одиничній формі, так що надана кількість містить попередньо визначену кількість сполуки. Сиропи можуть бути отримані шляхом розчинених сполуки в прийнятному ароматизованому водному розчині, тоді як еліксири готують з використанням нетоксичного спиртового носія. Суспензії можуть бути виготовлені диспергуванням сполуки в нетоксичному носії. Крім того, доданими можуть бути солюбілізатори й емульгатори, такі як етоксильовані ізостеарилові спирти та поліоксиетиленсорбітолові етери, консерванти, смакові добавки, такі як олія м'яти перцевої або натуральні підсолоджувачі або сахарин або інші штучні підсолоджувачі, тощо. Композиції для введення (наприклад, для перорального введення) можуть бути призначені для забезпечення модифікованого профілю вивільнення таким чином, щоб підтримувати або, при інших обставинах, контролювати вивільнення терапевтично активного агента. Модифікований профіль вивільнення терапевтично активного агента, можуть отримувати шляхом розробки полімерних матриць, що включають різні варіанти та властивості полімерів, які біорозкладаються/біоруйнуються (наприклад, полі(етиленвініл)ацетат (EVA), супергідролізований PVA), гідроксіалкілцелюлоза (HPC), метилцелюлоза (МС), гідроксипропілметилцелюлоза (HPMC), полікапролактон, полі(гліколева) кислота, полі(молочна) кислота, поліангідрід, полімерні молекулярні маси, полімерну кристалічність, співполимерні співвідношення, умови обробки, обробка поверхні, геометрія, додавання наповнювача та полімерні покриття, які підвищуватимуть дифузію лікарського засобу, ерозії, розчинення та осмосу. У разі необхідності, дозовані одиничні композиції для перорального введення можуть бути в мікроінкапсульованими. Композицію можуть отримувати для подовження або підтримання вивільнення як, наприклад, покриття або введення зернистого матеріалу в полімери, воск, тощо. Сполуки формули (I) та їх фармацевтично прийнятні солі, також можуть бути введені у форму ліпосомних систем доставки, таких як невеликі моноламелярні везикули, великі моноламелярні везикули і багаламелярні везикули. Ліпосоми можуть бути утворені з різних фосфоліпідів, таких як холестерин, стеариламін або фосфатидилхолін. Фармацевтичні композиції, адаптовані для місцевого введення можуть бути сформульовані у вигляді мазей, кремів, суспензій, емульсій, лосьйонів, порошків, розчинів, паст, гелів, пін, спреїв, аерозолів або олій. Такі фармацевтичні композиції можуть включати звичайні добавки, які включають, але не обмежуються цим, консерванти, розчинники, що сприяють проникненню ліків, співрозчинники, пом'якшувальні речовини, пропеленти, агенти, що модифікують в'язкість (гелеутворюючі агенти), поверхнево-активні речовини та носії. В одному втіленні передбачається фармацевтична композиція, адаптована для місцевого введення, яка містить 11 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 від 0,01-10 %, або від 0,01-1 % сполуки формули (I), або її фармацевтично прийнятної солі в розрахунку на масу композиції. Для лікування очей або інших зовнішніх тканин, наприклад рота та шкіри, композиції переважно наносять у вигляді мазі, крему, гелю, спрею або піни. ПриВ процесі формулювання у вигляді мазі, активний інгредієнт може бути використаний з мазевою основою або парафіновою або такою, яка змішується з водою. Альтернативно, активний інгредієнт може бути сформульований у вигляді крему з кремовою основою олія-в-воді або основою вода-в-олії. Фармацевтичні композиції, адаптовані для місцевого введення в око, включають очні краплі, в яких активний інгредієнт є розчиненим або суспендованим в прийнятному носії, зокрема, водному розчиннику. Композиції для введення в око будуть мати офтальмологічно сумісний рН та осмоляльність. Один або більше офтальмологічно прийнятних агентів, які регулюють рН, та/або буферних агентів можуть бути включеними в композицію за винаходом, включаючи кислоти, такі як оцтова, борна, лимонна, молочна, фосфатна та гідрогенхлоридна кислоти; основи, таких як гідроксид натрію, фосфат натрію, борат натрію, цитрат натрію, ацетат натрію та лактат натрію; та буфери, такі як цитрат/декстроза, бікарбонат натрію та хлорид амонію. Такі кислоти, основи та буфери можуть бути включеними в кількості, необхідній для підтримки рН композиції в офтальмологічно прийнятному діапазоні. Одна або більше офтальмологічно прийнятних солей можуть бути включеними в композицію в кількості, достатній для приведення осмоляльності композиції в офтальмологічно прийнятний діапазон. Такі солі включають солі, що містять катіони натрію, калію або амонію, та аніони хлориду, цитрату, аскорбату, борату, фосфату, бікарбонату, сульфату, тіосульфату або бісульфіту. Очний засіб доставки може бути призначеним для контрольованого вивільнення одного або більше терапевтичних агентів з кількома визначеними швидкостями вивільнення та уповільненими кінетиками дози та проникності. Фармацевтичні композиції для очної доставки також включають in situ гелеутворюючі водні композиції. Така композиція містить гелеутворюючий агент в концентрації, ефективній для сприяння гелеутворення при контакті з оком або з слізною рідиною. Відповідні гелеутворюючі агенти включають, але не обмежуються цим, термореактивні полімери. Термін " in situ гелеутворюючий", як використовується в даному документі, включає не тільки рідини з низькою в'язкістю, які утворюють гелі при контакті з оком або з слізною рідиною, але також включає більш в'язкі рідини, такі як напіврідкі та тиксотропні гелі, які демонструють суттєво підвищену в'язкость, або гелеву жорсткість при введенні в око. Дивись, наприклад, Ludwig (2005) Adv. Drug Deliv. Rev. 3;57:1595-639, яка є включеною в даний документ, як посилання з метою його вивчення прикладів полімерів для застосування в доставці очних лікарських засобів. Дозовані форми для назального або інгаляційного введення, можуть бути традиційно сформульовані у вигляді аерозолів, розчинів, суспензій, гелів або сухих порошків. Для композицій прийнятних та/або адаптованих для інгаляційного введення, переважним є, що сполука формули (I) або її фармацевтично прийнятна сіль знаходиться в фракційно приведеній формі, наприклад, отриманій шляхом мікронізації. Переважно у формі зі зниженим розміром часток (наприклад, микронизированна) сполука або солі визначається значенням D50 від приблизно 0,5 до приблизно 10 мікрон (наприклад, як виміряно, використовуючи лазерну дифракцію). Аерозольні препарати, наприклад, для інгаляційного введення, можуть містити розчин або тонку суспензію активної речовини у фармацевтично прийнятному водному або неводному розчиннику. Аерозольні препарати можуть бути представлені в одно- або багатодозованих кількостях у стерильній формі в герметичному контейнері, який може мати форму картриджа або перезапрвляючого картриджу для застосування з розпилюим пристроєм або інгалятором. В альтернативному варіанті герметичний контейнер може бути одиничним дозуючим пристроєм, таким як одиничний дозований назальний інгалятор або аерозольний розпилювач, забезпечений дозуючим клапаном (дозуючий інгалятор), який призначений для того, щоб випускати один вивільнений вмісту з контейнера. Коли дозована форма містить аерозольний розпилювач, вона переважно містить прийнятний пропеллент під тиском, такий як стиснене повітря, діоксид карбону або органічний пропелент, такий як гідрофлуоркарбон (HFC). Відповідні HFC пропелленти включають 1,1,1,2,3,3,3-гептафлуорпропан та 1,1,1,2-тетрафлуоретан. Аерозольні дозовані форми можуть також мати форму насоса-розпилювача. Аерозоль під тиском може містити розчин або суспензію активної сполуки. Це може вимагати включення додаткових наповнювачів, наприклад, співрозчинників та/або поверхнево-активних речовин для покращення дисперсійних характеристик та однорідності суспензійних препаратів. Препарати у вигляді розчинів, крім того, можуть вимагати додавання співрозчинників, таких як етанол. 12 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для фармацевтичних композицій прийнятних та/або адаптованих для інгаляційного введення, фармацевтична композиція може бути сухим порошком прийнятної для інгаляції композиції. Така композиція може містити порошкоподібну основу, таку як лактоза, глюкоза, трегалоза, маніт або крохмаль, сполуку формули (I) або її фармацевтично прийнятну сіль (переважно у формі зі зниженим розміром часток, наприклад у мікронізованій формі) та, необов'язково, модифікатор ефективності, такий як L-лейцин або інша амінокислота, та/або солі металу стеаринової кислоти, такі як стеарат магнію або кальцію. Переважно, сухий порошок для інгаляційної композиції містить суху порошкоподібну суміш лактози, наприклад, моногідрату лактози та сполуки формули (I) або її солі. Такі композиції можуть вводити пацієнту, використовуючи прийнятний пристрій, такий як DISKUS® пристрій, що поставляється на ринок фірмою GlaxoSmithKline, який описаний, наприклад, в GB 2242134 A. Сполуки формули (I) та їх фармацевтично прийнятні солі можуть бути сформульовані у вигляді препарату для доставки рідини з рідинного дозатора, наприклад рідинного дозатора, що має дозуючу насадку або дозуючий отвір, через який відміряна доза рідинного препарату розподіляється для застосування користувачем, прикладаючи зусилля до механізму насосу рідинного дозатору. Такі рідинні дозатори, як правило, є забезпеченими резервуаром для декількох відміряних доз рідинного препарату, дози, яка вивільняється при послідовних натисканнях насосу. Сопло-дозатор або отвір можуть бути налаштованими для введення в ніздрі користувача для розпилення дозування рідинного препарату в порожнину носа. Дозатор рідини із зазначеного вище типу є описаними та проілюстрованими в WO-A-2005/044354. Терапевтично ефективна кількість сполуки формули (I) або її фармацевтично прийнятної солі, буде залежати від ряду факторів, включаючи, наприклад, вік та вага пацієнта, визначений стан, який вимагає лікування, та його тяжкість, природа препарату та спосіб введення, та в кінцевому підсумку буде визначена фаховим лікарем або ветеринаром. В фармацевтичній композиції, кожна дозована одиниця для перорального або парентерального введення, переважно, містить від 0,01 до 3000 мг, більш переважно від 0,5 до 1000 мг сполуки формули (I) або її фармацевтично прийнятної солі в розрахунку на вільну основу. Кожна дозована одиниця для назального або інгаляційного введення, переважно, містить від 0,001 до 50 мг, більш переважно від 0,01 до 5 мг сполуки формули (I) або її фармацевтично прийнятної солі в розрахунку на вільну основу. Фармацевтично прийнятні сполуки формули (I) та її фармацевтично прийнятні солі, можуть вводити в добовій дозі (для дорослого пацієнта), наприклад, для пероральної або парентеральної дози, від 0,01 мг до 3000 мг на день, від 0,5 до 1000 мг на день, або від 100 мг до 2500 мг в день, або назальної або інгаляційної дози від 0,001 до 50 мг на день або від 0,01 до 5 мг на день сполуки формули (I) або її фармацевтично прийнятної солі, з розрахунку на вільну основу. Дана кількість може бути надана в одиничній дозі на день або частіше, як правило, в кількості (наприклад, два, три, чотири, п'ять або шість) суб-доз на день, так що загальна добова доза буде такою ж самою. Ефективна кількість її солі, може бути визначеною у вигляді частини ефективної кількості сполуки формули (I) в чистому вигляді. Сполуки формули (I) та їх фармацевтично прийнятні солі, можуть застосовувати самостійно або в комбінації з іншими терапевтичними агентами. Комбінована терапія відповідно до представленого винаходу, таким чином, включає введення, щонайменше, однієї сполуки формули (I) або її фармацевтично прийнятної солі, та застосування, щонайменше, одного іншого терапевтично активного агенту. Переважно, комбіновані терапії відповідно до представленого винаходу включають введення, щонайменше, однієї сполуки формули (I) або її фармацевтично прийнятної солі та, щонайменше, з одним іншим терапевтично активним агентом. Сполука(и) формули (I) та її(їх) фармацевтично прийнятні солі, та інший(і) терапевтично активний(і) агент(и) можуть вводити разом в одній фармацевтичній композиції або окремо, та при введенні окремо їх можуть вводити одночасно або послідовно в будь-якому порядку. Кількості сполуки() формули (I) і їх фармацевтично прийнятних солей, та іншого(их) терапевтично активного(их) агенту(ів), та відносні терміни введення будуть вибирати для того, щоб досягти бажаний комбінований терапевтичний ефект. Таким чином, в додатковому аспекті передбачається комбінація, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та, щонайменше, один інший терапевтично активний агент. Таким чином, в одному аспекті сполуку формули (I) або її фармацевтично прийнятну сіль, та фармацевтичні композиції, що містять сполуку формули (I) або її фармацевтично прийнятну сіль відповідно до винаходу можуть застосовувати в поєднанні з або включати один або більше інших терапевтичних агентів, наприклад, вибраних з антибіотиків, антивірусних препаратів, глюкокортикостероїдів, бета- 2 агоністів мускаринових антагоністів та аналогів вітаміну D3. В наступному втіленні сполуку формули (I) або її фармацевтично прийнятну сіль можуть 13 UA 110838 C2 5 10 15 20 25 30 35 40 застосовувати в поєднанні з додатковим терапевтичним агентом, який є прийнятним для лікування раку. Приклади таких додаткових терапевтичних агентів є описаними в Cancer th Principles and Practice of Oncology за редакцією V.T. Devita and S. Hellman (редактори), 6 edition (2001), Lippincott Williams & Wilkins Publishers. Кваліфікований фахівець в даній галузі зможе визначити, які комбінації агентів були б корисними в залежності від конкретних характеристик лікарських засобів та в раку, який має місце. Додаткові терапевтичні агенти, які застосовується в поєднанні зі сполукою формули (I) або її фармацевтично прийнятною сіллю, включають, але не обмежуються цим, антимікротубулинові агенти (наприклад, дітерпеноїди та алкалоїди барвінку), координаційні комплекси платини, алкілуючі агенти (такі як хлормктин, оксазафосфорини, алкілсульфонати, нітрозосечовини та триазени); антибіотики (такі як антрацикліни, актиноміцини та блеоміцини); інгібітори топоізомерази II (такі як епіподофіллотоксини); антиметаболіти (такі як пуринові та піримідинові аналоги та антифолатні сполуки); інгібітори топоізомерази I (такі як камптотецини; гормони та аналоги гормонів); інгібітори сигнальної трансдукції (такі як інгібітори тирозинових рецепторів); нерецепторні інгібітори ангіогенезу тирозинкінази; імунотерапевтичні агенти; проапоптотичні агенти; епігеннтичні або транскрипційні модулятори (такі як, інгібітори гістондеацетілази) та інгібітори клітинного циклу передачи сигналу. Слід мати на увазі, що коли сполуку формули (I) або її фармацевтично прийнятну сіль, вводять в комбінації з іншими терапевтичними агентами, зазвичай, яку вводять інгаляційним, внутрішньовенним, пероральним або інтраназальним способом, результатом чого є фармацевтична композиція, яку можуть вводити, використовуючи той самий спосб. Альтернативно, індивідуальні компоненти композиції можуть вводити різними шляхами. Один варіант здійснення винаходу включає комбінації, які включають один або два інших терапевтичних агентів. Кваліфікованому фахівцю в даній галузі буде ясно, що, при необхідності, інший(і) терапевтичний(і) інгредієнт(и) можуть застосовувати у формі солей, наприклад солей лужних металів або амонію, або як кислотно-адитивні солі, або проліки, або як естери, наприклад, нижчі алкільні естери, або у вигляді сольватів, наприклад, гідратів, щоб оптимізувати активність та/або стабільність та/або фізичні характеристики, такі як розчинність, терапевтичного інгредієнту. Крім того, буде ясно, що, в разі необхідності, терапевтичні інгредієнти можуть застосовувати в оптично чистій формі. Комбінації, зазначені вище, традиційно можуть бути представлені для застосування у вигляді фармацевтичної композиції та, таким чином, фармацевтичні композиції, що містять комбінацію, як визначено вище, разом з фармацевтично прийнятним розріджувачем або носієм, представляють собою додатковий аспект винаходу. Сполуки формули (I) та їх фармацевтично прийнятні солі, можуть бути отримані, використовуючи способи, описані нижче, або за аналогічними способами. Таким чином, отримують наступні проміжні сполуки, та приклади слугують для ілюстрації отримання сполук формули (I) та їх фармацевтично прийнятних солей, та їх не слід розглядати як такі, що будьяким чином обмежують об'єм винаходу. Загальні експериментальні особливості Всі температури є зазначеними в°С. Назви наступних сполук були отримані, використовуючи програму, яка називає сполуки "ACD Name Pro 6.02" або Chem Draw Ultra 12.0. 45 Скорочення: 1,2-ДХЕ AcOH CHCl3 D6-ДМСО ДХМ ДІПЕА ДМСО DPPA Et3N EtOAc год. HATU HCl i-PrOac 1,2-дихлоретан оцтова кислота хлороформ дейтерований диметилсульфоксид дихлорметан діізопропіламін диметилсульфоксид дифенілфосфорилазид триетиламін етилацетат година(и) O-(7-Азабензотриазол-1-іл)-N, N,N",N’-тетраметилуронію гексафлуорфосфат гідрогенхлоридна кислота ізопропілацетат 14 UA 110838 C2 діізопропіловий етер рідинна хроматографія - мас-спектроскопія літію гідроксид молярна (концентрація) ацетонітрил метанол хвилина(и) нормальна (концентрація) натрію карбонат натрію сульфат паладій на вугіллі час утримання трет-бутилметиловий етер трифлуороцтова кислота тетрагідрофуран ультра-ефективна рідинна хроматографія i-Pr2O РХМС LiOH M MeCN MeOH хв. N Na2CO3 Na2SO4 Pd/C Rt TБME ТФО ТГФ УЕРХ 5 10 РХМС методологія Форміатний спосіб Умови РХ УЕРХ аналіз проводили на колонці Acquity UPLC BEH C18 (50 мм x 2,1 мм, i.d. 1,7 мкм діаметр упаковки) при 40C. Розчинниками, які використовували, були: A=0,1 % об./об. розчин мурашиної кислоти у воді B=0,1 % об./об. розчин мурашиної кислоти в ацетонітрилі. Градієнт, який використовували, був: Час (хв.) 0 1,5 1,9 2,0 15 20 25 30 Швидкість потоку (мл/хв.) 1 1 1 1 %A 97 0 0 97 %B 3 100 100 3 УФ-детектування представляє собою сумарний сигнал з довжиною хвилі 210 нм до 350 нм. MС умови MС: Waters ZQ Режим іонізації: Сканування за вибором позитивне та негативне електороспрей Діапазон сканування: від 100 до 1000 ат.мас.од. Час сканування: 0,27 сек Inter scan delay: 0,10 сек. ЯМР Спектри записували на 400 МГц ЯМР приладі при або 302 K, або для VT спектрів при 392393 K. Проміжна сполука 1 7-(3,5-диметилізоксазол-4-іл)-6-метокси-N-(1-метоксипропан-2-іл)-3-нітрохінолін-4-амін До розчину 4-(4-хлор-6-метокси-3-нітрохінолін-7-іл)-3,5-диметилізоксазолу (Manchester Organics) (20 г, 59.9 ммоль) в 1,4-діоксані (200 мл) додавали 1-метоксипропан-2-амін (31.6 мл, 300 ммоль) та реакційну суміш нагрівали при 70 ºC протягом 1,5 год. Розчинник видаляли при зниженому тиску та одержану в результаті тверду речовину розподіляли між етилацетатом (3 × 750 мл) та водою (750 мл). Органічні шари поєднують, сушили (гідрофобний фріт) та 15 UA 110838 C2 5 10 15 20 25 30 35 40 випаровували при зниженому тиску, одержуючи 7-(3,5-диметилізоксазол-4-іл)-6-метокси-N-(1метоксипропан-2-іл)-3-нітрохінолін-4-амін (25,8 г), який використовували на наступній стадії без додаткової очистки. ЯМР (D6-ДМСО): δH 9,03 (с, 1H), 8,63 (д, 1H), 7,83 (с, 1H), 7,81 (с, 1H), 4,39 (м, 1H), 3,97 (с, 3H), 3,54 (м, 2H), 3,27 (с, 3H), 2,34 (с, 3H), 2,15 (с, 3H), 1,41 (д, 3H). + РХМС (форміат): Rt=0,97 хв., MH 387. Проміжна сполука 2 7-(3,5-диметилізоксазол-4-іл)-6-метокси-N4-(1-метоксипропан-2-іл)хінолін-3,4-діамін 7-(3,5-Диметилізоксазол-4-іл)-6-метокси-N-(1-метоксипропан-2-іл)-3-нітрохінолін-4-амін (одержання дивись щодо проміжної сполуки 1) (25,8 г, 66,8 ммоль) розчиняли в суміші етилацетату (1000 мл) та ДМСО (50 мл) та розчин гідрогенізували, використовуючи пристрій для проточного гідрогенування (H-cube™) (характеристики: 20 °C, 1 бар, швидкість потоку 1 мл/хв.) та 10 % Pd/C CatCart 70 картридж з каталізатором. Картридж з каталізатором замінювали, кожен раз, коли він ставав заболкованим. Реакційну суміш випаровували при зниженому тиску та розподіляли між етилацетатом (750 мл) та водою (3 × 750 мл). Водні шари об'єднували та екстрагували етилацетатом (750 мл). Органічні шари об'єднували, сушили (гідрофобний фріт) та випаровували при зниженому тиску. Залишок розчиняли в ДХМ та пропускали через силікагельний картридж (100 г). Картридж елюювали 2M амонієм в метанол/ДХМ градієнті (0-4 %). Відповідні фракції об'єднували та випаровували при зниженому тиску, одержуючи 7-(3,5-диметилізоксазол-4-іл)-6-метокси-N4-(1-метоксипропан-2-іл)хінолін-3,4діамін та відновлений 7-(3,5-диметилізоксазол-4-іл)-6-метокси-N-(1-метоксипропан-2-іл)-3нітрохінолін-4-амін (6.5 г) Відновлену вихідну речовину розчиняли в етилацетаті (250 мл), та розчин гідрогенізували, використовуючи пристрій для проточного гідрогенування (H-cube™) (характеристики: 20 °C, 1 бар, швидкість потоку 1 мл/хв.) та 10 % Pd/C CatCart 70 картридж з каталізатором. Реакційну суміш випарювали при зниженому тиску, та залишок розчиняли в ДХМ та пропускали через силікагельний картридж (100 г). Картридж елюювали 2 М амонієм в метанол/ДХМ градієнті (04 %). Відповідні фракції об'єднували та випаровували при зниженому тиску, одержуючи 7-(3,5диметилізоксазол-4-іл)-6-метокси-N4-(1-метоксипропан-2-іл)хінолін-3,4-діамін. Порції продукту об'єднували, одержуючи 7-(3,5-диметилізоксазол-4-іл)-6-метокси-N4-(1метоксипропан-2-іл)хінолін-3,4-діамін (15,6 г, 43,8 ммоль, 65,6 % вихід) у вигляді липкої темнокоричневою смоли. ЯМР (D6-ДМСО): δH 8,29(с, 1H), 7,55(с, 1H), 7,45(с, 1H), 5,13(с, 2H), 4,48(д, 1H), 3,88(с, 3H), 3,54(м, 1H), 3,35(м, 2H), 3,29(с, 3H), 2,30(с, 3H), 2,10(с, 3H), 1,18(д, 3H). РХМС (форміат): Rt 0,73 + хв., MH 357. Проміжна сполука 3 N-(7-(3,5-диметилізоксазол-4-іл)-6-метокси-4-((1-метоксипропан-2-іл)аміно)хінолін-3іл)тетрагідро-2H-піран-4-карбоксамід Розчин 7-(3,5-диметилізоксазол-4-іл)-6-метокси-N4-(1-метоксипропан-2-іл)хінолін-3,4-діаміну (одержання дивись щодо проміжної сполуки 2) (9,1г) в ДХМ (300 мл) обробляли піридином (30мл) та тетрагідро-2H-піран-4-карбонілхлоридом (5,0 мл) та розчин струшували під азотом при температурі навколишнього середовища протягом 3,5 годин та потім залишали стояти 16 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 протягом ночі (температура навколишнього середовища, під азотом). Летючі речовини випаровували в вакуумі, та залишок розподіляли між ДХМ та водою. Органічну фазу промивали водою x2, та об'єднані водні фази екстрагували ДХМ. Об'єднані органічні фазі промивали сольовим розчином, сушили (гідрофобний фріт) та сушили насухо в вакуумі. Об'єднані водні фази, включаючи сольові промивні фази, (~pH4) підлужнювали твердим гідрокарбонатом натрію та водну фазу екстрагували ДХМ x2. Органічні фракції сушили (гідрофобний фріт), об'єднували з попередньою речовиною та сушили насухо в вакуумі, одержуючи коричнеіу піну. Дану піну додатково сушили в вакуумі, розтирали з діетиловим етером, охолоджену суспензію (на бані крига/вода) та тверду речовину відокремлювали фільтруванням. тверду речовину промивали невеликою кількістю діетилового етеру та сушили на повітрі, отримуючи N-(7-(3,5диметилізоксазол-4-іл)-6-метокси-4-((1-метоксипропан-2-іл)аміно)хінолін-3-іл)тетрагідро-2Hпіран-4-карбоксамід, у вигляді бежевої твердої речовини (11,95 г, 100 %). ЯМР (D6-ДМСО): δH 9,49(с, 1H), 8,38(с, 1H), 7,70(с, 1H), 7,63(с, 1H), 5,33(д, 1H), 3,96-3,90(м, 6H), 3,43-3,28(м частково в обміні з водою, 7H), 2,69(м, 1H), 2,32(с, 3H), 2,12(с, 3H), 1,81-1,67(м, + 4H), 1,19(д, 3H). РХМС (форміат): Rt 0,69 хв., MH 469. Приклад 1 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7іл)-3,5-диметилізоксазол Суспензію N-(7-(3,5-диметилізоксазол-4-іл)-6-метокси-4-((1-метоксипропан-2іл)аміно)хінолін-3-іл)тетрагідро-2H-піран-4-карбоксаміду (одержання дивись щодо проміжної сполуки 3) (29,4 г, 62,7 ммоль) в оцтовій кислоті (250 мл, 62,7 ммоль) нагрівали при 120 ºC протягом 2 годин. Додавали молекулярні сита 3 Å (20 г), та продовжували нагрівання протягом 3,5 годин. Додатково додавали молекулярні сита 3 Å (20 г, сушили в шкафу), та продовжували нагрівання протягом ночі. Крім того, додавали молекулярні сита 3 Å (20 г, сушили в шкафу), та продовжували нагрівання протягом додаткових 24 годин. Реакційну суміш давали охолонути до кімнатної температури, та тверду речовину відфільтровували. Залишок та фільтрат об'єднували та випаровували при зниженому тиску. Додавали воду, та одержану в результаті глинисту суспензію нейтралізували повільним додаванням твердого гідрокарбонату натрію. Водну глинисту суспензію екстрагували ДХМ (3 × 1 l), та органічні фази об'єднували, сушили (гідрофобний фріт) та випаровували при зниженому тиску, одержуючи коричневу смолу. Смолу розчиняли при нагріванні та обробці ультразвуком в мінімальній кількості ДХМ. Розчин пропускають через силікагелеву колонку (750 г), яка попередньо була змоченою ДХМ. Колонку елюювали градієнтом [2 M аміаку в метанолі, метанол (3:1)]/ДХМ (0-~8 %). Фракції, що містять продукт, об'єднували та упарювали насухо при зниженому тиску, одержуючи кремового кольору піна/скло (13,027 г). Змішані фракції продукту об'єднували та упарювали насухо при зниженому тиску, одержуючи темно-жовту олію. Дану олію розчиняли в діетиловому етері, та летючі речовини випаровували в вакуумі, одержуючи жовту тверду речовину. Тверду речовину розтирали з діетиловим етером, тверду речовину виділяли фільтрацією та промивали діетиловим етером (x 2), одержуючи 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазол. Кремову піну/скло розтирали з діетиловим етером/етилацетатом, суміш упарювали насухо при зниженому тиску та розтирання повторювали з діетиловим етером. Попередню фракцію з продуктом додавали до суспензії та суміш вистоювалась протягом ночі. тверду речовину виділяли фільтрацією та промивали діетиловим етером, одержуючи 4-(8-метокси-1-(1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазол у вигляді кремової твердої речовини. тверду речовину сушили в вакуумі та знову розтирали з діетиловим етером зі струшуванням протягом понад ~30 хв. тверду речовину виділяли фільтрацією та промивали діетиловим етером. тверду речовину сушили в вакуумі, 17 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 одержуючи 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазол, у вигляді білої твердої речовини (11,73 г). VT ЯМР (D6-ДМСО): δH 9,04(с, 1H), 7,99(с, 1H), 7,74(с, 1H), 5,45(м, 1H), 4,14(м, 1H), 4,064,01(м, 6H), 3,62(м, 2H), 3,47(м, 1H), 3,28(с, 3H), 2,35(с, 3H), 2,17(с, 3H), 2,09(м, 2H), 1,92(м, 2H), + 1,83(д, 3H). РХМС(форміат): Rt 0,76 хв., MH 451. Приклад 1 – альтернативне одержання 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7іл)-3,5-диметилізоксазол Суміш N-(7-(3,5-диметилізоксазол-4-іл)-6-метокси-4-((1-метоксипропан-2-іл)аміно)хінолін-3іл)тетрагідро-2H-піран-4-карбоксаміду (одержання дивись щодо проміжної сполуки 3) (11,95 г, 25,5 ммоль) та п-толуїлсульфонову кислоту (1,2 г, 25,5 ммоль) в толуолі (250 мл) нагрівали під азотом при кип'ятінні зі зворотним холодильником, використовуючи насадку Діна-Старка протягом 3 днів. Додатково додавали п-толуїлсульфонову кислоту (0,2 г, 4,3 ммоль) та продовжували нагрівання протягом ночі. додавали воду (750 мл), та суміш підлужнювали до pH 8, використовуючи насичений водний розчин гідрокарбонату натрію. Водну фазу екстрагували етилацетатом (3 × 750 мл), органічні шари об'єднували, сушили (гідрофобний фріт)та випаровували при зниженому тиску. Залишкову тверду речовину розтирали в етері (~200 мл), швидко обробляли ультразвуком. Виявилось, що основна частина отриманої твердої речовини була тонким порошком. Тонкий порошок, суспендований в етері, декантували, тверду речовину виділяли фільтрацією, та сушили у вакуумній шафі, одержуючи сирий 4-(8-метокси-1-(1метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5диметилізоксазол (6,3 г). Дану речовину розтирали в етері (~100 мл), швидко обробляли ультразвуком, та залишали стояти протягом ночі при кімнатній температурі. Тверду речовину виділяли фільтрацією та сушили у вакуумній шафі – 4-(8-метокси-1-(1-метоксипропан-2-іл)-2(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол (4,9 г, 10,88 ммоль, + вихід 42,6 %). РХМС (форміат): Rt 0,75 хв., MH 451. Липку тверду речовину, яка залишилася після декантування, розтирали в етері (100 мл), обробляли ультразвуком протягом 15 хв. та витримували при кімнатній температурі протягом 3 днів. Тверда речовина відокремлювали фільтруванням та сушили у вакуумній шафі, одержуючи 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)+ 3,5-диметилізоксазол (3,6 г, 7,99 ммоль, вихід 31,3 %). РХМС (форміат): Rt 0,76 хв., МН 451. Приклад 2 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазол Хіральне розділення 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1Hімідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол проводили, використовуючи наступні умови: Колонка: Chiralpak AD-H (250 × 30 мм, 5 мікрон) [ADH10029-01] Швидкість потоку: 45 мл/хв Детектування: УФ DAD (300 нм (ширина смуги 180 нм, стандартна 550 нм (ширина смуги 100 нм)). Рухома фаза A: н-гексан (10 мл ізопропіламіну на велику ємність (2,5 л)) Рухома фаза B: Етанол (10 мл ізопропіламіну на велику ємність (2,5 л)) Ізократична система – 85:15 рухома фаза A:B Час пробігу – приблизно 35 хв. 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7іл)-3,5-диметилізоксазол (500 мг) суспендували в суміші етанолу та етиленгліколю (10 мл:5 мл) та потім обробляли ультразвуком, та нагрівали для переведення в розчин. Потім додавали ізопропіламін (1 мл). Даний робочий розчин нагрівали на електричній плиті (60 C), утримуючи розчин таким під час продовження очистки. Впорскування (1,5 мл) робили, використовуючи автоматичний дозатор. Фракції, зібрані в точно визначений час, використовуючи збирач фракцій 18 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 з воронкою між 28 хв. та 35 хв. Об'єднані розчини фракції випаровували насухо, використовуючи роторний випарник (температура бані 30 C), та залишок переносилу у відтаровану 20 мл скляну ємність, використовуючи етанол (приблизно 12 мл). Етанол випаровували під струменем газоподібного азоту (при кімнатній температурі). 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазол (1.16г), виділений використовуючи спосіб, описаний вище, розтирали з діетиловим етером (~3 мл) протягом понад ~4 годин при температурі навколишнього середовища. Тверду речовину виділяли фільтрацією, промивали діетиловим етером та сушили в вакуумі, одержуючи 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол у вигляді твердої речовини кремового кольору (0,96г). VT ЯМР (D6-ДМСО): δH 9.03(с, 1H), 7.98(с, 1H), 7.74(с, 1H), 5.43(м, 1H), 4.13(м, 1H), 4.044.00(м, 6H), 3.61(м, 2H), 3.46(м, 1H), 3.28(с, 3H), 2.35(с, 3H), 2.16(с, 3H), 2.08(м, 2H), 1.92(м, 2H), + 1.82(д, 3H). РХМС (форміат): Rt 0,76 хв., MH 451. Приклад 3 4-(8-метокси-1-((S)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазол Хіральне розділення 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1Hімідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол проводили, використовуючи наступні умови: Колонка: Chiralpak AD-H (250 × 30 мм, 5 мікрон) [ADH10029-01] Швидкість потоку: 45 мл/хв. Детектування: УФ DAD (300 нм (ширина смуги 180 нм, стандартна 550 нм (ширина смуги 100 нм)). Рухома фаза A: Гептан Рухома фаза B: Етанол Ізократична система – 85:15 рухома фаза A:B Час пробігу – приблизно 35 хв. 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7іл)-3,5-диметилізоксазол (85 мг) розчиняли в етанолі (приблизно 4 мл) при нагріванні та обробці ультразвуком. Потім робили впорскування (400 мкл) за допомогою пластикового шприця. Фракції між 24 хв. та 26,5 хв. збирали та об'єднували, розчини фракції випаровували насухо, використовуючи роторний випарник (температура бані 30 C). Залишок переносили до відтарованої скляної ємності, використовуючи етанол (приблизно 12 мл). Розчинник потім видаляли випаровуванням під струменем газоподібного азоту (кімнатна температура), одержуючи 4-(8-метокси-1-((S)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1Hімідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол (38 мг). VT ЯМР (D6-ДМСО): δH 9,00(с, 1H), 7,95(с, 1H), 7,72(с, 1H), 5,41(м, 1H), 4,10(м, 1H), 4,033,97(м, 6H), 3,59(м, 2H), 3,45(м, 1H), 3,26(с, 3H), 2,32(с, 3H), 2,13(с, 3H), 2,07(м, 2H), 1,90(м, 2H), + 1,80(д, 3H). РХМС (форміат): Rt 0,73 хв, MH 451. Приклад 4 Одержання кристалічної форми 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2Hпіран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол (безводна форма 1) 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазол (одержання дивись в прикладі 2 або схему реакції 1, 18,87г) розчиняли в ізопропілацетаті (95 мл) при кип'ятінні зі зворотним холодильником та потім давали охолонути до 20 ºC протягом понад 1 години. Потім протягом понад 1 години додавали циклогексан (190 мл), та одержану в результаті глинисту суспензію витримували протягом 1 години. Потім глинисту суспензію фільтрували та промивали сумішшю 2:1 циклогексан: ізопропілацетат (30 мл), та далі циклогексаном (30 мл) перед тим як сушити віджимали. Корж 19 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 потім сушили у шафі протягом ночі при 40 ºC в вакуумі. для даної сполуки записували порошкову рентгенівську дифрактограму (дивись приклад 9). Приклад 5 Одержання кристалічної форми 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2Hпіран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазолу (безводна форма 2) Попередньо змішаний розчин ізопропілацетату (211 мл) та циклогексану (422 мл) додавали до 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазолу (одержання дивись в прикладі 2 або схему реакції 1, 42,19 г, 94 ммоль). Одержану в результаті суспензію струшували протягом 24 годин, фільтрували, одержану в результаті тверду речовину промивали (1x сумішшю циклогексан: ізопропілацетат (2:1, 180мл), 1x циклогексан (180мл), 1x TБME (180 мл)), віджимали до сухості та сушили в вакуумі при 40 °C до постійної маси, одержуючи майже білу тверду речовину (90 % вихід). для даної сполуки записували порошкову рентгенівську дифрактограму (дивись приклад 9). Приклад 6 Одержання кристалічної форми 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2Hпіран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазолу (гідрат) Попередньо змішаний розчин етанолу (2,000 мл) та води (8,00 мл) додавали до 4-(8метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)3,5-диметилізоксазолу (одержання дивись в прикладі 2 або схему реакції 1, 1,00 г, 2,220 ммоль) та одержану в результаті суспензію струшували протягом ночі. Суспензію фільтрували, промивали (2x водою, 2x TБME), віджимали до сухості за допомогою вакууму та сушили в вакуумі при 40 °C, одержуючи білий порошок. для даної сполуки записували порошкову рентгенівську дифрактограму (дивись приклад 9). Приклад 7 Одержання кристалічної форми 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2Hпіран-4-іл)-1H-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазолу (безводна форма 3) 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазолу гідрат (одержання дивись в прикладі 6, 860 мг, 1,835 ммоль) нагрівали при 135 °C при 9 мбар протягом ночі. для даної речовини записували порошкову рентгенівську дифрактограму (дивись приклад 9). Приклад 8 Одержання 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1Hімідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазолу гідрохлориду (гідрохлорид) В першому реакторі розчин 7-(3,5-диметилізоксазол-4-іл)-6-метокси-4-(N-((R)-1метоксипропан-2-іл)тетрагідро-2H-піран-4-карбоксамідо)хінолін-3-карбонової кислоти (для одержання дивись схему 1, 23,3 кг) в ДХМ (113 кг) та ДІПЕА (3.8 kг) об'єднували з ацетонітрилом (61,6 кг) та діізопропіламіном (12,8 кг), суміш охолодували від -10 до -3 °C. Додавали дифенілфосфорилазид (19,0 кг), утримуючи температуру в діапазоні від -10 до -3 °C, та реакційну суміш струшували при даній температурі. Додавали додатковий дифенілфосфорилазид (2,4 кг), утримуючи температуру в діапазоні від -10 до -3 °C, та реакційну суміш струшували при даній температурі до утворення першого розчину. В другому реакторі диметилформамід (144 кг) та воду (72 кг) нагрівали до 90-100 °C. Додавали перший розчин, утримуючи температуру в діапазоні 85-100 °C, реактор 1 промивали ацетонітрилом (7 кг) та промивні додавали в другий реактор, утримуючи температуру в діапазоні 85-100 °C. Суміш струшували при даній температурі та потім охолоджували до 2030 °C. pH регулювали до pH=10 30 мас. % водним розчином гідроксиду натрію (10,4 кг), утримуючи температуру в діапазоні 20-30 °C. Загружали дихлорметан (315 кг) та воду (351 кг), шари розділяли, та водний шар екстрагували дихлорметаном (315 kг). Об'єднані органічні шари промивали водою (234 кг). В органічний шар загружали воду (234 кг), суміш струшували, додавали хлорид натрію (80 кг), та шари розділяли. Органічний шар концентрували при зниженому тиску, нижче 30 °C, загружали метанол (201 кг), та розчин концентрували при зниженому тиску нижче 50 °C. Додатково загружали метанол (199 кг) та 4M гідрогенхлоридну кислоту в метанолі (68,5 кг), утримуючи температуру 20-30 °C, та реакційну суміш струшували при даній температурі. Суміш концентрували при зниженому тиску, нижче 50 °C, та загружали ацетонітрил (104 кг). Суміш концентрували при зниженому тиску, нижче 50 °C, та загружали ацетонітрил (97 кг). Суміш концентрували при зниженому тиску, нижче 50 °C, та знову загружали ацетонітрил (116 кг). Суміш випаровували при зниженому тиску, нижче 50 °C та додатково загружали ацетонітрил (103,0 кг). Суміш охолоджували до -5-0 °C та струшували при даній температурі. Глинисту суспензію 20 UA 110838 C2 5 10 15 центрифугували двома порціями, кожну порцію промивали ацетонітрилом (9 кг), одержуючи названу сполуку (33,40 кг, 99,3 % чистоти), у вигляді вологого коржа. Приклад 9 дослідження способом рентгенівської порошкової дифракції кристалічних форм 4-(8метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо [4,5-c]хінолін-7-іл)3,5-диметилізоксазол у вигляді вільної основи та у вигляді гідрохлоридної солі Дані були отримані на порошковому дифрактометрі PANalytical X'Pert Pro, моделі PW3040/60 з використанням детектора X'Celerator. Умовами дослідження були: випромінювання: Cu Kα, генератор напруги: 40 кВ, струм генератора: 45 мА, початковий кут: 2,0° 2θ, кінцевий кут: 40,0° 2θ, розмір кроку: 0,0167° 2θ, час на крок: 31,75 секунд. Зразок отримували шляхом установки декількох міліграмів зразка на кремнієвій пластині (нульовий фон), в результаті отримуючи тонкий шар порошку. Положення піків вимірювали за допомогою Highscore програмного забезпечення. Статистична похибка становить близько ± 0,1° 2θ для кожного з розподілення піків. Інтенсивність піків може змінюватися від зразка до зразку через переважну орієнтацію. Таблиця 1 показує характерний пік XRPD позиції і d-відстаней для кристалічної форми сполуки 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2-(тетрагідро-2H-піран-4-іл)-1H-імідазо[4,5c]хінолін-7-іл)-3,5-диметилізоксазол у вигляді вільної основи та у вигляді гідрохлорідної солі. Таблиця 1 Вільна основа безводна форма 1 Вільна основа Вільна основа безводна форма 2 безводна форма 3 Вільна основа Гідрат гідрохлорид 2θ/° dвідстань/Å 2θ/° dвідстань/Å 2θ/° dвідстань/Å 2θ/° dвідстань/Å 2θ/° 7,9 8,5 10,7 12,1 12,7 13,9 15,9 16,7 18,8 21,0 22,7 24,3 29,1 29,8 11,1 10,4 8,3 7,3 7,0 6,4 5,6 5,3 4,7 4,2 3,9 3,7 3,1 3,0 6,5 10,8 13,0 14,0 15,3 17,7 19,3 20,8 21,6 22,6 25,3 27,2 13,6 8,2 6,8 6,3 5,8 5,0 4,6 4,3 4,1 3,9 3,5 3,3 8,8 11,2 11,7 16,1 16,5 18,2 20,6 21,5 23,0 10,0 7,9 7,5 5,5 5,4 4,9 4,3 4,1 3,9 8,1 10,2 12,0 14,8 16,6 17,5 18,2 18,8 19,7 20,5 23,3 24,1 26,6 10,9 8,7 7,4 6,0 5,3 5,1 4,9 4,7 4,5 4,3 3,8 3,7 3,4 9,4 12,8 13,5 14,4 14,9 17,4 18,9 19,9 20,4 24,0 25,7 26,2 32,7 dвідстань/ Å 9,4 6,9 6,6 6,1 5,9 5,1 4,7 4,5 4,4 3,7 3,5 3,4 2,7 20 25 30 35 Способи біологічного дослідження Сполуки формули (I) можуть бути досліджені одним або більше з наступних аналізів. Аналіз за метод резонансного переносу енергії флуоресценціі з розділенням за часом (TRFRET) Зв'язування сполук формули (I) з бромодоменами BRD2, BRD3 і BRD4 оцінювали, використовуючи аналіз зв'язування за методом резонансного переносу енергії флуоресценціі з розділенням за часом, який вимірює зв'язування ацетильованого гістонового пептиду з протеїном бромодомену. Протеїн бромодомену, пептид гістону та змінна концентрація сполуки, яка досліджується, інкубують разом, щоб досягти термодинамічну рівновагу. Аналіз виконаний так, що за відсутності сполуки, яка досліджується, бромодомен та пептид є в значній мірі зв'заними (~ 30 %) та в присутності достатньої концентрації потенційного інгібітору дана взаємодія руйнується, що призводить до значного зниження резонансного переносу енергії флуоресценціі. Пептид гістону: H-Ser-Gly-Arg-Gly-Lys(Ac)-Gly-Gly-Lys(Ac)-Gly-Leu-Gly-Lys(Ac)-Gly-Gly-Ala-Lys(Ac)-Arg-HisGly-Ser-Gly-Ser-Lys(Біотин)-OH. 3ТФО Захищений пептид збирали на твердофазному синтезаторі з використанням попередньо загруженої смоли Ванга (Wang) та з використанням стандартних протоколів синтезу Fmoc. Стермінальний лізин був захищений гіпер кислото-лабільною групою, що дозволяє його 21 UA 110838 C2 5 10 15 20 25 30 35 40 45 50 55 селективне видалення в кінці збірки та прикріплення біотину. Сирий пептид отримували після відщеплення від смоли за допомогою суміші трифлуороцтової кислоти (ТФО), триізопропілсилану та води (95:2,5:2,5) протягом 3 год. при кімнатній температурі, та потім чистили, використовуючи колонку з оберненою фазою C18, застосовуючи градієнт водний 0,1 % ТФО-буфер/ацетонітрил. Отримані в результаті фракції аналізують, та фракції, які мали > 95 % чистоти за даними аналітичної ВЕРХ та давали правильний мВт (по MALDiTOF масспектроскопії), об'єднували та сушили при заморожуванні. Кінцеву речовину аналізували, використовуючи ВЕРХ, щоб підтвердити чистоту. Одержання протеїну: рекомбінантні людські бромодомени (BRD2 (1-473), BRD3 (1-435) та BRD4 (1-477)) експресували в клітинах E.coli (в pET15b векторі) з шістьма His-мітками на N-кінці. His-мічений бромодомен екстрагували з клітин E.coli, використовуючи ультразвук, та чистили, використовуючи нікель-сефарозну колонку 6FF, протеїни промивали та потім елюювали 50 мМ Тріс-HCl рН 8,0, 300 мМ NaCl, 1 мМ β-меркаптоетанол та 20 мМ імідазолу. Подальше очищення проводили за допомогою афінної хроматографії на HisTRAP HP колонці, елюіруются лінійним 0500 мМ градієнтом хлориду натрію, понад 20 об'ємами колонки. Остаточне очищення завершували, використовуючи колонку Superdex 200 класу профілю для гель-хроматографії. Очищений білок зберігали при -80 °C в 20 мМ HEPES, рН 7,5 та 100 мМ NaCl. Ідентичність протеїну підтверджували, використовуючи спосіб ідентифікації протеїнів по "відбиткам пептидних мас" та передбачену молекулярну масу підтверджували, використовуючи масспектрометрію. Протокол щодо бромодомен BRD 2, 3 і 4 аналізів: Всі компоненти аналізу розчиняли в буфері складу 50 мМ HEPES рН 7,4, 50 мМ NaCl і 0,5 мМ CHAPS. Кінцева концентрація бромодоменових протеїнів становила 100 нМ та пептиду гістону становила 300 нМ, дані компоненти попередньо змішують та залишають для врівноваження протягом 1 години в темряві. 8 мкл даної реакційної суміші додавали в усі лунки, що містять по 50 нл в різних концентраціяз розчину сполуки, яку досліджують, або розчин носія в ДМСО (0,5 %) в Greiner 384 малооб'ємні мікротитраційні планшети з чорними лунками та інкубували в темряві протягом 60 хвилин при кімнатній температурі. 2 мкл суміші для детектування, що містить анти-6his XL665 мічені антитіла та стрептавідин, мічений криптатом європію, додавали в усі лунки, та проводили інкубування в темряві, щонайменше 30 хвилин. Планшети потім зчитували, використовуючи планшетний рідер Envision, (λекс. = 317 нм, донор λEM=615 нм; акцептор λEM=665 нм; діхроічний LANCE dual). Час вимірювання розділеної інтенсивності флуоресценції проводили на обох довжинах хвиль емісії та розраховували співвідношення акцептор/донор та використовували для аналізу даних. Всі дані були нормалізовані до середнього значення 16 високих і 16 низьких контрольних лунок в кожнрму планшеті. Потім застосовували чотири параметра крива відповідні наступному виду: y=a + ( (b – a)/ (1 + (10 ^ x/10 ^ c) ^ d) Де 'а' є мінімальним значенням, "b" є нахилом кривої, 'с' є pIC50 та "d" є максимальним значенням. Приклади 1-3 досліджували в усіх BRD2, BRD3 і BRD4 аналізах, описаних вище, та було встановлено, що pIC50 мали значення в діапазоні 6,5-7,5 в кожному аналізі. Вимірювання LPS індукованої IL-6 секреції з цільної крові Активація моноцитарних клітин агоністами толл-подобних рецепторів, таких як бактеріальні ліпополісахариди (LPS) в результаті призводить до отримання ключових медіаторів запалення, включаючи IL-6. широко вважається, що такі шляхи займають центральне місце в патофізіології ряду аутоімунних і запальних розладів. Сполуки, які досліджують, розбавляють, щоб одержати широкий спектр відповідних концентраціях, з яких 1 мкл розбавлених стокових розчинів додають в 96-лунковий планшет. Після додавання цільної крові (130 мкл) планшети інкубували при 37 градусах (5 % CO2) протягом 30 хв перед додаванням 10 мкл LPS 2,8 мкг/мл, розбавленого в повному середовищі RPMI 1640 (кінцева концентрація = 200 нг/мл), щоб одержати загальний об'єм 140 мкл на лунку. Після подальшої інкубації протягом 24 годин при 37 градусах додають 140 мкл PBS в кожну лунку. Планшети герметизують, струшують протягом 10 хвилин та потім центрифугують (2500 обертів на хвилину х 10 хв). 100 мкл супернатанта видаляють та аналізують рівні IL-6 методом імуноферментного аналізу (як правило, за технологією MesoScale Discovery) або безпосередньо, або після зберігання при -20 градусах. Концентраційні криві відповіді для кожної сполуки генерували з даних та розраховували значення IC50. Приклади 1 і 2 досліджували в даному аналізі, та було виявлено, що pIC50 мають значення в діапазоні 6,0-7,0. 22 UA 110838 C2 5 10 15 20 25 30 35 40 Ці дані показують, що інгібітори бромодомену досліджені як описано вище з цільною кров'ю інгібують продукування ключового запального медіатору IL-6. In vivo мишина модель, яка демонструє модуляцію прозапальної відповіді Самці CD1 мишей (25-30 г, n=4 в групі) отримували одиничну внутрішньовенну ін'єкцію ударної дози речовини LPS (100 мкг/кг) у хвостову вену через 1 год. після попередньої обробки шляхом одного перорального введення або носія (1 % (вага/об'єм) розчину метилцелюлози у стерильній воді) або сполуки, яку досліджують (3, 10 і 30 мг/кг). Серійні зразки крові були отримані з хвостової вени шляхом прямої венепункції в різний моменти часу аж до 5 годин після введення LPS для аналізу IL-6 та концентрації сполуки, яку досліджують, за Meso Scale Discovery (MSD) аналізом та РХ-МС/МС, відповідно. У контрольних мишей, які отримували носій, внутрішньовенний LPS індукував залежне від часу збільшення концентрацій в сироватці IL-6, в той час як миші, яким попередньо вводили перорально сполуку прикладу 2 (3, 10 і 30 мг/кг), рівні максимуму (C max) IL-6 зменшувалися на 46 %, 79 %, 73 %, відповідно, та загальне виділення (AUC) IL-6 зменшувалося на 35 %, 70 %, 63 %, відповідно. Дане зменшення IL-6 є співставимим з максимальним зниженням, яке спостерігається, при позитивному контролі дексаметазоном, тобто: зменшення 73 % і 70 % Cmax IL-6 та AUC, відповідно. Ці дані показують, що сполука прикладу 2, яку досліджували у вищевказаному аналізі, знижувала LPS-індуковані системні рівні IL-6 у мишей після одноразового перорального введення і, відповідно, може бути застосована як протизапальний засіб. Онкологічний аналіз росту клітин Лінії клітин людини (n=80, що містять клітинних ліній, описані нижче в таблиці 2) культивували в RPMI-1640, що містить 10 % фетальної бичачої сироватки, 1000 життєздатних клітин на лунку висівали в 384-лункові чорні плоскодонні полістиролові планшети (Greiner # 781086) в 48 мкл культурального середовища. Всі планшети були розміщені при 5 % CO2, 37 ºС протягом ночі. Наступного дня один планшет збирали за допомогою CellTiter-Glo (CTG, Promega # G7573) протягом часу, що дорівнює 0 (T0) вимірювання та в інші планшети додавали сполуку (20 точок титрування з 14,7 мкМ до 7 пМ). Кінцева концентрація ДМСО в усіх лунках становила 0,15 %. Клітини інкубували протягом 72 годин або протяго зазначеного часу, та кожен планшет обробляли за допомогою CellTiter-Glo реагенту, використовуючи об'єм, еквівалентний об'єму культури клітин в лунках. Планшети струшували протягом приблизно 2 хвилин та хемілюмінесцентний сигнал зчитували, використовуючи Analyst GT (Molecular Devices) або EnVision планшетний рідер (Perkin Elmer). Результати виражають у відсотках від T0 та будують графік проти концентрації сполуки. Значення T0 нормалізували до 100 % та представляє собою кількість клітин за час додавання сполуки, та дані концентрації відповіді приводили у відповідність до 4 параметрів кривої відповідності, використовуючи програмне забезпечення XLfit (модель 205). Концентрація, що інгібує ріст клітин на 50 % (gIC50) є серединою "вікна росту" (між T0 та ДМСО контролем). Ymin Т0 значення визначають шляхом віднімання значення T0 (100 %) від значення Ymin (%), яке визначають за відповідністю кривої концентраційної відповіді. Значення з лунок, які не мають клітин, віднімали зі всіх зразків для корекції фону. Сполуку прикладу 2 досліджували відповідно до описаної вище процедури, та виявили, що gIC50 має значення такі, як показано в таблиці 2. Таблиця 2 Тип клітинної лінії Множинна мієлома Дрібноклітинний рак легені (SCLC) Рак шийки матки NUT-серединна карцинома Нейробластома Рак стравоходу n (кількість ліній) 16 38 4 2 12 8 gIC50 1,1 до > 29326 нМ (середнє значення 414 нМ), з 15 через 16 клітинних ліній в діапазоні від 1,1 до 2000 нМ 76 до > 29326 нМ (середнє значення 538 нМ), з 35 через 38 клітинних ліній в діапазоні від 76 до 2500 нМ 266-847 нМ 59 – 66 нМ 25-435 нМ (середнє значення 193 нМ) 208 – 1544 нМ (середнє значення 759 нМ) 45 Сполуку прикладу 2 також досліджували у відповідності з аналогічною методикою, використовуючи 96-лункові планшети разом з відповідними модифікаціями щодо об'ємів та 23 UA 110838 C2 концентраціій, які були б очевидними для кваліфікованого фахівця в даній галузі. Сполуку прикладу 2 досліджували, та виявили, що gIC50 має значення такі, як показано в таблиці 3. Таблиця 3 n (кількість ліній) 1 1 1 3 1 1 1 Тип клітинної лінії Гострий моноцитарний лейкоз Гострий промієлоцитарний лейкоз Т-клітинна лімфома шкіри Лімфома Беркітта Хронічний мієлоїдний лейкоз Рак молочної залози (проток) Карцинома яєчника 5 10 gIC50 123 нМ 141 нМ 162 нМ 181 – 807 нМ 776 нМ 537 нМ 707 нМ Ці дані показують, що сполука прикладу 2, яку досліджують у вищевказаному аналізі, інгібувала ріст клітин в панелі ліній онкологічних клітин та, таким чином, можуть застосовувати в лікуванні одного або декількох видів раку. Всі публікації, включаючи, але не обмежуючись цим, патенти та заявки на патенти, цитовані в даному описі, є включеними в даний документ як посилання, так як якщо кожна окрема публікація була конкретно та індивідуально вказана, щоб бути включеними в даний документ як посилання, в повному обсязі. ФОРМУЛА ВИНАХОДУ 15 1. Сполука формули (І), яка являє собою 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро2Н-піран-4-іл)-1Н-імідазо[4,5-с]хінолін-7-іл)-3,5-диметилізоксазол O O N N O N N O 20 , (I) або її сіль. 2. Сполука формули (ІА), яка являє собою 4-(8-метокси-1-((R)-1-метоксипропан-2-іл)-2(тетрагідро-2Н-піран-4-іл)-1Н-імідазо[4,5-с]хінолін-7-іл)-3,5-диметилізоксазол O O N N O N N O , (IA) 24 UA 110838 C2 або її сіль. 3. Сполука формули (IB), яка являє собою 4-(8-метокси-1-((S)-1-метоксипропан-2-іл)-2(тетрагідро-2Н-піран-4-іл)-1Н-імідазо[4,5-с]хінолін-7-іл)-3,5-диметилізоксазол O O N N O N N O 5 10 15 20 25 , (IB) або її сіль. 4. Сполука за будь-яким одним з пунктів 1-3 або її фармацевтично прийнятна сіль. 5. Фармацевтична композиція, яка містить сполуку або її фармацевтично прийнятну сіль за пунктом 4 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. 6. Комбінований фармацевтичний продукт, який містить сполуку або її фармацевтично прийнятну сіль за пунктом 4 разом з одним або більше інших терапевтично активних агентів. 7. Сполука або її фармацевтично прийнятна сіль за пунктом 4 для застосування в терапії. 8. Сполука або її фармацевтично прийнятна сіль за пунктом 4 для застосування в лікуванні захворювань або станів, для яких є показаним інгібітор бромодомену. 9. Сполука за пунктом 8, де захворювання або стан є хронічним аутоімунним та/або запальним станом. 10. Сполука за пунктом 8, де захворювання або стан є раком. 11. Застосування сполуки або її фармацевтично прийнятної солі за пунктом 4 у виробництві лікарського засобу для лікування захворювань або станів, для яких є показаним інгібітор бромодомену. 12. Спосіб лікування захворювання або стану, для яких є показаним інгібітор бромодомену, у суб'єкта, що цього потребує, за яким суб'єкту вводять терапевтично ефективну кількість сполуки або її фармацевтично прийнятної солі за пунктом 4. 13. Спосіб лікування за пунктом 12, де захворювання або стан є хронічним аутоімунним та/або запальним станом. 14. Спосіб лікування за пунктом 12, де захворювання або стан є раком. 15. Спосіб лікування за будь-яким одним з пунктів 12-14, в якому суб'єктом є людина. 25 UA 110838 C2 26 UA 110838 C2 27 UA 110838 C2 28
ДивитисяДодаткова інформація
Назва патенту англійською4-(8-methoxy-1-((1-methoxypropan-2-yl)-2-(tetrahydro-2h-pyran-4-yl)-1h-imidazo[4,5-c]quinolin-7-yl)-3,5-dimethylisoxazole and its use as bromodomain inhibitor
Автори англійськоюDemont, Emmanuel, Hubert, Jones, Katherine, Louise, Watson, Robert J.
Автори російськоюДемон Эмманюэль Юбер, Джонс Кэтрин Луиз, Вотсон Роберт Дж.
МПК / Мітки
МПК: C07D 471/04, A61P 29/00, A61K 31/4745, A61P 37/00
Мітки: інгібітора, бромодомену, застосування, 4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2н-піран-4-іл)-1н-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол
Код посилання
<a href="https://ua.patents.su/32-110838-4-8-metoksi-1-1-metoksipropan-2-il-2-tetragidro-2n-piran-4-il-1n-imidazo45-ckhinolin-7-il-35-dimetilizoksazol-ta-jjogo-zastosuvannya-yak-ingibitora-bromodomenu.html" target="_blank" rel="follow" title="База патентів України">4-(8-метокси-1-(1-метоксипропан-2-іл)-2-(тетрагідро-2н-піран-4-іл)-1н-імідазо[4,5-c]хінолін-7-іл)-3,5-диметилізоксазол та його застосування як інгібітора бромодомену</a>
Попередній патент: Енергоефективна конфорка електрична
Наступний патент: Гранули спученого перліту з покриттям, спосіб їх виготовлення і способи виготовлення бетону й виробів з них
Випадковий патент: Регенератор однофазної напруги мережі