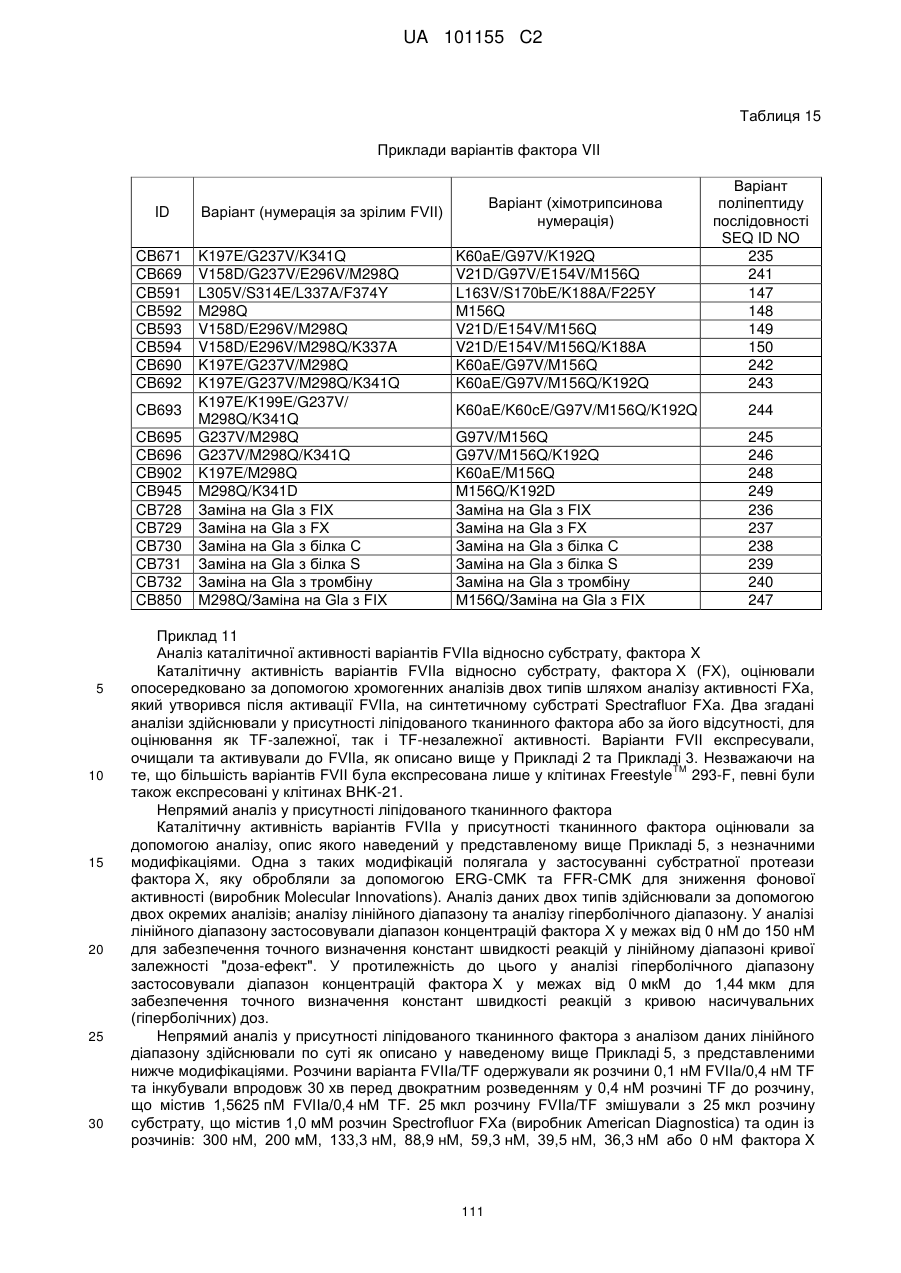
Модифікований поліпептид фактора vii та його застосування
Номер патенту: 101155
Опубліковано: 11.03.2013
Автори: Медісон Едвін Л., Танос Кристофер Д., Рагглз Сандра Уоф, Коглін Шон
Формула / Реферат
1. Модифікований поліпептид фактора VII (FVII), який містить модифікацію у поліпептиді FVII, його алельному або видовому варіанті, або його активних фрагментах, де
зазначена модифікація знаходиться у положенні, що відповідає положенню D196, K197 або K199 у поліпептиді FVII, що має амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, або у відповідних залишках у поліпептиді FVII; та
модифікація вибрана з-посеред D196F, D196W, D196L, D196I, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199D та K199E;
причому модифікований поліпептид FVII демонструє підвищену коагулянтну активність та/або підвищену стійкість до інгібіторів, порівняно з немодифікованим поліпептидом FVII.
2. Модифікований поліпептид FVII за п. 1, де немодифікований поліпептид містить поліпептид послідовності SEQ ID NO: 3.
3. Модифікований поліпептид FVII за п. 1 або п. 2, де модифікацією у поліпептиді FVII є D196Y або K197Y.
4. Модифікований поліпептид FVII за будь-яким із пп. 1-3, що також містить додаткову модифікацію у іншому положенні у поліпептиді FVII, де додатковою модифікацією є амінокислотна заміна, інсерція або делеція.
5. Модифікований поліпептид FVII за п. 4, де додатковою модифікацією є амінокислотна заміна або інсерція у положенні, що відповідає положенню, вибраному з-посеред D196, K197, K199, G237, T239, R290 та K341, причому перша модифікація та друга модифікація знаходяться на різних амінокислотах.
6. Модифікований поліпептид FVII за п. 4 або п. 5, де додаткова амінокислотна модифікація вибрана з-посеред D196K, D196R, D196A, D196Y, D196F, D196W, D196L, D196I, K197Y, K197A, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199A, K199D, K199E, G237W, G237T, G237I, G237V, T239A, R290E, R290D, R290N, R290Q, R290K, K341E, K341R, K341N, K341M, K341D та K341Q.
7. Модифікований поліпептид FVII за п. 5, де додатковою модифікацією є амінокислотна інсерція, вибрана з-посеред G237T238insA, G237T238insS, G237T238insV, G237T238insAS, G237T238insSA, D196K197insK, D196K197insR, D196K197insY, D196K197insW, D196K197insA, D196K197insM, K197I198insE, K197I198insY, K197I198insA та K197I198insS.
8. Модифікований поліпептид FVII за будь-яким із пп. 4-7, який має модифікації, вибрані з-посеред D196R/K197E/K199E, D196K/K197E/K199E, D196R/K197E/K199E/R290E, D196R/K197M/K199E, D196R/K197M/K199E/R290E, D196K/K197L, D196F/K197L, D196L/K197L, D196M/K197L, D196W/K197L, D196F/K197E, D196W/K197E, K196V/K197E, K197E/K341Q, K197L/K341Q, K197E/G237V/K341Q, K197E/K199E, K197E/G237V, K199E/K341Q та K197E/K199E/K341Q.
9. Модифікований поліпептид фактора VII (FVII), який має модифікацію у поліпептиді FVII, його алельному або видовому варіанті, або його активних фрагментах, вибрану з-посеред амінокислотних модифікацій, які відповідають D196R, G237W, G237I, G237V, R290M, R290V, K341M, G237T238insA, G237T238insS, G237T238insV, G237T238insAS, G237T238insSA, D196K197insK, D196K197insR, D196K197insY, D196K197insW, D196K197insA, D196K197insM,K197I198insE, K197I198insY, K197I198insA або K197I198insS у поліпептиді FVII, що має амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, або у відповідних залишках у поліпептиді FVII; а також факультативно додаткову модифікацію, якою є амінокислотна заміна, інсерція або делеція.
10. Модифікований поліпептид FVII за п. 9, який містить додаткову модифікацію, якою є одна або декілька амінокислотних замін у положенні, яке відповідає положенню, вибраному з-посеред D196, K197, K199, G237, T239, R290 та K341, причому ця додаткова модифікація знаходиться у іншому положенні, порівняно з першою модифікацією.
11. Модифікований поліпептид FVII за п. 10, де зазначена додаткова амінокислотна модифікація вибрана з-посеред D196K, D196R, D196A, D196Y, D196F, D196M, D196W, D196L, D196I, K197Y, K197A, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199A, K199D, K199E, G237W, G237T, G237I, G237V, T239A, R290E, R290D, R290N, R290Q, R290K, K341E, K341R, K341N, K341M, K341D та K341Q.
12. Модифікований поліпептид FVII за п. 11, який містить модифікації, вибрані з-посеред D196R/R290E, D196R/R290D, D196R/K197E/K199E, D196K/K197E/K199E, D196R/K197E/K199E/R290E, D196R/K197M/K199E, D196R/K197M/K199E/R290E, D196K/K197L, D196F/K197L, D196L/K197L, D196M/K197L, D196W/K197L, D196F/K197E, D196W/K197E, K197L/K341Q, G237V/K341Q, K197E/G237V/K341Q, K197E/K199E, K197E/G237V, K199E/K341Q, K197E/K199E/K341Q та K196V/K197E.
13. Модифікований поліпептид фактора VII (FVII), який містить дві або декілька модифікацій у поліпептиді FVII, його алельному та видовому варіанті або його активних фрагментах, де:
зазначені дві або декілька амінокислотних модифікацій вибрані з-посеред амінокислотних модифікацій, які відповідають D196K, D196R, D196A, D196Y, D196F, D196M, D196W, D196L, D196I, K197Y, K197A, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199D, K199E, G237W, G237T, G237I, G237V, R290E, R290D, K341R, K341N, K341M, K341D, G237T238insA, G237T238insS, G237T238insV, G237T238insAS, G237T238insSA, D196K197insK, D196K197insR, D196K197insY, D196K197insW, D196K197insA, D196K197insM, K197I198insE, K197I198insY, K197I198insA або K197I198insS у поліпептиді FVII, який має амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, або у відповідних залишках у поліпептиді FVII, який має амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, або у відповідних залишках у поліпептиді FVII; та причому поліпептид FVII має 2, 3, 4, 5, 6 або 7 модифікацій.
14. Модифікований поліпептид FVII за п. 13, де згаданий поліпептид FVII містить амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3.
15. Модифікований поліпептид FVII, який має модифікації, вибрані з-посеред D196R/R290E, D196K/R290E, D196R/R290D, D196R/K197E/K199E, D196K/K197E/K199E, D196R/K197E/K199E/R290E, D196R/K197M/K199E, D196R/K197M/K199E/R290E, D196K/K197L, D196F/K197L, D196L/K197L, D196M/K197L, D196W/K197L, D196F/K197E, D196W/K197E, D196V/K197E, K197E/K341Q, K197L/K341Q, G237V/K341Q, K197E/G237V/K341Q, K197E/K199E, K197E/G237V, K199E/K341Q, K197E/K199E/K341Q та K197E/G237V/M298Q.
16. Модифікований поліпептид FVII за будь-яким із пп. 1-15, який демонструє підвищену стійкість до інгібітора шляху тканинного фактора (TFPI), порівняно з немодифікованим поліпептидом FVII.
17. Модифікований поліпептид FVII за будь-яким із пп. 1-16, що додатково містить гетерологічний Gla-домен або його фрагмент, достатній для здійснення зв'язування фосфоліпідів.
18. Модифікований поліпептид FVII за будь-яким із пп. 1-17, який містить одну або декілька додаткових амінокислотних модифікацій, які підвищують стійкість до антитромбіну-III (AT-III), підвищують зв'язування з фосфоліпідами та/або спорідненість до них, підвищують спорідненість до тканинного фактора (TF), підвищують притаманну активність, підвищують TF-залежну каталітичну або коагулянтну активність, підвищують коагулянтну активність, змінюють конформацію поліпептиду зі зміною проферментності, підвищують каталітичну або коагулянтну активність шляхом зміщення рівноваги між високоактивними та менш активними конформаціями FVIIa на користь високоактивних конформацій, підвищують стійкість до протеаз, зменшують глікозилування, підвищують глікозилування, зменшують імуногенність, підвищують стабільність та/або полегшують зв'язування хімічних груп.
19. Модифікований поліпептид FVII за будь-яким із пп. 2-18, який містить одну або декілька додаткових амінокислотних модифікацій у положенні Q176, M298 або E296 у поліпептиді FVII, який має амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, або у відповідних залишках у поліпептиді FVII.
20. Модифікований поліпептид FVII за п. 19, де амінокислотні модифікації вибрані з-посеред Q176A, M298Q, E296V та E296A.
21. Модифікований поліпептид FVII за п. 20, який містить амінокислотні модифікації, вибрані з-посеред V158D/G237V/E296V/M298Q, K197E/G237V/M298Q, K197E/G237V/M298Q/K341Q, K197E/K199E/G237V/M298Q/K341Q, G237V/M298Q, G237V/M298Q/K341Q, M298Q/заміна на Gla з FIX, K197E/M298Q та M298Q/K341D.
22. Модифікований поліпептид FVII за будь-яким із пп. 2-21, який містить одну або декілька додаткових амінокислотних модифікацій, вибраних з-посеред S278C/V302C, L279C/N301C, V280C/V301C, S281C/V299C, інсерції тирозину у положенні 4, F4S, F4T, P10Q, P10E, P10D, P10N, Q21N, R28F, R28E, I30C, 130D, I30E, K32D, K32Q, K32E, K32G, K32H, K32T, K32C, K32A, K32S, D33C, D33F, D33E, D33K, A34C, A34E, A34D, A34I, A34L, A34M, A34V, A34F, A34W, A34Y, R36D, R36E, T37C, T37D, T37E, K38C, K38E, K38T, K38D, K38L, K38G, K38A, K38S, K38N, K38H, L39E, L39Q, L39H, W41N, W41C, W41+E, W41D, I42R, I42N, I42S, I42A, I42Q, I42N, I42S, I42A, I42Q, I42K, S43Q, S43N, Y44K, Y44C, Y44D, Y44E, S45C, S45D, S45E, D46C, A51N, S53N, G58N, G59S, G59T, K62E, K62R, K62D, K62N, K62Q, K62T, L65Q, L65S, L65N, F71D, F71Y, F71E, F71Q, F71N, P74S, P74A, A75E, A75D, E77A, E82Q, E82N, E82S, E82T T83K, N95S, N95T, G97S, G97T, Y101N, D104N, T106N, K109N, E116D, G117N, G124N, S126N, T128N, L141C, L141D, L141E, E142D, E142C, K143C, K143D, K143E, R144E, R144C, R144D, N145Y, N145G, N145F, N145M, N145S, N145I, N145L, N145T, N145V, N145P, N145K, N145H, N145Q, N145E, N145R, N145W, N145D, N145C, K157V, K157L, K157I, K157M, K157F, K157W, K157P, K157G, K157S, K157T, K157C, K157Y, K157N, K157E, K157R, K157H, K157D, K157Q, V158L, V158I, V158M, V158F, V158W, V158P, V158G, V158S, V158T, V158C, V158Y, V158N, V158E, V158R, V158K, V158H, V158D, V158Q, A175S, A175T, G179N, I186S, I186T, V188N, R202S, R202T, I205S, I205T, D212N, E220N, I230N, P231N, P236N, G237N, Q250C, V253N, E265N, T267N, E270N, A274M, A274L, A274K, A274R, A274D, A274V, A274I, A274F, A274W, A274P, A274G, A274T, A274C, A274Y, A274N, A274E, A274H, A274S, A274Q, F275H, R277N, F278S, F278A, F278N, F278Q, F278G, L280N, L288K, L288C, L288D, D289C, D289K, L288E, R290C, R290G, R290S, R290T, R290K, R290D, R290E, G291E, G291D, G291C, G291N, G291K, A292C, A292K, A292D, A292E, T293K, E296V, E296L, E296I, E296M, E296F, E296W, E296P, E296G, E296S, E296T, E296C, E296Y, E296N, E296K, E296R, E296H, E296D, E296Q, M298Q, M298V, M298L, M298I, M298F, M298W, M298P, M298G, M298S, M298T, M298C, M298Y, M298N, M298K, M298R, M298H, M298E, M298D, P303S, P303ST, R304Y, R304F, R304L, R304M, R304G, R304T, R304A, R304S, R304N, L305V, L305Y, L305I, L305F, L305A, L305M, L305W, L305P, L305G, L305S, L305T, L305C, L305N, L305E, L305K, L305R, L305H, L305D, L305Q, M306D, M306N, D309S, D309T, Q312N, Q313K, Q313D, Q313E, S314A, S314V, S314I, S314M, S314F, S314W, S314P, S314G, S314L, S314T, S314C, S314Y, S314N, S314E, S314K, S314R, S314H, S314D, S314Q, R315K, R315G, R315A, R315S, R315T, R315Q, R315C, R315D, R315E, K316D, K316C, K316E, V317C, V317K, V317D, V317E, G318N, N322Y, N322G, N322F, N322M, N322S, N322I, N322L, N322T, N322V, N322P, N322K, N322H, N322Q, N322E, N322R, N322W, N322C, G331N, Y332S, Y332A, Y332N, Y332Q, Y332G, D334G, D334E, D334A, D334V, D334I, D334M, D334F, D334W, D334P, D334L, D334T, D334C, D334Y, D334N, D334K, D334R, D334H, D334S, D334Q, S336G, S336E, S336A, S336V, S336I, S336M, S336F, S336W, S336P, S336L, S336T, S336C, S336Y, S336N, S336K, S336R, S336H, S336D, S336Q, K337L, K337V, K337I, K337M, K337F, K337W, K337P, K337G, K337S, K337T, K337C, K337Y, K337N, K337E, K337R, K337H, K337D, K337Q, K341E, K341Q, K341G, K341T, K341A, K341S, G342N, H348N, R353N, Y357N, I361N, F374P, F374A, F374V, F374I, F374L, F374M, F374W, F374G, F374S, F374T, F374C, F374Y, F374N, F374E, F374K, F374R, F374H, F374D, F374Q, V376N, R379N, L390C, L390K, L390D, L390E, M391D, M391C, M391K, M391N, M391E, R392C, R392D, R392E, S393D, S393C, S393K, S393E, E394K, P395K, E394C, P395D, P395C, P395E, R396K, R396C, R396D, R396E, P397D, P397K, P397C, P397E, G398K, G398C, G398D, G398E, V399C, V399D, V399K, V399E, L400K, L401K, L401C, L401D, L401E, R402D, R402C, R402K, R402E, A403K, A403C, A403D, A403E, P404E, P404D, P404C, P404K, F405K, P406C, K32N/A34S, K32N/A34T, F31N/D33S, F31N/D33T, I30N/K32S, I30N/K32T, A34N/R36S, A34N/R36T, K38N/F40S, K38N/F40T, T37N/L39S, T37N/L39T, R36N/K38S, R36N/K38T, L39N/W41S, L39N/W41T, F40N/I42S, F40N/I42T, I42N/Y44S, I42N/Y44T, Y44N/D46S, Y44N/D46T, D46N/D48S, D46N/D48T, G47N/Q49S, G47N/Q49T, K143N/N145S, K143N/N145T, E142N/R144S, E142N/R144T, L141N/K143S, L141N/K143T, I140N/E142S/, I140N/E142T, R144N/A146S, R144N/A146T, A146N/K148S, A146N/K148T, S147N/P149S/, S147N/P149T, R290N/A292S, R290N/A292T, D289N/G291S, D289N/G291T, L288N/R290S, L288N/R290T, L287N/D289S, L287N/D289, A292N/A294S, A292N/A294T, T293N/L295S, T293N/L295T, R315N/V317S, R315N/V317T, S314N/K316S, S314N/K316T, Q313N/R315S, Q313N/R315T, K316N/G318S, K316N/G318T, V317N/D319S, V317N/D319T, K341N/D343S, K341N/D343T, S339N/K341S, S339N/K341T, D343N/G345S, D343N/G345T, R392N/E394S, R392N/E394T, L390N/R392S, L390N/R392T, K389N/M391S, K389N/M391T, S393N/P395S, S393N/P395T, E394N/R396S, E394N/R396T, P395N/P397S, P395N/P397T, R396N/G398S, R396N/G398T, P397N/V399S, P397N/V399T, G398N/L400S, G398N/L400T, V399N/L401S, V399N/L401T, L400N/R402S, L400N/R402T, L401N/A403S, L401N/A403T, R402N/P404S, R402N/P404T, A403N/F405S, A403N/F405T, P404N/P406S та P404N/P406T.
23. Модифікований поліпептид FVII за будь-яким із пп. 1-22, де немодифікований поліпептид FVII має амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3.
24. Модифікований поліпептид FVII за будь-яким із пп. 1-23, який має амінокислотну послідовність, представлену будь-якою з послідовностей SEQ ID NO: 18-43, SEQ ID NO: 125-146, SEQ ID NO: 206-235, SEQ ID NO: 241-246 та SEQ ID NO: 248-250.
25. Модифікований поліпептид FVII за будь-яким із пп. 1-24, де немодифікований поліпептид FVII являє собою алельний або видовий варіант поліпептиду, який представлений послідовністю SEQ ID NO: 3.
26. Модифікований поліпептид FVII за будь-яким із пп. 1-25, який є людським поліпептидом.
27. Модифікований поліпептид FVII за будь-яким із пп. 1-25, який є нелюдським поліпептидом.
28. Модифікований поліпептид FVII за будь-яким із пп. 1-27, який є активним або зрілим поліпептидом.
29. Модифікований поліпептид FVII за будь-яким із пп. 1-28, де модифікованою є лише первинна послідовність.
30. Модифікований поліпептид FVII за будь-яким із пп. 1-28, який додатково містить хімічну модифікацію або посттрансляційну модифікацію.
31. Модифікований поліпептид FVII за п. 30, де поліпептид FVII є глікозилованим, карбоксилованим, гідроксилованим, сульфатованим, фосфорилованим, альбумінованим або кон'югованим із поліетиленгліколевою (PEG) складовою.
32. Модифікований поліпептид FVII за будь-яким із пп. 1-31, який являє собою одноланцюговий поліпептид.
33. Модифікований поліпептид FVII за будь-яким із пп. 1-31, який являє собою дволанцюговий поліпептид.
34. Модифікований поліпептид FVII за будь-яким із пп. 1-31, який є активним або активованим.
35. Модифікований поліпептид за будь-яким із пп. 2-34, де згадана додаткова модифікація підвищує коагуляційну активність, порівняно з поліпептидом FVII, який не має такої додаткової амінокислотної модифікації.
36. Молекула нуклеїнової кислоти, яка містить послідовність нуклеотидів, що кодує модифікований поліпептид FVII за будь-яким із
пп. 1-35.
37. Вектор, який містить молекулу за п. 36.
38. Вектор за п. 37, який є вектором на основі прокаріотних клітин, вірусним вектором або вектором на основі еукаріотних клітин.
39. Вектор за п. 37, який являє собою вектор на основі клітин ссавців.
40. Вектор за п. 37, де вірусний вектор вибраний з-посеред аденовірусу, аденоасоційованого вірусу, ретровірусу, вірусу герпесу, лентивірусу, вірусу групи віспи та вірусу цитомегалії.
41. Виділена клітина, яка містить вектор за будь-яким із пп. 37-40.
42. Клітина за п. 41, яка є еукаріотною клітиною.
43. Клітина за п. 42, де згаданою еукаріотною клітиною є клітина ссавця.
44. Клітина, що містить вектор за будь-яким із пп. 37-40, яка є клітиною ссавця, вибраною з-посеред клітин нирок дитинча хом'ячка (BHK-21), клітин лінії 293 або клітин CHO.
45. Клітина, яка містить вектор за будь-яким із пп. 37-40, яка являє собою дріжджову клітину.
46. Клітина за п. 45, яка являє собою клітину Pichia sp.
47. Клітина за п. 46, яка являє собою клітину Pichia pastoris.
48. Фармацевтична композиція, яка містить терапевтично ефективну концентрацію або кількість модифікованого поліпептиду FVII за будь-яким із пп. 1-35, або молекули за п. 36, або вектора за будь-яким із пп. 37-40, або клітини за будь-яким із пп. 31-47 у фармацевтично прийнятному носії.
49. Фармацевтична композиція за п. 48, призначена для місцевого або системного введення.
50. Фармацевтична композиція за п. 48, призначена для перорального, назального, долегеневого, доротового, черезшкірного, підшкірного, інтрадуоденального, ентерального, парентерального, внутрішньовенного або внутрішньом'язового введення.
51. Фармацевтична композиція за будь-яким із пп. 48-50, призначена для пролонгованого виділення.
52. Фармацевтична композиція за будь-яким із пп. 48-51, призначена для введення разовою дозою.
53. Спосіб, який включає лікування пацієнта шляхом введення фармацевтичної композиції за будь-яким із пп. 48-53, де згаданий пацієнт має захворювання або стан, що лікується шляхом введення FVII або прокоагулянта.
54. Спосіб за п. 53, який відрізняється тим, що згадане захворювання або стан лікують шляхом введення проферменту або активної форми FVII.
55. Спосіб за п. 53 або п. 54, який відрізняється тим, що захворювання або стан, що підлягає лікуванню, вибране(ий) з-посеред розладів згортання крові, гематологічних розладів, геморагічних розладів, гемофілії, дефіциту фактора VII, розладів з кровотечею, кровотечі, пов'язаної з оперативним втручанням, або кровотечі, що є наслідком травми.
56. Модифікований поліпептид FVII за будь-яким із пп. 1-35 для застосування для лікування захворювання або стану, що лікується шляхом введення FVII або прокоагулянта.
57. Застосування фармацевтичної композиції за будь-яким із пп. 48-52 для виготовлення лікарського засобу для лікування захворювання або стану, що лікується шляхом введення FVII або прокоагулянта.
58. Модифікований поліпептид FVII за п. 56 або застосування за п. 57, де захворювання або стан лікується шляхом введення проферменту або активної форми FVII.
59. Модифікований поліпептид FVII за п. 56 або п. 58, або застосування за п. 57 або п. 58, де захворювання або стан, що підлягає лікуванню, вибране(ий) з-посеред розладів згортання крові, гематологічних розладів, геморагічних розладів, гемофілії, дефіциту фактора VII, розладів із кровотечею, кровотечі, пов'язаної з оперативним втручанням, або кровотечі, спричиненої травмою.
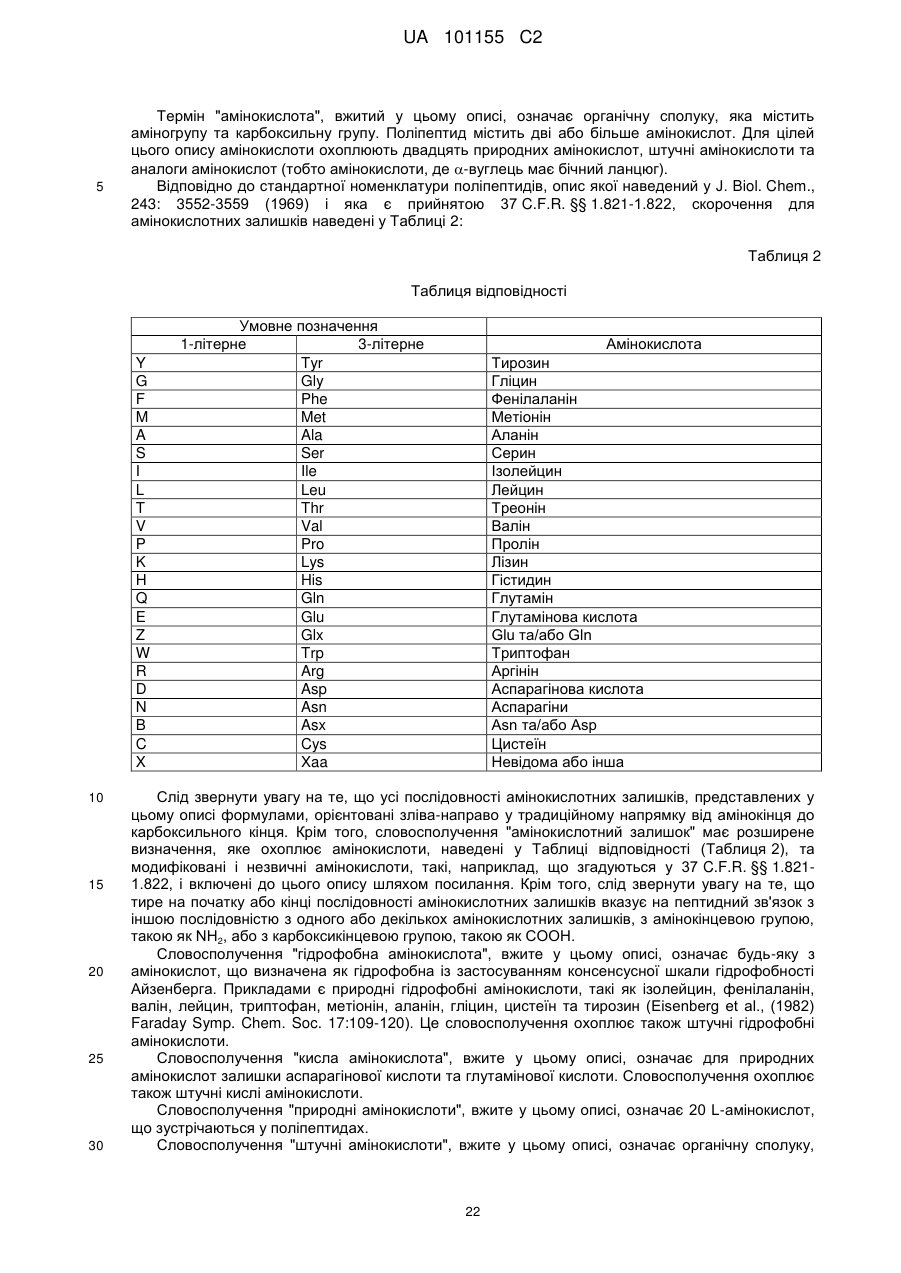
Текст
Реферат: UA 101155 C2 (12) UA 101155 C2 Винахід належить до модифікованого поліпептиду фактора VII (FVII), який має заміни в позиціях D196, K197, K199 тощо, які призводять до підвищеної коагулянтної активності та/або підвищеної стійкості до інгібіторів, порівняно з немодифікованим поліпептидом. Винахід також належить до молекули нуклеїнової кислоти, що кодує даний поліпептид, вектору, виділеної клітини, фармацевтичної композиції, способу лікування та застосування фармацевтичної композиції для виготовлення лікарського засобу для лікування захворювання або стану, що лікується шляхом введення FVII або прокоагулянта. UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 Споріднені заявки Ця заявка претендує на пріоритет за попередньою заявкою на патент США № 60/923,512 на ім'я Едвін Медісон (Edwin Madison), Крістофер Танос (Christopher Thanos), Сандра Уоф Рагглз (Sandra Waugh Ruggles) та Шон Кофлін (Shaun Coughlin), яка має назву "MODIFIED FACTOR VII POLYPEPTIDES AND USES THEREOF" і яка була подана 13 квітня 2007 року. Ця заявка є спорідненою до пов'язаної заявки на патент США № 12/082,662 на ім'я Едвін Медісон (Edwin Madison), Крістофер Танос (Christopher Thanos), Сандра Уоф Рагглз (Sandra Waugh Ruggles) та Шон Кофлін (Shaun Coughlin), яка має назву "MODIFIED FACTOR VII POLYPEPTIDES AND USES THEREOF", яка також претендує на пріоритет у за попередньою заявкою на патент США № 60/923,512. Там, де це дозволяється, предмет кожної з вищезгаданих заявок включено до цього опису у повному обсязі шляхом посилання. Галузь, до якої належить винахід Пропонуються модифіковані терапевтичні білки. Зокрема, пропонуються модифіковані поліпептиди фактора VII, в тому числі поліпептиди фактора VIIa та інших форм фактора VII, і їх застосування. Передумови створення винаходу Гемостаз являє собою складний фізіологічний процес, який призводить до припинення кровотечі. Тромбоцити, білки плазми, кровоносні судини та ендотеліальні клітини являють собою три складові цього процесу, в якому кожна з них відіграє важливу роль у явищах, які відбуваються негайно після пошкодження тканини, і результатом яких у нормальних умовах є швидке утворення згустка крові. Центральною частиною цього процесу є коагуляційний каскад, ряд протеолітичних явищ, у яких певні білки плазми (або коагуляційні фактори) послідовно активуються у "каскаді" іншим заздалегідь активованим коагуляційним фактором, що призводить до швидкого утворення тромбіну. Великі кількості тромбіну, який продукується у цьому каскаді, у подальшому розщеплюють фібриноген на пептиди фібрину, які є необхідними для утворення згустка крові. Коагуляційні фактори циркулюють як неактивні одноланцюгові проферменти, які активуються розщепленням у одному або декількох положеннях з утворенням дволанцюгової активованої форми білка. Фактор VII (FVII), вітамін K-залежний білок плазми, спочатку циркулює у крові як профермент. Профермент FVII активується протеолітичним розщепленням на одному 152 153 сайті, Arg -Ile , результатом чого є утворення дволанцюгової протеази, зв'язаної одним дисульфідним зв'язком (FVIIa). FVIIa зв'язує свій кофактор, тканинний фактор (TF), з утворенням комплексу, у якому FVIIa може ефективно активувати фактор X (FX) до FXa, ініціюючи тим самим низку явищ, результатом яких є утворення фібрину та гемостаз. Незважаючи на те, що у більшості випадків досягається нормальний гемостаз, порушення у процесі можуть призвести до виникнення розладів із кровотечею, які спричинюють подовження часу, необхідного для утворення згустка крові. Такі розлади можуть бути вродженими або набутими. Наприклад, гемофілія А та гемофілія В являють собою спадкові захворювання, які характеризуються дефіцитом фактора VIII (FVIII) та фактора IX (FIX), відповідно. Замісна терапія, яка є традиційним способом лікування гемофілії A та гемофілії B, передбачає внутрішньовенне введення FVIII або FIX, одержаних із людської плазми або у вигляді рекомбінантних білків. Однак у багатьох випадках у пацієнтів утворюються антитіла (відомі також як інгібітори) проти введених шляхом вливання білків, які зменшують або зводять ® нанівець ефективність лікування. Рекомбінантний FVIIa (Novoseven ) був схвалений для лікування пацієнтів, що страждають на гемофілію А або гемофілію В, які мають інгібітори FVIII або FIX; згаданий рекомбінантний фактор застосовують також для припинення епізодів кровотечі або запобігання кровотечі, пов'язаній з травмою та/або оперативним втручанням. Рекомбінантний FVIIa був схвалений також для лікування пацієнтів із вродженою недостатністю FVII, і згаданий фактор застосовується при лікуванні все більшої кількості розладів, наприклад, для лікування кровотечі, пов'язаної з іншими вродженими або набутими розладами з кровотечею, з травмою та оперативним втручанням в організм пацієнтів, які не страждають на гемофілію. Застосування рекомбінантного FVIIa для стимулювання утворення згустка крові підкреслює його зростаючу важливість як терапевтичного засобу. Однак лікування FVIIa залишається таким, що суттєво не задовольняє медичну потребу. Наприклад, виходячи з даних клінічних випробувань, для надання допомоги при епізодах гострої кровотечі у пацієнтів, що страждають на гемофілію, необхідно у середньому 3 дози FVIIa впродовж періоду часу тривалістю шість або більше годин. Для зменшення необхідної кількості доз потрібні більш ефективні варіанти FVIIa. Отже, однією з цілей з-посеред наведених у цьому описі є надання модифікованих поліпептидів 1 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 FVII, розроблених так, щоб мати поліпшені терапевтичні властивості. Короткий виклад суті винаходу Цим винаходом пропонуються модифіковані поліпептиди фактора VII (FVII). Зокрема, цим винаходом пропонуються модифіковані поліпептиди FVII, які демонструють прокоагулянтну активність. Поліпептиди FVII є модифікованими у первинній послідовності, порівняно з немодифікованим поліпептидом FVII, і можуть містити амінокислотні інсерції, делеції та заміни. Модифіковані поліпептиди FVII, що пропонуються цим винаходом, охоплюють поліпептиди FVII, які демонструють підвищену стійкість до інгібувальної дії інгібітора шляху тканинного фактора (TFPI), підвищену стійкість до інгібувальної дії антитромбіну-III (AT-III), зменшену інтенсивність 2+ зв'язування Zn , поліпшені фармакокінетичні властивості, такі як підвищений період напіввиведення, підвищена каталітична активність у присутності та/або за відсутності TF та/або підвищена інтенсивність зв'язування з активованими тромбоцитами. Модифіковані поліпептиди FVII можуть містити будь-яку комбінацію модифікацій, які пропонуються цим винаходом, завдяки яким одна або декілька активностей або властивостей поліпептиду є зміненими, порівняно з немодифікованим поліпептидом FVII. За типовим варіантом модифікований поліпептид FVII зберігає прокоагулянтну активність. Цим винаходом також пропонуються нуклеїновокислотні молекули, вектори та клітини, які кодують/експресують модифіковані поліпептиди FVII. Цим винаходом також пропонуються фармацевтичні композиції, готові вироби, набори та способи лікування. Поліпептиди FVII охоплюють алельні та видові варіанти і поліпептиди та інші варіанти, що мають модифікації, які впливають на інші активності та/або властивості. Цей винахід охоплює також активні фрагменти поліпептидів FVII, які містять модифікацію, що пропонується цим винаходом. Прикладами поліпептидів FVII є поліпептиди, які містять амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, а також їх варіанти, які мають з нею 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 88 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або більшу ідентичність послідовності. Поліпептиди фактора VII (FVII) є модифікованими у первинній послідовності, порівняно з немодифікованим поліпептидом FVII, і можуть містити амінокислотні інсерції, делеції та заміни. Модифіковані поліпептиди FVII, що пропонуються цим винаходом, охоплюють поліпептиди FVII, які демонструють підвищену стійкість до інгібувальної дії TFPI, підвищену стійкість до 2+ інгібувальної дії AT-III, зменшену інтенсивність зв'язування Zn , поліпшені фармакокінетичні властивості, такі як підвищений період напіввиведення, підвищену каталітичну активність у присутності та/або за відсутності (тканинного фактора) TF та/або підвищену інтенсивність зв'язування з активованими тромбоцитами. Модифіковані поліпептиди FVII можуть містити будь-яку комбінацію модифікацій, які пропонуються цим винаходом, завдяки яким одна або декілька активностей або властивостей поліпептиду є зміненими, порівняно з немодифікованим поліпептидом FVII. Поліпептиди FVII можуть містити інші модифікації, які змінюють інші властивості та/або активності. За типовим варіантом модифікований поліпептид FVII зберігає прокоагулянтну активність. Цим винаходом також пропонуються нуклеїновокислотні молекули, вектори та клітини, які кодують/експресують модифіковані поліпептиди FVII. Цим винаходом також пропонуються фармацевтичні композиції, готові вироби, набори та способи лікування. Зокрема, пропонуються модифіковані поліпептиди фактора VII (FVII), їх алельні та видові варіанти або активні фрагменти чи інші їх варіанти. Цим винаходом пропонуються поліпептиди FVII, в тому числі їх алельні та видові варіанти або активні фрагменти, які містять модифікацію, яка знаходиться у положенні, що відповідає положенню D196, K197 або K199 у поліпептиді FVII з послідовністю, яка представлена послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII, в тому числі його алельних та видових варіантах, активних фрагментах та інших поліпептидах FVII, модифікованих для одержання інших активностей або властивостей. Поліпептиди FVII містять щонайменше одну модифікацію у положенні, що відповідає положенню D196, K197 або K199 у поліпептиді FVII, який містить амінокислотну послідовність, яка представлена послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII. Згаданою модифікацією є інсерція та/або заміна на гідрофобну або кислу амінокислоту, вибрану з-посеред Val (V), Leu (L), Ile (I), Phe (F), Trp (W), Met (M), Tyr (Y), Cys (C), Asp (D) та Glu (E). Коли пропонується активний фрагмент, згаданий активний фрагмент містить такі модифікації. Наприклад, пропонуються модифіковані поліпептиди фактора VII (FVII), його алельні та видові варіанти або активні фрагменти чи інші варіанти, які також містять заміну, вибрану з-посеред D196F, D196W, D196L, D196I, D196Y, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199D, K199E та K197Y. Крім того, модифіковані поліпептиди FVII, що пропонуються, можуть містити іншу модифікацію, у тому числі амінокислотну заміну, інсерцію або делецію, у іншому положенні у поліпептиді FVII. За деякими прикладами згаданою іншою модифікацією є амінокислотна заміна 2 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 у положенні, що відповідає положенню, вибраному з-посеред D196, K197, K199, G237, T239, R290 та K341, де перша модифікація та друга модифікація припадають на різні амінокислоти. До цих модифікацій можуть належати (але без обмеження ними) D196K, D196R, D196A, D196Y, D196F, D196W, D196L, D196I, K197Y, K197A, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199A, K199D, K199E, G237W, G237T, G237I, G237V, T239A, R290A, R290E, R290D, R290N, R290Q, R290K, K341E, K341R, K341N, K341M, K341D та K341Q. Іншими прикладами модифікацій є амінокислотні інсерції, наприклад (але без обмеження ними), будьяка з наведених нижче інсерцій: G237T238insA, G237T238insS, G237T238insV, G237T238insAS, G237T238insSA, D196K197insK, D196K197insR, D196K197insY, D196K197insW, D196K197insA, D196K197insM, K197I198insE, K197I198insY, K197I198insA та K197I198insS. До інших прикладів модифікованих поліпептидів FVII належать такі модифікації: D196R/K197E/K199E, D196K/K197E/K199E, D196R/K197E/K199E/R290E, D196R/K197M/K199E, D196R/K197M/K199E/R290E, D196K/K197L, D196F/K197L, D196L/K197L, D196M/K197L, D196W/K197L, D196F/K197E, D196W/K197E, K196V/K197E, K197E/K341Q, K197L/K341Q, K197E/G237V/K341Q, K197E/K199E, K197E/G237V, K199E/K341Q та K197E/K199E/K341Q. Пропонуються також модифіковані поліпептиди FVII, а також їх алельні та видові варіанти або активні фрагменти чи інші їх варіанти, що також можуть містити амінокислотні модифікації, які відповідають будь-якій або декільком із наведених нижче: D196R, D196Y, D196F, D196W, D196L, D196I, K197Y, K197E, K197D, K197L, K197M, K197M, K197I, K197V, K197F, K197W, K199D, K199E, G237W, G237I, G237V, R290M, R290V, K341M, K341D, G237T238insA, G237T238insS, G237T238insV, G237T238insAS, G237T238insSA, D196K197insK, D196K197insR, D196K197insY, D196K197insW, D196K197insA, D196K197insM, K197I198insE, K197I198insY, K197I198insA або K197I198insS у поліпептиді FVII, що має амінокислотну послідовність, яка представлена послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII. Крім того, ці модифіковані поліпептиди FVII можуть містити іншу модифікацію, у тому числі амінокислотну заміну, інсерцію або делецію, у іншому положенні у поліпептиді FVII. У деяких прикладах згаданою додатковою модифікацією може бути амінокислотна заміна у положенні, що відповідає положенню D196, K197, K199, G237, T239, R290 та K341, де згадана інша модифікація знаходиться у іншому положенні, порівняно з першою модифікацією. Наприклад, модифікований поліпептид FVII може також містити амінокислотну заміну, вибрану з-посеред D196K, D196R, D196A, D196Y, D196F, D196M, D196W, D196L, D196I, K197Y, K197A, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199A, K199D, K199E, G237W, G237T, G237I, G237V, T239A, R290A, R290E, R290D, R290N, R290Q, R290K, K341E, K341R, K341N, K341M, K341D та K341Q. Прикладами такого модифікованого поліпептиду FVII є поліпептиди, які містять модифікації, вибрані з-посеред D196R/R290E, D196R/R290D, D196R/K197E/K199E, D196K/K197E/K199E, D196R/K197E/K199E/R290E, D196R/K197M/K199E, D196R/K197M/K199E/R290E, D196K/K197L, D196F/K197L, D196L/K197L, D196M/K197L, D196W/K197L, D196F/K197E, D196W/K197E, K197L/K341Q, G237V/K341Q, K197E/G237V/K341Q, K197E/K199E, K197E/G237V, K199E/K341Q, K197E/K199E/K341Q та K196V/K197E. У деяких випадках модифікований поліпептид фактора FVII (FVII), а також його алельні та видові варіанти або його активні фрагменти чи інші його варіанти, можуть містити дві або декілька модифікацій поліпептиду FVII, де щонайменше дві амінокислотні модифікації відповідають D196K, D196R, D196A, D196Y, D196F, D196M, D196W, D196L, D196I, K197Y, K197A, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199A, K199D, K199E, G237W, G237T, G237I, G237V, T239A, R290A, R290E, R290D, R290N, R290Q, R290K, K341E, K341R, K341N, K341M, K341D, K341Q, G237T238insA, G237T238insS, G237T238insV, G237T238insAS, G237T238insSA, D196K197insK, D196K197insR, D196K197insY, D196K197insW, D196K197insA, D196K197insM, K197I198insE, K197I198insY, K197I198insA або K197I198insS у поліпептиді FVII, що має або містить амінокислотну послідовність, яка представлена послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII. Згаданий поліпептид може містити більше ніж дві модифікації, наприклад, 2 модифікації, 3 модифікації, 4 модифікації, 5 модифікацій, 6 модифікацій або 7 модифікацій. Прикладами таких поліпептидів є поліпептиди FVII, які містять модифікації, вибрані зпосеред D196R/R290E, D196K/R290E, D196R/R290D, D196R/K197E/K199E, D196K/K197E/K199E, D196R/K197E/K199E/R290E, D196R/K197M/K199E, D196R/K197M/K199E/R290E, D196K/K197L, D196F/K197L, D196L/K197L, D196M/K197L, D196W/K197L, D196F/K197E, D196W/K197E, D196V/K197E, K197E/K341Q, K197L/K341Q, G237V/K341Q, K197E/G237V/K341Q, K197E/K199E, K197E/G237V, K199E/K341Q, K197E/K199E/K341Q та K197E/G237V/M298Q. Будь-який з вищезгаданих модифікованих поліпептидів FVII може демонструвати підвищену 3 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 стійкість до інгібітора шляху тканинного фактора (TFPI), порівняно з немодифікованим поліпептидом FVII. У деяких прикладах модифікований поліпептид FVII має підвищену на або щонайменше приблизно на 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше стійкість до TFPI. Крім того, ці модифіковані поліпептиди FVII можуть також містити гетерологічний Gla-домен або достатню його частину для здійснення зв'язування фосфоліпідів. Цим винаходом також пропонуються модифіковані поліпептиди FVII, які містять гетерологічний Gla-домен або достатню його частину, наприклад, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або більше гетерологічного Gla-домену для здійснення зв'язування фосфоліпідів. Будь-який або усі з вищезгаданих модифікованих поліпептидів FVII можуть також містити заміну Gla, у тому числі заміни Gla, приклади яких та опис наводяться у цьому документі. Гетерологічний Gla-домен може бути вибраний з-посеред Gla-доменів фактора IX (FIX), фактора X (FX), протромбіну, білка C, білка S, остеокальцину, матричного Gla-білка, білка блокування росту 6 (Gas6) або білка Z. У деяких прикладах гетерологічний Gla-домен модифікованого поліпептиду FVII, що пропонується цим винаходом, має амінокислотну послідовність, представлену будь-якою з послідовностей SEQ ID NO: 110-118, SEQ ID NO: 120 та SEQ ID NO: 121, або достатню її частину для здійснення зв'язування фосфоліпідів. Модифікації поліпептиду FVII можуть здійснюватись шляхом видалення усього або суміжної частини нативного Gla-домену FVII, який може містити амінокислоти 1-45 у поліпептиді FVII, який має або містить амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII, і заміни його на гетерологічний Gla-домен або достатню його частину для здійснення зв'язування фосфоліпідів, наприклад, для підвищення інтенсивності зв'язування. Результатом таких модифікацій може бути модифікований поліпептид FVII, що демонструє підвищене зв'язування фосфоліпідів, порівняно з немодифікованим поліпептидом FVII. Наприклад, модифікований поліпептид FVII може демонструвати підвищене на або щонайменше приблизно на 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше зв'язування фосфоліпідів. Модифіковані поліпептиди FVII можуть мати весь (або суміжну частину) нативний Gla-домен FVII, видалений або замінений на гетерологічний Gla-домен (або достатню його частину) для здійснення зв'язування фосфоліпідів. Прикладами таких поліпептидів є поліпептиди, у яких нативний Gla-домен FVII містить амінокислоти 1-45 у поліпептиді FVII, який має або містить амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII. Модифікації Gla охоплюють (але не обмежуються ними) модифікації, вибрані з-посеред заміни на Gla з FIX, заміни на Gla з FX, заміни на Gla з білка С, заміни на Gla з білка S та заміни на Gla з тромбіну. В результаті заміни Gla модифікований поліпептид FVII може демонструвати підвищене зв'язування фосфоліпідів. Таке підвищення може становити підвищене на або щонайменше приблизно на 0,5 %, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше зв'язування фосфоліпідів. Модифіковані поліпептиди FVII, які містять гетерологічні Gla-домени, можуть містити інші модифікації у положеннях, що призводять до або демонструють підвищену стійкість до інгібітора шляху тканинного фактора (TFPI), порівняно з немодифікованим поліпептидом FVII. Прикладами таких модифікацій є одна або декілька амінокислотних модифікацій у положеннях, вибраних з-посеред D196, K197, K199, G237, T239, R290 та K341 у поліпептиді FVII, який має або містить амінокислотну послідовність, яка представлена послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII. Конкретно, такі модифікації можуть включати в себе одну або декілька амінокислотних модифікацій, вибраних з-посеред D196K, D196R, D196A, D196Y, D196F, D196M, D196W, D196L,D196I, K197Y, K197A, K197E, K197D, K197L, K197M, K197I, K197V, K197F, K197W, K199A, K199D, K199E, G237W, G237T, G237I, G237V, T239A, R290A, R290E, R290D, R290N, R290Q, R290K, K341E, K341R, K341N, K341M, K341D, K341Q, G237T238insA, G237T238insS, G237T238insV, G237T238insAS, G237T238insSA, D196K197insK, D196K197insR, D196K197insY, D196K197insW, D196K197insA, D196K197insM, K197I198insE, K197I198insY, K197I198insA та K197I198insS. Наприклад, модифіковані поліпептиди FVII, які містять гетерологічний Gla-домен, можуть також містити амінокислотні заміни та/або інсерції, такі як (але без обмеження ними) D196R/R290E, D196K/R290E, D196R/R290D, 4 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 D196R/K197E/K199E, D196K/K197E/K199E, D196R/K197E/K199E/R290E, D196R/K197M/K199E та D196R/K197M/K199E/R290E. У деяких випадках результатом таких подальших модифікацій є підвищена стійкість згаданого модифікованого поліпептиду до TFPI, порівняно з поліпептидом FVII, який не містить згаданої модифікації, тобто немодифікованим FVII. Будь-який з модифікованих поліпептидів FVII, опис яких наведений вище, у тому числі поліпептиди, які демонструють підвищену стійкість до TFPI або підвищене зв'язування із фосфоліпідами чи будь-яку їх комбінацію, можуть також містити інші модифікації, у тому числі будь-які з тих, опис яких наведений у цій галузі. Такі інші амінокислотні модифікації можуть підвищувати стійкість до антитромбіну-III (AT-III), підвищувати зв'язування з фосфоліпідами та/або спорідненість до них, підвищувати спорідненість до тканинного фактора (TF), підвищувати притаманну активність, змінювати конформацію поліпептиду для зміни форми проферменту, у тому числі змінювати конформацію із наданням більш проферментоподібної форми або менш проферментоподібної форми, підвищувати стійкість до протеаз, зменшувати глікозилування, підвищувати глікозилування, зменшувати імуногенність, підвищувати стабільність та/або полегшувати зв'язування хімічних груп. Наприклад, модифіковані поліпептиди FVII, що пропонуються цим винаходом, можуть містити модифікацію(-ії) у положенні Q176, M298 або E296 у поліпептиді FVII, який має або містить амінокислотну послідовність, яка представлена послідовністю SEQ ID NO: 3, або у відповідних залишках поліпептиду FVII. У деяких прикладах модифіковані поліпептиди FVII можуть також містити амінокислотні модифікації з числа Q176A, M298Q, E296V та/або E296A. За іншими прикладами модифіковані поліпептиди FVII можуть також містити, крім Gla та/або інших визначених модифікацій, одну або декілька з наведених нижче подальших амінокислотних модифікацій: S278C/V302C, L279C/N301C, V280C/V301C, S281C/V299C, інсерцію тирозину у положенні 4, F4S, F4T, P10Q, P10E, P10D, P10N, Q21N, R28F, R28E, I30C, I30D, I30E, K32D, K32Q, K32E, K32G, K32H, K32T, K32C, K32A, K32S, D33C, D33F, D33E, D33K, A34C, A34E, A34D, A34I, A34L, A34M, A34V, A34F, A34W, A34Y, R36D, R36E, T37C, T37D, T37E, K38C, K38E, K38T, K38D, K38L, K38G, K38A, K38S, K38N, K38H, L39E, L39Q, L39H, W41N, W41C, W41E, W41D, I42R, I42N, I42S, I42A, I42Q, I42N, I42S, I42A, I42Q, I42K, S43Q, S43N, Y44K, Y44C, Y44D, Y44E, S45C, S45D, S45E, D46C, A51N, S53N, G58N, G59S, G59T, K62E, K62R, K62D, K62N, K62Q, K62T, L65Q, L65S, L65N, F71D, F71Y, F71E, F71Q, F71N, P74S, P74A, A75E, A75D, E77A, E82Q, E82N, E82S, E82T T83K, N95S, N95T, G97S, G97T, Y101N, D104N, T106N, K109N, E116D, G117N, G124N, S126N, T128N, L141C, L141D, L141E, E142D, E142C, K143C, K143D, K143E, R144E, R144C, R144D, N145Y, N145G, N145F, N145M, N145S, N145I, N145L, N145T, N145V, N145P, N145K, N145H, N145Q, N145E, N145R, N145W, N145D, N145C, K157V, K157L, K157I, K157M, K157F, K157W, K157P, K157G, K157S, K157T, K157C, K157Y, K157N, K157E, K157R, K157H, K157D, K157Q, V158L, V158I, V158M, V158F, V158W, V158P, V158G, V158S, V158T, V158C, V158Y, V158N, V158E, V158R, V158K, V158H, V158D, V158Q, A175S, A175T, G179N, I186S, I186T, V188N, R202S, R202T, I205S, I205T, D212N, E220N, I230N, P231N, P236N, G237N, Q250C, V253N, E265N, T267N, E270N, A274M, A274L, A274K, A274R, A274D, A274V, A274I, A274F, A274W, A274P, A274G, A274T, A274C, A274Y, A274N, A274E, A274H, A274S, A274Q, F275H, R277N, F278S, F278A, F278N, F278Q, F278G, L280N, L288K, L288C, L288D, D289C, D289K, L288E, R290C, R290G, R290A, R290S, R290T, R290K, R290D, R290E, G291E, G291D, G291C, G291N, G291K, A292C, A292K, A292D, A292E, T293K, E296V, E296L, E296I, E296M, E296F, E296W, E296P, E296G, E296S, E296T, E296C, E296Y, E296N, E296K, E296R, E296H, E296D, E296Q, M298Q, M298V, M298L, M298I, M298F, M298W, M298P, M298G, M298S, M298T, M298C, M298Y, M298N, M298K, M298R, M298H, M298E, M298D, P303S, P303ST, R304Y, R304F, R304L, R304M, R304G, R304T, R304A, R304S, R304N, L305V, L305Y, L305I, L305F, L305A, L305M, L305W, L305P, L305G, L305S, L305T, L305C, L305N, L305E, L305K, L305R, L305H, L305D, L305Q, M306D, M306N, D309S, D309T, Q312N, Q313K, Q313D, Q313E, S314A, S314V, S314I, S314M, S314F, S314W, S314P, S314G, S314L, S314T, S314C, S314Y, S314N, S314E, S314K, S314R, S314H, S314D, S314Q, R315K, R315G, R315A, R315S, R315T, R315Q, R315C, R315D, R315E, K316D, K316C, K316E, V317C, V317K, V317D, V317E, G318N, N322Y, N322G, N322F, N322M, N322S, N322I, N322L, N322T, N322V, N322P, N322K, N322H, N322Q, N322E, N322R, N322W, N322C, G331N, Y332S, Y332A, Y332N, Y332Q, Y332G, D334G, D334E, D334A, D334V, D334I, D334M, D334F, D334W, D334P, D334L, D334T, D334C, D334Y, D334N, D334K, D334R, D334H, D334S, D334Q, S336G, S336E, S336A, S336V, S336I, S336M, S336F, S336W, S336P, S336L, S336T, S336C, S336Y, S336N, S336K, S336R, S336H, S336D, S336Q, K337L, K337V, K337I, K337M, K337F, K337W, K337P, K337G, K337S, K337T, K337C, K337Y, K337N, K337E, K337R, K337H, K337D, K337Q, K341E, K341Q, K341G, K341T, K341A, K341S, G342N, H348N, 5 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 R353N, Y357N, I361N, F374P, F374A, F374V, F374I, F374L, F374M, F374W, F374G, F374S, F374T, F374C, F374Y, F374N, F374E, F374K, F374R, F374H, F374D, F374Q, V376N, R379N, L390C, L390K, L390D, L390E, M391D, M391C, M391K, M391N, M391E, R392C, R392D, R392E, S393D, S393C, S393K, S393E, E394K, P395K, E394C, P395D, P395C, P395E, R396K, R396C, R396D, R396E, P397D, P397K, P397C, P397E, G398K, G398C, G398D, G398E, V399C, V399D, V399K, V399E, L400K, L401K, L401C, L401D, L401E, R402D, R402C, R402K, R402E, A403K, A403C, A403D, A403E, P404E, P404D, P404C, P404K, F405K, P406C, K32N/A34S, K32N/A34T, F31N/D33S, F31N/D33T, I30N/K32S, I30N/K32T, A34N/R36S, A34N/R36T, K38N/F40S, K38N/F40T, T37N/L39S, T37N/L39T, R36N/K38S, R36N/K38T, L39N/W41S, L39N/W41T, F40N/I42S, F40N/I42T, I42N/Y44S, I42N/Y44T, Y44N/D46S, Y44N/D46T, D46N/D48S, D46N/D48T, G47N/Q49S, G47N/Q49T, K143N/N145S, K143N/N145T, E142N/R144S, E142N/R144T, L141N/K143S, L141N/K143T, I140N/E142S/, I140N/E142T, R144N/A146S, R144N/A146T, A146N/K148S, A146N/K148T, S147N/P149S/, S147N/P149T, R290N/A292S, R290N/A292T, D289N/G291S, D289N/G291T, L288N/R290S, L288N/R290T, L287N/D289S, L287N/D289, A292N/A294S, A292N/A294T, T293N/L295S, T293N/L295T, R315N/V317S, R315N/V317T, S314N/K316S, S314N/K316T, Q313N/R315S, Q313N/R315T, K316N/G318S, K316N/G318T, V317N/D319S, V317N/D319T, K341N/D343S, K341N/D343T, S339N/K341S, S339N/K341T, D343N/G345S, D343N/G345T, R392N/E394S, R392N/E394T, L390N/R392S, L390N/R392T, K389N/M391S, K389N/M391T, S393N/P395S, S393N/P395T, E394N/R396S, E394N/R396T, P395N/P397S, P395N/P397T, R396N/G398S, R396N/G398T, P397N/V399S, P397N/V399T, G398N/L400S, G398N/L400T, V399N/L401S, V399N/L401T, L400N/R402S, L400N/R402T, L401N/A403S, L401N/A403T, R402N/P404S, R402N/P404T, A403N/F405S, A403N/F405T, P404N/P406S та P404N/P406T, V158D/G237V/E296V/M298Q, K197E/G237V/M298Q, K197E/G237V/M298Q/K341Q, K197E/K199E/G237V/M298Q/K341Q, G237V/M298Q, G237V/M298Q/K341Q, M298Q/Заміна на Gla з FIX, K197E/M298Q та M298Q/K341D. Будь-який із модифікованих поліпептидів FVII, що пропонується цим винаходом, може містити одну або декілька інших амінокислотних модифікацій, які підвищують стійкість до антитромбіну-III (AT-III), підвищують зв'язування та/або спорідненість до фосфоліпідів, підвищують спорідненість до тканинного фактора (TF), підвищують притаманну активність, змінюють конформацію поліпептиду зі зміною форми проферменту, підвищують стійкість до протеаз, зменшують глікозилування, підвищують глікозилування, зменшують імуногенність, підвищують стабільність та/або полегшують зв'язування хімічних груп. Наприклад, змінена форма проферменту може забезпечувати одержання більш проферментоподібної форми або менш проферментоподібної форми. Такі модифіковані поліпептиди FVII можуть включати в себе, наприклад, заміну положень 300-322, 305-322, 300-312 або 305-312 на відповідні амінокислоти трипсину, тромбіну або FX або заміну положень 310-329, 311-322 або 233-329 на відповідні амінокислоти трипсину. Модифіковані поліпептиди, що пропонуються цим винаходом, охоплюють поліпептиди, у яких немодифікований поліпептид FVII містить лише або включає в себе амінокислотну послідовність, представлену послідовністю SEQ ID NO: 3. Прикладами модифікованих поліпептидів FVII є поліпептиди, які мають або містять амінокислотну послідовність, представлену будь-якою з послідовностей SEQ ID NO: 18-43, SEQ ID NO: 125-150 та SEQ ID NO: 206-250 або їх алельні чи видові варіанти або інші їх варіанти. Алельний або видовий варіант чи інший варіант може мати 40 %, 50 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 88 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або більше ідентичність послідовності з поліпептидом, представленим послідовністю SEQ ID NO: 3, за виключення амінокислотної(-их) модифікації(-й). До джерел поліпептидів FVII належать люди та інші види, крім людей. Згадані поліпептиди можуть бути зрілими поліпептидами або поліпептидамипопередниками. В деяких варіантах здійснення модифікується лише первинна послідовність поліпептиду FVII. Крім того, поліпептиди FVII можуть містити хімічну модифікацію або посттрансляційну модифікацію, таку як (але без обмеження ними) глікозилування, карбоксилування, гідроксилування, сульфонування, фосфорилування, альбумінування або кон'югування з іншою складовою, такою як поліетиленгліколева (PEG) складова. Модифіковані поліпептиди FVII можуть надаватись у вигляді одноланцюгових поліпептидів або у вигляді сумішей одноланцюгових та дволанцюгових чи багатоланцюгових форм або у вигляді дволанцюгових, триланцюгових чи інших багатоланцюгових форм. Модифіковані поліпептиди FVII можуть надаватись у вигляді неактивних або у вигляді активованих поліпептидів. Активація може здійснюватись, наприклад, шляхом протеолітичного розщеплення, шляхом аутоактивації, розщеплення фактором IX (FIXa), розщеплення фактором X (FXa), розщеплення фактором XII (FXIIa) або розщеплення тромбіном. 6 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 Модифіковані поліпептиди FVII, як правило, зберігають одну або декілька активностей або властивостей немодифікованого поліпептиду FVII. Модифікації можуть охоплювати модифікації у 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50 або 60 амінокислотних положеннях доти, доки поліпептид зберігає щонайменше одну активність FVII немодифікованого поліпептиду FVII. Збереження активності може дорівнювати або становити щонайменше приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 96 %, 97 %, 98 %, 99 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше активності немодифікованого поліпептиду FVII. Активності охоплюють, наприклад, зв'язування тканинного фактора (TF), активацію фактора X (FX), активацію фактора IX (FIX), зв'язування фосфоліпідів та коагуляційну активність. Активності можуть бути підвищеними або зменшеними. До числа модифікованих поліпептидів, що надаються цим винаходом, належать ті, у яких коагуляційна активність є підвищеною. Активність може оцінюватись in vitro або in vivo. Пропонуються також молекули нуклеїнових кислот, які містять послідовність нуклеотидів, яка кодує будь-який з модифікованих поліпептидів FVII. Пропонуються також вектори, такі як прокаріотні вектори або еукаріотні вектори, у тому числі вектори на основі клітин ссавців та вектори на основі вірусного геному. Прикладами векторів на основі вірусного геному є вектори на основі геному аденовірусу, аденоасоційованого вірусу, ретровірусу, вірусу герпесу, лентівірусу, вірусу групи віспи та цитомегаловірусу. Пропонуються також клітини, які містять нуклеїновокислотні молекули або вектори. Згадані клітини можуть бути еукаріотними клітинами, такими як клітини ссавців або клітини дріжджів, чи прокаріотними клітинами. До клітин ссавців належать, наприклад, клітини нирок хом'ячка (BHK-21) або клітини лінії 293 чи клітини яєчника китайського хом'ячка (CHO). Згадані клітини можуть культивуватись в умовах, за яких експресується модифікований поліпептид FVII. Згаданий поліпептид може секретуватись. Пропонується модифікований поліпептид FVII, що продукується такими клітинами. Пропонуються також композиції, які містять модифіковані поліпептиди FVII, що пропонуються цим винаходом. Зокрема, пропонуються фармацевтичні композиції, які містять такі поліпептиди. Згадані композиції можуть містити терапевтично ефективну концентрацію або кількість модифікованого поліпептиду FVII або нуклеїновокислотної молекули чи вектора або клітини, що пропонуються цим винаходом, у фармацевтично прийнятному носії. Фармацевтичні композиції можуть розроблятись для введення однократною дозою або багатократними дозами. Фармацевтичній композиції може надаватись будь-яка форма, така як рідина, гель або тверда речовина, і згадана композиція може пропонуватись у капсулах, контейнерах або інших прийнятних носіях. Композиції можуть виготовлятись для розведення перед введенням або у будь-якій прийнятній формі. Кількість може залежати від розладу, який піддають лікуванню, та/або пацієнта, якого піддають лікуванню, та у разі необхідності може визначатись емпіричним шляхом. Фармацевтична композиція може виготовлятись для будь-якого шляху введення, у тому числі, наприклад, для місцевого, системного або локального введення, чи виготовлятись для перорального, назального, долегеневого, защічного, черезшкірного, підшкірного, інтрадуоденального, ентерального, парентерального, внутрішньовенного або внутрішньом'язового введення. Фармацевтичні композиції можуть виготовлятись для пролонгованого виділення. Пропонуються також способи лікування та варіанти застосування композицій для лікування. Фармацевтичні композиції вводять або виготовляють для введення пацієнту, який має захворювання або стан, який лікується шляхом введення FVII, у тому числі шляхом введення активного FVII (FVIIа). Лікування за допомогою фармацевтичної композиції поліпшує або полегшує тяжкість симптомів, пов'язаних із захворюванням або станом. Після введення може здійснюватись контролювання пацієнта щодо змін симптомів, пов'язаних із FVIIопосередкованим захворюванням або станом, чи введення може супроводжуватись таким контролюванням. Захворювання або стани, які піддають лікуванню, охоплюють (але ними не обмежуються) розлади, пов'язані із згортанням крові, гематологічні розлади, геморагічні розлади, гемофілії, дефіцит фактора FVII та розлади з кровотечею. Прикладами таких розладів є гемофілія A або гемофілія B чи гемофілія C. Гемофілія може бути вродженою або набутою, наприклад, унаслідок ускладнення з кровотечею унаслідок хірургічного втручання або травми. Кровотеча може проявлятись у вигляді гострого гемартрозу, хронічної гемофільної артропатії, гематом, гематурії, кровотеч до центральної нервової системи, кровотеч до шлунковокишкового тракту або внутрішньомозкових крововиливів і може бути наслідком, наприклад, видалення зубів або оперативного втручання, наприклад, пластичної операції на судинах, операції на легенях, операції на органах черевної порожнини, операції на хребті, операції на головному мозку, операції на судинах, стоматологічної операції або операції по пересадженню органу, такої як трансплантація кісткового мозку, серця, легень, підшлункової залози та печінки. 7 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пацієнт може мати аутоантитіла проти фактора VIII або фактора IX. Лікування може супроводжуватись введенням, послідовним або періодичним, одного або декількох додаткових коагуляційних факторів, таких як плазматичні очищені або рекомбінантні коагуляційні фактори, прокоагулянтів, таких як вітамін К, похідна вітаміну К та інгібітори білка C, плазма, тромбоцити, еритроцити та кортикостероїди. Фармацевтичні композиції можуть застосовуватись із композиціями, які містять такі інші коагуляційні фактори. Пропонуються готові вироби, які включають в себе пакувальний матеріал та фармацевтичну композицію, вміщену у пакувальній матеріал, та факультативно інструкції з введення. Наприклад, модифікований поліпептид FVII у фармацевтичній композиції може призначатись для лікування FVII-опосередкованого захворювання або розладу, а пакувальний матеріал може включати в себе етикетку, яка вказує, що модифікований поліпептид FVII застосовується для лікування FVII-опосередкованого захворювання або розладу. Пропонуються також набори, які включають в себе фармацевтичні композиції, пристрій для ведення згаданої композиції та факультативно інструкції з введення. Короткий опис фігур Фіг. 1 відображає коагуляційний каскад. Згадана фігура показує внутрішній шлях та зовнішній шлях коагуляції для незалежного продукування FXa і сходження згаданих шляхів у спільний шлях для утворення тромбіну та фібрину для формування згустка крові. Ці шляхи є взаємопов'язаними. Згадана фігура відображає порядок молекул, задіяних у активаційному каскаді, у якому профермент перетворюється на активовану протеазу шляхом розщеплення одного або декількох пептидних зв'язків. Згадана активована протеаза у подальшому діє як активуюча протеаза для наступної молекули проферменту у каскаді, що зрештою призводить до утворення згустка крові. Фіг. 2 відображає клітинну модель коагуляції (дивись, наприклад, Hoffman and al., (2002) Thromb. Haemost. 85:958-965). Згадана фігура відображає коагуляційні явища як такі, що розбиваються на три фази, де ініціювання коагуляції здійснюється шляхом активації FX у FXa комплексом TF/FVIIa на TF-несучій клітині, результатом чого є утворення невеликої кількості тромбіну після активації FXa/FVa. Ампліфікація відбувається тоді, коли тромбін зв'язується з тромбоцитами і активує їх та ініціює активацію достатньої кількості відповідних коагуляційних факторів для утворення комплексів FVIIIa/FIXa та FVa/FXa. Поширення коагуляції відбувається на поверхні великої кількості активованих тромбоцитів на місці пошкодження, результатом чого є сплеск утворення тромбіну, який є достатньо великим для утворення достатньої кількості фібрину з фібриногену для утворення згустка крові на місці пошкодження. Фіг. 3 відображає механізми, за допомогою яких FVIIa може ініціювати утворення тромбіну. Згадана фігура ілюструє TF-залежний шлях утворення тромбіну FVIIа, який впливає на поверхню TF-несучої клітини і передбачає утворення комплексу FVIIа з TF перед активацією FX у FXa. Згадана фігура також відображає TF-незалежний шлях утворення тромбіну FVIIа, впродовж якого FVIIа зв'язується з фосфоліпідами на активованому тромбоциті і активує FX у FXa, який у свою чергу утворює комплекси з FVa для розщеплення протромбіну у тромбін. Фіг. 4 відображає четвертинний пригнічувальний комплекс, який утворюється при зв'язуванні комплексу TFPI/FXa з комплексом TF/FVIIa. TFPI містить три домени Kunitz. Домен Kunitz-2 (K-2) взаємодіє з FXa та пригнічує його, у той час як домен Kunitz-1 (K-1) взаємодіє з FVIIa та пригнічує його. Фіг. 5 відображає впорядковане розміщення амінокислотної послідовності перших доменів 5L15 Kunitz (a) BPTI (положення амінокислот 1-55 послідовності SEQ ID NO: 106) та TFPI-2 (положення амінокислот 14-65 послідовності SEQ ID NO: 105), та (b) TFPI-1 (положення амінокислот 26-76 послідовності SEQ ID NO: 102) та TFPI-2 (положення амінокислот 14-65 послідовності SEQ ID NO: 105), і показує консервативні амінокислоти. Фіг. 6 відображає гомологічну модель, яка застосовується для визначення контактних залишків на ділянці взаємодії FVIIa та TFPI. Структура домену Kunitz-1 (K-1) була одержана з 5L15 кристалічної структури комплексу трипсин/TFPI і змодельована на BPTI на кристалічній 5L15 структурі TF/FVIIa/BPTI . In silico мутагенез здійснили для підгонки відповідних амінокислот TFPI-1 K1 до моделі. Контактні залишки FVIIa, які ймовірно приймають участь у взаємодії з TFPI на ділянці контакту білків, були ідентифіковані та встановлені як кандидати для мутагенезу при розробці TFPI-стійких поліпептидів FVII. Фіг. 7 відображає змодельовану взаємодію між FVIIa та TFPI. Зокрема, згадана фігура відображає контактні залишки FVII, наявні на ділянці взаємодії FVIIa та TFPI, і відповідні контактні залишки TFPI, які утворюють комплементарні електростатичні контакти. Докладний опис Короткий огляд 8 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 A. Визначення B. Загальний огляд гемостазу 1. Адгезія і агрегація тромбоцитів 2. Коагуляційний каскад a. Ініціювання b. Ампліфікація c. Поширення 3. Регулювання коагуляції C. Фактор FVII (FVII) 1. Структура і організація FVII 2. Посттрансляційні модифікації 3. Процесинг FVII 4. Активація FVII 5. Функція FVII a. Активність FVIIа, залежна від тканинного фактора b. Активність FVIIа, незалежна від тканинного фактора 6. FVII як біофармацевтичний засіб D. Модифіковані поліпептиди FVII 1. Стійкість до інгібіторів a. TFPI Модифікації для забезпечення підвищеної стійкості до TFPI b. Антитромбін III (AT-III) Модифікації для забезпечення підвищеної стійкості до AT-III 2. Зв'язування з активованими тромбоцитами Модифікація шляхом ведення гетерологічного Gla-домену 3. Комбінації та додаткові модифікації a. Модифікації, що підвищують притаманну активність b. Модифікації, що підвищують стійкість до протеаз c. Модифікації, що підвищують зв'язування із фосфоліпідами d. Модифікації, що змінюють глікозилування e. Модифікації, що полегшують зв'язування хімічних груп f. Приклади комбінаційних мутантів FVII E. Конструювання та способи модифікування FVII 1. Логічне обгрунтування 2. Емпіричне обгрунтування (тобто скринінг) a. Неспецифічний мутагенез b. Зосереджений мутагенез c. Скринінг 3. Відбір варіантів FVII F. Продукування поліпептидів FVII 1. Вектори та клітини 2. Експресійні системи a. Експресія у прокаріотах b. Дріжджі c. Комахи та клітини комах d. Клітини ссавців e. Рослини 2. Очищення 3. Гібридні білки 4. Модифікації поліпептидів 5. Нуклеотидні послідовності G. Оцінка активності модифікованих поліпептидів FVII 1. In vitro аналізи a. Посттрансляційна модифікація b. Протеолітична активність c. Коагуляційна активність d. Зв'язування з іншими білками та/або їх пригнічення e. Зв'язування фосфоліпідів 2. Тваринні (крім людини) моделі 3. Клінічні аналізи 9 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 H. Технологія виготовлення лікарського засобу і його введення 1. Композиції a. Дози b. Лікарські форми 2. Введення модифікованих поліпептидів FVII 3. Введення нуклеїнових кислот, які кодують модифіковані поліпептиди FVII (генотерапія) I. Варіанти терапевтичного застосування 1. Вроджені розлади з кровотечею a. Гемофілія b. Дефіцит FVII c. Інші 2. Набуті розлади з кровотечею a. Тромбоцитопенія унаслідок хіміотерапії b. Інші коагулопатії c. Кровотеча унаслідок трансплантації d. Кровотеча унаслідок антикоагулянтної терапії e. Набута гемофілія 3. Кровотеча унаслідок травми та оперативного втручання J. Комбіновані способи лікувального пливу K. Готові вироби та набори L. Приклади А. Визначення Якщо не зазначається інше, усі технічні та наукові терміни, вжиті у цьому описі, мають таке саме значення, що традиційно розуміється фахівцем у тій галузі, до якої належить(-ать) винахід(-оди). Усі патенти, заявки на патенти, опубліковані заявки та публікації, послідовності Genbank, бази даних, веб-сайти та інші опубліковані матеріали, на які робиться посилання в усьому наведеному у цьому документі описі, якщо не зазначається інше, включаються у повному обсязі шляхом посилання. У разі наявності численних визначень термінів, вжитих у цьому описі, переважають ті визначення, що наводяться у цьому розділі. Коли посилання робиться на URL (уніфікований вказівник інформаційного ресурсу) або інший такий ідентифікатор або адресу, слід розуміти, що такі ідентифікатори можуть змінюватись, і конкретна інформація у інтернеті може з'являтись і зникати, однак еквівалентна інформація може бути знайдена у інтернеті шляхом пошуку. Посилання на інтернет свідчить про доступність та відкрите поширення такої інформації. Словосполучення "коагуляційний шлях" або "коагуляційний каскад", вжите у цьому описі, означає ряд активаційних явищ, що призводить до утворення нерозчинного фібринового згустка. У коагуляційному каскаді або на коагуляційному шляху неактивний білок серинової протеази (який називають також проферментом) перетворюється на активну протеазу шляхом розщеплення одного або декількох пептидних зв'язків, які у подальшому діють як активуюча протеаза для наступної молекули проферменту у каскаді. На кінцевій протеолітичній стадії каскаду фібриноген протеолітично розщеплюється тромбіном до фібрину, який у подальшому перехресно зшивається на ділянці пошкодження з утворенням згустка. Термін "гемостаз", вжитий у цьому описі, означає припинення кровотечі або потоку крові у органі або частині тіла. Згаданий термін "гемостаз" може означати весь процес згортання крові для запобігання втраті крові після пошкодження кровоносної судини до подальшого розчинення згустка крові після загоєння тканини. Термін "згортання крові" або "коагуляція", вжитий у цьому описі, означає утворення нерозчинного фібринового згустка або процес, за яким коагуляційні фактори крові взаємодіють у коагуляційному каскаді, кінцевим результатом якого є утворення нерозчинного фібринового згустка. Термін "протеаза", вжитий у цьому описі, означає фермент, який каталізує гідроліз ковалентних пептидних зв'язків. Ці означення охоплюють проферментні форми та їх активовані одно-, дво- та багатоланцюгові форми. Для ясності посилання на протеази стосується усіх форм. Протеази охоплюють, наприклад, серинові протеази, цистеїнові протеази, аспарагінові протеази, треонінові протеази та металопротеази, у залежності від каталітичної активності їх активного центру та механізму розщеплення пептидних зв'язків субстрату-мішені. Термін "серинові протеази" або "серинові ендопептидази", вжитий у цьому описі, означає клас пептидаз, які характеризуються наявністю залишку серину у активному центрі згаданого ферменту. Серинові протеази приймають участь у різноманітних функціях організму, у тому числі згортанні крові та запаленні, а також функціонують як травні ферменти у прокаріотів та 10 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 еукаріотів. Механізм розщеплення сериновими протеазами базується на нуклеофільному руйнуванні пептидного зв'язку-мішені серином. Цю роль можуть також відігравати молекули цистеїну, треоніну або води, приєднані до аспартату або металів. Впорядковано розміщені бічні ланцюги серину, гістидину та аспартату утворюють каталітичну тріаду, спільну для більшості серинових протеаз. Активний центр серинових протеаз має форму щілини, де зв'язується поліпептидний субстрат. Термін "фактор VII" (FVII, F7; який також згадується як фактор 7, коагуляційний фактор VII, сироватковий фактор VII, антифібринолізин (SPCA), проконвертин та ептаког альфа), вжитий у цьому описі, означає серинову протеазу, яка є складовою частиною коагуляційного каскаду. FVII містить Gla-домен, два домени EGF (епідермальний фактор росту) (EGF-1 та EGF-2) та домен серинової протеази (або домен пептидази S1), який є одним із висококонсервативних членів родини пептидази S1 серинових протеаз, таких як, наприклад, хімотрипсин. Послідовність прикладу попередника FVII, який має сигнальний пептид та пропептид, відображена послідовністю SEQ ID NO: 1. Приклад зрілого поліпептиду FVII представлений послідовністю SEQ ID NO: 3. FVII існує як одноланцюговий профермент, проферментоподібний дволанцюговий поліпептид та повністю активована дволанцюгова форма. Повна активація, яка проходить при конформаційній зміні з проферментоподібної форми, відбувається шляхом зв'язування з його кофактором – тканинним фактором. Можуть також вводитись мутації, результатом яких є конформаційна зміна при відсутності тканинного фактора. Таким чином, згадування FVII охоплює його одноланцюгову та дволанцюгову форми, у тому числі проферментоподібну та повністю активовану дволанцюгову форми. Згадування поліпептиду FVII охоплює також поліпептиди-попередники та зрілі поліпептиди FVII у одноланцюговій та дволанцюговій формах, їх скорочені форми, які мають активність, та охоплює алельні варіанти та видові варіанти, варіанти, що кодуються сплайсованими варіантами, та інші варіанти, у тому числі поліпептиди, які мають щонайменше 40 %, 45 %, 50 %, 55 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 96 %, 97 %, 98 %, 99 % або більше ідентичність послідовності з поліпептидом-попередником, представленим послідовністю SEQ ID NO: 1 або його зрілою формою. Це згадування охоплює модифіковані поліпептиди FVII, такі як поліпептиди, що мають послідовності SEQ ID NO: 18-43, SEQ ID NO: 125-150 або SEQ ID NO: 206-150, та їх варіанти. Це згадування охоплює також поліпептиди, що зберігають принаймні активність FVII, таку як зв'язування TF, зв'язування фактора X, зв'язування фосфоліпідів та/або коагулянтна активність FVII. При збереженні активності згадана активність може бути змінена, наприклад, зменшена або збільшена, порівняно з FVII дикого типу, доки рівень збереженої активності є достатнім, щоб чинити виявний вплив. До поліпептидів FVII належать (але ними не обмежуються) тканиноспецифічні ізоформи та їх алельні варіанти, синтетичні молекули, одержані шляхом трансляції нуклеїнових кислот, білки, одержані шляхом хімічного синтезу, наприклад, методами синтезу, які передбачають лігування коротших поліпептидів, за допомогою рекомбінантних методів, білки, виділені з людських та нелюдських тканин та клітин, химерні поліпептиди FVII та їх модифіковані форми. До поліпептидів FVII належать також фрагменти або частини FVII, які мають достатню довжину або містять відповідні ділянки для збереження щонайменше однієї активності (після активації, при необхідності) повнорозмірного зрілого поліпептиду. До поліпептидів FVII належать також поліпептиди, які містять хімічні або посттрансляційні модифікації, та поліпептиди, які не містять хімічних або посттрансляційних модифікацій. Такі модифікації охоплюють (але ними не обмежуються) пегілування, альбумінування, глікозилування, фарнізилування, карбоксилування, гідроксилування, фосфорилування та інші модифікації поліпептидів, відомі у цій галузі. Прикладами поліпептидів FVII є поліпептиди, які походять від ссавців, у тому числі людей. Приклади амінокислотних послідовностей FVII людського походження представлені послідовностями SEQ ID NO: 1, SEQ ID NO: 2 та SEQ ID NO: 3. До прикладів варіантів такого людського поліпептиду FVII належать будь-який з поліпептидів-попередників, представлених послідовностями SEQ ID NO: 44-100. До поліпептидів FVII належать також будь-який поліпептид нелюдського походження, у тому числі (але без обмеження) поліпептиди мишачого, собачого, кошачого, заячого, пташиного, бичачого, овечого, свинячого, конячого, риб'ячого, жаб'ячого фактора FVII та поліпептиди фактора FVII приматів, крім людини. Прикладами поліпептидів FVII нелюдського походження є, наприклад, поліпептиди корови (Bos taurus, послідовність SEQ ID NO: 4), миші (Mus musculus, послідовність SEQ ID NO: 5), карликового шимпанзе (Pan paniscus, послідовність SEQ ID NO: 6), звичайного шимпанзе (Pan troglodytes, послідовність SEQ ID NO: 7), кролика (Oryctolagus cuniculus, послідовність SEQ ID NO: 8), пацюка (Rattus norvegicus, послідовність SEQ ID NO: 9), макаки-резус (Macaca mulatta, послідовність SEQ ID NO: 10), свині (Sus scrofa, послідовність SEQ ID NO: 11), собаки (Canis familiaris, 11 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовність SEQ ID NO: 12), смугастого даніо (Brachydanio rerio, послідовність SEQ ID NO: 13), риби-фугу (Fugu rubripes, послідовність SEQ ID NO: 14), курчати (Gallus gallus, послідовність SEQ ID NO: 15), орангутана (Pongo pygmaeus, послідовність SEQ ID NO: 16) та горили (Gorilla gorilla, послідовність SEQ ID NO: 17). Фахівцю у цій галузі зрозуміло, що згадувані положення зрілого поліпептиду фактора VII (послідовність SEQ ID NO: 3) відрізняються на 60 амінокислотних залишків, при порівнянні з ізоформою a поліпептиду-попередника FVII, представленою послідовністю SEQ ID NO: 1, яка являє собою ізоформу a поліпептиду фактора VII, яка містить сигнальний пептид та пропептидні послідовності. Так, перший амінокислотний залишок послідовності SEQ ID NO: 3 "відповідає" шістдесят першому (61-ому) амінокислотному залишку послідовності SEQ ID NO: 1. Фахівцю у цій галузі зрозуміло також, що згадувані положення зрілого поліпептиду фактора VII (послідовність SEQ ID NO: 3) відрізняються на 38 амінокислотних залишків, при порівнянні з поліпептидом-попередником FVII, представленим послідовністю SEQ ID NO: 2, яка являє собою ізоформу b поліпептиду фактора VII, яка містить сигнальний пептид та пропептидні послідовності. Так, перший амінокислотний залишок послідовності SEQ ID NO: 3 "відповідає" тридцять дев'ятому (39-ому) амінокислотному залишку послідовності SEQ ID NO: 2. Словосполучення "відповідні залишки", вжите у цьому описі, означає залишки, які знаходяться на впорядковано розміщених локусах. Споріднені або варіантні поліпептиди впорядковано розміщуються будь-яким способом, відомим фахівцям у цій галузі. Такі способи, як правило, забезпечують максимальне суміщення пар і охоплюють такі способи, як застосування ручного впорядкованого розміщення та застосування численних доступних програм впорядкованого розміщення (наприклад, BLASTP) та інші, відомі фахівцям у цій галузі. Шляхом впорядкованого розміщення послідовностей поліпептидів, фахівець у цій галузі може ідентифікувати відповідні залишки із застосуванням консервативних та ідентичних амінокислотних залишків як покажчиків. Наприклад, шляхом впорядкованого розміщення послідовностей поліпептидів фактора VII, фахівець у цій галузі може ідентифікувати відповідні залишки із застосуванням консервативних та ідентичних амінокислотних залишків як покажчиків. Наприклад, аланін у амінокислотному положенні 1 (A1) послідовності SEQ ID NO: 3 (зрілий фактор VII) відповідає аланіну у амінокислотному положенні 61 (A61) послідовності SEQ ID NO: 1 та аланіну у амінокислотному положенні 39 (A39) послідовності SEQ ID NO: 2. У інших випадках можуть бути ідентифіковані відповідні ділянки. Наприклад, Gla-домен відповідає амінокислотним положенням від A1 до F45 послідовності SEQ ID NO: 3, амінокислотним положенням від A61 до S105 послідовності SEQ ID NO: 1 та амінокислотним положенням від A39 до S83 послідовності SEQ ID NO: 2. Фахівець у цій галузі може також застосовувати консервативні амінокислотні залишки як покажчики для знаходження відповідних амінокислотних залишків між та серед людських і нелюдських послідовностей. Наприклад, амінокислотні залишки S43 та E163 послідовності SEQ ID NO: 3 (людська) відповідають S83 та E203 послідовності SEQ ID NO: 4 (бичача). Відповідні положення можуть також базуватись на структурних порівняннях, наприклад, шляхом застосування імітованого комп'ютером впорядкованого розміщення структури білків. У інших випадках можуть бути ідентифіковані відповідні ділянки. Терміни "проділянка", "пропептид" або "пропослідовність", вжиті у цьому описі, означають ділянку або сегмент, що розщеплюється з одержанням зрілого білка. Термін може охоплювати сегменти, які функціонують для пригнічення протеолітичної активності шляхом маскування каталітичного механізму і, тим самим, запобігання утворенню каталітичного проміжного продукту (тобто шляхом стеричного оклюдування зв'язувального центру субстрату). Проділянка являє собою послідовність амінокислот, розміщених на амінокінці зрілого біологічно активного поліпептиду, і може складатись усього з декількох амінокислот або може бути полідоменною структурою. Термін "зрілий фактор VII", вжитий у цьому описі, означає поліпептид FVII, якому бракує сигнальної послідовності та пропептидної послідовності. Як правило, сигнальна послідовність спрямовує білок на секрецію шляхом ендоплазматична сітка (ER)-тільця Гольджі і розщеплюється після введення до ER під час трансляції. Пропептидна послідовність, як правило, функціонує у посттрансляційній модифікації білка і розщеплюється перед секрецією білка з клітини. Таким чином, зрілий поліпептид FVII є, як правило, секретованим білком. За одним із прикладів зрілий людський поліпептид FVII представлений послідовністю SEQ ID NO: 3. Амінокислотна послідовність, представлена послідовністю SEQ ID NO: 3, відрізняється від амінокислотних послідовностей поліпептидів-попередників, представлених послідовностями SEQ ID NO: 1 та SEQ ID NO: 2, тим, що послідовності SEQ ID NO: 3 бракує як сигнальної послідовності, яка відповідає амінокислотним залишкам 1-20 послідовностей 12 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO: 1 та SEQ ID NO: 2, так і пропептидної послідовності, яка відповідає амінокислотним залишкам 21-60 послідовності SEQ ID NO: 1 та амінокислотним залишкам 21-38 послідовності SEQ ID NO: 2. Згадування зрілого поліпептиду FVII охоплює одноланцюгову проферментну форму та дволанцюгову форму. Термін "дикого типу" або "нативний", вжитий у цьому описі стосовно FVII, означає поліпептид FVII, який кодується нативним або природним геном FVII, у тому числі алельними варіантами, наявним у організмі, у тому числі людському та інших тварин, у природі. Посилання на фактор VII дикого типу без визначення виду означає будь-який вид фактора VII дикого типу. До числа поліпептидів FVII дикого типу належать поліпептид-попередник, його фрагменти та його процесовані форми, такі як зріла форма, якій бракує сигнального пептиду, а також будь-які його перед- або посттрансляційно процесовані або модифіковані форми. До числа нативних поліпептидів FVII належать також поліпептиди, які є посттрансляційно модифікованими, в тому числі (але без обмеження ними) модифікації шляхом глікозилування, карбоксилування та гідроксилування. До нативних поліпептидів FVII належать також одноланцюгові та дволанцюгові форми. Наприклад, люди експресують нативний FVII. Амінокислотна послідовність прикладу людського FVII дикого типу представлена послідовностями SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 та алельними варіантами, представленими послідовностями SEQ ID NO: 44-100 і його зрілими формами. Інші тварини продукують нативний FVII, у тому числі (але без обмеження) корова (Bos taurus, послідовність SEQ ID NO: 4), миша (Mus musculus, послідовність SEQ ID NO: 5), карликовий шимпанзе (Pan paniscus, послідовність SEQ ID NO: 6), звичайний шимпанзе (Pan troglodytes, послідовність SEQ ID NO: 7), кролик (Oryctolagus cuniculus, послідовність SEQ ID NO: 8), пацюк (Rattus norvegicus, послідовність SEQ ID NO: 9), макак-резус (Macaca mulatta, послідовність SEQ ID NO: 10), свиня (Sus scrofa, послідовність SEQ ID NO: 11), собака (Canis familiaris, послідовність SEQ ID NO: 12), смугастий даніо (Brachydanio rerio, послідовність SEQ ID NO: 13), риба-фугу (Fugu rubripes, послідовність SEQ ID NO: 14), курча (Gallus gallus, послідовність SEQ ID NO: 15), орангутан (Pongo pygmaeus, послідовність SEQ ID NO: 16) та горила (Gorilla gorilla, послідовність SEQ ID NO: 17). Словосполучення "видові варіанти", вжите у цьому описі, означає варіанти поліпептидів між різними видами, у тому числі між різними видами ссавців, таких як миша та людина. Словосполучення "алельні варіанти", вжите у цьому описі, означає варіації білків між членами одного й того самого виду. Словосполучення "сплайсований варіант", вжите у цьому описі, означає варіант, що продукується шляхом альтернативного процесингу первинного транскрипту геномної ДНК, результатом чого є одержання мРНК більше ніж одного типу. Термін "профермент", вжитий у цьому описі, означає протеазу, яка активується шляхом протеолітичного розщеплення, у тому числі розщеплення для повного дозрівання, такого як активаційне розщеплення та/або утворення комплексу з іншим(-и) білком(-ами) та/або кофактором(-ами). Профермент являє собою неактивний попередник протеолітичного ферменту. Такі попередники є, як правило, більшими, хоча не обов'язково більшими, за активну форму. Стосовно серинових протеаз, проферменти перетворюються на активні ферменти специфічним розщепленням, у тому числі каталітичним та аутокаталітичним розщепленням, або шляхом зв'язування активуючого кофактора, який утворює активний фермент. Наприклад, як правило, проферменти є наявними у одноланцюговій формі. Проферменти, як правило, є неактивними і можуть перетворюватись на зрілі активні поліпептиди шляхом каталітичного або аутокаталітичного розщеплення на одному або декількох протеолітичних сайтах з утворенням багатоланцюгового, наприклад, дволанцюгового поліпептиду. Профермент, таким чином, являє собою ферментативно неактивний білок, який перетворюється на протеолітичний фермент під дією активатора. Розщеплення може здійснюватись шляхом аутоактивації. Ряд коагуляційних білків є проферментами; вони неактивні, але розщеплюються і активуються при стимуляції коагуляційної системи після пошкодження кровоносної судини. Стосовно поліпептидів FVII, вони існують у плазмі крові як проферменти до розщеплення протеазами, такими як, наприклад, активований фактор IX (FIXa), активований фактор X (FXa), активований фактор XII (FXIIa), тромбін, або шляхом аутоактивації з утворенням проферментоподібної дволанцюгової форми, яка у подальшому потребує додаткової конформаційної зміни для повної активності. Словосполучення "проферментоподібний" білок або поліпептид, вжите у цьому описі, означає білок, який був активований шляхом протеолітичного розщеплення, але все ще демонструє властивості, пов'язані з проферментом, такі як, наприклад, низька активність або повна її відсутність чи конформація, яка нагадує конформацію проферментної форми білка. Наприклад, коли дволанцюгова активована форма FVII не зв'язана з тканинним фактором, вона являє собою проферментоподібний білок; він зберігає конформацію, подібну до 13 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 нерозщепленого проферменту FVII і, таким чином, демонструє дуже низьку активність. При зв'язуванні з тканинним фактором дволанцюгова активована форма FVII зазнає конформаційної зміни і набуває своєї повної активності як коагуляційний фактор. Словосполучення "активаційна послідовність", вжите у цьому описі, означає послідовність амінокислот у проферментах, яка являє собою ділянку, необхідну для активаційного розщеплення або розщеплення для повного дозрівання для одержання активної протеази. Розщеплення активаційної послідовності може каталізуватись аутокаталітичним шляхом або активаційними партнерами. Словосполучення "активаційне розщеплення", вжите у цьому описі, являє собою тип розщеплення для повного дозрівання, яке індукує конформаційну зміну, що є необхідною для розвитку повної ферментативної активності. Це класичний активаційний шлях, наприклад, для серинових протеаз, у яких розщеплення утворює новий N-кінець, який взаємодіє з консервативними ділянками протеази, такими як Asp194 у хімотрипсину, з індукуванням конформаційних змін, необхідних для активності. Результатом активації може бути продукування багатоланцюгових форм протеаз. У певних випадках одноланцюгові форми протеази можуть демонструвати протеолітичну активність. Словосполучення "активований фактор VII" або "FVIIа", вжите у цьому описі, означає будьяку дволанцюгову форму поліпептиду FVII. Дволанцюгова форма, як правило, є результатом протеолітичного розщеплення, але може продукуватись і синтетичним шляхом. Таким чином, словосполучення "активований фактор VII" охоплює проферментоподібну дволанцюгову форму з низькою коагулянтною активністю, повністю активовану форму (приблизно у 1000 разів більша активність), яка виникає при зв'язуванні з тканинним фактором, та мутовані форми, які існують у повністю активованій дволанцюговій формі або зазнають конформаційної зміни до повністю активованої форми. Наприклад, одноланцюгова форма поліпептиду FVII (дивись, наприклад, послідовність SEQ ID NO: 3) є розщепленою протеолітичним шляхом між амінокислотними залишками R152 та I153 зрілого поліпептиду FVII. Продукти розщеплення, важкий ланцюг FVII та легкий ланцюг FVII, які утримуються разом дисульфідним зв'язком (між амінокислотними залишками 135C та 162C у FVII послідовності SEQ ID NO: 3), утворюють дволанцюговий активований фермент FVII. Протеолітичне розщеплення може бути продовжене, наприклад, за допомогою активованого фактора IX (FIXa), активованого фактора X (FXa), активованого фактора XII (FXIIa), тромбіну або шляхом аутоактивації. Термін "властивість" поліпептиду FVII, вжитий у цьому описі, означає фізичну або структурну властивість, наприклад, об'ємну структуру, pI, період напіввиведення, конформацію та інші подібні фізичні властивості. Термін "активність" поліпептиду FVII, вжитий у цьому описі, означає будь-яку активність, яка демонструється поліпептидом фактора VII. Такі активності можуть досліджуватись in vitro та/або in vivo, і охоплюють (але без обмеження ними) коагуляційну або коагулянтну активність, прокоагулянтну активність, протеолітичну або каталітичну активність, наприклад, для здійснення активації фактора X (FX) або активації фактора IX (FIX); антигенність (здатність до зв'язування з поліпептидом або конкурування з ним за зв'язування з антитілом проти FVII); здатність до зв'язування тканинного фактора, фактора X або фактора IX; та/або здатність до зв'язування з фосфоліпідами. Активність може визначатись in vitro або in vivo із застосуванням визнаних аналізів, наприклад, шляхом визначення коагуляції in vitro або in vivo. Результати таких аналізів вказують на те, що поліпептид демонструє активність, яка може корелювати з активністю поліпептиду in vivo, де на активність in vivo можна посилатись як на біологічну активність. Аналізи з визначення функціональності або активності модифікованих форм FVII є відомими фахівцям у цій галузі. Прикладами аналізів з оцінювання активності поліпептиду FVII є аналіз протромбопластинового часу (PT) або аналіз активованого часткового (парціального) тромбопластинового часу (aPTT) для визначення коагулянтної активності або хромогенні аналізи із застосуванням синтетичних субстратів, опис яких, наприклад, наведений у Прикладі 4, Прикладі 5 та Прикладі 11, для оцінювання каталітичної або протеолітичної активності. Словосполучення "демонструє щонайменше одну активність" або "зберігає щонайменше одну активність", вжите у цьому описі, означає активність, яка демонструється модифікованим поліпептидом FVII, у разі порівняння з немодифікованим поліпептидом FVII тієї самої форми та в таких самих умовах. Наприклад, модифікований поліпептид FVII у дволанцюговій формі порівнюють із немодифікованим поліпептидом FVII у дволанцюговій формі у таких самих експериментальних умовах, де єдиною різницею між двома поліпептидами є досліджувана модифікація. За іншим прикладом модифікований поліпептид FVII у одноланцюговій формі порівнюють із немодифікованим поліпептидом FVII у одноланцюговій формі у таких самих 14 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 експериментальних умовах, де єдиною різницею між двома поліпептидами є досліджувана модифікація. За типовим варіантом модифікований поліпептид FVII, який зберігає або демонструє щонайменше одну активність немодифікованого поліпептиду FVII такої самої форми, зберігає достатній рівень активності, так що при введенні in vivo модифікований поліпептид FVII є терапевтично ефективним як прокоагулянтний терапевтичний засіб. Як правило, для того, щоб модифікований поліпептид FVII зберіг терапевтичну ефективність як прокоагулянт, збережений рівень активності повинен бути або становити приблизно 0,5 %, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 11 %, 12 %, 13 %, 14 %, 15 %, 16 %, 17 %, 18 %, 19 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше від активності немодифікованого поліпептиду FVII такої самої форми, яка демонструє терапевтичну ефективність як прокоагулянт. Рівень активності, що є необхідним для підтримання терапевтичної ефективності як прокоагулянта, може у разі необхідності бути визначений емпіричним шляхом. Як правило, збереження від 0,5 % до 20 %, від 0,5 % до 10 %, від 0,5 % до 5 % активності є достатнім для збереження терапевтичної ефективності як прокоагулянта in vivo. Слід розуміти, що активність, що демонструється або є збереженою модифікованим поліпептидом FVII, може бути будь-якою активністю, в тому числі (але без обмеження) коагуляційною або коагулянтною активністю, прокоагулянтною активністю; протеолітичною або каталітичною активністю, наприклад, для здійснення активації фактора X (FX) або активації фактора IX (FIX); антигенності (здатності до зв'язування з поліпептидом або конкурування з ним за зв'язування з антитілом проти FVII); здатності до зв'язування тканинного фактора, фактора X або фактора IX та/або здатності до зв'язування із фосфоліпідами. У певних випадках модифікований поліпептид FVII може зберегти активність, що є підвищеною, порівняно з немодифікованим поліпептидом FVII. У деяких випадках модифікований поліпептид FVII може зберегти активність, яка є зниженою порівняно з немодифікованим поліпептидом FVII. Активність модифікованого поліпептиду FVII може становити будь-яку частину відсотка активності немодифікованого поліпептиду, де обидва поліпептиди знаходяться у однаковій формі, в тому числі але без обмеження, 1 % активності, 2 %, 3 %, 4 %, 5 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 96 %, 97 %, 98 %, 99 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше відсотків активності, порівняно з поліпептидом, який не містить модифікації, яка є предметом обговорення. Наприклад, модифікований поліпептид FVII може демонструвати підвищену або знижену активність порівняно з немодифікованим поліпептидом FVII такої самої форми. Наприклад, він може зберегти щонайменше приблизно або щонайменше 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 95 %, 96 %, 97 %, 98 % чи щонайменше 99 % активності немодифікованого поліпептиду FVII. За іншими варіантами здійснення зміна активності є у щонайменше приблизно 2 рази, 3 рази, 4 рази, 5 разів, 6 разів, 7 разів, 8 разів, 9 разів, 10 разів, 20 разів, 30 разів, 40 разів, 50 разів, 60 разів, 70 разів, 80 разів, 90 разів, 100 разів, 200 разів, 300 разів, 400 разів, 500 разів, 600 разів, 700 разів, 800 разів, 900 разів, 1000 разів або більше разів більшою, ніж у немодифікованого FVII. Конкретний рівень для збереження залежить від передбачуваного застосування поліпептиду і може бути визначений емпіричним шляхом. Активність може визначатись, наприклад, із застосуванням in vitro та in vivo аналізів, наприклад, таких, опис яких наведений у цьому описі або у Прикладах, наведених нижче. Словосполучення "коагуляційна активність" або "коагулянтна активність" чи "прокоагулянтна активність", вжите у цьому описі, означає здатність поліпептиду до здійснення коагуляції. Аналізи з визначення коагулянтної активності є відомими фахівцям у цій галузі і охоплюють аналіз протромбопластинового часу (PT) або аналіз активованого часткового (парціального) тромбопластинового часу (aPTT). Словосполучення "каталітична активність" або "протеолітична активність" щодо FVII, вжите у цьому описі, означає здатність білка FVII до каталізування протеолітичного розщеплення субстрату, і згадані словосполучення вживаються взаємозамінно. Аналізи з визначення таких активностей є відомими у цій галузі. Наприклад, протеолітична активність FVII може визначатись із застосуванням хромогенних субстратів, таких як спектрозим (Spectrozyme) FVIIa (CH3SO2-D-CHA-But-Arg-pNA), де розщеплення субстрату контролюється за оптичною густиною та швидкістю гідролізу субстрату, яка визначається за допомогою лінійної регресії. Словосполучення "притаманна властивість" стосовно FVII, вжите у цьому описі, означає каталітичну, протеолітичну та/або коагулянтну активність білка FVII за відсутності тканинного фактора. Термін "домен" (як правило, послідовність із трьох або більше, у більшості випадків, 5 або 7 чи більше амінокислот), вжитий у цьому описі, означає частину молекули, наприклад, білків або 15 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 кодуючих нуклеїнових кислот, яка структурно та/або функціонально відрізняється від інших частин молекули і може бути ідентифікована. Наприклад, домени включають в себе ті частини поліпептидного ланцюга, які можуть утворити незалежно укладену структуру у межах білка, що складається з одного або декількох структурних мотивів та/або розпізнається завдяки функціональній активності, такій як протеолітична активність. Білок може мати один або більше одного чітко окресленого домену. Наприклад, домен може бути ідентифікований, визначений або відрізнений за гомологією його послідовності зі спорідненими членами родини, такою як гомологія з мотивами, які визначають протеазний домен або Gla-домен. За іншим прикладом домен може бути відрізнений за його функцією, такою як протеолітична активність або здатність до взаємодії з біологічною молекулою, наприклад, зв'язування ДНК, зв'язування ліганду та димеризація. Домен незалежно може демонструвати біологічну функцію або активність, так що домен незалежно або злитий з іншою молекулою може здійснювати активність, таку як, наприклад, протеолітична активність або зв'язування ліганду. Домен може бути лінійною послідовністю амінокислот або нелінійною послідовністю амінокислот. Багато поліпептидів містять велику кількість доменів. Такі домени є відомими і можуть ідентифікуватись фахівцями у цій галузі. Для наведення прикладів у цьому описі надаються визначення, однак зрозумілим є те, що розпізнавання конкретних доменів за назвою повністю знаходиться у межах можливостей фахівців у цій галузі. За потреби для ідентифікування доменів можуть застосовуватись відповідні програмні засоби. Словосполучення "протеазний домен", вжите у цьому описі, означає каталітично активну частину протеази. Посилання на протеазний домен протеази охоплює одно-, дво- або багатоланцюгові форми будь-якого із цих білків. Протеазний домен білка містить усі необхідні властивості цього білка, необхідні для його протеолітичної активності, такі як, наприклад, каталітичний центр. Стосовно FVII, протеазний домен поділяє гомологію та характерну структурну відмінність з протеазними доменами родини хімотрипсину/трипсину, у тому числі каталітичну тріаду. Наприклад, у зрілого поліпептиду FVII, представленого послідовністю SEQ ID NO: 3, протеазний домен відповідає амінокислотним положенням з 153 до 392. Словосполучення "домен гамма-карбоксиглутамату (Gla)", вжите у цьому описі, означає частину білка, наприклад, вітамін К-залежного білка, яка містить посттрансляційні модифікації залишків глутамату (як правило, більшості, але не усіх залишків глутамату) шляхом вітамін Кзалежного карбоксилування з утворенням Gla. Gla-домен відповідає за високоафінне зв'язування іонів кальцію та зв'язування з негативно зарядженими фосфоліпідами. Gla-домен, як правило, розпочинається на N-кінці зрілої форми вітамін К-залежних білків і закінчується консервативним ароматичним залишком. У зрілому поліпептиді FVII Gla-домен відповідає амінокислотним положенням від 1 до 45 прикладу поліпептиду, представленого послідовністю SEQ ID NO: 3. Gla-домени є добре відомими, і їх локус може бути ідентифікований у конкретних поліпептидів. Gla-домени різних вітамін К-залежних білків поділяють послідовність, структурну та функціональну гомологію, у тому числі групування N-кінцевих гідрофобних залишків у гідрофобний "осередочок", що опосередковує взаємодію з негативно зарядженими фосфоліпідами на клітинній мембрані. Іншими прикладами Gla-вмісних поліпептидів є (але ними не обмежуються) FIX, FX, протромбін, білок C, білок S, остеокальцин, матричний Gla-білок, білок блокування росту 6 (Gas6) та білок Z. Gla-домени цих та інших білків представлені у будьякій з послідовностей SEQ ID NO: 110-121. Термін "нативний" або "ендогенний", вжитий у цьому описі, стосовно Gla-домену означає природний Gla-домен, пов'язаний з усім або частиною поліпептиду, що має Gla-домен. Для цілей цього опису нативний Gla-домен вказується з посиланням на поліпептид FVII. Наприклад, нативний Gla-домен FVII, представлений у послідовності SEQ ID NO: 3, відповідає амінокислотам 1-45 послідовності амінокислот, представленої у послідовності SEQ ID NO: 3. Словосполучення "гетерологічний Gla-домен", вжите у цьому описі, означає Gla-домен поліпептиду (того самого або іншого виду), що не є Gla-доменом FVII. Прикладами гетерологічних Gla-доменів є Gla-домени Gla-вмісних поліпептидів, у тому числі (але без обмеження ними), FIX, FX, протромбіну, білка C, білка S, остеокальцину, матричного Gla-білка, білка блокування росту 6 (Gas6) та білка Z. Gla-домени цих та інших прикладів білків представлені у будь-якій з послідовностей SEQ ID NO: 110-118, SEQ ID NO: 120 та SEQ ID NO: 121. Словосполучення "суміжна частина" Gla-домену, вжите у цьому описі, означає щонайменше дві або більше прилеглих амінокислот, як правило, 2, 3, 4, 5, 6, 8, 10, 15, 20, 30, 40 або більше аж до усіх амінокислот, що утворюють Gla-домен. Словосполучення "частина Gla-домену, достатня для здійснення зв'язування фосфоліпідів", вжите у цьому описі, означає щонайменше одну амінокислоту, як правило, 2, 3, 4, 5, 6, 8, 10, 15 16 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 або більше амінокислот згаданого домену, однак менше ніж усі амінокислоти, що утворюють згаданий домен, доти, доки поліпептид, що містить таку частину, демонструє зв'язування фосфоліпідів. Термін "заміна", відносно Gla-домену, або словосполучення "заміна Gla-домену", вжиті у цьому описі, означають процес, за допомогою якого ендогенний Gla-домен білка замінюють, із застосуванням рекомбінантних, синтетичних або інших методів, на Gla-домен іншого білка. У контексті "заміни Gla-домену" "Gla-домен" означає будь-який набір амінокислот Gla-домену і прилеглих ділянок, що є достатнім для збереження активності зв'язування фосфоліпідів. Заміна Gla-домену, як правило, буде передбачати заміну від 40 до 50 амінокислот ендогенного білка на 40-50 амінокислот іншого білка, але може передбачати меншу або більшу кількість амінокислот. Словосполучення "домен епідермального фактора росту (EGF)" (EGF-1 або EGF-2), вжите у цьому описі, означає частину білка, яка поділяє гомологію послідовності зі специфічною частиною послідовності епідермального фактора росту (EGF), яка складається з 3040 амінокислот. EGF-домен містить шість залишків цистеїну, які, як було показано (у EGF), є задіяними в утворення дисульфідних зв'язків. Головною структурою EGF-домену є двониткова бета-складка, за якою йде петля до короткої C-кінцевої двониткової складки. FVII містить два EGF-домени: EGF-1 та EGF-2. Ці домени відповідають амінокислотним положенням 46-82 та 87128, відповідно, зрілого поліпептиду FVII, представленого послідовністю SEQ ID NO: 3. Словосполучення "немодифікований поліпептид" або "немодифікований FVII" та його граматичні варіанти, вжите у цьому описі, означає вихідний поліпептид, вибраний для модифікації, як пропонується цим винаходом. Згаданим вихідним поліпептидом може бути природний поліпептид дикого типу. Крім того, вихідний поліпептид може змінюватись або зазнавати мутацій, в результаті чого він відрізняється від нативної ізоформи дикого типу, але, незважаючи на це, у цьому описі на нього посилаються як на вихідний немодифікований поліпептид відносно модифікованих у подальшому поліпептидів, які одержують за цим винаходом. Таким чином, існуючі білки, відомі у цій галузі, які були модифіковані з одержанням бажаного збільшення або зменшення конкретної активності або властивості, порівняно з немодифікованим еталонним білком, можуть вибиратись та застосовуватись, як вихідний немодифікований поліпептид. Наприклад, білок, який був модифікований з його нативної форми шляхом заміни однієї або декількох окремих амінокислот і який має посилення або ослаблення бажаної властивості, наприклад, заміну амінокислотного залишку або залишків зі зміною глікозилування, може бути білком-мішенню, на який у цьому описі посилаються як на немодифікований, для додаткового модифікування тієї самої або іншої властивості. Прикладом модифікованих поліпептидів FVII, відомим у цій галузі, є будь-який поліпептид FVII, опис якого наведений, наприклад, у патентах США № 5,580,560, № 6,017,882, № 6,693,075, № 6,762,286 та № 6,806,063, патентних документах США № 2003/0100506 та № 2004/0220106 та PCT заявках WO1988/010295, WO2001/83725, WO2003/093465, WO2003/38162, WO2004/083361, WO2004108763, WO2004029090, WO2004/029091, WO2004/111242 та WO2005/123916. Словосполучення "модифіковані поліпептиди фактора VII" та "модифікований фактор VII", вжиті у цьому описі, означають поліпептид FVII, який має одну або декілька амінокислотних відмінностей, порівняно з немодифікованим поліпептидом фактора VII. Одна або більше амінокислотних відмінностей можуть бути амінокислотними мутаціями, такими як заміни, інсерції або делеції однієї або декількох амінокислот, чи можуть бути інсерціями або делеціями цілих доменів та будь-якими їх комбінаціями. Як правило, модифікований поліпептид FVII має одну або декілька модифікацій у первинній послідовності, порівняно з немодифікованим поліпептидом FVII. Наприклад, модифікований поліпептид FVII, що пропонується цим винаходом, може мати 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50 або більше амінокислотних відмінностей, порівняно з немодифікованим поліпептидом FVII. Будь-яка модифікація здійснюється доти, доки одержаний у результаті поліпептид демонструє щонайменше одну активність FVII, пов'язану з нативним поліпептидом FVII, таку як, наприклад, каталітична активність, протеолітична активність, здатність до зв'язування TF або здатність до зв'язування активованих тромбоцитів. Словосполучення "інгібітори коагуляції", вжите у цьому описі, означає білки або молекули, дія яких полягає у пригніченні або запобіганні коагуляції чи утворенню згустка. Пригнічення або запобігання коагуляції може спостерігатись in vivo або in vitro і може досліджуватись із застосуванням будь-якого методу, відомого у цій галузі, у тому числі (але без обмеження ними), аналізу протромбопластинового часу (PT) або аналізу активованого часткового (парціального) тромбопластинового часу (aPTT). Словосполучення "інгібітор шляху тканинного фактора (TFPI, який також називають TFPI-1)", вжите у цьому описі, означає інгібітор типу Kunitz, який приймає участь в утворенні 17 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 четвертинного інгібіторного комплексу TF/FVIIa/TFPI/FXa, у якому активність FVIIa є пригніченою. TFPI експресується у вигляді попередників двох різних форм після альтернативного сплайсингу, а саме попередників TFPI (послідовність SEQ ID NO: 101) та TFPI (послідовність SEQ ID NO:103), які розщеплюються під час секреції з утворенням зрілого білка з 276 амінокислот (послідовність SEQ ID NO: 102) та зрілого білка з 223 амінокислот (послідовність SEQ ID NO: 104), відповідно. TFPI містить 3 домени Kunitz, з яких домен Kunitz-1 несе відповідальність за зв'язування та пригнічення FVIIa. Словосполучення "TFPI-2 (відомий також як плацентарний білок 5 (PP5)" та "інгібітор матричної серинової протеази (MSPI)", вжиті у цьому описі, означають гомолог TFPI. Зрілий білок TFPI-2 з 213 амінокислот (послідовність SEQ ID NO: 105) містить три домени типу Kunitz, які демонструють 43 %, 35 % та 53 % ідентичність первинної послідовності з доменами типу Kunitz 1, 2 та 3 TFPI-1, відповідно. TFPI-2 відіграє роль у регуляції розкладу та ремоделювання екстрацелюлярного матриксу, і, як гадають, не є важливим фактором коагуляційного шляху. Термін "антитромбін III (AT-III)", вжитий у цьому описі, означає інгібітор серинової протеази (серпін). AT-III синтезують як білок-попередник, що містить 464 амінокислотні залишки (послідовність SEQ ID NO: 122), який розщеплюється під час секреції з виділенням зрілого антитромбіну довжиною 432 амінокислоти (послідовність SEQ ID NO: 123). Термін "кофактор", вжитий у цьому описі, означає білки або молекули, які зв'язуються з іншими специфічними білками або молекулами з утворенням активного комплексу. За деякими прикладами зв'язування з кофактором є необхідним для оптимальної протеолітичної активності. Наприклад, тканинний фактор (TF) являє собою кофактор FVIIа. Зв'язування FVIIа з TF індукує конформаційні зміни, результатом яких є підвищена протеолітична активність FVIIа відносно своїх субстратів, FX and FIX. Словосполучення "тканинний фактор (TF)", вжите у цьому описі, означає трансмембранний глікопротеїн довжиною 263 амінокислоти (послідовність SEQ ID NO: 124), який функціонує як кофактор FVIIа. Він конститутивно експресується клітинами гладеньких м'язів та фібробластами і допомагає ініціювати коагуляцію шляхом зв'язування FVII та FVIIа, коли ці клітини вступають у контакт із кровотоком після пошкодження тканини. Словосполучення "активований тромбоцит", вжите у цьому описі, означає тромбоцит, який був ініційований зв'язуванням молекул, таких як колагену, тромбоксану А2, ADP (аденозин-5дифосфат) та тромбіну, із зазнанням різних змін у морфології, фенотипі та функції, що, зрештою, стимулює коагуляцію. Наприклад, форма активованого тромбоциту змінюється на більш аморфну з виступними пальцями. Активовані тромбоцити також зазнають "перевертання" клітинної мембрани, унаслідок чого фосфатидилсерин та інші негативно заряджені фосфоліпіди, які у нормальних умовах знаходяться на внутрішньому листку клітинної мембрани, пересуваються на зовнішню поверхню, орієнтовану у бік плазми. Ці мембрани активованих тромбоцитів надають поверхню, на якій відбуваються численні реакції коагуляційного каскаду. Активовані тромбоцити також секретують пухирці, які містять такі прокоагулянтні фактори, як vWF (фактор фон Віллебрандта), FV, тромбін, ADP (аденозин-5дифосфат) та тромбоксан A2, і прилипають один до одного з утворенням тромбоцитарної пробки, яка стабілізується фібрином з утворенням згустка крові. Словосполучення "підвищене зв'язування активованих тромбоцитів" та/або "підвищена спорідненість до активованих тромбоцитів" та будь-які їхні граматичні варіанти, вжиті у цьому описі, означають посилену здатність поліпептиду або білка, наприклад, поліпептиду FVII, до зв'язування з поверхнею активованого тромбоциту, порівняно з еталонним поліпептидом або білком. Наприклад, здатність модифікованого поліпептиду FVII до зв'язування з активованими тромбоцитами може бути більшою за здатність немодифікованого поліпептиду FVII до зв'язування з активованими тромбоцитами. Зв'язування поліпептиду з активованими тромбоцитами та/або спорідненість до них може бути підвищена на щонайменше приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше, порівняно зі зв'язуванням та/або спорідненістю немодифікованого поліпептиду. Дослідження з визначення зв'язування поліпептиду з активованими тромбоцитами та/або спорідненість до них є відомими у цій галузі. Зв'язування поліпептиду FVII з активованими тромбоцитами опосередковується через взаємодію амінокислот Gla-домену поліпептиду FVII та негативно заряджених фосфоліпідів, таких як фосфатидилсерин, на активованому тромбоциті. Як такі, методи аналізу зв'язування поліпептидів, таких як поліпептиди FVII, з активованими тромбоцитами застосовують мембрани та пухирці, які містять фосфоліпіди, такі як фосфатидилсерин. Наприклад, здатність поліпептиду до зв'язування з активованим тромбоцитом відображається здатністю поліпептиду до зв'язування з фосфоліпідними пухирцями, яка може визначатись методами 18 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 світлорозсіювання. Словосполучення "підвищене зв'язування фосфоліпідів" та/або "підвищена спорідненість до фосфоліпідів" та будь-які їхні граматичні варіанти, вжиті у цьому описі, означають посилену здатність поліпептиду або білка до зв'язування з фосфоліпідами, порівняно з еталонним поліпептидом або білком. Фосфоліпіди можуть охоплювати будь-які фосфоліпіди, але, зокрема, включають фосфатидилсерин. Зв'язування поліпептиду з фосфоліпідами та/або спорідненість до них може бути підвищена на щонайменше приблизно 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше, порівняно із зв'язуванням та/або спорідненістю немодифікованого поліпептиду. Аналізи з визначення спорідненості та/або зв'язування поліпептиду з фосфоліпідами є відомими у цій галузі. Наприклад, зв'язування поліпептиду FVII із фосфоліпідними пухирцями може визначатись відносним розсіюванням світла під кутом 90 до падаючого світла. Інтенсивність розсіювання світла із самими фосфоліпідними пухирцями та із фосфоліпідними пухирцями з FVII вимірюють для визначенням константи дисоціації. Поверхневий плазмовий резонанс, наприклад, на біосенсорі приладу BIAcore, також може застосовуватись для визначення спорідненості поліпептидів FVII до фосфоліпідних мембран. Словосполучення "підвищена стійкість до інгібіторів" або "підвищена стійкість до TFPI" чи "підвищена стійкість до AT-III", вжиті у цьому описі, означають будь-який рівень зниження чутливості поліпептиду до пригнічувальної дії інгібітора, такого як TFPI або AT-III, порівняно з еталонним поліпептидом, таким як немодифікований поліпептид FVII. Наприклад, TFPI, у комплексі з FXa, зв'язується з комплексом TF/FVIIa. У цьому випадку він пригнічує активність FVIIa. Таким чином, модифікований поліпептид FVII, що зменшує або запобігає зв'язуванню TFPI з комплексом TF/FVIIa, і тим самим зменшує або запобігає TFPI-опосередкованому пригніченню активності FVIIa, демонструє підвищену стійкість до TFPI. Підвищена стійкість до інгібітора, такого як TFPI, може оцінюватись шляхом визначення зв'язування модифікованого поліпептиду FVII з інгібітором. Підвищена стійкість до інгібітора, такого як TFPI, може також оцінюватись шляхом визначення притаманної активності або коагуляційної активності поліпептиду FVII у присутності TFPI. Аналізи з визначення зв'язування поліпептиду з інгібітором, такого як TFPI або AT-III, є відомими у цій галузі. Для нековалентних інгібіторів, таких як, наприклад, TFPI, може визначатись ki. Для ковалентних інгібіторів, таких як, наприклад, AT-III, може визначатись константа швидкості пригнічення другого порядку. Крім того, поверхневий плазмовий резонанс, наприклад, на біосенсорі приладу BIAcore, також може застосовуватись для визначення зв'язування поліпептидів FVII з TFPI, AT-III або іншими інгібіторами. Однак для ковалентних інгібіторів, таких як AT-III, за допомогою приладу BIAcore може вимірюватись лише швидкість асоціації. Аналізи з визначення пригнічувальної дії, наприклад, TFPI, на коагулянтну активність або притаманну активність FVII також є відомими у цій галузі. Наприклад, може визначатись здатність модифікованого поліпептиду FVII до розщеплення його субстрату FX у присутності TFPI або за його відсутності та ступінь, з яким TFPI пригнічує реакцію. Це може порівнюватись зі здатністю немодифікованого поліпептиду FVII до розщеплення його субстрату FX у присутності TFPI або за його відсутності. Модифікований поліпептид, що демонструє підвищену стійкість до інгібітора, демонструє, наприклад, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 %, 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 100 %, 200 %, 300 %, 400 %, 500 % або більше підвищення стійкості до дії інгібітора, порівняно з немодифікованим поліпептидом. Словосполучення "біологічна активність", вжите у цьому описі, означає in vivo активності сполуки або фізіологічні реакції, які є результатом in vivo введення сполуки, композиції або іншої суміші. Біологічна активність, таким чином, означає терапевтичну дію та фармацевтичну активність таких сполук, композицій та сумішей. Біологічні активності можуть спостерігатись за допомогою in vitro систем, розроблених для випробування або застосування таких активностей. Таким чином, для цілей цього опису, біологічна активність поліпептиду FVII означає коагулянтну активність. Термін "оцінювати" та його граматичні варіанти, вжитий у цьому описі, означає кількісне та якісне визначення у сенсі одержання абсолютного значення активності поліпептиду, а також одержання коефіцієнта, відношення, відсотка, візуального або іншого значення, що вказує на рівень активності. Оцінювання може бути прямим або опосередкованим. Наприклад, виявлення розщеплення субстрату поліпептидом може здійснюватись шляхом прямого вимірювання продукту або може визначатись опосередковано шляхом визначення результуючої активності розщепленого субстрату. Словосполучення "хімотрипсинова нумерація", вжите у цьому описі, означає нумерацію амінокислот зрілого хімотрипсинового поліпептиду послідовності SEQ ID NO: 107. Порівняльний 19 UA 101155 C2 5 10 15 20 25 аналіз протеазного домену іншої протеази, такого як, наприклад, протеазний домен фактора VII, може здійснюватись за допомогою хімотрипсину. У цьому випадку амінокислотам фактора VII, які відповідають амінокислотам хімотрипсину, надають номери амінокислот хімотрипсину. Відповідні положення можуть визначатись за допомогою такого порівняльного аналізу фахівцем у цій галузі шляхом ручного впорядкованого розміщення або за допомогою численних доступних програм порівняльного аналізу (наприклад, BLASTP). Відповідні положення можуть також базуватись на результатах структурного порівняльного аналізу, наприклад, із застосуванням комп'ютерного порівняльного аналізу білкової структури. Вказання на те, що амінокислоти поліпептиду відповідають амінокислотам у розкритій послідовності, стосується амінокислот, ідентифікованих при впорядкованому розміщенні поліпептиду та розкритої послідовності для досягнення максимального рівня ідентичності або гомології (де впорядковано розміщуються консервативні амінокислоти) із застосуванням стандартного алгоритму впорядкованого розміщення, такого як алгоритм GAP. Відповідні хімотрипсинові номери амінокислотних положень поліпептиду FVII від 153 до 406, представлених у послідовності SEQ ID NO: 3, наведені у Таблиці 1. Амінокислотні положення відносно послідовності, наведеної у послідовності SEQ ID NO: 3, позначені нормальним шрифтом, амінокислотні залишки у цих положеннях виділені жирним шрифтом, а відповідні хімотрипсинові номери виділені курсивом. Наприклад, при впорядкованому розміщенні зрілого фактора VII (послідовність SEQ ID NO: 3) зі зрілим хімотрипсином (послідовність SEQ ID NO: 107), ізолейцину (I) у амінокислотному положенні 153 у факторі VII надається хімотрипсинова нумерація I16. Подальші амінокислоти нумеруються відповідним чином. За одним із прикладів глутамінова кислота (Е) у амінокислотному положенні 210 зрілого фактора VII (послідовність SEQ ID NO: 3) відповідає амінокислотному положенню Е70 за хімотрипсиновою нумерацією. Коли залишок існує у протеази, але є відсутнім у хімотрипсину, амінокислотному залишку надається літерне позначення. Наприклад, залишки у хімотрипсині, який є частиною петлі з амінокислотою 60 за хімотрипсиновою нумерацією, але вставлені до послідовності фактора VII, що порівнюється з хімотрипсином, позначаються, наприклад, як K60a, I60b, K60c або N60d. Ці залишки відповідають K197, I198, K199 та N200, відповідно, за нумерацією відносно послідовності зрілого фактора VII (послідовність SEQ ID NO: 3). 30 Таблиця 1 Хімотрипсинова нумерація фактора VII 153 I 16 154 V 17 155 G 18 156 G 19 157 K 20 158 V 21 159 C 22 160 P 23 161 K 24 162 G 25 163 E 26 164 C 27 165 P 28 166 W 29 167 Q 30 168 V 31 169 L 32 170 L 33 171 L 34 172 V 35 173 N 37 174 G 38 175 A 39 176 Q 40 177 L 41 178 C 42 179 G 43 180 G 44 181 T 45 182 L 46 183 I 47 184 N 48 185 T 49 186 I 50 187 W 51 188 V 52 189 V 53 190 S 54 191 A 55 192 A 56 193 H 57 194 C 58 195 F 59 196 D 60 197 K 60A 198 I 60B 199 K 60C 200 N 60D 201 W 61 202 R 62 203 N 63 204 L 64 205 I 65 206 A 66 207 V 67 208 L 68 209 G 69 210 E 70 211 H 71 212 D 72 213 L 73 214 S 74 215 E 75 216 H 76 217 D 77 218 G 78 219 D 79 220 E 80 221 Q 81 222 S 82 223 R 83 224 R 84 225 V 85 226 A 86 227 Q 87 228 V 88 229 I 89 230 I 90 231 P 91 232 S 92 233 T 93 234 Y 94 235 V 95 236 P 96 237 G 97 238 T 98 239 T 99 240 N 100 241 H 101 242 D 102 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 20 UA 101155 C2 I 103 A 104 L 105 L 106 R 107 L 108 H 109 Q 110 P 111 V 112 V 113 L 114 258 V 118 259 V 119 260 P 120 261 L 121 262 C 122 263 L 123 264 P 124 265 E 125 266 R 126 267 T 127 268 F 128 269 S 129 273 L 129D 274 A 129E 275 F 129F 276 V 129G 277 R 134 278 F 135 279 S 136 280 L 137 281 V 138 282 S 139 283 G 140 284 W 141 285 G 142 286 Q 143 287 L 144 288 L 145 289 D 146 290 R 147 291 G 149 292 A 150 293 T 151 294 A 152 295 L 153 296 E 154 297 L 155 298 M 156 299 V 157 300 L 158 301 N 159 302 V 160 303 P 161 304 R 162 305 L 163 306 M 164 307 T 165 308 Q 166 309 D 167 310 C 168 311 L 169 312 313 314 315 316 317 Q Q S R K V 170 170A 170B 170C 170D 170E 321 P 170I 322 N 175 323 I 176 324 T 177 325 E 178 326 Y 179 327 M 180 328 F 181 329 C 182 330 331 332 A G Y 183 184A 184 318 G 170F 319 320 D S 170G 170H T 115 D 116 H 117 270 271 272 E R T 129A 129B 129C 333 S 185 337 K 188 338 D 189 339 S 190 340 C 191 341 K 192 342 G 193 343 D 194 344 S 195 345 G 196 346 G 197 347 P 198 349 A 200 350 T 201 351 H 202 352 Y 203 353 R 204 354 G 205 355 T 206 356 W 207 357 Y 208 358 L 209 359 T 210 360 G 211 361 I 212 362 V 213 364 W 215 365 G 216 366 Q 217 367 G 219 368 369 370 C A T 220 221A 221 371 V 222 372 G 223 373 H 224 374 F 225 375 G 226 376 V 227 377 Y 228 378 T 229 379 R 230 380 V 231 381 S 232 382 Q 233 383 Y 234 384 I 235 385 E 236 386 W 237 387 L 238 388 Q 239 389 K 240 390 L 241 391 M 242 392 R 243 393 S 244 15 336 S 188A 363 S 214 10 335 G 187 348 H199 5 334 D 186 394 E 245 395 P 246 396 R 247 397 P 248 398 G 249 399 V 250 400 L 251 401 L 252 402 R 253 403 A 254 404 P 255 405 F 256 406 P 257 Термін "нуклеїнові кислоти", вжитий у цьому описі, означає ДНК, РНК та їх аналоги, у тому числі пептидо-нуклеїнові кислоти (PNA) та їх суміші. Нуклеїнові кислоти можуть бути одно- або двонитковими. При посиланні на зонди або праймери, які факультативнj мітяться, наприклад, виявною міткою, такою як флуоресцентна або радіоактивна мітка, маються на увазі однониткові молекули. Довжина таких молекул є, як правило, такою, що їх мішень є статистично одно- або малокопійною (як правило, менше ніж 5, у більшості випадків менше ніж 3) для зондування або праймування бібліотеки. У більшості випадків зонд або праймер містить щонайменше 14, 16 або 30 суміжних нуклеотидів послідовності, яка є комплементарною або ідентичною гену, що становить інтерес. Довжина зондів та праймерів може становити 10, 20, 30, 50, 100 або більше нуклеїнових кислот. Термін "пептид", вжитий у цьому описі, означає поліпептид довжиною у 2-40 амінокислот. Амінокислоти, що зустрічаються у різних послідовностях амінокислот, що пропонуються цим винаходом, ідентифікуються за їх відомими трилітерними або однолітерними скороченнями (Таблиця 1). Нуклеотиди, що зустрічаються у різних нуклеїновокислотних фрагментах, позначаються стандартними однолітерними позначеннями, які традиційно вживаються у цій галузі. 21 UA 101155 C2 5 Термін "амінокислота", вжитий у цьому описі, означає органічну сполуку, яка містить аміногрупу та карбоксильну групу. Поліпептид містить дві або більше амінокислот. Для цілей цього опису амінокислоти охоплюють двадцять природних амінокислот, штучні амінокислоти та аналоги амінокислот (тобто амінокислоти, де -вуглець має бічний ланцюг). Відповідно до стандартної номенклатури поліпептидів, опис якої наведений у J. Biol. Chem., 243: 3552-3559 (1969) і яка є прийнятою 37 C.F.R. §§ 1.821-1.822, скорочення для амінокислотних залишків наведені у Таблиці 2: Таблиця 2 Таблиця відповідності Y G F M A S I L T V P K H Q E Z W R D N B C X 10 15 20 25 30 Умовне позначення 1-літерне 3-літерне Tyr Gly Phe Met Ala Ser Ile Leu Thr Val Pro Lys His Gln Glu Glx Trp Arg Asp Asn Asx Cys Xaa Амінокислота Тирозин Гліцин Фенілаланін Метіонін Аланін Серин Ізолейцин Лейцин Треонін Валін Пролін Лізин Гістидин Глутамін Глутамінова кислота Glu та/або Gln Триптофан Аргінін Аспарагінова кислота Аспарагіни Asn та/або Asp Цистеїн Невідома або інша Слід звернути увагу на те, що усі послідовності амінокислотних залишків, представлених у цьому описі формулами, орієнтовані зліва-направо у традиційному напрямку від амінокінця до карбоксильного кінця. Крім того, словосполучення "амінокислотний залишок" має розширене визначення, яке охоплює амінокислоти, наведені у Таблиці відповідності (Таблиця 2), та модифіковані і незвичні амінокислоти, такі, наприклад, що згадуються у 37 C.F.R. §§ 1.8211.822, і включені до цього опису шляхом посилання. Крім того, слід звернути увагу на те, що тире на початку або кінці послідовності амінокислотних залишків вказує на пептидний зв'язок з іншою послідовністю з одного або декількох амінокислотних залишків, з амінокінцевою групою, такою як NH2, або з карбоксикінцевою групою, такою як COOH. Словосполучення "гідрофобна амінокислота", вжите у цьому описі, означає будь-яку з амінокислот, що визначена як гідрофобна із застосуванням консенсусної шкали гідрофобності Айзенберга. Прикладами є природні гідрофобні амінокислоти, такі як ізолейцин, фенілаланін, валін, лейцин, триптофан, метіонін, аланін, гліцин, цистеїн та тирозин (Eisenberg et al., (1982) Faraday Symp. Chem. Soc. 17:109-120). Це словосполучення охоплює також штучні гідрофобні амінокислоти. Словосполучення "кисла амінокислота", вжите у цьому описі, означає для природних амінокислот залишки аспарагінової кислоти та глутамінової кислоти. Словосполучення охоплює також штучні кислі амінокислоти. Словосполучення "природні амінокислоти", вжите у цьому описі, означає 20 L-амінокислот, що зустрічаються у поліпептидах. Словосполучення "штучні амінокислоти", вжите у цьому описі, означає органічну сполуку, 22 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 яка містить аміногрупу та карбоксильну групу, що не є однією з природних амінокислот, перелік яких наведений у Таблиці 2. Штучні амінокислоти, таким чином, охоплюють, наприклад, амінокислоти або аналоги амінокислот, інші ніж 20 природних амінокислот, і до їх числа належать (але ними не обмежуються) D-стереоізомери амінокислот. Приклади штучних амінокислот є відомими фахівцям у цій галузі і можуть бути введені до модифікованого поліпептиду фактора VII. Словосполучення "генно-інженерна конструкція на основі ДНК", вжите уцьому описі, означає молекулу одно- або двониткової лінійної або кільцевої ДНК, яка містить сегменти ДНК, об'єднані та розміщені таким чином, який не зустрічається у природі. Генно-інженерні конструкції існують як результат людської маніпуляції і охоплюють клони та інші копії молекул, які зазнали маніпуляцій. Словосполучення "сегмент ДНК", вжите у цьому описі, означає частину більшої молекули ДНК, що має певні властивості. Наприклад, сегмент ДНК, що кодує визначений поліпептид, являє собою частину молекули довшої ДНК, такої як плазміда або фрагмент плазміди, при цьому згаданий сегмент при зчитуванні у 5-3 напрямку кодує послідовність амінокислот визначеного поліпептиду. Термін "полінуклеотид", вжитий у цьому описі, означає одно- або двонитковий полімер дезоксирибонуклеотидів або рибонуклеотидних основ, що зчитується у 5-3 напрямку. Полінуклеотиди охоплюють РНК та ДНК і можуть бути виділені із природних джерел, синтезовані in vitro або одержані з комбінації природних та синтетичних молекул. Довжина молекули полінуклеотиду вказується у цьому описі у нуклеотидах (скорочення "н.") або парах основ (скорочення "п.н."). Термін "нуклеотиди" вживають для позначення одно- та двониткових молекул, де це дозволяється контекстом. Коли згаданий термін вживають для позначення двониткових молекул, він означає загальну довжину і буде розумітись як такий, що є еквівалентом терміну "пар нуклеотидів". Фахівцям у цій галузі буде зрозуміло, що дві нитки двониткового полінуклеотиду можуть злегка різнитись за довжиною, так що їхні кінці можуть бути ступінчастими; отже, усі нуклеотиди у межах двониткової молекули полінуклеотиду можуть не бути спарованими. Довжина таких неспарованих кінців у більшості випадків не буде перевищувати 20 нуклеотидів. Словосполучення "первинна послідовність", вжите у цьому описі, означає послідовність амінокислотних залишків у поліпептиді. Термін "подібність" між двома білками або нуклеїновими кислотами, вжитий у цьому описі, означає спорідненість між амінокислотними послідовностями білків або нуклеотидними послідовностями нуклеїнових кислот. Подібність може базуватись на ступені ідентичності та/або гомології послідовностей залишків та залишків, які вони містять. Методи визначення ступеня подібності між білками або нуклеїновими кислотами є відомими фахівцям у цій галузі. Наприклад, за одним із методів визначення подібності послідовностей, дві амінокислотні або нуклеотидні послідовності впорядковано розміщують так, щоб одержати максимальний рівень ідентичності між згаданими послідовностями. "Ідентичність" означає ступінь, до якого амінокислотні або нуклеотидні послідовності є інваріантними. При впорядкованому розміщенні амінокислотних послідовностей і до певної міри нуклеотидних послідовностей, можна також приймати до уваги консервативні відмінності та/або повторювані заміни у амінокислотах (або нуклеотидах). Консервативними відмінностями є відмінності, які зберігають фізико-хімічні властивості залишків, яких вони стосуються. Впорядковане розміщення може бути глобальним (впорядковане розміщення порівнюваних послідовностей по усій довжині згаданих послідовностей, в тому числі усіх залишків) або локальним (впорядковане розміщення частини послідовностей, що охоплює лише найбільш подібну ділянку або ділянки). Терміни "гомологія" та "ідентичність", вжиті у цьому описі, вживаються взаємозамінно, але термін "гомологія" для білків може охоплювати заміни консервативних амінокислот. Загалом для ідентифікування відповідних положень, послідовності амінокислот впорядковано розміщуються так, що одержують узгодження найвищого порядку (дивись, наприклад, Computational Molecular Biology, Lesk A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin A.M. and Griffin H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje G., Academic Press, 1987; та Sequence Analysis Primer, Gribskov M. and Devereux J., eds., M Stockton Press, New York, 1991; Carillo et al., (1988) SIAM J. Applied Math 48:1073). Словосполучення "ідентичність послідовності", вжите у цьому описі, означає кількість ідентичних амінокислот (або пар нуклеотидів) у порівнянні між експериментальним та еталонним поліпептидом або полінуклеотидом. Словосполучення "гомологічні поліпептиди" 23 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 означає заздалегідь визначену кількість ідентичних або гомологічних амінокислотних залишків. Гомологія охоплює як заміни консервативних амінокислот, так і ідентичні залишки. Ідентичність послідовності може бути визначена за допомогою програм стандартних алгоритмів впорядкованого розміщення, які застосовуються зі штрафними балами за гаданий прорив, які встановлюються кожним постачальником. Словосполучення "молекули гомологічних нуклеїнових кислот" означає заздалегідь визначену кількість ідентичних або гомологічних нуклеотидів. Гомологія охоплює заміни, які не змінюють закодованої амінокислоти (тобто "мовчазні заміни"), а також ідентичні залишки. Молекули по суті гомологічних нуклеїнових кислот гібридизуються, як правило, в умовах помірної жорсткості або в суворих умовах вздовж усієї довжини нуклеїнової кислоти або вздовж щонайменше приблизно 70 %, 80 % або 90 % довжини молекули непроцесованої нуклеїнової кислоти, що становить інтерес. Розглядаються також молекули нуклеїнових кислот, які містять вироджені кодони на місці кодонів у молекулах нуклеїнових кислот, що гібридизуються. (Для визначення гомології білків, впорядковано можуть розміщуватись як консервативні амінокислоти, так і ідентичні амінокислоти; у цьому випадку відсоток ідентичності та відсоток гомології різняться). Чи мають будь-які дві молекули нуклеїнової кислоти нуклеотидні послідовності (або будь-які два поліпептиди мають амінокислотні послідовності), що є на щонайменше 80 %, 85 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % "ідентичними", може бути визначене із застосуванням відомих обчислювальних алгоритмів, таких як програма "FAST A", із застосуванням, наприклад, значень параметра за замовчуванням, як у Pearson et al., Proc. Natl. Acad. Sci. USA 85: 2444 (1988) (до прикладів таких програм також належать програми GCG (Devereux J. et al., Nucleic Acids Research 12(I): 387 (1984)), BLASTP, BLASTN, FASTA (Atschul S.F. et al., J. Molec. Biol. 215:403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego (1994) та Carillo et al., SIAM J. Applied Math 48: 1073 (1988)). Наприклад, функція BLAST бази даних National Center for Biotechnology Information може застосовуватись для визначення ідентичності. До інших наявних на ринку або загальнодоступних програм належать програма DNAStar "MegAlign" (Madison, штат Вісконсин) та програма "Gap" групи комп'ютерних генетичних досліджень університету штату Вісконсин (University of Wisconsin Genetics Computer Group (UWG)) (Madison, штат Вісконсин). Відсоток гомології або ідентичності білків та/або молекул нуклеїнових кислот може визначатись, наприклад, шляхом порівняння інформації про послідовності за допомогою комп'ютерної програми GAP (наприклад, Needleman et al., J. Mol. Biol. 48: 443 (1970), яка була модифікована Сміт та Уотермен (Smith and Waterman, Adv. Appl. Math. 2: 482 (1981)). Стисло, програма GAP визначає подібність як кількість впорядковано розміщених символів (тобто нуклеотидів або амінокислот), які є подібними, поділену на загальну кількість символів у коротшій з двох послідовностей. Значення параметрів за замовчуванням для програми GAP можуть охоплювати: (1) унарну порівняльну матрицю (що містить значення 1 для ідентичностей та 0 для неідентичностей) та зважену порівняльну матрицю (Gribskov et al., Nucl. Acids Res. 14: 6745 (1986), опис якої надається у Schwartz and Dayhoff, eds., Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, pp. 353-358 (1979); (2) штрафний бал 3,0 за кожен прорив та додатковий штрафний бал 0,10 за кожен символ у кожному прориві; та (3) відсутність штрафного балу за кінцеві прориви. Таким чином, термін "ідентичність", вжитий у цьому описі, означає порівняння між експериментальним та еталонним поліпептидом або полінуклеотидом. За одним з необмежувальних прикладів словосполучення "на щонайменше 90 % ідентичний" означає відсоткову ідентичність від 90 % до 100 % відносно еталонних поліпептидів. Ідентичність на рівні 90 % або більше свідчить про те, що, приймаючи для прикладу порівняння експериментального та еталонного полінуклеотиду довжиною у 100 амінокислот, не більше ніж 10 % (тобто 10 із 100) амінокислот експериментального поліпептиду відрізняються від амінокислот еталонних поліпептидів. Подібні порівняння можуть здійснюватись між експериментальними та еталонними полінуклеотидами. Такі відмінності можуть представлятись як точкові мутації, довільно розподілені по всій довжині амінокислотної послідовності, або ж вони можуть групуватись на одній або декількох ділянках різної довжини до максимально дозволеної, наприклад, відмінність амінокислот 10/100 (приблизно 90 % ідентичність). Відмінності визначаються як нуклеїновокислотні або амінокислотні заміни, інсерції або делеції. На рівні гомології або ідентичності більше приблизно 85-90 % результати повинні бути незалежними від програми та встановлених параметрів проривів; такі високі рівні ідентичності можуть легко визначатись, часто навіть не вдаючись до програмного забезпечення. Слід розуміти також, що терміни "по суті ідентична" або "подібна", вжиті у цьому описі, змінюються у залежності від контексту, що є зрозумілим фахівцям у відповідній галузі, так щоб фахівці могли це визначати. 24 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 Словосполучення "впорядковано розміщена послідовність", вжите у цьому описі, означає застосування гомології (подібності та/або ідентичності) для впорядкованого розміщення відповідних положень у послідовності нуклеотидів або амінокислот. Як правило, впорядковано розміщуються дві або декілька послідовностей, які мають 50 % або більшу ідентичність. Словосполучення "впорядковано розміщений набір послідовностей" означає 2 або декілька послідовностей, які є суміщеними за відповідними положеннями і можуть охоплювати суміщувальні послідовності, що походять із РНК, такі як EST (експресована секвенувальна мітка), та інших кДНК, і є суміщеними з послідовністю геномної ДНК. Словосполучення "специфічно гібридизується", вжите у цьому описі, означає об'єднання, шляхом комплементарного парування основ, нуклеїновокислотної молекули (наприклад, олігонуклеотиду) з нуклеїновокислотною молекулою-мішенню. Фахівцям у цій галузі добре відомі in vitro та in vivo параметри, які впливають на специфічну гібридизацію, такі як довжина та склад конкретної молекули. До параметрів, які мають особливе значення для in vitro гібридизації, також належать температура об'єднання та промивання, склад буфера та концентрація солі. Приклади умов промивання для видалення неспецифічно зв'язаних нуклеїновокислотних молекул за суворих умов: 0,1SSPE (NaCl+Na2HPO4+NaHPO4+етилендіамінтетраоцтова кислота), 0,1 % SDS (додецилсульфат натрію), 65C, та за умов помірної жорсткості: 0,2SSPE, 0,1 % SDS, 50C. Умови еквівалентної жорсткості є відомими у цій галузі. Фахівець може легко підібрати ці параметри для забезпечення специфічної гібридизації нуклеїновокислотної молекули з нуклеїновокислотною молекулою-мішенню, прийнятні для конкретного застосування. Виділений або очищений поліпептид чи білок або його біологічно активна частина є по суті вільним від клітинного матеріалу або інших контамінуючих білків із клітини тканини, з якої згаданий білок походить, або є по суті вільним від хімічних попередників або інших хімічних продуктів, у разі, якщо він є хімічно синтезованим. Сполуки можуть бути визначені як такі, що є по суті вільними, якщо вони видаються вільними від легко виявлюваних домішок, що визначається за допомогою стандартних методів аналізу, таких як тонкошарова хроматографія (TLC), гель-електрофорез та високоефективна рідинна хроматографія (HPLC), які застосовуються фахівцями у цій галузі для визначення такої чистоти або того, що препарати є достатньо чистими, за умови, що додаткове очищення суттєво не змінить фізичних та хімічних властивостей, наприклад, протеолітичної та біологічної активності, речовини. Методи очищення сполук для одержання по суті хімічно чистих сполук є відомими фахівцям у цій галузі. Однак по суті хімічно чиста сполука може бути сумішшю стереоізомерів. У таких випадках додаткове очищення може підвищити питому активність сполуки. Словосполучення "по суті вільний від клітинного матеріалу" означає препарати білків, у яких білок є відокремленим від клітинних компонентів клітин, з яких білок виділяють або одержують рекомбінантним шляхом. За одним з варіантів здійснення словосполучення "по суті вільний від клітинного матеріалу" означає препарати протеазних білків, які мають менше ніж приблизно 30 % (за масою матеріалу у сухому стані) непротеазних білків (які у цьому описі називають також контамінаційними білками), як правило, менше ніж приблизно 20 % непротеазних білків або 10 % непротеазних білків чи менше ніж приблизно 5 % непротеазних білків. Коли протеазний білок або його активну частину одержують рекомбінантним шляхом, він також є по суті чистим від культурального середовища, тобто вміст культурального середовища дорівнює або становить менше ніж приблизно 20 %, 10 % або 5 % об'єму препарату протеазного білка. Словосполучення "по суті вільний від хімічних попередників або інших хімічних продуктів", вжите у цьому описі, означає препарати протеазних білків, у яких білок є відокремленим від хімічних попередників або інших хімічних продуктів, які приймають участь у синтезі білка. Згадане словосполучення охоплює препарати протеазних білків, які мають менше ніж приблизно 30 % (за масою матеріалу у сухому стані), 20 %, 10 %, 5 % або менше хімічних попередників або непротеазних хімічних препаратів або складових. Словосполучення "одержання методами рекомбінантних ДНК" або "із застосуванням методів рекомбінантних ДНК", вжите у цьому описі, означає застосування добре відомих методів молекулярної біології для експресії білків, закодованих клонованою ДНК. Термін "вектор (або плазміда)", вжитий у цьому описі, означає дискретні елементи, які застосовуються для введення гетерологічної нуклеїнової кислоти у клітини для її експресії або реплікації. Згадані вектори, як правило, залишаються епісомними, але можуть конструюватись так, щоб здійснювати інтеграцію гена або його частини у хромосому геному. Передбачаються також вектори, які є штучними хромосомами, такими як штучні хромосоми бактерій, штучні хромосоми дріжджів та штучні хромосоми ссавців. Вибір та застосування таких носіїв є добре відомим фахівцям у цій галузі. 25 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "експресія", вжитий у цьому описі, означає процес, за яким нуклеїнова кислота транскрибується у мРНК та транслюється у пептиди, поліпептиди або білки. Якщо нуклеїнова кислота є похідною геномної ДНК, експресія може, якщо вибрана відповідна еукаріотна клітинахазяїн або організм, охоплювати процесинг, такий як сплайсування мРНК. Термін "експресійний вектор", вжитий цьому описі, означає вектори, здатні експресувати ДНК, яка є функціонально зв'язаною з регуляторними послідовностями, такими як промоторні ділянки, які є здатними до здійснення експресії таких фрагментів ДНК. Такі додаткові сегменти можуть включати в себе промоторні та термінаторні послідовності, і факультативно можуть включати в себе одну або декілька точок початку реплікації, один або декілька селектовних маркерів, енхансер, сигнал поліаденілування тощо. Еспресійні вектори, як правило, є похідними плазмідної або вірусної ДНК або ж можуть містити елементи обох ДНК. Таким чином, експресійний вектор являє собою генно-інженерну конструкцію на основі рекомбінантної ДНК або РНК, таку як плазміда, фаг, рекомбінантний вірус або інший вектор, результатом введення якого до відповідної клітини-хазяїна є експресія клонованої ДНК. Відповідні експресійні вектори є добре відомими фахівцям у цій галузі і охоплюють ті з них, що розмножуються у еукаріотних клітинах та/або прокаріотних клітинах, ті, що залишаються епісомними, або ті, що інтегруються до геному клітини-хазяїна. Термін "вектор", вжитий у цьому описі, означає також "вектори на основі вірусного геному". Вектори на основі вірусного геному являють собою віруси, одержані методами генної інженерії, які є функціонально зв'язаними з екзогенними генами для перенесення (як носії або "човники") екзогенних генів у клітини. Термін "аденовірус", вжитий у цьому описі, означає будь-який вірус із групи ДНК-вмісних вірусів, який спричинює кон'юнктивіт та інфекції верхніх дихальних шляхів у людей. Термін "оголена" ДНК, вжитий у цьому описі, означає безгістонну ДНК, яка може застосовуватись для виготовлення вакцин та генотерапії. "Оголена" ДНК являє собою генетичний матеріал, який переходить із клітини до клітини у процесі перенесення генів, який називають трансформацією або трансфекцією. При трансформації або трансфекції очищена або "оголена" ДНА, яка поглинається клітиною-реципієнтом, надасть клітині-реципієнту нову властивість або новий фенотип. Термін "функціонально" або словосполучення "функціонально зв'язаний", вжиті у цьому описі, по відношенню до сегментів ДНК означають, що ці сегменти розміщені так, що вони узгоджено функціонують для досягнення призначеної мети, наприклад, транскрипція розпочинається на промоторі і проходить через кодувальний сегмент до термінатора. Словосполучення "агент, що модулює активність білка або експресію гена чи нуклеїнової кислоти", вжите у цьому описі, означає агент, який зменшує або підвищує чи іншим чином змінює активність білка або певним чином активує чи пригнічує або іншим чином змінює експресію нуклеїнової кислоти у клітині. Термін "химерний білок" або "гібридний білок", вжитий у цьому описі, означає поліпептид, функціонально зв'язаний з іншим поліпептидом. Химерний або гібридний білок, що пропонується цим винаходом, може включати в себе один або декілька поліпептидів FVII чи його частину та один або декілька інших поліпептидів для будь-якого одного або декількох транскрипційних/трансляційних контрольних сигналів, сигнальних послідовностей, мітки для локалізації, мітки для очищення, частини домену імуноглобуліну G та/або спрямувального агента. Химерний поліпептид FVII також включає в себе химерні або гібридні білки, що обміняли свої ендогенні домени або ділянки поліпептиду з іншим поліпептидом. Ці химерні або гібридні білки охоплюють білки, продуковані методами рекомбінантних ДНК, наприклад, гібридні білки, білки, продуковані хімічними методами, такими як хімічне сполучення, наприклад, сполучення із сульфгідрильними групами, та білки, продуковані будь-яким іншим методом, де щонайменше один поліпептид (тобто FVII) або його частина є зв'язаним, безпосередньо або опосередковано через лінкер(-и), з іншим поліпептидом. Словосполучення "функціонально зв'язаний", вжите у цьому описі по відношенню до гібридного білка, означає протеазний поліпептид та непротеазний поліпептид, які є взаємно злитими у межах рамки зчитування. Непротеазний поліпептид може бути злитим із N-кінцем або C-кінцем протеазного поліпептиду. Термін "спрямувальний (таргетувальний) агент", вжитий у цьому описі, означає будь-яку складову, таку як білок або його ефективна частина, що забезпечує специфічне зв'язування з молекулою на поверхні клітини, наприклад, поверхневоклітинним рецептором, який у певних випадках може інтерналізувати зв'язаний кон'югат або його частину. Спрямувальним (таргетувальним) агентом також може бути агент, який стимулює або полегшує, наприклад, афінне виділення або очищення кон'югату, прикріплення кон'югату до поверхні або виявлення 26 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 кон'югату чи комплексів, які містять кон'югат. Термін "похідна" або "аналог" молекули, вжитий у цьому описі, означає частину, яка є похідною або модифікованим варіантом молекули. Термін "захворювання" або "розлад", вжитий у цьому описі, означає патологічний стан організму, який є результатом фактора або стану, у тому числі (але без обмеження ними), інфекцій, набутих станів, генетичних станів, і характеризується ідентифіковними симптомами. Захворюваннями та розладами, що становлять інтерес, у цьому описі є захворювання та розлади, що спричинюють згортання, у тому числі ті з них, що опосередковуються коагуляційними білками, та ті з них, у яких коагуляційні білки відіграють роль у етіології або патології. Захворювання та розлади також охоплюють ті з них, що спричинюються відсутністю білка, наприклад, гемофілію, і особливий інтерес у цьому описі становлять ті розлади, при яких коагуляція не відбувається унаслідок недостатності або дефекту коагуляційного білка. Термін "прокоагулянт", вжитий у цьому описі, означає будь-яку речовину, що стимулює згортання крові. Термін "антикоагулянт", вжитий у цьому описі, означає будь-яку речовину, що пригнічує згортання крові. Термін "гемофілія", вжитий у цьому описі, означає розлад із кровотечею, що спричинюється дефіцитом факторів згортання крові. Гемофілія може бути результатом, наприклад, відсутності, зниженої експресії або зниженої функції фактора згортання крові. Найпоширенішим типом гемофілії є гемофілія А, яка є результатом дефіциту фактора VIII. Другим із найпоширеніших типів гемофілії є гемофілія В, яка є результатом дефіциту фактора IX. Гемофілія С, яку називають також дефіцитом фактора XI, є більш м'якою та менш поширеною формою гемофілії. Термін "вроджена гемофілія", вжитий у цьому описі, означає типи гемофілії, що є спадковими. Вроджена гемофілія є результатом мутації, делеції, інсерції або іншої модифікації гена фактора згортання крові, при якій продукування фактора згортання крові є відсутнім, зниженим або нефункціональним. Наприклад, результатом спадкових мутацій гена фактора згортання крові, такого як фактор VIII та фактор IX, є вроджені гемофілії, гемофілія А та гемофілія В, відповідно. Термін "набута гемофілія", вжитий у цьому описі, означає тип гемофілії, що розвивається у період статевого дозрівання унаслідок продукування аутоантитіл, які інактивують FVIII. Термін "розлад із кровотечею", вжитий у цьому описі, означає стан, при якому суб'єкт має знижену спроможність контролювання кровотечі. Розлади з кровотечею можуть бути спадковими або набутими і можуть бути результатом, наприклад, дефектів або недостатностей коагуляційного шляху, дефектів або недостатностей активності тромбоцитів або судинних дефектів. Термін "набутий розлад із кровотечею", вжитий у цьому описі, означає розлади з кровотечею, які є результатом недостатностей згортання крові, спричинених такими станами, як захворювання печінки, дефіцит вітаміну К або лікування кумадином (варфарином) або іншим антикоагулянтним лікарським засобом. Термін "лікування" пацієнта, який страждає на захворювання або стан, вжитий у цьому описі, означає, що поліпептид, композицію або інший продукт, що пропонуються цим винаходом, вводять згаданому пацієнту. Термін "терапевтичний засіб", "схема лікування", "радіопротектор" або "хіміотерапевтичний засіб", вжитий у цьому описі, означає традиційні лікарські засоби, у тому числі вакцини, які є відомими фахівцям у цій галузі. Радіотерапевтичні засоби є добре відомими у цій галузі. Термін "лікування", вжитий у цьому описі, означає будь-який спосіб, за яким тяжкість симптомів стану, розладу або захворювання полегшується або благотворно змінюється іншим чином. Виходячи з цього, термін "лікування" означає профілактику та/або терапію. Термін "лікування" означає також будь-яке фармацевтичне застосування композиції, що пропонується цим винаходом. Термін "лікування" означає також будь-яке фармацевтичне застосування модифікованого FVII та композицій, що пропонуються цим винаходом. Словосполучення "полегшення тяжкості симптомів конкретного захворювання або розладу шляхом лікування, наприклад, шляхом введення фармацевтичної композиції або іншого терапевтичного засобу", вжите у цьому описі, означає будь-яке зменшення, постійне або тимчасове, тривале або минуче, симптомів, що може приписуватись або пов'язуватись із введенням композиції або лікарського засобу. Термін "запобігання" або "профілактика", вжитий у цьому описі, означає методи, за допомогою яких зменшується ризик розвитку захворювання або стану. Профілактика охоплює зниження ризику розвитку захворювання або стану та/або запобігання погіршенню симптомів або розвитку захворювання або зниження ризику погіршення симптомів чи розвитку 27 UA 101155 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання. Словосполучення "ефективна кількість сполуки або композиції для лікування конкретного захворювання", вжите у цьому описі, означає кількість, яка є достатньою для полегшення тяжкості або зменшення якимсь чином симптомів, пов'язаних із захворюванням. Така кількість може вводитись однією дозою або може вводитись відповідно до схеми лікування, яка забезпечує її ефективність. Згадана кількість може лікувати захворювання, але, як правило, її вводять для полегшення тяжкості симптомів захворювання. Як правило, для досягнення бажаного полегшення тяжкості симптомів необхідним є повторне введення. Словосполучення "терапевтично ефективна кількість" або "терапевтично ефективна доза", вжиті у цьому описі, означають агент, сполуку, матеріал або композицію, що містять сполуку, яка є принаймні достатньою для спричинення терапевтичного ефекту. Ефективною кількістю є кількість терапевтичного засобу, необхідна для запобігання, вилікування, полегшення тяжкості симптомів, припинення або часткового припинення симптомів захворювання або розладу. Термін "пацієнт" або "суб'єкт", якого піддають лікуванню, вжитий у цьому описі, означає людей і тварин, крім людини, у тому числі ссавців. До ссавців належать примати, такі як люди, шимпанзе, горили та мавпи; свійські тварини, такі як собаки, коні, кішки, свині, кози, корови; та гризуни, такі як миші, пацюки, хом'яки та піщанки. Термін "комбінація", вжитий у цьому описі, означає будь-який зв'язок між двома або декількома речами. Згаданий зв'язок може бути просторовим або означати застосування двох або декількох речей зі спільною метою. Термін "композиція", вжитий у цьому описі, означає будь-яку суміш двох або декількох продуктів або сполук (наприклад, агентів, модуляторів, регуляторів тощо). Це може бути розчин, суспензія, рідина, порошок, паста, водна або неводна композиція чи будь-яка їх комбінація. Словосполучення "готовий виріб", вжите у цьому описі, означає продукт, який виготовляється і продається. Згаданий термін, у значенні, у якому він вживається у цьому описі, означає модифіковані протеазні поліпептиди та нуклеїнові кислоти, вміщені в упаковку. Термін "текуче середовище", вжитий у цьому описі, означає будь-яку композицію, що може плинути. Таким чином, термін "текучі середовища" означає композиції, які мають форму напівтвердих речовин, паст, розчинів, водних сумішей, гелів, лосьйонів, кремів та інших подібних композицій. Термін "набір", вжитий у цьому описі, означає упаковану комбінацію, яка факультативно включає в себе реактиви та інші продукти та/або компоненти для практичного здійснення методів із застосуванням складових елементів комбінації. Наприклад, пропонуються набори, які включають в себе модифікований протеазний поліпептид або молекулу нуклеїнової кислоти, яка пропонується цим винаходом, та інший предмет для цілі, яка передбачає (але без обмеження ними) введення, діагностування та оцінювання біологічної активності або властивості. Набори за факультативним варіантом включають в себе інструкції з користування. Термін "антитіло", вжитий у цьому описі, охоплює фрагменти антитіла, такі як Fabфрагменти, які складаються з легкого ланцюга та варіабельної ділянки важкого ланцюга. Термін "рецептор", вжитий у цьому описі, означає молекулу, яка має спорідненість до конкретного ліганду. Рецептори можуть бути природними або синтетичними молекулами. Рецептори у цій галузі можуть також називатись анти-лігандами. Термін "тварина", вжитий у цьому описі, означає будь-яку тварину, таку як (але без обмеження ними) примати, у тому числі люди, горили та мавпи; гризунів, таких як миші та пацюки; птахів, таких як курчати; жуйних, таких як кози, корови, олені, вівці; нежуйних, таких як свині, та інших тварин. Термін "тварина, крім людини" не означає людину, яка охоплена терміном "тварина". Протеази, що пропонуються цим винаходом, походять із будь-якого джерела, яким може бути тварина, рослина, прокаріотний організм або грибок. Термін "генотерапія", вжитий у цьому описі, означає перенесення гетерологічної нуклеїнової кислоти, такої як ДНК, у певні клітини, клітини-мішені, організм ссавця, зокрема, людини, з розладом або станом, для якого така терапія є необхідною. Згадану нуклеїнову кислоту, таку як ДНК, вводять у вибрані клітини-мішені безпосередньо або за допомогою вектора чи іншого засобу доставки, так що гетерологічна нуклеїнова кислота, така як ДНК, експресується, і продукується терапевтичний продукт, що кодується при цьому. За альтернативним варіантом гетерологічна нуклеїнова кислота, така як ДНК, може певним чином опосередковувати експресію ДНК, що кодує терапевтичний продукт, або вона може кодувати продукт, такий як пептид або РНК, який певним чином опосередковує, безпосередньо або опосередковано, експресію терапевтичного продукту. Генотерапія може також застосовуватись для доставки нуклеїнової кислоти, що кодує генний продукт, який замінює дефектний ген або доповнює генний продукт, що продукується ссавцем або клітиною, в яку він вводиться. Введена 28
ДивитисяДодаткова інформація
Назва патенту англійськоюModified polypeptide of factor vii (fvii) and its using
Автори англійськоюMadison, Edwin L., Thanos, Christopher D., Ruggles, Sandra Waugh, Coughlin, Shaun
Назва патенту російськоюМодифицированный полипептид фактора vii (fvii) и его применение
Автори російськоюМедисон Эдвин Л., Танос Кристофер Д., Рагглз Сандра Уоф, Коглин Шон
МПК / Мітки
МПК: A61P 7/04, C12N 9/64, C07K 14/745, A61K 38/36
Мітки: фактора, поліпептид, модифікований, застосування
Код посилання
<a href="https://ua.patents.su/321-101155-modifikovanijj-polipeptid-faktora-vii-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Модифікований поліпептид фактора vii та його застосування</a>
Попередній патент: Машинозчитуваний носій запису
Наступний патент: Сенсори со2 рослин, кодуючі їх нуклеїнові кислоти і способи їх одержання і застосування
Випадковий патент: Спосіб оперативного моніторингу розповсюдження хохулі звичайної (desmana moschata linnaeus, 1758)