Похідне n-(1,2-цис-2-фторциклопропіл)піридонкарбонової кислоти
Текст
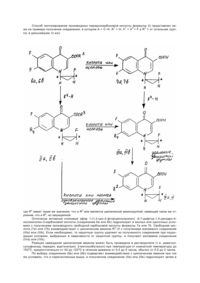
Настоящее изобретение касается антимикробного соединения, полезного в качестве лекарственного средства для человека и животных, лекарства для рыб, сельскохозяйственного химикалия и антисептиков. Производные хинолона, которые являются синтетическими противомикробными средствами, имеющие скелет конденсированной пиридонкарбоновой кислоты, известны как потенциальные противомикробные соединения при замещении их 1-положения циклопропиловой группой. Далее известно, что производные 1-циклопропилхинолина, имеющие введенный во 2-положение циклопропиловой группы атом фтора в цис-конфигурации с частью молекулы пиридонкарбоновой кислоты, также проявляют противомикробную активность, как описано в заявке на патент Японии А–62–12760 (термин "JP–A", использованный в описании, означает "не прошедшая экспертизу опубликованная заявка на патент Японии"). Полагают, что они обладают не только высокой противомикробной активностью, но и повышенной безопасностью. Пример производных хинолона, имеющих цис-фторциклопропиловую группу в 1-положении, представлен ниже: O COOH F N N CH3 -N F Производные хинолона, имеющие цис-галоидоциклопропиловую группу, включая и цис-фторциклопропиловую группу, в 1-положении, как утверждалось выше, обладают отличными свойствами, касающимися противомикробной активности и надежности. В этих соединениях с заместителем в 7-положении части молекул пиридонкарбоновой кислоты, не проявляющих изомеризма, само галоидоциклопропановое кольцо образует два энантиомера, восходящих к стерическому родству между составляющей пиридонкарбоновую кислоту и атомом галогена по отношению к циклопропановому кольцу, как показано ниже: R1 O COOH X1 R2 O A N H X2 H R1 X1 HOOC и X2 N H R2 H A в которых R1, R2, A, X1 и X2 будут определены ниже. Эти производные хинолона находят применение в качестве лекарственных средств постольку, поскольку они являются рацематами. С другой стороны, если имеет место изомеризм заместителя в 7-положении части молекулы пиридонкарбоновой кислоты, то такие производные хинолона имеют четыре вида стереоизомеров, включающие диастереомеры и энантиомеры. При получении смеси диастереомеров имеются трудности в определении полезных соединений и применении в качестве лекарственных средств. В свете изложенной выше ситуации изобретатели предприняли широкие исследования с целью получения отдельного изомера производных 1-(1,2-цис-2-фторциклопропил)-замещенного хинолона, содержащих диастереомеры и добились успеха в получении каждого энантиомера цис-2-фторциклопропиламина в виде чистого изомера. В результате дальнейших исследований им также удалось синтезировать каждый из изомеров-энантиомеров производного хинолона, которые определяются только пространственной конфигурацией фторциклопропанового кольца, используя упомянутый выше амин как исходное соединение. Успех в получении изомера 2-фторциклопропиламина, полезного в качестве промежуточного соединения, сделал возможным синтез оптически активного производного хинолона, содержащего отдельный единственный диастереомер, путем взаимодействия с отдельным изомером амина для введения циклической аминогруппы в 7-положение. Каждый из этих диастереомеров проявлял более сильную антимикробную активность в сравнении с соответствующими производными хинолона, замещенными простой циклоп ропиловой группой, и в дополнение к этому имел высокую безопасность с заметно улучшенной избирательной токсичностью. Настоящее изобретение создано на базе этих находок. Это изобретение касается производного N1-(1,2-цис-2-галоидоциклопропил)-замещенной пиридонкарбоновой кислоты, представленного формулой (I): R1 O COOH X1 R2 A N X2 (І) в которой R1 обозначает аминогруппу, или атом водорода, R2 представляет пирролидинил, который может иметь более одного заместителя, выбранного из группы, включающей С1–6 алкил, аминогруппу, амино-замещенный алкил С1–6; азаспиро[2,4]гептанил, который может иметь заместитель, выбранный из группы, включающей аминогруппу и гидроксильную группу; азаспиро[3,4]октанил, который может иметь в качестве заместителя амино группу; или пиперазинил; А обозначает С–Х3 или атом азота; Х1 и Х2, которые могут быть одинаковыми или различными, каждый обозначает атом галогена; и Х3 обозначает атом галогена, атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, или алкокси группу, имеющую от 1 до 6 атомов углерода; при условии, что случай, при котором R1 обозначает атом водорода, а R2 является пиперазином или 4-алкил-замещенным пиперазиновым остатком, исключается; или его хлористоводородная соль. Конкретные соединения формулы I представляют собой: 7-[3-(S)-амино-1-пирролидинил]-6-фтор-1-(1,2-цис-2- фторциклопропил)-4-оксо-1,4-дигидрохинолин-3карбоновую кислоту, 7-[3-(S)-амино-1-пирролидинил]- 8-хлор-6-фтор-1-(1,2-цис-2- фторциклопропил)-4-оксо-1,4-дигидрохинолин-3- карбоновую кислоту; 7[7-амино-5-азаспиро[2,4]гептан-5-ил]- 8-хлор-6-фтор-1(1,2-цис-2- фторциклопропил)-4-оксо-1,4-дигидрохинолин-3- карбоновую кислоту; 5-амино-7-[3-(S)-амино-1пирролидинил] -6,8-дифтор-1-(1,2-цис-2- фторциклопропил)-4-оксо-1,4-дигидрохинолин-3- карбоновую кислоту, 7-[4-(S)-амино-2-(S)-метил-1-пирролидинил] -6-фтор-1-(1,2-цис-2- фторциклопропил)-4-оксо-1,4 -дигидро-1,8-нафтиридин-3-карбоновую кислоту; 7-[3-(R)-[1-(S)-аминоэтил]-1-пирролидинил]-8-хлор -6-фтор-1(1,2-цис-2- фторциклопропил)-4-оксо-1,4- дигидрохинолин-3-карбоновую кислоту; 7-[4-(S)-амино-2-(S)-метил-1-пирролидинил] -6-фтор-1-(1,2-цис-2- фторциклопропил)-8-метил-4-оксо-1,4 -дигидрохинолин-3-карбоновую кислоту, 5-амино-7-[7-амино-5-азаспиро[2,4]гептан-5-ил]- 6,8-дифтор-1-(1,2-цис-2- фторциклопропил) -4-оксо-1,4-дигидрохинолин-3- карбоновую кислоту, 7-[8-амино-6-азаспиро[3,4]октан-6-ил]-8-хлор-6фтор-1-(1,2-цис-2- фторциклопропил)-4-оксо-1,4-дигидрохинолин-3- карбоновую кислоту; 7-[4-амино-3,3-диметил-1-пирролидинил]- 8-хлор-6-фтор-1-(1,2-цис-2- фторциклопропил)-4-оксохинолин-3- карбоновую кислоту; 7-[4-(S)-амино-2-(S)-метил-1-пирролиди-нил] -6-фтор-1-(1,2-цис-2- фторциклопропил)-4-оксо-1,4 -дигидрохинолин-3-карбоновую кислоту, 7[7-амино-5-азаспиро[2,4]гептан-5-ил]- 8-хлор-6-фтор-1-(1,2-цис-2фторциклопропил)-4-оксо-1,4-дигидрохинолин-3- карбоновую кислоту или соль этих соединений. Производные пиридонкарбоновой кислоты согласно настоящему изобретению включают соответствующие свободные кислоты, кислотно-аддитивные соли и соли при карбоксильной группе. Кислотно-аддитивные соли включают соли неорганической кислоты, т.е. гидрохлориды, сульфаты, нитраты, гидробромиды, гидроиодиды и фосфаты, и соли органических кислот, т.е. ацетаты, метансульфонаты, бензолсульфонаты, толуолсульфонаты, цитраты, малеаты, фумараты и лактаты. Соли при карбоксильной группе могут быть органическими или неорганическими и включают соли щелочных металлов, т.е. соли лития, соли натрия и соли калия; соли щелочноземельных металлов, т.е. соли магния, и соли кальция; соли аммония, N-метилглюкаматы и соли трис-(оксиметил)-аминометана. Некоторые из этих свободных кислот и солей существуют в гидратной форме. Этерификация части молекулы карбоновой кислоты производных пиридонкарбоновой кислоты формулы (I) дает соединения, полезные в качестве промежуточных соединений для синтеза или пролекарств. Например, сложные алкиловые эфиры, сложные бензиловые эфиры, сложные алкоксикарбонильные эфиры и фениловые эфиры полезны как промежуточные соединения для синтеза. Сложные эфиры, которые легко отщепляются в организме с образованием свободных карбоновых кислот полезны в качестве пролекарств. Примерами таких сложных эфиров являются ацетоксиметиловые эфиры, пивалоилоксиметиловые эфиры, этоксикарбонилоксиэфиры, холиновые эфиры, диметиламиноэтиловые эфиры, 5-индалиловые эфиры, фталидиниловые эфиры, 5-индалиловые эфиры, фталидиниловые эфиры и оксоалиловые эфиры (т.е. 5-замещенные-2-оксо-1,3-диоксол-4илметиловые сложные эфиры и 3-ацетокси-2-оксобутиловые сложные эфиры). Способ синтезирования производных пиридонкарбоновой кислоты формулы (I) представлен ниже на примере получения соединения, в котором A = C–H, R1 = H; X1 = X2 = F и R3 = эт (этильная группа, в дальнейшем то же): где R4 имеет такие же значения, что и R2 или является циклической аминогруппой, имеющей такое же строение, что и R2, но защищенной. Оптически активный этиловый эфир 1-(1,2-цис-2-фторциклопропил) -6,7-дифтор-1,4-дигидро-4оксохинолин-3-карбоновой кислоты (соединение 6а или 6b) гидролизуют в кислых или щелочных условиях с получением производного свободной карбоновой кислоты формулы 7a или 7b. Свободная кислота (7a) или (7b) взаимодействует с циклическим амином R4–H с получением желаемого соединения (IIIa) или (IIIb). Если необходимо, то защитную группу удаляют из полученного соединения при подходящих условиях, выбранных в зависимости от защитной группы, и получают желаемое соединение (IVa) или (IVb). Реакция замещения циклическим амином может быть проведена в растворителе (т.е. диметилсульфоксид, пиридин, ацетонитрил, 3-метоксибутанол) при температуре от комнатной температуры до 150оС, предпочтительно от 40 до 120оС в течение времени от 0,5 до 5 часов, обычно от 0,5 до 2 часов. По выбору соединение (6a) или (6b) подвергают взаимодействию с циклическим амином при тех же условиях, что и перечисленные выше, и полученное соединение (IIa) или (IIb) гидролизуют затем в кислотных или щелочных условиях и, если необходимо, удаляют защитную группу, чтобы получить желаемое соединение (IIIa) или (IIIb) или (IVa) или (IVb). Оптически активный цис-фторциклопропиламин можно синтезировать следующим образом. 2Фторциклопропанкарбоновую кислоту подвергают реакции с (R)-(+)-a-метилбензиламином с получением N-[1-(R)-фенилэтил]-1,2-цис-2-фторциклопропанкарбоксамида. Реакция может быть проведена в тетрагидрофуране в присутствии N,N-карбонилдиимидазола. Реакция может быть также осуществлена в соответствии с процессом использования смешанного ангидрида кислоты, при котором карбоновую кислоту растворяют в апротонном растворителе и подвергают взаимодействию со сложным эфиром галоидомуравьиной кислоты в присутствии основания при низких температурах и затем взаимодействию с бензиламином для получения карбоксамида. Полученный карбоксамид может быть разделен на каждый энантиомер методом хроматографии. Апротонный растворитель, используемый в процессе получения смешанного ангидрида кислоты, особенно не ограничен и включает простые эфиры, например, диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 1,4-диоксан и 1,2-диметоксиэтан; галогенизированные углеводороды, т.е. дихлорметан, хлороформ, 1,2-дихлорэтан и 1,1,2,2-тетрахлорэтан; ароматические углеводороды, например, бензол, толуол, и ксилол и алифатические углеводороды, например, пентан, гексан, гептан и циклогексан. Из них обычно используют тетрагидрофуран или хлороформ. Воду, содержащуюся в используемом растворителе, обычно удаляют заранее. Галогеном в сложном эфире галоидомуравьиной кислоты нормально является атом хлора. Сложный эфир галоидомуравьиной кислоты включает метиловый, этиловый, 2,2,2-трихлорэтиловый, фениловый, пара-нитрофениловый и бензиловый эфиры. Используемое основание может быть либо органическим, либо неорганическим. Неорганическое основание включает гидроокись щелочного металла, карбонаты или кислые карбонаты, т.е. гидроокись лития, гидроокись натрия, гидроокись калия, карбонат лития, карбонат натрия, карбонат калия, кислый карбонат натрия и кислый карбонат калия. Органическое основание включает триалкиламины, например, триэтиламин, трипропиламин, трибутиламин, N,N-диизопропилэтиламин; диалкиланилины, например, диэтиланилин и диметиланилин и ароматические соединения, например, N-метилморфолин, пиридин и N,N-диметиламинопиридин. Разделение карбоксамида на оптические изомеры может быть осуществлено известными методами, такими как хроматография на силикагеле при нормальном давлении или при пониженном давлении, препаративная тонкослойная хроматография и высокопроизводительная жидкостная хроматография. Разделение на оптические изомеры может быть также проведено другими методами разделения, обычно применяемые при этом, такими как перекристаллизация, переосаждение. Разделенный таким образом оптически активный карбоксамид может быть введен в оптически активную цис-2-фторциклопропанкарбоновую кислоту тепловой обработкой в кислых условиях. Реакция может быть проведена растворением карбоксамида, например, в концентрированной хлористоводородной кислоте с последующим нагреванием. Хлористоводородная кислота может быть заменена серной кислотой или азотной кислотой. Может быть использован растворитель, такой как уксусная кислота и низший спирт. Полученная карбоновая кислота может быть защищена сразу реакцией Курциуса в присутствии трет-бутанола с получением цис-1-(трет-бутоксикарбониламино)-2-фторциклопропана. Реакция может быть проведена традиционно с использованием дифенилфосфорплазида, но синтез промежуточного азидного соединения не ограничивается этим методом и могут быть применены общие методы синтеза. Полученное производное оптически активного цис-2-фторциклопропиламина может быть далее использовано для получения хинолинового производного, имеющего цис-фторциклопропиловую группу в 1-положении как единственного изомера. Производное хинолона согласно настоящему изобретению затем может быть получено взаимодействием этого изомера с циклическим амином, как описано выше. Производные пиридонкарбоновой кислоты согласно изобретению проявляют потенциальную противомикробную активность и таким образом могут быть использованы в качестве лечебных средств в медицине и ветеринарии, для лечения рыб, в качестве сельскохозяйственных химикатов и в консервации продуктов питания. Доза производных пиридонкарбоновой кислоты для использования в лечебных целях составляет от 50 мг до 1,0 г, предпочтительно от 100 мг до 300 мг в день для взрослого человека. Доза для использования в лечебных целях в ветеринарии составляет от 1 мг до 200 мг, предпочтительно от 5 до 100 мг на кг веса тела в день, хотя возможно большее или меньшее варьирование в зависимости от цели ведения (терапевтическое или профилактическое использование и так далее), вида и размера животного, вида патогенных организмов и симптомов. Дневная доза, указанная выше, может быть разделена на 2–4 дозы в день. Если необходимо, то дневная доза иногда может отклоняться от указанного интервала. Производные пиридонкарбоновой кислоты согласно изобретению активны против разнообразных микроорганизмов, вызывающих различные инфекционные заболевания, и могут излечивать или смягчать боли и/или предотвращать болезни, вызванные этими патогенами. Наглядными примерами бактерий или похожих на бактерии микроорганизмов, против которых производные пиридонкарбоновой кислоты эффективны, являются: Staphylococcus Sp., Streptococcus pyogenes, Streptococcus haemolyticus, Enterococci, Streptococcus pneumaniae, Petrostreptococcus Sp., Neisseria gonorihocoa, Escherichia coli, Citobacter Spp., Slugella Sp., Klebsiella pneumoniae, Enterobacter Sp., Serroctia Sp., Piroteus Sp., Pseudomonas aeryginosa, Hemophilus influenziae, Acinetobacter Sp., Camplylobacter Sp. и Chlamidiae. Примеры заболеваний, вызванных этими патогенными микроорганизмами, являются: фолликулиты, фурункул, карбункул, рожистое воспаление, флегмона, лимфангиит/лимфаденит, гнойное воспаление подушечки пальцев, подкожный абсцесс, гидраценит, шаровидные угри, инфекционная атерома, внутрианальный абсцесс, мастит, поверхностные вторичные инфекции после травмы, ожоговая или хирургическая травма, фаринголарингит, острый бронхит, тонзиллит, хронический бронхит, бронхоэктаз, диффузный панбронхиолит, вторичные инфекции после хронических респираторных заболеваний, пневмония, гидронефрит, киста, простатит, эпидидимит, гонококковый уретрит, негонококковый уретрит, холецистит, холангит, бактериальная дизентерия, энтерит, аднексит, внутриматочная инфекция, бартолинит, блефарит, ячмень, дакриоцистит, тарзаденит, изъязвление роговицы, воспаление среднего уха, синусит, парадентит, эндокардит, заражение крови, менингит и кожные инфекции. Примеры подверженных воздействию микроорганизмов, вызывающих болезни инфекционные животных, включая заболевания домашней птицы, включают такие микроорганизмы, как Escherichia coli, Salmonella Sp., Pasteurella Sp., Kaemophilus Sp., Bordetella Sp., Staphylococcus Sp., и Mycoplasma Sp. Конкретные примеры ветеринарных заболеваний, вызванных этими микроорганизмами, включают коли-бактериоз, заболевание цыплят, птичий паратиф, холеру домашней птицы, инфекционный ринит, стафилококковые инфекции, микоплазменные инфекции; болезни крупного рогатого скота, такие как коли-бактериоз, сальмонеллез, заражение крови, микоплазменные болезни, инфекционная плевропневмония коров и мастит коров; инфекционные болезни свиней, такие как коли-бактериоз, сальмонеллез, геморрагическая септицемия, гемофильная инфекция, атрофический ринит, экссудативный эпидермит и микоплазменные болезни; инфекционные болезни собак, такие как заражение бактериями, относящимися к кишечной группе, сальмонеллез, геморрагическая септицемия, пиометра и цистит; инфекционные болезни кошек, такие как геморрагический плеврит, цистит, хронический ринит, гемофильная инфекция, диарея котят, и микоплазменные болезни. Соединение согласно настоящему изобретению может быть приготовлено в виде противомикробных препаратов в подходящей дозной форме в соответствии с путем введения, выбранным при традиционных методах приготовления лекарственных препаратов. Дозная форма для перорального введения включает таблетки, порошки, гранулы, капсулы, растворы, сиропы, эликсиры и масляные или водные суспензии. Инъекции могут содержать в дополнение к активному ингредиенту стабилизаторы, антисептики и повышающие растворимость агенты. Раствор, который может содержать такие наполнители, помещают в контейнер и далее раствор может быть подвергнут лиофилизации или подобному воздействию для получения твердых препаратов, которые могут быть растворены перед использованием. Контейнер может содержать либо разовую дозу, или несколько доз. Дозированная форма для наружного употребления включает растворы, суспензии, эмульсии, мази, гели, кремы, лосьоны и аэрозоли. При приготовлении твердых препаратов активный ингредиент может быть смешан с подходяще выбранными фармацевтически приемлемыми носителями, такими как наполнители, добавками, связующими, диспергирующими средствами, ускорителями растворения, смачивающими агентами и смазками.Жидкие препараты включают растворы, суспензии и эмульсии. Они могут содержать наполнители, такие как стабилизаторы суспензии и эмульгаторы. Соединение согласно изобретению может быть введено животным через рот либо как таковое или в смеси с кормом, или его раствор может быть введен непосредственно или смешан с питьевой водой или кормом. Соединение может быть введено также и не перорально, а, например, инъекцией. Соединение согласно изобретению может быть приготовлено в качестве препаратов для животных, таких как порошки, мелкие гранулы, растворяющиеся порошки, сиропы, растворы и инъекции в соответствии с обычными методами приготовления лекарственных форм. Ссылочные примеры описывают синтез оптически активных скелетов из оптически активной цис-2-фторциклопропанкарбоновой кислоты. Противомикробную активность оптически активных соединений, полученных в примерах, оценивали стандартным методом, установленным Nippon Karakevigoho Gakkai и результаты выражены в единицах минимальной ингибирующей концентрации (МИК, микрограмм/мл) и представлены в таблицах 1 и 2 ниже. Используемыми сравнительными соединениями являются: Европатент № 0268053: ципрофлаксацин (CPFX) и метилципрофлоксацин (Me–CPFX). (В данной схеме хотя и описан этилципрофлоксацин, Me–CPFX используют вместо него), Европатент № 0153163: соединение примера 44 (№ 44) и соединение примера 46 (№ 46), Европатент № 0132845: соединение примера 1 данной ссылки. Из прилагаемых сравнительных данных можно видеть, что: (1) CPFX и Me–CPFX Европатента № 0268053 являются более лучшими в отношении противобактериальной активности против грамположительных бактерий. (2) Соединение примера 44 и соединение примера 46 Европатента № 0153163 являются более лучшими в отношении противобактериальной активности против Ser или Ps, и (3) Соединение (пример 1) Европатента № 0132845 является более лучшим в отношении противобактериальной активности против грамположительной бактерии. С другой стороны, соединения в соответствии с настоящим изобретением, в частности, соединения 13а, 13b, 18a, 18b, 26bb и 56b, проявляют высокую противобактериальную активность. Таблица 1 Антимикробная активность (МИК, мг/мл) Бактерия/Соединение 9а 13a 13b 18a 18b 26bb 26aa
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivative of n-(1,2-cis-2-fluorocyclopropyl)-substituted pyridone carbonic acid
Автори англійськоюIsao Khayakava, Eiti Kimura
Назва патенту російськоюПроизводное n-(1,2-цис-2-фторциклопропил)пиридонкарбоновой кислоты
Автори російськоюИсао Хаякава, Йоити Кимура
МПК / Мітки
МПК: C07D 401/04, A61K 31/495, A61K 31/435, C07D 215/56, A61K 31/47, C07D 471/04, A61P 31/04
Мітки: n-(1,2-цис-2-фторциклопропіл)піридонкарбонової, похідне, кислоти
Код посилання
<a href="https://ua.patents.su/33-29378-pokhidne-n-12-cis-2-ftorciklopropilpiridonkarbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Похідне n-(1,2-цис-2-фторциклопропіл)піридонкарбонової кислоти</a>