Застосування c-met-модуляторів в комбінації з темозоломідом та/або променевою терапією для лікування раку
Номер патенту: 108618
Опубліковано: 25.05.2015
Автори: Афтаб Дана Т., Холланд Джеймс, Вейцман Аарон, МЮЛЛЕР Томас
Формула / Реферат
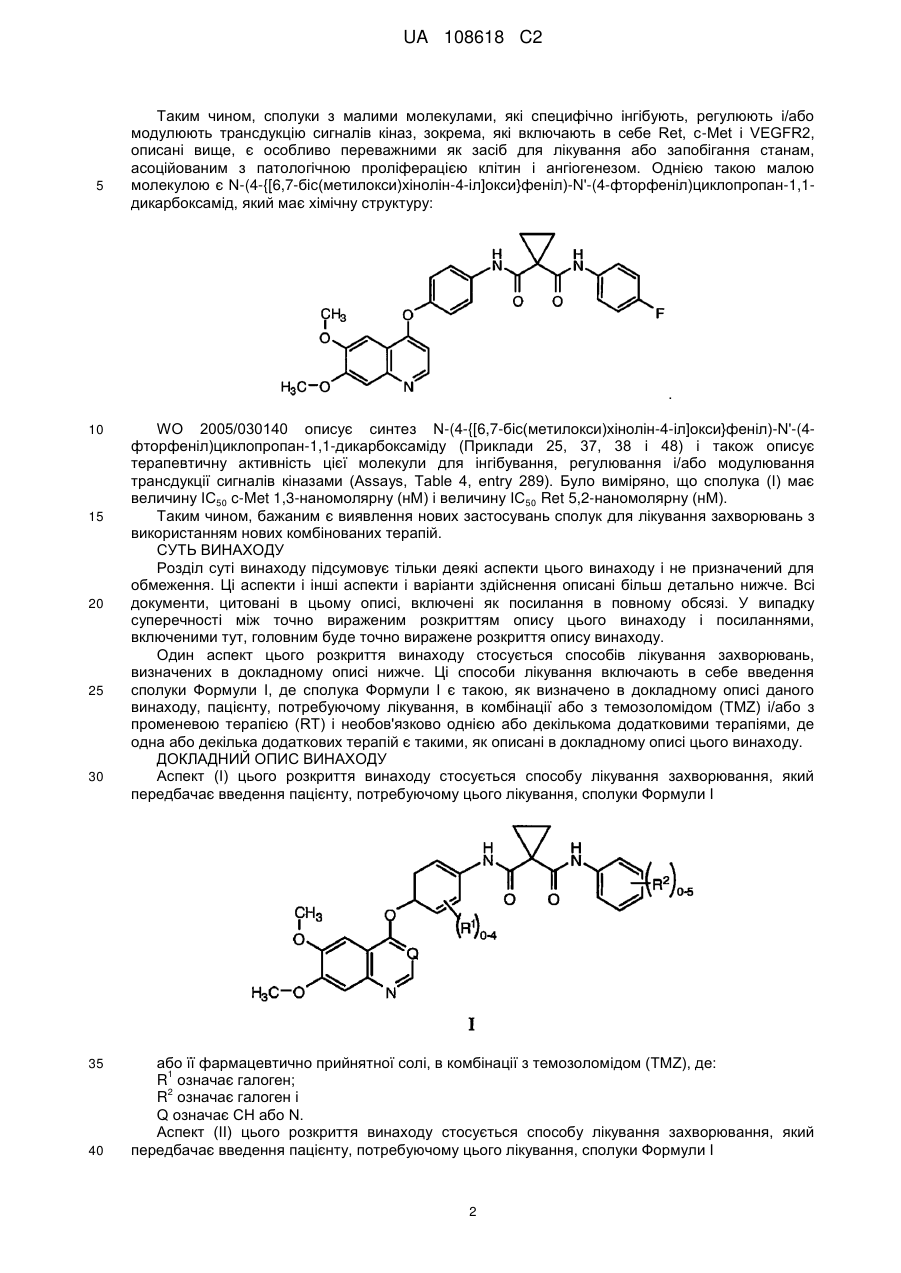
1. Застосування сполуки, яка має структуру:
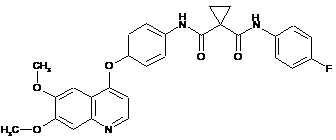 ,
,
або її фармацевтично прийнятної солі, в комбінації з променевою терапією (RT) або з комбінацією темозоломіду (TMZ) з променевою терапією (RT) для лікування раку, який вибраний з астроцитоми, гліобластоми, гігантоклітинної гліобластоми, гліосаркоми і гліобластоми з олігодендрогліальними компонентами, де застосування включає (1) одночасну фазу, (2) фазу спокою і (3) фазу підтримання, де:
одночасна фаза передбачає введення пацієнту:
сполуки або
сполуки і темозоломіду, або
сполуки і променевої терапії, або
сполуки, темозоломіду і променевої терапії, де
сполука вводиться в дозах 40-60 мг один раз на день;
RT вводиться пацієнту під час одночасної фази з використанням як функціонального локального випромінювання 1,8-2 Gy на фракцію один раз на день протягом 5 днів на тиждень протягом 6-7 тижнів з отриманням загальної дози до 60 Gy;
фаза спокою передбачає відсутність введення сполуки, темозоломіду або опромінення пацієнту, і
фаза підтримання передбачає введення пацієнту:
сполуки; або
сполуки і темозоломіду, де
сполуку вводять пацієнту в дозах 40-60 мг на день.
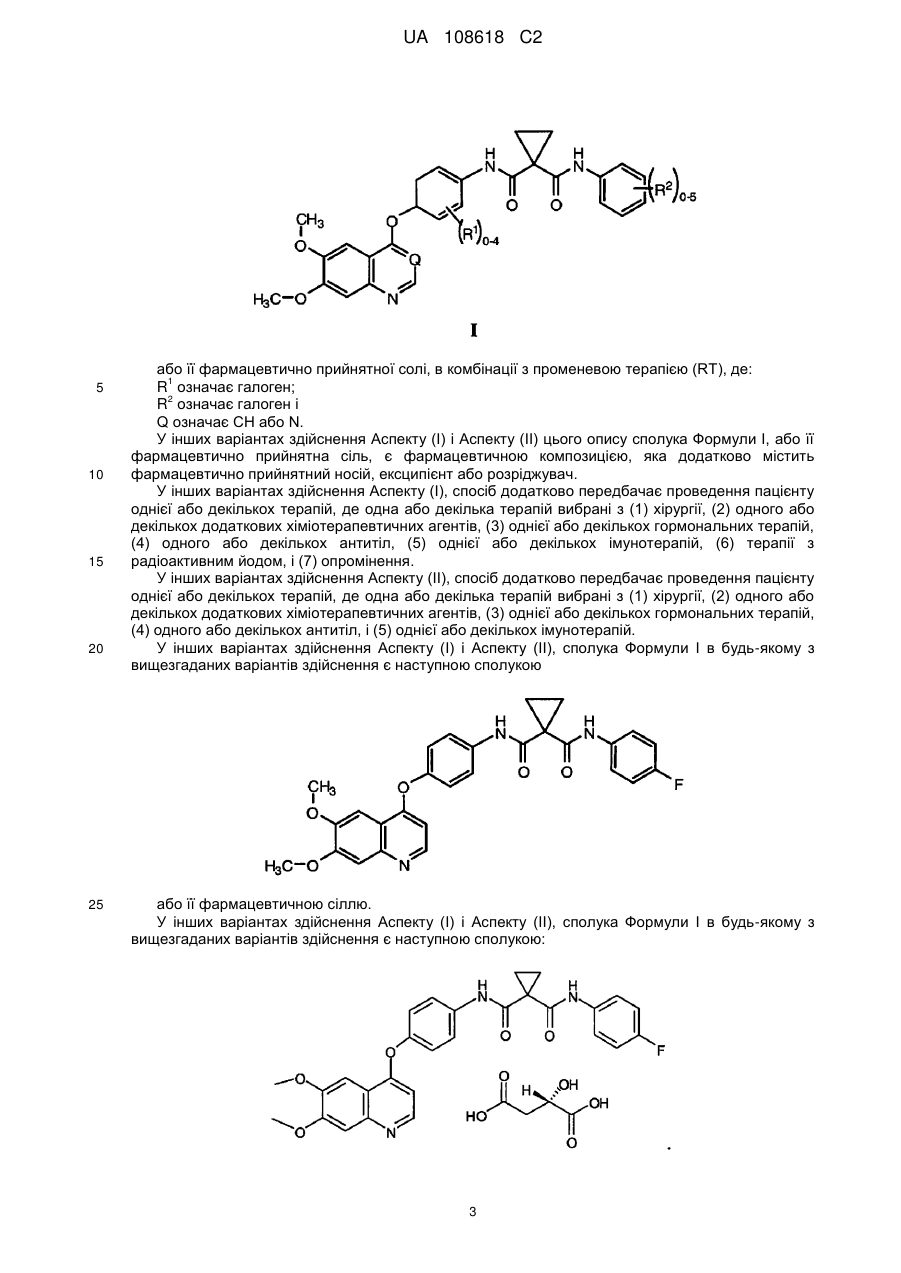
2. Застосування за п. 1, де сполука представлена наступною структурою:
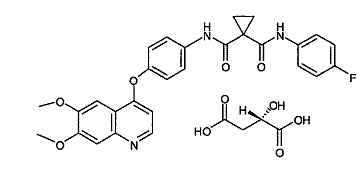 .
.
3. Застосування за п. 1, де сполука або її фармацевтично прийнятна сіль додатково містить фармацевтично прийнятний носій, ексципієнт або розріджувач.
4. Застосування за п. 1, де одночасна фаза складає 6-7 тижнів за тривалістю, а фаза спокою складає приблизно 4 тижні за тривалістю, і фаза підтримання має тривалість, достатню для уповільнення росту раку.
5. Застосування за п. 1, де TMZ вводять пацієнту в дозах 5-180 мг один раз на день під час одночасної фази; RT проводять пацієнту під час одночасної фази з використанням 1,8-2 Gy на фракцію один раз на день протягом 5 днів на тиждень для загальної дози до 60 Gy; сполуку Формули І вводять пацієнту в дозах 25-125 мг один раз на день під час фази підтримання, і TMZ вводять пацієнту в дозах 5-180 мг протягом 5 послідовних днів і повторюють кожні 28 днів, доки ріст раку не сповільниться.
Текст
Реферат: Застосування сполуки, яка має структуру: H N CH3 O H N O O F O H3C O N , або її фармацевтично прийнятної солі, в комбінації з променевою терапією (RT), або з комбінацією темозоломіду (TMZ) з променевою терапією (RT) для лікування раку. UA 108618 C2 (12) UA 108618 C2 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої належить винахід Цей винахід стосується способів застосування c-Met-модуляторів і, конкретно, c-Metмодуляторів в комбінації з іншими протираковими агентами і/або опроміненням, які можуть бути застосовні для модуляції різної клітинної активності і для лікування різних захворювань, представлених в цьому описі. Рівень техніки Традиційно, суттєві поліпшення в лікуванні раку асоціюються з ідентифікацією терапевтичних агентів, діючих за допомогою нових механізмів. Одним механізмом, який може бути використаний в лікуванні раку, є модулювання активності протеїнкінази, оскільки трансдукція сигналу через активацію протеїнкінази є відповідальною за багато які характеристики пухлинних клітин. Трансдукція сигналу протеїнкіназою особливо доречна у випадку, наприклад, раку щитовидної залози, шлунка, голови і ший, легені, молочної залози, передміхурової залози і колоректального раку, а також в рості і проліферації пухлинних клітин головного мозку. Протеїнкінази можуть бути класифіковані як протеїнкінази рецепторного типу або нерецепторного типу. Тирозинкінази рецепторного типу включають в себе велике число трансмембранних рецепторів з різною біологічною активністю. Стосовно докладного обговорення тирозинкіназ і їх лігандів див. Plowman et al., DN&Р 7(6): 334-339, 1994. Оскільки протеїнкінази і їх ліганди відіграють критичну роль в різній клітинній активності, порушення регуляції ферментативної активності протеїнкінази може приводити до зміненої клітинної активності, такої як неконтрольований ріст клітин, асоційований з раком. Крім онкологічних показань, змінена передача сигналу кіназою бере участь в численних інших патологічних захворюваннях, наприклад імунологічних порушеннях, серцево-судинних захворюваннях, запальних захворюваннях і дегенеративних захворюваннях. Таким чином, протеїнкінази є привабливими мішенями для виявлення лікарських засобів з малими молекулами. Особливо привабливі мішені для модуляції малих молекул відносно антиангіогенної і антипроліферативної активності включають в себе тирозинкінази рецепторного типу Ret, c-Met і VEGFR2. Кіназа c-Met є членом-прототипом підродини гетеродимерних рецепторних тирозинкіназ (RTK), які включають в себе Met, Ron і Sea. Ендогенним лігандом для c-Met є фактор росту гепатоцитів (HGF), сильнодіючий індуктор ангіогенезу. Зв'язування HGF з c-Met індукує активацію цього рецептора за допомогою автофосфорилування, приводячи до збільшення рецепторзалежної передачі сигналу, що стимулює ріст і інвазію клітин. Було показано, що антиHGF-антитіла або антагоністи HGF інгібують метастазування пухлин in vivo (див. Maulik et al. Cytokine & Growth Factor Reviews 2002, 13, 41-59). Надекспресія c-Met, VEGFR2 і/або Ret була продемонстрована на великій різноманітності типів пухлин, що включають в себе рак молочної залози, ободової кишки, рак нирки, легені, плоскоклітинний мієлоїдний лейкоз, гемангіоми, меланоми, астроцитоми і гліобластоми. Білок Ret є трансмембранним рецептором з тирозинкіназною активністю. Ret є мутованим в більшості сімейних форм медулярного раку щитовидної залози. Ці мутації активують кіназну функцію Ret і перетворюють його в онкогенний продукт. Інгібування трансдукції сигналів EGF, VEGF і ефрину буде запобігати проліферації і ангіогенезу клітин, двом ключовим клітинним процесам, необхідним для росту і виживання пухлини (Matter А. Drug Disc. Technol. 2001, 6, 1005-1024). Кіназа KDR (як називають рецепторну тирозинкіназу з кіназним доменом-інсертом) і flt-4 (fms-подібна тирозинкіназа-4), обидві, є рецепторами ендотеліального фактора росту судин (VEGF). Інгібування передачі сигналів EGF, VEGF і ефрину буде запобігати проліферації і ангіогенезу клітин, двом ключовим клітинним процесам, необхідним для росту і виживання пухлини (Matter А. Drug Disc. Technol. 2001, 6, 1005-1024). Рецептори EGF і VEGF є бажаними мішенями для інгібування малих молекул. Гліобластома є найбільш агресивною формою первинної пухлини головного мозку, з зустрічальністю 2,3 на 100000 суб'єктів на рік в Сполучених Штатах. Медіанний час виживання після встановлення діагнозу дорівнює 12-15 місяцям з існуючим стандартом догляду, що включає в себе хірургію з подальшою променевою терапією. Повідомлялося, що ураження шляху MET потенціює реакцію GBM на гамма-опромінення (Lal et al., 2005). Повідомлялося також, що експресія MET корелює з GBM-пухлинами високої стадії (Hirose et al., 1998) і експресія HGF і MET корелює зі злоякісністю (Koochekpour et al., 1995; Abounader et al., 2001, Uchinokura et al., 2006). Повідомлялося також, що гліома, вироблена фактором стовбурових клітин, індукує ангіогенез в головному мозку. SCF і VEGF можуть грати доповнюючі ролі в сильній ангіогенній реакції в GBM (Sun et al., 2006). 1 UA 108618 C2 5 Таким чином, сполуки з малими молекулами, які специфічно інгібують, регулюють і/або модулюють трансдукцію сигналів кіназ, зокрема, які включають в себе Ret, c-Met і VEGFR2, описані вище, є особливо переважними як засіб для лікування або запобігання станам, асоційованим з патологічною проліферацією клітин і ангіогенезом. Однією такою малою молекулою є N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1дикарбоксамід, який має хімічну структуру: . 10 15 20 25 30 35 40 WO 2005/030140 описує синтез N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4фторфеніл)циклопропан-1,1-дикарбоксаміду (Приклади 25, 37, 38 і 48) і також описує терапевтичну активність цієї молекули для інгібування, регулювання і/або модулювання трансдукції сигналів кіназами (Assays, Table 4, entry 289). Було виміряно, що сполука (I) має величину IC50 c-Met 1,3-наномолярну (нМ) і величину IC50 Ret 5,2-наномолярну (нМ). Таким чином, бажаним є виявлення нових застосувань сполук для лікування захворювань з використанням нових комбінованих терапій. СУТЬ ВИНАХОДУ Розділ суті винаходу підсумовує тільки деякі аспекти цього винаходу і не призначений для обмеження. Ці аспекти і інші аспекти і варіанти здійснення описані більш детально нижче. Всі документи, цитовані в цьому описі, включені як посилання в повному обсязі. У випадку суперечності між точно вираженим розкриттям опису цього винаходу і посиланнями, включеними тут, головним буде точно виражене розкриття опису винаходу. Один аспект цього розкриття винаходу стосується способів лікування захворювань, визначених в докладному описі нижче. Ці способи лікування включають в себе введення сполуки Формули I, де сполука Формули I є такою, як визначено в докладному описі даного винаходу, пацієнту, потребуючому лікування, в комбінації або з темозоломідом (TMZ) і/або з променевою терапією (RT) і необов'язково однією або декількома додатковими терапіями, де одна або декілька додаткових терапій є такими, як описані в докладному описі цього винаходу. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Аспект (I) цього розкриття винаходу стосується способу лікування захворювання, який передбачає введення пацієнту, потребуючому цього лікування, сполуки Формули I або її фармацевтично прийнятної солі, в комбінації з темозоломідом (TMZ), де: 1 R означає галоген; 2 R означає галоген і Q означає CH або N. Аспект (II) цього розкриття винаходу стосується способу лікування захворювання, який передбачає введення пацієнту, потребуючому цього лікування, сполуки Формули I 2 UA 108618 C2 5 10 15 20 25 або її фармацевтично прийнятної солі, в комбінації з променевою терапією (RT), де: 1 R означає галоген; 2 R означає галоген і Q означає CH або N. У інших варіантах здійснення Аспекту (I) і Аспекту (II) цього опису сполука Формули I, або її фармацевтично прийнятна сіль, є фармацевтичною композицією, яка додатково містить фармацевтично прийнятний носій, ексципієнт або розріджувач. У інших варіантах здійснення Аспекту (I), спосіб додатково передбачає проведення пацієнту однієї або декількох терапій, де одна або декілька терапій вибрані з (1) хірургії, (2) одного або декількох додаткових хіміотерапевтичних агентів, (3) однієї або декількох гормональних терапій, (4) одного або декількох антитіл, (5) однієї або декількох імунотерапій, (6) терапії з радіоактивним йодом, і (7) опромінення. У інших варіантах здійснення Аспекту (II), спосіб додатково передбачає проведення пацієнту однієї або декількох терапій, де одна або декілька терапій вибрані з (1) хірургії, (2) одного або декількох додаткових хіміотерапевтичних агентів, (3) однієї або декількох гормональних терапій, (4) одного або декількох антитіл, і (5) однієї або декількох імунотерапій. У інших варіантах здійснення Аспекту (I) і Аспекту (II), сполука Формули I в будь-якому з вищезгаданих варіантів здійснення є наступною сполукою або її фармацевтичною сіллю. У інших варіантах здійснення Аспекту (I) і Аспекту (II), сполука Формули I в будь-якому з вищезгаданих варіантів здійснення є наступною сполукою: 3 UA 108618 C2 5 Сполука Формули (I) і всі з представлених в даному описі варіантів сполуки Формули (I) включають в себе як вказані сполуки, так і індивідуальні ізомери і суміші ізомерів. У кожному випадку, сполука Формули (I) включає в себе фармацевтично прийнятні солі, гідрати і/або сольвати вказаних сполук і будь-які індивідуальні ізомери або суміш їх ізомерів. Абревіатури і визначення Наступні абревіатури і терміни мають вказані значення у всьому тексті: Абревіатура Ac Br °С сCBZ д дд дт ДХМ DME ДМФ ДМСО dppf EI г Gy год. або година HPLC л М м мг МГMT МГц хв. мл мкл мкМ мМ ммоль моль MС N нМ ЯМР кв RT с т або тр ТФО ТГФ ТШХ 10 15 Значення ацетил бром градус Цельсія цикло карбобензокси = бензилоксикарбоніл дублет дублет дублетів дублет триплетів дихлорметан 1,2-диметоксіетан N, N-диметилформамід диметилсульфоксид 1,1'-біс(дифенілфосфіно)фероцен іонізація електронним ударом грам (грами) одиниця дози радіації Грей година (години) рідинна хроматографія високого тиску літр (літри) молярний або молярність (м) мультиплет міліграм (міліграми) 6 О -метилгуанінметилтрансфераза мегагерц (частота) хвилина (хвилини) мілілітр (мілілітри) мікролітр (мікролітри) мікромоль (мікромолі) або мікромолярний мілімолярний мілімоль (мілімолі) моль (молі) мас-спектральний аналіз нормальний або нормальність наномолярний ядерний магнітний резонанс (к) квартет променева терапія (с) синглет триплет трифтороцтова кислота тетрагідрофуран тонкошарова хроматографія Символ "-" означає простий (ординарний) зв'язок, "=" означає подвійний зв'язок. При зображенні або описі хімічних структур, якщо абсолютно точно не вказується інше, передбачається, що всі атоми вуглецю мають водневе заміщення для конформації валентності чотири. Наприклад, в структурі лівої сторони схеми, наведеній нижче, є дев'ять атомів водню. Ці дев'ять атомів водню зображені в правій структурі. Іноді конкретний атом в структурі описується текстовою формулою як такою, що має водень або атоми водню як заміщення (точно 4 UA 108618 C2 визначений водень), наприклад -СН2СН2-. Середньому кваліфікованому в даній галузі фахівцю зрозуміло, що вищезгадані описові способи є звичайними в галузях хімії для забезпечення стислості і простоти опису складних у іншому випадку комплексів. 5 Якщо група "R" зображена як "плаваюча" на кільцевій системі, як, наприклад, в формулі: 10 15 20 25 , то, якщо не вказане інше, замісник "R" може знаходитися на будь-якому атомі цієї кільцевої системи, при припущенні витіснення зображеного, передбачуваного або точно визначеного атома водню з одного з атомів кільця, поки утвориться стабільна структура. Якщо група "R" зображена як плаваюча на системі конденсованих кілець, як, наприклад, в формулах: або або , то, якщо не вказане інше, замісник "R" може знаходитися на будь-якому атомі цієї системи конденсованих кілець, при припущенні витіснення зображеного водню (наприклад, -NH- в формулі вище), передбачуваного водню (наприклад, як в формулі, наведеній вище, де ці атоми водню не показані, але зрозуміло, що вони присутні) або точно визначеного водню (наприклад, де в формулі вище "Z" означає =CH-) з одного з атомів кільця, поки утвориться стабільна структура. В зображеному прикладі, група "R" може знаходитися або на 5-членному, або на 6членному кільці цієї конденсованої системи кілець. В формулах, зображених вище, може бути більше ніж одна група R (Ry), де у означає ціле число 1 або більше. Коли у є, наприклад, 2, то ці дві групи "R" можуть знаходитися на будь-яких двох атомах системи кілець, знову при припущенні, що кожна витісняє зображений, передбачуваний або точно визначений водень на цьому кільці. Коли група "R" зображена як існуюча на системі кільця, що містить насичені атоми вуглецю, як, наприклад, в формулі: 30 , 35 40 де, в цьому прикладі, "y" може бути більшим ніж 1, при припущенні, що кожна витісняє зображений, передбачуваний або точно визначений водень на цьому кільці, то, якщо не вказане інше, де одержана структура є стабільною, дві групи "R" можуть знаходитися на одному і тому ж вуглеці. Простим прикладом є приклад, коли R є метильною групою, може існувати здвоєний диметил на вуглеці зображеного кільця ("кільцевий" вуглець). У іншому прикладі, дві групи R на одному і тому ж вуглеці, з включенням цього вуглецю, можуть утворювати кільце, зі створенням таким чином структури спіроциклічного кільця ("спіроциклільної групи") із зображеним кільцем, наприклад, у вигляді формули: . 5 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 "Галоген" або "гало" стосується фтору, хлору, брому або йоду. "Вихід" для кожної з описаних в даному описі реакцій виражається у вигляді процента теоретичного виходу. "Раком" називають клітинно-проліферативні стани захворювання, що включають в себе, але не обмежуються ними: серцеві: саркому (ангіосаркому, фібросаркому, рабдоміосаркому, ліпосаркому), міксому, рабдоміому, фіброму, ліпому і тератому; легеневі: бронхогенну карциному (плоскоклітинну карциному, карциному недиференційованих малих клітин, недиференційованих великих клітин, аденокарциному), альвеолярну (бронхіолярну) карциному, бронхіальну аденому, саркому, лімфому, хондроматозну ханлартому, мезотеліому; шлунковокишкові: стравоходу (плоскоклітинну карциному, аденокарциному, лейоміосаркому, лімфому), шлунка (карциному, лімфому, лейоміосаркому), підшлункової залози (проточну аденокарциному, інсуліному, глюкагоному, гастриному, карциноїдні пухлини, віпому), тонкої кишки (аденокарциному, лімфому, карциноїдні пухлини, саркому Капоші, лейоміому, гемангіому, ліпому, нефрофіброму, фіброму), товстої кишки (аденокарциному, трубчасту аденому, ворсинчасту аденому, гамартому, лейоміому); сечостатевих шляхів: нирки (аденокарциному, пухлину Вільмса [нефробластому], лімфому, лейкоз), сечового міхура і уретри (плоскоклітинну карциному, перехідноклітинний рак, аденокарциному), передміхурової залози (аденокарциному, саркому), яєчок (семіному, тератому, ембріональну карциному, тератокарциному, хоріокарциному, саркому, карциному інтерстиціальних клітин, фіброму, фіброаденому, аденоматозні пухлини, ліпому); печінки: гепатому (гепатоклітинну карциному), холангіокарциному, гепатобластому, ангіосаркому, гепатоклітинну аденому, гемангіому; кісткової тканини: остеогенну саркому (остеосаркому), фібросаркому, злоякісну фіброзну гістіоцитому, хондросаркому, саркому Юїнга, злоякісну лімфому (ретикулоклітинну саркому), множинну мієлому, злоякісну гігантоклітинну пухлинну хордому, остеохондрому (кістковохрящові екзостози), злоякісну хондрому, хондробластому, хондроміксофіброму, остеоїдну остеому і гігантоклітинні пухлини; нервової системи: черепа (остеому, гемангіому, гранульому, ксантому, деформуючий остоз (хвороба Педжета)), мозкових оболонок (менінгіому, менінгіосаркому, гліоматоз), головного мозку (астроцитому, медулобластому, гліому, епендимому, герміному [пінеалому], гліобластому мультиформну, олігодендрогліому, шваному, ретинобластому, врироджені пухлини), нейрофіброму спинного мозку, менінгіому, гліому, саркому); гінекологічні: матки (ендометріальну карциному), шийки матки (рак шийки матки, передпухлинну дисплазію шийки матки), яєчників (рак яєчника [серозну цистаденокарциному, муцинозну цистаденокарциному, некласифіковану карциному], пухлини гранульозооболонкових клітин, пухлини клітин Сертолі-Лейдіга, дисгерміному, злоякісну тератому), вульви (плоскоклітинний рак, інтраепітеліальний рак, аденокарциному, фібросаркому, меланому, піхви (прозороклітинну карциному, плоскоклітинний рак, ботріоїдну саркому (ембріональну рабдоміосаркому), фаллопієвих труб (карциному); гематологічні: крові (мієлоїдний лейкоз [гострий і хронічний], гострий лімфобластний лейкоз, хронічний лімфоцитарний лейкоз, мієлопроліферативні захворювання, множинну мієлому, мієлодиспластичний синдром), хворобу Ходжкіна, неходжкінську лімфому [злоякісну лімфому]; шкіри: злоякісну меланому, базальноклітинну карциному, плоскоклітинну карциному, саркому Капоші, диспластичні родимі плями, ліпому, ангіому, дерматофіброму, келоїди, псоріаз; надниркових залоз: нейробластому; і рак молочної залози. Таким чином, термін "ракова клітина", описаний тут, включає в себе клітину, уражену будь-яким з ідентифікованих вище станів. "Терапія гормонами" або "гормональна терапія" включає в себе, наприклад, лікування одним або декількома з наступних лікарських засобів: стероїди (наприклад, дексаметазон), фінастерид, тамоксифен і інгібітор ароматази. "Пацієнт" для цілей даного винаходу включає в себе людей і інших тварин, зокрема ссавців, і інші організми. Таким чином, ці способи застосовні як до терапії людини, так і до ветеринарних застосувань. У іншому варіанті здійснення цим пацієнтом є ссавець і в іншому варіанті здійснення цим пацієнтом є людина. "Фармацевтично прийнятна сіль" сполуки означає сіль, яка є фармацевтично прийнятною сіллю і яка має бажану фармакологічну активність вихідної сполуки. Зрозуміло, що ці фармацевтично прийнятні солі є нетоксичними. Додаткова інформація про придані th фармацевтично прийнятні солі може бути знайдена в Remington's Pharmaceutical Sciences, 17 ed., Mack Publishing Company, Easton, PA, 1985, який включений в даний опис за допомогою посилання, або в керівництві Berge S.M. et al. "Pharmaceutical Salts", J. Pharm. Sci, 1977; 66:1-19, яке включене в даний опис за допомогою посилання. 6 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади фармацевтично прийнятних кислотно-адитивний солей включають в себе солі, утворені неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, азотна кислота, фосфорна кислота і т. п.; а також органічними кислотами, такими як оцтова кислота, трифтороцтова кислота, пропіонова кислота, гексанова кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, щавлева кислота, малеїнова кислота, малонова кислота, янтарна кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, 3-(4гідроксибензоїл)бензойна кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, 4-хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, 4-толуолсульфонова кислота, камфорсульфонова кислота, глюкогептонова кислота, 4,4'метиленбіс-(3-гідроксі-2-єн-1-карбонова кислота), 3-фенілпропіонова кислота, триметилоцтова кислота, трет-бутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота, п-толуолсульфонова кислота, саліцилова кислота і т. п. Приклади фармацевтично прийнятних основно-адитивних солей включають в себе солі, утворені, коли кислотний протон у вихідній сполуці замінений іоном металу, таким як натрій, калій, літій, солі амонію, кальцію, магнію, заліза, цинку, міді, марганцю, алюмінію і т. п. Конкретними солями є солі амонію, калію, натрію, кальцію і магнію. Солі, одержані з фармацевтично прийнятних органічних нетоксичних основ, включають в себе, але не обмежуються ними, солі первинного, вторинного і третинного амінів, заміщених амінів, які включають в себе аміни, що зустрічаються в природі, циклічні аміни і катіонообмінні смоли. Приклади органічних основ включають в себе ізопропіламін, триметиламін, діетиламін, триетиламін, трипропіламін, етаноламін, 2-диметиламіноетанол, 2-діетиламіноетанол, дициклогексиламін, лізин, аргінін, гістидин, кофеїн, прокаїн, гідрабамін, холін, бетаїн, етилендіамін, глюкозамін, метилглюкамін, теобромін, пурини, піперазин, піперидин, Nетилпіперидин, трометамін, N-метилглюкамін, поліамінні смоли і т. п. Прикладами органічних основ є ізопропіламін, діетиламін, етаноламін, триметиламін, дициклогексиламін, холін і кофеїн. "Платина (платини)" і "агент (агенти), що містить платину" включають в себе цисплатин, карбоплатин і оксаліплатин. "Проліки" стосується сполук, які перетворюються (звичайно швидко) in vivo з утворенням вихідної сполуки вищеописаних формул, наприклад гідролізом в крові. Звичайні приклади включають в себе, але не обмежуються ними, складноефірні і амідні форми сполуки, яка має активну форму, що несе групу карбонової кислоти. Приклади фармацевтично прийнятних складних ефірів сполук даного винаходу включають в себе, але не обмежуються ними, алкілові ефіри (наприклад, з приблизно одним - приблизно шістьма атомами вуглецю), де алкільна група є прямим або розгалуженим ланцюгом. Прийнятні складні ефіри включає в себе також циклоалкілові і арилалкілові складні ефіри, такі як, але не обмежуються цим, бензил. Приклади фармацевтично прийнятних амідів даного винаходу включають, але ними не обмежуються, первинні аміди і вторинні і третинні алкіламіди (наприклад, з приблизно одним - приблизно шістьма атомами вуглецю). Аміди і складні ефіри сполук цього винаходу можуть бути одержані відповідно до загальноприйнятих способів. Докладне обговорення проліків забезпечене в Higuchi T. and Stella V. "Pro-drugs as Novel Delivery Systems", Vol. 14 °F the A.C.S. Symposium Series, і в Bioreversible Carriers in Drug Design, ed. Edward В. Roche, American Pharmaceutical Association and Pergamon Press, 1987, які включені в даний опис за допомогою посилання для всіх цілей. "Таксан (таксани)" включає в себе, наприклад, одну або більше з наступних речовин: ® ® Паклітаксел (Таксол ) і Доцетаксел (Taksotere ). "Терапевтично ефективною кількістю" є кількість сполуки цього винаходу, яка при введенні пацієнту ослабляє симптом цього захворювання. Передбачається, що терапевтично ефективна кількість включає в себе кількість сполуки, однієї або в комбінації з іншими активними інгредієнтами, ефективними для модуляції Ret, c-Met і/або VEGFR2 або ефективними для лікування або запобігання раку. Кількість сполуки цього винаходу, яка складає "терапевтично ефективну кількість", буде варіюватися залежно від конкретної сполуки, патологічного стану і його тяжкості, віку підлягаючого лікуванню пацієнта і т. д. Терапевтично ефективна кількість може бути визначена рутинним чином фахівцем в даній галузі з урахуванням знань і відповідно до цього опису. "Інгібітор топоізомерази" включає в себе, наприклад, одну або декілька з наступних речовин: амсакрин, камптотецин, етопозид, фосфат етопозиду, екзатекан, іринотекан, луртотекан і теніпозид і топотекан. 7 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Лікування" або "терапія" захворювання, порушення або синдрому включає в себе в даному контексті (i) запобігання появі цього захворювання, порушення або синдрому у людини, тобто розвитку клінічних симптомів цього захворювання, порушення або синдрому у тварини, яка може бути підданою або схильною до цього захворювання, порушення або синдрому, але яка ще не має або не виявляє симптомів цього захворювання, порушення або синдрому; (ii) інгібування захворювання, порушення або синдрому, тобто затримання його розвитку; і (iii) ослаблення захворювання, порушення або синдрому, тобто викликання регресії цього захворювання, порушення або синдрому. Як відомо в даній галузі, можуть бути необхідні коректування відносно системної проти локалізованої доставки, віку, маси тіла, загального здоров'я, статі, раціону, часу введення, взаємодії лікарських засобів і тяжкості стану, і вони будуть визначатися рутинним експериментуванням фахівцем із звичайною кваліфікацією в даній галузі. Додаткові варіанти здійснення винаходу У іншому варіанті здійснення Аспекту (I) або Аспекту (II) даного опису, захворювання, що підлягає лікуванню, вибране з астроцитоми, гліобластоми, гігантоклітинної гліобластоми, гліосаркоми і гліобластоми з олігодендрогліальними компонентами. У іншому варіанті Аспекту (I) даного опису, спосіб додатково включає в себе проведення променевої терапії пацієнту. У іншому варіанті Аспекту (I) даного опису, захворювання вибране з астроцитоми, гліобластоми, гігантоклітинної гліобластоми, гліосаркоми і гліобластоми з олігодендрогліальними компонентами; і спосіб додатково включає в себе проведення променевої терапії пацієнту. У іншому варіанті Аспекту (I) або Аспекту (II) даного опису, захворювання вибране з астроцитоми, гліобластоми, гігантоклітинної гліобластоми, гліосаркоми і гліобластоми з олігодендрогліальними компонентами; і спосіб додатково включає процедуру, пов'язану з хірургічним втручанням, для пацієнта. У іншому варіанті Аспекту (I) даного опису, захворювання вибране з астроцитоми, гліобластоми, гігантоклітинної гліобластоми, гліосаркоми і гліобластоми з олігодендрогліальними компонентами; і спосіб додатково включає в себе проведення променевої терапії і хірургії цьому пацієнту. Необмежувальні приклади додаткового хіміотерапевтичного агента (додаткових хіміотерапевтичних агентів), який може бути використаний в будь-якому з вищезгаданих варіантів здійснення, включають в себе рапаміцин, аналог рапаміцину, алкілувальний агент (алкілувальні агенти), таксан (таксани) і платину (платини). Хіміотерапевтичний агент (агенти) вибраний з рапаміцину, темозоломіду, паклітакселу, доцетакселу, цисплатину, оксаліплатину, гефітинібу (Iressa®), ерлотинібу (Tarceva®), Zactima (ZD6474), HKI-272, пелітинібу, канертинібу і лапатинібу. Необмежувальним прикладом антитіла, яке може бути використане як одна або декількох додаткових терапій в Аспекті (I) або Аспекті (II) даного опису, є панітумумаб. У іншому варіанті Аспекту (I) або Аспекту (II) даного опису винаходу, однією або декількома додатковими терапіями є одна або декілька терапій гормонами. Необмежувальні приклади терапії гормоном (терапії гормонами), яка може бути використана в цьому варіанті здійснення, включають в себе тамоксифен, Тореміфен (Fareston), Фульвестрант (Faslodex), Мегестролу ацетат (Megace), видалення яєчника, Ралоксифен, аналог рилізинг-фактора лютеїнізуючого гормону (LHRH) (що включає в себе госерелін і лейпролід) і один або декілька інгібіторів ароматази; в іншому варіанті здійснення, один або декілька інгібіторів ароматази вибрані з летрозолу (Femara), анастрозолу (Arimidex) і екземестану (Aromasin). У іншому варіанті здійснення, одна або декілька терапій гормонами вибрані з тамоксифену і інгібітору ароматази. У іншому варіанті здійснення Аспекту (I) або Аспекту (II) даного опису винаходу, це захворювання є астроцитарною пухлиною, вибраною з астроцитоми, гліобластоми, гігантоклітинної гліобластоми, гліосаркоми і гліобластоми з олігодендрогліальними компонентами, і одна або декілька терапій вибрані з (1) хірургії, (2) опромінення, (3) одного або декількох додаткових хіміотерапевтичних агентів, (4) одного або декількох протисудомних агентів, і (5) одного або декількох агентів для зменшення опухання. Необмежувальні приклади променевої терапії, які можуть бути використані в цьому варіанті здійснення, включають в себе зовнішнє опромінення, внутрішньотканинне опромінення і стереотактичну радіохірургію. Необмежувальні приклади додаткових хіміотерапевтичних агентів, які можуть бути використані в цьому варіанті здійснення, включають в себе кармустин (BCNU), Ерлотиніб (Tarceva), бевацизумаб, гефітиніб (Iressa), рапаміцин, цисплатин, BCNU, ломустин, прокарбазин і вінкристин. Одним необмежувальним прикладом протисудомних агентів, які можуть бути 8 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 60 використані в цьому варіанті здійснення, є дифенілгідантоїн (Dilantin). Необмежувальним прикладом агента, який може бути використаний для зменшення опухання, є дексаметазон (Decadron). У іншому варіанті здійснення Аспекту (I) даного опису, однією або декількома додатковими терапіями є опромінення і хірургія. У іншому варіанті здійснення Аспекту (I) даного опису, однією або декількома додатковими терапіями є опромінення і один або декілька додаткових хіміотерапевтичних агентів. У іншому варіанті здійснення Аспекту (I) або Аспекту (II) даного опису однією або декількома додатковими терапіями є хірургічне втручання і один або декілька додаткових хіміотерапевтичних агентів. У іншому варіанті здійснення, терапія для пацієнтів з GB передбачає (1) "одночасну фазу", за якою іде (2) "фаза спокою", за якою іде (3) "фаза підтримання". За одночасною фазою іде (2) "фаза спокою", яка може знаходитися в діапазоні приблизно 2 тижнів - приблизно 8 тижнів по тривалості. Передбачається, що фаза спокою дозволяє відновитися від затриманої токсичності у випадку її присутності. У іншому варіанті здійснення, фаза спокою може знаходитися в діапазоні приблизно 3 тижнів - приблизно 6 тижнів по тривалості. У іншому варіанті здійснення, фаза спокою триває приблизно 4 тижні. За фазою спокою іде (3) "фаза підтримання", під час якої пацієнти одержують фармацевтично активні інгредієнти протягом приблизно дванадцяти 28-денних циклів, але ці цикли можуть варіюватися від приблизно шести до приблизно двадцяти чотирьох 28-денних циклів. У різних варіантах здійснення, пацієнти одержують різні кількості сполуки Формули I в різних часових точках відповідно до фази TMZ і променевої терапії. Одночасна фаза Під час одночасної (узгодженої) фази сполука Формули I, в одному варіанті здійснення, може вводитися пацієнту одночасно з RT і TMZ протягом 3-12 тижнів або 4-10 тижнів, або 6-7 тижнів. У іншому варіанті здійснення, для пацієнтів, що мають мутацію в промоторі МГMT, де мутований промотор МГMT є неметилованим промотором, сполука Формули I буде вводитися пацієнту одночасно з RT протягом 6-7 тижнів в одночасній фазі. Ця одночасна фаза буде знаходитися в діапазоні від приблизно 3 до приблизно 12 тижнів по тривалості. У іншому варіанті здійснення, ця одночасна фаза знаходиться в діапазоні від приблизно 4 тижнів до приблизно 10 тижнів по тривалості. У іншому варіанті здійснення, одночасна фаза знаходиться в діапазоні від приблизно 6 тижнів до приблизно 8 тижнів по тривалості. У іншому варіанті здійснення, одночасна фаза знаходиться в діапазоні від приблизно 6 тижнів до приблизно 7 тижнів по тривалості. Під час цієї одночасної фази, активні фармацевтичні інгредієнти надаються з RT. У іншому варіанті здійснення, активними фармацевтичними інгредієнтами в одночасній фазі є TMZ і сполука Формули I. У іншому варіанті здійснення, активним фармацевтичним інгредієнтом в одночасній фазі є TMZ, за умови, що сполука Формули I є щонайменше одним з активних фармацевтичних інгредієнтів в фазі підтримання. У іншому варіанті здійснення, активним фармацевтичним інгредієнтом в одночасній фазі є сполука Формули I. Фаза спокою Під час фази спокою, ні RT, ні сполуку Формули I, ні TMZ не вводять пацієнту. Фаза спокою може тривати від приблизно 2 тижнів до приблизно 12 тижнів. У іншому варіанті здійснення, фаза спокою може знаходитися в діапазоні від приблизно 3 тижнів до приблизно 6 тижнів по тривалості. У іншому варіанті здійснення, діапазон фази спокою становить приблизно 4 тижні по тривалості. Фаза підтримання У одному варіанті фази підтримання, сполуку Формули I вводять пацієнту. У іншому варіанті фази підтримання, пацієнту вводять як темозоломід, так і сполуку Формули I. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом періоду часу в діапазоні від приблизно 4 місяців до приблизно 10 місяців. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом приблизно 4 місяців. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом приблизно 5 місяців. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом приблизно 6 місяців. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом приблизно 7 місяців. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом приблизно 8 місяців. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом приблизно 9 місяців. У іншому варіанті фази підтримання, як темозоломід, так і сполуку Формули I вводять пацієнту протягом приблизно 10 9 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять пацієнту протягом періоду часу в діапазоні від приблизно 4 місяців до приблизно 10 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять протягом приблизно 4 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять протягом приблизно 5 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять протягом приблизно 6 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять протягом приблизно 7 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять протягом приблизно 8 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять протягом приблизно 9 місяців. У іншому варіанті фази підтримання, сполуку Формули I вводять протягом приблизно 10 місяців. Під час фази підтримання, сполука Формули I може вводитися один раз на день у вигляді єдиного перорального агента в дозах 10-200 мг (які можуть знаходитися в капсулах або таблетках). У іншому варіанті фази підтримання, сполука Формули I може вводитися один раз на день як єдиний пероральний агент в дозі 25-125 мг або дозі 25-100 мг (які можуть знаходитися в капсулі або таблетці). Під час фази підтримання, TMZ також може вводитися протягом 5 послідовних днів, і введення може повторюватися кожні 28 днів. TMZ, під час фази підтримання, може вводитися пацієнту у вигляді доз 5-300 мг (які можуть знаходитися в капсулах або таблетках). Для цілей даного опису винаходу, для всіх прикладів, які описані тут, які посилаються на сполуку Формули I або темозоломід в дозових кількостях в міліграмах (мг), це повинно розумітися як мг сполуки, що розглядається, і ця дозова кількість може вводитися в будь-якій формі, в тому числі в формі таблетки і капсули. Приклади форм капсули або таблетки, які знаходяться в дужках після дозових кількостей, є необмежувальними прикладами того, яким чином ці дози можуть вводитися, і передбачається, що ці приклади не є обмежувальними. Наприклад, в наведеному вище варіанті, TMZ може вводитися в інших способах, нарівні з капсулами або таблетками, які, як мається на увазі, є тільки необмежувальними прикладами того, яким чином може бути введена ця дозова кількість. У необмежувальних прикладах у всіх вищезгаданих варіантах (що включають в себе одночасну фазу і фазу підтримання), сполука Формули I може вводитися в дозах 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг, 140 мг, 145 мг, 150 мг, 155 мг, 160 мг, 165 мг, 170 мг, 175 мг, 180 мг, 185 мг, 190 мг, 195 мг і 200 мг (які можуть знаходитися в капсулах або таблетках). У необмежувальних прикладах у всіх вищезгаданих варіантах (що включають в себе одночасну фазу і фазу підтримання), TMZ може вводитися в дозах 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг, 140 мг, 145 мг, 150 мг, 155 мг, 160 мг, 165 мг, 170 мг, 175 мг, 180 мг, 185 мг, 190 мг, 195 мг, 200 мг, 205 мг, 210 мг, 215 мг, 220 мг, 225 мг, 230 мг, 235 мг, 240 мг, 245 мг, 250 мг, 255 мг, 260 мг, 265 мг, 260 мг, 275 мг, 280 мг, 285 мг, 290 мг, 295 мг і 300 мг (які можуть знаходитися в капсулах або таблетках). У іншому варіанті здійснення Аспекту (I) або Аспекту (II) даного опису, одночасна фаза передбачає проведення опромінення і введення сполуки Формули I пацієнту; фаза спокою передбачає відсутність введення сполуки Формули I або проведення опромінення пацієнту; і фаза підтримання передбачає введення сполуки Формули I пацієнту. У одному підваріанті цього варіанта, одночасна фаза може мати тривалість приблизно 7-8 тижнів, фаза спокою може мати тривалість приблизно 4 тижні і фаза підтримання має тривалість, достатню для уповільнення росту раку. У іншому підваріанті цього варіанта, сполуку Формули I вводять пацієнту в дозах 25100 мг або дозах 25-125 мг (які можуть знаходитися в капсулах або таблетках) один раз на день під час одночасної фази; TMZ вводять пацієнту в дозах 5-180 мг (які можуть знаходитися в капсулах або таблетках) один раз на день під час одночасної фази; RT вводять пацієнту під час одночасної фази з використанням 1,8-2 Gy (Грей) на фракцію, один раз на день протягом 5 днів на тиждень для одержання загальної дози до 60 Gy; сполуку Формули I вводять пацієнту в дозах 25-100 мг або дозах 25-125 мг (які можуть знаходитися в капсулах або таблетках) один раз на день під час фази підтримання; і TMZ вводять пацієнту в дозах 5-180 мг (які можуть знаходитися в капсулах або таблетках) протягом 5 послідовних днів і повторюють введення кожні 28 днів, поки ріст раку не зменшиться. У інших варіантах здійснення будь-якого з варіантів Аспекту (I) і Аспекту (II), сполукою Формули I є наступна сполука 10 UA 108618 C2 5 10 15 20 25 30 35 40 або її фармацевтична сіль. У іншому варіанті здійснення, сполукою Формули I є форма (L)-малатної солі N-(4-{[6,7біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)-циклопропан-1,1-дикарбоксаміду, що має наступну структуру: Загальне введення У одному аспекті, винахід забезпечує фармацевтичні композиції, які містять сполуку Формули I, описану вище, і фармацевтично прийнятний носій, ексципієнт або розріджувач. У деяких інших варіантах здійснення, способом введення є пероральне введення. Введення сполуки Формули I або її фармацевтично прийнятних солей, в чистому вигляді або у вигляді придатної фармацевтичної композиції, може проводитися за допомогою будь-якого із загальноприйнятих способів введення або агентів для обслуговування подібних застосувань. Так, введення може бути, наприклад, пероральним, назальним, парентеральним (внутрішньовенним, внутрішньом'язовим або підшкірним), місцевим, черезшкірним, внутрішньопіхвовим, внутрішньоміхуровим, інтрацистернальним або ректальним, у формі твердої, напівтвердої речовини, ліофілізованого порошку або рідких лікарських форм, таких як, наприклад, таблетки, супозиторії, пілюлі, м'які і тверді желатинові форми (які можуть бути в капсулах або таблетках), порошки, розчини, суспензії або аерозолі або т. п., особливо в одиничних дозованих формах, придатних для простого введення точних доз. Композиції будуть включати в себе загальноприйняті фармацевтичні носій або ексципієнт і сполуку Формули I як активний агент і, крім того, можуть включати в себе носії і ад'юванти, і т. п. Ад'юванти включають в себе консервувальні, зволожуючі, суспендувальні, підсолоджувальні, ароматизуючі, емульгуючи, диспергуючі агенти і віддушки. Запобігання дії мікроорганізмів може забезпечуватися різними антибактеріальними і протигрибковими агентами, наприклад парабенами, хлорбутанолом, фенолом, сорбіновою кислотою і т. п. Може бути також бажаним включення ізотонічних агентів, наприклад цукрів, хлориду натрію і т. п. Пролонгована абсорбція ін'єкційної фармацевтичної форми може бути одержана з використанням затримуючих абсорбцію агентів, наприклад моностеарату алюмінію і желатину. Якщо бажано, фармацевтична композиція сполуки Формули I може також містити мінорні кількості допоміжних речовин, таких як зволожуючі або емульгуючі агенти, рН забуферювальні агенти, антиоксиданти і т. п., такі як, наприклад, лимонна кислота, монолаурат сорбітану, олеат триетаноламіну, бутильований гідрокситолуол і т. д. Вибір готової форми залежить від різних факторів, таких як спосіб введення лікарського засобу (наприклад, для перорального введення, препарати в формі таблеток, пілюль або капсул) і біодоступність лікарського засобу. Нещодавно, були розроблені фармацевтичні композиції спеціально для лікарських засобів, які виявляють слабку біодоступність, на основі принципу, що біодоступність може бути збільшена збільшенням площі поверхні, тобто 11 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 60 зменшення розміру частинок. Наприклад, Патент США № 4107288 описує фармацевтичний препарат, що має частинки в діапазоні розмірів від 10 до 1000 нм, в яких цей активний матеріал підтримується на зшитому матриксі макромолекул. Патент США № 5145684 описує одержання фармацевтичного препарату, в якому лікарську речовину розпилюють на наночастинки (середній розмір частинок 400 нм) в присутності модифікатора поверхні і потім диспергують в рідкому середовищі з одержанням фармацевтичного препарату, який виявляє дивно високу біодоступність. Композиції, придатні для парентеральної ін'єкції, можуть містити фізіологічно прийнятні стерильні водні або неводні розчини, дисперсії, суспензії або емульсії і стерильні порошки для відтворення в стерильні ін'єкційні розчини або дисперсії. Приклади придатних водних або неводних носіїв, розріджувачів, розчинників або наповнювачів включають в себе воду, етанол, поліоли (пропіленгліколь, поліетиленгліколь, гліцерин і т. п.), їх придатні суміші, рослинні олії (такі як оливкова олія) і ін'єктовані органічні складні ефіри, такі як етилолеат. Належна текучість може підтримуватися, наприклад, застосуванням покриття, такого як лецитин, підтриманням необхідного розміру частинок у випадку дисперсій і застосуванням поверхнево-активних речовин. Одним конкретним способом введення є пероральний, що використовує зручну схему денних доз, яка може коректуватися згідно зі ступенем тяжкості підлягаючого лікуванню патологічного стану. Тверді лікарські форми для перорального введення включають в себе капсули, таблетки, пілюлі, порошки і гранули. У таких твердих лікарських формах, активна сполука змішана щонайменше з одним інертним загальноприйнятим ексципієнтом (або носієм), таким як цитрат натрію або дикальційфосфат, або (а) наповнювачами або розріджувачами, такими як, наприклад, крохмаль, лактоза, сахароза, глюкоза, маніт і кремнієва кислота, (b) зв'язуючими речовинами, такими як, наприклад, похідні целюлози, крохмаль, альгінати, желатин, полівінілпіролідон, сахароза і аравійська камедь, (с) зволожувачами, такими як, наприклад, гліцерин, (d) дезінтегруючими агентами, такими як, наприклад, агар-агар, карбонат кальцію, крохмаль картоплі або тапіоки, альгінова кислота, натрійкроскармелоза, комплексні силікати і карбонат натрію, (е) ретардантами розчинів, такими як, наприклад, парафін, (f) прискорювачами абсорбції, такими як, наприклад, сполуки четвертинного амонію, (g) зволожуючими агентами, такими як, наприклад, цетиловий спирт і моностеарат гліцерину, стеарат магнію і т. п., (h) адсорбентами, такими як, наприклад, каолін і бентоніт, і (i) мастильними речовинами, такими як, наприклад, тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію або їх суміші. У випадку капсул, таблеток і пілюль, лікарські форми можуть також містити буферні агенти. Тверді лікарські форми, описані вище, можуть бути приготовані з покриттями і оболонками, такими як ентеросолюбільні покриття, і іншими, добре відомими в даній галузі. Вони можуть містити заспокійливі агенти і можуть також бути такою композицією, що вони вивільняють активну сполуку або активні сполуки в певній частині кишкового тракту затриманим чином. Прикладами застосовуваних композицій, які можуть бути використані, є полімерні речовини і віск. Активні сполуки можуть знаходитися також в мікроінкапсульованій формі, якщо необхідно, з одним або декількома вищезгаданими ексципієнтами. Рідкі лікарські форми для перорального введення включають в себе фармацевтично прийнятні емульсії, розчини, суспензії, сиропи і еліксири. Такі лікарські форми готують, наприклад, розчиненням, диспергуванням і т. д. сполуки Формули I, або її фармацевтично прийнятної солі, і необов'язкових фармацевтичних ад'ювантів в носії, такому як, наприклад, вода, сольовий розчин, водна декстроза, гліцерин, етанол і т. п.; солюбілізуючих агентах і емульгаторах, таких як, наприклад, етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід; оліях, зокрема бавовняній олії, арахісовій олії, олії зародків кукурудзи, оливковій олії, касторовій олії і кунжутній олії, гліцерині, тетрагідрофурфуриловому спирті, поліетиленгліколях і ефірах жирної кислоти сорбітану; або сумішах цих речовин, і т. п., з утворенням таким чином розчину або суспензії. Суспензії, нарівні з активними сполуками, можуть містити суспендувальні агенти, такі як, наприклад, етоксиловані ізостеарилові спирти, поліоксіетиленсорбітол і складні ефіри сорбітану, мікрокристалічну целюлозу, метагідроксид алюмінію, бентоніт, агар-агар і трагакант або суміш цих речовин, і т. п. Композиціями для ректального введення є, наприклад, супозиторії, які можуть бути приготовані змішуванням сполуки Формули I, наприклад, з придатними неподразнюючими ексципієнтами або носіями, такими як какао-масло, поліетиленгліколь або віск для супозиторіїв, 12 UA 108618 C2 5 10 15 20 25 30 35 40 45 50 55 які є твердими при звичайній температурі, але рідкими при температурі тіла, і, отже, плавляться у придатній порожнині тіла і вивільняють активний компонент, що знаходиться в них. Лікарські форми для місцевого введення сполуки Формули I включають в себе мазі, порошки, спреї і інгаляційні засоби. Цей активний компонент змішують при стерильних умовах з фізіологічно прийнятним носієм і будь-якими консервантами, буферами або пропелентами, які можуть бути потрібні. Офтальмічні препарати, очні мазі, порошки і розчини розглядаються також як такі, що знаходяться в обсязі цього опису винаходу. Для диспергування сполуки Формули I в аерозольній формі можуть бути використані стиснені гази. Інертними газами, приданими для цієї мети, є азот, діоксид вуглецю і т. д. Звичайно, залежно від передбачуваного способу введення, фармацевтичні композиції будуть містити приблизно 1 мас. % - приблизно 99 мас. % сполуки (сполук) Формули I, або її фармацевтично прийнятної солі, і 99 мас. % - 1 мас. % придатного фармацевтичного ексципієнта. У одному прикладі, композиція буде містити приблизно 5 мас. % - приблизно 75 мас. % сполуки (сполук) Формули I, або її фармацевтично прийнятної солі, причому інша частина є придатними фармацевтичними ексципієнтами. Сучасні способи приготування таких лікарських форм відомі або будуть очевидними кваліфікованим в даній галузі фахівцям; наприклад, див. Remington's Pharmaceutical Sciences, th 18 Ed. (Mack Publishing Company, Easton, Pa., 1990). Композиція, що підлягає введенню, буде, в будь-якому випадку, містити терапевтично ефективну кількість сполуки Формули I, або її фармацевтично прийнятної солі, для лікування патологічного стану відповідно до принципів цього опису. Сполуки даного опису, або їх фармацевтично прийнятні солі або сольвати, вводять в терапевтично ефективній кількості, яка буде варіюватися залежно від різних факторів, що включають в себе активність конкретно використовуваної сполуки, метаболічну стабільність і тривалість дії цієї сполуки, вік, масу тіла, загальне здоров'я, стать, раціон, спосіб і час введення, швидкість екскреції, комбінацію лікарських засобів, тяжкість конкретних патологічних станів і хазяїна, що піддається терапії. Сполука Формули I може вводитися пацієнту при рівнях доз в діапазоні приблизно 0,1 - приблизно 1000 мг на день. Для здорової дорослої людини, що має масу тіла близько 70 кілограмів, зразковою дозою є доза в діапазоні приблизно 0,01 - приблизно 100 мг/кг маси тіла на день. Однак конкретна доза може варіюватися. Наприклад, доза може залежати від ряду факторів, що включають в себе вимоги пацієнта, тяжкість підлягаючого лікуванню стану і фармакологічну активність використовуваної сполуки. Визначення оптимальних доз для конкретного пацієнта добре відоме кваліфікованому фахівцю в даній галузі. При приготуванні у вигляді фіксованої дози, такі комбіновані продукти використовують сполуку Формули I в межах вищеописаного діапазону доз і інші фармацевтично активні агенти в межах схваленого для них діапазону доз. Сполуки Формули I можуть альтернативно використовуватися послідовно з відомим фармацевтично прийнятним агентом (відомими фармацевтично прийнятними агентами), коли комбінована форма є неприйнятною. Загальний синтез Сполуки цього винаходу можуть бути одержані синтетичними процедурами, описаними нижче. Ці процедури є тільки ілюстрацією деяких способів, за допомогою яких можуть бути синтезовані сполуки Формули I, і можуть бути зроблені різні модифікації цих процедур. Вихідні матеріали і проміжні продукти реакції можуть бути виділені і очищені, якщо бажано, з використанням загальноприйнятих способів, які включають в себе, але не обмежуються ними, фільтрування, дистиляцію, кристалізацію, хроматографію і т.п. Такі матеріали можуть бути охарактеризовані з використанням загальноприйнятих засобів, що включають в себе фізичні константи і спектральні дані. Цей опис додатково ілюструється наступними прикладами, які не повинні розглядатися як такі, що обмежують цей опис в ідеї або обсязі відносно специфічних процедур, описаних в них. ПРИКЛАДИ Приклад 1A Одержання N-(4-{[6,7-біс(метилокси)хінолін-4-іл]окси}феніл)-N'-(4-фторфеніл)циклопропан1,1-дикарбоксаміду і його (L)-малатної солі Синтетичний спосіб, що був використаний для одержання N-(4-{[6,7-біс(метилокси)хінолін-4іл]окси}феніл)-N'-(4-фторфеніл)циклопропан-1,1-дикарбоксаміду і його (L)-малатної солі, зображений на Схемі 1: СХЕМА 1 13 UA 108618 C2 (L)-яблучна кислота, Оксалілхлорид , Сполука (І) 5 10 15 20 25 30 Наведений вище процес описаний більш докладно нижче. Одержання 4-хлор-6,7-диметоксихіноліну Реактор завантажували послідовно 6,7-диметоксихінолін-4-олом (10,0 кг) і ацетонітрилом (64,0 л). Одержану суміш нагрівали до приблизно 65С і додавали оксихлорид фосфору (POCl3 50,0 кг). Після додавання POCl3 температуру цієї реакційної суміші підвищували до приблизно 80С. Реакцію вважали завершеною (приблизно 9,0 годин), коли залишалося
ДивитисяДодаткова інформація
Назва патенту англійськоюMethods of using c-met modulators
Автори англійськоюAftab, Dana T., Mueller, Thomas, Weitzman, Aaron, Holland, James
Автори російськоюАфтаб Дана Т., Мюллер Томас, Вейцман Аарон, Холланд Джеймс
МПК / Мітки
МПК: A61K 45/06, A61K 31/517, A61K 31/47, A61P 35/00
Мітки: лікування, комбінації, раку, темозоломідом, c-met-модуляторів, терапією, променевою, застосування
Код посилання
<a href="https://ua.patents.su/34-108618-zastosuvannya-c-met-modulyatoriv-v-kombinaci-z-temozolomidom-ta-abo-promenevoyu-terapiehyu-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Застосування c-met-модуляторів в комбінації з темозоломідом та/або променевою терапією для лікування раку</a>
Попередній патент: Спосіб одержання 1,4-діамінобутану
Наступний патент: Пестицидні композиції
Випадковий патент: Спосіб виробництва порошкоподібних фруктово-ягідних, овочевих і грибних напівфабрикатів і/або сухопродуктів