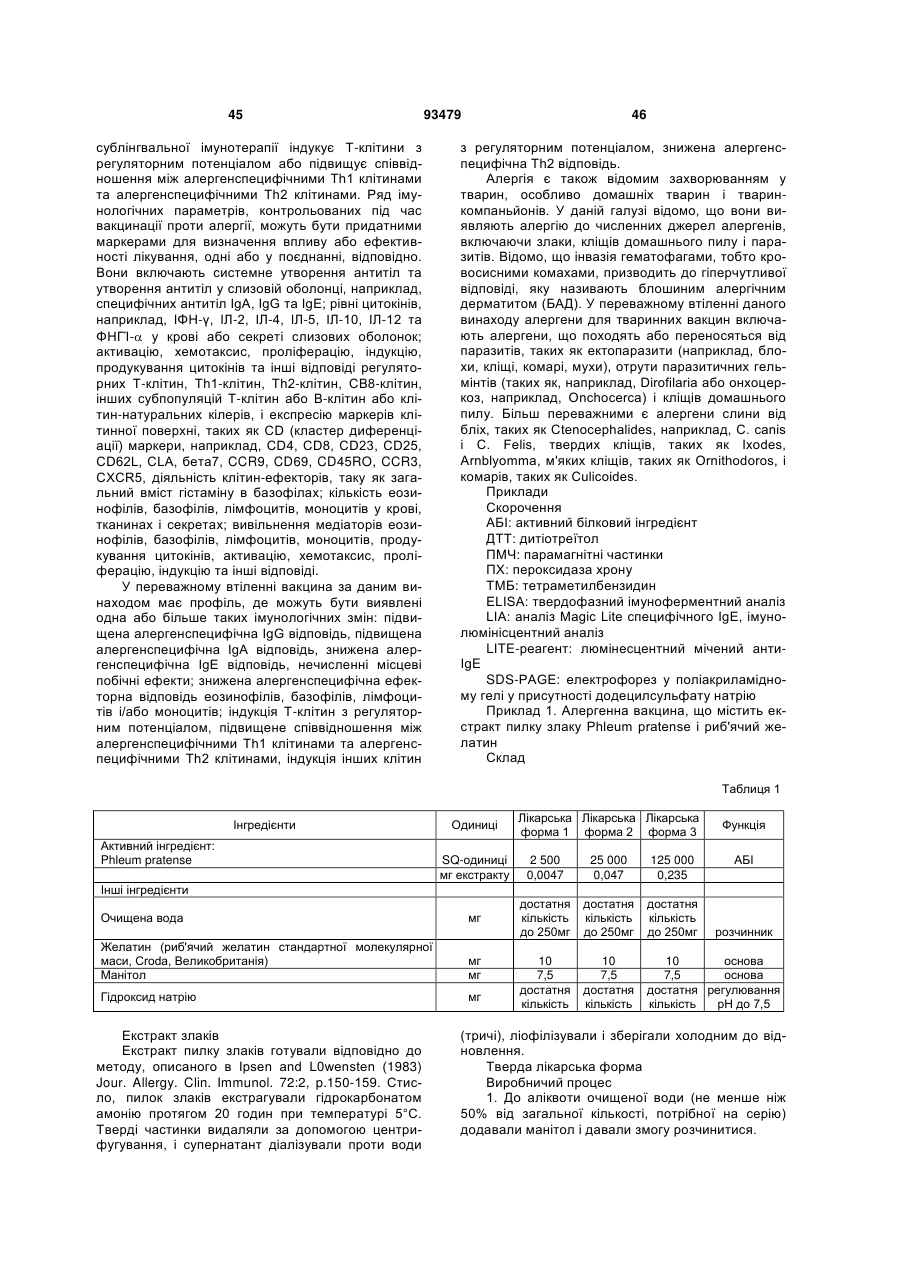
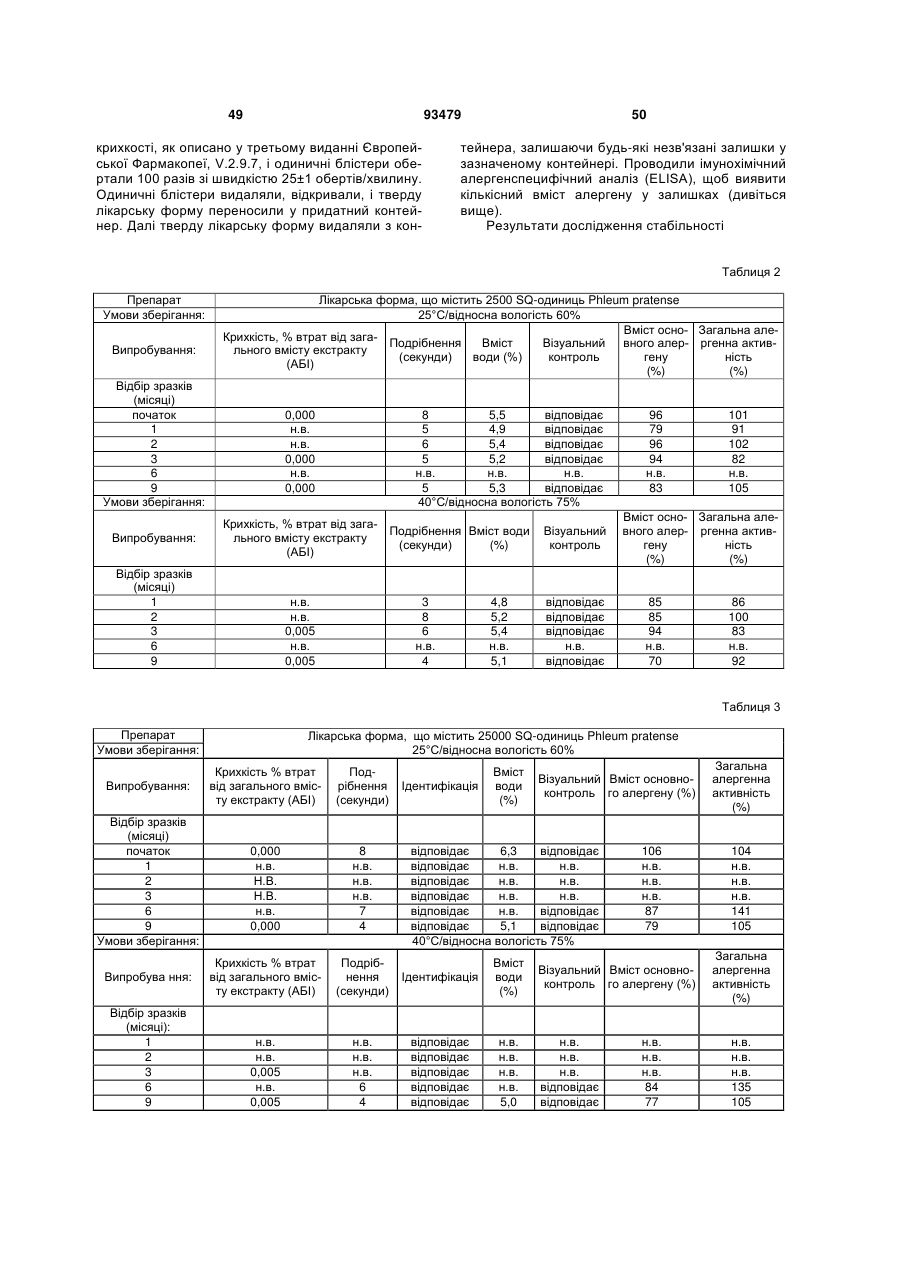
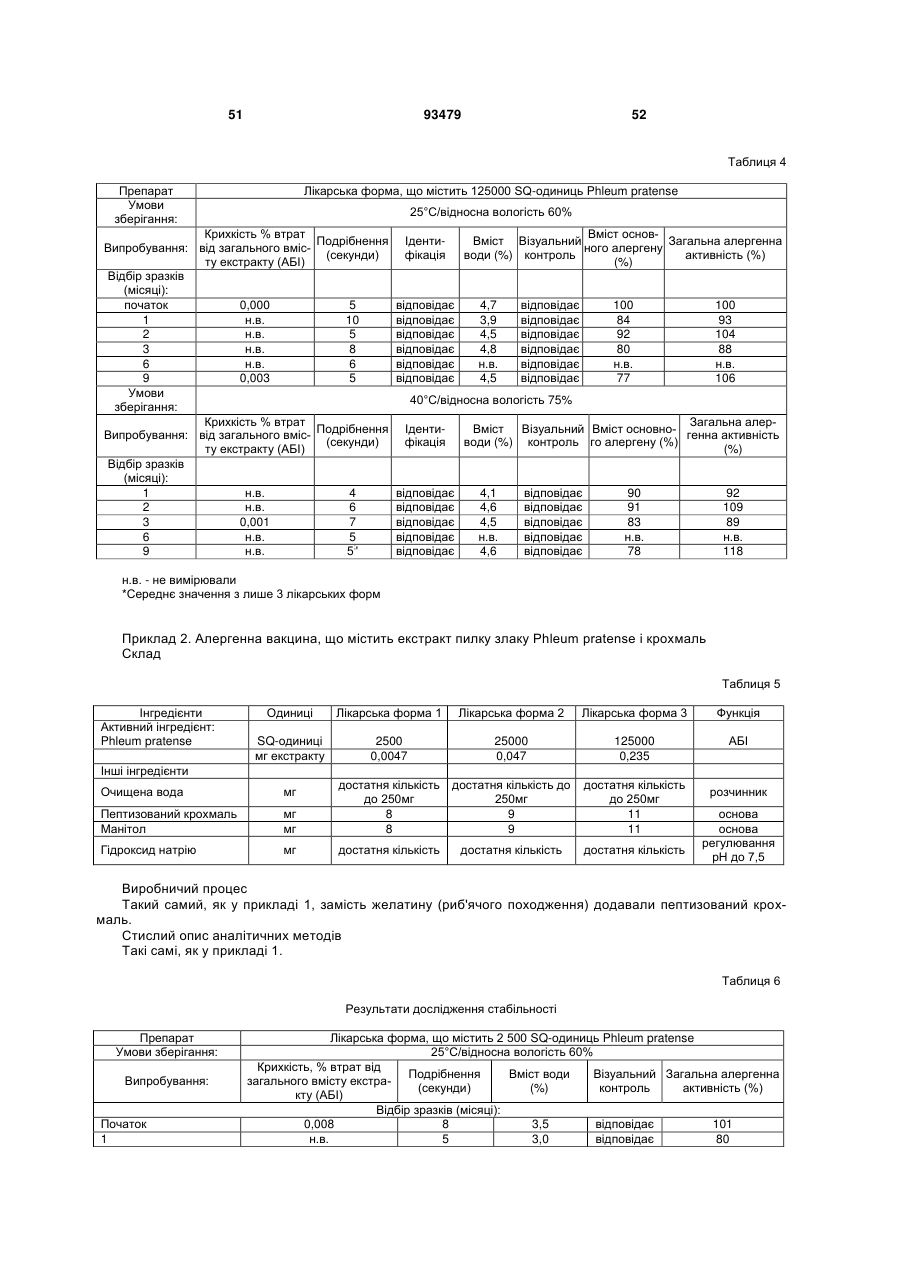
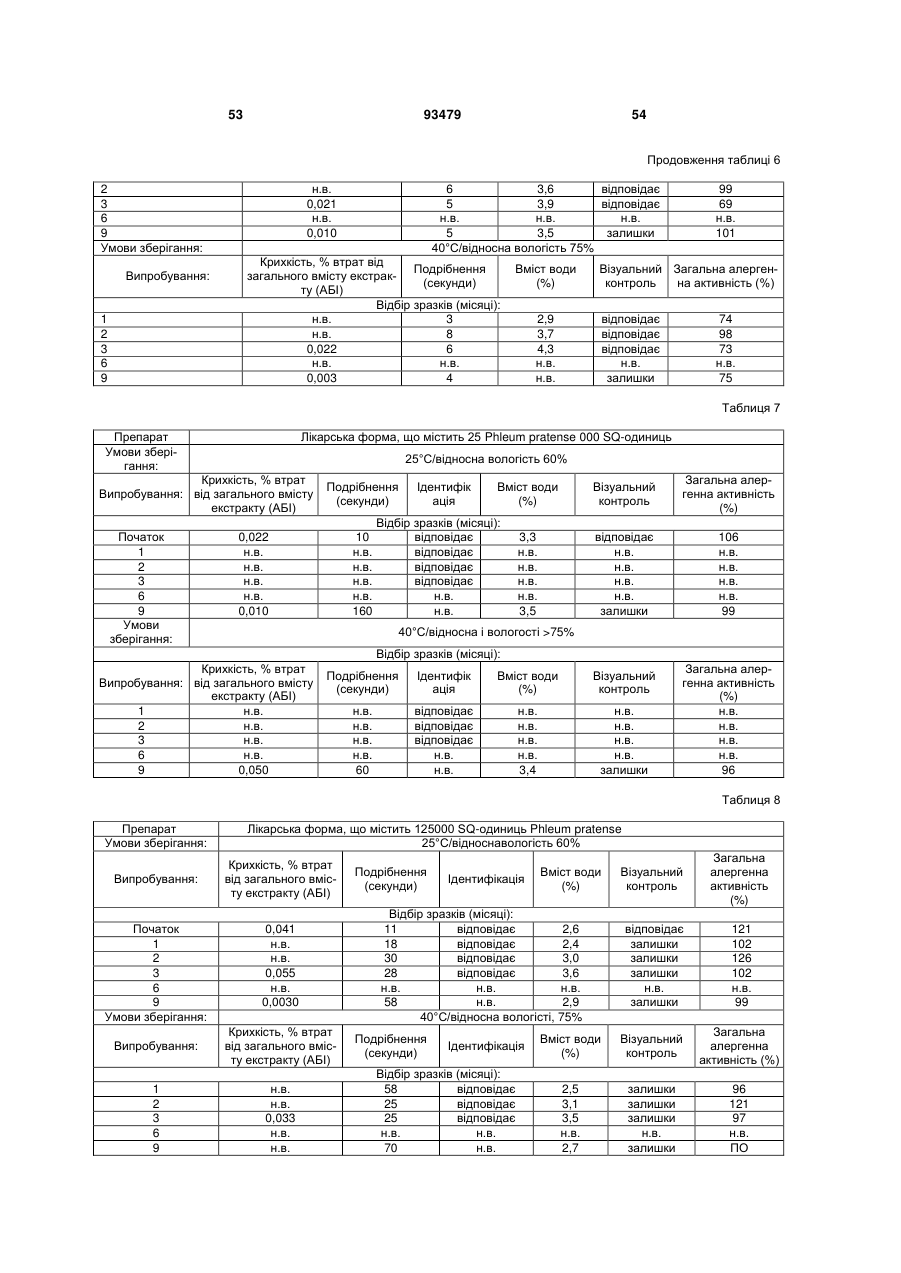
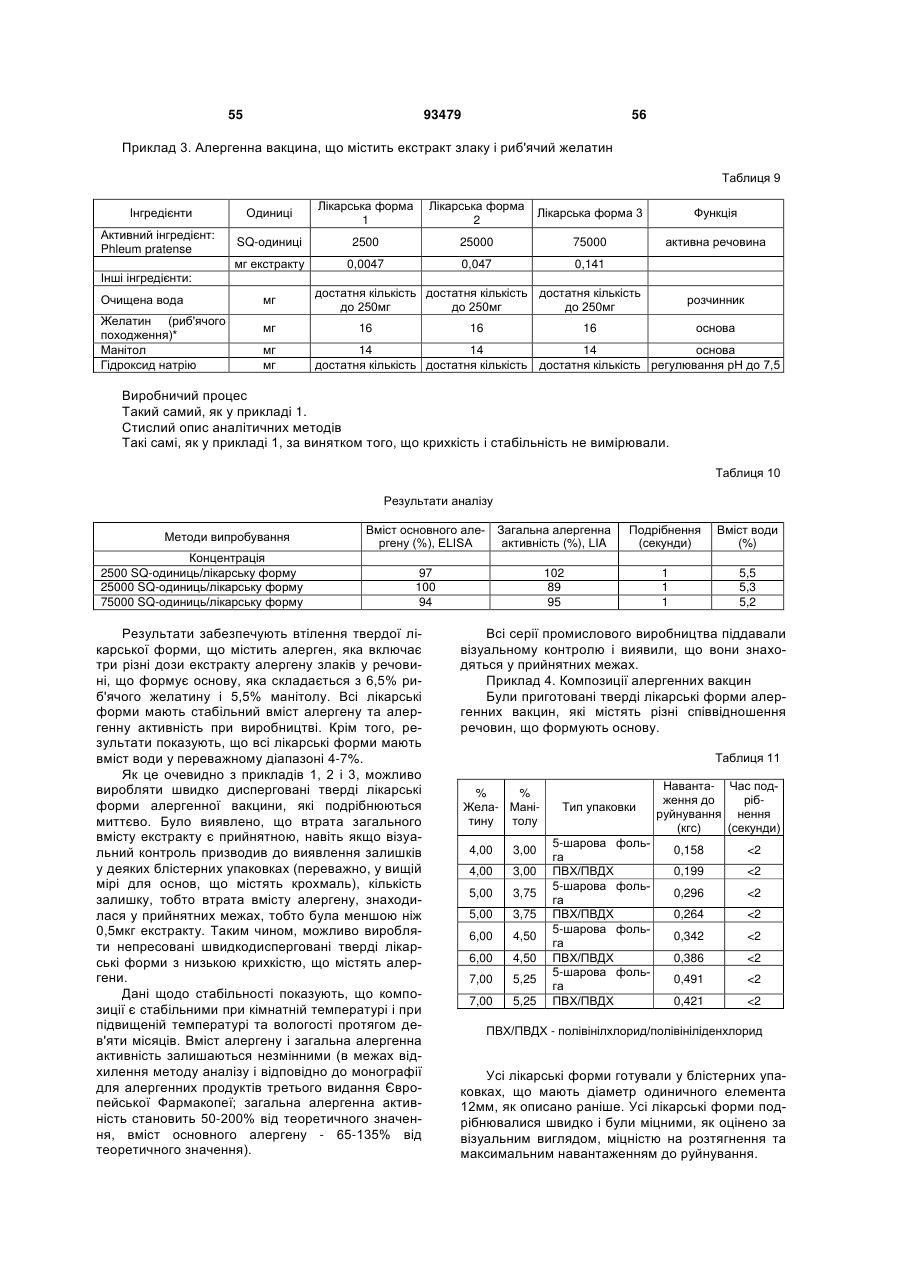
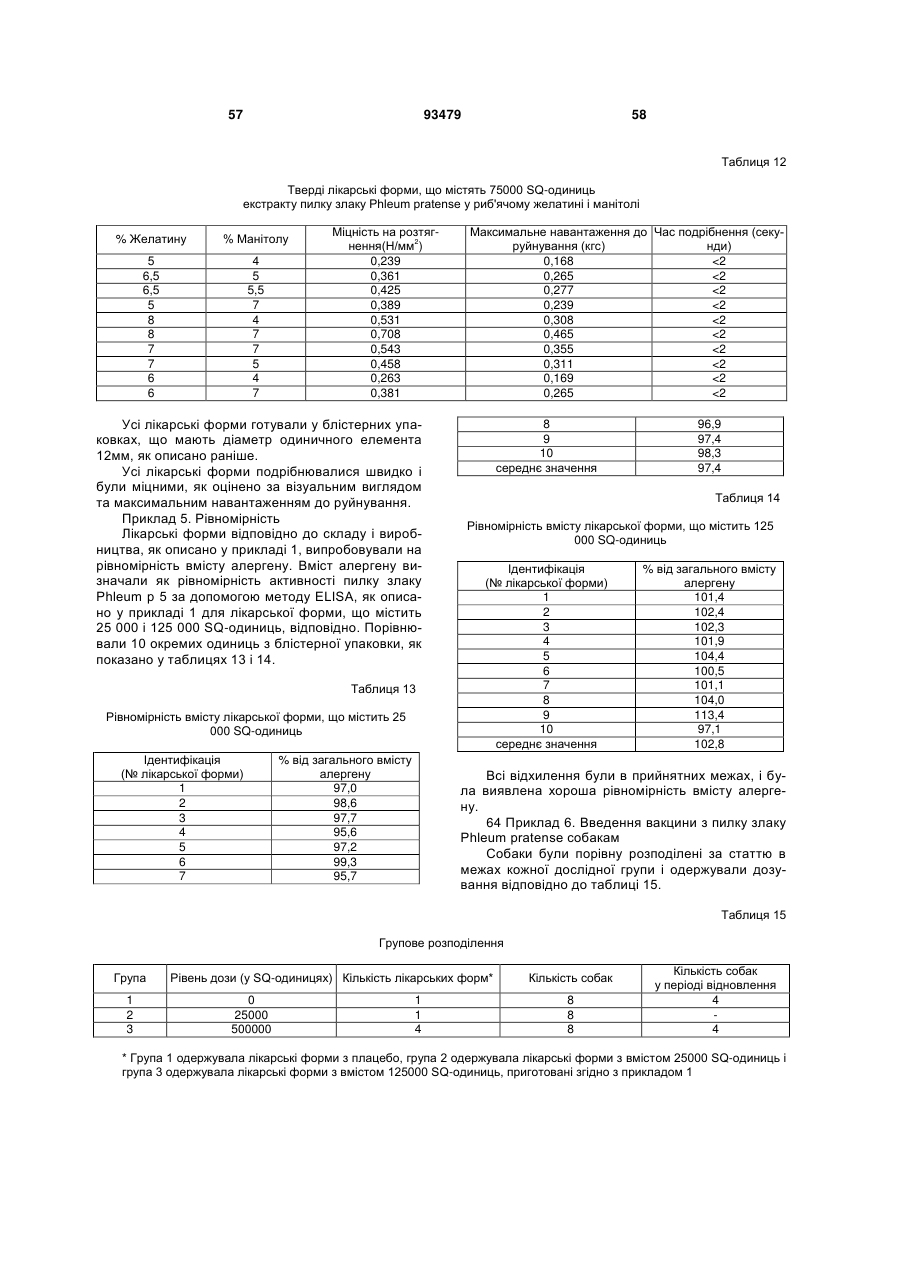
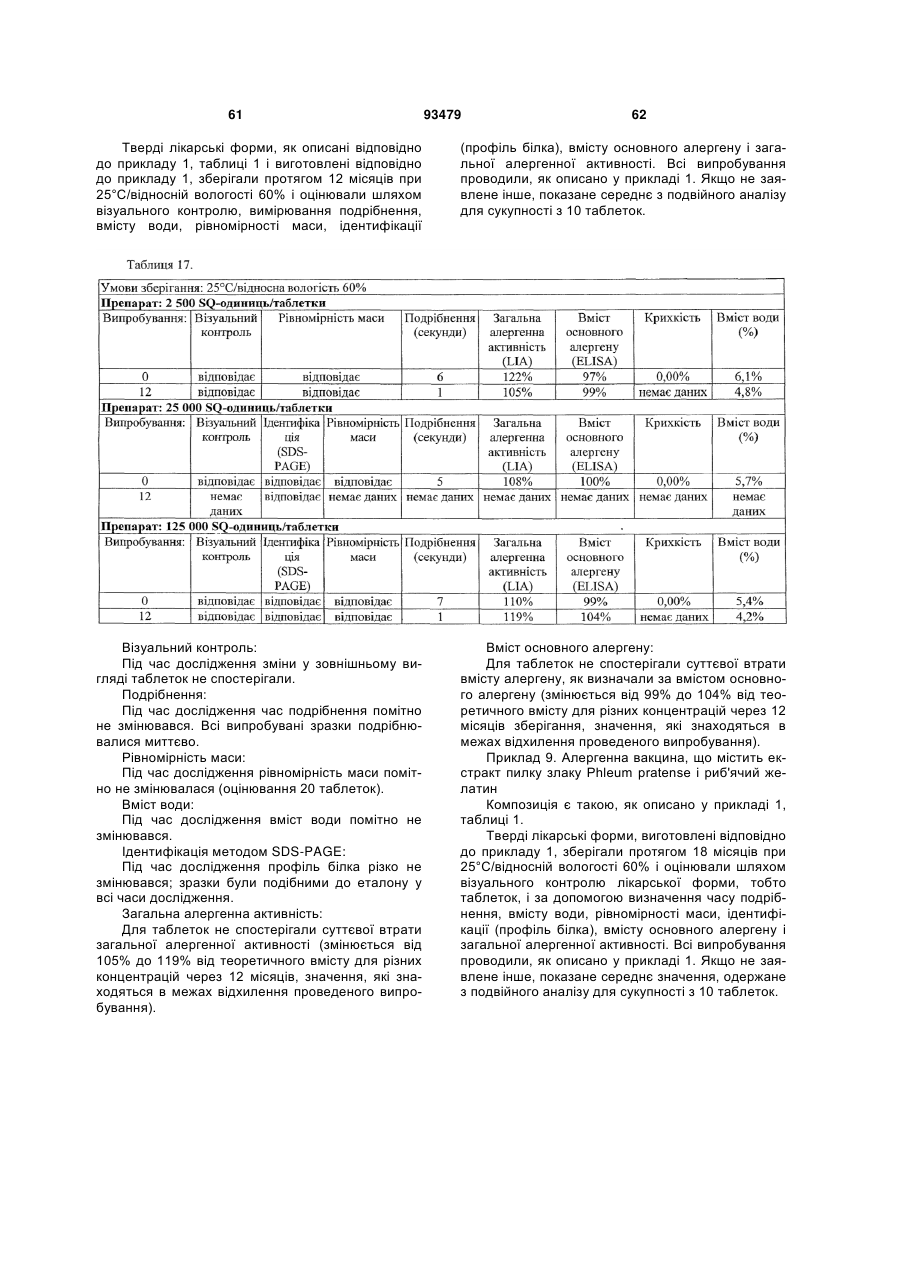
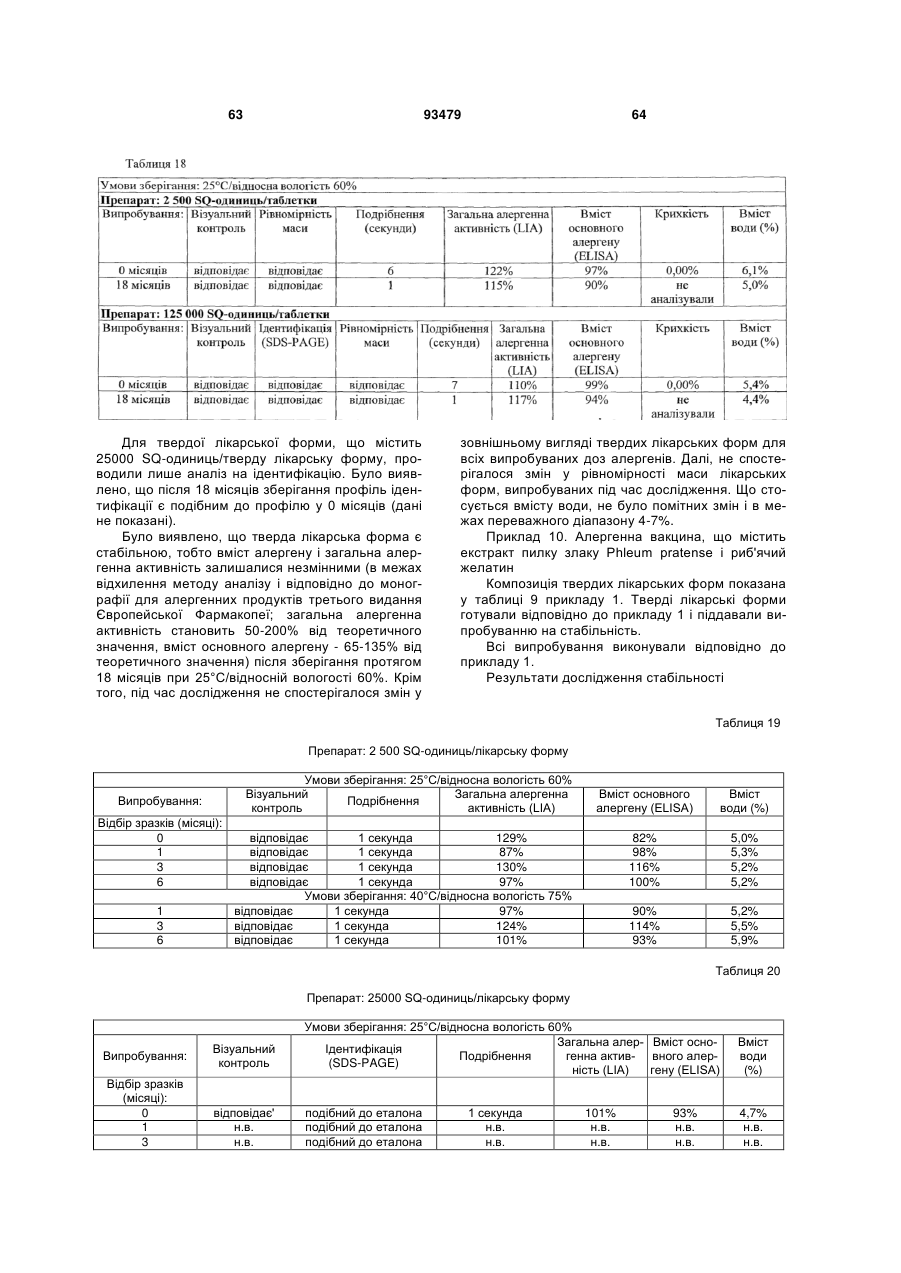
Фармацевтичний алергенний препарат
Номер патенту: 93479
Опубліковано: 25.02.2011
Автори: Меркедаль Лізе Лунд, Лундегорд Аннетте Реммельмайєр, Якобі Хенрік Хьюго, Осмуль-Ольсен Стіг, Андерсен Ян Сендергорд, Хафтон Крістіан Гаугуін
Формула / Реферат
1. Фармацевтичний препарат, придатний для введення алергену, який містить швидко дисперговану непресовану тверду лікарську форму, придатну для оромукозального введеня, яка містить:
(а) матрицю, де матриця утворена з розчину, який містить приблизно від 2 до 10 мас. % желатину і приблизно від 1 до 10 % мас. манітолу, або матриця утворена з розчину, який містить приблизно від 2 до 10 мас. % крохмалю і приблизно від 1 до 10 % мас. манітолу, і
(b) ефективну дозу алергену для десенсибілізації особи до вказаного алергену,
де вказана тверда лікарська форма містить екстракт алергену у кількості приблизно 0,5 мкг - 5 мг/лікарську форму, або вказана тверда лікарська форма містить основний алерген у кількості приблизно 0,05-500 мкг/лікарську форму.
2. Фармацевтичний препарат за п. 1, в якому
(с) втрата вмісту алергену у вказаній лікарській формі є меншою ніж 50 % від початкового вмісту алергену після зберігання протягом 3 місяців при температурі 25 °С і відносній вологості 60 %, і
(d) втрата вмісту алергену з вказаної твердої лікарської форми є меншою ніж приблизно 0,5 мкг екстракту алергену, коли вона піддається випробуванню на крихкість.
3. Фармацевтичний препарат за п. 1, в якому
(с) втрата вмісту алергену у вказаній лікарській формі є меншою ніж 50 % від початкового вмісту алергену після зберігання протягом 3 місяців при температурі 25 °С і відносній вологості 60 %, і
(d) втрата із вказаної твердої лікарської форми є меншою ніж приблизно 0,05 мкг екстракту алергену, коли вона піддається випробуванню на крихкість.
4. Фармацевтичний препарат за п. 1, який відрізняється тим, що його крихкість вимірюють у випробуванні на крихкість, як описано в Європейській Фармакопеї, V.2.9.7.
5. Фармацевтичний препарат за п. 1, який відрізняється тим, що його крихкість вимірюють у випробуванні на крихкість, що включає такі етапи:
(а) вміщення окремих герметичних блістерів, кожен з яких містить тверду лікарську форму, в обладнання, придатне для вимірювання крихкості;
(b) переміщення герметичного блістера, що містить тверду лікарську форму, протягом відповідного часу і при відповідній швидкості;
(с) видалення герметичного блістера, що містить тверду лікарську форму;
(d) відкриття блістера і вміщення твердої лікарської форми і будь-яких залишків у контейнер;
(е) видалення твердої лікарської форми з контейнера, залишаючи будь-які незв’язані залишки у вказаному контейнері;
(f) проведення алергеноспецифічного аналізу вказаних залишків з визначенням вмісту алергену у вказаних залишках; і, необов’язково, розрахунку відсотка вмісту алергену у вказаних залишках від загального вмісту алергену в одиничній твердій лікарській формі.
6. Фармацевтичний препарат за п. 5, який відрізняється тим, що
(а) використовують від 1 до 100 блістерів, що містять тверду лікарську форму, для вимірювання крихкості,
(b) використовують обладнання для вимірювання крихкості, як описано в Європейській Фармакопеї, V.2.9.7,
(с) тверді лікарські форми обертають 100 разів зі швидкістю 25±1 обертів/хвилину, і
(d) алергеноспецифічний аналіз є імунохімічним алергеноспецифічним аналізом.
7. Фармацевтичний препарат за п. 5 або 6, де алергеноспецифічний аналіз є твердофазовим імуноферментним аналізом.
8. Фармацевтичний препарат за будь-яким з пп. 1-7, що містить від приблизно 2,5 мкг до приблизно 3,75 мг екстракту алергену.
9. Фармацевтичний препарат за п. 8, що містить від приблизно 2,5 мкг до приблизно 2,5 мг екстракту алергену.
10. Фармацевтичний препарат за п. 9, що містить від приблизно 25 мкг до приблизно 2,5 мг екстракту алергену.
11. Фармацевтичний препарат за п. 10, що містить від приблизно 25 мкг до приблизно 1,25 мг екстракту алергену.
12. Фармацевтичний препарат за п. 11, що містить від приблизно 25 мкг до приблизно 1 мг екстракту алергену.
13. Фармацевтичний препарат за п. 12, що містить від приблизно 25 мкг до приблизно 750 мкг екстракту алергену.
14. Фармацевтичний препарат за будь-яким з пп. 1-7, що містить від приблизно 0,25 мкг до приблизно 0,25 мг основного алергену.
15. Фармацевтичний препарат за п. 14, що містить від приблизно 2,5 мкг до приблизно 0,25 мг основного алергену.
16. Фармацевтичний препарат за п. 15, що містить від приблизно 2,5 мкг до приблизно 0,125 мг основного алергену.
17. Фармацевтичний препарат за п. 16, що містить від приблизно 2,5 мкг до приблизно 0,1 мг основного алергену.
18. Фармацевтичний препарат за п. 17, що містить від приблизно 2,5 мкг до приблизно 75 мкг основного алергену.
19. Фармацевтичний препарат за будь-яким з пп. 1-7, що містить дозу від приблизно 65 до приблизно 15,000 БАО.
20. Фармацевтичний препарат за п. 19, що містить дозу від приблизно 650 до приблизно 15,000 БАО.
21. Фармацевтичний препарат за п. 20, що містить дозу від приблизно 650 до приблизно 6,000 БАО.
22. Фармацевтичний препарат за п. 21, що містить дозу від приблизно 650 до приблизно 4,700 БАО.
23. Фармацевтичний препарат за п. 22, що містить дозу від приблизно 650 до приблизно 3,500 БАО.
24. Фармацевтичний препарат за будь-яким з пп. 19-23, де алерген є алергеном пилку злаків.
25. Фармацевтичний препарат за будь-яким з пп. 1-24, де втрата вмісту алергену є меншою ніж приблизно 30 % від початкового вмісту після зберігання протягом 3 місяців при 25 °C і відносній вологості 60 %.
26. Фармацевтичний препарат за п. 25, де втрата вмісту алергену є меншою ніж приблизно 20 % від початкового вмісту після зберігання протягом 3 місяців при 25 °C і відносній вологості 60 %.
27. Фармацевтичний препарат за п. 26, де втрата вмісту алергену є меншою ніж приблизно 15 % від початкового вмісту після зберігання протягом 3 місяців при 25 °C і відносній вологості 60 %.
28. Фармацевтичний препарат за п. 27, де втрата вмісту алергену є меншою ніж приблизно 10 % від початкового вмісту після зберігання протягом 3 місяців при 25 °C і відносній вологості 60 %.
29. Фармацевтичний препарат за п. 28, де втрата вмісту алергену є меншою ніж приблизно 5 % від початкового вмісту після зберігання протягом 3 місяців при 25 °C і відносній вологості 60 %.
30. Фармацевтичний препарат за п. 29, де втрата вмісту алергену є меншою ніж приблизно 2 % від початкового вмісту після зберігання протягом 3 місяців при 25 °C і відносній вологості 60 %.
31. Фармацевтичний препарат за будь-яким з пп. 1–30, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,25 мкг екстракту алергену.
32. Фармацевтичний препарат за п. 31, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,15 мкг екстракту алергену.
33. Фармацевтичний препарат за п. 32, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,075 мкг екстракту алергену.
34. Фармацевтичний препарат за п. 33, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,025 мкг екстракту алергену.
35. Фармацевтичний препарат за п. 34, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,01 мкг екстракту алергену.
36. Фармацевтичний препарат за пп. 1-30, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,025 мкг основного алергену.
37. Фармацевтичний препарат за п. 36, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,015 мкг основного алергену.
38. Фармацевтичний препарат за п. 37, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,0075 мкг основного алергену.
39. Фармацевтичний препарат за п. 38, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,0025 мкг основного алергену.
40. Фармацевтичний препарат за п. 39, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,001 мкг основного алергену.
41. Фармацевтичний препарат за будь-яким з пп. 1-40, де матрицю утворюють шляхом сублімації розчину, що містить вказаний алерген і принаймні одну речовину, яка формує матрицю.
42. Фармацевтичний препарат за будь-яким з пп. 1-41, де вміст води у лікарській формі становить від приблизно 2 % до приблизно 8 %, за масою.
43. Фармацевтичний препарат за п. 42, де вміст води у лікарській формі становить від приблизно 4 % до приблизно 7 %, за масою.
44. Фармацевтичний препарат за будь-яким з пп. 1-43, де желатин включає риб’ячий желатин.
45. Фармацевтичний препарат за будь-яким з пп. 1-43, де матрицю формують з розчину, який містить від приблизно 2 % до приблизно 10 % мас. риб’ячого желатину і від приблизно 1 % до приблизно 10 % за масою манітолу.
46. Фармацевтичний препарат за п. 45, де розчин містить від приблизно 3 % до приблизно 6,5 %, мас. риб’ячого желатину і від приблизно 3 % до приблизно 5,5 % мас. манітолу.
47. Фармацевтичний препарат за п. 46, де розчин містить приблизно 6,5 % мас. риб’ячого желатину і приблизно 5,5 %, мас. манітолу.
48. Фармацевтичний препарат за п. 46, де розчин містить приблизно 6,0 % мас. риб’ячого желатину і приблизно 5,08 % мас. манітолу.
49. Фармацевтичний препарат за будь-яким з пп. 1-43, де матрицю формують з розчину, який містить 3-6,5 % мас. крохмалю і 3-5,5 % мас. манітолу.
50. Фармацевтичний препарат за будь-яким з пп. 1-49, який подрібнюється у слині людини протягом приблизно 60 секунд.
51. Фармацевтичний препарат за будь-яким з пп. 1-49, який подрібнюється у слині людини протягом приблизно 30 секунд.
52. Фармацевтичний препарат за будь-яким з пп. 1-49, який подрібнюється у слині людини протягом приблизно 10 секунд.
53. Фармацевтичний препарат за будь-яким з пп. 1-49, який подрібнюється у слині людини протягом приблизно 5 секунд.
54. Фармацевтичний препарат за будь-яким з пп. 1-49, який подрібнюється у слині людини протягом приблизно 2 секунд.
55. Фармацевтичний препарат за будь-яким з пп. 1-54, де алерген вибирають із групи, що складається з алергенів пилку дерев, алергенів пилку бур’янів, алергенів пилку трав’янистих рослин, алергенів амброзії, котячих алергенів, алергенів берези, алергенів пилку злакових, алергенів кліщів, алергенів комах, алергенів отрути, алергенів шерсті тварин, алергенів лупи і харчових алергенів.
56. Фармацевтичний препарат за п. 55, де алерген є у формі екстракту, очищеного алергену, модифікованого алергену або рекомбінантного алергену, або рекомбінантного мутантного алергену, або будь-якого їхнього поєднання.
57. Фармацевтичний препарат за п. 55 або 56, де алерген є алергеном пилку злаків.
58. Фармацевтичний препарат за п. 55, де алерген є у формі екстракту пилку злаків.
59. Фармацевтичний препарат за п. 55 або 56, де алерген є кліщовим алергеном домашнього пилу.
60. Фармацевтичний препарат за п. 55 або 56, що містить головний кліщовий алерген, вибраний з групи, яка складається з алергену кліщів групи 1 та алергену кліщів групи 2.
61. Фармацевтичний препарат за п. 59, де алерген є у формі екстракту кліща домашнього пилу.
62. Фармацевтичний препарат за п. 55 або 56, де алерген є алергеном амброзії.
63. Фармацевтичний препарат за п. 55 або 56, де алерген є у формі екстракту амброзії.
64. Фармацевтичний препарат за п. 55 або 56, який містить головний алерген пилку амброзії 1.
65. Фармацевтичний препарат за п. 55 або 56, де алерген є котячим алергеном.
66. Фармацевтичний препарат за п. 55 або 56, що містить головний котячий алерген 1 (fel d 1).
67. Фармацевтичний препарат за п. 55 або 56, де алерген є алергеном берези.
68. Фармацевтичний препарат за п. 55 або 56, де алерген є у формі алергену пилку берези.
69. Фармацевтичний препарат за п. 55 або 56, що містить головний алерген пилку дерев 1 (bet v 1).
70. Фармацевтичний препарат за будь-яким з пп. 1-69, який містить принаймні два різні алергени.
71. Фармацевтичний препарат за будь-яким з пп. 1-70, де відхилення у вмісті алергену між різними твердими лікарськими формами знаходиться в межах приблизно 10 %.
72. Фармацевтичний препарат за п. 71, де відхилення у вмісті алергену між різними твердими лікарськими формами знаходиться в межах приблизно 7 %.
73. Фармацевтичний препарат за п. 72, де відхилення у вмісті алергену між різними твердими лікарськими формами знаходиться в межах приблизно 5 %.
74. Фармацевтичний препарат за будь-яким з пп. 1-73, де тверда лікарська форма має міцність на розтягнення, меншу ніж приблизно 1,0 Н/мм2.
75. Фармацевтичний препарат за будь-яким з пп. 1-74, де вказана тверда лікарська форма має максимальне навантаження до руйнування не менше ніж приблизно 0,05 кгс і нижче ніж приблизно 0,9 кгс.
76. Фармацевтичний препарат за будь-яким з пп. 1-75, де вказана лікарська форма є достатньо міцною, щоб бути видаленою з блістерної упаковки без вивільнення залишків, що містять більше ніж приблизно 0,5 мкг екстракту, у навколишнє середовище.
77. Фармацевтичний препарат за пп. 1-75, де вказана лікарська форма є достатньо міцною, щоб бути видаленою з блістерної упаковки без вивільнення залишків, що містять більше ніж приблизно 0,05 мкг основного алергену, у навколишнє середовище.
78. Фармацевтичний препарат за будь-яким з пп. 1-75, де вказана лікарська форма є достатньо міцною, щоб бути видаленою з блістерної упаковки без вивільнення залишків, що містять більше ніж приблизно 13 БАО, у навколишнє середовище.
79. Фармацевтичний препарат за будь-яким з пп. 1-75, де лікарська форма включає один або більшу кількість наповнювачів.
80. Фармацевтичний препарат за п. 79, що містить наповнювач, вибраний з групи, яка включає антациди, розріджувачі, речовини, що сприяють прилипанню до слизової оболонки, посилювачі, смакові речовини, речовини, що маскують смак, консерванти, антиоксиданти, поверхнево-активні речовини, посилювачі в’язкості, барвники, модифікатори рН і підсолоджувальні речовини.
81. Фармацевтичний препарат за будь-яким з пп. 1-84, який додатково містить ад’ювант.
82. Фармацевтичний препарат за п. 81, де ад’ювант вибирають з групи, що включає солі алюмінію, нетоксичні бактеріальні фрагменти, цитокіни, токсин холери, детоксифіковані фракції токсину холери, хітозан, термолабільні фрагменти E. сoli, детоксифіковані фракції термолабільних фрагментів E. сoli, сапоніни, ліпополісахариди, мурамілдипептид, ліпосоми, імуностимулюючі послідовності ДНК і мікрочастинкові полімери лактиду/гліколіду.
83. Багатодозовий контейнер, що містить множину твердих лікарських форм за будь-яким з пп. 1-82.
84. Багатодозовий контейнер за п. 83, де багатодозовий контейнер є блістерною упаковкою.
85. Багатодозовий контейнер за п. 83, де багатодозовий контейнер є повністю алюмінієвою блістерною упаковкою.
86. Багатодозовий контейнер за п. 83, де багатодозовий контейнер є багатошаровою повністю алюмінієвою блістерною упаковкою.
87. Спосіб лікування алергії або полегшення симптомів алергії, що включає оромукозальне застосування фармацевтичного препарату за будь-яким з пп. 1-82.
88. Спосіб виробництва швидко диспергованої непресованої твердої і стабільної лікарської форми за п. 1, що має низьку крихкість, містить принаймні одну речовину, яка формує матрицю і придатна для оромукозального застосування, і містить ефективну дозу для десенсибілізації особи до принаймні одного алергену, що включає етапи:
(а) приготування водного розчину, який містить вказаний принаймні один алерген і вказану принаймні одну речовину, що формує матрицю,
(b) внесення розчину у заглиблення на багатошаровій ламінованій блістерній пластині,
(с) піддавання наповненої пластини заморожуванню і сушінню сублімацією при стандартних умовах температури зберігання і тиску в камері, щоб одержати вказану тверду лікарську форму в кожному заглибленні.
89. Набір для лікування алергії або полегшення симптомів алергії, який містить:
a) множину твердих пероральних лікарських форм за п. 1 у запечатаному контейнері, кожна із вказаних твердих пероральних лікарських форм вкладена у запечатану оболонку і містить ефективну кількість алергену, придатного для оромукозального застосування; і
b) кожна із вказаних твердих лікарських форм містить однакову кількість алергену.
90. Набір за п. 89, який додатково містить інструкції з використання багаторазових твердих лікарських форм.
91. Набір за пп. 89, 90, де лікарська форма є швидко диспергованою лікарською формою.
92. Набір за пп. 89-91, де кожна з твердих лікарських форм розміщена в окремо запечатаних блістерах у множинній блістерній упаковці.
93. Набір за пп. 89-92, де тверді лікарські форми додатково включають желатин.
94. Набір за п. 93, де тверді лікарські форми додатково включають манітол.
95. Набір за п. 93 або 94, де желатин є риб’ячим желатином.
96. Набір за будь-яким з пп. 89-95, де ефективна кількість становить від приблизно 2,5 мкг до приблизно 3,75 мг екстракту/твердої лікарської форми.
97. Спосіб лікування людини-пацієнта, яка страждає на алергію, що включає:
a) забезпечення набору за пп. 89-96, і
b) багаторазове введення вказаній людині принаймні однієї із вказаних твердих лікарських форм з набору до послаблення симптомів алергії, де багаторазове введення обходиться без етапу зростаючого дозування.
98. Фармацевтичний препарат, що включає придатну для перорального застосування тверду лікарську форму за п. 1, де вказана лікарська форма має вміст алергену принаймні 50 % від початкового вмісту алергену після зберігання протягом 3 місяців при 25 °С і відносній вологості 60 %.
99. Фармацевтичний препарат за п. 98, де тверду лікарську форму вибирають з групи, що складається з пастилок, таблеток, капсул і каплет.
100. Фармацевтичний препарат за будь-яким з пп. 1-82 для оромукозального лікування алергії або полегшення симптомів алергії.
101. Застосування твердої лікарської форми, яка визначена у будь-якому з пп. 1-82, для оромукозального лікування алергії або полегшення симптомів алергії.
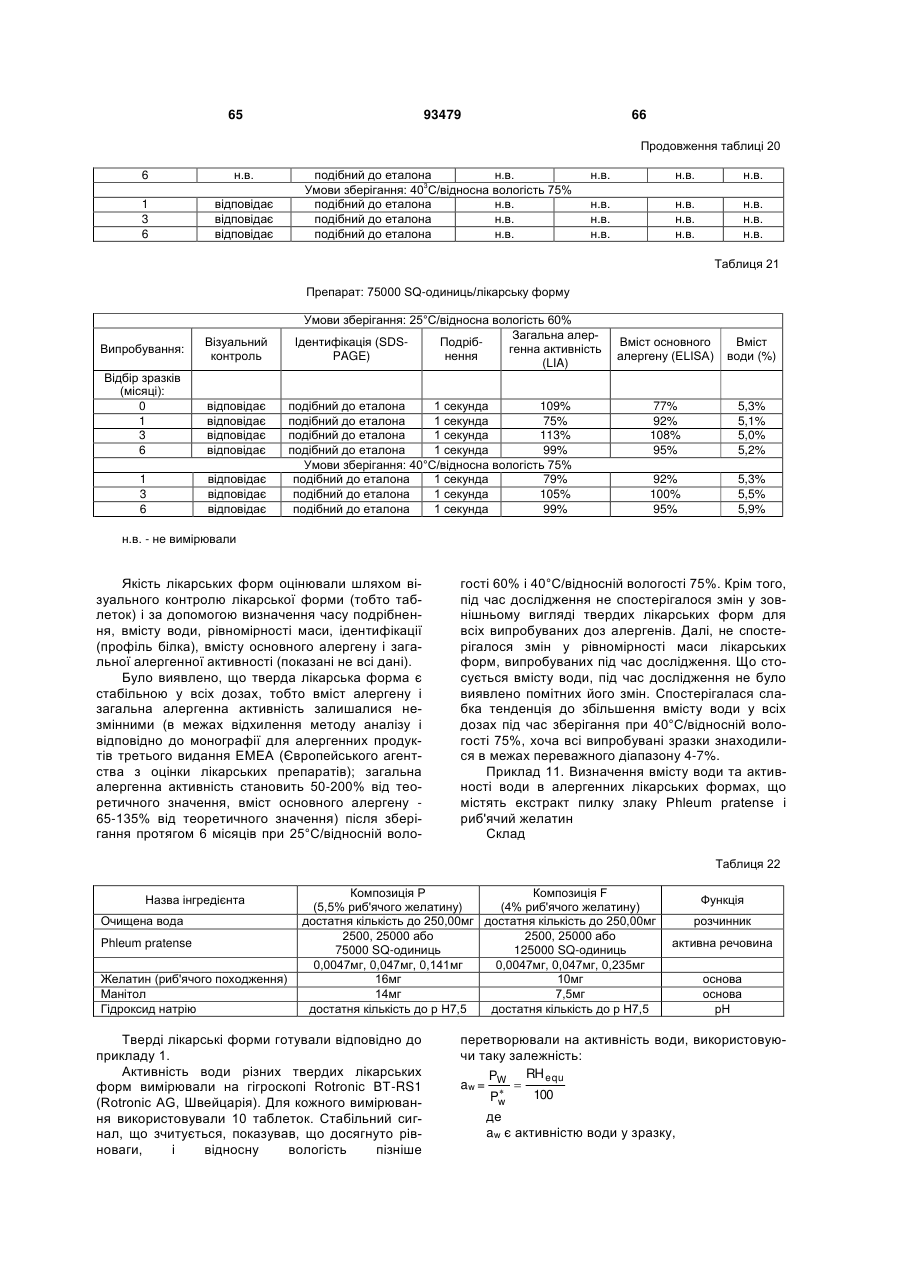
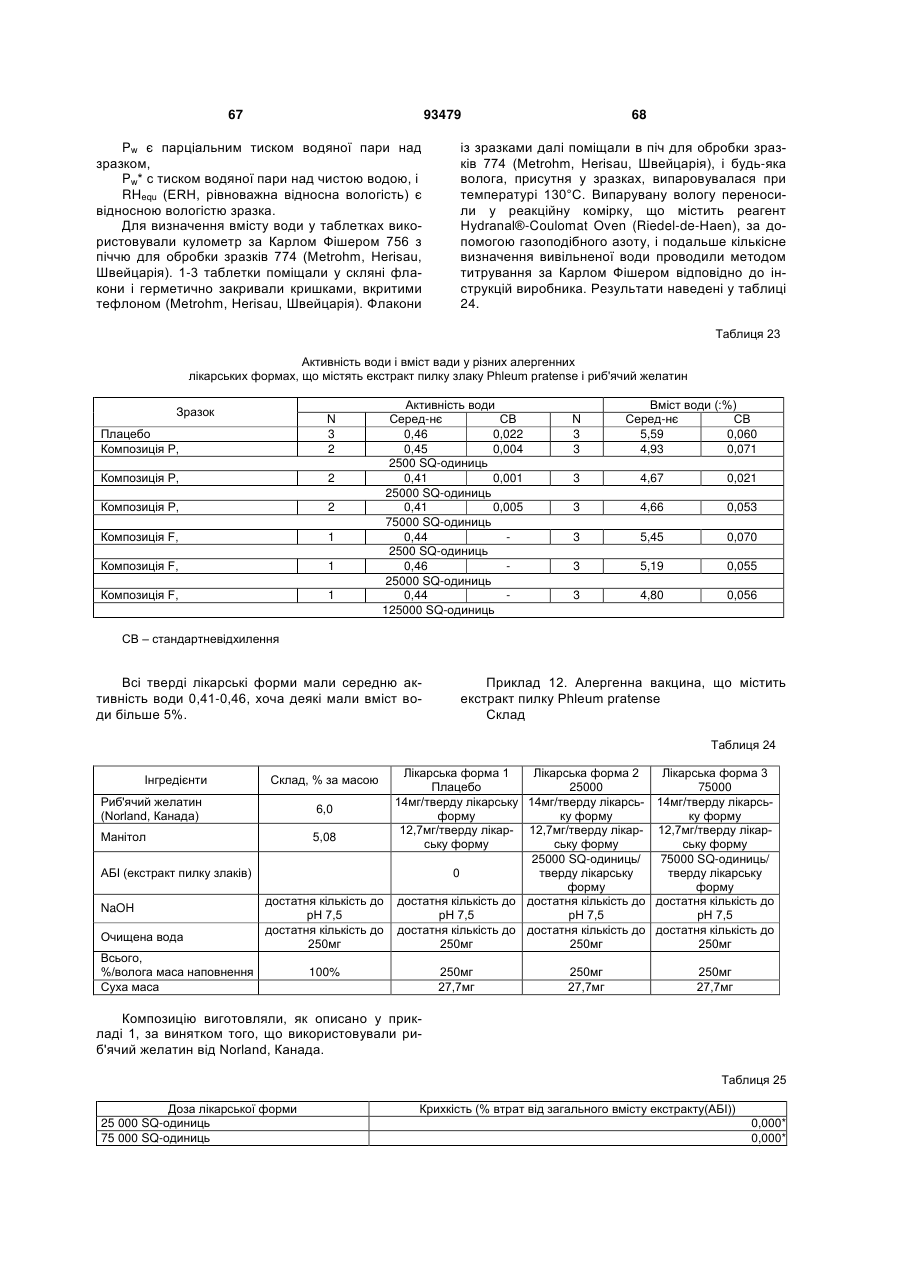
Текст
1. Фармацевтичний препарат, придатний для введення алергену, який містить швидко дисперговану непресовану тверду лікарську форму, придатну для оромукозального введеня, яка містить: (а) матрицю, де матриця утворена з розчину, який містить приблизно від 2 до 10мас.% желатину і приблизно від 1 до 10%мас. манітолу, або матриця утворена з розчину, який містить приблизно від 2 до 10мас.% крохмалю і приблизно від 1 до 10%мас. манітолу, і (b) ефективну дозу алергену для десенсибілізації особи до вказаного алергену, де вказана тверда лікарська форма містить екстракт алергену у кількості приблизно 0,5мкг5мг/лікарську форму, або вказана тверда лікарсь 2 (19) 1 3 вказаних залишках; і, необов’язково, розрахунку відсотка вмісту алергену у вказаних залишках від загального вмісту алергену в одиничній твердій лікарській формі. 6. Фармацевтичний препарат за п.5, який відрізняється тим, що (а) використовують від 1 до 100 блістерів, що містять тверду лікарську форму, для вимірювання крихкості, (b) використовують обладнання для вимірювання крихкості, як описано в Європейській Фармакопеї, V.2.9.7, (с) тверді лікарські форми обертають 100 разів зі швидкістю 251 обертів/хвилину, і (d) алергеноспецифічний аналіз є імунохімічним алергеноспецифічним аналізом. 7. Фармацевтичний препарат за п.5 або 6, де алергеноспецифічний аналіз є твердофазовим імуноферментним аналізом. 8. Фармацевтичний препарат за будь-яким з пп.17, що містить від приблизно 2,5мкг до приблизно 3,75 мг екстракту алергену. 9. Фармацевтичний препарат за п.8, що містить від приблизно 2,5мкг до приблизно 2, мг екстракту алергену. 10. Фармацевтичний препарат за п.9, що містить від приблизно 25мкг до приблизно 2,5мг екстракту алергену. 11. Фармацевтичний препарат за п.10, що містить від приблизно 25мкг до приблизно 1,25 мг екстракту алергену. 12. Фармацевтичний препарат за п.11, що містить від приблизно 25мкг до приблизно 1мг екстракту алергену. 13. Фармацевтичний препарат за п.12, що містить від приблизно 25мкг до приблизно 750мкг екстракту алергену. 14. Фармацевтичний препарат за будь-яким з пп.17, що містить від приблизно 0,25мкг до приблизно 0,25мг основного алергену. 15. Фармацевтичний препарат за п.14, що містить від приблизно 2,5мкг до приблизно 0,25мг основного алергену. 16. Фармацевтичний препарат за п.15, що містить від приблизно 2,5мкг до приблизно 0,125мг основного алергену. 17. Фармацевтичний препарат за п.16, що містить від приблизно 2,5мкг до приблизно 0,1мг основного алергену. 18. Фармацевтичний препарат за п.17, що містить від приблизно 2,5мкг до приблизно 75мкг основного алергену. 19. Фармацевтичний препарат за будь-яким з пп.17, що містить дозу від приблизно 65 до приблизно 15,000 БАО. 20. Фармацевтичний препарат за п.19, що містить дозу від приблизно 650 до приблизно 15,000 БАО. 21. Фармацевтичний препарат за п.20, що містить дозу від приблизно 650 до приблизно 6,000 БАО. 22. Фармацевтичний препарат за п.21, що містить дозу від приблизно 650 до приблизно 4,700 БАО. 23. Фармацевтичний препарат за п.22, що містить дозу від приблизно 650 до приблизно 3,500 БАО. 24. Фармацевтичний препарат за будь-яким з пп.19-23, де алерген є алергеном пилку злаків. 93479 4 25. Фармацевтичний препарат за будь-яким з пп.124, де втрата вмісту алергену є меншою ніж приблизно 30 % від початкового вмісту після зберігання протягом 3 місяців при 25°C і відносній вологості 60 %. 26. Фармацевтичний препарат за п.25, де втрата вмісту алергену є меншою ніж приблизно 20% від початкового вмісту після зберігання протягом 3 місяців при 25°C і відносній вологості 60%. 27. Фармацевтичний препарат за п.26, де втрата вмісту алергену є меншою ніж приблизно 15% від початкового вмісту після зберігання протягом 3 місяців при 25°C і відносній вологості 60%. 28. Фармацевтичний препарат за п.27, де втрата вмісту алергену є меншою ніж приблизно 10% від початкового вмісту після зберігання протягом 3 місяців при 25°C і відносній вологості 60%. 29. Фармацевтичний препарат за п.28, де втрата вмісту алергену є меншою ніж приблизно 5% від початкового вмісту після зберігання протягом 3 місяців при 25°C і відносній вологості 60%. 30. Фармацевтичний препарат за п.29, де втрата вмісту алергену є меншою ніж приблизно 2% від початкового вмісту після зберігання протягом 3 місяців при 25°C і відносній вологості 60%. 31. Фармацевтичний препарат за будь-яким з пп.1–30, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,25мкг екстракту алергену. 32. Фармацевтичний препарат за п.31, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,15мкг екстракту алергену. 33. Фармацевтичний препарат за п.32, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,075мкг екстракту алергену. 34. Фармацевтичний препарат за п.33, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,025мкг екстракту алергену. 35. Фармацевтичний препарат за п.34, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,01мкг екстракту алергену. 36. Фармацевтичний препарат за пп.1-30, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,025мкг основного алергену. 37. Фармацевтичний препарат за п.36, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,015 мкг основного алергену. 38. Фармацевтичний препарат за п.37, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,0075мкг основного алергену. 39. Фармацевтичний препарат за п.38, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,0025мкг основного алергену. 40. Фармацевтичний препарат за п.39, де втрати з кожної твердої лікарської форми є меншими ніж приблизно 0,001мкг основного алергену. 41. Фармацевтичний препарат за будь-яким з пп.140, де матрицю утворюють шляхом сублімації розчину, що містить вказаний алерген і принаймні одну речовину, яка формує матрицю. 42. Фармацевтичний препарат за будь-яким з пп.141, де вміст води у лікарській формі становить від приблизно 2% до приблизно 8%, за масою. 5 43. Фармацевтичний препарат за п.42, де вміст води у лікарській формі становить від приблизно 4% до приблизно 7%, за масою. 44. Фармацевтичний препарат за будь-яким з пп.143, де желатин включає риб’ячий желатин. 45. Фармацевтичний препарат за будь-яким з пп.143, де матрицю формують з розчину, який містить від приблизно 2% до приблизно 10%мас. риб’ячого желатину і від приблизно 1% до приблизно 10% за масою манітолу. 46. Фармацевтичний препарат за п.45, де розчин містить від приблизно 3% до приблизно 6,5%, мас. риб’ячого желатину і від приблизно 3% до приблизно 5,5% мас. манітолу. 47. Фармацевтичний препарат за п.46, де розчин містить приблизно 6,5% мас. риб’ячого желатину і приблизно 5,5%, мас. манітолу. 48. Фармацевтичний препарат за п.46, де розчин містить приблизно 6,0% мас. риб’ячого желатину і приблизно 5,08% мас. манітолу. 49. Фармацевтичний препарат за будь-яким з пп.143, де матрицю формують з розчину, який містить 3-6,5% мас. крохмалю і 3-5,5% мас. манітолу. 50. Фармацевтичний препарат за будь-яким з пп.149, який подрібнюється у слині людини протягом приблизно 60 секунд. 51. Фармацевтичний препарат за будь-яким з пп.149, який подрібнюється у слині людини протягом приблизно 30 секунд. 52. Фармацевтичний препарат за будь-яким з пп.149, який подрібнюється у слині людини протягом приблизно 10 секунд. 53. Фармацевтичний препарат за будь-яким з пп.149, який подрібнюється у слині людини протягом приблизно 5 секунд. 54. Фармацевтичний препарат за будь-яким з пп.149, який подрібнюється у слині людини протягом приблизно 2 секунд. 55. Фармацевтичний препарат за будь-яким з пп.154, де алерген вибирають із групи, що складається з алергенів пилку дерев, алергенів пилку бур’янів, алергенів пилку трав’янистих рослин, алергенів амброзії, котячих алергенів, алергенів берези, алергенів пилку злакових, алергенів кліщів, алергенів комах, алергенів отрути, алергенів шерсті тварин, алергенів лупи і харчових алергенів. 56. Фармацевтичний препарат за п.55, де алерген є у формі екстракту, очищеного алергену, модифікованого алергену або рекомбінантного алергену, або рекомбінантного мутантного алергену, або будь-якого їхнього поєднання. 57. Фармацевтичний препарат за п.55 або 56, де алерген є алергеном пилку злаків. 58. Фармацевтичний препарат за п.55, де алерген є у формі екстракту пилку злаків. 59. Фармацевтичний препарат за п.55 або 56, де алерген є кліщовим алергеном домашнього пилу. 60. Фармацевтичний препарат за п.55 або 56, що містить головний кліщовий алерген, вибраний з групи, яка складається з алергену кліщів групи 1 та алергену кліщів групи 2. 61. Фармацевтичний препарат за п.59, де алерген є у формі екстракту кліща домашнього пилу. 62. Фармацевтичний препарат за п.55 або 56, де алерген є алергеном амброзії. 93479 6 63. Фармацевтичний препарат за п.55 або 56, де алерген є у формі екстракту амброзії. 64. Фармацевтичний препарат за п.55 або 56, який містить головний алерген пилку амброзії 1. 65. Фармацевтичний препарат за п.55 або 56, де алерген є котячим алергеном. 66. Фармацевтичний препарат за п.55 або 56, що містить головний котячий алерген 1 (fel d 1). 67. Фармацевтичний препарат за п.55 або 56, де алерген є алергеном берези. 68. Фармацевтичний препарат за п.55 або 56, де алерген є у формі алергену пилку берези. 69. Фармацевтичний препарат за п.55 або 56, що містить головний алерген пилку дерев 1 (bet v 1). 70. Фармацевтичний препарат за будь-яким з пп.169, який містить принаймні два різні алергени. 71. Фармацевтичний препарат за будь-яким з пп.170, де відхилення у вмісті алергену між різними твердими лікарськими формами знаходиться в межах приблизно 10%. 72. Фармацевтичний препарат за п.71, де відхилення у вмісті алергену між різними твердими лікарськими формами знаходиться в межах приблизно 7%. 73. Фармацевтичний препарат за п.72, де відхилення у вмісті алергену між різними твердими лікарськими формами знаходиться в межах приблизно 5%. 74. Фармацевтичний препарат за будь-яким з пп.173, де тверда лікарська форма має міцність на розтягнення, меншу ніж приблизно 1,0Н/мм2. 75. Фармацевтичний препарат за будь-яким з пп.174, де вказана тверда лікарська форма має максимальне навантаження до руйнування не менше ніж приблизно 0,05кгс і нижче ніж приблизно 0,9кгс. 76. Фармацевтичний препарат за будь-яким з пп.175, де вказана лікарська форма є достатньо міцною, щоб бути видаленою з блістерної упаковки без вивільнення залишків, що містять більше ніж приблизно 0,5мкг екстракту, у навколишнє середовище. 77. Фармацевтичний препарат за пп.1-75, де вказана лікарська форма є достатньо міцною, щоб бути видаленою з блістерної упаковки без вивільнення залишків, що містять більше ніж приблизно 0,05мкг основного алергену, у навколишнє середовище. 78. Фармацевтичний препарат за будь-яким з пп.175, де вказана лікарська форма є достатньо міцною, щоб бути видаленою з блістерної упаковки без вивільнення залишків, що містять більше ніж приблизно 13 БАО, у навколишнє середовище. 79. Фармацевтичний препарат за будь-яким з пп.175, де лікарська форма включає один або більшу кількість наповнювачів. 80. Фармацевтичний препарат за п.79, що містить наповнювач, вибраний з групи, яка включає антациди, розріджувачі, речовини, що сприяють прилипанню до слизової оболонки, посилювачі, смакові речовини, речовини, що маскують смак, консерванти, антиоксиданти, поверхнево-активні речовини, посилювачі в’язкості, барвники, модифікатори рН і підсолоджувальні речовини. 7 93479 8 81. Фармацевтичний препарат за будь-яким з пп.180, який додатково містить ад’ювант. 82. Фармацевтичний препарат за п.81, де ад’ювант вибирають з групи, що включає солі алюмінію, нетоксичні бактеріальні фрагменти, цитокіни, токсин холери, детоксифіковані фракції токсину холери, хітозан, термолабільні фрагменти E. сoli, детоксифіковані фракції термолабільних фрагментів E. сoli, сапоніни, ліпополісахариди, мурамілдипептид, ліпосоми, імуностимулюючі послідовності ДНК і мікрочастинкові полімери лактиду/гліколіду. 83. Багатодозовий контейнер, що містить множину твердих лікарських форм за будь-яким з пп.1-82. 84. Багатодозовий контейнер за п.83, де багатодозовий контейнер є блістерною упаковкою. 85. Багатодозовий контейнер за п.83, де багатодозовий контейнер є повністю алюмінієвою блістерною упаковкою. 86. Багатодозовий контейнер за п.83, де багатодозовий контейнер є багатошаровою повністю алюмінієвою блістерною упаковкою. 87. Спосіб лікування алергії або полегшення симптомів алергії, що включає оромукозальне застосування фармацевтичного препарату за будь-яким з пп.1-82. 88. Спосіб виробництва швидко диспергованої непресованої твердої і стабільної лікарської форми за п.1, що має низьку крихкість, містить принаймні одну речовину, яка формує матрицю і придатна для оромукозального застосування, і містить ефективну дозу для десенсибілізації особи до принаймні одного алергену, що включає етапи: (а) приготування водного розчину, який містить вказаний принаймні один алерген і вказану принаймні одну речовину, що формує матрицю, (b) внесення розчину у заглиблення на багатошаровій ламінованій блістерній пластині, (с) піддавання наповненої пластини заморожуванню і сушінню сублімацією при стандартних умовах температури зберігання і тиску в камері, щоб одержати вказану тверду лікарську форму в кожному заглибленні. 89. Набір для лікування алергії або полегшення симптомів алергії, який містить: a) множину твердих пероральних лікарських форм за п.1 у запечатаному контейнері, кожна із вказаних твердих пероральних лікарських форм вкла дена у запечатану оболонку і містить ефективну кількість алергену, придатного для оромукозального застосування; і b) кожна із вказаних твердих лікарських форм містить однакову кількість алергену. 90. Набір за п.89, який додатково містить інструкції з використання багаторазових твердих лікарських форм. 91. Набір за пп.89, 90, де лікарська форма є швидко диспергованою лікарською формою. 92. Набір за пп.89-91, де кожна з твердих лікарських форм розміщена в окремо запечатаних блістерах у множинній блістерній упаковці. 93. Набір за пп.89-92, де тверді лікарські форми додатково включають желатин. 94. Набір за п.93, де тверді лікарські форми додатково включають манітол. 95. Набір за п.93 або 94, де желатин є риб’ячим желатином. 96. Набір за будь-яким з пп.89-95, де ефективна кількість становить від приблизно 2,5мкг до приблизно 3,75 мг екстракту/твердої лікарської форми. 97. Спосіб лікування людини-пацієнта, яка страждає на алергію, що включає: a) забезпечення набору за пп.89-96, і b) багаторазове введення вказаній людині принаймні однієї із вказаних твердих лікарських форм з набору до послаблення симптомів алергії, де багаторазове введення обходиться без етапу зростаючого дозування. 98. Фармацевтичний препарат, що включає придатну для перорального застосування тверду лікарську форму за п.1, де вказана лікарська форма має вміст алергену принаймні 50% від початкового вмісту алергену після зберігання протягом 3 місяців при 25С і відносній вологості 60%. 99. Фармацевтичний препарат за п.98, де тверду лікарську форму вибирають з групи, що складається з пастилок, таблеток, капсул і каплет. 100. Фармацевтичний препарат за будь-яким з пп.1-82 для оромукозального лікування алергії або полегшення симптомів алергії. 101. Застосування твердої лікарської форми, яка визначена у будь-якому з пп.1-82, для оромукозального лікування алергії або полегшення симптомів алергії. Дана заявка стверджує, відповідно до розділу 35 зводу законів США, §119 (е), пріоритет попередньої заявки США, реєстраційний номер 60/429 086, зареєстрованої 26 листопада 2002р. Дана заявка також стверджує пріоритет датської патентної заявки РА 200201852, зареєстрованої 26 листопада 2002p., і датської патентної заявки РА 200300279 (24 лютого 2003р.). Кожна з цих пріоритетних заявок включена сюди за допомогою посилання і у всій своїй повноті. Даний винахід стосується алергенних вакцин, і, зокрема, швидко диспергованих твердих лікарських форм алергенних вакцин та способу приготування таких лікарських форм. Алергія є головною проблемою зі здоров'ям у країнах, адаптованих до західного стилю життя. До того ж, у цих країнах збільшується поширеність алергічних захворювань. Хоча алергію загалом не можна розглядати як небезпечне для життя захворювання, астма щорічно спричиняє значну кількість смертей. Незвичайна поширеність захворювання серед приблизно 30% підлітків виражає суттєву втрату якості життя, робочих днів та грошей, і підтверджує його класифікацію серед головних проблем зі здоров'ям у західному світі. Алергія є комплексним захворюванням. У явище сенсибілізації роблять внесок багато факторів. Серед них - індивідуальна чутливість, яка 9 визначається як поки що недостатньо зрозуміла взаємодія між декількома генами. Іншим важливим фактором є піддавання впливу алергену вище певних порогових величин. У процесі сенсибілізації важливими можуть бути окремі фактори навколишнього середовища, включаючи забруднення, дитячі інфекції, паразитарні інфекції, кишкові мікроорганізми і т.д. Якщо особа була колись сенсибілізована, і встановилася алергічна імунна відповідь, присутність лише незначних кількостей алергену ефективно перетворюється на симптоми. Нормальний перебіг алергічного захворювання звичайно супроводжується погіршенням на двох рівнях. По-перше, це прогресування симптомів і тяжкості захворювання. Наприклад, це прогресування від сінної пропасниці до астми. Подруге, найчастіше відбувається поширення специфічних алергенів, що призводить до алергічної мультиреактивності. Хронічне запалення призводить до загального ослаблення механізмів захисту слизової оболонки, що дає у результаті неспецифічне подразнення і, в кінцевому підсумку, руйнування слизової тканини. Немовлята можуть ставати сенсибілізованими, головним чином, до їжі, тобто молока, що призводить до екземи або шлунково-кишкових розладів; однак найчастіше вони спонтанно переростають ці симптоми. Ці немовлята мають ризик розвитку інгаляційної алергії пізніше у своєму Житті. Найважливіші джерела алергенів знаходяться серед найпоширеніших частинок певного розміру у повітрі, яким ми дихаємо. Ці джерела є у найвищій мірі універсальними і включають пилок трав та частинки фекалій кліщів у домашньому пилові, які разом є відповідальними за приблизно 50% всіх алергій. Загальну важливість також має лупа тварин, а саме, лупа котів і собак, інший пилок, такий як пилок полину звичайного, і мікроскопічні грибки, такі як Alternaria. На регіональній основі може домінувати інший пилок, такий як пилок берези у Північній і Центральній Європі, амброзії у Східних і Центральних Сполучених Штатах, та пилок японського кедра в Японії. Комахи, а саме отрута бджіл і ос, та харчові продукти є причинами приблизно 2% (для кожної причини) усіх алергій. Алергія, тобто гіперчутливість І типу, спричиняється невідповідною імунологічною реакцією на чужорідні непатогенні речовини. Важливі клінічні прояви алергії включають астму, сінну пропасницю, екзему та шлунково-кишкові розлади. Алергічна реакція є негайною і досягає максимуму в межах 20 хвилин після контакту зі специфічним алергеном. Крім того, алергічна реакція є специфічною у тому сенсі, що конкретна особа є чутливою до конкретного алергену (алергенів), тоді як ця особа необов'язково показує алергічну реакцію на , інші речовини, відомі як такі, що викликають алергічне захворювання. Алергічний фенотип характеризується вираженим запаленням слизової оболонки органа-мішені і присутністю алергенспецифічних антитіл класу IgE у кровообігу та на поверхні тучних клітин і базофілів. Алергічний напад ініціюється реакцією чужорідного алергену з алергенспецифічними антитілами IgE, коли антитіла зв'язані з високоафінними 93479 10 IgE специфічними рецепторами на поверхні тучних клітин і базофілів. Тучні клітини і базофіли містять заздалегідь сформовані медіатори, тобто гістамін, триптазу та інші речовини, які вивільняються при перехресному зшиванні двох або більшої кількості зв'язаних з рецептором антитіл IgE. Антитіла IgE перехресно зшиваються шляхом одночасного зв'язування однієї молекули алергену. Отже, виходить, що чужорідна речовина, яка має лише один епітоп, що зв'язує антитіло, не ініціює алергічну реакцію. Перехресне зшивання зв'язаних з рецепторами IgE на поверхні тучних клітин також призводить до вивільнення сигнальних молекул, відповідальних за атракцію еозинофілів, алергенспецифічних Т-клітин та інших типів клітин до місця алергічної реакції. Ці клітини у взаємодії з алергеном, IgE та ефекторними клітинами призводять до поновленого спалаху симптомів, що відбувається через 12-24 години після зіткнення з алергеном (пізня фаза реакції). Терапія алергічного захворювання включає діагностику і лікування, включаючи профілактичне лікування. Діагностика алергії стосується виявлення алергенспецифічного IgE та ідентифікації джерела алергену. У багатьох випадках ретельного анамнезу може бути достатньо для діагностики алергії і для ідентифікації матеріалу - джерела специфічного алергену. Однак найчастіше діагноз підтверджується об'єктивними заходами, такими як шкірна проба з наколюванням, аналіз крові або провокаційний тест. Терапевтичні варіанти поділяються на три основні категорії. Першою можливістю є уникання алергену або зменшення експозиції. Тоді як уникання алергену є очевидним, наприклад, у випадку харчових алергенів, воно може бути складним або дорогим, як для кліщових алергенів домашнього пилу, або може бути неможливим, як для пилкових алергенів. Другим і найбільш широко застосовуваним терапевтичним варіантом є призначення класичних симптоматичних лікарських засобів, таких як антигістамінні засоби і стероїди. Симптоматичні лікарські засоби є безпечними та ефективними; однак вони не змінюють справжню причину захворювання і не контролюють поширення захворювання. Третьою терапевтичною альтернативою є специфічна алергічна вакцинація, яка у більшості випадків зменшує або полегшує симптоми алергії, спричинені алергеном, про який йде мова. Стандартна специфічна алергічна вакцинація є причинним лікуванням алергічного захворювання. Вона перешкоджає основним імунологічним механізмам, призводячи до стійкого поліпшення імунного статусу пацієнтів. Таким чином, захисний ефект специфічної алергічної вакцинації поширюється за межі періоду лікування, на відміну від симптоматичної терапії лікарськими засобами. Деякі пацієнти, що одержують лікування, виліковуються, і, крім того, більшість пацієнтів відчувають полегшення тяжкості захворювання і симптомів, яких вони зазнають, або, принаймні, уповільнення загострення захворювання. Таким чином, специфічна алергічна вакцинація має профілактичний вплив, зменшуючи ризик розвитку 11 сінної пропасниці в астму, і зменшуючи ризик розвитку нової чутливості. Імунологічний механізм, що лежить в основі успішної алергічної вакцинації, невідомий у деталях. Специфічна імунна відповідь така як продукування антитіл проти конкретного патогену, відома як адаптивна імунна відповідь. Цю відповідь можна відрізнити від вродженої імунної відповіді, яка є неспецифічною реакцією по відношенню до патогенів. Алергічна вакцина зв'язується, щоб спрямувати адаптивну імунну відповідь, яка включає клітини і молекули з антигенною специфічністю, такі як Т-клітини і В-клітини, що продукують антитіла. В-клітини не можуть дозрівати до клітин, що продукують антитіла, без допомоги Т-клітин відповідної специфічності. Т-клітини, які беруть участь у стимулюванні алергічної імунної відповіді, є, в основному, клітинами Th2 типу. Встановлення нового балансу між Th1 і Th2 клітинами було запропоноване як корисне і головне для імунологічного механізму специфічної алергічної вакцинації. Чи було це викликане зменшенням кількості Th2 клітин, зсув від Th2 до Th1 клітин або підвищувальна регуляція Th1 клітин є сумнівними. Останнім часом було припущено, що регуляторні Т-клітини є важливими для механізму алергічної вакцинації. Відповідно до цієї моделі, регуляторні Т-клітини, тобто Th3 або Тr1 клітини здійснюють знижувальну регуляцію як Th1, так і Th2 клітин відповідної антигенної специфічності. Незважаючи на ці неоднозначності, загалом вважають, що активна вакцина повинна мати здатність стимулювати алергенспецифічні Т-клітини, переважно ТН1 клітини. Специфічна алергічна вакцинація, незважаючи на свої достоїнства, не набула широкого розповсюдження, головним чином, з двох причин. Однією причиною є незручності, пов'язані з традиційною програмою вакцинації, що включає повторні вакцинації, такі як ін'єкції через декілька місяців. Іншою причиною, що більш важливо, є ризик алергічних побічних реакцій. Звичайні вакцинації проти інфекційних агентів ефективно здійснюють, застосовуючи одну або декілька імунізацій з високою дозою. Однак цю стратегію не можна використовувати для вакцинації проти алергії, оскільки патологічна імунна відповідь уже діє. Отже, стандартну специфічну алергічну вакцинацію проводять, використовуючи багаторазові підшкірні імунізації, застосовуючи їх протягом тривалого періоду часу. Курс розділяють на дві фази, фазу зростаючого дозування і фазу підтримання. У фазі зростаючого дозування застосовують дози, що збільшуються, типово протягом 16-тижневого періоду, починаючи з незначних доз. Коли досягається рекомендована доза підтримання, цю дозу застосовують для фази підтримання, типово з ін'єкціями кожних шість тижнів. Після кожної ін'єкції пацієнт повинен залишатися під медичним наглядом протягом 30 хвилин через ризик анафілактичних побічних реакцій, які, в принципі, хоча і є надзвичайно рідкісними, можуть бути небезпечними для життя. Крім того, клініка повинна бути обладнана так, щоб підтримувати невідкладну терапію. Без сумніву, вакцина, що ґрунтується на відмінному шляху введення, могла б виключити або змен 93479 12 шити ризик алергічних побічних реакцій, властивих сучасній вакцині, що ґрунтується на підшкірному введенні, а також сприяти більш широко розповсюдженому використанню, імовірно, навіть уможливлюючи самовакцинацію вдома. Спроби удосконалити вакцини для специфічної алергічної вакцинації робилися протягом більше ніж 30 років і включали різноманітні підходи. Деякі підходи були спрямовані на сам алерген через модифікацію реактивності IgE. Інші були спрямовані на даний шлях введення. Імунна система є досяжною через ротову порожнину, і сублінгвальне застосування алергенів є відомим шляхом введення. Умовно, алергічна вакцина, що використовує шлях введення крізь слизову оболонку рота, складається з періодичних дозувань розчину алергену з проміжками між ними, принаймні, один день. Для порівняння, дані терапевтичні (кумулятивні) дози підтримання перевищували підтримання порівнянної підшкірної дози у 5-500 разів. Очевидними недоліками цієї лікарської форми і шляху введення є проблеми, пов'язані з правильним і однаковим самостійним застосуванням пацієнтом точної дози (може бути необхідним дати декілька крапель, однаковість окремих крапель, правильність місця застосування і т.п.). Крім того, існує необхідність зберігати лікарський препарат у холоді та включати до його складу консерванти. Netien et al. ("Galenica 16-Medicaments homeopathiques" ed. 2, 1986, pp.77-99) розкриває рідкий розчин, яким просочені тверді частинки (гранули) або звичайні пресовані таблетки лактози, сахарози або їхніх сумішей для сублінгвального застосування ліків, таких як алергени. DD-A. 0 107 208 розкриває спосіб приготування звичайних пресованих таблеток, що містять алерген. При застосуванні таблетка розчиняється за допомогою слини, і алерген далі всмоктується крізь слизову оболонку ротової порожнини. Ця композиція містить нерозчинний у воді наповнювач, а саме тальк, а також парафін і жирні кислоти, який є небажаним, оскільки він залишатиме неприємний залишок у роті пацієнта. Крім того, тертя, створюване під час процесу таблетування, може бути згубним для фізичної стабільності алергенів. ЕР 278 877 розкриває фармацевтичну композицію для сублінгвального використання, де твердий носій покривають розчином алергену при розпиленні розчину на глобули твердого носія. Стверджують, що одержана в результаті композиція подрібнюється швидко, але не миттєво. Однак не розкрито, як досягнути цієї мети. Крім того, композиція містить відновлювальні цукрі, у формі лактози, які схильні реагувати з алергенами. Для того, щоб гарантувати, що максимальна кількість застосованої дози певного алергену є присутньою на слизовій оболонці ротової порожнини і, крім того, що час контакту подрібненого продукту з слизовою оболонкою є максимізованим, дуже важливо, щоб лікарська форма подрібнювалася миттєво при контакті зі слиною ротової порожнини. Швидкодисперговані тверді лікарські фор 13 ми, які легко вивільняють активний інгредієнт у ротовій порожнині, є відомими у даній галузі. Патент США №4371516 розкриває лікарські форми, що містять активні інгредієнти, які швидко подрібнюються у воді. Ці лікарські форми включають відкритий матриксний каркас речовини-носія, яка подрібнюється у межах 10 секунд. Носій на основі ліофілізованого риб'ячого желатину, як розкрито у WO 00/61117, призначений для вивільнення активного інгредієнта миттєво при контакті з слиною, коли його застосовують у ротовій порожнині. Носій з ліофілізованого модифікованого крохмалю, як розкрито у WO 00/44351, призначений для вивільнення активного інгредієнта миттєво при контакті з слиною, коли його застосовують у ротовій порожнині. WO 99/21579 розкриває швидко дисперговану лікарську форму, яка включає вакцину та ад'ювант для перорального застосування. WO 02/13858 розкриває швидкорозчинну фармацевтичну композицію, що містить вакцини, у формі швидкорозчинного "коржа" для перорального застосування. Метою WO 02/13858, очевидно, є забезпечення вірусних або бактеріальних вакцин, що залишатимуться неушкодженими у шлунковокишковому тракті. Це досягається шляхом захисту антигену від кислотного вмісту шлунку за допомогою введення у "корж" антацидів, таких як карбонат кальцію. WO 00/51568 розкриває швидко подрібнювану пресовану таблетку з низькою крихкістю, призначену для розчинення у роті при контакті зі слиною менше ніж за 30 секунд, з утворенням легкої для ковтання суспензії. У патенті США №4371516 стверджується, що ця композиція є корисною для пероральних вакцин. У випадку WO 00/61117, WO 00/44351, WO 99/21579 і WO 02/13858 також стверджується, що ці винаходи спрямовані на неінфекційні імуномодульовані стани, такі як системні алергічні стани, наприклад, сінна пропасниця. Однак в жодній з цих заявок не розкривається технічна інформація або приклади того, як може бути виготовлена швидко диспергована тверда лікарська форма алергенної вакцини. Наприклад, у жодній з розкритих композицій немає вказівок щодо придатного дозування певного алергену. Дуже важливо призначити пацієнту правильне дозування алергену, оскільки надмірна доза може викликати у пацієнта анафілактичний шок. До того ж, немає уявлення або вказівок щодо відповідних заходів по відношенню до стабільності або крихкості таких композицій. Даний винахід стосується фармацевтичного препарату, що включає швидко дисперговану не пресовану тверду лікарську форму алергену, придатну для застосування на слизову оболонку рота, яка характеризується тим, що ця лікарська форма є стабільною, достатньо міцною і не вивільняє небезпечні кількості залишку при маніпулюванні нею пацієнтом, та містить принаймні один алерген і основу. Крім того, фармацевтичний препарат, що включає швидко дисперговану не пресовану твер 93479 14 ду лікарську форму, придатну для застосування на слизову оболонку рота, містить речовину, що формує основу, алерген, де цей алерген є стабільним, і лікарська форма має низьку крихкість по відношенню до вивільнення алергену, лікарська форма розчиняється швидко і не потребує ад'юванту. Зокрема, винахід стосується фармацевтичного препарату, придатного для застосування алергену, що включає швидко дисперговану не пресовану тверду лікарську форму, придатну для застосування на слизову оболонку рота, яка включає: a) основу, утворену з принаймні однієї речовини, що формує основу, і b) ефективну дозу алергену для десенсибілізації особи до зазначеного алергену, де c) втрата вмісту алергену у зазначеній лікарській формі є меншою ніж 50% від початкового вмісту алергену після зберігання протягом 3 місяців при температурі 25°С і відносній вологості 60%, і d) втрати із зазначеної твердої лікарської форми є меншими ніж приблизно 0,5мкг екстракту алергену або меншими ніж приблизно 0,05мкг основного алергену, коли вона піддається випробуванню на крихкість. В одному переважному втіленні винаходу тверда лікарська форма містить риб'ячий желатин і манітол як речовини, що формують основу. В іншому переважному втіленні винаходу тверда лікарська форма містить крохмаль і манітол як речовини, що формують основу. Даний винахід також забезпечує способи виробництва цих твердих лікарських форм і способи лікування алергії шляхом застосування цих твердих лікарських форм. Детальний опис винаходу Даний винахід ґрунтується на ряді несподіваних знахідок, жодна з яких не могла б з обґрунтованим очікуванням успіху бути передбаченою апріорі. По-перше, він ґрунтується на висновку, що швидко дисперговану не пресовану лікарську форму можна використовувати для приймання алергену, і що можна досягнути ефективного лікування алергії за допомогою використання такої композиції. Зокрема, було показано, що дійсно можна досягнути доставки достатньої кількості алергену до імунної системи пацієнта через слизову оболонку рота, використовуючи швидко дисперговану не пресовану тверду лікарську форму без викликання небажаного рівня побічних ефектів. Крім того, даний винахід забезпечував придатні рівні доз для одержання терапевтичного ефекту без неприйнятних побічних ефектів. По-друге, винахід ґрунтується на висновку, що ефективне лікування можна одержати за допомогою використання швидко диспергованої не пресованої лікарської форми без використання ад'юванту. По-третє, винахід ґрунтується на висновку, що можна створити композицію алергену у вигляді швидко диспергованої не пресованої лікарської форми, у той же час відповідаючи особливим вимогам, що висуваються алергеном, відносно ста 15 більності і низької крихкості. Зокрема, було показано, що можна урівноважити протилежно спрямовані вимоги щодо того, що лікарська форма повинна бути швидко диспергованою, з одного боку, та бути стабільною і мати низьку крихкість, з іншого боку, для того щоб одержати лікарську форму, яка у достатній мірі є швидко диспергованою, стабільною і має низьку крихкість. Білки алергену є чутливими до деградації, на яку впливає ряд факторів навколишнього середовища, в якому вони містяться. Для лікування алергії і, зокрема, для вакцинації проти алергії є придатним, що алерген доставляється неушкодженим до імунної системи у терапевтично значимих дозах. Таким чином, алерген повинен залишатися стабільним під час виробництва, зберігання і використання. Дана робота показала, що насправді можна створити композицію білків алергену у швидкодиспергованій непресованій лікарській формі, яка є стабільною по відношенню до доз алергену та алергенної активності. Крім того, несподівано було виявлено, що ці композиції є дійсно стабільними при кімнатній температурі. Ці дані мають суттєву важливість для процедур завантаження-розвантаження і транспортування кінцевого продукту. Холодильне зберігання на заводівиробнику, під час транспортування або під час зберігання в аптеці часто асоціюється з високою вартістю, оскільки холодильне обладнання необхідно ретельно контролювати, а інвестування у надійне холодильне обладнання є дуже дорогим. Разом з тим, по відношенню до схвалення пацієнта, також є переважним, якщо лікарську форму можна зберігати при кімнатній температурі. Таким чином, дана робота показала, що насправді можна створити композицію білків алергену у швидкодиспергованій непресованій лікарській формі, яка є терапевтично ефективною без необхідності у ад'юванті. До того ж, далі такі тверді лікарські форми, що містять алерген, є стабільними при сприятливих умовах. Коли білки алергену знаходяться у складі швидко диспергованої не пресованої лікарської форми, є додатково вигідним, що одержана у результаті лікарська форма суттєво не вивільняє алергени в оточуюче середовище або на особу, що здійснює маніпуляції з лікарською формою, при безпосередньому контакті. Апріорі, непресовані швидкодисперговані тверді лікарські форми характеризуються низькою механічною міцністю у порівнянні з пресованими таблетками внаслідок вроджених властивостей не пресованої основи, яка є крихкою і ламкою, майже подібною до вафлі. Під час, наприклад, пакування, зберігання, транспортування і маніпуляцій пацієнта з лікарською формою залишкові частинки, що містять алерген, можуть вивільнятися у навколишнє середовище і на пацієнта. Це особливо шкідливо, коли активним інгредієнтом є алерген, оскільки алерген може викликати алергічну реакцію у схильної до цього особи або стимулювати алергічну реакцію; такі сенсибілізація або алергічна відповідь є залежними від дози. Були запропоновані максимально допустимі рівні для забруднення навколишнього середовища у формі, наприклад, алергену у пилові, 93479 16 в залежності від алергену, про який йде мова, вони доходять до 2 мікрограмів основного алергену на грам домашнього пилу. (Allergy. Principles and practice (1993, 4 ed.), Mosby-Year book, Vol. I, page 520). Непресовані швидкодисперговані тверді лікарські форми, які виробляють шляхом видалення рідини із затверділої системи, що включає речовини, які формують основу, активний інгредієнт та інші необов'язкові речовини, переважно виробляють in situ. Виробничий процес in situ звичайно включає видалення розчинника із затверділої системи активного інгредієнта та наповнювачів, що формують основу, всередині кінцевої упаковки, такої як блістерна упаковка. Технологія in situ, використовувана в промислових масштабах, не дозволяє покриття лікарської форми. Застосування покриття лікарської форми могло б у більшості випадків вплинути на диспергування твердої лікарської форми, таким чином ризикуючи властивостями негайного вивільнення лікарської форми. Отже, незважаючи на діаметрально протилежну природу цих вимог, дана робота показала, що насправді можна створити ефективні дозування білків алергену у швидкодиспергованій непресованій лікарській формі, у той же час одержуючи низьку крихкість і підтримуючи властивість швидкого диспергування. Всі вищезгадані висновки підтверджуються експериментальною лабораторною роботою або доклінічними випробуваннями з використанням експериментальних тварин, де це є застосовним, або клінічними випробуваннями, де це є застосовним. Термін "швидко диспергована лікарська форма" стосується лікарських форм, які подрібнюються менше ніж за приблизно 90 секунд, переважно, менше ніж за приблизно 60 секунд, переважно, менше ніж за приблизно 30 секунд, більш переважно, менше ніж за приблизно 20 секунд, навіть більш переважно, менше ніж за приблизно 10 секунд у ротовій порожнині, навіть більш переважно, менше ніж за приблизно 5 секунд, і найбільш переважно, менше ніж за приблизно 2 секунди після поміщення у ротову порожнину. Тверда лікарська форма за даним винаходом може бути у формі таблеток, капсул, пастилок або каплет. Терміни таблетки, тверда лікарська форма і вакцина вживають тут почергово. Термін "стабільний" стосується лікарських форм, де втрата у вмісті алергену принаймні одного основного алергену є меншою ніж 50% від початкового вмісту, виміряного відповідно до методу ELISA (твердофазного імуноферментного аналізу), як описано в Obispo et al. (Allergy, 1997, 52, pp.806813) з використанням алергенспецифічних реагентів, після зберігання протягом 3 місяців при 25°С і відносній вологості 60%. Термін "низька крихкість" стосується кількості матеріалу, що містить алерген, яка втрачається з лікарської форми, коли її піддають дії зовнішньої сили. Тверда лікарська форма має достатню крихкість і міцність, щоб її можна було транспортувати, зберігати і проводити маніпуляції, якщо втрати матеріалу, що містить алерген, містять менше ніж 17 0,5мкг екстракту алергену або 0,05мкг основного алергену на тверду лікарську форму. Для цілей даного винаходу крихкість може бути виміряна за допомогою способу за даним винаходом. Термін "не пресована" стосується твердої лікарської форми, яку виробляють шляхом видалення рідини із затверділої системи, що містить речовини, які формують основу, активний інгредієнт та інші придатні інгредієнти, одержуючи у результаті тверду основу, яка містить алерген. Термін "тверда лікарська форма" стосується одиничної лікарської форми, яка не є рідиною або порошком, коли її застосовують у ротовій порожнині. "Міцність на розтягнення σ" розраховують відповідно до такого рівняння: σ=3Wa×9,8Нмм-2/2d2b де w = максимальне навантаження до руйнування (кгс) а = відстань між опорами d = товщина швидко диспергованої твердої лікарської форми (мм) b = діаметр швидко диспергованої лікарської форми (мм) "Максимальне навантаження до руйнування" означає максимальне зусилля, необхідне для руйнування об'єкта у три-точковому випробуванні на згин з використанням відповідного інструменту (наприклад, СТ5, Engineering Systems, 1 Loach Court, Radford Bridge Road, Nottingham NG8 1NA, UK). Термін "оромукозальна" стосується лікарської форми, яку необхідно помістити під язик або ще де-небудь у ротовій порожнині, що дозволяє активному інгредієнту стикатися з слизовою оболонкою ротової порожнини або глоткою пацієнта. Термін "алерген" стосується будь якого природного білка або сумішей білків, про які повідомлялося, що вони викликають алергічні, тобто опосередковані IgE реакції при їхньому повторному впливові на особу. Приклади природних алергенів включають пилкові алергени (алергени пилку дерев, бур'янів, трав'янистих рослин і злаків), кліщові алергени (наприклад, кліщів домашнього пилу і кліщів сховища), алергени комах (інгаляційні алергени, алергени-похідні слини та отрути), алергени тварин, наприклад, зі слини, шерсті і лупи, наприклад, собак, котів, коней, пацюків, мишей і т.д., грибкові алергени і харчові алергени. Алерген може бути використаний у формі екстракту алергену, очищеного алергену, модифікованого алергену або рекомбінантного алергену, або рекомбінантного мутантного алергену, будь-якого фрагмента алергену довжиною понад 30 амінокислот, або будь-якого їхнього поєднання. Вираз "екстракт алергену", як вжито тут, стосується екстракту, одержаного шляхом екстракції біологічного матеріалу - джерела алергену, як у загальних рисах описано в "Allergenic extracts", Η. Ipsen et al, розділ 20 в "Allergy, principle and practise" (Ed. S. Manning) 1993, Mosby-Year Book, St. Louis. Такий екстракт може бути одержаний шляхом водної екстракції водорозчинного матеріалу, супроводжуваної етапами очищення, такого як фільтрування, щоб одержати розчин, тобто екстракт. Потім екстракт може піддаватися подальшому очищенню і/або обробленню, такому як су 93479 18 шіння сублімацією (ліофілізація) з суттєвим видаленням. Загалом, екстракт алергену містить суміш білків та інших молекул. Білки алергену часто класифікують як основний алерген або другорядний алерген. Екстракт алергену звичайно містить як основний, так і другорядний алергени. Основні алергени, як правило, складатимуть приблизно 515% середнього екстракту алергену, частіше близько 10%. Класифікація алергенів ґрунтується на оцінці клінічної значимості конкретного алергену і наведена нижче. Приклади важливих основних алергенів, виявлених в екстрактах, включають алергени злаків групи 1 та 5 і 6 (наприклад, Phi р 1, 5 і 6), кліщові алергени пилу групи 1 і 2 (наприклад, Der р 1, Der р 2), алерген пилку дерев 1 (Bet v 1), алергени кедрового пилку 1 і 2 (наприклад, Cry j I, Cry j 2), пилку амброзії 1 і 2 (Amb a 1, Amb a 2), котячий алерген 1 (тобто Fel d 1). Особа з середньою алергією буде чутливою до і реагуватиме на один або більшу кількість основних алергенів, і далі може також ставати чутливою до та реагувати на другорядні алергени. Кількості екстракту алергену, згадані тут, стосуються вмісту сухої речовини таких екстрактів алергену. Переважно, вміст води у сухій речовині не перевищує 10%, більш переважно, 5%, за масою. Вираз "біологічний матеріал - джерело алергену", як вжито тут, стосується будь-якого біологічного матеріалу, що містить один або більшу кількість алергенів. Прикладами таких матеріалів є акариди РМВ (чисте тіло кліща) або WMC (повна кліщова культура), знежирений або не знежирений пилок, наприклад, злаків, трав'янистих рослин, бур'янів і дерев, шерсть і лупа тварин, шкіра, міцелій і спори грибків, тіло, отрута або слина комах, та харчові продукти. Біологічні матеріали - джерела алергенів можуть містити забруднюючі матеріали, такі як чужорідний пилок і уламки рослин та квітів для пилкового матеріалу - джерела алергенів. Ступінь забруднення має бути мінімізований. Переважно, вміст забруднюючих речовин не повинен перевищувати 10% (за масою) біологічного матеріалу - джерела алергенів. Звичайно екстракт алергену містить принаймні 10% білка від вмісту сухої речовини екстракту алергену, як визначено у стандартному аналізі білка, такому як ВСА або реакція Лоурі, а залишок складається з іншого "небілкового матеріалу", який може бути компонентами, такими як ліпіди, вуглеводи або зв'язана вода, що походять з біологічного джерела алергенів. Екстракт алергену може бути виготовлений як композиція і зберігатися у формі ліофілізованого матеріалу, одержуваного шляхом сушіння сублімацією рідкого екстракту алергену під тиском нижче 800 мікробарів і протягом періоду до 100 годин, з видаленням води. У галузі екстрактів алергенів не існує міжнародного загальноприйнятого методу стандартизації. Існує ряд різних одиниць сили екстракту, тобто біоефективності. Застосовані методи і використані одиниці звичайно вимірюють вміст алергену та біологічну активність. Прикладами цього є SQ 19 одиниці (одиниці стандартизованої якості), БАО (біологічні алергенні одиниці), БО (біологічні одиниці), ОМ (одиниці маси), МО (міжнародні одиниці) та ПР (показник реактивності). Отже, якщо використовують екстракти іншого походження, ніж ті, що розкриті тут, їх необхідно стандартизувати по відношенню до екстракту, розкритого тут, для того щоб визначити їхню активність у SQ-одиницях. Цю тему обговорюють в "Allergenic extracts", Η. Ipsen et al, розділ 20 в "Allergy, principle and practise" (Ed. S. Manning) 1993, Mosby-Year Book, St. Louis і L0wenstein Н. (1980) Arb Paul Ehrlich Inst 75:122. Біоефективність, тобто алергенна активність in vivo, даного екстракту залежить від ряду факторів, найважливішим є вміст основних алергенів в екстракті, який змінюється в залежності від складу біологічного матеріалу - джерела алергенів. Кількість екстракту алергену в грамах, яка має бути використана для одержання бажаної біоефективності, змінюється в залежності від типу екстракту, про який іде мова, і для даного типу екстракту кількість екстракту алергену змінюється від однієї серії до іншої в залежності від біоефективності екстракту. Для даної серії екстракту кількість екстракту алергену в грамах, яка має бути використана для одержання бажаної біоефективності, можна визначити з використанням такої методики: a) Біоефективність різних кількостей еталонного екстракту визначають, використовуючи одне або більшу кількість імунологічних випробувань in vivo, щоб встановити взаємозв'язок між біоефективністю та кількістю еталонного екстракту. Прикладами зазначених імунологічних випробувань in vivo є шкірна проба з наколюванням, кон'юнктивальна провокаційна проба, бронхіальна стимуляція алергеном та різні клінічні випробування, в яких відслідковують один або більше симптомів алергії, дивіться, наприклад, Haugaard et al., J Allergy Clin Immunol, Vol. 91, No. 3, pp.709-722, March 1993. b) На основі встановленого взаємозв'язку між біоефективністю та еталонним екстрактом вибирають біоефективність однієї або більшої кількості придатних доз для використання у лікарських формах за даним винаходом, з належною увагою до урівноваження факторів і) ефекту лікування або полегшення симптомів алергії, іі) побічних ефектів, зареєстрованих в імунологічних випробуваннях in vivo, та ііі) мінливості і) та іі) від однієї особи до іншої. Урівноваження здійснюють, щоб одержати максимальний адекватний терапевтичний ефект, не зазнаючи несприятливого рівня побічних ефектів. Спосіб урівноваження цих факторів є добре відомим фахівцям у даній галузі. Виявлена біоефективність однієї або більшої кількості придатних доз може бути виражена у будь-яких доступних одиницях біоефективності, таких як SQ-одиниці, БАО, одиниці ПР, МО, порівняйте вище. c) 3 еталонного екстракту готують один або більшу кількість еталонних за біоефективністю стандартних екстрактів і, якщо використовують, одиничні значення біоефективності еталонних стандартних екстрактів розраховують на основі одиничного значення біоефективності, призначе 93479 20 ного одній або більшій кількості придатних доз. Наприклад, такий стандарт для БАО може бути одержаний від FDA (Управління по контролю за харчовими і лікарськими продуктами США), як ілюстровано нижче. d) Для еталонних стандартних екстрактів кожного типу екстракту вибирають ряд параметрів для оцінювання біоефективності екстрактів. Прикладами таких параметрів оцінки є загальна алергенна активність, кількість основних алергенів і загальний хімічний склад екстракту. Загальну алергенну активність можна виміряти, використовуючи конкурентний імунологічний аналіз in vitro, такий як ELISA і MagicLite® імунолюмінісцентний аналіз (LIA), з використанням стандартизованої суміші антитіл, вирощеної проти екстракту, одержаного з використанням стандартних методів, наприклад, антитіла, вирощені у мишей або кролів, або пул сироватки крові пацієнтів з алергією. Вміст основних алергенів можна виміряти, наприклад, допомогою ракетного імуноелектрофорезу (RIE) і порівняти з еталонними стандартами. Загальний хімічний склад можна дослідити, використовуючи, наприклад, перехресний імуноелектрофорез (СІЕ) та електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію (SDS-PAGE). є) Для даної серії екстракту невідомої біоефективності (дослідного екстракту) кількість екстракту, яку слід використати для одержання бажаного рівня біоефективності (ефективна доза для використання у твердій лікарській формі за даним винаходом), можна визначити наступним чином. Для кожного вибраного параметра оцінювання дослідний екстракт порівнюють з еталонними стандартними екстрактами, використовуючи релевантні методи вимірювання, як описано вище, і на основі результатів вимірювання розраховують кількість екстракту, що має бажану біоефективність. SQ-одиниця: SQ-одиницю визначають відповідно до ALK-Abello A/S методу стандартизації "SQ біоефективність", де 100 000 SQ-одиниць дорівнюють стандартній підшкірній дозі підтримання. Звичайно 1мг екстракту містить від 100000 до 1000000 SQ-одиниць, в залежності від джерела алергену, з якого вони походять, і застосованого виробничого процесу. Точну кількість алергену можна визначити за допомогою імунологічного аналізу, тобто загальний вміст основного алергену і загальну алергенну активність. БАО (біологічні алергенні одиниці) є одиницями біологічної активності, як визначено відповідно до вимог Управління по контролю за харчовими і лікарськими продуктами США для алергенних продуктів, описаних у "Quantitative determination of relative potency of allergenic extracts" ("Methods of the allergen products testing Laboratory" "ELISA competition assay". Page 15, #49N-0012, FDA, October 1993). Доза 100 000 SQ-одиниць, що містить екстракт злаків, відповідно до вищезазначеного методу, дорівнює вмісту - 2600-4700 БАО. Подібним чином, відповідно до вищезазначеного методу можна оцінити інші екстракти. "Ефективна доза алергену для десенсибілізації" повинна означати одну або більше доз або режимів дозування алергену, здатних полегшити 21 алергічні симптоми при застосуванні. Клінічні симптоми алергії включають риніт, кон'юнктивіт, астму, кропив'янку, екзему, які включають реакції шкіри, очей, носа, верхніх і нижніх дихальних шляхів із загальними симптомами, такими як почервоніння і свербіж очей і носа, свербіж у носі і нежить, кашель, свистяче дихання, задишка, свербіж і набряк тканин. "Рівномірність вмісту", як вжито тут, стосується відхилення одиниці доз від встановленої дози. "Вміст води", як вжито тут, стосується вмісту залишкової води в одиниці твердої лікарської форми, визначеного кількісно з використанням принципу титрування за Карлом Фішером. Цей метод оснований на тому принципі, що задана кількість L2 призводить до перетворення еквівалентної кількості води (Європейська Фармакопея, 3 видання, 2.5.12). Як вжито тут, "активність води aw" є ефективною водою у зразку. Вимірювання активності води проводять з використанням методів, відомих фахівцеві у даній галузі, наприклад, технології точки роси на охолодженому дзеркалі, відносної вологості з сенсорами, що змінюють електричний опір або ємнісний опір, або використовуючи хлориднолітієвий електрод. aw можна розрахувати відповідно до такого рівняння: aw=p/ps=ERH(%)/100 де р = парціальний тиск водяної пари на поверхні продукту, ps = тиск насиченої пари або парціальний тиск водяної пари над чистою водою при температурі продукту, ERH = рівноважна відносна вологість. Термін "приблизно" або "близько" означає в межах прийнятного діапазону для окремого значення, як визначає фахівець у даній галузі, який буде частково залежати від того, як це значення вимірюють або визначають, наприклад, обмежень системи вимірювання. Наприклад, "приблизно" може означати діапазон до 20%, переважно, до 10%, більш переважно, до 5%, і все ж більш переважно, до 1% від заданого значення. У цей час несподівано було виявлено, що тверда лікарська форма за даним винаходом забезпечує оромукозальну алергенну вакцину, яка забезпечує ефективні дози алергену, що дають алергенспецифічну імунну відповідь у залежний від дози спосіб і мають прийнятні побічні ефекти. Далі було виявлено, що дійсно можливо виробляти не пресовану швидко дисперговану тверду лікарську форму з низькою крихкістю, що містить алергени, яка є достатньо міцною і не вивільняє небезпечні кількості залишку при маніпулюванні нею пацієнтом. Крім того, несподівано було виявлено, що ці композиції є стабільними при кімнатній температурі. Алергени в тій чи іншій мірі є особливо чутливими до деградації у водному середовищі, такому як водний розчин алергену або продукт з високим вмістом води і/або високою активністю води. 93479 22 Монографія Європейської Фармакопеї для алергенних продуктів і "Note for guidance on allergen products" CPMP (Комітету з патентованих лікарських препаратів) (Лондон, 13 березня 1996) встановлюють, що для ліофілізованих препаратів (наприклад, екстрактів алергенів у флаконах) рівні вологості не повинні перевищувати 5%, і ці препарати потрібно зберігати замороженими (-20°С). Холодильне зберігання (2-8°С) є також вимогою для сублінгвальних композицій на рідкій основі, які далі мають обмежений термін придатності при зберіганні. Несподівано було виявлено, що алергени, включаючи нестійкі алергени, є стабільними алергенами за умов кімнатної температури. Навіть лікарські форми за даним винаходом, що мають вміст води вищий, ніж встановлений максимальний рівень 5%, є стабільними при кімнатній температурі. Не прив'язуючись до теорії, це можна пояснити тим фактом, що наповнювачі швидко диспергованої твердої лікарської форми зв'язують воду, що залишається у лікарській формі, і зменшують активність води алергенної твердої лікарської форми. Отже, зменшуючи активність води композиції, можна одержати стабільну лікарську форму без деградації алергену, навіть якщо вміст води є вищим, ніж максимальний рівень 5%, що встановлений для екстрактів алергенів у флаконах. Активність води є одним із важливих факторів, що роблять внесок у термін придатності при зберіганні препарату. Добре відомо, що активність води препарату впливає на ріст бактерій, так само як на стабільність, активність і консистенцію фармацевтичних препаратів. Активність води також суттєво впливає на стабільність білків, завдяки відносно ламкій природі білків. Більшість білків повинні підтримувати конформацію, щоб залишатися активними. Підтримання низьких рівнів активності води допомагає попередити або відволікти конформаційні зміни, які пізніше є важливими для забезпечення того, що білок у формі алергену є стабільним. Також активність води впливає на гідролітичну деградацію білків, спричинену ферментами чи ні. Більше того, вважають, що вміст води буде впливати на механічну міцність твердої лікарської форми. Загалом, високі показники збільшуватимуть ризик того, що тверда лікарська форма більше розпливатиметься, тоді як нижчий показник впливатиме на міцність твердої лікарської форми, наприклад, тверда лікарська форма ставатиме більш крихкою і ламкою. Вимірювання активності води проводять з використанням методів, відомих фахівцеві у даній галузі, наприклад, технології точки роси на охолодженому дзеркалі, відносної вологості з сенсорами, що змінюють електричний опір або ємнісний опір, або використовуючи хлоридно-літієвий електрод. Активність води твердої лікарської форми переважно не перевищує 70% рівноважної відносної вологості, і переважно становить від 10% до 70% рівноважної відносної вологості, більш переважно, від 20% до 60% рівноважної відносної вологості, більш переважно, від 30% до 50% рівноважної 23 відносної вологості, і найбільш переважно, від 40% до 50% рівноважної відносної вологості. Вміст води у твердій лікарській формі, визначений відповідно до способу, описаного у прикладі 1, переважно не перевищує 25%, і переважно становить від 0,1% до 20%, більш переважно, від 0,5% до 15%, більш переважно, від 2% до 8%, більш переважно, від 4% до 7%, і найбільш переважно, від 4,5% до 6% води. Відповідно до одного втілення даного винаходу, алергенний терапевтичний лікарський засіб забезпечують у швидкодиспергованій твердій лікарській формі, яка швидко розчиняється у ротовій порожнині при контакті зі слиною, таким чином приводячи алерген у тісний контакт з імунологічно важливою тканиною слизової оболонки і дозволяючи алергену досягати її. Приклади природних алергенів включають пилкові алергени (алергени пилку дерев, трав'янистих рослин, бур'янів і злаків), алергени комах (інгаляційні алергени, алергени слини та отрути, наприклад, кліщові алергени, алергени тарганів і комарів, алергени отрути перетинчастокрилих), алергени шерсті і лупи тварин (наприклад, собак, котів, коней, пацюків, мишей і т.д.) і харчові алергени. Важливими пилковими алергенами з дерев, злаків і трав'янистих рослин є ті, що походять з таксономічних порядків Fagales (букові), Oleales (маслинові), Pinales (соснові) і родини Platanaceae (платанові), включаючи, наприклад, березу (Betula), вільху (Alnus), ліщину (Corylus), граб (Carpinus) і оливу (Оіеа), кедр (Cryptomeria та Juniperus), платан (Platanus), порядку Poales (злакові), включаючи, наприклад, злакові трави родів Lolium (райграс), Phleum (тимофіївка), Роа (тонконогі), Cynodon (свинорий), Dactylis, Holcus (бухарник), Phalaris, Secale (жито) і Sorghum (сорго), порядків Asterales (айстрові) і Urticales (кропив'яні), включаючи, наприклад, трав'янисті рослини родів Ambrosia (амброзія), Artemisia (полин) і Parietaria (пристінниця). Іншими важливими інгаляційними алергенами є алергени кліщів домашнього пилу роду Dermatophagoides і Euroglyphus, кліщів сховища, наприклад, Lepidoglyphys, Glycyphagus і Tyrophagus, алергени тарганів, комарів і бліх, наприклад, Blatella, t Periplaneta, Chironomus i Ctenocepphalides, і алергени ссавців, таких як коти, собаки і коні, алергени отрути, включаючи ті, що походять від комах, які жалять або кусають, таких як комахи з таксономічного порядку Hymenoptera (перетинчастокрилі), включаючи бджіл (надродина Apidae), ос (надродина Vespidea) та мурах (надродина Formicoidae). Важливими інгаляційними алергенами грибків є, наприклад, ті, що походять з родів Alternaria і Cladosporium. У більш переважному втіленні винаходу алергеном є Bet v 1, Aln g 1, Cor a 1 і Car b 1, Que a 1, Cry j 1, Cry j 2, Cup a 1, Cup s 1, Jun a 1, Jun a 2, Jun a 3, Ole e 1, Lig ν 1, Pla 1 1, Pla a 2, Amb a 1, Amb a 2, Amb t 5, Art ν 1, Art ν 2, Par j 1, Par j 2, Par j 3, Sal к 1, Ave e 1, Суп d 1, Суп d 7, Dae g 1, Fes p 1, Hoi 1 1, Lol ρ 1 і 5, Pha a 1, Pas n 1, Phi ρ 1, Phi p 5, Phi p 6, Poa p 1, Poa p 5, Sec с 1, Sec с 5, Sor h 1, Der f 1, Der f 2, Der p 1, Der p 2, Der p 7, Der m 1, Eur m 2, Gly d 1, Lep d 2, Bio 1 1, Tyr p 2, Bla g 1, 93479 24 Bla g 2, Per a 1, Fel d 1, Can f 1, Can f 2, Bos d 2, Equ с 1, Equ с 2, Equ с 3, Mus m 1, Rat n 1, Apis m 1, Арі m 2, Ves ν 1, Ves ν 2, Ves ν 5, Dol m 1, Dil m 2, Dol m 5, Pol a 1, Pol a 2, Pol a 5, Sol і 1, Sol і 2, Sol і 3 та Sol і 4, Alt a 1, Cla h 1, Asp f 1, Bos d 4, Mal d 1, Gly m 1, Gly m 2, Gly m 3, Ara h 1, Ara h 2, Ara h 3, Ara h 4, Ara h 5 або змішані гібриди від Molecular Breeding (Maxygen, Inc.) будь-яких з цих алергенів. У найбільш переважному втіленні винаходу алерген є алергеном пилку злаків, або кліщовим алергеном домашнього пилу, або алергеном амброзії, або алергеном кедра, або котячим алергеном, або алергеном берези. У ще одному втіленні винаходу швидко диспергована тверда лікарська форма включає принаймні два різні типи алергенів, кожен з яких походить з того ж самого джерела алергенів або походить з різних джерел алергенів. Наприклад, швидко диспергована тверда лікарська форма включає алергени злаків групи 1 і групи 5, або кліщові алергени групи 1 і групи 2 від різних видів кліщів і злаків, відповідно, антигени бур'янів, такі як алергени дрібної і гігантської амброзії, алергени різних грибків, таких як Alternaria і Cladosporium, алергени дерев, такі як алергени берези, ліщини, граба, дуба і вільхи, харчові алергени, такі як алергени арахісу, сої і молока. Алерген, включений до складу швидко диспергованої твердої лікарської форми, може бути у формі екстракту, очищеного алергену, модифікованого алергену, рекомбінантного алергену або мутантного рекомбінантного алергену. Алергенний екстракт природно м^же містити одну або більше ізоформ одного й того самого алергену, тоді як рекомбінантний алерген типово являє собою лише одну ізоформу алергену. У переважному втіленні алерген знаходиться у формі екстракту. В іншому переважному втіленні алерген є рекомбінантним алергеном. У додатковому переважному втіленні алерген є природним мутантом з низьким зв'язуванням IgE або рекомбінантним мутантом з низьким зв'язуванням IgE. Алергени можуть бути присутніми в еквімолярних кількостях, або співвідношення присутніх алергенів може змінюватися переважно аж до 1:20. У додатковому втіленні винаходу алерген з низьким зв'язуванням IgE є алергеном за WO 99/47680 або WO 02/40676 або PCT/DK03/00322 ("Мутантні алергени"). Для характеристики алергену доступними є декілька лабораторних випробувань. Найбільш широко використовуваними методами є електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію (SDS-PAGE), ізоелектрофокусування (IEF), перехресний імуноелектрофорез (СІЕ) і ракетний імуноелектрофорез (RIE). Визначення кількості окремих алергенів можна здійснити за допомогою ряду методів кількісного імуноелектрофорезу (QIE), радіальної імунодифузії (RIE) або твердофазного імуноферментного аналізу (ELISA). Визначення загальної алергенної активності найчастіше здійснюють за допомогою радіоалергосорбентного тесту (RAST), 25 аналізу Magic Lite (імунолюмінісцентного аналізу, LIA) або споріднених методів. Також можуть бути використані методи на основі ELISA. Посібник до звичайно застосовуваних, прийнятних тестів, що вимірюють біоефективність, знаходиться, наприклад, у "Note for Guidance on Allergen Product"; The European Agency for the Evaluation of Medicinal Product, CPMP_BWP_243_96, London, 1996. Класифікація алергену як основного алергену може бути предметом декількох випробувань. Алерген звичайно класифікують як основний алерген, якщо принаймні 25% пацієнтів показують сильне зв'язування IgE (оцінка 3) і принаймні 50% пацієнтів - помірне зв'язування (оцінка 2), зв'язування визначають за допомогою CRIE (перехресного радіоімуноелектрофорезу) (сильне зв'язування за методом CRIE, тобто видиме зв'язування IgE на рентгенівській плівці через один день; помірне зв'язування за методом CRIE, тобто зв'язування через·3 дні; слабке зв'язування за методом CRIE, тобто зв'язування через 10 днів). Сильне зв'язування IgE у принаймні 10% пацієнтів класифікує цей алерген як проміжний алерген, і чітко специфічне зв'язування у менше ніж 10% пацієнтів класифікує його як другорядний алерген. Інші методи також можуть бути використані для визначення зв'язування IgE, наприклад, IgE-блоттинг. Класична десенсибілізація зі зростаючим дозуванням, де дозу алергену у формі швидко диспергованої твердої лікарської форми збільшують до певного максимуму, полегшує симптоми алергії. Переважною активністю одноразової дози лікарської форми є активність від 150 до 1000000 SQ-одиниць/лікарську форму, більш переважною є активність від 500 до 500000 SQодиниць/лікарську форму, більш переважною є активність від 500 до 375000 SQодиниць/лікарську форму, більш переважною є активність від 2500 до 375000 SQодиниць/лікарську форму, більш переважною є активність від 2500 до 250000 SQодиниць/лікарську форму, більш переважно, 25000-250000 SQ-одиниць/лікарську форму, більш переважно, 25000-125000 SQ-одиниць/лікарську форму, більш переважно, 25000-100000 SQодиниць/лікарську форму, і найбільш переважно, 25000-75000 SQ-одиниць/лікарську форму. У ще одному втіленні винаходу тверда лікарська форма є повторною монодозою, переважно в межах діапазону від 2500 до 375000 SQодиниць/лікарську форму, більш переважно, від 2500 до 250000 SQ-одиниць/лікарську форму, більш переважно, від 25000 до 250000 SQодиниць/лікарську форму, більш переважно, від 25000 до 125000 SQ-одиниць/лікарську форму, навіть більш переважно, від 25000 до 100000 SQодиниць/лікарську форму, і найбільш переважно, від 25000 до 75000 SQ-одиниць/лікарську форму. В особливо переважному втіленні тверда лікарська форма містить екстракт алергену злаків, де активність становить від 150 до 1000000 SQодиниць/лікарську форму, більш переважною є активність від 500 до 500000 SQодиниць/лікарську форму, більш переважною є 93479 26 активність від 500 до 375000 SQодиниць/лікарську форму, більш переважно, активність становить від 2500 до 375000 SQодиниць/лікарську форму, більш переважною є активність від 2500 до 250000 SQодиниць/лікарську форму, більш переважне·, від 25000 до 250000 SQ-одиниць/лікарську форму, більш переважно, 25000-125000 SQодиниць/лікарську форму, більш переважно, 25000-100000 SQ-одиниць/лікарську форму, і найбільш переважно, 25 000-75 000 SQодиниць/лікарську форму. У ще додатковому втіленні активність твердої лікарської форми за даним винаходом становить від приблизно 5 до 50 000 БАО/лікарську форму, більш переважною є активність від 15 до 25000 БАО/лікарську форму, більш переважно, активність становить від приблизно 15 до 17600 БАО/лікарську форму, більш переважно, активність становить від приблизно 65 до 17600 БАО/лікарську форму, більш переважно, активність становить від приблизно 65 до 15000 БАО/лікарську форму, більш переважно, активність становить від приблизно 650 до 15000 БАО/лікарську форму, більш переважно, 650-6000 БАО/лікарську форму, більш переважно, 650-4700 БАО/лікарську форму, і найбільш переважно, 6503500 БАО/лікарську форму. У ще одному втіленні винаходу тверда лікарська форма є повторною монодозою, переважно в межах діапазону приблизно 65-17600 БАО/лікарську форму, більш переважно, приблизно 65-15000 БАО/лікарську форму, більш переважно, приблизно 650-15000 БАО/лікарську форму, більш переважно, 650-6000 БАО/лікарську форму, навіть більш переважно, 650-4700 БАО/лікарську форму, і найбільш переважно, 650-3500 БАО/лікарську форму. В особливо переважному втіленні тверда лікарська форма містить екстракт алергену злаків, де активність становить від приблизно 5 до 50 000 БАО/лікарську форму, більш переважною є активність від 15 до 25000 БАО/лікарську форму, більш переважно, активність становить від приблизно 15 до 17600 БАО/лікарську форму, більш переважно, активність становить від приблизно 65 до 17600 БАО/лікарську форму, більш переважно, активність становить від приблизно 65 до 15000 БАО/лікарську форму, більш переважно, активність становить від приблизно 650 до 15000 БАО/лікарську форму, більш переважно, 650-6000 БАО/лікарську форму, більш переважно, 650-4700 БАО/лікарську форму, і найбільш переважно, 6503500 БАО/лікарську форму. 1мг екстракту алергену звичайно містить від 100000 до 1000000 SQ-одиниць. Це означає, що 1000000 SQ-одиниць міститься у від 1мг екстракту до 10мг екстракту алергену, і що 100000 SQодиниць містяться у від 0,1мг екстракту до 1мг екстракту алергену. Аналогічно, будь-яку дозу у SQ-одиницях можна перетворити у діапазон доз екстракту алергену. На цій основі вищезазначені діапазони доз, наведені у SQ-одиницях, можуть бути перераховані у діапазони доз, заданих у мг або мкг екстракту алергену, де для нижньої межі 27 діапазону у SQ-одиницях використовують нижню межу відповідного діапазону екстракту алергену, і де для верхньої межі діапазону у SQ-одиницях використовують верхню межу відповідного діапазону екстракту алергену. Таким чином, у подальшому втіленні тверда лікарська форма за даним винаходом має вміст екстракту алергену приблизно 0,15мкг10мг/лікарську форму, більш переважним є вміст екстракту алергену приблизно 0,5мкг-5мг/лікарську форму, більш переважно, вміст екстракту алергену становить приблизно 0,5мкг-3,75мг/лікарську форму, більш переважно, вміст екстракту алергену становить приблизно 2,5мкг-3,75мг/лікарську форму, більш переважно, вміст екстракту алергену становить приблизно 2,5мкг-2,5мг/лікарську форму, більш переважно, вміст екстракту алергену становить приблизно 25мкг-2,5мг/лікарську форму, більш переважно, приблизно 25мкг1,25мг/лікарську форму, навіть більш переважно, приблизно 25мкг-1мг/лікарську форму, і найбільш переважно, приблизно 25мкг-0,75мг/лікарську форму. У ще одному втіленні винаходу тверда лікарська форма є повторною монодозою, переважно в межах діапазону приблизно 2,5мкг3,75мг/лікарську форму, більш переважно, 2,5мкг2,5мг/лікарську форму, більш переважно, приблизно 25мкг-2,5мг/лікарську форму, більш переважно, приблизно 1,5мкг-1,25мг/лікарську форму, навіть більш переважно, приблизно 25мкг1мг/лікарську форму, і найбільш переважно, приблизно 25мкг-0,75мг/лікарську форму. У подальшому втіленні тверда лікарська форма за даним винаходом має вміст основного алергену приблизно 0,015мкг-1мг/лікарську форму, більш переважно, приблизно 0,05мкг500мкг/лікарську форму, більш переважно, приблизно 0,05мкг-375мкг/лікарську форму, більш переважно, приблизно 0,25мкг-375мкг/лікарську форму, більш переважно, приблизно 0,25мкг250мкг/лікарську форму, більш переважно, приблизно 2,5мкг-250мкг/лікарську форму, більш переважно, приблизно 2,5мкг-125мкг/лікарську форму, навіть більш переважно, приблизно 2,5мкг100мкг/лікарську форму, і найбільш переважно, приблизно 2,5мкг-75мкг/лікарську форму. У ще одному втіленні винаходу тверда лікарська форма є повторною монодозою, переважно в межах діапазону 0,25мкг-375мкг/лікарську форму, більш переважно, приблизно 0,25мкг250мкг/лікарську форму, більш переважно, приблизно 2,5мкг-250мкг/лікарську форму, більш переважно, приблизно 2,5мкг-125мкг/лікарську форму, навіть більш переважно, приблизно 2,5мкг100мкг/лікарську форму, і найбільш переважно, приблизно 2,5мкг-75мкг/лікарську форму. Вміст основних алергенів може пояснюватися декількома основними алергенами, в залежності від джерела алергену, про яке йде мова. Звичайно кількість основних алергенів знаходиться у діапазоні від 1 до 10, головним чином, від 1 до 5. Основний алерген може міститися в екстракті алергену або бути створений рекомбінантно. Рекомбінантні основні алергени можуть бути викори 93479 28 стані у такій самій кількості, як у екстрактах алергену, що містять такий основний алерген, або у більш високих дозах. Вважають, що вищі дози є більш ефективними, але також вважають, що вони пов'язані з ризиком потенційно більш частих або більш тяжких побічних ефектів. У додатковому переважному втіленні основні алергени включають алергени злаків групи 1, наприклад, phl p 1, Ιοl p 1, sor h 1, dac g 1, суn d 1, hol 1 1, pha a 1, алергени злаків групи 2/3, наприклад, phi p 2/3, Ιοl p 2/3, алергени злаків групи 5, наприклад, phl p 5, Ιοl p 5, dac g 5, poa p 5, алергени злаків групи 6, наприклад, phl p 6, poa p 6, алергени пилку дерев групи 1, наприклад, bet ν 1, aln g 1, cor a 1, car b 1, кліщові алергени групи 1, наприклад, der p 1, der f 1, eur m 1, кліщові алергени групи 2, наприклад, der p 2, der f 2, eur m 2, котячий алерген, наприклад, fel d 1, алергени кедра групи 1 і групи 2, наприклад, cry j 1 і 2, алергени пилку дрібної або гігантської амброзії, наприклад, amb a 1, amb a 2, amb 1, amb 12. Для доз твердого алергену, застосовуваних оромукозально, був виявлений, порівняйте приклад 6, ефект залежності відповіді від дози. Оскільки особи з алергією є неоднорідною групою, що показує різні симптоми і різні ступені тяжкості симптомів при піддаванні дії навіть однакового алергену, ефективні дози можуть відрізнятися. Деякі пацієнти можуть витримувати більші дози, не зазнаючи неприйнятних побічних ефектів, у той час як інші є гіперчутливими. У деяких випадках можуть бути призначені зростаючі дози, щоб досягнути більших доз, оскільки звичайно вважають, що більші дози є більш ефективними дозами. Вважають, що для більшості населення з середньою алергією ефективна доза алергену за даним винаходом переважно буде становити від 65 БАО/тверду лікарську форму до 17600 БАО/тверду лікарську форму, але доза настільки низька, як 4 БАО, і аж до 47000 БАО може бути застосовною для інших пацієнтів з алергією. В однаковій мірі до цього, для середньої особи з алергією придатною може бути доза екстракту алергену від 0,5мкг до 3,75мг/лікарську форму, або доза з вмістом основного алергену від 0,05мкг до 375мкг/лікарську форму. Для гіпоалергенних варіантів основних алергенів, тобто алергенів зі зменшеною здатністю викликати негайну алергічну реакцію або пізню фазу алергічної реакції, лікарська форма за даним винаходом переважно містить у 10-100 разів більше основного алергену на лікарську форму. Такі гіпоалергенні варіанти можуть бути рекомбінантними або мати природне походження. Вміст алергену у твердій лікарській формі за даним винаходом можна визначити за допомогою звичайного імунологічного аналізу, такого як СІЕ (перехресний імуноелектрофорез), RIE (радіоімуноелектрофорез) і SDS-PAGE (електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію) та імунологічного аналізу, такого як ELISA і аналіз Magic Lite специфічного IgE (LIA) по відношенню до компонентів екстракту, таких як основні алергени. 29 Переважно, для мети даного винаходу стабільність активного інгредієнта, тобто алергену, далі оцінюють за допомогою вимірювання активності алергену, такого як вимірювання загальної алергенної активності, крім вмісту основного алергену. "Початкова алергенна активність" або "початковий вміст принаймні одного основного алергену" твердої лікарської форми означає таку величину, яка була після завершення виробництва твердої лікарської форми. Втрата у вмісті алергену принаймні одного основного алергену є переважно меншою ніж 50% від загального початкового вмісту, більш переважно, меншою ніж 30% від загального початкового вмісту, більш переважно, меншою ніж 20% від загального початкового вмісту, більш переважно, меншою ніж 15% від початкового вмісту, більш переважно, меншою ніж 10% від початкового вмісту, більш переважно, меншою ніж 5% від початкового вмісту. Подальша втрата загальної алергенної активності, відповідно до методу, описаного у прикладі 1, повинна переважно бути меншою ніж 50% від загальної початкової активності, більш переважно, меншою ніж 30% від загальної початкової активності, більш переважно, меншою ніж 20% від загальної початкової активності, більш переважно, меншою ніж 15% від загальної початкової активності. Звичайно випробування на стабільність проводять відповідно до сучасних директив ІСН (Міжнародної конференції з гармонізації технічних вимог до реєстрації лікарських препаратів для людини) (наприклад, директива ІСН ICQ/Q1AR2, прийнята СРМР у березні 2003p., видана як СРМР/ІСН/2736/99) і Управління по контролю за харчовими і лікарськими продуктами США. Умови для випробування на стабільність часто називають умовами зон 1-4. Зони 1 і 2 представляють кліматичні умови в країнах ЄС, Японії та США. Звичайно тверді лікарські форми за даним винаходом переважно повинні бути стабільними протягом принаймні 3 місяців, більш переважно, протягом принаймні 6 місяців, більш переважно, протягом принаймні 12 місяців, навіть більш переважно, протягом принаймні 18 місяців і найбільш переважно, протягом принаймні 2 років при "довготривалих" умовах 25°С/60% відносної вологості, більш переважно, при проміжних умовах 30°С/65% відносної вологості, і навіть більш переважно, при "прискорених" умовах 40°С/75% відносної вологості. Для того, щоб гарантувати достатній термін придатності при зберіганні кінцевого продукту, бажаними є лікарські форми, які суттєво не змінюються після виробництва у відношенні фізичних і хімічних властивостей, наприклад, активності і вмісту алергену, механічної міцності та органолептичних властивостей. Щоб гарантувати, що тверда лікарська форма є достатньо міцною протягом зберігання і коли з нею здійснює маніпуляції пацієнт, лікарська форма повинна мати певну стійкість до зовнішньої сили, але у той самий час тверда лікарська форма повинна швидко подрібнюватися у роті. 93479 30 Таким чином, на додаток до стабільності активного інгредієнта, тобто алергену, тверді лікарські форми також можна оцінювати за додатковими параметрами, такими як механічна міцність, аналогічно, крихкість, міцність на розтягнення і максимальне навантаження до руйнування. Крім того, стабільність твердих лікарських форм можна оцінити за фізичними властивостями, такими як час диспергування та органолептичні властивості, такі як візуальний вигляд лікарської форми. Ці параметри можна оцінити, наприклад, за допомогою вимірювань максимального навантаження до руйнування або міцності на розтягнення твердих лікарських форм за даним винаходом. Як це є очевидним з рівняння, з якого можна розрахувати міцність на розтягнення, одержаний показник міцності на розтягнення залежить від ряду параметрів, які піддаються змінам. Наприклад, товщина або діаметр твердої лікарської форми робитимуть внесок у зміну показника. Тому вважають, що максимальне навантаження до-руйнування є навіть більш точною характеристикою для оцінювання міцності твердих одиниць дозування за даним винаходом. У втіленні винаходу тверда лікарська форма має максимальне навантаження до руйнування не менше ніж 0,05кгс і нижче ніж 0,9кгс. Переважними є лікарські форми, які мають максимальне навантаження до руйнування від 0,05 до 0,9кгс, більш переважно, від 0,1 до 0,8кгс, і найбільш переважно, від 0,1 до 0,6кгс. У подальшому втіленні даного винаходу тверда лікарська форма має міцність на розтягнення меншу ніж 1,0Н/мм2, більш переважно, нижчу ніж 0,9Н/мм2. Переважно, швидко диспергована лікарська форма подрібнюється у роті миттєво або швидко при контакті зі слиною, для того щоб забезпечити максимальну експозицію алергену з імунокомпетентною тканиною слизової оболонки перед ковтанням. У переважному втіленні тверда лікарська форма подрібнюється менше ніж за приблизно 90 секунд, переважно, менше ніж за приблизно 60 секунд, переважно, менше ніж за приблизно 30 секунд, більш переважно, менше ніж за приблизно 20 секунд, більш переважно, менше ніж за приблизно 15 секунд, навіть більш переважно, менше ніж за приблизно 10 секунд у ротовій порожнині, навіть більш переважно, менше ніж за приблизно 5 секунд, і найбільш переважно, менше ніж за приблизно 2 секунди у ротовій порожнині. У переважному втіленні винаходу композиції винаходу є швидко диспергованими твердими лікарськими формами, що містять твердий каркас алергену і будь-яку водорозчинну або вододисперговану основу. Каркас одержують, сублімуючи розчинник із композиції у твердому стані, композиції, що містить розчин алергену та основу. Більш переважно, каркас одержують шляхом ліофілізації. Фармацевтично прийнятні наповнювачі, що утворюють частину основи у швидкодиспергованій твердій лікарській формі за даним винаходом, є речовинами, що формують основу, і, додатково, іншими придатними наповнювачами, такими як антациди, розріджувачі, посилювачі, речовини, що 31 сприяють прилипанню до слизової оболонки, смакові речовини, речовини, що маскують смак, консерванти, антиоксиданти, поверхнево-активні речовини, посилювачі в'язкості, барвники, модифікатори рН, підсолоджувальні речовини і т.д. Всі ці наповнювачі вибирають відповідно до загальноприйнятої фармацевтичної практики у спосіб, зрозумілий фахівцям у галузі створення алергенних терапевтичних засобів. Речовини, що формують основу, придатні для використання згідно з даним винаходом, включають наповнювачі, що є похідними від тваринних або рослинних білків, такі як желатини, декстрини та білки насіння сої, пшениці і подорожника; смоли, такі як аравійська камедь, гуарова смола, агар і ксантан; полісахариди; крохмаль і модифікований крохмаль, альгінати; карбоксиметилцелюлозу; карагенани; декстрани; пектини; синтетичні полімери, такі як полівінілпіролідон; і комплекси поліпептид/протеїн або полісахарид, такі як комплекси желатин-аравійська камедь. Желатини є гетерогенною сумішшю водорозчинних колоїдних макромолекул. Такі гетерогенні суміші з середнім розподілом молекулярних мас можуть бути одержані при гідролітичній дії на матеріал тваринного походження, багатий на колаген, такий як кістки, шкіра, сухожилля, зв'язки і т.д. Желатини можуть бути одержані з ссавців, наприклад, великої рогатої худоби, свиней, або не ссавців, наприклад, тепловодних або холодноводних риб. Желатини можуть бути гідролізованими або негідролізованими, поперечно зшитими або незшитими. Крім того, вони можуть бути гелеутворюючого або не гелеутворюючого типу, не гелеутворюючий тип звичайно одержують холодноводних риб. У ще одному окремому втіленні використовують крохмаль. Крохмалі є складними сумішами вуглеводних полімерів. Інші речовини, що формують основу, придатні для використання за даним винаходом, включають цукри, такі як манітол, декстроза, лактоза, галактоза і трегалоза; циклічні цукри, такі як циклодекстрин; неорганічні солі, такі як фосфат натрію, хлорид натрію і силікати алюмінію; та амінокислоти, що мають від 2 до 12 атомів вуглецю, такі як гліцин, L-аланін, L-аспарагінова кислота, Lглутамінова кислота, L-гідроксипролін, Lізолейцин, L-лейцин і L-фенілаланін. Тверда лікарська форма переважно включає принаймні 50%, за масою, принаймні однієї речовини, що формує основу, у розчині дозування. Розчин дозування є не твердою композицією речовин, що утворюють основу, алергену та інших необов'язкових наповнювачів перед етапом затвердіння. В одному втіленні винаходу тверда лікарська форма містить 5-30%, за масою, більш переважно, 5-20%, за масою, навіть більш переважно, від 5% до 12%, за масою, принаймні однієї речовини, що формує основу, у розчині дозування. Потреба у вмісті сухої речовини розчину дозування також буде залежати від розмірів таблетки. Було виявлено, що швидко диспергована тверда лікарська форма, яка включає як наповнювачі, що формують основу, риб'ячий желатин і манітол, 93479 32 є особливо вигідною по відношенню до стабільності, візуального вигляду, низької крихкості, міцності на розтягнення, максимального навантаження до руйнування і відчуттів у роті. У переважному втіленні швидко диспергована тверда лікарська форма містить твердий каркас з алергену і речовин, що формують основу, у формі риб'ячого желатину і манітолу. У переважному втіленні вміст риб'ячого желатину становить від 2% до 20%, за масою, у розчині дозування, а вміст манітолу - від 1% до 20%, за масою, у розчині дозування. У ще одному переважному втіленні вміст риб'ячого желатину становить від 2% до 10%, за масою, у розчині дозування, а вміст манітолу - від 1% до 10%, за масою, у розчині дозування. У додатковому переважному втіленні вміст риб'ячого желатину становить від 3% до 6,5%, за масою, у розчині дозування, а вміст манітолу - від 3% до 5,5%, за масою, у розчині дозування. Термін "розчин дозування", як вжито у цьому контексті, означає об'єм рідини, який готують, а потім розподіляють у контейнер, такий як блістерна упаковка або інша упаковка, перед подальшим обробленням, таким як висушування або етап ліофілізації. У ще додаткових втіленнях основа включає 4%, за масою, риб'ячого желатину у розчині дозування і 3%, за масою, манітолу у розчині дозування. У ще одному втіленні основа включає 6,5%, за масою, риб'ячого желатину у розчині дозування і 5,5%, за масою, манітолу у розчині дозування. Було також виявлено, що швидко диспергована тверда лікарська форма, яка включає як наповнювачі, що формують основу, крохмаль і манітол, є особливо вигідною по відношенню до стабільності, візуального вигляду, низької крихкості, міцності на розтягнення, максимального навантаження до руйнування і відчуттів у роті. У переважному втіленні швидко диспергована тверда лікарська форма містить твердий каркас з алергену і речовин, що формують основу, у формі крохмалю, переважно, пептизованого, наприклад, з картоплі, пшениці, кукурудзи, маїсу або рису, і манітолу. У переважному втіленні вміст крохмалю становить від 2% до 20%, за масою, у розчині дозування, а вміст манітолу - від 1% до 20%, за масою, у розчині дозування. У ще одному переважному втіленні вміст крохмалю становить від 2% до 10%, за масою, у розчині дозування, а вміст манітолу - від 1% до 10%, за масою, у розчині дозування. У ще додатковому переважному втіленні вміст крохмалю становить від 3% до 6,5%, за масою, у розчині дозування, а вміст манітолу - від 3% до 5,5%, за масою, у розчині дозування. У ще одному втіленні основа включає 4,4%, за масою, крохмалю у розчині дозування і 4,4%, за масою, манітолу у розчині дозування. Переважно, рН регулюють до затвердіння розчину, що містить алерген і основу, щоб уникнути денатурації алергену, осадження і забезпечити стабільний продукт. Оптимальне значення рН для різних алергенів у розчині охоплює майже цілий діапазон рН, в залежності від їхньої ізоелектричної точки. Суміші алергенів, такі як екстракти, в однаковій мірі мають оптимальні рН для розчинності і 33 стабільності, які визначаються такими факторами, як концентрація окремих алергенів в екстракті. Отже, може бути передбачене окреме визначення можливого діапазону рН для композиції за даним винаходом. Оптимальне значення рН для алергену, про який іде мова, визначають, проводячи дослідження прискореної стабільності з композиціями, що мають різні значення рН. Схема таких досліджень є відомою фахівцеві у галузі створення твердих лікарських форм алергену. Переважно, рН композицій основи, що містять екстракт алергену, повинен бути доведений до рН 3,5-10, більш переважно, 4-9, і найбільш переважно, 6-9. Крім того, у даній галузі добре відомо, що іонна сила може бути фактором, який впливає на стабільність ліофілізованої твердої лікарської форми, головним чином, через її вплив на процеси сублімаційного сушіння. Також відомо, що висока іонна сила впливає на осадження. Таким чином, необхідно встановити оптимум за допомогою вимірювань, добре відомих фахівцеві у даній галузі. Переважно, іонна сила екстракту з концентрацією 10мкг/мл знаходиться у діапазоні 1-1500мкСм/см (См=сіменс), більш переважно, від 300 до 800мкСм/см, найбільш переважно, становить приблизно 500мкСм/см, для системи, що містить основу та алерген, краще, якщо іонна сила знаходиться у діапазоні 1-2000мкСм/см, більш переважно, приблизно 500-1500мкСм/см. Тверді лікарські форми за даним винаходом можуть далі містити барвники, смакові речовини, модифікатори рН або речовини, що маскують смак. Придатні барвники включають червоний, чорний і жовтий оксиди заліза та барвники FD&C (для харчових, лікарських і косметичних продуктів), такі як FD&C синій №2 і FD&C червоний №40. Придатні смакові речовини включають присмаки м'яти, малини, лакриці, апельсину, лимону, грейпфруту, карамелі, ванілі, вишні і винограду, та їхнє поєднання. Придатні модифікатори рН включають лимонну кислоту, винну кислоту, фосфорну кислоту, хлороводневу кислоту і малеїнову кислоту. Придатні підсолоджувальні речовини включають аспартам, ацесульфам К і thaumatic. Придатні речовини, що маскують смак, включають бікарбонат натрію, іонообмінні смоли, циклодекстринові сполуки включення, адсорбовані речовини або мікроінкапсульовані активні речовини. Ад'юванти звичайно використовують для посилення абсорбції алергену, а також для посилення імуностимулюючих властивостей алергену. В одному втіленні винаходу принаймні один ад'ювант включений до лікарської форми за даним винаходом. Прикладами придатних ад'ювантів є солі алюмінію, нетоксичні бактеріальні фрагменти, цитокічи, токсин холери (і його детоксифіковані фракції), субодиниця b токсину холери, хітозан, гомологічні термолабільні фрагменти Е. соїі (і їхні детоксифіковані фракції), сапоніни, бактеріальні продукти, такі як ліпополісахариди (ЛПС) і мураміл-дипептид (МДП), ліпосоми, CpG (імуностимулюючі послідовності ДНК), лактид/гліколід гомо + співполімери у формі мікрочастинкових полімерів, і т.д. Використання ад'ювантів в алергенному фа 93479 34 рмацевтичному препараті, наприклад, вакцинах, часто аргументують тим фактом, що алергени, про які йде мова, не здатні пройти крізь бар'єр, який необхідно перетнути. Таким чином, ад'юванти можуть служити як речовини, що посилюють абсорбцію, або вони можуть діяти як імуностимулюючі речовини. Однак використання ад'ювантів може бути пов'язане із серйозними недоліками, такими як ненавмисне стимулювання різних механізмів імунної відповіді, системний червоний вовчак, або вплив на бар'єрні можливості слизових мембран, що, таким чином, дозволяє проходження шкідливих речовин. Крім того, з промислової точки зору додавання ад'ювант у далі складає додаткову вартість виробництва і матеріалу, крім великих вимог до документації, що стосується реєстрації лікарського засобу. У ще одному переважному втіленні винаходу швидко диспергована тверда лікарська форма за даним винаходом не містить ад'юванту. Також несподівано було виявлено, що немає необхідності включати ад'ювант до швидко диспергованої твердої лікарської форми, для того щоб посилити імуностимулюючі властивості алергену, про який іде мова. Іншими словами, тверда лікарська форма, як описана тут, може піднімати специфічну імунну відповідь, як продемонстровано у прикладі 6. Не пресована швидко диспергована тверда лікарська форма може до деякої міри прилипати до слизової оболонки. Однак у переважному втіленні винаходу може бути необхідним додатково ввести до зазначеної лікарської форми наповнювачі, що сприяють прилипанню до слизової оболонки, для того щоб збільшити час контакту цієї лікарської форми з слизовою оболонкою ротової порожнини. Придатними наповнювачами, що сприяють прилипанню до слизової оболонки, є поліакрилові полімери, такі як карбомер і похідні карбомеру; похідні целюлози, такі як гідроксипропілметилцелюлоза, гідроксіетилцелюлоза, гідроксипропілцелюлоза і натрій карбоксиметилцелюлоза; природні полімери, такі як желатин, альгінат натрію, пектин і гліцерин. У подальшому втіленні винаходу алергенну лікарську форму, розчинену у слині, не ковтають до 3 хвилин після застосування, для того щоб дозволити достатній час контакту, наприклад, для абсорбції на слизовій оболонці у роті. У ще додатковому переважному втіленні алергенну лікарську форму не розбавляють у ротовій порожнині, наприклад, введенням рідини, такої як вода, до закінчення 5 хвилин. Відомо, що небажані явища або побічні ефекти існують також у зв'язку з лікуванням алергії. Зокрема, лікування, спрямоване на модулювання існуючої відповіді у сенсибілізованої особи може являти собою ризик індукування побічних ефектів при введенні алергену. Побічні ефекти, що спостерігаються у зв'язку з оромукозальним лікуванням, звичайно описані для очей, носа, рота, верхніх і нижніх дихальних шляхів і в залежності від ступеня, який вважають прийнятним. Найпоширенішим є явище свербежу. Побічні реакції, такі як анафілактичний шок, набряки верхніх і нижніх ди 35 хальних шляхів, ускладнене дихання, падіння артеріального тиску, зупинка серця не були б припустимими. Швидко дисперговану тверду лікарську форму за даним винаходом можна виробляти та упаковувати в одноразові контейнери, що містять множину твердих лікарських форм, тобто багатодозові контейнери. Особливо переважними є такі методи і матеріали, як описані у патентах США №№5729958 і 5343762. Прикладами придатних багатодозових контейнерів є повністю алюмінієві блістерні упаковки, блістерні упаковки, зроблені з полімерів, наприклад, поліпропілену, блістерні упаковки з полівінілхлориду і блістерні упаковки, сформовані з полівініхлоридного/полівініліденхлоридного шаруватого матеріалу і запечатані, наприклад, алюмінієм, ламінованим на каландрованому крафт-папері, Aclar® або Triplex®. У втіленні винаходу швидко дисперговану лікарську форму виробляють та упаковують у блістерні упаковки, сформовані з полівініхлоридного/полівініліденхлоридного шаруватого матеріалу і запечатані алюмінієм, ламінованим на каландрованому крафт-папері. У ще одному його втіленні блістерну упаковку вміщують в алюмінієве саше придатного розміру, що складається з алюмінію, ламінованого на каландрованому крафт-папері. У ще інших втіленнях швидко дисперговану лікарську форму упаковують у блістерні упаковки, сформовані з алюмінію і запечатані алюмінієм, ламінованим на каландрованому крафт-папері. У подальшому втіленні швидко дисперговану лікарську форму упаковують у багатошарові блістерні упаковки, сформовані, наприклад, з п'ятишарового алюмінієвого ламінату і запечатані алюмінієм, ламінованим на каландрованому крафтпапері. У ще одному втіленні швидко дисперговану лікарську форму упаковують у блістерні упаковки, сформовані з алюмінієвого шаруватого матеріалу і запечатані алюмінієм, ламінованим на каландрованому крафт-папері, у такий спосіб, що дітям буде важко відкрити блістерну упаковку, наприклад, стійкі до відкривання дітьми упаковки. Тверду лікарську форму цього типу в цілому можна охарактеризувати низькою механічною міцністю у порівнянні з пресованими таблетками через власну природу такої не пресованої лікарської форми. Це може призвести до вивільнення залишкових частинок, що містять алерген, при вийманні з блістерного заглиблення і під час маніпуляцій пацієнта з лікарською формою. У більшості ситуацій це неважливо або має, головним чином, косметичну значимість. Однак це є особливо шкідливим, коли активним інгредієнтом є алерген, оскільки низькі кількості алергену можуть викликати алергічну реакцію у схильної особи або сенсибілізувати раніше не сенсибілізовану особу. Звичайно експозиція знаходиться у діапазоні 10мкг/рік для накопиченого білка основного алергену, наприклад, для пилкових алергенів або кліщових алергенів пилу, яка є адекватною, щоб давати сенсибілізацію або симптоми. 93479 36 При здійсненні маніпуляцій з твердими лікарськими формами алергени можуть вступати у контакт з органами-мішенями, такими як дихальні шляхи або очі, і викликати відповідь у особи з алергією. Одна лікарська форма може містити таку кількість алергену, дії якої особа піддається протягом одного року або більше, в залежності від характеру експозиції. Можна викликати симптоми з боку очей у пацієнтів з алергією, використовуючи кон'юнктивальну стимуляцію алергеном. Ґрунтуючись на таких дослідженнях імунності до специфічного агента, можна оцінити, як багато алергенного екстракту потрібно, щоб викликати кон'юнктивальні симптоми. У популяції пацієнтів з тяжкою сінною пропасницею, викликаною пилком злаків, найнижча доза екстракту пилку злаків, що спричиняє кон'юнктивальні симптоми, була запропонована на рівні 3000 SQодиниць/мл×0,05мл=150 SQ-одиниць (середнє значення) (S.R. Durham, S.M. Walker, E.M. Varga, M.R. Jacobson, F. O'Brien, W. Noble, S.J. Till, Q.A. Hamid, and K.T. Noun-Aria. Long-term clinical efficacy of grass-pollen immunotherapy. N. Engl. J. Med. 341 (7):468-475, 1999). Таким чином, в одному втіленні з кожної твердої лікарської форми під час ручного маніпулювання може вивільнятися менше ніж приблизно 500 SQ-одиниць, більш переважно, менше ніж приблизно 250 SQ-одиниць, більш переважно, менше ніж приблизно 150 SQ-одиниць, більш переважно, менше ніж приблизно 75 SQ-одиниць, більш переважно, менше ніж приблизно 25 SQодиниць, і найбільш переважно, менше ніж приблизно 10 SQ-одиниць. У ще одному втіленні з кожної твердої лікарської форми під час ручного маніпулювання може вивільнятися менше ніж приблизно 13 БАО, більш переважно, менше ніж приблизно 7 БАО, більш переважно, менше ніж приблизно 5 БАО, більш переважно, менше ніж приблизно 1,95 БАО, більш переважно, менше ніж приблизно0,65 БАО, і найбільш переважно, менше ніж приблизно 0,26 БАО. У подальшому втіленні з кожної твердої лікарської форми під час ручного маніпулювання може вивільнятися менше ніж приблизно 0,5мкг екстракту алергену, більш переважно, менше ніж приблизно 0,25мкг екстракту алергену, більш переважно, менше ніж приблизно 0,15мкг екстракту алергену, більш переважно, менше ніж приблизно 0,075мкг екстракту алергену, більш переважно, менше ніж приблизно 0,025мкг екстракту алергену, і найбільш переважно, менше ніж приблизно 0,01мкг екстракту алергену. У ще одному втіленні з кожної твердої лікарської форми під час ручного маніпулювання може вивільнятися менше ніж приблизно 0,05мкг основного алергену, більш переважно, менше ніж приблизно 0,025мкг основного алергену, більш переважно, менше ніж приблизно 0,015мкг основного алергену, більш переважно, менше ніж приблизно 0,0075мкг основного алергену, більш переважно, менше ніж приблизно 0,0025мкг основного алергену, і найбільш переважно, менше ніж приблизно 0,001мкг основного алергену. 37 Для того щоб гарантувати, що залишки твердої лікарської форми, які містять алерген, не виділяються у навколишнє середовище при відкриванні багатодозового контейнера, важливо, щоб крихкість лікарської форми була наскільки це можливо низькою, без піддавання ризику вивільнення алергену з лікарської форми після перорального застосування. У переважному втіленні даного винаходу залишковий вміст пилу у багатодозовому контейнері після видалення лікарської форми не перевищує приблизно 2% від загального вмісту алергену, більш переважно, приблизно 0,5% від загального вмісту алергену у твердій лікарській формі, більш переважно, приблизно 0,2% від загального вмісту алергену у твердій лікарській формі, більш переважно, приблизно 0,1% від загального вмісту алергену у твердій лікарській формі, більш переважно, приблизно 0,01%, більш переважно, приблизно 0,005%, більш переважно, приблизно 0,003% від загального вмісту алергену у твердій лікарській формі, і найбільш переважно, приблизно 0,001% від загального вмісту алергену у твердій лікарській формі. Як вжито тут, "випробування на крихкість" має стосуватися будь-якого придатного випробування, що вимірює легкість, з якою тверда лікарська форма кришиться, розсипається на шматочки і подрібнюється у порошок. Придатна крихкість для використання у даному винаході проілюстрована нижче і включає розділ 2.9.7. третього видання Європейської Фармакопеї (ЕР 3rd ed. 2.9.7.). Звичайно випробування таблеток на крихкість виконують, як викладено у ЕР 3rd ed. 2.9.7. та USP (Фармакопея США) , де втрату маси оцінюють як характеристику неушкодженої лікарської форми. Випробування на крихкість, описане у ЕР 3rd ed. 2.9.7., використовує барабан, що має діаметр 286 мм і глибину приблизно 39мм. Зразок таблеток поміщають на сито №100, і будь-які незв'язані залишки видаляють, використовуючи тиск повітря або м'яку щітку. Таблетки зважують і після цього поміщають у барабан. Таблетки обертають у барабані 100 разів. Потім видаляють незв'язані залишки, як щойно описано, і таблетки зважують знову. Далі результат виражають як втрату маси і розраховують як відсоток від початкової маси. Згідно з USP , можна використовувати барабан з діаметром від 283 до 291мм і глибиною від 36 до 40мм, та обертання зі швидкістю 25+1 обертів/хвилину. Відповідно, неушкодженість даної лікарської форми можна оцінити за допомогою візуального огляду і вимірювання маси таблетки при піддаванні такому методу. Альтернативно, через низьку масу лікарських форм за даним винаходом зважування можна замінити на імунологічний аналіз, специфічний для алергену, про який іде мова. Було виявлено, що використання модифікованого випробування на крихкість є корисним інструментом для оцінювання того, які композиції є найбільш стабільними щодо стійкості і механічної міцності. У втіленні винаходу крихкість зазначеної твердої лікарської форми, виміряна як кількість вивіль 93479 38 неного алергену, є меншою ніж приблизно 500 SQодиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 250 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 150 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 75 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 50 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 25 SQ-одиниць на тверду лікарську форму, і найбільш переважно, меншою ніж приблизно 10 SQ-одиниць на тверду лікарську форму у будь-якому придатному випробуванні на крихкість, що прикладає достатню зовнішню силу до композицій, які мають бути випробувані. У більш переважному втіленні крихкість, виміряна як кількість вивільненого алергену, є меншою ніж приблизно 500 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 250 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 150 SQодиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 75 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 50 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 25 SQ-одиниць на тверду лікарську форму, і найбільш переважно, меншою ніж приблизно 10 SQ-одиниць на тверду лікарську форму у випробуванні на крихкість, виконаному відповідно до 3 видання Європейської Фармакопеї. У навіть більш переважному втіленні крихкість, виміряна як кількість вивільненого алергену, є меншою ніж приблизно 500 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 250 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 150 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 75 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 50 SQ-одиниць на тверду лікарську форму, більш переважно, меншою ніж приблизно 25 SQ-одиниць на тверду лікарську форму, і найбільш переважно, меншою ніж приблизно 10 SQ-одиниць на тверду лікарську форму у способі, що включає такі етапи: a) вміщення окремих герметичних блістерів, кожен з яких містить тверду лікарську форму, в обладнання, придатне для вимірювання крихкості; b) переміщення герметичного блістера, що містить тверду лікарську форму, протягом відповідного часу і при відповідній швидкості; c) видалення герметичного блістера, що містить тверду лікарську форму; d) відкриття блістера і вміщення твердої лікарської форми і будь-яких залишків у контейнер; є) видалення одиничної твердої лікарської форми з контейнера, залишаючи будь-які незв'язані залишки у зазначеному контейнері; f) проведення алергенспецифічного аналізу зазначених залишків з визначенням вмісту алергену у зазначених залишках; і g) необов'язково, розрахунку відсотка вмісту алергену у зазначених залишках від загального 39 вмісту алергену в одиничній твердій лікарській формі. У ще одному втіленні крихкість зазначеної твердої лікарської форми, виміряна як кількість вивільненого алергену, є меншою ніж приблизно 0,5мкг екстракту алергену на тверду лікарську форму під час ручного маніпулювання, більш переважно, меншою ніж приблизно 0,25мкг екстракту алергену на тверду лікарську форму, більш переважно, меншою ніж приблизно 0,15мкг екстракту алергену на тверду лікарську форму, більш переважно, меншою ніж приблизно 0,075мкг екстракту алергену на тверду лікарську форму, більш переважно, меншою ніж приблизно 0,025мкг екстракту алергену на тверду лікарську форму, і найбільш переважно, меншою ніж приблизно 0,01мкг екстракту алергену на тверду лікарську форму у способі, що включає такі етапи: a) вміщення окремих герметичних блістерів, кожен з яких містить тверду лікарську форму, в обладнання, придатне для вимірювання крихкості; b) переміщення герметичного блістера, що містить тверду лікарську форму, протягом відповідного часу і при відповідній швидкості; c) видалення герметичного блістера, що містить тверду лікарську форму; d) відкриття блістера і вміщення твердої лікарської форми і будь-яких залишків у контейнер; є) видалення одиничної твердої лікарської форми з контейнера, залишаючи будь-які незв'язані залишки у зазначеному контейнері; f) проведення алергенспецифічного аналізу зазначених залишків з визначенням вмісту алергену у зазначених залишках; і g) необов'язково, розрахунку відсотка вмісту екстракту алергену у зазначених залишках від загального вмісту екстракту алергену в одиничній твердій лікарській формі. У ще одному втіленні крихкість, виміряна як кількість вивільненого алергену, є меншою ніж приблизно 0,05мкг основного алергену, більш переважно, меншою ніж приблизно 0,025мкг основного алергену, більш переважно, меншою ніж приблизно 0,015мкг основного алергену на тверду лікарську форму, більш переважно, меншою ніж приблизно 0,0075мкг основного алергену на тверду лікарську форму, більш переважно, меншою ніж приблизно 0,0025мкг основного алергену на тверду лікарську форму, і найбільш переважно, меншою ніж приблизно 0,001мкг основного алергену на тверду лікарську форму у способі, що включає такі етапи: a) вміщення окремих герметичних блістерів, кожен з яких містить тверду лікарську форму, в обладнання, придатне для вимірювання крихкості; b) переміщення герметичного блістера, що містить тверду лікарську форму, протягом відповідного часу і при відповідній швидкості; c) видалення герметичного блістера, що містить тверду лікарську форму; d) відкриття блістера і вміщення твердої лікарської форми і будь-яких залишків у контейнер; є) видалення одиничної твердої лікарської форми з контейнера, залишаючи будь-які незв'язані залишки у зазначеному контейнері; 93479 40 f) проведення алергенспецифічного аналізу зазначених залишків з визначенням вмісту основного алергену принаймні одного основного алергену у зазначених залишках; і g) необов'язково, розрахунку відсотка принаймні зазначеного основного алергену у зазначених залишках від загального вмісту основного алергену в одиничній твердій лікарській формі. У ще одному переважному втіленні способу (a) використовують від 1 до 100 блістерів, що містять тверду лікарську форму, (b) використовують обладнання для вимірювання крихкості, як описане в Європейській Фармакопеї, V.2.9.7, (c) тверді лікарські форми обертають 100 разів зі швидкістю 25±1 обертів/хвилину, і (d) алергенспецифічний аналіз є імунохімічним алергенспецифічним аналізом. У додатковому переважному втіленні способу вимірювання крихкості вміст алергену визначають методом ELISA. Крім того, пероральна лікарська форма повинна мати привабливий зовнішній вигляд. Отже, як частина контролю якості, швидкодисперговані тверді лікарські форми за даним винаходом переважно піддають візуальному огляду, наприклад, перевіряють колір, форму, нерівності і дефекти. Для того щоб забезпечити оптимальне схвалення пацієнта, лікарська форма може також бути випробувана на відчуття у роті. Наприклад, пацієнти сприймають лікарську форму як приємну, коли її вміщують у рот і дозволяють подрібнитися. Оскільки алергени є дуже біоефективними для особи з алергією, тобто навіть невелика кількість може ініціювати відповідь, рівномірність вмісту є важливою характеристикою під час лікування, щоб гарантувати, наприклад, що картина, яка спостерігається для пацієнта, є відтворюваною, коли взяти таку саму дозу. Переважно, відхилення вмісту алергену одноразових доз всередині багатодозового контейнера знаходиться у межах ±10%, переважно, у межах +7%, найбільш переважно, у межах ±5% у порівнянні з встановленою дозою. Багатодозовий контейлер може містити будьяку можливу кількість швидкс диспергованих твердих лікарських форм. Переважно тверді алергенні лікарські форми упаковують і використовують як групу. Окремі тверді лікарські форми упаковують, дозуючи їх як рідку суміш в індивідуальні контейнери, супроводжуючи видаленням води. Блістери, що містять множину доз, можуть бути компоновані у більші пластини, і пластини, що містять множину доз, можуть бути упаковані і продаватися разом. Наприклад, контейнер, такий як блістерна упаковка, може містити множину твердих лікарських форм, переважно, 1-100 твердих лікарських форм, більш переважно, 1-35, і найбільш переважно, 110 твердих лікарських форм на блістерну упаковку. Ще одне втілення забезпечує економію виробництва, поширення і зберігання за допомогою використання множинних блістерних упаковок, які можуть, наприклад, забезпечити 2, 3, 4, 5, 6 або більше для використання в одиничному запланованому курсі лікування. Ця конкретна схема упакування є особливо корисною для монодозового лікування, і зроблена можливою завдяки режимам 41 дозування, як описані тут, в яких відсутній етап зростаючого дозування. Додаткове втілення також забезпечує схему лікування, яка використовує єдину стандартну лікарську форму для завершення цілісної сенсибілізаційної терапії, без зростаючого дозування, тобто підвищення дози, з різними рівнями алергену до досягнення конкретної дози. Це втілення є вигідним, тому що воно спрощує та економить на виробництві, поширенні і зберіганні лікарської форми, не вимагаючи кількостей багаторазових доз для одиничного лікування. Крім того, при спрощенні курсу лікування поліпшується схвалення пацієнтом, що безпосередньо призводить до більшої клінічної ефективності. Ще одне втілення забезпечує терапевтичну упаковку для лікування алергії або полегшення симптомів алергії. Терапевтична упаковка включає герметичну упаковку з множиною твердих лікарських форм, кожна з яких містить ефективну кількість алергену. Терапевтична упаковка може містити, наприклад, принаймні 2, 4, 6, 7, 10, 14, 30, 60, 90, 100, 120, 200, 240 або більше твердих лікарських форм. Терапевтична упаковка може містити достатню кількість лікарських форм для повного лікування або достатньо для частини лікування. Переважно, терапевтична упаковка містить принаймні один місячний запас одноразових доз. У ще одному переважному втіленні винаходу всі тверді лікарські форми терапевтичної упаковки містять однакові дози алергену, таким чином, виключаючи необхідність виробництва, поширення і зберігання різноманітних одноразових доз для лікування в особи єдиної алергії. Терапевтична упаковка може далі містити інструкції щодо використання твердої лікарської форми. Інструкції можуть включати застереження, інструкції щодо режиму дозування або будь-яку іншу інформацію, важливу для користувача. Інструкції фізично можуть містити, наприклад, інструкцію у вигляді окремої брошури, аркуша паперу, плаката і/або одного або більше попереджень, надрукованих на упаковці, такій як коробка, що містить одноразові дози. Інструкції також можуть бути представлені на компакт-диску або інших носіях інформації, які зручно читати на комп'ютері, або на відеокасеті. Більш бажано, множину твердих лікарських форм терапевтичної упаковки формують з рідкої суміші за допомогою процесу in situ, що видаляє суспензію і/або сольватаційну рідину, яка може містити воду і/або інші органічні розчинники, і вони є швидко диспергованими. У ще одному втіленні кожна з твердих лікарських форм терапевтичної упаковки розміщена в окремо запечатаних блістерах у множинній блістерній упаковці. У подальшому втіленні тверді лікарські форми терапевтичної упаковки містять желатин, більш переважно, риб'ячий желатин. У ще додатковому втіленні тверді лікарські форми терапевтичної упаковки додатково містять манітол. У ще одному втіленні терапевтичної упаковки ефективна кількість твердої лікарської форми ста 93479 42 новить від приблизно 2,5мкг до приблизно 3,75мкг екстракту/тверду лікарську форму. Ще одне втілення забезпечує спосіб лікування алергії або полегшення симптомів алергії, який включає забезпечення а) терапевтичної упаковки і b) багаторазового оромукозального застосування однієї або більшої кількості лікарських форм із терапевтичної упаковки до полегшення симптомів. Ще одне втілення забезпечує схему лікування, яка використовує одноразову дозу твердої лікарської форми для завершення цілісної сенсибілізаційної терапії, без зростаючого дозування з різними рівнями алергену. Це втілення спрощує та економить на виробництві, поширенні і зберіганні одноразової дози, не вимагаючи кількостей багаторазових доз для одиничного лікування. Крім того, при спрощенні курсу лікування поліпшується схвалення пацієнтом, що може призводити до більшої клінічної ефективності. Швидко диспергована тверда лікарська форма за даним винаходом може бути приготована за допомогою процесу сублімації, відповідно до процесу, розкритого у патенті США №4371516. Відповідно, затверділий розчин алергену і наповнювачів, що формують основу, піддають сублімації. Процес сублімації переважно здійснюють шляхом ліофілізації розчину. Розчин міститься у виїмці багатодозового контейнера під час етапу ліофілізації, щоб виготовити тверду лікарську форму будь-якої бажаної конфігурації. Багатодозовий контейнер можна охолоджувати, використовуючи рідкий азот або твердий діоксид вуглецю. Після етапу заморожування заморожений розчин у багатодозовому контейнері піддають зниженому тиску і, якщо це бажано, регульованому застосуванню тепла, щоб сприяти сублімації розчинника. Є декілька клінічних проявів і симптомів алергії, і вони можуть відрізнятися в залежності від сенсибілізованої особи та спричиненої алергії. Поширеними є такі симптоми як набряк, свербіж, почервоніння і виділення з очей та носа (риніт і кон'юнктивіт) і симптоми з боку верхніх і нижніх дихальних шляхів, такі як свистяче дихання, кашель, задишка, шкірні симптоми, такі як екзема, кропив'янка та свербіж. Також відчувають інші симптоми, такі як втома. Симптоматичне лікування має на меті зменшення або вплив на тяжкість симптомів або зменшення потреби в інших ліках, які приймають паралельно. Симптоматичні лікарські засоби включають антигістамінні засоби, такі як антагоністи рецепторів Н1 і Н2, інтраназальні та системні кортикостероїди, нестероїдні протизапальні засоби, назальні протинабрякові засоби, такі як адреноміметики. Лікування і полегшення одного або більше симптомів алергії або зменшення необхідності в іншому лікуванні є додатковою метою даного винаходу. Ще одним втіленням винаходу є фармацевтичний препарат, що містить перорально застосовувану тверду лікарську форму, яка включає основу, утворену принаймні одним фармацевтично прийнятним матеріалом, ефективну кількість алергену для десенсибілізації людини до зазначеного алергену, зазначена лікарська форма має вміст алергену принаймні приблизно 50% від початкового 43 вмісту алергену після зберігання протягом 3 місяців при температурі 25°С та відносній вологості 60%, і втрата із зазначеної твердої лікарської форми є меншою ніж приблизно 0,5мкг екстракту алергену, або меншою ніж приблизно 0,05мкг основного алергену. Переважно, зазначений фармацевтичний препарат знаходиться у формі пастилок, таблеток, капсул або каплет. Таким чином, подальшою метою даного винаходу є забезпечення способу лікування алергії або полегшення симптомів алергії, що включає оромукозальне застосування ефективної кількості лікарської форми алергенної вакцини, що містить (а) основу і (b) принаймні один алерген у будь-якому з описаних вище втілень. Спосіб лікування алергії або алергічних симптомів також включає оромукозальне застосування ефективної кількості лікарської форми алергенної вакцини, що містить (а) основу і (b) принаймні один алерген, який додатково включає протиалергічний засіб, наприклад, антигістамінні засоби, у будь-якому з описаних вище втілень. Винахід додатково включає використання алергену для виробництва стабільної швидко диспергованої не пресованої твердої лікарської форми алергенної вакцини з низькою крихкістю, що містить (а) основу і (b) принаймні один алерген, форму для використання у лікуванні алергії або полегшенні симптомів алергії. У подальшому втіленні винаходу включений фармацевтичний препарат, що містить тверді лікарські форми для оромукозального лікування алергії або полегшення симптомів алергії. Винахід також включає використання фармацевтичного препарату, що містить тверду лікарську форму для оромукозального лікування алергії або полегшення симптомів алергії. Далі винахід забезпечує стабільну швидко дисперговану не пресовану тверду лікарську форму алергенної вакцини з низькою крихкістю, що містить (а) основу і (b) принаймні один алерген, для оромукозального лікування алергії або симптомів алергії, і використання зазначеної лікарської форми для лікування алергії або симптомів алергії. У подальшому втіленні винаходу включене використання алергену для виробництва стабільної швидко диспергованої не пресованої твердої лікарської форми алергенної вакцини з низькою крихкістю, що містить (а) основу і (b) принаймні один алерген, для оромукозального лікування алергії або симптомів алергії. У ще одному втіленні винаходу стабільну швидко дисперговану не пресовану тверду лікарську форму алергенної вакцини з низькою крихкістю, що містить (а) основу і (b) принаймні один алерген, яка додатково включає антигістамінний засіб, використовують для оромукозального лікування алергії або симптомів алергії. Ще однією метою даного винаходу є забезпечення способу виробництва швидко диспергованої не пресованої твердої і стабільної лікарської форми, придатної для сублінгвального застосування, що має низьку крихкість і містить принаймні одну речовину, яка формує основу, та ефективну дозу 93479 44 для десенсибілізації особи до принаймні одного алергену, що включає етапи: a) приготування водного розчину, який містить зазначені принаймні один алерген і принаймні одну речовину, що формує основу, b) внесення розчину у заглиблення на шаруватій блістерній пластині, c) піддавання наповненої пластини заморожуванню і сушінню сублімацією при стандартних умовах температури зберігання і тиску в камері, щоб одержати зазначену тверду лікарську форму в кожному заглибленні. У переважному втіленні способу блістерна пластина є повністю алюмінієвою блістерною пластиною. В особливо переважному втіленні способу блістерна пластина є багатошаровою повністю алюмінієвою блістерною пластиною. У ще одному втіленні передбачений спосіб одержання фармацевтичного препарату, що включає швидко дисперговану не пресовану тверду і стабільну лікарську форму, придатну для сублінгвального застосування, яка має низьку крихкість і містить принаймні одну речовину, що формує основу, та ефективну дозу для десенсибілізації особи до принаймні одного алергену, що включає: 1) створення стабільної швидко диспергованої не пресованої твердої лікарської форми, 2) вимірювання крихкості зазначеної лікарської форми у випробуванні, що включає етапи: а) вміщення окремих герметичних блістерів, кожен з яких містить тверду лікарську форму, в обладнання, придатне для вимірювання крихкості; b) переміщення герметичного блістера, що містить тверду лікарську форму, протягом відповідного часу і при відповідній швидкості; c) видалення герметичного блістера, що містить тверду лікарську форму; d) відкриття блістера і вміщення твердої лікарської форми і будь-яких залишків у контейнер; є) видалення одиничної твердої лікарської форми з контейнера, залишаючи будь-які незв'язані залишки у зазначеному контейнері; f) проведення алергенспецифічного аналізу зазначених залишків з визначенням вмісту основного алергену принаймні одного основного алергену у зазначених залишках; і g) розрахунку відсотка принаймні зазначеного основного алергену у зазначених залишках від загального вмісту основного алергену в одиничній твердій лікарській формі, виявлення того, чи лікарська форма задовольняє вимоги до низької крихкості, і 3) повторення 1) та 2) доти, поки не будуть виконані вимоги до лікарської форми. Сублінгвальна імунотерапія може розглядатися як спосіб стимулювання толерантності і стимулювання вакцинації слизової оболонки. Слизова оболонка рота багата на дендритні клітини з сильним потенціалом для презентації антигену. Вважають, що дендритні клітини обробляють алергени і потім мігрують до локальних лімфовузлів, де вони презентують пептиди - похідні алергену алергенспецифічним Т-клітинам. Вважають, що ця взаємодія дендритних клітин з Т-клітинами під час 45 93479 сублінгвальної імунотерапії індукує Т-клітини з регуляторним потенціалом або підвищує співвідношення між алергенспецифічними Тh1 клітинами та алергенспецифічними Th2 клітинами. Ряд імунологічних параметрів, контрольованих під час вакцинації проти алергії, можуть бути придатними маркерами для визначення впливу або ефективності лікування, одні або у поєднанні, відповідно. Вони включають системне утворення антитіл та утворення антитіл у слизовій оболонці, наприклад, специфічних антитіл IgA, IgG та IgE; рівні цитокінів, наприклад, ΙΦΗ-γ, ІЛ-2, ІЛ-4, ІЛ-5, ІЛ-10, ІЛ-12 та ΦΗΓΊ- у крові або секреті слизових оболонок; активацію, хемотаксис, проліферацію, індукцію, продукування цитокінів та інші відповіді регуляторних Т-клітин, Тh1-клітин, Th2-клітин, СВ8-клітин, інших субпопуляцій Т-клітин або В-клітин або клітин-натуральних кілерів, і експресію маркерів клітинної поверхні, таких як CD (кластер диференціації) маркери, наприклад, CD4, CD8, CD23, CD25, CD62L, CLA, бета7, CCR9, CD69, CD45RO, CCR3, CXCR5, діяльність клітин-ефекторів, таку як загальний вміст гістаміну в базофілах; кількість еозинофілів, базофілів, лімфоцитів, моноцитів у крові, тканинах і секретах; вивільнення медіаторів еозинофілів, базофілів, лімфоцитів, моноцитів, продукування цитокінів, активацію, хемотаксис, проліферацію, індукцію та інші відповіді. У переважному втіленні вакцина за даним винаходом має профіль, де можуть бути виявлені одна або більше таких імунологічних змін: підвищена алергенспецифічна IgG відповідь, підвищена алергенспецифічна IgA відповідь, знижена алергенспецифічна IgE відповідь, нечисленні місцеві побічні ефекти; знижена алергенспецифічна ефекторна відповідь еозинофілів, базофілів, лімфоцитів і/або моноцитів; індукція Т-клітин з регуляторним потенціалом, підвищене співвідношення між алергенспецифічними Тh1 клітинами та алергенспецифічними Th2 клітинами, індукція інших клітин 46 з регуляторним потенціалом, знижена алергенспецифічна Th2 відповідь. Алергія є також відомим захворюванням у тварин, особливо домашніх тварин і тваринкомпаньйонів. У даній галузі відомо, що вони виявляють алергію до численних джерел алергенів, включаючи злаки, кліщів домашнього пилу і паразитів. Відомо, що інвазія гематофагами, тобто кровосисними комахами, призводить до гіперчутливої відповіді, яку називають блошиним алергічним дерматитом (БАД). У переважному втіленні даного винаходу алергени для тваринних вакцин включають алергени, що походять або переносяться від паразитів, таких як ектопаразити (наприклад, блохи, кліщі, комарі, мухи), отрути паразитичних гельмінтів (таких як, наприклад, Dirofilaria або онхоцеркоз, наприклад, Onchocerca) і кліщів домашнього пилу. Більш переважними є алергени слини від бліх, таких як Ctenocephalides, наприклад, С. canis і С. Felis, твердих кліщів, таких як Ixodes, Arnblyomma, м'яких кліщів, таких як Ornithodoros, і комарів, таких як Culicoides. Приклади Скорочення АБІ: активний білковий інгредієнт ДТТ: дитіотреїтол ПМЧ: парамагнітні частинки ПХ: пероксидаза хрону ТМБ: тетраметилбензидин ELISA: твердофазний імуноферментний аналіз LIA: аналіз Magic Lite специфічного IgE, імунолюмінісцентний аналіз LITE-реагент: люмінесцентний мічений антиIgE SDS-PAGE: електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію Приклад 1. Алергенна вакцина, що містить екстракт пилку злаку Phleum pratense і риб'ячий желатин Склад Таблиця 1 Інгредієнти Активний інгредієнт: Phleum pratense Одиниці Лікарська Лікарська Лікарська форма 1 форма 2 форма 3 Функція АБІ SQ-одиниці мг екстракту 2 500 0,0047 25 000 0,047 125 000 0,235 мг достатня кількість до 250мг достатня кількість до 250мг достатня кількість до 250мг 10 7,5 достатня кількість 10 7,5 достатня кількість 10 основа 7,5 основа достатня регулювання кількість рН до 7,5 Інші інгредієнти Очищена вода Желатин (риб'ячий желатин стандартної молекулярної маси, Croda, Великобританія) Манітол мг мг Гідроксид натрію мг Екстракт злаків Екстракт пилку злаків готували відповідно до методу, описаного в Ipsen and L0wensten (1983) Jour. Allergy. Clin. Immunol. 72:2, p.150-159. Стисло, пилок злаків екстрагували гідрокарбонатом амонію протягом 20 годин при температурі 5°С. Тверді частинки видаляли за допомогою центрифугування, і супернатант діалізували проти води розчинник (тричі), ліофілізували і зберігали холодним до відновлення. Тверда лікарська форма Виробничий процес 1. До аліквоти очищеної води (не менше ніж 50% від загальної кількості, потрібної на серію) додавали манітол і давали змогу розчинитися. 47 2. До розчину манітолу додавали желатин і розчин перемішували за допомогою магнітної мішалки до повного розчинення желатину. 3. Другу аліквоту очищеної води (не більше ніж 35% від загальної кількості, потрібної на серію) використовували для відновлення екстракту алергену у флаконах. Відновлений екстракт алергену додавали до манітол-желатинового розчину. 4. Значення рН нерозфасованої композиції доводили до 7,5, використовуючи свіжоприготовлений розчин гідроксиду натрію (3%, за масою). 5. Розраховували додаткову кількість очищеної води, необхідну для закінчення композиції, і переносили до не розфасованої суміші. 6. Розчин дозували у попередньо сформовані блістерні упаковки. Розчини дозували за умов температури навколишнього середовища. 7. Після дозування заповнені блістерні упаковки пропускали крізь морозильний тунель з рідким азотом. Всі заморожені препарати негайно поміщали на зберігання у замороженому стані до ліофілізації. Одиничні упаковки ліофілізували при стандартних умовах температури зберігання і тиску в камері. 8. Ліофілізовані одиничні упаковки герметично закривали покривною фольгою та остаточно пакували у саше. Стислий опис аналітичних методів Ідентифікація, профіль білка: Профіль білка визначали методом SDS-PAGE на системі Novex Mini Cell Xcell II (Invitrogen) відповідно до інструкцій виробників. Стисло, зразки розводили буфером для зразка, додавали відновник (0,5Μ ДТТ) і піддавали нагріванню до 70°С протягом 10 хвилин та залишали охолоджуватися протягом 5 хвилин. Зразок, еталон власного виробництва і стандартний маркер з низьким діапазоном розмірів (виробництва BIO-RAD) наносили в кожну ямку на NuPAGE 4-12% Bis-Tris градієнтний гель. Електрофорез виконували при 200В протягом приблизно 35 хвилин. Пізніше гель забарвлювали сріблом. Профіль білка має бути подібним до профілю еталону власного виробництва. Візуальний контроль: Всі одиничні упаковки піддавали візуальному контролю, наприклад, перевіряли колір, форму, нерівності і дефекти, щоб гарантувати прийнятний зовнішній вигляд. Подрібнення: Випробування проводили, як описано в Європейській Фармакопеї (третє видання) або сучасній Фармакопеї США. Вміст води: Залишкову воду визначали, застосовуючи принцип титрування за Карлом Фішером. Метод дає кількісне визначення вмісту води у зразку, основане на тому принципі, що задана кількість І2 призводить до перетворення еквівалентної кількості Н2О. Стисло, 1-3 тверді лікарські форми на кожен флакон тестували у трьох повторностях у титраторі Карла Фішера відповідно до інструкцій виробників разом з контрольними пробами (4 на серію) і стандартними зразками KF, дивіться приклад 10. Загальна алергенна активність: Випробування проводили, використовуючи LIA (описаний в Eiken et al., Allergy 1992, 47:495-497), який є конкурентним імунологічним аналізом. 100 мкл моноклона 93479 48 льних антитіл до IgE людини, зв'язаних з парамагнітними частинками (ПМЧ) (ADVIA Centaur PMP, ALK-Abello A/S, Данія), промивали тричі і додавали 100мкл пулу сироватки пацієнта зі специфічними до Phleum pratense антитілами IgE та інкубували на апараті для струшування протягом 2 годин при температурі 2-8°С, за допомогою чого специфічні IgE зв'язувалися з ПМЧ. ПМЧ промивали для видалення антитіл IgG тричі желатиновим буфером. Десять твердих лікарських форм розчиняли у желатиновому буфері і готували розведення 625 SQодиниць або 1250 SQ-одиниць на таблетку. Застосовували зразки або еталони з відомим вмістом біотинільованого АБІ Phleum pratense та інкубували протягом ночі на апараті для струшування при температурі 2-8°С. Зразки і біотинільований АБІ будуть конкурувати за сайти зв'язування IgE, коли концентрація алергену у зразку зростає, кількість зв'язаного біотинільованого АБІ падатиме. Після інкубування зразки тричі промивали желатиновим буфером і наносили LITE-реагент, наприклад, стрептавідин-зв'язаний акридиновий ефір хемілюмінесцентної сполуки (ADVIA Centaur Lite Reagens, ALK-Abello A/S). Зразки інкубували протягом 2 годин на апараті для струшування при 2-8°С, тричі промивали желатиновим буфером і читали у люменометрі. Відповідь є обернено зв'язаною з концентрацією алергену у зразку. Вміст основного алергену: Випробування проводили, використовуючи метод ELISA згідно з Obispo et al, Allergy, 1997, 52, pp.806-813. Метод ELISA вимірює концентрацію основного алергену 5 Phleum pratense (Phi р 5). Два моноклональні антитіла (ALK-Abello A/S, Данія), що реагують з різними епітопами на молекулі Phi p 5, покривали мікротитраційний планшет протягом ночі при 4°С. Після промивання (4 рази з промивним буфером, 0,1 Μ фізіологічним розчином з фосфатним буфером, 0,05% Tween-20) і блокування планшета блокувальним буфером (2% казеїновим буфером), наносили зразки/еталони, які потім зв'язуються з антитілами. Після промивання знову (4 рази з промивним буфером) біотинільовані поліклональні антитіла кроля (ALK-Abello A/S, Данія) проти антигенів Phleum pratense наносили у ямки і давали їм змогу реагувати. Після чотириразового промивання промивним буфером стрептавідин, зв'язаний з пероксидазою хрону (ПХ) (DAKO, Denmark), наносили на ямки і дозволяли реагувати протягом 1 години при кімнатній температурі (при струшуванні). Після чотириразового промивання промивним буфером наносили субстрат (ТМБ, КЕМ EN ТЕС) для ферменту ПХ і дозволяли реагувати протягом 20 хвилин, після чого реакцію зупиняли 0,5н. сірчаною кислотою. Колір, який розвивався, вимірювали на спектрофотометрі, наприклад, Multilabel counter Victor 2, при 450нм. Крихкість: Крихкість швидко диспергованих лікарських форм вимірювали, використовуючи такий метод: Герметично запечатану блістерну пластину, що містить 10 блістерів, кожен з яких містить тверду лікарську форму, розрізали на 10 окремих блістерів, і кожен блістер вміщували в окрему одиницю обладнання, придатного для вимірювання 49 93479 крихкості, як описано у третьому виданні Європейської Фармакопеї, V.2.9.7, і одиничні блістери обертали 100 разів зі швидкістю 25±1 обертів/хвилину. Одиничні блістери видаляли, відкривали, і тверду лікарську форму переносили у придатний контейнер. Далі тверду лікарську форму видаляли з кон 50 тейнера, залишаючи будь-які незв'язані залишки у зазначеному контейнері. Проводили імунохімічний алергенспецифічний аналіз (ELISA), щоб виявити кількісний вміст алергену у залишках (дивіться вище). Результати дослідження стабільності Таблиця 2 Препарат Умови зберігання: Випробування: Лікарська форма, що містить 2500 SQ-одиниць Phleum pratense 25°С/відносна вологість 60% Вміст осно- Загальна алеКрихкість, % втрат від загаПодрібнення Вміст Візуальний вного алер- ргенна активльного вмісту екстракту (секунди) води (%) контроль гену ність (АБІ) (%) (%) Відбір зразків (місяці) початок 1 2 3 6 9 Умови зберігання: Випробування: 8 5,5 відповідає 5 4,9 відповідає 6 5,4 відповідає 5 5,2 відповідає н.в. н.в. н.в. 5 5,3 відповідає 40°С/відносна вологість 75% 0,000 н.в. н.в. 0,000 н.в. 0,000 Крихкість, % втрат від загаПодрібнення Вміст води льного вмісту екстракту (секунди) (%) (АБІ) Відбір зразків (місяці) 1 2 3 6 9 н.в. н.в. 0,005 н.в. 0,005 3 8 6 н.в. 4 4,8 5,2 5,4 н.в. 5,1 Візуальний контроль відповідає відповідає відповідає н.в. відповідає 96 79 96 94 н.в. 83 101 91 102 82 н.в. 105 Вміст осно- Загальна алевного алер- ргенна активгену ність (%) (%) 85 85 94 н.в. 70 86 100 83 н.в. 92 Таблиця 3 Препарат Умови зберігання: Випробування: Відбір зразків (місяці) початок 1 2 3 6 9 Умови зберігання: Випробува ння: Відбір зразків (місяці): 1 2 3 6 9 Лікарська форма, що містить 25000 SQ-одиниць Phleum pratense 25°С/відносна вологість 60% Крихкість % втрат від загального вмісту екстракту (АБІ) Подрібнення (секунди) 0,000 н.в. Н.В. Н.В. н.в. 0,000 8 н.в. н.в. н.в. 7 4 Крихкість % втрат від загального вмісту екстракту (АБІ) Подрібнення (секунди) Ідентифікація Вміст води (%) н.в. н.в. 0,005 н.в. 0,005 н.в. н.в. н.в. 6 4 відповідає відповідає відповідає відповідає відповідає н.в. н.в. н.в. н.в. 5,0 Ідентифікація Вміст води (%) Візуальний Вміст основноконтроль го алергену (%) відповідає 6,3 відповідає відповідає н.в. н.в. відповідає н.в. н.в. відповідає н.в. н.в. відповідає н.в. відповідає відповідає 5,1 відповідає 40°С/відносна вологість 75% 106 н.в. н.в. н.в. 87 79 Візуальний Вміст основноконтроль го алергену (%) н.в. н.в. н.в. відповідає відповідає н.в. н.в. н.в. 84 77 Загальна алергенна активність (%) 104 н.в. н.в. н.в. 141 105 Загальна алергенна активність (%) н.в. н.в. н.в. 135 105 51 93479 52 Таблиця 4 Препарат Умови зберігання: Лікарська форма, що містить 125000 SQ-одиниць Phleum pratense 25°С/відносна вологість 60% Крихкість % втрат Вміст основПодрібнення ІдентиВміст Візуальний Загальна алергенна Випробування: від загального вмісного алергену (секунди) фікація води (%) контроль активність (%) ту екстракту (АБІ) (%) Відбір зразків (місяці): початок 0,000 5 відповідає 4,7 відповідає 100 100 1 н.в. 10 відповідає 3,9 відповідає 84 93 2 н.в. 5 відповідає 4,5 відповідає 92 104 3 н.в. 8 відповідає 4,8 відповідає 80 88 6 н.в. 6 відповідає н.в. відповідає н.в. н.в. 9 0,003 5 відповідає 4,5 відповідає 77 106 Умови 40°С/відносна вологість 75% зберігання: Крихкість % втрат Загальна алерПодрібнення ІдентиВміст Візуальний Вміст основноВипробування: від загального вмісгенна активність (секунди) фікація води (%) контроль го алергену (%) ту екстракту (АБІ) (%) Відбір зразків (місяці): 1 н.в. 4 відповідає 4,1 відповідає 90 92 2 н.в. 6 відповідає 4,6 відповідає 91 109 3 0,001 7 відповідає 4,5 відповідає 83 89 6 н.в. 5 відповідає н.в. відповідає н.в. н.в. ; 9 н.в. 5' відповідає 4,6 відповідає 78 118 н.в. - не вимірювали *Середнє значення з лише 3 лікарських форм Приклад 2. Алергенна вакцина, що містить екстракт пилку злаку Phleum pratense і крохмаль Склад Таблиця 5 Інгредієнти Активний інгредієнт: Phleum pratense Одиниці Лікарська форма 1 Лікарська форма 2 Лікарська форма 3 Функція SQ-одиниці мг екстракту 2500 0,0047 25000 0,047 125000 0,235 АБІ достатня кількість до 250мг 9 9 достатня кількість до 250мг 11 11 достатня кількість достатня кількість Інші інгредієнти Очищена вода мг Пептизований крохмаль Манітол мг мг достатня кількість до 250мг 8 8 Гідроксид натрію мг достатня кількість розчинник основа основа регулювання рН до 7,5 Виробничий процес Такий самий, як у прикладі 1, замість желатину (риб'ячого походження) додавали пептизований крохмаль. Стислий опис аналітичних методів Такі самі, як у прикладі 1. Таблиця 6 Результати дослідження стабільності Препарат Умови зберігання: Випробування: Початок 1 Лікарська форма, що містить 2 500 SQ-одиниць Phleum pratense 25°С/відносна вологість 60% Крихкість, % втрат від Подрібнення Вміст води Візуальний Загальна алергенна загального вмісту екстра(секунди) (%) контроль активність (%) кту (АБІ) Відбір зразків (місяці): 0,008 8 3,5 відповідає 101 н.в. 5 3,0 відповідає 80 53 93479 54 Продовження таблиці 6 н.в. 0,021 н.в. 0,010 2 3 6 9 Умови зберігання: Випробування: 1 2 3 6 9 6 3,6 відповідає 5 3,9 відповідає н.в. н.в. н.в. 5 3,5 залишки 40°С/відносна вологість 75% Крихкість, % втрат від Подрібнення загального вмісту екстрак(секунди) ту (АБІ) Відбір зразків (місяці): н.в. 3 н.в. 8 0,022 6 н.в. н.в. 0,003 4 Вміст води (%) 99 69 н.в. 101 Візуальний Загальна алергенконтроль на активність (%) відповідає відповідає відповідає н.в. залишки 2,9 3,7 4,3 н.в. н.в. 74 98 73 н.в. 75 Таблиця 7 Препарат Умови зберігання: Лікарська форма, що містить 25 Phleum pratense 000 SQ-одиниць 25°С/відносна вологість 60% Крихкість, % втрат Випробування: від загального вмісту екстракту (АБІ) Початок 1 2 3 6 9 Умови зберігання: Подрібнення (секунди) 0,022 н.в. н.в. н.в. н.в. 0,010 10 н.в. н.в. н.в. н.в. 160 Ідентифік ація Візуальний контроль Відбір зразків (місяці): відповідає відповідає відповідає відповідає н.в. н.в. 3,3 н.в. н.в. н.в. н.в. 3,5 Загальна алергенна активність (%) відповідає н.в. н.в. н.в. н.в. залишки Вміст води (%) 106 н.в. н.в. н.в. н.в. 99 40°С/відносна і вологості >75% Відбір зразків (місяці): Крихкість, % втрат Випробування: від загального вмісту екстракту (АБІ) 1 н.в. 2 н.в. 3 н.в. 6 н.в. 9 0,050 Подрібнення (секунди) Ідентифік ація Вміст води (%) Візуальний контроль н.в. н.в. н.в. н.в. 60 відповідає відповідає відповідає н.в. н.в. н.в. н.в. н.в. н.в. 3,4 н.в. н.в. н.в. н.в. залишки Загальна алергенна активність (%) н.в. н.в. н.в. н.в. 96 Таблиця 8 Препарат Умови зберігання: Випробування: Початок 1 2 3 6 9 Умови зберігання: Лікарська форма, що містить 125000 SQ-одиниць Phleum pratense 25°С/відноснавологість 60% Крихкість, % втрат від загального вмісту екстракту (АБІ) 0,041 н.в. н.в. 0,055 н.в. 0,0030 Випробування: Крихкість, % втрат від загального вмісту екстракту (АБІ) 1 2 3 6 9 н.в. н.в. 0,033 н.в. н.в. Подрібнення (секунди) Ідентифікація Візуальний контроль Загальна алергенна активність (%) відповідає залишки залишки залишки н.в. залишки 121 102 126 102 н.в. 99 Вміст води (%) Візуальний контроль Загальна алергенна активність (%) 2,5 3,1 3,5 н.в. 2,7 залишки залишки залишки н.в. залишки 96 121 97 н.в. ПО Вміст води (%) Відбір зразків (місяці): 11 відповідає 2,6 18 відповідає 2,4 30 відповідає 3,0 28 відповідає 3,6 н.в. н.в. н.в. 58 н.в. 2,9 40°С/відносна вологісті, 75% Подрібнення (секунди) Ідентифікація Відбір зразків (місяці): 58 відповідає 25 відповідає 25 відповідає н.в. н.в. 70 н.в. 55 93479 56 Приклад 3. Алергенна вакцина, що містить екстракт злаку і риб'ячий желатин Таблиця 9 Інгредієнти Одиниці Лікарська форма 1 Лікарська форма 2 Лікарська форма 3 Функція Активний інгредієнт: Phleum pratense SQ-одиниці 2500 25000 75000 активна речовина мг екстракту 0,0047 0,047 0,141 Інші інгредієнти: Очищена вода Желатин (риб'ячого походження)* Манітол Гідроксид натрію мг мг мг мг достатня кількість достатня кількість достатня кількість до 250мг до 250мг до 250мг 16 16 розчинник основа 16 14 14 14 основа достатня кількість достатня кількість достатня кількість регулювання рН до 7,5 Виробничий процес Такий самий, як у прикладі 1. Стислий опис аналітичних методів Такі самі, як у прикладі 1, за винятком того, що крихкість і стабільність не вимірювали. Таблиця 10 Результати аналізу Методи випробування Концентрація 2500 SQ-одиниць/лікарську форму 25000 SQ-одиниць/лікарську форму 75000 SQ-одиниць/лікарську форму Вміст основного алергену (%), ELISA Загальна алергенна активність (%), LIA Подрібнення (секунди) Вміст води (%) 97 100 94 102 89 95 1 1 1 5,5 5,3 5,2 Результати забезпечують втілення твердої лікарської форми, що містить алерген, яка включає три різні дози екстракту алергену злаків у речовині, що формує основу, яка складається з 6,5% риб'ячого желатину і 5,5% манітолу. Всі лікарські форми мають стабільний вміст алергену та алергенну активність при виробництві. Крім того, результати показують, що всі лікарські форми мають вміст води у переважному діапазоні 4-7%. Як це очевидно з прикладів 1, 2 і 3, можливо виробляти швидко дисперговані тверді лікарські форми алергенної вакцини, які подрібнюються миттєво. Було виявлено, що втрата загального вмісту екстракту є прийнятною, навіть якщо візуальний контроль призводив до виявлення залишків у деяких блістерних упаковках (переважно, у вищій мірі для основ, що містять крохмаль), кількість залишку, тобто втрата вмісту алергену, знаходилася у прийнятних межах, тобто була меншою ніж 0,5мкг екстракту. Таким чином, можливо виробляти непресовані швидкодисперговані тверді лікарські форми з низькою крихкістю, що містять алергени. Дані щодо стабільності показують, що композиції є стабільними при кімнатній температурі і при підвищеній температурі та вологості протягом дев'яти місяців. Вміст алергену і загальна алергенна активність залишаються незмінними (в межах відхилення методу аналізу і відповідно до монографії для алергенних продуктів третього видання Європейської Фармакопеї; загальна алергенна активність становить 50-200% від теоретичного значення, вміст основного алергену - 65-135% від теоретичного значення). Всі серії промислового виробництва піддавали візуальному контролю і виявили, що вони знаходяться у прийнятних межах. Приклад 4. Композиції алергенних вакцин Були приготовані тверді лікарські форми алергенних вакцин, які містять різні співвідношення речовин, що формують основу. Таблиця 11 % % Жела- Манітину толу 4,00 3,00 4,00 3,00 5,00 3,75 5,00 3,75 6,00 4,50 6,00 4,50 7,00 5,25 7,00 5,25 Тип упаковки 5-шарова фольга ПВХ/ПВДХ 5-шарова фольга ПВХ/ПВДХ 5-шарова фольга ПВХ/ПВДХ 5-шарова фольга ПВХ/ПВДХ Наванта- Час подження до рібруйнування нення (кгс) (секунди) 0,158
ДивитисяДодаткова інформація
Назва патенту англійськоюAllergen dosage form
Автори англійськоюHoughton Christian Gauguin, Lundegaard Annette Rommelmayer, Jacobi Henrik Hugo, Aasmul-Olsen Stig, Maerkedahl Lise Lund, Andersen Jan Sondergaard
Назва патенту російськоюФармацевтический аллергенный препарат
Автори російськоюХафтон Кристиан Гаугуин, Лундегорд Аннетте Реммельмайер, Якоби Хенрик Хьюго, Осмуль-Ольсен Стиг, Меркедаль Лизе Лунд, Андерсен Ян Сендергорд
МПК / Мітки
МПК: A61K 47/26, A61K 47/36, A61K 9/26, A61K 47/42, A61K 39/35, A61P 37/08
Мітки: препарат, алергенний, фармацевтичний
Код посилання
<a href="https://ua.patents.su/35-93479-farmacevtichnijj-alergennijj-preparat.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичний алергенний препарат</a>
Попередній патент: Виділене моноклональне антитіло людини, яке зв’язується з сd20, та його застосування
Наступний патент: Каталізатор для окиснення метанолу у формальдегід, спосіб його виготовлення та спосіб окиснення метанолу у формальдегід
Випадковий патент: Спосіб інтелектуальної діагностики виробничих об'єктів