Лікування запальних захворювань кишечника бета-дефензинами людини
Номер патенту: 99539
Опубліковано: 27.08.2012
Автори: Кджаєрульфф Соерен, Мюгін Пер Хольсе, Брінч Кароліне Зідельманн, Андерсен Біргітте, Кджаєр Таня Марія Розенкільд, Крузе Томас
Формула / Реферат
1. Застосування бета-дефензину людини при виробництві лікарського препарату для парентерального введення при лікуванні запального захворювання кишечника.
2. Застосування за п. 1, де бета-дефензин людини вводиться підшкірно або внутрішньовенно.
3. Застосування за будь-яким з пп. 1, 2, де бета-дефензин людини вводиться при добовому дозуванні від 0,001 мг/кг ваги тіла до 10 мг/кг ваги тіла, переважно від 0,01 мг/кг ваги тіла до 10 мг/кг ваги тіла.
4. Застосування за будь-яким з пп. 1-3, де бета-дефензин людини має щонайменше 80% ідентичність до амінокислотних послідовностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 або SEQ ID NO:4.
5. Застосування за будь-яким з пп. 1-4, де бета-дефензин людини являє собою бета-дефензин-1 людини, бета-дефензин-2 людини, бета-дефензин-3 людини або бета-дефензин-4 людини.
6. Застосування за будь-яким з пп. 1-5, де бета-дефензин людини має щонайменше 80% ідентичність до амінокислотної послідовності SEQ ID NO:2.
7. Застосування за будь-яким з пп. 1-6, де бета-дефензин людини являє собою бета-дефензин-2 людини (SEQ ID NO: 2).
8. Застосування за будь-яким з пп. 1-7, де активність TNF-альфа в оброблених тканинах зменшується.
Текст
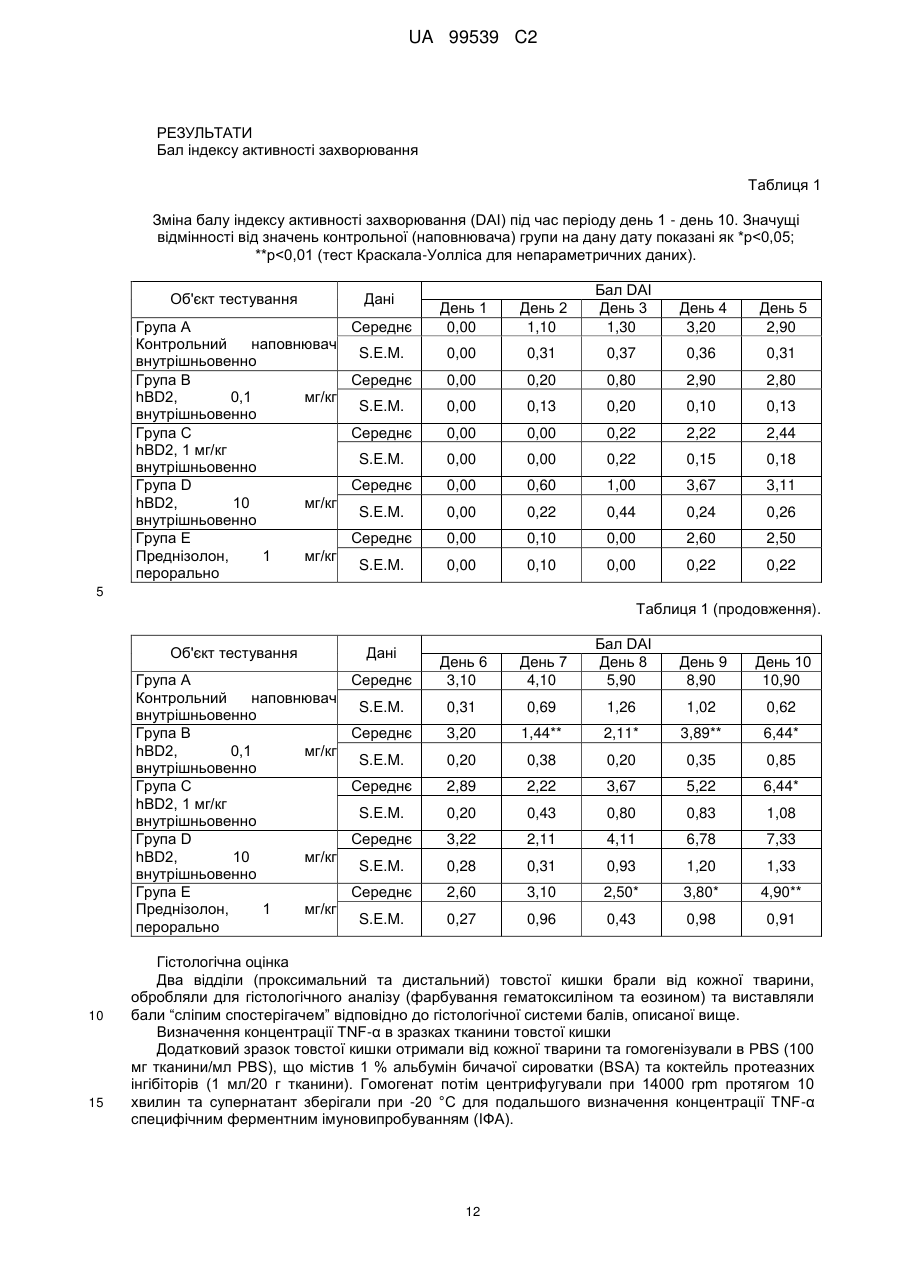
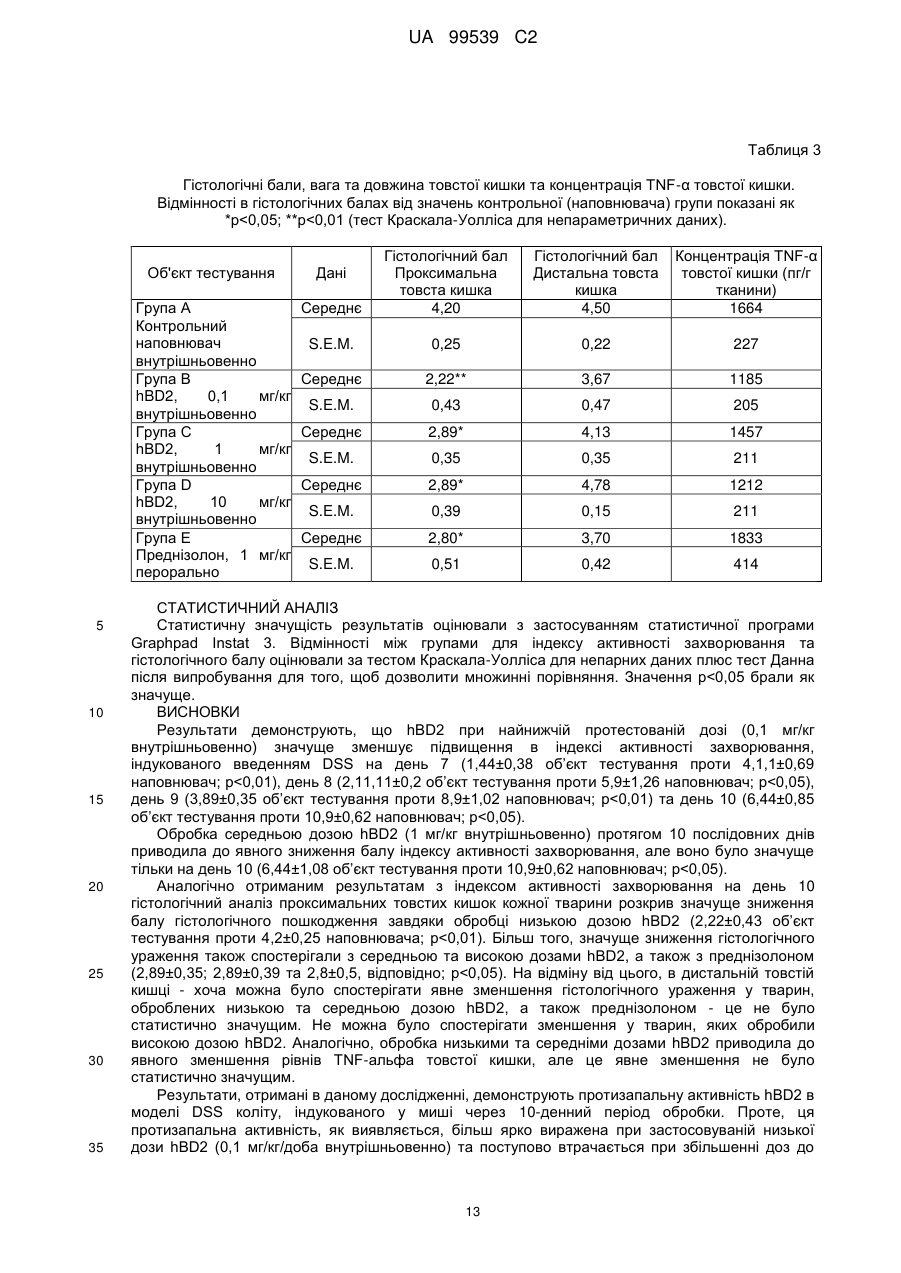
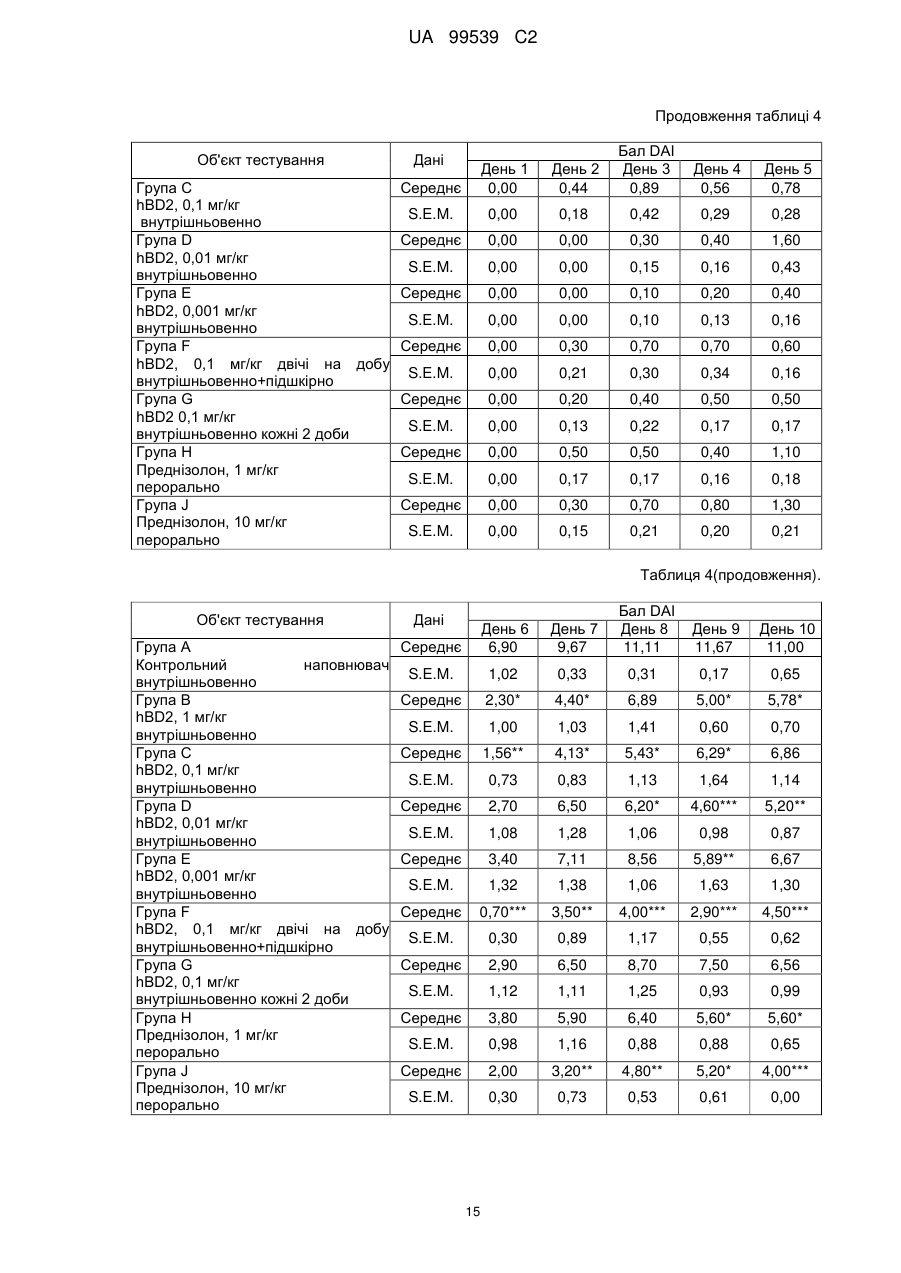
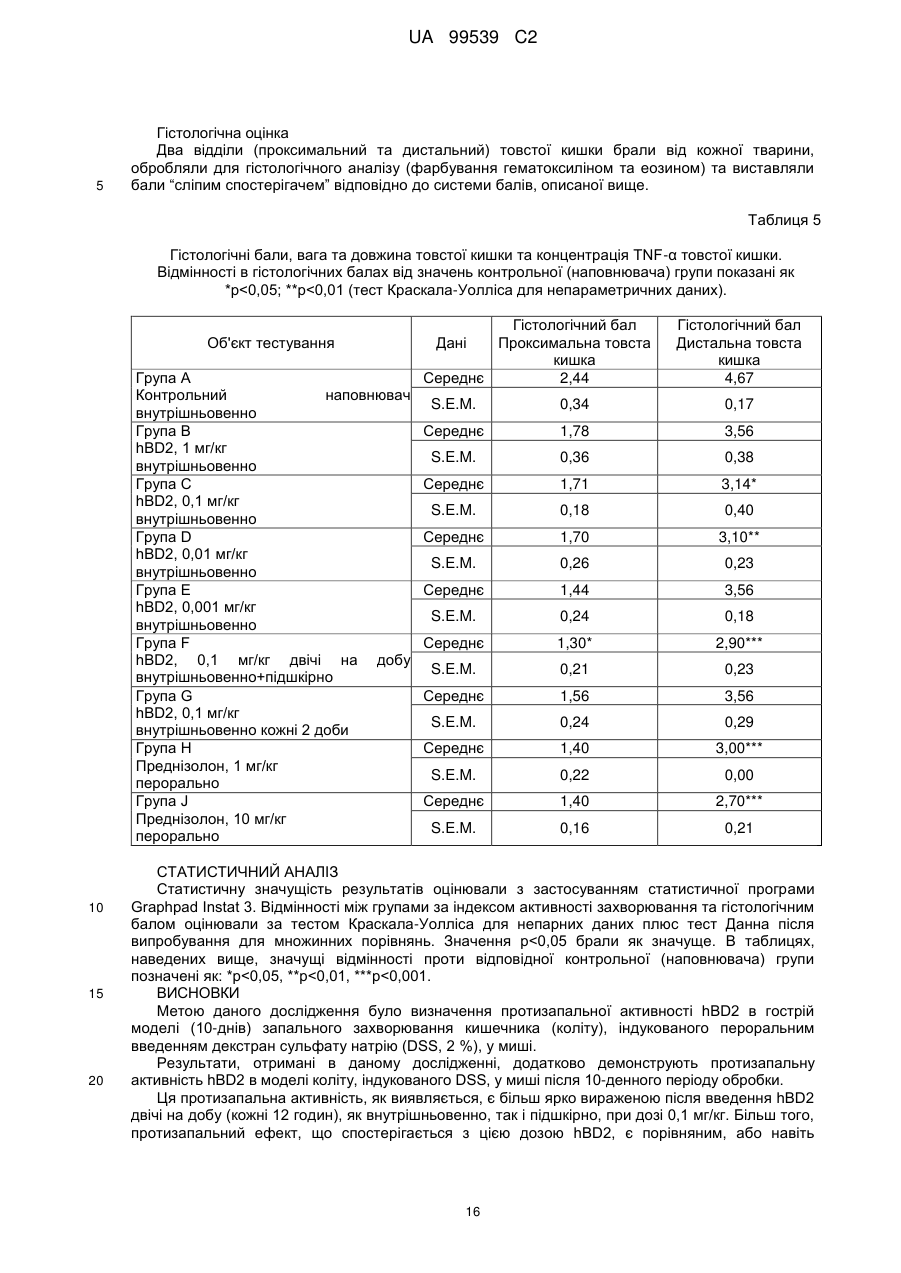
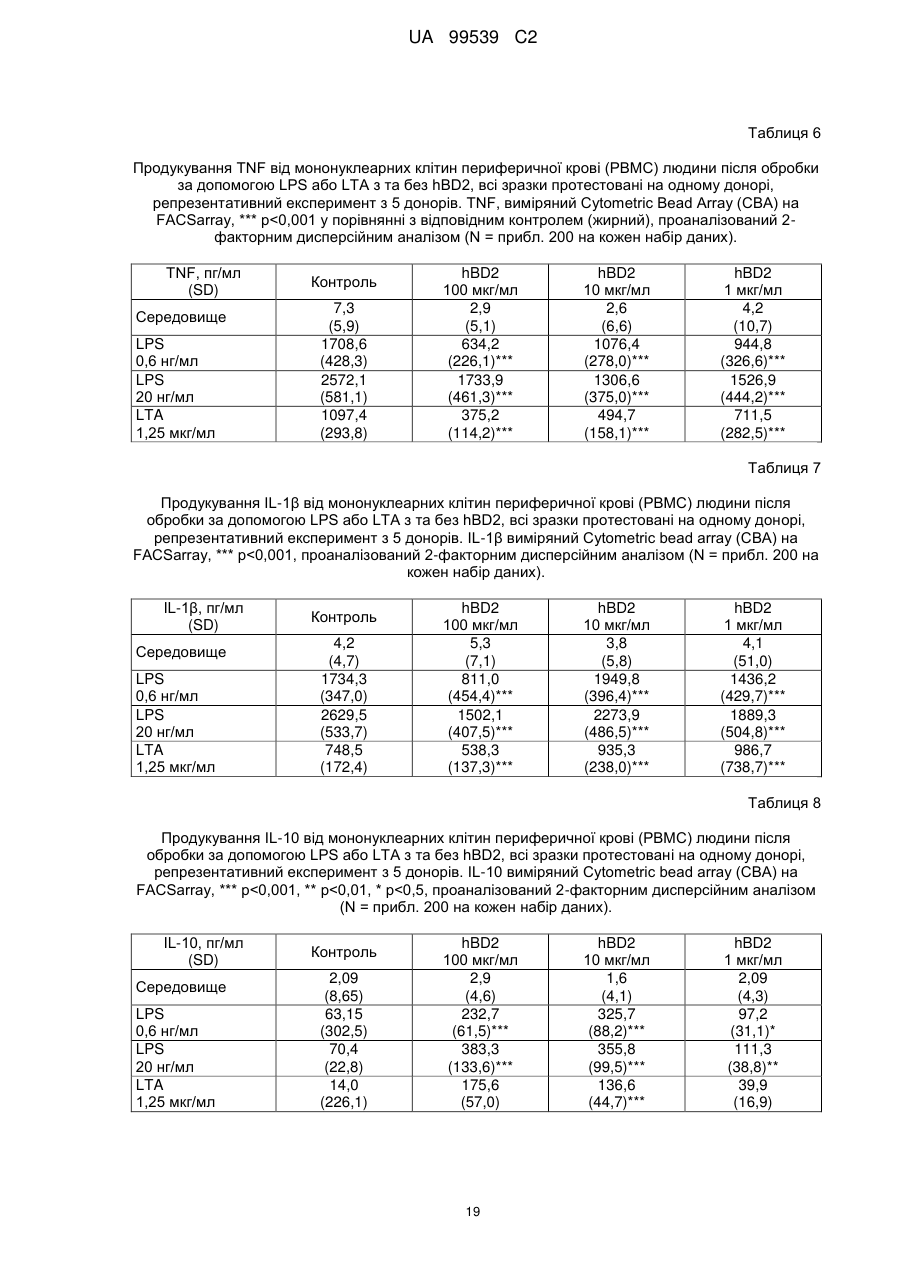
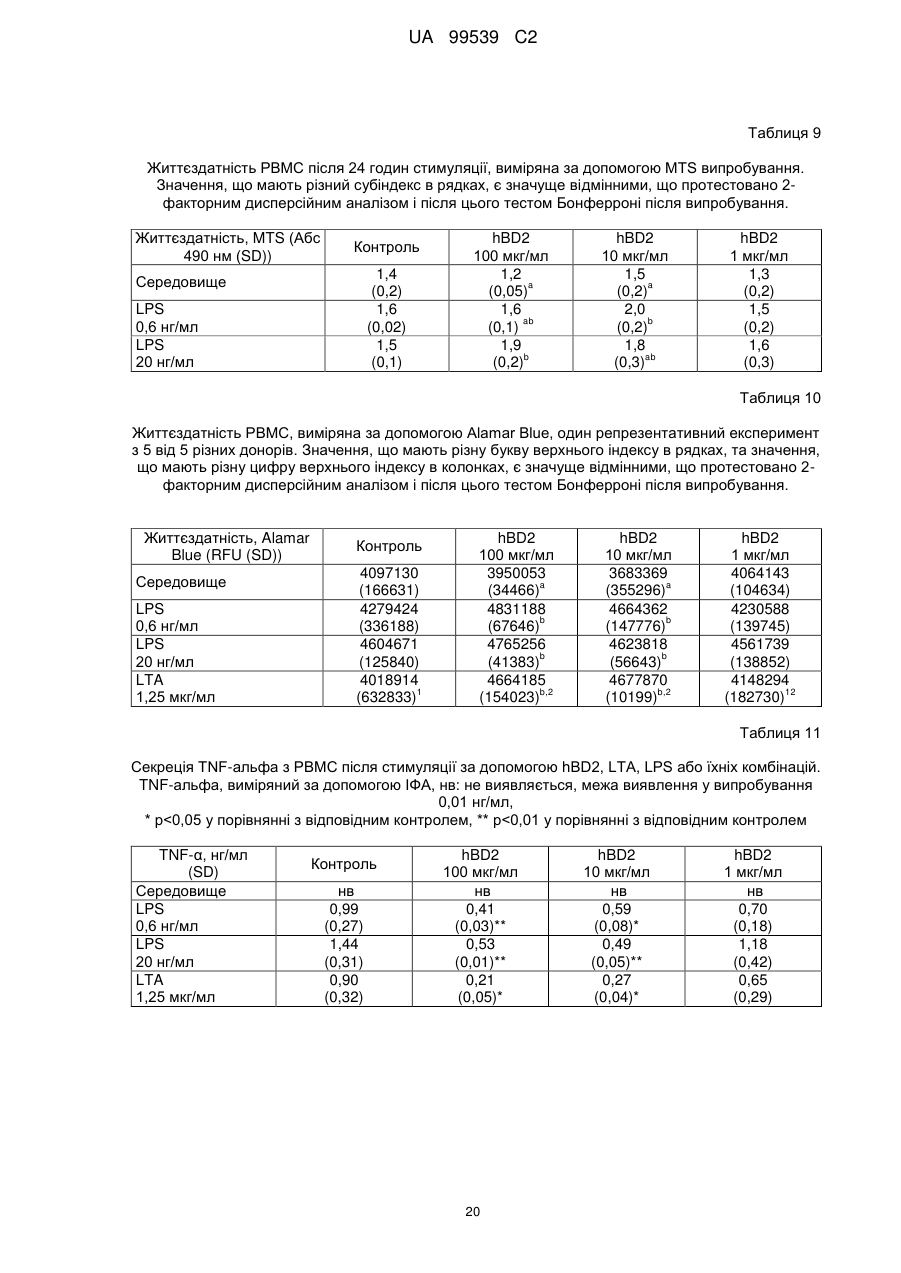
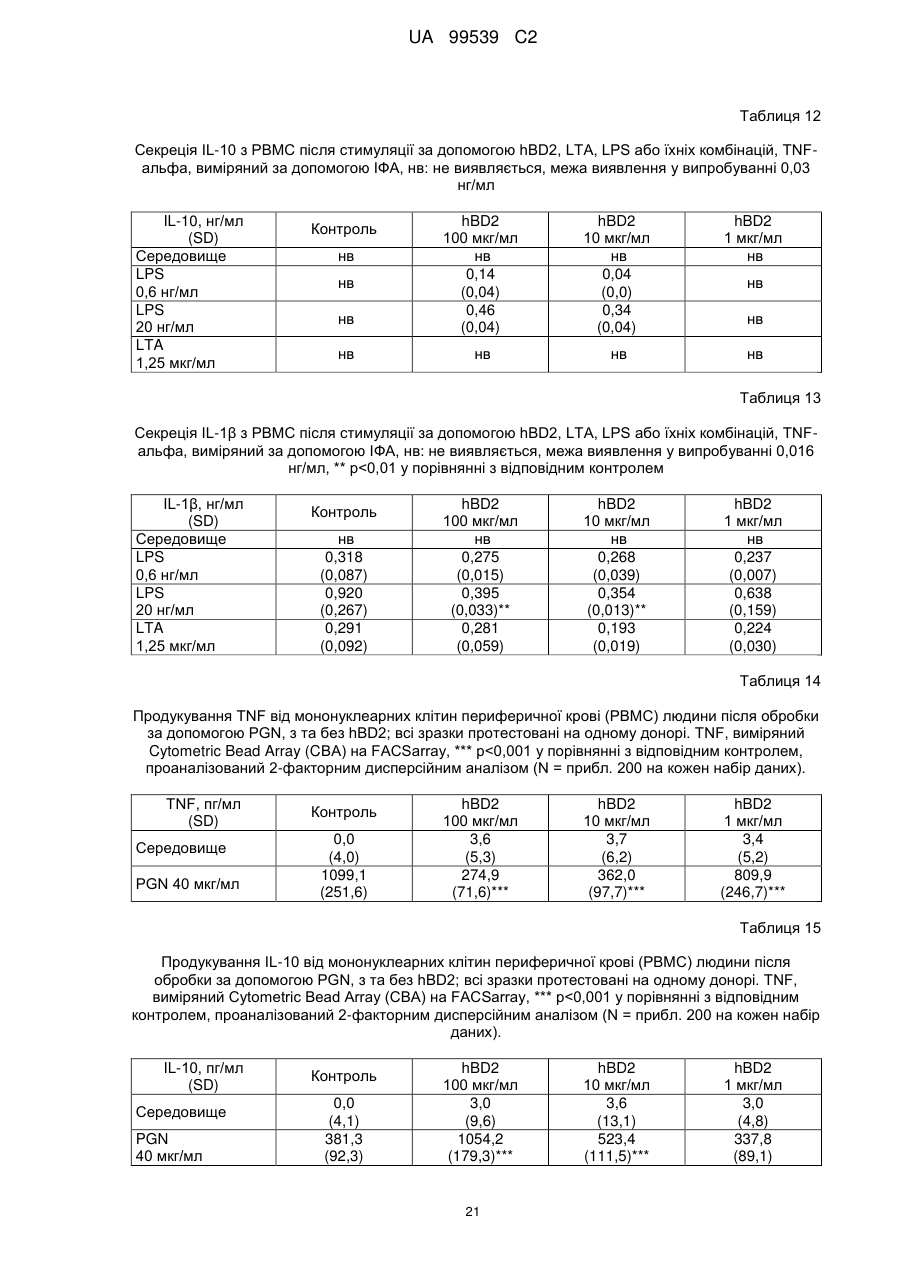
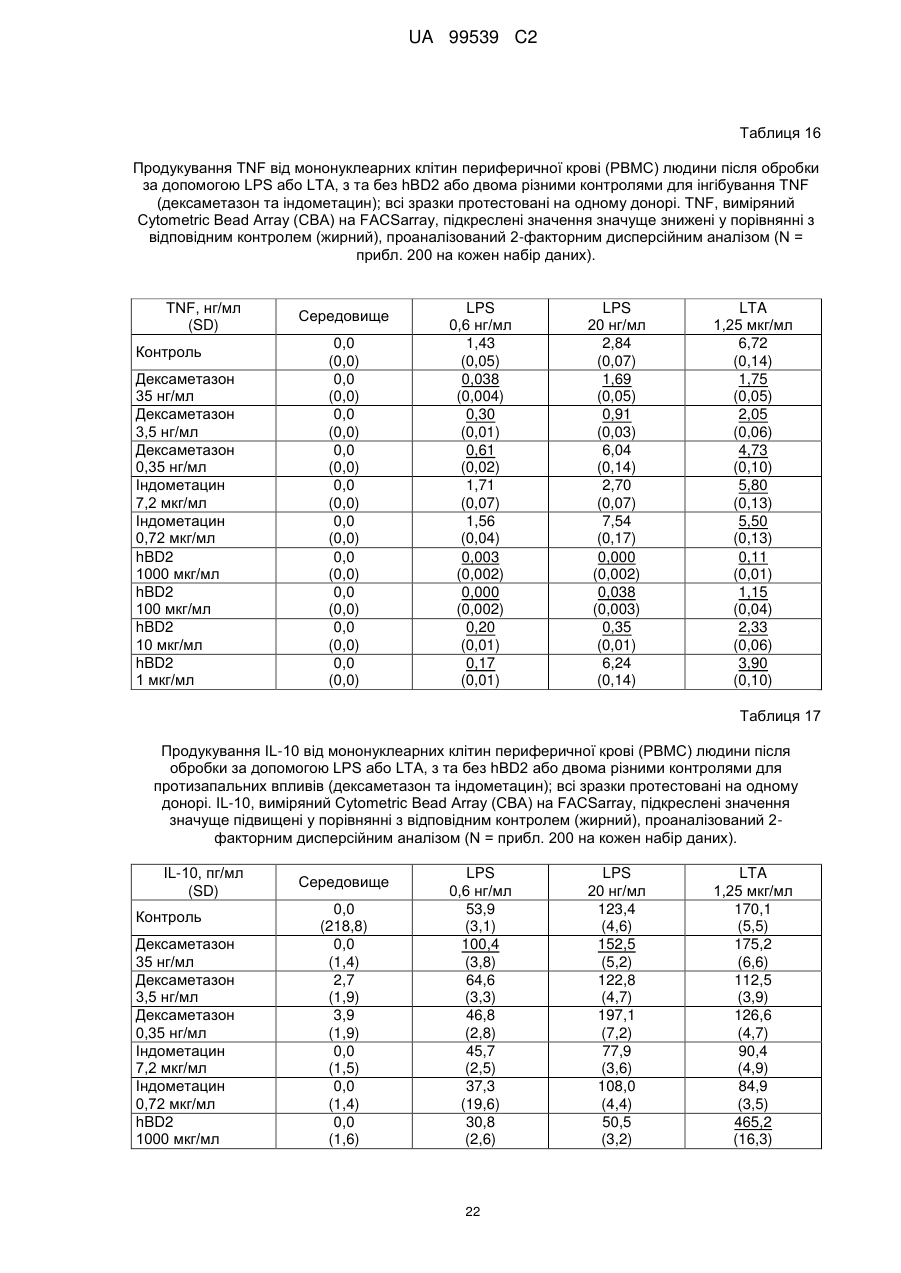
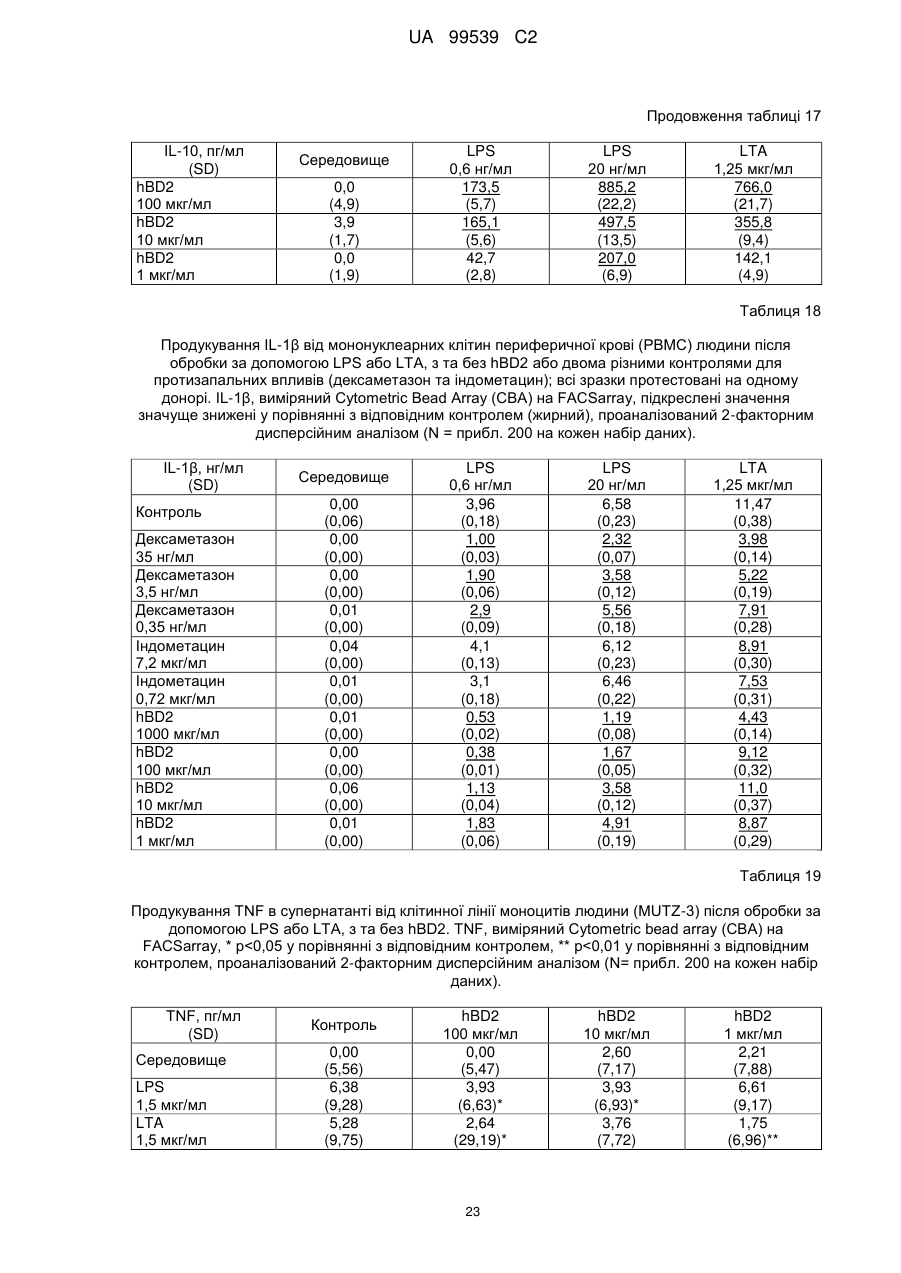
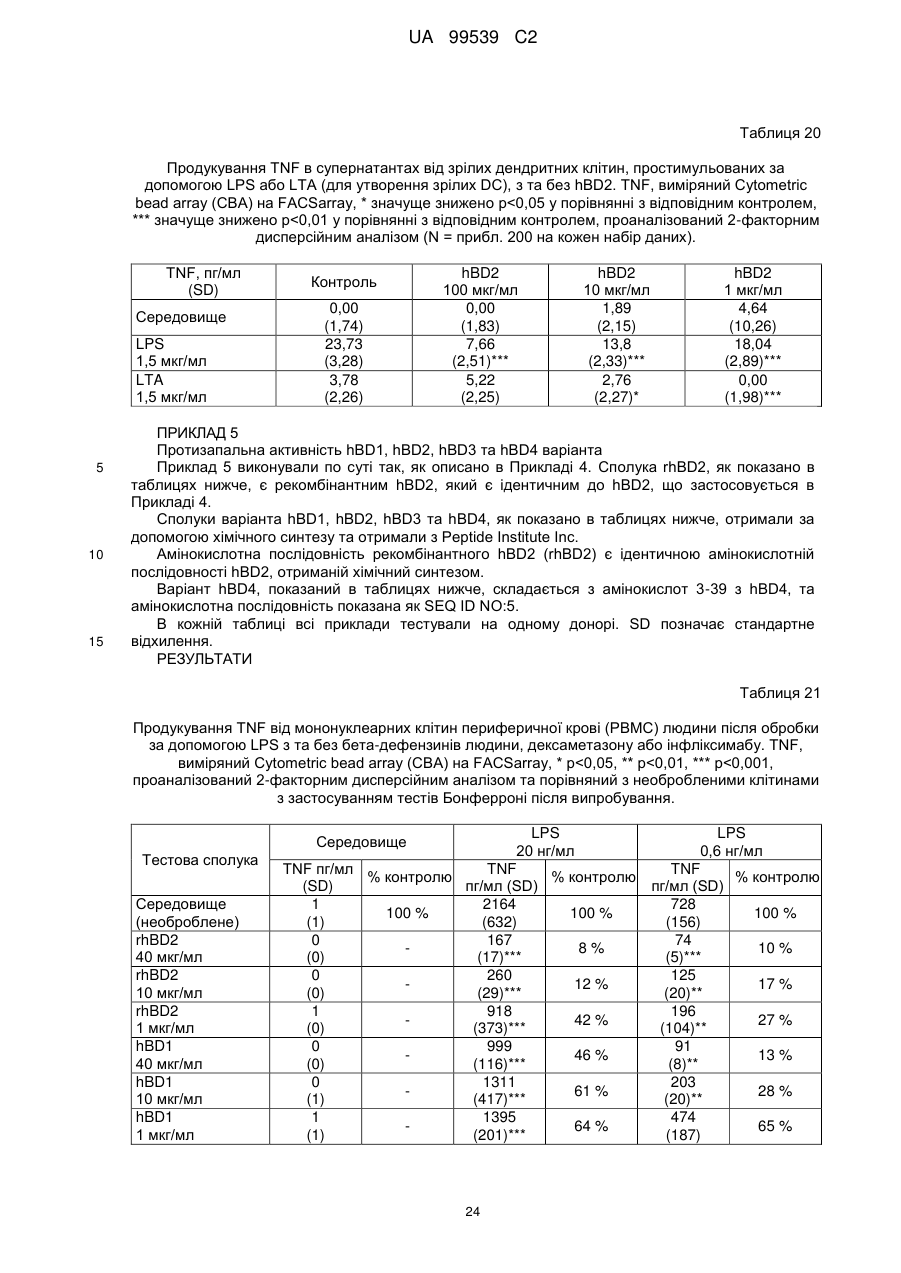
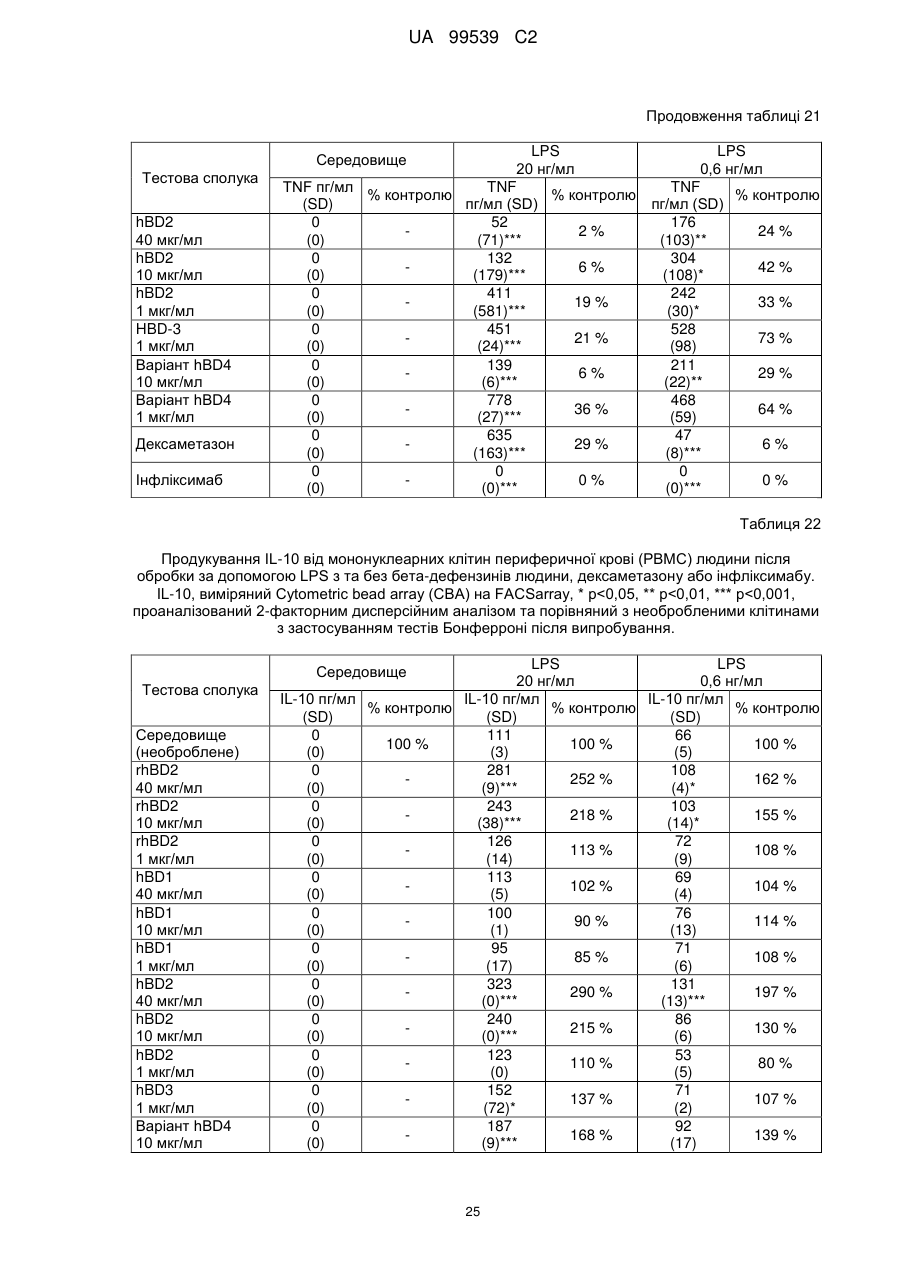
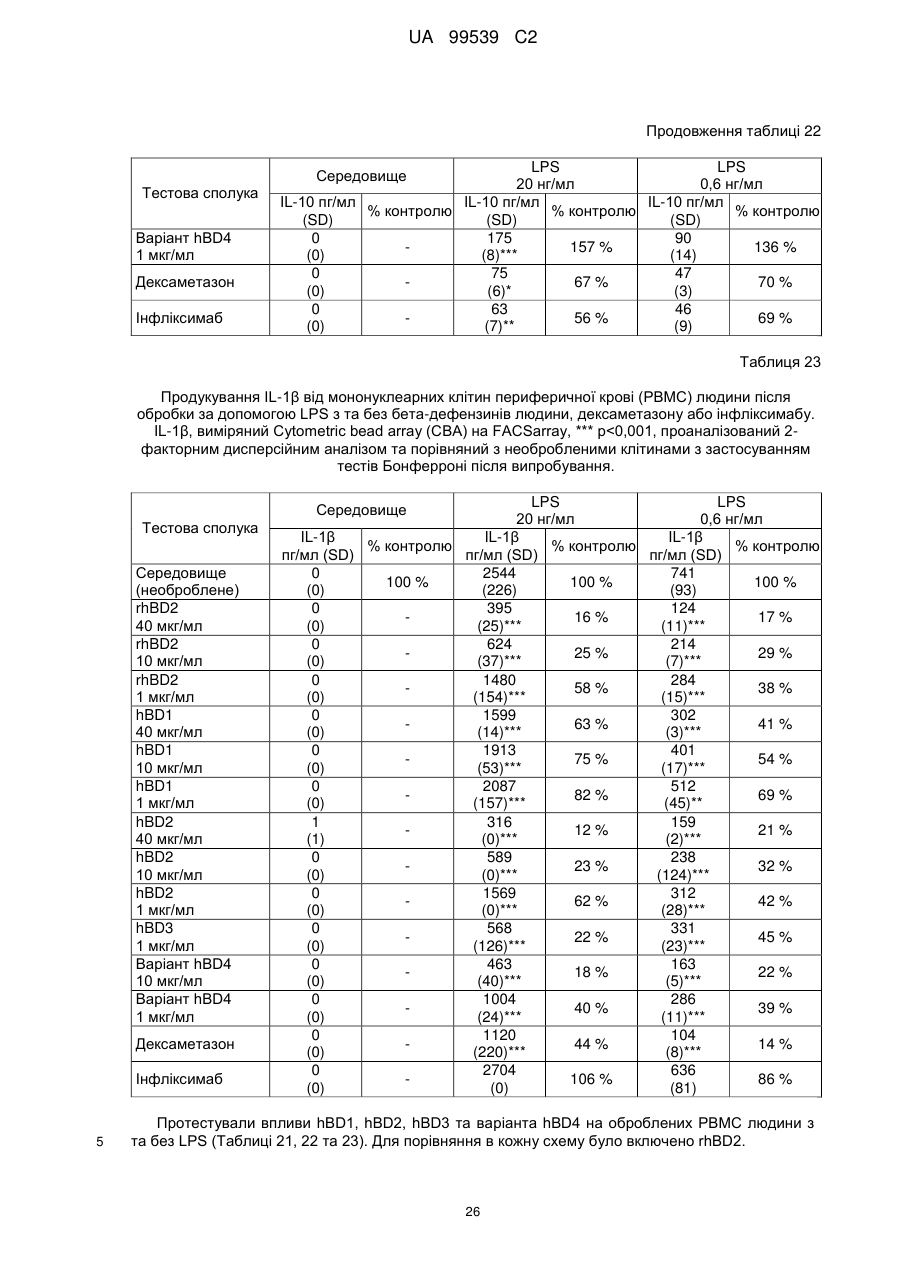
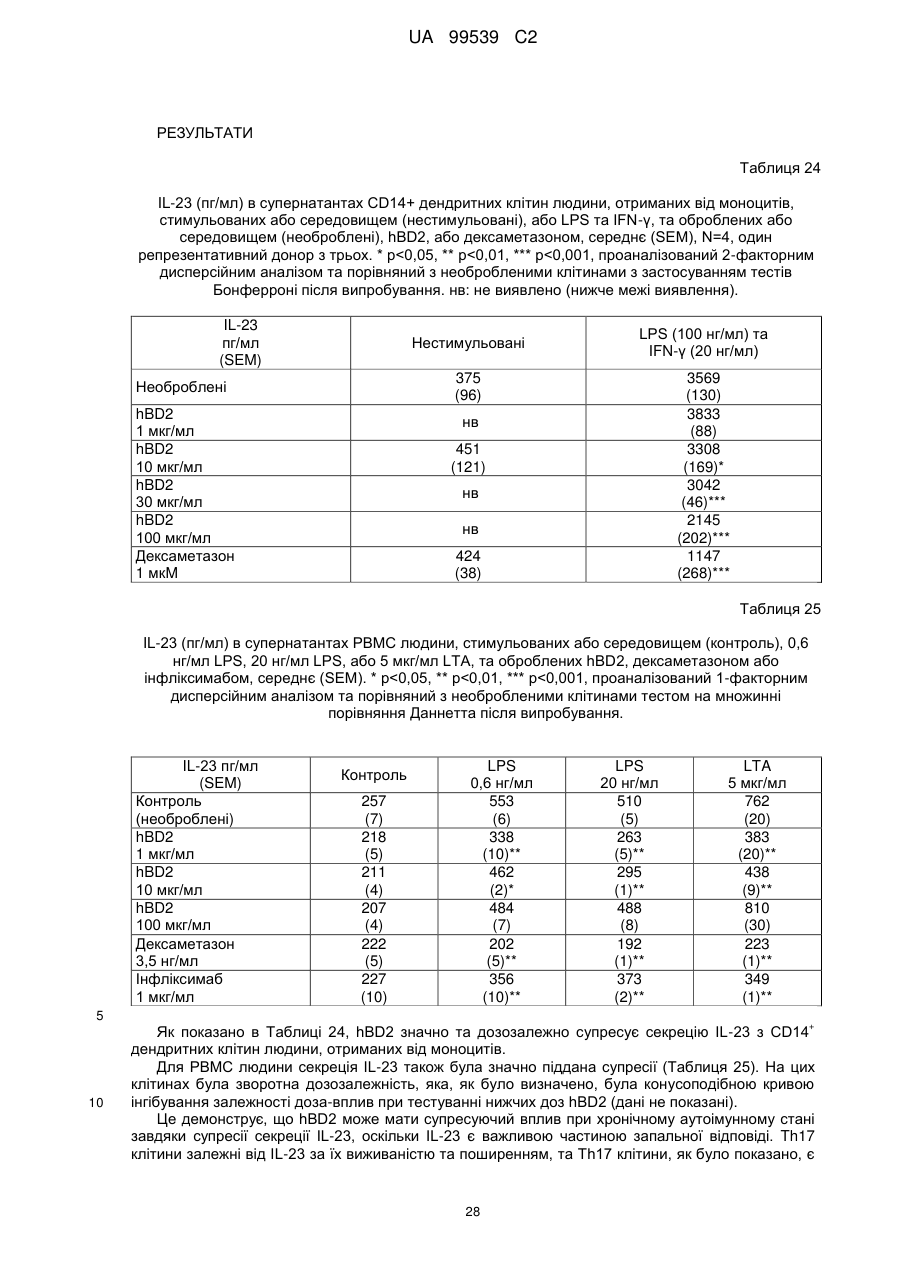
Реферат: Винахід стосується застосування бета-дефензину людини при виробництві лікарського препарату для парентерального введення при лікуванні запального захворювання кишечника. UA 99539 C2 (12) UA 99539 C2 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця заявка містить Перелік послідовностей у формі, що читається комп’ютером. Форма, що читається комп’ютером, включається в даний документ за посиланням. Даний винахід стосується попередження та лікування запальних захворювань кишечника введенням бета-дефензину ссавців. Дефензини людини Серед багатьох інших елементів ключовими компонентами природженого імунітету є антимікробні пептиди (AMP), які окремо виявляють значну селективність, але разом здатні швидко знищувати широкий спектр бактерій, вірусів і грибів. Біологічне значення AMP підкреслюється повсюдним поширенням у природі, та вони, можливо, продукуються усіма багатоклітинними організмами. У людей переважаючими AMP є дефензини. Дефензини людини являють собою невеликі катіонні пептиди, які можна поділити на α- і β-дефензини на основі топології їх трьох внутрішньомолекулярних цистеїнових дисульфідних зв'язків. α-дефензини далі можна підрозділити на виділені вперше з гранул нейтрофілів (HNP1-4) і такі, що експресуються клітинами Панета в криптах тонкої кишки (HD5 і HD6). β-дефензини переважно експресуються епітеліальними клітинами в різних тканинах і органах, включаючи шкіру, трахею, шлунково-кишковий тракт, сечостатеву систему, нирки, підшлункову та молочну залози. Найкраще охарактеризованими членами родини β-дефензинів є hBD1-3. Проте, за допомогою різних інструментів біоінформатики в людському геномі було відзначено майже 40 відкритих рамок зчитування, що кодують передбачувані гомологи β-дефензину. Деякі з дефензинів людини продукуються конститутивно, в той час як інші індукуються прозапальними цитокінами або екзогенними мікробними продуктами. Стало набагато зрозуміліше, що дефензини людини на додаток до їх безпосередньої антимікробної активності також мають широкий діапазон імуномодуляторних/альтернативних властивостей. Вони включають індукцію різноманітних хемокінів і цитокінів, хемотаксичну та апоптичну активності, індукцію простагландину, вивільнення гістаміну та лейкотрієну, інгібування комплементу, стимуляцію дозрівання дендритних клітин за допомогою проведення сигналу toll-подібним рецептором і стимуляцію кліренсу патогенів нейтрофілами. Крім того, дефензини людини також грають роль у загоєнні ран, проліферації епітеліальних клітин і клітин фібробластів, ангіогенезу і васкулогенезу. Існує все більше доказів того, що дефензини людини відіграють важливу роль в багатьох інфекційних і запальних захворюваннях. Надекспресія дефензинів людини часто спостерігається у запаленій та/або інфікованій шкірі, найбільш ймовірно через місцеву індукцію мікробними компонентами або ендогенними прозапальними цитокінами. При псоріазі hBD2 та hBD3 є надлишковими, та в ураженому епітелії пацієнтів зі звичайними вуграми або поверхневим фолікулітом спостерігалась значуща підвищуюча регуляція hBD2. З іншого боку, даунрегуляцію hBD2 та hBD3 пов’язували з атопічним дерматитом. Клубову хворобу Крона пов’язували з недостатньою експресією HD5 та HD6 та при хворобі Крона в товстій кишці даунрегулюється експресія hBD2-4. Цитокіни Цитокіни являють собою невеликі поліпептиди, що секретуються, з вищих еукаріот, які відповідають за міжклітинну передачу сигналу та які впливають на зростання, поділ та функції інших клітин. Вони являють собою сильнодіючі, плейотропні поліпептиди які, наприклад через відповідні рецептори, діють як місцеві або системні міжклітинні регуляторні фактори та, отже, відіграють вирішальну роль в багатьох процесах, таких як імунітет, запалення та гемопоез. Цитокіни продукуються різноманітними типами клітин, включаючи фібробласти, ендотеліальні клітини, епітеліальні клітини, макрофаги/моноцити та лімфоцити. TNF-α залучається у різних патофізіологічних процесах та може бути або захисним, як при захисті хазяїна, або шкідливим, як при аутоімунітеті. TNF-α є одним з ключових цитокінів, який запускає та підтримує запальну відповідь, та інактивація TNF-α, як було доведено, є важливою у даунрегулюванні запальних реакцій, пов’язаних з аутоімунними захворюваннями. Після інфікування TNF-α секретується у великих кількостях макрофагами та опосередковує рекрутмент нейтрофілів та макрофагів до місць інфікування завдяки стимулюванню ендотеліальних клітин на продукування молекул адгезії та завдяки продукуванню хемокінів, які є хемотаксичними цитокінами. TNF-α допомагає активувати лейкоцити та інші клітини запалення та підвищує судинну проникність в уражених тканинах. TNF-α головним чином продукується макрофагами, моноцитами та дендритними клітинами, але також широкою різноманітністю інших типів клітин, включаючи лімфоїдні клітини, тучні клітини, ендотеліальні клітини, кардіоміоцити, жирову тканину, фібробласти та нейрональну тканину. Існуючі протизапальні лікарські засоби блокують дію TNF-α завдяки зв’язуванню з ним, та, таким чином, запобігається проведення сигналу рецепторів TNF-α на поверхні клітин. Цей тип 1 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 блокування має деякі серйозні побічні ефекти, з яких деякі є інфекціями, такими як туберкульоз, сепсис та грибкові інфекції, та можливо підвищує захворюваність на рак. IL-10, також відомий як фактор, що інгібує синтез цитокінів, людини (CSIF), також відіграє ключову роль в імунній регуляції у якості протизапального цитокіну. Цей цитокін продукується декількома типами клітин, включаючи моноцити, макрофаги, T-клітини, В-клітини, дендритні клітини та тучні клітини. Цей цитокін має плейотропні ефекти при імунорегуляції та запаленні. Він даунрегулює експресію прозапальних цитокінів, цитокінів, що секретуються Th1/Th17 клітинами, антигенів МНС класу ІІ та костимуляторних молекул на антигенпрезентуючих клітинах. IL-10 також секретується популяцією T-клітин, що зветься регуляторні T-клітини (Treg). Ці клітини не запобігають початковій активації T-клітин; скоріше вони інгібують стійку відповідь та запобігають хронічним та потенційно небезпечним відповідям. На периферії деякі T-клітини індукуються антигеном та або IL-10, або TGF-β, щоб стати Treg. Treg, індуковані IL-10, є CD4+/CD25+/Foxp3- та позначаються як Tr1 клітини. Ці клітини супресують імунні відповіді завдяки секреції IL-10. Останні дослідження виявили більш велику різноманітність спектра ефекторів T-клітин ніж Th1/Th2/Treg через ідентифікацію Th17 клітин. Ця субпопуляція, як було показано, є патогенною при декількох аутоімунних захворюваннях, таких як хвороба Крона, виразковий коліт, псоріаз та розсіяний склероз, який раніше приписували Th1 лінії диференціювання. Цитокіни, що секретуються Th17, також даунрегулюються IL-10, та блокування TNF запобігає псоріазу через інактивацію Th17 клітин. Загальна активність IL-10 є протизапальною та, як було показано, запобігає запаленню та ушкодженню в декількох дослідженнях тварин, проте клінічне лікування IL-10 залишається незадовільним через труднощі шляху введення IL-10 та його періоду напіввиведення. Запальні захворювання кишечника Запальні захворювання кишечника (ЗЗК) визначаються хронічними, рецидивуючими кишковими запаленнями неясного походження. ЗЗК відносяться до двох різних розладів, хвороби Крона та виразкового коліту (ВК). Обидва захворювання виникають у результаті нестримної активації запальної відповіді у кішечнику. Цей запальний каскад, як вважається, зберігається через дії прозапальних цитокінів та селективну активацію субпопуляцій лімфоцитів. У пацієнтів з ЗЗК виразки та запалення внутрішньої оболонки кишечника призводить до симптомів болі в животі, проносу та ректальної кровотечі. Виразковий коліт проходить в товстій кишці, в той час як при хворобі Крона хвороба може залучати весь кишково-шлунковий тракт, а також тонку та товсту кишки. Для більшості пацієнтів ЗЗК - хронічний стан з симптомами, які тривають від місяців до декількох років. Вони найбільш поширені серед молодих дорослих людей, але може виникнути в будь-якому віці. Вони виявляються у всьому світі, але найбільш поширені в промислово розвинених країнах, таких як Сполучені Штати, Англія та Північна Європа. Особливо часто зустрічається у людей єврейського походження, а також має расові відмінності в захворюваності. Клінічні симптоми ЗЗК - періодичні ректальні кровотечі, спастичний біль у животі, втрата ваги та пронос. Діагностика ЗЗК заснована на клінічних симптомах, використання барієвої клізми, але пряма візуалізація (ректороманоскопія або колоноскопія) є найбільш точним дослідженням. Тривалі ЗЗК є чинником ризику для раку товстої кишки, і лікування ЗЗК може включати медикаментозне лікування та хірургію. Деякі пацієнти тільки з ВК мають захворювання прямої кишки (проктит). Інші з ВК мають захворювання, які обмежується прямою кишкою і прилеглою висхідною ободочною кишкою (проктосигмоїдит). Тим не менш інші мають ВК всієї товстої кишки (загальні ЗЗК). Симптоми ВК, як правило, більш важкі з більш розповсюдженим патологічним процесом (більша частина товстої кишки залучена захворюванням). Прогноз для пацієнтів із захворюванням, яке обмежується прямою кишкою (проктит), або ВК, який обмежується кінцем висхідної ободочної кишки (проктосигмоїдит), - кращий ніж такий для ВК всієї товстої кишки. Короткі періодичні лікування за допомогою пероральних лікарьских препаратів або клізм можуть бути достатніми. У людей з більш розповсюдженим патологічним процесом втрата крові із запалених кишечників може призвести до анемії, а також може бути потрібне лікування добавками заліза або навіть переливання крові. Рідко товста кишка може різко розширюватися до великих розмірів, коли запалення стає дуже тяжким. Цей стан називається токсичний мегаколон. Пацієнти з токсичним мегаколоном дуже потерпають від лихоманки, болей в животі та здуття, зневоднення та недоїдання. Якщо стан пацієнта швидко не поліпшується за допомогою ліків, операція, як правило, необхідна для запобігання прориву товстої кишки. Хвороба Крона може спостерігатися у всіх областях шлунково-кишкового тракту. При цьому захворюванні непрохідність кишечника через запалення і фіброз відбувається у великої кількості 2 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 60 пацієнтів. Гранульоми та утворення фістул є частими ускладненнями хвороби Крона. Наслідки прогресування захворювання включають внутрішньовенне харчування, хірургію та колостомію. ЗЗК можна лікувати медикаментозно. Найбільш часто використовуваними лікарьскими препаратами для лікування ЗЗК є протизапальні лікарські засоби, такі як саліцилати. Саліцилатні препарати були ефективні при лікуванні помірних та середніх ступенів захворювання. Вони можуть також зменшити частоту спалахів захворювання, коли ліки приймаються на тривалій основі. Приклади саліцилатів включають сульфасалазин, олсалазин та месаламін. Усі ці лікарські препарати приймають перорально у великих дозах для максимальної терапевтичної корисності. Ці медикаменти не без побічних ефектів. Азульфідин може викликати розлад шлунку, коли його приймають у великих дозах, а також повідомлялися рідкісні випадки помірного запалення нирок з деякими саліцилатними препаратами. Кортикостероїди є більш сильними та швидкодіючими, ніж саліцилати, при лікуванні ЗЗК, але потенційно серйозні побічні ефекти обмежують застосування кортикостероїдів до пацієнтів з більш важким ступенем захворювання. Побічні ефекти кортикостероїдів виникають при довготривалому застосуванні. Вони включають витончення кісток і шкіри, інфекції, діабет, м'язову атрофію, округлення лиця, психіатричні порушення і, в окремих випадках, руйнування тазостегнового суглоба. Для пацієнтів з ЗЗК, що не реагують на саліцилати або кортикостероїди, використовуються лікарські препарати, які пригнічують імунну систему. Приклади імунодепресантів включають азатіоприн і 6-меркаптопурин. Імунодепресанти, застосовувані в цій ситуації, допомагають контролювати ЗЗК і дозволяють поступове скорочення або усунення кортикостероїдів. Однак, імунодепресанти призводять до послабленння імунітету пацієнта і роблять його більш сприйнятливим до багатьох інших захворювань. Добре відомою моделлю для вивчення ЗЗК є модель коліту миші, викликаного DSS, як описано у Kawada et al.. «Insights from advances in research of chemically induced experimental models of human inflammatory bowel disease», World J. Gastroenterol., Vol. 13 (42), pp. 5581-5593 (2007); та Wirtz та Neurath «Mouse models of inflammatory bowel disease», Advanced Drug Delivery Reviews, Vol. 59 (11), 1073-1083 (2007). Очевидно, існує велика потреба в засобах, здатних запобігати та лікувати ЗЗК. Застосуванння дефензинів людини для лікування запальних захворювань кишечника Примітно, що хворобу Крона в тонкій кишці пов’язували зі зниженими рівнями HD5 та HD6 αдефензинів клітин Панета, в той час як хворобу Крона в товстій кишці пов’язували з зниженим продукуванням hBD2 та hBD3 β-дефензинів (Gersemann et al., 2008; Wehkamp et al., 2005). Крім того, переконливо продемонстровано залучення мікрофлори кишечника у патогенезі хвороби Крона (Swidsinski et al., 2002). За допомогою флуоресцентної гібридизації in situ ці дослідники показали, що при активній хворобі Крона спостерігається різке збільшення пов’язаних з слизовою оболонкою та інвазивних бактерій, у той час як ці бактерії не з’являються в нормальному епітелії тонкої та товстої кишки. Разом ці спостереження об’єдналися в гіпотезу, яка припускає, що у здорових людей належний рівень дефензинів разом з інтестинальним епітеліальним бар’єром контролює склад та кількість бактерій просвіту та утримують їх від прилипання та проникнення до слизу, що починає запалення (Wang et al., 2007). З іншого боку, у людей з недостатньою здатністю продукування захисного рівня дефензинів, які секретуються, змінюється баланс між антимікробним захистом та бактеріями просвіту. В результаті це дозволяє бактеріальну інвазію в інтестинальні тканини, що розміщені нижче, що викликає запальний стан, який, у свою чергу, може розвитися у хворобу Крона. На основі цієї гіпотези WO 2007/081486 розкриває застосування декількох дефензинів людини при лікуванні запальних захворювань кишечника. Винахідники припустили, що дефензини, які вводяться перорально пацієнтам з хворобою Крона, в складі, що дозволяє їх вивільнення у належних локалізаціях у інтестинальному просвіту, може зменшити кількість бактерій, що проникають, відновити нормальну епітеліальну бар’єрну функцію та, таким чином, зменшити тяжкість запального захворювання. Відповідно до WO 2007/081486, функція дефензинів полягає в безпосередньому націлюванні та знищенні бактерій у просвіті задля попередження їх інвазії у епітеліальну тканину. Тобто, функція дефензинів є виключно така ж, як протиінфекційної сполуки. Стосовно WO/2007/081486, є несподіваним те, що hBD2, який вводять парентерально, здатний зменшувати тяжкість коліту, викликаного DSS, у мишей завдяки тому, що при застосуванні цього шляху введення пептид ніколи не зустрінеться з бактеріями просвіту. Додатково, в даному описі демонструється, що впливом hBD2 є зниження рівня прозапальних цитокінів TNFα, IL-1β та IL-23, що секретуються PBMC (мононуклеарними клітинами периферичної крові). Ці цитокіни відомі як ключові в багатьох запальних захворюваннях, включаючи запальні 3 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання кишечника. Відомо протягом більш ніж десяти років, що дефензини крім їх антимікробних функцій також мають ряд імуномодуляторних функцій. Проте, більшість робіт стосовно властивостей імунної модуляції дефензинів людини описує їх як такі, що мають, перш за все, прозапальні функції або функції посилення імунітету (Дивись, наприклад, Niyonsaba et al., 2007; Bowdish et al., 2006; Lehrer, 2004). Тому, є дійсно несподіваним те, що hBD2, що вводиться парентерально, здатний зменшувати тяжкість у пацієнтів з ЗЗК. Перш за все, при парентеральному застосуванні hBD2 ніколи не зможе досягти інтестинального просвіту, щоб зустріти шкідливі бактерії, які залучені при збудженні захворювання. Більш того, на основі більшості опублікованої літератури можна очікувати, що дефензин, який попадає в кровотік, може скоріше викликати прозапалення, ніж протизапальну відповідь, як зазначається в роботі, представленій у даному описі. Дефензин: Вираз «дефензин», як застосовується у даному документі, стосується поліпептидів, які визнаються фахівцем в даній галузі техніки як ті, що належать до дефензинового класу антимікробних пептидів. Для визначення того, чи є поліпептид дефензином за даним винаходом, амінокислотну послідовність можна порівняти з профілями прихованої марковської моделі (HMM профілі) бази даних PFAM із застосуванням вільно доступного пакета програмного забезпечення HMMER. Дефензинові родини PFAM включають, наприклад, дефензин_1 або «дефензин ссавців» (інвентарний номер PF00323) та дефензин_2 або дефензин_бета, або «бета-дефензин» (інвентарний номер PF00711). Дефензини даного винаходу належать до класу бета-дефензинів. Дефензини з класу бетадефензинів мають загальні структурні ознаки, такі як цистеїновий рисунок. Приклади дефензинів за даним винаходом включають бета-дефензин-1 людини (hBD1; див. SEQ ID NO:1), бета-дефензин-2 людини (hBD2; див. SEQ ID NO:2), бета-дефензин-3 людини (hBD3; див.SEQ ID NO:3), бета-дефензин-4 людини (hBD4; див.SEQ ID NO:4) та бета-дефензин3 миші (mBD3; див.SEQ ID NO:6). Ідентичність: Спорідненість між двома амінокислотними послідовностями або між двома нуклеотидними послідовностями описується параметром «ідентичність». Для цілей даного винаходу ступінь ідентичності між двома амінокислотними послідовностями визначається за допомогою алгоритму Нідлмена-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), як забезпечується в програмі Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends in Genetics 16: http://emboss.org), переважно версії 3.0.0 або пізніше. Застосовувані факультативні параметри являють собою штраф за відкриття гепа - 10, штраф за подовження гепа - 0,5 та матрицю замін EBLOSUM62 (EMBOSS версії BLOSUM62). Вихідні дані Needle, що позначаються «найдовша ідентичність» (отримані за допомогою опції - nobrief), використовують як відсоткову ідентичність та підраховують наступним чином: (Ідентичні залишки x 100)/(Довжина вирівнювання - Загальна кількість гепів у вирівнюванні) Для цілей даного винаходу ступінь ідентичності між двома дезоксирибонуклеотидними послідовностями визначається за допомогою алгоритму Нідлмена-Вунша (Needleman and Wunsch, 1970, раніше), як забезпечується в програмі Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, раніше; http://emboss.org), переважно версії 3.0.0 або пізніше. Застосовувані факультативні параметри являють собою штраф за відкриття гепа - 10, штраф за подовження гепа - 0,5 та матрицю замін EDNAFULL (EMBOSS версії NCBI NUC4.4). Вихідні дані Needle, що позначаються «найдовша ідентичність» (отримані за допомогою опції - nobrief), використовують як відсоткову ідентичність та підраховують наступним чином: (Ідентичні дезоксирибонуклеотиди x 100)/(Довжина вирівнювання – Загальна кількість гепів у вирівнюванні) Виділений поліпептид: Вираз «виділений варіант» або «виділений поліпептид», як застосовується у даному документі, стосується варіанта або поліпептиду, якого виділено з джерела. В одному аспекті варіант або поліпептид є, щонайменше, 1 % чистоти, переважно, щонайменше, 5 % чистоти, більш переважно, щонайменше, 10 % чистоти, більш переважно, щонайменше, 20 % чистоти, більш переважно, щонайменше, 40 % чистоти, більш переважно, щонайменше, 60 % чистоти, навіть більш переважно, щонайменше, 80 % чистоти та найбільш переважно, щонайменше, 90 % чистоти, як визначено за допомогою SDS-PAGE (електрофорез у поліакриламідному гелі з додецилсульфатом натрію). По суті чистий поліпептид: Вираз «по суті чистий поліпептид» позначає в даному описі поліпептидний препарат, що містить не більше 10 %, переважно не більше 8 %, більш 4 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно не більше 6 %, більш переважно не більше 5 %, більш переважно не більше 4 %, більш переважно не більше 3 %, навіть більш переважно не більше 2 %, найбільш переважно не більше 1 % та навіть найбільш переважно не більше 0,5 % за вагою інших поліпептидних матеріалів, з якими він нативно або рекомбінантно пов’язаний. Отже, переважним є, щоб по суті чистий поліпептид був, щонайменше, 92 % чистоти, переважно, щонайменше, 94 % чистоти, більш переважно, щонайменше, 95 % чистоти, більш переважно, щонайменше, 96 % чистоти, більш переважно, щонайменше, 96 % чистоти, більш переважно, щонайменше, 97 % чистоти, більш переважно, щонайменше, 98 % чистоти, навіть більш переважно, щонайменше, 99 %, найбільш переважно, щонайменше, 99,5 % чистоти та навіть найбільш переважно 100 % чистоти за вагою загального поліпептидного матеріалу, присутнього в препараті. Поліпептиди даного винаходу є переважно в по суті чистій формі. Це можна здійснити, наприклад, отриманням поліпептиду добре відомими рекомбінантними способами або класичними способами очищення. Бета-дефензини ссавців Даний винахід стосується фармацевтичних застосувань бета-дефензинів ссавців, таких як бета-дефензини людини та/або бета-дефензини миші, при лікуванні запальних захворювань кишечника, таких як виразковий коліт та/або хвороба Крона. Лікування є переважно пов’язаним зі зменшеною активністю TNF-альфа в оброблених тканинах. У варіанті здійснення бета-дефензини ссавців даного винаходу мають ступінь ідентичності, щонайменше, 80 %, переважно, щонайменше, 85 %, більш переважно, щонайменше, 90 % та найбільш переважно, щонайменше, 95 % до будь-якої з амінокислотних послідовностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5 та/або SEQ ID NO:6. У переважному варіанті здійснення бета-дефензини ссавців даного винаходу мають ступінь ідентичності, щонайменше, 80 %, переважно, щонайменше, 85 %, більш переважно, щонайменше, 90 % та найбільш переважно, щонайменше, 95 % до будь-якої з амінокислотних послідовностей SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 та/або SEQ ID NO:4. В більш переважному варіанті здійснення бета-дефензини ссавців даного винаходу включають бетадефензин-1 людини (SEQ ID NO:1), бета-дефензин-2 людини (SEQ ID NO:2), бета-дефензин-3 людини (SEQ ID NO:3), бета-дефензин-4 людини (SEQ ID NO:4), варіант бета-дефензину-4 людини (SEQ ID NO:5) та/або бета-дефензин-3 миші (SEQ ID NO:6). У навіть найбільш переважному варіанті здійснення бета-дефензини ссавців даного винаходу включають бетадефензин-1 людини (SEQ ID NO:1), бета-дефензин-2 людини (SEQ ID NO:2), бета-дефензин-3 людини (SEQ ID NO:3) та/або бета-дефензин-4 людини (SEQ ID NO:4). В іншому варіанті здійснення бета-дефензини ссавців даного винаходу мають ступінь ідентичності, щонайменше, 80 %, переважно, щонайменше, 85 %, більш переважно, щонайменше, 90 % та найбільш переважно, щонайменше, 95 % до амінокислотної послідовності SEQ ID NO:2. У переважному варіанті здійснення бета-дефензини ссавців даного винаходу включають бета-дефензин-2 людини (SEQ ID NO:2). У ще одному варіанті здійснення бета-дефензини ссавців даного винаходу включають бетадефензини людини та/або бета-дефензини миші та їх функціонально еквівалентні варіанти. Переважно бета-дефензини ссавців включають бета-дефензин-1 людини, бета-дефензин-2 людини, бета-дефензин-3 людини, бета-дефензин-4 людини та бета-дефензин-3 миші та їх функціонально еквівалентні варіанти. Більш переважно бета-дефензини ссавців даного винаходу включають бета-дефензин-2 людини та його функціонально еквівалентні варіанти. Бета-дефензини ссавців даного винаходу також звуться як сполуки переважних варіантів здійснення. В контексті даного винаходу «функціонально еквівалентний варіант» бета-дефензинів ссавців (наприклад, людини) є модифікованим бета-дефензином ссавців (наприклад, людини), що виявляє приблизно такий самий вплив на запальне захворювання кишечника, як і вихідний бета-дефензин ссавців (наприклад, людини). Переважно він також виявляє приблизно такий самий вплив на активність TNF-альфа, як і бета-дефензин ссавців (наприклад, людини). За даним винаходом функціонально еквівалентний варіант бета-дефензину ссавців (наприклад, людини) може містити 1-5 амінокислотних модифікацій, переважно 1-4 амінокислотних модифікацій, більш переважно 1-3 амінокислотних модифікацій, найбільш переважно 1-2 амінокислотну(их) модифікацію(ій) та, зокрема, одну амінокислотну модифікацію у порівнянні з амінокислотною послідовністю бета-дефензину ссавців (наприклад, людини). Вираз «модифікація» позначає в даному описі будь-яку хімічну модифікацію бетадефензину ссавців (наприклад, людини). Модифікацією(ями) може бути заміна(и), делеція(ї) та/або інсерція(ї) амінокислоти(амінокислот), а також заміщення(декілька заміщень) амінокислотного(их) бокового(их) ланцюга(ів); або застосування неприродних амінокислот з 5 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 60 подібними характеристиками у амінокислотній послідовності. Зокрема модифікацією(ями) можуть бути амідування, такі як амідування C-кінця. Переважно, амінокислотні модифікації мають незначний характер, тобто консервативні амінокислотні заміщення або інсерції, які значно не впливають на укладання та/або активність поліпептиду; одиночні делеції; невеликі аміно- або карбоксил-кінцеві подовження; невеликий лінкерний пептид розміром до близько 20-25 залишків; або невелике подовження, яке сприяє очищенню завдяки зміні сумарного заряду або іншої функції, такі як, полігістидинова мітка, антигенний епітоп або зв’язуючий домен. Приклади консервативних заміщень знаходяться у межах групи основних амінокислот (аргінін, лізин та гістидин), кислих амінокислот (глутамінова кислота та аспарагінова кислота), полярних амінокислот (глутамін та аспарагін), гідрофобних амінокислот (лейцин, ізолейцин та валін), ароматичних амінокислот (фенілаланін, триптофан та тирозин) та невеликих амінокислот (гліцин, аланін, серин, треонін та метіонин). Амінокислотні заміщення, які в цілому не змінюють специфічну активність, відомі в даному рівні техніки та описані, наприклад, H. Neurath and R.L. Hill, 1979, In, The Proteins, Academic Press, New York. Заміщенями, що зустрічаються найбільш звичайно, є Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu та Asp/Gly. На додаток до 20 стандартних амінокислот, нестандартні амінокислоти (такі як 4гідроксипролін, 6-N-метиллізин, 2-аміноізомасляна кислота, ізовалін та альфа-метилсерин) можуть бути заміщені амінокислотними залишками поліпептиду дикого типу. Обмежена кількість неконсервативних амінокислот, амінокислот, які не кодуються генетичним кодом, та неприродних амінокислот може бути заміщена на амінокислотні залишки. «Неприродні амінокислоти» були модифіковані після синтезу білка та/або мають хімічну структуру в їхньому боковому ланцюгу(ах), яка відрізняється від структури із стандартних амінокислот. Неприродні амінокислоти можна синтезувати хімічно, та, переважно, вони є комерційно доступними та включають піпеколінову кислоту, тіазолідинкарбонову кислоту, дегідропролін, 3- та 4метилпролін та 3,3-диметилпролін. Необхідні амінокислоти в бета-дефензинах ссавців можна ідентифікувати відповідно процедурам, що відомі в даній галузі техніки, таким як сайт-спрямований мутагенез або аланінскануючий мутагенез (Cunningham and Wells, 1989, Science 244:1081-1085). В останній техніці одиничні мутації аланіна вводять в кожний залишок в молекулі та отримані в результаті мутантні молекули тестують на біологічну активність (тобто, активність проти запального захворювання кишечника та/або супресію активності TNF-альфа) для ідентифікації амінокислотних залишків, що є вирішальними для активності молекули. Див. також Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Ідентичності необхідних амінокислот можна також вивести з аналізу ідентичностей з поліпептидами, які належать до бета-дефензинів ссавців. Одиничні або множинні амінокислотні заміщення можна здійснити та протестувати за допомогою відомих способів мутагенезу, рекомбінації та/або перетасовування з наступною відповідною процедурою скринінгу, таких як описаних Reidhaar-Olson and Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413; або WO 95/22625. Інші способи, які можна застосовувати, включають схильну до помилок ПЛР, фаговий дисплей (наприклад, Lowman et al., 1991, Biochem. 30:10832-10837; патент США № 5223409; WO 92/06204) та ділянка-спрямований мутагенез (Derbyshire et al., 1986, Gene 46:145; Ner et al., 1988, DNA 7:127). N-кінцеве подовження поліпептидів даного винаходу може придатно складатися з від 1 до 50 амінокислот, переважно 2-20 амінокислот, особливо 3-15 амінокислот. В одному варіанті здійснення N-кінцеве пептидне подовження не містить Arg (R). В іншому варіанті здійснення Nкінцеве подовження містить kex2 або kex2-подібний сайт розщеплення, як буде визначено далі нижче. У переважному варіанті здійснення N-кінцеве подовження являє собою пептид, що містить, щонайменше, два Glu (E) та/або Asp (D) амінокислотні залишки, такий як N-кінцеве подовження, що містить одну з наступних послідовностей: EAE, EE, DE та DD. Бета-дефензин-2 людини, як було виявлено, значно знижує тяжкісь параметрів захворювання у 10-денній моделі коліту, індукованого декстран сульфатом натрію (DSS), у миші; таким чином демонструючи сильну активність у якості лікарського препарату для лікування запальних захворювань кишечника, таких як виразковий коліт та хвороба Крона. Даний винахід, таким чином, надає способи лікування запальних захворювань кишечника, лікування яких включає введення парентерально об’єкту, який потребує такого лікування, ефективної кількості бета-дефензину ссавців, такого як бета-дефензин-2 людини, наприклад, у формі фармацевтичної композиції. Також надаються бета-дефензини ссавців, такі як бетадефензин-2 людини, для виготовлення лікарського препарату для парентерального введення, 6 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 60 та застосування бета-дефензинів ссавців, таких як бета-дефензин-2 людини, для виготовлення лікарського препарату для парентерального введення, наприклад, фармацевтичної композиції, для лікування запального захворювання кишечника. Лікування включає лікування існуючого захворювання або розладу, а також профілактику (запобігання) захворювання або розладу. У варіанті здійснення лікування приводить до зменшеної активності TNF-альфа в оброблених тканинах, переважно зменшеної активності TNF-альфа та підвищеної активності IL10. Бета-дефензини ссавців можна застосовувати терапевтично в композиціях, складених для введення будь-яким традиційним шляхом, включаючи ентерально (наприклад, трансбукальний, оральний, назальний, ректальний), парентерально (наприклад, внутрішньовенний, інтракраніальний, інтраперитонеальний, підшкірний або внутрішньом’язовий) або місцево (наприклад, нашкірний, інтраназальний або інтратрахеальний). В інших варіантах здійснення композиції, описані в даному документі, можна вводити як частину імплантату з уповільненим вивільненням. В наступних інших варіантах здійснення композиції переважних варіантів здійснення можуть бути складені у вигляді ліофілізату з використанням відповідних формоутворюючих, що забезпечують стабільність у вигляді ліофілізату, та наступною повторною гідратацією. Фармацевтичні композиції, що містять бета-дефензини ссавців, такі як бета-дефензин людини, можна виготовити відповідно із загальноприйнятими способами, наприклад, за допомогою процесів змішування, гранулювання, покриття, розчинення або ліофілізації. Фармацевтичні композиції переважних варіантів здійснення включають бета-дефензин ссавців, такий як бета-дефензин людини, та фармацевтично прийнятний носій та/або розріджувач. Бета-дефензин ссавців, такий як бета-дефензин людини, переважно застосовується у фармацевтичних композиціях у кількості, що є ефективною для лікування запального захворювання кишечника, переважно з прийнятною токсичністю для пацієнта. Для такого лікування придатне дозування буде, звичайно, варіювати в залежності від, наприклад, хімічної природи та фармакокінетичних даних застосовуваної сполуки даного винаходу, окремого хазяїна, способу введення та природи та тяжкості станів, які лікують. Проте, загалом, для задовільних результатів у великих ссавців, наприклад, людей, вказане добове дозування становить переважно від приблизно 0,001 г до приблизно 1,5 г, більш переважно від приблизно 0,01 г до 1,0 г; або від приблизно 0,01 мг/кг ваги тіла до приблизно 20 мг/кг ваги тіла, переважно від приблизно 0,01 мг/кг ваги тіла до приблизно 20 мг/кг ваги тіла, більш переважно від приблизно 0,1 мг/кг ваги тіла до приблизно 10 мг/кг ваги тіла, наприклад, при введенні невеликими дозами лікарського засобу, повторюваними через певні інтервали часу, до одного, двох, трьох або чотирьох разів на добу. Сполуки переважних варіантів здійснення можна вводити великим ссавцям, наприклад, людям, подібними способами введення в подібних дозуваннях, ніж застосовуваних традиційно. У певних варіантах здійснення фармацевтичні композиції переважних варіантів здійснення можуть включати супресор(и) TNF-альфа в кількості від приблизно 0,5 мг або менше до приблизно 1500 мг або більше на стандартну лікарську форму в залежності від шляху введення, переважно від приблизно 0,5, 0,6, 0,7, 0,8 або 0,9 мг до приблизно 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900 або 1000 мг та більш переважно від приблизно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 або 25 мг до приблизно 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 або 100 мг. У певних варіантах здійснення, проте, можуть бути переважні нижчі або вищі, ніж згадані вище дозування. Придатні концентрації та дозування можуть бути легко визначені фахівцем в даній галузі. Фармацевтично прийнятні носії та/або розріджувачі добре відомі фахівцям даної галузі техніки. Для композицій, складених у вигляді рідких розчинів, прийнятні носії та/або розріджувачі включають сольовий розчин та стерильну воду та можуть факультативно включати антиоксиданти, буфери, бактеріостатичні фактори та інші звичайні добавки. Композиції можуть також бути складені у вигляді пігулок, капсул, гранул, таблеток (покритих або непокритих), (ін’єкційних) розчинів, твердих розчинів, суспензій, дисперсій, твердих дисперсій (наприклад, у формі ампул, флаконів, кремів, гелів, паст, інгаляційного порошка, пін, тинктур, губних помад, крапель, спреїв або супозиторіїв). Склад може містити (додатково до бета-дефензину ссавців та інших факультативних активних інгредієнтів) носії, наповнювачі, розпушувачі, покращувачі сипкості, цукри та підсолоджувачі, віддушки, антикоагулянти, стабілізатори, змочувальні засоби, емульгатори, солюбілізатори, солі для регулювання осмотичного тиску, буфери, розріджувачі, диспергуючі та поверхнево-активні засоби, зв’язувальні речовини, ковзні речовини та/або інші фармацевтичні формоутворюючі, які відомі в даному рівні техніки. Фахівець в даній галузі 7 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 техніки може додатково скласти бета-дефензини ссавців відповідним способом та відповідно до визнаних практик, так як описано у Remington's Pharmaceutical Sciences, Gennaro, Ed., Mack Publishing Co., Easton, PA 1990. Бета-дефензини ссавців, такі як бета-дефензини людини, можна застосовувати окремо або у комбінованих терапіях з однією, двома або більше іншими фармацевтичними сполуками або лікарськими речовинами та/або з одним або більше фармацевтично прийнятним(и) формоутворюючим(и). Синтез in vitro Бета-дефензини ссавців можна отримати синтезом in vitro, застосовуючи традиційні способи, які відомі у даній галузі техніки. Доступні різні комерційні прилади для синтезу, наприклад, автоматизовані синтезатори від Applied Biosystems Inc., Beckman, і т.д. За допомогою синтезаторів амінокислоти, що зустрічаються в природі, можуть бути заміщені неприродними амінокислотами, зокрема D-ізомерами (або D-формами), наприклад, D-аланін та D-ізолейцин, діастереоізомерами, боковими ланцюгами з різними довжинами та функціональностями, та подібними. Конкретна послідовність та спосіб отримання буде визначатися за зручністю, економією та необхідною чистотою, та подібним. Хімічне зв’язування може бути забезпечено для різних пептидів або білків, що містять зручні функціональності для утворення зв’язків, такі як аміно групи для утворення аміду або заміщеного аміну, наприклад, відновне амінування, тіольні групи для утворення тіоетерів або дисульфідів, карбоксильні групи для утворення амідів та подібне. За необхідністю під час синтезу або під час експресії в пептид можуть бути введені різні групи, які дозволяють зв’язування з іншими молекулами або з поверхнею. Таким чином цистеїни можна застосовувати для отримання тіоетерів, гістидини – для зв’язування з комплексом іону металу, карбоксильні групи – для утворення амідів або естерів, аміногрупи – для утворення амідів та подібне. Бета-дефензини ссавців або їхні функціональні еквіваленти також можна виділити та очистити відповідно до загальноприйнятих способів рекомбінантного синтезу. Лізат можна отримати з хазяїна для експресії та очищений лізат – за допомогою HPLC (високоефективна рідинна хроматографія), ексклюзійної хроматографії, гель-електрофорезу, афінної хроматографії або іншої техніки очищення. Даний винахід далі описується наступними прикладами, які не слід розуміти як обмежуючі обсяг даного винаходу. ПРИКЛАДИ Під час тестування hBD2 на імуномодуляторні впливи несподівано спостерігалось, що hBD2 мав значну протизапальну здатність. В даному документі показано, що hBD2 має значний вплив при лікуванні запального захворювання кишечника (коліту), індукованого пероральним введенням декстран сульфату натрію (DSS) у миші. Також показано, що hBD2 має даунрегулюючий потенціал на TNF-альфа. ПРИКЛАД 1 Отримання бета-дефензину-2 людини (hBD2) hBD2 отримали рекомбінантно. Фрагмент синтетичної ДНК (ДНК 2.0), що кодує hBD2 клонували в експресуючий вектор pET-32(+) (Novagen). Отримана плазміда кодувала трансляційний гібридний пептид, що містить N-кінцеву тіоредоксинову частину, за якою йде hisмітка, ентерокіназний сайт розщеплення та, зрештою, пептид hBD2. Експресійну плазміду трансформували в штам BL21 E. coli. Добову культуру цього штаму розбавили в 100 разів в TB-гліцерині, що містив 100 мкг/мл ампіциліну, та зрощували до OD600 (оптична щільність) приблизно 8 при 37 °C та індукували за допомогою 0,5 мM IPTG протягом 3 годин, після чого клітини зібрали центрифугуванням. Hisмічений trx-hBD2 гібридний пептид очистили на Ni-NTA кульках (QIAGEN) з застосуванням стандартних протоколів. Очищений гібридний пептид з his-міткою потім піддали діалізу протягом ночі в ентерокіназний буфер (50 мM трис-HCl pH 7,5, 1 мM CaCl2) та розщепили ентерокіназою для вивільнення зрілого hBD2. Пептид hBD2 далі очистили катіон-обмінною хроматографією з застосуванням 15 S матриці Source (Amersham Biosciences). Точну молекулярну вагу hBD2 перевірили за допомогою MALDI-TOF (іонізація лазерною десорбцією за сприяння матриці - час прольоту) мас-спектрометрії. Отримання mBD3 (див. Приклад 7) проводили з застосуванням ідентичного протоколу. Належне укладання та топологію дисульфідних містків молекули hBD2 потім перевірили за допомогою трипсинового розщеплення у поєднанні з LC-MS (рідинна хроматографія – масспектрометрія) та NMR (ядерно-магнітний резонанс) спектроскопією. 8 UA 99539 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ендотоксин видалили препаративною RP-HPLC (HPLC зі зворотною фазою) при низькому pH, та вміст ендотоксину визначили LAL випробуванням (Endosafe KTA2), та рівень, як визначили, був нижче межі виявлення випробування (0,05 EU/мг). Для того, щоб впевнитись, що рівні нижчі ніж межа виявлення випробування ендотоксину не були здатні стимулювати PBMC, побудували криві титрування стимуляції за допомогою дуже сильного ліпополісахариду (E. coli, O111:B4, Sigma L4391). Дуже низькі рівні цього LPS (0,06 нг/мл) були здатні стимулювати PBMC для виявлюваного продукування цитокіну. ПРИКЛАД 2 10-денна модель індукованого декстран сульфатом натрію (DSS) коліту у миші Метою наступного дослідження було визначення протизапальної активності бетадефензину-2 людини в гострій (10-днів) моделі запального захворювання кишечника (коліт), індукованого пероральним введенням декстран сульфату натрію (DSS), у миші. Модель DSS коліту миші є добре відомою моделлю для вивчення запальних захворювань кишечника, як описано у Kawada et al. «Insights from advances in research of chemically induced experimental models of human inflammatory bowel disease», World J. Gastroenterol., Vol. 13 (42), pp. 5581-5593 (2007); та Wirtz та Neurath «Mouse models of inflammatory bowel disease», Advanced Drug Delivery Reviews, Vol. 59 (11), 1073-1083 (2007). МАТЕРІАЛИ Об’єкти тестування Бета-дефензин-2 людини (hBD2); див. Приклад 1 вище Метилпреднізолон 21-гемісукцинат («преднізолон») PBS буфер (GIBCO) Експериментальні тварини У дослідженні застосовували самців C57BL/6 мишей (Harlan Interfauna Ibérica, Барселона, Іспанія), оскільки це вид та стать, які, як продемонстровано, розвивають значне запалення товстої кишки при вживанні 2 % розчину DSS у питній воді через 10-денний період. Ідентифікація Тварин ідентифікували за числовим та літерним кодами на їхніх хвостах. Додатково, кожну клітку ідентифікували за картою з кольоровим кодом, яка вказує кількість та стать тварин, код та ім’я об’єкта тестування, рівень дози, шлях введення, період обробки, номер групи, код дослідження та ім’я керівника дослідження. Вага Середня вага тіла тварин на день початку дослідження складала 22,4 ± 0,16 г Акліматизація (карантин) Мінімум 7 днів перед початком дослідження за тих самих умов, що й основного дослідження. Житлові умови Після прибуття тварин поділили та оселили випадковим чином у полікарбонатних клітках (Eтипу, Charles River, 255x405x197 мм) з кришками з нержавіючої сталі. Тварин оселили в групах по п’ять тварин на клітку відповідно за їх статтю в камерах для тварин з контрольованою температурою (22±2 °C), освітленням (12/12 годин світло/темрява), атмосферним тиском, кількістю оновлень повітря та відносною вологістю (30-70 %). Усі клітки мали деревну тирсу (Lignocel 3-4; Harlan Interfauna Ibérica, Іспанія) на підлозі в якості підстилки. Їжа та вода Усі миші мали вільний доступ до сухого, гранульованого стандартного корму для гризунів (Teklad Global 2014; Harlan Interfauna Ibérica, Іспанія). Воду забезпечували скільки завгодно у пляшках. Постачання водопровідної води до камер для тварин періодично аналізують задля перевірки її складу та задля виявлення можливих забруднень (хімічних та мікробіологічних). Обладнання та матеріали Обладнання: - Терези для тварин Sartorius модель BP 2100 - Обладнання для хірургічного розтинання - Центрифуга Eppendorf 5415C - Мікроскоп Nikon Eclipse E600FN - Пристрій для перемішування з обертанням Hook & Tucker instruments - Гомогенізатор IKA UltraTurrax - Аналітичні терези Sartorius модель BP 221S - Мікроплашентий ІФА зчитувач Labsystems Multiskan EX Матеріали та реактиви: 9 UA 99539 C2 5 10 15 20 25 30 35 40 - Стерильні одноразові шприци (1 мл) - Інфузійний набір з голкою типу “метелик” 25G - Анестетик (кетамін/ксилазин) - Місцевий анестезуючий крем (EMLA, Astra Zeneca) - Декстран сульфат натрію 30000-50000 Да (MP Biomedicals) - Фосфатний буферизований сольовий розчин (PBS; Sigma) - Нейтрально буферизований формалін (VWR) - Альбумін бичачої сироватки (Sigma) - Коктейль протеазних інгібіторів (Sigma) - ІФА (імуноферментний аналіз) набір для визначення TNF-α миші (GE Healthcare) ЕКСПЕРИМЕНТАЛЬНИЙ ПРОТОКОЛ Схема дослідження Тварин поділили на 5 експериментальних груп. Кожна група складалася з 10 самців: Група A: Оброблені контрольним наповнювачем (PBS) внутрішньовенно Група B: Оброблені hBD2 (0,1 мг/кг внутрішньовенно) Група C: Оброблені hBD2 (1 мг/кг внутрішньовенно) Група D: Оброблені hBD2 (10 мг/кг внутрішньовенно) Група E: Оброблені метилпреднізолоном (1 мг/кг перорально) Розміщення тварин для всіх експериментальних груп було виконано у випадковому порядку. Максимально 5 мишей оселили в кожну клітку (згідно з Директивою 86/609/EEC). Всіх тварин зважили після їх прибуття до лабораторії та перед введенням об’єктів тестування. Введення тестової речовини Контрольний наповнювач та hBD2 вводили внутрішньовенно через хвостову вену з застосуванням стерильної голки (25G) в об’ємі дозування 5 мл/кг ваги тіла як повільну ін’єкцію ударної дози сполуки. Тварини отримували одну дозу щодобово (кожні 24 години) відповідного об’єкта тестування (hBD2, преднізолон або контрольний наповнювач) протягом 10 послідовних днів. Преднізолон давали перорально при дозі 1 мг/кг в об’ємі дозування 5 мл/кг ваги тіла, в тому самому режимі дозування, що й hBD2. ЕКСПЕРИМЕНТАЛЬНА ПРОЦЕДУРА Індукція коліту Коліт індукували у мишей шляхом доповнення їх питної води DSS 2% протягом 7 днів. На день 1 всіх мишей зважили та помітили відповідно з їх експериментальними групами. Пляшку для пиття кожної клітки заповнили розчином DSS, запевняючись, що всі кришки пляшок були відповідно закріплені, та жодна не була переповнена. На день 3 будь-який розчин, що залишився в пляшках, видалили та знову наповнили свіжим розчином DSS. Цю процедуру знову повторили на день 5. На день 8 будь-який розчин, що залишився, вилили та замінили автоклавованою водою. Тварин умертвляли через 2 дні на день 10. Клінічне оцінювання (Індекс активності захворювання) Щодобово проводили клінічне оцінювання оброблених DSS тварин з підрахуванням валідованого клінічного індексу активності захворювання (DAI), що змінюється від 0 до 4 відповідно наступним параметрам: консистенція випорожнення, наявність або відсутність ректальної кровотечі та втрата ваги: 45 Параметр Зміна у вазі тіла: Ректальна кровотеча: Консистенція випорожнення 15 % Негативно Позитивно Нормальна Часті рідкі випорожнення Пронос Бал DAI 0 1 2 3 4 0 4 0 2 4 Втрату ваги тіла підраховували як відсоткову різницю між початковою вагою тіла (День 1) та поточною вагою тіла на кожен експериментальний день (2-10). 10 UA 99539 C2 5 10 15 20 Появу проносу визначають як слизовий/каловий матеріал, прилиплий до анальної шерсті. Ректальну кровотечу визначають як пронос, що містить видиму кров/слиз або явну ректальну кровотечу. Максимальний бал DAI кожного дня дорівнює 12. Забір крові Два зразки крові отримували від кожної тварини в двох окремих випадках під час ходу дослідження: на день 1 та на день 5. Зразки крові отримували в кожному випадку в мікропробірки Microvette CB-300 проколюванням підшкірної вени через 2 години після введення об’єкта тестування. Цей спосіб добування крові не потребує анестетика або анальгетиків та спричиняє мінімальний стрес у тварин (Hem et al., 1998). Додатково, кінцевий зразок крові отримали від всіх тварин на останній день дослідження з абдомінальної порожнистої вени також через дві години після введення об’єкта тестування. Зразкам крові дали скипіти та потім центрифугували при 3000 rpm (обертів на хвилину) протягом 10 хвилин та отриману сироватку заморозили при -80 °C для зберігання. Евтаназія та забір зразків товстої кишки На день 10, дві години опісля останнього введення контрольного наповнювача, hBD2 або преднізолону, тварин вбивали передозуванням анестетику. Видаляли їх товсті кишки та вимірювали їх довжину та вагу після видалення сліпої кишки. Два відділи (проксимальний та дистальний) товстої кишки брали від кожної тварини та зберігали в нейтральному буферизованому формаліні для наступного гістологічного аналізу (фарбування гематоксиліном та еозином) відповідно до наступної системи балів: Опис Не спостерігали зміни Мінімальні розсіяні слизові клітинні запальні інфільтрати з або без мінімальної епітеліальної гіперплазії. Помірно розсіяні - дифузні клітинні запальні інфільтрати, які подекуди поширюються у підслизову оболонку та пов’язані з ерозіями, з мінімальною помірною епітеліальною гіперплазією та мінімальним - помірним вичерпанням муцину з келихоподібних клітин. Помірні - середні клітинні запальні інфільтрати, які подекуди були трансмуральні, часто пов’язані з укриванням виразками, з середньою епітеліальною гіперплазією та вичерпанням муцину. Значні клітинні запальні інфільтрати, які часто були трансмуральні та пов’язані з укриванням виразками, зі значною епітеліальною гіперплазією та вичерпанням муцину. Значні трансмуральні запалення з тяжким укриванням виразками та втратою кишкових залоз. 25 Бал 0 1 2 3 4 5 Визначення концентрації TNF-альфа в зразках тканини товстої кишки Додатковий зразок товстої кишки отримали від кожної тварини та гомогенізували в PBS (100 мг тканини/мл PBS), що містив 1 % альбумін бичачої сироватки (BSA) та коктейль протеазних інгібіторів (1 мл/20г тканини). Гомогенат потім центрифугували при 14000 rpm протягом 10 хвилин та супернатант зберігали при -20 °C для подальшого визначення концентрації TNF-α специфічним ферментним імуновипробуванням (ІФА). 11 UA 99539 C2 РЕЗУЛЬТАТИ Бал індексу активності захворювання Таблиця 1 Зміна балу індексу активності захворювання (DAI) під час періоду день 1 - день 10. Значущі відмінності від значень контрольної (наповнювача) групи на дану дату показані як *p
ДивитисяДодаткова інформація
Назва патенту англійськоюTreatment of inflammatory bowel diseases with mammal beta defensins
Автори англійськоюKjaer, Tanja Maria Rosenkilde, Kruse, Thomas, Mygind, Per Holse, Brinch, Karoline Sidelmann, Kjaerulff, Soeren, Andersen, Birgitte
Назва патенту російськоюЛечение воспалительных заболеваний кишечника бета-дефензинами человека
Автори російськоюКджаер Таня Мария Розенкильд, Крузе Томас, Мюгин Пер Хольсе, Бринч Каролине Зидельманн, Кджаерульфф Соерен, Андерсен Биргитте
МПК / Мітки
МПК: A61K 38/17, A61P 1/00
Мітки: лікування, запальних, бета-дефензинами, людини, захворювань, кишечника
Код посилання
<a href="https://ua.patents.su/35-99539-likuvannya-zapalnikh-zakhvoryuvan-kishechnika-beta-defenzinami-lyudini.html" target="_blank" rel="follow" title="База патентів України">Лікування запальних захворювань кишечника бета-дефензинами людини</a>
Попередній патент: Спосіб одержання чорного залізоокисного пігменту
Наступний патент: Заміщені місткованим хіноксаліном піперидинові сполуки та їх застосування
Випадковий патент: Спосіб боротьби з фітопатогенними хворобами сільськогосподарських рослин та фунгіцидна композиція