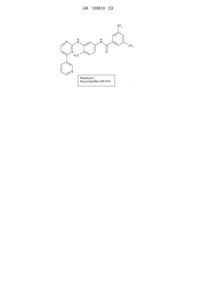
Кристалічна форма похідних феніламінопіримідину
Номер патенту: 103610
Опубліковано: 11.11.2013
Автори: Компелла Амала кішан, Адібхатла Калі Сатіа Бхуджанга Рао, Рачаконда Срінівас, Венкаіах Човдарі Наннапанені
Формула / Реферат
1. Кристалічна форма III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формули І), яка має характеристики XRPD:
Кут [2-тета]
Значення d Ангстрем
Інтенсивність %
5,909
14,94417
24,9
6,491
13,60517
66,4
8,267
10,68690
100,0
11,854
7,45967
58,2
13,181
6,71147
40,0
14,609
6,05866
50,0
15,960
5,54851
5,8
16,612
5,33224
9,5
18,826
4,70995
14,4
19,571
4,53226
52,1
21,302
4,16774
54,0
21,612
4,10861
37,7
22,160
4,00828
3,5
22,970
3,86869
23,8
23,278
3,81812
51,6
24,000
3,70491
8,7
25,112
3,54329
11,1
25,887
3,43895
3,1
26,500
3,36079
3,3
27,517
3,23887
3,4
29,476
3,02788
6,8
29,857
2,99011
8,6
30,474
2,93102
3,5
32,886
2,72133
3,2
33,559
2,66829
5,0
35,916
2,49836
3,8
39,645
2,27157
4,9
43,061
2,09893
2,6
43,748
2,06753
3,8
44,055
2,05383
3,9
2. Кристалічна форма III за п. 1, яка має температуру плавлення 240 °C або вище.
3. Кристалічна форма III за п. 1, яка є по суті чистою.
4. Спосіб одержання кристалічної форми III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула І), як визначено в п. 1, в якому здійснюють
обробку сполуки формули І у кристалічній формі І або II оцтовою кислотою або сумішшю диметилформаміду й ацетону, гексану або толуолу; і
наступну обробку однократно обробленої сполуки оцтовою кислотою, ацетоном, гексаном або толуолом;
де кристалічна форма І має характеристики XRPD:
Кут [2-тета]
Значення d Ангстрем
Інтенсивність %
6,793
13,00131
13,9
9,823
8,99680
3,9
11,106
7,96069
54,2
13,267
6,66829
48,5
16,386
5,40523
7,0
17,941
4,94015
11,3
18,997
4,66785
13,0
19,778
4,48530
50,5
21,894
4,05635
100,0
22,396
3,96650
20,5
23,469
3,78750
19,7
24,466
3,63545
32,4
24,939
3,56759
52,6
25,525
3,48695
14,6
26,968
3,30351
10,3
28,777
3,09991
22,0
30,545
2,92436
14,8
33,011
2,71129
11,0
і кристалічна форма II має характеристики XRPD:
Кут [2-тета]
Значення d Ангстрем
Інтенсивність %
6,500
13,58651
12,2
10,816
8,17295
100,0
12,094
7,31197
3,4
12,988
6,81061
49,7
16,120
5,49381
6,0
17,669
5,01562
10,9
19,521
4,54367
41,7
21,675
4,09687
39,9
22,083
4,02198
17,1
23,230
3,82602
21,9
24,264
3,66523
17,8
24,639
3,61023
8,5
28,460
3,13371
4,8
29,328
3,04290
2,3
30,256
2,95165
4,1
32,746
2,73261
3,5
34,035
2,63201
3,1
35,590
2,52050
1,5
39,660
2,27072
1,9
42,123
2,14346
2,5
44,193
2,04777
1,7
5. Спосіб за п. 4, в якому здійснюють:
обробку сполуки формули І у кристалічній формі І або II оцтовою кислотою; і
наступну обробку однократно обробленої сполуки оцтовою кислотою.
6. Спосіб за п. 4, в якому здійснюють:
обробку сполуки формули І у кристалічній формі І або II сумішшю диметилформаміду й ацетону; і
наступну обробку однократно обробленої сполуки ацетоном.
7. Спосіб за п. 4, в якому здійснюють:
обробку сполуки формули І у кристалічній формі І або II сумішшю диметилформаміду й гексану; і
наступну обробку однократно обробленої сполуки гексаном.
8. Спосіб за п. 4, в якому здійснюють:
обробку сполуки формули І у кристалічній формі І або II сумішшю диметилформаміду й толуолу; і
наступну обробку однократно обробленої сполуки толуолом.
9. Кристалічна форма III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула І), як визначено в п. 1, для використання у способі лікування проліферативного захворювання.
10. Фармацевтична композиція, що містить фармацевтично прийнятний ексципієнт і кристалічну форму III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула І), де кристалічна форма III, як визначено в п. 1.
11. Застосування кристалічної форми III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула І), як вказано в п. 1, для виготовлення антипроліферативного лікарського засобу для лікування пухлинного захворювання.
Текст
Реферат: Даний винахід стосується конкретної кристалічної форми (3,5-бістрифторметил)-N-[4-метил-3(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула І), способів її одержання, фармацевтичних композицій, що містять дану кристалічну форму, і їхнього застосування як протипухлинного засобу в людини. Сполука формули І, також відома як AN-019, являє собою: формулу (І) UA 103610 C2 (12) UA 103610 C2 CF3 H N N H N CF3 N H3 C O N Формула І Код розробки AN-019 . UA 103610 C2 5 10 15 20 25 30 35 Галузь техніки Даний винахід відноситься до конкретної форми (3, 5-бістрифторметил)-N-[метил-3-(4піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула I), до способів її одержання, фармацевтичним композиціям, що містять таку кристалічну форму, і їх застосуванню в якості протипухлинного засобу у людині. Сполука формули I, також відома як AN-019, являє собою: Рівень техніки, до якої відноситься винахід Одержання (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2іламіно)феніл]бензаміду формули I і його застосування, особливо в якості протипухлинного засобу, описано в прикладах 3 і 4 WO2006/027795 (PCT/IN05/00243, поданої 19 липня 2005 року), яка опублікована 16 березня 2006 року, і у відповідних заявках багатьох інших країн, включаючи США (Pub. No.: US 2007/0232633). У цих публікаціях поліморфізм не розглянутий. У даний час несподівано виявлено, що в певних умовах утворюється нова поліморфна форма сполуки формули I, яка надалі в даному описі описана як кристалічна форма III, і вона має переважні властивості. Сутність винаходу Даний винахід відноситься до конкретної форми (3,5-біс-трифторметил)-N-[4-метил-3-(4піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула I), способам її одержання, фармацевтичним композиціям, що містять таку кристалічну форму, і до їхнього застосування в якості протипухлинних засобів у людини. Сполука формули I, також відома як AN-019, являє собою: В одному з варіантів здійснення даний винахід відноситься до кристалічної форми III (3,5біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула I), яка має характеристики XRPD, наведені нижче в таблиці 3. Дана кристалічна форма може мати температуру плавлення 240С або вище. Кристалічна форма може бути по суті чистою. В одному з варіантів здійснення даний винахід відноситься до способу лікування суб'єкта, що потребує антипроліферативну терапію. Даний варіант здійснення способу може включати введення суб'єктові кристалічної форми III (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3ілпіримідин-2-іламіно)феніл]бензаміду (формула I), яка має характеристики XRPD, наведені нижче в таблиці 3. Даний винахід також відноситься до фармацевтичної композиції. Фармацевтична композиція містить фармацевтично прийнятний ексципієнт і кристалічну форму III (3,5-біс-трифторметил)N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула I), яка має характеристики XRPD, наведені нижче в таблиці 3 . Даний винахід також відноситься до застосування кристалічної форми III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула I), яка має характеристики XRPD, наведені нижче в таблиці 1, для одержання 1 UA 103610 C2 5 10 15 20 25 30 35 40 45 50 55 60 антипроліферативного лікарського засобу для лікування пухлинного захворювання. Даний винахід відноситься до способу одержання кристалічної форми III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл] бензаміду (формула I), яка має характеристики XRPD, наведені нижче в таблиці 3. Даний спосіб включає обробку сполуки формули I у кристалічній формі I або II оцтовою кислотою або сумішшю диметилформаміду й ацетону, гексану або толуолу. Даний спосіб також може включати наступну обробку однократно обробленої сполуки оцтовою кислотою, ацетоном, гексаном або толуолом. В іншому аспекті даний винахід відноситься до кристалічної форми I (3,5-біс-трифторметил)N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула I), яка має характеристики XRPD, наведені нижче в таблиці 1. В іншому аспекті даний винахід відноситься до кристалічної форми II (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (формула I), яка має характеристики XRPD, наведені нижче в таблиці 2. Короткий опис фігур. На фіг.1 представлена діаграма рентгенівської дифракції (XRD) кристалічної форми I сполуки формули I. Значення 2θ і інтенсивності наведено в таблиці 1. На фіг.2 представлена діаграма рентгенівської дифракції (XRD) кристалічної форми II сполуки формули I. Значення 2θ і інтенсивності наведено в таблиці 2. На фіг.3 представлена діаграма рентгенівської дифракції (XRD) кристалічної форми III сполуки формули I. Значення 2θ і інтенсивності наведено в таблиці 3. На фіг.4 представлена термограма диференціальної сканувальної калориметрії (DSC) кристалічної форми I сполуки формули I. На фіг.5 представлена термограма диференціальної сканувальної калориметрії (DSC) кристалічної форми II сполуки формули I. На фіг.6 представлена термограма диференціальної сканувальної калориметрії (DSC) кристалічної форми III сполуки формули I. На фіг.7 представлена морфологія кристалічної форми I сполуки формули I. На фіг.8 представлена морфологія кристалічної форми II сполуки формули I. На фіг.9 представлена морфологія кристалічної форми III сполуки формули I. На фіг.10A і 10B проілюстровано, що внутрішньоочеревинні ін'єкції сполуки формули I (приклад 1) викликали регресію лейкозу в голих мишей. Мазки крові, узяті із хвостової вени, показали підвищення LGI у контролів і прогресуюче зниження LGI у мишей, оброблених іматинобом і AN019 (фіг.10A). На 48 добу було визначено, що LGI у мишей, оброблених іматинобом, склав 20±5, і LGI у мишей, оброблених AN019, склав 10±2 із практично нормальним числом клітин (фіг.10B). На фіг.11 проілюстровано, що клітини, оброблені AN019, не показували будь-якого збільшення селезінки, у той час як у мишей, оброблених іматинобом, спостерігалося збільшення селезінки (приклад 2). На фіг.12 проілюстровано, що AN019 у концентрації 1 мг/кг не індукував зниження експресії люциферази, 5 мг/кг викликали фіксацію лейкозних клітин на постійних рівнях експресії, і концентрації 10 і 20 мг/кг викликали зниження експресії люциферази. На фіг.13 проілюстровано, що пероральне введення іматинобу (1, 5, 10 і 20 мг/кг) голим мишам, яким імплантували клітини лейкозу людини K562luc, приводило до регресії лейкозу при більш високих концентраціях. Уведення іматинобу в концентрації 1 мг/кг не індукувало зниження експресії люциферази, у той час як 10 мг/кг і 20 мг/кг показали вповільнення експресії люциферази. Фіг.14A, 14B і 14C. На даних фігурах проілюстровані результати досліджень, аналогічних дослідженням, проілюстрованим на фігурах 12 і 13, але з використанням контрольного лікарського засобу дасатинібу (приклад 16). Фіг.15 і 16. Аналіз інвазії в матригель in vitro клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності зазначених концентрацій AN-019, AN-024 при опроміненні й без нього. Фіг.17. Аналіз ангіогенезу in vitro клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності зазначених концентрацій AN-019, AN-024 при опроміненні й без нього. Фіг.18. Вестерн-Блот аналіз клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності зазначених концентрацій AN-019, AN-024 при опроміненні й без нього. Фіг.19. Експресія люциферази в мишей, яким імплантували K562luc, після обробки AN024, 2 UA 103610 C2 5 10 AN019 або іматинобом. Фіг.20. Кількість тварин, вилікуваних після обробки AN024 або AN019 на 58 добу. Обробку лікарським засобом припиняли на 42 добу, лікувальний вплив AN024 і AN019 у тварин тривало після припинення обробки лікарським засобом (дані, засновані на люмінесценції). Фіг.21. Число бластних клітин у мазках крові, узятих у тварин на зазначену добу. Обробку лікарським засобом припиняли на 42 добу. AN024 і AN019 показали ефективність після припинення обробки лікарським засобом. Було виявлено, що іматиніб є неефективним. Фіг.22. Напівкількісний аналіз внутрічерепних пухлин у голих мишей після введення TMZ, AN024 або AN019 з опроміненням або без нього (5Gly). Фіг.23. Графічне подання голих мишей, що показують відсутність пухлин після обробки лікарським засобом AN-019, AN-024 з опроміненням або без нього. Докладний опис винаходу У таблиці 1 представлені значення 2θ і інтенсивності кристалічної форми I сполуки формули I з діаграми рентгенівської дифракції (XRD) фіг.1. 15 20 У таблиці 2 представлені значення 2θ і інтенсивності кристалічної форми II сполуки формули I з діаграми рентгенівської дифракції (XRD) фіг.2. 3 UA 103610 C2 У таблиці 3 представлені значення 2θ і інтенсивності кристалічної форми III сполуки формули I з діаграми рентгенівської дифракції (XRD) фіг.3. 5 4 UA 103610 C2 5 10 15 20 Кристалічна форма III сполуки формули I характеризується голкоподібними кристалами. Кристалічні форми I і II сполуки формули I характеризуються неголкоподібними кристалами. Кристалічні форми I і II сполуки формули I є метастабільними при кімнатній температурі. Однак кристалічна форма III сполуки формули I є термодинамічно стабільною при кімнатній температурі. Це вказує на високу стабільність кристалічної форми III. Таким чином, в одному з варіантів здійснення даний винахід відноситься до кристалічної форми III сполуки формули I, яка є стабільною при кімнатній температурі й навіть при більш високих температурах (наприклад, 120C) і в умовах збільшеного навантаження, і має характеристики, наведені в таблиці 3 (вище). В одному з варіантів здійснення даний винахід відноситься до способу одержання кристалічної форми III сполуки формули I, яка є стабільною й має характеристики, наведені в таблиці 3. У таблиці 4 представлена стабільність при нагріванні кристалічної форми III при температурах 110-140С. Було показано, що форма III не є метастабільною й стабільна при нагріванні до 130С протягом 6 годин. Чисту кристалічну форму III (1 г), отриману за способом даного винаходу, поміщали в трубку для кип'ятіння й поступово нагрівали на масляній бані. Потім речовину досліджували XRPD. Результати представлено в таблиці 4. Таблиця 4 Вміст поліморфа* до нагрівання Форма III Форма III Форма III Температура 110 120 130 Час нагрівання (години) 6 6 6 Поліморфна форма, виявлена* після нагрівання Форма III Форма III Форма III * Наявність форм I і II у даних зразках була нижче рівня детекції. 25 Отримані дані демонструють, що кристалічна форма III не була метастабільною. Кристалічна форма III була стабільною при нагріванні навіть при 130С протягом 6 годин. У таблиці 5 представлена стабільність кристалічної форми III в умовах збільшеного навантаження (45±2C , 75±5% RH, 6 місяців) у сипучій і в капсульованій формі. 5 UA 103610 C2 Таблиця 5 Стабільність кристалічної форми III у сипучій і в капсульованій формі Вміст поліморфа* сполуки формули I у виготовленій капсулі Виявлена поліморфна форма Форма III Форма III Форма III Форма III Форма III Вміст поліморфа* сполуки формули I у сипучій формі Тривалість зберігання (місяці) при 40±2С/75±5% RH Виявлена поліморфна форма Форма III Форма III Форма III Форма III Форма III 0 місяць 1 місяць 2 місяця 3 місяця 6 місяців * Наявність форм I і II у даних зразках була нижче рівня детекції. 5 10 15 Отримані дані демонструють, що форма III не перетворюється в інші форми із часом. Таким чином, була встановлена стабільність форми III у сипучій і в капсульованій формі. В одному з варіантів здійснення даний винахід відноситься фармацевтичної композиції, корисної при терапії пухлини, що містить стабільну кристалічну форму III сполуки формули I. Дозована форма композиції, що містить стабільну кристалічну форму III, яку можна одержувати способом даного винаходу, наприклад, пероральна дозована форма, може являти собою капсулу, що містить композицію, наприклад, порошкову або гранульовану тверду композицію, або у твердій, або в м'якій оболонці. Оболонка може бути виготовлена з желатину, який необов'язково містить пластифікатор, такий як гліцерин або сорбіт, і агент, що надає непрозорість, або барвник. Способи, відомі в даній галузі, можна використовувати для одержання фармацевтичної композиції, що містить кристалічну форму III, у формі капсул. Ексципієнти, які можна використовувати, включають мікрокристалічну целюлозу, полоксамер 407, кросповідон XL, Aerosil, SLS, стеарат магнію або їх суміші. У таблиці 6 представлені підходящі кількості активних інгредієнтів і ексципієнтів (% мас.) для фармацевтичних сполук даного винаходу. Таблиця 6 Варіант отримання фармацевтичної композиції, що має кристалічну форму III No. Речовини 1. 2. 3. 4. 5. 6. 7. Композиція (мас./мас.), мг/капсула 25,0 8,0 12,5 12,5 0,5 4,0 0,25 Матеріал Сполука формули I, III Мікрокристалічна целюлоза Полоксамер 407 Кросповідон XL Стеарат магнію SLS Aeрoсiл 20 25 30 В одному з варіантів здійснення винахід відноситься до конкретної по суті чистої кристалічної форми III (3,6-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіридимін-2іламіно)феніл]бензаміду (формула I). Термін "по суті чистий" у контексті даного винаходу означає, що приблизно від 90 до 100% мас., приблизно від 95 до 100% мас., або, наприклад, приблизно від 99 до 100% мас. кристалів формули I присутні в кристалічній формі даного винаходу, наприклад, кристалічній формі III. У контексті формулювання, кристалічна форма III формули I показує діаграму рентгенівської дифракції по суті як на фіг.3, термін "по суті" означає, що присутні щонайменше основні лінії діаграми, наведеної на фіг.3, тобто лінії, що мають відносну інтенсивність більш 10%, особливо більш 20%, у порівнянні з найбільш інтенсивною лінією в діаграмі. Кристалічні форми мають наступні властивості: 6 UA 103610 C2 5 10 15 20 25 30 35 40 45 50 55 60 Температура плавлення в кросповідон DSC кристалічної форми III становить 246,7С. Температура плавлення в термограмі DSC кристалічної форми I становить 234, і кристалічної форми II становить 240,47С, 249,2С(пік). Діаграми рентгенівської дифракції також демонструють інші виражені відмінності. В одному з варіантів здійснення по суті чиста кристалічна форма III сполуки формули I має діаграму рентгенівської дифракції, зазначену на фіг.3. В одному з варіантів здійснення винахід відноситься до кристалічної форми III сполуки формули I, яка характеризується наявністю кристалів, що мають форму, представлену на фіг.9, наприклад, кристалічну форму III у по суті чисту форму. В одному з варіантів здійснення кристалічна форма III сполуки формули I має температуру плавлення більш 240С, наприклад, від 245 до 250С. Кристалічну форму III (наприклад, по суті чисту) можна одержати в такий спосіб: обробкою іншої кристалічної форми, наприклад, кристалічної форми I або II, сполуки формули I полярним розчинником, що підходить, наприклад, N,N-ди-нижчий алкіл-нижчим алканкарбоксамідом, таким як N,N-диметилформамід або N,N-диметилацетамід, або, наприклад, аліфатичною карбоновою кислотою, такою як оцтова кислота, або сумішшю зазначених вище сполук з кетоном, таким як ацетон, або гідрофобним вуглеводнем, наприклад, толуолом або гексаном, або їх сумішшю, при підходящій температурі. В одному з варіантів здійснення сполуку формули I обробляють сумішшю диметилформаміду й ацетону з наступною обробкою ацетоном. В одному з варіантів здійснення сполуку формули I обробляють сумішшю диметилформаміду й гексану з наступною обробкою гексаном. В одному з варіантів здійснення сполуку формули I обробляють сумішшю диметилформаміду й толуолу з наступною обробкою толуолом. В одному з варіантів здійснення сполуку формули I обробляють один або кілька раз оцтовою кислотою. У цьому контексті, "проведення обробки" або "обробка" відноситься до нагрівання, охолодження, кип'ятіння зі зворотним холодильником, промиванню, суспендуванню або подібному, у розчиннику або суміші розчинників. Кожний із зазначених варіантів здійснення приводить до кристалічної форми III сполуки формули I. У певних варіантах здійснення спосіб одержання кристалічної форми III за даним винаходом не включає обробку іншої кристалічної форми сполуки формули I хлороформом, метанолом, дихлорметаном, простим ефіром (наприклад, діетиловим ефіром), водою, етилацетатом або їх сумішшю. У певних варіантах здійснення кристалічну форму III не одержують обробкою іншої кристалічної форми сполуки формули I хлороформом, метанолом, дихлорметаном, простим ефіром (наприклад, діетиловим ефіром), водою, етилацетатом або їх сумішшю. Кристалічна форма III сполуки формули I, а також інші форми, мають підходящі фармакологічні властивості, і їх можна використовувати, наприклад, у якості протипухлинних засобів. Також даний винахід відноситься до способу одержання сполуки формули I. Даний спосіб може включати: надання сполуки формули VI, 3,5-біс-трифторметилбензоїлхлориду; або одержання даної сполуки відомими способами; конденсацію 4-метил-3-нітроаніліну зі сполукою формули (IV) при приблизно від 0 до приблизно -10C у хлорвуглеводневому розчиннику з додаванням основної сполуки, з одержанням сполуки формули III, ((3,5-біс-трифторметил)-N-(4-метил-3-нітрофеніл))бензаміду; відновлення сполуки формули (III) хлоридом олова (II)/концентрованої HСl при температурі кипіння зі зворотним холодильником протягом приблизно від 0,5 до приблизно 1 години, з одержанням сполуки формули IV, (3,5-біс-трифторметил)-N-(3-аміно-4-метилфеніл))бензаміду; конденсацію сполуки формули IV з водяним розчином ціанаміду при температурі кипіння зі зворотним холодильником у н-бутанольному розчиннику, з одержанням сполуки формули V, (3,5-біс-трифторметил)-N-(3-гуанідино-4-метилфеніл))-бензаміду; конденсацію сполуки формули (V) з 3-диметиламіно-1-піридин-3-іл-пропеноном у присутності основи при температурі кипіння зі зворотним холодильником, з одержанням сполуки формули (I). В одному з варіантів здійснення спосіб здійснюють, як описано в прикладі 10. Опис патентної заявки США No. 11/714565, поданої 5 березня 2007 року (публікація США No. US 2007/0232633, опублікована 4 жовтня 2007 року) і заявки PCT No. PCT/IN 2005/000243, поданої 19 липня 2005 року (публікація PCT No. WO2006/027795, опублікована 16 березня 2006 року) включені в даний опис за допомогою посилань у всій їхній повноті. Варіанти здійснення даного винаходу описані в прикладах, наведених нижче, які надані тільки для ілюстрації винаходу й, таким чином, їх не слід витлумачувати, як такі, що обмежують 7 UA 103610 C2 5 10 15 20 25 30 35 40 45 50 55 60 об'єм винаходу. Приклади Загальний коментар Виявлено, що основна сполука даного винаходу формули I (зазначена за допомогою коду розробки AN-019), має корисну протипухлинну активність, що перевершує деякі з існуючих схвалених лікарських засобів цього класу. Виявлено, що дана сполука володіє трьома різними поліморфними формами I, II і III, як обговорювалося вище. Незважаючи на те, що всі форми мають цінні фармакологічні властивості, і їх можна використовувати в якості протипухлинних засобів, форма III була обрана для оцінки біологічної активності, виходячи з її термодинамічної стабільності. Код розробки AN-024 відноситься до іншої сполуки того ж класу, описаному авторами даного винаходу в іншому місці. Біологічну ефективність і активність сполук даного винаходу порівнювали зі схваленими лікарськими засобами, такими як іматинобу мезилат і дасатиніб, щоб вони служили як позитивні контролі в даному дослідженні. "Іматинобу мезилат" скорочують і позначають у даному дослідженні як "іматиніб". Приклад 1 - Установлення активності AN-019 проти CML у голих мишей, яким імплантували клітини k562 (фіг.10A і 10B) Для визначення активності сполук даного винаходу проти CML, клітини K562 одержували від ATCC і ці клітини імплантували голим мишам. У якості контролю для порівняння використовували іматиніб у тій же концентрації на кг маси тіла. Обробку лікарським засобом починали через 15 діб після імплантації й продовжували до 48 діб за допомогою внутрішньоочеревинних ін'єкцій 10 мг/кг раз на добу. Кров відбирали із хвостової вени кожні 6 діб, визначали відсоток клітин K562 і обчислювали процентний індекс росту лейкозу (LGI). У мишей, оброблених AN019, спостерігалося стійке зниження LGI після початку обробки лікарським засобом. LGI для мишей, оброблених іматинобом, також показав зниження, але значно відстаюче від мишей, оброблених AN019. Через сорок вісім діб після постійних внутрішньоочеревинних ін'єкцій, миші, оброблені AN019, були порівнянні з нормальними контрольними мишами, і в мишей, оброблених іматинобом, LGI становив 20±5 у порівнянні з контролями. Імуногістохімія селезінки на білок Crk виявила локалізацію клітин K562 у селезінці контрольних мишей. У мишей, оброблених AN019, спостерігалися базальні рівні експресії Crk, у той час як у мишей, оброблених іматинобом, спостерігалася менша кількість колоній від низьких до таких, що не піддаються детекції рівнів експресії Crk. Способи Імплантація K562 6 Голим мишам (nu/nu) імплантували клітини K562 (1×10 ) через хвостову вену. Використовували чотири миші на групу і їх розділяли на 4 групи. У трьох групах імплантували клітини K562 і одну групу використовували як нормальних контролів. Групу 2 інокулювали клітками K562, і вона служила в якості позитивних контролів без уведення. Дві інші групи, яким імплантували клітини K562, обробляли або іматинобом, або AN019. Внутрішньоочеревинна ін'єкція AN019 і іматинобу Мишей, яким імплантували K562, обробляли або іматинобом, або AN019 (10 мг/кг маси тіла) за допомогою внутрішньоочеревинних ін'єкцій. Вихідні розчини іматинобу й ANO19 одержували в концентрації 100 мкг/мкл у ДМСО. Мишам робили ін'єкції зазначених вище дозувань внутрішньоочеревинним шляхом. Було визначено, що середня маса голих мишей становить 30±3 г, і було обчислено, що дозування на мишу становить 300±30 мкг/миша. Три мікролітри вихідних розчинів розводили до 100 мкл стерильною водою безпосередньо перед внутрішньоочеревинними ін'єкціями. Внутрішньоочеревинні ін'єкції проводили раз на добу починаючи з 15 доби після імплантації до 48 доби, усього проводячи 33 ін'єкції. Визначення індексу росту лейкозу (LGI) Індекс росту лейкозу визначали з використанням формули LGI (%)=(V 0-Vt)/Vc×100%. Vc означає середню кількість бластних клітин (K562) на мл крові в контрольних тварин у певний час виміру, і Vt означає середню кількість бластних клітин на мл крові в тестуємих тварин у певний час виміру. Відбір крові в мишей (оброблених і неопрацьованих) проводили на шосту добу після імплантації клітин K562 і продовжували з інтервалом кожні шість діб протягом 48 діб. Відбір крові проводили через хвостову вену. Кількісний аналіз LGI представляли графічно. Імуноцитохімія Контрольних мишей умертвляли на 42 добу, коли спостерігали вторинні симптоми лейкозу, такі як збільшення живота й відсутність кровотоку в периферичних судинах, що приводить до втрати пальців і червоним плямам під поверхнею шкіри. Селезінку й будь-які вторинні пухлини витягали, фіксували у формальдегіді й занурювали в парафін у відповідності зі стандартними протоколами. Одержували парафіновий зріз і обробляли його для імуноцитохімії. Регідратовані 8 UA 103610 C2 5 10 15 20 25 30 35 40 45 50 55 60 зрізи обробляли 0,3% H2O2 для інактивації будь-яких нативних пероксидаз перед імунологічним дослідженням. Зрізи блокували стерилізованим фільтрацією (0, 22-мкм фільтр) 1% BSA-PBS при кімнатній температурі протягом 1 год. Після блокування зрізи піддавали імунозондуванню зі специфічним проти Crk людини первинним моноклональним антитілом, індукованого в кролика, проти синтетичного пептиду, відповідного до залишків в SH2 домені близько N-кінця білка Crkl людини (Abeam, Cambridge, MA, USA) в 1% BSA-PBS протягом ночі. Вторинне антитіло (антитіло проти антитіл кролика), конъюговане з HRP, використовували для детекції наявності первинного антитіла. Зрізи швидко промивали три рази в розчині PBS після імунозондування вторинним антитілом, і додавали субстрат HRP DAB згідно з інструкціями виготовлювача (Sigma St Louis MO USA). Реакції давали можливість протікати доти, поки не спостерігався чіткий контраст між позитивними й негативними контролями. Для негативних контролів первинне антитіло видаляли. Селезінка мишей з лейкозом служила в якості позитивних контролів. Результати Внутрішньоочеревинні ін'єкції AN019 викликали регресію лейкозу в голих мишей. Мазки крові, які одержували кожні шість діб після імплантації, показали підвищення LGI у контрольних мишей у порівнянні з мишами без уведення. Мазки крові, узяті із хвостової вени, показали підвищення LGI у контролів і прогресуюче зниження LGI у мишей, оброблених іматинобом і AN019 (фіг.10A). Починаючи з п'ятнадцятої доби після імплантації, мишам проводили внутрішньоочеревинні ін'єкції AN019 або іматинобу в дозуванні 10 мг/кг маси тіла. Миші, оброблені іматинобом, відставали від мишей, оброблених AN019, у кожний момент часу. На 48 добу було визначено, що LGI мишей, оброблених іматинобом, становить 20±5, у той час як було виявлено, що LGI мишей, оброблених AN019, становить 10±2 із практично нормальною кількістю клітин (фіг.10B). Приклад 2 - Ін'єкції AN019 голим мишам, яким імплантували клітини K562, не показали збільшення селезінки й експресії Crk (фіг.11) Голим мишам, яким імплантували клітини K562, уводили іматиніб або AN019 внутрішньоочеревинними ін'єкціями. Після того, як спостерігали зниження LGI, мишей умертвляли й селезінку витягали. Збільшення селезінки спостерігали при макроскопічному дослідженні, і було визначено, що в контрольних мишей селезінка була збільшеною, що вказує на локалізацію клітин K562. Клітини, оброблені AN019, не показали будь-якого збільшення селезінки, у той час як у мишей, оброблених іматинобом, селезінка була трохи збільшена (фіг.11). Парафінові зрізи селезінки, піддані імунозондуванню відносно наявності білка Crk, показали виражену локалізацію експресії Crk, що супроводжується підвищеною клітинною щільністю, що вказує на локалізацію K562 у контрольних мишей. У мишей, оброблених AN019, спостерігався тільки базальний рівень експресії Crk, порівнянний з негативним контролем. У мишей, оброблених іматинобом, спостерігалися локалізовані області експресії Crk, що вказують на клітини K562 у селезінці. У контрольних мишей також розвивалися випадковим образом розташовані підшкірні пухлини, що демонструють експресію Crk, що вказувало на присутність клітин K562. С отриманих результатів, мабуть, що введення AN019 викликало регресію LGI у голих мишей. У мишей, оброблених іматинобом, також спостерігалося значиме зниження LGI, але воно відставало від зниження в мишей, оброблених AN019. Миші, оброблені як AN019, так і іматинобом, не мали фізіологічних, фенотипічних або поведінкових відхилень. У контрольних мишей спостерігалася наявність випадковим чином розташованих підшкірних пухлин із втратою пальців, що супроводжується червонуватими плямами під шкірою й невеликим збільшенням живота. С отриманих результатів очевидно, що AN019 являє собою перспективний лікарський засіб для лікування лейкозу. Приклад 3 - Дослідження in vivo з використанням клітинних ліній CML миші Baf3, стійких до іматинібу Для визначення in vivo протилейкозної активності AN019 і AN024, голим мишам внутрішньоочеревинно імплантували клітини лейкозу миші Baf3 (Wt, T315I, M351T і E225K), і через 15 діб після імплантації мишей обробляли іматинобом (10 мг/кг), AN019 (20 мг/кг) і AN024 (20 мг/кг) шляхом пероральної примусової годівлі або внутрішньоочеревинних ін'єкцій. Мазки крові одержували через хвостову вену або через стегнову вену кожні 6 діб, проводили підрахунок бластних клітин і одержували його графічне зображення. Мазки крові мишей, яким імплантували Baf3Wt і обробляли іматинобом (10 мг/кг), AN019 (20 мг/кг) або AN024 (20 мг/кг), були подібними з нормальними контролями через 42 доби. Мазки крові мишей, яким імплантували Baf3T315I і вводили іматиніб (10 мг/кг), AN019 (20 мг/кг) або AN024 (20 мг/кг), показали значиме зниження кількості бластних клітин у випадку мишей, оброблених AN024 і AN019. У мишей, оброблених пероральним дозуванням іматинобу, 9 UA 103610 C2 5 10 15 20 25 30 35 40 45 50 55 60 не спостерігалося зниження кількості бластних клітин, і воно було подібним з контролями без уведення й мишами, яким імплантували Baf3M351T. Миші, яким імплантували Baf3E255K, також мали подібну поведінку з мишами, яким імплантували Baf3M351T і Baf3T315I. Голих мишей, яким імплантували мутантні клітини Baf3 Wt, E255K, T315I і M351T, обробляли іматинобом, AN019 і AN024 (перорально й внутрішньоочеревинно). Мишам уводили іматиніб (10 мг/кг), AN019 (20 мг/кг) і AN024 (20 мг/кг) примусовою пероральною годівлею або внутрішньоочеревинними ін'єкціями через 15 діб після імплантації. Моніторинг збільшення живота й зниження активності проводили щодоби, кожні 6 діб брали мазки крові із хвостової вени або стегнової вени й фарбували їх H&E згідно зі стандартними протоколами. Через 42 доби після імплантації, мишей умертвляли й селезінку витягали. Визначали збільшення селезінки й зіставляли її з кількістю бластних клітин у мазках крові. Результати Мікроскопічне визначення кількості бластних клітин У мишей, яким імплантували клітини Baf3, кожні 6 діб до 42 діб відбирали кров із хвостової вени або стегнової вени. На 15 добу після імплантації, мишей обробляли іматинобом, AN019 і AN024 (перорально й внутрішньоочеревинно), як описано вище. Було виявлено, що у мишей, яким імплантували Baf3Wt, при всіх умовах уведення спостерігалося прогресуюче зниження кількості бластних клітин. Baf3M351T, T315I і E225K погано відповідали на обробку іматинобом. Пероральне введення іматинобу не мало істотного впливу на мишей, яким імплантували Baf3M351T, T315I і E225K. У цілому, внутрішньоочеревинне введення AN024 і AN019 було значно краще відносно зниження кількості бластних клітин у всіх мишей, яким імплантували Baf3. Обробка AN019 мишей, яким імплантували Baf3Wt, індукувала повну регресію лейкозних бластних клітин, і вони були порівнянні з контролями без уведення. Внутрішньоочеревинне введення перевершувало пероральне введення. Обробка AN019 мишей, яким імплантували Baf3 M351T, T315I і E225K, показала значиме зниження кількості бластних клітин, і на 42 добу вони були порівнянні з мишами, яких на 12 добу після імплантації піддавали обробці; миші, яким проводили внутрішньоочеревинне введення, продемонстрували більшу регресію бластних клітин, ніж миші, яким проводили пероральне введення. Обробка AN024 мишей, яким імплантували Baf3 M351T, T315I і E225K, продемонструвала значиме зниження кількості бластних клітин, і вона перевершувала обробку AN019 на 42 добу; у мишей, яким проводили внутрішньоочеревинне введення, спостерігалася більша регресія бластних клітин, ніж у мишей, яким проводили пероральне введення. Приклад 4 - Відповідь голих мишей, яким імплантували лейкозні клітини людини k562 normal/luc, з низькою дозою AN024, AN019 і іматинобу (фіг.12 і 13) 6 Голим мишам (nu/nu) імплантували клітини K562 (1×10 ) normal/luc через хвостову вену. Використовували за п'ять мишей на групу і їх підрозділяли на 24 групи+2 контролю. Усім групам імплантували клітини K562 normal/luc. С 24 груп, 12 використовували для досліджень люциферази, у той час як інші 12 використовували для досліджень із підрахунком у мазках крові. Пероральне введення AN019, AN024 і іматинобу Лікарські засоби вводили за допомогою примусової пероральної годівлі (2% гуміарабік і 2% SLS у водній суспензії). Результати Пероральне введення ANO19 (1, 5, 10 і 20 мг/кг) голим мишам, яким імплантували лейкозні клітини людини K562luc, привело до регресії лейкозу при більш високих концентраціях. Концентрація AN019 1 мг/кг не індукувала зниження експресії люциферази, у той час як концентрація 5 мг/кг викликала фіксацію клітин лейкозу на постійних рівнях експресії, і концентрації 10 і 20 мг/кг викликала зниження експресії люциферази (фіг.12). Пероральне введення іматинобу (1, 5, 10 і 20 мг/кг) голим мишам, яким імплантували лейкозні клітини людини K562luc, приводило до регресії лейкозу при більш високих концентраціях. Уведення іматинобу в концентрації 1 мг/кг не індукувало зниження експресії люциферази, у той час як 10 мг/кг і 20 мг/кг показали вповільнення експресії люциферази (фіг.13). Дане дослідження демонструє перевагу AN-019 над іматинобом відносно регресії лейкозу, зокрема, через 24 доби після введення. Приклад 5 - Визначення ефективності лікарського засобу (De) і визначення проникності для лікарського засобу із часом Визначення ефективності лікарського засобу (De) Ефективність лікарського засобу визначали з використанням рівняння, 10 UA 103610 C2 5 æèâèõ æèâèõ C De æèâèõ 100 luc luc Ñâèõ³äíå C де: живих означає загальну кількість живих мишей при даній концентрації наприкінці експерименту, помножене на кількість фотонів, luc означає загальну кількість живих мишей, що демонструють експресію люциферази при даній концентрації наприкінці експерименту, і c означає кількість контрольних тварин без уведення, помножене на кількість фотонів, і Ñ âèõ³äíå 10 означає вихідну кількість тварин у контрольній групі на початку експерименту, помножене на кількість фотонів. Результати були представлені графічно як відсоток ефективності лікарського засобу (таблиця 7). Результати У таблиці 7 представлена ефективність лікарського засобу при різних концентраціях іматинобу, AN019 і AN024, при визначенні в дослідженнях in vivo. З таблиці 7 очевидно, що AN019 є дозозалежним, у той час як іматиніб і AN024 не є дозозалежними, і вони були ефективними в низьких концентраціях. 15 Таблиця 7 Лікарський засіб Іматиніб De AN019 De AN024 De 20 25 30 35 40 45 5 мг/кг 10,00 25,82 30,00 10 мг/кг 32,00 78,20 85,00 20 мг/кг 13,33 83,40 87,00 40 мг/кг 8,00 85,20 90,00 Визначення проникності для лікарського засобу із часом (Tp) Проникність із часом обчислювали з використанням наступного рівняння, P P n a n ter Tp P P n a n b де: P означає кількість фотонів на добу "a", доба "ter" або на добу "b", де "a" означає добу, коли обробку лікарським засобом припиняли, "ter" означає добу, коли експеримент завершували, і "b" означає добу, коли P було мінімальним після доби a, але до доби "ter". n дорівнює числу живих тварин під час виміру P. Більше значення вказує на високу ефективність лікарського засобу після припинення обробки лікарським засобом, тобто проникність для лікарського засобу із часом. Результати Для визначення проникності із часом для AN019, AN024 і іматинобу, голим мишам імплантували клітини K562luc. Тварин після трансплантації фотографували з інтервалами 6 діб. Обробку лікарським засобом (AN019 20 мг/кг, AN024 20 мг/кг і іматинобом 10 мг/кг) починали через 15 діб після імплантації за допомогою внутрішньоочеревинних уведень раз на добу. Обробку лікарським засобом припиняли на 35 добу, тварин фотографували до 45 доби, і проводили обчислення, як описано в способах. С використанням рівняння для проникності із часом, були визначені наступні значення T p: AN019=2,0 AN024=2,4 Іматиніб=0,8 Значення Tp указують на те, що AN024 мав активність вище контролю без обробки й був значно краще, чим AN019, відносно активності із часом після припинення обробки лікарським засобом. Приклад 6 - Ефект дасатинібу в голих мишей, яким імплантували Baf3, у порівнянні з AN024, AN019 і іматинобом (фіг.14A, 14B і 14C) У прикладі 3 показана ефективність AN024 і AN019 для лікування лейкозу в порівнянні з іматинобом з використанням мутантних клітинних ліній Baf3 (wt, T315I, M351T і E255K). У цьому випадку, автори даного винаходу використовували дасатиніб у якості контрольного лікарського засобу для визначення відповіді мутантних клітин Baf3 на введення, у порівнянні з AN019, 11 UA 103610 C2 AN024 і іматинобом. Спосіб Схема експерименту наведена нижче у формі таблиці: Уведення ↓, імплантована клітинна лінія → Wt Т3151 М351Т Е255К Контролі, (виконано раніше) Дасатиніб (10 мг/кг) 5 10 15 20 25 30 35 40 45 50 Перорально Внутрішньоочеревинно 5 5 5 5 5 5 5 5 Голим мишам внутрішньоочеревинно імплантували мутантні клітини Baf3 (wt, T315I, M351T або E255K). Через 15 діб після імплантації, мишам уводили або перорально, або внутрішньоочеревинно 10 мг/кг дасатиніб протягом 27 діб. Кожні 6 діб відбирали кров зі стегнової вени або хвостової вени, визначали кількість бластних клітин і його графічно зображували. Результати На 6 добу, мазки крові голих мишей, яким імплантували мутантні клітини Baf3 (wt, T315I, M351T або E255K), продемонстрували нормальну кількість бластних клітин, і кількість бластних клітин поступово зростала, як спостерігали на 12 добу. Уведення дасатинібу починали на 15 добу після імплантації. Уведення дасатинібу давало результати не кращі, чим уведення іматинобу. На 42 добу, при завершенні експерименту, миші, яким імплантували клітини wt, продемонстрували виражену відповідь на дасатиніб, що вказує на те, що внутрішньоочеревинне введення перевершувало пероральне. Миші, яким імплантували T315I і M351T, були подібні з контролями без значимого зниження кількості бластних клітин. У мишей, яким імплантували E255K, результати були трохи кращими, чим у випадку імплантованих клітин T315I, у відповідь на введення дасатинібу. Загалом, уведення дасатинібу приводило тільки до вповільнення прогресування лейкозу без значимого лікувального ефекту. Кількість бластних клітин було значно більш низьким у групі, який вводили AN019. Отримані результати проілюстровано на фігурах 14A, 14B і 14C. Приклад 7 - Дослідження in vitro на клітинних лініях гліоми й рака молочної залози (фіг.1518) Матеріали й способи Для визначення ефекту AN019, AN024 і темозоломіду з опроміненням або без нього на клітини гліоми й рака молочної залози, клітини обробляли конкретними дозами й визначали інвазію, ангіогенез і зміни певних молекул передачі сигналу. Аналіз інвазії в матригелю Інвазивність in vitro клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій сполук оцінювали з використанням модифікованого 6 аналізу в камері Бойдена. Клітини обробляли даними сполуками протягом 48 год. 1×10 клітин суспендували в 600 мкл безсироваткового середовища, доповненого 0,2% BSA і поміщеного у верхнє відділення камер transwell оC orning Costar Fischer Scientific, каталожний #07-200-158, Pittsburgh PA), покритих матригелем (0,7 мг/мл). Нижнє відділення камери заповнювали 200 мкл сироваткового середовища й кліткам давали можливість мігрувати протягом 24 год. Після інкубації клітини фіксували, фарбували Hema-3 і кількісно визначали, як описано раніше (Mohanam et al. 1993). клітини, що мігрували, візуалізували під мікроскопом для визначення зниження інвазивності, індукованої сполуками даного винаходу. Аналіз ангіогенезу Ангіогенез in vitro клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і 4 ZR71 у присутності певних концентрацій сполук визначали в такий спосіб. Клітини (2×10 /лунка) висівали на предметні стекла з 8-ямковими камерами й обробляли різними концентраціями тестуємих сполук. Після інкубації протягом 24 год, кондиціоновані середовища видаляли й 4 додавали до 4×10 ендотеліальних клітин дерми людини (моношар у предметних стеклах з 8ямковими камерами), ендотеліальним кліткам дерми людини давали можливість рости протягом 72 год. Потім клітини фіксували в 3,7% формальдегіді, фарбували H&E і фотографували. Вестерн-Блот аналіз Вестерн-Блот аналіз клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій сполук оцінювали у відповідності зі стандартними протоколами. Клітини обробляли AN019, AN024 або темозоломідом у певних концентраціях. 12 UA 103610 C2 5 10 15 Через 24 год послу обробки, клітини збирали й клітинні лизати екстрагували. Рівні кількості білків фракціонували за допомогою SDS-PAGE. Фракціоновані білки піддавали блоттингу на нейлонові мембрани й імунозондували на AKT, ERK і Pi3k. Виділені білки клітин рака молочної залози, крім того, імунозондували на EGFR, ErbВ1, ErbВ2 і ErbВ3. Результати Аналіз інвазії в матригелю Інвазивність in vitro клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій сполук оцінювали з використанням модифікованого аналізу в камері Бойдена. Клітини обробляли даними сполуками протягом 48 год. У таблиці 2 представлені результати досліджень in vitro в аналізі інвазії в матригелі клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій сполук, при опроміненні й без нього. Зміна інвазивності різних клітинних ліній наведена в таблиці 8. З аналізу інвазії очевидно, що AN019 і AN024 були найбільш ефективними у відношенні інгібування інвазії більшості клітин, як при опроміненні, так і без нього. Таблиця 8 Клітинна лінія ZR-71 MDA-MB231 4910 5310 U87 20 25 30 35 40 Лікарський засіб Темозоламід AN024 AN019 Темозоламід AN024 AN019 Темозоламід AN024 AN019 Темозоламід AN024 AN019 Темозоламід AN024 AN019 - Опромінювання % інвазії 70% 48% 33% 62% 43% 45% 95% 56% 42% 50% 27% 5% 90% 53% 18% + Опромінювання Змінення інвазії % інвазії після опромінення 65% -5% 45% -3% 19% -14% 49% -13% 47% +4% 15% -30% 73% -22% 39% -17% 15% -27% 63% +13% 32% +5% 6% +1% 93% +3% 29% -24% 18% 0% На фіг.15 і 16 проілюстровані результати аналізу інвазії в матригелі in vitro клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій AN-019, при опроміненні й без нього. Аналіз ангіогенезу З експериментів з аналізом ангіогенезу було виявлено, що AN019 є найбільш ефективним у відношенні інгібування ангіогенезу. Обробка темозоломідом викликала повне інгібування ангіогенезу в клітках ZR-71, у той час як у клітках MDA-MB-231 спостерігали тільки невелике інгібування в контрольних умовах зі зростанням інгібування після опромінення. Клітини ксенотрансплантату гліоми 4910 показали виражене інгібування ангіогенезу як при опроміненні, так і без нього. У випадку клітин 5310, інгібування ангіогенезу спостерігали в контрольних умовах, у той час як після обробки опроміненням відбувалася стимуляція ангіогенезу. Клітини гліоми U87 продемонстрували подібний характер інгібування, як при опроміненні, так і без нього. Обробка AN024 викликала повне інгібування ангіогенезу в клітках ZR-71, у той час як у клітках MDA-MB-231 спостерігали тільки невелике інгібування в контрольних умовах і при обробці опроміненням. Клітини ксенотрансплантата гліоми 4910 продемонстрували значиме інгібування ангіогенезу як при опроміненні, так і без нього. У випадку клітин 5310, інгібування ангіогенезу спостерігали в контрольних умовах, у той час як ангіогенез далі інгібувався після обробки опроміненням. Клітини гліоми U87 продемонстрували значиме вповільнення ангіогенезу зі збільшенням інгібування після опромінення. Обробка AN019 викликала повне інгібування ангіогенезу в клітках ZR-71, у той час як у клітках MDA-MB-231 спостерігали невелике інгібування, як у контрольних умовах, так і при обробці опроміненням. Клітини ксенотрансплантату гліоми 4910 продемонстрували інгібування 13 UA 103610 C2 5 10 15 20 25 30 35 40 45 50 55 60 ангіогенезу, подібне із клітками MDA-MB-231, з підвищенням інгібування ангіогенезу після опромінення. У випадку клітин 5310, інгібування ангіогенезу було більшим у контрольних умовах, ніж після обробки опроміненням. Клітини гліоми U87 продемонстрували подібне вповільнення ангіогенезу, як при опроміненні, так і без нього. На фіг.17 проілюстровані результати, отримані при аналізі ангіогенезу in vitro клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій AN-019, при опроміненні й без нього. Вестерн-Блот аналіз Вестерн-Блот аналіз клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій сполук даного винаходу показав, що клітини U87 не показують значимої зміни рівнів AKT або PI3k, як при опроміненні, так і без нього, у той час як у клітках, оброблених AN024, спостерігали невелике зниження рівнів ERK, і після опромінення зниження підсилювалося. Клітини 4910 були подібні із клітками U87, зі зниженням рівнів AKT після обробки AN024, і зниження рівнів AKT підсилювалося після опромінення. У випадку клітин 5310, не спостерігали значимих відмінностей в експресії ERK, у той час як обробка AN019 викликала зниження рівнів експресії AKT. У клітках, оброблених AN019 без опромінення, рівні PВk практично не подавалися детекції, але повторно з'являлися після обробки опроміненням. У випадку клітин рака молочної залози MDA-MB-231, не спостерігали значимої зміни в AKT, ERK або PI3k, у той час як у випадку ZR71 обробка AN019 викликала зниження рівнів AKT, яке підсилювалося після опромінення. Обробка AN024 не показала будь-якої значимої зміни в умовах без опромінення, у той час як після опромінення клітини, оброблені AN024, показали зниження експресії AKT. Рівні PDk були відсутні при обробці AN019 як при опроміненні, так і без нього. Обробка AN024 приводила до зниження рівнів PBk після опромінення. Рівні pAKT значно не змінювалися при кожній з обробок, з опроміненням або без нього, у той час як у клітках, оброблених AN019, рівні pERK значно знижувалися, як при опроміненні, так і без нього. AN024 також показав зниження рівнів pERK, але меншою мірою ніж AN019. Обробка темозоломідом як при опроміненні, так і без нього, не показала яких-небудь значимих змін у рівнях pAKT або ERK. На фіг.18 проілюстровані результати вестерн-блот аналізу клітин гліоми 4910, 5310 і U87 і клітин раку молочної залози MDAMB231 і ZR71 у присутності певних концентрацій AN-024, при опроміненні й без нього. Приклад 8 - Аналіз виживання при лейкозі (фіг.19-21) Клітини K562, експресуючі люциферазу, імплантували внутрішньоочеревинно голим мишам; мишей сканували з використанням обладнання для візуалізації xenogeny IVIS після внутрішньоочеревинних ін'єкцій люциферину для визначення імплантації. Обробку лікарським засобом починали, як і в попередніх дослідженнях, через 15 діб після імплантації. Тварин обробляли до 42 діб, потім обробку лікарським засобом припиняли й визначали виживаність тварин відповідно до правил догляду за тваринами. Було виявлено, що в контрольних тварин розвивався лейкоз, і смерть відбувалася на 34 і 35 добу, згідно із правилами, автори даного винаходу прийняли рішення умертвити 8 тварин, що залишилися на 35 добу. Обробку лікарським засобом припиняли на 42 добу після імплантації й визначали виживання тварин. У тварин, оброблених AN024, спостерігалася смертність на 38 добу, у загиблих тварин при подальшім дослідженні не було виявлено збільшення селезінки й було визначено, що причина смерті відмінна від лейкозу, при цьому мазкі крові від загиблих тварин взяти було не можна. Серед 10 використаних тварин в 8 тварин на 55 добу не було ознак лейкозу. Серед тварин, оброблених AN019, не було ніякої смертності, і в 7 з 10 тварин спостерігалася повна відсутність симптомів лейкозу. У тварин, оброблених іматинобом, спостерігалося повторне виникнення симптомів лейкозу після припинення введення, і в них смертність наступала на 55, 56, 57 і 58 добу. У тварин, що вижили, була виявлена наявність симптомів лейкозу. На фіг.19 проілюстрована величина експресії люциферази на K5621uc, отримана в імплантованих мишей після обробки AN024, AN019 або іматинобом. На фіг.20 проілюстрована кількість тварин, вилікуваних після обробки AN024 або AN019 на 58 добу. Обробку лікарським засобом припиняли на 42 добу, у тварин після обробки AN024 і AN019 спостерігалося продовження ефекту лікування після припинення обробки лікарським засобом. На фіг.21 проілюстрована кількість бластних клітин з мазків крові, узятих у тварин на зазначену добу. Обробку лікарським засобом припиняли на 42 добі. AN024 і AN019 продемонстрували ефективність після припинення обробки лікарським засобом. Було виявлено, що іматиніб є неефективним. Приклад 8A - Дослідження ED50, LD50, MTD і терапевтичного індексу 14 UA 103610 C2 У представленій нижче таблиці узагальнені ED50, LD50, цитована вище MTD (максимальна переносима доза) і терапевтичний індекс сполук даного винаходу в порівнянні з іматинобом. Використовували способи згідно J. Pharmacol. Exp. Ther., (1949), 96: 96-113. Експериментальна речовина Іматинобу мезилат AN-019 AN-024 LD50(po) миші (мг/кг) 949 1133 1440 ED50(po) миші (мг/кг) 12 11,5 10 MTD миші (мг/кг) 250 500 500 Терапевтичний* індекс LD50/ ED50 78,9 98,5 144 * миші з лейкозом (K562) 5 10 15 20 25 30 35 40 45 50 Приклад 9 - Дослідження гліоми з опроміненням (фіг.22 і 23) Голим мишам інтракраніально імплантували клітини ксенотрансплантату гліоми людини 4910 (1×106 клітин). Через десять діб після імплантації мишам уводили AN019, AN024 або темозоломід з опроміненням або без нього (5 Gy/тиждень). Експеримент завершували на 40 добу після імплантації. З результатів було виявлено, що в 100% контрольних тварин розвилися внутрічерепні пухлини й опромінення окремо мало дуже невеликий ефект на зниження розміру пухлини. У тварин, оброблених TMZ окремо, було виявлено зниження внутрічерепних пухлин, причому в 3 з 10 тварин спостерігалася повна відсутність пухлин. Обробка опроміненням, комбінована із уведенням TMZ, викликала подальше зменшення розміру пухлин, причому у тварин меншою мірою спостерігалися симптоми внутрічерепного тиску (дугоподібна спина), у цьому випадку в 2 з 10 тварин спостерігалася відсутність видимих внутрічерепних пухлин. У тварин, оброблених AN024 без опромінення, спостерігалася наявність внутрічерепних пухлин, однак пухлини були чітко обмеженими й не демонстрували дифузійних країв, як спостерігали в контролів або при введенні TMZ, 3 з 10 тварин виліковували. Після обробки опроміненням 7 з 10 тварин виліковували, тварини, у яких спостерігалася наявність пухлин, продемонстрували чітко обмежені прийнятні для хірургічної операції пухлини. У тварин, оброблених AN019 окремо, спостерігалися пухлини, подібні з пухлинами тварин, оброблених AN024, і в цьому випадку, як при опроміненні, так і без нього, 6 з 10 тварин виліковували. Спостерігали, що після опромінення розмір пухлини значно зменшувався. На фіг.22 проілюстровані результати, отримані в напівкількісному аналізі внутрічерепних пухлин у голих мишей після введення TMZ, AN024 або AN019 з опроміненням або без нього (5 Гр). На фіг.23 показано графічне зображення голих мишей, що показали відсутність внутрічерепних пухлин після обробки лікарським засобом AN-019, AN-024 і без обробки опроміненням. У наступних прикладах проілюстровані препаративний синтез і інші аспекти сполук даного винаходу Приклад 10 - Одержання форми I (3,5-біс-трифторметил)-N-[ метил-3-( 4-піридин-3-ілпіримідин-2-іламіно)феніл]бензамід формули I, одержували згідно четиристадійному способу прикладу 3 з WO2006/027795 (US 2007/0232633) у такий спосіб: Одержання (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2іламіно)феніл]бензаміду (I) Стадія (I): Одержання нового (3,5-біс-трифторметил)-N-(4-метил-3-нітрофеніл))бензаміду Спочатку одержували 3,5-біс-трифторметилбензоїлхлорид, який використовували в якості одної з вихідних речовин, у такий спосіб До розчину 3,5-бістрифторметилбензойної кислоти (Lancaster) (250,0 г, 0,97 моль) у хлороформі (2,5 л) додавали тіонілхлорид (576,0 г, 4,8 моль) протягом 15 хв при кімнатній температурі. Реакційну суміш кип'ятили зі зворотним холодильником протягом 1 години. До розчину 3,5-бістрифторметилбензойної кислоти (Lancaster) (250,0 г, 0,97 моль) у хлороформі (2,5 л) додавали тіонілхлорид (576,0 г, 4,8 моль) протягом 15 хв при кімнатній температурі. Реакційну суміш кип'ятили зі зворотним холодильником протягом 1 години. Надлишок тіонілхлориду видаляли спільною дистиляцією із хлороформом при зниженому тиску. Після завершення дистиляції, отриманий 3,5-біс-трифторметилбензоїлхлорид охолоджували до кімнатної температури й розчиняли в 400 мл хлороформу. Розчин 4-метил-3-нітроаніліну (92,0 г, о 0,60 моль) у хлороформі (1,2 л) охолоджували до -5 C і додавали триетиламін (304,8 г, 3,0 моль). По краплях додавали розчин 3,5-біс-трифторметилбензоїлхлориду в хлороформі при 15 UA 103610 C2 о 5 10 15 20 25 30 35 40 45 50 55 60 о 5 C протягом 60-75 хв. Отриману суспензію перемішували протягом 1 год при -5 C. Суспензію піддавали дистиляції до кінцевого об'єму 800 мл і фільтрували, промивали охолодженим хлороформом (200 мл) і сушили у вакуумі, з одержанням 160,0 г нового (3,5-біс-трифторметил)N-(4-метил-3-нітрофеніл))бензаміду (68%) у вигляді кремових кристалів (чистота по ВЕЖХ о 98,2%) MR-123-130 C. Стадія (II): одержання (3,5-біс-трифторметил)-N-(3-аміно-4-метилфеніл))бензаміду Суспензію нового (3,5-біс-трифторметил)-N-(4-метил-3-нітрофеніл)бензаміду (160 г, 0,41 моль) і хлориду олова (II) (460,8 г, 2,0 моль) в абсолютному етанолі (850 мл) кип'ятили зі зворотним холодильником протягом 40 хв. Потім отриману суспензію охолоджували до кімнатної температури й гасили 5 л крижаної води. pН реакційної суміші доводили до 8,0 за допомогою 4,3 л 5% розчину гідроксиду натрію й екстрагували 2×2 л етилацетатом. Шар етилацетату промивали послідовно водою й насиченим розчином солі й сушили над сульфатом натрію. Етилацетат повністю відганяли, до осаду додавали 500 мл гексану й фільтрували. Осад о на фільтрі сушили при високому вакуумі при 60 С, з одержанням 96,0 г нового (3,5-бістрифторметил)-N-(3-аміно-4-метилфеніл))бензаміду (65%) у вигляді жовтих кристалів. (Чистота о по ВЕЖХ 98,5%) MR-153-156 С. Стадія (III): одержання (3,5-біс-трифторметил)-N-(3-аміно-4-метилфеніл)бензаміду Суспензію (3,5-біс-трифторметил)-N-(3-аміно-4-метилфеніл)бензаміду (90 г, 0,20 моль) у нбутанолі (500 мл) обробляли послідовно концентрованою азотною кислотою, доти, поки значення pН не досягало 2,5 (15,9 г), і розчином ціанаміду (15,7 г, 0,37 моль) у воді (15 мл) протягом 30 хв. Отриману реакційну суміш перемішували при кип'ятінні зі зворотним холодильником протягом 6 год. Потім реакційну суміш повністю відганяли у вакуумі й осаду давали можливість охолодитися до кімнатної температури. До реакційної маси додавали суміш 180 мл метанолу й 180 мл IPE і її перемішували при кімнатній температурі протягом 1 год. Продукт фільтрували при відсмоктуванні, промивали сумішшю метанолу й IPE (3×50 мл) і о сушили у вакуумі при 60 C, з одержанням 72 г нітратної солі нового (3,5-біс-трифторметил)-N(3-гуанідино-4-метилфеніл)бензамиду з виходом 62% від теоретичного (чистота по ВЕЖХ о 99,2%), MR-285-287 C . Стадія (IV): одержання (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2іламіно)феніл]бензаміду (I) Суспензію нітрату (3,5-біс-трифторметил)-N-(3-гуанідино-4-метилфеніл)бензаміду (70 г, 0,15 моль) у н-бутанолі (470 мл) в атмосфері азоту обробляли послідовно пластівцями гідроксиду натрію (7,0 г, 0,18 моль) і 3-диметиламіно-1-піридин-3-ілпропеноном (28,0 г, 0,16 моль). Отриману суспензію кип'ятили зі зворотним холодильником протягом 2 год. Реакційні суміші перетворювалися в гомогенний темно-жовтогарячий розчин і диметиламін видаляли відгоном з н-бутанолом. Реакційну масу охолоджували до кт, додавали суміш води й хлороформу (300 мл+300 мл) і шар хлороформу відокремлювали. Шар хлороформу промивали водою й піддавали дистиляції до кінцевого об'єму 70 мл. До реакційної маси додавали етилацетат (350 мл) і фільтрували при відсмоктуванні, виділену тверду речовину промивали етилацетатом (2×50 о мл) і водою (2×50 мл) і сушили у вакуумі при 60 С. Вихід: 48,0 г (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-іламінопіридимін-2іламіно)феніл]бензаміду формули I. Сполуку формули I, отриману чотиристадійним способом, суспендували в 480 мл о хлороформу й нагрівали до 50-55 С. Реакційну масу охолоджували до кімнатної температури, і о потім охолоджували до (-5)-0 С. Продукт фільтрували й промивали хлороформом (250 мл). о Вологий осад сушили протягом 6 годин при 60 С. Вихід склав 40 г. Температура плавлення 230о 237 C (DSC). На фіг.1, доданої до даного опису, представлена порошкова рентгенограма (XRPD), на якій показаний, головним чином, по суті чистий зразок форми I, отриманої згідно зі способом, описаним у даному прикладі. Значення 2θ і інтенсивності наведено в таблиці 1. На фіг.4 представлена термограма DSC кристалічної модифікації I, отриманої способом, описаним у даному прикладі (в інтервалі від 40,0 до 325С, 10,00C/хв; N2 80 мл/хв). На фіг.7 показані кристали кристалічної форми I сполуки формули (I) Приклад 11 - Одержання форми II (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензамід формули I, одержували згідно способу прикладу 4 описаного у WO2006/027795 (US 2007/0232633) у такий спосіб: Альтернативний спосіб одержання (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3ілпіримідин-2-іламіно)феніл]бензаміду Спочатку одержували 3,5-біс-трифторметилбензоїлхлорид, який використовували в якості 16 UA 103610 C2 5 10 15 20 25 30 35 40 45 50 55 60 одної з вихідних речовин, у такий спосіб: Тіонілхлорид (2,04 кг, 17,2 моль) додавали протягом 15 хв до розчину 3,5-бістрифторметилбензойної кислоти (855,0 г, 3,3 моль) і ДМФА (9 мл) у хлороформі (9 л) при кімнатній температурі. Реакційну суміш кип'ятили зі зворотним холодильником протягом 1 години. Надлишок тіонілхлориду видаляли спільною дистиляцією із хлороформом при о зниженому тиску при 40 С. Після закінчення дистиляції, отриманий 3,5-бістрифторметилбензоїлхлорид охолоджували до кімнатної температури й розчиняли в 700 мл хлороформу. Розчин N-(5-аміно-2-метилфеніл)-(3-піридил)-2-піримідинаміну (0,73 кг, 2,64 моль) у о хлороформі (9 л) охолоджували до -5 С и додавали триетиламін (1,03 кг, 10,2 моль). По краплях о додавали 3,5-біс-трифторметилбензоїлхлорид у хлороформі при -5 C протягом 60-75 хв. о Отриману суспензію перемішували протягом 1 год при -5 C . Суспензію фільтрували, промивали D.M. водою й метанолом, з одержанням 1,3 кг неочищеної вологої зазначеної в заголовку сполуки, яка при перекристалізації з метанолу давала 0,82 кг (60%) (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензаміду (I). Сполуку формули-I, отриману зазначеним вище способом, суспендували в 5 л метанолу й кип'ятили зі зворотним холодильником. Реакційну масу витримували при тій же температурі о протягом 30-40 хвилин, повільно охолоджували до 40-45 С та витримували при цій температурі о протягом 60 хвилин. Продукт фільтрували й промивали 0,5 л метанолу при 40-45 С. Вологий о осад сушили протягом 6 годин при 60 C . Вихід: 650 г. На фіг.2, доданої до даного опису, представлена порошкова рентгенограма (XRPD), на якій показаний, головним чином, по суті чистий зразок форми II, отриманої способом, описаним у даному прикладі. Значення 2θ і інтенсивності наведено в таблиці 2. На Фіг.5 представлена термограма DSC кристалічної форми II, отриманої способом, описаним у даному прикладі (інтервал від 30,0 до 350С, 10,00C/хв; N2 80 мл/хв). На Фіг.8 показані кристали кристалічної форми II сполуки формули (I) Приклад 12 - Одержання форми III (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензамід формули I, одержували способом прикладу 4 в WO2006/027795, як зазначено в представленому вище прикладі 11. Сполуку формули I, отриману зазначеним вище способом, суспендували в суміші 2,5 л о диметилформаміду й 4,1 л ацетону й нагрівали до 50 С. Реакційну масу витримували при тій же о температурі протягом 30-40 хвилин, потім повільно охолоджували до 25-30 С и витримували о при цій температурі протягом 60 хвилин. Суспензію продукту потім охолоджували до -5 С, фільтрували й промивали 0,8 л ацетону. Вологий осад суспендували в 0,4 л ацетону й кип'ятили зі зворотним холодильником. Охолоджену суспензію фільтрували й промивали 0,4 л о ацетону. Вологий осад сушили протягом 6 годин при 60 C . Вихід: 500 г. На фіг.3, доданої до даного опису, представлена порошкова рентгенограма (XRPD), на якій показаний, головним чином, по суті чистий зразок форми III, отриманої способом, описаним у даному прикладі. Значення 2θ і інтенсивності наведено в таблиці 3. На фіг.6 представлена термограма DSC кристалічної модифікації форми III, отриманої способом, описаним у даному прикладі (в інтервалі від 40,0 до 325С, 10,00C/хв; N2 80 мл/хв). На фіг.9 показані кристали кристалічної форми III сполуки формули (I). Приклад 13 - Одержання форми III (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензамід формули I, одержували згідно зі способом прикладу 4 в WO2006/027795, як зазначено в представленому вище прикладі 11. Сполуку формули I, отриману зазначеним вище способом, суспендували в суміші 2,5 л о диметилформаміду й 4,1 л гексану й нагрівали до 50 С. Реакційну масу витримували при тій же о температурі протягом 30-40 хвилин, повільно охолоджували до 25-30 С та витримували при цій о температурі протягом 12 годин. Суспензію продукту потім охолоджували до -5 С, фільтрували й о промивали 0,8 л гексану. Вологий осад сушили протягом 6 годин при 60 C . Вихід: 400 г; DSC: 248,2 (пік). Приклад 14 - Одержання форми III (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензамід формули I, одержували згідно зі способом прикладу 4 в WO2006/027795, як зазначено в представленому вище прикладі 11. Сполуку формули I, отриману зазначеним вище способом, суспендували в суміші 2,5 л о диметилформаміду й 4,1 л толуолу й нагрівали до 50 С. Реакційну масу витримували при тій же о температурі протягом 30-40 хвилин, повільно охолоджували до 25-30 С и витримували при цій 17 UA 103610 C2 о 5 10 15 20 25 30 35 40 45 температурі протягом 12 годин. Суспензію далі охолоджували до -5 С, фільтрували й о промивали 0,8 л толуолу. Вологий осад сушили протягом 6 годин при 60 С. Вихід: 450 г; DSC: 246,7 (пік). Приклад 15 - Одержання форми III (3,5-біс-трифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2-іламіно)феніл]бензамід формули I, одержували згідно зі способом прикладу 4 в WO2006/027795, як зазначено в представленому вище прикладі 11. Сполуку формули I, отриману зазначеним вище способом, суспендували в суміші 2,5 л о оцтової кислоти й нагрівали до 50 С. Реакційну масу витримували при тій же температурі о протягом 30-40 хвилин, повільно охолоджували до 25-30 С та витримували при цій температурі протягом 96 годин. Продукт фільтрували й промивали 0,4 л охолодженої оцтової кислоти. о Вологий осад сушили протягом 6 годин при 60 С. Вихід: 650 г; DSC: 246,3 (пік). Приклад 16 - Одержання форми III Форму I, отриману за прикладом 10 (40 г), суспендували в суміші 120 мл диметилформаміду о й 200 мл ацетону й нагрівали до 50 С. Реакційну масу витримували при тій же температурі о протягом 30-40 хвилин, повільно охолоджували до 25-30 С и витримували при цій температурі о протягом 60 хвилин. Суспензію охолоджували до -5 С, фільтрували й промивали 40 мл ацетону. Вологий осад суспендували в 200 мл ацетону, нагрівали до температури кипіння зі зворотним холодильником і витримували протягом 60 хвилин при температурі кип'ятіння зі зворотним о холодильником. Суспензію охолоджували до 25 C , фільтрували й промивали 40 мл ацетону. о о Вологий осад сушили протягом 6 годин при 60 C . Вихід: 25 г; DSC: 247,0 С (пік). Приклад 17 - Одержання форми III Форму II, отриману за прикладом 11 (650 г), суспендували в суміші 1,95 л о диметилформаміду й 3,25 л ацетону й нагрівали до 50 С. Реакційну масу витримували при тій о же температурі протягом 30-40 хвилин. Реакційну масу повільно охолоджували до 25-30 С и витримували при цій температурі протягом 60 хвилин. Продукт фільтрували й промивали 0,7 л ацетону. Вологий осад суспендували в 3,5 л ацетону й нагрівали до температури кип'ятіння зі о зворотним холодильником. Суспензію охолоджували до 25 C , фільтрували й промивали 0,7 л о о ацетону. Вологий осад сушили протягом 6 годин при 60 C . Вихід: 395 г; DSC: 246,5 С (пік). Як використано в даному описі, термін "приблизно" відноситься до відхилення в кількості або діапазоні, яке є загальноприйнятим в області органічної хімії, наприклад, до конкретного відхилення в температурах або часі при вимірі в реальних ситуаціях у лабораторії органічної хімії, при збільшенні масштабу або у виробничому приміщенні, або в оцінці антипроліферативних засобів. Будь-який діапазон або кількість, використовувана в описі даного винаходу, які модифіковані терміном "приблизно", також є частиною винаходу, навіть якщо вони не доповнені терміном "приблизно". Наприклад, вказівка на "приблизно від 10 до приблизно 20" також включає вказівку на " від 10 до 20". Слід зазначити, як використано в даному описі й прикладеній формулі винаходу, що форма однини включає множину, якщо зміст явно не вказує на інше. Таким чином, наприклад, вказівка на композицію, що містить "сполуку", включає суміш двох або більш сполук. Також слід зазначити, що термін "або" звичайно використовують у його значенні "і/або", якщо зміст явно не вказує на інше. Усі публікації й патентні заявки в даному описі відповідають рівню середнього фахівця в галузі, до якої відноситься даний винахід. Винахід описаний за допомогою різних і кращих варіантів здійснення й способів. Однак слід розуміти, що можуть бути проведені зміни й модифікації, зберігаючи сутність і об'єм винаходу. ФОРМУЛА ВИНАХОДУ 50 1. Кристалічна форма III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2іламіно)феніл]бензаміду (формули І), яка має характеристики XRPD: Кут [2-тета] 5,909 6,491 8,267 11,854 13,181 14,609 15,960 Значення d Ангстрем 14,94417 13,60517 10,68690 7,45967 6,71147 6,05866 5,54851 18 Інтенсивність, % 24,9 66,4 100,0 58,2 40,0 50,0 5,8 UA 103610 C2 16,612 18,826 19,571 21,302 21,612 22,160 22,970 23,278 24,000 25,112 25,887 26,500 27,517 29,476 29,857 30,474 32,886 33,559 35,916 39,645 43,061 43,748 44,055 5 10 5,33224 4,70995 4,53226 4,16774 4,10861 4,00828 3,86869 3,81812 3,70491 3,54329 3,43895 3,36079 3,23887 3,02788 2,99011 2,93102 2,72133 2,66829 2,49836 2,27157 2,09893 2,06753 2,05383 9,5 14,4 52,1 54,0 37,7 3,5 23,8 51,6 8,7 11,1 3,1 3,3 3,4 6,8 8,6 3,5 3,2 5,0 3,8 4,9 2,6 3,8 3,9 2. Кристалічна форма III за п. 1, яка має температуру плавлення 240 °C або вище. 3. Кристалічна форма III за п. 1, яка є по суті чистою. 4. Спосіб одержання кристалічної форми III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3ілпіримідин-2-іламіно)феніл]бензаміду (формула І), як визначено в п. 1, в якому здійснюють обробку сполуки формули І у кристалічній формі І або II оцтовою кислотою або сумішшю диметилформаміду й ацетону, гексану або толуолу; і наступну обробку однократно обробленої сполуки оцтовою кислотою, ацетоном, гексаном або толуолом; де кристалічна форма І має характеристики XRPD: Кут [2-тета] 6,793 9,823 11,106 13,267 16,386 17,941 18,997 19,778 21,894 22,396 23,469 24,466 24,939 25,525 26,968 28,777 30,545 33,011 Значення d Ангстрем 13,00131 8,99680 7,96069 6,66829 5,40523 4,94015 4,66785 4,48530 4,05635 3,96650 3,78750 3,63545 3,56759 3,48695 3,30351 3,09991 2,92436 2,71129 Інтенсивність, % 13,9 3,9 54,2 48,5 7,0 11,3 13,0 50,5 100,0 20,5 19,7 32,4 52,6 14,6 10,3 22,0 14,8 11,0 і кристалічна форма II має характеристики XRPD: Кут [2-тета] 6,500 Значення d Ангстрем 13,58651 19 Інтенсивність, % 12,2 UA 103610 C2 10,816 12,094 12,988 16,120 17,669 19,521 21,675 22,083 23,230 24,264 24,639 28,460 29,328 30,256 32,746 34,035 35,590 39,660 42,123 44,193 5 10 15 20 25 8,17295 7,31197 6,81061 5,49381 5,01562 4,54367 4,09687 4,02198 3,82602 3,66523 3,61023 3,13371 3,04290 2,95165 2,73261 2,63201 2,52050 2,27072 2,14346 2,04777 100,0 3,4 49,7 6,0 10,9 41,7 39,9 17,1 21,9 17,8 8,5 4,8 2,3 4,1 3,5 3,1 1,5 1,9 2,5 1,7 5. Спосіб за п. 4, в якому здійснюють: обробку сполуки формули І у кристалічній формі І або II оцтовою кислотою; і наступну обробку однократно обробленої сполуки оцтовою кислотою. 6. Спосіб за п. 4, в якому здійснюють: обробку сполуки формули І у кристалічній формі І або II сумішшю диметилформаміду й ацетону; і наступну обробку однократно обробленої сполуки ацетоном. 7. Спосіб за п. 4, в якому здійснюють: обробку сполуки формули І у кристалічній формі І або II сумішшю диметилформаміду й гексану; і наступну обробку однократно обробленої сполуки гексаном. 8. Спосіб за п. 4, в якому здійснюють: обробку сполуки формули І у кристалічній формі І або II сумішшю диметилформаміду й толуолу; і наступну обробку однократно обробленої сполуки толуолом. 9. Кристалічна форма III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2іламіно)феніл]бензаміду (формула І), як визначено в п. 1, для використання у способі лікування проліферативного захворювання. 10. Фармацевтична композиція, що містить фармацевтично прийнятний ексципієнт і кристалічну форму III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3-ілпіримідин-2іламіно)феніл]бензаміду (формула І), де кристалічна форма III, як визначено в п. 1. 11. Застосування кристалічної форми III (3,5-бістрифторметил)-N-[4-метил-3-(4-піридин-3ілпіримідин-2-іламіно)феніл]бензаміду (формула І), як вказано в п. 1, для виготовлення антипроліферативного лікарського засобу для лікування пухлинного захворювання. 20 UA 103610 C2 21 UA 103610 C2 22 UA 103610 C2 23 UA 103610 C2 24 UA 103610 C2 25 UA 103610 C2 26 UA 103610 C2 27 UA 103610 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystal form of phenylamino pyrimidine derivatives
Автори російськоюKompella, Amala, Kishan, Rachakonda, Sreenivas, Adibhatla Kali Satya, Bhujanga, Rao, Venkaian Chowdary, Nannapaneni
МПК / Мітки
МПК: A61K 31/506, A61P 35/02, C07D 401/04
Мітки: феніламінопіримідину, форма, похідних, кристалічна
Код посилання
<a href="https://ua.patents.su/36-103610-kristalichna-forma-pokhidnikh-fenilaminopirimidinu.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма похідних феніламінопіримідину</a>
Попередній патент: Похідні 1-бензил-3-гідроксиметиліндазолу та їх застосування у лікуванні хвороб, основаних на експресії mcp-1, cx3cr1 та р40
Наступний патент: Суперконденсатор з великою кількістю обмоток
Випадковий патент: Басейн