Похідні 1-бензил-3-гідроксиметиліндазолу та їх застосування у лікуванні хвороб, основаних на експресії mcp-1, cx3cr1 та р40
Номер патенту: 103609
Опубліковано: 11.11.2013
Автори: Мангано Джорджина, Гугліелмотті Анджело, Каццолла Нікола, Фурлотті Гвідо
Формула / Реферат
1. Сполука формули (I)
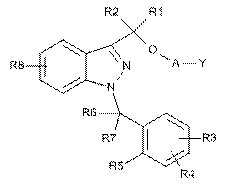 , (І)
, (І)
у якій:
A може являти собою зв’язок σ, -X1- або -X1-O-X2-, де
X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що містять від 1 до 3 атомів вуглецю,
Y являє собою H, коли A являє собою зв’язок σ, або Y може являти собою H, -OH або -N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-,
у якій
R11 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом,
R12 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом,
R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю,
R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R”, -SO2R’, нітрогрупу та трифторметил; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю,
R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, нітрогрупу та трифторметил, або R5 разом з одним з-поміж R6 та R7 утворює кільце, що має 5 або 6 атомів вуглецю; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю,
R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю,
за умови, що, коли A являє собою зв’язок σ та Y, R1, R2, R6 та R7 являють собою атоми водню,
якщо R8 являє собою атом водню, тоді група, зв’язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від бензильної групи, 4-хлорбензильної групи або 2,4-дихлорбензильної групи,
якщо R8 являє собою атом фтору у 5-му положенні індазольного кільця, тоді група, зв’язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від 5-хлор-2-метоксибензильної групи, і
якщо R8 являє собою трифторметильну групу у 6-му положенні індазольного кільця, тоді група, зв’язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від 2,4-дихлорбензильної групи.
2. Сполука за п. 1, де X1 та X2 являють собою, незалежно один від іншого, алкільну групу, що має від 1 до 4 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 3 атомів вуглецю, або однієї або більшої кількість алкоксигруп, що мають 1 або 2 атоми вуглецю.
3. Сполука за п. 1, де X1 вибраний з групи, що включає групу CH2, групу CH2CH2, групу C(CH3)2 та групу C(CH3)2CH2, та X2 вибраний з групи, що включає групу CH2, групу CH2CH2 та групу CH2CH2CH2.
4. Сполука за п. 1, де залишок A вибраний з групи, що включає зв’язок σ, групу CH2CH2, групу CH2CH2CH2, групу C(CH3)2CH2, групу CH2CH2OCH2, групу CH2CH2OCH2CH2, групу C(CH3)2CH2OCH2 та групу C(CH3)2CH2OCH2CH2.
5. Сполука за п. 1, де R11 та R12, які можуть бути однаковими або відрізнятися один від іншого, являють собою атом водню, алкільну групу, що містить від 1 до 3 атомів вуглецю, або разом утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом.
6. Сполука за п. 1, де R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, являють собою атом водню або алкільну групу, що містить від 1 до 3 атомів вуглецю.
7. Сполука за п. 1, де R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, вибрані з групи, яка включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом Br, Cl або F, OH-групу, нітрогрупу, трифторметильну групу або групу N(R’)(R”), N(R’)COR”, -CN, -CONR’R”, -SO2NR’R”, -SO2R’, причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 3 атомів вуглецю.
8. Сполука за п. 1, де R5 вибраний з групи, яка включає атом водню, алкільну групою, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом галогену, OH-групу, або R5, разом з одним з-поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю.
9. Сполука за п. 1, де R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, вибрані з групи, яка включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, або разом утворюють групу C=O, або один з-поміж R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю.
10. Фармацевтична композиція, що містить сполуку формули (I) за будь-яким з попередніх пунктів або її стереоізомер або енантіомер, або її фармацевтично прийнятну сіль, складний ефір або проліки та щонайменше один фармацевтично прийнятний носій.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що фармацевтично прийнятна сіль являє собою сіль приєднання з фізіологічно прийнятними органічними або неорганічними кислотами або основами.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що фізіологічно прийнятні кислоти вибрані з групи, що включає хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту, азотну кислоту, оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, пара-толуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту.
13. Фармацевтична композиція за п. 11, яка відрізняється тим, що фізіологічно прийнятні основи вибрані з групи, що включає гідроксид амонію, гідроксид кальцію, карбонат магнію, гідрокарбонат натрію, гідрокарбонат калію, аргінін, бетаїн, кофеїн, холін, N,N-дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, N-метилглюкамін, глюкамін, глюкозамін, гістидин, N-(2-гідроксіетил)піперидин, N-(2-гідроксіетил)піролідин, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, теобромін, триетиламін, триметиламін, трипропіламін та трометамін.
14. Фармацевтична композиція за п. 10, яка відрізняється тим, що фармацевтично прийнятний складний ефір утворений з фізіологічно прийнятними органічними кислотами, вибраними з групи, що включає оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, пара-толуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту.
15. Фармацевтична композиція за будь-яким з пунктів 10-14, яка відрізняється тим, що містить стереоізомер або енантіомер сполуки формули (I) або її фармацевтично прийнятну сіль, складний ефір або проліки або їх суміш.
16. Фармацевтична композиція за будь-яким з пунктів 10-15, яка відрізняється тим, що фармацевтично прийнятний носій вибраний з групи, що включає гліданти, зв’язуючі речовини, дезінтегранти, наповнювачі, розріджувачі, ароматизатори, барвники, флюїдизатори, лубриканти, консерванти, гігроскопічні речовини, абсорбенти та підсолоджувачі.
17. Застосування сполуки формули (I)
 , (І)
, (І)
у якій:
A може являти собою зв’язок σ, -X1- або -X1-O-X2-, де
X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що містять від 1 до 3 атомів вуглецю,
Y являє собою H, коли A являє собою зв’язок σ, або Y може являти собою H, -OH або -N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-,
у якій
R11 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом,
R12 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом,
R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю,
R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R”, -SO2R’, нітрогрупу та трифторметил; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю,
R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, нітрогрупу та трифторметил, або R5, разом з одним з-поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю,
R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю,
для одержання фармацевтичної композиції для лікування хвороб, основаних на експресії MCP-1, CX3CR1 та p40.
18. Застосування за п. 17, де хвороби, основані на експресії MCP-1 та CX3CR1, вибрані з групи, що включає такі як: хвороби суглобів, хвороби нирок, серцево-судинні хвороби, метаболічний синдром, ожиріння, діабет, резистентність до інсуліну та рак.
19. Застосування за п. 17, де хвороби, основані на експресії MCP-1, вибрані з групи, що включає такі як: ревматоїдний артрит, артрит, викликаний вірусними інфекціями, псоріатичний артрит, артроз, вовчаковий нефрит, діабетична нефропатія, гломерулонефрит, полікістозна хвороба нирок, інтерстиціальна легенева хвороба, фіброз, розсіяний склероз, хвороба Альцгеймера, пов’язана з ВІЛ деменція, атопічний дерматит, псоріаз, васкуліт, рестеноз, атеросклероз, інфаркт міокарда, стенокардія, гострі коронарні хвороби, аденоми, карциноми та метастази, метаболічні хвороби та ускладнення після хірургічних втручань.
20. Застосування за п. 17, де хвороби, основані на експресії CX3CR1, вибрані з групи, що включає такі як: ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, коронарні хвороби серця, рестеноз, атеросклероз, інфаркт міокарда, стенокардія та ускладнення після хірургічних втручань.
21. Застосування за п. 17, де хвороби, основані на експресії p40, вибрані з групи, що включає аутоімунні хвороби, хронічні дегенеративні запальні хвороби та рак.
22. Застосування за п. 17, де хвороби, основані на експресії p40, вибрані з групи, що включає ревматоїдний артрит, псоріаз, гломерулонефрит, діабет, червоний вовчак, діабет, хворобу Крона та пухлини.
23. Спосіб лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40, у якому пацієнту, що цього потребує, вводять ефективну кількість сполуки формули (I):
 , (І)
, (І)
у якій:
A може являти собою зв’язок σ, -X1- або -X1-O-X2-, де
X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що містять від 1 до 3 атомів вуглецю,
Y являє собою H, коли A являє собою зв’язок σ, або Y може являти собою H, -OH або -N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-,
у якій
R11 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом,
R12 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом,
R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю,
R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, -CN, -CONR’R”, -SO2NR’R”, -SO2R’, нітрогрупу та трифторметил; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю,
R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R’)(R”), -N(R’)COR”, нітрогрупу та трифторметил, або R5, разом з одним з-поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю,
R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю.
Текст
Реферат: Даний винахід стосується нових похідних 1-бензил-3-гідроксиметиліндазолу відповідно до формули (І) UA 103609 C2 (12) UA 103609 C2 (I) та фармацевтичної композиції, що містить їх разом з фармацевтично прийнятним носієм. Крім того, даний винахід стосується застосування похідних 1-бензил-3-гідроксиметиліндазолу для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб, основаних на експресії МСР-1, CX3CR1 та р40, та їх застосування у способі лікування або профілактики хвороб, основаних на експресії МСР-1, CX3CR1 та р40. UA 103609 C2 ГАЛУЗЬ ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до похідних 1-бензил-3-гідроксиметиліндазолу, до фармацевтичної композиції, що містить їх, та до їх застосування у лікуванні хвороб, основаних на експресії MCP-1, CX3CR1 та p40. Зокрема, даний винахід відноситься до нових похідних 1-бензил-3-гідроксиметиліндазолу відповідно до формули (I), представленої нижче, та до фармацевтичної композиції, що містить їх разом з фармацевтично прийнятним носієм. Крім того, даний винахід відноситься до застосування похідних 1-бензил-3-гідроксиметиліндазолу для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб, основаних на експресії MCP-1, CX3CR1 та p40, та до їх застосування у способі лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Як відомо, MCP-1 (Моноцитарний Хемотаксичний Білок-1) являє собою білок, що належить до підсімейства хемокінів. MCP-1 має сильну хемотаксичну дію на моноцити та робить всій вплив також на T лімфоцити, мастоцити та базофіли (Rollins B.J., Chemokines, Blood 1997; 90: 909-928; M. Baggiolini, Chemokines and leukocyte traffic, Nature 1998; 392: 565-568). Інші хемокіни, що належать до підсімейства, являють собою, наприклад, MCP-2 (Моноцитарний Хемотаксичний Білок-2), MCP-3, MCP-4, MIP-1 та MIP-1, RANTES. підсімейство відрізняється від підсімейства тим, що у структурі перші два цистеїни є суміжними для підсімейства, в той час як для підсімейства вони є розділеними проміжною амінокислотою. MCP-1 виробляється різними типами клітин (лейкоцити, тромбоцити, фібробласти, ендотеліальні клітини та клітини гладких м'язів). Серед всіх відомих хемокінів, MCP-1 показує найвищу специфічність до моноцитів та макрофагів, для яких він визначає не тільки хемотаксичний фактор, але також активаційний стимул, таким чином, індукуючи процеси вироблення численних запальних факторів (суперпероксиди, арахідонова кислота та похідні, цитокіни/хемокіни) та посилюючи фагоцитарну активність. Секреція хемокінів загалом, та MCP-1 зокрема, як правило, викликається різними прозапальними факторами, наприклад, такими як інтерлейкін-1 (IL-1), інтерлейкін-2 (IL-2), TNF (Фактор некрозу пухлини ), інтерферон- та бактеріальний ліпополісахарид (LPS). Запобігання появі запальної відповіді шляхом блокування системи хемокін/хемокіновий рецептор представляє одну з головних цілей фармакологічного втручання (Gerard C. and Rollins B.J., Chemokines and disease. Nature Immunol. 2001; 2:108-115). Існує багато доказів того, що MCP-1 грає ключову роль в запальних процесах та показаний як нова та підтверджена ціль у різних патологіях. Доведення значного фізіопатологічного внеску MCP-1 отримане у випадку пацієнтів з запальними хворобами суглобів та нирок (ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія та відторгнення після трансплантації). Однак, нещодавно, MCP-1 був показаний серед факторів, залучених у запальні патології ЦНС (розсіяний склероз, хвороба Альцгеймера, пов'язана з ВІЛ деменція) та інші патології та стани, з та без очевидного запального компоненту, включаючи атопічний дерматит, коліт, інтерстиціальні легеневі патології, рестеноз, атеросклероз, ускладнення після хірургічного втручання (наприклад, такого як пластична операція на судинах, артеректомія, трансплантація, заміна органу та/або тканини, протезування), рак (аденоми, карциноми та метастази) та навіть метаболічні хвороби, такі як резистентність до інсуліну та ожиріння. Крім того, незважаючи на той факт, що хемокінова система залучена у контролювання та подолання вірусних інфекцій, нещодавні дослідження показали, що відповідь певних хемокінів, та зокрема MCP-1, може грати шкідливу роль у випадку взаємодій між хазяїном та патогенним мікроорганізмом. Зокрема, MCP-1 був показаний серед хемокінів, які роблять свій внесок у ураження органу та тканини в патологіях, що опосередковуються альфа вірусами, які характеризується інфільтрацією моноциту/макрофагу у суглобах та м'язах (Mahalingam S. et al. Chemokines and viruses: friend or foes? Trends in Microbiology 2003; 11: 383-391; Rulli N. et al. Ross River Virus: molecular and cellular aspects of disease pathogenesis. 2005; 107: 329-342). Моноцити є головними попередниками макрофагів та дендритних клітин, та грають критичну роль як медіатори запальних процесів. CX3CR1, з його лігандом CX3CL1 (fractalkine), 1 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 60 являє собою ключовий фактор у регулюванні міграції та адгезивності моноцитів. CX3CR1 експресується у моноцитах, в той час як CX3CL1 являє собою трансмембранний хемокін у ендотеліальних клітинах. Генетичні дослідження на людських та тваринних моделях показали важливу роль у фізіопатології запальних хвороб CX3CR1 та CX3CL1. Фактично існує багато доказів ключового внеску CX3CR1 та його ліганду у патогенез та прогресування запальних хвороб суглобів, нирок, шлунково-кишкового тракту та судин (наприклад, ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, рестеноз та атеросклероз). Експресія CX3CR1 надрегулюється у T клітинах, що, як вважають, накопичуються у синовіальній оболонці пацієнтів, що страждають на ревматоїдний артрит. Крім того, експресія CX3CL1 надрегулюється у ендотеліальних клітинах та фібробластах, присутніх у синовіальній оболонці цих пацієнтів. Отже, CX3CR1/CX3CL1 система грає важливу роль у контролюванні типу клітини та способу інфільтрації синовіальної оболонки та робить свій внесок у патогенез ревматоїдного артриту (Nanki T. et al., "Migration of CX3CR1-positive T cells producing type 1 cytokines and cytotoxic molecules into the synovium of patients with rheumatoid arthritis", Arthritis & Rheumatism (2002), vol. 46, No. 11, pp. 2878-2883). У пацієнтів, що страждають від ураження нирок, більшість запальних лейкоцитів, які інфільтрують нирки, експресують CX3CR1, та зокрема він експресується на двох з основних типів клітин, залучених у найбільш розповсюджені запальні патології нирок та у відторгнення трансплантату нирки, T клітинах та моноцитах (Segerer S. et al., Expression of the fractalkine receptor (CX3CR1) in human kidney diseases, Kidney International (2002) 62, pp. 488-495). Також передбачається, що CX3CR1/CX3CL1 система приймає участь у запальних хворобах кишок (IBD). У випадку пацієнтів, що страждають від IBD (наприклад, хвороба Крона, виразковий коліт), фактично, було показане значне збільшення у виробленні CX3CL1 капілярною системою кишечнику та значне збільшення у CX3CR1-позитивних клітинах, як у кровоносному рівні, так і у слизовій оболонці (Sans M. et al., "Enhanced recruitment of CX3CR1+T cells by mucosal endothelial cell-derived fractalkine in inflammatory bowel diseases", Gastroenterology 2007, vol. 132, No. 1, pp. 139-153). Навіть більш цікавою є демонстрація ключової ролі, які грає система CX3CR1/CX3CL1 в ураженні судин та зокрема за патологічних умов, наприклад, таких як атеросклероз та рестеноз. Показано, що CX3CR1 є критичним фактором у процесі інфільтрації та накопичення моноцитів у стінці судини, та CX3CR1 поліморфізм у людини пов'язаний із зниженим рівнем розповсюдженості атеросклерозу, коронарних хвороб серця та рестенозу (Liu P. et al., "Crosstalk among Smad, MAPK and integrin signalling pathways enhances adventitial fibroblast functions activated by transforming growth factor-1 and inhibited by Gax" Arterioscler. Thromb. Vasc. Biol. 2008; McDermott D.H. et al., "Chemokine receptor mutant CX3CR1-M280 has impaired adhesive function and correlates with protection from cardiovascular diseases in humans", J. Clin. Invest. 2003; Niessner A. et al., Thrombosis and Haemostasis 2005). IL-12 та IL-23 є членами невеликого сімейства прозапальних гетеродимерних цитокінів. Обидва цитокіни поділяють загальну субодиницю, p40, яка є ковалентно прикріпленою або до p35 субодиниці для одержання зрілої форми IL-12, або до p19 субодиниці для одержання зрілої форми IL-23. Рецептор для IL-12 складається з субодиниць IL-12R1 та IL-12R2, в той час як рецептор для IL-23 складається з субодиниць IL-12R1 та IL-23R. IL-12 та IL-23, головним чином, експресуються активованими дендритними клітинами та фагоцитами. Рецептори для двох цитокінів експресуються на T та NK клітинах, та NK T клітинах, але низькі рівні комплексів рецептору для IL-23 також присутні у моноцитах, макрофагах та дендритних клітинах. Незважаючи на ці подібності, існує багато доказів того, що IL-12 та IL-23 контролюють різні імунологічні ланцюги. Фактично, в той час як IL-12 контролює розвиток Th1 клітин, які здатні виробляти гама-інтерферон (IFN-), та збільшує цитотоксичну, протимікробну та протипухлинну + відповідь, IL-23 регулює ланцюг, який веде до створення CD4 клітин, які здатні виробляти IL-17. Індукування IL-23-залежних процесів веде до мобілізації різних типів запальних клітин, наприклад TH-17, та, як було показано, є критичним для патогенезу численних запальних патологій, що опосередковуються імунологічними відповідями. Типові приклади патологій, пов'язаних з експресією p40, включають хронічні запальні хвороби суглобного апарату (наприклад, ревматоїдний артрит), дерматологічного апарату (наприклад, псоріаз) та шлунково-кишкового апарату (наприклад, хвороба Крона). Однак, IL-23 також грає роль у промотуванні появи та росту пухлини. В дійсності, IL-23 регулює цілий ряд ланцюгів у мікрооточенні пухлини, стимулюванні ангіогенезу та виробленні медіаторів запалення. 2 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 60 Псоріаз є хронічною запальною хворобою шкіри, на яку хворіє 3 % всього населення світу (Koo J. Dermatol. Clin. 1996; 14:485-96; Schon M.P. et al., N. Engl. J. Med. 2005; 352: 1899912). Аберантна імунна відповідь типу-1 корелюється з патогенезом псоріазу, та цитокіни, які викликають цю відповідь, такі як IL-12 та IL-23, можуть являти собою підходящі терапевтичні об'єкти. Експресія IL-12 та IL-23, які поділяють субодиницю p40, є значно збільшеною у псоріатичних бляшках, та доклінічні дослідження показали роль цих цитокінів у патогенезі псоріазу. Нещодавно, лікування анти- IL-12 та IL-23 моноклональними антитілами пацієнтів, що страждають на псоріаз, довело ефективність у покращенні ознак прогресування та серйозності хвороби та додатково збільшило роль IL-12 та IL-23 у фізіопатології псоріазу. Хвороба Крона являє собою хронічну запальну патологію травного апарату та може впливати на будь-яку його область – від рота до ануса. Як правило, вона уражує кінцевий тракт підвздошної кишки та певні області товстої кишки. Часто вона пов'язана з системними автоімунними розладами, такими як виразки у роті та ревматоїдний артрит. Від хвороби Крона страждає 500 000 людей у Європі та 600 000 людей у Сполучених Штатах. Хвороба Крона являє собою патологію, пов'язану з Th1 клітина-опосередкованою надмірною активністю цитокінів. IL-12 являє собою ключовий цитокін у ініціації запальної відповіді, опосередкованої Th1 клітинами. Хвороба Крона характеризується збільшеним виробленням IL-12 клітинами, що надають антиген у тканині кишечнику, та гама-інтерферону (IFN-) та TNF лімфоцитами та макрофагами кишечнику. Ці цитокіни викликають та підтримують запальний процес та потовщення стінки кишечнику, які є характерними ознаками патології. Доклінічні та клінічні дослідження показали, що інгібування IL-12 є ефективним у контролюванні запальної відповіді у моделях запалення кишечнику та/або у пацієнтів, що страждають від хвороби Крона. Взаємозв'язок між раком та запаленням наразі є встановленим фактом. Багато форм пухлин виникають у місцях запалення, та медіатори запалення часто виробляються у пухлинах. IL-23 визначений, як цитокін, пов'язаний з раком, та, зокрема, експресія IL-23 є значно вищою у зразках карцином людини у порівнянні з нормальними прилеглими тканинами. Крім того, відсутність значної експресії IL-23 у нормальних прилеглих тканинах говорить про надрегулювання IL-23 у пухлинах, збільшуючи його роль у генезисі пухлини. Європейський патент EP-B-0 382 276 описує декілька 1-бензил-3-гідроксиметиліндазольних похідних, що мають аналгетичну активність. У свою чергу, Європейський патент EP-B-0 510 748 описує, з іншого боку, застосування цих похідних для одержання фармацевтичної композиції, яка є активною у лікуванні автоімунних хвороб. Нарешті, Європейський патент EP-B-1 005 332 описує застосування цих похідних для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб, що виникають від вироблення MCP-1. Вважають, що 2-метил-2-{[1-(фенілметил)-1H-індазол-3-іл]метокси}-пропанова кислота здатна інгібувати, дозо-залежним способом, вироблення MCP-1 та TNF-, що індукуються in vitro у моноцитах з LPS та Candida albicans, в той час як та сама сполука не показала жодного ефекту у виробленні цитокінів IL-1 та IL-6, та хемокінів IL-8, MIP-1, та RANTES (Sironi M. et al., "A small synthetic molecule capable of preferentially inhibiting the production of the CC chemokine monocyte chemotactic protein-1", European Cytokine Network. Vol. 10, No. 3, 437-41, September 1999). Європейська патентна заявка EP-A-1 185 528 відноситься до триазинових похідних для інгібування вироблення IL-12. Європейські патентні заявки EP-A-1 188 438 та EP-A-1 199 074 відносяться до застосування інгібіторів ферменту PDE4, наприклад, Роліпрам (Rolipram), Аріфло (Ariflo) та діазепін-індольні похідні, у лікуванні та профілактиці хвороб, пов'язаних з надмірним виробленням IL-12. Європейська патентна заявка EP-A-1 369 119 відноситься до застосування гіалуронану з молекулярною масою від 600000 до 3000000 дальтонів для контролювання та інгібування експресії IL-12. Європейська патентна заявка EP-A-1 458 687 відноситься до застосування піримідинових похідних для лікування хвороб, пов'язаних з надвиробленням IL-12. Європейська патентна заявка EP-A-1 819 341 відноситься до застосування азотних гетероциклічних сполук, наприклад, піридинових, піримідинових та триазинових похідних, для інгібування вироблення IL-12 (або його цитокінів, таких як IL-23 та IL27, які стимулюють вироблення IL-12). Європейська патентна заявка EP-A-1 827 447 відноситься до застосування піримідинових похідних для лікування хвороб, пов'язаних з надвиробленням IL-12, IL-23 та IL-27. Європейські патентні заявки EP-A-1 869 055, EP-A-1 869 056 та EP-A-1 675 862 описують 1,3-тіазоло-4,5-піримідинові похідні, які здатні діяти як антагоністи CX3CR1 рецептору. Одержання сполуки [1-(2,4-дихлорбензил)-1H-індазол-3-іл]метанолу описано в патентних заявках US2007/0015771 та US2007/0043057 (сполука 58). Сполуку 58 застосовують як 3 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 проміжну сполуку для синтезу альдегідних похідних, і вона не пов'язується з будь-якою фармакологічною активністю. Одержання сполуки (1-бензил-1H-індазол-3-іл)метанолу описано в Henke B.R. et al.; "Optimization of 3-(1H-lndazol-3-ylmethyl)-1,5-benzodiazepines as Potent, Orally Active CCK-A Agonists." Journal of Medicinal Chemistry (1997), 40(17), 2706-2725 (сполука 59). Сполуку 59 застосовують як проміжну сполуку для синтезу бензодіазепіну, і вона не пов'язується з будьякою фармакологічною активністю. Одержання сполуки [1-(4-хлорбензил)-1H-індазол-3-іл]метанолу описано в Corsi G, Palazzo G.; "1-halobenzyl-1H-indazoles-3-carboxilyc acids. A new class of antispermatogenic agents". Journal of Medicinal Chemistry (1976), 19(6), 778-783 (сполука 46). Сполуку 46 застосовують як проміжну сполуку для синтезу карбоксильних похідних, і вона не пов'язується з будь-якою фармакологічною активністю. Незважаючи на активність, винайдену до сих пір, все ще відчувається необхідність у нових фармацевтичних композиціях та сполуках, які є ефективними у лікуванні хвороб, основаних на експресії MCP-1, CX3CR1 та p40. Неочікувано, Заявник винайшов нові 1-бензил-3-гідроксиметиліндазольні похідні з фармакологічною активністю. Неочікувано, Заявник визначив, що 1-бензил-3-гідроксиметиліндазольні похідні відповідно до формули (I) даного винаходу здатні зменшувати вироблення хемокіну MCP-1. Ще більш неочікувано, Заявник визначив, що 1-бензил-3-гідроксиметиліндазольні похідні відповідно до формули (I) даного винаходу здатні зменшувати експресію хемокіну MCP-1. Навіть ще більш неочікувано, Заявник визначив, що нові 1-бензил-3гідроксиметиліндазольні похідні відповідно до формули (I) даного винаходу здатні зменшувати експресію субодиниці p40, залученої у вироблення цитокінів IL-12 та IL-23, та експресію рецептору CX3CR1. Таким чином, у першому аспекті, даний винахід включає сполуку формули (I) , у якій: A може являти собою зв'язок σ, -X1- або -X1-O-X2-, де X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов'язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю або однієї або більшої кількості алкокси груп, що містять від 1 до 3 атомів вуглецю, Y являє собою H, коли A являє собою зв'язок σ, або Y може являти собою H, -OH, або N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-, у якій R11 може являти собою водень, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R 11 разом з R12 утворюють 4- – 7-членний гетероцикл, R12 може являти собою водень, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R12 разом з R11 утворюють 4- – 7-членний гетероцикл, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", -CN, -CONR'R", -SO2NR'R", SO2R", нітрогрупу та трифторметил; причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R5 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", нітрогрупу 4 UA 103609 C2 5 10 15 20 25 30 35 40 45 та трифторметил, або R5 разом з одним з R6 та R7 утворює кільце, що має 5 або 6 атомів вуглецю; причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю, за умови, що, коли A являє собою зв'язок σ, та Y, R1, R2, R6, та R7 являють собою атоми водню, - якщо R8 являє собою атом водню, тоді група, зв'язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від бензильної групи, 4-хлорбензильної групи або 2,4дихлорбензильної групи, - якщо R8 являє собою атом фтору у 5-му положенні індазольного кільця, тоді група, зв'язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від 5-хлор-2метоксибензильної групи, і - якщо R8 являє собою трифторметильну групу у 6-му положенні індазольного кільця, тоді група, зв'язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від 2,4дихлорбензильної групи. У другому аспекті, даний винахід відноситься до фармацевтичної композиції, що містить нові похідні 1-бензил-3-гідроксиметиліндазолу відповідно до формули (I) або їх фармацевтично прийнятну сіль разом з щонайменше одним фармацевтично прийнятним носієм. Надрегулювання та/або підвищення експресії описаних вище MCP-1, CX3CR1, та p40, відповідно останнє приводить до IL-12 та/або IL-23 експресії/вироблення, що приводить до розвинення патології та/або хвороби, яку часто називають у даній галузі техніки терміном "надекспресія". Для цілі даного винаходу, термін експресія, як передбачається, включає надекспресію, як відомо у даній галузі техніки. Неочікувано, Заявник виявив, що 1-бензил-3-гідроксиметиліндазольні похідні, відповідно до формули (І) даного винаходу, можуть бути використані для одержання фармацевтичної композиції, яка є активною для лікування хвороб, основаних на експресії хемокіну MCP-1, субодиниці p40, та відповідно цитокінів IL-12 та IL-23, та рецептору CX3CR1. Таким чином, у третьому аспекті, даний винахід відноситься до застосування сполуки формули (I) , у якій: A може являти собою зв'язок σ, -X1- або -X1-O-X2-, де X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов'язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю або однієї або більшої кількості алкокси груп, що містять від 1 до 3 атомів вуглецю, Y являє собою H, коли A являє собою зв'язок σ, або Y може являти собою H, -OH, або N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-, у якій R11 може являти собою водень, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R 11 разом з R12 утворюють 4- – 7-членний гетероцикл, R12 може являти собою водень, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R 12 разом з R11 утворюють 4- – 7-членний гетероцикл, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 5 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 60 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", -CN, -CONR'R", -SO2NR'R", SO2R", нітрогрупу та трифторметил; де R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R5 може являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, алкокси групу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R")(R"), -N(R")COR", нітрогрупу та трифторметил, або R5 разом з одним з поміж R6 та R7 утворює кільце, що має 5 або 6 атомів вуглецю; причому R" та R", які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою водень, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з поміж R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю, для одержання фармацевтичної композиції для лікування хвороб, основаних на експресії MCP-1, CX3CR1 та p40. Крім того, у четвертому аспекті, даний винахід відноситься до способу лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40, що характеризується введенням пацієнту, який цього потребує, ефективної кількості сполуки формули (I), як описано вище. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ У формулі (I) описаній вище, залишок A представлений зв'язком σ, групою -X1- або групою X1-O-X2-. Переважно, у формулі (I) описаній вище, X1 та X2 являють собою, незалежно один від іншого, алкільну групу, що має від 1 до 4 атомів вуглецю, необов'язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 3 атомів вуглецю або однієї або більшої кількість алкокси груп, що мають 1 або 2 атоми вуглецю. Більш бажано, X1 являє собою групу CH2, групу CH2CH2, групу C(CH3)2, або групу C(CH3)2CH2, та X2 являє собою групу CH2, групу CH2CH2 або групу CH2CH2CH2. Здебільшого, у формулі (I) описаній вище, залишок A являє собою зв'язок σ, групу CH2CH2, групу CH2CH2CH2, групу C(CH3)2CH2, групу CH2CH2OCH2, групу CH2CH2OCH2CH2, групу C(CH3)2CH2OCH2, та групу C(CH3)2CH2OCH2CH2. У формулі (I) описаній вище, коли A являє собою зв'язок σ, тоді Y являє собою атом водню, тоді як, коли A являє собою -X1- або -X1-O-X2-, тоді Y може являти собою водень, -OH, або N(R11)(R12). Здебільшого, R11 представлений атомом водню, алкільною групою, що містить від 1 до 3 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл. Здебільшого, R12 представлений атомом водню, алкільною групою, що містить від 1 до 3 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл. Переважно, R1 та R2, які можуть бути однаковими або відрізнятися, представлені атомом водню, або алкільною групою, що містить від 1 до 3 атомів вуглецю. Переважно, R3, R4 та R8, які можуть бути однаковими або відрізнятися, представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, алкокси групою, що має 1 або 2 атоми вуглецю, атомом Br, Cl або F, OH групою, нітро групою, трифторметильною групою або групою N(R")(R") або N(R")COR"; -CN, -CONR'R", -SO2NR'R", -SO2R", причому R" та R", які можуть бути однаковими або відрізнятися, представлені атомом водню та алкільною групою, що має від 1 до 3 атомів вуглецю. Здебільшого, R5 представлений атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, алкокси групою, що має 1 або 2 атоми вуглецю, атомом галогену, OH групою, або R 5, разом з одним з поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю. Переважно, R6 та R7, які можуть бути однаковими або відрізнятися, представлені атомом водню, алкільною групою, що має від 1 до 3 атомів вуглецю, або разом утворюють групу C=O, або один з поміж R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю. У випадку певних замісників, сполука формули (I) відповідно до даного винаходу може мати асиметричний атом вуглецю та тому може бути у формі стереоізомерів та енантіомерів. В залежності від природи замісників, сполука формули (I) може утворювати солі приєднання з фізіологічно прийнятними органічними або неорганічними кислотами або основами. Типові приклади підходящих фізіологічно прийнятних неорганічних кислот включають хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту та азотну кислоту. Типові приклади підходящих фізіологічно прийнятних органічних кислот включають оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну 6 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, паратолуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту. Типові приклади підходящих фізіологічно прийнятних неорганічних основ включають гідроксиди, карбонати та гідрокарбонати амонію, кальцію, магнію, натрію та калію, наприклад, гідроксид амонію, гідроксид кальцію, карбонат магнію, гідрокарбонат натрію та гідрокарбонат калію. Типові приклади підходящих фізіологічно прийнятних органічних основ включають: аргінін, бетаїн, кофеїн, холін, N, N-дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, Nметилглюкамін, глюкамін, глюкозамін, гістидин, N-(2-гідроксиетил)піперидин, N-(2гідроксиетил)піролідин, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, теобромін, триетиламін, триметиламін, трипропіламін та трометамін. В залежності від природи замісників, сполука формули (I) може утворювати складні ефіри з фізіологічно прийнятними органічними кислотами. Типові приклади підходящих фізіологічно прийнятних органічних кислот являють собою оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, пара-толуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту. Сполуки даного винаходу також включають проліки, стереоізомери, енантіомери та фармацевтично прийнятні солі або складні ефіри сполук, представлених формулою (I), описаною у пунктах Формули винаходу. Проліки сполуки формули (I) являють собою речовину по суті у неактивній формі, яка, при введенні живій істоті, метаболізується у сполуку формули (I). Терміни "фармацевтично прийнятний" та "фізіологічно прийнятний", як передбачають, позначають, без будь-якого певного обмеження, будь-який матеріал, прийнятний для одержання фармацевтичної композиції для введення живій істоті. Сполуки відповідно до формули (I) даного винаходу можуть бути використані для одержання фармацевтичної композиції, яка є активною у лікуванні хвороб (або патологій), основаних на експресії хемокіну MCP-1, цитокіну p40, субодиниці p40 (залученої у вироблення цитокінів IL-12 та IL-23) та рецептору CX3CR1. Переважно, патології, пов'язані з експресією MCP-1 та CX3CR1, являють собою хвороби суглобів, хвороби нирок, серцево-судинні хвороби, метаболічний синдром, ожиріння, діабет, резистентність до інсуліну та рак. Зокрема, патології, пов'язані з експресією MCP-1, являють собою такі як: ревматоїдний артрит, артрит, викликаний вірусними інфекціями, псоріатичний артрит, артроз, вовчаковий нефрит, діабетична нефропатія, гломерулонефрит, полікистозна хвороба нирок, інтерстиціальна легенева хвороба, фіброз, розсіяний склероз, хвороба Альцгеймера, пов'язана з ВІЛ деменція, атопічний дерматит, псоріаз, васкуліт, рестеноз, атеросклероз, інфаркт міокарда, стенокардія, гострі коронарні хвороби, аденоми, карциноми та метастази, метаболічні хвороби та ускладнення після хірургічних втручань, таких як, наприклад, пластична операція на судинах, артеректомія, процедури поновлення кровообігу, трансплантації, заміни органів, заміни тканин та протезування. Зокрема, патології, пов'язані з експресією CX3CR1, являють собою такі як: ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, коронарні хвороби серця, рестеноз, атеросклероз, інфаркт міокарда, стенокардія, та ускладнення після хірургічних втручань, таких як, наприклад, пластична операція на судинах, артеректомія та процедури поновлення кровообігу. Переважно, патології, пов'язані з експресією p40, та патології, пов'язані з експресією IL-12 та IL-23, являють собою такі як: аутоімунні хвороби, такі як хронічні дегенеративні запальні хвороби та рак. Зокрема, патології, пов'язані з експресією p40, являють собою такі як: ревматоїдний артрит, псоріаз, гломерулонефрит, діабет, червоний вовчак, діабет, хвороба Крона, та пухлини, такі як, наприклад, карциноми товстої кишки, карциноми молочної залози, карциноми легені та карциноми передміхурової залози, та шкіри та неоплазії ЦНС. Переважно, фармацевтичні композиції даного винаходу одержують у прийнятних дозованих формах, що включають ефективну дозу щонайменше однієї сполуки формули (I), або її фармацевтично прийнятної солі, складного ефіру або проліків, та щонайменше один фармацевтично прийнятний носій. Приклади фармацевтично прийнятних носіїв, відомих з попереднього рівня техніки, 7 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 включають, наприклад, гліданти, зв'язуючі речовини, дезінтегранти, наповнювачі, розріджувачі, ароматизатори, барвники, флюідизатори, любриканти, консерванти, гігроскопічні речовини, абсорбенти та підсолоджувачі. Приклади придатних фармацевтично прийнятних наповнювачів включають цукри, такі як лактоза, глюкоза або сахароза, крохмалі, такі як кукурудзяний крохмаль та картопляний крохмаль, целюлозу та її похідні, наприклад, карбоксиметилцелюлоза натрію, етилцелюлоза та ацетат целюлози, трагакантова камедь, солод, желатин, тальк, масло какао, воски, масла, такі як арахісове масло, бавовняне масло, соняшникове масло, кунжутне масло, оливкове масло, кукурудзяне масло та соєве масло, гліколі, такі як пропіленгліколь, поліоли, такі як гліцерин, сорбіт, маніт та поліетиленгліколь, складні ефіри, такі як етилолеат та етиллаурат, агар-агар та подібні. Приклади прийнятних дозованих форм включають таблетки, капсули, покриті таблетки, гранули, розчини та сиропи для перорального введення; лікарські пластирі, розчини, пасти, креми та мазі для трансдермального введення; супозиторії для ректального введення та стерильні розчини для ін'єкційного або аерозольного введення. Інші прийнятні дозовані форми включають форми уповільненого вивільнення та форми на основі ліпосом, або для перорального або ін'єкційного шляху. Дозовані форми також можуть містити інші звичайно використовувані інгредієнти, такі як: консерванти, стабілізатори, поверхнево-активні речовини, буфери, регулятори осмотичного тиску, емульгатори, підсолоджувачі, барвники, ароматизатори та подібні. Коли необхідно для певних видів терапії, фармацевтична композиція даного винаходу може містити інші фармакологічно активні інгредієнти, одночасне введення яких є корисним. Кількість сполуки формули (I) або її фармацевтично прийнятної солі, складного ефіру або проліків у фармацевтичній композиції даного винаходу може змінюватися у широкому інтервалі як функція відомих факторів, наприклад, таких як тип патології, яку необхідно лікувати, серйозність хвороби, маса тіла пацієнта, дозована форма, вибраний шлях введення, кількість введень на день та ефективність вибраної сполуки формули (I). Однак, оптимальна кількість може бути визначена просто та у плановому порядку спеціалістом, кваліфікованим у даній галузі техніки. Як правило, кількість сполуки формули (I) або її фармацевтично прийнятної солі, складного ефіру або проліків у фармацевтичній композиції даного винаходу буде такою, що забезпечує рівень введення від 0,001 до 100 мг/кг/день. Переважно, рівень введення становить від 0,05 до 50 мг/кг/день та навіть більш переважно від 0,1 до 10 мг/кг/день. Дозовані форми фармацевтичної композиції даного винаходу можуть бути одержані відповідно до технологій, які добре відомі хімікам - фармацевтам, включаючи змішування, гранулювання, пресування, розчинення, стерилізацію та подібні. Активність сполук даного винаходу на MCP-1 та CX3CR1 показана in vitro у моноцитах людини за допомогою технологій аналізу генної експресії з РЧ-ПЛР (RT-PCR) "у реальному часі" та шляхом аналізу білкового вироблення за допомогою імуноферментного тесту. Як відомо спеціалістам у даній галузі техніки, описані вище експериментальні моделі вважаються корисними для перевірки активності сполук відносно експресії та вироблення MCP-1 та експресії CX3CR1. Отже, описані вище моделі можуть вважатися прогнозуючими активність у людини для лікування патологій, що характеризуються експресією та виробленням MCP-1, експресією CX3CR1 та запальними станами з присутністю інфільтратів, у яких багато моноцитів та макрофагів. Активність сполук даного винаходу на p40 показана in vitro у моноцитах людини за допомогою технологій аналізу генної експресії з РЧ-ПЛР (RT-PCR) "у реальному часі". Як відомо спеціалістам у даній галузі техніки, описані вище експериментальні моделі вважаються корисними для перевірки активності сполук відносно експресії p40 та можуть вважатися прогнозуючими активність у людини для лікування патологій, що характеризуються експресією p40. Одержання сполук загальної формули (I) може бути проведене відповідно до однієї з наступних процедур. Спосіб (A) застосовують, коли замісник A формули (I) являє собою зв'язок σ. Способи (B), (C) і (D) застосовують коли замісник A формули (I) відрізняється від зв'язку σ. Спосіб (A): 8 UA 103609 C2 5 10 15 20 25 30 У способі (A), складні ефіри індазолкарбонової кислоти загальної формули (II), у якій Alk означає алкільну групу, що містить від 1 до 5 атомів вуглецю, відновлюють до відповідних спиртів загальної формули (III). Замісники R1 – R8 приймають значення, представлені вище для сполук формули (I). Спосіб (A) може бути виконаний відповідно до звичайно використовуваних методик. Наприклад, відновлення карбоксильних складних ефірів формули (II) може бути здійснено з використанням відновників, таких як алюмогідрид літію, борогідрид натрію або органометалічних агентів, таких як реактиви Гріньяра. Загалом, реакцію проводять в придатних апротонних розчинниках таких як, наприклад, тетрагідрофуран, діетиловий ефір та 1,4-діоксан. Реакції переважно здійснюють при температурі, що може знаходитися в межах від 0 приблизно 0 C до температури зрошення використовуваного розчиннику. Реакції цього типу можуть тривати від 1-2 годин до 24 годин. Спосіб (B): У способі (B), продукти загальної формули (IV), у якій Q показує відхідну групу, яку вибирають з групи, що включає галоген, CH 3SO3- та п-CH3PhSO3-, вводять у реакцію зі спиртами загальної формули (V). Замісники R1 – R8, A та Y приймають значення, представлені вище для сполук формули (I). Спосіб (B) може бути виконаний відповідно до звичайно використовуваних методик. Наприклад, спирти формули (V) вводять у реакцію з похідними формули (IV). Переважно, Q являє собою відхідну групу, вибрану з групи, що включає атом хлору, атом брому та метансульфонільну групу. Зазначену реакцію проводять у присутності підходящої основи та у придатному розчиннику. Основи, які переважно можуть бути використані, включають NaH, бутиллітій та діізопропіламін літію, тоді як розчинники, які є прийнятними для цього типу реакції являють собою переважно полярні апротонні розчинники, такі як тетрагідрофуран, діетиловий ефір або 1,4-діоксан. Реакції переважно здійснюють при температурі, що становить від кімнатної температури до температури зрошення використовуваного розчиннику. Реакції цього типу можуть тривати від декількох годин до декількох днів. Спосіб (C): 9 UA 103609 C2 5 10 15 20 25 30 35 40 У способі (C), продукти загальної формули (VІ), у якій Q показує відхідну групу яку вибирають з групи, що включає галоген, CH 3SO3- та п-CH3PhSO3-, вводять у реакцію зі спиртами та амінами загальної формули (VII). Замісники R1 – R8, A та Y приймають значення, представлені вище для сполук формули (I). Спосіб (C) може бути виконаний відповідно до звичайно використовуваних методик. Наприклад, аміни загальної формули (VII) вводять у реакцію з похідними формули (VІ) у присутності підходящої основи та у придатному розчиннику. Переважно, Q являє собою відхідну групу переважно вибрану з групи, що включає атом хлору, атом брому та метансульфонільну групу. Основи, які переважно можуть бути використані, включають карбонат натрію, карбонат калію та аліфатичні аміни, такі як триетиламін, діізопропілетиламін або той самий реакційний амін (VII). Переважно, використовувані розчинники являють собою полярні апротонні розчинники, такі як Ν,Ν-диметилформамід, тетрагідрофуран та дихлорметан. Загалом, реакції здійснюють при температурі, що становить від кімнатної температури до температури зрошення використовуваного розчиннику. Реакції цього типу можуть тривати від декількох годин до декількох днів. Коли сполуки формули (VII) являють собою спирти, стандартні реакційні методики можуть включати застосування сильної основи, такої як NaH, бутиллітій або діізопропіламід літію, та прийнятних полярних апротонних розчинників, таких як тетрагідрофуран, діетиловий ефір або 1,4-діоксан. Загалом, реакції здійснюють при температурі, що становить від кімнатної температури до температури зрошення використовуваного розчиннику. Реакції цього типу можуть тривати від декількох годин до декількох днів. Спосіб (D): У способі (D), складні ефіри або аміди загальної формули (VIII) відновлюють, відповідно, до спиртів або амінів загальної формули (I). Замісники R1 – R8, A та Y приймають значення, представлені вище для сполук формули (I), та у якій група B-CH2 має те саме значення, як і A. Спосіб (D) може бути виконаний відповідно до стандартних методик. Наприклад, відновлення карбонільних сполук формули (VIII) може бути здійснено з використанням відновників, таких як алюмогідрид літію, борогідрид натрію або органометалічних агентів, таких як реактиви Гріньяра. Загалом, реакцію проводять в придатних апротонних розчинниках таких як, наприклад, тетрагідрофуран, діетиловий ефір та 1,4-діоксан. Реакції переважно здійснюють при температурі, що може знаходитися в межах від 0 приблизно 0 C до температури зрошення використовуваного розчиннику. Реакції цього типу можуть тривати від 1-2 годин до 24 годин. Наступні приклади призначені для ілюстрації даного винаходу, однак, не обмежуючи його будь-яким способом. Препаративні приклади Сполуки формули (I), представлені у Таблиці A нижче, одержують, використовуючи способи, описані вище. 10 UA 103609 C2 ТАБЛИЦЯ A № A Y 1 2 3 4 5 6 7 8 σ “ “ “ “ “ “ “ “ H “ “ “ “ “ “ “ “ Групи R 1 2 H H “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ CH2CH2 “ CH2CH2CH2 “ C(CH3)2CH2 “ (CH2)2 “ “ “ “ “ ОН N(CH3)2 “ ОН “ N-морфолін ОН “ “ CH3 “ CH3 H “ “ “ “ “ CH3 H “ CH3 “ H “ “ “ “ “ “ CH3 H “ “ “ “ “ “ “ N(CH3)2 “ “ “ “ “ “ “ “ (CH2)2OCH2 “ “ “ (СН2)2O(СН2)2 “ 3 H п-OCH3 п-CH3 п-Cl м-Cl o-Cl п-F о-СН3 4 H “ “ “ п-Cl п-Cl H п-Cl H H о-СН3 o-Cl о-СН3 H “ “ “ “ “ “ п-CF3 пN(CH3)2 п-Cl “ “ H “ “ “ “ “ “ “ “ п-Cl o-Cl “ “ H “ H “ “ “ “ “ “ “ “ H “ “ “ N(CH3)2 “ “ “ CH3 H “ “ “ “ “ CH3 H “ “ “ “ оN(CH3)2 м-OH H “ п-OCH3 H о-ОСН3 С(СН3)2СН2ОСН2 C(CH3)2CH2 “ H NHCH2CH3 NH-2піридин “ CH3 “ CH3 H H 37 С(СН3)2СН2O(СН2)2 N(CH3)2 “ “ 38 σ “ ОН “ “ “ “ “ 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 39 “ “ “ “ “ “ оп-OCH3 СН3 м-NO2 H H “ “ “ п-CH3 H “ оСН3 H “ 5 H “ “ “ “ “ “ “ “ 6 H “ “ “ “ “ “ “ “ 7 H “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ “ CH3 H “ “ “ “ “ “ “ “ “ “ CH3 H “ o'CH3 H “ “ “ “ “ H H “ CO “ H “ “ “ CH3 (СН2)3 H H о'“ СН3 H " “ “ “ СО о'СН3 H “ 5-Cl “ 5CONH2 5-NO2 “ H H “ CH3 H “ “ “ H 5-Cl H “ “ “ CO (CH2)3 H 8 H “ “ “ “ “ “ “ 5OCH3 H “ “ “ “ “ “ “ “ “ 5-CN H " “ H H “ “ “ “ 5-NO2 H “ “ 5-CN 5CONH2 Деталі одержання сполук 1-18 представлені у цьому описі нижче. Сполуки 19-39 одержують відповідно до подібних методик, використовуючи придатні вихідні продукти та реагенти. 5 Одержання сполуки 1 1-бензил-3-гідроксиметил-індазол Одержання продукту 1 було здійснено, я к описано у Прикладі 1a EP 0382 276 A2. 11 UA 103609 C2 5 10 15 20 25 30 Одержання сполуки 2 [1-(4-метоксибензил)-1H-індазол-3-іл]метанол До суспензії 60 % NaH (2,7 г; 0,07 моль) у толуолі (200 мл) додають 1-бензил-3гідроксиметиліндазол (10 г; 0,07 моль). Суміш доводять до точки кипіння та залишають перемішуватися при зрошенні впродовж 1 години. Потім додають 4-метоксибензилхлорид (14 г; 0,09 моль). Після цього, суміш перемішують при зрошенні впродовж 4 годин. Реакцію завершують шляхом охолодження суміші до кімнатної температури та додавання води (50 мл). Органічну фазу відділяють та промивають, відповідно, за допомогою 2N HCl (50 мл) та води (5 × 50 мл). Розчинник випарюють при зниженому тиску. Отриманий таким чином сирий залишок очищують за допомогою флеш-хроматографії на силікагелі, використовуючи як елюент суміш 3/2 гексан/етилацетат. Отриманий продукт кристалізують з суміші 5/1 гексан/етилацетат, що приводить до одержання 5,1 г [1-(4-метоксибензил)-1H-індазол-3-іл]метанолу з температурою плавлення 95°-97 °C. 1 H-ЯМР (CDCl3, δ ppm): 3,43 (t, J=6,9 Гц, 1 H), 3,67 (s, 3 H), 4,98 (d, J=6,9 Гц, 2 H), 5,36 (s, 2 H), 6,5-6,8 (m, 2 H), 6,9-7,4 (m, 7 H), 7,80 (d, J=7,86 Гц, 1 H). Одержання сполуки 3 [1-(4-метилбензил)-1H-індазол-3-іл]метанол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 2, але використовуючи як реагент 4-метилбензилхлорид (0,09 моль) замість 4-метоксибензилхлориду. Отриманий продукт очищують кристалізацією з суміші 5/1 гексан/етилацетат. Температура плавлення = 90°-92 °C. 1 H-ЯМР (CDCl3, δ ppm): 2,24 (s, 3 H), 3,4 (bs, 1 H), 5,0 (s, 2 H), 5,36 (s, 2 H), 6,9-7,4 (m, 7 H), 7,79 (d, J=7,84 Гц, 1 H). Одержання сполуки 4 [1-(4-хлорбензил)-1H-індазол-3-іл]метанол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 2, але використовуючи як реагент 4-хлорбензилхлорид (0,09 моль) замість 4-метоксибензилхлориду. Отриманий продукт очищують кристалізацією з суміші 5/1 гексан/етилацетат. Температура плавлення = 102°-104 °C 1 H-ЯМР (CDCl3, δ ppm): 3,5 (bs, 1 H), 5,01 (s, 2 H), 5,37 (s, 2 H), 6,8-7,5 (m, 7 H), 7,81 (d, J=7,82 Гц, 1 H). 35 40 Одержання сполуки 5 [1-(3,4-дихлорбензил)-1H-індазол-3-іл]метанол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 2, але використовуючи як реагент 3,4-дихлорбензилхлорид (0,09 моль) замість 4метоксибензилхлориду. Отриманий продукт очищують кристалізацією з суміші 1/1 гексан/етилацетат. Температура плавлення = 118°-120 °C 1 H-ЯМР (CDCl3, δ ppm): 3,1-3,3 (m, 1 H), 4,9-5,2 (m, 2 H), 5,38 (s, 2 H), 6,89 (dd, J=8,27; 2,05 Гц, 1 H), 7,1-7,5 (m, 5 H), 7,82 (dt, J=8,01; 0,93, 1 H). 45 50 Одержання сполуки 6 [1-(2,4-дихлорбензил)-1H-індазол-3-іл]метанол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 2, але використовуючи як реагент 2,4-дихлорбензилхлорид (0,09 моль) замість 4метоксибензилхлориду. Отриманий продукт очищують кристалізацією з суміші 7/3 етанол/вода. Температура плавлення = 105°-106 °C 1 H-ЯМР (CDCl3, δ ppm): 3,0 (bs, 1 H), 5,04 (s, 2 H), 5,52 (s, 2 H), 6,58 (d, J=8,36 Гц, 1 H), 6,96 (dd, J=8,34; 2,07 Гц, 1 H), 7,1-7,5 (m, 4 H), 7,84 (dt, J=9,79; 1,12 Гц, 1 H). 55 60 Одержання сполуки 7 [1-(4-фторбензил)-1H-індазол-3-іл]метанол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 2, але використовуючи як реагент 4-фторбензилхлорид (0,09 моль) замість 4-метоксибензилхлориду. Продукт очищують кристалізацією з гексану. 12 UA 103609 C2 Температура плавлення = 80°-81 °C 1 H-ЯМР (CDCl3, δ ppm): 3,4 (bs, 1 H), 5,02 (s, 2 H), 5,38 (s, 2 H), 6,7-7,5 (m, 7 H), 7,83 (d, J=8,01 Гц, 1 H). 5 10 Одержання сполуки 8 [1-(4-хлор-2-метилбензил)-1H-індазол-3-іл]метанол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 2, але використовуючи як реагент 4-хлор-2-метилбензилхлорид (0,09 моль) замість 4метоксибензилхлориду. Продукт очищують кристалізацією з абсолютного етанолу. Температура плавлення = 109°-110 °C 1 H-ЯМР (DMSO-d6, δ ppm): 2,34 (s, 3 H), 4,78 (d, J=5,70 Гц, 2 H), 5,26 (td, J=5,77; 0,88 Гц, 1 H), 5,58 (s, 2 H), 6,74 (d, J=8,18 Гц, 1 H), 7,09-7,18 (m, 2 H), 7,29 (d, J=2,05 Гц, 1 H), 7,37 (ddd, J=8,33; 7,02; 1,02 Гц, 1 H), 7,59 (d, J=8,48 Гц, 1 H), 7,88 (d, J=8,04 Гц, 1 H). 15 20 25 30 35 40 45 50 55 60 Одержання сполуки 9 (1-бензил-5-метокси-1H-індазол-3-іл)метанол 9a) Бензил 1-бензил-5-метокси-1H-індазол-3-карбоксилат Суспензію 5-метокси-1H-індазол-3-карбонової кислоти (21,5 г; 0,11 моль) і 60 % NaH (10,5 г; 0 0,44 моль) в Ν,Ν-диметилформаміді (DMF) (200 мл) перемішують при 70 C впродовж 1 години. 0 Потім повільно додають бензилхлорид (32,9 г; 0,26 моль) і суміш перемішують при 70 C впродовж 4 годин. Реакцію завершують шляхом охолодження суміші до кімнатної температури і виливання у воду з льодом. Продукт екстрагують етилацетатом (3 x 250 мл). Об'єднані органічні фази концентрують при зниженому тиску. Отриманий таким чином сирий залишок очищують шляхом послідовних кристалізацій з 95° етанолу, що приводить до одержання 18 г бензил 10 бензил-5-метокси-1H-індазол-3-карбоксилату з температурою плавлення 107-109 C. 1 H-ЯМР (CDCl3, δ ppm): 3,78 (s, 3 H), 5,51 (s, 2 H), 6,9-7,6 (m, 13 H). 9b) (1-бензил-5-метокси-1H-індазол-3-іл)метанол До розчину бензил 1-бензил-5-метокси-1H-індазол-3-карбоксилату (17,7 г; 0,05 моль), діетилового ефіру (100 мл) та тетрагідрофурану (ТГФ) (170 мл), який перемішують при кімнатній температурі, повільно додають LiAlH4 (3,8 г; 0,1 моль). Після закінчення додавання, цю суспензію перемішують при зрошенні впродовж 24 годин. Реакцію завершують руйнуванням надлишку LiAlH4 шляхом додавання води (40 мл) та 5N NaOH (10 мл). Органічну фазу відділяють та розчинник випарюють при зниженому тиску. Отриманий сирий залишок очищують кристалізацією з 95° етанолe, що приводить до одержання 14 г (1-бензил-5-метокси-1H-індазол3-іл)метанолe з температурою плавлення 97°-98 °C. 1H-ЯМР (CDCl3, δ ppm): 3,3 (bs, 1 H), 3,80 (s, 3 H), 4,92 (s, 2 H), 5,47 (s, 2H), 6,9-7,5 (m, 8 H). Одержання сполуки 10 2-[1-(4-хлор-2-метилбензил)-1H-індазол-3-іл]пропан-2-олу 10a) етил 1-(4-хлор-2-метилбензил)-1H-індазол-3-карбоксилат До суспензії 1-(4-хлор-2-метилбензил)-1H-індазол-3-карбонової кислоти, отриманої як описано у J. Med. Chem. (1976) 19, 778-783, (120 г; 0,4 моль) в абсолютному етанолі (850 мл), яку перемішують при кімнатній температурі, обережно додають концентровану H 2SO4 (15 мл). Після цього, суміш киплятять зі зрошенням впродовж 9 годин. Після цього, реакцію завершують шляхом охолодження суміші до кімнатної температури. Утворену таким чином тверду речовину 0 відфільтровують в прохолодних умовах (10 C) та ретельно промивають на фільтрі водою. Таким чином отримують 126 г етил 1-(4-хлор-2-метилбензил)-1H-індазол-3-карбоксилату, який використовують в наступній реакції без додаткового очищення. Температура плавлення = 120°-122 °C 1 H-ЯМР (CDCl3, δ ppm): 1,49 (t, J=7,21 Гц, 3 H), 2,33 (s, 3 H), 4,53 (q, J=7,21 Гц, 2 H), 5,85 (s, 2 H), 6,67 (d, J=8,20 Гц, 1 H), 7,0-7,4 (m, 5 H), 8,1-8,3 (m, 1 H). 10b) 2-[1-(4-хлор-2-метилбензил)-1H-індазол-3-іл]пропан-2-ол До розчину, одержаного зі стружки магнію (2,4 г; 0,1 моль) та метилйодиду (6,1 мл; 0,1 моль) в діетиловому ефірі (100 мл), який перемішують при приблизно 5 °C, додають етил 1-(4-хлор-2метилбензил)-1H-індазол-3-карбоксилат (13,2 г; 0,04 моль). Суміш перемішують у холодних умовах впродовж 24 годин. Реакцію завершують шляхом додавання насиченого розчину хлориду амонію (50 мл), та відділену органічну фазу промивають водою (2 × 50 мл). Після цього, органічну фазу концентрують при зниженому тиску та сирий залишок очищують 0 кристалізацією з 40-60 C петролейного ефіру. 13 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином отримують 6 г 2-[1-(4-хлор-2-метилбензил)-1H-індазол-3-іл]пропан-2-олу. Температура плавлення = 72°-74 °C 1 H-ЯМР (DMSO-d6, δ ppm): 1,60 (s, 6 H), 2,38 (s, 3 H), 5,24 (s, 1 H), 5,56 (s, 2 H), 6,66 (d, J=8,18 Гц, 1 H), 7,04-7,16 (m, 2 H), 7,25-7,36 (m, 2 H), 7,52 (d, J=8,48 Гц, 1 H), 8,05 (d, J=8,33 Гц, 1 H). Одержання сполуки 11 2-[1-(2,4-дихлорбензил)-1H-індазол-3-іл]пропан-2-ол 11a) етил 1-(2,4-дихлорбензил)-1H-індазол-3-карбоксилат Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 10a, але використовуючи як реагент 1-(2,4-дихлорбензил)-1H-індазол-3-карбонову кислоту, отриману як описано у J. Med. Chem. (1976) 19, 778-783, (0,4 моль) замість 1-(4-хлор-2-метилбензил)-1Hіндазол-3-карбонової кислоти. Продукт очищують за допомогою флеш-хроматографії на силікагелі, використовуючи як елюент суміш 7/3 гексан/етилацетат. 1 H-ЯМР (CDCl3, δ ppm): 1,47 (t, J=7,24 Гц, 3 H), 5,42 (q, J=7,24 Гц, 2 H), 5,75 (s, 2 H), 6,68 (d, J=8,75 Гц, 1 H), 6,9-7,5 (m, 5 H), 8,1-8,4 (m, 1 H). 11 b) 2-[1-(2,4-дихлорбензил)-1H-індазол-3-іл]пропан-2-ол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 10b, але використовуючи як вихідний матеріал сполуку 11a (0,4 моль) замість сполуки 10a. Продукт був очищений шляхом подвійної кристалізації з гексану. Температура плавлення = 76°-78 °C 1 H-ЯМР (DMSO-d6, δ ppm): 1,60 (s, 6 H), 5,26 (s, 1 H), 5,65 (s, 2 H), 6,72 (d, J=8,33 Гц, 1 H), 7,11 (t, J=7,45 Гц, 1 H), 7,27-7,40 (m, 2 H), 7,54 (d, J=8,48 Гц, 1 H), 7,66 (d, J=2,19 Гц, 1 H), 8,07 (d, J=8,18 Гц, 1 H). Одержання сполуки 12 1-[1-(4-хлор-2-метилбензил)-1H-індазол-3-іл]етанол 12a) 1-(4-хлор-2-метилбензил)-1H-індазол-3-карбоксальдегід Суміш одержану з 1-(4-хлор-2-метилбензил)-1H-індазол-3-карбонової кислоти (250 г; 0,83 0 моль) та тіонілхлориду (450 мл) перемішують при 50 C до повного розчинення вихідних 0 матеріалів (30 хвилин), а потім нагрівають при 80 C впродовж 5 годин. Реакцію завершують шляхом охолодження розчину до кімнатної температури та видалення розчинника за допомогою дистиляції при зниженому тиску. Після цього залишок обробляють гексаном (300 мл) та утворену таким чином тверду речовину відфільтровують і висушують у вакуумі, що приводить до одержання 240 г проміжного ацилхлориду, цей продукт суспендують у толуолі (2,5 L) та, при кімнатній температурі, додають до нього N-метиланілін (88 г; 0,82 моль). Після цього, суміш перемішують при 80 °C впродовж 6 годин. Потім, реакцію завершують шляхом додавання толуолу (1,5 L) до цієї суміші та промивання розчину водою до нейтрально рН. Органічну фазу 0 концентрують до 50 % при зниженому тиску. Потім розчин охолоджують до 0 C та одержану тверду речовину відфільтровують, що приводить до одержання приблизно 230 г аніліну, цей продукт розчиняють в діетиловому ефірі (2,7 л) та ТГФ (400 мл). Одержаний розчин 0 перемішують при 0 C. До розчину повільно додають LiAlH4 (10,8 г; 0,29 моль). Після закінчення додавання, суспензію перемішують при кімнатній температурі впродовж 24 годин. Реакцію завершують шляхом обережного додавання до суміші води (20 мл), 2N NaOH (20 мл) та знову води (35 мл). Після цього, суміш відфільтровують та розчинник концентрують при зниженому тиску. Залишок переносять в метанол (3,5 л) та перемішують при 50 °C. До цього розчину додають розчин NaHSO3 (228 г; 2,19 моль) в воді (650 мл). Суміш перемішують впродовж 30 0 хвилин, а потім охолоджують до 0 C, і утворену таким чином тверду речовину відфільтровують, а потім додають до водного розчину 10 % Na2CO3 (3 л), який перемішують при кімнатній температурі. Через 3 години, суміш відфільтровують, а тверду речовину очищують кристалізацією, спочатку з суміші 1/1 етанол/етилацетат, а потім з 95° етанолу. Таким чином отримують 98 г 1-(4-хлор-2-метилбензил)-1H-індазол-3-карбоксальдегіду. Температура плавлення = 107°-109 °C 1 H-ЯМР (DMSO-d6, δ ppm): 2,35 (s, 3 H), 5,84 (s, 2 H), 6,91 (d, J=8,73 Гц, 1 H), 7,1-8,3 (m, 6 H), 10,18 (s, 1 H). 12b) 1-[1-(4-хлор-2-метилбензил)-1H-індазол-3-іл]етанол Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 10b, але використовуючи як вихідний матеріал сполуку 12a (0,4 моль) замість сполуки 10a. Продукт очищують кристалізацією з гексану. 14 UA 103609 C2 5 10 15 Температура плавлення = 82°-84 °C 1 H-ЯМР (DMSO-d6, δ ppm): 1,54 (d, J=6,58 Гц, 3 H), 2,36 (s, 3 H), 5,10 (dq, J=6,53; 4,82 Гц, 1 H), 5,34 (d, J=4,82 Гц, 1 H), 5,56 (s, 2 H), 6,70 (d, J=8,18 Гц, 1 H), 7,06-7,17 (m, 2 H), 7,29 (d, J=1,90 Гц, 1 H), 7,34 (ddd, J=8,33; 7,02; 1,02 Гц, 1 H), 7,56 (d, J=8,48 Гц, 1 H), 7,95 (d, J=8,18 Гц, 1 H). Одержання сполуки 13 2-[(1-бензил-1H-індазол-3-іл)метокси]етанол До розчину NaOH (2,8 г; 0,07 моль) в етиленгліколі (150 мл), який перемішують при кімнатній температурі, додають 1-бензил-3-хлорметиліндазол, отриманий, як описано у Прикладі 2a 0 публікації EP 382 276 (17,6 г; 0,07 моль). Цей розчин нагрівають при 130 C впродовж 4 годин, а потім охолоджують до кімнатної температури та розчинник випарюють при зниженому тиску. Залишок переносять у воду (100 мл) і продукт екстрагують етилацетатом (3 × 100 мл). Об'єднані органічні фази концентрують при зниженому тиску, та отриманий сирий залишок очищують кристалізацією з суміші приблизно 1/1 гексан/етилацетат. Таким чином отримують 13,8 г 2-[(1-бензил-1H-індазол-3-іл)метокси]етанол. Температура плавлення = 67°-69 °C 1 H-ЯМР (CDCl3, δ ppm): 2,15 (bs, 1 H), 3,61-3,82 (m, 4 H), 4,97 (s, 2 H), 5,57 (s, 2 H), 7,11-7,38 (m, 8 H), 7,81 (dt, J=8,15; 0,97 Гц, 1 H). 20 25 30 35 40 Одержання сполуки 14 2-[(1-бензил-1H-індазол-3-іл)метокси]-N, N-диметилетанамін гідрохлорид До розчину (1-бензил-1H-індазол-3-іл)метанолу (20 г; 0,084 моль) у толуолі (200 мл), який перемішують при кімнатній температурі, додають 55 % NaH (3,6 г; 0,082 моль). Через 30 хвилин після закінчення додавання, додають розчин 2-хлор-N, N-диметилетанаміну (9,2 г; 0,082 моль) у толуолі (200 мл). Суміш перемішують при зрошенні впродовж 7 годин. Реакцію завершують шляхом додавання води (200 мл). Органічну фазу промивають водою (3 x 100 мл), а потім екстрагують розведеною H2SO4 (3 x 100 мл). Комбіновані кислотні фази промивають толуолом (3 x 50 мл) та доводять до основного pH за допомогою 10 N NaOH. Після цього продукт екстрагують етилацетатом (3 × 200 мл) та об'єднані органічні фази промивають водою до нейтрального рН. Розчинник концентрують при зниженому тиску, і отриманий сирий залишок очищують шляхом дистиляції при тиску 0,4 мм ртутного стовпчика та при 182°-185 °C. Таким чином отримують 16 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-N, N-диметил-етанаміну (масло). Частину цього продукту (13,1 г; 0,042 моль) розчиняють в ізобутанолі (150 мл) та обробляють концентрованою HCl (3,5 мл; 0,045 моль) при кімнатній температурі впродовж 1 години. Після обробки, розчинник випарюють при зниженому тиску. Одержаний, таким чином, твердий продукт очищують кристалізацією з ізопропанолу. Таким чином отримують 10 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-N, N-диметил-етанаміну гідрохлориду. Температура плавлення = 138°-140 °C 1 H-ЯМР (DMSO-d6, δ ppm): 2,72 (s, 6 H), 3,28 (t, J=5,10 Гц, 2 H), 3,85 (t, J=5,10 Гц, 2 H), 4,88 (s, 2 H), 5,65 (s, 2 H), 7,17 (ddd, J=7,97; 7,06; 0,66 Гц, 1 H), 7,21-7,35 (m, 5 H), 7,41 (ddd, J=8,38; 6,98; 0,99 Гц, 1 H), 7,72 (d, J=8,42 Гц, 1 H), 7,88 (d, J=8,09 Гц, 1 H), 10,68 (bs, 1 H). 45 50 55 Одержання сполуки 15 3-[(1-бензил-1H-індазол-3-іл)метокси]-N, N-диметилпропан-1-амін гідрохлорид Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 14, але використовуючи як реагент 3-хлор-N, N-диметилпропан-1-амін (0,08 моль) замість 2-хлор-N, Nдиметилетанаміну. Продукт очищають шляхом подвійної кристалізації з ізопропанолу. Температура плавлення = 119°-121 °C 1 H-ЯМР (DMSO-d6, δ ppm): 1,86-2,02 (m, 2 H), 2,68 (s, 6 H), 2,99-3,09 (m, 2 H), 3,55 (t, J=6,03 Гц, 2 H), 4,81 (s, 2 H), 5,63 (s, 2 H), 7,16 (ddd, J=7,97; 6,98; 0,74 Гц, 1 H), 7,20-7,34 (m, 5 H), 7,39 (ddd, J=8,34; 7,02; 0,99 Гц, 1 H), 7,69 (d, J=8,59 Гц, 1 H), 7,83 (dt, J=8,13; 0,89 Гц, 1 H), 10,75 (bs, 1 H). Одержання сполуки 16 3-[(1-бензил-1H-індазол-3-іл)метокси]пропан-1-ол 15 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей продукт отримують використовуючи спосіб, описаний для одержання сполуки 13, але використовуючи як реагент 1,3-пропандіол (150 мл) замість етиленгліколю. Продукт очищують за допомогою флеш-хроматографії на силікагелі, використовуючи як елюент суміш 1/1 гексан/етилацетат. 1 H-ЯМР (CDCl3, δ ppm): 1,85 (q, J=5,83 Гц, 2 H), 2,75 (bs, 1 H), 3,71 (t, J=7,74 Гц, 4 H), 4,91 (s, 2 H), 5,55 (s, 2 H), 7,0-7,4 (m, 8 H), 7,80 (d, J=7,77 Гц, 1 H). Одержання сполуки 17 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропан-1-ол До суспензії LiAlH4 (4,48 г; 0,118 моль) в діетиловому ефірі (100 мл), яку перемішують при кімнатній температурі, повільно додають розчин метил 2-[(1-бензил-1H-індазол-3-іл)метокси]-2метилпропаноату, одержаного відповідно до способу, описаного в EP 0 382 276, (20 г; 0,06 моль) в діетиловому ефірі (200 мл) та ТГФ (50 мл). Після закінчення додавання, суміш перемішують при кімнатній температурі впродовж 30 хвилин, а потім реакцію завершують шляхом додавання 10 N NaOH (20 мл) та води (40 мл). Розчинник випарюють при зниженому тиску і маслянистий залишок очищують за допомогою дистиляції при тиску 0,01 мм ртутного 0 стовпчика при 190 C. Одержаний, таким чином, продукт кристалізують з ізопропанолу. Таким чином отримують 11 г 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метилпропан-1-олу. Температура плавлення = 52°-53 °C 1 H-ЯМР (CDCl3, δ ppm): 1,34 (s, 6 H), 2,50 (bs, 1 H), 3,51 (s, 2 H), 4,87 (s, 2 H), 5,55 (s, 2 H), 7,14 (ddd, J=8,04; 6,21; 1,68 Гц, 1 H), 7,17-7,38 (m, 7 H), 7,78 (dt, J=8,08; 1,00 Гц, 1 H). Одержання сполуки 18 1-бензил-3-[(1,1-диметил-2-морфолін-4-ілетокси)метил]-1H-індазол малеат 18a) 1-бензил-3-[(1,1-диметил-2-морфолін-4-іл-2-оксиетокси)метил]-1H-індазол 72 г (0,222 моль) 2-[(1-бензил-1H-індазол-3-іл)метокси]-2-метил-пропанової кислоти обробляють при кімнатній температурі 30 % метоксидом натрію в метанолі (39 мл; 0,222 моль) впродовж 10 хвилин, потім розчинник випаровують при зниженому тиску та отриманий залишок суспендують в безводному толуолі (750 мл). До цієї суспензії, яку перемішують при кімнатній температурі, додають морфолін (77,6 мл; 0,888 моль) з наступним повільним додаванням розчину тіонілхлориду (19,3 мл; 0,266 моль) у толуолі (150 мл). Суміш перемішують впродовж 24 годин, і реакцію завершують фільтруванням утвореної, таким чином, твердої речовини. Розчин концентрують при зниженому тиску та отриманий сирий залишок очищують кристалізацією з ізопропанолу. Отримують 14 г 1-бензил-3-[(1,1-диметил-2-морфолін-4-іл-2-оксиетокси)метил]-1H-індазолу. 1 H-ЯМР (DMSO-d6, δ ppm): 1,47 (s, 6 H), 3,1-4,0 (2bs, 8 H), 4,73 (s, 2 H), 5,83 (s, 2 H), 7,0-7,9 (m, 9 H). 18b) 1-бензил-3-[(1,1-диметил-2-морфолін-4-ілетокси)метил]-1H-індазол малеат До суспензії LiAlH4 (5,16 г; 0,136 моль) в діетиловому ефірі (100 мл), яку перемішують при кімнатній температурі, додають розчин 1-бензил-3-[(1,1-диметил-2-морфолін-4-іл-2оксиетокси)метил]-1H-індазолу (27 г; 0,068 моль) в ТГФ (180 мл). Після цього, суміш кип'ятять зі зрошенням впродовж 1 години. Після кип'ятіння зі зрошенням, реакцію завершують шляхом додавання 10 N NaOH (25 мл) та води (50 мл). Після цього, органічну фазу відділяють та екстрагують 1N HCl (2 × 50 мл). Комбіновані кислотні фази промивають доводять до основного pH за допомогою 1N NaOH, а потім екстрагують діетиловим ефіром (3 × 150 мл). Об'єднані органічні фази концентрують при зниженому тиску та сирий залишок очищують кристалізацією з ізопропанолу, що приводить до одержання 6 г 1-бензил-3-[(1,1-диметил-2-морфолін-4ілетокси)метил]-1H-індазолу. Після цього, 1-бензил-3-[(1,1-диметил-2-морфолін-4-ілетокси)метил]-1H-індазол розчиняють в абсолютному етанолі (50 мл) та обробляють при кімнатній температурі малеїновою кислотою (1,75 г; 0,016 моль). Одержану тверду речовину відфільтровують та очищують кристалізацією з ізопропанолу. Таким чином отримують 5,4 г 1-бензил-3-[(1,1-диметил-2-морфолін-4-ілетокси)метил]-1Hіндазолу малеату. Температура плавлення = 87°-88 °C 1 H-ЯМР (DMSO-d6, δ ppm): 1,38 (s, 6 H), 3,09 (bs, 8 H), 3,71 (bs, 4 H), 4,80 (s, 2 H), 5,61 (s, 2 H), 6,09 (s, 2 H), 7,09-7,44 (m, 7 H), 7,70 (d, J=8,59 Гц, 1 H), 7,82 (d, J=8,09 Гц, 1 H). Приклад 1 Аналіз генної експресії MCP-1 у моноцитарній лінії людини 16 UA 103609 C2 5 10 15 Оцінюють здатність сполук інгібувати експресію MCP-1 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 1 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 4 годин. Всю РНК екстрагують з клітинної таблетки, використовуючи мінінабір RNeasy (Qiagen), обернено зчитують генетичний код за допомогою набору TaqMan Reverse transcription reagents synthesis (Applied Biosystems) та отримані кДНК використовують для ПЦР реакції у реальному часі. Ампліфікацію отримують у 96-лункових планшетах, використовуючи ABI Prism 7000 систему визначення послідовності (Applied Biosystems), застосовуючи наступний температурний профіль: 50 °C впродовж 2 хвилин, 95 °C впродовж 10 хвилин та 45 циклів при 95 °C впродовж 15 секунд та 60 °C впродовж 1 хвилини. Для ампліфікації використовують набір праймерів та зонд, специфічний для MCP-1 людини (Applied Biosystems, RefSeq NM_002982.3). Набір праймерів та зонд для -актину використовують у окремих лунках як внутрішній контроль зразків для цілей нормалізації. Коли реакція відбулася, дані флуоресценції аналізують, використовуючи програмне забезпечення ABI Prism 7000 SDS, шляхом розрахунку граничного циклу (Ct) для кожного зразку та далі проводячи відносне кількісне визначення за допомогою ΔΔCt способу. Отримані результати, виражені як відсоток інгібування, представлені у Таблиці 1 нижче. 20 ТАБЛИЦЯ 1 № 1 10 14 13 17 25 30 35 % інгібування 30 72 52 55 53 [мкM] 150 30 150 300 150 Як видно з результатів, отриманих та представлених у Таблиці 1, сполуки здатні значно інгібувати LPS-викликану експресію MCP-1 у моноцитарній лінії людини, та показують зменшення у рівнях специфічних мРНК на рівні між 30 % та 72 %. Приклад 2 Вимірювання вироблення MCP-1 у моноцитарній лінії людини Оцінюють здатність сполук інгібувати експресію MCP-1 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 2 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 20 годин. Кількість виробленого MCP-1 вимірюють у надосадових рідинах, прийнятно розведених буфером, за допомогою імуноферментного способу (ELISA), використовуючи комерційний набір (ELISA MCP-1/JE, R&D Systems). Отримані результати, виражені як відсоток інгібування, представлені у Таблиці 2 нижче. ТАБЛИЦЯ 2 40 № 1 4 6 8 10 11 12 13 14 15 17 18 % інгібування 54 85 54 75 81 88 76 78 64 44 82 85 17 [мкM] 150 75 30 30 30 30 30 300 150 75 150 75 UA 103609 C2 Як показано у результатах, отриманих та представлених у Таблиці 2, сполуки здатні значно інгібувати LPS-викликану експресію MCP-1 у моноцитарній лінії людини, та показують зменшення у рівнях виробленого білку на рівні між 44 % та 88 %. 5 10 15 20 25 Приклад 3 Аналіз генної експресії CX3CR1 у моноцитарній лінії людини Оцінюють здатність сполук інгібувати експресію CX3CR1 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 3 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 20 годин. Всю РНК екстрагують з клітинної таблетки, використовуючи мінінабір RNeasy (Qiagen), обернено зчитують генетичний код за допомогою набору TaqMan Reverse transcription reagents synthesis (Applied Biosystems) та отримані кДНК використовують для ПЦР реакції у реальному часі. Ампліфікацію отримують у 96-лункових планшетах, використовуючи ABI Prism 7000 систему визначення послідовності (Applied Biosystems), застосовуючи наступний температурний профіль: 50 °C впродовж 2 хвилин, 95 °C впродовж 10 хвилин та 45 циклів при 95 °C впродовж 15 секунд та 60 °C впродовж 1 хвилини. Для ампліфікації використовують набір праймерів та зонд, специфічний для CX3CR1 людини (Applied Biosystems, RefSeq NM_001337.3). Набір праймерів та зонд для -актину використовують у окремих лунках як внутрішній контроль зразків для цілей нормалізації. Коли реакція відбулася, дані флуоресценції аналізують, використовуючи програмне забезпечення ABI Prism 7000 SDS, шляхом розрахунку граничного циклу (Ct) для кожного зразка та далі проводячи відносне кількісне визначення за допомогою ΔΔCt способу. Отримані результати, виражені як відсоток інгібування, показані у Таблиці 3 нижче. ТАБЛИЦЯ 3 № 1 10 13 14 17 30 35 40 45 50 % інгібування 72 89 90 96 88 [мкM] 150 30 300 150 150 Як показано у результатах, отриманих та представлених у Таблиці 3, сполуки здатні значно інгібувати LPS-викликану експресію CX3CR1 у моноцитарній лінії людини, та показують зменшення у рівнях специфічної мРНК на рівні між 72 % та 96 %. Приклад 4 Аналіз генної експресії p40 у моноцитарній лінії людини Оцінюють здатність сполук інгібувати експресію p40 стимульованими ліпополісахаридами (LPS) MonoMac6 клітинами. Клітини поміщають у 96-лункові планшети при концентрації 50000 клітин/лунку. Сполуки досліджують при максимальній розчинній концентрації, представленій у Таблиці 4 (у інтервалі 30-300 мкM) та інкубують впродовж 1 години. Потім клітини стимулюють за допомогою LPS (100 нг/мл) впродовж 4 годин. Всю РНК екстрагують з клітинної таблетки, використовуючи мінінабір RNeasy (Qiagen), обернено зчитують генетичний код за допомогою набору TaqMan Reverse transcription reagents synthesis (Applied Biosystems) та отримані кДНК використовують для ПЦР реакції у реальному часі. Ампліфікацію отримують у 96-лункових планшетах, використовуючи ABI Prism 7000 систему визначення послідовності (Applied Biosystems), застосовуючи наступний температурний профіль: 50 °C впродовж 2 хвилин, 95 °C впродовж 10 хвилин та 45 циклів при 95 °C впродовж 15 секунд та 60 °C впродовж 1 хвилини. Для ампліфікації використовують набір праймерів та зонд, специфічний для p40 людини (Applied Biosystems, RefSeq NM_002187.2). Набір праймерів та зонд для -актину використовують у окремих лунках як внутрішній контроль зразків для цілей нормалізації. Коли реакція відбулася, дані флуоресценції аналізують, використовуючи програмне забезпечення ABI Prism 7000 SDS, шляхом розрахунку граничного циклу (Ct) для кожного зразку та далі проводячи відносне кількісне визначення за допомогою ΔΔCt способу. Отримані результати, виражені як відсоток інгібування, представлені у Таблиці 4 нижче. ТАБЛИЦЯ 4 18 UA 103609 C2 № 1 10 17 18 5 % інгібування 32 65 37 39 [мкM] 150 30 150 75 Як показано у результатах, отриманих та представлених у Таблиці 4, сполуки здатні значно інгібувати LPS-викликану експресію p40 у моноцитарній лінії людини, та показують зменшення у рівнях специфічної мРНК на рівні між 32 % та 65 %. ФОРМУЛА ВИНАХОДУ 1. Сполука формули (I) 10 15 20 25 30 35 40 , (І) у якій: A може являти собою зв’язок σ, -X1- або -X1-O-X2-, де X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що містять від 1 до 3 атомів вуглецю, Y являє собою H, коли A являє собою зв’язок σ, або Y може являти собою H, -OH або N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-, у якій R11 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом, R12 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R', нітрогрупу та трифторметил; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', нітрогрупу та трифторметил, або R5, разом з одним з-поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю, за умови, що, коли A являє собою зв’язок σ та Y, R1, R2, R6 та R7 являють собою атоми водню, якщо R8 являє собою атом водню, тоді група, зв’язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від бензильної групи, 4-хлорбензильної групи або 2,4дихлорбензильної групи, 19 UA 103609 C2 5 10 15 20 25 30 35 40 45 50 55 60 якщо R8 являє собою атом фтору у 5-му положенні індазольного кільця, тоді група, зв’язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від 5-хлор-2метоксибензильної групи, і якщо R8 являє собою трифторметильну групу у 6-му положенні індазольного кільця, тоді група, зв’язана з атомом азоту у 1-му положенні індазольного кільця, відрізняється від 2,4дихлорбензильної групи. 2. Сполука за п. 1, де X1 та X2 являють собою, незалежно один від іншого, алкільну групу, що має від 1 до 4 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 3 атомів вуглецю, або однієї або більшої кількість алкоксигруп, що мають 1 або 2 атоми вуглецю. 3. Сполука за п. 1, де X1 вибраний з групи, що включає групу CH2, групу CH2CH2, групу C(CH3)2 та групу C(CH3)2CH2, та X2 вибраний з групи, що включає групу CH2, групу CH2CH2 та групу CH2CH2CH2. 4. Сполука за п. 1, де залишок A вибраний з групи, що включає зв’язок σ, групу CH 2CH2, групу CH2CH2CH2, групу C(CH3)2CH2, групу CH2CH2OCH2, групу CH2CH2OCH2CH2, групу C(CH3)2CH2OCH2 та групу C(CH3)2CH2OCH2CH2. 5. Сполука за п. 1, де R11 та R12, які можуть бути однаковими або відрізнятися один від іншого, являють собою атом водню, алкільну групу, що містить від 1 до 3 атомів вуглецю, або разом утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом. 6. Сполука за п. 1, де R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, являють собою атом водню або алкільну групу, що містить від 1 до 3 атомів вуглецю. 7. Сполука за п. 1, де R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, вибрані з групи, яка включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом Br, Cl або F, OH-групу, нітрогрупу, трифторметильну групу або групу N(R')(R''), N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R', причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 3 атомів вуглецю. 8. Сполука за п. 1, де R5 вибраний з групи, яка включає атом водню, алкільну групою, що має від 1 до 3 атомів вуглецю, алкоксигрупу, що має 1 або 2 атоми вуглецю, атом галогену, OHгрупу, або R5, разом з одним з-поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю. 9. Сполука за п. 1, де R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, вибрані з групи, яка включає атом водню, алкільну групу, що має від 1 до 3 атомів вуглецю, або разом утворюють групу C=O, або один з-поміж R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю. 10. Фармацевтична композиція, що містить сполуку формули (I) за будь-яким з попередніх пунктів або її стереоізомер або енантіомер, або її фармацевтично прийнятну сіль, складний ефір або проліки та щонайменше один фармацевтично прийнятний носій. 11. Фармацевтична композиція за п. 10, яка відрізняється тим, що фармацевтично прийнятна сіль являє собою сіль приєднання з фізіологічно прийнятними органічними або неорганічними кислотами або основами. 12. Фармацевтична композиція за п. 11, яка відрізняється тим, що фізіологічно прийнятні кислоти вибрані з групи, що включає хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту, азотну кислоту, оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, пара-толуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту. 13. Фармацевтична композиція за п. 11, яка відрізняється тим, що фізіологічно прийнятні основи вибрані з групи, що включає гідроксид амонію, гідроксид кальцію, карбонат магнію, гідрокарбонат натрію, гідрокарбонат калію, аргінін, бетаїн, кофеїн, холін, N,Nдибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, N-метилглюкамін, глюкамін, глюкозамін, гістидин, N-(2-гідроксіетил)піперидин, N-(2-гідроксіетил)піролідин, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, теобромін, триетиламін, триметиламін, трипропіламін та трометамін. 14. Фармацевтична композиція за п. 10, яка відрізняється тим, що фармацевтично прийнятний складний ефір утворений з фізіологічно прийнятними органічними кислотами, вибраними з групи, що включає оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, пара-толуолсульфонову кислоту, бензолсульфонову кислоту, бурштинову кислоту, дубильну кислоту та винну кислоту. 20 UA 103609 C2 5 10 15 20 25 30 35 40 45 15. Фармацевтична композиція за будь-яким з пунктів 10-14, яка відрізняється тим, що містить стереоізомер або енантіомер сполуки формули (I) або її фармацевтично прийнятну сіль, складний ефір або проліки або їх суміш. 16. Фармацевтична композиція за будь-яким з пунктів 10-15, яка відрізняється тим, що фармацевтично прийнятний носій вибраний з групи, що включає гліданти, зв’язуючі речовини, дезінтегранти, наповнювачі, розріджувачі, ароматизатори, барвники, флюїдизатори, лубриканти, консерванти, гігроскопічні речовини, абсорбенти та підсолоджувачі. 17. Застосування сполуки формули (I) , (І) у якій: A може являти собою зв’язок σ, -X1- або -X1-O-X2-, де X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що містять від 1 до 3 атомів вуглецю, Y являє собою H, коли A являє собою зв’язок σ, або Y може являти собою H, -OH або N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-, у якій R11 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом, R12 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R', нітрогрупу та трифторметил; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', нітрогрупу та трифторметил, або R5, разом з одним з-поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю, для одержання фармацевтичної композиції для лікування хвороб, основаних на експресії MCP1, CX3CR1 та p40. 18. Застосування за п. 17, де хвороби, основані на експресії MCP-1 та CX3CR1, вибрані з групи, що включає такі як: хвороби суглобів, хвороби нирок, серцево-судинні хвороби, метаболічний синдром, ожиріння, діабет, резистентність до інсуліну та рак. 19. Застосування за п. 17, де хвороби, основані на експресії MCP-1, вибрані з групи, що включає такі як: ревматоїдний артрит, артрит, викликаний вірусними інфекціями, псоріатичний артрит, артроз, вовчаковий нефрит, діабетична нефропатія, гломерулонефрит, полікістозна хвороба нирок, інтерстиціальна легенева хвороба, фіброз, розсіяний склероз, хвороба Альцгеймера, пов’язана з ВІЛ деменція, атопічний дерматит, псоріаз, васкуліт, рестеноз, атеросклероз, 21 UA 103609 C2 5 10 15 20 25 30 35 40 інфаркт міокарда, стенокардія, гострі коронарні хвороби, аденоми, карциноми та метастази, метаболічні хвороби та ускладнення після хірургічних втручань. 20. Застосування за п. 17, де хвороби, основані на експресії CX3CR1, вибрані з групи, що включає такі як: ревматоїдний артрит, вовчаковий нефрит, діабетична нефропатія, хвороба Крона, виразковий коліт, коронарні хвороби серця, рестеноз, атеросклероз, інфаркт міокарда, стенокардія та ускладнення після хірургічних втручань. 21. Застосування за п. 17, де хвороби, основані на експресії p40, вибрані з групи, що включає аутоімунні хвороби, хронічні дегенеративні запальні хвороби та рак. 22. Застосування за п. 17, де хвороби, основані на експресії p40, вибрані з групи, що включає ревматоїдний артрит, псоріаз, гломерулонефрит, діабет, червоний вовчак, діабет, хворобу Крона та пухлини. 23. Спосіб лікування або профілактики хвороб, основаних на експресії MCP-1, CX3CR1 та p40, у якому пацієнту, що цього потребує, вводять ефективну кількість сполуки формули (I): , (І) у якій: A може являти собою зв’язок σ, -X1- або -X1-O-X2-, де X1 та X2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою алкільну групу, що містить від 1 до 5 атомів вуглецю, необов’язково заміщену за допомогою однієї або більшої кількості алкільних груп, що містять від 1 до 5 атомів вуглецю, або однієї або більшої кількості алкоксигруп, що містять від 1 до 3 атомів вуглецю, Y являє собою H, коли A являє собою зв’язок σ, або Y може являти собою H, -OH або N(R11)(R12), коли A являє собою -X1- або -X1-O-X2-, у якій R11 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R11 разом з R12 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом, R12 може являти собою атом водню, алкільну групу, що містить від 1 до 5 атомів вуглецю, або R12 разом з R11 утворюють 5- або 6-членний гетероцикл, що містить принаймні один N-атом, R1 та R2, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, R3, R4 та R8, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R', нітрогрупу та трифторметил; причому R' та R'', які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R5 може являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, алкоксигрупу, що має від 1 до 3 атомів вуглецю, атом галогену, -OH, -N(R')(R''), -N(R')COR'', нітрогрупу та трифторметил, або R5, разом з одним з-поміж R6 та R7, утворює кільце, що має 5 або 6 атомів вуглецю; причому R’ та R”, які можуть бути однаковими або відрізнятися один від іншого, представлені атомом водню та алкільною групою, що має від 1 до 5 атомів вуглецю, R6 та R7, які можуть бути однаковими або відрізнятися один від іншого, можуть являти собою атом водню, алкільну групу, що має від 1 до 5 атомів вуглецю, або разом утворюють групу C=O, або один з R6 та R7, разом з R5, утворює кільце, що має 5 або 6 атомів вуглецю. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 22
ДивитисяДодаткова інформація
Назва патенту англійською1-benzyl-3-hydroxymethylindazole derivatives and use thereof in the treatment of diseases based on the expression of mcp-1, cx3cr1 and p40
Автори англійськоюGuglielmotti, Angelo, Furlotti, Guido, Mangano, Giorgina, Cazzolla, Nicola
Автори російськоюГуглиэлмотти Анджело, Гуглиелмотти Анджело, Фурлотти Гвидо, Мангано Джорджина, Каццолла Никола
МПК / Мітки
МПК: A61P 9/00, A61K 31/416, A61K 31/435, C07D 401/12, A61P 13/00, C07D 231/54, A61P 3/10
Мітки: похідні, mcp-1, cx3cr1, експресії, 1-бензил-3-гідроксиметиліндазолу, застосування, хвороб, основаних, лікуванні
Код посилання
<a href="https://ua.patents.su/24-103609-pokhidni-1-benzil-3-gidroksimetilindazolu-ta-kh-zastosuvannya-u-likuvanni-khvorob-osnovanikh-na-ekspresi-mcp-1-cx3cr1-ta-r40.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-бензил-3-гідроксиметиліндазолу та їх застосування у лікуванні хвороб, основаних на експресії mcp-1, cx3cr1 та р40</a>
Попередній патент: Спосіб та пристрій для облагороджування текучих мас
Наступний патент: Кристалічна форма похідних феніламінопіримідину
Випадковий патент: Спосіб одержання лікувально-профілактичного засобу із гіпоглікемічною дією з листя чорниці звичайної












