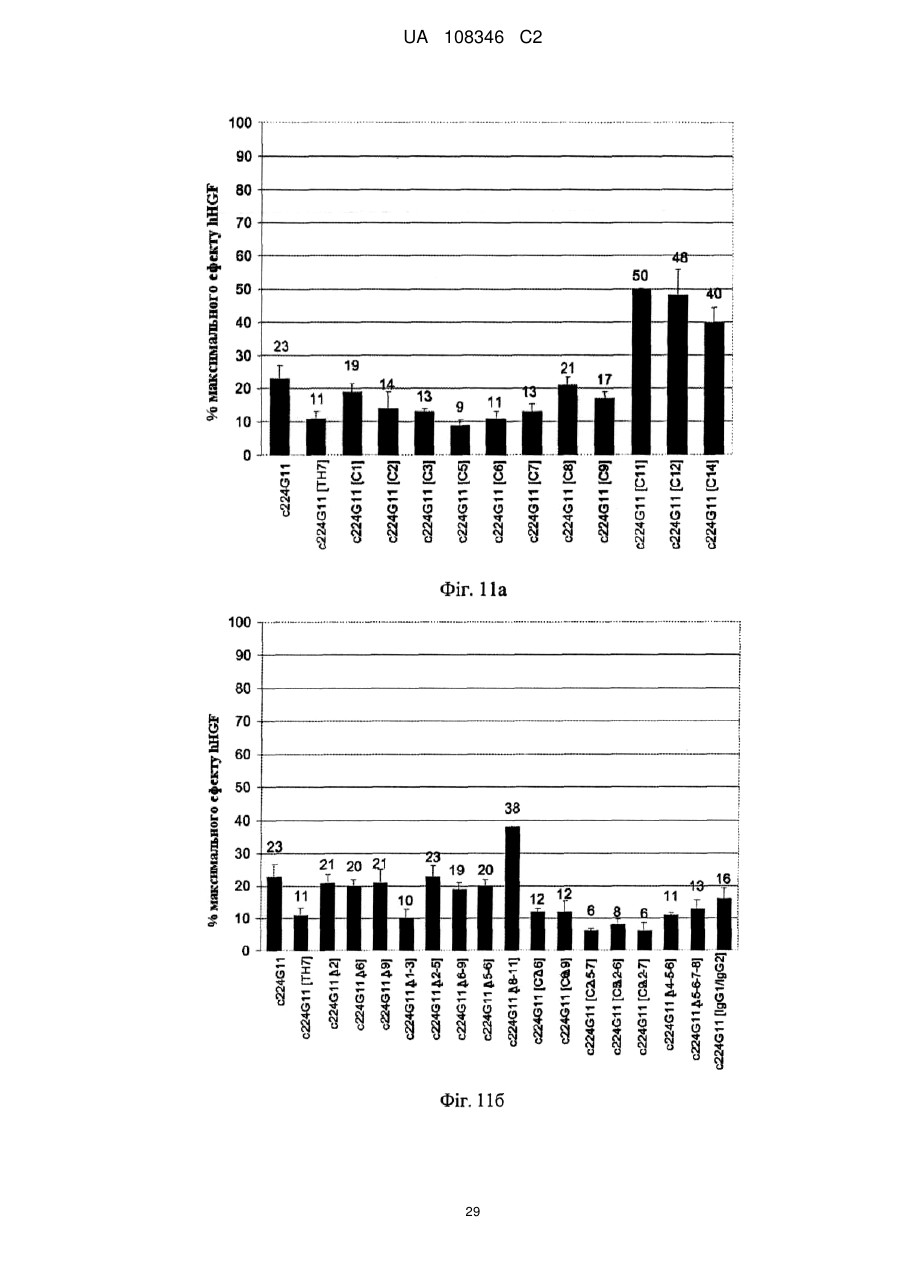
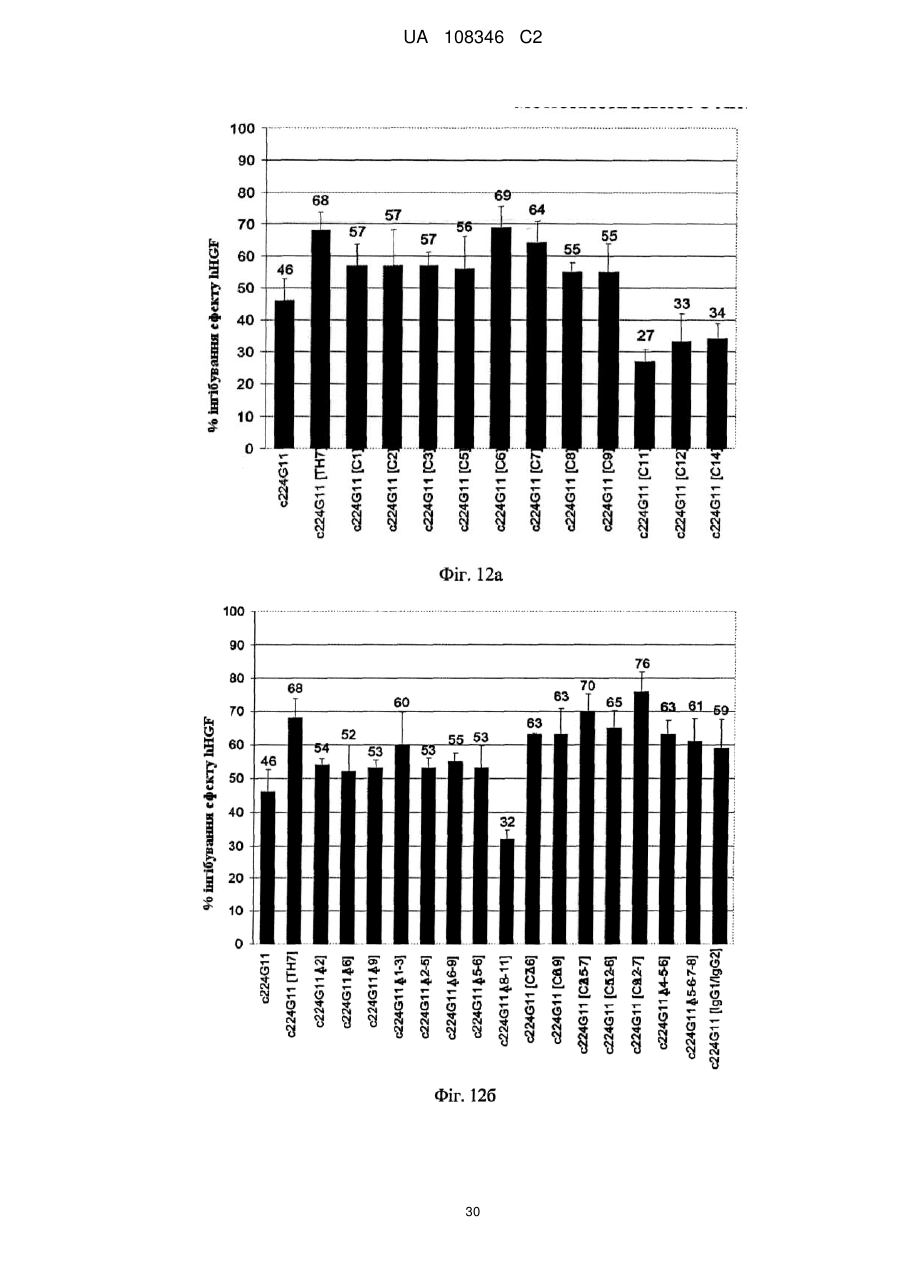
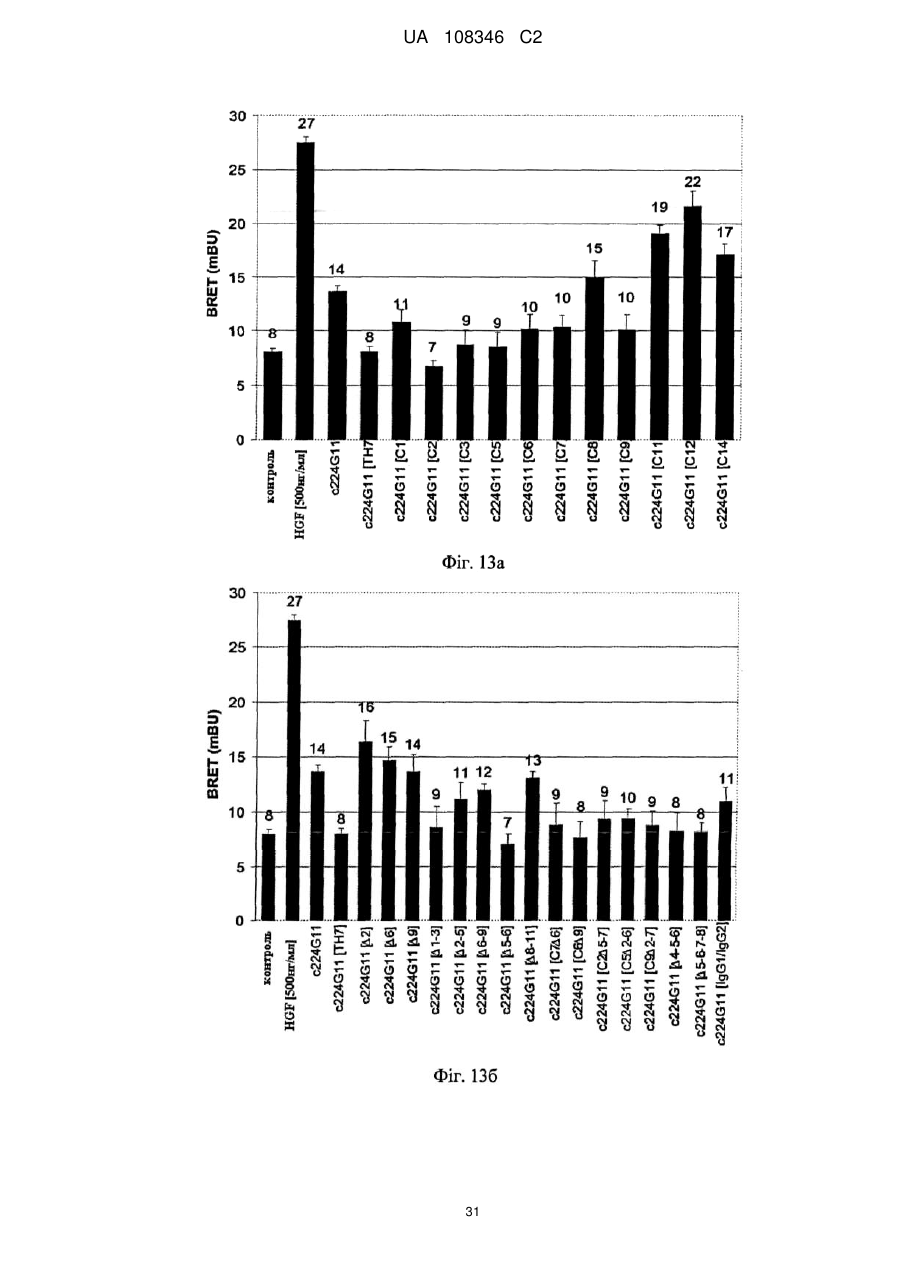
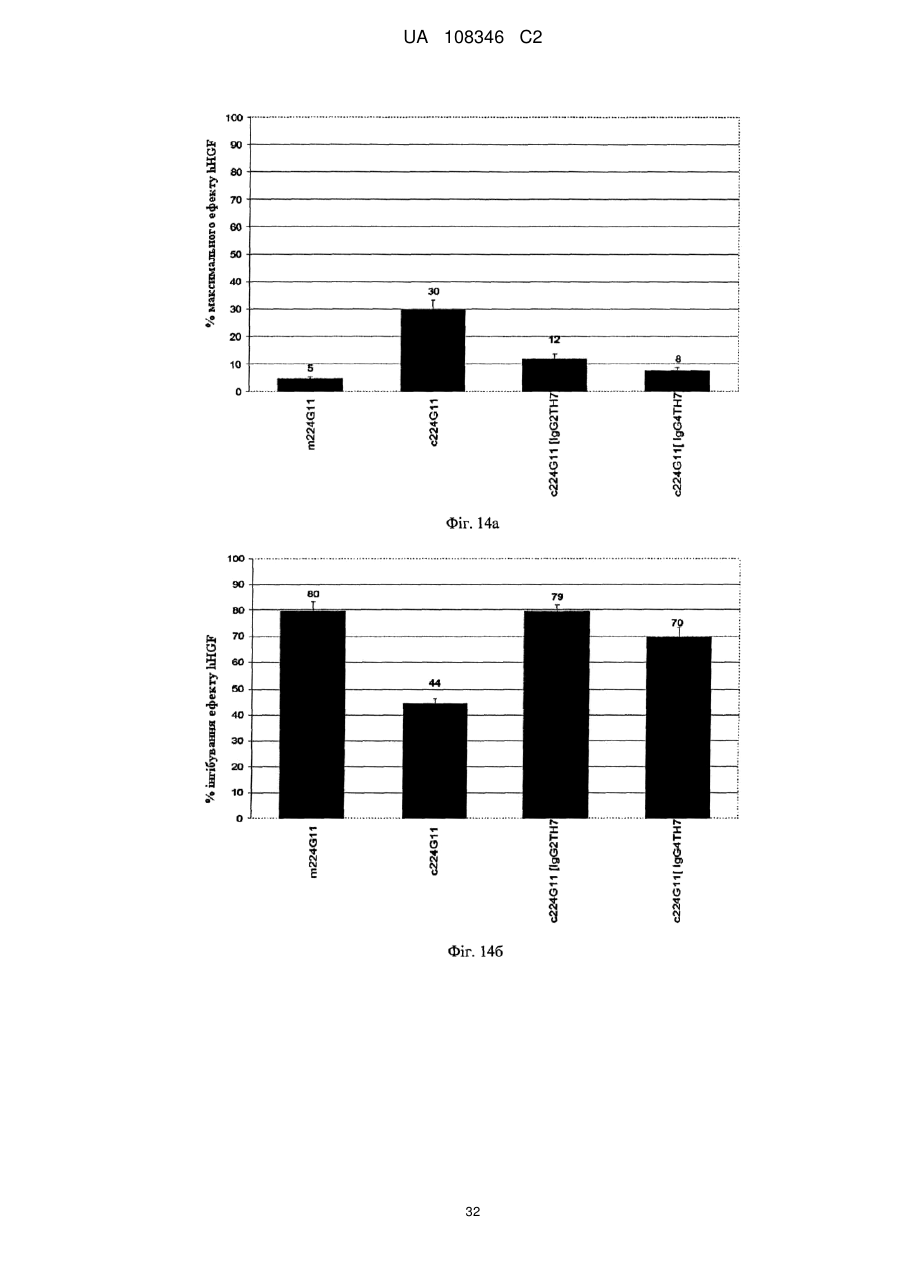
Спосіб модулювання антагоністичної активності моноклонального антитіла
Формула / Реферат
1. Спосіб підвищення антагоністичної активності моноклонального химерного або гуманізованого антитіла, що включає константну область IgG1 людини та націлене проти специфічної молекули-мішені, або його двовалентного функціонального фрагмента, при цьому зазначене антитіло здатне інгібувати одну чи декілька біологічних активностей зазначеної молекули-мішені, де зазначений спосіб включає етап реконфігурації шарнірної області, що полягає у модифікації амінокислотної послідовності зазначеної шарнірної області шляхом видалення, додання або заміни щонайменше однієї амінокислоти, та де зазначена реконфігурована шарнірна область, одержана шляхом модифікації її амінокислотної послідовності, утворює шарнірну область, яка має послідовність, вибрану з групи, що складається з послідовностей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 23 - SEQ ID NO: 26, SEQ ID NO: 36 та SEQ ID NO: 42 - SEQ ID NO: 49.
2. Спосіб за п. 1, де зазначене моноклональне антитіло є двовалентним антитілом.
3. Спосіб за одним із пп. 1 та 2, де зазначена молекула-мішень є трансмембранним рецептором.
4. Спосіб за п. 3, де зазначений трансмембранний рецептор вибраний із групи, що складається з тирозинкіназних рецепторів, тетраспаніну та GPCR (рецепторів, зв'язаних з G білком).
5. Спосіб скринінгу антагоністичного моноклонального химерного або гуманізованого антитіла, що включає константну область IgG1 людини та націлене проти специфічної молекули-мішені, або його двовалентного фyнкціонального фрагмента, при цьому зазначене антитіло здатне інгібувати одну чи декілька біологічних активностей зазначеної молекули-мішені, де зазначений спосіб включає етапи:
(а) вибору вихідного антитіла з вихідним рівнем інгібування зазначеної однієї чи декількох біологічних активностей зазначеної молекули-мішені,
(б) заміни амінокислотної послідовності шарнірної області зазначеного вихідного антитіла за допомогою способу за одним з пп. 1-4,
(в) оцінювання модифікованого антитіла з етапу (б) щодо його здатності інгібувати зазначену одну чи декілька біологічних активностей зазначеної молекули-мішені, і
(г) вибір, як позитивного результату, антитіла з етапу (в) з рівнем інгібування однієї чи декількох біологічних активностей зазначеної молекули-мішені, вищим, ніж вихідний рівень зазначеного інгібування.
6. Moноклональне химерне або гуманізоване антитіло, що включає константну область IgGl людини та націлене проти специфічної молекули-мішені, або його двовалентний функціональний фрагмент, отримуваний за допомогою способу за одним із пп. 1-4, яке характеризується тим, що воно включає амінокислотну послідовність шарнірної області, вибрану з групи, що складається з послідовностей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 23 - SEQ ID NO: 26, SEQ ID NO: 36 та SEQ ID NO: 42 - SEQ ID NO: 49.
7. Виділена нуклеїнова кислота, що кодує моноклональне антитіло за п. 6.
8. Виділена нуклеїнова кислота за п. 7, де зазначена нуклеїнова кислота включає нуклеїнову послідовність, вибрану з групи, що включає SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 51- SEQ ID NO: 54, SEQ ID NO: 64 та SEQ ID NO: 70 - SEQ ID NO: 77.
Текст
Реферат: Винахід стосується способу підвищення антагоністичної активності моноклонального химерного або гуманізованого антитіла, що включає константну область IgG1 людини, та націленого проти специфічної молекули-мішені, або його двовалентного функціонального фрагмента, при цьому зазначене антитіло здатне інгібувати одну чи декілька біологічних активностей зазначеної молекули-мішені, де зазначений спосіб включає етап реконфігурації шарнірної області, що полягає у модифікації амінокислотної послідовності зазначеної шарнірної області шляхом видалення, додання або заміни щонайменше однієї амінокислоти, та де зазначена реконфігурована шарнірна область, одержана шляхом модифікації її амінокислотної послідовності, утворює шарнірну область, яка має послідовність вибрану з групи, що складається з послідовностей SEQ ID № 2, SEQ ID № 4, SEQ ID № 6, SEQ ID № 23- SEQ ID № 26, SEQ ID № 36 та SEQ ID № 42 - SEQ ID № 49. UA 108346 C2 (12) UA 108346 C2 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до галузі розробки антитіл та, конкретніше, до способу скринінгу антитіл, та/або модуляції агоністичної/антагоністичної активності антитіл. Конкретніше, винахід відноситься до способу модуляції антагоністичної активності моноклонального антитіла, або двовалентного функціонального фрагмента, або його похідного за допомогою генної інженерії. Винахід також відноситься до поліпептидів, використовуваних для такого способу модуляції, і до отриманих антитіл. Терміни "антитіло", "антитіла" або "імуноглобулін" використовуються як синоніми у найширшому розумінні, й включають моноклональні антитіла (наприклад, моноклональні антитіла повної довжини або інтактні), поліклональні антитіла, мультивалентні антитіла або мультиспецифічні антитіла (наприклад, біспецифічні антитіла доти, поки вони виявляють необхідну біологічну активність). Зокрема, така молекула є глікопротеїном, що включає щонайменше два важкі (H) ланцюги та два легкі (L) ланцюги, зв'язані один з одним дисульфідними зв'язками. Кожний важкий ланцюг складається з варіабельної області (або домену) важкого ланцюга (скороченої тут як HCVR або VH) і константної області важкого ланцюга. Константна область важкого ланцюга складається з трьох доменів, CH1, CH2 та CH3. Кожен легкий ланцюг складається з варіабельної області легкого ланцюга (скороченої тут як LCVR або VL) і константної області легкого ланцюга. Константна область легкого ланцюга складається з одного домену, CL. Області VH і VL також можна розділити на області гіперваріабельності, називані областями, що визначають комплементарність (CDR), які перемежовуються консервативнішими областями, називаними каркасними областями (framework regions, FR). Кожна VH і VL складається з трьох CDR і чотирьох FR, розташованих від аміно-кінця до карбокси-кінця у такому порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Варіабельні області важкого й легкого ланцюгів включають зв’язуючий домен, що взаємодіє з антигеном. Константні області антитіл можуть опосередковувати зв'язування імуноглобуліну з тканинами або факторами хазяїна, у тому числі з різними клітинами імунної системи (наприклад, ефекторними клітинами) і першим компонентом (C1q) класичної системи комплементу. Важкі ланцюги імуноглобулінів можна розділити на три функціональні області: область Fd, шарнірну область, область Fc (фрагмент, здатний до кристалізації), які з'єднані гнучкою шарнірною областю. Область Fd включає домени VH та CH1 і, у комбінації з легким ланцюгом, утворює Fab - антигензв’язуючий фрагмент. Fc-фрагмент відповідає за ефекторні функції імуноглобуліну, до яких відносяться, наприклад, зв'язування комплементу й зв'язування зі спорідненими Fc-рецепторами ефекторних клітин. Шарнірна область, присутня в імуноглобулінах класів IgG, IgA і IgD, виступає як гнучкий роздільник, що дозволяє Fab-частині вільно переміщатися у просторі відносно Fc-області. На відміну від константних областей, шарнірний домен може мати різну структуру, різнячись серед класів і підкласів імуноглобулінів як за послідовністю, так і за довжиною. За даними кристалографічних досліджень, шарнірну область імуноглобуліну можна також розділити структурно та функціонально на три області: верхню, ядерну й нижню (Shin et al., Immunological Reviews 130:87, 1992). Верхня шарнірна область включає амінокислоти з карбоксильного кінця CH1 до першого залишку шарнірної області, який обмежує рухливість, як правило, першого цистеїнового залишку, що формує міжланцюговий дисульфідний зв'язок між двома важкими ланцюгами. Довжина верхньої шарнірної області корелює із сегментарною гнучкістю антитіла. Ядро шарнірної області включає дисульфідні містки між важкими ланцюгами. Нижня шарнірна область приєднується до аміно-кінця домену СН2, і включає його залишки. Ядро шарнірної області людського IgG1 включає послідовність Cys-Pro-Pro-Cys, що при димеризації шляхом утворення дисульфідних зв'язків приводить до утворення циклічного октапептиду, який, очевидно, виступає як точка опори, забезпечуючи у такий спосіб рухливість. Конформаційні зміни, дозволені структурою й рухливістю поліпептидної послідовності шарнірної області імуноглобуліну, можуть впливати на ефекторні функції Fc-частини антитіла. Як правило, для отримання моноклональних антитіл мишачого походження або їх функціональних фрагментів можна послатися на способи, описані, зокрема, у посібнику "Antibodies" (Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor NY, pp. 726, 1988) або на методики отримання з гібридом, описані Kohler і Milstein (Nature, 256:495-497, 1975). Потім моноклональні антитіла можуть, наприклад, бути очищені на афінних колонках, на яких був заздалегідь іммобілізований рецептор, що становить інтерес, або один з його фрагментів, що включає епітоп, який є специфічно розпізнаваним зазначеними моноклональними антитілами. Зокрема, зазначені моноклональні антитіла можуть бути очищені за допомогою хроматографії на білку А та/або G, після чого проводять, або не проводять іонообмінну хроматографію, націлену на ліквідацію залишкових забруднень білком, а 1 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 також ДНК і ЛПС, проводять або не проводять ексклюзійну хроматографію на сефарозному гелі з метою усунення потенційних агрегатів у зв'язку з наявністю димерів або інших мультимерів. У ще кращому випадку усі ці методики можуть бути використані одночасно або послідовно. Під функціональним фрагментом антитіла за винаходом розуміється, зокрема, фрагмент антитіла, такий як фрагменти Fv, scFv (sc позначає один ланцюг), Fab, F(аb') 2, Fab', scFv-Fc, або димери антитіл чи будь-який фрагмент, час напівжиття якого був збільшений в результаті хімічної модифікації, такої як додання полі(алкілен)гліколю, такого як поліетиленгліколь ("пегилювання") (пегильовані фрагменти називаються Fv-ПЕГ, scFv-ПЕГ, Fab-ПЕГ, F(ab')2-ПЕГ або Fab'-ПЕГ) ("ПЕГ" означає поліетиленгліколь), або шляхом включення в ліпосому; при цьому зазначений фрагмент має щонайменше один характерний CDR вихідного антитіла. Краще, щоб цими функціональними фрагментами були фрагменти типу Fv, scFv, Fab, F(ab')2, F(ab'), scFv-Fc або димерні антитіла, які звичайно мають таку ж специфічність зв'язування, як і антитіло, з якого вони отримані. Відповідно до даного винаходу, фрагменти антитіла за винаходом можуть бути отримані з антитіл описаними вище способами, такими як розщеплення ферментами, такими як пепсин або папаїн, та/або розщеплення дисульфідних містків шляхом хімічного відновлення. В іншому випадку фрагменти антитіла можуть бути отримані за допомогою методик генетичної рекомбінації, також відомих фахівцям у даній галузі, або шляхом пептидного синтезу, наприклад - за допомогою автоматичних пептидних синтезаторів які, наприклад, поставляються компанією Applera, і т.д. Термін "антагоніст", використовуваний в даному документі, відноситься до молекули, яка здатна інгібувати одну чи декілька біологічних активностей молекули-мішені, наприклад позаклітинного або трансмембранного рецептора. Антагоністи можуть діяти, впливаючи на зв'язування рецептора з лігандом і, навпаки, шляхом зменшення фосфорилування рецептора, та/або шляхом виведення або знищення клітин, які були активовані лігандом. Антагоніст може повністю блокувати взаємодії рецептор-ліганд, або може суттєво знизити такі взаємодії за рахунок конкуренції, зміни конформації, випадання або знижувальної регуляції. Усі такі точки впливу антагоніста розглядаються як еквівалентні для цілей даного винаходу. Термін "агоніст", використовуваний в даному документі, відноситься до будь-якої сполуки, у тому числі білка, поліпептиду, пептиду, антитіла, фрагмента антитіла, кон’югата, великої молекули, невеликої молекули, здатної активувати одну чи декілька біологічних активностей молекули-мішені. У дослідженні терапевтичних антитіл часто очікується присутність антитіл як антагоністів, якщо це можливо. Класичними прикладами антагоністичних антитіл є антитіла герцептин, пертузумаб, цетуксимаб, анти-VEGFR або анти-IGF-1R. Як окремий приклад можна зазначити анти-с-Met-антитіло 5D5, створене Genentech [WO 96/38557], яке виявляє себе на різних моделях як потужний агоніст при введенні його одного. Для того, щоб вирішити цю технічну проблему, це антитіло було розроблено як Fab-фрагмент або як моновалентне антитіло (5D5 з однією гілкою), що має антагоністичну активність. Як наслідок, таке антитіло може розглядатися не як антитіло, а як фрагмент, і воно не показує усіх переваг формату "повного антитіла" (немає ефекторних функцій, знижені кліренс та період напівжиття [у два рази швидше, ніж традиційні двовалентні антитіла, описані на стендовій доповіді 411 на 20-му симпозіумі EORTC-NCI-AACR, Женева, 21-24 жовтня, 2008]). Фахівцеві в даній галузі буде зрозуміло, що ефекторні функції включають, наприклад, C1qзв'язування; комплемент-залежну цитотоксичність (complement dependent cytotoxicity, CDC), Fcрецепторне зв'язування; антитіло-залежну клітинну цитотоксичність (antibody-dependent cellmediated cytotoxicity, ADCC); фагоцитоз; і негативну регуляцію рецепторів клітинної поверхні (наприклад, В-клітинний рецептор, BCR) та подовження періоду напівжиття шляхом включення "ліганду зв'язування рятувального рецептора" (FcRn), описаного, наприклад, у патенті США № 5739277 від 14 квітня 1998 р. Одним із пропонованих аспектів даного винаходу є вирішення таких технічних проблем, тобто посилення антагоністичної активності антитіла при збереженні "повного двовалентного" формату. Тут слід зазначити, що винахід можна застосувати до модуляції агоністичної/антагоністичної активності людських антитіл, отриманих шляхом імунізації "олюднених мишей" (генетично модифікованих мишей, які продукують імуноглобуліни людини) або з використанням методик фагового дисплея для створення цілих антитіл з вибраних scFv, Fab, або будь-яких інших еквівалентних фрагментів. Інша класична технічна проблема може бути вирішена шляхом химеризації та/або гуманізації мишачого антитіла. Фахівцям у даній галузі добре відомо, що якщо процес 2 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 химеризації та/або гуманізації мишачого антитіла в теорії дуже простий, то не так легко керувати химеризацією та/або гуманізацією такого мишачого антитіла без втрати усіх або частини первинних властивостей. Химерне або гуманізоване антитіло може втратити частину його ADCC, CDC, антагоністичної/агоністичної, зв'язувальної, (TBC) ... активності. Даний винахід стосується, зокрема, модифікації агоністичної/антагоністичної активності мишачого антитіла після процесу химеризації та/або гуманізації. Як конкретний приклад наведений ряд анти-cMet антитіл, описаних нижче як 224G11, 2274H1 і 11E1, що діють як потужні антагоністичні мишачі антитіла, і які стали частковими агоністами після химеризації по формату людського IgG1. Цей перехід від потужних антагоністів до часткових агоністів призвів до повної втрати активності in vivo на моделях із ксенотрансплантатом. Даний винахід призначений для вирішення цих проблем і відноситься, зокрема, до способу підвищення антагоністичної активності моноклонального антитіла, націленого проти специфічної молекули-мішені, або двовалентного функціонального фрагмента чи його похідного, при цьому зазначене антитіло здатне інгібувати одну чи декілька біологічних активностей зазначеної молекули-мішені, де зазначений спосіб включає стадію реконфігурації шарнірної області, що полягає у модифікації амінокислотної послідовності зазначеної шарнірної області шляхом видалення, додання або заміни щонайменше однієї амінокислоти. Зрозуміло, що вислів "посилення антагоністичної активності" слід розуміти в його найширшому змісті, тобто як бажаний результат. Механістично, такий результат може бути отриманий шляхом посилення внутрішньої антагоністичної активності та/або зниження внутрішньої агоністичної активності антитіла. Зокрема, основні визначення термінів у кількісній фармакології базуються на оновлених рекомендаціях, наданих Комітетом з номенклатури рецепторів Міжнародного союзу фармакології (IUPHAR) (див. Neubig et al., 2003). Термін "агоніст" позначає ліганд (будь-який тип молекул), який зв'язується з рецептором та змінює стан рецептора, що приводить до стимулювання або підвищеної біологічної реакції. Агоністи можуть діяти як повні агоністи, або як часткові агоністи: - Повний агоніст: коли рецепторний стимул, індукований агоністом, досягає максимального реагування системи, то він викликає системну максимальну реакцію та стає повним агоністом у цій системі. Декілька агоністів можуть викликати таку ж максимальну відповідь, усі вони є повними агоністами в цій експериментальній системі. - Частковий агоніст: молекула, яка в тій або іншій тканині за певних умов не може викликати такого великого ефекту (навіть тоді, коли застосовується у високій концентрації, так що всі рецептори мають бути зайняті), який може викликати повний агоніст, що діє через ті ж рецептори у цій самій системі. Часткові агоністи, як правило, є також частковими антагоністами, тому що за одночасної присутності повного агоніста вони знижують максимальну реакцію зазначеного повного агоніста до їх власної максимальної відповіді. Це позначення повного та часткового агоніста залежить від системи, і повний агоніст для однієї системи або виміру може бути частковим агоністом для іншої. Термін "антагоніст" позначає молекулу, яка зменшує дію іншого лікарського препарату, як правило, агоніста. Багато антагоністів діють на ту ж рецепторну макромолекулу, що й агоніст. - Ефективність антагонізму може бути повним антагонізмом, де реакція системи за одночасної присутності антагоніста та агоніста відповідає базальній (без будь-якого ліганду) активності системи. - Антагоніст може діяти як частковий антагоніст, коли максимальне інгібування (навіть тоді, коли застосовується у високій концентрації, так що всі рецептори повинні бути зайняті антагоністом), викликане одночасною присутністю антагоніста та агоніста, є вищим за базальну активність системи. - Антагонізм може бути конкурентним, коли зв'язування агоніста та антагоніста є взаємовиключним. Це може бути спричинено тим, що агоніст та антагоніст конкурують за той самий сайт зв'язування, або об’єднуються із суміжними сайтами, що перекриваються. Третя можливість полягає в тому, що беруть участь різні сайти, але вони впливають на рецепторні макромолекули у такий спосіб, що агоністичні та антагоністичні молекули не можуть бути зв'язані одночасно. - Неконкурентний антагонізм спостерігається, коли агоніст і антагоніст можуть бути зв'язані з рецептором одночасно; зв'язування з антагоністом зменшує або запобігає дії агоніста з, або без будь-якого впливу на зв'язування агоніста. Видалення, додання або заміна можуть бути проведені класично у будь-який спосіб, відомий фахівцям. 3 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 Деякі способи можуть бути застосовані фахівцем для виконання додання, видалення або вставлення у дану послідовність ДНК. Без обмежень, можна зазначити часткове розщеплення ДНК підшлунковою ДНКазою I, часткове розщеплення ДНК ферментами рестрикції, базовані на лінкері інсерційні мутанти, вкладені набори делеційних мутантів за допомогою нуклеази BAL31, ДНКази I або екзонуклеази III. Ці способи широко описані в лабораторних посібниках, таких як Molecular Cloning, A laboratory manual (Sambrook, Fritsch and Maniatis). Для виконання видалення, вставлення або сайт-націленого мутагенезу в молекулі ДНК також можуть бути використані декілька базованих на ПЛР способів, таких як ПЛР із перекривними праймерами (overlap extension PCR) (Wurch et al., 1998), але не обмежуючись ним. Для виконання сайтнаціленого мутагенезу можуть бути використані деякі інші методики, наприклад, але без обмеження ними, можна згадати мутагенез за допомогою олігонуклеотидів на основі одного або двох праймерів, спосіб Кункеля, базований на вбудовуванні урацилу (Kunkel, 1985). Ці способи широко описані в лабораторних посібниках, таких як Molecular Cloning, A laboratory manual (Sambrook, Fritsch and Maniatis). Як необмежуючий приклад додання, можна відзначити додання проліну у шарнірну область, або поруч із нею. У кращому втіленні способу за винаходом зазначена модифікація вибрана з: i) видалення щонайменше однієї амінокислоти із зазначеної амінокислотної послідовності шарнірної області, та/або ii) додання щонайменше одного дисульфідного містка до зазначеної шарнірної області. Для того, щоб внести ясність у винахід, спочатку буде докладно описаний перший аспект (i), а потім другий аспект (ii). Слід розуміти, що це впорядкування зроблене тільки для написання даної заявки, і що обидва ці аспекти, як буде очевидно далі, мають однакову важливість. У окремому втіленні спосіб зміни амінокислотної послідовності шарнірної області буде полягати у видаленні не більше ніж 2, 3 або 4 амінокислот із зазначеної амінокислотної послідовності шарнірної області. Окремим аспектом винаходу є те, що зазначене моноклональне антитіло є двовалентним антитілом. Дійсно, як показано нижче, можна модулювати агоністичну/антагоністичну активність антитіла, змінюючи структуру зазначеного антитіла. У перший раз винахідники пропонують оригінальний спосіб модуляції такої агоністичної/антагоністичної активності зі збереженням двовалентної форми антитіл, націлений на збереження сприятливих властивостей, таких як тривалий період напівжиття або ефекторні функції. Тут також можна згадати, що якщо про зміну шарнірної області моноклонального антитіла з метою підвищення ефекторних функцій вже повідомлялося на даному рівні техніки, то, навпаки, ніколи не повідомлялося, що така зміна у шарнірній області може становити інтерес для модуляції агоністичної/антагоністичної активності моноклонального антитіла. Це, безсумнівно, є предметом даного винаходу, який є новим і винайденим по відношенню до сучасного рівня техніки. Як аспект згідно зі способом за винаходом, моноклональне антитіло є химерним антитілом. Під "химерним антитілом" розуміється антитіло, яке включає природну варіабельну ділянку (легкого ланцюга та важкого ланцюга), отриману з антитіла даного виду, у комбінації з константними ділянками легкого ланцюга та важкого ланцюга антитіла виду, гетерологічного зазначеному даному виду (наприклад, миші, коня, кролика, собаки, корови, курки і т.д.). Антитіла, або їх фрагменти химерного типу за винаходом можуть бути отримані за допомогою методик генетичної рекомбінації. Наприклад, химерне антитіло може бути отримане шляхом клонування рекомбінантної ДНК, яка включає промотор і послідовність, що кодує варіабельну область нелюдського, краще мишачого, моноклонального антитіла за винаходом, і послідовність, що кодує константну ділянку людського антитіла. Химерне антитіло за винаходом, закодоване таким рекомбінантним геном, буде, наприклад, химерою миші та людини, при цьому специфічність цього антитіла буде визначатися варіабельною ділянкою, отриманою з мишачої ДНК, а його ізотип буде визначатися константною ділянкою, отриманою з людської ДНК. Для способів отримання химерних антитіл можна послатися, наприклад, на Verhoeyn et al. (Bioessays, 8:74, 1988), Morrison et al. (Proc. Natl. Acad. Sci. USA 82:6851-6855, 1984) або на патент США № 4816567. Як інший аспект відповідно до способу за винаходом, моноклональне антитіло є гуманізованим антитілом. Під "гуманізованим антитілом" розуміється антитіло, що включає CDR-ділянки, отримані з антитіла нелюдського походження, при цьому інші частини молекули антитіла отримані з одного (або декількох) людських антитіл, або зародкових послідовностей. Крім того, деякі залишки сегментів скелета (називані FR, каркасні ділянки) можуть бути змінені з метою збереження 4 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 афінності зв'язування (Jones et al., Nature, 321:522-525, 1986; Verhoeyen et al., Science, 239:1534-1536, 1988; Riechmann et al., Nature, 332:323-327, 1988). Гуманізовані антитіла за винаходом, або їх фрагменти можуть бути отримані за допомогою методик, відомих фахівцям у даній галузі (наприклад таких, що описані в документах Singer et al., J. Immun. 150:2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10: 1-142, 1992; і Bebbington et al., Bio/Technology, 10:169-175, 1992). Іншим способом гуманізації, також відомим фахівцям у даній галузі є, наприклад, спосіб "CDR-щеплення", описаний Protein Design Lab (PDL) у патентних заявках EP 0451261, EP 0682040, EP 09127, EP 0566647 або US 5530101, US 6180370, US 5585089 і US 5693761. Також можна зазначити такі патентні заявки: US 5639641; US 6054297; US 5886152 і US 5877293. Як інший аспект відповідно до способу за винаходом, моноклональне антитіло є людським антитілом. Термін "людське антитіло" включає усі антитіла, що мають одну чи декілька варіабельних та константних областей, отриманих з людських імуноглобулінових послідовностей. У кращому втіленні всі варіабельні та константні домени (або області) отримані з людської імуноглобулінової послідовності (повного людського антитіла). Інакше кажучи, він включає будьяке антитіло, у якому варіабельні та константні області (якщо є) отримані з людських зародкових імуноглобулінових послідовностей, тобто яке має амінокислотну послідовність, що відповідає послідовності антитіла, продукованого людиною, та/або виробленого за допомогою будь-яких методик отримання людських антитіл, відомих фахівцям у даній галузі. В одному втіленні людські моноклональні антитіла продуковані гібридомою, яка містить Вклітину, отриману з трансгенної тварини (не людини), наприклад трансгенної миші, що має геном із трансгеном людського важкого ланцюга та трансгеном легкого ланцюга, злиту з іморталізованою клітиною. TM Як приклад такої трансгенної миші, можна зазначити XENOMOUSE , яка є розробленою мишачою лінією, що складається з великих фрагментів людських імуноглобулінових локусів, та є дефіцитною з продукування мишачого антитіла (Green at al., 1994, Nature Genetics, 7:13-21). TM XENOMOUSE продукує набір повних антитіл дорослої людини, а також утворює антигенTM специфічні людські моноклональні антитіла. Друге покоління XENOMOUSE включає приблизно 80% репертуару антитіл людини (Green & Jakobovits, 1998, J. Exp. Med., 188:483495). Для створення людського антитіла за винаходом також може бути використана будь-яка інша методика, відома фахівцям у даній галузі, така як методика фагового дисплея. Спосіб за винаходом може бути використаний для будь-якого типу імуноглобуліну, що включає шарнірну область, тобто для IgA, IgD та IgG. Як приклад, для ізотипу IgA шарнірна область IgA1 включає амінокислотну послідовність PSTPPTPSPSTPPTPSPS (SEQ ID № 8), а шарнірна область IgA2 включає амінокислотну послідовність PPPPP (SEQ ID № 9). Так само, шарнірна область IgD включає амінокислотну послідовність SPKAQASSVPTAQPQAEGSLAKATTAPATTRNTRGGEEKKKEKEKEEQEERETKTP (SEQ ID № 10). У окремому втіленні винаходу краще застосовувати IgG, у тому числі, наприклад, IgG1, IgG2, IgG3 або IgG4. Амінокислотними послідовностями, що відповідають шарнірним областям різних ізотипів IgG, є: PKSCDKTHTCPPCP (SEQ ID № 11) для IgG1, RKCCVECPPCP (SEQ ID № 7) для IgG2, LKTPLFTGDTTHTCPRCPEPKSCDTPPPCPRCPEPKSCDTPPPCPRCPEPKSCDTPPPCPRCP (SEQ ID № 12) для IgG3, і SKYGPPCPSCP (SEQ ID № 13) для IgG4. Ще конкретніше, краще використовувати IgG1. Дійсно, у галузі терапевтичних антитіл, та зокрема у лікуванні раку кращим є створення IgG1 для отримання ефекторних функцій, таких як ADCC і CDC, на додаток до функцій, пов'язаних зі специфічним зв'язуванням цільового антигену. Спосіб за винаходом характеризується тим, що зазначене моноклональне антитіло є IgG1. Поняття "молекула-мішень" у рамках винаходу відноситься до будь-якої молекули, з якою моноклональне антитіло здатне специфічно зв'язуватися або модулювати активність. Як правило, така молекула-мішень може бути названа "антигеном". Як необмежуючий приклад молекули-мішені, яка може стати мішенню моноклонального антитіла, можна згадати розчинні ліганди, рецептори, такі як трансмембранні рецептори, мембранні пухлинні маркери і т.д. 5 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 У кращому втіленні зазначена молекула-мішень є трансмембранним рецептором. Вислів "трансмембранний рецептор" відноситься до білка, що проходить через плазматичну мембрану клітини, з позаклітинним доменом білка, здатним зв'язуватися з лігандом, і внутрішньоклітинним доменом з активністю (такою як протеїнкіназна), яка може змінитися (збільшитися чи зменшитися) при зв'язуванні ліганду. Інакше кажучи, трансмембранні рецептори є інтегральними мембранними білками, які знаходяться і звичайно працюють у клітинній плазматичній мембрані, а також у мембранах деяких субклітинних компартментів та органел. Зв'язуючись із сигнальною молекулою, або іноді з парою таких молекул з одного боку мембрани, трансмембранні рецептори викликають відповідь з іншого боку. Таким чином, вони відіграють унікальну та важливу роль у зв'язуванні клітин та передачі сигналу. Багато трансмембранних рецепторів складаються з двох чи більше білкових субодиниць, що діють спільно та можуть дісоціювати, відпадати, коли зв'язують ліганди, або на іншому етапі їх циклів "активації". Вони часто класифікуються за їх молекулярною структурою або, через те що структура детально невідома для усіх рецепторів, крім декількох, класифікуються за їх можливою (а іноді та експериментально перевіреною) мембранною топологією. Поліпептидні ланцюги найпростіших, імовірно, перетинають біліпідний шар тільки один раз, тоді як інші перетинають його більшу кількість разів, наприклад, сім разів (так звані рецептори, зв'язані з Gбілком, або GPCR) або більше. Як і будь-який інтегральний мембранний білок, трансмембранний рецептор може бути розділений на три частини або домени, позаклітинний домен, трансмембранний домен і внутрішньоклітинний домен. Позаклітинний домен є частиною рецептора, яка виступає з мембрани із зовнішнього боку клітини або органели. Якщо поліпептидний ланцюг рецептора перетинає бішар декілька разів, зовнішній домен може складатися з декількох "петель", що виступають з мембрани. За визначенням, основною функцією рецептора є розпізнавання та відповідь на специфічний ліганд, наприклад, медіатор або гормон (хоча деякі рецептори відповідають також на зміни трансмембранного потенціалу), і в багатьох рецепторах ці ліганди зв'язуються з позаклітинним доменом. У більшості рецепторів, для яких доведена структура, трансмембранні альфа-спіралі складають більшу частину трансмембранного домену. У деяких рецепторах, таких як нікотиновий ацетилхоліновий рецептор, трансмембранний домен формує зв'язану з білком пору через мембрану, або іонний канал. Після активації позаклітинного домену шляхом зв'язування відповідного ліганду пора стає доступною для іонів, які потім проходять крізь неї. В інших рецепторах трансмембранні домени можливо зазнають конформаційних змін при зв'язуванні, що чинить вплив усередині клітини. У деяких рецепторах, таких як члени надродини 7TM, трансмембранний домен може включати ліганд-зв’язуючу кишеню. Внутрішньоклітинний (або цитоплазматичний) домен рецептора взаємодіє з внутрішньою частиною клітини або органели, ретранслюючи сигнал. Є два принципово різні способи цієї взаємодії а) внутрішньоклітинний домен здійснює зв'язок шляхом специфічних білок-білкових взаємодій з ефекторними білками, які у свою чергу посилають сигнал по сигнальному ланцюгу до місця призначення, та б) у фермент-зв'язаних рецепторів внутрішньоклітинний домен має ферментативну активність. Часто це тирозинкіназна активність. Ферментативна активність також може бути розміщена на ферменті, зв'язаному із внутрішньоклітинним доменом. У клітини є декілька способів регулювати активність трансмембранного рецептора. Більшість із них діють через внутрішньоклітинний домен. Найбільш важливими способами є фосфорилування та інтерналізація (див. убіквітин) або активація каскадів вторинних 2+ посередників, таких як цАМФ, IP, Ca або цГМФ. Усі мембранні білки, що демонструють ферментативну активність, також можуть бути мішенню для антитіл з модифікацією, описаною в даному винаході. Можна згадати як приклади, але без обмежень, родину матричних металопротеїназ (MMP), родину "дезінтегринів у комплексі з металопротеазними доменами" (ADAM), аденілатциклази, ... Усі мембранні білки, що діють як іонні канали, пори та переносники, також можуть бути мішенню для антитіл з модифікацією, описаною в даному винаході. Можна згадати як приклади, але без обмежень, родину натрієвих каналів, родину калієвих каналів, родину нікотинових ацетилхолінових рецепторів, сігма-рецептори, родину транспортерів моноамінів. У більш широкому розумінні всі мембранні білки, ідентифіковані як специфічні маркери для даного захворювання, також можуть бути мішенню для лікування антитілом, при цьому антитіло також може бути поліпшене шляхом модифікацій, описаних в даному винаході. У кращому втіленні винаходу зазначений трансмембранний рецептор вибраний з групи, що складається з тирозинкіназних рецепторів, тетраспаніну та GPCR. 6 UA 108346 C2 5 10 15 20 25 30 35 40 45 У ще кращому втіленні зазначений трансмембранний рецептор є тирозинкіназним рецептором, вибраним у кращому випадку з групи, що складається з IGF-1R, с-Met, RON, Axl, VEGF, VEGFR, Her-2neu, гомодимерів та гетеродимерів родини ErbB і т.д. У даній заявці, і зокрема у подальшому описі, послідовності будуть визначені відповідно до визначення IMGT. Унікальна нумерація IMGT була створена для порівняння варіабельних доменів незалежно від антигенного рецептора, типу ланцюга або виду [Lefranc M.-P., Immunology Today 18, 509 (1997) / Lefranc M.-P., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P., Pommié, C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В унікальній нумерації IMGT консервативні амінокислоти завжди займають одну й ту саму позицію, наприклад цистеїн 23 (1-CYS), триптофан 41 (CONSERVED-TRP), гідрофобна амінокислота 89, цистеїн 104 (2-CYS), фенілаланін або триптофан 118 (J-PHE або J-TRP). Унікальна нумерація IMGT передбачає стандартизоване розмежування каркасних ділянок (FR1-IMGT: позиції 1-26, FR2-IMGT: 39-55, FR3-IMGT: 66-104 і FR4-IMGT: 118-128) та ділянок, що визначають комплементарність: CDR1IMGT: 27-38, CDR2-IMGT: 56-65 і CDR3-IMGT: 105-117. Оскільки розриви є незайнятими позиціями, то довжини CDR-IMGT (показані в дужках і розділені крапками, наприклад [8.8.13]) стають важливою інформацією. Унікальна нумерація IMGT використовується в 2D-графічному відображенні, позначеному як IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002) / Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], і в 3D-структурах в IMGT/3Dstructure-db [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)]. Для фахівця в даній галузі буде легко перевести винахід, описаний відповідно до системи IMGT, у будь-яку іншу систему нумерації, таку як, наприклад, система нумерації Кабата. Унікальна нумерація IMGT для всіх IG і TR V-областей усіх видів ґрунтується на високій консервативності структури варіабельної області. Ця нумерація, створена після вирівнювання більше ніж 5000 послідовностей, враховує та поєднує визначення каркасної області (FR) та області, що визначає комплементарність (CDR), структурні дані досліджень рентгенівської дифракції та характеристику гіперваріабельних петель. Було проведено встановлення границь областей FR-IMGT і CDR-IMGT. Так само, унікальна нумерація IMGT була застосована для Сдомену та дозволила точно розмежувати Ig-подібні домени. С-домен відповідає повній Собласті, більшій частині C-області або тільки частині C-області, залежно від типу імуноглобуліну (IG). Нумерація IMGT для С-домену (IG і TR) була одержана як унікальна нумерація IMGT для Vобласті за принципами унікальної нумерації IMGT для V-області до позиції 104. Таким чином, можна легко порівняти амінокислотні позиції у С-домені та V-домені. Щоб точно визначити шарнірну область, нумерація IMGT C-домену була застосована для точної локалізації доменів CH1 і CH2. Шарнірна область включає всі амінокислотні залишки між останнім залишком IMGT-CH1 і першим залишком IMGT-CH2. Усі інші схеми нумерації імуноглобулінів, наприклад, Кабата або А. Онеггера, для того самого шарнірного домену, включені в даний винахід. Як кращий приклад винаходу, основаного на описаній вище системі нумерації IMGT, амінокислотна послідовність шарнірної області IgG1 включає залишки H1-H14 із сегментом H1H9, що відповідає верхній шарнірній області, та сегментом H10-Н14, що відповідає ядру шарнірної області. Конкретніше, людська IgG1 шарнірна область складається з амінокислотної послідовності PKSCDKTHTCPPCP (SEQ ID № 11), а мишача IgG1 шарнірна область складається з амінокислотної послідовності PRDCGCKPCICT (SEQ ID № 14). Таблиця 1 Шарнірна область Нумерація Верхня H1 H2 H3 H4 H5 H6 H7 H8 H9 Hu-IgG1 (SEQ ID № 11) P K S C D K T H T Mu-IgG1 (SEQ ID № 14) P R D C G C K P 7 Hu-IgG2 (SEQ ID № 7) R K C C V E Hu-IgG4 (SEQ ID № 11) S K Y G P P UA 108346 C2 Продовження таблиці 1 Ядерна 5 10 15 20 25 30 35 40 45 50 H10 H11 H12 H13 H14 C P P C P C I C T C P P C P C P S C P У кращому втіленні винаходу розглядається модифікація, націлена на зменшення довжини білкової послідовності, що кодує шарнірну область двовалентного антитіла. Зокрема, спосіб за винаходом включає етап видалення щонайменше однієї амінокислоти у шарнірній області. Як згадувалося раніше, кращим є видалення не більш ніж двох амінокислот зазначеної шарнірної області. Як згадувалося раніше, кращим є видалення не більш ніж трьох амінокислот зазначеної шарнірної області. Як згадувалося раніше, кращим є видалення не більш ніж чотирьох амінокислот зазначеної шарнірної області. У окремому застосуванні способу за винаходом модифікація полягає щонайменше у видаленні амінокислоти, вибраної з амінокислот на позиціях H1, H2, H3, H5, H6, H7, H8, H9, H11, H12 або H14. Конкретніше, автори винаходу продемонстрували включення конкретного залишку, і конкретний аспект винаходу полягає у виборі певних залишків. У кращому випадку IgG1 амінокислота в позиції H1 є проліном; амінокислота в позиції H2 є лізином в людській версії та аргініном у мишачій версії; амінокислота в позиції H3 є серином у людській версії та аспартатом у мишачій версії; амінокислота в позиції H5 є аспартатом у людській версії та гліцином у мишачій версії; амінокислота у позиції Н6 є лізином; амінокислота в позиції H8 є гістидином у людській версії та лізином в мишачій версії; амінокислота в позиції H9 є треоніном у людській версії та проліном у мишачій версії; амінокислота в позиції H11 є проліном у людській версії та ізолейцином у мишачій версії; і амінокислота у позиції Н12 є проліном у людській версії. Відповідно до кращого втілення це видалення повинно бути зроблене у "верхній шарнірній" області. У ще кращому втіленні це видалення є частиною "верхньої шарнірної" області, що складається, наприклад, для IgG1 з амінокислот H1-H9 порівняно з "ядерною шарнірною" областю, що складається з амінокислот H10-H14. У даній заявці нумерація амінокислот здійснюється за системою IMGT, описаною вище. Очевидно, що будь-яка інша система нумерації з модифікацією нумерації, але не природи заміщеного залишку в шарнірній області, повинна розглядатися як еквівалентна. Як приклад, зміна нумерації ідентифікованої амінокислотної частини винаходу (відповідно до системи IMGT) за системою Кабат повинна розглядатися як еквівалент. Інший аспект винаходу оснований на видаленні щонайменше одного цистеїну з "верхньої шарнірної" області, який у кращому випадку знаходиться в позиції H4. Інший аспект винаходу оснований на доданні щонайменше одного дисульфідного містка до шарнірної області. Конкретніше, спосіб за винаходом характеризується тим, що модифікація полягає у введенні щонайменше одного цистеїну до "верхньої шарнірної" області. За словами винахідників, правдоподібне пояснення основане на імовірності збільшення "жорсткості" шарніру в результаті або скорочення довжини, та/або введення іншого дисульфідного містка. Таке збільшення "жорсткості" дозволить підтримувати відповідну просторову конформацію антитіла з підвищеною, як наслідок, антагоністичною активністю. Зрозуміло, що будь-який спосіб, націлений на збільшення жорсткості шарнірної області, слід розглядати як спосіб, еквівалентний способу відповідно до даного винаходу. Введення цистеїну може бути зроблене шляхом додання такої амінокислоти, при цьому зазначене додання проводиться будь-яким способом, відомим фахівцеві в даній галузі. Інший кращий спосіб введення цистеїну в шарнірну область полягає у заміні щонайменше однієї амінокислоти. Конкретніше, кращий спосіб введення цистеїну в шарнірну область полягає у заміні щонайменше амінокислоти, вибраної з H1-H9. Така заміна може бути зроблена будь-яким способом, відомим фахівцям. 8 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 Конкретніше, спосіб за винаходом включає заміну треоніну в позиції H7 у "верхній шарнірній" області цистеїном. В іншому втіленні спосіб за винаходом включає заміну лізину в позиції H6 у "верхній шарнірній" області цистеїном. У ще одному втіленні спосіб за винаходом включає заміну проліну в положенні H1 у "верхній шарнірній" області цистеїном. У ще одному втіленні спосіб за винаходом включає заміну лізину в позиції H2 у "верхній шарнірній" області цистеїном. У ще одному втіленні спосіб за винаходом включає заміну серину в позиції H3 у "верхній шарнірній" області цистеїном. У ще одному втіленні спосіб за винаходом включає заміну аспартату в позиції H5 у "верхній шарнірній" області цистеїном. У ще одному втіленні спосіб за винаходом включає заміну гістидину в позиції H8 у "верхній шарнірній" області цистеїном. У ще одному втіленні спосіб за винаходом включає заміну треоніну в позиції H9 у "верхній шарнірній" області цистеїном. Відповідно до іншого втілення, також можна зменшити довжину шарнірної області, та/або додати дисульфідний місток, змінюючи всю амінокислотну послідовність, що кодує шарнірну область. Як кращий приклад, зміна способу за винаходом включає заміну амінокислот H1-Н14 з шарнірної області IgG1 амінокислотами H1-Н14 з шарнірної області IgG2, краще, коли зазначене моноклональне антитіло, антагоністичну активність якого необхідно поліпшити, є антитілом IgG1. В іншому аспекті винахід відноситься до способу вибору антагоністичного моноклонального антитіла, націленого проти специфічної молекули-мішені, або двовалентного функціонального фрагмента чи його похідного, при цьому зазначене антитіло здатне інгібувати одну чи декілька біологічних активностей зазначеної молекули-мішені, де зазначений спосіб включає етапи: (a) вибору початкового антитіла з початковим рівнем інгібування зазначеної однієї чи декількох біологічних активностей зазначеної молекули-мішені, (б) заміни амінокислотної послідовності шарнірної області зазначеного вихідного антитіла за допомогою способу за винаходом, (в) оцінювання модифікованого антитіла з етапу (б) з погляду його здатності інгібувати зазначену одну чи декілька біологічних активностей зазначеної молекули-мішені, і (г) вибору, як позитивного результату, антитіла з етапу (в) з більш високим рівнем інгібування зазначеної однієї чи декількох біологічних активностей зазначеної молекули-мішені, ніж вихідний рівень зазначеного інгібування. Вихідні антитіла можуть бути вибрані з існуючих антитіл, таких як, але без обмеження ними, антитіла-антагоністи до IGF-1R, с-Met, RON, Axl, CD151, VEGF, VEGFR, Her-2neu, гомодимери та гетеродимери родини ErbB. У необмежуючому кращому прикладі зазначені вихідні антитіла можуть складатися з герцептину, пертузумабу, цетуксимабу, анти-VEGFR або анти-IGF-1R антитіл. "Інгібувальний рівень" за винаходом ілюструє антагоністичну активність антитіла. Такий інгібувальний рівень може бути визначений будь-яким способом, відомим фахівцеві в даній галузі, таким як, без обмежень ними: а) прямим підрахунком клітин або з використанням 3 [H]тимідину, солей тетразолію або будь-яких інших флуоресцентних засобів для оцінювання проліферації, б) вестерн-блотингом, фосфо-ІФА або альфа-скринінговим аналізом для контролю передачі сигналу, в) аналізом BRET або FRET для аналізу димеризації, г) мікроскопією або флуоресцентними способами контролю міграції, інвазії, ангіогенезу або морфогенезу та e) вимірюванням розміру пухлини для оцінювання in vivo. Цей скринінговий спосіб може бути використаний для покращення підтверджених антитіл, або як відбірковий етап для наукових чи доклінічних досліджень антитіл. Інший аспект за винаходом відноситься до моноклонального антитіла, націленого проти специфічної молекули-мішені, або до двовалентних функціональних фрагментів або їх похідних, отримуваних за допомогою способу за винаходом, при цьому зазначене антитіло характеризується тим, що воно включає амінокислотну послідовність шарнірної області, вибрану з групи, що складається з SEQ ID № 1 (PRDCGCKPCICT), SEQ ID № 2 (PKSCGCKPCICT), SEQ ID № 3 (PKSCGCKPCICP), SEQ ID № 4 (PRDCGCKPCPPCP), SEQ ID № 5 (PRDCGCHTCPPCP), SEQ ID № 6 (PKSCDCHCPPCP), SEQ ID № 7 (RKCCVECPPCP), SEQ ID № 22 (CKSCDKTHTCPPCP), SEQ ID № 23 (PCSCDKTHTCPPCP), SEQ ID № 24 (PKCCDKTHTCPPCP), SEQ ID № 25 (PKSCCKTHTCPPCP), SEQ ID № 26 (PKSCDCTHTCPPCP) 9 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID № 27 (PKSCDKCHTCPPCP), SEQ ID № 28 (PKSCDKTCTCPPCP), SEQ ID № 29 (PKSCDKTHCCPPCP), SEQ ID № 30 (PKSCDKTHTCCPCP), SEQ ID № 31 (PKSCDKTHTCPCCP), SEQ ID № 32 (PKSCDKTHTCPPCC), SEQ ID № 33 (PSCDKTHTCPPCP), SEQ ID № 34 (PKSCDTHTCPPCP), SEQ ID № 35 (PKSCDKTHCPPCP), SEQ ID № 36 (KCDKTHTCPPCP), SEQ ID № 37 (PSCKTHTCPPCP), SEQ ID № 38 (PKSCDTHCPPCP), SEQ ID № 39 (PKSCTHTCPPCP), SEQ ID № 40 (PKSCDKTTCPCP), SEQ ID № 41 (PKSCDKTHCPPC), SEQ ID № 42 (PKSCDCHTCPPCP), SEQ ID № 43 (PKSCDCTHCPPCP), SEQ ID № 44 (PCSCKHTCPPCP), SEQ ID № 45 (PSCCTHTCPPCP), SEQ ID № 46 (PSCDKHCCPPCP), SEQ ID № 47 (PKSTHTCPPCP), SEQ ID № 48 (PKSCTCPPCP) або SEQ ID № 49 (PKSCDKCVECPPCP). Краще, моноклональне антитіло, отримане при реалізації способу за винаходом, можна охарактеризувати тим, що воно включає амінокислотну послідовність, вибрану з групи, що складається з SEQ ID № 1 (PRDCGCKPCICT), SEQ ID № 2 (PKSCGCKPCICT), SEQ ID № 3 (PKSCGCKPCICP), SEQ ID № 4 (PRDCGCKPCPPCP), SEQ ID № 5 (PRDCGCHTCPPCP), SEQ ID № 6 (PKSCDCHCPPCP), SEQ ID № 7 (RKCCVECPPCP), SEQ ID № 22 (CKSCDKTHTCPPCP), SEQ ID № 23 (PCSCDKTHTCPPCP), SEQ ID № 24 (PKCCDKTHTCPPCP), SEQ ID № 25 (PKSCCKTHTCPPCP), SEQ ID № 26 (PKSCDCTHTCPPCP) SEQ ID № 27 (PKSCDKCHTCPPCP), SEQ ID № 28 (PKSCDKTCTCPPCP), SEQ ID № 29 (PKSCDKTHCCPPCP), SEQ ID № 30 (PKSCDKTHTCCPCP), SEQ ID № 31 (PKSCDKTHTCPCCP), SEQ ID № 32 (PKSCDKTHTCPPCC), SEQ ID № 33 (PSCDKTHTCPPCP), SEQ ID № 34 (PKSCDTHTCPPCP), SEQ ID № 35 (PKSCDKTHCPPCP), SEQ ID № 36 (KCDKTHTCPPCP), SEQ ID № 37 (PSCKTHTCPPCP), SEQ ID № 38 (PKSCDTHCPPCP), SEQ ID № 39 (PKSCTHTCPPCP), SEQ ID № 40 (PKSCDKTTCPCP), SEQ ID № 41 (PKSCDKTHCPPC), SEQ ID № 42 (PKSCDCHTCPPCP), SEQ ID № 43 (PKSCDCTHCPPCP), SEQ ID № 44 (PCSCKHTCPPCP), SEQ ID № 45 (PSCCTHTCPPCP), SEQ ID № 46 (PSCDKHCCPPCP), SEQ ID № 47 (PKSTHTCPPCP), SEQ ID № 48 (PKSCTCPPCP) або SEQ ID № 49 (PKSCDKCVECPPCP). У кращому втіленні зазначене моноклональне антитіло є людським антитілом, ще краще, воно є антитілом IgG1. Винахід також відноситься до ізольованої нуклеїнової кислоті, що кодує описане вище моноклональне антитіло, тобто такої, що включає амінокислотну послідовність шарнірної області, вибрану з групи, що складається з SEQ ID № 1 (PRDCGCKPCICT), SEQ ID № 2 (PKSCGCKPCICT), SEQ ID № 3 (PKSCGCKPCICP), SEQ ID № 4 (PRDCGCKPCPPCP), SEQ ID № 5 (PRDCGCHTCPPCP), SEQ ID № 6 (PKSCDCHCPPCP), SEQ ID № 7 (RKCCVECPPCP), SEQ ID № 22 (CKSCDKTHTCPPCP), SEQ ID № 23 (PCSCDKTHTCPPCP), SEQ ID № 24 (PKCCDKTHTCPPCP), SEQ ID № 25 (PKSCCKTHTCPPCP), SEQ ID № 26 (PKSCDCTHTCPPCP) SEQ ID № 27 (PKSCDKCHTCPPCP), SEQ ID № 28 (PKSCDKTCTCPPCP), SEQ ID № 29 (PKSCDKTHCCPPCP), SEQ ID № 30 (PKSCDKTHTCCPCP), SEQ ID № 31 (PKSCDKTHTCPCCP), SEQ ID № 32 (PKSCDKTHTCPPCC), SEQ ID № 33 (PSCDKTHTCPPCP), SEQ ID № 34 (PKSCDTHTCPPCP), SEQ ID № 35 (PKSCDKTHCPPCP), SEQ ID № 36 (KCDKTHTCPPCP), SEQ ID № 37 (PSCKTHTCPPCP), SEQ ID № 38 (PKSCDTHCPPCP), SEQ ID № 39 (PKSCTHTCPPCP), SEQ ID № 40 (PKSCDKTTCPCP), SEQ ID № 41 (PKSCDKTHCPPC), SEQ ID № 42 (PKSCDCHTCPPCP), SEQ ID № 43 (PKSCDCTHCPPCP), SEQ ID № 44 (PCSCKHTCPPCP), SEQ ID № 45 (PSCCTHTCPPCP), SEQ ID № 46 (PSCDKHCCPPCP), SEQ ID № 47 (PKSTHTCPPCP), SEQ ID № 48 (PKSCTCPPCP) або SEQ ID № 49 (PKSCDKCVECPPCP). Відповідно до ще одного аспекту, даний винахід відноситься до ізольованої нуклеїнової кислоти, яка характеризується тим, що вона вибрана з таких нуклеїнових кислот: а) нуклеїнової кислоти, ДНК або РНК, що кодує штучну шарнірну область за винаходом, відповідної РНК або комплементарної послідовності; б) ізольованої нуклеїновокислотної послідовності, що включає нуклеїнову послідовність, вибрану з групи, що включає від SEQ ID № 15 до SEQ ID № 21, від SEQ ID № 50 до SEQ ID № 77, відповідної РНК та комплементарної послідовності; і в) нуклеїнової кислоти щонайменше з 18 нуклеотидами, здатної до гібридизації в умовах високої жорсткості щонайменше з однією з послідовностей від SEQ ID № 15 до 21 та від 50 до 77. Краще, коли винахід включає ізольовану нуклеїнову кислоту з нуклеїновою послідовністю, вибраною з групи, що включає від SEQ ID № 15 до SEQ ID № 21 та від SEQ ID № 50 до SEQ ID № 77. Інша частина винаходу включає вектор експресії або трансформовану приймальну клітину (клітину-хазяїна), що включає описану вище ізольовану нуклеїнову кислоту та, зокрема, ізольовану нуклеїнову кислоту з нуклеїновою послідовністю, вибраною з групи, що включає від SEQ ID № 15 до SEQ ID № 21, і від SEQ ID № 50 до SEQ ID № 77, відповідну РНК та 10 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 комплементарну послідовність. Під нуклеїновою кислотою, нуклеїновою або нуклеїновокислотною послідовністю, полінуклеотидом, олігонуклеотидом, полінуклеотидною послідовністю, нуклеотидною послідовністю, термінами, які рівнозначно використовуються в даному винаході, розуміється чітка послідовність нуклеотидів, модифікованих або не модифікованих, яка визначає фрагмент або область нуклеїнової кислоти, що включає або не включає неприродні нуклеотиди, і яка є або дволанцюговою ДНК, або одноланцюговою ДНК, або продуктами транскрипції зазначених ДНК. Тут також слід згадати, що даний винахід не відноситься до нуклеотидних послідовностей в їх природному хромосомному середовищі, тобто в природному стані. Він відноситься до послідовностей, які були виділені та/або очищені, тобто були взяті прямо чи опосередковано, наприклад - шляхом копіювання, при цьому їх середовище було щонайменше частково модифіковане. Таким чином, тут також слід припускати виділені нуклеїнові кислоти, одержані шляхом генетичної рекомбінації, наприклад - за допомогою приймальних клітин (клітин-хазяїв), або одержані шляхом хімічного синтезу. Гібридизація в умовах високої жорсткості означає, що температурні умови та умови іонної сили вибирають таким чином, щоб вони дозволяли зберігати гібридизацію двох комплементарних фрагментів ДНК. Наприклад, умови високої жорсткості на етапі гібридизації для визначення описаних вище полінуклеотидних фрагментів краще є такими. ДНК-ДНК- або ДНК-РНК-гібридизацію здійснюють у два етапи: (1) прегібридизація при 42 °C протягом трьох годин у фосфатному буфері (20 мМ, рН 7,5), що включає 5× SSC (цитратносольовий буфер) (1× SSC відповідає розчину 0,15M NaСl + 0,015М цитрату натрію), 50% формаміду, 7% додецилсульфату натрію (SDS), 10× розчин Денхардта, 5% сульфату декстрану та 1% ДНК сперми лосося; (2) власне гібридизація протягом 20 годин при температурі залежно від довжини зонда (наприклад: 42 °C для зонда довжиною більше 100 нуклеотидів), а потім два 20-хвилинних промивання при температурі 20 °C у 2× SSC + 2% SDS, одне 20-хвилинне промивання при 20 °C у 0,1× SSC + 0,1% SDS. Останнє промивання здійснюють в 0,1× SSC + 0,1% SDS протягом 30 хвилин при температурі 60 °C для зонда довжиною більше 100 нуклеотидів. Гібридизаційні умови високої жорсткості, описані вище для полінуклеотиду певного розміру, фахівець у даній галузі може адаптувати для олігонуклеотидів більшої або меншої довжини відповідно до опису в Sambrook, et al. (Molecular cloning: a laboratory manual, Cold Spring Harbor Laboratory; 3rd edition, 2001). Винахід також відноситься до вектора, що включає нуклеїнову кислоту відповідно до даного винаходу. Винахід особливо націлений на клонуючі та/або експресійні вектори, що включають нуклеотидну послідовність за винаходом. Вектори за винаходом краще включають елементи, які дозволяють експресувати та/або секретувати трансльовані нуклеотидні послідовності у визначеній приймальній клітині (клітиніхазяїні). Таким чином, вектор повинен містити промотор, сигнали ініціації та термінації трансляції, а також придатні ділянки регуляції транскрипції. Він повинен бути здатний підтримувати в стабільному стані приймальну клітину, та додатково може мати специфічні сигнали, що обумовлюють секрецію трансльованого білка. Фахівці в даній галузі вибирають та оптимізують ці різні елементи відповідно до функції використовуваної приймальної клітини. Для цього нуклеотидні послідовності за винаходом можуть бути введені до векторів автономної реплікації вибраного хазяїна, або можуть бути інтегративними векторами вибраного хазяїна. Такі вектори отримують за допомогою способів, що використовуються на цей час фахівцями в даній галузі, і одержані клони можуть бути введені до придатного хазяїна за допомогою стандартних способів, таких як ліпофекція, електропорація, тепловий шок або хімічні способи. Вектори за винаходом є, наприклад, векторами плазмідного або вірусного походження. Вони використовуються для трансформації приймальних клітин, щоб клонувати або експресувати нуклеотидні послідовності за винаходом. Винахід також включає приймальні клітини, трансформовані за допомогою вектора за винаходом, або такі, що включають його. Приймальна клітина може бути вибрана з прокаріотичних або еукаріотичних систем, наприклад бактеріальних клітин, а також дріжджових клітин або клітин тварин, зокрема, клітин ссавців. Можна також використовувати клітини комах або рослин. Інші характеристики та переваги винаходу з'являться в продовженні опису із прикладами та графічними матеріалами, де: Фіг. 1А і 1В: Вплив серій мишачих та відповідних химерних анти-с-Met МКА, продукованих як людський IgG1/каппа ізотип, на фосфорилування с-Met-рецептора на клітинах A549. 11 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 1А: агоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 1B: антагоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 2А і 2В: Порівняння впливу мишачого МКА 224G11 та химерних МКА 224G11, що включають різні розроблені шарнірні області, на фосфорилування с-Met-рецептора на клітинах А549. Фіг. 2А: агоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 2B: антагоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 3A і 3B, 4 і 5: BRET-моделі с-Met-димеризації та активації. Фіг. 6А та 6В: розпізнавання с-Met химерними та гуманізованими формами 224G11. Фіг. 7A, 7B і 7C: Вплив мишачих та химерних антитіл на HGF-індуковану проліферацію клітин NCI-H441 in vitro. Клітини NCI-H441 поміщали до безсироваткового середовища. Через двадцять чотири години після посіву додавали (фіг. 7А) m11E1 і [11E1]chim, (Фіг. 7В) m227H1 і [227H1]chim або (фіг. 7С) m224G11 та [224G11]chim за відсутності або у присутності HGF. Чорними стрілками вказані лунки, покриті тільки клітинами, або за відсутності (стрілка вліво), або у присутності (стрілка вправо) HGF. Мишачий IgG1 (mIgG1) вводили як ізотиповий контроль. Фіг. 8: Порівняння in vivo мишачих і химерних МКА 224G11 на моделі з ксенотрансплантатом NCI-H441. Фіг. 9А та 9В: Вплив мишачого МКА 224G11 та різних химерних і гуманізованих версій цього антитіла на HGF-індуковану проліферацію клітин NCI-H441 in vitro. Клітини NCI-H441 поміщали до безсироваткового середовища. Через двадцять чотири години після посіву додавали тестовані антитіла за відсутності, або у присутності HGF. На панелі (фіг. 9А) показані мишача m224G11, химерна IgG1 [224G11]chim, гуманізована IgG1 [224G11] [Hz1], [224G11] [Hz2], [224G11] [Hz3] версії. На панелі (фіг. 9B) показані мишача m224G11 та різні химерні IgG1 форми ([224G11]chim, [224G11] [MH chim], [224G11] [MUP9H chim], [224G11] [MMCH chim], [224G11] [TH7 chim]). Чорні стрілки вказують на лунки з клітинами тільки за відсутності (стрілка вліво) або у присутності (стрілка вправо) HGF. Мишачий IgG1 (mIgG1) вводили як негативний контроль агоністичної активності. M5D5 використовували як дозазалежний повний агоністичний контроль. Фіг. 10: Вплив мишачого МКА 224G11 та різних химерних і гуманізованих версій цього антитіла на HGF-індуковану проліферацію клітин NCI-H441 in vitro. Клітини NCI-H441 поміщали до безсироваткового середовища. Через двадцять чотири години після посіву додавали тестовані антитіла за відсутності, або у присутності HGF. Показані мишача m224G11 та химерні форми IgG1 [224G11]chim, [224G11] [TH7 chim]) і [224G11] [TH7 Hz1], [224G11] [TH7 Hz3]). Чорні стрілки вказують на лунки з клітинами тільки за відсутності (стрілка вліво) або у присутності (стрілка вправо) HGF. Мишачий IgG1 (mIgG1) вводили як негативний контроль агоністичної активності. M5D5 використовували як дозазалежний повний агоністичний контроль. Фіг. 11A-11B та 12A-12B: Вплив серій с-Met-МКА за винаходом з розробленою шарнірною областю на фосфорилування с-Met-рецептора на клітинах A549. Фіг. 11А та 11В: агоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 12А та 12В: антагоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 13А і 13В: BRET-моделі с-Met-димеризації та активації. Фіг. 14А: агоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 14B: антагоністичний вплив, розрахований як відсоток від максимальної стимуляції фосфорилування с-Met за допомогою HGF [100 нг/мл]. Фіг. 15: BRET-моделі с-Met-димеризації та активації. Фіг. 16: Мікроскопічний аналіз впливу різних форм МКА 214B2 на адгезію клітин PC3. Фіг. 17: Аналіз впливу різних форм МКА 214B2 на адгезію клітин PC3 за допомогою АТФаналізу. У кожній лунці визначали число прикріплених клітин за допомогою стандартної кривої PC3, від 0 до 200000 клітин/лунку. Результати показані в такий спосіб: необроблені клітини взяті як контроль (100%), а оброблені клітини показані у вигляді % від контролю. Приклад 1: Конструювання химерних МКА та функціональне оцінювання стану фосфорилування рецептора с-Met Декілька мишачих МКА, націлених на прототипний тирозинкіназний рецептор (с-Metрецептор) були перероблені як химерні МКА з мишачими варіабельними доменами та 12 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 людськими константними доменами. Їх внутрішні активності були проаналізовані на основі функціонального моніторингу інгібування ліганд(HGF)-залежного фосфорилування с-Metрецептора. Після ПЛР-клонування послідовностей мишачих варіабельних доменів (VH, VL) химерні МКА були сконструйовані шляхом лігування фрагмента рестрикції {Nhe1-Bcl1}, що несе мишачу VH або VL послідовність, з вектором pCEP4 (Invitrogen, США), що несе усю кодувальну послідовність константного домену або людського легкого ланцюга Ckappa, або людського важкого ланцюга [CH1-шарнір-CH2-CH3] з імуноглобуліну IgG1. Усі етапи клонування виконували відповідно до загальноприйнятих методик молекулярної біології, описаних в Laboratory manual (Sambrook and Russel, 2001), або відповідно до інструкцій виробника. Кожну генетичну конструкцію повністю підтверджували шляхом секвенування нуклеотидних послідовностей за допомогою набору Big Dye terminator cycle sequencing kit (Applied Biosystems, US), і аналізували за допомогою аналізатора 3100 Genetic Analyzer (Applied Biosystems, US). Продукування відповідних химерних МКА проводили за допомогою адаптованих до суспензії клітин HEK293 EBNA (Invitrogen, США), вирощених у безсироватковому середовищі Excel 293 (SAFC Biosciences) з доданням 6 мм глутаміну. Транзієнтну трансфекцію виконували за допомогою лінійного 25 кДа поліетиленіміну (PEI) (Polysciences). Процес культивації контролювали, базуючись на життєздатності клітин та продукуванні МКА. МКА очищали за допомогою звичайного хроматографічного підходу на смолі з білком А (GE Healthcare, США). Усі різні форми МКА були одержані на рівні, придатному для функціонального оцінювання. Рівні продуктивності, як правило, знаходились в діапазоні від 15 до 30 мг/л очищеного МКА. Функціональні оцінювання проводили на клітинах людського раку легені A549. Стан фосфорилування рецептора с-Met контролювали на клітинних лізатах шляхом специфічного пасткового ІФА. Козяче анти-с-Met-МКА (R&D, вих. № AF276) використовували як іммобілізоване (захоплююче) антитіло, у той час як антитіло для виявлення відповідало антифосфо-с-Met-МКА (Biosource, № KHO0281). Показники люмінесценції реєстрували на багатоканальному планшетному спектрофотометрі Mithras LB920 (Berthold). Усі три мишачі МКА 11E1, 224G11 і 227H1 показували порівняну внутрішню активність у відношенні фосфорилування рецептора с-Met: майже повна відсутність їх власної агоністичної активності (менше за 5% від ефекту HGF, фіг. 1А) та сильне інгібування HGF[100 нг/мл]індукованого фосфорилування рецептора с-Met (>70% інгібування ефекту HGF, фіг. 1В). Дуже дивно, що при зміні тільки константного домену МКА для перемикання мишачого IgG1/kappa на людський IgG1 kappa, спостерігалася повна зміна внутрішньої активності одержаних химерних МКА (фіг. 1А-1В). Дійсно, спостерігався сильний агонізм (досягаючий 20% від ефекту HGF для c11E1, фіг. 1А), пов'язаний зі значним зменшенням ефективності антагоніста (залишилося тільки 60% інгібування ефекту HGF для c224G11, фіг. 1В). Цей ефект не залежить від варіабельного домену антитіла, тому що це саме явище спостерігається для трьох досліджених МКА (моноклональні антитіла 11E1, 224G11 і 227H1, секретовані гібридомами, збережуваними в Національній колекції культур мікроорганізмів (CNCM, National Collection of Microorganism Cultures) (Інститут Пастера, Париж, Франція) 03/14/2007 за номерами CNCM I-3724 (відповідає 11E1), I-3731 (відповідає 224G11) та I-3732 (відповідає 227H1) (див. патентну заявку РСТ, опубліковану за номером WO 2009/007427). Приклад 2: Розроблення, клонування та продукування розроблених версій шарнірної області На основі проведених вище спостережень можна припустити, що порушення фармакологічного профілю, спостережуване при переформатуванні мишачого IgG1 у людські МКА IgG1, було викликано людським IgG1 доменом. З одного боку, з літератури відомо, що активація с-Met-рецептора була пов'язана з його димеризацією, та що інгібування димеризації с-Met-рецептора може інгібувати фосфорилування с-Met-рецептора та знизити передачу сигналу. З іншого боку, МКА за своєю сутністю є двовалентними молекулами через властиву їм структурну основу, і таким чином вони можуть виступати як індуктори димеризації с-Metрецептора. Таким чином, можна припустити, що за рахунок обмеження конформаційної гнучкості химерних МКА, наприклад поворотів, вигинів або вилянь (див. Roux Roux et al., 1997), можна було б відновити внутрішню активність, що викликає цікавість (сильний антагонізм та слабкий агонізм) батьківських мишачих МКА. Ця гіпотеза підкріплюється аналізом відповідних послідовностей мишачих і людських IgG1 шарнірних областей (що також згадуються як IgG1 Hобласті): мишача IgG1 Н-область PRDCGCKPCICT (SEQ ID № 1) 13 UA 108346 C2 5 10 людська IgG1 Н-область PKSCDKTHTCPPCP (SEQ ID № 11) людська IgG2 Н-область RKCCVECPPCP (SEQ ID № 7) Це вирівнювання показує, що мишача IgG1 H-область коротша та включає один додатковий дисульфідний місток (Cys), порівняно з людською IgG1 Н-областю. Воно також показує, що людська IgG2 H-область подібна до мишачої IgG1 H-області як за довжиною (11 AA (амінокислот)), так і за кількістю дисульфідних містків (4). У зв'язку з цим припустили, що підвищена жорсткість людської IgG1 H-області може бути одержана шляхом введення стабілізуючих мутацій, таких як Cys-залишки, та/або шляхом скорочення даного конкретного сегмента. Ця передбачувана підвищена жорсткість Н-області може бути пов'язана з поліпшенням функціональних властивостей розробленого людського IgG1 МКА. Першу серію з 7 розроблених версій отримали (табл. 2), створюючи химерні H-області шляхом заміни N-кінцевої або С-кінцевої частини шарніра між мишачою та людською послідовностями. Також було виконане конструювання еквівалента IgG2. 15 Таблиця 2 Дикий тип IgG2 Hu-IgG2 Mu-IgG1 R K C C V E C P P C P 20 Hu-IgG1 P K S C D K T H T C P P C P P R D C G C K P C I C T Дикий тип IgG1 Варіанти MH -IgG1 P R D C G C K P C I C T MMCH -IgG1 P K S C G C K P C I C T MMH -IgG1 P K S C G C K P C I C P MUP9H -IgG1 P R D C G C K P C P P C P MUC7H -IgG1 P R D C G C H T C P P C P TH7CΔ6,9 -IgG1 P K S C D C H C P P C P Додаткові серії з 28 мутантів в Н-області були розроблені та сконструйовані для оцінювання впливу або введення одного додаткового залишку цистеїну в Н-область, або видалення щонайменше однієї амінокислоти, або одночасного введення одного цистеїну та видалення щонайменше однієї амінокислоти в Н-області. Ці нові серії шарнірних мутантів описані в таблиці 3. Таблиця 3 C1 #01 C #02 K #03 S #04 C #05 D #06 K #07 T #08 H #09 T #10 C #11 P #12 P #13 C #14 P C2 P C S C D K T H T C P P C P C3 P K C C D K T H T C P P C P C5 P K S C C K T H T C P P C P C6 P K S C D C T H T C P P C P C7 P K S C D K C H T C P P C P C8 P K S C D K T C T C P P C P C9 P K S C D K T H C C P P C P C11 P K S C D K T H T C C P C P C12 P K S C D K T H T C P C C P 14 UA 108346 C2 Продовження таблиці 3 C14 P K S C D K T H T C P P C C Δ2 P S C D K T H T C P P C P Δ6 P K S C D T H T C P P C P Δ9 H C P P C P T H T C P P C P P S C K T H T C P P C P P K S C D T H C P P C P P K S C T H T C P P C P P K S C D K T T C P C P P K S C D K T H C P P C P K S C D C H T C P P C P C6Δ9 P K S C D C T H C P P C P C2Δ5-7 P C S C K H T C P P C P C5Δ2-6 P S C C T H T C P P C P C9Δ2-7 P S C D K H C C P P C P Δ4-5-6 P K S T H T C P P C P Δ5-6-7-8 P K S C T C P P C P IgG1/IgG2 35 T K C7Δ6 30 K D Δ9-14 25 D C Δ8-11 20 C Δ5-6 15 S K Δ6-9 10 K Δ2-5 5 P Δ1-3 P K S C D K C V E C P P C P Як приклад розроблення шарніра був вибраний варіабельний домен (важкий і легкий ланцюги) мишачого анти-с-Met-МКА, називаного 224G11. Ці мишачі послідовності були злиті в першу чергу з людськими константними доменами [Ckappa] для легкого ланцюга та [CH1-шарнір-CH2-CH3] для важкого ланцюга людського IgG1. Модифікація шарнірної області була проведена шляхом заміни рестрикційного фрагмента {Nhe1-Bcl1} на еквівалентну частину, що несе бажані модифікації, при цьому кожен відповідний {Nhe1-Bcl1} фрагмент був синтезований шляхом глобального синтезу гена (Genecust, Люксембург). Усі нові мутанти шарніра були сконструйовані на тій же основі. Усі етапи клонування виконували відповідно до загальноприйнятих методик молекулярної біології, описаних в Laboratory manual (Sambrook and Russel, 2001), або відповідно до інструкцій виробника. Кожну генетичну конструкцію повністю підтверджували шляхом секвенування нуклеотидних послідовностей за допомогою набору Big Dye terminator cycle sequencing kit (Applied Biosystems, US) і аналізували за допомогою аналізатора 3100 Genetic Analyzer (Applied Biosystems, США). Адаптовані до суспензії клітини HEK293 EBNA (Invitrogen, США) вирощували стандартним способом в 250 мл колбах в 50 мл безсироваткового середовища Excel 293 (SAFC Biosciences) з доданням 6 мМ глутаміну на орбітальному шейкері (зі швидкістю обертання 110 об/хв). Транзієнтну трансфекцію виконували з використанням 2×106 клітин/мл, лінійного 25 кДа поліетиленіміну (PEI) (Polysciences), приготовленого у воді з кінцевою концентрацією 1 мг/мл, та плазмідної ДНК (кінцева концентрація 1,25 мкг/мл зі співвідношенням плазмід з важким і легким ланцюгом 1:1). Через 4 години після трансфекції культури розводили одним об’ємом свіжого культурального середовища для досягнення кінцевої щільності клітин 106 клітин/мл. Процес культивації контролювали на основі життєздатності клітин та продукування МКА. Як правило, культури зберігали протягом 4-5 днів. МКА очищали за допомогою звичайного хроматографічного підходу на смолі з білком А (GE Healthcare, США). Усі різні форми МКА були одержані на рівні, придатному для функціонального оцінювання. Рівні продуктивності, як правило, знаходилися в діапазоні від 15 до 30 мг/л очищених МКА. Приклад 3: Оцінювання розроблених МКА в фосфо-с-Met-специфічному аналізі ІФА Клітини A549 висівали в 12 багатолункових (MW) планшетах у повному ростовому середовищі [F12K + 10% FCS (ембріональної телячої сироватки)]. Клітини залишали протягом 16 годин до стимуляції HGF [100 нг/мл], і кожне МКА для тестування додавали в кінцевій концентрації 30 мкг/мл за 15 хвилин до стимуляції лігандом. Через 15 хвилин після додання HGF додавали крижаний літичний буфер, щоб зупинити реакцію фосфорилування. Клітини 15 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 механічно руйнували, та клітинні лізати збирали шляхом центрифугування при 13000 об/хв протягом 10 хв при 4 °C і відповідно до фази супернатанта. Вміст білка кількісно оцінювали за допомогою набору BCA kit (Pierce) і зберігали при температурі -20 °C до моменту використання. Стан фосфорилування с-Met кількісно оцінювали за допомогою ІФА. Козяче анти-с-Met-МКА (R&D, № AF276) використовували як іммобілізоване (захоплююче) антитіло (посадка протягом ночі при температурі 4 °C), та після етапу насичення з 5% буфером TBS-BSA (1 година при кімнатній температурі) додавали 25 мкг білкових лізатів до кожної лунки покритого 96-лункового мікротитрувального планшета. Через 90 хвилин інкубації при кімнатній температурі планшети промивали чотири рази, та додавали антитіло для виявлення (анти-фосфо-с-Met-МКА, націлене проти фосфорилованих залишків Tyr у позиціях 1230, 1234 і 1235). Після додаткової інкубації протягом 1 години та чотирьох промивань додавали антикроляче антитіло, зв'язане з HRP (Biosource) на 1 годину при кімнатній температурі, і проявляли люмінесценцію шляхом додання люмінолу. Люмінесценцію реєстрували на багатоканальному планшетному спектрофотометрі Mithras LB920 (Berthold). Конструювали серії розроблених версій шарнірного домену важкого ланцюга та аналізували в аналізі фосфорилування с-Met-рецептора. Як показано на фіг. 2А, у порівнянні з 224G11 [IgG1-chim] спостерігалося значне скорочення агоністичного ефекту, пов'язаного з ізотипом hIgG1/kappa, як для конструкції на основі IgG2, так і для деяких розроблених конструкцій IgG1/kappa [MH, MUP9H і TH7, фіг. 2А]. Найслабкіші та порівняні агоністичні активності були одержані для 224G11 [MH-IgG1], що включає повну мишачу IgG1 шарнірну область, і для 224G11 [TH7], що включає найбільш людську розроблену IgG1 шарнірну область. Також було одержано супутнє збільшення антагоністичної ефективності [фіг. 2B]. Таким чином, як оснований на IgG2, так і розроблений оснований на hIgG1/kappa TH7 шарнірний мутант, зв'язаний з мишачою 224G11 варіабельною областю, виявили функціональну активність, практично схожу до мишачого МКА 224G11. Тим не менш, порівняння агоністичної/антагоністичної активності 224G11 [MMCH-IgG1-Chim] і 224G11 [IgG1-Chim] показало, що збільшення антагоністичної активності можна отримати шляхом розроблення антитіла незалежно від внутрішніх агоністичних властивостей такого антитіла. Другу серію розроблених версій шарнірного домену важкого ланцюга конструювали та аналізували в аналізі фосфорилування с-Met-рецептора. Як показано на фіг. 11А, амінокислотна заміна в шарнірному домені важкого ланцюга, яка вводить цистеїновий залишок, модифікує агоністичний ефект антитіл. Дійсно, з одного боку деякі версії, що зазнали мутації, демонструють слабкіший агоністичний ефект, ніж c224G11, наприклад c224G11[C2], c224G11[C3], c224G11[C5], c224G11[С6] або c224G11[C7], у той час як інші демонструють збільшений агоністичний ефект, наприклад c224G11[C11], c224G11[C12] і c224G11[C14]. Більш того, амінокислотні видалення в шарнірному домені важкого ланцюга, зв'язані або не зв'язані з амінокислотними замінами, також модифікують агоністичні властивості антитіл [фіг. 11B]. Наприклад, c224G11 [Δ1-3], c224G11 [Δ4-5-6], c224G11 [Δ5-6-7-8], c224G11 [C7Δ6], c224G11 [C6Δ9], c224G11 [С2Δ5-7], c224G11 [C5Δ2-6] або c224G11 [C9Δ2-7] демонструють слабкіший агоністичний ефект, ніж c224G11, у той час як c224G11[Δ8-11] демонструє сильніший агоністичний ефект. Як і c224G11 [TH7], усі нові версії, що демонструють слабкіший агоністичний ефект, показують супутнє збільшення антагоністичної ефективності [фіг. 12А и 12В], у той час як ті, що демонструють сильніший агоністичний ефект, мають слабкішу антагоністичну ефективність. У даній заявці застосування квадратних дужок не є необхідним і, наприклад, посилання на [224G11] [IgG2chim] слід розглядати як ідентичне 224G11IgG2chim. Так само, щоб показати, що антитіло є мишачим, може бути доданий вислів "murine" або буква m; щоб показати, що антитіло є химерним, може бути доданий вислів "chim" або буква с; щоб показати, що антитіло є гуманізованим, може бути доданий вислів "hum" або буква h. Наприклад, химерне антитіло 224G1IgG2 може розглядатися як c224G11IgG2, c224G11 [IgG2], с [224G11] IgG2, с [224G11] [IgG2], 224G11IgG2chim, 224G11 [IgG2chim], [224G11] IgG2chim або [224G11] [IgG2chim]. Символ Δ означає видалення. Приклад 4: Аналіз BRET У першій серії експериментів було проконтрольовано, що нерелевантний мишачий IgG1, людський IgG1 і людський IgG2 не впливають на HGF-індукований BRET-сигнал в обох моделях BRET (фіг. 3). Ці МКА були використані надалі як контролі. Потім був оцінений вплив IgG1 химерних форм мишачого 224G11 МКА ([224G11]Chim), мишачого 11E1 МКА ([11E1]Chim) та мишачого 227H1 МКА ([227H1]Chim) на BRET моделі с-Metдимеризації та с-Met-активації. Хоча мишаче 224G11 МКА інгібує 59% HGF-індукованого BRET-сигналу на моделі с-Met 16 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 димеризації, МКА [224G11]Chim інгібує тільки 29% (фіг. 4). [224G11]Chim антитіло також було менш ефективним в інгібуванні HGF-індукованої с-Met-активації, тому що антитіла [224G11]Chim і m224G11 інгібували 34,5% і 56,4% HGF-індукованого BRET-сигналу (фіг. 5). Більше того, m224G11 поодинці не впливало на с-Met-активацію, у той час як [224G11]Chim мав частковий агоністичний ефект на с-Met-активацію, що відповідає 32,9% HGF-індукованого сигналу. Цей частковий агоністичний ефект [224G11]Chim також можна було побачити на BRETмоделі с-Met-димеризації, тому що [224G11]Chim поодинці індукувало збільшення BRET, що відповідає 46,6% HGF-індукованого сигналу, порівняно з 21,3% для m224G11. Агоністичну ефективність других серій розроблених версій шарнірного домену важкого ланцюга оцінювали на BRET-моделі с-Met активації (фіг. 13А та 13В). На відміну від c224G11, який має частковий агоністичний вплив на с-Met-активацію, різні химерні форми антитіла 224G11 із мутованим шарніром, що включають амінокислотну заміну, амінокислотне видалення, або і те і інше, не показали значного впливу на с-Met-активацію поодинці для c224G11[С2], c224G11[C3], c224G11[C5], c224G11[C6], c224G11[C7], c224G11[Δ1-3], c224G11[Δ4-5-6], c224G11[Δ5-6-7-8], c224G11[C7Δ6], c224G11[C6Δ9], c224G11[С2Δ5-7], c224G11[C5Δ2-6] або c224G11[C9Δ2-7], відповідно. Навпаки, інші химерні форми з мутованим шарніром показали підвищений агоністичний вплив на c224G11[Δ6], c224G11[C11], c224G11[C12] і c224G11[C14]. Приклад 5: Розпізнавання с-Met химерними та гуманізованими формами 224G11 Був проведений прямій ІФА, щоб визначити здатність зв'язування різних химерних і гуманізованих форм по відноенню до рекомбінантного с-Met. Коротко, рекомбінантний димерний с-Met від R&D Systems поміщали в концентрації 1,25 мкг/мл до 96-лункових планшетів Immunol II. Після інкубації протягом ночі при температурі 4 °C лунки насичували розчином 0,5% желатину/PBS. Планшети інкубували протягом 1 години при температурі 37 °C перед доданням двократних розведень тестованих антитіл. Планшети додатково інкубували протягом години перед доданням HRP з козячим антимишачим IgG для виявлення мишачого антитіла і HRP з козячим антилюдським легким ланцюгом каппа для розпізнавання химерного та гуманізованого антитіла. Планшети інкубували протягом однієї години та додавали пероксидазний субстрат TMB Uptima на 5 хв до нейтралізації за допомогою 1M H2SO4. Результати, показані на фіг. 6А и 6В, показують, що усі тестовані форми були порівнянними з розпізнавання с-Met. Приклад 6: Вплив мишачих та химерних антитіл на HGF-індуковану проліферацію клітин NCI-H441 in vitro Клітини NCI-H441 з АТСС стандартним способом культивували у середовищі RPMI 1640 (Invitrogen Corporation, Шотландія, Великобританія), 10% FCS (Invitrogen Corporation), 1% Lглутаміну (Invitrogen Corporation). Для аналізу проліферації клітини розсіювали за три дні до використання, щоб вони перебували в конфлюентній фазі росту перед посівом. Клітини NCIH441 поміщали в 96-лункові плати для культивування із щільністю 3,75×104 клітин/лунку у 200 мкл безсироватковому середовищі (RPMI 1640 плюс 1% L-глутаміну). Через двадцять чотири години після посіву до NCI-H441 додавали тестовані антитіла та інкубували при 37 °C протягом тридцяти хвилин, перш ніж додавати HGF у кінцевій концентрації 400 нг/мл (5 нМ) на 142 додаткові години. Діапазон тестованих доз для кожного антитіла становив від 10 до 0,0097 мкг/мл (кінцева концентрація у кожній лунці). У цьому експерименті мишаче МКА IgG1 додавали як мишачий ізотиповий контроль, а протестовані були такі антитіла: m224G11, m11E1, m227H1 та їх людські IgG1 химерні форми, відповідно ідентифіковані як [224G11]Chim, [11E1]Chim і [227H1]Chim. Також були включені лунки, засіяні тільки клітинами -/+ HGF. Потім клітини піддавали імпульсу 0,25 мкКі [3Н]тимідину (Amersham Biosciences AB, Упсала, Швеція) протягом 7 годин 30 хвилин. Значення [3H]тимідину, включеного до нерозчинної в трихлороцтовій кислоті ДНК, кількісно оцінювали за допомогою рідинного сцинтіляційного лічильника. Результати наведені у вигляді нетрансформованих даних про cpm (імпульсів на хвилину) для кращого оцінювання потенційної внутрішньої агоністичної активності, яка може виникнути із анти-с-MetМКА при доданні їх поодинці до пухлинних клітин. Результати, описані у фіг. 7A, 7B і 7C, показують, що, як і очікувалося, мишачі антитіла не виявляли агоністичного ефекту при доданні їх поодинці до ракових клітин при будь-яких випробовуваних дозах. У цьому експерименті не спостерігалося ніякого істотного інгібування HGF-індукованої проліферації в ізотиповому контролі стосовно значних розбіжностей cpm, спостережуваних для цього ізотипового контролю. При доданні поодинці ані мишачий m224G11, ані m11E1 або m227H1 не виявляли агоністичного ефекту порівняно з ізотиповим контролем mIgG1 МКА, або тільки клітинами. Дозазалежна антипроліферативна активність досягала 78%, 80% або 80%, відповідно, для МКА m224G11, m11E1 або m227H1 (розрахунки % інгібування: 100-[(cpm клітин + тестоване МКА – середнє фонове cpm mIgG1) × 100 / (середнє cpm клітин + 17 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 HGF – середнє cpm тільки клітин)]). Дивно, що химерні форми цих трьох МКА індукували значний дозазалежний агоністичний ефект при доданні поодинці зі стимуляцією росту, близькою до тієї, що спостерігалася з HGF для [11E1]chim і [227H1]chim, відповідно. Для цих двох антитіл, що демонструють особливо високу внутрішню агоністичну активність, антагоністичний ефект був значно знижений до інгібувального ефекту у 53% і 21%, порівняно з 80%, спостережуваними для обох мишачих форм. Агоністичний ефект, спостережуваний для химерного [224G11]chim, також був дозазалежним, але він був нижчим, ніж спостережуваний для [11E1]chim і [227H1]chim. Однак, цей агоністичний ефект вплинув на інгібування HGFіндукованої проліферації in vitro, яка знизилася з 78% для мишачого m224G11 до 50% для його химерної форми. Для визначення того, чи сумісна така "низька" власна агоністична активність in vitro з незмінним ефектом in vivo, m224G11 і [224G11]chim були одержані для тестування in vivo. Оскільки у попередніх дослідженнях доза 30 мкг/мишу продемонструвала значну активність in vivo, така саме доза була вибрана для оцінювання in vivo. Приклад 7: Порівняння in vivo мишачого та химерного МКА 224G11 на моделі із ксенотрансплантатом NCI-H441 NCI-H441, одержані з папілярної аденокарциноми легенів, експресують високий рівень с-Met і демонструють конститутивне фосфорилування с-Met RTK. Для оцінювання in vivo ефекту антитіл на моделі із ксенотрансплантатом NCI-H441, атимічних мишей віком від шести до восьми тижнів поміщали у стерилізовані клітки з верхнім фільтром, залишали в стерильних умовах і проводили на них маніпуляції відповідно до французьких і європейських принципів. Мишам вводили підшкірно 9×106 клітин. Потім, через шість днів після імплантації клітин, пухлини вимірювали (приблизно 100 мм3), тварин ділили на групи по 6 мишей з порівнянними розмірами пухлин та вводили спочатку навантажувальну дозу 60 мкг антитіла/мишу, а потім два рази на тиждень по 1 мг/дозу кожного тестованого антитіла. У мишей спостерігали темпи росту ксенотрансплантата. Об’єм пухлини розраховували за формулою: π (Pi)/6 × довжина × ширина × висота. Результати, показані на фіг. 8, показують, що мишаче МКА, позбавлене агоністичної активності, in vivo поводиться, як і очікувалося, як потужний антагоніст навіть при низьких випробовуваних дозах. На противагу тому, що спостерігається з мишачим МКА, химерне МКА демонструє досить транзієнтну активність in vivo, і пухлина повністю пропадає при лікуванні на 20 день після ін'єкції клітин. Цей експеримент ясно показує, що збільшення агоністичного ефекту in vitro, яке призвело до зниження антагоністичної активності, було також відповідальним за значні втрати антагоністичної активності in vivo. Приклад 8: Вплив мишачого МКА 224G11 і різних химерних і гуманізованних версій цього антитіла на HGF-індуковану проліферацію клітин NCI-H441 in vitro Клітини NCI-H441 з АТСС стандартним способом культивували у середовищі RPMI 1640 (Invitrogen Corporation, Шотландія, Великобританія), 10% FCS (Invitrogen Corporation), 1% Lглутаміну (Invitrogen Corporation). Для аналізу проліферації клітини розсіювали за три дні до використання, щоб вони перебували в конфлюентній фазі росту перед посівом. Клітини NCIH441 поміщали у 96-лункові плати для культивування зі щільністю 3,75×104 клітин/лунку в 200 мкл безсироваткового середовища (RPMI 1640 плюс 1% L-глутаміну). Через двадцять чотири години після посіву до NCI-H441 додавали тестовані антитіла та інкубували при 37 °C протягом тридцяти хвилин, перш ніж додавати HGF у кінцевій концентрації 400 нг/мл (5 нМ) на 142 додаткових години. Діапазон тестованих доз для кожного антитіла становив від 10 до 0,0097 мкг/мл (кінцева концентрація в кожній лунці). У цьому експерименті мишаче МКА IgG1 додавали як мишачий ізотиповий контроль та як агоністичний негативний контроль. Були протестовані такі антитіла: i) m224G11, ii) його людські IgG1 химерні форми, відповідно ідентифіковані як [224G11]Chim, [224G11] [MH Chim], [224G11] [MUP9H Chim], [224G11] [MMCH Chim], [224G11] [TH7 Chim], iii) його гуманізовані IgG1 форми, відповідно описані як [224G11] [Hz1], [224G11] [Hz2], [224G11] [Hz3]. Також були включені лунки, засіяні тільки клітинами -/+ HGF. Ціле антитіло 5D5 від Genentech, комерційно доступне з ATCC у вигляді гібридомної клітинної лінії, було показане як повний агоністичний позитивний контроль, і далі назване як m5D5. Потім клітини піддавали імпульсу 0,25 мкКі [3Н]тимідину (Amersham Biosciences AB, Упсала, Швеція) протягом 7 годин 30 хвилин. Значення [3H]тимідину, включеного до нерозчинної у трихлороцтовій кислоті ДНК, кількісно оцінювали за допомогою рідинного сцинтіляційного лічильника. Результати показані у вигляді нетрансформованих даних про cpm (імпульсів на хвилину) для кращого оцінювання потенційної внутрішньої агоністичної активності, яка може виникнути з анти-с-MetМКА при доданні їх поодинці до пухлинних клітин. Результати, описані на фіг. 9A, показують, що, як і очікувалося, ані ізотиповий контроль, ані m224G11 не виявляли агоністичної активності відносно проліферації NCI-H441. Ізотиповий 18 UA 108346 C2 5 10 15 20 25 30 35 40 45 50 55 60 контроль не впливав на HGF-індуковану проліферацію клітин, тоді як m224G11 демонстрував 66%-не інгібування при доданні в кінцевій концентрації 10 мкг/мл. m5D5, використаний як агоністичний контроль, показав, як і очікувалося, повний дозазалежний агоністичний ефект при доданні до клітин поодинці. Як ми вже відзначали, МКА [224G11]chim демонструвало значний дозазалежний агоністичний ефект, і спостерігалася знижена інгібувальна активність цієї химерної форми: 19% замість 66% для мишачої форми. При доданні поодинці, три IgG1 гуманізованих МКА продемонстрували дозазалежний агоністичний ефект у порівнянні з формою m224G11. [224G11] [Hz1], [224G11] [Hz2] і [224G11] [Hz3] мали порівнянну антагоністичну активність, приблизно 46, 30 і 35%. Ці активності були значно нижчі, ніж та, що спостерігалася для m224G11. На фіг. 9В були перевірені різні IgG1 химерні форми. У порівнянні з формою [224G11]chim, яка демонструє дозазалежний агоністичний ефект при доданні поодинці до клітин NCI-H441, форми [224G11] [MH chim], [224G11] [MUP9H chim], [224G11] [MMCH chim], [224G11] [TH7 chim] не виявляли значного внутрішнього агоністичного ефекту. Їх антагоністична активність була вищою за ту, що спостерігалася у МКА m224G11 (57%) з досягненням інгібування 79, 78, 84 і 93% відповідно [224G11] [MH Chim], [224G11] [MUP9H Chim], [224G11] [MMCH Chim] і [224G11] [TH7 Chim]. Приклад 9: Вплив in vitro різних IgG1 химерних і гуманізованих форм МКА 224G11 Клітини NCI-H441 з АТСС стандартним способом культивували у середовищі RPMI 1640 (Invitrogen Corporation, Шотландія, Великобританія), 10% FCS (Invitrogen Corporation), 1% Lглутаміну (Invitrogen Corporation). Для аналізу проліферації клітини розсіювали за три дні до використання, щоб вони перебували в конфлюентній фазі росту перед посівом. Клітини NCIH441 поміщали на 96-лункові плати для культивування зі щільністю 3,75×104 клітин/лунку в 200 мкл безсироваткового середовища (RPMI 1640 плюс 1% L-глутаміну). Через двадцять чотири години після посіву до NCI-H441 додавали тестовані антитіла та інкубували при 37 °C протягом тридцяти хвилин, перш ніж додавати HGF у кінцевій концентрації 400 нг/мл (5 нМ) на 142 додаткових години. Діапазон тестованих доз для кожного антитіла становив від 10 до 0,0097 мкг/мл (кінцева концентрація у кожній лунці). У цьому експерименті мишаче IgG1 МКА додавали як фоновий негативний контроль агоністичної активності, а протестовані були такі антитіла: i) m224G11, ii) його людські IgG1 химерні форми, відповідно ідентифіковані як [224G11]Chim, [224G11] [TH7 Chim], iii) його гуманізовані IgG1 форми, відповідно описані як [224G11] [TH7 Hz1], [224G11] [TH7 Hz3]. Також були включені лунки, засіяні тільки клітинами -/+ HGF. Ціле антитіло 5D5 з Genentech, комерційно доступне з ATCC у вигляді гібридомної клітинної лінії, було представлене як повний агоністичний позитивний контроль, і далі назване як m5D5. Потім клітини піддавали імпульсу 0,25 мкКі [3Н]тимідину (Amersham Biosciences AB, Упсала, Швеція) протягом 7 годин 30 хвилин. Значення [3H]тимідину, включеного до нерозчинної в трихлороцтовій кислоті ДНК, кількісно оцінювали за допомогою рідинного сцинтіляційного лічильника. Результати показані у вигляді нетрансформованих даних про cpm (імпульсів на хвилину) для кращого оцінювання потенційної внутрішньої агоністичної активності, яка може виникнути з анти-с-Met-МКА при доданні їх поодинці до пухлинних клітин. На фіг. 10 показано, що МКА m224G11 демонструє звичайний інгібувальний ефект (74% інгібування). Химерна IgG1 форма [224G11]chim мала, як і очікувалося, дозазалежний внутрішній агоністичний ефект, та знижений антагоністичний ефект у порівнянні з мишачою формою: 33% проти 74% інгібування. [224G11] [TH7 chim] мало слабку агоністичну активність у цьому експерименті. Крім того, воно демонструвало високий інгібувальний ефект (81%), близький до ефекту, зазначеного для мишачого МКА. Дві гуманізовані форми не виявляли внутрішнього агоністичного ефекту та мали антагоністичну активність, близьку до спостережуваної для мишачого МКА або [224G11] [TH7 chim] з інгібуванням 67 і 76%, відповідно, для [224G11] [TH7 Hz1] та [224G11 ] [TH7 Hz3]. Приклад 10: Перемикання ізотипу для розробленої [TH7] шарнірної області Для того, щоб оцінити модуляцію фармакологічних властивостей, індуковану [TH7] шарнірною послідовністю, що відповідає PKSCDCHCPPCP, у скелетах імуноглобулінових ізотипів, крім людського IgG1, ми генетично перенесли описану вище послідовність [TH7] у людські скелети IgG2 та IgG4. Модифікацію шарнірної області проводили шляхом заміни рестрикційного фрагмента {Nhe1I-Bcl1} на еквівалентну частину, що несе модифікацію [TH7], при цьому фрагмент {Nhe1-Bcl1} синтезували шляхом глобального синтезу гена (Genecust, LU). Етапи клонування виконували відповідно до загальноприйнятих методик молекулярної біології, описаних в Laboratory manual (Sambrook and Russel, 2001), або відповідно до інструкцій виробника. Кожну генетичну конструкцію повністю підтверджували шляхом секвенування нуклеотидних послідовностей за допомогою набору Big Dye terminator cycle sequencing kit (Applied Biosystems, US) та аналізували за допомогою аналізатора 3100 Genetic Analyzer 19 UA 108346 C2 5 10 15 20 25 30 35 40 (Applied Biosystems, US). Одержані послідовності були описані як SEQ ID № 78, 79, 80 і 81 для відповідних амінокислотних і нуклеотидних послідовностей TH7 - розроблених людських ізотипів IgG2 і IgG4 (тільки важкий ланцюг, легкий ланцюг був ідентичний до c224G11/human Ckappa, використовуваного для всіх інших конструкцій на основі IgG1). Ці нові конструкції були застосовані до химерного 224G11 анти-с-Met-МКА, описаного вище у прикладі 2. Відповідні розроблені антитіла, c224G11 [IgG2TH7] і c224G11 [IgG4TH7], були одержані, як описано вище, шляхом транзієнтної експресії у адаптованих до суспензії клітинах НЕК293 EBNA. Приклад 11: Оцінювання розроблених МКА c224G11[IgG2TH7] і c224G11[IgG4TH7] у с-Metспецифічному аналізі ІФА та BRET-аналізі TH7-шарнір також був введений в IgG2 та IgG4 химерні МКА 224G11, і випробуваний в аналізі фосфорилування с-Met-рецептора. Як показано на фіг. 14А та 14В, c224G11 [IgG2TH7] і c224G11 [IgG4TH7] індукували слабкий агоністичний ефект поодинці, але значно слабкіший, ніж МКА c224G11, і демонстрували антагоністичний ефект, порівнянний з мишачою формою МКА 224G11 (m224G11). Цей результат був підтверджений на BRET-моделі с-Met-активації (фіг. 15), де c224G11[IgG2TH7] і c224G11[IgG4TH7] також показали себе як слабкіші агоністи, ніж МКА c224G11. Таким чином, шарнірна мутація TH7, введена в МКА формату IgG2 або IgG4, дала функціональні антитіла із властивостями, аналогічними c224G11 [TH7]. Приклад 12: Аналіз адгезії клітин Клітини раку передміхурової залози PC3 відокремлювали від чашок за допомогою трипсину, промивали три рази безсироватковим середовищем F12k і ресуспендували у цьому ж середовищі. Клітини (100000 клітин/лунку) висівали на 96-лункові планшети, покриті ламініном 1 у концентрації 1 мкг/мл. Такі форми анти-CD151 МКА для тестування були додані одночасно в кінцевій концентрації 10 мкг/мл: мишаче IgG1 МКА m214B2, немодифікована химерна форма IgG1 антитіла, називана c214B2, і химерна форма антитіла IgG1 з TH7 модифікацією, називана сTH7-214B2. CD151 є мембранним білком, що належить до родини тетраспанінів, і анти-CD151 МКА 214B2, продуковане гібридомою I-3919, що зареєстроване в CNCM 21 лютого 2008 року, описане в опублікованій патентній заявці WO 2009/136070. Мишачі та людські IgG1 антитіла використовували як ізотипові контрольні антитіла. Кінцеві умови були такими: 100000 клітин/лунку, та антитіла в концентрації 10 мкг/мл. Через одну годину інкубації при 37 °C планшети струшували та промивали двічі безсироватковим середовищем F12k. Перед аналізом 100 мкл безсироваткового середовища F12k вводили до кожної лунки. Для оцінювання впливу антитіл на клітинну адгезію лунки фотографували під фазово-контрастним мікроскопом (фіг. 16). Потім число прикріплених клітин визначали за допомогою аналізу АТФ (фіг. 17). Мишачі 214B2 та химерні TH7-214B2 антитіла були здатні модифікувати міжклітинні взаємодії (фіг. 16) та збільшувати еквівалентно клітинну адгезію PC3 (фіг. 17), у той час як не спостерігався ефект з модифікованою химерною формою 214B2 (c214B2), яка була порівнянна з людським IgG1 контрольним ізотиповим антитілом. ФОРМУЛА ВИНАХОДУ 45 50 55 60 1. Спосіб підвищення антагоністичної активності моноклонального химерного або гуманізованого антитіла, що включає константну область IgG1 людини та націлене проти специфічної молекули-мішені, або його двовалентного функціонального фрагмента, при цьому зазначене антитіло здатне інгібувати одну чи декілька біологічних активностей зазначеної молекули-мішені, де зазначений спосіб включає етап реконфігурації шарнірної області, що полягає у модифікації амінокислотної послідовності зазначеної шарнірної області шляхом видалення, додання або заміни щонайменше однієї амінокислоти, та де зазначена реконфігурована шарнірна область, одержана шляхом модифікації її амінокислотної послідовності, утворює шарнірну область, яка має послідовність, вибрану з групи, що складається з послідовностей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 23 - SEQ ID NO: 26, SEQ ID NO: 36 та SEQ ID NO: 42 - SEQ ID NO: 49. 2. Спосіб за п. 1, де зазначене моноклональне антитіло є двовалентним антитілом. 3. Спосіб за одним із пп. 1 та 2, де зазначена молекула-мішень є трансмембранним рецептором. 4. Спосіб за п. 3, де зазначений трансмембранний рецептор вибраний із групи, що складається з тирозинкіназних рецепторів, тетраспаніну та GPCR (рецепторів, зв'язаних з G білком). 20 UA 108346 C2 5 10 15 20 5. Спосіб скринінгу антагоністичного моноклонального химерного або гуманізованого антитіла, що включає константну область IgG1 людини та націлене проти специфічної молекули-мішені, або його двовалентного фyнкціонального фрагмента, при цьому зазначене антитіло здатне інгібувати одну чи декілька біологічних активностей зазначеної молекули-мішені, де зазначений спосіб включає етапи: (а) вибору вихідного антитіла з вихідним рівнем інгібування зазначеної однієї чи декількох біологічних активностей зазначеної молекули-мішені, (б) заміни амінокислотної послідовності шарнірної області зазначеного вихідного антитіла за допомогою способу за одним з пп. 1-4, (в) оцінювання модифікованого антитіла з етапу (б) щодо його здатності інгібувати зазначену одну чи декілька біологічних активностей зазначеної молекули-мішені, і (г) вибір, як позитивного результату, антитіла з етапу (в) з рівнем інгібування однієї чи декількох біологічних активностей зазначеної молекули-мішені, вищим, ніж вихідний рівень зазначеного інгібування. 6. Moноклональне химерне або гуманізоване антитіло, що включає константну область IgG1 людини та націлене проти специфічної молекули-мішені, або його двовалентний функціональний фрагмент, отримуваний за допомогою способу за одним із пп. 1-4, яке характеризується тим, що воно включає амінокислотну послідовність шарнірної області, вибрану з групи, що складається з послідовностей SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 23 - SEQ ID NO: 26, SEQ ID NO: 36 та SEQ ID NO: 42 - SEQ ID NO: 49. 7. Виділена нуклеїнова кислота, що кодує моноклональне антитіло за п. 6. 8. Виділена нуклеїнова кислота за п. 7, де зазначена нуклеїнова кислота включає нуклеїнову послідовність, вибрану з групи, що включає SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 51- SEQ ID NO: 54, SEQ ID NO: 64 та SEQ ID NO: 70 - SEQ ID NO: 77. 21 UA 108346 C2 22 UA 108346 C2 23 UA 108346 C2 24 UA 108346 C2 25 UA 108346 C2 26 UA 108346 C2 27 UA 108346 C2 28
ДивитисяДодаткова інформація
Автори російськоюGoetsch, Liliane, Wurch, Thierry
МПК / Мітки
МПК: A61K 39/395, C07K 16/18, A61P 35/00
Мітки: моноклонального, антитіла, спосіб, модулювання, антагоністичної, активності
Код посилання
<a href="https://ua.patents.su/36-108346-sposib-modulyuvannya-antagonistichno-aktivnosti-monoklonalnogo-antitila.html" target="_blank" rel="follow" title="База патентів України">Спосіб модулювання антагоністичної активності моноклонального антитіла</a>
Попередній патент: Пристрій та спосіб обгортання штабеля продукції плівкою
Наступний патент: Спосіб і пристрій для соусування сушених горіхів за допомогою дифузії шляхом соління, цукрування або ароматизації
Випадковий патент: Спосіб і пристрій для керування потужністю першої передачі даних в процедурі довільного доступу системи зв'язку fdma