Похідні піридину, придатні для інгібування системи обміну натрію/кальцію
Номер патенту: 81941
Опубліковано: 25.02.2008
Автори: Коскелайнен Туула, Левійокі Йоуко, Карьялайнен Арто, Раску Сірпа, Поллеселло Пьєро, Отсомаа Леєна
Формула / Реферат
1. Сполуки формули (І) або (II)
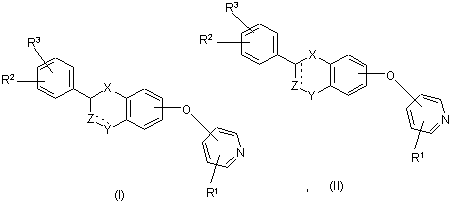 ,
,
де
X являє собою -О-, -СН2- або -С(О)-;
Z являє собою -CHR12- або валентний зв'язок;
Y являє собою -СН2-, -С(О)-, CH(OR13)-, -О-, -S-;
за умови, що у випадку, коли Z є валентним зв'язком, Y не є С(О);
пунктирна лінія являє собою необов'язковий подвійний зв'язок, у цьому випадку Z є -CR12-, a Y являє собою
-СН2, -С(О)- або CH(OR10)- (у формулі II), або -СН- (у формулі І);
R2 і R3, незалежно, являють собою Н, нижчий алкіл, нижчий алкокси, -NO2, галоген, -CF3, -ОН, бензилокси або групу формули (III)
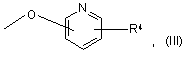
R1 являє собою Н, CN, галоген, -CONH2, -COOR15, -CH2NR15R18, NHC(O)R5, NHCH2R5, NHR20, NR21R22, NHC(NH)NHCH3 або, у випадку, коли сполука представлена формулою (II), де існує необов'язковий подвійний зв'язок, або, у випадку, коли R2 або R3 є бензилокси або групою формули (III), або, у випадку, коли піридинове кільце у формулі (І) або (II) зв'язане з атомом кисню в 3-, 4- або 5-положенні, R1 може також являти собою -NO2 або NR16R17;
R4 являє собою Н, -NO2, CN, галоген, -CONH2, -COOR15, -CH2NR15R18, -NR16R17, -NHC(O)R5 або -NHC(NH)NHCH3;
R5 являє собою алкіл, заміщений 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідрокси, або карбоксіалкіл, в якому алкільна частина є необов'язково заміщеною 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідроксилу, -CHR6NR7R8 або одну з наступних груп
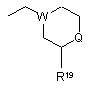 ,
,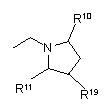 ,
,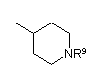 ,
,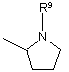 ,
,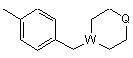 ,
,
W являє собою N або СН;
Q являє собою CHR14, NR9, S або О;
R6 являє собою Н або нижчий алкіл;
R7 і R8, незалежно, являють собою Н, ацил, нижчий алкіл або нижчий гідроксіалкіл;
R9 являє собою нижчий алкіл або феніл;
R10 і R11, незалежно, являють собою Н або нижчий алкіл;
R12 являє собою Н або нижчий алкіл;
R13 являє собою Н, алкілсульфоніл або ацил;
R14 являє собою Н, -ОН, -COOR15;
R15 являє собою Н або нижчий алкіл;
R16 і R17, незалежно, являють собою Н, ацил, алкілсульфоніл, -C(S)NHR18 або -C(O)NHR18;
R18 являє собою Н або нижчий алкіл;
R19 являє собою Н або -ОН;
R20 являє собою піридинільну групу, необов'язково заміщену групою -NO2;
R21 і R22 являють собою нижчий алкіл;
і їх фармацевтично прийнятні солі і складні ефіри.
2. Сполука за п. 1, де R1 являє собою -NHC(O)R5, X являє собою О, Y являє собою СН2 і Z являє собою CHR12.
3. Сполука за п. 2, де Z являє собою СН2 і R5 являє собою алкіл, заміщений 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідрокси, або карбоксіалкіл, у якого алкільна частина є, необов'язково, заміщеною 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідроксилу, -CHR6NR7R8 або одну з наступних груп:
 ,
, ,
, ,
, ,
, ,.
,.
4. Сполука за п. 1, де R2 або R3 є бензилокси або групою формули (Ша)
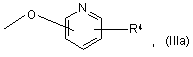
5. Сполука за п. 4, де R4 є NO2.
6. Сполука за п. 4 або 5, де R1 є NO2.
7. Фармацевтична композиція, що містить сполуку за п. 1 разом з фармацевтично прийнятним носієм.
8. Спосіб інгібування механізму обміну Na+/Ca2+ у клітині, що включає введення пацієнту, який потребує цього, терапевтично ефективної кількості сполуки за п. 1.
9. Спосіб лікування аритмій, що включає введення пацієнту, який потребує цього, терапевтично ефективної кількості сполуки за п. 1.
Текст
1. Сполуки формули (І) або (II) , Q W , W являє собою N або СН; 3 81941 4 Q являє собою CHR14, NR9, S або О; R10 R6 являє собою Н або нижчий алкіл; R7 і R8 , незалежно, являють собою Н, W ацил, нижчий алкіл або нижчий гідроксіалкіл; N 9 Q R являє собою нижчий алкіл або феніл; R10 і R11, незалежно, являють собою Н або R11 нижчий алкіл; R19 R19 R12 являє собою Н або нижчий алкіл; , , R13 являє собою Н, алкілсульфоніл або R9 ацил; R14 являє собою Н, -ОН, -COOR15; N R15 являє собою Н або нижчий алкіл; NR9 16 17 R і R , незалежно, являють собою Н, , , ацил, алкілсульфоніл, -C(S)NHR18 або -C(O)NHR18; R18 являє собою Н або нижчий алкіл; Q R19 являє собою Н або -ОН; 20 R являє собою піридинільну групу, W необов'язково заміщену групою -NO2; ,. R21 і R22 являють собою нижчий алкіл; 4. Сполука за п. 1, де R 2 або R3 є бензилокси або групою формули (Ша) і їх фармацевтично прийнятні солі і складні ефіри. 2. Сполука за п. 1 , де R 1 являє собою N O NHC(O)R5 , X являє собою О, Y я вляє собою СН2 і R4 Z являє собою CHR12. , (IIIa) 3. Сполука за п. 2, де Z являє собою СН2 і 5 R являє собою алкіл, заміщений 1-3 замісниками, 5. Сполука за п. 4, де R 4 є NO2. вибраними з групи, що складається з галоген у, 6. Сполука за п. 4 або 5, де R1 є NO2. аміно і гідрокси, або карбоксіалкіл, у якого 7. Фармацевти чна композиція, що алкільна частина є, необов'язково, заміщеною 1-3 містить сполук у за п. 1 разом з фармацевтично замісниками, вибраними з групи, що складається прийнятним носієм. з галогену, аміно і гідроксилу, -CHR6NR7R8 або 8 . Спо сіб ін гібування ме ханізм у обмін у одну з наступних груп: Na +/Ca 2+ у клі тині , що вк люча є введення пацієнту, який потребує цього, терапевтично ефективної кількості сполуки за п. 1. 9. Спосіб лікування аритмій, що включає введення пацієнту, який потребує цього, терапевтично ефективної кількості сполуки за п. 1. Даний винахід відноситься до нових терапевтично активних сполук і їх фармацевтично прийнятних солей і складних ефірів. Даний винахід відноситься також до фармацевтичних композицій, що містять дані сполуки як активні інгредієнти. Сполуки даного винаходу є сильними інгібіторами механізму обміну Na+/Ca2+. Ме ханізм обміну Na+/Ca2+ є одним з механізмів транспорту іонів, який регулює концентрацію іонів натрію і кальцію у клітинах. Сполуки, які селективно інгібують механізм обміну Na+/Ca2+ і, тим самим, запобігають надмірному накопиченню Са2+ у клітинах, вважаються корисними для запобігання запуску механізму ушкодження клітини серцевого м'яза і тому подібного після ішемії і реперфузії. Такі сполуки придатні, наприклад, для лікування ішемічних захворювань, таких як хвороби серця, ішемічні церебральні захворювання, ішемічні ниркові хвороби, і для захисту клітин під час тромболітичної терапії, ангіопластики, операції шунтування коронарної артерії або трансплантації органів і при аритміях. Сполуки, здатні до інгібування системи обміну Na+/Ca2+, були описані раніше, наприклад, у [патентних публікаціях WO 97/09306, ЕР 0978506, ЕР 1031556, JP 11049752 і JP 11302235]. Виявлено, що сполуки формули (І) або (II) є особливо сильними інгібіторами механізму обміну Na+/Ca2+ і особливо підходять для лікування аритмій. Сполуки даного винаходу мають структуру, представлену формулою (І) або (II): S-; де X являє собою -О-, -СН2- або -С(О)-; Ζ являє собою -CHR12- або валентний зв'язок; Υ являє собою -СН2-, -С(О)-, CH(OR13)-, -О-, за умови, що у випадку, коли Ζ є валентним зв'язком, Υ не є С(О); пунктирна лінія являє собою необов'язковий подвійний зв'язок, у цьому випадку Ζ є -CR12-, a Y являє собою -СН2-, -С(О)- або CH(OR 10)- (у формулі II) або 5 81941 -СН- (у формулі І); R2 і R3, незалежно, являють собою Н, нижчий алкіл, нижчий алкокси, -NO2, галоген, -CF3 , -ОН, бензилокси або групу формули (IIIа) R1 являє собою Н, CN, галоген, -CONH2, COOR15, -CH2NR15R18, NHC(O)R5, NHCH2R5, NHR20, NR21R22, NHC(NH)NHCH3 або, у випадку, коли сполука представлена формулою (II), де існує необов'язковий подвійний зв'язок, або у випадку, коли R2 або R3 є бензилокси або групою формули (llla), або у випадку, коли піридинове кільце у формулі (І) або (II) зв'язане з атомом кисню в 3-, 4- або 5-положенні, R1 може також являти собою -NO2 або NR16R17; R4 являє собою Н, -NO2, CN, галоген, -CONH2, -COOR 15, -CH2NR15R1i8, -NR16R17, -NHC(O)R 5 або NHC(NH)NHCH3; R5 являє собою алкіл, заміщений 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідрокси, або карбоксіалкіл, в якому алкільна частина є необов'язково заміщеною 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідроксилу, CHR6NR7R8 або одну з наступних гр уп W являє собою N або СН; Q являє собою CHR14, NR9, S або О; R6 являє собою Η або нижчий алкіл; R7 і R8, незалежно, являють собою Н, ацил, нижчий алкіл або нижчий гідроксіалкіл; R9 являє собою нижчий алкіл або феніл; R10 і R11, незалежно, являють собою Η або нижчий алкіл; R12 являє собою Η або нижчий алкіл; R13 являє собою Н, алкілсульфоніл або ацил; R14 являє собою Н, -ОН, -COOR 15 ; R15 являє собою Η або нижчий алкіл; R16 і R17, незалежно, являють собою Н, ацил, алкілсульфоніл, -C(S)NHR18 або -C(O)NHR18; R18 являє собою Η або нижчий алкіл; R19 являє собою Η або -ОН; R20 являє собою піридинільну групу, необов'язково заміщену групою -NO2 ; R21 і R22 являють собою нижчий алкіл; і їх фармацевтично прийнятні солі та складні ефіри. До однієї групи переважних сполук і їх фармацевтично прийнятних солей та складних ефірів відносяться сполуки формули (Іb) aбо (llb), де значення R1, R2, R3, Χ, Υ і Ζ представлені вище. 6 До підгрупи переважних сполук і їх фармацевтично прийнятних солей та складних ефірів відносяться сполуки формули (Іс) або (llс), де R1, R2, R3, Χ, Υ і Ζ мають значення, представлені вище. До іншої гр упи переважних сполук і їх фармацевтично прийнятних солей та складних ефірів відносяться сполуки формули (І) або (II), де R1 являє собою -NHC(O)R 5, X є О, Υ є СН2 і Ζ є CHR12. До однієї з підгруп переважних сполук і їх фармацевтично прийнятних солей та складних ефірів відносяться сполуки формули (І) або (II), де R1 являє собою -NHC(O)R 5, X є О, Υ є СН2 і Ζ є СН2 і R5 являє собою алкіл, заміщений 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідрокси, або карбоксіалкіл, в якому алкільна частина є необов'язково заміщеною 1-3 замісниками, вибраними з групи, що складається з галогену, аміно і гідроксилу, CHR6NR7R8 або одну з наступних гр уп: До іншої гр упи переважних сполук і їх фармацевтично прийнятних солей та складних ефірів відносяться сполуки, у яких R2 або R3 є бензилокси або групою формули (llla) До однієї з підгруп переважних сполук і їх фармацевтично прийнятних солей та складних ефірів відносяться сполуки, де R4 і R1 є NO2 . Даний винахід представляє також фармацевтичну композицію, що містить сполуку формули (І) або (II) разом з фармацевтично прийнятним носієм. Даний винахід, крім того, представляє спосіб інгібування механізму обміну Na+/Ca2+ у клітині, що включає введення пацієнту, який потребує цього, терапевтично ефективної кількості сполуки формули (І) і (II). Даний винахід додатково включає спосіб запобігання надмірному накопиченню іонів Са 2+ у клітинах, що включає введення пацієнту, який потребує цього, терапевтично ефективної кількості сполуки формули (І) або (II). 7 81941 8 Даний винахід, крім того, представляє спосіб Похідні нікотинової кислоти (12) і їх складні лікування аритмій, що включає введення пацієнту, ефіри (11) одержують, як показано на схемі 3. який потребує цього, терапевтично ефективної Етерифікація 6-хлорнікотинової кислоти і її реакція кількості сполуки формули (І) і (II). з фенольними похідними (IV) дає похідні Фіг.1 представляє вплив сполук з прикладів складного ефіру нікотинової кислоти (11) (R може 13, 33, 14а і 14b на початковому відрізку часу бути нижчим алкілом). Похідні нікотинової кислоти швидкого підвищення викликаних уабаїном (12) одержують шляхом гідролізу. додаткових скорочень папілярних м'язів морських свинок. Фіг.2 представляє вплив сполук з прикладів 13, 33, 14а і 14b на максимальний рівень викликаних уабаїном додаткових скорочень папілярних м'язів морських свинок. Фіг.3 представляє вплив сполук з прикладів 13, 33, 14а і 14b на час максимального рівня викликаних уабаїном додаткових скорочень папілярних м'язів морських свинок. Сполуки даного винаходу можуть бути одержані з відповідних фенольних похідних (IV), де R2, R3, Χ, Ζ і Υ мають ті ж значення, які наведені вище. Способи синтезу показані на схемі 1, де формула (IV) представлена абревіатурою як ArОН (IV). Піридин-2-ілокси-похідні (1) одержують шляхом реакцій з відповідними галогенпіридинами (2), де R1 може бути воднем, нітро, ціано, галогеном або амідом, а Х1 - хлором або бромом. Нітропіридинові і нікотинамідні похідні можуть бути відновлені до відповідних амінів (3) і (4), відповідно. Реакція 2-хлор-5-хлорметилпіридину (5) з диметиламіном дає у результаті (6-хлорпіридин-3ілметил)диметиламін (6), який, у свою чергу можна вводити у взаємодію з фенольними похідними (IV), як показано на схемі 2. Амінопіридинові похідні (3) вводять у взаємодію з відповідними амінокислотами та іншими похідними карбонових кислот, використовуючи гідрохлорид 1(диметиламінопропіл)-3-етилакарбодііміду як конденсуючий реагент, щоб одержати амідні похідні (13), як показано на наступній схемі 4, де R5 має значення, наведені вище. За бажанням, амідні похідні (13) можуть бути одержані добре відомими методами ацилювання. Захисні групи, якщо необхідно, видаляють. 4-(4-метилпіперазин-1-ілметил)бензойну кислоту (17) одержують, як описано на наступній схемі 5. 4-хлорметилбензойну кислоту (14) спочатку етерифікують до метилового ефіру, щоб захистити кислотну гр упу у наступній реакції. Потім метиловий ефір 4-хлорметилбензойної кислоти (15) взаємодіє з 1-метилпіперазином з одержанням метилового ефіру 4-(4метилпіперазин-1-ілметил)бензойної кислоти (16). Метиловий ефір розщеплюють нагріванням з гідроксидом калію у метанолі. 4-(4метилпіперазин-1-ілметил)бензойну кислоту вводять у взаємодію з амінопіридиновими похідними (3), як описано вище на схемі 4, з одержанням N-4-(4-метилпіперазин-1ілметил)бензамідних похідних (13). Таким же чином можуть бути одержані інші N-4-(піперазин-1ілметил)бензамідні похідні. 9 81941 10 група 1-інданонів (28) може бути відновлена за Клеменсеном. У кінці метоксііндан (29) піддають дефлегмації у концентрованій бромистоводневій кислоті з одержанням 2-феніліндан-5-олів (30). 2-Хлорацетамідні похідні (13'), де R5 являє собою СН 2СI, вводять у взаємодію з азидом натрію з одержанням азидних похідних (18), які, у свою чергу, відновлюють до відповідних 2аміноацетамідних похідних (19), як показано на наступній схемі 6, де R7 і R8 мають значення, наведені вище. Ацетамідні похідні (20) одержують з 2-хлорацетамідних похідних (13') за реакцією з різними амінами. Амідна група ацетамідних похідних (20) може бути відновлена для одержання відповідних амінів (21). Похідні 6-гідроксифлаванону можна синтезувати, як показано на схемі 9, де R 2, R3 і R12 мають значення, вказані вище. 2',5'Дигідроксіацетофенон або відповідний пропіофенон (32) конденсують з відповідним бензальдегідом (31), одержуючи суміш бажаного 6-гідроксифлаванону (34) і відповідного халькону (35). Халькон циклізують до флаванону. Як показано на наступній схемі 7, де R 2 і R3 є такими, як визначено вище, 6і 7гідроксифлаванові похідні (23) одержують з відповідних флаванонів (22) шляхом відновлення Клеменсена. 6- і 7-гідроксифлаванони (22) доступні для придбання або можуть бути синтезовані методами, описаними у літературі, наприклад, [J. Org. Chem., 1960, 25, 1247-9 і J. Org. Chem., 1958, 23, 1159-61], як описано далі на схемі 9. На наведеній нижче схемі 8, де R 2 і R3 є такими, як визначено вище, описаний синтез 2феніл-індан-5-олів (30). Конденсація панізальдегіду (24) із заміщеною фенілоцтовою кислотою (25) дає суміш цис- і транс-ізомерів відповідної акрилової кислоти (26). Після гідрування і внутрішньомолекулярної реакції Фріделя-Крафтса карбонільна функціональна Похідні бензальдегіду (31), де R2 і R3 можуть містити піридиновий залишок, одержують реакцією гідроксибензальдегідів (35) з похідними піридину (36) (де X1 може бути хлором або бромом, і R' воднем, нітро або галогеном), як показано на схемі 10. 2-Фенілхроман-4,6-діольні похідні (39) одержують з відповідних 6-гідроксифлаванонів 11 81941 (38) відновленням, як показано на схемі 11, де R2, R3 і R12 , мають значення, наведені вище. Ці діольні похідні можуть бути відновлені далі до 6гідроксифлаванів (40). На наступній схемі 12, де R2 і R3 мають значення, наведені вище, описаний синтез 7гідроксіізофлавонів (45) і 7-гідроксіізофлаванів (46). Ацилювання 3-метоксифенолу (41) заміщеними фенілоцтовими кислотами (42) дає відповідні 2-гідроксидезоксибензоїни (43), які можна циклізувати за допомогою триетилортоформіату з одержанням ізофлавонів (44). Видалення захисту бромистоводневою кислотою і каталітичним гідруванням дає 7гідроксіізофлавани (46). 12 На наведеній нижче схемі 14 описаний синтез 6-феніл-5,6,7,8-тетрагідронафталін-2-олу (55) і 6гідрокси-2-феніл-3,4-дигідро-2Н-нафталін-1-ону (54). a-арилування, що каталізується паладієм, 6метокси-1-тетралону (51) дає 6-метокси-2-феніл3,4-дигідро-2Н-нафталін-1-он (53), що, після деметилування, приводить до фенольної сполуки (54). Відновлення триетилсиланом дає 6-феніл5,6,7,8-тетрагідронафталін-2-ол (55). На наступній схемі 15, де R2 і R3 мають значення, наведені вище, і R1 є відповідною захисною групою, описаний синтез 2,3-дигідро-2фенілбензо[1,4]діоксин-6-олів (60). Після того, як захисні групи 2,5-дигідроксіацетофенону видаляють, цей кетон піддають перегрупуванню з перкислотами і після гідролізу це дає фенол (56). Фенол (56) конденсують з галогенкетоном, і після відновлення і видалення захисних гр уп гідроксифенол (59) циклізують до 2,3-Дигідро-2фенілбензо[1,4]-діоксин-6-олу (60). На наступній схемі 13 описаний синтез 2феніл-2,3-дигідробензо[1,4]оксатіїн-6-олу (50). Реакція 2-меркаптобензол-1,4-діолу (47) з епоксидом стиролу (48) у присутності основи дає сульфід (49). Циклізація за допомогою кислотної іонообмінної смоли дає 2-феніл-2,3дигідробензо[1,4]оксатіїн-6-ол (50). 13 81941 Дигідроксифлаванові похідні (61) можна вводити у взаємодію з піридиновими похідними таким же чином, як описано для сполуки (1) на схемі 1. 4-Хроманольне похідне (62), де R* є ОН, може бути відновлене до відповідного флавану триетилсиланом у кислому середовищі. 5нітропіридинові похідні (62) відновлюють до відповідних 2-амінопохідних (63), які, у свою чергу, можна ацилювати або мезилювати, або вводити у взаємодію з різними похідними амінокислот або карбонових кислот, як описано на схемі 4 для сполуки (13). 14 Коли нітрогрупу у бензилоксипохідних (65) відновлюють гідруванням з використанням паладію як каталізатора, одержують [6-(5амінопіридин-2-ілокси)хроман-2-іл] фенольні похідні (68), які, у свою чергу, можуть бути ацильовані або мезильовані. Ці фенольні похідні (69) можуть бути потім введені у взаємодію з піридиновими похідними (2) з одержанням похідних, подібних до (70), як показано на наступній схемі 17. Відновлення цинком приводить до амінів, подібних до (66), які, у свою чергу, ацилюють, мезилюють або вводять у взаємодію з різними похідними амінокислот і карбонових кислот, як описано на схемі 4 для сполуки (13). Алкільні похідні амінопіридинів (3) можуть бути одержані відновним амінуванням, як показано на схемі 18 для диметиламінових похідних (71). У ході реакції аміногрупа частково мігрує з 5 у 4 положення. 15 81941 16 виготовлені у вигляді дозованих лікарських форм із застосуванням методик, відомих фа хівцям. їх можна давати пацієнту як такі, або у комбінації з відповідними фармацевтичними наповнювачами у вигляді таблеток, гранул, капсул, супозиторіїв, емульсій, суспензій або розчинів. Вибір відповідних інгредієнтів для композиції є На наступній схемі 19 описаний синтез 1звичайним для фахівців у даній галузі. Очевидно, метил-3-(піридиніл)тіосечовини (73) і похідних Nщо також можна використовувати відповідні носії, метил-N'-(піридиніл)гуанідину (74). розчинники, гелетвірні інгредієнти, інгредієнти, що Амінопіридинові похідні (3) вводять у взаємодію з формують дисперсію, антиоксиданти, барвники, метилізотіоціанатом з одержанням похідних підсолоджувачі, сполуки, що підвищують тіосечовини (73), які потім обробляють спочатку змочування, та інші інгредієнти, які звичайно метилйодидом, а потім метанольним розчином використовуються у даній галузі техніки. аміаку, щоб одержати гуанідинові похідні (74). Композиції, що містять дану активну сполуку можуть призначатися ентерально або парентерально, причому пероральний шлях є переважним. Вміст активної сполуки у композиції складає від приблизно 0,5 до 100%, переважно, від приблизно 0,5 до приблизно 20% від загальної ваги композиції. Експерименти Солі і складні ефіри даних сполук, коли це застосовно, можна одержати відомими методами. Дію сполук даного винаходу випробовували при аритміях, викликаних уабаїном на папілярних Як активні лікарські засоби придатні фізіологічно м'язах морських свинок. прийнятні солі. Прикладами є солі з неорганічними Методи кислотами, такими як соляна кислота, Папілярні м'язи морських свинок вміщували у бромистоводнева кислота або азотна кислота, і солі з органічними кислотами, такими як горизонтальну кювету для м'язів. Гачок, з'єднаний з датчиком зусилля, з'єднували з іншим кінцем метансульфонова кислота, лимонна кислота або м'яза. М'язовим препаратам задавали ритм в 1Гц винна кислота. Фізіологічно прийнятні складні електричною стимуляцією через платинові ефіри також придатні як активні лікарські засоби. електроди. Модифікований розчин Тіроде Прикладами є складні ефіри з аліфатичними або ароматичними кислотами, такими як оцтова використовували для зволоження м'язових препаратів. Склад розчину Тіроде був наступним кислота, або з аліфатичними або ароматичними (мМ): NaCl 135, MgCl2x6Η2Ο 1, КСl 5, СаСl2x2Η2Ο спиртами, такими як етанол. 2, NaHCO3 15, Na2HPO4x2H2 O 1 і глюкоза 10. Термін «алкіл» відповідно до даного опису, Розчин Тіроде насичували газом карбогеном (95% окремо або у складі іншої групи, включає радикали з лінійним, розгалуженим і циклізованим ланцюгом О2, 5% СО2) до одержання рН 7,4. Експерименти проводили при 37°С. Виявлення і аналіз до 18 атомів вуглецю, переважно, від 1 до 7 атомів напруженості скорочень здійснювали за вуглецю. Термін «нижчий алкіл» відповідно до допомогою системи вимірювання сили і потенціалу даного опису, окремо або у складі іншої групи, дії (ACFO ν. 1.0, Fision Ltd, Finland). включає радикали з лінійним, розгалуженим і циклізованим ланцюгом від 1 до 7 атомів вуглецю. Інгібування викликаних уабаїном аритмій Уабаїн, шляхом блокування натрій-калієвої Конкретними прикладами алкільного і нижчого АТФ-ази, підвищує внутрішньоклітинний вміст алкільного залишків, відповідно, є метил, етил, натрію, який замінюється на кальцій шляхом NCX. пропіл, ізопропіл, бутил, трет-бутил, пентил, Підвищена внутрішньоклітинна концентрація циклопентил, гексил, циклогексил, октил, децил і додецил, включаючи їх ізомери з розгалуженим кальцію приводить до перевантаження саркоплазматичного ретикулуму (СР) і ланцюгом. спонтанного виділення кальцію з СР, що викликає Термін «алкокси» відповідно до даного опису, затримку наступних поляризацій (ЗНП). окремо або у складі іншої групи, включає алкільну Еквівалентами для ЗНП у сигналі зусилля є груп у, якій дане визначення вище, зв'язану з атомом кисню. додаткові скорочення (ДС), які спостерігаються як спонтанні скорочення після проходження Термін «ацил» відповідно до даного опису, регульованого скорочення. окремо або у складі іншої групи, відноситься до Оцінювали антиаритмічний вплив сполук з алкілкарбонільної або алкенілкарбонільної групи, прикладів 13, 33, 14а і 14b. Результати показані на причому алкільній і алкенільній групам дане визначення вище. Фігура х з 1 по 3. На Фігурі 1 показаний вплив даних сполук на час початку швидкого підвищення Сполуки даного винаходу можна вводити викликаних уабаїном додаткових скорочень. На пацієнту у терапевтично ефективних кількостях, Фігурі 2 показаний вплив даних сполук на які звичайно знаходяться в інтервалі від максимальну силу викликаних уабаїном приблизно 0,05 до 200мг, переважно, від 0,1 до 100мг, більш переважно, від 0,5 до 50мг на добу в додаткових скорочень папілярних м'язів морських свинок. На Фігурі 3 показаний вплив даних сполук залежності від віку, ваги, стану пацієнта, шляху на час максимальної сили викликаних уабаїном введення та використовуваного інгібітору обміну Na+/Ca2+. Сполуки даного винаходу можуть бути 17 81941 18 додаткових скорочень папілярних м'язів морських 7,20 (д, 1Н, J 9,2Гц), 7,00-6,89 (м, 3Н), 5,15 (дд, 1Н, свинок. J 10,1, 2,2Гц), 2,99 (ядд, 1Н, J -16,8, 11,3, 6,2Гц), В основному, сполуки даного винаходу 2,75 (ддд, 1Н, J -16,8, 5,4, 3,3Гц) 2,18 (м, 1Н), 2,02 уповільнюють появу і знижують амплітуду (м, 1Н). додаткових скорочень. Сполука з прикладу 33 при Використовуючи ту ж методику, яка описана концентрації 10мкМ здатна повністю придушува ти вище для 5-нітро-2-(2-фенілхроман-6появу викликаного уабаїном другого додаткового ілокси)піридину, але замінюючи 2-фенілхроман-6скорочення. ол на 2-фенілхроман-7-ол, одержували: Приклади 5-Нітро-2-(2-фенілхроман-7-ілокси)піридин 1 У прикладах 1-11 в основному описане Н ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J одержання проміжних продуктів для сполук даного 2,8Гц), 8,60 (дд, 1Н, J 9,1, 2,8Гц), 7,46-7,32 (м, 5Н), винаходу. Одержання сполук даного винаходу в 7,22 (д, 1Н, J 9,1Гц), 7,20 (д, 1Н, J 8,9Гц) 6,72 (дд, основному описане у прикладі 12, далі. 1Н, J 8,9, 2,3Гц), 6,72 (д, 1Н, J 2,3Гц), 5,16 (дд, 1Н, Приклад 1. Проміжні сполуки J 10,1, 2,1Гц), 2,97 (ддд, 1Н, J -16,7, 11,3, 5,9Гц), а) 2-фенілхроманольні проміжні сполуки 2,77 (ддд, 1Н, J -16,7, 8,1, 4,5Гц) 2,20 (м, 1Н), 2,02 2-фенілхроман-6-ол (м, 1Н). Цинк (5,4г, 83,2ммоль), хлорид ртуті (II) Приклад 2. Проміжні сполуки (340мг), концентровану соляну кислоту (0,2мл) і а) Хроман-4-онові проміжні сполуки воду змішували при кімнатній температурі 6-Гідрокси-2-(4-фторфеніл)хроман-4-он протягом 15 хвилин, і суміш декантували. 62',5'-Дигідроксіацетофенон (3,0г) розчиняли у Гідроксифлаванон (1,0г) додавали у вигляді теплій льодяній оцтовій кислоті (40мл). Додавали суспензії у суміші оцтової кислоти (25мл), 4-фторбензальдегід (2,4мл) і ацетат амонію концентрованої соляної кислоти (5,2мл) і води (1,97г). Реакційну суміш нагрівали зі зворотним (2мл). Реакційну суміш нагрівали зі зворотним холодильником протягом 8 годин. Їй давали холодильником протягом 1,5 години. Після охолонути до кімнатної температури і виливали на охолоджування до кімнатної температури лід. Осад, що утворився, відфільтровували, реакційну суміш фільтр ували, і фільтрат одержуючи у результаті 4,23г суміші 2-(4екстрагували етилацетатом. Об'єднані органічні фтор феніл)-6-гідроксихроман-4-ону і 1-(2,5шари промивали насиченим розчином NaHCO3, дигідроксифеніл)-3-(4-фторфеніл)пропенону. потім водою і сушили Na2SO4. 2-Фенілхроман-6-ол Одержану суміш розчиняли в етанолі (75мл) і очищали колонковою хроматографією з додавали ацетат натрію (3,4г). Реакційну суміш використанням гептану-етилацетату (2:1) як нагрівали зі зворотним холодильником протягом 5 елюенту. годин. Потім їй давали охолонути до кімнатної 1 H ЯМР (400мг, d6-ДМСО) d: 8,78 (с, 1Н), 7,43температури і розбавляли водою, і фільтрували. 27,31 (м, 5Н), 6,63 (д, 1Н, J 8,6Гц) 6,51 (дд, 1Н, J (4-фторфеніл)-6-гідроксихроман-4-он 8,6, 2,9Гц), 6,48 (д, 1Н, J 2,9Гц), 4,98 (дд, 1Н, J, 9,9, перекристалізовували з оцтової кислоти. 1 2,2Гц), 2,89 (ддд, ін, J -16,7, 11,3, 6,1Гц), 2,63 (ддд, Н ЯМР (400МГц, d6-ДМСО) d: 7,59 (м, 2Н), 1Н, J -16,7, 5,5, 3,3Гц) 2,10 (м, 1Н), 1,94 (м, 1Н). 7,27 (м, 2Н), 7,14 (д, 1Н, J 3,1Гц), 7,05 (дд, 1Н, J Використовуючи ту ж методику, яка описана 8,9, 3,1Гц),6,96 (д, 1Н, J 8,9Гц), 5,56 (дд, 1Н, J вище для 2-фенілхроман-6-олу, але замінюючи 613,2, 2,8Гц), 3,18 (дд, 1Н, J -16,9, 13,2Гц), 2,77 (дд, гідроксифлаванон 7-гідроксифлаваноном, 1Н, J -16,9, 2,8Гц). одержували: Використовуючи ту ж методику, яка описана 2-Фенілхроман-7-ол вище для 6-гідрокси-2-(4-фторфеніл)хроман-4-ону, 1 H ЯМР (400МГц, CD3OD) d: 7,41-7,28 (м, 5Н), але замінюючи 4-фторбензальдегід відповідним 6,86 (д, 1Н, J 8,2Гц) 6,32 (дд, 1Н, J 8,2, 2,4Гц), 6,29 бензальдегідом, одержували: (д, 1Н, J 2,4Гц), 5,00 (дд, 1Н, J 9,9, 2,4Гц), 2,84 (м, 2-(3-Фторфеніл)-6-гідроксихроман-4-он 1 1Н), 2,64 (м, 1Н) 2,15 (м, 1Н), 1,99 (м, 1Н). Н ЯМР (400МГц, d6-ДМСО) d: 9,45 (с, 1Н), 7,47 b) 5-Нітро-2-(2(м, 1Η), 7,40-7,37 (м, 2Н), 7,22 (м, 1Н), 7,12 (д, 1Н, (незаміщений)фенілхроманілокси)піридинові J 3,0Гц), 7,05 (дд, 1H, J 8,8, 3,0Гц), 6,98 (д, 1H, J проміжні сполуки 8,8Гц), 5,59 (дд, 1Н, J 13,0, 2,9Гц), 3,21 (дд, 1H, J 5-Нітро-2-(2-фенілхроман-6-ілокси)піридин 16,9, 13,0Гц), 2,82 (дд, 1Н, J -16,9, 2,9Гц). Фторид калію (225мг) додавали у розчин 22-(2-Фторфеніл)-6-гідроксихроман-4-он 1 фенілхроман-6-олу (300мг) у безводному ДМФ H ЯМР (400МГц, d6-ДМСО) d: 9,45 (с, 1Н), 7,67 (3мл). Після перемішування одержаної суміші при (м, 1Н), 7,47 (м, 1H), 7,32-7.25 (м, 2Н), 7,14 (д, 1H, 120°С протягом 30 хвилин додавали 2-хлор-5J 3,0Гц), 7,04 (дд, 1H, J 8,9, 3,0Гц), 6,95 (д, 1H, J нітропіридин (195мг). Реакційну суміш 8,9Гц), 5,77 (дд, 1H, J 13,5, 2,8Гц), 3,26 (дд, 1H, J перемішували протягом ще 6,5 годин при 120°С. 16,9, 13,5Гц), 2,76 (дд, 1H, J -16,9, 2,8Гц). Після охолоджування до кімнатної температури 2-(2,3-Дифторфеніл)-6-гідроксихроман-4-он 1 додавали 1Μ розчин НСl, і суміш екстрагували Н ЯМР (400МГц, d6-ДМСО) d: 9,51 (с, 1Н), етилацетатом. Об'єднані органічні шари 7,53-7,46 (м, 2Н), 7,31 (м, 1Н), 7,14 (д, 1Н, J 3,0Гц), промивали водою, потім насиченим розчином 7,05 (дд, 1Н, J 8,8, 3,0Гц), 6,96 (д, 1Н, J 8,8Гц), 5,82 NaCl і сушили Na2SO4. 5-Нітро-2-(2-фенілхроман(дд, 1Н, J 13,4, 2,8Гц), 3,26 (дд, 1Н, J -16,9, 6-ілокси)піридин перекристалізовували з ацетон-213,4Гц), 2,79 (дд, 1Н, J -16,9, 2,8Гц). пропанолу (1:5). 2-(2,4-Дифторфеніл)-6-гідроксихроман-4-он 1 1 Н ЯМР (400МГц, d6-ДМСО) d: 9,00 (д, 1Н, J Н ЯМР (400МГц, d6-ДМСО) d: 9,46 (с, 1Н), 7,73 2,9Гц), 8,60 (дд, 1Н, J 9,2, 2,9Гц), 7,47-7,32 (м, 5Н), (м, 1Н), 7,34 (м, 1Н), 7,19 (м, 1Н), 7,13 (д, 1Н, J 19 81941 20 2,9Гц), 7,04 (дд, 1Н, J 8,8, 2,9Гц), 6,95 (д, 1Н, J 8,8Гц), 5,57 (дд, 1Н, J 13,0, 2,9Гц), 3,12 (дд, 1Н, J 8,8Гц), 5,74 (дд, 1Н, J 13,5, 2,8Гц), 3,28 (дд, 1Н, J 16,9, 13,0Гц), 2,81 (дд, 1H, J -16,9, 2,9Гц). 16,9, 13,5Гц), 2,74 (дд, 1Н, J -16,9, 2,8Гц). 2-(4-Етилфеніл)-6-гідроксихроман-4-он 1 2-(2,5-Дифторфеніл)-6-гідроксихроман-4-он Н ЯМР (400МГц, d6-ДМСО) d: 7,43 (д, 2Н, J 1 H ЯМР (300МГц, dб -ДМСО) d: 9,4 6 (с, 1Н), 8,1Гц), 7,25 (д, 2Н, J 8,1Гц), 7,11 (д, 1Н, J 3,1Гц), 7,53 (м, 1Н), 7,36-7,30 (м, 2Н), 7,14 (д, 1Н, J 3,0Гц), 7,03 (дд, 1Н, J 8,9, 3,1Гц), 6,93 (д, 1Н, J 8,9Гц), 5,51 7,05 (ддг 1Н, J 8,8, 3,0Гц), 6,97 (д, 1Н, J 8,8Гц), 5,76 (дд, 1Н, J 13,0, 2,9Гц), 3,15 (дд, 1Н, J -16,9, (дд, 1Н, J 13,6, 2,7Гц), 3,26 (дд, 1Н, J -16,8, 13,0Гц), 2,75 (дд, 1Н, J -16,9, 2,9Гц), 2,62 (кв., 2Н, J 13,6Гц), 2,76 (дд, 1Н, J -16,8, 2,7Гц). 7,5Гц), 1,18 (т, 3H, J 7,5Гц). 2-(2,6-Дифторфеніл)-6-гідроксихроман-4-он 6-гідрокси-2-(2-нітрофеніл)хроман-4-он 1 1 H ЯМР (400МГц, d6-ДМСО) d: 7,55 (м, 1Н) H ЯМР (400МГц, d6-ДМСО) d: 9,49 (с, 1Н), 7,22-7,18 (м, 2Н), 7,14 (д, 1Н, J 3,0Гц), 7,03 (дд, 1Н, 8,05-8,06 (м, 1Н), 7,96-7,98 (м, 1Н), 7,83-7,87 (м, J 8,9, 3,0Гц), 6,93 (д, 1Н, J 8,9Гц), 5,84 (дд, 1Н, J 1Н), 7,65-7,69 (м, 1Н), 7,14 (д, 1Н, J 3,1Гц), 7,05 14,0, 3,0Гц), 3,38 (дд, 1Н, J -17,0, 14,0Гц), 2,80 (дд, (дд, 1Н, J 8,8, 3,1Гц), 6,91 (д, 1Н, J 8,8Гц), 5,69 (дд, 1Н, J -17,0, 3,0Гц). 1Н, J 13,0, 2,6Гц), 3,22 (дд, 1Н, J 16,8, 13,0Гц), 2,98 2-(3,5-Дифторфеніл)-6-гідроксихроман-4-он (дд, 1Н, J 16,8, 2,6Гц). 1 6-гідрокси-2-(3-нітрофеніл)хроман-4-он Н ЯМР (400МГц, dб -ДМСО) d: 9,47 (с, 1Н), 1 7,30-7,23 (м, 3H), 7,12 (д, 1Н, J 2,9Гц), 7,06 (дд, 1Н, Н ЯМР (300МГц, d6-ДМСО) d: 8,40 (с, 1Н), 8,24 J 8,8, 2,9Гц), 7,00 (д, 1Н, J 8,8Гц), 5,60 (дд, 1Н, J (дд, 1Н, J 8,2, 2,3Гц), 8,01 (д, 1Н, J 7,9Гц), 7,74 (т, 13,1, 2,8Гц), 3,15 (дд, 1Н, J -16,8, 13,1Гц), 2,85 (ддг 1Н, J 15,9, 7,9Гц), 7,13 (д, 1Н, J 2,9Гц), 7,07 (дд, 1Н, J -16,8, 2,8Гц), 1Н, J 8,8, 2,9Гц), 7,00 (д, 1Н, ь,8Гц), 5,75 (дд, 1Н, J 6-гідрокси-2-(2-трифторметилфеніл)хроман-413,1, 2,9Гц), 3,21 (дд, 1Н, J 16,8, 13,1Гц), 2,88 (дд, он 1Н, J 16,8, 2,9Гц). 1 Н ЯМР (300МГц, d6-ДМСО) 6: 9,48 (с, 1Н), 6-гідрокси-2-(4-нітрофеніл)хроман-4-он 1 8,07 (м, 1Н) 7,86-7,79 (м, 2Н), 7,66 (м, 1Н), 7,15 (д, Н ЯМР (400МГц, d6-ДМСО) d: 9,48 (с, 1Н), 8,29 1Н, J 3,0Гц), 7,06 (дд, 1Н, J 8,8, 3,0Гц), 6,95 (д, 1Н, (д, 2Н, J 6,9Гц), 7,83 (д, 2Н, J 6,9Гц), 7,13 (д, 1Н J J 8,8Гц), 5,70 (дд, 1Н, J 13,8, 2,4Гц), 3,38 (дд, 1Н, J 2,9Гц), 7,06 (дд, 1Н, J 8,8, 2,9Гц), 7,01 (д, 1Н, J -16,9, 13,8Гц), 2,66 (дд, 1Н, J -16,9, 3,0Гц). 8,8Гц), 5,77 (дд, 1Н, J 13,0, 3,0Гц), 3,15 (дд, 1Н, J 6-гідрокси-2-(4-трифторметилфеніл)хроман-416,8, 13,0Гц), 2,89 (дд, 1Н, J 16,8, 3,0Гц). он 6-гідрокси-2-(3-метоксифеніл)хроман-4-он 1 1 Н ЯМР (400МГц, d6-ДМСО) d: 9,47 (с, 1Н), Н ЯМР (400МГц, d6-ДМСО) d: 9,42 (с, 1Н), 7,33 7,82-7,76 (м, 4Н), 7,13 (д, 1Н, J 3,0Гц), 7,06 (дд, 1Н, (т, 1Η, J 15,8, 8,3Гц), 7,12 (д, 1Н, J 3,0Гц), 7,10 (с, J 8,8, 3,0Гц), 6,99 (д, 1Н, J 8,8Гц), 5,70 (дд, 1Н, J 1Н), 7,09 (д, 1Н, J 8,3Гц), 7,04 (дд, 1Н, J 8,8, 3,0Гц), 12,9, 2,9Гц), 3,16 (дд, 1Н, J -16,9, 12,9Гц), 2,86 (дд, 6,96 (д, 1Н, 8,8Гц), 6,93 (дд, 1Н, J 8,0, 2,5Гц), 5,52 1Н, J -16,9, 2,9Гц). (дд, 1Н, J 12,9, 2,9Гц), 3,77 (с, 3H), 3,17 (дд, 1Н, J 2-(3-Хлор-4-фторфеніл)-6-гідроксихроман-4-он 16,9, 12,9Гц), 2,77 (дд, 1Н, J 16,9, 2,9Гц). 1 H ЯМР (400МГц, d6-ДМСО) d: 9,45 (с, 1Н), 7,53 6-гідрокси-3-метил-2-фенілхроман-4-он 1 (м, 1Н), 7,36-7,31 (м, 2Н), 7,13 (д, 1Н, J 3,0Гц), 7,05 H ЯМР (300МГц, d6-ДМСО) d: 9,37 (с, 1Н), 7,53 (дд, 1Н, J 8,9, 3,0Гц), 6,96 (д, 1Н, J 8,9Гц), 5,76 (дд, (м, 2Н), 7,47-7,39 (м, 3H), 7,13 (д, 1Н, J 3,1Гц), 7,02 1Н, J 13,5, 2,7Гц), 3,26 (дд, 1Н, J -16,9, 13,5Гц), (дд, 1Н, J 8,9, 3,1Гц), 6,89(д, 1Н, J 8,9Гц), 5,17 (д, 2,75 (дд, 1Н, J -16,9, 2,7Гц). 1Н, J 12,3), 3,18 (дкв, 1Н, J 12,3, 6,9Гц), 0,84 (д, 3H, 2-(2-Хлорфеніл)-6-гідроксихроман-4-он J 6,9Гц). 1 H ЯМР (400МГц, d6-ДМСО) d: 9,49 (с, 1Н), 7,77 b) Хроман-4,6-діольні проміжні сполуки 2-(4(дд, 1Н, J 7,7, 2,0Гц), 7,53 (дд, 1Н, J 7,6, 1,8Гц), Фторфеніл)хроман-4,6-діол 7,49-7,41 (м, 2Н), 7,14 (д, 1Н, J 2,9Гц), 7,06 (дд, 1Н, У суспензію 2-(4-фторфеніл)-6J 8,8, 2,9Гц), 6,93 (д, 1Н, J 8,8Гц), 5,78 (дд, 1Н, J гідроксихроман-4-ону (3,4г) у безводному ТГФ 13,6, 2,6Гц), 3,19 (дд, 1Н, J -16,9, 13,6Гц), 2,78 (дд, (34мл) краплями додавали розчин боран-ТГФ 1Н, J -16,9, 2,6Гц). комплексу (20мл, 1,0Μ у ТГФ) в атмосфері азоту. 2-(3-Хлорфеніл)-6-гідроксихроман-4-он Реакційну суміш нагрівали зі зворотним 1 холодильником протягом 1 години. Після Н ЯМР (400МГц, d6-ДМСО) d: 9,47 (с, 1Н), 7,62 охолоджування до кімнатної температури її (с, 1Н), 7,51-7,45 (м, 3H), 7,12 (д, 1Н, J 3,0Гц), 7,05 виливали у льодяний 2М розчин НСl. 2-(4(дд, 1Н, J 8,8, 3,0Гц), 6,98 (д, 1Н, J 8,8Гц), 5,58 (дд, Фторфеніл)хроман-4,6-діол відфільтровували. 1Н, J 13,1, 2,9Гц), 3,18 (дд, 1Н, J -16,9, 13,1Гц), 1 2,81 (ддг 1Н, J -16,9, 2,9Гц). Н ЯМР (400МГц, d6-ДМСО) d: 8,84 (с, 1Н), 7,48 2-(2,4-Дихлорфеніл)-6-гідроксихроман-4-он (м, 2Н), 7,21 (м, 2Η), 6,89 (д, 1Н, J 2,7Гц), 6,59 (д, 1 1H, J 8,7Гц), 6,54 (дд, 1Н, J 8,7, 2,7Гц), 5,42 H ЯМР (400МГц, d6-ДМСО) d: 9,49 (с, 1Н), 7,78 (ушир.с, 1Н), 5,12 (д, 1Н, J 10,7Гц), 4,87 (м, 1H), (д, 1Н, J 8,5Гц), 7,71 (д, 1Н, J 2,0Гц), 7,57 (дд, 1Н, J 2,25 (м, 1Н), 1,89 (м, 1Н). 8,5, 2,0Гц), 7,14 (д, 1Н, J 3,0Гц), 7,06 (дд, 1Н, J 8,8, Використовуючи ту ж методику, яка описана 3,0Гц), 6,97 (д, 1Н, J 8,8Гц), 5,77 (дд, 1Н, J 13,5, вище для 2-(4-фтор феніл)хроман-4,6-діолу, але 2,7Гц), 3,18 (дд, 1Н, J -16,9, 13,5Гц), 2,78 (дд, 1Н, J замінюючи 2-(4-фторфеніл)-6-гідроксихроман-4-он -16,9, 2,7Гц). відповідним 2-феніл-6-гідроксихроман-4-оном, 2-(3-Бромфеніл)-6-гідроксихроман-4-он 1 одержували: Н ЯМР (300МГц, d6-ДМСО) d: 9,41 (с, 1Н), 7,50 2-(3-фторфеніл)хроман-4,6-діол (м, 1Н), 7,59-7,53 (м, 2Н), 7,39 (м, 1Н) 7,12 (д, 1Н, J 2,9Гц), 7,05 (дд, 1Н, J 8,8, 2,9Гц), 6,98 (д, 1Н, J 21 81941 22 1 Н ЯМР (400МГц, d6-ДМСО) d: 8,85 (с, 1Н), 7,45 H ЯМР (400МГц, d6-ДМСО) d: 8,85 (с, 1Н), 7,50 (м, 1Н), 7,30-7,25 (м, 2Н), 7,15 (м, 1Н), 6,88 (д, 1Н, (д, 1Н, J 1,7Гц), 7,46-7,38 (м, 3H), 6,88 (д, 1Н, J J 2,8Гц), 6,62 (д, 1Н, J 8,7Гц), 6,55 (дд, 1Н, J 8,7, 2,5Гц), 6,62 (д, 1Н, J 8,6Гц), 6,55 (дд, 1Н, J 8,6, 2,8Гц), 5,44 (д, 1H, J 7,0Гц), 5,15 (д, 1Н, J 10,7Гц), 2,5Гц), 5,44 (д, 1Н, J 6,6Гц), 5,15 (дд, 1Н, J 11,8, 4,86 (м, 1Н), 2,29 (м, 1Н), 1,86 (м, 1Н). 1,4Гц), 4,87 (м, 1Н), 2,29 (м, 1Н), 1,85 (м, 1Н). 2-(2-фторфеніл)хроман-4,6-діол 2-(2,4-Дихлорфеніл)хроман-4,6-діол 1 1 H ЯМР (400МГц, d6-ДМСО) d: 8,85 (с, 1Н), 7,56 H ЯМР (400МГц, d6-ДМСО) d: 8,89 (с, ХН), (м, 1Н), 7,40 (м, 1Н), 7,28-7,21 (м, 2Н), 6,89 (д, 1Н, 7,66 (д, 1Н, J 2,1Гц), 7,64 (д, 1Н, J 8,5Гц), 7,51 (дд, J 2,9Гц), 6,60 (д, 1Н, J 8,7Гц), 6,54 (дд, 1Н, J 8,7, 1Н, J 2,1, 8,5Гц), 6,89 (д, 1Н, J 2,7Гц), 6,63 (д, 1Н, J 2,8Гц), 5,46 (д, 1Н, J 6,9Гц), 5,35 (д, 1Н, J 10,6Гц), 8,7Гц), 6,56 (дд, 1Н, J 2,7, 8,7Гц), 5,50 (д, 1Н, J 4,89 (м, 1Н), 2,26 (м, 1Н), 1,98 (м, 1Н). 6,8Гц), 5,37 (д, 1Н, J 10,4Гц), 4,90 (м, 1Η), 2,32 (м, 2-(2,3-Дифторфеніл)хроман-4,6-діол 1Η), 1,80 (м, 1Н). 1 2-(3-Бромфеніл)хроман-4,6-діол H ЯМР (400МГц, d6-ДМСО) d: 8,88 (с, 1Н), 1 7,45-7,36 (м, 2Н), 7,28 (м, 1Н), 6,89 (д, 1Н, J 2,8Гц), H ЯМР (300МГц, d6-ДМСО) d: 8,83 (с, 1Н), 7,63 6,61 (д, 1Н, J 8,7Гц), 6,55 (дд, 1Н, J 8,7, 2,8Гц), 5,49 (м, 1Н) 7,53 (м, 1H) 7,46 (м, 1H) 7,37 (м, 1H), 6,88 (ушир.с, 1Н), 5,40 (дд, 1Н, J 11,8, 1,4Гц), 4,90 (м, (д, 1Н, J 2,9Гц), 6,62 (д, 1Н, J 8,7Гц), 6,55 (дд, 1Н, J 1Н), 2,28 (м, 1Н), 1,99 (м, 1Н). 8,7, 2,9Гц), 5,42 (д, 1Н, J 7,0Гц), 5,14 (Д, 1Н, J 2-(2,4-Дифторфеніл)хроман-4,6-діол 10,5Гц), 4,86 (м, 1Н), 2,29 (м, 1Η), 1,84 (м, 1Н). 1 2-(4-Етилфеніл)хроман-4,6-діол H ЯМР (400МГц, d6-ДМСО) d: 8,86 (с, 1Н), 7,61 1 (м, 1Н), 7,28 (м, 1Н), 7,14 (м, 1H), 6,88 (д, 1Н, J H ЯМР (400МГц, d6-ДМСО) d: 8,81 (с, 1Н), 7,34 2,7Гц), 6,59 (д, 1Н, J 8,9Гц), 6,54 (дд, 1Н, J 8,9, (д, 2Н, J 8,0Гц) 7,22 (д, 2Н, J 8,0Гц), 6,88 (д, 1Н, J 2,7Гц), 5,46 (с, 1Н), 5,32 (дд, 1Н, J 11,9, 1,4Гц), 4,88 2,8Гц), 6,57 (д, 1Н, J 8,6Гц), 6,53 (дд, 1Н, J 8,6, (м, 1Н), 2,24 (м, 1Н), 1,99 (м, 1Н). 2,8Гц), 5,39 (д, 1Н, J 7,1Гц), 5,06 (д, 1Н, J 10,7Гц), 2-(2,5-Дифторфеніл)хроман-4,6-діол 4,86 (м, 1Н), 2,61 (кв., 2Н, J 7,6Гц), 2,29 (м, 1Н), 1 1,84 (м, 1Н), 1,19 (т, 3H, J 7,6Гц). Н ЯМР (400МГц, d6-ДМСО) d: 8,87 (с, 1Н), 7,39-7,22 (м, 3H), 6,89 (д, 1Н, J 2,8Гц), 6,63 (д, 1Н, 2-(2-Нітрофеніл)хроман-4,6-діол 1 J 8,7Гц), 6,56 (дд, 1Н, J 8,7, 2,8Гц), 5,50 (д, 1Н, J H ЯМР (300МГц, d6-ДМСО) d: 8,87 (с, ХН), 6,8Гц), 5,35 (д, 1Н, J 11,2Гц), 4,89 (м, 1Н), 2,28 (м, 7,99-8,02 (м, 1Н), 7,77-7,86 (м, 2Н), 7,59-7,64 (м, 1Н), 1,95 (м, 1Н). ХН), 6,89 (д, ХН, J 2,4Гц), 6,56-6,57 (м, 2Н), 5,512-(2,6-Дифторфеніл)хроман-4,6-діол 5,55 (м, 2Н), 4,85-4,92 (м, 1Н), 2,42-2,47 (м, 1Н), 1 1,85-1,96 (м, 1Н). Н ЯМР (400МГц, d6-ДМСО) d: 8,87 (с, 1Н), 7,48 2-(3-Нітрофеніл)хроман-4,6-діол (м, 1Н), 7,17-7,13 (м, 2Н), 6,90 (д, 1Н, J 2,9Гц), 1 6,55-6,54 (м, 2Н), 5,46 (дд, 1Н, J 12,2, 1,8Гц), 4,87 Н ЯМР (400МГц, d6-ДМСО) d: 8,89 (ушир, с, (м, 1Н), 2,37 (м, 1Н), 2,23 (м, 1Н). 1Н), 8,29 (с, 1Н), 8,20 (дд, 1Н, J 8,2, 2,3Гц), 7,93 (д, 2-(3,5-Дифторфеніл)хроман-4,6-діол 1Н, J 7,9Гц), 7,71 (т, 1Н, J 15,9, 7,9Гц), 6,89 (д, 1Н, 1 J 2,8Гц), 6,66 (д, 1Н, J 8,7Гц), 6,57 (дд, 1Н, J 8,7, Н ЯМР (400МГц, d6-ДМСО) d: 8,87 (с, 1Η), 2,9Гц), 5,47 (ушир.с, 1Н), 5,33 (д, ХН, J 10,7Гц), 7,21-7,17 (м, 3H), 6,88 (д, 1Н, J 2,4Гц), 6,64 (д, 1Н, 4,88-4,92 (м, 1Н), 2,33-2,39 (м, 1Н), 1,83-1,92 (м, J 8,7Гц), 6,55 (дд, 1Н, J 2,4, 8,7Гц), 5,47 (д, 1Н, J 1Н). 7,0Гц), 5,17 (д, 1Н, J 10,5Гц), 4,86 (м, 1Н), 2,32 (м, 1Н), 1,85 (м, 1Н). 2-(4-Нітрофеніл)хроман-4,6-діол 1 2-(2-Трифторметилфеніл)хроман-4,6-діол H ЯМР (300МГц, d6-ДМСО) d: 8,86 (с, 1H), 8,26 1 (д, 2Н, J 6,9Гц), 7,74 (д, 2Н, J 6,9Гц), 6,89 (д, 1Н J H ЯМР (300МГц, d6-ДМСО) d: 8,89 (с, 1Н), 7,83 2,8Гц), 6,65 (д, 1Н, J 8,6Гц), 6,56 (дд, 1Н, J 8,6, (м, 1Н), 1,19-1,74 (м, 2Н), 7,58 (м, 1Н), 6,90 (д, 1Н, 2,8Гц), 5,46 (д, 1Н, J 6,9Гц), 5,32 (д, 1Н, J 10,5Гц), J 2,7Гц), 6,61 (д, 1Н, J 8,9Гц), 6,56 (дд, 1Н, J 8,7, 4,86-4,94 (м, 1Н), 2,31-2,38 (м, 1Н), 1,78-1,89 (м, 2,7Гц), 5,51 (д, 1Н, J 6,5Гц), 5,34 (д, 1Н, J 11,6Гц), 1Н). 4,88 (м, 1Н), 2,21 (м, 1Н), 1,95 (м, 1Н). 2-(3-Метоксифеніл)хроман-4,6-діол 2-(4-Трифторметилфеніл)хроман-4,6-діол 1 1 Н ЯМР (400МГц, d6-ДМСО) d: 8,82 (с, 1Н), 7,31 Н ЯМР (400МГц, d6-ДМСО) d: 8,86 (с, 1Н), 7,77 (д, 2Н, J 8,3Гц), 7,68 (д, 2Н, J 8,3Гц), 6,89 (д, 1Н, J (т, 1Η, J 15,7, 7,9Гц), 6,99-7,02 (м, 2Н), 6,88-6,90 (м, 2Н), 6,59 (д, 1Н, J 8,7Гц), 6,54 (дд, 1Н, J 8,7, 2,8Гц), 2,9Гц), 6,63 (д, 1Н, J 8,7Гц), 6,56 (дд, 1Н, J 8,7, 5,40 (д, 1Н, J 7,0Гц), 5,08 (д, 1Н, J 11,5Гц), 4,832,9Гц), 5,45 (д, 1Н, J 7,0Гц), 5,26 (д, 1Н, J 11,2Гц), 4,89 (м, 1Н), 3,77 (с, 3H), 2,23-2,28 (м, 1Н), 1,834,90 (м, 1Н), 2,32 (м, 1Н), 1,85 (м, 1Н). 1,92 (м, 1Н). 2-(3-Хлор-4-фторфеніл)хроман-4,6-діол 1 3-Метил-2-фенілхроман-4,6-діол Н ЯМР (400МГц, d6-ДМСО) d: 8,88 (с, 1Н), 1 Н ЯМР (300МГц, d6-ДМСО) d: 8,79 (с, 1Н), 7,39-7,24 (м, 3H), 6,88 (д, 1Н, J 2,8Гц), 6,63 (д, 1Н, 7,42-7,33 (м, 5Н), 6,88 (ушир.с, 1Н,), 6,53 (м, 2Н), J 8,7Гц), 6,55 (дд, 1Н, J 8,7, 2,8Гц), 5,49 (д, 1Н, J 5,37 (д, 1Н, J 8,0Гц), 4,70 (д, 1Н, J 10,6Гц), 1,94 (м, 6,8Гц), 5,35 (д, 1Н, J 11,3Гц), 4,89 (м, 1Н), 2,39 (м, 1Н), 0,73 (д, 3H, J 6,7Гц). 1Н), 1,97 (м, 1Н). с) Хроман-6-ольні проміжні сполуки 2-(2-Хлорфеніл)хроман-4,6-діол 1 2-(4-Фторфеніл)хроман-6-ол H ЯМР (400МГц, d6-ДМСО) d: 7,63 (дд, 1Н, J Триетилсилан (14мл) повільно додавали у 7,7, 1,8Гц), 7,49 (дд, 1Н, J 7,8, 1,4Гц), 7,45-7,36 (м, розчин 2-(4-фторфеніл)хроман-4,6-діолу (2,9г) у 2Н), 6,89 (д, 1Н, J 2,9Гц), 6,63 (д, 1Н, J 8,8Гц), 6,56 дихлорметані (58мл). Потім у реакційну суміш по (дд, 1Н, J 8,9, 2,9Гц), 5,39 (дд, 1Н, J 11,7, 1,5Гц), краплях додавали трифтороцтову кислоту (27мл), і 4,90 (м, 1Н), 2,33 (м, 1Н), 1,82 (м, 1Н). перемішували її при кімнатній температурі 2-(3-Хлорфеніл)хроман-4,б-діол 1 23 81941 24 протягом 1 години. Реакційну суміш виливали у 8,6Гц), 6,53 (д, 1Н, J 2,9Гц), 6,51 (дд, 1Н, 8,6, льодяну воду і екстрагували дихлорметаном. 2,9Гц), 5,12 (д, 1Н, J 8,3Гц), 2,90 (м, 1Н), 2,63 (м, Залишок випарювали при зниженому тиску з 1Н), 2,16 (м, 1Н), 1,92 (м, 1Н). толуолом з одержанням 2-(4-фторфеніл)хроман-62-(3-Хлор-4-фторфеніл)хроман-6-ол 1 олу. Н ЯМР (400МГц, d6-ДМСО) d: 8,84 (с, 1Н), 1 Н ЯМР (400 МГц, CDCl3) d: 7,38 (м, 2Н), 7,06 7,33-7,21 (м, 3H), 6,66 (д, 1Н, J 8,3Гц) 6,54-6,51 (м, (м, 2Н), 6,77 (д, 1Н, J 8,6Гц), 6,61 (дд, 1Н, J 8,6, 2Н), 5,19 (д, 1Н, J, 8,8Гц), 2,92 (м, 1Н), 2,66 (м, 1Н) 2,9Гц) 6,57 (д, 1Н, 8,6Гц), 4,97 (дд, 1Н, J 10,2, 2,12 (м, 1Н), 1,96 (м, 1Н). 2,4Гц), 2,95 (ддд, 1Н, J -16,8, 11,4, 6,2Гц), 2,74 2-(2-Хлорфеніл)хроман-6-ол 1 (ддд, 1Н, J -16,8, 5,3, 3,1Гц), 2,15 (м, 1Н), 2,05 (м, Н ЯМР (300МГц, d6-ДМСО) d: 7,58-7,36 (м, 1Н). 4Н), 6,66 (м, 1Н), 6,55-6,51 (м, 2Н), 5,23 (дд, 1Н, J Використовуючи ту ж методику, яка описана 10,1, 2,1 Гц), 2,92 (м, 1Н), 2,68 (м, 1Н), 2,17 (м, 1Н), вище для 2-(4-фторфеніл)хроман-6-олу, але 1,87 (м, 1Н). замінюючи 2-(4-фторфеніл)хроман-4,6-діол 2-(3-Хлорфеніл)хроман-6-ол 1 відповідним 2-фенілхроман-4,6-діолом, H ЯМР (300МГц, d6-ДМСО) d: 8,79 (с, 1Н), 7,48 одержували: (д, 1Н, J 0,7Гц), 7,42-7,37 (м, 3H), 6,71-6,49 (м, 3H), 2-(3-Фторфеніл)хроман-6-ол 5,04 (м, 1H), 2,91 (м, 1Н), 2,65 (м, 1Н), 2,12 (м, 1Н), 1 Н ЯМР (400МГц, d6-ДМСО) d: 8,78 (с, 1Н), 7,43 1,93 (м, 1Н). (м, 1Н), 7,28-7,25 (м, 2Η), 7,14 (м, 1Η), 6,66 (д, 1Н, 2-(2,4-Дихлорфеніл)хроман-6-ол 1 J 8,5Гц) 6,52 (дд, 1H, J 8,5, 2,7Гц), 6,49 (д, 1H, J Н ЯМР (400МГц, d6-ДМСО) d: 8,85 (с, 1Н), 7,65 2,7Гц), 5,03 (дд, 1Н, J 9,9, 2,1Гц), 2,86 (м, 1Н), 2,63 (д, 1Н, J 2,2Гц), 7,57 (д, 1Н, J 8,4Гц), 7,49 (дд, 1Н, J (м, 1Н) 2,13 (м, 1Н), 1,93 (м, 1Н). 8,4, 2,2Гц), 6,67-6,51 (м, 3H), 5,21 (дд, 1Н, J 10,3, 2-(2-Фторфеніл)хроман-6-ол 2,1Гц), 2,91 (м, 1Н), 2,69 (м, 1Н), 2,16 (м, 1Н), 1,85 1 H ЯМР (300МГц, d6-ДМСО) d: 7,50 (м, 1Н), (м, 1Н). 7,39 (м, 1Н), 7,26-7,19 (м, 2Н), 6,63 (м, 1Н) 6,532-(3-Бромфеніл)хроман-6-ол 1 6,50 (м, 2Н), 5,21 (дд, 1Н, J, 10,2, 2,3Гц), 2,98 (ддд, H ЯМР (400МГц, d6-ДМСО) d: 8,81 (с, 1Н), 7,61 1Н, J -16,9, 11,2, 6,0Гц), 2,66 (ддд, 1Н, J -16,9, 5,0, (м, 1Н), 7,51 (м, 1Н), 7,43 (м, 1Н), 7,35 (м, 1Н) 6,672,9Гц) 2,11 (м, 1Н), 1,99 (м, 1Н). 6,48 (м, 3H), 5,01 (м, 1Н), 2,87 (м, 1Н, ), 2,63 (м, 2-(2,3-Дифторфеніл)хроман-6-ол 1Н), 2,12 (м, 1Н), 1,92 (м, 1Н). 1 Н ЯМР (400МГц, d6-ДМСО) d: 8,85 (с, 1Н), 7,41 2-(4-Етилфеніл)хроман-6-ол 1 (м, 1Н), 7,33 (м, 1Η), 7,26 (Μ, 1Η), 6,64 (дд, 1Н, 9,0, H ЯМР (400МГц, CD3OD) d: 7,26 (д, 2Н, J 2,8Гц), 6,54-6,51 (м, 2Η), 5,25 (дд, 1Η, J 10,2, 8,2Гц) 7,13 (д, 2Н, J 8,2Гц), 6,65 (д, 1Н, J 8,6Гц), 2,2Гц), 2,93 (м, 1Η), 2,66 (м, 1Η), 2,14 (м, 1Η), 2,01 6,55 (дд, 1Н, J 8,6, 2,8Гц), 6,51 (д, 1Н, J 2,8Гц), 4,83 (м, 1Н). (дд, 1Н, J 10,1, 2,3Гц), 2,84 (м, 1Н, ), 2,62 (м, 1Н), 2-(2,4-Дифторфеніл)хроман-6-ол 2,59 (кв., 2Н, J 7,6Гц) 2,03 (м, 1Н), 1,93 (м, 1Н), 1 Н ЯМР (400МГц, d6-ДМСО) d: 8,83 (с, 1Н), 7,56 1,19 (т, 3H, J 7,6Гц). (м, 1Н), 7,28 (м, 1Η), 7,13 (м, 1Η), 6,63 (м, 1Η), 6,532-(2-Нітрофеніл)хроман-6-ол 1 6,50 (м, 2Н), 5,17 (дд, 1Η, J 10,3, 2,3Гц), 2,92 (ддд, Н ЯМР (400МГц, d6-ДМСО) d: 8,85 (с, 1Н), 8,00 1Η, J -17,0, 11,5, 5,8Гц), 2,66 (ддд, 1H, J -17,0, 5,0, (д, 1Н, J 8,0Гц), 7,79-7,80 (м, 2Н), 7,59-7,63 (м, 1Н), 2,7Гц), 2,09 (м, 1H), 1,98 (м, 1Н). 6,59-6,62 (м, 1Н), 6,50-6,53 (м, 2Н), 5,36 (дд, 1Н, J 2-(2,5-Дифторфеніл)хроман-6-ол 10,2, 2,0Гц), 2,89-2,93 (м, 1Н), 2,67-2,73 (м, 1Н), 1 Н ЯМР (300МГц, d6-ДМСО) d: 8,82 (с, 1Η), 2,26-2,31 (м, 1Н), 1,90-1,95 (м, 1Н). 7,34-7,22 (м, 3H), 6,71-6,51 (м, 3H), 5,20 (м, 1Н), 2-(3-Нітрофеніл)хроман-6-ол 1 2,93 (м, 1Н), 2,68 (м, 1Н), 2,11 (м, 1Н), 1,98 (м, 1Н). Н ЯМР (300МГц, d6-ДМСО) d: 8,80 (с, 1Н), 8,26 2-(2,6-Дифторфеніл)хроман-6-ол (с, 1Н), 8,19 (дд, 1Н, J 8,1, 2,3Гц), 7,90 (д, 1Н, J 1 Н ЯМР (300МГц, d6-ДМСО) d: 8,85 (с, 1Н), 7,41 7,9Гц), 7,70 (т, 1Н, J 15,9, 7,9Гц), 6,70 (д, 1Н, J (м, 1H), 7,33 (м, 1H), 7,26 (м, 1Н), 6,64 (дд, 1Н, J 8,4Гц), 6,51-6,55 (м, 2Н), 5,19 (дд, 1Н, J 10,0, 2,0), 9,0, 2,8Гц), 6,54-6,51 (м, 2Н), 5,25 (дд, 1Н, J 10,2, 2,86-2,91 (м, 1Н), 2,61-2,68 (м, 1Н), 2,17-2,23 (м, 2,2Гц), 2,93 (м, 1Н, ), 2,66 (м, 1Н), 2,14 (м, 1Н), 2,01 1Н), 1,91-1,97 (м, 1Н). (м, 1Н) 2-(4-Нітрофеніл)хроман-6-ол 1 2-(3,5-Дифторфеніл)хроман-6-ол H ЯМР (400МГц, d6-ДМСО) d: 8,84 (с, 1Н), 8,26 1 H ЯМР (300МГц, d6-ДМСО) d: 8,82 (с, 1Н), (д, 2Н, J 6,9Гц), 7,71 (д, 2Н, J 6,9Гц), 6,69 (д, 1Н, J 7,20-7,14 (м, 3H), 6,68 (д, 1Н, J 8,6Гц), 6,53 (д, 1Н, 8,6Гц), 6,53 (дд, 1Н, J 8,6, 2,8Гц), 6,50 (д, 1Н, J J 2,9Гц), 6,50 (дд, 1Н, J 8,6, 2,9Гц), 5,05 (дд, 1Н, J 2,8Гц), 5,19 (дд, 1H, J 9,9, 2,2Гц), 2,87-2,91 (м, 1Н), 9,8, 2,2Гц), 2,88 (ддд, 1Н, J -16,7, 10,8, 5,9Гц), 2,62 2,61-2,66 (м, 1Н), 2,16-2,21 (м, 1Н), 1,89-1,93 (м, (ддд, 1Н, J -16,7, 8,9, 5,0Гц), 2,15 (м, 1Н), 1,93 (м, 1Н). 1Н).2-(3-Метоксифеніл)хроман-6-ол 1 2-(2-Трифторметилфеніл)хроман-6-ол Н ЯМР (300МГц, d6-ДМСО) d: 8,75 (с, 1Н), 7,28 1 Н ЯМР (400МГц, d6-ДМСО) d: 8,86 (с, 1Н), (т, 1Η, J 15,7, 7,9Гц), 6,96-6,99 (м, 2Н), 6,87 (дд, 7,81-7,75 (м, 3H), 7,57 (м, 1Н), 6,674 (дд, 1Н, J 7,1, 1Н, J 7,9, 2,5Гц), 6,63 (д, 1Н, J 8,3Гц), 6,52 (д, 1H, J 2,1Гц), 6,54-6,51 (м, 2Н), 5,14 (д, 1Н, J 10,5Гц), 2,95 2,9Гц), 6,48 (с, 1Н), 4,95 (дд, 1Н, J 9,8, 2,2Гц), 3,75 (м, 1Н), 2,72 (м, 1Н), 2,05 (м, 1Н), 1,96 (м, 1Н). (с, 3H), 2,82-2,89 (м, 1Н), 2,57-2,66 (м, 1Н), 2,062-(4-Трифторметилфеніл)хроман-6-ол 2,13 (м, 1Н), 1,89-1,97 (м, 1Н). 1 Н ЯМР (400МГц, d6-ДМСО) d: 8,82 (с, 1Н), 7,75 З -метил-2-фенілхроман-6-ол (д, 2Н, J 8,3Гц), 7,65 (д, 2Н, J 8,3Гц), 6,67 (д, 1Н, J 25 81941 26 2-[2-(2,6-Дифторфеніл)хроман-6-ілокси]-5Н ЯМР (400МГц, CD3 OD) d: 8,77 (с, 1Н), 7,41нітропіридин 7,33 (м, 5Н), 6,59-6,48 (м, 3H), 4,56 (д, 1Н, J 9,2Гц), 1 2,73 (дд, 1Н, J -16,5, 5,0Гц), 2,54 (дд, 1Н, J -16,5, Н ЯМР (400МГц, CDCl3) d: 9,04 (д, 1Н, J 5,8Гц), 2,11 (м, 1Н), 0,72 (д, 3H, J 6,6Гц). 3,0Гц), 8,60 (дд, 1Н, J 9,1, 3,0Гц), 7,45 (м, 1Н), 7,38 d) 2-[2-Фенілхроман-6-ілокси]-5(м, 1Н), 7,30 (м, 1Н), 7,21 (д, 1Н, J 9,1Гц), 7,03 ( д, нітропіридинові проміжні сполуки 1Н, J 2,7Гц), 6,98 (дд, 1Н, J 8,8, 2,7Гц) 6,92 (д, 1Н, 2-[2-(4-Фторфенілхроман-6-ілокси]-5J 8,8Гц), 5,42 (дд, 1Н, J 10,4, 2,3Гц), 3,04 (м, 1Н), нітропіридин 2,79 (м, 1Н) 2,21 (м, 1Н), 2,08 (м, 1Н). 2-[2-(4-Фторфенілхроман-6-ілокси]-52-[2-(3,5-Дифторфеніл)хроман-6-ілокси]-5нітропіридин одержували, як описано для 5-нітронітропіридин 1 2-(2-фенілхроман-6-ілокси)піридину у прикладі Н ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J 2, 1(b), виходячи зі 160мг 2-(4-фторфеніл)хроман-69Гц), 8,60 (дд, 1Н, J 9,1, 2,9Гц), 7,23-7,19 (м, 4Н), олу. 7,01-6,95 (м, 3H), 5,18 (дд, 1Н, J 10,0, 2,1Гц), 2,97 1 H ЯМР (400МГц, d6-ДМСО) d: 9,04 (дд, 1H, J (ддд, 1Н, J -16,9, 10,9, 5,7Гц), 2,76 (ддд, 1Н, J 2,9, 0,4Гц), 8,60 (дд, 1H, J 9,1, 2,9Гц), 7,51 (м, 2Н), 16,9, 8,4, 4,7Гц) 2,22 (м, 1Н), 1,99 (м, 1Н). 7,24 (м, 1H), 7,20 (дд, 1H, J 9,1, 0,4Гц), 7,01 (д, 1H, 2-[2-(2-Трифторметилфеніл)хроман-6-ілокси]J 2,8Гц), 6,96 (дд, 1H, J 8,7, 2,8Гц) 6,91 (д, 1Н, 5-нітропіридин 1 8,7Гц), 5,15 (дд, 1Н, J 10,3, 2,2Гц), 2,94 (м, 1H), H ЯМР (300МГц, d6-ДМСО) d: 9,04 (д, 1Н, J 2,76 (м, 1H) 2,17 (м, 1H), 2,01 (м, 1H). 2,9Гц), 8,60 (дд, 1Н, J 9,2, 2,9Гц), 7,86-7,76 (м, 3H), Використовуючи ту ж методику, яка описана 7,60 (м, 1Н), 7,22 (д, 1Н, J 9,2Гц) 7,05 (д, 1Н, J вище для 2-[2-(4-фторфеніл)хроман-6-ілокси]-52,7Гц), 6,99 (дд, 1Н, J 8,7, 2,7Гц), 6,91 (д, 1Н, нітропіридину, але замінюючи 2-(48,7Гц), 5,30 (д, 1Н, J 10,0,Гц), 3,05 (м, 1Н), 2,84 (м, фтор феніл)хроман-6-он відповідним 21Н) 2,16-2,00 (м, 2Н). фенілхроман-6-олом, одержували: 2-[2-(4-Трифторметилфеніл)хроман-6-ілокси]2-[2-(3-Фторфеніл)хроман-6-ілокси]-55-нітропіридин 1 нітропіридин H ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J 1 H ЯМР (400МГц, CDCl3) d: 9,07 (д, 1Н, J 2,9Гц), 8,60 (дд, 1Н, J 9,1, 2,9Гц), 7,79 (д, 2Н, J 2,8Гц), 8,46 (дд, 1Н, J 9,0, 2,8Гц), 7,36 (м, 1Н), 7,218,2Гц), 7,70 (д, 1Н, J 8,2Гц), 7,21 (д, 1Н, J 9,1Гц) 7,15 (м, 2Н), 7,03 (м, 1Н), 7,01 (д, 1Н, J 9,0Гц), 6,98 7,01 (дд, 1Н, J 8,7, 2,7Гц) 6,98 (д, 1Н, J 2,7Гц), 6,95 (д, 1Н, J 8,6Гц) 6,92 (дд, 1Н, J 8,6, 2,7Гц), 6,90 (д, (д, 1Н, 8,7Гц), 5,29 (дд, 1Н, J 10,1, 2,0Гц), 3,00 1Н, J 2,7Гц), 5,09 (дд, 1Н, J 10,3, 2,4Гц), 3,01 (ддд, (ддд, 1Н, J -16,9, 10,1, 5,8Гц), 2,4 (ддд, 1Н, J -16,9, 1Н, J -16,9, 11,4, 6,0Гц), 2,82 (ддд, 1Н, J -16,9, 5,1, 8,4, 4,5Гц) 2,24 (м, 1Н), 1,99 (м, 1Н). 3,2Гц) 2,24 (м, 1Н), 2,09 (м, 1Н). 2-[2-(3-Хлор-4-фторфеніл)хроман-6-ілокси]-52-[2-(2-Фторфеніл)хроман-6-ілокси]-5нітропіридин 1 нітропіридин Н ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J 1 Н ЯМР (400МГц, CDCl3) d: 9,04 (д, 1Н, J 2,9Гц), 8,60 (дд, 1Н, J 9,1, 2,9Гц), 7,40-7,27 (м, 3H), 2,8Гц), 8,60 (дд, 1Н, J 9,1, 2,8Гц), 7,56 (м, 1Н), 7,43 7,21 (д, 1Н, J 9,1Гц), 7,03 (д, 1Н, J 2,7Гц) 6,98 (дд, (м, 1Н), 7,30-7,22 (м, 2Н), 7,20 (д, 1Н, J 9,1Гц), 7,02 1Н, J 8,8, 2,7Гц), 6,94 (д, 1Н, J 8,8Гц), 5,36 (дд, 1Н, (д, 1Н, J 2,8Гц) 6,98 (дд, 1Н, J 8,7, 2,8Гц), 6,91 (д, J 10,7, 2,1Гц), 3,04 (м, 1Н), 2,80 (м, 1Н) 2,18 (м, 1Н, J 8,7Гц), 5,37 (дд, 1Н, J 10,4, 2,3Гц), 3,04 (ддд, 1Н), 1,99 (м, 1Н). 1H, J -17,0, 11,5, 6,0Гц), 2,82 (ддд, 1Н, J -17,0, 5,1, 2-[2-(2-Хлорфеніл)хроман-6-ілокси]-52,8Гц) 2,18 (м, 1Н), 2,08 (м, 1Н). нітропіридин 1 2-[2-(2,3-Дифторфеніл)хроман-6-ілокси]-5H ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J нітропіридин 2,9, 0,5Гц), 8,60 (дд, 1Н, J 9,1, 2,9Гц), 7,62 (дд, 1Н, 1 Н ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J J 7,5, 1,8Гц), 7,51 (дд, 1Н, J 7,6, 1,7Гц), 7,45-7,40 3,0Гц), 8,60 (дд, 1Н, J 9,1, 3,0Гц), 7,45 (м, 1Н), 7,38 (м, 2Н), 7,21 (дд, 1Н, J 9,1, 0,5Гц), 7,04 (д, 1Н, J (м, 1Н), 7,30 (м, 1Н), 7,21 (д, 1Н, 9,1Гц), 7,03 (д, 1Н, 2,7Гц), 6,99 (дд, 1Н, J 8,8, 2,7Гц), 6,94 (д, 1Н, J 2,7Гц), 6,98 (дд, 1Н, J 8,8, 2,7Гц), 6,92 (д, 1Н, 8,8Гц), 5,40 (дд, 1Н, J 10,4, 2,1Гц), 3,04 (м, 1Н), 8,8Гц), 5,42 (дд, 1Н, J 10,4, 2,3Гц), 3,04 (м, 1Н), 2,80 (м, 1Н) 2,24 (м, 1Н), 1,95 (м, 1Н). 2,79 (м, 1Н) 2,21 (м, 1Н), 2,08 (м, 1Н). 2-[2-(3-Хлорфеніл)хроман-6-ілокси]-52-[2-(2,4-Дифторфеніл)хроман-6-ілокси]-5нітропіридин 1 нітропіридин Н ЯМР (400МГц, CDCl3) d: 9,04 (д, 1Н, J 1 H ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J 2,9Гц), 8,60 (дд, 1Н, J 9,0, 2,9Гц), 7,53 (с, 1Н), 7,463,0Гц), 8,60 (дд, 1Н, J 9,0, 3,0Гц), 7,61 (м, 1Н), 7,31 7,42 (м, 3H), 7,20 (д, 1Н, J 9,0 Гц) 7,00 (дд, 1Н, J (м, 1Н), 7,21 (д, 1Н, 9,0Гц), 7,17 (м, 1Н) 7,02 (д, 1Н, 8,7, 2,7Гц), 6,97 (д, 1Н, J 2,7Гц), 6,94 (д, 1Н, J J 2,9Гц), 6,97 (дд, 1Н, J 8,9, 2,9Гц), 6,91 (д, 1Н, 8,7Гц), 5,18 (дд, 1Н, J 10,2, 2,2Гц), 2,97 (ддд, 1Н, J 8,9Гц), 5,34 (дд, 1Н, J 9,9, 2,0Гц), 3,03 (м, 1Н), 2,78 -17,0, 11,5, 5,9Гц), 2,83 (ддд, 1Н, J -17,0, 8,1, 4,5Гц) (м, 1Н) 2,17 (м, 1Н), 2,07 (м, 1Н). 2,21 (м, 1Н), 2,00 (м, 1Н). 2-[2-(2,5-Дифторфеніл)хроман-6-ілокси]-52-[2-(2,4-Дихлорфеніл)хроман-6-ілокси]-5нітропіридин нітропіридин 1 1 Н ЯМР (400МГц, CDCl3) d: 9,07 (дд, 1Н, J 2,8, H ЯМР (400МГц, CDCl3) d: 9,06 (д, 1Н, J 0,4Гц), 8,47 (дд, 1Н, J 9,1, 2,8Гц), 7,26 (м, 1Н), 7,052,7Гц), 8,47 (дд, 1Н, J 9,0, 2,7Гц), 7,56 (д, 1Н, J 6,91 (м, 6Н), 5,35 (дд, 1Н, J 10,3, 1,5Гц), 3,04 (ддд, 8,4Гц), 7,41 (д, 1Н, J 2,0Гц), 7,33 (дд, 1Н, J 8,4, 1Н, J -16,9, 11,7, 6,0Гц), 2,82 (ддд, 1Н, J -16,9, 5,2, 2,0Гц) 7,02 (д, 1Н, J 9,0Гц) 6,99-6,92 (м, 3H), 5,39 3,0Гц) 2,29 (м, 1Н), 2,01 (м, 1Н). (дд, 1Н, J 10,4, 2,2Гц), 3,06 (ддд, 1Н, J -16,9, 11,9, 1 27 81941 28 6,0Гц), 2,83 (ддд, 1Н, J -16,9, 5,3, 2,7Гц) 2,34 (м, 6-(5-Нітропіридин-2-ілокси)-2-фенілхроман-41Н), 1,89 (м, 1Н). он одержують, як описано для 5-нітро-2-(22-[2-(3-Бромфеніл)хроман-6-ілокси]-5фенілхроман-6-ілокси)піридину у прикладі 1(b) з нітропіридин використанням 200мг 6-гідроксифлаванону. 1 1 Н ЯМР (400МГц, CDCl3) d: 9,04 (д, 1Н, J H ЯМР (400МГц, d6-ДМСО) d: 9,03 (ушир, с, 2,9Гц), 8,60 (дд, 1Н, J 9,2, 2,9Гц), 7,66 (ушир.с, 1Н), 1Н), 8,64 (д, 1Η, J 9,0Гц), 7,59-7,41 (м, 7H), 7 Г31 (д, 7,55 (м, 1Н), 7,48 (м, 1Н), 7,39 (м, 1Н) 7,20 (д, 1Н, J 1H, J 9,0Гц), 7,23 (д, 1Н, 8,8Гц), 5,75 (ДДГ 1Н, J 9,2Гц) 7,01-6,93 (м, 3H), 5,17 (дд, 1Н, J 10,1, 2,2Гц), 12,3, 2,9Гц), 3,30 (дд, 1Н, -16,3, 12,3Гц), 2,87 (дд, 2,97 (м, 1Н), 2,72 (м, 1Н) 2,20 (м, 1Н), 2,00 (м, 1Н). 1Н, -16,3, 2,9Гц). 2-[2-(4-Етилфеніл)хроман-6-ілокси]-5Використовуючи ту ж методику, яка описана нітропіридин вище для 6-(5-нітропіридин-2-ілокси)-21 фенілхроман-4-ону, але замінюючи 6H ЯМР (400МГц, CDCl3) d: 9,04 (д, 1Н, J гідроксифлаванон відповідним 22,8Гц), 8,60 (дд, 1Н, J 9,1, 2,8Гц), 7,36 (д, 2Н, J фенілхроманоновим похідним, одержували: 8,1Гц) 7,24 (д, 2Н, J 8,1Гц), 7,20 (д, 1Н, J 9,1Гц), 7-(5-Нітропіридин-2-ілокси)-2-фенілхроман-47,00 (д, 1Н, J 2,7Гц) 6,96 (дд, 1Н, J 8,8, 2,7Гц), 6,89 он (д, 1Н, J 2,7Гц), 5,11 (дд, 1Н, J 10,1, 2,2Гц), 2,98 (м, 1 1Н), 2,75 (м, 1Н), 2,62 (кв., 2Н, J 7,5Гц) 2,16 (м, 1Н), Н ЯМР (400МГц, d6-ДМСО) d: 9,07 (д, 1Н, J 2,01 (м, 1Н), 1,19 (т, 3H, J 7,5Гц). 2,8Гц), 8,67 (дд, 1Н, J 9,0, 2,8Гц), 7,89 (д, 1Н, 5-нітро-2-[2-(2-нітрофеніл)хроман-68,6Гц), 7,60-7,35 (м, 6Н), 7,04 (д, 1Н, 2,1Гц), 6,97 ілокси]піридин (дд, 1 Н, 8,6, 2,1Гц), 5,75 (дд, 1Н, J 13,0, 2,7Гц), 1 3,32 (дд, 1Н, 16,9, 13,0Гц), 2,85 (д, -16,9, 2,7Гц). H ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J 2, 9Гц), 8,60 (дд, 1Н, J 9,1, 2,9Гц), 8,03 (д, 1Н, J 3-Метил-6-(5-нітропіридин-2-ілокси)-2фенілхроман-4-он 7,9Гц), 7,80-7,85 (м, 2Н), 7,62-7,66 (м, 1Н), 7,22 (д, 1 1Н, J 9,1Гц), 7,04 (д, 1Н, J 2,8Гц), 6,98 (дд, 1Н, J Н ЯМР (400МГц, d6-ДМСО) d: 9,03 (д, 1Н, J 8,8, 2,8Гц), 6,88 (д, 1Н, J 8,8Гц), 5,52 (дд, 1Н, J 2,9Гц), 8,64 (дд, 1Н, J 9,1, 2,9Гц), 7,59-7,56 (м, 3H), 10,3, 2,0Гц), 2,99-3,31 (м, 1Н), 2,80-2,85 (м, 1Н), 7,50-7,32 (м, 4Н) 7,30 (д, 1Н, J 9,1Гц), 7,18 (д, 1Н, J 2,35-2,40 (м, 1Н), 1,99-2,04 (м, 1Н). 8,9Гц), 5,38 (д, 1Н, J 12,5Гц), 3,36 (дд, 1Н, J 12,5, 5-нітро-2-[2-(3-нітрофеніл)хроман-66,9Гц), 0,86 (д, 3H, J 6,9Гц). ілокси]піридин Приклад 4. Проміжна сполука 1 2-(2,3-Дигідро-2-фенілбензо[1,4]діоксин-6H ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J ілокси)-5-нітропіридин 2,9Гц), 8,60 (дд, 1Н, J 9,0, 2,9Гц), 8,32 (с, 1Н), 8,23 а) 1-[2,5-Біс(бензилокси)феніл]етанон (д, 1Н, J 8,3Гц), 7,95 (д, 1H, J 7,9Гц), 7,74 (т, 1H, J Суміш 1-(2,5-дигідроксифеніл)етанону (3,16г), 15,8, 7,9Гц), 7,21 (д, 1H, J 9,0Гц), 6,96-7,03 (м, 3H), бензилхлориду (7,04г), карбонату калію (12,4г) і 5,35 (д, 1H, J 8,7Гц), 2,98-3,06 (м, 1H), 2,72-2,79 (м, 18-краун-6 (30мг) у 2-бутаноні (50мл) нагрівали зі 1Н), 2,26-2,33 (м, 1H), 1,99-2,06 (м, 1H). зворотним холодильником протягом 5 годин. Після 5-нітро-2-[2-(4-нітрофеніл)хроман-6охолоджування осад відфільтровували. Фільтрат ілокси]піридин 1 випарювали досуха при зниженому тиску і до Н ЯМР (300МГц, d6-ДМСО) d: 9,04 (д, 1H, J залишку додавали ефір (50мл). Розчин промивали 2,9Гц), 8,60 (дд, 1H, J 9,1, 2,9Гц), 8,29 (д, 2Н, J двічі розбавленим розчином гідроксиду натрію, 6,9Гц), 7,76 (д, 2Н, J 6,9Гц), 7,21 (д, 1H, J 9,1Гц), двічі розбавленою соляною кислотою, сушили над 6,98-7,02 (м, 3H), 5,35 (дд, 1H, J 9,9, 2,2Гц), 2,96сульфатом натрію і по суті випарювали досуха при 3,05 (м, 1H), 2,73-2,78 (м, 1H), 2,24-2,29 (м, 1H), зниженому тиску. Залишок розтирали з холодним 1,96-2,04 (м, 1H). н-гептаном (30мл), і осад відфільтровували 2-[2-(3-Метоксифеніл)хроман-6-ілокси]-5вакуумфільтр уванням з одержанням після сушіння нітропіридин 1 2,85г 1-[2,5-біс(бензилокси)феніл]етанону. 1Н ЯМР Н ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1H, J (400МГц, ДМСО-d6) d: 2,50 (с, 3H), 5,08 (с, 2Н), 2,9Гц), 8,60 (дд, 1H, J 9,1, 2,9Гц), 7,32 (т, 1H, J 5,18 (с, 2Н), 7,20-7,50 (м, 13Н). 15,7, 7,9Гц), 7,20 (д, 1Н, J 9,1Гц), 7,03 (д, 1Н, J b) 2,5-біс(бензилокси)феніловий ефір оцтової 8,4Гц), 7,01 (с, 1Н), 7,00 (д, 1Н, J 2,8Гц), 6,96 (дд, кислоти 1Н, J 8,7, 2,8Гц), 6,92 (д, 1Н, J 8,7Гц), 6,90 (дд, 1Н, Розчин 1-[2,5-біс(бензилокси)феніл]етанону J 8,4, 2,6Гц), 5,12 (дд, 1Н, J 10,0, 2 ,3Гц), 3,77 (с, (2,25г) і 40% пероцтової кислоти (1,63мл) в оцтовій 3H), 2,93-2,97 (м, 1Н), 2,71-2,77 (м, 1Н), 2,15-2,20 кислоті (5,4мл) перемішували при 60°С протягом 1 (м, 1Н), 1,99-2,05 (м, 1Н). години. Після охолоджування до кімнатної 2-(3-Метил-2-фенілхроман-6-ілокси)-5температури осаджений продукт збирали нітропіридин 1 фільтруванням, промивали холодним ефіром і Н ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J сушили при зниженому тиску. 2,52,8Гц), 8,59 (дд, 1Н, J 9,1, 2,8Гц), 7,43-7,36 (м, 5Н), Біс(бензилокси)феніловий ефір оцтової кислоти 7,19 (д, 1Н, J 9,1Гц), 7,00 (д, 1Н, J 2,6Гц) 6,95 (дд, перекристалізовували з 2-пропанолу. Вихід 1Н, J 8,7, 2,6Гц), 6,86 (д, 1Н, J 8,7Гц), 4,73 (д, 1Н, J становить 1,87г. 1H ЯМР (ДМСО-d 6) d: 2,23 (с, 1Н), 9,3Гц), 2,85 (дд, 1Н, J -16,7, 5,0Гц), 2,64 (дд, 1Н, J 5,03 (с, 2Н), 5,05 (с, 2Н), 6,84-7,44 (м, 13Н). 16,5, 10,9Гц), 2,18 (м, 1Н), 0,77 (д, 3H, J 6,7Гц). c) 2,5-Біс(бензилокси)фенол Приклад 3. Проміжні сполуки Розчин 2,5-біс(бензилокси)фенілового ефіру (5-Нітропіридин-2-ілокси)-2-фенілхроман-4оцтової кислоти (1,85г) і 5Μ розчин гідроксиду онові проміжні сполуки натрію (10,6мл) в етанолі (11мл) нагрівали зі 6-(5-Нітропіридин-2-ілокси)-2-фенілхроман-4зворотним холодильником протягом 6,5 годин. он 29 81941 30 1 Після того, як етанол випарювали при зниженому Н ЯМР (ДМСО-d6) d: 4,02 (дд, J 8,5, 11,4Гц, тиску, прозорий розчин підкислювали 1Н), 4,35 (дд, J 2,3, 11,4Гц, 1Н), 5,11 (дд, J 8,5, розбавленою соляною кислотою. Осаджений 2,3Гц, 1Н), 6,29 (дд, J 2,8, 8,5Гц, 1Н), 6,32 (д, J продукт збирали фільтруванням, промивали 2,8Гц, 1Н), 6,75 (д, J 8,5Гц, 1Н), 7,36-7,47 (м, 5Н), холодною водою і сушили при зниженому тиску. 8,99 (с, 1Н). Вихід становить 0,56г. 1Н ЯМР (ДМСО-d6) d: 4,97 h) 2-(2,3-Дигідро-2-фенілбензо[1,4]діоксин-6(с, 2Н), 5,01 (с, 2Н), 6,34 (дд, J 3,1, 8,8Гц, 1Н), ілокси)-5-нітропіридин 6,49(д, J 3,1Гц, 1Н), 6,85 (д, J 8,8Гц, 1Н), 7,28-7,46 Розчин 2,3-дигідро-2-фенілбензо[1,4]діоксин-6(м, 10Н), 9,1 (ушир.с, 1Н). олу (80мг), 2-хлор-5-нітропіридину (56мг) і d) 2-[2,5-Біс(бензилокси)фенокси]-1карбонату калію (52мг) у диметилформаміді фенілетанон (1,0мл) перемішували при 120°С протягом 2 годин. Суміш 2,5-біс(бензилокси)фенолу (0,28г), 2Після охолоджування суміші додавали воду (10мл) бромацетофенону (0,22г), гідрокарбонату калію і осаджений продукт відфільтровували, промивали (0,25г) і 18-краун-6 (3мг) в ацетонітрилі (4,2мл) водою і 2-пропанолом і сушили при зниженому перемішували при 22°С протягом одного тижня. тиску. Ви хід становить 60мг, і т.плавл. дорівнює Суміш фільтр ували і випарювали досуха при 163-170°С. 1 зниженому тиску. Залишок розтирали із сумішшю H ЯМР (ДМСО-d6) d: 4,16 (дд, J 8,5, 11,6Гц, ефіру (8,2мл) і води (1,4мл) при температурі 1Н), 4,47 (дд, J 11,6, 2,6Гц, 1Н), 5,28 (дд, J 2,6, льодяної бані. Продукт збирали фільтруванням, 8,5Гц, 1H), 6,75 (дд, J 2,6, 8,8Гц, 1H), 6,88 (д, J промивали холодним ефіром і сушили при 2,6Гц, 1Н), 7,05 (д, J 8,8Гц, 1Н), 7,21 (д, J 9,1Гц, зниженому тиску, ви хід становить 0,14 г. 1Н), 7,39-7,52 (м, 5H), 8,60 (дд, J 2,8, 9,1Гц, 1Н), 1 H ЯМР (ДМСО-d6) d: 4,98 (с, 2Н), 5,06 (с, 2Н), 9,05 (д, J 2,8Гц, 1H). 5,58 (с, 2Н), 6,51 (дд, J 8,9, 2,3Гц, 1Н), 6,68 (д, J Приклад 5. Проміжна сполука 2,3Гц, 1Н), 6,94 (д, J 8,9Гц, 1Н), 7,28-8,03 (м, 15Н). 5-нітро-2-(6-феніл-5,6,7,8-тетрагідронафталіне) 2-[2,5-Біс(бензилокси)фенокси]-12-ілокси)-піридин фенілетанол а) 6-Метокси-2-феніл-3,4-дигідро-2Н-нафталінДо розчину 2-[2,5-біс(бензилокси)фенокси]-11-он фенілетанону (0,14г) у метанолі (0,5мл) і Суміш ацетату паладію (II) (0,57г), рац-2,2'тетрагідрофурані (1,9мл) додавали при біс(дифенілфосфіно)-1,1'-бінафтилу (1,91г) і треттемпературі 0°С борогідрид натрію (6,5мг). бутоксиду калію (4,15г) у безводному толуолі Реакційну суміш перемішували 15 хвилин при перемішували в а тмосфері аргону протягом 10 температурі 0°С і 2 години при температурі 22°С. хвилин. Додавали бромбензол (5,34г) і 6-метоксиПісля того, як залишок перемішували при 22°С 0,5 1-тетралон (3,0г), сольватований у безводному години, продукт фільтрували, промивали толуолі, і суміш перемішували при 100°С протягом холодною водою і сушили при зниженому тиску. 2 годин. Реакційну суміш охолоджували до Вихід становить 0,09г. кімнатної температури і виливали у насичений 1 водний розчин хлориду амонію і екстрагували H ЯМР (ДМСО-d6) d: 4,05 (м, 2Н), 4,91 (м, 1Н), етиловим ефіром. Органічний екстракт промивали 4,95 (с, 2Н), 5,01 (с, 2Н), 5,59 (д, J 4,7Гц, 1Н), 6,47 насиченим розчином солі, сушили і випарювали. (дд, J 2,8, 8,8Гц, 1H), 6,68 (д, J 2,8Гц, 1Н), 6,89 (д, J Сирий продукт очищали флеш-хроматографією на 8,8Гц, 1Н), 7,24-7,45 (м, 15Н). силікагелі з використанням толуолу і толуолf) 2-(2-Гідрокси-2-фенілетокси)бензол-1,4-діол Розчин 2-[2,5-біс(бензилокси)фенокси]-1етилацетату (9:1) як елюенту. 1 фенілетанолу (3,9г) в етанолі (175мл) гідрували у H ЯМР (400МГц, d6-ДМСО) d: 7,87 (д, 1Η, J присутності 10% паладію на вугіллі (100мг) при 7,8Гц), 7,16-7,33 (м, 5Н), 6,91-6,94 (м, 2Η), 3,85 (с, 30фунт/дюйм 2. Каталізатор видаляли 3H), 3,82-3,88 (м, 1Н), 3,06-3,14 (м, 1Н), 2,92-2,98 фільтруванням і розчинник випарювали при (м, 1Н), 2,23-2,38 (м, 2Н). зниженому тиску. Залишок перекристалізовували з b) 6-Гідрокси-2-феніл-3,4-дигідро-2Н-нафталінсуміші толуолу-етилацетату 8:1 (15мл). Вихід 2-(21-он гідрокси-2-фенілетокси)бензол-1,4-діолу становить 6-Метокси-2-феніл-3,4-дигідро-2Н-нафталін-11,2г. он (1,0г) нагрівали зі зворотним холодильником з 1г 47% НВr (20мл) до зникнення вихідної речовини. Н ЯМР (ДМСО-d6) d: 3,79 (дд, J 9,6, 8,3Гц, Суміш виливали у воду і екстрагували 1Н), 4,00 [дд, J 9,6, 3,6Гц, 1Н), 4,94 (ддд, J 3,6, 8,3, етилацетатом. Етилацетат сушили і випарювали. 3,9Гц, 1Н), 5,66 (д, J 3,9Гц, 1H), 6,18 (дд, J 8,5, Даний продукт перекристалізовували з толуолу. 2,3Гц, 1Н), 6,34 (д, J 2,3, 1H), 6,57 (д, J 8,5, 1H), 1 7,26-7,47 (м, 5H), 7,97 (с, 1Η), 8,66 (с, 1Н). H ЯМР (400МГц, d6-ДМСО) d: 10,35 (с, 1Н), g) 2,3-Дигідро-2-фенілбензо[1,4]діоксин-6-ол 7,79 (д, 1Η, J 8,6Гц), 7,15-7,33 (м, 5H), 6,75 (дд, 1Н, Розчин 2-(2-гідрокси-2-фенілетокси)бензолJ 8,6, 2,4Гц), 6,68 (д, 1Н, J 2,3Гц), 3,79-3,85 (м, 1Н), 1,4-діолу (1,2г) у толуолі (75мл) нагрівали з 2,99-3,06 (м, 1Н), 2,83-2,90 (м, 1Н), 2,19-2,33 (м, каталізатором амберліст 15 (Amberlyst 15) (0,5г) 2Н). при нагріванні зі зворотним холодильником c) Феніл-5,6,7,8-тетрагідронафталін-2-ол протягом 7 годин. Після фільтрування розчинник До розчину 6-гідрокси-2-феніл-3,4-дигідро-2Нвипарювали при зниженому тиску. Залишок нафталін-1-ону (50мг) у трифтороцтовій кислоті очищали колонковою хроматографією на додавали триетилсилан (98мг). Суміш нагрівали і силікагелі (толуол/етилацетат/оцтова кислота, витримували при 60°С протягом 3 годин. 8:1:1). Вихід 2,3-дигідро-2-фенілбензо[1,4]діоксинРозчинник випарювали, до залишку додавали 6-олу становить 0,5г. 31 81941 32 1 воду і суміш екстрагували етилацетатом. H ЯМР (400МГц, d6-ДМСО) d: 8,57 (с, 1Н), 8,06 Органічний екстракт сушили і випарювали. (д, 1Н, J 8,9Гц), 7,45-7,50 (м, 3H), 7,21-7,25 (м, 1Н), 1 7,20 (д, 1Н, J 2,4Гц), 7,12 (дд, 1Н, J 8,9, 2,4Гц), 3,92 Η ЯМР (400МГц, d6-ДМСО) d: 9,02 (с, 1Η), 7,18-7,32 (м, 5Η), 6,87 (д, 1Н, J7,9), 6,50-6,53 (м, (с, 3H). 2Н), 2,68-2,92 (м, 5Η), 1,94-1,99 (м, 1Н), 1,81-1,89 c) 3-(3-Фторфеніл)-7-гідроксихромен-4-он (м, 1Н). 3-(3-Фторфеніл)-7-метоксихромен-4-он (320мг) d) 5-Нітро-2-(6-феніл-5,6,7,8нагрівали із зворотним холодильником з 47% HBr тетрагідронафталін-2-ілокси)-піридин (18мл) до зникнення вихідної речовини. Суміш 6-Феніл-5,6,7,8-тетрагідронафталін-2-ол виливали у воду і залишок відфільтровували і (30мг), 2-хлор-5-нітропіридин (21мг) і фторид калію сушили, одержуючи 3-(3-фторфеніл)-7(23мг) у безводному диметилформаміді нагрівали і гідроксихромен-4-он. 1 витримували при 120°С до зникнення вихідної Н ЯМР (400МГц, d6-ДМСО) d: 10,87 (с, 1Н), речовини. Додавали воду і 1н НСl, і суміш 8,49 (с, 1Н), 7,99 (д, 1Н, J 8,7Гц), 7,43-7,49 (м, 3H), екстрагували етилацетатом. Етилацетат 7,20-7,24 (м, 1Н), 6,97 (дд, 1H, J 8,7, 2,2Гц), 6,90 (д, промивали насиченим розчином солі і водою, 1H, J 2,2Гц). сушили і випарювали. Продукт d) 3-(3-Фторфеніл)хроман-7-ол перекристалізовували з толуолу. 3-(3-Фторфеніл)-7-гідроксихромен-4-он (160мг) 1 H ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J розчиняли в етанолі (40мл) і додавали 10% 2,4Гц), 8,61 (дд, 1Н, J 9,0, 2,5), 7,18-7,35 (м, 7Н), паладію на вугіллі (400мг). Реакційну суміш 6,95-6,99 (м, 2Н), 2,83-3,01 (м, 5Н), 1,87-2,04 (м, гідрували протягом 6 годин при нормальному 2Н). тиску і кімнатній температурі. Потім її фільтрували Приклад 6. Проміжна сполука через целіт і промивали етанолом. Розчинник 6-(5-Нітропіридин-2-ілокси)-2-феніл-3,4випарювали при зниженому тиску з одержанням 3дигідро-2Н-нафталін-1-он (3-фторфеніл)хроман-7-олу. 1 6-(5-Нітропіридин-2-ілокси)-2-феніл-3,4H ЯМР (400МГц, d6-ДМСО) d: 9,19 (ушир.с, дигідро-2Н-нафталін-1-он одержували, як описано 1Н), 7,38 (м, 1H), 7,17-7,21 (м, 2Η), 7,08 (м, 1Η), для 5-нітро-2-(6-феніл-5,6,7,8-тетрагідронафталін6,88 (д, 1Н, J 8,2Гц), 6,30 (дд, 1Н, J 8,2, 2,4Гц), 6,20 2-ілокси)піридину у прикладі 5(d) з використанням (д, 1H, J 2,4Гц), 4,22 (ддг 1Н, J 10,3, 3,6Гц), 4,02 (т, 50мг 6-гідрокси-2-феніл-3,4-дигідро-2Н-нафталін1H, 10,3Гц), 3,20 (м, 1Н), 2,90 (м, 2Н). 1-ону, 33мг 2-хлор-5-нітропіридину і 37мг фториду e) 2-[3-(3-Фторфеніл)хроман-7-ілокси]-5калію. нітропіридин 1 2-[3-(3-Фторфеніл)хроман-7-ілокси]-5H ЯМР (400МГц, d6-ДМСО) d: 9,07 (д, 1Н, J 2,8Гц), 8,68 (дд, 1Н, J 9,0, 2,9), 8,01 (д, 1Н, J 8,5), нітропіридин одержували, як описано для 5-нітро7,37 (д, 1Н, J 9,1Гц), 7,21-7,38 (м, 7Н), 3,96-4,04 (м, 2-(2-фенілхроман-6-ілокси)піридину у прикладі 1Н), 3,15-3,23 (м, 1Н), 2,98-3,04 (м, 1Н), 2,39-2,48 1(b), використовуючи 125мг 3-(3(м, 1Н), 2,25-2,31 (м, 1Н). Фторфеніл)хроман-7-олу. Продукт Приклад 7. Проміжні сполуки перекристалізовували з етанолу. 1 2-[3-(феніл)хроман-7-ілокси]-5-нітропіридинові Н ЯМР (400МГц, CDCl3) d: 9,07 (д, 1H, J проміжні сполуки 2,8Гц), 8,47 (дд, 1H, J 9,0, 2,8Гц), 7,33 (м, 1H), 7,16 a) 2-(3-Фторфеніл)-1-(2-гідрокси-4(д, 1H J 8,9Гц), 6,95-7,06 (м, АН), 6,69-6,71 (ω, 2Η), метоксифеніл)етанон 4,38 (дд, 1Н, J 10,6, 4,3Гц), 4,06 (т, 1H, 10,6Гц), (3-Фторфеніл)оцтову кислоту (3,7г) і 33,30 (м, 1H), 3,06 (м, 2Н). метоксифенол (3,0г) розчиняли у BF3·EtO (60мл, Використовуючи ту ж методику, яка описана 20екв) в атмосфері аргону. Суміш перемішували вище для 3-(3-Фторфеніл)хроман-7-олу, але при 60-70°С до зникнення вихідних речовин (9 замінюючи 3-(3-фторфеніл)-7-гідроксихромен-4-он годин) і виливали у великий об'єм льодяної води. 7-гідрокси-3-фенілхромен-4-оном, одержували: Після екстрагування етилацетатом об'єднані 3-Фенілхроман-7-ол 1 органічні шари промивали водою, сушили і H ЯМР (400МГц, d6-ДМСО) d: 8,18 (ушир.с, випарювали. Сирий продукт очищали колонковою 1Н), 7,31-7,34 (м, 4Η), 7,25-7,27 (м, 1Н), 6,88 (д, 1Η, хроматографією з використанням СН 2Сl2 як J 8,2Гц), 6,30 (дд, 1H, J 8,2, 2,4Гц), 6,20 (д, 1H, J елюенту. 2,4Гц), 4,21 (дд, 1Н, J 10,3, 3,6Гц), 4,00 (т, 1Η, 1 H ЯМР (400МГц, d6-ДМСО) d: 12,41 (ушир, с, 10,3Гц), 3,13 (м, 1Н), 2,84-2,87 (м, 2Н). 1Н), 8,02 (д, 1Η, J 9,0Гц), 7,34-7,38 (м, 1H), 7,09Використовуючи ту ж методику, яка описана 7,13 (м, 3H), 6,56 (дд, 1Н, J 9,0, 2,5Гц), 6,49 (д, 1Н, вище для 2-[3-(3-фторфеніл)хроман-7-ілокси]-5J 2,5Гц), 4,41 (с, 2Н), 3,83 (с, 3H). нітропіридину, але замінюючи 3-(3b) 3-(3-Фторфеніл)-7-метоксихромен-4-он фтор феніл)хроман-7-ол 3-фенілхроман-7-олом, 2-(3-Фторфеніл)-1-(2-гідрокси-4одержували: 5-Нітро-2-(3-фенілхроман-7метоксифеніл)етанон (1,76г) розчиняли у піридині ілокси)піридин 1 (88мл). Додавали піперидин (8,8мл) і Н ЯМР (400МГц, d6-ДМСО) d: 9,05 (д, 1Н, J 2, триетилортоформіат (88мл), і суміш перемішували 9Гц), 8,61 (лд, 1Н, J 9,1, 2,9Гц), 7,34-7,38 (м, 4Н), при 120°С протягом 3,5 годин. Після того, як суміш 7,27-7,30 (м, 1Н), 7,22 (м, 2Н), 6,70-6,74 (м, 2Н), виливали у воду і підкислювали конц. НСl, сирий 4,31 (дд, 1Н, J 10,4, 3,5Гц), 4,12 (т, 1Н, 10,4Гц), продукт відфільтровували. Очищення колонковою 3,24 (м, 1Н), 3,01-3,11 (м, 2Н). хроматографією з використанням гептану7-Гідрокси-3-фенілхромен-4-он доступний для етилацетату (7:3) як елюенту давало 3-(3придбання або може бути синтезований фтор феніл)-7-метоксихромен-4-он. способами, описаними для 3-(3-фторфеніл)-7 33 81941 34 1 гідроксихромен-4-ону. Приклад 8. Проміжна H ЯМР (400МГц, d6-ДМСО): 12,6 (ушир.с, 1Н), сполука 5-нітро-2-(2-феніл-2,37,67 (с, 1Н), 7,4-7,3 (м, 3H), 7,2-7,1 (м, 2Н), 7,0-6,9 дигідробензо[1,4]оксатіїн-6-ілокси)піридин (м, 2Н), 6,8-6,7 (м, 2Н), 3,70 (с, 3H), (М)+=254 a) 2-(2-Гідрокси-1(100%). фенілетилсульфаніл)бензол-1,4-діол b) 3-(4-Метоксифеніл)-2-фенілпропіонова До розчину, що перемішується, 2кислота меркаптобензол-1,4-діолу (0,5г) і карбонату калію 13г 3-(4-Метоксифеніл)-2-фенілакрилової (0,49г) у воді (5мл) додавали 2-фенілоксиран кислоти розчиняли у 600мл етилацетату і (0,40мл) в атмосфері аргону. Суміш перемішували додавали 2,6г 10% паладію на вугіллі в інертній при кімнатній температурі протягом 2,5 годин і атмосфері. Вихідну речовину гідр ували при потім обробляли 2Μ НСl і екстрагували кімнатній температурі з одержанням кількісного етилацетатом. Об'єднані органічні шари виходу 3-(4-метоксифеніл)-2-фенілпропіонової промивали водою і насиченим розчином солі, кислоти. 1 сушили і випарювали. Сирий продукт очищали H ЯМР (400МГц, d6-ДМСО): 12,3 (ушир.с, 1Н), колонковою хроматографією, використовуючи 7,32-7,20 (м, 5Н), 7,1-7,0 (м, 2Н), 6,8-6,7 (м, 2Н), гептан-етилацетат (1:1) як елюент. 3,79 (дд, 1Н, J 6,9, 8,7Гц), 3,70 (с, 3H), 3,22 (дд, 1Н, 1 J 8,7, 13,7Гц), 2,87 (дд, 1Н, J 6,9, 13,7Гц). Н ЯМР (400МГц, d6-ДМСО) d: 8,94 (ушир.с, 1Н), 8,72 (ушир.с, 1Н), 7,24-7,37 (м, 5Н), 6,62-6,65 c) 6-Метокси-2-феніліндан-1-он До розчину 3-(4-метоксифеніл)-2(м, 2Н), 6,47 (дд, 1Н, J 8,6, 2,8Гц), 4,97 (ушир.с, фенілпропіонової кислоти (4,6г) у безводному 1Н), 4,34 (м, 1Н), 3,72 (м, 2Н). дихлорметані (26мл) додавали дві краплі b) 2-Феніл-2,3-дигідробензол[1,4]оксатіїн-6-ол безводного ДМФ. Додавали тіонілхлорид (3мл) і Розчин 2-(2-гідрокси-1фенілетилсульфаніл)бензол-1,4-діолу (0,83г) у реакційну суміш перемішували при 40°С протягом 4 годин. Розчинник випарювали під вакуумом. безводному толуолі (60мл) перемішували з Залишок розчиняли у ди хлорметані. Розчин амберлістом 15 (0,5г) при 60°С до зникнення охолоджували до 0-3°С. Цей розчин і хлорид вихідної речовини. Після того, як суміш алюмінію (2,5г) повільно змішували протягом 4 фільтрували і розчинник випарювали, сирий продукт очищали колонковою хроматографією, годин, підтримуючи температуру нижче 4°С. Після змішування реакційну суміш перемішували при використовуючи гептан-етилацетат (1:1) як кімнатній температурі протягом 2 годин. Реакцію елюент. 1 завершували виливанням у розбавлений H ЯМР (400МГц, CDCl3) d: 7,41 (м, 4Н), 7,33льодяний розчин соляної кислоти. Шари розділяли 7,40 (м, 1Н), 6,81 (д, 1Н, J 8,7Гц), 6,61 (д, 1Н, J і водний розчин екстрагували дихлорметаном. 3,0Гц), 6,51 (дд, 1Н, J 8,7, 3,0Гц), 5,10 (дд, 1Н, J Об'єднані органічні шари промивали водою, 9,6, 1,9Гц), 3,28 (дд, 1Н, J 13,0, 9,6Гц), 3,06 (дд, сушили і випарювали. Сирий продукт розтирали з 1Н, J 13,0, 1,9Гц). одержанням 2,9г 6-метокси-2-феніліндан-1-ону. с) 5-Нітро-2-(2-феніл-2,31 Н-ЯМР (400МГц, d6-ДМСО): 7,56 (д, 1Н), 7,35дигідробензо[1,4]оксатіїн-6-ілокси)піридин 7,23 (м, 4Н), 7,18-7,13 (м, 3H), 4,02 (дд, 1Н, J 3,9, 5-Нітро-2-(2-феніл-2,38,0Гц), 3,82 (с, 3H), 3,61 (дд, 1Н, J 8,0, 17,2Гц), 3,11 дигідробензо[1,4]оксатіїн-6-ілокси)піридин (дд, 1Н, J 3,9, 17,2Гц). одержували, як описано для 5-нітро-2-(2d) 5-Метокси-2-феніліндан фенілхроман-6-ілокси)піридину у прикладі 1(b), 5-Метокси-2-феніліндан одержували, як використовуючи 269мг 2-феніл-2,3описано для 2-фенілхроман-6-олу у прикладі 1(а), дигідробензо[1,4]оксатіїн-6-олу. Продукт використовуючи 600мг 6-метокси-2-феніліндан-1перекристалізовували з етанолу. 1 ону. H ЯМР (400МГц, CDCl3) d: 9,07 (д, 1Н, J 1 Н-ЯМР (400МГц, d6-ДМСО): 7,32-7,27 (м, 4Н), 2,8Гц), 8,47 (дд, 1Н, J 9,1, 2,8Гц), 7,43 (м, 4Н), 7,377,21-7,18 (м, 1Н), 7,13 (д, 1Н, J 8,2Гц), 6,83 (д, 1Н, 7,41 (м, 1Н), 7,02 (д, 1Н, J 9,1Гц), 6,99 (д, 1Н, J J 2,4Гц), 6,72 (дд, 1Н, J 2,4, 8,2Гц), 3,72 (с, 3H), 8,9Гц), 6,95 (д, 1Н, J 2,8Гц), 6,82 (дд, 1Н, J 8,9, 3,64 (к, 1Н, J 8,5Гц), 3,23 (дт, 2Н, J 8,5, 15,9Гц), 2,8Гц), 5,21 (дд, 1Н, J 9,7, 1,9Гц), 3,31 (дд, 1Н, 2,92 (м, 2Н). 13,2, 9,7Гц), 3,11 (дд, 1Н, 13,2, 1,9Гц). e) 2-Феніліндан-5-ол Приклад 9. Проміжна сполука Суміш 5-метокси-2-феніліндану (200мг) і 5-Нітро-2-(2-феніліндан-5-ілокси)піридин концентрованої HBr (4мл) нагрівали зі зворотним a) 3-(4-Метоксифеніл)-2-фенілакрилова холодильником протягом 5,5 годин. Реакційній кислота суміші давали охолонути до кімнатної Триетиламін додавали до розчину птемператури і додавали 20мл льодяної води, і її анізальдегіду (10г) і фенілоцтової кислоти (10г) в екстрагували дихлорметаном. Об'єднані органічні оцтовому ангідриді (25мл). Реакційну суміш шари промивали насиченим розчином солі і перемішували при 90°С протягом 8 годин. сушили за допомогою Na2SO4. Розчинники Реакційну суміш охолоджували і додавали водний випарювали з одержанням 2-феніліндан-5-олу. (600мл) розчин карбонату калію (81г). Після 1 H ЯМР (400МГц, d6-ДМСО): 9,05 (ушир.с, 1Н), додавання реакційну суміш нагрівали і 7,3-7,28 (м, 4Н), 7,26-7,15 (м, 1Н), 7,0 (д, 1Н, J витримували при 60°С протягом години. Перед 8,1Гц), 6,64 (д, 1Н, J 1,9Гц), 6,55 (дд, 1Н, J 1,9, нейтралізацією концентрованою соляною 8,1Гц), 3,60 (к, 1Н, J 8,6Гц), 3,18 (м, 2H), 2,86 (дт, кислотою реакційну суміш о холоджували нижче 2Н, J 8,6, 16Гц). 10°С. Осад відфільтровували і промивали водою. f) 5-Нітро-2-(2-феніліндан-5-ілокси)піридин 35 81941 36 5-Нітро-2-(2-феніліндан-5-ілокси)піридин 6-[2-(2,4-Д(їфторфеніл)хроман-6одержували як описано для 2-фенілхроман-6ілокси]піридин-3-іламін 1 ілокси)піридину у прикладі 1(b), використовуючи Н ЯМР (400МГц, d6-ДМСО) d: 7,58 (м, 1H), 107мг 2-феніліндан-5-олу. 7,51 (д, 1Н, J 3,3Гц), 7,30 (м, 1Н), 7,15 (м, 1Н), 7,05 1 H ЯМР (4 0 МГц, d6-ДМСО): 9,04 (д, 1Н, J (дд, 1Н, J 8,3, 3,3Гц), 6,84-6,73 (м, 3H), 6,70 (д, 1Н, 2,9Гц), 8,61 (дд, 1Н, J 2,9, 9,1Гц), 7,38-7,28 (м, 5Н), J 8,3Гц), 5,27 (дд, 1Н, J 10,3, 2,3Гц), 5,01 (ушир.с, 7,24-7,20 (м, 2Н), 7,11 (д, 1Н, J 2,2Гц), 7,00 (дд, 1Н, 2Н), 2,97 (м, 1Н), 2,73 (м, 1Н), 2,13 (м, 1Н), 2,03 (м, J 2,2, 8,0Гц), 3,72 (к, 1Н, J 8,9Гц), 3,36-3,28 (м, 2H), 1Н). 3,01 (дд, 2Н, J 8,9, 15,3Гц). 6-[2-(2,5-Дифторфеніл)хроман-6Приклад 10. Проміжні сполуки ілокси]піридин-3-іламін 1 5-Амінопіридинові проміжні сполуки H ЯМР (300МГц, d6-ДМСО) Na2SO 4: 7,51 (д, 5-Аміно-2-(2-фенілхроман-6-ілокси)піридин 1Н, J 2,9Гц), 7,36-7,25 (м, 3H), 7,05 (дд, 1Н, J 8,6, 5-Нітро-2-(2-фенілхроман-6-ілокси)піридин 2,9Гц), 6,84-6,68 (м, 4Н), 5,29 (д, 1Н, J 8,6), 4,99 (2,26г) розчиняли у 350мл льодяної оцтової (ушир.с, 2Н), 2,96 (м, 1Н), 2,72 (м, 1Н), 2,14 (м, 1Н), кислоти. Декількома порціями, через екзотермічну 2,01 (м, 1Н). реакцію, додавали порошок цинку (8,48г). С уміш 6-[2-(2,6-Дифторфеніл)хроман-6перемішували при кімнатній температурі протягом ілокси]піридин-3-іламін 1 2 годин і фільтрували. Цинк промивали льодяною Н ЯМР (400МГц, d6-ДМСО) d: 7,52-7,47 (м, оцтовою кислотою. Кислоту випарювали і 2Н), 7,24 (м, 1Н), 7,19-7,14 (м, 3H), 7,07 (дд, 1Н, J додавали толуол, і знову випарювали. Суміш 8,6, 2,9Гц), 6,76-6,51 (м, 3H), 5,37 (ддг 1Н, J 11,6, продукту розчиняли у СН 2Сl2 і промивали 1Μ 2,0Гц), 5,00 (ушир.с, 2Н), 3,00 (м, 1Н), 2,78 (м, 1H), NaOH. Водну фазу додатково промивали СН 2СІ2. 2,32 (м, 1H), 2,11 (м, 1Н). Обидві органічні фракції об'єднували і сушили над 6-[2-(3,5-Дифторфеніл)хроман-6Na2SO4. Продукт очищали колонковою ілокси]піридин-3-іламін 1 хроматографією. H ЯМР (400МГц, d6-ДМСО) d: 7,51 (д, 1Н, J 1 H ЯМР (400МГц; d6-ДМСО) d: 7,52 (д, 1Н, J 2,9Гц), 7,22-7,17 (м, 3H), 7,05 (дд, 1Н, J 8,6, 2,9Гц), 2,8Гц), 7,46-7,30 (м, 5Н), 7,05 (дд, 1Н, J 8,6, 3,0Гц), 6,84 (дд, 1Н, J 7,9, 2,0Гц), 6,76-6,74 (м, 2Н), 6,69 (д, 6,82-6,72 (м, 3H), 6,69 (д, 1Н, J 8,6Гц), 5,08 (дд, 1Н, 1Н, J 8,6Гц), 5,14 (дд, 1Н, J 10,0, 2,2Гц), 5,01 J 10,0, 2,1Гц), 5,00 (с, 2Н), 3,00-2,87 (м, 1Н), 2,74(ушир.с, 2Н), 2,91 (м, 1Н), 2,69 (м, 1Н), 2,20 (м, 1Н), 2,64 (м, 1Η), 2,19-2,10 (м, 1Η), 2,05-1,91 (м, 1Η). 1,97 (м, 1Н). Використовуючи ту ж методику, яка описана 6-[2-(4-Трифторметилфеніл)хроман-6вище для 5-Аміно-2-(2-фенілхроман-6ілокси]піридин-3-іламін 1 ілокси)піридину, але замінюючи 5-Нітро-2-(2Н ЯМР (400МГц, d6-ДМСО) d: 7,78 (д, 2Н, J фенілхроман-6-ілокси)піридин відповідною 8,4Гц), 7,68 (д, 2Н, J 8,4Гц), 7,52 (да, 1Н, J 2,9, нітропіридиновою проміжною сполукою, 0,5Гц), 7,06 (дд, 1Н, 8,6, 2,9Гц) 6,84 (м, 1Η), 6,77одержували: 6,75 (м, 2Н), 6,70 (дд, 1Н, J 8,6, 0,5Гц), 5,23 (дд, 6-[2-(4-Фторфеніл)хроман-6-ілокси]піридин-31Н, J 10,0, 2,0Гц), 5,01 (ушир.с, 2Н), 2,95 (ддд, 1Н, іламін -16,8, 11,1, 5,9Гц), 2,69 (ддд, 1Н, J -16,8, 8,5, 1 Н ЯМР (400МГц, d6-ДМСО) d: 7,52-7,47 (м, 4,8Гц), 2,21 (м, 1Н), 1,97 (м, 1Н). 3H), 7,24 (м, 2Н), 7,05 (дд, 1Н, J 8,6, 3,0Гц), 6,846-[2-(2-Хлорфеніл)хроман-6-ілокси]піридин-36,68 (м, 4Н), 5,09 (дд, 1Н, J 10,2, 2,1Гц), 5,00 іламін 1 (ушир.с, 2Н), 2,93 (м, 1Н), 2,69 (м, 1Н), 2,13 (м, 1Н), Н ЯМР (400МГц, d6-ДМСО) d: 7,59 (м, 1Н), 1,98 (м, 1Н). 7,52-7,38 (м, 4Н), 7,06 (дд, 1Н, J 8,6, 3,0Гц), 6,876-[2-(3-Фторфеніл)хроман-6-ілокси]піридин-36,70 (м, 4Н), 5,33 (дд, 1Н, J 10,3, 2,1Гц), 5,01 іламін (ушир.с, 2НІ, 2,97 (м, 1Н), 2,74 (м, 1Н), 2,20 (м, 1Н), 1 H ЯМР (400МГц, d6-ДМСО) d: 7,51 (д, 1H, J 1,93 (м, 1Н). 3,0Гц), 7,44 (м, 1Н), 7,30-7,25 (м, 2H), 7,16 (м, 1H), 6-[2-(2-Амінофеніл)хроман-6-ілокси]піридин-37,05 (дд, 1Η, J 8,6, 3,0Гц), 6,83-6,73 (м, 3H), 6,69 (д, іламін 1 1Н, J 8,6Гц), 5,13 (дд, 1Н, J 10,0, 3,0Гц), 5,00 (с, H ЯМР (300МГц, d6-ДМСО) d: 7,51 (д, 1Н, J 2Н), 2,93 (ддд, 1Н, -16,8, 10,5, 5,3Гц), 2,68 (ддд, 2,9Гц), 7,15-7,18 (м, 1Η), 7,05 (дд, 1Н, J 8,6, 2,9Гц), 1Н, J -16,8, 8,0, 4,4Гц), 2,18 (м, 1Н), 1,96 (м, 1Н). 6,98-7,00 (м, 1H), 6,77 (д, 1Н, J 8,6Гц), 6,73-6,75 (м, 6-[2-(2-Фторфеніл)хроман-6-ілокси]піридин-32H), 6,66-6,71 (м, 2Н), 6,56-6,61 (м, 1Н), 5,11 (дд, іламін 1Н, J 10,4, 2,0Гц), 5,01 (с, 2Н), 4,99 (с, 2Н), 2,941 H ЯМР (400МГц, d6-ДМСО) d: 7,52 (м, 1Н), 2,99 (м, 1Н), 2,66-2,74 (м, 1Н), 2,06-2,13 (м, 1Н), 7,51 (д, 1Н, J 3,0Гц), 7,41 (м, 1Н), 7,28-7,24 (м, 2Н), 1,88-1,95 (м, 1Н). 7,05 (дд, 1Н, J 8,6, 3,0Гц), 6,81-6,73 (м, 3H), 6,70 (д, 6-[2-(3-Амінофеніл)хроман-6-ілокси]піридин-31Н, J 8,6Гц), 5,31 (дд, 1Н, J 10,3, 2,2Гц), 5,00 (с, іламін 1 2Н), 2,98 (м, 1Н), 2,72 (м, 1Н), 2,15 (м, 1Н), 2,06 (м, H ЯМР (300МГц, d6-ДМСО) d: 7,51 (д, 1Н, J 1Н). 2,8Гц), 7,05 (дд, 1Н, J 8,6, 2,8Гц), 7,01 (т, 1Н, J 6-[2-(2,3-Дифторфеніл)хроман-615,4, 7,7Гц), 6,70-6,78 (м, 3H), 6,68 (д, 1Н, J 8,6Гц), ілокси]піридин-3-іламін 6,63 (с, 1Н), 6,54 (д, 1Н, J 7,7Гц), 6,50 (д, 1Н, J 1 Н ЯМР (400МГц, d6-ДМСО) d: 7,52 (д, 1Н, J 8,6Гц), 5,06 (с, 2Н), 4,98 (с, 2Н), 4,90 (дд, 1Н, J 3,0Гц), 7,45-7,27 (м, 3H), 7,06 (дд, 1Н, J 8,6, 3,0Гц), 10,0, 2,2Гц), 2,85-2,96 (м, 1H), 2,62-2,74 (м, 1Н), 6,76-6,69 (м, 4Н), 5,36 (дд, 1Н, J 10,3, 2,2Гц), 5,01 2,05-2,11 (м, 1Н), 1,89-1,95 (м, 1Н). (ушир.с, 2Н), 2,97 (м, 1Н), 2,73 (м, 1Н), 2,18 (м, 1Н), 6-[2-(4-Амінофеніл)хроман-6-ілокси]піридин-32,03 (м, 1Н). іламін 37 81941 38 Н ЯМР (400МГц, d6-ДМСО) Na2SO 4: 7,50 (д, 5-нітро-2-(2-фенілхроман-7-ілокси)-піридин, 1Н, J 2,9Гц), 7,07 (д, 2Н, 8,4Гц), 7,04 (дд, 1Н, J 8,6, 7-(5-нітропіридин-2-ілокси)-2-фенілхроман-42,9Гц), 6,71 (с, 3H), 6,68 (д, 1Н, J 8,6 Гц), 6,56 (д, он, 2Н, J 8,4Гц), 5,07 (с, 2Н), 4,99 (с, 2Н), 4,84 (дд, 1Н, 3-метил-6-(5-нітропіридин-2-ілокси)-2J 9,7, 2,3Гц), 2,86-2,95 (м, 1Н), 2,66-2,71 (м, 1Н), фенілхроман-4-он, 1,95-2,05 (м, 2Н). 2-(2,3-Дигідро-2-фенілбензо[1,4]діоксин-66-[2-(3-Метоксифеніл)хроман-6-ілокси]піридинілокси)-5-нітропіридин, 3-іламін ORM-10684 5-нітро-2-(6-феніл-5,6,7,8-тетрагідронафталін1 2-ілокси)піридин, H ЯМР (400МГц, d6-ДМСО) d: 7,51 (д, 1Н, J 6-(5-нітропіридин-2-ілокси)-2-феніл-3,43,0Гц), 7,31 (т, 1Н, J 15,8, 7,9Гц), 7,04 (дд, 1Н, J дигідро-2Н-нафталін-1-он, 8,7, 3,0Гц), 6,99-7,02 (м, 1Н), 6,99 (д, 1Н, J 2,6Гц), 2-[3-(3-фторфеніл)хроман-7-ілокси]-56,90 (дд, 1Н, J 8,9, 2,6Гц), 6,79-6,81 (м, 1Н), 6,726,74 (м, 2Н), 6,69 (д, 1Н, J 8,9Гц), 5,06 (дд, 1Н, J нітропіридин, 2-(3-фенілхроман-7-ілокси)-5-нітропіридин, 9,9, 2,2Гц), 4,50 (с, 2Н), 3,77 (с, 3H), 2,88-2,95 (м, 5-нітро-2-(2-феніліндан-5-ілокси)піридин, 1Н), 2,66-2,71 (м, 1Н), 2,12-2,17 (м, 1Н), 1,94-2,00 5-Нітро-2-(2-феніліндан-5-ілокси)піридин, (м, 1Н). можна одержати: 6-(5-Амінопіридин-2-ілокси)-2-фенілхроман-4он 6-[2-(3,4-дифторфеніл)хроман-61 ілокси]піридин-3-іламін, Н ЯМР (400МГц, CD3OD) d: 7,62 (д, 1Н, J 6-[2-(2-трифторметилфеніл)хроман-63,0Гц), 7,51-7,49 (м, 2Н), 7,42-7,33 (м, 3H), 7,25ілокси]піридин-3-іламін, 7,18 (м, 3H), 7,06 (д, 1Н, J 8,8Гц), 6,76 (д, 1Н, J 6-[2-(3-хлор-4-фторфеніл)хроман-68,6Гц), 5,50 (дд, 1Н, J 13,0, 2,9Гц), 3,08 (дд, 1Н, ілокси]піридин-3-іламін, 17,0, 13,0Гц), 2,82 (дд, 1H, J -17,0, 2,9Гц). 6-[2-(3-хлорфеніл)хроман-6-ілокси]піридин-36-(2-Феніл-2,3-дигідробензо[1,4]оксатіїн-6іламін, ілокси)піридин-3-іл аміну гідрохлорид 1 6-[2-(2,4-дихлорфеніл)хроман-6H ЯМР (400МГц, CDCl3) d: 8,20 (д, 1Н, J ілокси]піридин-3-іламін, 2,1Гц), 7,87 (дд, 1Н, J 8,9, 2,1Гц), 7,41-7,44 (м, 4Н), 6-[2-(3-бромфеніл)хроман-6-ілокси]піридин-37,37-7,40 (м, 1Н), 6,98 (д, 1Н, J 8,9Гц), 6,97 (д, 1Н, іламін, J 8,8Гц), 6,93 (д, 1Н, J 2,7Гц), 6,80 (дд, 1Н, J 8,8, 6-[2-(4-етилфеніл)хроман-6-ілокси]піридин-32,7Гц), 5,20 (дд, 1Н, J 9,6, 1,9Гц), 3,30 (дд, 1Н, іламін, 13,2, 9,6Гц), 3,12 (дд, 1Н, 13,2, 1,9Гц). 6-(3-метил-2-фенілхроман-6-ілокси)піридин-36-(5-Амінопіридин-2-ілокси)-2-фенілхромен-4іламін, он 1 5-аміно-2-(2-фенілхроман-7-ілокси)піридин, H ЯМР (300МГц; d6-ДМСО) d: 8,14-8,10 (м, 7-(5-амінопіридин-2-ілокси)-2-фенілхроман-42Н), 7,63-7,51 (м, 5Н), 7,42 (д, 1Н, J 2,9Гц) 7,14 (дд, он, 1Н, J 8,6, 2,9Гц), 7,03 (с, 1Н), 6,89 (д, 1Н, J 8,6Гц), 6-(5-амінопіридин-2-ілокси)-3-метил-25,19 (с, 2Н). фенілхроман-4-он, 6-(2-[3(Піридин-2-ілокси)феніл]хроман-66-(2-феніл-2,3-дигідробензо[1,4]діоксин-6ілокси}піридин-3-іламін 1 ілокси)піридин-3-іламін. Н ЯМР (400МГц, d6-ДМСО) d: 8,16 (дд, 1Н, J 6-(6-феніл-5,6,7,8-тетрагідронафталін-24,7, 1,3Гц), 7,86 (ддд, 1Н, Η 8,7, 6,9, 2,0Гц), 7,51 (д, ілокси)піридин-3-іламін, 1Н, J 2,8Гц), 7,44 (т, 1Н, J 7,8Гц), 7,29 (д, 1Н, J 6-(5-амінопіридин-2-ілокси)-2-феніл-3,47,8Гц), 7,19 (с, 1Н), 7,13 (дд, 1Н, J 6,9, 5,2Гц), 7,09дигідро-2Н-нафталін-1-он, 7,03 (м, 3H), 6,81-6,71 (м, 3H), 6,69 (д, 1Н, J 8,7Гц), 6-[3-(3-фторфеніл)хроман-7-ілокси]піридин-35,11 (д, 1Н, J 9,8Гц), 4,99 (с, 2Н), 2,89 (м, 1Н), 2,68 іламін, (м, 1Н), 2,17 (м, 1Н), 1,97 (м, 1Н). 6-(3-фенілхроман-7-ілокси)-піридин-3-іламін, Використовуючи ту ж саму методику, яка 6-(2-феніліндан-5-ілокси)-піридин-3-іламін, описана для 5-аміно-2-(2-фенілхроман-6відповідно. ілокси)піридину, але замінюючи 5-нітро-2-(2Приклад 11. Проміжні сполуки фенілхроман-6-ілокси)піридин на: 3-Піридинілоксибензальдегідні проміжні 2-[2-(3,4-дифторфеніл)хроман-6-ілокси]-5сполуки нітропіридин, 3-(5-Хлорпіридин-2-ілокси)бензальдегід 5-нітро-2-[2-(2-трифторметилфеніл)хроман-63-Гідроксибензальдегід (3,0г) розчиняли у ілокси]піридин, безводному ДМФ (30мл) в атмосфері азоту. У 2-[2-(3-хлор-4-фторфеніл)хроман-6-ілокси]-5розчин додавали трет-бутоксид калію (3,0г) і нітропіридин, одержану суміш перемішували протягом 30 2-[2-(3-хлорфеніл)хроман-6-ілокси]-5хвилин. Додавали 2,5-дихлорпіридин (3,6г) і суміш нітропіридин, перемішували при 120°С протягом 1,5 години. 2-[2-(2,4-дихлорфеніл)хроман-6-ілокси]-5Реакційній суміші давали охолонути до кімнатної нітропіридин, температури і додавали 1Μ розчин НСI, і цю суміш 2-[2-(3-бромфеніл)хроман-6-ілокси]-5екстрагували етилацетатом. Об'єднані органічні нітропіридин, фази промивали водою і насиченим розчином 2-[--(4-етилфеніл)хроман-6-ілокси]-5NaCl і сушили. Продукт очи щали колонковою нітропіридин, хроматографією, використовуючи гептан2-(3-метил-2-фенілхроман-6-ілокси)-5етилацетат (3:1) як елюент. нітропіридин, 1 39 81941 40 6-Гідрокси-2-[3-(піридин-2H ЯМР (400МГц, d6-ДМСО) d: 10,01 (с, 1Н), ілокси)феніл]хроман-4-он 8,22 (д, 1Н, J 2,6Гц), 8,01 (дд, 1Н, J 8,7, 2,6Гц), 7,79 1 (д, 1Н, J 7,6Гц), 7,69-7,65 (м, 2Н), 7,52 (м, 1Н), 7,20 Н ЯМР (300МГц, d6-ДМСО) d: 8,16 (ддд, 1Н, J (д, 1Н, J 8,7Гц). 5,0, 2,0, 1,8Гц), 7,86 (м, 1Н), 7,46 (т, 1Н, J 7,8Гц), Подібним чином, виходячи з 2-хлорпіридину 7,37 (д, 1Н, J 7,8Гц), 7,30 (д, 1Н J 2,0Гц), 7,16-7,10 одержували: (м, 3H), 7,06-7,02 (м, 2Н), 6,94 (д, 1Н, J 8,8Гц), 5,57 3-(піридин-2-ілокси)бензальдегід. (дд, 1Н, J 12,9, 2,9Гц), 3,17 (дд, 1Н, J -16,8, 1 12,9Гц), 2,80 (дд, 1Н, J -16,8, 2,9Гц). H ЯМР (400МГц, d6-ДМСО) d: 10,01 (с, 1Н), b) 2-(3-Гідроксифеніл)хроман-4,6-діол 8,17 (дд, 1Η, J 5,0, 1,7Гц), 7,90 (ддд, 1H, J 8,5, (проміжна сполука) 6,8,1,9Гц), 7,77 (д, 1H, J 7,8Гц), 7,66, (т, 1H, J 2-(3-Гідроксифеніл)хроман-4,6-діол 7,8Гц), 7,63 (м, 1H), 7,50 (м, 1Н), 7,18 (дд, 1Η, J 6,9, одержували, як описано для 2-(45,0Гц), 7,13 (д, 1Н, 8,3Гц). фтор феніл)хроман-4,6-діолу у прикладі 2(b), але Приклад 12 виходячи з 6-гідрокси-2-(3-гідроксифеніл)хроман6-(5-Нітропіридин-2-ілокси)-2-фенілхромен-44-ону. он 1 6-(5-Нітропіридин-2-ілокси)-2-фенілхромен-4H ЯМР (400МГц, d6-ДМСО) d: 9,43 (ушир.с, он одержували, як описано для 5-нітро-2-(21Н), 8,88 (ушир.с, 1Н), 7,19-7,15 (м, 1Н), 6,87 (д, фенілхроман-6-ілокси)піридину у прикладі 1(b), 1Н, J 2,7Гц), 6,84-6,82 (м, 2Н), 6,72-6,69 (м, 1Н), виходячи з 500мг 6-гідроксифлавону. Продукт 6,58 (д, 1Н, J 8,7Гц), 6,53 (дд, 1Н, J 2,7, 8,7), 5,01 перекристалізовували з суміші 2-пропанолу і (д, 1Н, J 11,3Гц), 4,86 (дд, 1Н, J 6,2, 10,8Гц), 2,25ацетону. 2,19 (м, 1Н), 1,88-1,75 (м, 1Н). 1 Подібним чином одержували: H ЯМР (300МГц, d6-ДМСО) d: 9,04 (д, 1Н, J 2-(4-Гідроксифеніл)хроман-4,6-діол 2,9Гц), 8,67 (дд, 1Н, J 9,0, 2,9Гц), 8,16-8,13 (м, 2Н), 1 7,95 (д, 1Н, J 9,0Гц), 7,82 (д, 1Н, J 2,9Гц), 7,63 (дд, H ЯМР (400МГц, d6-ДМСО) d: 9,41 (ушир.с, 1Н, J 9,1, 2,9Гц), 7,64-7,61 (м, 3H), 7,38 (д, 1Н, J 1Н), 8,79 (ушир.с, 1Н), 7,23-7,21 (м, 2Н), 6,87 (с, 9,1Гц), 7,09 (с, 1Н). 1Н), 6,77-6,74 (м, 2Н), 6,53 (м, 2Н), 5,37 (д, 1Н, J Приклад 13 7,0Гц), 4,97 (д, IK, J 11,6Гц), 4,85-4,82 (м, 1Н), 2,202-[2-(3-(5-Нітропіридин-2-ілокси)феніл)хроман2,15 (м, 1Н), 1,95-1,85 (м, 1Н). 6-ілокси]-5-нітропіридин і його похідні 2-(4-Бензилоксифеніл)хроман-4,6-діол 1 а) 6-Гідрокси-2-(3-гідроксифеніл)хроман-4-он ЯМР (400МГц, d6-ДМС О) d: 8,81 (ушир.с, 1Н), (проміжна сполука) 7,47-7,28 (м, 6Н), 7,09 (с, 1Н), 7,02 (д, 1Н, J 7,9Гц), 6-Гідрокси-2-(3-гідроксифеніл)хроман-4-он 6,97 (дд, 1Н, J 2,4, 7,9Гц), 6,88 (д, 1Н, J 2,8Гц), 6,59 одержували, як описано тля 6-гідрокси-2-(4(д, 1Н, J 8,7Гц), 6,54 (дд, 1Н, J 2,8, 8,7Гц), 5,40 (д, фтор феніл)хроман-4-ону у прикладі 2(а), але 1Н, J 6,2Гц), 5,12 (с, 2Н), 5,08 (д, 1Н, J 10,9Гц), виходячи з 3-гідроксибензальдегіду. Продукт 4,88-4,85 (м, 1Н), 2,28-2,23 (м, 1Н), 1,92-1,77 (м, перекристалізовували з етанолу. 1Н). 1 H ЯМР (400МГц, d6-ДМСО) d: 9,50 (ушир.с, 2-[3-(5-Хлорпіридин-2-ілокси)феніл]хроман1Н), 9,41 (ушир.с, 1Н), 7,22-7,17 (м, 1Н), 7,11 (д, 4,6-діол 1 1Н, J 3,0Гц), 7,03 (дд, 1Н J 3,0, 8,9Гц), 6,64 (д, 1Н, H ЯМР (400МГц, d6-ДМСО) d: 8,82 (с, 1Н), 8,22 J 8,9Гц), 6,92-6,90 (м, 2Η), 6,76-6,73 (м, 1Η), 5,46 (д, 1Н, J 2,6Гц), 7,97 (дд, 1Н, J 8,6, 2,6Гц), 7,45 (т, (дд, 1Н J 2,9, 12,7Гц), 3,09 (дд, 1Н, J 12,7, 16,9Гц), 1Н, J 7, 9Гц), 7,31 (д, 1Н, J 7,9Гц), 7,20 (д, 1Н, J 2,75 (дд, 1Н, J 2,9, 16,9Гц). 1,7Гц), 7,12 (д, 1Н, J 8,6Гц), 7,11 (дд, 1Н, J 7,9, Подібним чином одержували: 1,7Гц), 6,87 (д, 1Н, J 2,6Гц), 6,59 (д, 1Н, J 8,6Гц), 6-Гідрокси-2-(4-гідроксифеніл)хроман-4-он 6,53 (дд, 1Н, J 8,6, 2,6Гц), 5,41 (ушир.с, 1Н), 5,14 1 H ЯМР (400МГц, d6-ДМСО) d: 9,54 (ушир, с, (д, 1Н, J 12,9Гц), 4,86 (м, 1Н) 2,29 (м, 1Н), 1,87 (м, 1Н), 9,38 (ушир.с, 1Н), 7,34-7,31 (м, 2Н), 7,10 (д, 1Н). 1H, J 3,0Гц), 7,02 (дд, 1Н J 3,0, 8,8Гц), 6,91 (д, 1Н, 2-[3-(Піридин-2-ілокси)феніл]хроман-4,6-діол 1 J 8,8Гц), 6,80-6,77 (м, 2Н), 5,40 (дд, 1Н J 2,7, H ЯМР (400МГц, d6-ДМСО) d: 8,82 (с, 1Н) 8,17 13,1Гц), 3,17 (дд, 1Н, J 13,2, 16,9Гц), 2,68 (дд, 1Н, J (м, 1Н), 7,86 (м, 1H), 7,43 (т, 1Н, J 7,8Гц), 7,29 (д, 2,7, 16,9Гц). 1Н, J 7,8Гц), 7,18 (с, 1Н), 7,15-7,04 (м, 3H), 6,87 (д, 6-Гідрокси-2-(3-бензилоксифеніл)хроман-4-он 1Н, J 2,7Гц), 6,59 (д, 1Н, J 8,7Гц), 6,53 (дд, 1Н, J 1 Н ЯМР (400МГц, d6-ДМСО) d: 9,41 (ушир, с, 8,7, 2,7Гц), 5,40 (д, 1Н, J 7,0Гц), 5,14 (д, 1Н, J 1Н), 7,50-7,30 (м, 6Н), 7,20 (с, 1Н), 7,12-7,08 (м, 11,6Гц), 4,86 (м, 1Н) 2,29 (м, 1Н), 1,88 (м, 1Н). 2Н), 7,05-7,00 (м, 2Н), 6,95 (д, 1Н, J 8,9Гц), 5,52 с) 2-(3-Гідроксифеніл)хроман-6-ол (проміжна (дд, 1Н J 2,9, 12,9Гц), 5,12 (с, 2Н), 3,16 (дд, 1Н, J сполука) 12,9, 16,9Гц), 2,78(дд, 1Н, J 2,9, 16,9Гц). 2-(3-Гідроксифеніл)хроман-6-ол одержували, 2-[3-(5-Хлорпіридин-2-ілокси)феніл]-6як описано для 2-(4-фторфеніл)хроман-6-олу у гідроксихроман-4-он прикладі 2(с), але виходячи з 2-(31 гідроксифеніл)хроман-4,6-діолу. H ЯМР (400МГц, d6-ДМСО) d: 9,52 (ушир.с, 1 1Н), 8,22 (д, 1Н, J 2,6Гц), 7,97 (дд, 1Н, J 8,8, 2,6Гц), H ЯМР (400МГц, d6-ДМСО) d: 9,38 (с, 1Н), 8,77 7,47 (т, 1Н, J 7,7Гц), 7,39 (д, 1Н, J 7,7Гц), 7,32 (с, (с, 1Н), 7,17-7,13 (м, 1H), 6,82-6,79 (м, 2Η), 6,701Н), 7,16-7,10 (м, 3H), 7,04 (дд, 1Н, J 8,8, 3,0Гц), 6,67 (м, 1Н), 6,62 (д, 1H, J 8,6Гц), 6,52-6,47 (м, 2H), 6,96 (д, 1Н, J 8,8Гц), 5,57 (дд, 1Н, J 13,0, 2,7Гц), 4,89 (дд, 1Н, J 2,1, 9,9Гц), 2,86-2,82 (м, 1Н), 2,653,17 (дд, 1Н, J -16,8, 13,0Гц), 2,80 (дд, 1Н, J -16,8, 2,59 (м, 1Н), 2,09-2,04 (м, 1Н), 1,91-1,85 (м, 1Н). 2,7Гц). Подібним чином одержували: 2-(3-Бензилоксифеніл)хроман-6-ол 1 41 81941 42 a) 6-(5-Нітропіридин-2-ілокси)-2-[3-(5Н ЯМР (400МГц, d6-ДМСО) d: 8,77 (с, 1Н), нітропіридин-2-ілокси)феніл]хроман-4-ол 7,46-7,26 (м, 6Н), 7,06 (с, 1Н), 7,00-6,93 (м, 2Н), 6,63 (д, 1Н, J 8,5Гц), 6,52-6,47 (м, 2Н), 5,10 (с, 2Н), 6-(5-Нітропіридин-2-ілокси)-2-[3-(5нітропіридин-2-ілокси)феніл]хроман-4-ол 4,96 (дд, 1Н, J 1,8, 9,8Гц), 2,91-2,82 (м, 1Н), 2,67одержували, як описано для 5-нітро-2-(22,59 (м, 1Н), 2,12-2,07 (м, 1Н), 1,99-1,87 (м, 1Н). фенілхроман-6-ілокси)піридину у прикладі 1(b), 2-[3-(5-Хлорпіридин-2-ілокси)феніл]хроман-6але виходячи з 2-(3-гідроксифенілхроман-4,6-діолу ол 1 і використовуючи 210моль% 2-хлор-5H ЯМР (300МГц, d6-ДМСО) d: 8,75 (с, 1Н), 8,21 нітропіридину. (д, 1Н, J 2,6Гц), 7,95 (дд, 1Н, J 8,7, 2,6Гц), 7,43 (т, 1 H ЯМР (400МГц, d6-ДМСО) d: 9,06 (д, 1Н, J 1Н, J 7,8Гц), 7,28 (д, 1Н, J 7,8Гц), 7,18 (д, 1Н, J 2,8Гц), 9,03 (д, 1Н, J 2,8Гц), 8,64 (дд, 1H, J 2,8, 1,9Гц), 7,11-7,07 (м, 2Н), 6,61-6,48 (м, 3H), 5,01 (дд, 9,1Гц), 8,61 (дд, 1H, J 2,8, 9,1Гц), 7,54 (т, 1H, J 1Н, J 9,8, 2,0Гц), 2,87 (м, 1Н) 2,62 (м, 1Н), 2,13 (м, 7,9Гц), 7,43 (д, 1Н, J 7,9Гц), 7,36 (с, 1Н), 7,30 (д, 1Н), 1,93 (м, 1Н). 1Н, J 9,1Гц), 7,25-7,21 (м, 3H) 7,01 (дд, 1Н, J 2,9, 2-[3-(Піридин-2-ілокси)феніл]хроман-6-ол 1 8,7Гц), 6,89 (д, 1Н, J 8,7Гц), 5,67 (д, 1Н, J 6,4Гц), Н ЯМР (400МГц, d6-ДМСО) d: 8,81 (ушир, с, 5,36 (д, 1Н, J 10,8Гц), 5,01-4,95 (м, 1Н), 2,41-2,36 1Н), 8,17 (м, 1Н), 7,85 (м, 1Н), 7,42 (т, 1Н, J 7,9Гц), (м, 1Н), 2,02-1,92 (м, 1Н). 7,26 (д, 1Н, J 7,9Гц), 7,16-7,12 (м, 2Н), 7,07-7,02 (м, Подібним чином одержували: 2Н), 6,63 (д, 1Н, J 8,2Гц), 6,57-6,48 (м, 2Н), 5,01 (д, b) 6-(5-Нітропіридин-2-ілокси)-2-[4-(51Н, J 8,5Гц), 2,88 (м, 1Н) 2,63 (м, 1Н), 2,13 (м, 1Н), нітропіридин-2-ілокси)феніл]хроман-4-ол 1,93 (м, 1Н). 1 H ЯМР (400МГц, d6-ДМСО) d: 9,05-9,04 (м, 2Н, d) 2-[2-(3-(5-Нітропіридин-2ілокси)феніл)хроман-6-ілокси]-5-нітропіридин основний (великий) і другорядний (малий)), 8,668,60 (м, 2Н, основний (великий) і другорядний 2-[2-(3-(5-Нітропіридин-2-ілокси)феніл)хроман(малий)), 7,61-7,58 (м, 2Н, основний (великий) і 6-ілокси]-5-нітропіридин одержували, як описано другорядній (малий)), 7,31-7,21 (м, 5Н, основний для 5-нітро-2-(2-фенілхроман-6-ілокси)піридину у (великий) і другорядний (малий)), 7,10 (дд, 1H, J прикладі 1(b), але виходячи з 2-(3гідроксифеніл)хроман-6-олу і використовуючи 2,9, 8,8Гц, другорядний (малий)), 7,03 (дд, 1H, J 3, 8,8Гц, основний (великий)), 6,97 (д, 1H, J 8,8Гц, 210моль % 2-хлор-5-нітропіридину. 1 другорядний (малий)) 6,89 (д, 1H, J 8,8Гц, Н ЯМР (400МГц, d6-ДМСО) d: 9,05 (д, 1Н, J основний (великий)), 5,68 (д, 1H, J 6,4Гц, основний 2,9Гц), 9,03 (дг 1Н, J 2,9Гц), 8,64 (дд, 1Н, J 2,9, (великий)), 5,63 (д, 1H, J 4,7Гц, другорядний 9,1Гц), 8,60 (дд, 1Н, J 2,9, 9,1Гц), 7,52 (т, 1Н, J (малий)), 5,37-5,30 (м, 1H, основний (великий) і 7,8Гц), 7,41 (д, 1H, J 7,8Гц), 7,33-7,31 (м, 1H), 7,28 другорядний (малий)), 5,04-4,97 (м, 1H, основний (д, 1H, J 7,8Гц), 7,23-7,18 (м, 2Η) 7,01-6,90 (м, 3H), (великий)), 4,69-4,65 (м, 1Н, другорядний (малий)), 5,20 (дд, 1Н, J 2,1, 10,1Гц), 3,07-2,92 (м, 1H), 2,802,41-2,36 (м, 1Н, основний (великий)), 2,21-2,15 (м, 2,70 (м, 1H), 2,30-2,18 (м, 1H), 2,10-1,98 (м, 1H). 2Н, основний (великий) і другорядний (малий)), Використовуючи тільки 100моль% 2-хлор-52,07-1,98 (м, 1Н, основний (великий)). нітропіридину, одержували: 5-Нітро-2-[2-(3Приклад 15 бензилоксифеніл)хроман-6-ілокси]піридин 1 2-{2-[4-(5-Нітропіридин-2-ілокси)феніл]хроманН ЯМР (300МГц, d6-ДМСО) d: 9,03 (д, 1H, J 6-ілокси}-5-нітропіридин 2,9Гц), 8,59 (дд, 1H, J 2,9, 9,1Гц), 7,47-7,29 (м, 6Н), 2-{2-[4-(5-Нітропіридин-2-ілокси)феніл]хроман7,19 (д, 1H, J 9,1Гц), 7,10 (с, 1H), 7,05-6,92 (м, 5Н), 6-ілокси}-5-нітропіридин одержували, як описано 5,14-5,10 (м, 3H), 3,00-2,88 (м, 1H), 2,75-2,69 (м, для 2-(4-фторфеніл)хроман-6-олу у прикладі 2(с), 1H), 2,20-2,14 (м, 1H), 2,07-1,95 (м, 1H). але виходячи з 6-(5-нітропіридин-2-ілокси)-2-[4-(55-Нітро-2-{2-[3-(5-хлорпіридин-2нітропіридин-2-ілокси)феніл]-хроман-4-олу. ілокси)феніл]хроман-6-ілокси}піридин 1 1 H ЯМР (400МГц, d6-ДМСО) d: 9,05 (д, 2Н, J H ЯМР (300МГц, d6-ДМСО) d: 9,02 (д, 1H, J 2,9Гц), 8,65-8,58 (м, 2Н), 7,58-7,55 (м, 2Н), 7,302,9Гц), 8,59 (дд, 1H, J 9,1, 2,9Гц), 8,22 (д, ХН, J 7,26 (м, 3H), 7,20 (д, 1Н, J 9,1Гц), 7,03-6,91 (м, 3H) 2,8Гц), 7,97 (ддг 1H, J 8,7, 2,8Гц), 7,46 (т, 1H, J 5,20 (дд, 1н, J 2,0, 10,1Гц), 3,06-2,97 (м, 1Н), 2,817,8Гц), 7,33 (д, 1Н, J 7,8Гц), 7,23, (с, 1Н), 7,19 (д, 2,75 (м, 1Н), 2,26-2,21 (м, 1Н), 2,11-2,02 (м, 1Н). 1Н, J 9,1Гц), 7,13-7,10 (м, 2Н), 6,99-6,89 (м, 3H), Приклад 16 5,18 (д, 1Н, J 8,0Гц), 2,97 (м, 1Н), 2,75 (м, 1Н), 2,21 6-[2-(3-(5-Амінопіридин-2-ілокси)феніл)хроман(м, 1Н), 2,01 (м, 1Н). 6-ілокси]-піридин-3-іламін і його похідні 5-Нітро-2-{2-[3-(піридин-26-[2-(3-(5-Амінопіридин-2-ілокси)феніл)хроманілокси)феніл]хроман-6-ілокси}піридин 1 6-ілокси]-піридин-3-іламін одержували, як описано Н ЯМР (400МГц, d6-ДМСО) d: 9,04 (д, 1Н, J для 5-аміно-2-(2-фенілхроман-6-ілокси)піридину у 2,7Гц), 8,59 (дд, 1Н, J 9,1, 2,7Гц), 8,17 (м, 1H), 7,86 прикладі 10, але виходячи з 2-[2-(3-(5(м, 1Н), 7,45 (т, 1Н, J 7,8Гц), 7,31 (д, 1Н, J 7,8Гц), нітропіридин-2-ілокси)феніл)хроман-6-ілокси]-57,21, (с, 1Н), 7,20 (д, 1Н, J 9,1Гц), 7,13 (м, 1Н), 7,09 нітропіридину. Продукт виділяли у вигляді (м, 1Н), 7,06 (8,6Гц), 7,04 (2,5Гц), 6,96 (дд, 1Н, J дигідрохлориду. 8,6, 2,5Гц), 5,18 (д, 1Н, J 8,8Гц), 2,98 (м, 1Н), 2,72 1 H ЯМР (300МГц, d6-ДМСО) d: 8,12 (м, 2Н), (м, 1Н), 2,21 (м, 1Н), 2,02 (м, 1Н). 7,78 (м, 1Н), 7,45 (т, 1Н, J 7,8Гц), 7,31 (д, 1Н, J Приклад 14 7,2Гц), 7,21 (с, 1Н), 7,13-7,04 (м, 3H), 6,91-6,87 (м, 6-(5-Нітропіридин-2-ілокси)-2-[3-(53H), 5,15 (д, 1Н, J 9,8Гц), 3,02-2,91 (м, 1Н), 2,76нітропіридин-2-ілокси)феніл]хроман-4-ол і його 2,70 (м, 1Н), 2,23-2,17 (м, 1Н), 2,05-1,93 (м, 1Н). похідні Подібним чином одержували: 1 43 81941 44 6-[2-(3-бензилоксифеніл)хроман-66-[2-(2,6-дифторфеніл)хроман-6ілокси]піридин-3-іламіну гідрохлорид ілокси]піридин-3-іламін, 1 6-[2-(3,4-дифторфеніл)хроман-6H ЯМР (400МГц, d6-ДМСО) d: 7,85 (с, 1Н), ілокси]піридин-3-іламін, 7,47-7,29 (м, 6Η), 7,09 (с, 1Н), 7,02 (д, 1H, J 7,4Гц), 6-[2-(3,5-дифторфеніл)хроман-66,98 (дд, 1Н, J 2,3, 8,2Гц), 6,91 (д, 1Н, J 8,7Гц), ілокси]піридин-3-іламін, 6,85-6,81 (м, АН), 5,12 (с, 2Н), 5,09 (д, 1Н, J 9,5Гц), 6-[2-(2-трифторметилфеніл)хроман-62,96-2,89 (м, 1Н), 2,72-2,67 (м, 1Н) 2,20-2,14 (м, 1Н), 2,03-1,97 (м, 1Н). ілокси]піридин-3-іламін, 6-[2-(4-трифторметилфеніл)хроман-66-(5-Амінопіридин-2-ілокси)-2-[3-(5ілокси]піридин-3-іламін, амінопіридин-2-ілокси)феніл)хроман-4-олу 6-[2-(3-хлор-4-фторфеніл)хроман-6дигідрохлорид 1 ілокси]піридин-3-іламін, Н ЯМР (400МГц, d6-ДМСО) d: 8,15 (д, 2Н, J 6-[2-(2-хлорфеніл)хроман-6-ілокси]піридин-32,6Гц), 7,82 (дд, 2Н, J 2,6, 8,8Гц), 7,47 (т, 1Н, іламін, 7,9Гц), 7,35 (д, 1H, J 7,9Гц), 7,24 (с, 1Н), 7,19-7,08 6-[2-(3-хлорфеніл)хроман-6-ілокси]піридин-3(м, 4Н), 6,94 (дд, 1Н, 2,8, 8,8Гц), 6,84 (д, 1Н, 8,8Гц), іламін, 5,30 (д, 1Н, J 10,9Гц), 4,96 (дд, 1Н, J 6,1, 10,7Гц), 6-[2-(2,4-дихлорфеніл)хроман-62,38-2,32 (м, 1Н), 1,98-1,88 (м, 1H). ілокси]піридин-3-іламін, Приклад 17 6-[2-(3-бромфеніл)хроман-6-ілокси]піридин-33-[6-(5-Амінопіридин-2-ілокси)хроман-2іламін, іл]фенол 6-[2-(4-етилфеніл)хроман-6-ілокси]піридин-32,15г 5-нітро-2-[2-(3-бензилоксифеніл)хроманіламін, 6-ілокси]піридину розчиняли у 600мл етанолу і 6-[2-(3-метоксифеніл)хроман-6-ілокси]піридиндодавали 430мг 10% паладію на вугіллі в інертній 3-іламін, атмосфері. Вихідну речовину гідр ували при 6-(3-метил-2-фенілхроман-6-ілокси)піридин-3кімнатній температурі з одержанням кількісного іламін, виходу 3-[6-(5-амінопіридин-2-ілокси)хроман-25-аміно-2-(2-фенілхроман-7-ілокси)піридин, іл]фенолу. 1 6-(5-амінопіридин-2-ілокси)-2-фенілхроман-4Н ЯМР (400МГц, d6-ДМСО) d: 9,50 (ушир.с, он, 1H), 7,52 (д, 1H, J 3,0Гц), 7,17 (т, 1H, J 8,1Гц), 7,05 7-(5-амінопіридин-2-ілокси)-2-фенілхроман-4(дд, 1H, J 3,0, 8,6Гц), 6,84-6,68 (м, 7Н), 5,01-4,99 он, (м, 3H), 2,91-2,86 (м, 1Н), 2,70-2,63 (м, 1Н), 2,146-(5-амінопіридин-2-ілокси)-3-метил-22,08 (м, 1Н), 1,96-1,89 (м, 1Н). фенілхроман-4-он, Приклад 18 6-(2-феніл-2,3-дигідробензо[1,4]діоксин-62-Ацетиламіно-N-[6-(2-фенілхроман-6ілокси)піридин-3-іламін, ілокси)піридин-3-іл]-ацетамід 6-(6-феніл-5,6,7,8-тетрагідронафталін-25-Аміно-2-(2-фенілхроман-6-ілокси)піридин ілокси)піридин-3-іламін, (500мг) і N-ацетилгліцин (275мг) розчиняли у 35мл 6-(5-амінопіридин-2-ілокси)-2-феніл-3,4дихлорметану. Додавали 1-(3дигідро-2Н-нафталін-1-он, диметиламінопропіл)-3-етилкарбодііміду 6-(2-феніл-2,3-дигідробензо[1,4]оксатіїн-6гідрохлорид (450мг). Суміш перемішували при ілокси)піридин-3-іламін, кімнатній температурі протягом 6 годин. Реакцію 6-[3-(3-фторфеніл)хроман-7-ілокси]піридин-3гасили додаванням води, і утворений осад іламін, відфільтровували. 1 6-(3-фенілхроман-7-ілокси)піридин-3-іламін, H ЯМР (400МГц; d6-ДМСО) d: 10,1 (с, 1H), 8,30 6-(5-амінопіридин-2-ілокси)-2-фенілхромен-4(д, 1H, J 2,7Гц), 8,21 (т, 1H, J 5,7Гц), 8,00 (дд, 1Н, J он, 2,7, 8,9Гц), 7,47-7,30 (м, 5Н), 6,95 (д, 1Н,,Т 8,9Гц), 6-(2-феніліндан-5-ілокси)піридин-3-іламін, 6,87-6,84 (м, 3H), 5,12 (дд, 1Н, J 1,90, 10,0Гц), 3,86 одержували: (д, 2Н, J 5,7Гц), 3,00-2,92 (м, 1Н), 2,75-2,70 (м, 1Н), 2-ацетиламіно-N-{6-[2-(4-фторфеніл)хроман-62,19-2,14 (м, 1Н), 2,03-1,97 (м, 1Н). ілокси]піридин-3-іл}ацетамід, Використовуючи ту ж саму методику, яка 2-ацетиламіно-N-{6-[2-(3-фторфеніл)хроман-6описана для 2-ацетиламіно-N-[6-(2-фенілхроманілокси]піридин-3-іл}ацетамід, 6-ілокси)піридин-3-іл]-ацетаміду, ви ще, але 2-ацетиламіно-N-{6-[2-(2-фторфеніл)хроман-6замінюючи 5-аміно-2-(2-фенілхроман-6ілокси]піридин-3-іл}ацетамід, ілокси)піридин на: 2-ацетиламіно-N-{6-[2-(2,36-[2-(4-фторфеніл)хроман-6-ілокси]піридин-3Дифторфеніл)хроман-6-ілокси]піридин-3іламін, іл}ацетамід, 6-[2-(3-фторфеніл)хроман-6-ілокси]піридин-32-ацетиламіно-N-{6-[2-(2,4іламін, дифторфеніл)хроман-6-ілокси]піридин-36-[2-(2-фторфеніл)хроман-6-ілокси]піридин-3іл}ацетамід, іламін, 2-ацетиламіно-N-{6-[2-(2,56-[2-(2,3-дифторфеніл)хроман-6дифторфеніл)хроман-6-ілокси]піридин-3ілокси]піридин-3-іламін, іл}ацетамід, 6-[2-(2,4-дифторфеніл)хроман-62-ацетиламіно-Н-{6-[2-(2,6ілокси]піридин-3-іламін, дифторфеніл)хроман-6-ілокси]піридин-36-[2-(2,5-дифторфеніл)хроман-6іл}ацетамід, ілокси]піридин-3-іламін, 45 81941 46 2-ацетиламіно-N-{6-[2-(3,4холодильником протягом декількох годин. Реакцію дифторфеніл)хроман-6-ілокси]піридин-3гасили додаванням води і екстрагували іл}ацетамід, етилацетатом. Об'єднані органічні шари 2-ацетиламіно-N-{6-[2-(3,5промивали водою, насиченим розчином карбонату дифторфеніл)хроман-6-ілокси]піридин-3натрію, сушили Na2SO 4 і випарювали. 1 іл}ацетамід, H ЯМР (300МГц; d6-ДМСО) d: 10,0 (с, 1Н), 8,31 2-ацетиламіно-N-{6-[2-(2-трифторметил феніл (д, 1Н, J 2,7Гц), 8,03 (дд, 1Н, J 2,7, 8,8Гц), 7,47-7,33 )хроман-6-ілокси]піридин-3-іл}ацетамід, (м, 5Н), 6,92 (д, 1Н, J 8,8Гц), 6,87-6,84 (м, 3H), 5,13 2-ацетиламіно-N-{6-[2-(4(дд, 1Н, J 2,2, 10,1Гц), 4,04-3,96 (м, 2Η), 2,99-2,91 трифторметилфеніл)хроман-6-ілокси]піридин-3(м, 1Н), 2,81-2,69 (м, 3H), 2,20-2,12 (м, 2Н), 2,08іл}ацетамід, 1,98 (м, 1Н), 1,79-1,74 (м, 3H), 1,50-1,35 (м, 11Н). 2-ацетиламіно-N-{6-[2-(3-хлор-4b) [6-(2-Фенілхроман-6-ілокси)піридин-3-іл]амід фтор феніл)хроман-6-ілокси]піридин-3-іл}ацетамід, піперидин-4-карбонової кислоти 2-ацетиламіно-N-{6-[2-(2-хлорфеніл)хроман-6Суміш трет-бутилового е фіру 4-[6-(2ілокси]піридин-3-іл}ацетамід, фенілхроман-6-ілокси)піридин-32-ацетиламіно-N-{6-[2-(3-хлорфеніл)хроман-6ілкарбамоїл]піперидин-1-карбонової кислоти ілокси]піридин-3-іл}ацетамід, (860мг) і 1Μ HCI у діетиловому ефірі (13мл) 2-ацетиламіно-N-{6-[2-(2,4перемішували при кімнатній температурі протягом дихлорфеніл)хроман-6-ілокси]піридин-324 годин. Осад відфільтровували і промивали іл}ацетамід, ефіром. 1 2-ацетиламіно-N-{6-[2-(3-бромфеніл)хроман-6H ЯМР (300МГц; d6-ДМСО) d: 10,3 (с, 1Н), 8,97 ілокси]піридин-3-іл}ацетамід, (ушир.с, 1Н), 8,65 (ушир.с, 1Н), 8,34 (д, 1Н, J 2-ацетиламіно-N-{6-[2-(4-етилфеніл)хроман-62,7Гц), 8,04 (дд, 1Н, J 2,7, 8,8Гц), 7,47-7,33 (м, 5Н), ілокси]піридин-3-іл}ацетамід, 6,94 (д, 1Н, J 8,8Гц), 6,86-6,84 (м, 3H), 5,11 (дд, 1Н, 2-ацетиламіно-N-{6-[2-(3J 2,3, 10,0Гц), 3,35-3,29 (м, 2Н), 2,97-2,89 (м, 3H), метоксифеніл)хроман-6-ілокси]піридин-32,74-2,66 (м, 2Н), 2,19-2,13 (м, 1Н), 2,00-1,74 (м, іл}ацетамід, 5Н), 1,50-1,35 (м, 11Н). 2-ацетиламіно-N-{6-(3-метил-2-фенілхроман-6Приклад 20 ілокси)піридин-3-іл}ацетамід, 2-Аміно-N-[6-(2-фенілхроман-6-ілокси)піридин2-ацетиламіно-N-[6-(2-фенілхроман-73-іл]-пропіонамід і його похідні ілокси)піридин-3-іл]ацетамід, 2-Аміно-N-[6-(2-фенілхроман-6-ілокси)піридин2-ацетиламіно-N-[6-(4-оксо-2-фенілхроман-63-іл]-пропіонамід і його похідні одержували, як ілокси)піридин-3-іл]ацетамід, описано для [6-(2-фенілхроман-6-ілокси)піридин-32-ацетиламіно-N-[6-(4-оксо-2-фенілхроман-7іл]аміну піперидин-4-карбонової кислоти у ілокси)піридин-3-іл]ацетамід, прикладі 19 а) і b), але замінюючи Ν-(трет2-ацетиламіно-N-[6-(3-метил-4-оксо-2бутоксикарбоніл)ізоніпекотинову кислоту (S), (R) фенілхроман-6-ілокси)піридин-3-іл]ацетамід, або (S,R)-2-трет2-ацетиламіно-N-[6-(2-феніл-2,3бутоксикарбоніламінопропіоновою кислотою. дигідробензо[1,4]діоксин-6-ілокси)піридин-3а) Трет-бутиловий ефір {1-[6-(2-фенілхроманіл]ацетамід, 6-ілокси)піридин-3-ілкарбамоїл]етил}карбамінової 2-ацетиламіно-N-[6-(6-феніл-5,6,7,8кислоти і його похідні тетрагідронафталін-2-ілокси)піридин-3-іл]ацетамід, Трет-бутиловий ефір {(S)-1-[6-(2-фенілхроман2-ацетиламіно-N-[6-(5-оксо-6-феніл-5,6,7,86-ілокси)піридин-3-ілкарбамоїл]етил}карбамінової тетрагідронафталін-2-ілокси)піридин-3-іл]ацетамід, кислоти 1 2-ацетиламіно-N-[6-(2-феніл-2,3Н-ЯМР (300МГц; d6-ДМСО) d: 10,0 (с, 1Н), дигідробензо[1,4]оксатіїн-6-ілокси)піридин-38,31 (д, 1Н, J 2,7Гц), 8,03 (дд, 1Н, J 2,7, 8,9Гц), іл]ацетамід, 7,47-7,33 (м, 5Н), 6,94 (д, 1Н, J 8,9Гц), 6,87-6,84 (м, 2-ацетиламіно-N-{6-[3-(3-фторфеніл)хроман-73H), 5,11 (дд, 1Н, J 2,0, 10,0Гц), 4,08 (т, 1Н, J ілокси]піридин-3-іл}ацетамід, 7,1Гц), 3,00-2,91 (м, 1Н), 2,75-2,69 (м, 1Н), 2,192-ацетиламіно-N-[6-(3-фенілхроман-72,04 (м, 1Н), 2,02-1,97 (м, 1Н), 1,38 (с, 9Н), 1,26 (д, ілокси)піридин-3-іл] ацетамід, 3H, J 7,1Гц). 2-ацетиламіно-N-[6-(4-оксо-2-феніл-4НТрет-бутиловий ефір {(R)-1-[6-(2-фенілхроманхромен-6-ілокси)піридин-3-іл] ацетамід, 6-ілокси)піридин-3-ілкарбамоїл]етил}карбамінової 2-ацетиламіно-N-[6-(2-феніліндан-5кислоти 1 ілокси)піридин-3-іл]ацетамід, відповідно. Н ЯМР (400МГц, d6-ДМСО) d: 10,05 (ушир.с, Приклад 19 1Н), 8,31 (д, 1Н, J 2,4Гц), 8,04 (дд, 1Н, J 2,4, 8,9Гц), [6-(2-Фенілхроман-6-ілокси)піридин-3-іл]амід 7,39-7,46 (м, 3H), 7,32-7,35 (м, 1Н), 7,08 (м, 1Н), піперидин-4-карбонової кислоти 6,94 (д, 1Н, J 8,9Гц), 6,81-6,86 (м, 3H), 5,12 (д, 1Н, а) Трет-бутиловий ефір 4-[6-(2-Фенілхроман-6J 10,1Гц), 4,11 (м, 1Н), 2,98 (м, 1Н), 2,70 (м, 1Н), ілокси)піридин-3-ілкарбамоїл]піперидин-12,17 (м, 1Н), 2,00 (м, 1Н), 1,38 (с, 9Н), 1,26 (д, 3H, J карбонової кислоти 7,1Гц). 5-Аміно-2-(2-фенілхроман-6-ілокси)піридин b) 2-Аміно-N-[6-(2-фенілхроман-6(500мг) і N-(трет-бутоксикарбоніл)ізоніпекотинову ілокси)піридин-3-іл]пропіонамід і його похідні кислоту (541мг) розчиняли у 40мл ТГФ. Додавали (S)-2-аміно-N-[6-(2-фенілхроман-61-(3-диметиламінопропіл)-3-етилкарбодііміду ілокси)піридин-3-іл]пропіонаміду гідрохлорид гідрохлорид (451мг). Суміш нагрівали зі зворотним 47 81941 48 Приклад 22 Н-ЯМР (400МГц; d6-ДМСО) d: 10,9 (с, 1Н), (S)-2-Аміно-3-метил-N-(6-{2-[3-(5-нітропіридин8,39 (д, 1H, J 2,5Гц), 8,05 (дд, 1Н, J 2,5, 8,8Гц), 7,46-7,31 (м, 5Н), 7,00 (д, 1Н, J 8,8Гц), 6,88-6,85 (м, 2-ілоксифенілхроман-6-ілокси}піридин-3іл)бутираміду гідрохлорид 3H), 5,12 (д, 1Н, J 8,6Гц), 4,07 (м, 1Н) 3,01-2,92 (м, a) Трет-бутиловий ефір ((S)-1-{6-[2-(31Н), 2,75-2,70 (м, 1Н), 2,19-2,15 (м, 1Н), 2,02-1,97 гідроксифеніл)хроман-6-ілокси]піридин-3(м, 1Н). ілкарбамоїл}-2-метилпропіл)карбамінової кислоти (R)-2-Аміно-N-[6-(2-фенілхроман-6ілокси)піридин-3-іл]пропіонаміду гідрохлорид Трет-бутиловий ефір ((S)-1-{6-[2-(31 гідроксифеніл)хроман-6-ілокси]піридин-3H ЯМР (400МГц, d6-ДМСО) d: 10,78 (ушир.с, ілкарбамоїл}-2-метилпропіл)карбамінової кислоти 1H), 8,37 (д, 1Η, J 2,8Гц), 8,27 (ушир.с, 2Н), 8,03 одержували, використовуючи ту ж саму методику, (дд, 1Н, J 2,8, 8,8Гц), 7,39-7,46 (м, 4Н), 7,34-7,35 яка описана у прикладі 21 а) для трет-бутилового (м, 1Н), 7,00 (д, 1Н, J 8,8Гц), 6,86-6,88 (м, 3H), 5,12 ефіру {(S)-2-метил-1-[6-(2-фенілхроман-6(д, 1Н, J 10,5Гц), 4,04 (м, 1Н), 2,96 (м, 1Н), 2,72 (м, ілокси)піридин-3-ілкарбамоїл]пропіл}карбамінової 1Н), 2,17 (м, 1Н), 2,01 (м, 1Н), 1,47 (д, 3H, J 6,9Гц). кислоти, але замінюючи 5-аміно-2-(2-фенілхроманПриклад 21 6-ілокси)піридин 3-[6-(5-амінопіридин-22-Аміно-3-метил-N-[6-(2-фенілхрсман-6ілокси)хроман-2-іл] фенолом (описаний у прикладі ілокси)піридин-3-іл]бутирамід і його похідні 17). 2-Аміно-3-метил-N-[6-(2-фенілхроман-61 H ЯМР (400МГц, d6-ДМСО) d: 10,11 (ушир.с, ілокси)піридин-3-іл]бутирамід і його похідні 1H), 9,42 (ушир.с, 1H), 8,32 (с, 1H); 8,04 (дд, 1H, J одержували, як описано для [6-(2-фенілхроман-62,2, 8,9Гц), 7,18 (т, 1H, J 8,2Гц), 6,95 (д, 1Н, J ілокси)піридин-3-іл]аміну піперидин-4-карбонової 8,9Гц), 6,90 (д, 1Н, J 8,5Гц), 6,84-6,86 (м, 6Н), 6,71 кислоти у прикладі 19 а) і b), але замінюючи Ν(д, 1Н, J 8,2Гц), 5,03 (д, 1Н, J 9,7Гц), 3,91 (м, 1Н), (трет-бутоксикарбоніл)ізоніпекотинову кислоту (S), 2,94 (м, 1Н), 2,70 (м, 1Н), 2,14 (м, 1Н), 1,95 (м, 1Н), (R) або (S,R)-2-трет-бутоксикарбоніламіно-31,39 (с, 9Н), 0,90 (д, 6Н, J 6,6Гц). метилмасляною кислотою. b) Трет-бутиловий ефір [(S)-2-Метил-1-(6-{2-[3a) Трет-бутиловий ефір {2-метил-1-[6-(2(5-нітропіридин-2-ілокси)феніл]хроман-6фенілхроман-6-ілокси)піридин-3ілокси}піридин-3-ілкарбамоїл)пропіл]карбамінової ілкарбамоїл]пропіл}карбамінової кислоти і його кислоти похідні Трет-бутиловий ефір [(S)-2-Метил-1-(6-{2-[3-(5Трет-бутиловий ефір {(S)-2-метил-1-[6-(2нітропіридин-2-ілокси)феніл]хроман-6фенілхроман-6-ілокси)піридин-3ілокси}піридин-3-ілкарбамоїл)пропіл]карбамінової ілкарбамоїл]пропіл}карбамінової кислоти 1 кислоти одержували як описано для 5-нітро-2-(2H ЯМР (300МГц; d6-ДМСО) d: 10,1 (с, 1Н), 8,32 фенілхроман-6-ілокси)піридину у прикладі 1b). (д, 1Н, J 2,7Гц), 8,04 (дд, 1Н, J 2,7, 8,8Гц), 7,47-7,33 1 H ЯМР (400МГц, d6-ДМСО) d: 10,14 (ушир, с, (м, 5Н), 6,94 (д, 1Н, J 8,8Гц), 6,89-6,84 (м, 3H), 5,11 1Н), 9,05 (д, 1Н, J 2,8Гц), 8,63 (дд, 1Н, 2,8, 9,0Гц), (дд, 1Н, J 2,2, 10,0Гц), 3,91 (т, 1Н, J 6,7Гц), 3,042,91 (м, 1Н), 2,78-2,69 (м, 1Н), 2,21-2,12 (м, 1Н), 8,32 (с, 1Н) ; 8г04 (дд, 1Н, J 2,6, 8,7Гц), 7,52 (т, 1Н, J 8,0Гц), 7,40 (д, 1Н, J 7,6Гц), 7,27-7,31 (м, 2Н), 2,07-1,92 (м, 2Н), 1,39 (с, 9Н), 0,9 (д, 6Н, J 6,7Гц). 7,21 (дд, 1Н, J 0,9, 8,0Гц), 6,94 (д, 1Н, J 8,7Гц), Трет-бутиловий ефір {(R)-2-метил-1-[6-(26,85-6,91 (м, АИ), 5,17 (д, 1Н, J 9,8Гц), 3,91 (м, 1Н), фенілхроман-6-ілокси)піридин-32,94 (м, 1Н), 2,73 (м, 1Н), 2,21 (м, 1Н), 2,02 (м, 1Н), ілкарбамоїл]пропіл}карбамінової кислоти 1 1,39 (с, 9Н), 0,89 (д, 6Н, J 6,6Гц). H ЯМР (400МГц, d6-ДМСО) d: 10,11 (ушир.с, с) (S)-2-Аміно-3-метил-N-(6-{2-[3-(51Н), 8,32 (д, 1Н, J 2,3Гц), 8,04 (дд, 1Н, J 2,6, 8,8Гц), ттропіридин-2-ілокси)феніл]хроман-67,39-7,46 (м, 4Н), 7,32-7,35 (м, 1Н), 6,95 (д, 1Н, J ілокси}піридин-3-іл)бутираміду гідрохлорид 8,8Гц), 6,85~6,87(м, 4Н), 5,11 (д, 1Н, J 8,1Гц), 3,91 (S)-2-Аміно-3-метил-N-(6-{2-[3-(5-нітропіридин(м, 1Н), 2,94 (м, 1Н), 2,72 (м, 1Н), 2,16 (м, 1Н), 1,962-ілокси)феніл]хроман-6-ілокси}піридин-32,03 (м, 2Н), 1,39 (с, 9Н), 0,90 (д, 6Н, J 6,6Гц). іл)бутираміду гідрохлорид одержували таким же b) 2-Аміно-3-метил-N-[6-(2-фенілхроман-6чином, як описано для (S)-2-Аміно-3-метил-N-[6-(2ілокси)піридин-3-іл]бутирамід і його похідні фенілхроман-6-ілокси)-піридин-3-іл]бутираміду у (S)-2-Аміно-3-метил-N-[6-(2-фенілхроман-6прикладі 21 b). ілокси)піридин-3-іл]бутирамід 1 1 H ЯМР (400МГц, d6-ДМСО) d: 10,91 (ушир.с, H ЯМР (300МГц; d6-ДМСО) d: 10,8 (с, 1Н), 8,38 1Н), 9,05 (д, 1H, J 2,7Гц), 8,64 (дд, 1Н, 3,0, 9,1Гц), (д, 1Н, J 2,7Гц), 8,31 (ушир.с, 3H), 8,05 (дд, 1Н, J 8,38 (д, 1Н, J 2,5Гц), 8,32 (ушир.с, 2Н), 8,06 (дд, 2,7, 8,9Гц), 7,47-7,33 (м, 5Н), 7,00 (д, 1Н, J 8,9Гц), 1Н, J 2,5, 8,8Гц), 7,52 (т, 1Н, J 7,9Гц), 7,40 (д, 1H, J 6,98-6,86 (м, 3H), 5,12 (дд, 1Н, J 2,2, 10,0Гц), 3,827,6Гц), 7,27-7,32 (м, 2H), 7,22 (д, 1Н, J 8,1Гц), 7,00 3,78 (м, 1Н), 3,08-2,90 (м, 1Н), 2,78-2,68 (м, 1Н), (д, 1H, J 8,8Гц), 6,86-6,89 (м, 4Η), 5,17 (д, 1Н, J 2,30-2,10 (м, 2Н), 2,07-1,92 (м, 1Н), 1,02-0,98 (м, 8,8Гц), 3,81 (м, 1H), 2,96 (м, 1H), 2,73 (м, 1H), 2,20 6Н). (м, 1H), 2,00 (м, 1H), 0,99-1,01 (м, 6Н). (R)-2-Аміно-3-метил-N-[6-(2-фенілхроман-6Приклад 23 ілокси)піридин-3-іл]бутираміду гідрохлорид 1 [6-(2-фенілхроман-6-ілокси)піридин-3-іл]амід H ЯМР (400МГц, d6-ДМСО) d: 10,97 (ушир, с, піролідин-2-карбонової кислоти і його похідні 1Н), 8,43 (с, 1Н), 8,35 (ушир.с, 2Н), 8,07 (дд, 1H, J [6-(2-фенілхроман-6-ілокси)піридин-3-іл]амід 2,4, 8,7Гц), 7,39-7,46 (м, 4Н), 7,32-7,36 (м, 1Н), 7,00 піролідин-2-карбонової кислоти і його похідні (д, 1H, J 8,7Гц), 6,86-6,89 (м, 3H), 5,12 (д, 1Н, J одержували, як описано для [6-(2-фенілхроман-610,2Гц), 3,83 (м, 1Н), 2,97 (м, 1Н), 2,73 (м, 1Н), ілокси)піридин-3-іл]аміну піперидин-4-карбонової 2,17-2,23 (м, 2Н), 1,99 (м, 1Н), 1,00 (д, 6Н, J 6,5Гц). 1 49 81941 50 кислоти у прикладі 19 а) і b), але замінюючи ΝГідрохлорид [6-(2-фенілхроман-6(трет-бутоксикарбоніл)ізоніпекотинову кислоту 1ілокси)піридин-3-іл]аміду (R)-піролідин-2трет-бутиловим ефіром (S). (R) або (R,S)карбонової кислоти 1 пipoлiдин-1,2-дикapбoнoвoї кислоти і 5-аміно-2-(2Н ЯМР (400МГц, d6-ДМСО) d: 11,11 (с, 1Н), фенілхроман-6-ілокси)піридин відповідними 510,03 (ушир.с, 1Н), 8,71 (ушир.с, 1Н), 8,40 (с, 1Н), амінопіридиновими похідними. 8,06 (д, 1Η, J 8,8Гц), 7,46-7,32 (м, 5Н), 7,00 (д, 1H, а) Трет-бутиловий ефір 2-[6-(2-фенілхроман-6J 8,8Гц), 6,88-6,86 (м, 3H), 5,12 (д, 1Н, 9,9Гц), 4,39 ілокси)піридин-3-ілкарбамоїл]піролідин-1(м, 1Н), 3,27-3,20 (м, 2Н), 2,98 (м, 1Н), 2,73 (м, 1Н), карбонової кислоти і його похідні 2,44 (м, 1Н), 2,17 (м, 1Н), 2,04-1,93 (м, 4Н). Трет-бутиловий ефір 2-[6-(2-фенілхроман-6Гідрохлорид [6-(2-(4-фторфеніл)хроман-6ілокси)піридин-3-ілкарбамоїл]-(S)-піролідин-1ілокси)піридин-3-іл]аміду (S)-піролідин-2карбонової кислоти карбонової кислоти 1 1 Н ЯМР (300МГц, d6-ДМСО) d: 10,1 (с, 1Н), 8,31 H ЯМР (400МГц, d6-ДМСО) d: 10,92 (с, 1Н), (д, 1Η, J 2,4Гц), 8,03 (дд, 1H, J 2,4, 8,8Гц), 7,47-7,33 9,72 (ушир.с, 1Н), 8,70 (ушир.с, 1Н), 8,38 (д, 1Н, J (м, 5H), 6,95 (д, 1Н, J 8,8Гц), 6,87-6,85 (м, 3H), 5,12 2,5Гц), 8,03 (дд, 1Н, J 8,9, 2,5Гц), 7,50 (м, 2Н), 7,23 (дд, 1Н, J 2,1, 9,9Гц), 4,25 (м, 1Н), 3,5-3,3 (м, 2Н), (м, 2Н), 7,00 (д, 1Н, J 8,9Гц), 6,89-6,86 (м, 3H), 5,12 2,97 (м, 1Н), 2,74 (м, 1Н), 2,29-2,11 (м, 2Н), 2,09(д, 1Н, 10,1Гц), 4,35 (м, 1Н), 3,29-3,24 (м, 2Н), 2,97 1,73 (м, 4Н), 1,40 (с, 3H) 1,29 (м, 6Н). (м, 1Н), 2,73 (м, 1Н), 2,42 (м, 1Н), 2,16 (м, 1Н), 2,03Трет-бутиловий ефір 2-[6-(2-фенілхроман-61,91 (м, 4Н). ілокси)піридин-3-ілкарбамоїл]-(R)-піролідин-1Гідрохлорид [6-(2-(3-фторфеніл)хроман-6карбонової кислоти ілокси)піридин-3-іл]аміду (S)-піролідин-21 Н ЯМР (400МГц, d6-ДМСО) d: 10,09 (с, 1Н), карбонової кислоти 1 8,31 (с, 1Η), 8,03 (д, 1Н, J 8,8Гц), 7,46-7,33 (м, 5Н), H ЯМР (400МГц, d6-ДМСО) d: 10,97 (с, 1Н), 6,95 (д, 1Н, J 8,8Гц), 6,88-6,85 (м, 3H), 5,12 (д, 1Н, 9,79 (ушир.с, 1Н), 8,70 (ушир.с, 1Н), 8,38 (д, 1Н, J J 10,0Гц), 4,18 (м, 1Н), 3,42-3,31 (м, 2Н), 2,97 (м, 2,6Гц), 8,04 (дд, 1Н, J 8,9, 2,6Гц), 7,46 (м, 1Η), 7,311Н), 2,75 (м, 1Н), 2,22-2,17 (м, 2Н), 2,01-1,80 (м, 7,27 (м, 2Н), 7,17 (м, 1Н), 7,01 (д, 1Н, J 8,9Гц), 6,904Н), 1,40 (с, 3H) 1,29 (м, 6Н). 6,85 (м, 3H), 5,16 (д, 1Н, 8,4Гц), 4,37 (м, 1Н), 3,29Трет-бутиловий ефір 2-[6-(2-(43,24 (м, 2Н), 2,96 (м, 1Н), 2,72 (м, 1Н), 2,42 (м, 1Н), фтор феніл)хроман-6-ілокси)піридин-32,20 (м, 1Н), 2,03-1,91 (м, 4Н). ілкарбамоїл]-(S)-піролідин-1-карбонової кислоти Гідрохлорид [6-(2-(2-фторфеніл)хроман-61 H ЯМР (400МГц, d6-ДМСО) d: 10,09 (с, 1Н), ілокси)піридин-3-іл] аміду (S)-піролідин-28,31 (д, 1Н, 2,5Гц), 8,03 (дд, 1Н, J 8,8, 2,5Гц), 7,50 карбонової кислоти 1 (м, 2Н), 7,23 (м, 2Н), 6,95 (д, 1Н, J 8,8Гц), 6,88-6,85 Н ЯМР (400МГц, d6-ДМСО) d: 10,90 (с, 1Н), (м, 3H), 5,12 (д, 1Н, J 8,6Гц), 4,26 (м, 1Н), 3,41-3,34 9,70 (ушир.с, 1Н), 8,71 (ушир.с, 1Н), 8,38 (д, 1Н, J (м, 2Н), 2,96 (м, 1Н), 2,73 (м, 1Н), 2,22-2,13 (м, 2Н), 2,7Гц), 8,03 (дд, 1Н, J 8,9, 2,5Гц), 7,55 (м, 1Н), 7,42 1,90-1,80 (м, 4Н), 1,40 (с, 3H) 1,29 (м, 6Н). (м, 1Н), 7,29-7,23 (м, 2Н), 7,01 (д, 1Н, J 8,9Гц), Трет-бутиловий ефір 2-[6-(2-(36,90-6,86 (м, 3H), 5,34 (д, 1Н, 8,6Гц), 4,37 (м, 1Н), фтор феніл)хроман-6-ілокси)піридин-33,29-3,24 (м, 2Н), 2,99 (м, 1Н), 2,76 (м, 1Н), 2,40 (м, ілкарбамоїл]-(S)-піролідин-1-карбонової кислоти 1Н), 2,17 (м, 1Н), 2,07-1,91 (м, 4Н). 1 Н ЯМР (400МГц, d6-ДМСО) d: 10,09 (с, 1Н), Приклад 24 8,31 (с, 1Н), 8,03 (д, 1Η, J 8,7Гц), 7,46 (м, 1H), 7,31(6-{2-[3-(5-нітропіридин-2-ілокси)феніл]хроман7,27 (м, 2Н), 7,17 (м, 1Н), 6,95 (д, 1H, J 8,7Гц), 6,876-ілокси}піридин-3-іл)амід (S)-піролідин-26,85 (м, 3H), 5,16 (д, 1Н, J 8,6Гц), 4,17 (м, 1Η), 3,41карбонової кислоти 3,34 (м, 2Н), 2,95 (м, 1Н), 2,72 (м, 1Н), 2,22-2,18 (м, (6-{2-[3-(5-нітропіридин-2-ілокси)феніл]хроман2Н), 1,95-1,79 (м, 4Н), 1,40 (с, 3H) 1,29 (м, 6Н). 6-ілокси}піридин-3-іл)амід (S)-піролідин-2Трет-бутиловий ефір 2-[6-(2-(2карбонової кислоти одержували, як описано для фтор феніл)хроман-6-ілокси)піридин-3(S)-2-аміно-3-метил-N-(6-{2-[3-(5-нітропіридин-2ілкарбамоїл]-(S)-піролідин-1-карбонової кислоти ілокси-феніл-хроман-6-ілокси}піридин-31 іл)бутираміду у прикладі 22 а)-с), виходячи з 1H ЯМР (400МГц, d6-ДМСО) d: 10,09 (с, 1Н), трет-бутилового ефір у (S)-піролідин-1,28,31 (с, 1Н), 8,03 (д, 1Н, J 8,7Гц), 7,55 (м, 1Н), 7,41 (м, 1Н), 7,29-7,23 (м, 2Н), б,96 (д, 1Н, J 8,7 Гц), дикарбонової кислоти. a) Трет-бутиловий ефір 2-{6-[2-(36,90-6,85 (м, 3H), 5,34 (д, 1Н, J 9,6Гц), 4,17 (м, 1Н), гідроксифеніл)хроман-6-ілокси]піридин-33,44-3,35 (м, 2Н), 3,00 (м, 1Н), 2,75 (м, 1Н), 2,17 (м, ілкарбамоїл}-(S)-піролідин-1-карбонової кислоти 1Н) 2,05 (м, 1Н), 1,90-1,77 (м, 4Н), 1,40 (С, 3H) 1,29 1 (м, 6Н). Н ЯМР (400МГц, d6-ДМСО) d: 10,09 (с, 1Н), b) [6-(2-фенілхроман-6-ілокси)піридин-3-іл]амід 9,43 (с, 1Н), 8,31 (с, 1Н), 8,03 (д, 1Н, J 8,9Гц), 7,18 піролідин-2-карбонової кислоти і його похідні (т, 1Н, J 8,0Гц), 6,95 (д, 1H, J 8,9Гц), 6,87-6,84 (м, Гідрохлорид [6-(2-фенілхроман-65H), 6,71, (д, 1Н, J 7,2Гц), 5,03 (д, 1Н, J 8,2Гц), 4,19 ілокси)піридин-3-іл]аміду (S)-піролідин-2(м, 1Н), 3,42-3,35 (м, 2Н), 2,93 (м, 1Н), 2,69 (м, 1H), карбонової кислоти 2,21-2,12 (м, 2Н), 1,95-1,79 (м, 4Н), 1,40 (с, 3H) 1 1,28 (м, 6Н). H ЯМР (300МГц, d6-ДМСО) d: 10,9 (с, 1Н), 8,38 b) Трет-бутиловий ефір 2-(6-{2-[3-(5(д, 1Η, J 2,7Гц), 8,03 (дд, 1H, J 2,7, 8,8Гц), 7,47-7,33 нітропіридин-2-ілокси)феніл]хроман-6(м, 5H), 7,00 (д, 1Н, J 8,8 Гц), 6,99-6,85 (м, 3H), 5,12 ілокси}піридин-3-ілкарбамоїл)-(S)-піролідин-1(дд, 1Н, 2,2, 10,1Гц), 3,32-3,20 (м, 2Н), 2,97 (м, 1Н), карбонової кислоти 2,74 (м, 1Н), 2,42 (м, 1Н), 2,15 (м, 1Н), 2,08-1,90 (м, 4Н). 51 81941 52 1Η, J 7,7Гц), 6,93 (д, 1Н, J 8,8Гц), 6,84-6,86 (м, 3H), H ЯМР (400МГц, d6-ДМСО) d: 10,09 (с, 1Η), 5,12 (д, 1Н, J 10,0Гц), 3,84 (м, 1Н), 2,97 (м, 1Η), 9,05 (д, 1Н, J 2,9Гц), 8,63 (дд, 1Н, J 8,9, 2,9Гц), 8,31 (с, 1Η), 8,03 (д, 1Η, J 8,8Гц), 7,52 (т, 1H, J 7,8Гц), 2,71 (м, 1H), 2,38-2,42 (м, 2Η), 2,16 (м, 1Н), 1,962,04 (м, 2Η), 1,81 (м, 1Н), 1,40 (с, 9Н), 1,38 (с, 9Н). 7,40 (д, 1H, J 7,8Гц), 7,31-7,27 (м, 2H) 7,21 (дд, 1Н, b) Гідрохлорид (S)-2-аміно-4-[6-(2J 7,8, 1,7Гц), 6,95 (д, 1Н, J 8,9Гц), 6,87-6,85 (м, 3H), фенілхроман-6-ілокси)піридин-3-ілкарбамоїл] 5,17 (д, 1Н, J 9,3Гц), 4,18 (м, 1Н), 3,42-3,34 (м, 2Н), масляної кислоти 2,95 (м, 1Н), 2,73 (м, 1Н), 2,20 (м, 1Н), 1,97 (м, 1Н), 1 1,89-1,79 (м, 4Н), 1,40 (с, 3H) 1,28 (м, 6Н). H ЯМР (400МГц, d6-ДМСО) d: 10,28 (ушир.с, с) Гідрохлорид (6-{2-[3-(5-нітропіридин-21Н), 8,41 (ушир.с, 2Н), 8,33 (д, 1Н, J 2,4Гц), 8,03 ілокси)феніл]хроман-6-ілокси}піридин-3-іл]аміду (дд, 1Н, J 2,4, 8,8Гц), 7,39-7,46 (м, 4Н), 7,32-7,36 (S)-піролідин-2-карбонової кислоти (м, 1Н), 6,94 (д, 1Н, J 8,8Гц), 6,85-6,86 (м, 3H), 5,12 1 (л, 1Н, J 10,1Гц), 3,96 (м, 1Н), 2,97 (м, 1Н), 2,72 (м, Н ЯМР (400МГц, d6-ДМСО) d: 10,89 (с, 1Н), 1Н), 2,50-2,65 (м, 2Н), 2,12-2,19 (м, 3H), 2,00 (м, 9,69 (ушир.с, 1Н), 9,05 (д, 1Н, J 2,8Гц), 8,71 1Н). (ушир.с, 1Н), 8,64 (дд, 1Н, J 9,0, 2,8Гц), 8,37 (д, 1Н, Приклад 27 J 2,7Гц), 8,04 (дд, 1H, J 8,8, 2,7Гц), 7,52 (т, 1Η, J (S)-4-аміно-4-[6-(2-фенілхроман-67,9Гц), 7,40 (д, 1Н, J 7,9Гц), 7,31-7,27 (м, 2Η), 7,21 ілокси)піридин-3-ілкарбамоїл]масляна кислота (д, 1Н, J 8,8Гц), 7,00 (д, 1Н, J 9,0Гц), 6,88-6,83 (м, (S)-4-аміно-4-[6-(2-фенілхроман-63H), 5,17 (д, 1H, 8,4Гц), 4,35 (м, 1Н), 3,29-3,24 (м, ілокси)піридин-3-ілкарбамоїл]масляну кислоту 2Н), 2,95 (м, 1Н), 2,73 (м, 1H), 2,40 (м, 1Н), 2,22 (м, одержували, як описано для [6-(2-фенілхроман-61Н), 2,04-1,91 (м, 4Н). ілокси)піридин-3-іл]аміну піперидин-4-карбонової Приклад 25 кислоти у прикладі 19 а) і b), але замінюючи N(S)-2-Аміно-3-гідрокси-N-[6-(2-фенілхроман-6(трет-бутоксикарбоніл)ізоніпекотинову кислоту 5ілокси)піридин-3-іл]пропіонаміду гідрохлорид трет-бутиловим ефіром (S)-2(S)-2-Аміно-3-гідрокси-N-[6-(2-фенілхроман-6карбоксіамінопентандикарбонової кислоти. ілокси)піридин-3-іл]пропіонаміду гідрохлорид a) Трет-бутиловий ефір (S)-4-третодержували, як описано для [6-(2-фенілхроман-6бутоксикарбоніламіно-4-[6-(2-фенілхроман-6ілокси)піридин-3-іл]аміну піперидин-4-карбонової ілокси)піридин-3-ілкарбамоїл]масляної кислоти кислоти у прикладі 19 а) і b), але замінюючи N1 (трет-бутоксикарбоніл)ізоніпекотинову кислоту (S)Н ЯМР (400МГц, d6-ДМСО) d: 10,09 (ушир.с, 2-трет-бутоксикарбоніламіно-31Н), 8,32 (д, 1Η, J 2,4Гц), 8,04 (дд, 1H, J 2,4, 8,8Гц), гідроксипропіоновою кислотою. 7,39-7,47 (м, 4Н), 7,32-7,35 (м, 1Η), 7,06 (ушир.д, а) Трет-бутиловий ефір {(S)-2-гідрокси-1-[6-(21Н, J 7,7Гц), 6,94 (д, 1H, J 8,8Гц), 6,85-6,86 (м, 3H), фенілхроман-6-ілокси)піридин-35,12 (д, 1H, J 10,0Гц), 4,07 (м, 1H), 2,95 (м, 1H), ілкарбамоїл]етил}карбонової кислоти 2,72 (м, 1H), 2,26-2,27 (м, 2Н), 2,17 (м, 1H), 1,921 2,04 (м, 2Н), 1,75 (м, 1H), 1,38 (ушир.с, 18Н), Н ЯМР (400МГц, d6-ДМСО) d: 10,07 (ушир.с, b) Гідрохлорид (S)-4-аміно-4-[6-(21Н), 8,33 (д, 1Н, J 2,4Гц), 8,05 (дд, 1Н, J 2,4, 9,0Гц), 7,39-7,47 (м, 5Н), 7,32-7,36 (м, 1Н), 6,94 (д, 1Н, J фенілхроман-6-ілокси)піридин-3ілкарбамоїл]масляної кислоти 9,0Гц), 6,85-6,86 (м, 2Н), 6,77 (ушир.д, 1Н, J 7,3Гц), 1 5,12 (д, 1Н, J 10,0Гц), 4,95 (ушир.с, 1Н), 4,14 (м, H ЯМР (400МГц, MeOD) d: 8,54 (д, 1H, J 1Н), 3,63 (ушир.с, 2Н), 2,95 (м, 1Н), 2,70 (м, 1Н), 2,8Гц), 8,15 (дд, 1H, J 2,8, 9,0Гц), 7,43-7,45 (м, 2Н), 2,18 (м, 1Н), 2,01 (м, 1Н), 1,39 (с, 9Н). 7,36-7,40 (м, 2Н), 7,29-7,33 (м, 1H), 7,01 (д, 1H, J b) (S)-2-Аміно-3-гідрокси-N-[6-(2-фенілхроман9,0Гц), 6,93-6,94 (м, 3H), 5,11 (д, 1H, J 10,0Гц), 4,11 6-ілокси)піридин-3-іл]пропіонаміду гідрохлорид (м, 1H), 3,01 (м, 1H), 2,79 (м, 1H), 2,56 (м, 2Н), 2,221 2,30 (м, 3H), 2,03-2,09 (м, 1H). H ЯМР (400МГц, CD3OD) d: 8,63 (д, 1Н, J Приклад 28 2,4Гц), 8,22 (дд, 1Н, J 2,4, 9,1Гц), 7,36-7,45 (м, 4Н), (S)-3-Аміно-N-[6-(2-фенілхроман-67,29-7,33 (м, 1Н), 7,05 (д, 1Н, J 9,1Гц), 6,94-6,97 (м, ілокси)піридин-3-іл]бурштинової кислоти моноамід 3H), 5,11 (д, 1Н, J 10,0Гц), 4,15 (м, 1Н), 3,97-4,06 (S)-3-Аміно-N-[6-(2-фенілхроман-6(м, 2Н), 3,03 (м, 1Н), 2,79 (м, 1Н), 2,24 (м, 1Н), 2,07 ілокси)піридин-3-іл]бурштинової кислоти моноамід (м, 1Н). одержували, як описано для [6-(2-фенілхроман-6Приклад 26 ілокси)піридин-3-іл]аміну піперидин-4-карбонової (S)-2-аміно-4-[6-(2-фенілхроман-6кислоти у прикладі 19 а) і b), але замінюючи Nілокси)піридин-3-ілкарбамоїл]масляна кислота (трет-бутоксикарбоніл)-ізоніпекотинову кислоту 4(S)-2-аміно-4-[6-(2-фенілхроман-6трет-бутиловим ефіром (S)-2-третілокси)піридин-3-ілкарбамоїл]масляну кислоту бутоксикарбоніламінобурштинової кислоти. одержували, як описано для [6-(2-фенілхроман-6a) Трет-бутиловий ефір (S)-3-третілокси)піридин-3-іл]аміну піперидин-4-карбонової бутоксикарбоніламіно-N-[6-(2-фенілхроман-6кислоти у прикладі 19 а) і b), але замінюючи Nілокси)піридин-3-іл]бурштинової кислоти (трет-бутоксикарбоніл)ізоніпекотинову кислоту 1моноаміду трет-бутиловим ефіром (S)-21 карбоксіамінопентандикарбонової кислоти. Н-ЯНР (400МГц; d6-ДМСО) d: 10,12 (с, 1Н), a) Трет-бутиловий ефір (S)-2-трет8,31 (д, 1Η, J 2,4Гц), 8,02 (дд, 1H, J 8,9, 2,4Гц), бутоксикарбоніламіно-4-[6-(2-фенілхроман-67,46-7,39 (м, 5H), 7,34 (д, 1Н, J 7,1Гц), 6,94 (д, 1H, ілокси)піридин-3-ілкарбамоїл]масляної кислоти J 8,9Гц), 6,87-6,84 (м, 3H), 5,12 (д, 1Η, J 10,0Гц), 1 4,44 (м, 1H), 2,97 (м, 1Н), 2,74-2,65 (м, 2Η), 2,50 (м, Н ЯМР (400МГц, d6-ДМСО) d: 10,01 (ушир.с, 1Η), 2,16 (м, 1H), 2,00 (м, 1Η), 1,38 (с, 18Η). 1Н), 8,28 (дг 1Η, J 2,4Гц), 8,01 (дд, 1H, J 2,4, 8,8Гц), 7,39-7,46 (м, 4H), 7,32-7,35 (м, 1H), 7,14 (ушир.д, 1 53 81941 54 b) Гідрохлорид (S)-3-аміно-N-[6-(2температури. Суміш фільтрували і випарювали. фенілхроман-6-ілокси)піридин-3-іл]бурштинової Залишок розчиняли в етилацетаті і промивали кислоти моноаміду водою. Розчинник сушили Na2SO4 і випарювали з 1 одержанням метилового ефіру 4-(4H ЯМР (400МГц; d6-ДМСО) d: 10,83 (с, 1Н), метилпіперазин-1-ілметил)-бензойної кислоти. 8,41 (ушир.с, 3H), 8,36 (д, 1Н, J 2,4Гц), 8,03 (дд, 1 1Н, J 8,9, 2,4Гц), 7,47-7,32 (м, 5Н), 7,00 (д, 1Н, J H ЯМР (300МГц, d6-ДМСО) d: 2,18 (с, 3H), 2,37 8,9Гц), 6,88-6,85 (м, 3H), 5,12 (д, 1Н, J 10,1Гц), 4,25 (ушир.с, 8Н), 3,53 (с, 2Н), 3,84 (с, 3H), 7,44 (д, 2Н, J (м, 1Н), 3,03-2,87 (м, 3H), 2,73 (м, 1Н), 2,17 (м, 1Н), 8,1Гц), 7,91 (д, 2Н, J 8,2Гц). 2,00 (м, 1Н). НСІ-сіль метилового ефіру 4-(4Приклад 29 метилпіперазин-1-ілметил)бензойної кислоти (S)-2-Аміно-N-[6-(2-фенілхроман-6розчиняли в етилацетаті і додавали 1Μ розчин ілокси)піридин-3-іл]бурштинової кислоти моноамід HCI у діетиловому ефірі. Суміш перемішували (S)-2-Аміно-N-[6-(2-фенілхроман-6протягом 1 години, і осаджену НСІ-сіль ілокси)піридин-3-іл]бурштинової кислоти моноамід відфільтровували і промивали діетиловим ефіром. 1 одержували, як описано для [6-(2-фенілхроман-6H ЯМР (300МГц, d6-ДМСО) d: 2,78 (с, 3H), ілокси)піридин-3-іл]аміну піперидин-4-карбонової 3,10-3,75 (м, 8Н), 3,87 (С, 3H), 4,35 (ушир.с, 2Н) кислоти у прикладі 19 а) і b), але замінюючи N7,77 (д, 2Н, J 7,5Гц), 8,00 (д, 2Н, J 8,1Гц). (трет-бутоксикарбоніл)ізоніпекотинову кислоту 1c) 4-(4-Метилпіперазин-1-ілметил)бензойна трет-бутиловим ефіром (S)-2-треткислота бутоксикарбоніламінобурштинової кислоти. НСІ-сіль метилового ефіру 4-(4а) трет-Бутиловий ефір (S)-2-третметилпіперазин-1-ілметил)бензойної кислоти Бутоксикарбоніламіно-N-[6-(2-фенілхроман-6(1,25г) розчиняли у метанольному розчині ілокси)піридин-3-іл]бурштинової кислоти гідроксиду калію (0,93г КОН у 15мл метанолу). моноаміду Додавали воду (0,75мл) і суміш нагрівали зі 1 H ЯМР (400МГц; d6-ДМСО) d: 10,10 (с, 1Н), зворотним холодильником протягом 1 години. 8,29 (с, 1Н), 8,15 (д, 1Н, J 8,9Гц), 7,47-7,39 (м, 5Н), Реакційній суміші давали охолонути до кімнатної 7,34 (д, 1Н, J 8,4Гц), 6,94 (д, 1Н, J 8,9Гц), 6,86-6,84 температури і рН доводили до 6 2Μ HCI. (м, 3H), 5,12 (д, 1H, J 10,0Гц), 4,29 (м, 1Н), 2,97 (м, Розчинник випарювали, і залишок сушили під 1Н), 2,82-2,76 (м, 2Н), 2,61 (м, 1Н), 2,17 (м, 1Н), вакуумом. Залишок містив 4-(4-метилпіперазин-12,01 (м, 1Н), 1,38 (с, 12Н), 1,36 (с, 6Н). ілметил)бензойну кислоту і неорганічні солі. Його b) Гідрохлорид (S)-3-аміно-N-[6-(2далі використовували без очищення, і вихід фенілхроман-6-ілокси)піридин-3-іл]бурштинової сполуки, названої у заголовку, становив 100%. 1 кислоти моноаміду H ЯМР (400МГц, d6-ДМСО) d: 2,27 (с, 3H), 2,44 1 H ЯМР (400МГц; d6-ДМСО) d: 13,7 (ушир.с, (ушир.с, 2Н), 3,18-3,95 (м, 8Н), 7,41 (д, 2Н, J 8,0Гц), 1H), 10,52 (с, 1Н), 8,36-8,32 (м, 4Н), 8,01 (д, 1Н, J 7,89 (д, 2Н, J 8,1Гц). 8,7Гц), 7,46-7,32 (м, 5Н), 6,96 (д, 1H, J 8,7Гц), 6,87d) N-{6-[2-(4-фторфеніл)хроман-66,85 (м, 3H), 5,12 (д, 1H, J 10,0Гц), 4,27 (м, 1H), ілокси]піридин-3-іл}-4-(4-метилпіперазин-13,07-2,93 (м, 3H), 2,72 (м, 1H), 2,18 (м, 1H), 2,00 (м, ілметил)бензамід 1H). 4-(4-Метилпіперазин-1-ілметил)бензойну Приклад 30 кислоту (приблизно 0,19г), 6-[2-(4N-{6-[2-(4-фторфеніл)фенілхроман-6фтор феніл)хроман-6-ілокси]піридин-3-іламін ілокси]піридин-3-іл}-4-(4-метилпіперазин-1(0,18г) і 1-(3-диметиламінопропіл)-3ілметил)бензамід етилкарбодііміду гідрохлорид (0,12г) додавали у a) Метиловий ефір 4-хлорметилбензойної дихлорметан (0,12мл). Суміш перемішували при кислоти кімнатній температурі і через 4 години додавали 4-хлорметилбензойну кислоту (2,0г) розчиняли додатково 4-(4-метилптеразин-1-ілметил)бензойну у 300мл метанолу і додавали 0,5мл кислоту (приблизно 0,11г) і 1-(3концентрованої сірчаної кислоти. Суміш диметиламінопропіл)-3-етилкарбодііміду перемішували при кімнатній температурі протягом гідрохлорид (0,046г). Перемішування восьми днів. Метанол випарювали і залишок продовжували протягом ще 3 годин. Додавали розчиняли в етилацетаті. Органічний шар воду і дихлорметан і органічну і водну фазу промивали насиченим розчином NaHCO3, сушили розділяли. Водну фазу екстрагували Na2SO4 і випарювали з одержанням метилового дихлорметаном. Продукт очищали колонковою ефіру 4-хлорметилбензойної кислоти. хроматографією, використовуючи дихлорметан1 метанол (9:1) як елюент з одержанням N-{6-[2-(4H ЯМР (300МГц, d6-ДМСО) d: 3,86 (с, 3H), 4,84 фтор феніл)хроман-6-ілокси]піридин-3-іл}-4-(4(с, 2Н), 7,59 (д, 2Н, J 8,2Гц), 7,97 (д, 2Н, J 8,2Гц). метилпіперазин-1-ілметил)бензаміду. b) Метиловий ефір 4-(4-метилпіперазин-11 ілметил)бензойної кислоти H ЯМР (300МГц, d6-ДМСО) d: 1,90-2,08 (м, Метиловий ефір 4-хлорметилбенюйної 1Н), 2,11-2/21 (м, 1Н), 2,18 (с, 3H), 2,38 (ушир.с, кислоти (1,66г), 1-метилпіперазин (1,8г) і йодид 8Н), 2,68-2,79 (м, 1Н), 2,91-3,05 (м, 1Н), 3,54 (с, натрію (0,67г) додавали в ацетон (50мл). 2Н), 5,13 (дд, 1Н, J 2,0, 10,1Гц), б78б (д, 2Н, J Реакційну суміш перемішували при 60°С протягом 1,2Гц), 6,90 (с, 1Н), 6,98 (д, 1Н, J 8,8Гц), 7,19-7,27 9 годин. Додавали ще 1-метилпіперазину (0,9г) і (м, 2Н), 7,43-7,54 (м, 4Н), 7,92 (д, 2Н, J 8,2Гц), 8,18 йодиду калію (0,34г) і, після перемішування (дд, 1Н, J 2,7, 8,9Гц), 8,48 (д, 1Н, J 2,7Гц), 10,31 (с, протягом ще 1,5 години при 60°С, реакційній 1Н), суміші давали охолонути до кімнатної Приклад 31 55 81941 56 N-[6-(2-Фенілхроман-6-ілокси)піридин-32-хлор-N-{6-[2-(2,3-дифторфеніл)хроман-6іл]бурштинової кислоти моно амід ілокси]піридин-3-іл}ацетамід, 6-(2-Фенілхроман-6-ілокси)піридин-3-іламін 2-хлор-N-{6-[2-(2,4-дифторфеніл)хроман-6(приклад 35) (270мг) і бурштинову кислоту (151мг) ілокси]піридин-3-іл}ацетамід, розчиняли у дихлорметані (16мл). У реакційну 2-хлор-N-{6-[2-(2,5-дифторфеніл)хроман-6суміш додавали 1-(3-диметиламінопропіл)-3ілокси]піридин-3-іл}ацетамід, етилкарбодііміду гідрохлорид (245мг) і її 2-хлор-N-{6-[2-(2,6-дифторфеніл)хроман-6перемішували при кімнатній температурі протягом ілокси]піридин-3-іл}ацетамід, 3 годин. Додавали воду і суміш фільтрували. Осад 2-хлор-N-{6-[2-(3,4-дифторфеніл)хроман-6збирали і обробляли метанолом і знову ілокси]піридин-3-іл}ацетамід, фільтрували. Ме танольний фільтрат випарювали 2-хлор-N-{6-[2-(3,5-дифторфеніл)хроман-6досуха з одержанням N-[6-(2-Фенілхроман-6ілокси]піридин-3-іл}ацетамід, ілокси)піридин-3-іл]бурштинової кислоти 2-хлор-N-{6-[2-(2-трифторметилфеніл)хроманмоноаміду. 6-ілокси]піридин-3-іл} ацетамід, 1 2-хлор-N-{6-[2-(4-трифторметилфеніл)хроманH ЯМР (400МГц, d6-ДМСО) d: 12,0 (ушир.с, 6-ілокси]піридин-3-іл} ацетамід, 1Н), 10,08 (с, 1Н), 8,29 (д, 1Н, J 2,4Гц), 8,01 (дд, 2-хлор-N-{6-[2-(3-хлор-4-фторфеніл)хроман-61Н, J 8,8, 2,4Гц), 7,46-7,32 (м, 5Н), 6,93 (д, 1Н, J 8,8Гц), 6,86-6,84 (м, 3H), 5,11 (д, 1Н, J 8,6Гц), 2,96 ілокси]піридин-3-іл}ацетамід, 2-хлор-N-{6-[2-(2-хлорфеніл)хроман-6(м, 1Н), 2,70 (м, 1H), 2,56-2,52 (м, 4Н), 2,16 (м, 1Н), ілокси]піридин-3-іл}ацетамід, 2,00 (м, 1Н). 2-хлор-N-{6-[2-(3-хлорфеніл)хроман-6Приклад 32 ілокси]піридин-3-іл}ацетамід, 2-Хлор-N-[6-(2-фенілхроман-6-ілокси)піридин3-іл]ацетамід 2-хлор-N-{6-[2-(2,4-дихлорфеніл)хроман-6ілокси]піридин-3-іл}ацетамід, До охолодженого розчину 5-аміно-2-(22-хлор-N-{6-[2-(3-бромфеніл)хроман-6фенілхроман-6-ілокси)-піридину (500мг) у 7,5мл ілокси]піридин-3-іл}ацетамід, дихлорметану додавали триетиламін (437мкл) і 2-хлор-N-{6-[2-(4-етилфеніл)хроман-6хлорацетилхлорид (163мкл). Реакційну суміш перемішували при кімнатній температурі протягом ілокси]піридин-3-іл}ацетамід, 2-хлор-N-{6-[2-(3-метоксифеніл)хроман-63 годин і гасили додаванням води. Водний шар ілокси]піридин-3-іл}ацетамід, підкислювали і екстрагували дихлорметаном. 2-хлор-N-[6-(3-метил-2-фенілхроман-6Об'єднані органічні шари сушили Na2SO4 і ілокси)піридин-3-іл]ацетамід, випарювали. 2-Хлор-N-[6-(2-фенілхроман-6ілокси)піридин-3-іл]-ацетамід очищали колонковою 2-хлор-N-[6-(2-фенілхроман-7-ілокси)піридин3-іл]ацетамід, хроматографією, використовуючи 10% метанол у 2-хлор-N-[6-(4-оксо-2-фенілхроман-6метиленхлориді як елюент. 1 ілокси]піридин-3-іл]ацетамід, H ЯМР (400МГц, d6-ДМСО) d: 10,4 (с, 1Н), 8,30 2-хлор-N-[6-(4-оксо-2-фенілхроман-7(д, 1Η, J 2,7Гц), 8,03 (дд, 1Н, J 2,7, 8,8Гц), 7,47-7,32 ілокси]піридин-3-іл]ацетамід, (м, 5H), 6,97 (д, 1Н, J 8,8Гц), 6,88-6,85 (м, 3H), 5,12 2-хлор-N-[6-(3-метил-4-оксо-2-фенілхроман-6(дд, 1Н, J 2,10, 10,1Гц), 4,27 (с, 2Н), 2,97-2,92 (ω, ілокси]піридин-3-іл]ацетамід, 1Η), 2,76-2,70 (м, 1Н), 2,19-2,14 (м, 1Н), 2,02-1,97 2-хлор-N-[6-(2-феніл-2,3(м, 1Н). дигідробензо[1,4]діоксин-6-ілокси]піридин-32-Хлор-N-{6-[2-(4-фторфеніл)хроман-6іл]ацетамід, ілокси)піридин-3-іл}-ацетамід одержували, 2-хлор-N-[6-(6-феніл-5,6,7,8використовуючи ту ж саму методику, яка описана тетрагідронафталін-2-ілокси)піридин-3-іл]ацетамід, вище для 2-хлор-Ν-[6-(2-фенілхроман-62-хлор-N-[6-(5-оксо-6-феніл-5,6,7,8ілокси)піридин-3-іл]ацетаміду, але замінюючи 5тетрагідронафталін-2-ілокси)піридин-3-іл]ацетамід, аміно-2-(2-фенілхроман-6-ілокси)-піридин на 52-хлор-N-[6-(2-феніл-2,3аміно-2-(2-(4-фторфенілхроман-6-ілокси)піридин. 1 дигідробензо[1,4]оксатіїн-6-ілокси)піридин-3H ЯМР (400МГц; d6-ДМСО) d: 10,4 (с, 1H), 8,29 іл]ацетамід, (д, 1Н, J 2,7Гц), 8,02 (дд, 1Н, J 2,7, 8,8Гц), 7,52-7,48 2-хлор-N-{6-[3-(3-фторфеніл)хроман-7(м, 2Н), 7,25-7,20 (м, 2Н), 6,97 (д, 1Н, J 8,8Гц), ілокси]піридин-3-іл}ацетамід, 6,88-6,84 (м, 3H), 5,12 (дд, 1Н, J 1,90, 10,2Гц), 4,27 2-хлор-N-[6-(3-фенілхроман-7-ілокси)піридин(с, 2Н), 2,98-2,92 (м, 1Н), 2,76-2,69 (м, 1Η), 2,183-іл]ацетамід, 2,13 (м, 1Η), 2,01-1,96 (м, 1H). 2-хлор-N-[6-(4-оксо-2-фенілхромен-6Подібним чином, використовуючи ту ж саму ілокси)піридин-3-іл]ацетамід, методику, яка описана вище для 2-хлор-N-[6-(22-хлор-N-[6-(2-феніліндан-5-ілокси)піридин-3фенілхроман-6-ілокси)піридин-3-іл]ацетаміду, але іл]ацетамід, відповідно. замінюючи 5-аміно-2-(2-фенілхроман-6Приклад 33 ілокси)піридин відповідним піридин-3-іламіновим 2-Аміно-N-[6-(2-фенілхроман-6-ілокси)піридинпохідним, з перерахованих у прикладі 18, можна 3-іл]ацетамід одержати: а) 2-Азидо-N-[6-(2-фенілхроман-62-хлор-N-{6-[2-(3-фторфеніл)хроман-6ілокси)піридин-3-іл]ацетамід ілокси]піридин-3-іл}ацетамід, Змішували 2-хлор-N-[6-(2-фенілхроман-62-хлор-N-{6-[2-(2-фторфеніл)хроман-6ілокси)піридин-3-іл]ацетамід (500мг), азид натрію ілокси]піридин-3-іл}ацетамід, (445мг) і ацетонітрил. Реакційну суміш нагрівали зі 57 81941 58 зворотним холодильником протягом 3 годин. Після 2-(4-Метилпіперазин-1-іл)-N-[6-(2охолоджування до кімнатної температури фенілхроман-6-ілокси)піридин-3-іл]ацетамід реакційну суміш фільтр ували, і фільтрат До розчину 2-хлор-N-[6-(2-фенілхроман-6випарювали досуха. ілокси)піридин-3-іл]ацетаміду (200мг) в 1 ацетонітрилі додавали карбонат калію (133мг) і 1H ЯМР (400МГц; d6-ДМСО) d: 10,3 (с, 1Н), 8,29 метилпіперазин (62мкл). Суміш перемішували при (д, 1Н, J 2,7Гц), 8,03 (дд, 1H, J 2,7, 8,8Гц), 7,47-7,33 кімнатній температурі. До реакційної суміші (м, 5H), 6,96 (д, 1Н, J 8,8Гц), 6,88-6,85 (м, 3H), 5,12 (дд, 1Н, J 2,20, 10,1Гц), 4,07 (с, 2Н), 3,00-2,92 (м, додавали воду. Розчин екстрагували дихлорметаном. Органічний екстракт сушили і 1Н), 2,76-2,70 (м, 1Н), 2,19-2,14 (м, 1Н), 2,02-1,97 випарювали. N-[6-(2-фенілхроман-6(м, 1Н). ілокси)піридин-3-іл]-2-(4-метилпіперазин-1Подібним чином одержували: іл)ацетамід виділяли у вигляді гідрохлориду. 2-азидо-N-{6-(2-(4-фторфеніл)хроман-61 ілокси)піридин-3-іл}ацетамід H ЯМР (300МГц; d6-ДМСО) d: 10,7 (с, 1H), 8,38 1 (д, 1Η, J 2,7Гц), 8,04 (дд, 1Н, J 2,7, 8,8Гц), 7,47-7,31 Н-ЯМР (400МГц; d6-ДМСО) d: 10,3 (с, 1HJ, (м, 5Н), 6,99 (д, 1Н, J 8,8Гц), 6,88-6,85 (м, 3H), 5,12 8,30 (д, 1Η, J 2,7Гц), 8,03 (дд, 1H, J 2,7, 8,8Гц), (дд, 1Н, J 2,0, 10,0Гц), 3,95 (с, 2Н), 3,68-3,42 (м, 7,53-7,47 (м, 2H), 7,26-7,19 (м, 2Н), 6,96 (д, 1Η, J 4Н), 3,42-3,18 (м, 4Н), 2,97-2,91 (м, 1Н), 2,81 (с, 8,8Гц), 6,88-6,84 (м, 3H), 5,12 (дд, 1Н, J 2,1, 3H), 2,80-2,73 (м, 1Н), 2,25-2,10 (м, 1Н), 2,10-1,96 10,1Гц), 4,07 (с, 2Н), 3,00-2,92 (м, 1Н), 2,76-2,70 (м, (м, 1Н). 1Н), 2,19-2,14 (м, 1Н), 2,02-1,97 (м, 1Н). Приклад 36 b) 2-Аміно-Ν-[6-(2-фенілхроман-6N-[6-(2-Фенілхроман-6-ілокси)піридин-3-іл]-2ілокси)піридин-3-іл]ацетамід піперазин-1-ілацетамід 2-Азидо-N-[6-(2-фенілхроман-6-ілокси)піридинДо розчину 2-хлор-N-[6-(2-фенілхроман-63-іл]ацетамід (500мг) розчиняли у метанолі ілокси)піридин-3-іл]ацетаміду (200мг) в (100мл) і додавали 10% паладію на вугіллі (125мг). ацетонітрилі додавали карбонат калію (133мг) і 1Вихідну речовину гідр ували протягом 5 годин при метилпіперазин (262мкл). Суміш перемішували кімнатній температурі з одержанням 2-аміно-N-[6при кімнатній температурі. До реакційної суміші (2-фенілхроман-6-ілокси)піридин-3-іл]ацетаміду. додавали воду. Розчин екстрагували Продукт виділяли у вигляді гідрохлориду. 1 дихлорметаном. Органічний екстракт сушили і H ЯМР (400МГц; d6-ДМСО) d: 10,7 (с, 1Н), 8,35 випарювали. N-[6-(2-Фенілхроман-6(д, 1Н, J 2,6Гц), 8,17 (ушир.с, 3H), 8,01 (дд, 1Н, J ілокси)піридин-3-іл]-2-піперазин-1-ілацетамід 2,6, 8,9Гц), 7,47-7,32 (м, 5Н), 7,00 (д, 1Н, J 8,9Гц), виділяли у вигляді дигідрохлориду. 6,89-6,86 (м, 3H), 5,12 (дд, 1Н, J 1,90, 10,1Гц), 3,79 1 Η-ΗΜΡ (400МГц; d6-ДМСО) d: 10,7 (с, 1Н), (кв., 2Н, J 5,6Гц), 3,01-2,92 (м, 1Н), 2,74-2,70 (м, 8,38 (д, 1Н, J 2,7Гц), 8,03 (дд, 1Н, J 2,7, 8,9Гц), 1Н), 2,20-2,15 (м, 1Н), 2,05-1,94 (м, 1Н). 7,47-7,33 (м, 5Н), 6,99 (д, 1Н, J 8,9Гц), 6,88-6,85 (м, Подібним чином одержували: 3H), 5,12 (ДД, 1Н, J 2,1, 10,1Гц), 3,5-3,2 (м, 10H), 2-Аміно-N-{6-[2-(4-фторфеніл)хроман-6ілокси]піридин-3-іл}-ацетамід 2,97-2,92 (м, 1Н), 2,74-2,70 (м, 1Н), 2,20-2,15 (м, 1 1Н), 2,03-1,97 (м, 1Н). Н-ЯМР (400МГц; d6-ДМСО) d: 10,8 (с, 1Н), Приклад 37 8,36 (д, 1Н, J 2,7Гц), 8,21 (ушир.с, 3H), 8,02 (дд, 2-Морфолін-4-іл-N-[6-(2-фенілхроман-61Н, J 2,1, 8,9Гц), 7,52-7,47 (м, 2Н), 7,26-7,19 (м, ілокси)піридин-3-іл]ацетамід 2Н), 6,99 (д, 1Н, J 8,9Гц), 6,88-6,85 (м, 3H), 5,14 До розчину 2-хлор-N-[6-(2-фенілхроман-6(дд, 1Н, J 1,90, 10,0Гц), 3,79 (кв., 2Н, J 5,7Гц), 2,97ілокси)піридин-3-іл]ацетаміду (200мг) в 2,91 (м, 1Н), 2,74-2,69 (м, 1Н), 2,19-2,12 (м, 1Н), ацетонітрилі додавали карбонат калію (133 г) і 2,01-1,91 (м, 1Н). морфолін (53мг). Суміш перемішували при Приклад 34 кімнатній температурі. До реакційної суміші N-[6-(2-фенілхроман-6-ілокси)піридин-3-іл]-2додавали воду. Розчин екстрагували (4-фенілпіперазин-1-іл)ацетамід етилацетатом. Органічний екстракт сушили і До розчину 2-хлор-N-[6-(2-фенілхроман-6випарювали. 2-Морфолін-4-іл-N-[6-(2ілокси)піридин-3-іл]ацетаміду (500мг) в фенілхроман-6-ілокси)піридин-3-іл]-ацетамід ацетонітрилі додавали карбонат калію (333мг) і 1виділяли у вигляді гідрохлориду. фенілпіперазин (213мкл). Суміш перемішували 1 при кімнатній температурі. До реакційної суміші H ЯМР (400МГц; d6-ДМСО) d: 11,1 (с, 1Н), 8,38 (д, 1Η, J 2,7 Гц), 8,03 (дд, 1H, J 2,7, 8,9Гц), 7,47додавали воду. Розчин екстрагували 7,32 (м, 5H), 7,01 (д, 1Н, J 8,9Гц), 6,89-6,85 (м, 3H), дихлорметаном. Органічний екстракт сушили і 5,12 (дд, 1Н, J 1,9, 10,0Гц), 4,23 (с, 2Н), 4,02-3,76 випарювали. Продукт очищали колонковою (м, 4Н), 3,55-3,20 (м, 4Н), 3,00-2,92 (м, 1Н), 2,75хроматографією, використовуючи 10% метанол у 2,69 (м, 1Н), 2,19-2,15 (м, 1Н), 2,03-1,98 (м, 1Н). дихлорметані як елюент. N-[6-(2-фенілхроман-6Приклад 38 ілокси)піридин-3-іл]-2-(4-фенілпіперазин-1N-[6-(2-Фенілхроман-6-ілокси)піридин-3-іл]-2іл)ацетамід виділяли у вигляді дигідрохлориду. 1 тіоморфолін-4-ілацетамід Н ЯМР (300МГц, d4-МеОН) d: 8,70 (ушир.с, До розчину 2-хлор-N-[6-(2-фенілхроман-61Н), 8,25 (дд, 1H, J 2,1, 9,1Гц), 7,46-7,28 (м, 7H), ілокси)піридин-3-іл]ацетаміду (200мг) в 7,09-6,96 (м, 7Н), 5,12 (дд, 1Н, J 2,3, 9,8Гц), 4,32 (с, ацетонітрилі додавали карбонат калію (133мг) і 2Н), 3,73-3,40 (м, 8Н), 3,10-2,95 (м, 1Н), 2,90-2,76 тіоморфолін (63мг). Суміш перемішували при (м, 1Н), 2,33-2,20 (м, 1Н), 2,13-2,00 (м, 1Н). кімнатній температурі. До реакційної суміші Приклад 35. додавали воду. Розчин екстрагували 59 81941 60 етилацетатом. Органічний екстракт сушили і 3,41 (м, 2Н), 3,15-2,90 (м, 3H), 2,79-2,67 (м, 1Н), випарювали. N-[6-(2-Фенілхроман-62,24-2,12 (м, 1Н), 2,07-1,92 (м, 1Н), 1,85-1,33 (м, ілокси)пірицин-3-іл]-2-тіоморфолін-4-ілацетамід 6Н). виділяли у вигляді гідрохлориду. Приклад 42 1 2-(4-Гідроксипіперидин-1-іл)-N-[6-(2H ЯМР (400МГц; d6-ДМСО) d: 11,0 (с, 1Н), 8,37 фенілхроман-6-ілокси)піридин-3-іл]ацетамід (д, 1Н, J 2,6 Гц), 8,02 (дд, 1Н, J 2,6, 8,9Гц), 7,46До розчину 2-хлор-N-[6-(2-фенілхроман-67,32 (м, 5Н), 7,01 (д, 1Н, J 8,9Гц), 6,89-6,86 (м, 3H), 5,12 (дд, 1Н, J 1,9, 10,1Гц), 4,20 (ушир.с, 2Н), 3,85ілокси)піридин-3-іл]ацетаміду (200мг) в ацетонітрилі додавали карбонат калію (133мг) і 42,65 (м, 10H), 2,20-2,15 (м, 1Н), 2,05-1,95 (м, 1Н). гідроксипіперидин (62мкл). Суміш перемішували Приклад 39 при кімнатній температурі. До реакційної суміші N-[6-(2-Фенілхроман-6-ілокси)піридин-3-іл]-2додавали воду. Розчин екстрагували піролідин-1-ілацетамід До розчину 2-хлор-N-[6-(2-фенілхроман-6етилацетатом. Органічний екстракт сушили і випарювали. Продукт очищали колонковою ілокси)піридин-3-іл]ацетаміду (200мг) в хроматографією, використовуючи 10% метанол у ацетонітрилі додавали карбонат калію (133мг) і метиленхлориді як елюент. 2-(4піролідин (51мкл). Суміш перемішували при Гідроксипіперидин-1-іл)-N-[6-(2-фенілхроман-6кімнатній температурі. До реакційної суміші додавали воду. Розчин екстрагували ілокси)піридин-3-іл]ацетамід виділяли у вигляді гідрохлориду. етилацетатом. Органічний екстракт сушили і 1 випарювали. N-[6-(2-Фенілхроман-6H ЯМР (400МГц; d6-ДМСО) d: 8,41 (с, 1Н), 8,06 ілокси)піридин-3-іл]-2-піролідин-1-ілацетамід (дд, 1Н, J 2,7, 9,0Гц), 7,45-7,28 (м, 5Н), 6,95-6,85 виділяли у вигляді гідрохлориду. (м, 4Н), 5,10 (дд, 1Н, J 2,1, 10,0Гц), 4,13 (с, 2Н), 1 3,72-3,68 (м, 1Н), 3,48-3,43 (м, 3H), 3,25-3,10 (м, H ЯМР (400МГц; d6-ДМСО) d: 10,8 (с, 1Н), 8,35 1Н), 3,02-2,97 (м, 1Н), 2,81-2,75 (м, 1Н), 2,26-1,76 (д, 1Н, J 2,7Гц), 8,02 (дд, 1Н, J 2,7, 8,9Гц), 7,47-7,32 (м, 6Н), (М)+ = 459 (5,8%), 360 (7,4%), 114 (100%). (м, 5Н), 7,00 (д, 1Н, J 8,9Гц), 6,89-6,85 (м, 3H), 5,12 Приклад 43 (дд, 1Н, J 1,9, 10,0Гц), 4,25 (д, 2Н, 5,4Гц), 3,67-3,55 2-(3-Гідроксипіперидин-1-іл)-N-[6-(2(м, 2Н), 3,20-3,06 (м, 2Н), 3,06-2,90 (м, 1Н), 2,80фенілхроман-6-ілокси)піридин-32,65 (м, 1Н), 2,23-2,12 (м, 1Н), 2,10-1,85 (м, 5Н). іл]ацетамідугідрохлорид Приклад 40 2-(3-Гідроксипіперидин-1-іл)-N-[6-(22-(2,5-Диметилпіролідин-1-іл)-N-[6-(2фенілхроман-6-ілокси)піридин-3-іл]ацетаміду фенілхроман-6-ілокси)піридин-3-іл]ацетамід гідрохлорид синтезували, використовуючи ту ж До розчину 2-хлор-N-[6-(2-фенілхроман-6саму методику, яка описана для 2-(4ілокси)піридин-3-іл]ацетаміду (200мг) в гідроксипіперидин-1-іл)-N-[6-(2-фенілхроман-6ацетонітрилі додавали карбонат калію (133мг) і ілокси)піридин-3-іл]ацетаміду у прикладі 41, але 2,5-диметилпіролідин (81мкл). Суміш замінюючи 4-гідроксипіперидин 3перемішували при кімнатній температурі. До гідроксипіперидином. реакційної суміші додавали воду. Розчин 1 екстрагували етилацетатом. Органічний екстракт H ЯМР (400MГц; MeOD) d: 1,47 (м, 1Н), 1,62 сушили і випарювали. Продукт очищали (м, 1Н), 1,75 (м, 1Н), 1,87 (м, 1Н), 2,05 (м, 1Н), 2,22 колонковою хроматографією, використовуючи (м, 1Н), 2,37-2,57 (м, 3H), 2,68-2,72 (м, 2Н), 3,01 (м, градієнтне елюювання метанолом-дихлорметаном 1Н), 3,08-3,22 (м, 2Н), 3,80-3,88 (м, 1Н), 5,08 (дд, (2%>5%). 1Н, J 1,8, 10,0Гц), 6,82-6,91 (м,,4Н), 7,27-7,46 (м, 1 5Н), 8,06 (м, 1Н), 8,35 (д, 1Н, J 2,1Гц). H ЯМР (300МГц; 1H ЯМР) d: 9,66 (с, 1Н), 8,35 Приклад 44 (д, 1Н, J 2,7Гц), 8,06 (дд, 1Н, J 2,7, 8,8Гц), 7,47-7,32 2-(3-Гідроксипіролідин-1-іл)-N-[6-(2(м, 5Н), 6,93 (д, 1Н, J 8,8Гц), 6,88-6,84 (м, 3H), 5,12 фенілхроман-6-ілокси)піридин-3-іл]ацетаміду (дд, 1Н, J 2,1, 9,9Гц), 3,22 (с, 2Н), 3,05-2,88 (м, 1Н), 2,78-2,66 (м, 3H), 2,22-2,12 (м, 1Н), 2,08-1,92 (м, гідрохлорид 2-(3-Гідроксипіролідин-1-іл)-N-[6-(21Н), 1,90-1,79 (м, 2Н), 1,43-1,34 (м, 2Н), 1,06 (д, 6Н, фенілхроман-6-ілокси)піридин-3-іл]ацетаміду J 6,1Гц). гідрохлорид синтезували, використовуючи ту ж Приклад 41 саму методику, як описано для 2-(4N-[6-(2-Фенілхроман-6-ілокси)піридин-3-іл]-2піперидин-1-ілацетамід гідроксипіперидин-1-іл)-N-[6-(2-фенілхроман-6ілокси)піридин-3-іл]ацетаміду у прикладі 41, але До розчину 2-хлор-N-[6-(2-фенілхроман-6замінюючи 4-гідроксипіперидин піролідин-3-олом. ілокси)піридин-3-іл]ацетаміду (200мг) в 1 ацетонітрилі додавали карбонат калію (133мг) і H ЯМР (400МГц; d6-ДМСО) d: 1,81-2,31 (м, піперидин (60мкл). Суміш перемішували при 4Н), 2,68-2,77 (м, 1Н), 2,91-3,02 (м, 1Н), 3,05-3,57 кімнатній температурі. До реакційної суміші (м, 2 Η), 3,63-3,78 (м, 2Н), 4,17-4,50 (м, 3H), 5,12 (д, додавали воду. Розчин екстрагували 1Н, J 8,5Гц), 6,84-6,90 (м, 3H), 7,00 (дд, 1Н, J 2,5, дихлорметаном. Органічний екстракт сушили і 8,8Гц), 7,32-7,49 (м, 5Н), 8,03 (дд, 1 Н, J 2,7, 8,8Гц), випарювали. N-[6-(2-Фенілхроман-68,36 (с, 1Н), 10,40 (ушир.д, 1Н, J 30,3Гц), 10,93 (д, ілокси)піридин-3-іл]-2-(4-піперидин-1-іл)ацетамід 1Н, J 3,2Гц). виділяли у вигляді гідрохлориду. Приклад 45 1 Етиловий ефір 1-{[6-(2-Фенілхроман-6H ЯМР (400МГц; d6-ДМСО) d: 11,0 (с, 1Η), 8,38 ілокси)піридин-3-ілкарбамоїл]метил}піперидин-4(д, 1Η, J 2,7Гц), 8,03 (дд, 1H, J 2,7, 8,8Гц), 7,46-7,32 карбонової кислоти (м, 5H), 7,00 (д, 1Н, J 8,8Гц), 6,89-6,85 (м, 3H), 5,12 (дд, 1Н, J 1,9, 10,0Гц), 4,13 (д, 2Н, J 4,9Гц), 3,52
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridine derivatives useful for inhibiting sodium/calcium exchange
Автори англійськоюOtsomaa Leena, Koskelainen Tuula, Karjalainen Arto, Rasku Sirpa, Pollesello Piero, Levijoki Jouko
Назва патенту російськоюПроизводные пиридина, пригодные для ингибирования системы обмена натрия/кальция
Автори російськоюОтсомаа Леена, Коскелайнен Туула, Карьялайнен Арто, Раску Сирпа, Поллеселло Пьеро, Левийоки Йоуко
МПК / Мітки
МПК: C07D 213/75, A61P 9/00, C07D 411/00, C07D 405/14, C07D 405/12
Мітки: піридину, інгібування, обміну, системі, придатні, похідні
Код посилання
<a href="https://ua.patents.su/36-81941-pokhidni-piridinu-pridatni-dlya-ingibuvannya-sistemi-obminu-natriyu-kalciyu.html" target="_blank" rel="follow" title="База патентів України">Похідні піридину, придатні для інгібування системи обміну натрію/кальцію</a>
Попередній патент: Таблетка з плівковим покриттям, яка містить екстракт листя червоного винограду
Наступний патент: Спосіб визначення структурного стану води, спосіб визначення фальсифікатів водних розчинів і спосіб визначення вмісту дейтерію
Випадковий патент: Пуринільні похідні та їх застосування як модуляторів каналів калію












