Сполуки, що є сильнодіючими інгібіторами механізму обміну na+/ca+2 при лікуванні аритмії
Номер патенту: 76168
Опубліковано: 17.07.2006
Автори: Коскелайнен Туула, Карьялайнен Арто, Норе Пентті, Тіайнен Ейя, Отсомаа Леена, Котовуорі Пекка, Термякангас Оллі, Тенхунен Юкка, Раску Сірпа
Формула / Реферат
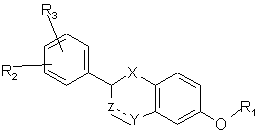
1. Сполуки формули (І):
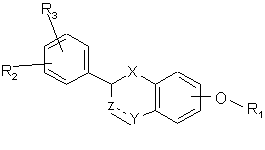 , (I)
, (I)
в якій:
X являє собою -О-, -CH2- або -С(O)-;
Z являє собою -CHR9- або валентний зв'язок;
Y являє собою -CH2-, -С(O)-, СН(OR10)-, -CH(NR11R12)-, -О-, -S-, -S(O)- або -S(O2)-, за умови, що у тому випадку, коли Z являє собою валентний зв'язок, Y не є С(O);
пунктирна лінія являє собою необов'язковий подвійний зв'язок у тому випадку, коли Z являє собою -CR9- і Y являє собою -СН-, C(OR10)-, або -C(NR11R12)-;
R1 являє собою -(CH2)nNR4R7 або одну з наступних груп:
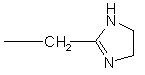 ,
, 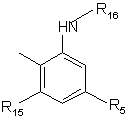 ,
,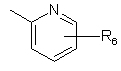 ,
,
n дорівнює 1-4,
R2 і R3 незалежно являють собою Н, нижчий алкіл, нижчий алкокси, -NO2, галоген, -СF3, -ОН, -NHR8 або -СООН.
R4 і R7 незалежно являють собою Н, нижчий алкіл або нижчий гідроксіалкіл,
R5 незалежно являє собою Н, нижчий алкокси, -СF3, -NH2 або -CN,
R6 являє собою -NO2, -NR14R19, -CF3 або
 ,
,
R8 і R16 незалежно являють собою Н або ацил,
R9 являє собою Н або нижчий алкіл,
R10 являє собою Н, алкілсульфоніл або ацил,
R11 і R12 незалежно являють собою Н, нижчий алкіл або ацил,
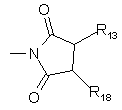
R13 і R18 незалежно являють собою Н або -OR20,
R14 і R19 незалежно являють собою Н, ацил, алкілсульфоніл, C(S)NHR17 або C(O)NHR17,
R15 являє собою Н або NH2,
R17 являє собою Н або нижчий алкіл,
R20 являє собою Н або ацил;
та їх фармацевтично прийнятні солі і складні ефіри.
2. Сполука за п. 1, що має структуру
 , (lb)
, (lb)
де R2, R3, X, Z, Y і R1 є такими, як вони визначені вище.
3. Сполука за п. 1 або 2, де Х є О і Z і Y є -СН2-.
4. Сполука за будь-яким з пунктів 1 або 2, де Х є О, Z є -СН2- і Y є СНОН.
5. Сполука за будь-яким з пп. 1-4, де R1 являє собою одну з наступних груп:
 ,
, .
.
6. Сполука за будь-яким з пп. 1-5, де R6 є NO2 або -NR14R19.
7. Сполука за п. 6, де R14 і R19 незалежно являють собою Н, ацил або алкілсульфоніл.
8. Сполука за будь-яким з пп. 1-7, де R15 і R16 являють собою Н.
9. Сполука за будь-яким з пп. 1-8, де R5 являє собою Н або нижчий алкокси.
10. Сполука за будь-яким з пп. 1-9, де R2 і R3 незалежно являють собою Н або галоген.
11. Сполука за п. 10, де галоген являє собою фтор.
12. Сполука за будь-яким з пп. 1-11, де n=2.
13. Сполука за будь-яким з пп.1-12, де R4 і R7 являють собою метил.
14. Фармацевтична композиція, що містить сполуку за п. 1 разом з фармацевтично прийнятним носієм.
15. Спосіб інгібування механізму обміну іонів Na+/Ca2+ у клітині, при якому вводять суб'єкту, у випадку необхідності, терапевтично ефективну кількість сполуки за п. 1.
16. Спосіб лікування аритмії, при якому вводять суб'єкту, у випадку необхідності, терапевтично ефективну кількість сполуки за п. 1.
Текст
1. Сполуки формули (І): 3 76168 4 10. Сполука за будь-яким з пп. 1-9, де R2 і R3 незасієм. лежно являють собою Н або галоген. 15. Спосіб інгібування механізму обміну іонів 11. Сполука за п. 10, де галоген являє собою Na+/Ca2+ у клітині, при якому вводять суб'єкту, у фтор. випадку необхідності, терапевтично ефективну 12. Сполука за будь-яким з пп. 1-11, де n=2. кількість сполуки за п. 1. 13. Сполука за будь-яким з пп.1-12, де R4 і R7 яв16. Спосіб лікування аритмії, при якому вводять ляють собою метил. суб'єкту, у випадку необхідності, терапевтично 14. Фармацевтична композиція, що містить сполуефективну кількість сполуки за п. 1. ку за п. 1 разом з фармацевтично прийнятним но Даний винахід відноситься до нових терапевтично активних сполук та їх фармацевтично прийнятних солей і складних ефірів. Винахід відноситься також до фармацевтичних композицій, що містять дані сполуки як активні інгредієнти. Сполуки винаходу є сильнодіючими інгібіторами механізму обміну іонів Na+/Ca2+. Механізм обміну іонів Na+/Ca2+ є одним з механізмів перенесення іонів, що регулюють концентрацію іонів натрію і кальцію у клітинах. Сполуки, які вибірно інгібують механізм обміну іонів Na+/Ca2+ і внаслідок цього запобігають надмірному навантаженню Са2+ у клітинах, можуть застосовуватися для запобігання механізму пошкодження клітин серцевого м'яза і подібних після ішемії та реперфузії. Дані сполуки застосовні при лікуванні ішемічних захворювань серця, ішемічних церебральних захворювань, ішемічних ниркових захворювань і при захисті клітин під час тромболітичної терапії, пластичної операції на судинах, обхідної операції коронарної артерії або трансплантації органів і аритмії. Сполуки, здатні інгібувати систему обміну Na+/Ca2+, були представлені раніше, наприклад, в опублікованих [патентах WO 97/09306, ЕР 0978506, ЕР 1031556, JP 11049752 і JP 11302235.] Було виявлено, що сполуки формули (І), зокрема, є сильнодіючими інгібіторами механізму обміну іонів Na+/Ca2+ і успішно можуть використовуватися при лікуванні аритмії. Сполуки даного винаходу та їх фармацевтично прийнятні солі і складні ефіри мають структуру, представлену формулою (І): (I) в якій: X являє собою -О-, -СН2- або -С(О)-; Ζ являє собою -CHR9- або валентний зв'язок; Υ являє собою -СН2-, -С(О)-, CH(OR10)-, CH(NR11R12)-, -О-, -S-, -S(O)- або -S(O2)-, за умови, що у тому випадку, коли Ζ являє собою валентний зв'язок, Υ не є С(О); пунктирна лінія являє собою необов'язковий подвійний зв'язок у тому випадку, коли Ζ являє собою -CR9- та Υ являє собою -СН-, С(OR10)- або C(NR11R12)-; R1 являє собою -(CH2)nNR4R7 або одну з наступних груп: n дорівнює 1-4, R2 і R3 незалежно являють собою Н, нижчий алкіл, нижчий алкокси, -NO2, галоген, -CF3, -OH, NHR8 або -СООН, R4 і R7 незалежно являють собою Н, нижчий алкіл або нижчий гідроксіалкіл, R5 незалежно являє собою Н, нижчий алкокси, -CF3, -NH2 або -CN, R6 являє собою -NO2, -NR14R19, -CF3 або R8 і R16 незалежно являють собою Η або ацил, R9 являє собою Η або нижчий алкіл, R10 являє собою Н, алкілсульфоніл або ацил, R11 і R12 незалежно являють собою Н, нижчий алкіл або ацил, R13 і R18 незалежно являють собою Η або OR20, R14 і R19 незалежно являють собою Н, ацил, алкілсульфоніл, C(S)NHR17 або C(O)NHR17, R15 являє собою Η або ΝΗ2, R17 являє собою Η або нижчий алкіл, R20 являє собою Η або ацил; і їх фармацевтично прийнятні солі та складні ефіри. В одному класі переважних сполук та їх фармацевтично прийнятних солей і складних ефірів знаходяться сполуки формули: (Ib) в якій R1, R2, R3, Χ, Υ і Ζ є такими, як вони визначені вище. В іншому класі переважних сполук та їх фармацевтично прийнятних солей і складних ефірів знаходяться сполуки формули (І), в якій X являє собою О і Ζ являє собою –СН2-. У ще одному іншому класі переважних сполук та їх фармацевтично прийнятних солей і складних ефірів знаходяться сполуки формули (І), в якій X являє 5 76168 6 собою О і Ζ являє собою -СН2- і Υ являє собою Похідні 2-оксиметилімідазоліну (14) можуть СНОН. бути синтезовані з похідних фенолу (II) через проВ одному підкласі переважних сполук та їх міжну сполуку, що являє собою простий ціаномефармацевтично прийнятних солей і складних ефітиловий ефір (13), який перетворюється з викорирів знаходяться сполуки формули (І), в якій R1 явстанням відомого методу [наприклад, J. Med. ляє собою одну з наступних груп: Chem. 1994, 37(12), 1814] в імідазолін (14). Похідні алкоксіазиду (16) одержують у результаті взаємодії відповідних галогеналкоксисполук (15) з азидом натрію. Азиди (16) перетворюються в аміни (17) шляхом взаємодії з трифеніламіном. 2В іншому підкласі переважних сполук знахо(Диметиламіно)етокси сполуки (18) одержують дяться сполуки, в яких R6 являє собою –NO2 або взаємодією фенолів формули (II) з NR14R19-. У групі даного підкласу R14 і R19 незалежно являють собою Н, ацил або алкілсульфоніл, R15 і R16 переважно являють собою Н, і R5 являє собою Η або нижчий алкокси. В одному підкласі переважних сполук знаходяться сполуки, в яких R2 і R3 незалежно являють собою Η або галоген. Переважний галоген являє Як показано на наступній схемі 3, коли R2 і R3 собою фтор. є такими, як вони визначені вище, похідні 6- і 7В одному класі переважних сполук знаходятьгідроксифлавану одержують з відповідних флавася сполуки, в яких n=2. R4 і R7 переважно являють нонів (1) відновленням за Клеменсеном. 6- і 7собою метил. гідроксифлаванони (1) комерційно доступні або У даному винаході пропонується також фарможуть бути синтезовані методами, описаними у мацевтична композиція, що містить сполуку форлітературі, [наприклад, в: J. Org. Chem., 1960, 25, мули (І) разом з фармацевтично прийнятним носі1247-9 і J. Org. Chem., 1958, 23, 1159-61] або як єм. показано далі на схемі 5. У даному винаході пропонується також спосіб інгібування механізму обміну іонів Na+/Ca2+ у клітині, що включає введення суб'єкту, у випадку необхідності, терапевтично ефективної кількості сполуки формули (І). У даному винаході пропонується також спосіб запобігання надмірному навантаженню іонів Са2+ у Наступна схема 4, де R2 і R3 є такими, як вони клітинах, що включає введення суб'єкту, у випадку визначені вище, показує синтез 2-феніліндан-5необхідності, терапевтично ефективної кількості олів (9). Конденсація р-анісового альдегіду (3) із сполуки формули (І). заміщеною фенілоцтовою кислотою (4) дає суміш У даному винаході пропонується також спосіб цис- і трансізомерів відповідної акрилової кислоти лікування аритмії, що включає введення суб'єкту, у (5). Після гідрування і внутрішньомолекулярної випадку необхідності, терапевтично ефективної реакції Фріделя-Крафтса функціональна карбонікількості сполуки формули (І). льна група 1-інданонів (7) може бути відновлена Фіг.1 показує протиаритмічні дії сполуки приквідновленням за Клеменсеном. І, нарешті, метоксіладу 27 на післяскорочення ізольованих сосочкоіндан (8) нагрівають зі зворотним холодильником у вих м'язів морської свинки, викликані уабаїном. концентрованій бромистоводневій кислоті з одерФіг.2 показує протиаритмічні дії сполуки прикжанням 2-феніліндан-5-олів (9). ладу 67 на післяскорочення ізольованих сосочкоПохідні 2-фенілхроман-4,6-діолу (37) одержувих м'язів морської свинки, викликані уабаїном. ють з відповідних 6-гідроксифлаванонів (36) відноСполуки винаходу можуть бути одержані з відвленням, як показано на схемі 6. Вказані похідні повідних похідних фенолу (II), де R2, R3, Χ, Ζ і Υ є діолу можуть бути потім відновлені у 6такими, як вони визначені вище. гідроксифлавани (38). (II) Синтези показані на схемі 1, де формула (II) скорочено представлена як Аr-ОН (II) і R4, R5, R6, R7, R15 і R16 є такими, як вони визначені вище, і Hal означає галоген. Сполуки формули (II) можуть взаємодіяти з похідними 1-хлор-2-нітробензолу з утворенням нітрофеноксисполук (10), які, у свою чергу, у результаті гідрування перетворюються у похідні феніламіну (11). 5-нітропіридин-2-ілоксисполуки (12) одержують шляхом взаємодії з 2-хлор-5нітропіридином. Як показано на наступній схемі 7, похідні 4аміно-2-фенілхроманолу (19) можуть бути синтезовані з відповідних флаванонів (1) через гідрокси 7 76168 8 2-фенілхроман-4-оноксими (20). Відновлення похіНаступна схема 10 показує синтез 6-фенілдного оксиму дає 4-аміно-2-фенілхроманоли (21), 5,6,7,8-тетрагідронафталін-2-олу (41) і 6-гідроксиякі можуть бути алкіловані або ациловані загаль2-феніл-3,4-дигідро-2Н-нафталін-1-ону (40). Катановідомими методами. Похідні 4-гідрокси-2лізоване Pd α-арилування 6-метокси-1-тетралону фенілхроманолу можуть бути оброблені подібнидає 6-метокси-2-феніл-3,4-дигідро-2Н-нафталін-1ми методами. он (39), після деметилування якого одержують фенолову сполуку (40). Наступна схема 8, де R2 і R3 є такими, як вони визначені вище, показує синтез 7гідроксіізофлавонів (29) і 7-гідроксіізофлаванів (30). Ацилювання 3-метоксифенолу заміщеними фенілоцтовими кислотами дає відповідні 2гідроксидезоксибензоїни (27), які можуть бути циклізовані з триетилортоформіатом з одержанням ізофлавонів (28). У результаті видалення захисту з використанням бромистоводневої кислоти і каталітичного гідрування утворюються 7гідроксіізофлавани (30). Наступна схема (11), де R2 і Яз є такими, як вони визначені вище, показує синтез 2,3-дигідро-2фенілбензо[1,4]діоксин-6-олів (45). Після захисту гідроксильних груп 2,5-дигідроксіацетофенону вказаний кетон перегруповується з перкислотами і після гідролізу утворюється фенол. Фенол конденсують з галогенкетоном і після відновлення і видалення захисних груп гідроксифенол (44) циклізується у 2,3-дигідро-2-фенілбензо[1,4]діоксин-6-ол (45). Наступна схема 9 показує синтез 2-феніл-2,3дигідробензо[1,4]оксатіїн-6-олу (34). Реакція 2меркаптобензол-1,4-діолу з епоксидним полімером стиролу у присутності основи дає сульфід (33). У результаті замикання кільця з використанням катіоніту у кислій формі одержують 2-феніл-2,3дигідробензо[1,4]оксатіїн-6-ол (34). Солі і складні ефіри сполук можуть бути одержані відомими методами. Фізіологічно прийнятні солі використовуються як активні лікарські засоби. Прикладами таких солей є солі з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота або азотна кислота, і солі з органічними кислотами, такими як метансульфонова кислота, лимонна кислота або винна кислота. Фізіологічно прийнятні складні ефіри також застосовуються як активні лікарські засоби. 9 76168 10 Прикладами є складні ефіри з аліфатичними або сили скорочень м'яза. М'язові препарати електриароматичними кислотами, такими як оцтова кислочно стимулювали полем при частоті 1Гц за допота, або з аліфатичними або ароматичними спирмогою платинових електродів. Для підвищеного тами. злиття м'язових препаратів використовували моВикористаний у даному описі термін «алкіл» дифікований розчин Tyrode. Склад розчину Tyrode сам по собі або як частина іншої групи включає був наступним (мМ): NaCl 135, MgCl2 6H2O 1, KСl радикали як з прямим, так і з розгалуженим і цик5, СаСl2 2Н2О 2, NaHCO3 15, Na2HPO4 2H2O 1 і лізованим ланцюгом, що містять до 18 атомів вугглюкоза 10. Розчин Tyrode газували карбогеном лецю, переважно від 1 до 7 атомів вуглецю, най(95% О2, 5% СО2) для встановлення рН при знабільш переважно від 1 до 4 атомів вуглецю. ченні 7,4. Експерименти здійснювали при 37°С. Використаний у даному описі термін «нижчий алАналіз судомних напружень м'яза здійснювали із кіл» сам по собі або як частина іншої групи вклюзастосуванням системи для вимірювання потенцічає радикали як з прямим, так і з розгалуженим і алу дії і сили скорочень (ACFO ν 1,0, Fision Ltd, циклізованим ланцюгом, що містять від 1 до 7, Фінляндія). переважно від 1 до 4, найбільш переважно 1 або 2 Інгібування аритмії, викликаної уабаїном атоми вуглецю. Конкретні приклади алкільних і Уабаїн за рахунок блокування натрійкалійаденижчих алкільних залишків відповідно являють нозинтрифосфатази підвищує вміст внутрішньоксобою метил, етил, пропіл, ізопропіл, бутил, третлітинного натрію, який замінюється на кальцій за бутил, пентил, циклопентил, гексил, циклогексил, допомогою NCX. Підвищений вміст внутрішньокліоктил, децил і додецил, включаючи різні їх ізомери тинного кальцію приводить до надмірного наванз розгалуженим ланцюгом. таження саркоплазматичної сітки (SR) і мимовільВикористаний у даному описі термін «алкокси» ного вивільнення кальцію з SR, що викликає сам по собі або як частина іншої групи включає уповільнені поляризації післядії (DAD). Еквіваленвизначену вище алкільну групу, зв'язану з атомом тністю DAD у сигналі сили скорочень м'яза є післякисню. скорочення (АС), які розглядаються як мимовільні Використаний у даному описі термін «ацил» судомні скорочення після стимуляції регульованосам по собі або як частина іншої групи відноситься го судомного скорочення. до алкілкарбонільної або алкенілкарбонільної груСполуки винаходу уповільнювали появу післяпи, при цьому алкільна і алкенільна групи визнаскорочень і зменшували їх амплітуду. Як показано чені вище. на фіг. 1, вказана у заголовку прикладу 27 сполука Сполуки винаходу можуть бути введені хворопри концентрації 30мкМ уповільнювала появу пісму у терапевтично ефективних кількостях, які звиляскорочень [38±7,5хв. у порівнянні з наповнювачайно знаходяться у діапазоні від близько 0,05 до чем: 25±8,9хв. (середній ±SD), р=0,013, n=5] і зме200мг, переважно від 0,1 до 100мг, більш переваншувала максимальну амплітуду післяскорочень жно від 0,5 до 50мг на день в залежності від віку, №1 (74±16мг у порівнянні з наповнювачем: маси тіла, стану хворого, способу введення лікар143±54мг, р=0,008, однобічний ANOVA з подальського засобу та використовуваного інгібітору обшим LSD; n=5). Як показано на Фіг.2, вказана у міну Na+/Ca2+. Сполуки винаходу можуть бути призаголовку прикладу 67 сполука при концентрації готовані у вигляді лікарських форм з 10мкМ зменшувала максимальну амплітуду після використанням методик, відомих у даній області. скорочень №1 (88±20мг у порівнянні з наповнюваВони можуть бути введені хворому як такі або у чем: 143±54мг, р=0,027, n=5). комбінації з відповідними фармацевтичними ексПРИКЛАДИ ципієнтами у формі таблеток, гранул, капсул, суПриклад 1: позиторіїв, емульсій, суспензій або розчинів. Вибір 5-Нітро-2-(2-фенілхроман-6-ілокси)піридин придатних інгредієнтів для композиції здійснюєтьa) 2-фенілхроман-6-ол ся звичайним шляхом фахівцем у даній області Цинк (5,4г, 83,2моль), хлорид ртуті (II) (340мг), відповідно до практики, що встановилася. Очевиконцентрований хлористий водень (0,2мл) і воду дно, що можуть бути також використані відповідні змішували при кімнатній температурі протягом 15 носії, розчинники, гелетвірні інгредієнти, інгредієнхвилин і суміш декантували. У суміш оцтової кисти, які утворюють дисперсію, антиоксиданти, барлоти (25мл), концентрованого хлористого водню вники, підсолоджувачі, змочувальні речовини та (5,2мл) і води (2мл) додавали 6-гідроксифлаванон інші інгредієнти, що звичайно використовуються у (1,0г) у вигляді суспензії. Реакційну суміш кип'ятитехнології даної області. Композиції, що містять ли зі зворотним холодильником протягом 1½ годиактивну сполуку, можуть бути введені ентерально ни. Після охолоджування до кімнатної температуабо парентерально, при цьому пероральний спори реакційну суміш фільтрували і фільтрат сіб введення є переважним. Вміст активної сполуекстрагували етилацетатом. Об'єднані органічні ки у композиції складає від близько 0,5 до 100%, шари промивали насиченим розчином NaHCO3, переважно від близько 0,5 до близько 20% з розпотім водою і сушили над Na2SO4. 2-Фенілхроманрахунку на загальну масу композиції. 6-ол очищали колонковою хроматографією з викоВипробовували дію сполук винаходу на аритристанням як елюенту суміші гептан:етилацетат мію сосочкових м'язів морської свинки, викликану (2:1). 1 уабаїном. H-ЯМР (400МГц, d6-ДМСО) δ: 8,78 (с, 1H), Методи 7,43-7,31 (м, 5Н), 6,63 (д, 1Н, J=8,6Гц), 6,51 (дд, Сосочкові м'язи морської свинки поміщали у 1Н, J=8,6, 2,9Гц), 6,48 (д, 1H, J=2,9Гц), 4,98 (дд, горизонтальну кювету для м'язів. До іншого кінця 1Н, J=9,9, 2,2Гц), 2,89 (ддд, 1Н, J=16,7, 11,3, м'яза прикріплювали гачок, з'єднаний з датчиком 6,1Гц), 2,63 (ддд, 1Н, J=16,7, 5,5, 3,3Гц), 2,10 (м, 11 76168 12 1H), 1,94 (м, 1Η). му тиску і кімнатній температурі. Потім її фільтруb) 5-Нітро-2-(2-фенілхроман-6-ілокси)піридин вали через пухкий шар целіту і промивали етилаУ розчин 2-фенілхроман-6-олу (300мг) у сухоцетатом. Виділяли 5-метокси-2-(2-фенілхроман-6му ДМФА (3мл) додавали фторид калію (225мг). ілокси)феніламін у вигляді його хлористоводневої Після перемішування суміші, що утворилася, при солі. 1 120°С протягом 30 хвилин додавали 2-хлор-5Н-ЯМР (400МГц, d6-ДМСО) δ: 7,44-7,33 (м, нітропіридин (195мг). Реакційну суміш перемішу5Н), 6,83-6,72 (м, 4Н), 6,68 (д, 1H, J=2,9Гц), 6,48 вали протягом ще 6½ годин при 120°С. Після охо(дд, 1H, 5=8,9, 2,8Гц), 5,07 (дд, 1Н, J=10,0, 2,2Гц), лоджування до кімнатної температури додавали 3,70 (с, 3Н), 2,93 (ддд, 1Н, J=17,0, 11,1, 6,1Гц), 2,68 1М розчин НСl і суміш екстрагували етилацетатом. (ддд, 1Н, J-17,0, 8,3, 4,5Гц), 2,15 (м, 1H), 1,97 (м, Об'єднані органічні шари промивали водою, потім 1Н). насиченим розчином NaCl і сушили над Na2SO4. 5Приклад 4: Нітро-2-(2-фенілхроман-6-ілокси)піридин перекри2-(2-Фенілхроман-6сталізовували з суміші ацетон-2-пропанол (1:5). ілокси)етиламінметансульфонат 1 H-ЯМР (400МГц, d6-ДМСО) δ: 9,00 (д, 1Н, а) 6-(2-азидоетокси)-2-фенілхроман J=2,9Гц), 8,60 (дд, 1Н, J-9,2, 2,9Гц), 7,47-7,32 (м, 2-Фенілхроман-6-ол (340мг), 1-бром-25Н), 7,20 (д, 1Н, J=9,2Гц), 7,00-6,89 (м, 3Н), 5,15 хлоретан (1,25мл) і карбонат цезію (997мг) розчи(дд, 1Н, J=10,1, 2,2Гц), 2,99 (ддд, Ш, J=16,8, 11,3, няли в ацетонітрилі (4мл). Реакційну суміш кип'я6,2Гц), 2,75 (ддд, 1Н, J=16,8, 5,4, 3,3Гц), 2,18 (м, тили зі зворотним холодильником протягом 4 го1Н), 2,02 (м,1Н). дин. Після охолоджування до кімнатної Приклад 2: температури її вливали в 1М розчин НСl та екстраДиметил[2-(2-фенілхроман-6-ілокси)етил]амін гували дихлорметаном. Об'єднані дихлорметанові Карбонат цезію (230мг) і надлишок 2екстракти промивали водою і сушили над Na2SO4. (диметиламіно)етилхлориду в етилацетаті додаСуміш пропускали через колонку з силікагелем з вали у розчин 2-фенілхроман-6-олу (150мг) в ацевикористанням як елюенту суміші етилацетонітрилі (5мл). Реакційну суміш кип'ятили зі звотат:гексан (1:7), в результаті одержували 190мг ротним холодильником протягом 30 хвилин. Після похідного галогенетану. Його розчиняли у ДМФА видалення розчинників залишок переносили у во(5мл) і додавали азид натрію (214мг). Реакційну ду і екстрагували етилацетатом. Об'єднані органісуміш кип'ятили зі зворотним холодильником прочні шари промивали водою і потім насиченим розтягом 2 годин. Суміш фільтрували. До фільтрату чином NaCl і сушили над Na2SO4. Диметил[2-(2додавали етилацетат і потім його промивали один фенілхроман-6-ілокси)етил]амін кристалізували з раз 1М розчином НСl і потім декілька разів водою і гептану. сушили над Na2SO4. Розчинники випарювали при 1 Н-ЯМР (400МГц, d6-ДМСО) δ: 7,43-7,30 (м, зниженому тиску з одержанням при цьому 6-(25Н), 6,75-6,67 (м, 3Н), 5,03 (дд, 1H, J=10,0, 2,2Гц), азидоетокси)-2-фенілхроману. 1 3,95 (τ, 2Η, J=5,9Гц), 2,94 (ддд, 1H, J=16,7, 10,9, H-ЯМР (400МГц, d6-ДМСО) δ: 7,44-7,32 (м, 5,8Гц), 2,69 (ддд, 1H, J=16,7, 5,2, 3,3Гц), 2,58 (т, 5Н), 6,78-6,71 (м, 3Н), 5,04 (дд, 1Н, J=10,1, 2,3Гц), 2Н, J=5,9Гц), 2,13 (м, 1H), 1,96 (м, 1Н). 4,10 (т, 2Η, J=4,8Гц), 3,60 (т, 2Η, J=4,8Гц), 2,95 Приклад 3: (ддд, 1Н, J=16,8, 11,1, 6,0Гц), 2,70 (ддд, 1Н, Гідрохлорид 5-метокси-2-(2-фенілхроман-6J=16,8, 5,3, 3,3Гц), 2,14 (м, 1Н), 1,97 (м, 1Н). ілокси)феніламіну b) 2-(2-Фенілхроман-6a) 6-(4-Метокси-2-нітрофенокси)-2ілокси)етиламінметансульфонат фенілхроман У розчин 6-(2-азидоетокси)-2-фенілхроману 2-Фенілхроман-6-ол (500мг) і 1-хлор-4(155мг) у тетрагідрофурані додавали трифенілфометокси-2-нітробензол (390мг) розчиняли у ДМСО сфін (165мг) і 40мкл води. Суміш, що утворилася, (10мл). Додавали гідроксид калію (230мг) та йодид перемішували протягом 2 годин при кімнатній темкалію (520мг) і суміш, що утворилася, перемішувапературі. Виділяли 2-(2-фенілхроман-6ли при 90°С протягом 1 години. Після охолоджуілокси)етиламін у вигляді його метансульфонатної вання її вливали в 1М розчин НСl (20мл) і екстрасолі. 1 гували дихлорметаном. Об'єднані органічні шари Н-ЯМР (400МГц, d6-ДМСО) δ: 7,91 (уш.с, 3Н), промивали водою до одержання нейтрального 7,44-7,32 (м, 5Н), 6,81-6,75 (м, 3Н), 5,05 (дд, 1H, середовища і потім насиченим розчином NaCl і J=9,9, 2,3Гц), 4,08 (т, 2Н, J=5,1Гц), 3,19 (м, 2Н), сушили над Na2SO4. Після випарювання розчинни2,95 (ддд, 1H, J=16,8, 11,0, 5,9,Гц), 2,71 (ддд, 1Н, ків одержували 6-(4-метокси-2-нітрофенокси)-2J=16,8, 5,2, 3,4Гц), 2,30 (с, 3Н), 2,15 (м, 1H), 1,97 фенілхроман розтиранням у метанолі. (м, 1Н). 1 Н-ЯМР (400МГц, d6-ДМСО) δ: 7,58 (д, 1H, Приклад 5: J=3,1Гц), 7,45-7,33 (м, 6Н), 7,28 (дд, 1H, J=9,2Гц, Гідрохлорид 2-(2-фенілхроман-6-ілоксиметил)3,1Гц), 7,10 (д, 1Н, J=9,2Гц), 6,86-6,78 (м, 3Н), 5,10 4,5-дигідро-1Н-імідазолу (дд, 1Н, J=10,0, 1,9Гц), 3,83 (с, 3Н), 2,92 (ддд, 1H, a) (2-Фенілхроман-6-ілокси)ацетонітрил J=16,9, 11,2, 5,9Гц), 2,75 (ддд, 1Н, J=16,9, 7,9, У розчин 2-фенілхроман-6-олу (200мг) в аце4,2Гц), 2,15 (м, 1H), 1,97 (м, 1H). тонітрилі (3мл) додавали карбонат цезію (310мг) і b) Гідрохлорид 5-метокси-2-(2-фенілхроман-6хлорацетонітрил (62мкл). Суміш, що утворилася, ілокси)феніламіну 6-(4-Метокси-2-нітрофенокси)-2кип'ятили зі зворотним холодильником протягом 6 фенілхроман (360мг) розчиняли в етилацетаті і годин. Реакційній суміші давали можливість охододавали 10% паладій на вугіллі (90мг). Реакційну лоджуватися до кімнатної температури і додавали суміш гідрували протягом 2 годин при нормально1М розчин НСl і її екстрагували етилацетатом. 13 76168 14 Об'єднані органічні шари промивали водою і насисуміш льоду і розчину 2М НСl. 2-Фенілхроман-4,6ченим розчином NaCl і сушили над Na2SO4. Роздіол фільтрували. 1 чинники випарювали при зниженому тиску з одерН-ЯМР (400МГц, (d6-ДМСО) δ: 8,83 (с, 1H), жанням (2-фенілхроман-6-ілокси)ацетонітрилу. 7,45-7,38 (м, 4H), 7,35 (м, 1Н), 6,89 (д, 1H, 1 Н-ЯМР (400МГц, d6-ДМСО) δ: 7,44-7,30 (м, J=2,8Гц), 6,59 (д, 1H, J=8,7Гц), 6,54 (дд, 1H, J=8,7, 5Н), 6,86-6,81 (м, 3Н), 5,08 (дд, 1H, J=9,8, 2,2Гц), 2,8Гц), 5,41 (д, 1H, J=7,0Гц), 5,11 (дд, 1Н, J=11,7, 5,07 (с, 2Н), 2,97 (ддд, 1Н, J=16,9, 10,9, 6,0,Гц), 1,2Гц), 4,87 (м, 1H), 2,26 (м, 1Н), 1,90 (м, 1H). 2,71 (ддд, 1H, J=16,9, 5,0, 3,4Гц), 2,15 (м, 1H), 1,97 (b) 6-(5-Нітропіридин-2-ілокси)-2-фенілхроман(м, 1Н). 4-ол b) Гідрохлорид 2-(2-фенілхроман-66-(5-Нітропіридин-2-ілокси)-2-фенілхроман-4ілоксиметил)-4,5-дигідро-1Н-імідазолу ол одержували з 1,5г 2-фенілхроман-4,6-діолу, У розчин (2-фенілхроман-6застосовуючи методику прикладу 1(b), описану ілокси)ацетонітрилу (270мг) у діетиловому ефірі і для одержання 5-нітро-2-(2-фенілхроман-690мкл абсолютного етанолу при охолоджуванні на ілокси)піридину. Продукт пропускали через колонбані з льодом пропускали сухий НСl. Реакційну ку з силікагелем з використанням як елюенту сусуміш випарювали досуха після утворення проміміші толуол:етилацетат (4:1) і потім кристалізуважного імідату. Залишок розчиняли в абсолютному ли з 2-пропанолу. 1 етанолі і до охолодженого розчину додавали Н-ЯМР (400МГц, d6-ДМСО) δ: 9,04 (д, 1H, 252мкл етилендіаміну. Реакційній суміші давали J=2,7Гц), 8,61 (дд, 1H, J=9,1, 2,7Гц), 7,50-7,36 (м, можливість нагріватися до кімнатної температури, 5Н), 7,25 (д, 1Н, J=2,7Гц), 7,22 (д, 1H, J=9,1Гц), випарювали досуха, розчиняли у дихлорметані і 7,00 (дд, 1H, J=8,7, 2,7Гц), 6,88 (д, 1H, J=8,7Гц), промивали водою. Об'єднані органічні шари суши5,65 (д, 1H, J=6,3Гц), 5,30 (дд, 1Н, J=11,9, 1,3Гц), ли і обробляли вугіллям. Виділяли 2-(24,99 (м, 1Н), 2,33 (м, 1H), 1,98 (м, 1Н). фенілхроман-6-ілоксиметил)-4,5-дигідро-1HПриклад 9: імідазол у вигляді його НСl солі. 2-[2-(3-Фторфеніл)хроман-6-ілокси]-51 Н-ЯМР (d4-MeOH): 7,5-7,2 (м, 5Н), 6,85-6,75 нітропіридин (м, 3Н), 5,01 (д, 1H, J=8,8Гц), 4,97 (с, 2Н), 4,00 (с, а)2-(3-Фторфеніл)-6-гідроксихроман-4-он 4Н), 3,02-2,90 (м, 1H), 2,80-2,70 (м, 1H), 2,21-2,12 2',5'-Дигідроксіацетофенон (1,50г) розчиняли у (м, 1H), 2,05-1,90 (м, 1Н). (М+)=308 (100%) теплій льодяній оцтовій кислоті (26мл). Додавали Приклад 6: 3-фторбензальдегід (1,35г) і ацетат амонію (0,98г). 6-(5-Нітропіридін-2-ілокси)-2-фенілхроман-4-он Реакційну суміш кип'ятили зі зворотним холодиль6-(5-Нітропіридін-2-ілокси)-2-фенілхроман-4-он ником протягом 2 годин. їй давали охолоджуватиодержували з використанням 200мг 6ся до кімнатної температури і вливали на лід. гідроксифлаванону, застосовуючи методику прикОсад, що утворився, фільтрували, в результаті ладу 1(b), описану для одержання 5-нітро-2-(2одержували 2,2г суміші 2-(3-фторфеніл)-6фенілхроман-6-ілокси)піридину. гідроксихроман-4-ону і 1-(2,5-дигідроксифеніл)-31 Н-ЯМР (400МГц, (d6-ДМСО) δ: 9,03 (уш.с, 1Н), (3-фторфеніл)пропенону. Одержану суміш розчи8,64 (д, 1H, J-9,0Гц), 7,59-7,41 (м, 7Н), 7,31 (д, 1H, няли в етанолі (90мл) і додавали ацетат натрію J=9,0Гц), 7,23 (д, 1H, J=8,8Гц), 5,75 (дд, 1H, J=12,3, (1,75г). Реакційну суміш кип'ятили зі зворотним 2,9Гц), 3,30 (дд, 1Н, J=16,3, 12,3Гц), 2,87 (дд, 1H, холодильником протягом 5 годин. Потім їй давали J=16,3, 2,9Гц). можливість охолоджуватися до кімнатної темпераПриклад 7: тури, розбавляли водою і фільтрували. 2-(37-(5-Нітропіридин-2-ілокси)-2-фенілхроман-4Фторфеніл)-6-гідроксихроман-4-он перекристаліон зовували з оцтової кислоти. 1 7-(5-Нітропіридин-2-ілокси)-2-фенілхроман-4Н-ЯМР (400МГц, d6-ДМСО) δ: 9,45 (с, 1H), он одержували з використанням 150мг 77,47 (м, 1Н), 7,40-7,37 (м, 2Н), 7,22 (м, 1Н), 7,12 (д, гідроксифлаванону, застосовуючи методику прик1H, J=3,0Гц), 7,05 (дд, 1H, J=8,8, 3,0Гц), 6,98 (д, ладу 1(b), описану для одержання 5-нітро-2-(21H, J=8,8Гц), 5,59 (дд, 1H, J=13,0, 2,9Гц), 3,21 (дд, фенілхроман-6-ілокси)піридину. 1H, J=16,9, 13,0Гц), 2,82 (дд, 1H, J=16,9, 2,9Гц). 1 Н-ЯМР (400МГц, d6-ДМСО) δ: 9,07 (д, 1H, b)2-(3-Фторфеніл)хроман-4,6-діол J=2,8Гц), 8,67 (дд, 1H, J=9,0, 2,8Гц), 7,89 (д, 1H, 2-(3-Фторфеніл)хроман-4,6-діол одержували з J=8,6Гц), 7,60-7,35 (м, 6Н), 7,04 (д, 1H, J=2,1Гц), 220мг 2-(3-фторфеніл)-6-гідроксихроман-4-ону, 6,97 (дд, 1H, J=8,6, 2,1Гц), 5,75 (дд, 1H, J=13,0, застосовуючи методику прикладу 8(а), описану 2,7Гц), 3,32 (дд, 1H, J=16,9, 13,0Гц), 2,85 (д, для одержання 2-фенілхроман-4,6-діолу. 1 J=16,9, 2,7Гц). Н-ЯМР (400МГц, d6-ДМСО) δ: 8,85 (с, 1H), Приклад 8: 7,45 (м, 1H), 7,30-7,25 (м, 2Н), 7,15 (м, 1H), 6,88 (д, 6-(5-Нітропіридин-2-ілокси)-2-фенілхроман-41Н, J=2,8Гц), 6,62 (д, 1H, J=8,7Гц), 6,55 (дд, 1H, Jол 8,7, 2,8Гц), 5,44 (д, 1H, J=7,0Гц), 5,15 (д, 1H, а) 2-Фенілхроман-4,6-діол J=10,7Гц), 4,86 (м, 1Н), 2,29 (м, 1Н), 1,86 (м, 1H). У суспензію 6-гідроксифлаванону (1,0г) у сус) 2-(3-Фторфеніл)хроман-6-ол хому ТГФ (11,5мл) додавали по краплях в атмосУ розчин 2-(3-фторфеніл)хроман-4,6-діолу фері азоту розчин комплексу боран-ТГФ (12,5мл, (195мг) у дихлорметані (4мл) повільно додавали 1,0 у ТГФ). Реакційну суміш кип'ятили зі зворотним триетилсилан (960мкл). Потім у реакційну суміш холодильником протягом 1 години. Після охолододавали по краплях трифтороцтову кислоту джування до кімнатної температури її вливали у (1,9мл) і її перемішували при кімнатній температурі протягом 5 годин. Реакційну суміш вливали у 15 76168 16 суміш води з льодом і екстрагували дихлормета(дд, 1Н, J=8,5, 2,0Гц), 7,14 (д, 1H, J=3,0Гц), 7,06 ном. Залишок випарювали при зниженому тиску з (дд, 1H, J=8,8, 3,0Гц), 6,97 (д, 1H, J=8,8Гц), 5,77 толуолом з одержанням при цьому 2-(3(дд, 1Н, J-13,5, 2,7Гц), 3,18 (дд, 1Н, J=16,9, фторфеніл)хроман-6-олу. 13,5Гц), 2,78 (дд, 1H, J=16,9, 2,7Гц). 1 Н-ЯМР (400МГц, d6-ДМСО) δ: 8,78 (с, 1H), b)2-(2,4-Дихлорфеніл)хроман-4,6-діол 7,43 (м, 1H), 7,28-7,25 (м, 2Н), 7,14 (м, 1Н), 6,66 (д, 2-(2,4-Дихлорфеніл)хроман-4,6-діол одержу1H, J=8,5Гц), 6,52 (дд, 1H, J=8,5, 2,7Гц), 6,49 (д, вали з 1,2г 2-(2,4-дихлорфеніл)-6-гідроксихроман1H, J=2,7Гц), 5.03 (дд, 1H, J=9,9, 2,1Гц), 2,86 (м, 4-ону, застосовуючи методику прикладу 8(а), опи1Н), 2,63 (м, 1H) 2,13 (м, 1Н), 1,93 (м, 1H). сану для одержання 2-фенілхроман-4,6-діолу. d) 2-[2-(3-Фторфеніл)хроман-6-ілокси]-5Продукт очищали колонковою хроматографією з нітропіридин використанням як елюенту суміші гептан2-[2-(3-Фторфеніл)хроман-6-ілокси]-5етилацетат (2:1). 1 нітропіридин одержували з 210мг 2-(3Н-ЯМР (400МГц, (d6-ДМСО) δ: 8,89 (с, 1Н), фторфеніл)хроман-6-олу, застосовуючи методику 7,66 (д, 1H, J=2,lГц), 7,64 (д, 1H, J=8,5Гц), 7,51 (дд, прикладу 1(b), описану для одержання 5-нітро-21H, J=2,1, 8,5Гц), 6,89 (д, 1H, J=2,7Гц), 6,63 (д, 1Н, (2-фенілхроман-6-ілокси)піридину. Продукт перекJ=8,7Гц), 6,56 (дд, 1Н, J=2,7, 8,7Гц), 5,50 (д, 1H, ристалізовували з 2-пропанолу. J=6,8Гц), 5,37 (д, 1Н, J=10,4Гц), 4,90 (м, 1Н), 2,32 1 Н-ЯМР (400МГц, CDCl3) δ: 9,07 (д, 1H, (м, 1H), 1,80(м, 1Н). J=2,8Гц), 8,46 (дд, 1H, J=9,0, 2,8Гц), 7,36 (м, 1H), с) 2-(2,4-Дихлорфеніл)хроман-6-ол 7,21-7,15 (м, 2Η), 7,03 (м, 1Н), 7,01 (д, 1Н, 2-(2,4-Дихлорфеніл)хроман-6-ол одержували з J=9,0Гц), 6,98 (д, 1H, J=8,6Гц), 6,92 (дд, 1H, J=8,6, 625мг 2-(2,4-дихлорфеніл)хроман-4,6-діолу, засто2,7Гц), 6,90 (д, 1Н, J=2,7Гц), 5,09 (дд, 1Н, J=10,3, совуючи методику прикладу 9(с), описану для 2,4Гц), 3,01 (ддд, 1Н, J=16,9, 11,4, 6,0Гц), 2,82 одержання 2-(3-фторфеніл)хроман-6-олу. 1 (ддд, 1H, J=16,9, 5,1, 3,2Гц), 2,24 (м, 1Н), 2,09 (м, Н-ЯМР (400МГц, d6-ДМСО) δ: 8,85 (с, 1H), 1H). 7,65 (д, 1H, J=2,2Гц), 7,57 (д, 1Н, J=8,4Гц), 7,49 Приклад 10: (дд, 1H, J=8,4, 2,2Гц), 6,67-6,51 (м, 3Н), 5,21 (дд, 5-Нітро-2-(2-фенілхроман-7-ілокси)піридин 1H, J=10,3, 2,1Гц), 2,91 (м, 1H), 2,69 (м, 1H), 2,16 a) 2-Фенілхроман-7-ол (м, 1Н), 1,85(м, 1H). 2-Фенілхроман-7-ол одержували з 1,0г 7(1)2-[2-(2,4-Дихлорфеніл)хроман-6-ілокси]-5гідроксифлаванону, застосовуючи методику прикнітропіридин ладу 1(а), описану для одержання 5-нітро-2-(22-[2-(2,4-Дихлорфеніл)хроман-6-ілокси]-5фенілхроман-6-ілокси)піридину. Продукт очищали нітропіридин одержували з 530мг2-(2,4колонковою хроматографією з використанням як дихлорфеніл)хроман-6-олу, застосовуючи методиелюенту суміші гептан-етилацетат (2:1). ку прикладу 1(b), описану для одержання 5-нітро1 Н-ЯМР (400МГц, CD3OD) δ: 7,41-7,28 (м, 5Н), 2-(2-фенілхроман-6-ілокси)піридину. Продукт очи6,86 (д, 1H, J=8,2Гц), 6,32 (дд, 1H, J=8,2, 2,4Гц), щали препаративною ТШХ на пластинці, покритій 6,29 (д, 1H, J=2,4Гц), 5,00 (дд, 1H, 9,9, 2,4Гц), 2,84 силікагелем, з використанням як елюенту суміші (м, 1Н), 2,64 (м, 1H), 2,15 (м, 1H), 1,99 (м, 1Н). гептан-етилацетат (3:1). 1 b) 5-Нітро-2-(2-фенілхроман-7-ілокси)піридин Н-ЯМР (400МГц, CDCl3) δ: 9,06 (д, 1H, 5-Нітро-2-(2-фенілхроман-7-ілокси)піридин J=2,7Гц), 8,47 (дд, 1H, J=9,0, 2,7Гц), 7,56 (д, 1H, одержували з 115мг 2-фенілхроман-7-олу, застоJ=8,4Гц), 7,41 (д, 1H, J=2,0Гц), 7,33 (дд, 1Н, J=8,4, совуючи методику прикладу 1(b), описану для 2,0Гц), 7,02 (д, 1H, J=9,0Гц), 6,99-6,92 (м, 3Н), 5,39 одержання 5-нітро-2-(2-фенілхроман-6(дд, 1H, J=10,4, 2,2Гц), 3,06 (ддд, 1H, J=16,9, 11,9, ілокси)піридину. Продукт очищали препаративною 6,0Гц), 2,83 (ддд, 1H, J=16,9, 5,3, 2,7Гц), 2,34 (м, ТШХ (TLC) на пластинці, покритій силікагелем, з 1Н), 1,89 (м, 1Н). використанням як елюенту суміші толуПриклад 12: ол:етилацетат (15:1). 2-[2-(3-Хлорфеніл)хроман-6-ілокси]-51 H-ЯМР (400МГц, d6-ДМСО) δ: 9,04 (д, 1H, нітропіридин J=2,8Гц), 8,60 (дд, 1Н, J=9,1, 2,8Гц), 7,46-7,32 (м, а) 2-(3-Хлорфеніл)-6-гідроксихроман-4-он 5Н), 7,22 (д, 1H, J=9,1Гц), 7,20 (д, 1H, J=8,9Гц) 6,72 2-(3-Хлорфеніл)-6-гідроксихроман-4-он одер(дд, 1H, J=8,9, 2,3Гц), 6,72 (д, 1Н, J=2,3Гц), 5,16 жували з 2,0г 2',5'-дигідроксіацетофенону і 1,85г 3(дд, 1Н, J=10,1, 2,1Гц), 2,97 (ддд, 1H, J=16,7, 11,3, хлорбензальдегіду, застосовуючи методику прик5,9Гц), 2,77 (ддд, 1H, J=16,7, 8,1, 4,5Гц), 2,20 (м, ладу 9(а), описану для одержання 2-(31Н), 2,02 (м, 1H). фторфеніл)-6-гідроксихроман-4-ону. Продукт пеПриклад 11: рекристалізовували з оцтової кислоти. 1 2-[2-(2,4-Дихлорфеніл)хроман-6-ілокси]-5Н-ЯМР (400МГц, (d6-ДМСО) δ: 9,47 (с, 1H), нітропіридин 7,62 (с, 1Н), 7,51-7,45 (м, 3Н), 7,12 (д, 1Н, J=3,0Гц), а)2-(2,4-Дихлорфеніл)-6-гідроксихроман-4-он 7,05 (дд, 1H, J=8,8, 3,0Гц), 6,98 (д, 1H, J=8,8Гц), 2-(2,4-Дихлорфеніл)-6-гідроксихроман-4-он 5,58 (дд, 1Н, J=13,1, 2,9Гц), 3,18 (дд, 1H, J=16,9, одержували з 1,0г 2',5'-дигідроксіацетофенону і 13,1Гц), 2,81 (дд, 1H, J=16,9, 2,9Гц). 1,4г 2,4-дихлорбензальдегіду, застосовуючи метоb)2-(3-Хлорфеніл)хроман-4,6-діол дику прикладу 9(а), описану для одержання 2-(32-(3-Хлорфеніл)хроман-4,6-діол одержували з фторфеніл)-6-гідроксихроман-4-ону. Продукт пе730мг 2-(3-хлорфеніл)-6-гідроксихроман-4-ону, рекристалізовували з оцтової кислоти. застосовуючи методику прикладу 8(а), описану 1 H-ЯМР (400МГц, d6-ДМСО) δ: 9,49 (с, 1H), для одержання 2-фенілхроман-4,6-діолу. 7,78 (д, 1H, J=8,5Гц), 7,71 (д, 1Н, J=2,0Гц), 7,57 17 76168 18 Н-ЯМР (400МГц, d6-ДМСО) δ: 8,85 (с, 1H), 2,62 (ддд, 1Н, J=16,7, 8,9, 5,0Гц), 2,15 (м, 1H), 1,93 7,50 (д, 1H, J=1,7Гц), 7,46-7,38 (м, 3Н), 6,88 (д, 1H, (м, 1H). J=2,5Гц), 6,62 (д, 1Н, J=8,6Гц), 6,55 (дд, 1H, J=8,6, d) 2-[2-(3,5-Дифторфеніл)хроман-6-ілокси]-52,5Гц), 5,44 (д, 1H, J=6,6Гц), 5,15 (дд, 1Н, J=11,8, нітропіридин 1,4Гц), 4,87 (м, 1Н), 2,29 (м, 1H), 1,85 (м, 1H). 2-[2-(3,5-Дифторфеніл)хроман-6-ілокси]-5с) 2-(3-Хлорфеніл)хроман-6-ол нітропіридин одержували з 340мг 2-(3,52-(3-Хлорфеніл)хроман-6-ол одержували з дифторфеніл)хроман-6-олу, застосовуючи мето635мг 2-(3-хлорфеніл)хроман-4,6-діолу, застосодику прикладу 1(b), описану для одержання 5вуючи методику прикладу 9(с), описану для одернітро-2-(2-фенілхроман-6-ілокси)піридину. Продукт жання 2-(3-фторфеніл)хроман-6-олу. очищали препаративною ТШХ на пластинці, пок1 Н-ЯМР (300МГц, d6-ДМСО) δ: 8,79 (с, 1H), ритій силікагелем, з використанням як елюенту 7,48 (д, 1H, J=0,7Гц), 7,42-7,37 (м, 3Н), 6,71-6,49 суміші толуол-етилацетат і потім викристалізову(м, 3Н), 5,04 (м, 1H), 2,91 (м, 1H), 2,65 (м, 1H), 2,12 вали з 2-пропанолу. 1 (м, 1Н), 1,93 (м, 1H). H-ЯМР (400МГц, d6-ДМСО) δ: 9,04 (д, 1H, d) 2-[2-(3-Хлорфеніл)хроман-6-ілокси]-5J=2,9Гц), 8,60 (дд, 1H, J=9,1, 2,9Гц), 7,23-7,19 (м, нітропіридин 4Н), 7,01-6,95 (м, 3Н), 5,18 (дд, 1H, J=10,0, 2,1Гц), 2-[2-(3-Хлорфеніл)хроман-6-ілокси]-52,97 (ддд, 1H, J=16,9, 10,9, 5,7Гц), 2,76 (ддд, 1H, нітропіридин одержували з 590мг 2-(3J=16,9, 8,4, 4,7Гц), 2,22 (м, 1Н), 1,99 (м, 1H). хлорфеніл)хроман-6-олу, застосовуючи методику Приклад 14: прикладу 1(b), описану для одержання 5-нітро-22-[2-(2,5-Дифторфеніл)хроман-6-ілокси]-5(2-фенілхроман-6-ілокси)піридину. Продукт перекнітропіридин ристалізовували із суміші 2-пропанолу і етилацеа)2-(2,5-Дифторфеніл)-6-гідроксихроман-4-он тату (3:1). 2-(2,5-Дифторфеніл)-6-гідроксихроман-4-он 1 H-ЯМР (400МГц, CDCl3) δ: 9,04 (д, 1H, одержували з 3,0г 2',5'-дигідроксіацетофенону і J=2,9Гц), 8,60 (дд, 1Н, J=9,0, 2,9Гц), 7,53 (с, 1H), 2,57мл 2,5-дифторбензальдегіду, застосовуючи 7,46-7,42 (м, 3Н), 7,20 (д, 1H, J=9,0Гц), 7,00 (дд, методику прикладу 9(а), описану для одержання 21H, J=8,7, 2,7Гц), 6,97 (д, 1Н, J=2,7Гц), 6,94 (д, 1Н, (3-фторфеніл)-6-гідроксихроман-4-ону. Продукт J=8,7Гц), 5,18 (дд, 1Н, J=10,2, 2,2Гц), 2,97 (ддд, перекристалізовували з оцтової кислоти. 1 1H, J=17,0, 11,5, 5,9Гц), 2,83 (ддд, 1Н, J=17,0, 8,1, Н-ЯМР (300МГц, d6-ДМСО) δ: 9,46 (с, 1Н), 4,5Гц), 2,21 (м, 1H), 2,00 (м, 1H). 7,53 (м, 1H), 7,36-7,30 (м, 2Н), 7,14 (д, 1H, Приклад 13: J=3,0Гц), 7,05 (дд, 1H, J=8,8, 3,0Гц), 6,97 (д, 1H, 2-[2-(3,5-Дифторфеніл)хроман-6-ілокси]-5J=8,8Гц), 5,76 (дд, 1Н, J=13,6, 2,7Гц), 3,26 (дд, 1H, нітропіридин J=16,8, 13,6Гц), 2,76 (дд, 1H, J=16,8, 2,7Гц). а) 2-(3,5-Дифторфеніл)-6-гідроксихроман-4-он b)2-(2,5-Дифторфеніл)хроман-4,6-діол 2-(3,5-Дифторфеніл)-6-гідроксихроман-4-он 2-(2,5-Дифторфеніл)хроман-4,6-діол одержуодержували з 1,0г 2',5'-дигідроксіацетофенону і вали з 1,0г 2-(2,5-дифторфеніл)-6-гідроксихроман1,12г 3,5-дифторбензальдегіду, застосовуючи ме4-ону, застосовуючи методику прикладу 8(а), опитодику прикладу 9(а), описану для одержання 2-(3сану для одержання 2-фенілхроман-4,6-діолу. 1 фторфеніл)-6-гідроксихроман-4-ону. Продукт пеН-ЯМР (400МГц, d6-ДМСО) δ: 8,87 (с, 1H), рекристалізовували з оцтової кислоти. 7,39-7,22 (м, 3Н), 6,89 (д, 1Н, J=2,8Гц), 6,63 (д, 1H, 1 Н-ЯМР (400МГц, d6-ДМСО) δ: 9,47 (с, 1H), J=8,7Гц), 6,56 (дд, 1H, J=8,7, 2,8Гц), 5,50 (д, 1Н, 7,30-7,23 (м, 3Н), 7,12 (д, 1H, J-2,9Гц), 7,06 (дд, 1H, J=6,8Гц), 5,35 (д, 1H, J=11,2Гц), 4,89 (м, 1H), 2,28 J=8,8, 2,9Гц), 7,00 (д, 1H, J=8,8Гц), 5,60 (дд, 1H, (м, 1H), 1,95 (м, 1H). J=13,1, 2,8Гц), 3,15 (дд, 1H, J-16,8, 13,1Гц), 2,85 с) 2-(2,5-Дифторфеніл)хроман-6-ол (дд, 1Н, J=16,8, 2,8Гц). 2-(2,5-Дифторфеніл)хроман-6-ол одержували b)2-(3,5-Дифторфеніл)хроман-4,6-діол з 420мг 2-(2,5-дифторфеніл)хроман-4,6-діолу, за2-(3,5-Дифторфеніл)хроман-4,6-діол одержустосовуючи методику прикладу 9(с), описану для вали з 800мг 2-(3,5-дифторфеніл)-6одержання 2-(3-фторфеніл)хроман-6-олу. 1 гідроксихроман-4-ону, застосовуючи методику Н-ЯМР (300МГц, d6-ДМСО) δ: 8,82 (с, 1H), прикладу 8(а), описану для одержання 27,34-7,22 (м, 3Н), 6,71-6,51 (м, 3Н), 5,20 (м, 1H), фенілхроман-4,6-діолу. 2,93 (м, 1H), 2,68 (м, 1H), 2,11 (м, 1H), 1,98 (м, 1H). 1 Н-ЯМР (400МГц, (d6-ДМСО) δ: 8,87 (с, 1H), d) 2-[2-(2,5-Дифторфеніл)хроман-6-ілокси]-57,21-7,17 (м, 3Н), 6,88 (д, 1H, J=2,4Гц), 6,64 (д, 1H, нітропіридин J=8,7Гц), 6,55 (дд, 1Н, J=2,4, 8,7Гц), 5,47 (д, 1H, 2-[2-(2,5-Дифторфеніл)хроман-6-ілокси]-5J=7,0Гц), 5,17 (д, 1H, J=10,5Гц), 4,86 (м, 1Н), 2,32 нітропіридин одержували з 100мг 2-(2,5(м, 1H), 1,85(м, 1Н). дифторфеніл)хроман-6-олу, застосовуючи метос) 2-(3,5-Дифторфеніл)хроман-6-ол дику прикладу 1(b), описану для одержання 52-(3,5-Дифторфеніл) хроман-6-ол одержували нітро-2-(2-фенілхроман-6-ілокси)піридину. Продукт з 500мг 2-(3,5-дифторфеніл)хроман-4,6-діолу, заперекристалізовували з 2-пропанолу. 1 стосовуючи методику прикладу 9(с), описану для H-ЯМР (400МГц, CDCl3) δ: 9,07 (дд, 1H, J=2,8, одержання 2-(3-фторфеніл)хроман-6-олу. 0,4Гц), 8,47 (дд, 1H, J=9,1, 2.8Гц), 7,26 (м, 1H), 1 Н-ЯМР (300МГц, (d6-ДМСО) δ: 8,82 (с, 1H), 7,05-6,91 (м, 6Η), 5,35 (дд, 1H, J=10,3, 1,5Гц), 3,04 7,20-7,14 (м, ЗН), 6,68 (д, 1H, J=8,6Гц), 6,53 (д, 1H, (ддд, 1H, J=16,9, 11,7, 6,0Гц), 2,82 (ддд, 1H, J=2,9Гц), 6,50 (дд, 1H, J=8,6, 2,9Гц), 5,05 (дд, 1Н, J=16,9, 5,2, 3,0Гц), 2,29 (м, 1Н), 2,01 (м, 1H). J=9,8, 2,2Гц), 2,88 (ддд, 1Н, J=16,7, 10,8, 5,9Гц), 1 19 76168 20 Приклад 15: J=16,9, 13,0Гц), 2,75 (дд, 1H, J=16,9, 2,9Гц), 2,62 2-[2-(3-Бромфеніл)хроман-6-ілокси]-5(кв, 2Н, J=7,5Гц), 1,18 (т, 3Н, J=7,5Гц). нітропіридин b) 2-(4-Етилфеніл)хроман-4,6-діол a) 2-(3-Бромфеніл)-6-гідроксихроман-4-он 2-(4-Етилфеніл)хроман-4,6-діол одержували з 2-(3-Бромфеніл)-6-гідроксихроман-4-он одер474мг 2-(4-етилфеніл)-6-гідроксихроман-4-ону, жували з 3,0г 2',5'-дигідроксіацетофенону і 2,3мл застосовуючи методику, описану для одержання 3-бромбензальдегіду, застосовуючи методику при2-фенілхроман-4,6-діолу. 1 кладу 9(а), описану для одержання 2-(3Н-ЯМР (400МГц, d6-ДМСО) δ: 8,81 (с, 1Н), фторфеніл)-6-гідроксихроман-4-ону. Продукт пе7,34 (д, 2H, J=8,0Гц) 7,22 (д, 2Н, J=8,0Гц), 6,88 (д, рекристалізовували з оцтової кислоти. 1Н, J=2,8Гц), 6,57 (д, 1H, J=8,6Гц), 6,53 (дд, 1H, 1 Н-ЯМР (300МГц, d6-ДМСО) δ: 9,41 (с, 1H), J=8,6, 2,8Гц), 5,39 (д, 1H, J=7,1Гц), 5,06 (д, 1Н, 7,50 (м, 1H), 7,59-7,53 (м, 2Н), 7,39 (м, 1H), 7,12 (д, J=10,7Гц), 4,86 (м, 1H), 2,61 (кв, 2Н, J=7,6Гц), 2,29 1H, J=2,9Гц), 7,05 (дд, 1H, J=8,8, 2,9Гц), 6,98 (д, (м, 1H), 1,84 (м, 1Н), 1,19 (т, 3Н, J=1,6Гц). 1H, J=8,8Гц), 5,57 (дд, 1H, J=13,0, 2,9Гц), 3,12 (дд, c) 2-(4-Етилфеніл)хроман-6-ол 1Н, J=16,9, 13,0Гц), 2,81 (дд, 1H, J=16,9, 2,9Гц). 2-(4-Етилфеніл)хроман-6-ол одержували з b) 2-(3-Бромфеніл)хроман-4,6-діол 425мг 2-(4-етилфеніл)хроман-4,6-діолу, застосо2-(3-Бромфеніл)хроман-4,6-діол одержували з вуючи методику прикладу 9(с), описану для одер1,0г 2-(3-бромфеніл)-6-гідроксихроман-4-ону, зажання 2-(3-фторфеніл)хроман-6-олу. Продукт стосовуючи методику прикладу 8(а), описану для очищали з використанням як елюенту суміші геподержання 2-фенілхроман-4,6-діолу. тан-етилацетат (3:1). 1 1 Н-ЯМР (300МГц, d6-ДМСО) δ: 8,83 (с, 1H), Н-ЯМР (400МГц, CD3OD) δ: 7,26 (д, 2Н, 7,63 (м, 1H), 7,53 (м, 1H), 7,46 (м, 1H), 7,37 (м, 1Н), J=8,2Гц) 7,13 (д, 2Н, J=8,2Гц), 6,65 (д, 1H, 6,88 (д, 1Н, J=2,9Гц), 6,62 (д, 1Н, J=8,7Гц), 6,55 J=8,6Гц), 6,55 (дд, 1H, J=8,6, 2,8Гц), 6,51 (д, 1H, (дд, 1Н, J=8,7, 2,9Гц), 5,42 (д, 1Н, J=7,0Гц), 5,14 (д, J=2,8Гц), 4,83 (дд, 1H, J=10,1, 2,3Гц), 2,84 (м, 1H), 1H, J=10,5Гц), 4,86 (м, 1H), 2,29 (м, 1H), 1,84 (м, 2,62 (м, 1H), 2,59 (кв, 2Н, J=7,6Гц) 2,03 (м, 1Н), 1Н). 1,93 (м, 1H), 1,19(т, 3Н, J=7,6Гц). c) 2-(3-Бромфеніл)хроман-6-ол d) 2-[2-(4-Етилфеніл)хроман-6-ілокси]-52-(3-Бромфеніл)хроман-6-ол одержували з нітропіридин 700мг 2-(3-бромфеніл)хроман-4,6-діолу, застосо2-[2-(4-Етилфеніл)хроман-6-ілокси]-5вуючи методику прикладу 9(с), описану для одернітропіридин одержували з 205мг 2-(4жання 2-(3-фторфеніл)хроман-6-олу. етилфеніл)хроман-6-олу, застосовуючи методику 1 Н-ЯМР (400МГц, d6-ДМСО) δ: 8,81 (с, 1Н), прикладу 1(b), описану для одержання 5-нітро-27,61 (м, 1H), 7,51 (м, 1Н), 7,43 (м, 1H), 7,35 (м, 1Н), (2-фенілхроман-6-ілокси)піридину. Продукт перек6,67-6,48 (м, 3Н), 5,01 (м, 1H), 2,87 (м, 1H), 2,63 (м, ристалізовували з суміші 2-пропанолу і ацетону. 1 1Н), 2,12 (м, 1H), 1,92 (м, 1H). Н-ЯМР (400МГц, CDCl3) δ: 9,04 (д, 1H, d) 2-[2-(3-Бромфеніл)хроман-6-ілокси]-5J=2,8Гц), 8,60 (дд, 1Н, J=9,1, 2,8Гц), 7,36 (д, 2Н, нітропіридин J=8,1Гц) 7,24 (д, 2Н, J=8,1Гц), 7,20 (д, 1H, 2-[2-(3-Бромфеніл)хроман-6-ілокси]-5J=9,1Гц), 7,00 (д, 1H, J=2,7Гц), 6,96 (дд, 1H, J=8,8, нітропіридин одержували з 339мг 2-(32,7Гц), 6,89 (д, 1H, J=2,7Гц), 5,11 (дд, 1H, J=10,1, бромфеніл)хроман-6-олу, застосовуючи методику 2,2Гц), 2,98 (м, 1H), 2,75 (м, 1H), 2,62 (кв, 2Н, прикладу 1(b), описану для одержання 5-нітро-2J=7,5Гц), 2,16 (м, 1Н), 2,01 (м, 1H), 1,19(т, 3Н, (2-фенілхроман-6-ілокси)піридину. Продукт фільтJ=7,5Гц). рували через силікагель з використанням як елюПриклад 17: енту суміші толуол-етилацетат і потім кристалізу2-(3-Метил-2-фенілхроман-6-ілокси)-5вали з 2-пропанолу. нітропіридин 1 Н-ЯМР (400МГц, CDCl3) δ: 9,04 (д, 1H, Jа) 6-Гідрокси-3-метил-2-фенілхроман-4-он 2,9Гц), 8,60 (дд, 1H, J=9,2, 2,9Гц), 7,66 (уш.с, 1Н), 6-Гідрокси-3-метил-2-фенілхроман-4-он одер7,55 (м, 1Н), 7,48 (м, 1Η), 7,39 (м, 1Н), 7,20 (д, 1H, жували з 2,0г 2,5-дигідроксипропіофенону і 1,63мл J=9,2Гц), 7,01-6,93 (м, ЗН), 5,17 (дд, 1H, J=10,1, бензальдегіду, застосовуючи методику прикладу 2,2Гц), 2,97 (м, 1H), 2,72 (м, 1Н), 2,20 (м, 1H), 2,00 9(а), описану для одержання 2-(3-фторфеніл)-6(м, 1Н). гідроксихроман-4-ону. Продукт очищали колонкоПриклад 16: вою хроматографією з використанням як елюенту 2-[2-(4-Етилфеніл)хроман-6-ілокси]-5суміші гептан-етилацетат (3:1). 1 нітропіридин Н-ЯМР (300МГц, d6-ДМСО) δ: 9,37 (с, 1H), a) 2-(4-Етилфеніл)-6-гідроксихроман-4-он 7,53 (м, 2Н), 7,47-7,39 (м, 3Н), 7,13 (д, 1H J=3,1Гц), 2-(4-Етилфеніл)-6-гідроксихроман-4-он одер7,02 (дд, 1H, J=8,9, 3,1Гц), 6,89 (д, 1H, J=8,9Гц), жували з 1,0г 2',5'-дигідроксіацетофенону і 0,8мл 5,17 (д, 1H, J=12,3Гц), 3,18 (дкв, 1H, J=12,3, 6,9Гц), 4-етилбензальдегіду, застосовуючи методику при0,84 (д, 3Н, J-6,9Гц). кладу 9(а), описану для одержання 2-(3b) 3-Метил-2-фенілхроман-4,6-діол фторфеніл)-6-гідроксихроман-4-ону. Продукт пе3-Метил-2-фенілхроман-4,6-діол одержували з рекристалізовували з оцтової кислоти. 474мг 6-гідрокси-3-метил-2-фенілхроман-4-ону, 1 H-ЯМР (400МГц, (d6-ДМСО) δ: 7,43 (д, 2Н, застосовуючи методику прикладу 8(а), описану J=8,1Гц), 7,25 (д, 2Н, J=8,1Гц), 7,11 (д, 1H, для одержання 2-фенілхроман-4,6-діолу. 1 J=3,1Гц), 7,03 (дд, 1Н, J=8,9, 3,1Гц), 6,93 (д, 1Н, JН-ЯМР (300МГц, (d6-ДМСО) δ: 8,79 (с, 1Н), 8,9Гц), 5,51 (дд, 1H, J=13,0, 2,9Гц), 3,15 (дд, 1H, 7,42-7,33 (м, 5Н), 6,88 (у1H.с, 1H), 6,53 (м, 2Н), 21 76168 22 5,37 (д, 1H, J=8,0Гц), 4,70 (д, 1Н, J=10,6Гц), 1,94 1H, J=2,9Гц), 6,60 (д, 1H, J=8,7Гц), 6,54 (дд, 1H, (м, 1Н), 0,73 (д, 3Н, J=6,7Гц). J=8,7, 2,8Гц), 5,46 (д, 1H, J=6,9Гц), 5,35 (д, 1H, c) 3-Метил-2-фенілхроман-6-ол J=10,6Гц), 4,89 (м, 1H), 2,26 (м, 1Н), 1,98 (м, 1H). 3-Метил-2-фенілхроман-6-ол одержували з c) 2-(2-Фторфеніл)хроман-6-ол 605мг 3-метил-2-фенілхроман-4,6-діолу, застосо2-(2-Фторфеніл)хроман-6-ол одержували з вуючи методику прикладу 9(с), описану для одер800мг 2-(2-фторфеніл)хроман-4,6-діолу, застосожання 2-(3-фторфеніл)хроман-6-олу. вуючи методику прикладу 9(с), описану для одер1 Н-ЯМР (400МГц, CD3OD) δ: 8,77 (с, 1H), 7,41жання 2-(3-фторфеніл)хроман-6-олу. 1 7,33 (м, 5Н), 6,59-6,48 (м, 3Н), 4,56 (д, 1Н, Н-ЯМР (300МГц, d6-ДМСО) δ: 7,50 (м, 1H), J=9,2Гц), 2,73 (дд, 1Н, J=16,5, 5,0Гц), 2,54 (дд, 1H, 7,39 (м, 1Н), 7,26-7,19 (м, 2Н), 6,63 (м, 1H), 6,53J=16,5, 5,8Гц), 2,11 (м, 1H), 0,72 (д, 3Н, J=6,6Гц). 6,50 (м, 2Н), 5,21 (дд, 1H, J=10,2+5 2,3Гц), 2,98 d) 2-(3-Метил-2-фенілхроман-6-ілокси)-5(ддд, 1H, J=16,9, 11,2, 6,0Гц), 2,66 (ддд, 1H, нітропіридин J=16,9, 5,0, 2,9Гц) 2,11 (м, 1H), 1,99 (м, 1Н). 2-(3-Метил-2-фенілхроман-6-ілокси)-5d)2-[2-(2-Фторфеніл)хроман-6-ілокси]-5нітропіридин одержували з 600мг 3-метил-2нітропіридин фенілхроман-6-олу, застосовуючи методику прик2-[2-(2-Фторфеніл)хроман-6-ілокси]-5ладу 1(b), описану для одержання 5-нітро-2-(2нітропіридин одержували з 390мг 2-(2фенілхроман-6-ілокси)піридину. Продукт очищали фторфеніл)хроман-6-олу, застосовуючи методику колонковою хроматографією з використанням як прикладу 1(b), описану для одержання 5-нітро-2елюенту суміші гептан-2-пропанол (20:1). (2-фенілхроман-6-ілокси)піридину. Продукт очи1 H-ЯМР (400МГц, d6-ДМСО) δ: 9,04 (д, 1H, щали колонковою хроматографією з використанJ=2,8Гц), 8,59 (дд, 1H, J=9,1, 2,8Гц), 7,43-7,36 (м, ням як елюенту суміші гептан-етилацетат (4:1). 1 5Н), 7,19 (д, 1H, J=9,1Гц), 7,00 (д, 1Н, J=2,6Гц), Н-ЯМР (400МГц, CDCl3) δ: 9,04 (д, 1H, 6,95 (дд, 1H, J=8,7, 2,6Гц), 6,86 (д, 1H, J=8,7Гц), J=2,8Гц), 8,60 (дд, 1H, 3=9,1, 2,8Гц), 7,56 (м, 1H), 4,73 (д, 1Н, J=9,3,Гц), 2,85 (дд, 1H, J=16,7, 5,0Гц), 7,43 (м, 1H), 7,30-7,22 (м, 2Н), 7,20 (д, 1H, 2,64 (дд, 1H, J=16,5, 10,9Гц), 2,18 (м, 1H), 0,77 (д, J=9,1Гц), 7,02 (д, 1H, J=2,8Гц), 6,98 (дд, 1H, J=8,7, 3Н, J=6,7Гц). 2,8Гц), 6,91 (д, 1Н, J=8,7Гц), 5,37 (дд, 1H, J=10,4, Приклад 18: 2,3Гц), 3,04 (ддд, 1H, J=17,0, 11,5, 6,0Гц), 2,82 3-Метил-6-(5-нітропіридин-2-ілокси)-2(ддд, 1H, J=17,0, 5,1, 2,8Гц) 2,18 (м, 1Н), 2,08 (м, фенілхроман-4-он 1H). 3-Метил-6-(5-нітропіридин-2-ілокси)-2Приклад 20: фенілхроман-4-он одержували з 200мг 6-гідрокси2-(2,3-Дигідро-2-фенілбензо[1,4]діоксин-63-метил-2-фенілхроман-4-ону, застосовуючи меілокси)-5-нітропіридин тодику прикладу 1(b), описану для одержання 5a) 1-[2,5-Біс(бензилокси)феніл]етанон нітро-2-(2-фенілхроман-6-ілокси)піридину. Продукт Суміш 1-(2,5-дигідроксифеніл)етанону (3,16г), очищали колонковою хроматографією з викорисбензилхлориду (7,04г), карбонату калію (12,4г) і танням як елюенту суміші гептан-етилацетат (2:1) і 18-краун-6 (30мг) у 2-бутаноні (50мл) кип'ятилизі потім кристалізували з суміші 2-пропанолу і ацезворотним холодильником протягом 5 годин. Після тону. охолоджування відфільтровували осад. Фільтрат 1 H-ЯМР (400МГц, d6-ДМСО) δ: 9,03 (д, 1H, випарювали досуха при зниженому тиску і до ньоJ=2,9Гц), 8,64 (дд, 1H, J=9,1, 2,9Гц), 7,59-7,56 (м, го додавали простий ефір (50мл). Розчин проми3Н), 7,50-7,32 (м, 4Н), 7,30 (д, 1H, J=9,1Гц), 7,18 (д, вали двічі розбавленим розчином гідроксиду на1H, J=8,9Гц), 5,38 (д, 1Н, J=12,5Гц), 3,36 (дд, 1H, трію, двічі розбавленою хлористоводневою J=12,5, 6,9Гц), 0,86 (д, 3Н, J=6,9Гц). кислотою, сушили над сульфатом натрію і випаПриклад 19: рювали по суті досуха при зниженому тиску. За2-[2-(2-Фторфеніл)хроман-6-ілокси]-5лишок розтирали у холодному н-гептані (30мл) і нітропіридин осад відфільтровували фільтрацією під розріа)2-(2-Фторфеніл)-6-гідроксихроман-4-он дженням з одержанням після сушіння 2,85г 1-[2,52-(2-Фторфеніл)-6-гідроксихроман-4-он одербіс(бензилокси)феніл]етанону. 1 жували з 2,0г 2',5'-дигідроксіацетофенону і 1,4мл Н-ЯМР (400МГц, ДМСО-(d6) δ=2,50 (с, 3Н), 2-фторбензальдегіду, застосовуючи методику при5,08 (с, 2Н), 5,18 (с, 2Н), 7,20-7,50 (м, 13Н). кладу 9(а), описану для одержання 2-(3b) 2,5-біс(бензилокси)феніловий ефір оцтової фторфеніл)-6-гідроксихроман-4-ону. Продукт пекислоти рекристалізовували з оцтової кислоти. Розчин 1-[2,5-біс(бензилокси)феніл]етанону 1 H-ЯМР (400МГц, d6-ДМСО) δ: 9,45 (с, 1H), (2,25г) і 40% пероцтової кислоти (1,63мл) в оцтовій 7,67 (м, 1H), 7,47 (м, 1H), 7,32-7,25 (м, 2Н), 7,14 (д, кислоті (5,4мл) перемішували при 60°С протягом 1 1Н, J=3,0Гц), 7,04 (дд, 1H, J=8,9, 3,0Гц), 6,95 (д, години. Після охолоджування до кімнатної темпе1H, J=8,9Гц), 5,77 (дд, 1H, J=13,5, 2,8Гц), 3,26 (дд, ратури осаджений продукт збирали фільтрацією, 1H, J=16,9, 13,5Гц), 2,76 (дд, 1Н, J=16,9, 2,8Гц). промивали холодним простим ефіром і сушили b) 2-(2-Фторфеніл)хроман-4,6-діол при зниженому тиску. 2,52-(2-Фторфеніл)хроман-4,6-діол одержували з Біс(бензилокси)феніловий ефір оцтової кислоти 1,19г 2-(2-фторфеніл)-6-гідроксихроман-4-ону, перекристалізовували з 2-пропанолу. Вихід склазастосовуючи методику прикладу 8(а), описану дав 1,87г. 1 для одержання 2-фенілхроман-4,6-діолу. Н-ЯМР (ДМСО-(d6) δ=2,23 (с, 1H), 5,03 (с, 2Н), 1 Н-ЯМР (400МГц, (d6-ДМСО) δ: 8,85 (с, 1Н), 5,05 (с, 2Н), 6,84-7,44 (м, 13Н). 7,56 (м, 1Н), 7,40 (м, 1H), 7,28-7,21 (м, 2Н), 6,89 (д, c) 2,5-Біс(бензилокси)фенол 23 76168 24 Розчин 2,5-біс(бензилокси)фенілового ефіру Залишок очищали колонковою хроматографією на оцтової кислоти (1,85г) і 5М розчину гідроксиду силікагелі (толуол/етилацетат/оцтова кислонатрію (10,6мл) в етанолі (11мл) кип'ятили зі звота=8:1:1). Вихід 2,3-дигідро-2-фенілротним холодильником протягом 6,5 годин. Після бензо[1,4]діоксин-6-олу складав 0,5г. 1 випарювання етанолу при зниженому тиску прозоН-ЯМР (ДМСО-d6) δ=4,02 (дд, J=8,5, 11,4Гц, рий розчин підкислювали розбавленою хлористо1H), 4,35 (дд, J=2,3, 11,4Гц, 1H), 5,11 (дд, J=8,5, водневою кислотою. Осаджений продукт збирали 2,3Гц, 1H), 6,29 (дд, J=2,8, 8,5Гц, 1H), 6,32 (д, фільтрацією, промивали холодною водою і сушили J=2,8Гц, 1H), 6,75 (д, J=8,5Гц, 1H), 7,36-7,47 (м, при зниженому тиску. Вихід складав 0,56г. 5Н), 8,99 (с, 1H). 1 Н-ЯМР (ДМСО-d6) δ=4,97 (с, 2Н), 5,01 (с, 2Н), h) 2-(2,3-Дигідро-2-фенілбензо[1,4]діоксин-66,34 (дд, J=3,1, 8,8Гц, 1H), 6,49 (д, J=3,1Гц, 1H), ілокси)-5-нітропіридин 6,85 (д, J=8,8Гц, 1H), 7,28-7,46 (м, 10Н), 9,1 (уш.с, Розчин 2,3-дигідро-2-фенілбензо[1,4]діоксин-61Н). олу (80мг), 2-хлор-5-нітропіридину (56мг) і карбоd)2-[2,5-Біс(бензилокси)фенокси]-1нату калію (52мг) у диметилформаміді (1,0мл) пефенілетанон ремішували при 120°С протягом 2 годин. Після Суміш 2,5-біс(бензилокси)фенолу (0,28г), 2охолоджування суміші додавали воду (10мл) і бромацетофенону (0,22г), кислого карбонату калію осаджений продукт фільтрували, промивали во(0,25г) і 18-краун-6 (3мг) в ацетонітрилі (4,2мл) дою і 2-пропанолом і сушили при зниженому тиску. перемішували при 22°С протягом одного тижня. Вихід складав 60мг і т.пл. 163-170°С. 1 Суміш фільтрували і випарювали досуха при зниН-ЯМР (ДМСО-(d6) δ=4,16 (дд, J=8,5, 11,6Гц, женому тиску. Залишок розтирали у суміші просто1Н), 4,47 (дд, J=11,6, 2,6Гц, 1Н), 5,28 (дд, J=2,6, го ефіру (8,2мл) і води (1,4мл) при температурі 8,5Гц, 1H), 6,75 (дд, J=2,6, 8,8Гц, 1H), 6,88 (д, бані з льодом. Продукт збирали фільтрацією, проJ=2,6Гц, 1H), 7,05 (д, J=8,8Гц, 1H), 7,21 (д, J=9,1Гц, мивали холодним простим ефіром і сушили при 1H), 7,39-7,52 (м, 5Н), 8,60 (дд, J=2,8, 9,1Гц, 1H), зниженому тиску. Вихід складав 0,14г. 9,05 (д, J=2,8Гц, 1Н). 1 Н-ЯМР (ДМСО-(d6) δ=4,98 (с, 2Н), 5,06 (с, 2Н), Приклад 21: 5,58 (с, 2Н), 6,51 (дд, J=8,9, 2,3Гц, 1H), 6,68 (д, 2-(2,3-Дигідро-2-фенілбензо[1,4]діоксин-6J=2,3Гц, 1H), 6,94 (д, J=8,9Гц, 1H), 7,28-8,03 (м, ілокси)-3-нітропіридин 15Н). 2-(2,3-Дигідро-2-фенілбензо[1,4]діоксин-6e) 2-[2,5-Біс(бензилокси)фенокси]-1ілокси)-3-нітропіридин одержували з 2,3-дигідро-2фенілетанол фенілбензо[1,4]діоксин-6-олу (80мг) і 2-хлор-3До розчину 2-[2,5-біс(бензилокси)фенокси]-1нітропіридину (56мг) таким же способом, як і вкафенілетанону (0,14г) у метанолі (0,5мл) і тетрагідзаний вище 2-(2,3-дигідро-2рофурані (1,9мл) додавали при 0°С боргідрид нафенілбензо[1,4]діоксин-6-ілокси)-5-нітропіридин. трію (6,5мл). Реакційну суміш перемішували 15хв. Вихід складав 30мг і т.пл.
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds being drastic inhibitors of na+/ca+2 exchange mechanism in treatment of arrhythmia
Автори англійськоюKoskelainen Tuula, Karjalainen Arto, Rasku Sirpa, Nore Pennti
Назва патенту російськоюСоединения, которые явяются сильнодействующими ингибиторами механизма обмена na+/ca+2 при лечении аритмии
Автори російськоюКоскелайнен Туула, Карьялайнен Арто, Раску Сирпа, Норе Пентти
МПК / Мітки
МПК: C07D 311/06
Мітки: інгібіторами, обміну, сильнодіючими, механізму, сполуки, аритмії, лікуванні
Код посилання
<a href="https://ua.patents.su/31-76168-spoluki-shho-eh-silnodiyuchimi-ingibitorami-mekhanizmu-obminu-na-ca2-pri-likuvanni-aritmi.html" target="_blank" rel="follow" title="База патентів України">Сполуки, що є сильнодіючими інгібіторами механізму обміну na+/ca+2 при лікуванні аритмії</a>
Попередній патент: П’єзоелектричний двигун
Наступний патент: Апарат і спосіб завантаження контейнерів гранульованим або порошкоподібним матеріалом
Випадковий патент: Спосіб двухстадійного пакетировання компонентів металовідходів












