Гербіцидна композиція
Номер патенту: 78071
Опубліковано: 15.02.2007
Автори: Фуджінамі Макото, Ямаджі Яшіхіро, Такахаші Сатору
Формула / Реферат
1. Гербіцидна композиція, що містить
і) ізоксазолінову похідну, представлену загальною формулою (І) і
іі) щонайменше одну сполуку, вибрану з групи А,
де
і) формула (І)
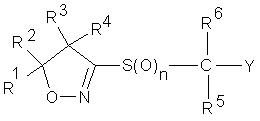 , (I)
, (I)
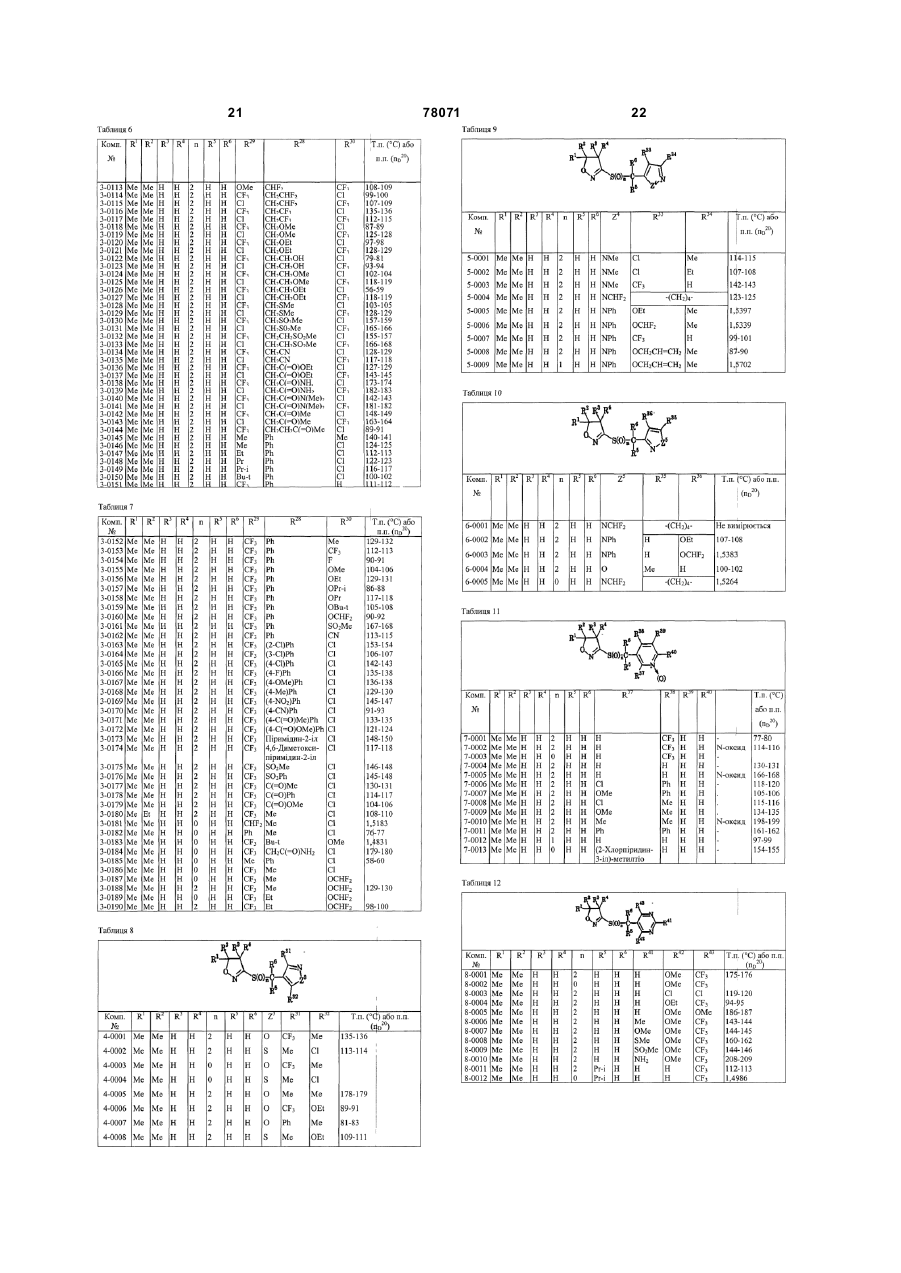
де R1 і R2 - метил;
R3, R4, R5 і R6 - водень;
Y - тієнільна група, піразолільна група, ізоксазолільна група, ізотіазолільна група або піримідинільна група;
Y може бути заміщена 2 або 3 однаковими або різними групами, вибраними з заміщувальної групи α;
n-2;
заміщувальна група α - хлор, метил, етил, 1-метоксііміноетил, трифторметил, дифторметил, метокси, етокси, дифторметокси, циклопентилокси, етансульфоніл, феніл, 2-хлорфенокси, ціано і N,N-диметиламінo; і
іі) група А - атразин і ціаназин.
2. Гербіцидна композиція за пунктом 1, відповідно до якого Y - тіофен-3-ільна група, піразол-4-ільна група, піразол-5-ільна група, ізоксазол-4-ільна група, ізотіазол-4-ільна група або піримідин-5-ільна група.
3. Гербіцидна композиція за пунктом 1, відповідно до якого Y - 2,5-диметил-4-(1-метоксііміноетил)тіофен-3-ільна група.
4. Гербіцидна композиція за пунктом 1, відповідно до якого Y-
5-хлор-1-феніл-3-трифторметилпіразол-4-ільна група,
5-етилсульфоніл-1-феніл-3-трифторметилпіразол-4-ільна група,
5-(N,N-диметиламіно)-1-феніл-3-трифторметилпіразол-4-ільна група,
5-хлор-1-дифторметил-3-трифторметилпіразол-4-ільна група,
3-хлор-1-дифторметил-5-трифторметилпіразол-4-ільна група,
3-етокси-1-метил-5-трифторметилпіразол-4-ільна група,
5-метокси-1-метил-3-трифторметилпіразол-4-ільна група,
5-(2-хлорфенокси)-1-метил-3-трифторметилпіразол-4-ільна група,
5-циклопентилокси-1-метил-3-трифторметилпіразол-4-ільна група,
5-ціано-1-метил-3-трифторметилпіразол-4-ільна група,
3,5-дихлор-1-етилпіразол-4-ільна група,
5-хлор-3-дифторметил-1-метилпіразол-4-ільна група,
5-хлор-1-метил-З-трифторметилпіразол-4-ільна група,
5-дифторметокси-1-метил-3-трифторметилпіразол-4-ільна група,
5-дифторметокси-1-етил-3-трифторметилпіразол-4-ільна група.
5. Гербіцидна композиція за пунктом 1, відповідно до якого Y - 5-метил-3-трифторметилізоксазол-4-ільна група.
6. Гербіцидна композиція за пунктом 1, відповідно до якого Y - 5-хлор-3-триметилізотіазол-4-ільна група.
7. Гербіцидна композиція за пунктом 1, відповідно до якого Y - 2-метокси-4-трифторметилпіримідин-5-ільна група.
8. Гербіцидна композиція за будь-яким з пунктів 1 і 7, відповідно до якого щонайменше одна сполука іі) групи А міститься в кількості від 0,001 до 100 масових частин на одну масову частину ізоксазолінової похідної і), представленої формулою (І).
9. Гербіцидна композиція за будь-яким з пунктів 1 і 8, що містить і) ізоксазолінову похідну формули (І) і іі) щонайменше одну сполуку групи А в загальній кількості від 0,5 до 90% мас. як агрохімічний продукт.
Текст
1. Гербіцидна композиція, що містить і) ізоксазолінову похідну, представлену загальною формулою (І) і іі) щонайменше одну сполуку, вибрану з групи А, де і) формула (І) C2 2 (19) 1 3 78071 4 8. Гербіцидна композиція за будь-яким з пунктів 1 і 9. Гербіцидна композиція за будь-яким з пунктів 1 і 7, відповідно до якого щонайменше одна сполука 8, що містить і) ізоксазолінову похідну формули (І) іі) групи А міститься в кількості від 0,001 до 100 і іі) щонайменше одну сполуку групи А в загальній масових частин на одну масову частину ізоксазокількості від 0,5 до 90% мас. як агрохімічний пролінової похідної і), представленої формулою (І). дукт. Даний винахід відноситься до гербіцидної композиції. У результаті тривалих досліджень і розробок були створені і знайшли практичне застосування різні види різних агрохімічних засобів, і ці гербіциди сприяють підвищенню врожайності сільськогосподарських культур або дозволяють зменшити трудозатрати при видаленні бур'янів. Однак навіть у даний час існує потреба у розробці нового агрохімічного засобу, який мав би більші задовільні гербіцидні властивості. Таким чином, існує потреба створити гербіцидний засіб, використовуваний для корисних сільськогосподарських культур, який забезпечував би задовільний гербіцидний ефект при малих дозах застосування і характеризувався би чудовою вибірковістю між цільовими сільськогосподарськими культурами і і бур'янами шляхом його нанесення на поверхню ґрунту або листя рослин. Ізоксазолінова сполука формули (І), яка є одним з активних інгредієнтів у гербіцидній композиції, запропонованій відповідно до даного винаходу, безпечна для рису, пшениці, ячменя, кукурудзи, сорго, сої, бавовни, цукроврго буряка, трав'яного покриву, фр уктових дерев тощо і, взята окремо, володіє чудовою гербіцидною дією. Авторами даного винаходу було встановлено, що в результаті об'єднання ізоксазолінової похідної формули (І) з, щонайменше, одним гербіцидом групи А при заданому співвідношенні компонентів може бути досягнутий не тільки простий загальний гербіцидний ефект, але і синергетичний гербіцидний ефект. Таким чином, шляхом об'єднання, щонайменше, двох агрохімічних засобів діапазон гербіцидної дії розширюється в порівнянні з діапазоном застосування! кожного з цих гербіцидних засобів окремо, а саме гербіцидний ефект досягається на ранній стадії і зберігається протягом тривалого проміжку часу, причому задовільний гербіцидний ефект може бути досягнутий при менших дозах внесення, чим це потрібно при внесенні кожного з цих засобів окремо. Крім того, гербіцидна композиція, приготовлена шляхом об'єднання, щонайменше, двох агірохімічних засобів, є безпечною для рису, пшениці, ячменя, кукурудзи, сорго, сої, бавовни, цукрового буряка, трав'яного покриву, фр уктових дерев тощо і дозволяє досягти задовільного гербіцидного ефекту в результаті однократної обробки. Даний винахід створений на основі саме цього відкриття. Даний винахід характеризується наявністю наданих нижче ознак. 1. Гербіцидна композиція, що містить і) ізоксазолінову похідну, представлену наданою нижче загальною формулою (І), або її сіль і іі), щонайменше, одну сполуку, вибрану з наданої нижче групи А: і) формула (І) де R1 і R2 - відповідно незалежно один від іншого атом водню, алкільна група С1-С10, циклоалкільна група С3-С8 або алкільна група С1-С3, заміщена циклоалкільною групою С3-С8; або R1 і R2 можуть бути зв'язані один з іншим з утворенням спірокільця С3-С7 разом з атомами вуглецю, з якими вони зв'язані; R3 і R4 - відповідно незалежно один від іншого атом водню, алкільна група С1-С10 або циклоалкільна група С3-С8; або R3 і R4 можуть бути зв'язані один з іншим з утворенням спірокільця С3-С7 разом з атомами вуглецю, з якими вони зв'язані, або R1, R2, R3 і R4 можуть утворювати 5-8-членне кільце разом з атомами вуглецю, з якими вони зв'язані; R5 і R6 - відповідно незалежно один від іншого атом водню або алкільна група С1-С10; Υ - 5-6-членна гетероциклічна група ароматичного ряду або конденсована гетероциклічна група ароматичного ряду, що має один або більше гетероатомів, вибраних з атома азоту, атома кисню й атома сірки; гетероциклічна група може бути заміщена від 0 до 6 однаковими або різними групами, вибраними з наданої нижче заміщувальної групи a; коли гетероциклічна група заміщена в двох суміжних положеннях двома алкільними групами, двома алкоксильниміи групами, алкільною групою й алкоксильною групою, алкільною групою й алкілтіогрупою, алкільною групою й алкілсульфонільною групою, алкільною групою і моноалкіламіногрупою або алкільною групою і діалкіламіногрупою, усі з яких вибрані з заміщувальної групи a, дві групи можуть утворювати разом з атомами, з якими вони зв'язані, 5-8-членне кільце, яке може бути заміщене 1-4 атомами галогену; гетероатом гетероциклічної групи, коли він є атомом азоту, може бути окислений з утворенням N-оксиду; n - ціле число від 0 до 2; (Заміщувальна група a) Гідроксильна група; тіольна група; атоми галогену; алкільні гру(пи С1-С10; кожна з алкільних груп С1-С10 монозаміщена групою, вибраною з наданої нижче заміщувальної групи b; галогеналкільні групи С1-С4; циклоалкільні гр|упи С3-С8; алкоксильні групи С1-С10; кожна з алкоксильних груп С1-С10 монозаміщена групою, вибраною з наданої нижче заміщувальної групи g; галогенал 5 78071 6 коксильні групи С1-С4; циклоалкілоксильні групи налкілсульфонільних груп С1-С4); карбамоїльна С3-С8; алкілоксильні груіпи С1-С3, заміщені цикгрупа (її атом азоту може бути заміщений однаколоалкільними групами С3-С8; алкілтіогрупи С1вими або різними алкільними групами С1-С10); С10; кожна з алкілтіогруп С1-С10 монозаміщена ацильні групи С1-С6; галогенал кіл карбонільні групи С1-С4; алкоксііміної групи С1-С10; ціаногругрупою, вибраною із заміщувальної групи g; галопа; необов'язково заміщена фенільна група; і негеналкілтіогрупи С1-С4; алкенильні групи С2-С6; обов'язково заміщена феноксильна група; алкенілоксильні групи С2-С6; алкінільні групи С2С6; алкінілоксильні групи С2-С6; алкілсульфінільні (3аміщувальна група g) групи С1-С10; кожна з алкілсульфінільних груп С1Алкоксикарбонільні групи С1-С10; необов'язС10 монозаміщена групою, вибраною із заміщуваково заміщена фенільна група; необов'язково заміщені гетероциклічні групи ароматичного ряду; льної групи g; алкілсульфонільні групи С1-С10; ціаногрупа; і карбамоїльна група (її атом азоту кожна з алкілсульфонільних груп С1-С10 монозаможе бути заміщений однаковими aбo різними міщена групою, вибраною із заміщувальної групи алкільними групами С1-С10); і g; галогеналкілсульфінільні групи ; С1-С4; алкіл іі) група А сульфонілоксильні групи С1-С10, кожна з яких атразин, симазин, ціаназин, ізоксафлутол, мемонозаміщена групою, вибраною із заміщувальної зотріон, флуметсулам, імазетапір, імазапір, дикагрупи g; галогеналкілсульфонільні групи С1-С4; мба, клопіралід, просульфурон, галогенсульфуалкілсульфонілоксильні групи С1-С10, галогеналрон-метил, римсульфурон, бентазон, кілсульфонілоксильні групи С1-С4; необов'язково карфентразон-етил, метрибузин, тифенсульфузаміщена фенільна група; необов'язково заміщена рон-метил, нікосульфурон, примісульфурон, клофеноксильна група; необов'язково заміщена фенірансулам-метил, глуфосинат, гліфосат, гліфосатлтіогрупа; необов'язково заміщені гетероциклічні тримезіум, пендиметалін, лінурон, прометрин, дигрупи ароматичного ряду; необов'язково заміщені флуфенікан, флуміоксазин і метолахлор. гетероциклічні оксильні групи ароматичного ряду; 2. Гербіцидна композиція за ознакою 1, відпонеобов'язково заміщені гетероциклічні тіогрупи відно до якої ізоксазолінова похідна формули (І) ароматичного ряду; необов'язково заміщені феніабо її сіль має замісник, вибраний із заміщувальлсульфінільні групи; необов'язково заміщені феніної групи a у гетероциклі, що може бути заміщений лсульфонільні групи; необов'язково заміщені гетевід 0 до 6 однаковими або різними групами, які роциклічні сульфонільні групи ароматичного ряду; включають гідроксильну групу; атоми галогену; необов'язково заміщені фенілсульфонілоксильні алкільні групи С1-С10; кожна з алкільних груп С1групи; ацильні групи; галогеналкілкарбонільні груС10 монозаміщена групою, вибраною із заміщувапи С1-С4; необов'язково заміщена бензилкарбонільної групи b; галогеналкільні групи С1-С4; циклольна група; необов'язково заміщена бензоїльна алкільні групи С3-С8; алкоксильні групи С1-С10; група; карбоксильна група, алкоксикарбонільні кожна з алкоксильних гр уп С1-С10 монозаміщена групи С1-С10; необов'язково заміщена бензилоксикарбонільна група; необов'язкової заміщена фегрупою, вибраною із заміщувальної групи g; галоноксикарбонільна група; ціаногрупа; карбамоїльна геналкоксильні групи С1-С4; циклоалкілоксильні група (її атом азоту може бути заміщений однакогрупи С3-С8; алкілоксильні групи С1-С3, заміщені вими або різними групами, вибраними з алкільних циклоалкільними групами С3-С8; алкілтіогрупи С1груп С1-С10 і необов'язково заміщеної фенільної С10; кожна з алкілтіогруп С1-С10 монозаміщена групи); ацилоксильні групи С1-С6, галогеналкілкагрупою, вибраною із заміщувальної групи g; галорбонілоксильні групи С1-С4; необов'язково замігеналкілтіогрупи С1-С4; алкенільні групи С2-С6; щена бензилкарбонілоксильна група; необов'язкоалкенілоксильні групи С2-С6; алкінільні групи С2во заміщена бензоїлоксильна група; нітрогрупа; і С6; алкінілоксильні групи С2-С6; алкілсульфонільаміногрупа (її атом азоту може бути заміщений ні групи С1-С10; галогеналкілсульфонільні групи однаковими або різними групами, вибраними з С1-С4; необов'язково заміщену фенільну гр упу; алкільних гр уп С1-С10, необов'язково заміщеної необов'язково заміщену феноксильну груп у; нефенільної групи, ацильних груп С1-С6, галогеналобов'язково заміщену фенілтіогруп у; необов'язкокілкарбонільних груп С1-С4, необов'язково заміво заміщені гетероциклічні групи ароматичного щеної бензилкарбонільної групи, необов'язково і ряду; необов'язково заміщені гетероциклічні оксизаміщеної бензоїльної групи, алкіл сульфонільної льні групи ароматичного ряду; необов'язково загрупи С1-С10, галогеналкілсульфонільних груп С1міщені гетероциклічні тіогрупи ароматичного ряду; С4, необов'язково заміщеної бензилсульфонільної необов'язково заміщені фенілсульфонільні групи; групи і нео|бов'язково заміщеної феніл сульфонінеобов'язково заміщені гетероциклічні сульфонільної групи); льні групи ароматичного ряду; ацильні групи С1С6; галогеналкілкарбонільні групи С1-С4; необо(Заміщувальна група b) Гідроксильна група; циклоалкільні групи С3-С8 в'язково заміщену бензилкарбонільну груп у; не(які можуть бути заміщені атомом галогену або обов'язково заміщену бензоїльну груп у; карбоксиалкільною групою); алкоксильні групи С1-С10; алльну груп у, алкоксикарбонільні групи С1-С10; кілтіогругіи С1-С10; алкілсульфонільні групи С1ціаногруппу; карбамоїльну гр упу (її а том азоту моС10; алкоксикарбонільні групи С1-С10; галогеналже бути заміщений однаковими або різними грукенільні групи С2-С6; аміногрупа (її атом азоту пами, вибраними з алкільних гр уп С1-С10 і необоможе бути заміщений однаковими або різними в'язково заміщеної фенільної групи); нітрогрупу; і групами, вибраними з алкільних груп C1-C10 ациаміногрупу (її атом азоту може бути заміщений льних груп С1-С6; галогеналкілкарбонільних груп однаковими або різними групами, вибраними з С1-С4, алкілсульфонільних груп С1-С10 і галогеалкільних груп С1-С10, необов'язкової заміщеної 7 78071 8 фенільної групи, ацильних груп С1-С6, галогеналатомом водню, алкільною групою С1-С10; алкількілкарбонільних груп С1-С4, необов'язково заміною групою С1-С10, яка монозаміщена групою, щеної бензилкарбонільної групи, необов'язково вибраною з заміщувальної групи b, галогеналкільзаміщеної бензоїльної групи, алкілсульфонільних ною групою С1-С4; циклоалкільною групою С3-С8; груп С1-С10, галогеналкілсульфонільних груп С1алкенільною групою С2-С6; алкінільною групою С4, необов'язково заміщеної бензилсульфонільної С2-С6; алкілсульфінільною групою С1-С10; алкілгрупи і необов'язково заміщеної фенілсульфонільсульфонільною групою С1-С10; алкілсульфонільної групи); коли гетероциклічна група заміщена в ною групою С1-С10, яка монозаміщена групою, двох суміжних положеннях двома алкільними грувибраною із заміщувальної групи g; галогеналкілпами, двома алкоксильним и групами, алкільною сульфонільною групою С1-С4; необов'язково загрупою й алкоксильною групою, алкільною групою міщеною фенільною групою; необов'язково замій алкілтіогрупою, алкільною групою й алкілсульщеною гетероциклічною групою ароматичного фонільною групою, алкільною групою і моноалкіряду; необов'язково заміщеною фенілсульфонільламіногрупою або алкільною групою і діалкіламіноноюі групою; необов'язково заміщеною гетероцикгрупою, дві групи можуть утворювати разом з лічною сульфонільною групою ароматичного ряду; атомами, з якими вони зв'язані, 5-8-членне кільце, ацильною групою; галогеналкілкарбонільною грущо може бути заміщене 1-4 атомами галогену. пою С1-С4; необов'язково заміщеною бензилкар3. Гербіцидна композиція за ознакою 2, відпобонільною групою; необов'язково заміщеною бенвідно до якої ізоксазолінова похідна формули (І) зоїльною групою; алкоксикарбонільною групою С1або її сіль має замісник, вибраний із заміщувальС10; необов'язково заміщеною бензилоксикарбоної групи a у гетероциклі, який може бути заміщенільною групою; необов'язково заміщеною фенокний від 0 до 6 однаковими aбo різними групами, сикарбонільною групою; карбамоїльною групою (її що включають атоми галогену; алкільні групи С1атом азоту може бути заміщений однаковими або С10; галогеналкільні групи С1-С4; алкільні групи різними групами, вибраними з алкільних груп С1С1-С3, заміщені алкоксильними групами С1-С10; С10 і необов'язково заміщеної фенільної групи) циклоалкільні групи С3-С8 (які можуть бути заміабо аміногрупою (її атом азоту може бути ізаміщещені атомом галогену або алкільною групою); алний однаковими або різними групами, вибраними з коксильні групи С1-С10; галогеналкоксильні групи алкільних гр уп С1-С10, необов'язково заміщеної С1-С4; алкілоксильні групи С1-С3, заміщені циклофенільної групи, ацильних груп, галогеналкілкаралкільними групаміи С3-С8; алкілоксильні групи бонільних груп С1-С4, необов'язково заміщеної С1-С3, заміщені циклоалкільними групами С3-С8; бензилкарбонільної групи, необов'язково заміщенеобов'язково заміщену фенільну групу; алкілтіогної бензоїльної групи, алкілсульфонільних груп рупи С1-С10; алкілсульфонільні групи С1-С10; С1-С10, галогеналкілсульфонільних груп С1-С4, ацильні групи; галогеналкілкарбонільні групи С1необов'язково заміщеної бензилсульфонільної С4; алкоксикарбонільні групи С1-С10; ціаногруппу і групи і необов'язково заміщеної феніл сульфонікарбамоїльну гр упу (її атом азоту може бути замільної групи). щений однаковими або різними алкільними група10. Гербіцидна композиція за ознакою 7, відми C1-C10). повідно до якої Υ являє собою піразол-5-ільну гру4. Гербіцидна композиція за будь-якою з ознак пу, а піразольне кільце в 4-положенні заміщене 1, 2 або 3, відповідно до якої R1 і R2 можуть бути заміщувальною групою a і в 1-положенні заміщене однаковими або різними і кожний являє собою атомом водню, алкільною групово С1-С10; алкіль3 метильну групу або етильну групу, а кожний з R , ною групою С1-С10, яка монозаміщена групою, R4, R5 і R6 являє собою атом водню. вибраною із заміщувальної групи b, галогеналкіль5. Гербіцидна композиція за будь-якою з ознак ною групою С1-С4; циклоалкільною групою С3-С8; 1, 2, 3 або 4, відповідно до якої Υ являє собою 5-6алкенільною групою С2-С6; алкінільною групою членну гетероциклічну групу ароматичного ряду, С2-С6; алкілсульфінільною групою С1-С10; алкілщо має гетероатом, вибраний з атома азоту, атосульфонільною групою С1-С10; алкілсульфонільма кисню й атома сірки. ною групою С1-С10, яка монозаміщена групою, 6. Гербіцидна композиція за ознакою 5, відповибраною із заміщувальної групи g; галогеналкілвідно до якої Υ являє собою тієнільну груп у, пірасульфонільною групою С1-С4; необов'язково зазолільну груп у, ізоксазолільну гр упу, ізотіазоліліьміщеною фенільною групою; необов'язково заміну груп у, піридильну груп у або піримідинільну щеною гетероциклічною групою ароматичного груп у. ряду; необов'язково заміщеною фенілсульфоніль7. Гербіцидна композиція за ознакою 6, відпоною групою; необов'язково заміщеною гетероциквідно до якої Υ являє собою тіофен-3-ільну групу, лічною сульфонільною групою ароматичного ряду; піразол-4-ільну групу, піразол-5-ільну груп у, ізоксаацильною групою; галогеналкілкарбонільною грузол-4-ільну гр упу, ізотіазол-4-ільну гр упу, піридинпою С1-С4; необов'язково заміщеною бензилкар3-ільну гр упу або піримдин-5-ільну гр упу. бонільною групою; необов'язково заміщеною бен8. Гербіцидна композиція за ознакою 7, відпозоїльною групою; алкоксикарбонільною групою С1відно до якої Υ являє собою тіофен-3-ільну групу, С10; необов'язково заміщеною бензилоксикарбоа тіофенове кільце заміщене в 2- і 4-прложеннях нільною групою; необов'язково заміщеною фенокзаміщувальною групою a. сикарбонільною групою; карбамоїльною групою (її 9. Гербіцидна композиція за ознакою 7, відпоатом азоту може бути заміщений однаковими або відно до якої Υ являє собою піразол-4-ільну гр упу, різними групами, вибраними з алкільних груп С1а піразольне кільце в 3- і 5-положеннях заміщене С10 і необов'язково заміщеної фенільної групи) заміщувальною групою a і в 1-положенні заміщено або аміногрупою (її атом азоту може бути заміще 9 78071 10 ний однаковими або різними групами, вибраними з до 100 масових частин на одну масову частину і) алкільних гр уп С1-С10, необов'язково заміщеної ізоксазолінової похідної, представленої формулою фенільної групи, ацильнихі груп, галогеналкілкар(І), або її солі. бонільних груп С1-С4, необов'язково заміщеної 22. Гербіцидна композиція за будь-якою з бензилкарбонільної групи, необов'язково заміщеознак 1-21, що використовується як агрохімічний ної бензоїльної групи, алкілсульфонільних груп продукт, що містить і) ізоксазолінову похідну форС1-С10, галогеналкілсульфонільних груп C1-C4, мули (І) або її сіль і іі), щонайменше, одну сполуку необов'язково заміщеної бензилсульфонільної групи А в загальній кількості від 0,5 до 90%мас. групи і необов'язково; заміщеної фенілсульфоніВизначення термінів, використовуваних у дальної групи). ному описі, надано нижче. 11. Гербіцидна композиція за ознакою 7, відТермін "С1-С10" і т.д. вказує на те, що замісповідно до якої Υ являє собою ізоксазол-4-ільну ник, що стоїть за цим терміном, має від 1 до 10 груп у, а ізоксазольне кільце в 3- і 5-положеннях атомів вуглецю у випадку вживання терміну "С1С10". заміщене заміщувальною групою a. Атом галогену відноситься до атома фтору, 12. Гербіцидна композиція за ознакою 7, відатома хлору, атома іброму або атома йоду. повідно до якої Υ являє собою ізотіазол-4-ільну Алкільна група С1-С10 відноситься до алкільгруп у, а ізотіазольне кільце в 3- і 5-положенняхної групи з нерозгалуженим або розгалуженим заміщене заміщувальною групою a. ланцюгом, яка має від 1 до 10 атомів вуглецю, 13. Гербіцидна композиція за ознакою 7, відякщо це не обговорено інакше; і в цьому зв'язку повідно до якої Υ являє собою піридин-3-ільну груможуть бути згадані, наприклад, метильна група, пу, а піридинове кільце в 2- і 4-положеннях заміетильна група, n-пропільна група, ізопропільна щене заміщувальною групою a. група, n-бутильна група, ізобутильна група, втор14. Гербіцидна композиція за ознакою 7, відбутильна група, трет-бутильна група, n-пентильна повідно до якої Υ являє собою піримідин-5-ільну група, ізопентильна група, неопентильна група, nгруп у, а піримидинове кільце в 4- і 6-положеннях гексильна група, ізогексильна група, 3,3заміщене заміщувальною групою a. диметилбутильна група, гептильна група й октиль15. Гербіцидна композиція за будь-якою з на група. ознак 1-14, відповідні до якої n являє собою ціле Циклоалкільна група С3-С8 відноситься до цичисло, яке дорівнює 2. клоалкільної групи, що має від 3 до 8 атомів вуг16. Гербіцидна композиція за будь-якою з лецю; і в цьому зв'язку можуть бути згадані, наприознак 1-14, відповідно до якої сполука групи А явклад, циклопропільна група, циклобутильна група, ляє собою, щонайменше, одну сполук у, вибрану з циклопентильна група і циклогексильна група. групи, що складається з атразину, ціаназину, сиАлкільна група С1-С3, заміщена циклоалкільмазину і прометрину. ною групою С3-С8, (яка може бути заміщена ато17. Гербіцидна композиція за будь-якою з мом галогену або алкільною групою) відноситься, ознак 1-14, відповідно до якої сполука групи А явякщо це не обговорено інакше, до алкільної групи ляє собою, щонайменше, одну сполуку, яка вибС1-С3, заміщеної циклоалкільною групою С3-С8, рана з[ групи, що складається з гліфосату, глуфояка може бути заміщена від 1 до 4 однаковими або синату, лінурону і флуметсуламу. різними атомами галогену або алкільною групою 18. Гербіцидна композиція, що містить і) ізоС1-С3; і в цьому зв'язку можуть бути згадані, наксазолінову похідну або її сіль, що являє собою приклад, циклопропілметильна група, 1сполуку, як це визначено у відповідності до ознаки циклопропілетильна група, 2-циклопропілетильна 9, і іі) сполуку групи А, що являє собою, щонаймегрупа, 1-циклопропілпропільна група, 2нше, одну сполуку, яка вибрана з групи, що склациклопропілпропільна група, 3дається з атразину, ціаназину, симазину, прометциклопропілпропільна група, циклобутилметильна рину, глі фосату, глуфосинату, лінурону, група, циклопентилметильна група, циклогексилфлуметсуламу, метрибузину, ізоксафлутолу, меметильна група, 2-хлорциклопропілметильна грузотріону, ди флуфенікану, пендиметаліну і флуміопа, 2,2-дихлорциклопропілметильна група, 2ксазину. фторциклопропілметильна група, 2,219. Гербіцидна композиція, що містить і) ізодифторциклопропілметильна група, 2ксазолінову похідну або її сіль, що являє собою метилциклопропілметильна група, 2,2сполуку, як це визначено у відповідності до ознаки диметилциклопропілметильна група і 29, і іі) сполуку групи А, що являє собою, щонаймеметилциклопропілетильна група. нше, одну сполуку, яка вибрана з групи, що склаАлкільна група С1-С3, заміщена циклоалкільдається з атразину, ціаназину, симазину і прометною групою С3-С8, відноситься до алкільної групи рину. С1-С3, що має від 1 до 3 атомів вуглецю, яка за20. Гербіцидна композиція, що містить і) ізоміщена циклоалкільною групою, що має від 3 до 8 ксазолінову похідну або її сіль, що являє собою атомів вуглецю; і в цьому зв'язку можуть бути згасполуку, як це визначено у відповідності до ознаки дані, наприклад, циклопропілметильна група, 19, і іі) сполуку групи А, що являє собою, щонаймециклопропілетильна група, 2-циклопропілетильна нше, одну сполуку, яка вибрана з групи, що склагрупа, 1-циклопропільропільна група, 2дається з гліфосату, глуфосинату, лінурону і флуциклопропілпропільна група, 3метсуламу. циклопропілпропільна група, циклобутилметильна 21. Гербіцидна композиція за будь-якою з група, циклопентилметильна група і циклогексилознак 1-20, відповідно до якої іі) щонайменше, одметильна група. на сполука групи А міститься в кількості від 0,001 11 78071 12 Галогеналкільна група С1-С4 відноситься, якциклогексилметоксильна група. що це не обговорено інакше, до алкільної групи з Алкенілоксильна група С2-С6 і алкінілоксильна нерозгалуженим або розгалуженим ланцюгом, що група С2-С6 відносяться відповідно до (алкеніл)-Омає від 1 до 4 атомів вуглецю, яка заміщена від 1 групи (алкініл)-О-групи, у кожній з яких алкенільна до 9 однаковими або різними атомами галогену; і в або алкінільна складова має зазначене вище вицьому зв'язку можуть бути згадані, наприклад, значення; і в цьому зв'язку можуть бути згадані, фторметильна група, хлорметильна група, бромнаприклад, 2-пропенілоксильна група і 2метильна група, дифторметильна; група, трифтопропінілоксильна група. рметильна група, 2,2-дифторетильна група, 2,2,2Алкоксііміногрупа С1-С10 відноситься до (алтрифторетильра група і пентафторетильна група. кокси)-N-групи, у якій алкоксильна складова має Алкенільна група С2-С6 відноситься до алкезазначене вище визначення; і в цьому зв'язку монільної групи з нерозгалуженим або розгалуженим жуть бути згадані, наприклад, метоксііміногрупа і ланцюгом, що має від 2 до 6 атомів вуглецю; і в етоксііміногрупа. цьому зв'язку можуть бути згадані, наприклад, Алкілтіогрупа С1-С10, алкілсульфінільна група етенільна група, 1-пропенільна j група, 2С1-С10 і алкілсульфонільна група С1-С10 віднопропенільна група, ізопропенільна група, 1сяться відповідно до (алкіл)-S-групи, (алкіл)-SОбутенільна група, 2-бутеніліьна група, 3-бутенільна групи і (алкіл)-SО2-груп, у кожній з яких алкільна група і 2-пентенільна група. складова має зазначене вище визначення; і в Алкінільна група С2-С6 відноситься до алкініцьому зв'язку можуть бути згадані, наприклад, мельної групи з нерозгалуженим або розгалуженим тилтіогрупа, етилтіогр упа, n-пропілтіогрупа, ізоланцюгом, що має від 2 до 6 атомів вуглецю; і в пропілтіогрупа, метилсульфінільна група, метилцьому зв'язку можуть бути згадані, наприклад, сульфонільна група, етилсульфонільна група, nетинільна група, 2-пропінільна група, 1-метил-2пропілсульфонільна група і ізопропілсульфонільна пропінільна група, 2-бутинільна група, 3група. бутинільна група і 2-метил-3-бутинільна група. Алкілсульфонілоксильна група С1-С10 відноГалогеналкенільна група С2-С6 відноситься, ситься до (алкіл сульфоніл)-О-групи, у якій алкілякщо це не обговорено інакше, до алкенільної грусульфонільна складова має зазначене вище випи з нерозгалуженим або розгалуженим ланцюгом, значення); і в цьому зв'язку можуть бути згадані, що має від 2 до 6 атомів вуглецю, яка заміщена від наприклад, метилсульфонілоксильнаї група і ети1 до 4 однаковими або різними атомами галогену; і лсульфонілоксильна група. в цьому зв'язку можуть бути згадані, наприклад, 3Алкоксикарбонільна група С1-С10 відноситься хлор-2-п]5опешльна група і 2-хлор-2-пропенільна до (алкокси)-СО-групи, у якій алкоксильна складогрупа. ва має зазначене вище визначення; і в цьому зв'яАлкоксильна група С1-С10 відноситься до (алзку можуть бути згадані, наприклад, метоксикаркіл)-О-групи, у якій алкільна складова має зазнабонільна група, етоксикарбонільна група, nчене вище визначення; і в цьому зв'язку можуть пропоксикарбонільна група і ізопропоксикарбонібути згадані, наприклад, метоксильна група, етокльна група. сильна група, n-пропоксильпа група, ізопропоксиАцильна група С1-С6 відноситься до ацильної льна група, трет-бутоксильна група, n-бутоксильна групи аліфатичного ряду з нерозгалуженим або група, втор-бутоксильна група і ізобутоксильна розгалуженим ланцюгом, що має від 1 до 6 атомів група. вуглецю; і в цьому зв'язку можуть бути згадані, Галогеналкоксильна група С1-С4 відноситься наприклад, формільна група, ацетильна група, до (галогеналкіл)-О-групи, у якій галогеналкільна пропіонільна група, ізопропіонільна група, бутирискладова має зазначене вище визначення; і в льна група і півалоїльна група. цьому зв'язку можуть бути згадані, наприклад, диАцилоксильна група С1-С10 відноситься до фторметоксильна група, трифторметоксильна гру(ацил)-О-групи, у який ацильна складова має запа, 2,2-дифторетоксильна група і 2,2,2значене вище визначення; і в цьому зв'язку можуть трифторетоксильна група. бути згадані, наприклад, ацетоксильна група, проЦиклоалкілоксильна група С3-С8 відноситься піонілоксильна група, ізопропіонілоксильна група і до (циклоалкіл)-О-групи, у якій циклоалкільна півалоїлоксильна група. складова має зазначене вище визначення; і в Галогеналкілкарбонільна група С1-С4, галогецьому зв'язку можуть бути згадані, наприклад, циналкілтіогрупа і С1-С4 і галогеналкілсульфонільна клопропілоксильна група, циклобутилоксиліьна група С1-С4 відносяться відповідно до (галфгенагрупа, циклопентилоксильна група і циклогексилолкіл)-СО-групи, (галогеналкіл)-S-групи і (галогенаксильна група. лкіл)-SО2-групи, у кожній з яких галогеналкільна Алкілоксильна група С1-С3, заміщена циклоаскладова має зазначене вище визначення; і в лкільною групою C3-C8, відноситься до (циклоалцьому зв'язку можуть бути згадані, наприклад, кілалкіл)-О-групи, у якій циклоалкілалкільна склахлорацетильна група, три фторацетильна група, дова має зазначене вище визначення; і в цьому пентафторпропільна група, дифторметилтіогрупа, зв'язку можуть бути згадані, наприклад, циклопротрифторметилтіогрупа, хлорметилсульфонільна пілметоксильна група, 1-циклопропілетоксильна група, ди фторметилсульфонільна група і трифтогрупа, 2-циклопропілетоксильна група, 1рметилсульфонільна група. циклопропілпропоксильна групa, 2Галогеналкілкарбонілоксильна група С1-С4 і хлорпропілпропоксильна група, 3галогеналкілсульфощлоксильна група С1-С4 відхлорпропілпропоксильна група, циклобутилметокносяться відповідно до (галогеналкілкарбоніл)-Осильна група, циклопентилметоксильна група і групи і (галогеналкілсульфоніл)-О-групи, у кожній з 13 78071 14 яких галогеналкілкарбонільна або галогеналкілсуково заміщеній) гетероциклічній групі ароматичнольфонільна складова має зазначене вище визнаго ряду, (необов'язково заміщеній) гетероциклічній чення; і в цьому зв'язку можуть бути згадані, наоксильній групі ароматичного ряду, (необов'язково приклад, хлор ацетилоксильна група, заміщеній) гетероциклічній тіогрупі ароматичного трифторацетилоксильна група, хлорметилсульряду і (необов'язково заміщеній) гетероциклічній фонілоксильна група і трифторметилсульфонілоксульфонільній групі ароматичного ряду відноситьсильна група. ся до 5-6-членної групи, що має рід 1 до 3 гетероТермін "необов'язково заміщена" у (необов'язатомів, довільно вибраних з атома азоту, атома ково заміщеній) фенільній групі, (необов'язково кисню й атома сірки; і в цьому зв'язку можуть бути заміщеній) гетероциклічній групі ароматичного згадані, наприклад, фурильна група, тієнільна груряду, (необов'язково заміщеній) феноксильній група, піролільна група, піразолільна група, ізоксазопі, (необов'язково {заміщеній) гетероциклічній оклільна група, ізотіазоліліна група, оксазолільна сильній групі ароматичного ряду, (необов'язково група, тіазолільна група, імідазолільна група, піри{заміщеній) фенілтіогрупі, (необов'язково заміщедиль|на група, піридазинільна група, піримідинільній) гетероциклічній тіогрупі ароматичного ряду, на група, піразинільна група, тріїазинільна група, (необов'язково заміщеній) фенілсульфонільній триазолільна група, оксадіазолільна група і тіадіагрупі, (необов'язково заміщеній) фенілсульфонілозолільна група. ксильній групі, (необов'язково {заміщеній) гетероФармацевтично прийнятна сіль являє собою циклічній сульфонільній групі ароматичного ряду, сіль сполуки загальної формули [І], що має у своїй (необов'язково заміщеній) бензилкарбонільній груструктурі гідроксильну групу, карбоксильну гр упу, пі, (необов'язково заміщеній) бензилкарбонілоксиаміногрупу тощо в сполученні з металом або оргальній групі, (необов'язково заміщеній) бензилсунічною основою або в сполученні з мінеральною льфонільній групі, (необов'язково заміщеній) кислотою або органічною кислотою. Що стосується бензоїльній групі, (необов'язково заміщеній) бензометалу, то в цьому зв'язку можуть бути згадані їлоксильній групі, (необов'язково заміщеній) бенлужні метали, наприклад, натрій, калій тощо, і лузилоксикарбонільній групі і (необов'язково заміщежноземельні метали, наприклад, магній, кальцій ній) феноксикарбонільній групі відноситься до тощо. Що стосується органічної основи, то в цьому групи, яка необов'язково заміщується, наприклад, зв'язку можуть бути згадані триетиламін, діізопроатомом галогену, алкільною групою С1-С10, галопіламін і так далі. Що стосується мінеральних кисгеналкільною групою С1-С4, алкоксіалкільною грулот, то в цьому зв'язку можуть бути згадані хлорипою С1-С10, алкоксильною групою С1-С10, алкілстоводнева кислота, сірчана кислота і так далі. Що тіогрупою С1-С10, алкілсульфонільною групою С1стосується органічної кислоти, то в цьому зв'язку С10, ацильною групою, алкоксикарбонільною груможуть бути згадані оцтова кислота, метансульпою С1-С10, ціаногрупою, карбамоїльною групою фонова кислота, р-толуолсульфонова кислота і (її атом азоту може бути заміщений однаковими так далі. або різними алкільними групами С1-С10), нітроУ наведеній вище загальній формулі [І] бажагрупою або аміногрупою (її атом азоту може бути но, щоб: і заміщений однаковими або різними групами, вибR1 і R2 були однаковими або різними, а кожний раними з алкільних груп С1-С10, ацильних груп з них являв собою метилову груп у або етилову С1-С6, галогеналкілкарбонільних гр уп С1-С4, алкігруп у; лсульфонільних груп С1-С10 і галогеналкілсулькожний з R3, R4, R5 і R6 являв собою атом водфонільних гр уп С1-С4). ню; 5-6-членна гетероциклічна група ароматичного n являло собою ціле число, рівне 2; а ряду, що має гетероатом, вибраний з атома азоту, Υ являв собою тіофен-3-ільну груп у [2- і 4атома кисню й атома сірки, включає, наприклад, положення цієї групи заміщені однаковими або фурильну груп у, тієнільну груп у, піролільну гр упу, різними групами, вибраними з атомів галогену, піразолільну гр упу, ізоксазолільну груп у, ізотіазоалкільних гр уп, галогеналкільних груп, алкоксіалкілільну групу, оксазолільну групу, тіазолільну групу, льних груп, циклоалкільних груп, алкоксильних імідазолільну групу, піридильну груп у, піридазинігруп, галогеналкоксильних груп, ацильних груп, льну груп у, піримідинільну гр упу, піразинільну гругалогеналкілкарбоніліьних груп, алкоксикарбонільпу, триазинільну груп у, триазолільну групу, оксадіних гр уп, ціаногрупи і карбамоїльної групи (її атом азолільну груп у і тіадіазолільну групу, кожна з яких азоту може бути заміщений однаковими або різмає від 1 до 3 гетероатомів. ними алкільними групами)], або Конденсована гетероциклічна група ароматичпіразол-4-ільну груп у [3- і 5-положення цієї ного ряду відноситься! до групи, що має від 1 до 3 групи заміщені однаковими або різними групами, гетероатомів, довільно вибраних з атома азоту, вибраними з атомів галогену, алкільних груп, галоатома кисню й атома сірки; і в цьому зв'язку могеналкільних груп, алкоксіалкільних гр уп, циклоалжуть бути згадані, наприклад, бензофурильна грукільних груп, алкоксильних груп, галогеналкоксипа, бензотієнільна група, індолільна група, бензольних груп, циклоалкілалкілоксильних гр уп, ксазолільна група, бензотіазолільна група, необов'язково заміщеної феноксильної групи, албензімідазолільна група, бензізоксазолільна група, кілтіогруп, алкілсульфонільних груп), ацильних бензізотіазолільна група, індазолільна група, хіногруп, галогеналкілкарбонільних гр уп, алкоксикарлільна група, ізохінолільна група, фталазинільна бонільних груп, ціаногрупи і карбамоїльної групи (її група, хіноксалінільна група, хіназолінільна група, атом азоту може бути заміщений однаковими а|бо цинолінільна група і бензотриазолільна група. різними алкільними групами); 1-положення заміГетероцикл ароматичного ряду в (необов'язщене атомом водню, алкільною групою, алкільною 15 78071 16 групою, що монозаміщена групою, вибраною із однаковими або різними алкільними групами)], або піримідин-5-ільну груп у [4- і 6-положення цієї заміщувальної групи b, галогеналкільною групою, циклоалкільною групою, алкенільною групою, алкігрупи заміщені однаковими або різними групами, вибраними з атомів галогену, алкільних груп, галонільною групою, алкілсульфонільною групою, алкігеналкільних груп, алкоксіалкільних гр уп, циклоаллсульфонільною групою, що монозаміщена грукільних груп, алкоксильких груп, галогеналкоксипою, вибраною із заміщувальної групи g, льних груп, алкілтіогруп, алкілсульфонільних груп, галогеналкілсульфонільною групою, необов'язково ацильних груп, галогеналкілкарбонільних груп, заміщеною фенільною групою, необов'язково заалкоксикарбонільних груп, ціаніогрупи і карбамоїміщеною гетероциклічною групою ароматичноіго льної групи (її атом азоту може бути заміщений ряду, необов'язково заміщеною фенілсульфонільоднаковими або різними алкільними групами)]. ною групою, необов'язково заміщеною гетероцикНезважаючи на те, що вміст відповідних інгрелічною сульфонільною групою ароматичного ряду, дієнтів залежить від їхньої відносної активності, ацильнор групою, галогеналкілкарбонільною грукомпозиція, запропонована відповідно до даного пою, необов'язково заміщеною бензилкарронільвинаходу, містить, щонайменше, одну сполуку ною групою, необов'язково заміщеною бензоїльформули [І], як правило, у кількості від 0,001 до ною групою, алкоксикарбонільною групою, 100 масових частин, переважно від 0,01 до 50 манеобов'язково заміщеною бензилоксикарбонільсових частин, більш і переважно від 0,05 до 30 ноюгрупою, необов'язково заміщеною феноксикамасових частин, на 1 масову частину ізоксазолінорбонільною групою або карбамоїльною групою (її вої похідної формули (І) або її солі. атом азоту може бути заміщений однаковими або Одним з активних інгредієнтів композиції, зарізними групами, вибраними з алкільних груп і непропонованої відповідно до даного винаходу, є обов'язково заміщеної фенільної групи)], або сполука формули (І), яка сама забезпечує досягпіразол-5-ільну груп у [4-положення цієї групи нення чудового гербіцидного ефекту. заміщене атомом галогену, алкільною групою, гаБільш конкретно, вона не виявляє істотного логеналкільною групою, алкоксіалкільною групою, фітотоксичного ефекту по відношенню до рису, галогеналкоксильною групою, ацильною групою, пшениці, ячменя, кукурудзи, сорго, сої, бавовни, галогеналкілкарбонільною групою, алкоксикарбоцукрового буряка, трав'яного покриву, фр уктових нільною групою, ціаногрупою або карбамоїльною дерев тощо, однак здійсняє чудову гербіцидну дію групою (її атом азоту може бути заміщений однав малих дозах на різні бур'яни, що ростуть на суковими або різними алкільними групами); 1ходільний ділянках, у широкому часовому діапазоположення заміщене атомом водню, алкільною ні - починаючи задовго до моменту проіростання і групою, алкільною гр|упою, що монозаміщена грукінчаючи вегетаційним періодом - і що включають пою, вибраною із заміщувальної групи b, галогенЬтакі трав'янисті бур'яни, як куряче просо їкільною групою, циклоалкільною групою або не(Echinochloa crusglli var. crus-galli), лапку кров'яну обов'язково заміщеною фенільною групою], або (DigitaiKa ciliaris), мишій зелений (Setaria viridis), ізоксазол-4-ільну гр упу [3- і 5-положення цієї тонконіг однолітній (Роа annua), дике сорго групи заміщені однаковими або різними групами, (Sorghum halepense Pers.), лисохвіст польовий вибраними з атомів галогену, алкільних груп, гало(Alopecurus myosuroidеs), вівсюг (Avena fatua) тогеналкільних груп, алкоксіалкільних гр уп, циклоалщо, такі широколисті бур'яни, як спориш шорсткукільних груп, алкоксильких груп, галогеналкоксиватий (polygonum lapathifolia), щириця зелена льних груп, алкілтіогруп, алкілсульфонільних груп, (Amaranthus viridis), лобода біла (Chenopodjium ацильних груп, галогеналкілкарбонільних груп, album L.), зірочник середній (Stellaria media Villars), алкоксикарбонільних груп, ціаногрупи і карбамоїабутилон (канатник) Теофраста (Abutilon льної групи (її атом азоту може бути заміщений theophrasti Medic), сіда (грудинка) колюча (Sida однаковими або різними алкільними групами)], або spinosa L.), сесбанія екзалтата (Sesbania exaltata ізотіазол-4-ільну груп у [3- і 5-положення цієї Gory), амброзія полинолистна (Ambrosia групи заміщені однаковими або різними групами, artemisiifolia), березка пурпурна тощо, і такі однолівибраними з атомів галогену, алкільних груп, галотні і багаторічні осоковидні бур'яни, як пурпурний геналкільних груп, алкоксіалкільних гр уп, циклоалсмикавець круглий (Cyperus rotundus L.), смикакільних груп, алкоксильких груп, галогеналкоксивець їстівний (Cyperus esculentus L.), смикавець льних груп, необов'язково заміщеної коротколистний (Cyperus brevifolius Η.), смикавець феноксильніої групи, алкілтіогруп, алкілсульфоніосоковидний (Cyperus microiria Steud), смикавець льних груп, ацильних груп, галогеналкілкарбонільрисовидний (Cypeijus iria L.) тощо. них груп, алкоксикарбонільних груп, ціаногрупи і Крім того, композиція, запропонована відповікарбамоїльної групи (її а том азоту може бути задно до даного винаходу, здійснює чудову гербіциміщений однаковими або різними алкільними грудну дію в малих дозах на різні бур'яни, що ростуть пами)], або на зрошуваних рисових полях, у широкому часопіридин-3-ільну груп у [2- і 4-положення цієї вому діапазоні - починаючи задовго до моменту групи заміщені однаковими або різними групами, проростання і кінчаючи вегетаційним періодом - і вибраними з атомів галогену, алкільних груп, галощо включають такі однолітні бур'яни, як плоскуха геналкільних груп, алкоксіалкільних гр уп, циклоалрисовидна (Echinochloa oryzicola), дрібіноквіткові кільних груп, алкоксильких груп, галогеналкоксизонтичні рослини (Cyperus difformis), монохорія льних груп, алкілтіогруп, алкілсульфонільних груп, піхвова (Monochoria vaginalis), ліндернія прокумацильних груп, галогеналкілкарбонільних груп, бенс (Lindernia procumbens) тощо, і такі багаторічні алкоксикарбонільних груп, ціаногрупи і карбамоїбур'яни, як смикавець пізній (Cyperus serotinus), льної групи (її атом азоту може бути заміщений 17 78071 18 елеохаріс куроуваї (Eleocharis Huroguwai), очерет ної формули (І) або її солі. Якщо кількість гербіци(Scirpus juncoides) тощо. ду групи А менше 0,001 масової частини, задовіСполука представленої нижче групи А, що є льний ефект може бути не досягнуто, а якщо ця іншим активним інгредієнтом, призначеним для кількість перевищує 100 масових частин, безпека у використання в комбінації з ізоксазоліновою похідвідношенні цільових культур може виявитися неною формули (І) або її сіллю, здійснює меншу фідостатньою. тотоксичну дію на злакові культури, наприклад, на Серед сполук групи А переважною є, щонайкукурудз у, пшеницю тощо, однак гербіцидну дію менше, одна сполука, я|ка вибрана з групи, що здійснює тільки на частину трав'янистих бур'янів, складається з атразину, ціаназину, симазину і наприклад, на куряче просо, і широколистих бур'япрометрину, або, щонайменше, одна сполука, яка нів, наприклад, на лободу білу і абутилон (канатвибрана з групи, що складається з гліфосату, глуник) Теофраста, і діапазон його гербіцидної дії фосинату, лінурону і флуметсуламу. Більш конквузький. ретно, переважною сполукою є ціаназин або атраГрупа А: зин. атразин, симазин, ціаназин, ізоксафлутол, меНижче в таблицях 1-14 приведені значущі призотріон, флуметсулам, імазетапір, імазапір, дикаклади запропонованої сполуки, представленої мба, клопіралід, просульфурон, галогенсульфузагальною формулою (І). Запропонована сполука, рон-метил, римсульфурон, бентазон, однак, не обмежується цими прикладами. карфентразон-етил, метрибузин, тіфенсульфуронПредставлені нижче скорочені вираження, виметил, нікосульфурон, примісульфурон, клорансукористовувані в таблицях, відносяться до наступлам-метил, глуфосинат, глі фосат, гліфосатних гр уп. тримезіум, пендиметалін, лінурон, прометрин, диMe: метильна група Et: етильна група фіїуфенікан, флуміоксазин і метолахлор. Рг: n-пропільна група Pr-і: ізопропільна група Відповідно до даного винаходу запропонована Pr-c: циклопропільна Вu: n-бутильна група гербіцидна композиція для ефективного застосугрупа вання в новому способі обробки ґрунту, наприBu-i: ізобутильна гру-Bu-s: втор-бутильна груклад, у орній культивації, що дозволяє забезпечипа па ти вибіркову боротьбу з бур'янами й широких Bu-t: трет-бутильнаВu-с: циклобутильна межах. Гербіцидна композиція, запропонована група група відповідно до даного винаходу, особливо ефектиPen: n-пентильнаPen-с: циклопентильна вна при знищенні основних бур'янів на кукурудзягрупа група ному полі, наприклад, дводольних рослин, вклюHex: n-гексильна гру-Нех-с: циклогексильна чаючи спориш в'юнковий (Fallopia convolvulua Α.), па група спориш шорсткуватий (Polygonum scabrum), порPh: фенільна група тулак городній (Portulaca oleracea L.), лободу білу Наприклад, (4-Cl)Ph означає 4-хлорфенільну (Chenopodium album L.), щирицю колосисту груп у, а 3-Нех означає 3-гексильну груп у. (Amaranthus retroflexus L.), гірчицю польову Коли запропонована сполука містить гідрокси(Sinapis Arvensis L.), сесбанію экзалтата (Sesbania льну групу як замісник, можуть бути присутніми oxaltata Gory), астрагал туполистний (Cassia кето-енольні таутомери. Будь-який з цих таутомеobtusifolia L.), абутилон (канатник) Теофраста рів і будь-яка суміш цих та утомерів включені в за(Abutilon theophrasti Medic), сіду (грудинку) колючу пропоновану сполуку. (Sida spinosa L.), березку плющовидну (Ipomoea Скорочення в заголовках таблиць: Комп. hederacea Jaccj), березку пурпурну (Ipomoea композиція; Т.п. - температура плавлення; п.п. purpurea), дурман звичайний (Datura stramonium), показник переломлення. пасльон чорний (Solarium nigrum L.), нетребу звичайну (Xanthium strumarium L.), Соняшник, березку польову (Convolvulus arvensis), молочай-сонцегляд (Euphorbia helioscopia), череду гіллясту (Bidens frondosa L.), амброзію полинолистну (Ambrosia artemisiifolia) тощо, і однодольних рослин, включаючи куряче просо (Echinochloa crusglli var. crusgalli), мишій зелений (Setaria viridis), мишій гігантський (Setari faberi), мишій сизий (Setari glacuca), лапку кров'яну (Digitaria ciliarisj), елевзину індійську (Eleusine indica Gaertn), дике сорго (Sorghum halepense Pbrs.), пирій повзучий (Agropyron repens P.), сорго звичайне (Sorghum vulgare) тоїцо, але не здійснює фітотоксичної дії на цільові культури, наприклад, на кукурудзу і сою, що вирощується слідом за кукурудзою. Гербіцидна копозиция, запропонована відповідно до даного винаходу, містить, щонайменше, одну сполуку гр упи А у кількості від 0,001 до 100 масових частин, переважно від 0,01 до 50 масових частин, більш переважно від 0,05 до 30 масових частин, на 1 масову частин у ізоксазолінової похід 19 78071 20 21 78071 22 23 78071 24 спиртових сульфатів, солі алкіларилсульфонової кислоти, солі лігнінсульфонової кислоти, поліоксіетиленгліколеві ефіри, поліоксіетиленалкіларилові ефіри, моноалкаляти поліоксіетиленсорбітану тощо. Що стосується активуючої добавки, то в цьому зв'язку можуть бути згадані, наприклад, карбоксиметилцелюлоза, поліетиленгліколь і аравійська камедь. Крім того, композиція, запропонована відповідно до даного винаходу, може бути приготовлена шляхом підбору рецептурного складу відповідних активних інгредієнтів зазначеним вище способом з наступним перемішуванням цих відповідних інгредієнтів. Приготовлена в такий спосіб композиція, запропонована відповідно до даного винаходу, може наноситися на рослини сама по собі або після розведення водою або яким-небудь іншим подібним розріджувачем. Композиція, запропонована відповідно до даного винаходу, може бути змішана з іншими гербіцидами з метою посилення її гербіцидного ефекту або може може бути додатково використана в комбінації з інсектицидом, фунгіцидом, регулятором росту рослин, добривом, меліоративним засобом тощо. Композиція, запропонована відповідно до даного винаходу, містить ізоксазолінову похідну формули (І) або її сіль і, щонайменше, одну сполуку, яка вибрана з групи А, переважно в загальній кількості від 0,5 до 90%мас., більш переважно від 1 до 80%мас. Крім того, ізоксазолінова похідна формули (І) або її сіль може бути змішана з двома або більше сполуками, вибраними з групи А, а її застосовувана кількість складає переважно від 0,5 до 90%мас., більш переважно від 1 до 80%мас., від загальної кількості двох інгредієнтів. Сполука формули (І), що використовується в композиції, яка запропонована відповідно до даного винаходу, може бути приготовлена, як це показано в представлених нижче прикладах готування, однак способи її готування не обмежуються ними. Одержання 3-(5Що стосується використання гербіцидної комхлор-1-феніл-3-трифторметил-1Н-піразол-4позиції, запропонованої відповідно до даного виілметилтіо)-5,5-диметил-2-ізоксазоліну (запропонаходу, то запропонована композиція може буги нована сполука №3-0001) використана в суміші окремо без додавання інших 2,1г гідрату гідросульфіду натрію (чистота: сполук, але вона може також бути використана й у 70%, 26,2ммоль) додали до розчину 2,3г вигляді порошку, що змочується, гранул, дрібних (13,1ммоль) 3-метилсульфоніл-5,5-диметил-2гранул, пудри, емульсійного концентрату, розчину, ізоксазоліну, розчиненого в 20мл Ν,Νповерхнево-активного речовини, диспергатору, що диметилформаміду. Суміш піддали перемішуванактивує добавки і т.д., які, як правило, є корисними ню протягом 2 годин. Потім до неї додали 1,8г прй розробці сполуки. (13,1ммоль) безводного карбонату калію, 2,0г Що стосується розріджувача, корисниго при (13,1ммоль) ронгаліту і 3,6г (10,5ммоль) 4розробці сполуки, то в цьому зв'язку можуть бути бромметил-5-хлор-1-феніл-3-трифторметил-1Нзгадані, наприклад, тверді розріджувачі, такі як піразолу. Отриману суміш піддали перемішуванню тальк, бентоніт, глина, каолін, діатомова земля, при кімнатній температурі протягом 15 годин з біла сажа, вермикуліт, карбонат кальцію, гашене метою ініціювання реакції. Після завершення реавапно, кременистий пісок, сульфат амонію, сечокції реакційну суміш влили у воду, після чого екствина тощо; і рідкі розріджувачі, такі як ізопропілорагували етилацетатом. Отриманий органічний вий спирт, ксилол, циклогексан, метилнафталін шар промили водним розчином хлориду натрію, а тощо. потім висушили над безводним сульфатом магнію. Що стосується поверхнево-активної речовини і Отриманий розчин піддали вакуумній перегонці з диспергатора, то в цьому зв'язку можуть бути згаметою видалення розчинника, що містився в ньодані, наприклад, металеві солі алкілбензолсульму. Залишок очистили методом колонкової хромафонових кислот, металеві солі конденсату алкілтографії на силікагелі (проявний розчинник: змішанафталінсульфонової кислоти і формаліну, солі ний розчинник гексан-етилацетат), у результаті 25 78071 26 чого було отримано 2,7г (вихід: 65,5%) 3-(5-хлор-1с), 1,35 (3Н, с) феніл-3-трифторметил-1Н-піразол-4-ілметилтіо) 5,5-диметил-2-ізоксазоліну у вигляді білих кристаОдержання 5,5-диметил-3-(5-фтор-1-феніл-3лів (температура плавлення: 89-90°С). трифторметил-1Н|-піразол-4-ілметилтіо)-21 ізоксазоліну (запропонована сполука №3-0021) Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 9,3г гідрату гідросульфіду натрію (чистота: 7,55-7,50 (5Н, м), 4,33 (2Н, с), 2,83 (2Н, с), 1,45 70%, 116,3ммоль) додали до розчину 18,7г (6Н, с) (105,7ммоль) 5,5-диметил-3-метилсульфоніл-2ізоксазоліну (запропанована сполука №2-1), розОдержання 3-(5-хлор-1-феніл-3чиненого в 300мл Ν,Ν-диметилформаміду. С уміш трифторметил-1Н-піразол-4-ілметилсульфоніл)піддали перемішуванню протягом 2 годин. Потім 5,5-диметил-2-ізоксазоліну (запропонована сполуреакційну систему остудили льодом. Після цього ка №3-0002) 0,63г m-хлорпербензойної кислоти (чистота: до неї додали розчин 30,3г (93,8ммоль) 4бромметил-5-фтор-1-феніл-3-трифторметил-1Н70%, 2,6ммоль) додали в умовах о холодження піразолу, розчиненого в 200мл Ν,Νльодом до розчину 0,4г (1,0ммоль) 3-(5-хлор-1диметилформаміду. Отриману суміш піддали пефеніл-3-трифторметил-1Н-піразол-4-ілметилтіо)ремішуванню при 0°С протягом 30 хвилин з метою 5,5-диметил-2-ізоксазоліну, розвиненого в 15мл хлороформу. Суміш піддали перемішуванню при ініціювання реакції. Після завершення реакції реакційну суміш влили у воду, після чого екстрагували кімнатній температурі протягом 22 годин з метою етилацетатом. Отриманий органічний шар промиініціювання реакції. Після завершения реакції реали водним розчином хлориду натрію, а потім викційну суміш влили у воду, після чого екстрагували сушили над безводним сульфатом магнію. Отрихлороформом. Отриманий органічний шар послідовно промили водним розчином гідросульфгїу маний розчин піддали вакуумній перегонці з метою видалення розчинника, що містився в ньому. Занатрію, водним розчином гідрокарбонату натрію і лишок очистили методом колонкової хроматограводним розчином хлориду натрію, а потім висушифії на силікагелі (проявний розчинник: змішаний ли над безводним сульфатом магнію. Отриманий розчинник гексан-етилацетат), у результаті чого розчин піддали вакуумній перегонці з метою видалення розчинника, що містився в ньому. Отримані було отримано 13,11г (вихід: 37,4%) 5,5-диметил3-(5-фтор-1-феніл-3-трифторметил-1Н-піразол-4кристали промили гексаном, у результаті чого буілметилтіо)-2-ізоксазоліну у вигляді жовтої масляло отримано 0,4г (вихід: 83,2%) 3-(5-хлор-1-фенілнистої речовини. 3-трифторметил-1Н-піразол-4-ілметилсульфоніл)1 5,5-диметил-2-ізоксазоліну у вигляді білих кристаН-ЯМР [CDCІ3 /TMC, d (проміль)]: лів (температура плав|лення: 132-133°С). 7,65-7,39 (5Н, м), 4,24 (2Н, с), 2,81 (2Н, с), 1,43 1 (6Н, с) Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 7,60-7,51 (5Н, м), 4,37 (2Н, с), 3,14 (2Н, с), 1,53 Одержання 5,5-диметил-3-(5-етилтіо-1-феніл(6Н, с) 3-трифторметил-1Н-піразол-4-ілметилтіо)-2 ізоксазоліну (запропонована сполука №3-0022) Одержання 3-(5-хлор-1-метил-3-феніл-1Н0,2г (4,0ммоль) гідроксиду натрію і 1мл води піразол-4-ілметилсульфініл)-5,5-диметил-2додали до розчину 0,25г (4,0ммоль) етантіолу, ізоксазоліну (запропонована сполука №3-0003) розчиненого в 10мл Ν,Ν-диметилформаміду. Су0,87г m-хлорпербензойної кислоти (чистота: міш піддали перемішуванню при кімнатній темпе70%, 3,54ммоль) додали в умовах охолодження ратурі протягом 30 хвилин. Потім до неї додали льодом до розчину 0,85г (2,53ммоль) 3-(5-хлор-10,5г (1,4ммоль) 5,5-диметил-3-(5-фтор-1-феніл-3метил-3-феніл-1Н-піразол-4-ілметилтіо)-5,5трифторметил-1Н-піразол-4-ілметилтіо)-2диметил-2-ізоксазоліну, розчиненого в 30мл хлоізоксазоліну, розчиненого в 5мл Ν,Νроформу. Суміш піддали перемішуванню при кімдиметилформаміду. Отриману суміш піддали пенатній температурі протягом 1 години з метою ремішуванню протягом 1 години з метою ініціюініціювання реакції. Після завершення реакції реавання реакції. Після завершення реакції реакційну кційну суміш влили у воду, після чого екстрагували суміш влили у воду, після чого екстрагували етихлороформом. Отриманий органічний шар послілацетатом. Отриманий органічний шар промили довно промили водним розчином гідросульфіту водним розчином хлориду натрію, а потім висушинатрію, водним розчином гідрокарбонату натрію і ли над безводним сульфатом магнію. Отриманий водним розчином хлориду натрію, а потім висуширозчин піддали вакуумній перегонці з метою видали над безводним сульфатом магнію. Отриманий лення розчинника, що містився в ньому, у резульрозчин піддали вакуумній перегонці з метою видататі чого було отримано 0,6г (вихід: 100%) 5,5лення розчинника, що містився в ньому. Залишок диметил-3-(5-етилтіо-1-феніл-3-трифторметил-1Ночистили методом колонкової хроматографії на 1 піразол-4-ілметилтіо)-2-ізоксазоліну. Н-ЯМР силікагелі (проявний розчинник: змішаний розчинник гексан-етилацетат), у результаті чого було [CDCІ3/TMC, d (проміль)]: отримано 0,48г (вихід: 53,9%) 3-(5-хлор-1-метил-37,62-7,47 (5Н, м), 4,44 (2Н, с), 2,83 (2Н, с), 2,50 феніл-1Н-піразол-4-ілметилсульфініл)-5,5(2Н, кв), 1,45 (6Н, с), 1,02 (3Н, т) диметил-2-ізоксазоліну у вигляді прозорої в'язкої речовини. Одержання 5,5-диметил-3-(5-етилсульфоніл-11 феніл-3-трифторметил-1Н-іпіразол~4Н-ЯМР [CDCІ3 /TMC, d (проміль)]: ілметилсульфоніл)-2-ізоксазоліну (запропонована 7,63-7,60 (2H, м), 7,48-7,37 (3Н, м), 4,29 (2Н, сполука №3-0004) кв), 3,91 (3Н, с), 3,12 (1Н, д), 2,79 (1Н,д), 1,41 (3Н, 27 78071 28 1,7 m-хлорпербензойної кислоти (чистота: при кімнатній температурі протягом 20 годин з 70%, 6,7ммоль) додали в умовах о холодження метою ініціювання реакції. Після завершення реальодом до розчину 0,6г (1,3ммоль) 5,5-диметил-3кції реакційну суміш влили у воду, після чого екст(5-етилтіо-1-феніл-3-трифторметил-1Н-піразол-4рагували хлороформом. Отриманий органічний ілметилтіо)-2-ізоксазоліну, розчиненого в 10мл шар послідовно промили водним розчином гідрохлороформу. Суміш піддали перемішуванню при сульфіту натрію, водним розчином гідрокарбонату кімнатній температурі протягом 16 годин з метою натрію і водним розчином хлориду натрію, а потім ініціювання реакції. Після завершеная реакції реависушили над безводним сульфатом магнію. кційну суміш влили у воду, після чого екстрагували Отриманий розчин піддали вакуумній перегонці з хлороформом. Отриманий органічний шар посліметою видалення розчинника, що містився в ньодовно промили водним розчином гідросульфіту му. Отримані кристали промили гексаном, у ренатрію, водним розчином гідрокарбонату натрію і зультаті чого було отримано 0,2г (вихід: 52,0%) водним розчином хлориду натрію, а потім висуши5,5-диметил-3-(5-диметиламіно-1-феніл-3ли над безводним сульфатом магнію. Отриманий трифтор)метил-1Н-піразол-4-ілметилсульфоніл)-2розчин піддали вакуумній перегонці з метою видаізоксазоліну у вигляді білого порошку (температулення розчинника, що містився в ньому. Отримані ра плавлення: 150-151°С). 1 кристали промили гексаном, у результаті чого буН-ЯМР [CDCІ3 /TMC, d (проміль)]: ло отримано 0,6г (вихід: 93,0%) 5,5-диметил-3-(57,61-7,38 (5Н, м), 4,75 (2Н, с), 3,13 (2Н, с), 2,76 етилсульфоніл-1-феніл-3-трифторметил-1Н(6Н, с), 1,53 (6Н, с) піразол-4-ілметилсульфоніл)-2-ізоксазоліну у ви гляді блідо-жовтих кристалів (температура плавОдержання 3-(1-трет-бутил-5-хлор-3лення: 158-160°С). трифторметил-1Н-піразол-4-ілметилтіо)-5,51 диметил-2-ізоксазоліну (запропонована сполука Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 7,58-7,54 (5Н, м), 5,16 (2Н, с), 3,18 (2Н, с), 3,15 №3-0006) (2Н, кв), 1,55 (6Н, с), 1,24 (3Н, т) 21,8г гідросульфіду натрію (чистота: 70%, 272,5ммоль) додали до розчину 24,1г Одержання 5,5-диметил-3-(5-диметиламіно-1(136,0ммоль) 5,5-диметил-3-метилсульфоніл-2феніл-3-трифторметил-1Н-піразол-4-ілметилтіо)-2ізоксазоліну, розчиненого в 200мл Ν,Νізоксазоліну (запропонована сполука №3-0023) диметилформаміду. Суміш піддали перемішуван0,8г (6,7ммоль) 40%-ого водного розчину диню протягом 1 години. Потім до неї додали 18,8г метиламіну додали до розчину 0,5г (1,3ммоль) 5,5(136,2ммоль) безводного карбонату натрію і 21,0г диметил-3-(5-фтор-1-феніл-3-трифторметил-1Н(136,2ммоль) ронгаліту. Отриману суміш піддали піразол-4-ілметилтіо)-2-ізоксазоліну, розчиненого в перемішуванню протягом 2 годин. Потім до неї 10мл Ν,Ν-диметилформаміду. С уміш піддали педодали в умовах о холодження льодом 40г ремішуванню при 100°С протягом 9 годин у герме(125ммоль) 4-бромметил-1-трет-бутил-5-хлор-3тизованій трубці. Потім до неї додали 3,0г трифторметил-1Н-піразолу. Отриману суміш під(26,6ммоль) 40%-ого водного розчину диметиладали перемішуванню при кімнатній температурі міну, після чого отриману суміш піддали переміпротягом 2 годин з метою ініціювання реакції. Пісшуванню протягом 9 годин з метою ініціювання ля завершення реакції реакційну суміш влили у реакції. Після завершення реакції реакційну суміш воду, після чого екстрагували етилацетатом. влили у воду, після чого екстрагували етилацетаОтриманий органічний шар промили водою і водтом. Отриманий органічний шар промили водним ним розчином хлориду натрію, а потім висушили розчином хлориду натрію, а потім висушили над над безводним сульфатом магнію. Отриманий безводним сульфатам магнію. Отриманий розчин розчин піддали вакуумній перегонці з метою видапіддали вакуумній перегонці з метою видалення лення розчинника, що містився в ньому. Залишок розчинника, що містився в ньому. Залишок очисочистили методом колонкової хроматографії на тили методом колонкової хроматографії на силікасилікагелі (проявний розчинник: змішаний розчингелі (проявний розчинник: змішаний розчинник ник гексан-етилацетат), у результаті чого було гексан-етилацетат), у результаті чого було отриотримано 23,0г (вихід: 57,1%) 3-(1-трет-бутил-5мано 0,4г (вихід: 80,6%) 5,5-диметил-3-(5хлор-3-трифторметил-1Н-піразол-4-ілметилтіо)диметиламіно-1-феніл-3-трифторметил-1Н5,5-диметил-2-ізоксазоліну у вигляді блідопіразол-4-ілметилтіо)-2-ізоксазоліну. рожевих кристалів (температура плавлення: 79,01 81,0°С). Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 1 7,58-7,38 (5Н, м), 4,35 (2Н, с), 2,82 (2Н, с), 2,77 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: (6Н, с), 1,45 (6Н, с) 4,24 (2Η, с), 2,80 (2Н, с), 1,71 (9Н, с), 1,43 (6Н, с) Одержання 5,5-диметил-3-(5-диметиламіно-1 феніл-3-трифторметил-1Н-піразол-4Одержання 3-(5-хлор-3-трифторметил-1Нілметилсульфоніл)-2-ізоксазоліну (запропонована піразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну сполука №3-0005) (запропонована сполука №3-0007) 0,7г m-хлорпербензойної кислоти (чистота: 19,8г (53,4ммоль) 3-(1-трет-бутил-5-хлор-370%, 2,7ммоль) додали в умовах о холодження трифторметил-1Н-піразол-4-ілметилтіо)-5,5льодом до розчину 0,4г (1,1ммоль) 5,5-диметил-3диметил-2-ізоксазоліну додали до 170мл 25%-ого (5-диметиламіно-1-феніл-3-трифторметил-1Нрозчину гідробромід-оцтова кислота. Суміш піддапіразол-4-ілметилтіо)-2-ізоксазоліну, розчиненого в ли перемішуванню при 40-50°С протягом 2 годин з 10мл хлороформу. Суміш піддали перемішуванню метою ініціювання реакції. Після підтвердження 29 78071 30 завершення реакції реакційну суміш влили у воду, ілметилтіо)-5,5-диметил-2-ізоксазоліну, розчиненопісля чого екстрагували етилацетатом. Отриманий го в 20мл хлороформу. С уміш піддали перемішуорганічний шар промили водою і водним розчином ванню спочатку протягом 1 години, а потім при хлориду натрію, а потім висушили над безводним кімнатній температурі протягом 12 годин з метою сульфатом магнію. Отриманий розчин піддали ініціювання реакції. Після підтвердження завервакуумній перегонці з метою видалення розчиннишення реакції реакційну суміш влили у воду, після ка, що містився в ньому, у результаті чого було чого екстрагували хлороформом. Отриманий оротримано 12,0г (вихід: 60,6%) 3-(5-хлор-3ганічний шар послідовно промили водним розчитрифто|)метил-1Н-піразол-4-ілметилтіо)-5,5ном гідросульфіту натрію, водним розчином гідродиметил-2-ізоксазоліну у вигляді блідо-жовтих карбонату натрію, водою і водним розчином кристалів (температура плавлення: 120,0-122,0°С). хлориду натрію, а потім висушили над безводним 1 сульфатом магнію. Отриманий розчин піддали Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 4,26 (2Н, с), 2,81 (2Н, с), 1,44 (6Н, с) вакуумній перегонці з метою видалення розчинника, що містився в ньому. Отриману тверду речови ну промили n-гексаном, у результаті чого було Одержання 3-(5-хлор-1-дифторметил-3отримано 0,4г (вихід: 53,3%) 3-(5-хлор-1трифторметил-1Н-піразол-4-ілметилтю)-5,5дифторметил-3-трифторметил-1Н-піразол-4диметил-2-ізоксазоліну (запропонована сполука №3-0008) і 3-(3-хлор-1-дифторметил-5ілметилсульфоніл)-5,5-димєnил-2-ізоксазоліну у вигляді білого порошку (температура плавлення: трифторметил-1Н-піразол-4-ілметилтіо)-5,5126,0-127,0°С). диметил-2-ізоксазоліну (запропонована сполука 1 №3-0009) Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 3,1г (22,5ммоль) безводного карбонату калію 7,26 (1Н, т), 4,68 (2Н, с), 3,11 (2Н, с), 1,53 (6Н, додали до розчину 2,3г (7,3ммоль) 3-(5-хлор-3с) трифторметил-1Н-піразол-4-ілметилтіо)-5,5 диметил-2-ізоксазоліну, розчиненого в 50мл Ν,ΝОдержання 3-(3-хлор-1-дифторметил-5диметилформаміду. Потім у неї вдули хлордифтотрифторметил-1Н-піразод-4-ілметилсульфоніл)рметан. Отриману суміш піддали перемішуванню 5,5-диметил-2-ізоксазоліну (запропонована сполупри 130-140°С протягом 3 годин з метою ініціюка №3-0011) вання реакції. Після підтвердження завершення 1,1г m-хлорпербензойної кислоти (чистота: реакції реакційну суміш влили у воду, після чого 70%, 6,4ммоль) додали в умовах о холодження екстрагували етилацетатом. Отриманий органічльодом до розчину 0,54г (1,5ммоль) 3-(3-хлор-1ний шар промили водою і водним розчином хлодифторметил-5-трифторметил-1Н-піразол-4риду натрію, а потім висушили над безводним суілметилтіо)-5,5-диметил-2-ізоксазоліну, розвиненольфатом магнію. Отриманий розчин піддали го в 20мл хлороформу. С уміш піддали перемішувакуумній перегонці з метою видалення розчинниванню спочатку протягом 1 години, а потім при ка, що містився в ньому. Залишок очистили метокімнатній температурі протягом 12 годин з метою дом колонкової хроматографії на силікагелі (проініціювання реакції. Після підтвердження заверявний розчинник: змішаний розчинник гексаншення реакції реакційну суміш влили у воду, після етилацетат), у результаті чого було отримано чого екстрагували хлороформом. Отриманий ор0,69г (вихід: 25,8%) 3-(5-хлор-1-дифторметил-3ганічний шар послідовно промили водним розчитрифторметил-1Н-піразол-4-ілметилтіо)-5,5ном гідросульфіту натрію, водним розчином гідродиметил-2-ізоксазоліну у вигляді блідо-жовтих карбонату натрію, водою і водним розчином кристалів (температура плавлення: 41,0-42,0°С) і хлориду натрію, а потім висушили над безводним 0,54г (вихід: 20,2%) 3-(3-хлор-1-дифторметил-5сульфатом магнію. Отриманий розчин піддали трифторметил-1Н-піразол-4-ілметилтіо)-5,5вакуумній перегонці з метою видалення розчиннидиметил-2-ізоксазоліну у вигляді білого порошку ка, що містився в ньому. Отриману тверду речови(температура плавлення: 89,0-90,0°С). 3-(5-хлор-1ну промили n-гексаном, у результаті чого було дифторметил-3-трифторметил-1Н-піразол-4отримано 0,47г (вихід: 79,7%) 3-(3-хлор-1ілметилтіо)-5,5-диметил-2-ізоксазолін дифторметил-5-трифторметил-1Н-піразол-41 ілметилсульфоніл)-5,5-диметил-2-ізоксазоліну у Н-ЯМР [CDCІ3 /TMC, d (проміль)]: вигляді білого порошку (температура плавлення: 7,22 (1Н, т), 4,25 (2Н, с), 2,80 (2Н, с), 1,44 (6Н, 136,0-137,0°С). с) 1 3-(3-хлор-1-дифторметил-5-трифторметил-1НН-ЯМР [CDCІ3 /TMC, d (проміль)]: піразол-4-ілметилтіо)-5,5-диметил-2-ізоксазолін 7,23 (1Н, т), 4,71 (2Н, с), 2,11 (2Н, с), 1,53 (6Н, 1 с) Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 7,19 (1Н, т), 4,28 (2Н, с), 2,80 (2Н, с), 1,44 (6Н, с) Одержання 5,5-диметил-3-(3-метокси-1-метил5-трифторметил-1Н-піразол-4-ілметилтіо)-2 ізоксазоліну (запропонована сполука №3-0024) Одержання 3-(5-хлор-1-дифторметил-33,1г гідрату гідросульфіду натрію (чистота: трифторметил-1Н-піразол-4-ілметилсульфоніл)70%, 22,0ммоль) додали до розчину 3,3г 5,5-диметил-2-ізоксазоліну (запропонована сполука №3-0010) (17,3ммоль) 5,5-диметил-3-етилсульфоніл-2ізоксазоліну, розчиненого в 10мл Ν,Ν1,4г m-хлорпербензойної кислоти (чистота: диметилформаміду. Суміш піддали перемішуван70%, 8,1ммоль) додали в умовах о холодження ню протягом 2 годин. Потім до неї додали 3,1г льодом до розчину 0,69г (1,9ммоль) 3-(5-хлор-1(22,0ммоль) безводного карбонату калію, 2,7г дифторметил-3-трифторметил-1Н-піразол-4 31 78071 32 (17,5ммоль) ронгаліту і 4,0г (17,5ммоль) 4ініціювання реакції. Після завершення реакції реахлорметил-3-метокси-1-метил-5-трифторметилкційну суміш влили у воду, після чого екстрагували 1Н-піразолу. Отриману суміш піддали перемішухлороформом. Отриманий органічний шар посліванню при кімнатній температурі протягом 2 годин довно промили водним розчином гідросульфіту з метою ініціювання реакції. Після завершення натрію, водним розчином гідрокарбонату натрію і реакції реакційну суміш влили у воду, після чого водним розчином хлориду натрію, а потім висушиекстрагували етилацетатом. Отриманий органічли над безводним сульфатом магнію. Отриманий ний шар промили водним розчином хлориду нарозчин піддали вакуумній перегонці з метою видатрію, а потім висушили над безводним сульфатом лення розчинника, що містився в ньому. Отримані магнію. Отриманій розчин піддали вакуумній перекристали промили гексаном, у результаті чого бугонці з метою видалення розчинника, що містився ло отримано 0,24г (вихід: 73,0%) 5,5-диметил-3-(3в ньому. Залишок очистили методом колонкової етокси-1-метил-5-трифторметил-1Н-піразол-4хроматографії на силікагелі (проявний розчинник: ілметилсульфоніл)-2-ізоксазоліну у вигляді білих змішаний розчинник гексан-етилацетат), у резулькристалів (температура плавлення: 124-125°С). 1 таті чого було отримано 2,8г (вихід: 52,0%) 5,5Н-ЯМР [CDCІ3 /TMC, d (проміль)]: диметил-3-(3-метокси-1-метил-5-трифторметил4,50 (2Н, с), 4,27 (2Н, кв), 3,86 (3Н, с), 3,04 (2Н, 1Н-піразол-4-ілметилтіо)-2-ізоксазоліну. с) 1,49 (6Н, с), 1,39 (3Н, т) Одержання 5,5-диметил-3-(3-гідрокси-1-метилОдержання 5,5-диметил-3-(5-фтор-1-метил-35-трифторметил-1Н-піразол-4-ілметилтіо)-2трифторметил-1Н-піразол-4-ілметилтіо)-2ізоксазоліну (запропонована сполука №3-0025) ізоксазоліну (запропонована сполука №3-0027) До 20мл 25%-ого розчину гідроброміду-оцтова 19,3г гідросульфіду натрію (чистота: 70%, кислота додали 3,3г (10,6ммоль) 5,5-диметил-3-(3344,6ммоль) додали до розчину 21,3г метокси-1-метил-5-трифторметил-1Н-піразол-4(120,3ммоль) 5,5-диметил-3-метилсульфоніл-2ілметилтіо)-2-ізоксазоліну. Суміш піддали переміізоксазоліну, розчиненого в 200мл Ν,Νшуванню при 50°С протягом 3 годин з метою ініцідиметилформаміду. Суміш піддали перемішуванювання реакції. Після завершення реакції реакційню протягом 1 години. Потім до неї додали 16,7г ну суміш піддали вакуумній перегонці з метою (121,0ммоль) безводного карбонату калію і 18,6г видалення розчинника, що містився в ній. Залишок (120,7ммоль) ронгаліту. Отриману суміш піддали влили у воду. Отримані кристали зібрали фільтраперемішуванню протягом 2 годин. Потім до неї цією, промини водою і висушили, у результаті чого додали в умовах о холодження льодом 31,4г було отримано 3,1г (вихід: 96,0%) цільового 5,5(120,3ммоль) 4-бромметил-5-фтор-1-метил-3диметил-3-(3-гідрокси-1-метил-5-трифторметилтрифторметил-1Н-піразолу. Отриману суміш під1Н-піразол-4-ілметилтіо)-2-ізоксазоліну. дали перемішуванню при кімнатній температурі протягом 2 годин з метою ініціювання реакції. ПісОдержання 5,5-диметил-3-(3-етокси-1-метилля підтвердження завершення реакції реакційну 5-трифторметил-1Н-піразол-4-ілметилтіо)-2суміш влили у воду, після чого екстрагували етиізоксазоліну (запропонована сполука №3-0026) лацетатом. Отриманий органічний шар промили 0,20г (1,3ммоль) безводного карбонату калію і водою і водним розчином хлориду натрію, а потім 0,20г (1,5ммоль) етил йодиду додали до розчину висушили над безводним сульфатом магнію. 0,30г (1,0ммоль) 5,5-диметил-3-(3-гідрокси-1Отриманий розчин піддали вакуумній перегонці з метил-5-трифторметил-1Н-піразол-4-ілметилтіо)метою видалення розчинника, що містився в ньо2-ізоксазоліну, розчиненого в 10мл Ν,Νму, у результаті чого було отримано 29,0г (вихід: диметилформаміду. Суміш піддали перемішуван90,3%) 5,5-диметил-3-(5-фтор-1-метил-3ню при 50°С протягом 3 годин з метою ініціювання трифторметил-1Н-піразол-4-ілметилтіо)-2реакції. Після завершення реакції реакційну суміш ізоксазоліну у вигляді жовтої маслянистої речовивлили у воду, після чого екстрагували етилацетани. 1 том. Отриманий органічний шар промили водним Н-ЯМР [CDCІ3 /TMC, d (проміль)]: розчином хлориду натрію, а потім висушили над 4,24 (2Η, с), 3,90 (3Н, с), 2,78 (2Н, с), 1,42 (6Н, безводним сульфатом магнію. Отриманий розчин с) піддали вакуумній перегонці з метою видалення розчинника, що містився в ньому, у результаті чого Одержання 5,5-диметил-3-(5-метокси-1-метилбуло отримано 0,30г (вихід: 92,0%) цільового 5,53-трифторметил-1Н-піразол-4-ілметилтіо)-2диметил-3-(3-етокси-1-метил-5-трифторметил-1Нізоксазоліну (запропонована сполука №3-0028) піразол-4-ілметилтіо)-2-ізоксазоліну. 0,77г (4,0ммоль) метилату натрію (28%-ий розчин метанолу) додали до розчину 0,5г Одержання 5,5-диметил-3-(3-етокси-1-метил(1,6ммоль) 5,5-диметил-3-(5-фтор-1-метил-35-трифторметил-1Н-піразод-4-ілметилсульфоніл)трифторметил-1Н-піразол-4-ілметилтіо)-22-ізоксазоліну (запропонована сполука №3-0012) ізоксазоліну, розчиненого в 20мл метанолу. Суміш 0,68г m-хлорпербензойної кислоти (чистота: піддали перемішуванню в умовах дефле гмації 70%, 2,76ммоль) додали в умовах охолодження протягом 4 годин з метою ініціювання реакції. Післьодом до розчину 0,30г (0,92ммоль) 5,5-диметилля підтвердження завершення реакції реакційну 3-(3-етокси-1-метил-5-трифторметил-1Н-піразол-4суміш влили у воду, після чого екстрагували етиілметилтіо)-2-ізоксазоліну, розчиненого в 10мл лацетатом. Отриманий органічний шар промили хлороформу. Суміш піддали перемішуванню при водою і водним розчином хлориду натрію, а потім кімнатній температурі протягом 5 годин з метою висушили над безводним сульфатом магнію. 33 78071 34 Отриманий розчин піддали вакуумній перегонці з 3-трифторметил-1Н-піразол-4-ілметилтіо)-5,5метою видалення розчинника, що містився в ньодиметил-2-ізоксазоліну у ви гляді жовтої маслянисму, у результаті чого було отримано 0,5г (вихід: тої речовини. 96,7%) 5,5-диметил-3-(5-метокси-1-метил-3 трифторметил-1Н-піразол-4-ілметилтіо)-2Одержання 3-(5-(2-хлорфенокси)-1-метил-3ізоксазоліну у вигляді жовтої маслянистої речовитрифторметил-1Н-піразол-4-ілметилсульфоніл)ни. 5,5-диметил-2-ізоксазоліну (запропонована сполу1 ка №3-0014) Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 1,0г m-хлорпербензойної кислоти (чистота: 4,26 (2Н, с), 4,07 (3Н, с), 3,72 (3Н, с), 2,80 (2Н, 70%, 5,8ммоль) додали в умовах о холодження с), 1,43 (6Н, с) льодом до розчину 0,63г (1,5ммоль) 3-(5-(2 хлорфенокси)-1-метил-3-трифторметил-1НОдержання 5,5-диметил-3-(5-метокси-1-метил3-трифторметил-1Н-піразол-4-ілметилсульфоніл)піразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну, розчиненого в 20мл хлороформу. Суміш піддали 2-ізоксазоліну (запропонована сполука №3-0013) перемішуванню спочатку протягом 1 години, а по1,3г m-хлорпербензойної кислоти (чистота: тім при кімнатній температурі протягом 12 годин з 70%, 7,5ммоль) додали в умовах о холодження метою ініціювання реакції. Після підтвердження льодом до розчину 0,5г (1,5ммоль) 5,5-диметил-3(5-метокси-1-метил-3-трифторметил-1Н-піразол-4завершення реакції реакційну суміш влили у воду, після чого екстрагували хлороформом. Отриманий ілметилтіо)-2-ізоксазоліну, розчиненого в 20мл органічний шар послідовно промили водним розхлороформу. Суміш піддали перемішуванню спочином гідросульфіту натрію, водним розчином чатку протягом 1 години, а потім при кімнатній тегідрокарбонату натрію, водою і водним розчином мпературі протягом 12 годин з метою ініціювання реакції. Після підтвердження завершення реакції хлориду натрію, а потім висушили над безводним сульфатом магнію. Отриманий розчин піддали реакційну суміш влили у воду, після чого екстрагувакуумній перегонці з метою видалення розчиннивали хлороформом. Отриманий органічний шар ка, що містився в ньому. Отриману тверду речовипослідовно промили водним розчином гідросульну промили n-гексаном, у результаті чого було фіту натрію, водним розчином гідрокарбонату натрію, водою і водним розчином хлориду натрію, а отримано 0,31г (вихід: 45,7%) 3-(5-(2хлорфенокси)-1-метил-3-трифторметил-1Нпотім висушили над безводним сульфатом магнію. піразол-4-ілметилсульфоніл)-5,5-диметил-2Отриманий розчин піддали вакуумній перегонці з ізоксазоліну у вигляді білого порошку (температуметою видалення розчинника, що містився в ньора плавлення: 67,0-70,0°С). му. Отриману тверду речовину промили n1 гексаном, у результаті чого було отримано 0,31г Н-ЯМР [CDCІ3 /TMC, d (проміль)]: (вихід: 58,2%) 5,5-диметил-3-(5-метокси-1-метил-37,50-6,91 (4Н, м), 4,45 (2Н, с), 3,71 (3Н, с), 3,03 трифторметил-1Н-піразол-4-ілметилсульфоніл)-2(2Н, с), 1,47 (6Н, с) ізоксазоліну у вигляді білого порошку (температу ра плавлення: 113,0-114,0°С). Одержання 3-(5-циклопентилокси-1-метил-31 трифторметил-1Н-піразол-4-ілметилтіо)-5,5Н-ЯМР [CDCІ3 /TMC, d (проміль)]: диметил-2-ізоксазоліну (запропонована сполука 4,60 (2Н, с), 4,11 (3Н, с), 3,79 (3Н, с), 3,10 (2Н, №3-0030) с), 1,51 (6Н, с) До розчину 0,43 (1,6ммоль) трифенілфосфіну, розчиненого в 10мл бензолу, додали 0,14г Одержання 3-(5-(2-хлорфенокси)-1-метил-3(1,6ммоль) циклопентанолу, 0,5г (1,6ммоль) 5,5трифторметил-1Н-піразол-4-ілметилтіо)-5,5диметил-3-(5-гідрокси-1-метил-3-трифторметилдиметил-2-ізоксазоліну (запропонована сполука 1Н-піразол-4-ілметилтіо)-2-ізоксазоліну і 0,7г №3-0029) (1,6ммоль) діетилазодикарбоксилату (40%-ий роз0,2г (8,3ммоль) гідриду натрію (чистота: 60%) чин толуолу). С уміш піддали перемішуванню при додали в умовах о холодження льодом до розчину кімнатній температурі протягом 12 годин з метою 0,44г (3,4ммоль) 2-хлорфенолу, розчиненого в ініціювання реакції. Після підтвердження завер30мл Ν,Ν-диметилформаміду. С уміш піддали пешення реакції реакційну суміш влили у воду, після ремішуванню протягом 1 години. Потім до неї дочого екстрагували етилацетатом. Отриманий ордали 0,7г (2,2ммоль) 5,5-диметил-3-(5-фтор-1ганічний шар промили водою і водним розчином метил-3-трифторметил-1Н-піразол-4-ілметилтіо)хлориду натрію, а потім висушили над безводним 2-ізоксазоліну. Отриману суміш піддали перемішусульфатом магнію. Отриманий органічний шар ванню при 120-130°С протягом 5 годин з метою піддали вакуумній перегонці з метою видалення ініціювання реакції. Після підтвердження заверрозчинника, що містився в ньому. Залишок очисшення реакції реакційну суміш влили у воду, після тили методом колонкової хроматографії на силікачого екстрагували етилацетатом. Отриамний оргелі (проявний розчинник: змішаний розчинник ганічний шар промили водою і водним розчином гексан-етилацетат), у результаті чого було отрихлориду натрію, а потім висушили над безводним мано 0,52г (вихід: 85,2%) 3-{5-циклопентилокси-1сульфатом магнію. Отриманий розчин піддали метил-3-трифторметил-1Н-піразол-4-ілметилтіо)вакуумній перегонці з метою видалення розчинни5,5-диметил-2-ізоксазоліну у ви гляді безбарвної ка, що містився в ньому. Залишок очистили метопрозорої маслянистої речовини. дом колонкової хроматографії на силікагелі (про явний розчинник: змішаний розчинник гексанОдержання 3-(5 -циклопентилокси-1-метил-3етилацетат), у результаті чого було отримано трифторметил-1Н-піразол-4-ілметилсульфоніл)0,63г (вихід: 66,7%) 3-(5-(2-хлорфенокси)-1-метил 35 78071 36 5,5-диметил-2-ізоксазоліну (запропонована сполуремішуваний) спочатку протягом 1 години, а потім ка №3-0015) при кімнатній температурі протягом 12 годин з 0,85г m-хлорпербензойної кислоти (чистота: метою ініціювання реакції. Після підтвердження 70%, 4,9ммоль) додали в умовах о холодження завершення реакції реакційну суміш влили у воду, льодом до розчину 0,52г (1,4ммоль) 3-(5після чого екстрагували хлороформом. Отриманий циклопентилокси-1-метил-3-трифторметил-1Норганічний шар послідовно промили водним розпіразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну, чином гідросульфіту натрію, водним розчином розчиненого в 20мл хлороформу. Суміш піддали гідрокарбонату натрію, водою і водним розчином перемішуванню спочатку протягом 1 години, а похлориду натрію, а потім висушили над безводним тім при кімнатній температурі протягом 12 годин з сульфатом магнію. Отриманий розчин піддали метою ініціювання реакції. Після підтвердження вакуумній перегонці з метою видалення розчиннизавершення реакції реакційну суміш влили у воду, ка, що містився в ньому. Отриману тверду речовипісля чого екстрагували хлороформом. Отриманий ну промили η-гексаном, у результаті чого було органічний шар послідовно промили водним розотримано 0,43г (вихід: 76,4%) 3-(5-ціано-1-метилчином гідросульфіту натрію, водним розчином 3-трифторметил-1Н-піразол-4-ілметилсульфоніл)гідрокарбонату натрію, водою і водним розчином 5,5-диметил-2-ізоксазоліну у вигляді білого порошхлориду натрію, а потім висушили над безводним ку (температура плавлення: 105,0-108,0°С). 1 сульфатом магнію. Отриманий розчин піддали Н-ЯМР [CDCІ3 /TMC, d (проміль)]: вакуумній перегонці з метою видалення розчинни4,73 (2Н, с), 4,16 (3Н, с), 3,14 (2Н, с), 1,53 (6Н, ка, що містився в ньому. Отриману тверду речовис) ну промили n-гексаном, у результаті чого було отримано 0,2г (вихід: 35,5%) 3-(5Одержання 3-(3,5-дихлор-1-етил-1Н-піразол-4циклопентилокси-1-метил-3-трифторметил-1Нілметилтіо)-5,5-диметил-2-ізоксазоліну (запропопіразол-4-ілметилсульфоніл)-5,5-диметил-2нована сполука №3-0032) ізоксазоліну у вигляді білого порошку (температу0,6г гідросульфіду натрію (чистота: 70%, ра плавлення: 113,0-114,0°С). 10,7ммоль) додали до розчину 0,7г (3,7ммоль) 5,51 Н -ЯМР [CDCІ3/TMC, d (проміль)]: диметил-3-етилсульфоніл-2-ізоксазоліну, розчине5,03 (1Н, шир.), 4,60 (2Н, с), 3,73 (ЗН, с), 3,05 ного в 30мл Ν,Ν-диметилформаміду. Суміш підда(2Н, с), 1,88-1,70 (8Н, м), 1,50 (6Н, с) ли перемішуванню протягом 1 години. Потім до неї додали 0,51г (3,7ммоль) безводного карбонату Одержання 3-(5-ціано-1-метил-3калію і 0,56г (3,6ммоль) ронгаліту. Отриману суміш трифторметил-1Н-піразол-4-ілметилтіо)-5,5піддали перемішуванню протягом 2 годин. Потім диметил-2-ізоксазоліну (запропонована сполука до неї додали в умовах охолодження льодом 0,9г №3-0031) (3,5ммоль) 4-бромметил-3,5-дихлор-1-етил-1Н0,2г (4,0ммоль) ціаніду натрію додали до розпіразолу. Отриману суміш піддали перемішуванню чину 0,5г (1,6ммоль) 5,5-диметил-3-(5-фтор-1при кімнатній температурі протягом 2 годин з меметил-3-трифторметил-1Н-піразол-4-ілметилтіо)тою ініціювання реакції. Після підтвердження за2-ізоксазоліну, розчиненого в 30мл Ν,Νвершення реакції реакційну суміш влили у воду, диметилформаміду. Суміш піддали перемішуванпісля чого екстрагували етилацетатом. Отриманий ню при 40°С протягом 1 години з метою ініціюванорганічний шар промили водою і водним розчином ня реакції. Післяпідтвердження завершення реакхлориду натрію, а потім висушили над безводним ції реакційну суміш влили у воду, рісля чого сульфатом магнію. Отриманий розчин піддали екстрагували етилацетатом. Отриманий органічвакуумній перегонці з метою видалення розчинниний шар промили водою і водним розчином хлока, що містився в ньому. Залишок очистили меториду натрію, а потім висушили над безводним судом колонкової хроматографії на силікагелі (прольфатом магнію. Отриманий розчин піддали явний розчинник: змішаний розчинник гексан-ети л вакуумній перегонці з метою видалення розчинниацетат), у результаті чого було о тримано 0,8г (вика, що містився в ньому, у результаті чого було хід: 70,8 %) 3-(3,5-дихлор-1-етил-1Н-піразол-4отримано 0,9г неочищфного 3-(5-ціано-1-метил-3ілметилтіо)-5,5-диметил-2-ізоксазоліну у вигляді трифторметил-1Н-піразол-4-ілметилтіо)-5,5безбарвної прозорої маслянистої речовини. 1 диметил-2-ізоксазоліну у ви гляді жовтої маслянисН-ЯМР [CDCІ3 /TMC, d (проміль)]: тої речовини. 4,14 (2Н, с), 4,14 (2Н, кв), 2,81 (2Н, с), 1,43 (6Н, 1 Н-ЯΜΡ [CDCІ3 /TMC, d (проміль)]: с), 1,42 (3Н, т) 4,30 (2Н, с), 4,08 (3Н, с), 2,81 (2Н, с), 1,43 (6Н, с) Одержання 3-(3,5-дихлор-1-етил-1Н-піразол-4 ілметилсульфоніл)-5,5-диметил-2-ізоксазоліну Одержання 3-(5-ціано-1-метил-3(запропонована сполука №3-0017) трифторметил-1Н-піразол-4-ілметилсульфоніл)2,0г m-хлорпербензойної кислоти (чистота: 5,5-диметил-2-ізоксазоліну (запропонована сполу70%, 11,6ммоль) додали в умовах охолодження ка №3-0016) льодом до розчину 0,8г (2,6ммоль) 3-(3,5-дихлор2,1г m-хлорпербензойної кислоти (чистота: 1-етил-1Н-піразол-4-ілметилтіо)-5,5-диметил-270%, 12,2ммоль) додали в умовах охолодження ізоксазоліну, розчиненого в 20мл хлороформу. льодом до розчину 0,9г 3-(5-ціано-1-метил-3Суміш піддали перемішуванню спочатку протягом трифторметил-1Н-піразол-4-ілметилтіо)-5,51 години, а потім при кімнатній температурі протядиметил-2-ізоксазоліну (неочищена сполука), розгом 12 годин з метою ініціювання реакції. Після чиненого в 50мл хлороформу. Суміш піддали пепідтвердження завершення реакції реакційну су 37 78071 38 міш влили у воду, після чого екстрагували хлоророзчин піддали вакуумній перегонці з метою видаформом. Отриманий органічний шар послідовно лення розчинника, що містивоя в ньому. Отримані промили водним розчином гідросульфіту натрію, кристали промили гексаном, у результаті чого буводним розчином гідрокарбонату натрію, водою і ло отримано 1,7г (вихід: 85,9%) 3-(5-хлор-3водним розчином хлориду натрію, а потім висушидифторметил-1-метил-1Н-піразол-4ли над безводним сульфатом магнію. Отриманий ілметилсульфоніл)-5,5-диметил-2-ізоксазоліну у розчин піддали вакуумній перегонці з метою видавигляді білих кристалів (температура плавлення: лення розчинника, що містився в ньому. Отриману 78-79°С). 1 тверду речовину промили n-гексаном, у результаті Н-ЯМР [CDCІ3 /TMC, d (проміль)]: чого було отримано 0,41г (вихід: 46,6%) 3-(3,56,80 (1Н, т, J=54,8Гц), 4,60 (2Н, с), 3,91 (3Н, с), дихлор-1-етил-1Н-піразол-4-ілметилсульфоніл)3,08 (2Н, с), 1,51 (6Н, с) 5,5-диметил-2-ізоксазоліну у вигляді білого порош ку (температура плавлення: 105,0-107,0°С). Одержання 5,5-диметил-3-(5-метил-31 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: трифторметилізоксазол-4-ілметилтіо)-24,48 (2Н, с), 4,19 (2Н, кв), 3,05 (2Н, с), 1,51 (6Н, ізоксазоліну (запропонована сполука №4-0003) с), 1,45 (3Н, т) 0,4г гідрату гідросульфіду натрію (чистота: 70%, 4,6ммоль) додали до розчину 0,4г (2,3ммоль) Одержання 3-(5-хлор-3-дифторметил-1-метил5,5-диметил-3-метилсульфоніл-2-ізоксазоліну, 1Н-піразол-4-ілметилтіо)-5,5-диметил-2розчиненого в 10мл Ν,Ν-диметилформаміду. Суізоксазоліну (запропонована сполука №3-0020) міш піддали перемішуванню протягом 2 годин. 1,2г гідрату гідросульфіду натрію (чистота: Потім до неї додали 0,3г (2,3ммоль) карбонату 70%, 15,0ммоль) додали до розчину 1,9г калію, 0,4г (2,3ммоль) ронгаліту і 0,5г (1,8ммоль) 4(10,0ммоль) 5,5-диметил-3-етилсульфоніл-2бромметил-6-метил-3-трифторметилізоксазолу. ізоксазоліну, розчиненого в 30мл Ν,ΝОтриману суміш піддали перемішуванню при кімдиметилформаміду. Суміш піддали перемішуваннатній температурі протягом 14 годин з метою ню протягом 2 годин. Потім до неї додали 2,1г ініціювання реакції. Після завершення реакції реа(15,0ммоль) безводного карбонату калію, 2,3г кційну суміш влили у воду, після чого екстрагували (15,0ммоль) ронгаліту і 2,6г (10,0ммоль) 4етилацетатом. Отриманий органічний шар промибромметил-5-хлор-3-дифторметил-1-метил-1Нли водним розчином хлориду натрію, а потім випіразолу. Отриману суміш піддали перемішуванню сушили над безводним сульфатом магнію. Отрипри кімнатній температурі протягом 15 годин з маний розчин піддали вакуумній перегонці з метою метою ініціювання реакції. Після завершення реавидалення розчинника, що містився в ньому. Закції реакційну суміш влили у воду, після чого екстлишок очистили методом колонкової хроматограрагували етилацетатом. Отриманий органічний фії на силікагелі (проявний розчинник: змішаний шар промили водним розчином хлориду натрію, а розчинник гексан-етилацетат), у результаті чого потім висушили над безводним сульфатом магнію. було отримано 0,4г (вихід: 70,0%) 5,5-диметил-3Отриманий розчин піддали вакуумній перегонці з (5-метил-3-трифторметилізоксазол-4-ілметилтіо)метою видалення розчинника, що містився в ньо2-ізоксазоліну. 1 му. Залишок очистили методом колонкової хромаН-ЯМР [CDCІ3 /TMC, d (проміль)]: тографії на силікагелі (проявний розчинник: зміша4,11 (2Н, с), 2,77 (2Н, с), 2,54 (3Н, с), 1,42 (6Н, ний розчинник гексан-етилацетат), у результаті с) чого було отримано 2,1г (вихід: 68,0%) 3-(5-хлор-3 дифторметил-1-метил-1Н-піразол-4-ілметилтіо)Одержання 5,5-диметил-3-(5-метил-35,5-диметил-2-ізоксазоліну у ви гляді безбарвної трифторметилізоксазол-4-ілметилсульфоніл)-2в'язкої рідини (nD20=1,5183). ізоксазоліну (запропонована сполука №4-0001) 1 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 0,8г m-хлорпербензойної кислоти (чистота: 6,70 (1Н, т, J=54,2Гц), 4,24 (2Н, с), 3,86 (3Н, с), 70%, 3,2ммоль) додали в умовах о холодження 2,80 (2Н, с), 1,42 (6Н, с) льодом до розчину 0,4г (1,3ммоль) 5,5-диметил-3 (5-метил-3-трифторметилізоксазол-4-ілметилтіо)Одержання 3-(5-хлор-3-дифторметил-1-метил2-ізоксазоліну, розчиненого в 10мл хлороформу. 1Н-піразол-4-ілметилсульфоніл)-5,5-диметил-2Суміш піддали перемішуванню при кімнатній темізоксазоліну (запропонована сполука №3-0018) пературі протягом 4 годин з метою ініціювання 3,6г m-хлорпербензойної кислоти (чистота: реакції. Після завершення реакції реакційну суміш 70%, 14,5ммоль) додали в умовах охолодження влили у воду, після чого екстрагували хлорофорльодом до розчину 1,8г (5,8ммоль) 3-(5-хлор-3мом. Отриманий органічний шар послідовно продифторметил-1-метил-1Н-піразол-4-ілметилтіо)мили водним розчином гідросульфіту натрію, вод5,5-диметил-2-ізоксазоліну, розчиненого в 15мл ним розчином гідрокарбонату натрію і водним хлороформу. Суміш піддали перемішуванню при розчином хлориду натрію, а потім висушили над кімнатній температурі протягом 22 годин з метою безводним сульфатом магнію. Отриманий розчин ініціювання реакції. Після завершення реакції реапіддали вакуумній перегонці з метою видалення кційну суміш влили у воду, після чого екстрагували розчинника, що містився в ньому. Отримані крисхлороформом. Отриманий органічний шар послітали промили гексаном, у результаті чого було довно промили водним розчином гідросульфіту отримано 0,4г (вихід: 95,0%) 5,5-диметил-3-(5натрію, водним розчином гідрокарбонату натрію і метил-3-трифторметилізоксазол-4водним розчином хлориду натрію, а потім висушиілметилсульфоніл)-2-ізоксазоліну у вигляді білих ли над безводним сульфатом магнію. Отриманий кристалів (температура плавлення: 135-136°С). 39 78071 40 ацетил-2,5-диметилтіофен-3-ілметилтіо)-5,5Н-ЯМР [CDCІ3 /TMC, d (проміль)]: диметил-2-ізоксазоліну, розчиненого в 50мл ета4,54 (2Н, с), 3,11 (2Н, с), 2,61 (3Н, с), 1,52 (6Н, с) нолу. С уміш піддали перемішуванню в умовах дефлегмації протягом 5 годин з метою ініціювання реакції. Після підтвердження завершення реакції Одержання [(5-хлор-3-метилізотіазол-4-іл)реакційну суміш влили у воду, після чого екстрагуметилтіо]-5,5-диметил-2-ізоксазоліну (запропоновали етилацетатом. Отриамний органічний шар вана сполука №4-0004) 0,82г гідросульфіду натрію (чистота: 70%, промили водою і водним розчином хлориду натрію, а потім висушили над безводним сульфатом 10,0ммоль) додали при кімнатній температурі до магнію. Отриманий розчин піддали вакуумній перозчину 0,89г (5,00ммоль) 5,5-диметил-3регонці з метою видалення розчинника, що містиметилсульфоніл-2-ізоксазоліну, розчиненого в вся в ньому. Залишок очистили методом колонко10мл Ν,Ν-диметилформаміду. С уміш піддали перемішуванню протягом 2 годин. Потім до неї дової хроматографії на силікагелі (проявний розчинник: змішаний розчинник гександали 0,70г (5,00ммоль) безводного карбонату каетилацетат), у результаті чого було отримано 0,4г лію, 0,78г (5,00ммоль) ронгаліту і 0,91г (вихід: 36,4%) 5,5-диметил-3-[2,5-диметил-4-(1(5,00ммоль) 5-хлор-4-хлорметил-3метоксііміноетил)-тіофен-3-ілметилтіо]-2метилізотіазолу. Отриману суміш піддали перемішуванню при кімнатній температурі протягом ночі ізоксазоліну у вигляді жовтої маслянистої речовини. з метою ініціювання реакції. Після підтвердження 1 завершення реакції реакційну суміш влили у воду, Н-ЯМР [CDCІ3 /TMC, d (промінь)]: після чого екстрагували етилацетатом. Отриманий 4,21 (2Н, с), 3,95 (3Н, с), 2,76 (2Н, с), 2,38 (3Н, органічний шар промили водою і водним розчином с), 2,34 (3Н, с), 2,13 (3Н, с), 1,42 (6Н, с) хлориду натрію, а потім висушили над безводним сульфатом магнію. Отриманий розчин піддали Одержання 5,5-диметил-3-[2,5-диметил-4-(1вакуумній перегонці з метою видалення розчинниметоксііміноетил)-тіофен-3-ілметилсульфоніл]-2ка, що містився в ньому. Залишок очистили метоізоксазоліну (запропонована сполука №2-0001) дом колонкової хроматографії на силікагелі, у ре0,61г m-хлорпербензойної кислоти (чистота: зультаті чого було отримано 1,38г (вихід: 70%, 3,5ммоль) додали в умовах о холодження кількісний) ((5-хлор-3-метилізотіазол-4-іл)льодом до розчину 0,4г (1,2ммоль) 5,5-диметил-3метилтіо]-5,5-диметил-2-ізоксазоліну. [2,5-диметил-4-(1-метоксііміноетил)-тіофен-3 ілметилтіо]-2-ізоксазоліну, розчиненого в 30мл Одержання [(5-хлор-3-метилізотіазол-4-іл)хлороформу. Суміш піддали перемішуванню спометилсульфоніл]-5,5-диметил-2-ізоксазоліну (зачатку протягом 1 години, а потім при кімнатній тепропонована сполука №4-0002) мпературі протягом 12 годин з метою ініціювання 2,96г m-хлорпербензойної кислоти (чистота: реакції. Після підтвердження завершення реакції 70%, 12,00ммоль) додали в умовах охолодження реакційну суміш влили у воду, після чого екстрагульодом до розчину 1,38г (5,00ммоль) [(5-хлор-3вали хлороформом. Отриманий органічний шар метилізотіазол-4-іл)-метилтіо]-5,5-диметил-2послідовно промили водним розчином гідросульізоксазоліну, розчиненого в 20мл хлороформу. фіту натрію, водним розчином гідрокарбонату наСуміш піддали перемішуванню спочатку протягом трію, водою і водним розчином хлориду натрію, а 1 годийи, а потім при кімнатній температурі протяпотім висушили над безводним сульфатом магнію. гом ночі з метою ініціювання реакції. Після заверОтриманий розчин піддали вакуумній перегонці з шення реакції реакційну суміш влили у воду, після метою видалення розчинника, що містився в ньочого екстрагували хлороформом. Отриманий орму. Залишок очистили методом колонкової хромаганічний шар послідовно промили водним розчитографії на силікагелі (проявний розчинник: змішаном гідросульфіту натрію, водним розчином гідроний розчинник гексан-етилацетат), у результаті карбонату натрію і водним розчином хлориду чого було отримано 0,35г (вихід: 80%) 5,5натрію, а потім висушили над безводним сульфадиметил-3-[2,5-диметил-4-(1-метоксііміноетил)том магнію. Отриманий розчин піддали вакуумній тіофен-3-ілметилсульфоніл]-2-ізоксазоліну у виперегонці з метою видалення розчинника, що місгляді білих кристалів (температура плавлення: тився в ньому. Залишок очистили методом колон95,0-96,0°С). 1 кової хроматографії на силікагелі, у результаті Н-ЯМР [CDCІ3 /TMC, d (проміль)]: чого було отримано 0,65г (вихід: 47,0%) [(5-хлор-34,79 (2Н, с), 3,95 (3Н, с), 2,93 (2Н, с), 2,42 (3Н, метилізотіазол-4-іл)-метилсульфоніл]-5,5с), 2,37 (3Н, с), 2,17 (3Н, с), 1,47 (6Н, с) диметил-2-ізоксазоліну у вигляді блідо-жовтого порошку (температура плавлення: 113-114°С). Одержання 5,5-диметил-3-(41 Н-ЯМР [CDCІ3 /ТМС, d (проміль)]: трифторметилпіридин-3-ілметилтіо)-2-ізоксазоліну 8,89 (1Н, с), 4,67 (2Н, с), 3,05 (2Н, с), 2,59 (3Н, (запропонована сполука №7-0003) с), 1,51 (6Н, с) 0,26г гідросульфіду натрію (чистота: 70%, 4,6ммоль) додали до розчину 0,3г (1,6ммоль) 5,5Одержання 5,5-диметил-3-[2,5-диметил-4-(1диметил-3-етилсульфоніл-2-ізоксазоліну, розчинеметоксііміноетил)-тіофен-3-ілметилтіо]-2ного в 20мл Ν,Ν-диметилформаміду. Суміш піддаізоксазоліну (запропонована сполука №2-0002) ли перемішуванню протягом 1 години. Потім до неї 0,57г (6,8ммоль) гідрохлориду Ододали 0,22г (1,6ммоль) безводного карбонату метилгідроксиламіну і 0,56г (6,8ммоль) ацетату калію і 0,25г (1,6ммоль) ронгаліту. Отриману суміш натрію додали до розчину 1,0г (3,4ммоль) 3-(4піддали перемішуванню протягом 2 годин. Потім 1 41 78071 42 до неї додали в умовах охолодження льодом 0,3г Одержання 5,5-диметил-[(4-метокси-6(1,3ммоль) 3-бромметил-4-трифторметилпіридину. трифторметилпіримідин-5-іл)-метилтіо]-2Отриману суміш піддали перемішуванню при кімізоксазоліну (запропонована сполука №8-0002) натній температурі протягом 2 годин з метою ініці0,32г гідросульфіду натрію (чистота: 70%, ювання реакції. Після підтвердження завершення 4,00ммоль) додали при кімнатній температурі до реакції реакційну суміш влили у воду, після чого розчину 0,35г (2,00ммоль) 5,5-диметил-3екстрагували етилацетатом. Отриманий органічметилсульфоніл-2-ізоксазоліну, розчиненого в ний шар промили водою і водним розчином хло10мл диметилформаміду. Суміш піддали переміриду натрію, а потім висушили над безводним сушуванню протягом 2 годин. Потім до реакційної льфатом магнію. Отриманий розчин піддали суміші додали 0,28г (2,00ммоль) безводного карвакуумній перегонці з метою видалення розчиннибонату калію, 0,31г (2,00ммоль) ронгаліту і 0,45г ка, що містився в ньому. Залишок очистили мето(2,00ммоль) 5-хлорметил-4-метокси-6дом колонкової хроматографії на силікагелі (протрифторметилпіримідину. Отриману суміш піддали явний розчинник: змішаний розчинник гексанперемішуванню при кімнатній температурі протяетилацетат), у результаті чого було отримано гом 2 годин з метою ініціювання реакції. Після під0,45г (вихід: 98,9%) 5,5-диметил-3-(4твердження завершення реакції реакційну суміш трифторметилпіридин-3-ілметилтіо)-2-ізоксазоліну влили у воду, після чого екстрагували етилацетау вигляді жовтої маслянистої речовини. том. Отриманий органічний шар промили водою і 1 водним розчином хлориду натрію, а потім висушиН-ЯМР [CDCІ3 /TMC, d (проміль)]: ли над безводним сульфатом магнію. Отриманий 8,98 (1Н, с), 8,70 (1Н, д), 7,51 (1Н, д), 4,47 (2Н, розчин піддали вакуумній перегонці з метою видас), 2,79 (2Н, с), 1,43 (6Н, с) лення розчинника, що містився в ньому. Залишок Одержання 5,5-диметил-3-(4очистили методом колонкової хроматографії на силікагелі, у результаті чого було о тримано 0,55г трифторметилпіридин-3-ілметилсульфоніл)-2(вихід: 85,9%) 5,5-диметил-[(4-метокси-6ізоксазоліну (запропонована сполука №7-0001) і трифторметилпіримідин-5-іл)-метилтіо]-25,5-диметил-3-(4-трифторметилпіридин-N-оксид-3ізоксазоліну. илметилсульфоніл)-2-ізоксазоліну (запропонована 1 сполука №7-0002) Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 0,77г m-хлорпербензойної кислоти (чистота: 8,81 (1Н, с), 4,44 (2Н, д), 4,12 (3Н, с), 2,81 (2Н, 70%, 4,5ммоль) додали в умовах о холодження с), 1,45 (6Н, с) льодом до розчину 0,45г (1,6ммоль) 5,5-диметил 3-(4-трифторметилпіридин-3-ілметилтіо]-2Одержання 5,5-диметил-[(4-метокси-6ізоксазоліну, розчиненого в 20мл хлороформу. трифторметилпіримідин-5-іл)-метилсульфоніл]-2Суміш піддали перемішуванню спочатку протягом ізоксазоліну (запропонована сполука №8-0001) 1 години, а потім при кімнатній температурі протя1,05г m-хлорпербензойної кислоти (чистота: гом 12 годин з метою ініціювання реакції. Після 70%, 4,28ммоль) додали в умовах охолодження підтвердження завершення реакції реакційну сульодом до розчину 0,55г (1,71ммоль) 5,5-диметилміш влили у воду, після чого екстрагували хлоро[(4-метокси-6-трифторметилпіримідин-5-іл)формом. Отриманий органічний шар послідовно метилтіо]-2-ізоксазоліну, розчиненого в 20мл хлопромили водним розчином гідросульфіту натрію, роформу. Суміш піддали перемішуванню спочатку водним розчином гідрокарбонату натрію, водою і протягом 1 години, а потім при кімнатній темпераводним розчином хлориду натрію, а потім висушитурі протягом 4 годин з метою ініціювання реакції. ли над безводним сульфатом магнію. Отриманий Після завершення реакції реакційну суміш влили у розчин піддали вакуумній перегонці з метою видаводу, після чого екстрагували хлороформом. лення розчинника, що містився в ньому. Залишок Отриманий органічний шар послідовно промили очистили методом колонкової хроматографії на водним розчином гідросульфіту натрію, водним силікагелі (проявний розчинник: змішаний розчинрозчином гідрокарбонату натрію і водним розчиник гексан-етилацетат), у результаті чого було ном хлориду натрію, а потім висушили над безвоотримано 0,06г (вихід: 12,0%) 5,5-диметил-3-(4дним сульфатом магнію. Отриманий розчин піддатрифторметилпіридин-3-ілметилсульфоніл)-2ли вакуумній перегонці з метою видалення ізоксазоліну у вигляді блідо-жовтих кристалів (терозчинника, що містився в ньому. Залишок очисмпература плавлення: 77,0-80,0°С) і 0,12г (вихід: тили методом колонкової хроматографії на силіка23,1%) і 5,5-диметил-3-(4-трифторметилпіридин-Nгелі, у результаті чого було отримано 0,45г (вихід: оксид-3-илметилтіо)-2-ізоксазоліну у вигляді білих 75,0%) 5,5-диметил-[(4-метокси-6кристалів (температура плавлення: 114,0-116,0°С). трифторметилпіримідин-5-іл)-метилсульфоніл]-25,5-диметил-3-(4-трифторметилпіридин-3ізоксазоліну у вигляді білих пероподібних кристаілметилсульфоніл)-2-ізоксазолін лів (температура плавлення: 175-176°С). 1 1 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 8,98 (1Н, с), 8,84 (1Н, д), 7,64 (1Н, д), 4,92 (2Н, 8,89 (1Η, с), 5,00 (2H, д), 4,11 (3Н, с), 3,11 (2Н, с), 3,09 (2Н, с), 1,52 (6Н, с) с), 1,53 (6Н, с) 5,5-диметил-3-(4-трифторметилпіридин-N оксид-3-илметилтіо)-2-ізоксазолін Одержання 3-(5,5-диметил-2-ізоксазолін-31 ілтіометил)-2-трифторметил-6,7-дигідро-5НН-ЯМР [CDCІ3 /TMC, d (проміль)]: піразоло-[5,1-b][1,3]-оксазину (запропонована спо8,50 (1Н, с), 8,25 (1Н, д), 7,59 (1Н, д), 4,81 (2Н, лука №3-0033) с), 3,12 (2Н, с), 1,53 (1Н, с) Розчин 0,82г (2,3ммоль) 3-[5-хлор-1-(3 43 78071 44 гідроксипропіл)-3-трифторметил-1Н-піразол-4ційної суміші додали 4,94г (35,8ммоль) безводного ілметилтіо]-5,5-диметил-2-ізоксазолу, розчиненого карбонату калію, 5,51г (35,8ммоль) ронгаліту і дов 5мл Ν,Ν-диметилформаміду, по краплях додали датково 9,46г (34,1ммоль) 4-бромметил-5-хлор-1до суспензії 0,11г (2,8ммоль) гідриду натрію, суметил-3-трифторметил-1Н-піразолу. Отриману спендованого в 15мл Ν,Ν-диметилформаміду. Пісуміш піддали перемішуванню при кімнатній темсля завершення покрапельного додавання отрипературі протягом однієї ночі з метою ініціювання ману суміш піддали перемішуванню при кімнатній реакції. Після підтвердження завершення реакції температурі протягом 30 хвилин, потім нагріли до реакційну суміш влили у воду, після чого екстрагу100°С и піддали перемішуванню протягом 1 годивали етилацетатом. Отриманий органічний шар ни з метою ініціювання реакції. Після підтвердженпослідовно промили водою і водним розчином ня завершення реакції реакційну суміш влили у хлориду натрію, а потім висушили над безводним воду, після чого екстрагували етилацетатом. сульфатом магнію. Отриманий розчин піддали Отриманий органічний шар промили водним розвакуумній перегонці з метою видалення розчинничином лимонної кислоти і водним розчином хлока, що містився в ньому. Залишок очистили меториду натрію, а потім висушили над безводним судом колонкової хроматографії на силікагелі, у рельфатом магнію. Отриманий розчин піддали зультаті чого було отримано 8,97г (вихід: 80,3%) 3вакуумній перегонці, у результаті чого було отри(5-хлор-1-метил-3-трифторметилпіразол-4мано 0,77г (вихід: 100%) 3-(5,5-диметил-2ілметилтіо)-5,5-диметил-2-ізоксазоліну. ізоксазолін-3-ілтіометил)-2-трифторметил-6,7 дигідро-5Н-піразоло-[5,1-b][1,3]-оксазину. Одержання 3-(5-хлор-1-метил-31 трифторметилпіразол-4-ілметансульфоніл)-5,5Н-ЯМР [CDCІ3 /TMC, d (проміль)]: диметил-2-ізоксазоліну (запропонована сполука 4,37 (2Н, т), 4,19 (2Н, т), 4,15 (2Н, с), 2,80 (2Н, с), 2,31 (2Н, м), 1,42 (6Н, с) №3-0039) 16,87г m-хлорпербензойної кислоти (чистота: 70%, 68,4ммоль) додали в умовах охолодження Одержання 3-(5,5-диметил-2-ізоксазолін-3льодом до розчину 8,97г (27,4ммоль) 3-(5-хлор-1ілсульфонілметил)-2-трифторїметил-6,7-дигідрометил-3-трифторметилпіразол-4-ілметилтіо)-5,55Н-шразоло-[5,1-b][1,3]-оксазину (запропонована сполука №3-0019) диметил-2-ізоксазоліну, розчиненого в 300мл хлороформу. Суміш піддали перемішуванню спочатку 1,25г m-хлорпербензойної кислоти (чистота: протягом 1 години, а потім при кімнатній темпера70%, 5,1ммоль) додали в умовах о холодження турі протягом однієї ночі з метою ініціювання реакльодом до розчину 0,77г (2,3ммоль) 3-(6,7-дигідроції. Після завершення реакції реакційну суміш вли3-трифторметил-5Н-піразоло-[5,1-b][1,3]-оксазин4-ілметилтіо)-5,5-диметил-2-ізоксазоліну, розчинели у воду, після чого екстрагували хлороформом. Отриманий органічний шар послідовно промили ного в 20мл хлороформу. Суміш піддали переміводним розчином гідросульфіту натрію, водним шуванню спочатку протягом 1 години, а потім при розчином гідрокарбонату натрію, водою і водним кімнатній температурі протягом 12 годин з метою розчином хлориду натрію, а потім висушили над ініціювання реакції. Після підтвердження завершення реакції реакційну суміш влили у воду, після безводним сульфатом магнію. Отриманий розчин піддали вакуумній перегонці з метою видалення чого екстрагували хлороформом. Отриманий оррозчинника, що містився в ньому. Отриману в таганічний шар послідовно промили водним розчикий спосіб тверду речовину промили n-гексаном, у ном гідросульфіту натрію, водним розчином гідрорезультаті чого було отримано 9,36г (вихід: 95,1%) карбонату натрію, водою і водним розчином хлориду натрію), а потім висушили над безводним 3-(5-хлор-1-метил-3-трифторметилпіразол-4ілметансульфоніл)-5,5-диметил-2-ізоксазоліну у сульфатом магнію. Отриманий розчин піддали вигляді білого порошку (температура плавлення: вакуумній перегонці з метою видалення розчинни115,0-116,0°С). ка, що містився в ньому. Залишок очистили мето1 дом колонкової хроматографії на силікагелі, у реН-ЯМР [dCDCІ3 /TMC, d (проміль)]: зультаті чого було отримано 0,36г (вихід: 43%) 34,63 (2Н, с), 3,95 (3Н, с), 3,10 (2Н, с), 1,52 (6Н, (5,5-диметил-2-ізоксазолін-3-ілсульфонілметил)-2с) трифторметил-6,7-дигідро-5Н-піразоло-[5,1-b][1,3] оксазину у вигляді білого порошку (температура Одержання 3-(5-дифторметокси-1-метил-3плавлення: 151,0-152,0°С). трифторметил-1Н-піразол-4-ілметилтіо)-5,51 диметил-2-ізоксазоліну (запропонована сполука Н-ЯМР [CDCІ3 /TMC, d (проміль)]: №3-0187) 4,47 (2Н, с), 4,40 (2Н, т), 4,23 (2Н, т), 3,09 (2Н, 49,4г (0,88моль) порошкоподібного гідроксиду с), 2,34 (2Н, м), 1,50 (6H, с) калію і 0,94г (2,9ммоль) броміду тетра-n бутиламонію додали при кімнатній температурі до Одержання 3-(5-хлор-1-метил-3розчину 90,3г (0,29моль) 3-(5-гідрокси-1-метил-3трифторметилпіразол-4-ілметилтіо)-5,5трифторметил-1Н-піразол-4-ілметилтіо)-5,5диметил~2-ізоксазоліну (запропонована сполука диметил-2-ізоксазоліну, розчиненого в 1000мл №3-0186) тетрагідрофурану. У процесі охолодження системи 5,59г гідрату гідросульфіду натрію (чистота: до 20°С або нижче в неї ввели надлишкову кіль70%, 69,8ммоль) додали при кімнатній температукість хлордифторметану до досягнення моменту рі до розчину 6,84г (35,8ммоль) 5,5-диметил-3насичення системи. Після цього реакційну суміш етансульфоніл-2-ізоксазоліну, розчиненого в піддали перемішуванню при кімнатній температурі 200мл Ν,Ν-диметилформаміду. Суміші піддали протягом 17 годин. Після підтвердження заверперемішуванню протягом 1 години. Потім до реак 45 78071 46 шення реакції реакційну суміш влили в льодяну розчинника, що містився в ньому. Залишок очисводу, після чого екстрагували етилацетатом. тили методом колонкової хроматографії на силікаОтриманий органічний шар послідовно промили гелі, у результаті чого було отримано 26,3г (вихід: водою і насиченим водним розчином хлориду на65,5%) 3-(5-дифторметокси-1-етил-3трію, а потім висушили над безводним сульфатом трифторметил-1Н-піразол-4-ілметилтіо)-5,5магнію. Отриманий розчин піддали вакуумній педиметил-2-ізоксазоліну. регонці з метою видалення розчинника, що місти вся в ньому. Залишок очистили методом колонкоОдержання 3-(5-дифторметокси-1-етил-3вої хроматографії на силікагелі, у результаті чого трифторметил-1Н-піразол-4-ілметансульфоніл)було отримано 66,6г (чистота: 85%, вихід: 54,0%) 5,5-диметил-2-ізоксазоліну (запропонована сполу3-(5-дифторметокси-1-метил-3-трифторметил-1Нка №3-0190) піразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну. 30,5г m-хлорпербензойної кислоти (чистота: 70%, 123,9ммоль) додали в умовах охолодження Одержання 3-(5-дифторметокси-1-метил-3льодом до розчину 18,5г (49,6ммоль) 3-(5трифторметил-1Н-піразол-4-ілметансульфоніл)дифторметокси-1-етил-3-трифторметил-1Н5,5-диметил-2-ізоксазоліну (запропонована сполупіразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну, ка №3-0188) розчиненого в 200мл хлороформу. Суміш піддали 157,6г m-хлорпербензойної кислоти (чистота: перемішуванню при кімнатній температурі протя70%, 0,64моль) додали в умовах о холодження гом однієї ночі з метою ініціювання реакції. Після льодом до розчину 56,5г (0,16моль) 3-(5завершення реакції реакційну суміш влили у воду, дифторметокси-1-метил-3-трифторметил-1Нпісля чого екстрагували хлороформом. Отриманий піразол-4-ілметилтіо)-5,5-диметил-2-ізоксазоліну, органічний шар послідовно промили водним розрозчиненого в 1000мл хлороформу. С уміш піддали чином гідросульфіту натрію, водним розчином перемішуванню при кімнатній температурі протягідрокарбонату натрію, водою і водним розчином гом 4 годин з метою ініціювання реакції. Після захлориду натрію, а потім висушили над безводним вершення реакції реакційну суміш відфільтр ували сульфатом магнію. Отриманий розчин піддали з метою видалення нерозчинних фракцій. Отривакуумній перегонці з метою видалення розчинниманий у такий спосіб фільтрат влили в льодяну ка, що містився в ньому. Залишок промили nводу, після чого екстрагували хлороформом. гексаном, у результаті чого було отримано 19,3г Отриманий органічний шар послідовно промили (вихід: 96,0%) 3-(5-дифторметокси-1-етил-310%-им водним розчином гідроксиду натрію, вотрифторметил-1Н-піразол-4-ілметансульфоніл)дою, водним розчином гідросульфіту натрію і на5,5-диметил-2-ізоксазоліну у вигляді білого порошсиченим водним розчином хлориду натрію, а потім ку (температура плавлення: 98-100°С). 1 висушили над безводним сульфатом магнію. Н-ЯМР [CDCІ3 /TMC, d (проміль)]: Отриманий розчин піддали вакуумній перегонці з 6,83 (1Н, т, J=72,0Гц), 4,60 (2Н, с), 4,19 (2Н, метою видалення розчинника, що містився в ньокв), 3,11 (2Н, с), 1,52 (6Н, с), 1,49 (3Н, т) му. Залишок промили n-гексаном, у результаті (Приклади приготування проміжних продуктів) чого було отримано 52,7г (вихід: 86,0%) 3-(5 дифторметокси-1-метил-3-трифторметил-1НОдержання 3-хлор-5,5-диметил-2-ізоксазоліну піразол-4-ілметансульфоніл)-5,5-диметил-2534,0г (4,0моль) N-хлорсукциніміду повільно ізоксазоліну у вигляді білих кристалів (температудодали при 65-70°С до розчину 182,7г (2,05моль) ра плавлення: 129,0-130,0°С). альдоксиму гліоксилової кислоти, розчиненого в 2 1 літрах 1,2-диметоксіетану. Суміш піддали дефлегН-ЯМР [CDCІ3 /TMC, d (промінь)]: 6,83 (1Н, т, J=71,9Гц), 4,60 (2Н, с), 3,88 (3Н, с), мації в умовах нагрівання протягом 1 години. По3,11 (2Н, с), 1,52 (6Н, с) тім до неї додали в умовах охолодження льодом 1440,0г (14,4моль) гідрокарбонату калію і 10мл Одержання 3-(5-дифторметокси-1-етил-3води. Потім додали 360,0г (6,4моль) 2трифторметил-1Н-піразол-4-ілметилтіо)-5,5метилпропену. Отриману суміш піддали перемідиметил-2-ізоксазоліну (запропонована сполука шуванню при кімнатній температурі протягом 24 №3-0189) годин з метою ініціювання реакції. Потім реакційну 30,1г (536,6ммоль) порошкоподібного гідросуміш влили у воду, після чого екстрагували діізоксиду калію і 0,5г броміду тетра-n-бутиламонію пропіловим ефіром. Отриманий органічний шар додали до розчину 34,7г (107,3ммоль) 3-(1-етил-5послідовно промили водою і водним розчином гідрокси-3-трифторметил-1Н-піразол-4хлориду натрію, а потім висушили над безводним ілметилтіо)-5,5-диметил-2-ізоксазоліну, розчиненосульфатом магнію. Отриманий розчин піддали го в 100мл дихлорметану. Потім в систему ввели вакуумній перегонці з метою видалення розчиннинадлишкову кількість хлордифторметану до досяка, що містився в ньому, у результаті чого було гнення моменту її насичення. Після цього реакційотримано 107,7г (вихід: 40,0%) 3-хлор-5,5ну суміш піддали перемішуванню протягом 3 годиметил-2-ізоксазоліну у вигляді жовтої в'язкої дин. Після підтвердження завершення реакції рідини. 1 реакційну суміш влили у воду, після чого екстрагуН-ЯМР [CDCІ3 /TMC, d (проміль)]: вали хлороформом. Отриманий органічний шар 2,93 (2Н, с), 1,47 (6Н, с) послідовно промили водою і насиченим водним розчином хлориду натрію, а потім висушили над Одержання 3-хлор-5-етил-5-метил-2безводним сульфатом магнію. Отриманий розчин ізоксазоліну піддали вакуумній перегонці з метою видалення 61,9г (463,4ммоль) N-хлорсукциніміду повільно 47 78071 48 додали при 60°С до розчину 20,6г (231,7ммоль) хроматографії на силікагелі (проявний розчинник: альдоксиму гліоксилової кислоти, розчиненого в змішаний розчинник гексан-етилацетат), у резуль500мл 1,2-диметоксіетану. Після додавання суміш таті чого було отримано 1,5г (вихід: 34,8%) 3-(2,6піддали дефлегмації в умовах нагрівання протягом дифторбензилсульфініл)-5-етил-5-метил-210 хвилин. Потім до неї додали в умовах охолоізоксазоліну у вигляді білого порошку (температудження льодом 50мл (463,4ммоль) 2-метил-1ра плавлення: 30°С або менше). 1 бутен у, 98,9г (1,622ммоль) гідрокарбонату калію і Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 10мл води. Отриману суміш піддали перемішуван7,39-7,28 (1Н, м), 7,03-6,94 (2Н, м), 4,38 (2Н, с), ню протягом 12 годин з метою ініціювання реакції. 3,04 (1Н, ABq, J=17,2, Dn=85,7Гц), 3,12 (1Н, с), 1,75 Потім реакційну суміш влили у воду, після чого (2Н, м), 1,44 (3Н, с) + 1,41 (3Н, с), 0,97 (3Н, м) екстрагували n-гексаном. Оотриманий органічний шар послідовно промили водою і водним розчином Одержання 3-(2,6-дифторбензилсульфоніл)-5хлориду натрію, а потім висушили над безводним етил-5-метил-2-ізоксазоліну сульфатом магнію. Отриманий розчин піддали 1,0г m-хлорпербензойної кислоти (чистота: вакуумній перегонці з метою видалення розчинни70%, 4,1ммоль) додали в умовах о холодження ка, що містився в ньому, у результаті чого було льодом до розчину 0,8г (2,8ммоль) 3-(2,6отримано 13,9г (вихід: 40,6%) 3-хлор-5-етил-5дифторбензилсульфініл)-5-етил-5-метил-2метил-2-ізоксазоліну у ви гляді жовтої в'язкої рідиізоксазоліну, розчиненого в 50мл хлороформу. ни. Суміш піддали перемішуванню спочатку протягом 1 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 1 години, а потім при кімнатній температурі протя2,91 (2Н, ABq, J=17,0, Dn=46,1Гц), 1,73 (2Н, гом 12 годин з метою ініціювання реакції. Після кв), 1,42 (3Н, с), 0,96 (3Н, т) завершення реакції реакційну суміш влили у воду, після чого екстрагували хлороформом. Отриманий Одержання 3-бензилтіо-5,5-диметил-2органічний шар послідовно промили водним розізоксазоліну чином гідросульфіту натрію, водним розчином 3,2г (23,2ммоль) безводного карбонату калію і гідрокарбонату натрію, водою і водним розчином 3,0г (22,5ммоль) 3-хлор-5,5-диметил-2-ізоксазоліну хлориду натрію, а потім висушили над безводним додали в атмосфері азоту до розчину 2,8г сульфатом магнію. Отриманий розчин піддали (22,5ммоль) бензилмеркаптану, розчиненого в вакуумній перегонці з метою видалення розчинни50мл Ν,Ν-диметилформаміду. С уміш піддали пека, що містився в ньому. Залишок очистили меторемішуванню при 100°С протягом 2 годин з метою дом колонкової хроматографії на силікагелі (проініціювання реакції. Після завершення реакції реаявний розчинник: змішаний розчинник гексанкційну суміш влили у воду, після чого екстрагували етилацетат), у результаті чого було отримано 0,6г етилацетатом. Отриманий органічний шар послі(вихід: 75,0%) 3-(2,6-дифторбензилсульфоніл)-5довно промили водою і водним розчином хлориду етил-5-метил-2-ізоксазоліну у вигляді білого поронатрію, а потім висушили над безводним сульфашку (температура плавлення: 64-65°С). 1 том магнію. Отриманий розчин піддали вакуумній Н-ЯМР [CDCІ3 /TMC, d (проміль)]: перегонці з метою видалення розчинника, що міс7,36-7,46 (1Н, м), 6,98-7,04 (2H, м), 4,73 (2Н, с), тився в ньому. Залишок очистили методом колон3,04 (2Н, ABq, J=17,2, Dn=51,1Гц), 1,77 (2Н, кв), кової хроматографії на силікагелі, у результаті 1,46 (3Н, с) 0,97 (3Н, т) чого було отримано 3,1г (вихід: 62,0%) 3 бензилтіо-5,5-диметил-2-ізоксазоліну у вигляді Одержання 5,5-диметил-3-метилсульфоніл-2жовтої в'язкої речовини (nD20=1,5521). ізоксазоліну 1 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 1,0кг водного розчину метантіолату натрію 7,24-7,39 (5Н, м), 4,26 (2Н, с), 2,77 (2Н, с), 1,40 (вміст: 15%, 2,14ммоль) по краплях додали в умо(6Н, с) вах о холодження льодом до розчину 143,0г (1,07моль) 3-хлор-5,5-диметил-2-ізоксазоліну, розОдержання 3-(2,6-дифторбензилсульфініл)-5чиненого в 500мл Ν,Ν-диметилформаміду. С уміш етил-5-метил-2-ізоксазоліну піддали перемішуванню при кімнатній температурі 4,6г m-хлорпербензойної кислоти (чистота: протягом 12 годин з метою ініціювання реакції. 70%, 18,8ммоль) додали в умовах охолодження Після завершення реакції реакційну суміш влили у льодом до розчину 4,1г (15,0ммоль) 3-(2,6воду, після чого екстрагували етилацетатом. дифторбензилтіо)-5-етил-5-метил-2-ізоксазоліну, Отриманий органічний шар промили водним розрозчиненого в 50мл хлороформу. Суміш піддали чином хлориду натрію, а потім висушили над безперемішуванню спочатку протягом 1 години, а поводним сульфатом магнію. Отриманий розчин підтім при кімнатній температурі протягом 12 годин з дали вакуумній перегонці з метою видалення метою ініціювання реакції. Після завершення реарозчинника, що містився в ньому, у результаті чого кції реакційну суміш влили у воду, після чого екстбуло отримано 115,0г (вихід: 74,1%) 5,5-диметилрагували хлороформом. Отриманий органічний 3-метилтіо-2-ізоксолану. Цей залишок шар послідовно промили водним розчином гідро(741,2ммоль) розчинили в 1 літрі хлороформу. До сульфіту натрію, водним розчином гідрокарбонату отриманого розчину додали в умовах о холодженнатрію, водою і водним розчином хлориду натрію, ня льодом 392,0г m-хлорпербензойної кислоти а потім висушили над безводним сульфатом маг(чистота: 70%, 1,59моль). Отриману суміш піддали нію. Отриманий розчин піддали вакуумній перегоперемішуванню спочатку протягом 1 години, а понці з метою видалення розчинника, що містився в тім при кімнатній температурі протягом 12 годин з ньому. Залишок очистили методом колонкової метою ініціювання реакції. Після завершення реа 49 78071 50 кції m-хлорпербензойну кислоту, що відділилася, години з метою ініціювання реакції. Після завервидалили шляхом фільтрації. Отриманий фільтрат шення реакції реакційну суміш піддали вакуумній послідовно промили водним розчином гідросульперегонці з метою видалення більшої частини фіту натрію, водою, водним розчином гідрокарборозчинника, що містився в ній. Залишок змішали з нату натрію і водним розчином хлориду натрію, а водою, у результаті чого осіли кристали. Кристали потім висушили над безводним сульфатом магнію. зібрали шляхом фільтрації, промили водою з меОтриманий розчин піддали вакуумній перегонці з тою нейтралізації фільтрату і висушили, у резульметою видалення розчинника, що містився в ньотаті чого було отримано 37,1г (вихід: 87,9%) 1му. Залишок промили діізопропіловим ефіром, у феніл-3-трифторметил-1Н-піразол-5-олу у вигляді результаті чого було отримано 77,6г (вихід: 59,1%) заохрених кристалів. 1 5,5-диметил-3-метилсульфоніл-2-ізоксазоліну у Н-ЯМР [CDCІ3 /TMC, d (проміль)]: вигляді білого порошку (температура плавлення: 7,68-7,41 (5Н, м), 5,86 (1Н, с), 3,71 (1Н, с) 82-84°С). 1 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: Одержання 5-хлор-1-феніл-3-трифторметил3,26 (3Н, с), 3,12 (2Н, с), 1,51 (6Н, с) 1Н-піразол-4-карбоальдегіду 33,6г (219,1ммоль) хлороксиду фосфор у доОдержання 5,5-диметил-3-етилтіо-2дали в умовах о холодження льодом до 7,7г ізоксазоліну (105,2ммоль) Ν,Ν-диметилформаміду. До отрима1500мл водного розчину, що містив 560,0г ної суміші додали при кімнатній температурі 20г (9,0моль) етилмеркаптану і 360,0г (9,0моль) гідро(87,7ммоль) 1-феніл-3-трифторметил-1Н-піразолксиду натрію, додали до розчину, що містив 35-олу. Отриману суміш піддали дефлегмації в хлор-5,5-диметил-2-ізоксазолін. Суміш піддали умовах нагрівання протягом 1 години з метою ініперемішуванню при 60-70°С протягом 16 годин з ціювання реакції. Після завершення реакції реакметою ініціювання реакції. Після підтвердження ційну суміш влили у воду в умовах о холодження завершення реакції реакційну суміш влили у воду, льодом, після чого екстрагували хлороформом. після чого екстрагували етилацетатом. Отриманий Отриманий органічний шар послідовно промили органічний шар промили водою і водним розчином водним розчином гідрокарбонату натрію і водним хлориду натрію, а потім висушили над безводним розчином хлориду натрію, а потім висушили над сульфатом магнію. Отриманий розчин піддали безводним сульфатом магнію. Отриманий розчин вакуумній перегонці з метою видалення розчиннипіддали вакуумній перегонці з метою видалення ка, що містився в ньому, у результаті чого було розчинника, що містився в ньому. Залишок очисотримано 270,0г неочищеного 5,5-диметил-3тили методом колонкової хроматографії на силікаетилтіо-2-ізоксазоліну у вигляді темно-червоної гелі (проявний розчинник: змішаний розчинник маслянистої речовини. гексан-етилацетат), у результаті чого було отри мано 19,1г (вихід: 79,1%) 5-хлор-1-феніл-3Одержання 5,5-диметил-3-етилсульфоніл-2трифторметил-1Н-піразол-4-карбоальдегіду у виізоксазоліну гляді білих кристалів. 1 270,0г (1,7моль) неочищеного маслянистого Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 5,5-диметил-3-етилтіо-2-ізоксазоліну розчинили в 10,06 (1Н, с), 7,57 (5Н, с) 1,0 літрі хлороформу. До отриманого розчину до дали в умовах охолодження льодом 1050г mОдержання (5-хлор-1-феніл-3-трифторметилхлорпербензойної кислоти (чистота: 70%, 1Н-піразол-4-іл)-метанолу 6,1моль). Отриману суміш піддали перемішуванню Розчин 0,21г (5,5ммоль) алюмогідриду літію, спочатку протягом 1 години, а потім при кімнатній розчиненого в 70мл тетрагідрофурану, остудили температурі протягом 12 годин з метою ініціювандо -30°С. Потім до нього повільно додали розчин ня реакції. Після підтвердження завершення реак3г (10,9ммоль) 5-хлор-1-феніл-3-трифторметилції m-хлорпербензойну кислоту, що відділилася, 1Н-піразол-4-карбоальдегіду, розчиненого в 30мл видалили шляхом фільтрації. Отриманий фільтрат тетрагідрофурану. Отриману суміш піддали перепослідовно промили водним розчином гідросульмішуванню при -30°С протягом 30 хвилин з метою фіту натрію, водним розчином гідрокарбонату наініціювання реакції. Після завершення реакції до трію, водою і водним розчином хлориду натрію, а суміші додали етилацетат з наступним перемішупотім висушили над безводним сульфатом магнію. ванням. Потім додали воду з наступним нетриваОтриманий розчин піддали вакуумній перегонці з лим перемішуванням. Реакційну суміш профільтметою видалення розчинника, що містився в ньорували під вакуумом. Фільтрат екстрагували му. Залишок промили n-гексаном, у результаті етилацетатом. Отриманий органічний шар промичого було отримано 133,6г (вихід: 65,4%) 5,5ли водним розчином хлориду натрію, а потім видиметил-3-етилсульфоніл-2-ізоксазоліну у вигляді сушили над безводним сульфатом магнію. Отрибілого порошку. маний розчин піддали вакуумній перегонці з метою видалення розчинника, що містився в ньому, у Одержання 1-феніл-3-трифторметил-1Нрезультаті чого було отримано 3,0г (вихід: 99,9%) піразол-5-олу (5-хлор-1-феніл-3-трифторметил-1Н-піразол-4-іл)20г (184,9ммоль) фенілгідразину і 4мл конценметанолу у ви гляді білих кристалів. 1 трованої хлористоводневої кислоти додали до Н-ЯМР [CDCІ3 /TMC, d (проміль)]: розчину 34,1г (184,9ммоль) етилтрифторацетоа7,54-7,51 (5Н, м), 4,71 (2Н, д), 1,79 (1Н, шир.) цетату, розчиненого в 500мл етанолу. Суміш під дали дефлегмації в умовах нагрівання протягом 1 Одержання 4-бромметил-5-хлор-1-феніл-3 51 78071 52 трифторметил-1Н-піразолу Одержання 4-бромметил-5-фтор-1-феніл-3Розчин 3,0г (10,9ммоль) (5-хлор-1-феніл-3трифторметил-1Н-піразолу трифторметил-1Н-піразол-4-іл)-метанолу, розчиРозчин 27,5г (105,7ммоль) (5-фтор-1-феніл-3неного в 60мл діетилового ефіру, остудили до трифторметил-1Н-піразол-4-іл)-метанолу, розчи10°С. Потім до нього додали 1,0г (3,8ммоль) триненого в 300мл діетилового ефіру, остудили до броміду фосфору. Отриману суміш піддали пере0°С. Потім до нього додали 10,0г (37,0ммоль) тримішуванню при кімнатній температурі протягом 1 броміду фосфору. Суміш піддали перемішуванню години з метою ініціювання реакції. Після заверпри кімнатній температурі протягом 2 годин з мешення реакції реакційну суміш влили у воду, після тою ініціювання реакції. Після завершення реакції чого екстрагували етилацетатом. Отриманий орреакційну суміш влили у воду, після чого екстрагуганічний шар промили водним розчином хлориду вали діетиловим ефіром. Отриманий органічний натрію, а потім висушили над безводним сульфашар промили водним розчином хлориду натрію, а том магнію. Отриманий розчин піддали вакуумній потім висушили над безводним сульфатом магнію. перегонці з метою видалення розчинника, що місОтриманий розчин піддали вакуумній перегонці з тився в ньому, у результаті чого було отримано метою видалення розчинника, що містився в ньо3,6г (вихід: 95,8%) 4-бромметил-5-хлор-1-феніл-3му, у результаті чого було отримано 30,3г (вихід: трифторметил-1Н-піразолу у вигляді білих криста88,8%) 4-бромметил-5-фтор-1-феніл-3лів. трифторметил-1Н-піразолу. 1 1 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 7,58-7,48 (5Н, м), 4,48 (2Н, с) 7,66-7,42 (5Н, м), 4,44 (2Н, с) Одержання 5-фтор-1-феніл-3-трифторметилОдержання 1-трет-бутил-3-трифторметил-1Н1Н-піразол-4-карбоальдегіду піразол-5-олу 10,5г (180,2ммоль) фториду калію додали до 373,8г (3,0моль) гідрохлориду третрозчину 33,0г (120,1ммоль) 5-хлор-1-феніл-3бутилгідразину і 50мл концентрованої хлористотрифторметил-1Н-піразол-4-карбоальдегіду, розводневої кислоти додали до розчину 552,3г чиненого в 500мл диметилсульфоксиду. Суміш (3,0моль) етилтрифторацетоацетату, розчиненого піддали перемішуванню при 100°С протягом 2 гов 1500мл етанолу. Суміш піддали дефлегмації в дин з метою ініціювання реакції. Після завершення умовах нагрівання протягом 2 днів з метою ініціюреакції реакційну суміш влили у воду, після чого вання реакції. Після завершення реакції реакційну екстрагували етилацетатом. Отриманий органічсуміш піддали вакуумній перегонці з метою виданий шар промили водним розчином хлориду налення більшої частини розчинника, що містився в трію, а потім висушили над безводним сульфатом ній. Залишок влили у воду, після чого екстрагувамагнію. Отриманий розчин піддали вакуумній пели етилацетатом. Отриманий органічний шар порегонці з метою видалення розчинника, що містислідовно промили водою і водним розчином хловся в ньому. Залишок очистили методом колонкориду натрію, а потім висушили над безводним вої хроматографії на силікагелі (проявний сульфатом магнію. Отриманий розчин піддали розчинник: змішаний розчинник гексанвакуумній перегонці з метою видалення розчинниетилацетат), у результаті чого було отримано ка, що містився в ньому. Залишок промили n26,5г (вихід: 85,0%) 5-фтор-1-феніл-3гексаном, у результаті чого було отримано 369,0г трифторметил-1Н-піразол-4-карбоальдегіду. (вихід: 59,1%) 1-трет-бутил-3-трифторметил-1Н1 піразол-5-олу у вигляді білого порошку. Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 9,96 (1Н, с), 7,68-7,51 (5Н,м) Одержання 1-трет-бутил-5-хлор-3 трифторметил-1Н-піразол-4-карбоальдегіду Одержання (5-фтор-1 -феніл-3-трифторметил462,0г (3,0моль) хлороксиду фосфору додали 1Н-піразол-4-іл)-метанолу в умовах о холодження льодом до 87,7г (1,2моль) До розчину 1,6г (41,0ммоль) борогідриду наΝ,Ν-диметилформаміду. До суміші додали при трію, розчиненого в 300мл метанолу, додали в кімнатній температурі 208,2г (1,0моль) 1-третумовах о холодження льодом розчин 26,5г бутил-3-три фторметил-1Н-піразол-5-олу. Отрима(102,5ммоль) 5-фтор-1-феніл-3-трифторметил-1Нну суміш піддали дефлегмації в умовах нагрівання піразол-4-карбоальдегіду, розчиненого в 200мл протягом 10 годин з метою ініціювання реакції. метанолу. Отриману суміш піддали перемішуванПісля завершення реакції реакційну суміш влили у ню при 0 °С протягом 30 хвилин з метою ініціюводу, після чого екстрагували хлороформом. вання реакції. Після завершення реакції реакційну Отриманий органічний шар послідовно промили суміш влили у воду, після чого екстрагували етиводою, 5%-им водним розчином гідроксиду натрію лацетатом. Отриманий органічний шар промили і знову водою, а потім висушили над безводним водним розчином хлориду натрію, а потім висушисульфатом магнію. Отриманий розчин піддали ли над безводним сульфатом магнію. Отриманий вакуумній перегонці з метою видалення розчиннирозчин піддали вакуумній перегонці з метою видака, що містився в ньому. Залишок очистили метолення розчинника, що містився в ньому, у резульдом колонкової хроматографії на силікагелі (протаті чого було отримано 28,5г (вихід: 100%) (5явний розчинник: змішаний розчинник гексанфтор-1-феніл-3-трифторметил-1Н-піразол-4-іл)етилацетат), у результаті чого було отримано метанолу. 1 131,5г (вихід: 21,7%) 1-трет-бутил-5-хлор-3Н-ЯМР [CDCІ3 /ТМС, d (проміль)]: трифторметил-1Н-піразол-4-карбоальдегіду у ви7,65-7,41 (5H, м), 4,68 (2Н, д), 1,73 (1Н, т) гляді білих кристалів. 53 78071 54 трифторметил-1Н-піразолу Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 15,0г (108,4ммоль) безводного карбонату ка9,97 (1Н,д), 1,76 (9Н,с) лію і 19,3г (135,5ммоль) метилйодиду додали при кімнатній температурі до розчину 18,8г Одержання (1-трет-бутил-5-хлор-3(90,3ммоль) 1-трет-бутил-3-трифторметил-1Нтрифторметил-1Н-піразол-4-іл)-метанолу піразол-5-олу, розчиненого в 100мл Ν.ΝРозчин 39,9г (156,9ммоль) 1-трет-бутил-5диметилформаміду. Суміш піддали перемішуванхлор-3-трифторметил-1Н-піразол-4карбоальдегіду, розчиненого в 300мл метанолу, ню протягом 15 годин з метою ініціювання реакції. Після завершення реакції реакційну суміш влили у остудили до 0°С. Потім до нього повільно додали воду, після чого екстрагували діетиловим ефіром. 6,5г (172,6ммоль) борогідриду натрію. Суміш підОтриманий органічний шар послідовно промили дали перемішуванню при кімнатній температурі водою і водним розчином хлориду натрію, а потім протягом 3 годин з метою ініціювання реакції. Після завершення реакції реакційну суміш влили у висушили над безводним сульфатом магнію. Отриманий розчин піддали вакуумній перегонці з воду, після чого екстрагували етилацетатом. метою видалення розчинника, що містився в ньоОтриманий органічний шар промили водним розму, у результаті чого було отримано 20,0г (вихід: чином хлориду натрію, а потім висушили над без99,8%) 1-трет-бутил-5-метокси-3-трифторметилводним сульфатом магнію. Отриманий розчин піддали вакуумній перегонці з метою видалення 1Н-піразолу. розчинника, що містився в ньому, у результаті чого Одержання 1-трет-бутил-4-хлорметил-3було отримано 37,7г (вихід: 93,6%) (1-трет-бутилметокси-3-трифторметил-1Н-піразолу 5-хлор-3-трифторметил-1Н-піразол-4-іл)5,4г параформальдегіду (180,2ммоль в одиниметанолу. 1 цях, віднесених до формальдегіду) і 20мл конценН-ЯМР [CDCІ3 /ТМС, d (проміль)]: трованої хлористоводневої кислоти додали до 4,60 (2Н, д), 1,72 (9Н, с), 1,58 (1Н, т) розчину 20,0г (90,1ммоль) 1-трет-бутил-5-метокси 3-трифторметил-1Н-піразолу, розчиненого в 90мл Одержання 4-бромметил-1-трет-бутил-5-хлороцтової кислоти. Суміш піддали перемішуванню 3-трифторметил-1Н-піразолу при 60°С протягом 30 хвилин з метою ініціювання Розчин 9,2г (35,7ммоль) (1-трет-бутил-5-хлорреакції. Після завершення реакції реакційну суміш 3-трифторметил-1Н-піразол-4-іл)-метанолу, розвлили у воду, після чого екстрагували діізопропічиненого в 100мл діетилового ефіру, остудили до ловим ефіром. Отриманий органічний шар проми10°С. Потім до нього додали 11,6г (42,9ммоль) ли водою, а потім висушили над безводним сультриброміду фосфору. Суміш піддали перемішуфатом магнію. Отриманий розчин піддали ванню при кімнатній температурі протягом ночі з вакуумній перегонці з метою видалення розчинниметою ініціювання реакції. Після завершення реака, що містився в ньому, у результаті чого було кції реакційну суміш влили у воду, після чого екстотримано 21,7г (вихід: 89,0%) 1-трет-бутил-4рагували діетиловим ефіром. Отриманий органічхлорметил-3-метокси-3-трифторметил-1Нний шар промили водним розчином хлориду піразолу. натрію, а потім висушили над безводним сульфа том магнію. Отриманий розчин піддали вакуумній Одержання 3-метокси-1-метил-5перегонці з метою видалення розчинника, що містрифторметил-1Н-піразолу тився в ньому, у результаті чого було отримано 10,0г (72,3ммоль) безводного карбонату калію 10,0г (вихід: 87,3%) 4-бромметил-1-трет-бутил-5і 12,8г (90,3ммоль) метилйодиду додали при кімхлор-3-трифторметил-1Н-піразолу. натній температурі до розчину 10,0г (60,2ммоль) 3 гідрокси-1-метил-5-трифторметил-1Н-піразолу, Одержання (1-трет-бутил-5-хлор-3розчиненого в 50мл N,N-диметилформаміду. Сутрифторметил-1Н-піразол-4-іл)-метантіолу міш піддали перемішуванню протягом 15 годин з 43,5г (136,1ммоль) 4-бромметил-1-трет-бутилметою ініціювання реакції. Після завершення реа5-хлор-3-трифторметил-1Н-піразолу додали до кції реакційну суміш влили у воду, після чого екстрозчину 21,8г гідрату гідросульфіду натрію (чисторагували діетиловим ефіром. Отриманий органічта: 70%, 272,2ммоль), розчиненого в 300мл Ν,Νний шар послідовно промили водою і водним диметилформамида. Суміш піддали перемішуванрозчином хлориду натрію, а потім висушили над ню при кімнатній температурі протягом ночі з мебезводним сульфатом магнію. Отриманий розчин тою ініціювання реакції. Після завершення реакції піддали вакуумній перегонці з метою видалення реакційну суміш влили у воду, після чого екстрагурозчинника, що містився в ньому, у результаті чого вали діетиловим ефіром. Отриманий органічний було отримано 9,8г (вихід: 90,7%) З-метокси-ішар промили водним розчином хлориду натрію, а метил-5-трифторметил-1Н-піразолу. потім висушили над безводним сульфатом магнію. Отриманий розчин піддали вакуумній перегонці з Одержання 4-хлорметил-3-метокси-1-метил-5метою видалення розчинника, що містився в ньотрифторметил-1Н-піразолу му, у результаті чого було отримано 32,3г (вихід: 0,45г параформальдегіду (15,0ммоль в одини87,0%) (1-трет-бутил-5-хлор-3-трифторметил-1Нцях, віднесених до формальдегіду) і 5мл концентпіразол-4-іл)-метантіолу. 1 рованої хлористоводневої кислоти додали до розН-ЯМР [CDCІ3 /TMC, d (проміль)]: чину 1,00г (5,6ммоль) 3-метокси-1-метил-53,65 (2Н, д), 1,90 (1Н, т), 1,70 (9Н, с) трифторметил-1Н-піразолу, розчиненого в 25мл оцтової кислоти. Суміш піддали перемішуванню Одержання 1-трет-бутил-5-метокси-31 55 78071 56 при 80°С протягом 2 годин з метою ініціювання органічний шар промили водою і водним розчином реакції. Після завершення реакції реакційну суміш хлориду натрію, а потім висушили над безводним влили у воду і нейтралізували карбонатом калію, сульфатом магнію. Отриманий розчин піддали після чого екстрагували етилацетатом. Отриманий вакуумній перегонці з метою видалення розчинниорганічний шар промили водою, а потім висушили ка, що містився в ньому, у результаті чого було над безводним сульфатом магнію. Отриманий отримано 31,4г (вихід: 80,8%) 4-бромметил-5розчин піддали вакуумній перегонці з метою видафтор-1-метил-3-трифторметил-1Н-тразолу. лення розчинника, що містився в ньому. Залишок очистили методом колонкової хроматографії на Одержання (етоксикарбоніл)-малондіальдегіду силікагелі (проявний розчинник: змішаний розчин12,6г гідриду натрію (чистота: 60%, ник гексан-етилацетат), у результаті чого було 525,0ммоль) промили діетиловим ефіром шляхом отримано 0,83г (вихід: 65,0%) 4-хлорметил-3багаторазової декантації, а потім перетворили в метокси-1-метил-5-трифторметил-1Н-піразолу. розчин шляхом додавання до 500мл діетилового ефіру. До отриманого розчину додали в умовах Одержання 5-фтор-1-метил-3-трифторметилпродування струменем азоту при 0-10°С 194г 1Н-піразол-4-карбоальдегіду (2,6моль) етилформіату і 50г (262,0ммоль) етил42,0г (711,9ммоль) фториду калію додали до 3,3-діетоксипропіонату. Отриману суміш піддали розчину 60,4г (282,7ммоль) 5-хлор-1-метил-3перемішуванню при кімнатній температурі протятрифторметил-1Н-піразол-4-карбоальдегіду, розгом 15 годин з метою ініціювання реакції. Після чиненого в 700мл диметилсульфоксиду. Суміш підтвердження завершення реакції реакційну супіддали перемішуванню при 120-140°С протягом 5 міш влиди у воду, після чого екстрагували діетигодин з метою ініціювання реакції. Після підтверловим ефіром. Концентрацію водню в отриманому дження завершення реакції реакційну суміш влили водному шарі довели до рН=1 шляхом додавання у воду, після чого екстрагували етилацетатом. хлористоводневої кислоти, після чого його екстраОтриманий органічний шар промили водою і водгували дихлорметаном. Отриманий органічний ним розчином хлориду натрію, а потім висушили шар промили водним розчином хлориду натрію, а над безводним сульфатом магнію. Отриманий потім висушили над безводним сульфатом магнію. розчин піддали вакуумній перегонці з метою видаОтриманий розчин піддали вакуумній перегонці з лення розчинника, що містився в ньому. Залишок метою видалення розчинника, що містився в ньоочистили методом колонкової хроматографії на му, у результаті чого було отримано 37,6г (вихід: силікагелі (проявний розчинник: змішаний розчин100%) неочищеного (етоксикарбоніл)ник гексан-етилацетат), у результаті чого було малондіальдегіду у вигляді темно-червоної масляотримано 36,8г (вихід: 66,0%) 5-фтор-1-метил-3нистої речовини. 1 трифторметил-1Н-піразол-4-карбоальдегіду. Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 9,09 (2Н, с), 5,26 (1Н, с), 4,27 (2Н, кв), 1,28 (3Н, Одержання (5-фтор-1-метил-3-трифторметилт) 1Н-піразол-4-іл)-метанолу До розчину 3,9г (102,6ммоль) борогідриду наОдержання етил-1Н-піразол-4-карбоксилату трію, розчиненого в 500мл метанолу, додали в 6,2г (193ммоль) гідразину додали в умовах умовах о холодження льодом розчин 36,8г охолодження льодом до розчину 27,6г (192ммоль) (187,6ммоль) 5-фтор-1-метил-3-трифторметил-1Н(етоксикарбоніл)-малондіальдегіду, розчиненого в піразол-4-карбоальдегіду, розчиненого в 200мл 150мл етанолу. Суміш піддали перемішуванню метанолу. Отриману суміш піддали перемішуванпри кімнатній температурі протягом 17 годин з ню при 0°С протягом 30 хвилин з метою ініціюванметою ініціювання реакції. Реакційну суміш підданя реакції. Після підтвердження завершення реакли вакуумній перегонці з метою видалення етаноції реакційну суміш влили у воду, після чого лу, що містився в ній. Залишок очистили методом екстрагували етилацетатом. Отриманий органічколонкової хроматографії на силікагелі (проявний ний шар промили водою і водним розчином хлорозчинник: змішаний розчинник дихлорметанриду натрію, а потім висушили над безводним суетилацетат), у результаті чого було отримано льфатом магнію. Отриманий розчин піддали 19,4г (вихід: 72,4%) етил-1Н-піразол-4вакуумній перегонці з метою видалення розчинникарбоксилату у вигляді жовтих кристалів. 1 ка, що містився в ньому, у результаті чого було Н-ЯМР [CDCІ3 /TMC, d (проміль)]: отримано 35,4г (вихід: 95,4%) (5-фтор-1-метил-38,08 (2Н, с), 5,30 (1Н, с), 4,31 (2Н, кв), 1,36 (3Н, трифторметил-1Н-піразол-4-іл)-метанолу. т) Одержання 4-бромметил-5-фтор-1-метил-3Одержання етил-1-етил-1Н-піразол-4трифторметил-1Н-піразолу карбоксилату Розчин 35,4г (178,7ммоль) 5-фтор-1-метил-33,7г (26,8ммоль) безводного карбонату калію і трифторметил-1Н-піразол-4-метанолу, розчинено4,2г (26,6ммоль) етилйодмду додали до розчину го в 500мл діетилового ефіру, остудили до -30°С. 1,5г (10,7ммоль) етил-1Н-піразол-4-карбоксилату, Потім до нього додали 54,0г (199,5ммоль) трибророзчиненого в 50мл Ν,Ν-диметилформаміду. Суміду фосфору. Суміш піддали перемішуванню при міш піддали перемішуванню при кімнатній темпекімнатній температурі протягом 12 годин з метою ратурі протягом 20 годин з метою ініціювання реаініціювання реакції. Після підтвердження заверкції. Після підтвердження завершення реакції шення реакції реакційну суміш влили у воду, після реакційну суміш влили у воду, після чого екстрагучого екстрагували діетиловим ефіром. Отриманий вали етилацетатом. Отриманий органічний шар 57 78071 58 промили водою і водним розчином хлориду на трію, а потім висушили над безводним сульфатом Одержання 4-бромметил-3,5-дихлор-1-етилмагнію. Отриманий розчин піддали вакуумній пе1Н-піразолу регонці з метою видалення розчинника, що містиРозчин 0,82 (4,2ммоль) (3,5-дихлор-1-етил-1Нвся в ньому. Залишок очистили методом колонкопіразол-4-іл)-метаноіу, розчиненого в 50мл діетивої хроматографії на силікагелі (проявний лового ефіру, остудили до -30°С. Потім до нього розчинник: змішаний розчинник гександодали 1,3г (4,8ммоль) триброміду фосфору. Суетилацетат), у результаті чого було отримано 1,6г міш піддали перемішуванню при кімнатній темпе(вихід: 88,9%) етил-1-етил-1Н-піразол-4ратурі протягом 12 годин з метою ініціювання реакарбоксилату у вигляді жовтої маслянистої речокції. Після підтвердження завершення реакції вини. реакційну суміш влили у воду, після чого екстрагу1 вали етилацетатом. Отриманий органічний шар Н-ЯМР [CDCІ3 /TMC, d (проміль)]: 7,90 (2Н, с), 4,28 (2Н, кв), 4,18 (2Н, кв), 1,51 промили водою і водним розчином хлориду натрію, а потім висушили над безводним сульфатом (3Н, т), 1,35 (3Н, т) магнію. Отриманий розчин піддали вакуумній пе регонці з метою видалення розчинника, що містиОдержання етил-3,5-дихлор-1-етил-1Нвся в ньому, у результаті чого було отримано 0,9г піразол-4-карбоксилату У скляну герметизовану трубку помістили 1,6г (вихід: 81,8%) 4-бромметил-3,5-дихлор-1-етил-1Нпіразолу у вигляді жовтої маслянистої речовини. (9,5ммоль) етил-1-етил-1Н-піразол-4-карбоксилату 1 і 5,1г (38,3ммоль) N-хлорсукциніміду, які залишили Н-ЯМР [CDCІ3 /TMC, d (проміль)]: реагувати при 160°С протягом 6 годин. Після за4,33 (2Н, с), 4,13 (2Н, кв), 1,43 (3Н, т) вершення реакції реакційну суміш остудили до кімнатної температури, промили тетрахлоридом Одержання 3-дифторметил-1-метил-1Нвуглецю і хлороформом і профільтрували під вапіразол-5-олу куумом. Отриманий фільтрат (органічний шар) 8,3г (180,6ммоль) метилгідразину і 5мл концепромили водою і водним розчином хлориду нантрованої хлористоводневої кислоти додали до трію, а потім висушили над безводним сульфатом розчину 30,0г (180,6ммоль) етилдифторацетоацемагнію. Отриманий розчин піддали вакуумній петату, розчиненого в 200мл етанолу. Суміш піддали регонці з метою видалення розчинника, що містидефлегмації протягом 2 днів в умовах нагрівання з вся в ньому. Залишок очистили методом колонкометою ініціювання реакції. Після завершення реавої хроматографії на силікагелі (проявний кції реакційну суміш піддали вакуумній перегонці з розчинник: змішаний розчинник гексанметою видалення більшої частини розчинника, що етилацетат), у результаті чого було отримано 1,0г містився в ній. Залишок влили у воду. Концентра(вихід: 44,2%) етил-3,5-дихлор-1-етил-1Н-піразолцію водню в отриманій суміші довели до рН=4 4-карбоксилату у вигляді жовтої маслянистої решляхом додавання лимонної кислоти, після чого човини. суміш екстрагували етилацетатом. Отриманий 1 органічний шар послідовно промили водою і водН-ЯМР [CDCІ3 /TMC, d (проміль)]: ним розчином хлориду натрію, а потім висушили 4,36 (2Н, кв), 4,21 (2Н, кв), 1,44 (3Н, т), 1,38 над безводним сульфатом магнію. Отриманий (3Н, т) розчин піддали вакуумній перегонці з метою вида лення розчинника, що містився в ньому. Залишок Одержання (3,5-дихлор-1-етил-1Н-піразол-4очистили методом колонкової хроматографії на іл)-метанолу силікагелі (проявний розчинник: змішаний розчинРозчин 0,16г (4,2ммоль) алюмогідриду літію, ник гексан-етилацетат), у результаті чого було розчиненого в 70мл тетрагідрофурану, остудили отримано 8,9г (вихід: 33,3%) 3-дифторметил-1до -50°С. Потім до нього повільно по краплях дометил-1Н-піразол-5-олу. дали розчин 1,0г (4,2ммоль) етил-3,5-дихлор-1 етил-1Н-піразол-4-карбоксилату, розчиненого в Одержання 5-хлор-3-дифторметил-1-метил30мл тетрагідрофурану. Отриману суміш піддали 1Н-піразол-4-карбоальдегіду перемішуванню при -50°С протягом 3 годин з ме41,6г (270,1ммоль) хлороксиду фосфор у дотою ініціювання реакції. Після підтвердження задали в умовах о холодження льодом до 7,9г вершення реакції до неї додали етилацетат з на(108,0ммоль) Ν,Ν-диметилформаміду. Потім до ступним нетривалим перемішуванням. Потім до суміші додали при кімнатній температурі 8,0г неї додали воду з наступним нетривалим перемі(54,0ммоль) 3-дифторметил-1-метил-1Н-піразол-5шуванням. Після цього отриману суміш профільтолу. Отриману суміш піддали дефлегмації протярували під вакуумом. Фільтрат екстрагували етигом 4 годин в умовах нагрівання з метою ініціюлацетатом. Отриманий органічний шар промили вання реакції. Після завершення реакції реакційну водою і водним розчином хлориду натрію, а потім суміш влили у воду, після чого екстрагували хловисушили над безводним сульфатом магнію. роформом. Отриманий органічний шар послідовно Отриманий розчин піддали вакуумній перегонці з промили водою, 5%-им водним розчином гідрометою видалення розчинника, що містився в ньоксиду натрію і знову водою, а потім висушили над му, у результаті чого було отримано 0,82г (вихід: безводним сульфатом магнію. Отриманий розчин 100%) (3,5-дихлор-1-етил-1Н-піразол-4-іл)піддали вакуумній перегонці з метою видалення метанолу у вигляді коричневої маслянистої речорозчинника, що містився в ньому. Залишок очисвини. 1 тили методом колонкової хроматографії на силікаН-ЯМР [CDCІ3 /TMC, d (проміль)]: гелі (проявний розчинник: змішаний розчинник 4,52 (2Н, с), 4,16 (2Н, кв), 1,43 (3Н, т) 59 78071 60 гексан-етилацетат), у результаті чого було отризультаті чого було отримано 24,7г (вихід: 38,0%) мано 7,7г (вихід: 73,3%) 5-хлор-3-дифторметил-1ефірату трифторацетальдегідоксиму. метил-1Н-піразол-4-карбоальдегіду у вигляді білих кристалів. Одержання ефірату трифторацетогідроксимо1 їлброміду Н-ЯМР [CDCІ3 /TMC, d (проміль)]: Розчин 38,8г (218,0ммоль) N-бромсукциніміду, 9,96 (1Н, с), 6,90 (1Н, т, J=53,6Гц), 3,93 (3Н, с) розчиненого в 125мл Ν,Ν-диметилформаміду, до Одержання (5-хлор-3-дифторметил-1-метилдали в умовах охолодження льодом до розчину 24,7г (131,7ммоль) ефірату трифторацетальдегі1Н-піразол-4-іл)-метанолу доксиму, розчиненого в 50мл Ν,ΝРозчин 7,2 (37,0ммоль) 5-хлор-3диметилформаміду. Суміш піддали перемішувандифторметил-1-метил-1Н-піразол-4ню при кімнатній температурі протягом 3 годин з карбоальдегіду, розчиненого в 100мл метанолу, остудили до 0°С. Потім до нього повільно додали метою ініціювання реакції. Після завершення реакції реакційну суміш влили у воду, після чого екст2,1г (55,5ммоль) борогідриду натрію. Отриману рагували діетиловим ефіром. Отриманий органічсуміш піддали перемішуванню при кімнатній темний шар промили водним розчином хлориду пературі протягом 3 годин з метою ініціювання натрію, а потім висушили над безводним сульфареакції. Після завершення реакції реакційну суміш влили у воду, після чого екстрагували етилацетатом магнію. Отриманий розчин піддали вакуумній перегонці з метою видалення розчинника, що містом. Отриманий органічний шар промили водним тився в ньому. Залишок піддали перегонщ, у рерозчином хлориду натрію, а потім висушили над зультаті чого було отримано 33,3г (вихід: 95,0%) безводним сульфатом магнію. Отриманий розчин ефірату трифторацетогідроксимоїлброміду у випіддали вакуумній перегонці з метою видалення розчинника, що містився в ньому, у результаті чого гляді коричневої маслянистої речовини. 1 було отримано 3,8г (вихід: 52,1%) (5-хлор-3Н-ЯМР [CDCІ3 /TMC, d (проміль)]: дифторметил-1-метил-1Н-піразол-4-іл)-метанолу. 9,30 (1Н, с) 1 Н-ЯМР [CDCІ3 /TMC, d (проміль)]: Одержання 4-етоксикарбоніл-5-метил-36,70 (1Н, т, J=40,8Гц), 4,63 (2Н, с), 3,86 (3Н, с), трифторметилізоксазолу 1,79 (1Н, шир.) 2,8г (51,3ммоль) метилату натрію додали до розчину 6,7г (51,3ммоль) етилацетоацетату, розОдержання 4-бромметил-5-хлор-3чиненого в 80мл метанолу. Потім до отриманої дифторметил-1-метил-1Н-піразолу суміші додали в умовах охолодження льодом розРозчин 2,0г (10,0ммоль) (5-хлор-3чин 5,0г (18,8ммоль) ефірату трифторгідроксимоїдифторметил-1-метил-1Н-піразол-4-іл)-метанолу, лброміду, розчиненого в 20мл метанолу. Отримарозчиненого в 50мл діетилового ефіру, остудили ну суміш піддали перемішуванню при кімнатній до -10°С. Потім до нього додали 1,0г (3,5ммоль) температурі протягом 3 години з метою ініціювантриброміду фосфору. Отриману суміш піддали ня реакції. Після завершення реакції реакційну перемішуванню при кімнатній температурі протясуміш піддали вакуумній перегонці з метою видагом ночі з метою ініціювання реакції. Після заверлення розчинника, що містився в ній. До залишку шення реакції реакційну суміш влили в льодяну додали воду з наступним екстрагуванням хлороводу, після чого екстрагували діетиловим ефіром. формом. Отриманий органічний шар промили воОтриманий органічний шар промили водним роздним розчином хлориду натрію, а потім висушили чином хлориду натрію, а потім висушили над безнад безводним сульфатом магнію. Отриманий водним сульфатом магнію. Отриманий розчин підрозчин піддали вакуумній перегонці з метою видадали вакуумній перегонці з метою видалення лення розчинника, що містився в ньому. Залишок розчинника, що містився в ньому, у результаті чого очистили методом колонкової хроматографії на було отримано 2,6г (вихід: 100,0%) 4-бромметил-5силікагелі (проявний розчинник: змішаний розчинхлор-3-дифторметил-1-метил-1Н-піразолу. ник гексан-етилацетат), у результаті чого було отримано 2,9г (вихід: 69,0%) 4-етоксикарбоніл-5Одержання ефірату трифторацетальдегідокметил-3-трифторметилізоксазолу у вигляді безбасиму рвної маслянистої речовини. 24,1г (347,0ммоль) гідрохлориду гідроксиламі1 ну і 160мл води додали до розчину 50,0г Н-ЯМР [CDCІ3 /TMC, d (проміль)]: (347,0ммоль) геміетилацеталю трифторацеталь4,36 (2Н, кв), 2,77 (3Н, с), 1,37 (3Н, т) дегіду, розчиненого в 80мл метанолу. Потім до отриманої суміші додали по краплях в умовах о хоОдержання (5-метил-3лодження льодом 80,0г 50 %-ого водного розчину трифторметилізоксазол-4-іл)-метанолу гідроксиду натрію (1,7моль). Після завершення Розчин 0,16г (4,2ммоль) алюмогідриду літію, покрапельного додавання отриману суміш піддали розчиненого в 15мл тетрагідрофурану, остудили перемішуванню при кімнатній температурі протядо 0°С. Потім до нього повільно додали розчин гом 6 годин з метою ініціювання реакції. Після за0,93г (4,2ммоль) 4-етоксикарбоніл-5-метил-3вершення реакції концентрацію водню в суміші трифторметилізоксазолу, розчиненого в 15мл тетдовели до рН=6 шляхом додавання 10%-ої хлорирагідрофурану. Отриману суміш піддали перемістоводневої кислоти. Отриману суміш екстрагувашуванню при 0°С протягом 1 години з метою ініціли діетиловим ефіром. Екстракт піддали вакуумній ювання реакції. Після завершення реакції до неї перегонці з метою видалення розчинника, що місдодали етилацетат з наступним нетривалим петився в ньому. Залишок піддали перегонці, у реремішуванням. Потім до неї додали воду з наступ
ДивитисяДодаткова інформація
Назва патенту англійськоюHerbicidal composition
Назва патенту російськоюГербицидная композиция
МПК / Мітки
МПК: A01N 43/90, A01N 43/80, A01N 43/82
Мітки: композиція, гербіцидна
Код посилання
<a href="https://ua.patents.su/37-78071-gerbicidna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Гербіцидна композиція</a>
Попередній патент: Спосіб закінчення свердловин
Наступний патент: Розкидач органічних добрив
Випадковий патент: Підвіска одновісного колісного причепа