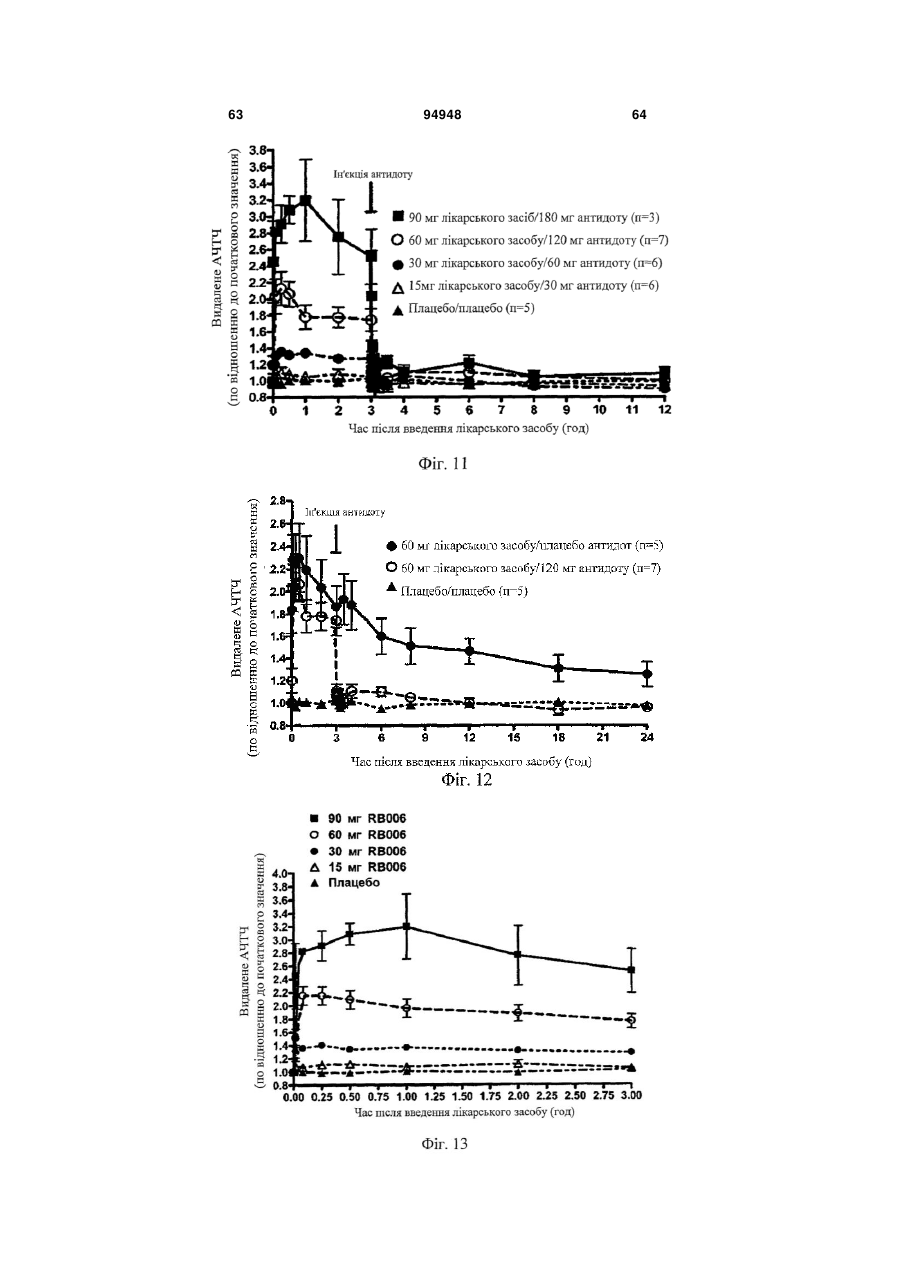
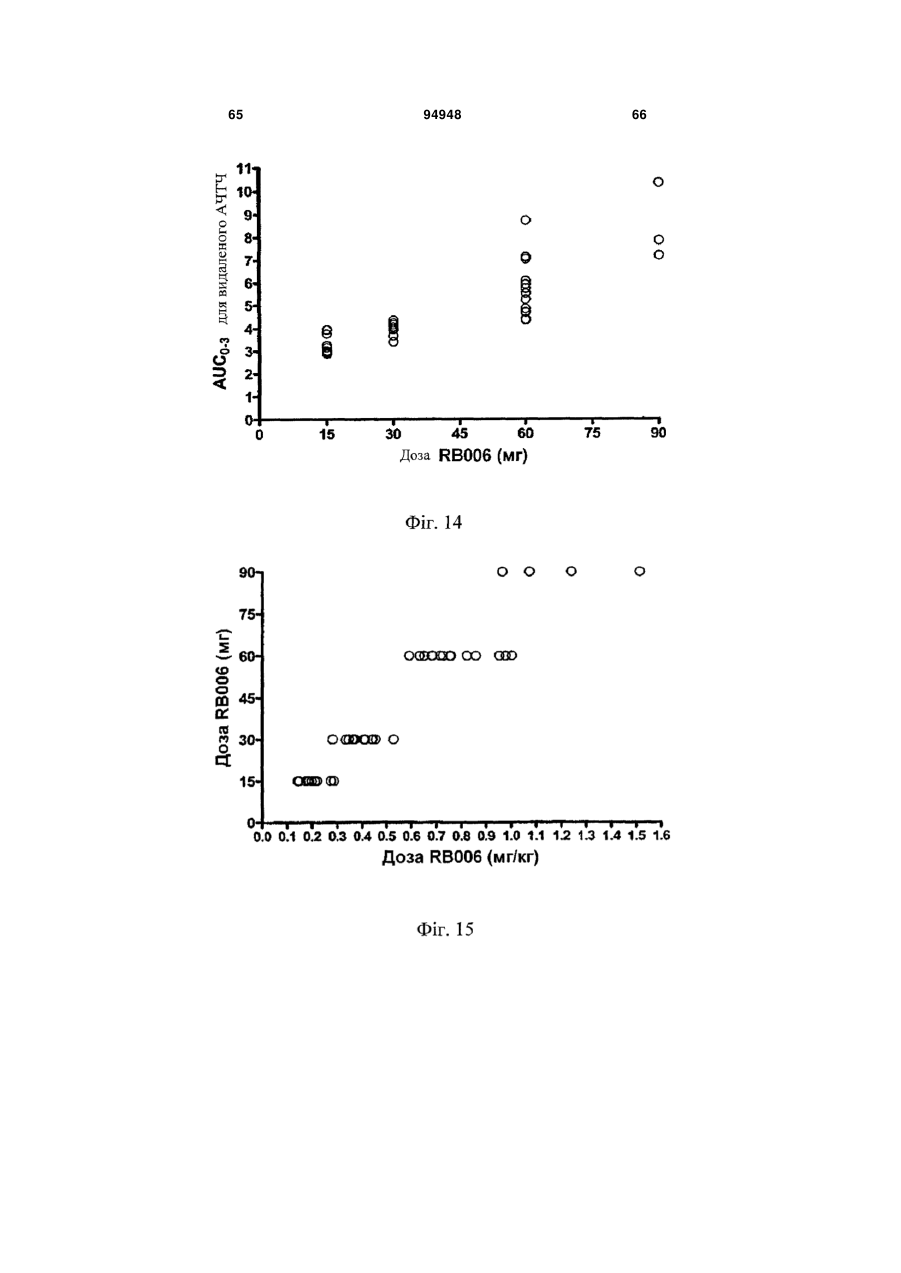
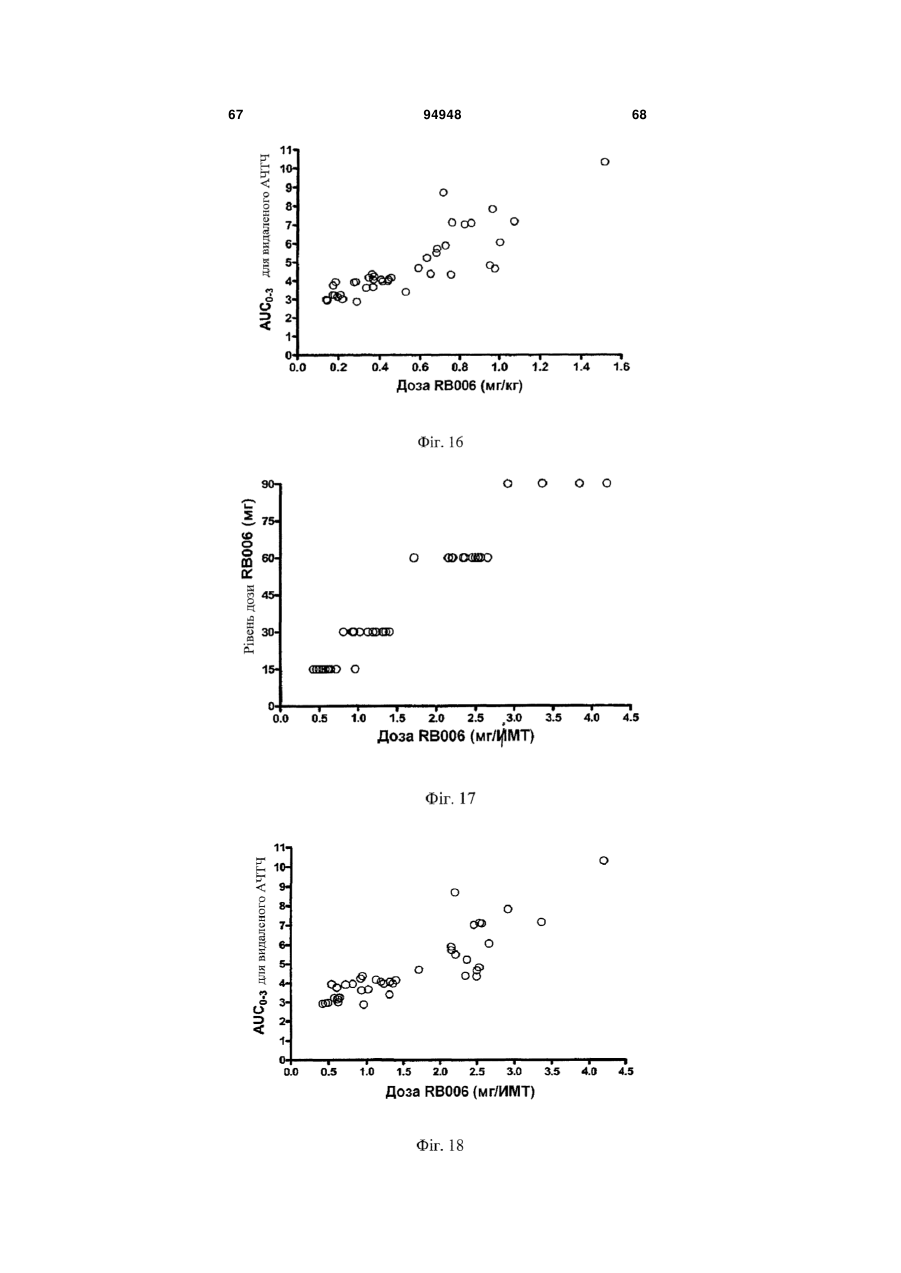
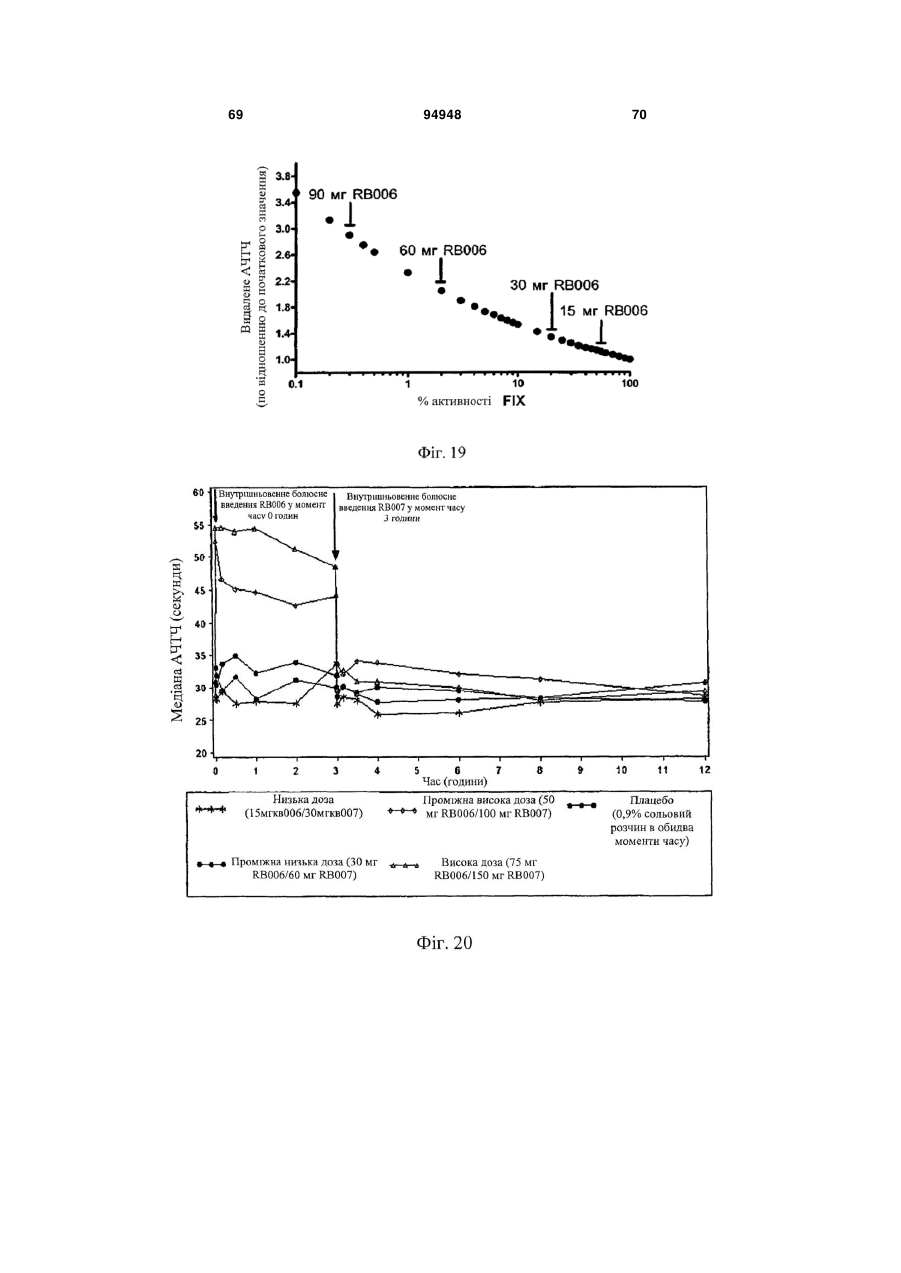
Введення протизсідної системи reg1
Формула / Реферат
1. Спосіб введения аптамеру, який включає:
a) вимірювання індексу маси тіла (ІМТ) суб'єкта;
b) визначення бажаної фармакодинамічної відповіді; і
с) введення суб'єкту дози аптамеру для досягнення бажаної фармакодинамічної відповіді на основі порівняння дози до ІМТ із фармакодинамічною відповіддю,
в якій аптамер містить SEQ ID NO 1, і де бажаною фармакодинамічною відповіддю є максимальний рівень антикоагуляції.
2. Спосіб за п. 1, який додатково включає введення суб'єкту дози антидоту аптамеру, де доза антидотуоснована на відомій дозі аптамеру, введеного раніше, і співвідношення антидот:аптамер основане на бажаному зниженні активності аптамеру.
3. Спосіб за п. 2, в якому аптамер вводиться в дозі 4 мг/ІМТ або більше.
4. Спосіб за п. 1, в якому бажаною фармакодинамічною відповіддю є рівень антикоагуляції приблизно 75 % від максимального, і в якому аптамер вводиться в дозі приблизно 3,0-4,0 мг/ІМТ.
5. Спосіб за п. 1, в якому бажаною фармакодинамічною відповіддю є рівень антикоагуляції приблизно 50 % від максимального, і в якому аптамер вводиться в дозі приблизно 2,0-3,0 мг/ІМТ.
6. Спосіб за п. 1, в якому доза протизсідного засобу складає від 0,1 до 10 мг/ІМТ.
7. Спосіб за п. 1, в якому доза протизсідного засобу складає приблизно 5 мг/ІМТ.
8. Спосіб введення аптамеру, що включає:
a) вимірювання ваги суб'єкта в кілограмах;
b) визначення бажаної фармакодинамічної відповіді;
с) введення суб'єкту дози аптамеру для досягнення бажаної фармакодинамічної відповіді на основі порівняння дози на кілограм з фармакодинамічною відповіддю; і,
d) введення дози антидоту аптамеру суб'єкту, де доза антидоту представлена, ґрунтуючись тільки на співвідношенні з дозою аптамеру,
в якому аптамер містить SEQ ID NO 1, при цьому доза протизсідного засобу складає приблизно 1,4 мг/кг або більше, і бажаною фармакодинамічною відповіддю є максимальний рівень антикогуляції, при цьому спосіб включає додаткове введення суб'єкту дози антидоту аптамеру, де доза антидоту основана на відомій дозі аптамеру, введеного раніше, і співвідношення антидот:аптамер основане на бажаному зниженні активності аптамеру.
9. Спосіб за п. 8, в якому бажаною фармакодинамічною відповіддю є рівень антикоагуляції приблизно 75 % від максимального, і в якому доза протизсідного засобу складає приблизно 1,0 мг/кг.
10. Спосіб за п. 8, в якому бажаною фармакодинамічною відповіддю є рівень антикоагуляції приблизно 50 % від максимального, і в якому доза протизсідного засобу складає приблизно 0,6-0,8 мг/кг.
11. Спосіб за п. 8, в якому доза протизсідного засобу складає від 5 до 10 мг/кг.
12. Спосіб за п. 1 або 8, в якому антидотом є олігонуклеотидний антидот.
13. Спосіб за п. 1 або 8, в якому фармакодинамічна відповідь вимірюється в аналізі коагулюючої активності.
14. Спосіб за п. 1 або 8, в якому аптамер вводять шляхом внутрішньовенного болюсного введення.
15. Спосіб за п. 1 або 8, в якому аптамер вводять шляхом підшкірної ін'єкції.
16. Спосіб за п. 2 або 8, в якому аптамер і антидот вводять у співвідношенні 1:1.
17. Спосіб за п. 2 або 8, в якому аптамер і антидот вводять у співвідношенні щонайменше 2:1.
18. Спосіб за п. 2 або 8, в якому аптамер і антидот вводять у співвідношенні 0,5:1 або меншому.
19. Спосіб за п. 2 або 8, в якому активність аптамеру зменшена на менше ніж 90 %.
20. Спосіб за п. 2 або 8, в якому активність аптамеру зменшена приблизно на 50 %.
Текст
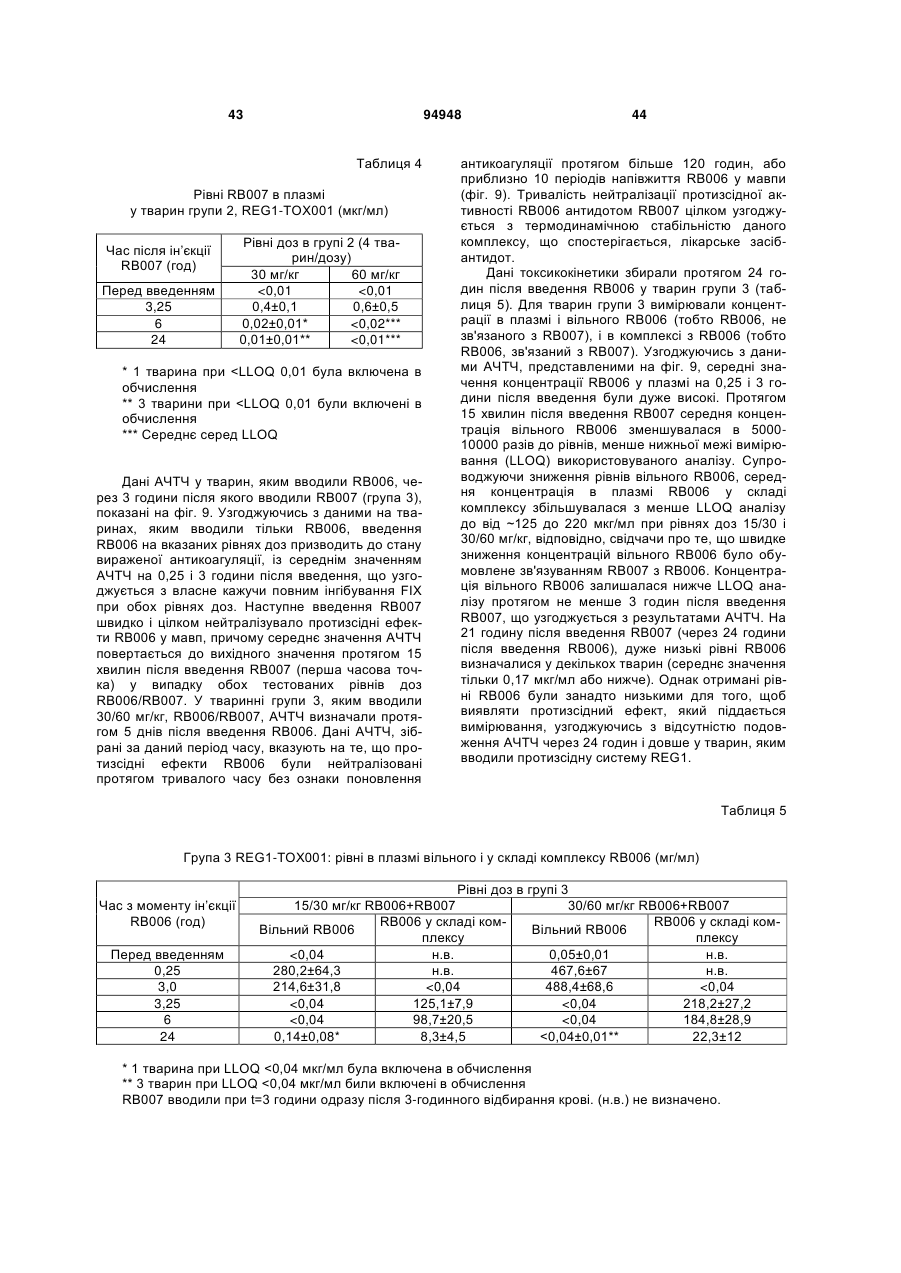
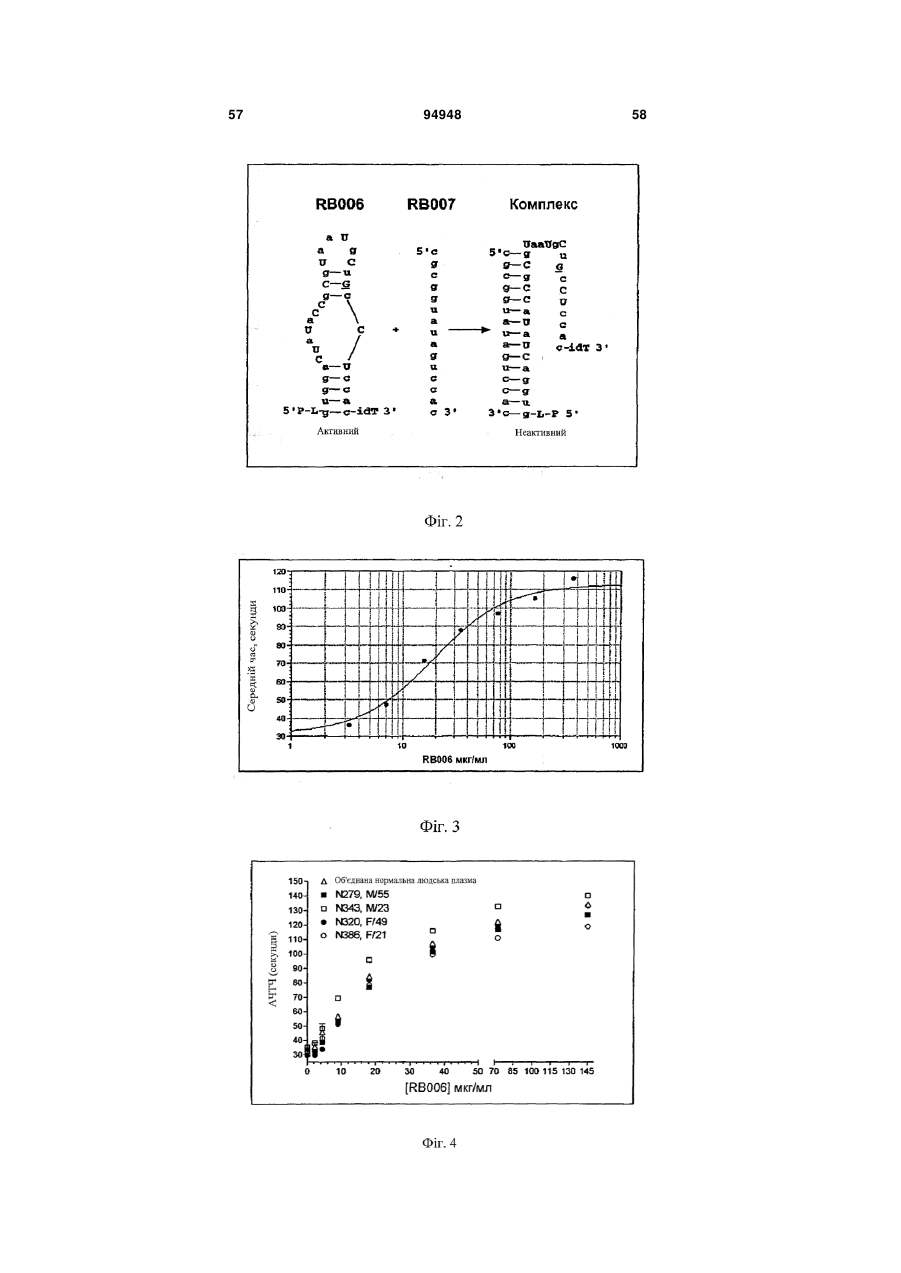
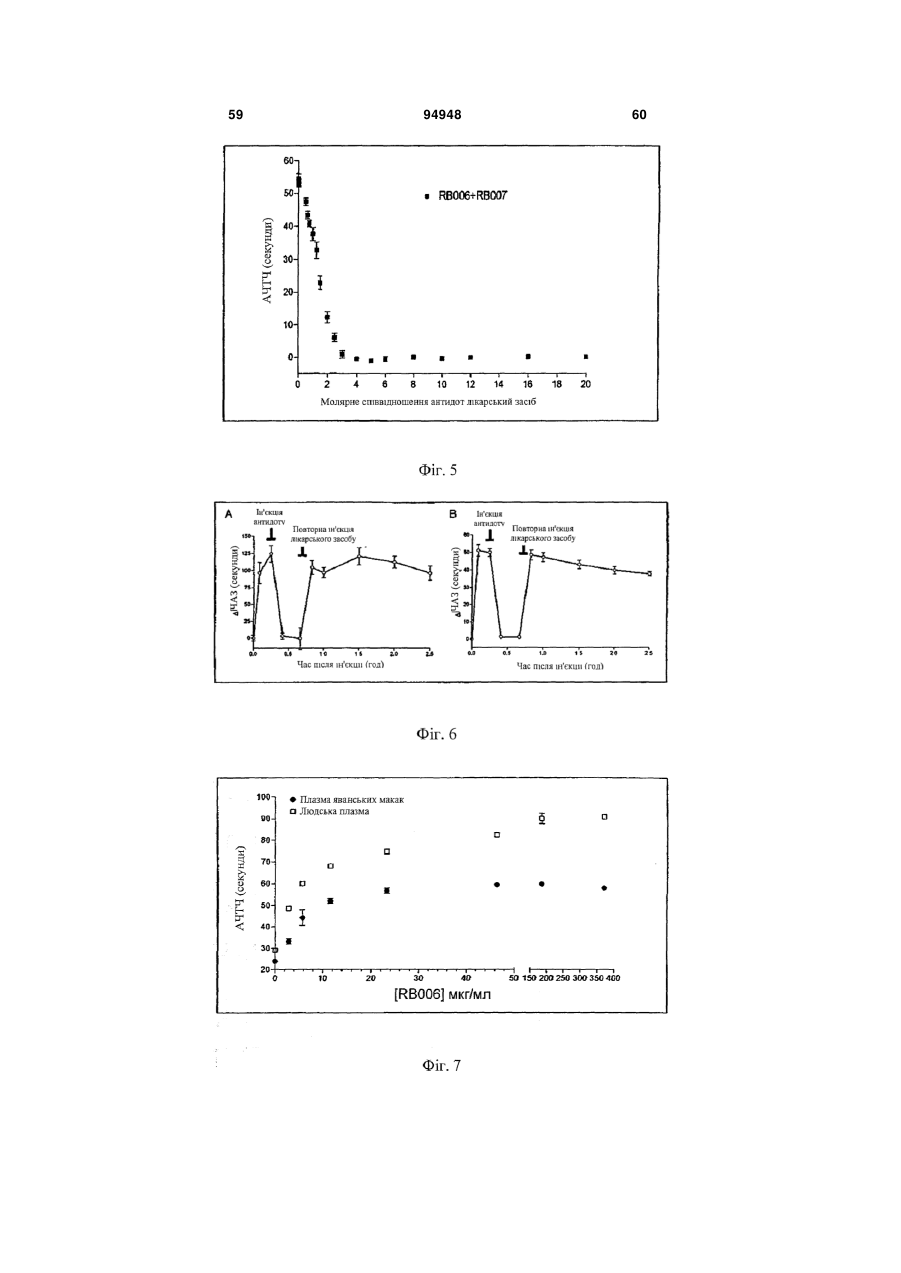
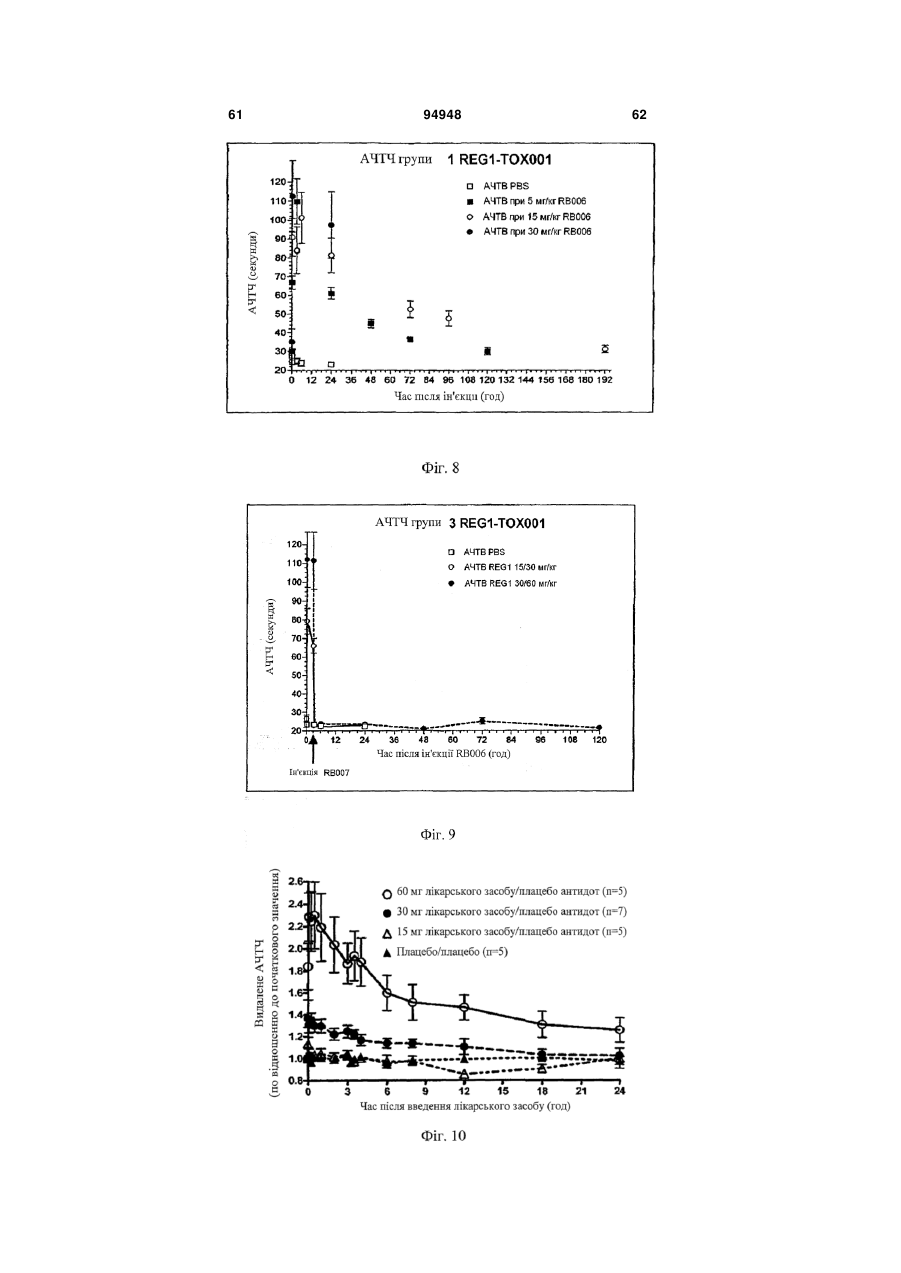
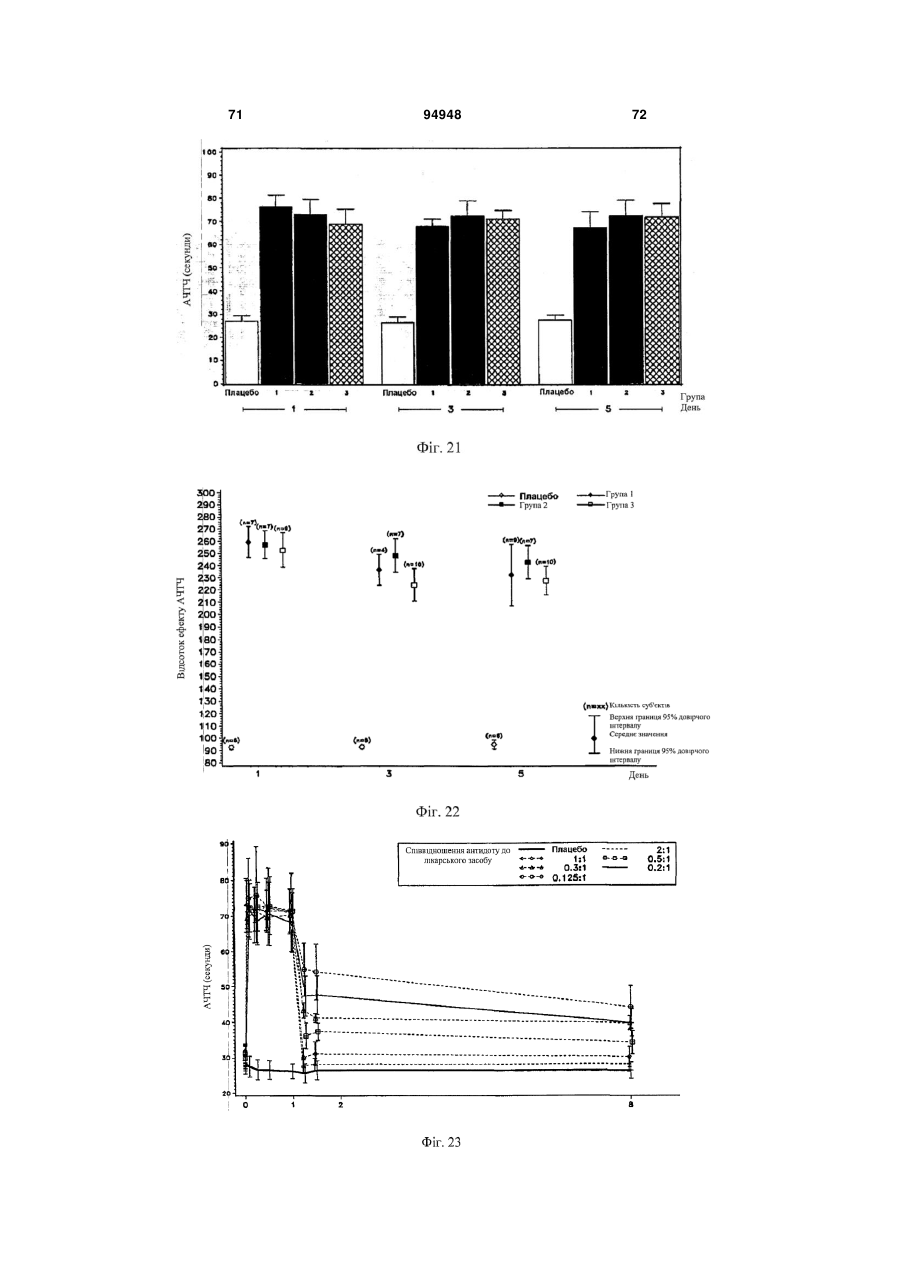
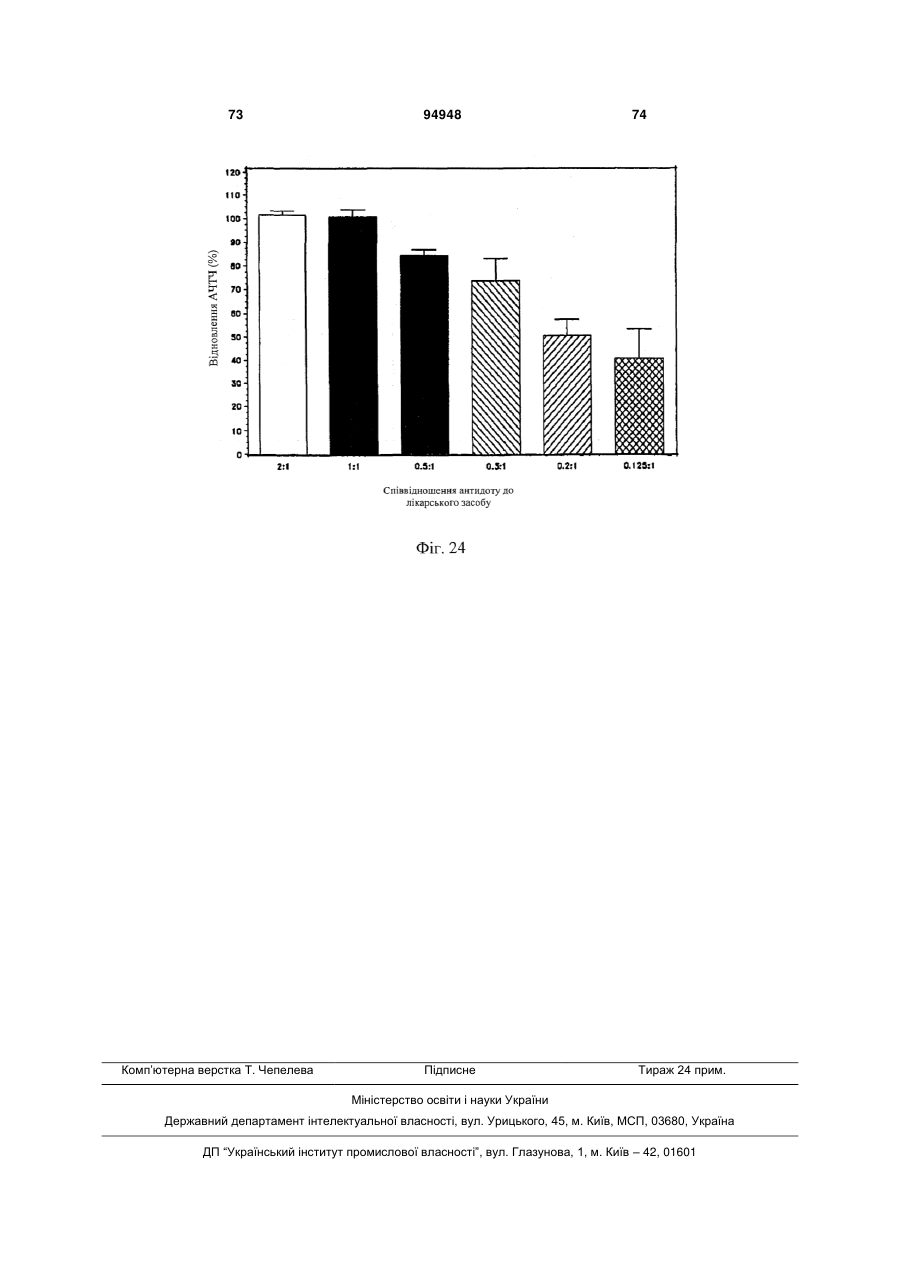
1. Спосіб введения аптамеру, який включає: a) вимірювання індексу маси тіла (ІМТ) суб'єкта; b) визначення бажаної фармакодинамічної відповіді; і с) введення суб'єкту дози аптамеру для досягнення бажаної фармакодинамічної відповіді на основі порівняння дози до ІМТ із фармакодинамічною відповіддю, в якій аптамер містить SEQ ID NO 1, і де бажаною фармакодинамічною відповіддю є максимальний рівень антикоагуляції. 2. Спосіб за п. 1, який додатково включає введення суб'єкту дози антидоту аптамеру, де доза антидоту основана на відомій дозі аптамеру, введеного раніше, і співвідношення антидот:аптамер основане на бажаному зниженні активності аптамеру. 3. Спосіб за п. 2, в якому аптамер вводиться в дозі 4 мг/ІМТ або більше. 4. Спосіб за п. 1, в якому бажаною фармакодинамічною відповіддю є рівень антикоагуляції приблизно 75 % від максимального, і в якому аптамер вводиться в дозі приблизно 3,0-4,0 мг/ІМТ. 5. Спосіб за п. 1, в якому бажаною фармакодинамічною відповіддю є рівень антикоагуляції прибли 2 (19) 1 3 94948 4 17. Спосіб за п. 2 або 8, в якому аптамер і антидот вводять у співвідношенні щонайменше 2:1. 18. Спосіб за п. 2 або 8, в якому аптамер і антидот вводять у співвідношенні 0,5:1 або меншому. 19. Спосіб за п. 2 або 8, в якому активність аптамеру зменшена на менше ніж 90 %. 20. Спосіб за п. 2 або 8, в якому активність аптамеру зменшена приблизно на 50 %. За даною заявкою запитується пріоритет відповідно до американської попередньої заявки № 60/808987, поданої 26 травня 2006 року, американською попередньою заявкою № 60/847809, поданої 27 вересня 2006 року, і американською попередньою заявкою № 60/865352, поданої 10 листопада 2006 року, що усі названі "Введення протизсідної системи REG1", розкриття яких включені в даний опис у своїй повноті. Представлений спосіб введення системи аптамеру й антидоту для регуляції коагуляції крові у суб'єкта на основі режиму дозування компонентів системи, нормованих на вагу або індекс маси тіла. Протизсідна терапія в умовах надання невідкладної допомоги Враховуючи центральну роль тромбозу в патології гострої ішемічної хвороби серця, протизсідні засоби для ін'єкцій стали основою лікування пацієнтів з гострими коронарними синдромами, такими як нестабільна стенокардія та інфаркт міокарда і тих, які проходять процедури реваскуляризації коронарного русла (Harrington та ін., 2004; Popma та ін., 2004). В даний час доступні протизсідні засоби включають нефракціонований гепарин (UFH), низькомолекулярні гепарини (LMWH) і прямі інгібітори тромбіну (DTI), такі як рекомбінантний гірудин, бівалірудин і аргатробан. Існуючою парадигмою як для застосування протизсідного засобу, так і для створення антитромботичного лікарського засобу тривалої дії є встановлення балансу між ефективністю, що означає зниження ризику ішемічних ускладнень, і безпекою, що означає зведення до мінімуму ризику кровотечі (Harrington та ін., 2004). Кожний з доступних засобів несе підвищений ризик кровотечі в порівнянні з плацебо. Головним побічним ефектом, пов'язаним із протизсідними й антитромботичними лікарськими засобами, є кровотеча, що може викликати стійку непрацездатність і смерть (Ebbesen та ін., 2001; Levine та ін., 2004). Як правило, кардіологиклініцисти були схильні іти на компроміс з підвищенням ризику кровотечі, якщо лікарський засіб може знизити ризик ішемічних ускладнень або гострих коронарних синдромів або процедур реваскуляризації коронарного русла. Однак недавно отримані дані змушують припустити, кровотечі, особливо такі, котрі вимагають переливання крові, значно впливають на результат і вартість лікування пацієнтів з ГКС. Частота переливань крові у хворих, яким робиться елективна операція аортокоронарного шунтування (CABG) складають 3060%, і переливання у вказаних пацієнтів пов'язане зі збільшеною швидкою, середньо тривалою і віддаленою летальністю (Bracey та ін., 1999; Engoren та ін., 2002; Hebert та ін., 1999). Кровотеча також є найчастішим і дорогим ускладненням, пов'язаним із черезшкірними коронарними втручаннями (PCI), з переливаннями, що виконуються в 5-10% пацієнтів з додатковими витратами $8000-$12000 (Moscucci, 2002). Крім того, частота значущих кровотеч у хворих, що проходять лікування з приводу ГКС, також висока, в інтервалі від 5% до 10% (крім пацієнтів, яким виконують АКШ), із кровотечею і переливанням, незалежно пов'язаним зі значним збільшенням миттєвої летальності (Moscucci та ін., 2003; Rao та ін., 2004). Тому, незважаючи на триваючий розвиток нових антитромботичних засобів, існує виражена клінічна потреба в більш безпечних протизсідних засобах. Швидке припинення дії лікарського засобу може бути досягнуте пасивно за допомогою композиції лікарського засобу, наприклад, засобу для інфузійного введення з коротким періодом напіввиведення з завершенням інфузії як способа припинення, або активно за допомогою введення другого засобу, антидоту, що може нейтралізувати дію лікарського засобу. Для пацієнтів, госпіталізованих з гострою ішемічною хворобою серця, ідеальний протизсідний засіб повинен вводитися за допомогою внутрішньовенної або підшкірної ін'єкції, бути негайно ефективним, легко дозованим, а також не вимагати частого контролю і бути негайно і надійно оборотним. Поточні підходи для вирішення проблеми UFH у даний час є єдиним оборотним за допомогою антидоту протизсідним засобом, що схвалений для застосування. Однак у UFH є значущі обмеження. По-перше, у гепарину складна фармакокінетика, що робить надійність його застосування ускладнюючою (Granger та ін., 1996). По-друге, передбачуваність дози його антидоту, протаміну, є ускладнюючою, і існують серйозні побічні ефекти, пов'язані з його застосуванням (Carr і Silverman, 1999; Welsby та ін., 2005). Нарешті, гепарин може викликати тромбоцитопенію (HIT) і тромбоцитопенію з тромбозом (HITT) (Warkentin, 2005; Warkentin і Greinacher, 2004). Незважаючи на вказані обмеження, гепарин залишається найбільш широко використовуваним протизсідним засобом для госпіталізованих пацієнтів насамперед тому, що він "оборотний". Протизсідні засоби більш нового покоління, такі як LMWH, мають поліпшену передбачуваність дозування UFH і не вимагають моніторування як практики при їхньому звичайному застосуванні, основаному на лабораторних дослідженнях. HIT і HITT рідше зустрічаються при застосуванні LMWH, ніж UFH, але при їхньому застосуванні вказаний ризик не усунутий. Два з трьох комерційно доступних DTI, лепірудин і аргатробана, зокрема, схвалені 5 для застосування у хворих, в яких розвився HIT або був в анамнезі. Бівалірудин схвалений для застосування як протизсідний засіб під час PCI, і тому представляє привабливу альтернативу UFH у хворих з HIT. Однак не існує ніяких прямих і ефективних антидотів для припинення протизсідних ефектів ні для LMWH, ні для DTI, що представляє особливий ризик при їхньому застосуванні в пацієнтів, яким проводять хірургічні або черезшкірні процедури реваскуляризації коронарних судин (Jones та ін., 2002). Кровотечі у пацієнтів, що одержували LMWH або DTI, купують введенням препаратів крові, включаючи фактори згортання. Згортання крові і FIX Клітинна модель згортання (фіг. 1) на сьогоднішній день представляє саме ясне пояснення, яким чином відбувається фізіологічне згортання коагуляція in vivo (Hoffman та ін., 1995; Kjalke та ін., 1998; Monroe та ін., 1996). Відповідно до вказаної моделі, реакція згортання проходить у три етапи: ініціація, ампліфікація і поширення. Ініціація коагуляції відбувається на клітинах, що несуть тканинний фактор, таких як активовані моноцити, макрофаги і ендотеліальні клітини. Фактор коагуляції VIIa, що утворює комплекс із тканинним фактором, каталізує активацію факторів згортання крові IX (FIX) і X (FX), що, у свою чергу, виробляє невелику кількість тромбіну з протромбіну. У фазі ампліфікації (фаза, що також позначається як праймінг), невелика кількість тромбіну, виробленого у фазі ініціації, активує фактори згортання крові V, VIII і XI, а також активує тромбоцити, що представляють поверхню, на якій проходять наступні реакції згортання. In vivo, невеликих кількостей тромбіну, утворених під час фази ампліфікації, не досить для перетворення фібриногену на фібрин у силу наявності ендогенних інгібіторів тромбіну, що називаються серпинами, такі як антитромбін III, α-2-макроглобулін і кофактор гепарину II. Заключна фаза реакції коагуляції, поширення, зустрічається винятково на поверхні активованих тромбоцитів. У фазі поширення значні кількості FIXa утворюються за допомогою FXIa-каталізованої активації FIX. FIXa утворює комплекс зі своїм обов'язковим кофактором FVIIIa, що активує FX. Згодом, FXa утворює комплекс зі своїм обов'язкової кофактором FVa. Комплекс FXa-FVa активує протромбін, що призводить до "вибухового" утворення тромбіну і відкладення фібрину. Кінцевим результатом є утворення стабільного згустку. Ґрунтуючись на зазначеній моделі, при згортанні FIXa грає дві ролі. У фазі ініціації FIXa відіграє важливу роль в утворенні невеликої кількості тромбіну за допомогою активації FX у FXa і наступної активації протромбіну. Однак зазначена роль FIXa щонайменше частково перекривається з перетворенням FX у FXa, що каталізується тканинним фактором і FVIIa. Більш критична функція FIXa здійснюється у фазі поширення, в якій ферментативний комплекс FVIIIa/FIXa служить єдиним каталізатором утворення FXa на поверхні активованого тромбоциту. Тому зниження активності FIXa, або в силу генетичної недостатності FIX (тобто гемофілія B), або в результаті фармаколо 94948 6 гічного інгібування FIX/IXa, як очікується, зробить декілька ефектів на коагуляцію. По-перше, інгібування або втрата дії FIXa повинні частково загальмувати ініціацію коагуляції. По-друге, інгібування або втрата дії FIXa повинні мати істотний вплив на фазу поширення коагуляції, призводячи до значного скорочення або усунення утворення тромбіну. Нарешті, обмеження утворення тромбіну під час фази поширення щонайменше частково пригнічує ампліфікацію коагуляції за механізмом зворотного зв'язку за допомогою зниження активації тромбоцитів і факторів згортання крові, задіяних на більш ранніх етапах, таких як фактори V, VII і XI. Оцінка інгібіторів FIXa на тваринах і людях на попередньому рівні техніки Інгібітори активності FIX, такі як фактор IXa з інактивованим активним сайтом (FIXai) або моноклональні антитіла проти FIX (наприклад, антитіло BC2), мають потужну протизсідну і антитромботичну активність в декількох моделях на тваринах, включаючи різні тварини моделі артеріального тромбозу й інсульту (Benedict та ін., 1991; Choudhri та ін., 1999; Feuerstein та ін., 1999; Spanier та ін., 1998a; Spanier і др., 1997; Spanier та ін., 1998b; Toomey та ін., 2000). Загалом, у вказаних дослідженнях було показано, що інгібітори FIXa мають більш високе відношення антитромботичної активності до ризику кровотечі, ніж нефракціонований гепарин у тварин. Однак, у вказаних дослідженнях, у дозах незначно вище, ніж ефективна доза, тварини, яким проводили лікування зазначеними засобами, мали профілі кровотечі, які не відрізнялися від таких для гепарину. Вказаний досвід контрольованих досліджень на тваринах змушує припускати, що в клінічних умовах здатність керувати активністю інгібітору FIXa підвищила б його безпеку і полегшила б його медичне застосування. Крім того, було показано, що FIXai є безпечним і ефективним як замісник гепарину в декількох хірургічних моделях на тваринах, в яких необхідна терапія протизсідним засобом, включаючи моделі ангіопластики синтетичним шматком на кроликах, так само, як і моделі CABG з екстрапульмональним кровообігом на собаках і нелюдських приматах (Spanier та ін., 1998a; Spanier та ін., 1997; Spanier та ін., 1998b). FIXai також успішно використовувався в декількох критично хворих пацієнтів, що потребували екстрапульмонального кровообігу, і в створенні інших екстракорпоральних способів кровообігу, таких як екстракорпоральна мембранна оксигенація (Spanier та ін., 1998a), лікарями Columbia College of Physicians and Surgeons у межах доброчинної допомоги. Таким чином, FIXa є обґрунтованою мішенню для терапії протизсідними засобами при процедурах реваскуляризації коронарних судин (і CABG, і PCI) і для лікування і профілактики тромбозу в пацієнтів з гострими коронарними синдромами. Розробка аптамерного лікарського засобу, пари лікарський засіб-антидот і REG1 Одним підходом до представлення контрольованої антикоагуляції є використання протизсідного засобу із середньо тривалою і тривалою дією ~12 годин і більше, що може досягти клінічно адекватної дії у відносно низьких дозах, у комбінації з дру 7 гим засобом, здатним до специфічного зв'язування і нейтралізації первинного протизсідного засобу. Така комбінація "лікарський засіб-антидот" може гарантувати передбачувану і безпечну нейтралізацію і припинення протизсідної активності лікарського засобу (Rusconi та ін., 2004, Nat Biotechnol. 22 (11):1423-8; Rusconi та ін., 2002, Nature 419 (6902):90-4). При відкритті протизсідної системи REG1, основаної на аптамері (див. фіг. 2), заявники застосували технологію лікарського засобу-антидоту. Аптамери є одноланцюжковими нуклеїновими кислотами, що з високою афінністю і специфічністю зв'язуються з білками-мішенями (Nimjee та ін., 2005) подібно до моноклональних антитіл. Однак для того, щоб зв'язатися і заінгібувати білокмішень, аптамер повинен прийняти визначену глобулярну третинну структуру. Утворення вказаної глобулярної третинної структури вимагає того, щоб аптамер прийняв правильну вторинну структуру (тобто правильні області спарених і неспарених основ). Як показано в схематичній формі на фіг. 2, введення олігонуклеотиду, комплементарного частині аптамеру, може змінити структуру аптамеру таким чином, що він більше не може зв'язуватися зі своїм білком-мішенню і, таким чином, ефективно припиняє або нейтралізує фармакологічну активність аптамерного лікарського засобу (Rusconi та ін., 2004, Nat Biotechnol. 22 (11):1423-8; Rusconi та ін., 2002, Nature 419 (6902):90-4). RB006 (40 кДа складний ефір P-LguggaCUaUaCCgCgUaaUgCuGcCUccacT, в якому P=mPEG2-NHS; L=C6 NH2 лінкер; G=2-О G; g=2’O-Me G; C=2-F C; c=2’-O-Мі C; U=2-F U; u=2’-O-Me U; a=2-O-Me A; і T=інвертований 2’-H T (SEQ IDT NO 1); див. фіг. 2), компонент лікарського засобу REG1 є прямим інгібітором FIXa, що зв'язується з фактором згортання FIXa з високої афінністю і специфічністю (Rusconi та ін., 2004, Nat Biotechnol. 22 (11):1423-8; Rusconi та ін., 2002, Nature 419 (6902):90-4; див. також WO05/106042 на ім'я Duke University). RB006 виявляє протизсідну активність за допомогою блокування FVIIIa/FIXaкаталізованого перетворення FX у FXa. RB006 є модифікованим РНК аптамером, 31 нуклеотид у довжину, що помірковано стабілізований проти деградації ендонуклеазами за допомогою наявності 2'-фтор і 2'-O-метил вмісних цукрових груп, і стабілізована проти деградації екзонуклеазами за допомогою 3'-інвертованого дезокситимідинового кепу. Нуклеїнова частина аптамеру кон’югована з 40-килодальтонним поліетиленгліколевим (ПЕГ) носієм для збільшення періоду його напівжиття в крові. При болюсній внутрішньовенній ін'єкції період напівжиття RB006 у мишах складає приблизно 8 годин і у мавпах приблизно 12 годин. Також, для підтримки стану, що протидіє згортанню, протягом більше декількох годин можна вводити RB006 у вигляді однократної болюсної ін'єкції, а не за допомогою внутрішньовенної інфузії. Як показано на фіг. 2, RB007 (cgcgguauaguccac, в якому g=2’-О-Me G; c=2’-O-Мі C; u=2’-O-Me U; і а=2’-O-Me А (SEQ IDT NO 2); див. фіг. 2), антидотний компонент REG1, є олігонукле 94948 8 отидом, що комплеменарний частини RB006, що може ефективно зв'язуватися з RB006 і, таким чином, нейтралізувати його анти-FIXa дія. RB007 являє собою 2’-O-метил РНК олігонуклеотид, 15 нуклеотидів за довжиною, що комплеменарна частині компоненту лікарського засобу REG1.2’-Oметил модификація наділяє антидот помірною стійкістю до нуклеаз, що забезпечує достатню in vivo стабільність для того, щоб дозволити йому знайти і зв'язатися з RB006, але не підтримує тривалу in vivo персистенцію. Неклінічний етап розробки REG1 Заявники одержали фармакологічні дані, що демонструють специфічність аптамеру RB006 до FIXa і афінність антидоту RB007 до аптамеру. Результати неклінічних фармакологічних досліджень можуть бути коротенько сформульовані в такий спосіб: лікарський компонент REG1 (RB006 і/або споріднені сполуки попередники) може: (1) ефективно інгібувати активацію фактора згортання X in vitro; (2) подовжувати час згортання плазми крові in vitro у плазмі людей і інших видів тварин; (3) робити системну протизсідну дію у тварин при болюсному внутрішньовенному введенні; (4) запобігати утворенню тромбу в моделі тромбозу при ушкодженні артерії на тваринах; (5) замінювати гепарин у моделі екстрапульмонального кровообігу у тварин, і (6) бути ефективним при повторному введенні тварині протягом 30 хвилин після нейтралізації антидотним компонентом REG1. У неклінічних фармакологічних дослідженнях до даного часу було показано, що антидотний компонент REG1 (RB007 і/або антидоти, специфічні до попередників лікарського компоненту REG1) може: (1) швидко і протягом тривалого часу нейтралізувати протизсідну активність лікарського компоненту REG1 (RB006) in vitro у плазмі людей і інших видів тварин; (2) швидко і протягом тривалого часу нейтралізувати протизсідну активність лікарського компоненту REG1 in vivo після внутрішньовенного болюсного введення тварині, якій проводили системну протизсідну терапію зазначеним засобом; (3) запобігати кровотечі, викликаній комбінацією надтерапевтичних доз лікарського компоненту REG1 і хірургічної травми і (4) нейтралізувати протизсідну активність лікарського компоненту REG1 у тварин після екстрапульмонального кровообігу. Крім того, антидот не виявив ніякої протизсідної або іншої фармакологічної активності in vitro у людській плазмі або у тварин після внутрішньовенного болюсного введення. Залишається потреба в представленні надійного способу введення, що враховує передбачуваний і відтворений ефект системи аптамерантидот. Було виявлено, що існує виразний зв'язок між нормованою на вагу дозою і, важливо, нормованою на індекс маси тіла дозою аптамеру і його фармакодинамічною відповіддю. Крім того, на здивування було виявлено, що доза антидоту аптамеру повинна бути нормована тільки на кількість аптамеру, введеного в організм, але не на будь-які додаткові критерії, для інгібування активності аптамеру до бажаного рівня. Це нове розуміння представляє підтримку для визначених способів 9 введення, що враховують передбачуваний і багаторазовий режим дозування при клінічному застосуванні. В одному варіанті здійснення даний винахід представляє поліпшений спосіб введення аптамерної протизсідної системи, що включає: 1) вимірювання індексу маси тіла (ІМТ) суб'єкта; 2) визначення бажаної фармакодинамічної відповіді; і 3) введення суб'єкту дози аптамерного протизсідного засобу для досягнення бажаної фармакодинамічної відповіді, ґрунтуючись на порівнянні дози до ІМТ із фармакодинамічною відповіддю. У приватних варіантах здійснення антидот аптамеру згодом вводиться суб'єкту, причому доза антидоту представлена, ґрунтуючись на співвідношенні раніше введеної дози аптамеру до бажаного зниження активності аптамеру. В окремих випадках зазначена доза антидоту нормується залежно від часу, що пройшов після введення аптамеру. В окремих випадках співвідношення антидоту до аптамеру знижене в два рази, якщо аптамер був введений раніше, ніж за 24 години. У приватних варіантах здійснення бажаний максимальний рівень протизсідного ефекту. У вказаних випадках аптамер може бути наданий у кількості 4 мг/ІМТ або більше. В інших випадках бажаний рівень антикоагуляції приблизно на 75% від максимального. У таких випадках суб'єкту вводиться доза приблизно 0,75-1,5 мг/ІМТ. В інших випадках бажаним є рівень антикоагуляції приблизно 50% від максимального. У вказаних випадках представлена доза складає приблизно 0,25-0,5 мг/ІМТ. У приватних загальних варіантах здійснення дозування використовуваного протизсідного засобу складає від 0,1 до 10 мг/ІМТ. В іншому варіанті здійснення дозування складає від 0,2 до 8 мг/ІМТ, або від 0,2 до 6 мг/ІМТ, від 0,2 до 5 мг/ІМТ, від 0,2 до 4 мг/ІМТ, від 0,2 до 3 мг/ІМТ, від 0,2 до 2 мг/ІМТ, або від 0,2 до 1 мг/ІМТ. У деяких варіантах здійснення доза протизсідного засобу складає приблизно 0,1 мг/ІМТ, або приблизно 0,2 мг/ІМТ, або приблизно 0,5 мг/ІМТ, або приблизно 0,75 мг/ІМТ, або приблизно 1 мг/ІМТ, або приблизно 2 мг/ІМТ, або приблизно 3 мг/ІМТ, або приблизно 4 мг/ІМТ, або приблизно 5 мг/ІМТ, або приблизно 6 мг/ІМТ, або приблизно 7 мг/ІМТ, або приблизно 8 мг/ІМТ, або приблизно 9 мг/ІМТ, або приблизно 10 мг/ІМТ. В іншому варіанті здійснення даний винахід представляє поліпшений спосіб введення аптамерної протизсідної системи, що включає: 1) вимірювання ваги суб'єкта; 2) визначення бажаної фармакодинамічної відповіді; і 3) введення суб'єкту дози аптамерного протизсідного засобу для досягнення бажаної фармакодинамічної відповіді, ґрунтуючись на порівнянні дози на кілограм ваги суб'єкта з фармакодинамічною відповіддю. У визначених варіантах здійснення антидот аптамеру згодом вводиться суб'єкту, причому доза антидоту, що вводиться, основана на співвідношенні до раніше введеної дози аптамеру, нормованої для бажаного зниження активності аптамеру. В окремих випадках зазначена доза антидоту розраховується, ґрунтуючись на часі, що пройшов після введення аптамеру. В окремих випадках відно 94948 10 шення антидоту до аптамеру подвоєне, якщо з моменту введення аптамеру пройшло більше 24 годин. У приватних варіантах здійснення бажаний максимальний рівень протизсідного ефекту. У вказаних випадках аптамер може бути введений у дозі 1,4 мг/кг або більше. В інших випадках бажаний рівень антикоагуляції приблизно на 75% від максимального. У таких випадках суб'єкту вводять дозу від 0,5 до 0,75 мг/кг. В інших випадках бажаний рівень антикоагуляції складає приблизно 50% від максимального. У вказаних випадках вводять дозу приблизно від 0,2 до 0,4 мг/кг. У приватних загальних варіантах здійснення використовувана доза складає від 0,1 до 2 мг/кг, від 0,1 до 1,8 мг/кг, від 0,1 до 1,6 мг/кг, від 0,1 до 1,5 мг/кг, від 0,1 до 1,4 мг/кг, від 0,1 до 1,3 мг/кг, від 0,1 до 1,2 мг/кг, від 0,1 до 1,1 мг/кг, від 0,1 до 1,0 мг/кг, від 0,1 до 0,9 мг/кг, від 0,1 до 0,8 мг/кг, від 0,1 до 0,7 мг/кг, від 0,1 до 0,6 мг/кг, від 0,1 до 0,5 мг/кг, від 0,1 до 0,4 мг/кг, від 0,1 до 0,3 мг/кг, або від 0,1 до 0,2 мг/кг. В інших варіантах здійснення доза складає від 1 до 20 мг/кг, від 1 до 18 мг/кг, від 1 до 15 мг/кг, від 2 до 15 мг/кг, від 3 до 15 мг/кг, від 4 до 15 мг/кг, від 5 до 20 мг/кг, від 5 до 15 мг/кг, або від 1 до 10 мг/кг, або від 5 до 10 мг/кг, або складає приблизно 1 мг/кг, приблизно 2 мг/кг, приблизно 3 мг/кг, приблизно 4 мг/кг, приблизно 5 мг/кг, приблизно 6 мг/кг, приблизно 7 мг/кг, приблизно 8 мг/кг, приблизно 9 мг/кг, або приблизно 10 мг/кг. У переважному варіанті здійснення аптамерною антикоагуляційною системою є система REG1, що включає протизсідний аптамер і олігонуклеотидний антидот. У приватних необмежуючих варіантах здійснення аптамером є RB006 (SEQ IDT NO 1) і антидотом є RB007 (SEQ IDT NO 2). В одному варіанті здійснення фармакодинамічну відповідь вимірюють в аналізах коагулюючої активності, таких як АЧТЧ (плазми або цільної крові) або час активного згортання (ЧАЗ), і може бути виражене у вигляді абсолютного значення, відсотка від ефекту, відсотка зміни, середньозваженого за часом або значення площі під кривою за визначений період часу. Рівень фармакодинамічної відповіді може бути будь-яким, який необхідний для приватної задачі. Наприклад, в окремих випадках, якщо в пацієнта низький ризик тромботичного ускладнення, то може бути бажаний низький рівень відповіді. В окремих випадках, можливо, не бажано досягати максимального інгібування фактора згортання, і зокрема, інгібування FIX або Fіха за допомогою використання надлишкової кількості протизсідного засобу, особливо аптамеру для Fіха, такого як RB006. В інших випадках, коли в пацієнта високий ризик тромбічного ускладнення або в нього розвивається тромбічне ускладнення, може бути бажаний високий рівень відповіді. У таких випадках може бути бажане максимальне збільшення інгібування фактора згортання, і зокрема, FIX або інгібування Fіха при використанні надлишкової кількості протизсідного засобу, зокрема, аптамеру до Fіха, такого як RB006. В одному варіанті здійснення протизсідний аптамер, такий як RB006, призначений для внутріш 11 ньовенного болюсного введення. В іншому варіанті здійснення протизсідний аптамер представлений для підшкірної ін'єкції. В іншому варіанті здійснення, після внутрішньовенного або підшкірного болюсного введення аптамеру проводять ін'єкцію антидоту. Процедури, описані в даному описі, дозволяють покроково вводити як протизсідний засіб, так і антидот, що дозволяє або титрувати одну, або обидві сполуки до бажаного рівня інгібування і нейтрилізації активності мішені. Відношення антидоту до аптамеру розраховували, ґрунтуючись на бажаному рівні інгібування аптамеру. Було виявлено, що дозу антидоту потрібно розраховувати тільки виходячи з дози аптамеру, і не треба додатково нормувати на фактори, що відносяться до суб'єкта. В одному варіанті здійснення відношення аптамеру до антидоту складає 1:1. В інших варіантах здійснення відношення аптамеру до антидоту складає більше 1:1, таке як 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 або більше. Вказані відношення можна також обчислити, ґрунтуючись на співвідношенні антидоту до аптамеру, що може, наприклад, бути менше приблизно 1:1, такими як 0,9:1 або приблизно 0,9:1, 0,8:1 або приблизно 0,8:1, 0,7:1 або приблизно 0,7:1, 0,6:1 або приблизно 0,6:1, 0,5:1 або приблизно 0,5:1, 0,45:1 або приблизно 0,45:1, 0,4:1 або приблизно 0,4:1, 0,35:1 або приблизно 0,35:1, 0,3:1 або приблизно 0,3:1, 0,25:1 або приблизно 0,25:1, 0,2:1 або приблизно 0,2:1, 0,15:1 або приблизно 0,15:1, 0,1:1 або приблизно 0,1:1 або менше 0,1:1, таке як про 0,005:1 або менше. У деяких варіантах здійснення співвідношення складає від 0,5:1 до 0,1:1, або від 0,5:1 до 0,2:1, або від 0,5:1 до 0,3:1. В інших варіантах здійснення співвідношення складає від 1:1 до 5:1, або від 1:1 до 10:1, або від 1:1 до 20:1. У деяких варіантах здійснення відбувається тільки часткова нейтралізація активності аптамеру. Наприклад, у деяких варіантах здійснення активність аптамеру нейтралізована на 90%, або менше 90%, наприклад, приблизно на 80%, приблизно на 70%, приблизно на 60%, приблизно на 50%, приблизно на 40%, приблизно на 30%, приблизно на 20%, приблизно на 10% або менше. Співвідношення антидоту до аптамеру можна або обчислити за допомогою порівняння ваги з вагою, або на основі молів. У приватних варіантах здійснення за даним винаходом організмом або суб'єктом, якому застосовують систему дозування, є людина. У певних варіантах здійснення організмом є людина, що має потребу в терапії антикоагулянтами. У певних варіантах здійснення організмом є людина, якій проводять операцію на судинах, наприклад, операція по АКШ. Короткий опис креслень На фіг. 1 зображена клітинна модель коагуляції. TF - тканинний фактор; vWF - фактор фон Віллебранда; II - протромбін; Ііа - тромбін; Va, VIIa, Vіііа, IXa, Xa, XIa - активовані форми факторів згортання V, VII, VIII, IX, X і XI. На фіг. 2 зображена протизсідна система REG1. Система складається з інгібітору FIXa 94948 12 RB006 і придатного для нього антидоту RB007. Впізнавання лікарського засобу антидотом відбувається як показано шляхом спарювання основ за правилом Уотсона-Кріка. RB006 є модифікованим РНК аптамером, що складається з залишків 2'фтор (верхній регістр), залишків 2'-O-метилу (нижній регістр) і одного залишку 2'-гідроксилу (підкреслений). RB006 кон’югований з 40-кДа поліетиленгліколевим носієм (P) через 6-вуглецевий амінолінкер (L), і захищений від деградації нуклеазами за допомогою інвертованого дезокситимідину на 3'-кінці (idT). RB007 (антидот) є 2’-O-метилмодифікованим РНК олігонуклеотидом. Фіг. 3 є діаграмою крива доза-відповідь АЧТЧ RB006 in vitro, на якій показано, що RB006 виявляє залежне від концентрації збільшення АЧТЧ нормальної об'єднаної людської плазми. Середнім значенням, у секундах, є середнє АЧТЧ. Дані підходили до чотирипараметричного логістичного рівняння, що дозволяє визначити IC50 за кривою. На фіг. 4 представлена діаграма протизсідного ефекту RB006 у плазмі пацієнтів. Протизсідну активність RB006 вимірювали в 4 пацієнтів: двох жінок і двох чоловіків. Зразки плазми були отримані з George King Biomedical (Overland Park, KS). Пацієнтів проскринували і підтвердили норму у відношенні рівнів факторів згортання. М/55 означає, що донором був чоловік, вік 55 років; F/49 означає, що донором була жінка, вік 49 років. Як реактив АЧТЧ використовували MDA Platelin L (Biomeriux), що відносно більш чутливі до рівнів FIX, ніж реактив АЧТЧ, використовуваний у дослідженні, що представлене на фіг. 3. На фіг. 5 представлений графік, що показує нейтралізуючу активність лікарського засобу антидотом RB007. Невеликий молярний надлишок антидоту RB007 відносно аптамеру RB006 цілком нейтралізує протизсідну активність RB006 протягом 10 хвилин. Показані дані представлені як середнє значення ± стандартна помилка середньої для трьох незалежних вимірювань. Молярне співвідношення основане на молях олігонуклеотидного аптамеру й антидоту (AD). На фіг. 6 представлений графік повторного введення аптамеру RB006 після нейтралізації антидоту попередньою дозою лікарського засобу. Свиням вводили 2,5 мг/кг аптамеру RB006, і через 15 хвилин, вводили 3 мг/кг антидоти RB007 (n=2) для нейтралізації вказаної вихідної дози. Далі, через 30 хвилин після введення антидоту RB007 (після 45 хвилин вихідного введення аптамеру), свиням повторно вводили 2,5 мг/кг аптамеру RB006. Зміну часу згортання вимірювали за (A) ЧАЗ (O) в аналізах цільної крові; або за (B) АЧТЧ (O) в аналізах згортання плазми. Показані дані представлені як середнє значення ± діапазон для повторних вимірювань для кожної тварини. Жирна лінія (у A і B) є простою лінією інтерполяції експериментальних точок. На фіг. 7 представлена діаграма RB006 in vitro кривої доза-відповідь АЧТЧ у плазмі яванських макак і людей. RB006 виявляє дозозалежну пролонгацію АЧТЧ у плазмі від мавп, що дуже схожа на таку, що спостерігається в людській плазмі. Експерименти виконували, використовуючи реак 13 тив для АЧТЧ такої ж марки, APTT-LS, як використовували для аналізу зразків плазми в неклінічних дослідженнях токсичності, що виконували на мавпах (REG1-TOX001 і REG1-TOX003). Тому отримані дані служать підставою для інтерпретації результатів АЧТЧ REG1-TOX001 і REG1-TOX003, представлених у розділах 8.4. Відповідно до виробника (Pacific Homeostasis, Middletown, VA), вказаний реактив визначає АЧТЧ ~87,3 секунди в зразках плазми людей, що містять 50%). Отже, за аналогією з аналізом АЧТЧ, величина подовження ЧАЗ, імовірно, буде скромна в порівнянні з подовженням, що спостерігається з нефракціонованим гепарином. Нарешті, у відповідь на інгібування FIXa аналіз, імовірно, досягне насичення. Така подібність в реакціях АЧТЧ і ЧАЗ була продемонстрована на мавпах, яких лікували різними дозами RB006 у неклінічних дослідженнях токсичності. Ефекти протизсідної системи REG1 на показники зсілості Попередні дані показують, що анти-FIXa аптамери не подовжують ПЧ як in vitro, так і після внутрішньовенного введення тварині (Rusconi та ін., 2004, Nat Biotechnol. 22 (11):1423-8; Rusconi та ін., 2002, Nature 419 (6902):90-4; Dyke, 2006, Circulation.114 (23):2490-7). Як показано на фіг. 3, RB006 виявляє дозозалежне збільшення АЧТЧ в об'єднаній нормальній людській плазмі in vitro. Отримані дані вказують на те, що для RB006 АЧТЧ крива доза-відповідь є найчутливішою від 0 до 3050 мкг/мл, і потім виходить на плато. Вказані особливості, включаючи фазу підвищення і фазу плато АЧТЧ кривої дози-відповіді узгоджуються в плазмах від усіх видів, в яких RB006 або попередні анти-FIX аптамери виявляють перехресну реактивність, включаючи людину, свиню, мишу і мавпу (Rusconi та ін., 2004, Nat Biotechnol. 22 (11):14238). Максимальне значення АЧТЧ, досягнуте у відповідь на обробку плазми in vitro анти-FIXa аптамером, залежить від використовуваного АЧТЧ реагенту і виду. Важливо, однак, що вказаний максимум АЧТЧ узгоджується з повним або майже повним інгібуванням активності FIXa. Це підтверджується тим фактом, що максимальне значення АЧТЧ у відповідь на анти-FIXa аптамер еквівалентне АЧТЧ у людській плазмі, що містить рівень FIX
ДивитисяДодаткова інформація
Назва патенту англійськоюAdministration of the reg1 anticoagulation system
Автори англійськоюRusconi Christopher P., Tonkens Ross M.
Назва патенту російськоюВведение противосвертывающей системы reg1
Автори російськоюРаскони Кристофер П., Тонкенс Росс М.
МПК / Мітки
МПК: A61K 31/7088, A61P 7/02
Мітки: системі, введення, протизсідної
Код посилання
<a href="https://ua.patents.su/37-94948-vvedennya-protizsidno-sistemi-reg1.html" target="_blank" rel="follow" title="База патентів України">Введення протизсідної системи reg1</a>