Стирилпіридинові похідні і їх застосування для зв’язування і візуалізації амілоїдних бляшок
Формула / Реферат
1. Сполука формули І
 І
І
або її фармацевтично прийнятна сіль, де у зазначеній формулі
n дорівнює одиниці;
щонайменше один, але не більше трьох з А1, А2, А3, А4 і А5 являє собою Ν, інші являють собою -СН або -CR2, за необхідності;
R1 являє собою
-(CH2)pNRaRb, де Ra і Rb являють собою, незалежно, водень або С1-4-алкіл, і p дорівнює 0;
R2 являє собою
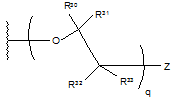 ,
,
де q дорівнює цілому числу від 1 до 5; кожний з R30, R31, R32 і R33 являє собою водень; Ζ являє собою галоген, галогензаміщений бензоїлокси, галогензаміщений бензилокси, галогензаміщений феніл(С1-4)алкіл, галогензаміщений арилокси або галогензаміщений С6-10-арил;
R7 і R8 в кожному випадку являють собою водень;
і де галоген, в кожному випадку, вибирають з І, 123І, 125І, 131І, Br, 76Br, 77Br, F або 18F.
2. Сполука за п. 1, яка має формулу
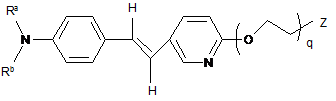 .
.
3. Сполука за п. 1, яка має формулу
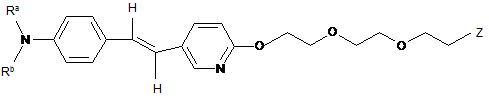 ,
,
де Ra і Rb являють собою, незалежно, водень або С1-4-алкіл, і Ζ являє собою І, 123I, 125I, 131I, Br, 76Br, 77Br, F aбo 18F.
4. Сполука за п. 1, яка має формулу
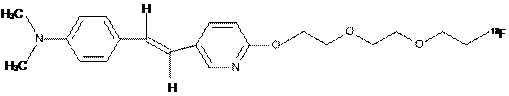 .
.
5. Сполука за п. 1, яка має формулу
 .
.
6. Фармацевтична композиція, яка містить як активне начало сполуку за будь-яким з пп. 1-5.
7. Діагностична композиція для візуалізації амілоїдних відкладень, що містить мічену радіоактивним ізотопом сполуку за будь-яким з пп. 1-5.
8. Спосіб візуалізації амілоїдних відкладень, що включає
a) введення ссавцю детектованої кількості діагностичної композиції за п. 7;
b) надання достатнього часу для асоціації міченої сполуки з амілоїдними відкладеннями; і
c) детектування міченої сполуки, асоційованої з одним або декількома амілоїдними відкладеннями.
9. Спосіб інгібування агрегації амілоїдних бляшок у ссавця, що включає введення композиції за п. 6 у кількості, ефективній для інгібування агрегації амілоїдних бляшок.
Текст
Реферат: Винахід стосується способу візуалізації амілоїдних відкладень і стирилпіридинів формули І, і способів одержання стирилпіридинів, мічених радіоактивними ізотопами, застосовних при візуалізації амілоїдних відкладень. UA 97802 C2 (12) UA 97802 C2 Даний винахід також стосується сполук і способів одержання сполук для інгібування агрегації амілоїдних білків, при якій утворюються амілоїдні відкладення, і способу доставки лікувального засобу до амілоїдних відкладень. R7 n R1 R8 R2 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується нових стирилпіридинів, їх застосування при діагностичній візуалізації та інгібуванні агрегації амілоїду-β і способів одержання зазначених сполук. Хвороба Альцгеймера (AD) являє собою прогресуючий нейродегенеративний розлад, що характеризується зниженням пізнавальних здібностей, необоротною втратою пам'яті, дезорієнтацією і погіршенням мови. Посмертне дослідження зрізів головного мозку з AD показує численні старечі бляшки (SP), які складаються з амілоїдних-β (Αβ) пептидів, і численні нейрофібрилярні сплетення (NFT), утворені філаментами високофосфорилованих тау-білків (останній огляд і додаткові посилання див. у Ginsberg S.D. et al., '"Molecular Pathology of Alzheimer's Disease and Related Disorders", у Cerebral Cortex: Neurodegenerative and Age-related Changes in Structure and Function of Cerebral Cortex, Kluwer Academic/Plenum, NY (1999), pp. 603654; Vogtlsberg-Ragaglia V. et al., "Cell Biology of Tau and Cytoskeletal Pathology in Alzheimer's Disease", Alzheimer's Disease, Lippincot, Williams & Wilkins, Philadelphia, PA (1999), pp. 359-372), Амілоїдоз є станом, що характеризується накопиченням різних нерозчинних фібрилярних білків у тканинах пацієнта. Амілоїдне відкладення утворюється шляхом агрегації амілоїдних білків з подальшим додатковим об'єднанням агрегатів і/або амілоїдних білків. Утворення і накопичення агрегатів амілоїдних-β (Αβ) пептидів у головному мозку є критичними факторами у розвитку і прогресуванні AD. Крім ролі амілоїдних відкладень при хворобі Альцгеймера показана наявність амілоїдних відкладень при таких захворюваннях, як середземноморська гарячка, синдром Muckfe-Wells, ідіопатична мієлома, амілоїдна поліневропатія, амілоїдна кардіоміопатія, системний сенільний амілоїдоз, спадкова внутрішньомозкова кровотеча з амілоїдозом, синдром Дауна, свербець, хвороба Крейтцфельда-Якоба, куру, синдром Gerstamnn-Straussler-Scheinker, медулярна карцинома щитовидної залози, Isolated atrial amyloid, β2-амілоїд мікроглобуліну у пацієнтів при діалізі, міозит тілець включення, відкладення β2-амілоїду при м'язовій атрофії та інсулінома острівців Лангерганса при діабеті типу її. Фібрилярні агрегати амілоїдних пептидів Αβ1-40 і Αβ1-42 є основними метаболічними пептидами, утвореними амілоїдним білком-попередником, виявленими у старечих бляшках і амілоїдних відкладеннях судин головного мозку у хворих AD (Xia W. et al., J. Proc. Natl. Acad. Sci, U.S.A., 97: 9299-9304 (2000)). Попередження і припинення утворення бляшок Αβ намічені як спосіб лікування такого захворювання (Selkoe D.J., JAMA, 283· 1615-1617 (2000); Wolfe M.S. et al., J Med. Chem., 41: 6-9 (1998); Skovronsky D.M. and Lee V.M., Trends Pharmacol. Sci., 21: 161163(2000)). Сімейна AD (FAD) викликана декількома мутаціями у білку-попереднику А (АРР), генах пресеніліну 1 (PS1) і пресеніліну 2 (PS2) (Ginsberg S.D. et al., "Molecular Pathology of Alzheimer's Disease and Related Disorders", у Cerebral Cortex: Neurodegenerative and Age-related Changes in Structure and Function of Cerebral Cortex, Kluwer Academic/Plenum, NY (1999). pp. 603-654; Vogelsberg-Ragaglia V. et al., "Cell Biology of Tau and Cytoskeletal Pathology in Alzheimer's Disease", Alzheimer's Disease, Lippincot, Williams & Wilkins, Philadelphia, PA (1999), pp. 359-372). Хоча точні механізми, що лежать в основі AD, цілком не з'ясовані, усі патогенні мутації FAD, досліджені дотепер, підвищують продукування більш амілоїдогенної форми пептиду Αβ довжиною у 42-43 амінокислоти. Таким чином, щонайменше, при FAD, представляється, що розрегулювання продукування Αβ є достатнім для індукування каскаду подій, що ведуть до нейродегенерації. Дійсно, гіпотеза амілоїдного каскаду передбачає, що утворення агрегатів позаклітинного фібрилярного Αβ у головному мозку може бути центральною подією у патогенезі AD (Selkoe D.J, "Biology β-amyloid Precursor Protein and the Mechanism of Alzheimer's Disease", Alzheimer's Disease, Lippincot. Williams & Wilkins, Philadelphia, PA (1999), pp. 293-310; Selkoe D.J, J. Am. Med. Assoc, 283: 1615-1617 (2000); Naslund J. et al., J. Am. Med. Assoc, 283: 1571-1577 (2000); Golde Т.Е. et al., Biochimica et Biophysica Acta, 1502: 172-187(2000)). У наш час різні підходи у спробі інгібувати утворення і знизити накопичення фібрилярного Αβ у головному мозку оцінюються як можливі методи лікування AD (Skovronsky D.M. and Lee V.M., Trends Pharmacol. Sci., 21: 161-163 (2000); Vassar R. et al., Science, 286: 735-741 (1999); Wolfe M.S. et al., J. Med. Chem.. 41: 6-9 (1998); Moore C.L. et al., J. Med. Chem., 43: 3434-3442 (2000); Findies M.A., Biochimica et Biophysica Acta, 1502: 76-84 (2000); Kunner P., Bohrmann et al., J. Biol. Chem., 273: 1673-1678 (2000)). Тому існує зацікавленість у розробці лігандів, які специфічно зв'язують агрегати фібрилярного Αβ. Оскільки позаклітинні SP є доступними мішенями, такі нові ліганди можна було б використовувати як діагностичні інструменти in vivo і зонди для візуалізації прогресуючого відкладення Αβ у дослідженнях амілоїдогенезу AD в організмі пацієнтів. У зв'язку з цим повідомляється про деякі підходи /для розробки специфічних лігандів до агрегатів фібрилярного Αβ (Ashburn Т.Т. et al., Chem. Biol., 3: 351-358 (1996); Han (3. et al., J. Am. 1 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Chem. Soc, 118: 4506-4507 (1996); Klunk W.E. et al., Biol. Psychiatry, 35: 627 (1994); Klunk W.E. et al., Neurobiol Aging, 16: 541-548 (1995); Kiunk W.E. et al., Society for Neuroscience Abstract, 23: 1638 (1997); Mathis С. A. et al., Proc. Xllth Intl. Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997); Lorenzo A. and Yankner B.A., Proc. Natl. Acad. Асі. U.S.A., 91. 12243-12247 (1994); Zhen W et. al., J. Med. Chem., 42:2805-2815 (1999)). Найбільш привабливий підхід базується на висококон'югованому хризаміні-G (CG) і коню червоному (GR), і останній використовують для флуоресцентного забарвлювання SP і NFT у посмертних зрізах головного мозку з AD (Ashburn T.T. et al., Chern Biol., 3: 351-358 (1996); Klunk W.E. et al., J. Histochem. Cytochem., 37: 1273-1281 (1980)). Константи інгібування (Kі) у випадку зв'язування з агрегатами фібрилярного Αβ CR, CG i 3'-бром- і 3'-йодпохідних CG складають 2800, 370, 300 і 250 нМ, відповідно (Mathis С.А. et al., Proc. Xllth Intl. Symp. Radiopharm. Chem., Uppsala. Sweden: 94-95 (1997)). Показано, що такі сполуки селективно зв'язуються з агрегатами пептиду Αβ (1-40) in vitro, а також з відкладеннями фібрилярного Αβ у зрізах головного мозку з AD (Mathis С.A et al., Proc. Xllth Intl. Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997)). Існує декілька можливостей візуалізації агрегатів Αβ у головному мозку. Метод візуалізації буде поліпшувати діагностику шляхом ідентифікації потенційних хворих з надлишковими бляшками Αβ у головному мозку; отже, у них можливий розвиток хвороби Альцгеймера. Він також буде застосовний для контролю за розвитком хвороби. Коли лікування лікарськими засобами проти бляшок стане доступним, візуалізація бляшок Αβ у головному мозку зможе забезпечити важливий інструмент для контролю за лікуванням. Таким чином, йде напружений пошук простого неінвазивного способу детектування і кількісного визначення амілоїдних відкладень у пацієнта. У наш час детектування амілоїдних відкладень включає гістологічний аналіз матеріалів біопсії або аутопсії. Обидва способи мають недоліки. Наприклад, аутопсію можна використовувати тільки для посмертного діагнозу. Безпосередня візуалізація амілоїдних відкладень in vivo ускладнена, оскільки відкладення можуть мати багато фізичних властивостей (наприклад, щільність і вміст води) таких же, як у здорових тканин. Спроби візуалізації амілоїдних відкладень з використанням ядерного магнітного резонансу (MRI) і допоміжної комп'ютерної томографії (CAT) не виправдали надій і дозволяли виявляти амілоїдні відкладення тільки при деяких сприятливих умовах. Крім того, зусилля стосовно мічення амілоїдних відкладень антитілами, сироватковим амілоїдиим Рбілком або іншими молекулами-зондами забезпечували деяку селективність на периферії тканин, але давали погану візуалізацію внутрішніх областей тканин. Потенційні ліганди для детектування агрегатів Αβ у живому головному мозку повинні долати інтактний гематоенцефалічний бар'єр. Таким чином, поглинання у головному мозку можна поліпшити, використовуючи ліганди з молекулами відносно невеликого розміру (у порівнянні з конго червоним) і підвищеною ліпофільністю. Звичайно як барвники для забарвлювання агрегатів Αβ у головному мозку використовують висококон'юговані тіофлавіни (S і Т) (Elhaddaoui A. et al., Biospectroscopy, 1: 351-356 (1995)). 18 Є повідомлення про високоліпофільний радіоактивний індикатор [ F]FDDNP для зв'язування як зі сплетеннями (що складаються, головним чином, з гіперфосфорилованого таубілка), так і з бляшками (що містять агрегати білка Αβ) (Shoghi-Jadid K. et al., Am. J. Geriatr. Psychiatry, 2002, 10: 24-35). Повідомляється, що, з використанням позитронної емісійної томографії (PET), таким радіоактивним індикатором специфічно мітили відкладення бляшок і сплетень у дев'яти хворих AD і семи суб'єктів для порівняння (Nordberg Α., Lancet Neurol., 2004, 3: 519-27). З використанням зазначеної нової процедури фармакокінетичного аналізу показані відмінності у відносному часі перебування у ділянці головного мозку, що представляє інтерес, проти моста у хворих AD і суб'єктів для порівняння. Відносний час перебування істотно вищий у хворих AD. Це додатково ускладнюється результатом, що викликає інтерес, що FDDNP конкурує з NSAID за зв'язування з фібрилами Αβ in vitro і бляшками Αβ ex vivo (Agdeppa E.D. et al., 2001; Agdeppa E.D. et al., Neuroscience, 2003, 117:723-30). Нещодавно з'явилися повідомлення про візуалізацію β-амілоїду у головному мозку хворих 11 11 AD з використанням похідного беюотіазоланіліну [ С]6-ОН-ВТА-1 (також називаного [ С]РІВ) (Mathis С.A. et al., Curr. Pharm. Des., 2004, 10: 1469-92; Mathis C.A. et al., Arch. Neurol., 2005, 67: 18 11 196-200). На противагу тому, що спостерігали у випадку [ F]FDDNP, [ С]6-ОН-ВТА-1 зв'язується специфічно з фібрйлярним Αβ in vivo. Хворі з діагнозом слабкої AD показали помітне 11 утримування [ С]6-ОН-ВТА-1 у корі головного мозку, що, як відомо, при AD містить велику 11 кількість амілоїдних відкладень. У груш хворих AD утримування [ C]6-OH-BTA-1 підвищене, головним чином, у лобовій частині кори головного мозку. Велике зростання також спостерігали у тім'яній, скроневій і потиличній частинах кори головного мозку і у смугастому тілі. Утримування 11 [ С]6-ОН-ВТА-1 еквівалентне у хворих AD і суб'єктів для порівняння у ділянках, які, як відомо, 2 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 відносно не піддаються відкладенню амілоїду (таких як підкіркова біла речовина, міст і мозочок). 11 11 Нещодавно досліджений інший зонд, що мітить С бляшки Αβ-похідне стильбену [ C]SB-13. 11 Зв'язування in vitro з використанням [ C]SB-13 припускає, що сполука демонструє чудову афінність зв'язування, і зв'язування можна чітко виміряти у сірій речовині кори головного мозку у випадках AD, але не у білій речовині (Kung M.-P. et al., Brain Res., 2004, 1025: 89-105). Специфічне зв'язування у гомогенатах кортикальних тканин контрольного головного мозку було 3 дуже низьким. Величини Kd [ H]SB-13 у кортикальних гомогенатах AD складали 2,4±0,2 нМ. Спостерігали високу зв'язувальну здатність і порівнянні значення (14-45 пмоль/мг білка) (там 11 же). Як очікувалося, у хворих AD [ C]SB-13 відображав високе накопичення у лобовій частині кори головного мозку (можливо, в області, що містить бляшки Αβ високої щільності) у хворих зі слабкою і помірною AD, але не у контрольних суб'єктів відповідного віку (Verhoeff N.P. et al., Am. J. Geriar. Psychiatry, 2004, 12: 584-95). Було б корисно мати неінвазивний метод візуалізації і кількісного визначення амілоїдних відкладень у пацієнта. Крім того, було б корисно мати сполуки, що інгібують агрегацію амілоїдних білків з утворенням амілоїдних осаджень і спосіб визначення здатності сполуки інгібувати агрегацію амілоїдних білків. Даний винахід стосується сполук формул І, Іа, II і III. Даний винахід також стосується діагностичних композицій, що містять мічену ізотопом сполуку формули І, Іа, II і III і фармацевтично прийнятний носій або розріджувач. Винахід також стосується способу візуалізації амілоїдних відкладень, що включає введення пацієнту кількості, що детектується, міченої ізотопом сполуки формули І, Іа, ll і lll або її фармацевтично прийнятної солі, ефіру, аміду або проліків Даний винахід також стосується способу інгібування агрегації амілоїдних білків, ідо включає введення ссавцю такої, що інгібує амілоїд, кількості сполуки формули І, Іа, II і III або її фармацевтично прийнятної солі, ефіру, аміду або проліків. Інший аспект даного винаходу стосується способів і проміжних сполук, застосовних для синтезу сполук, що інгібують і візуалізують амілоїд, формул l, Іа, II і III, описаних у даному описі. Фіг. 1 відображає плівку з результатами візуалізації сполукою за даним винаходом. Фіг. 2 відображає поглинання головним мозком і кістковою тканиною стирилпіридину 2 у порівнянні зі стильбеновим аналогом. Фіг. 3 відображає ауторадіографію на плівці, де стирилпіридин 2 порівнюється зі стильбеновим аналогом. Фіг. 4 відображає криву насичення стирилпіридину 2 у гомогенатах головного мозку з AD. Фіг. 5 відображає деякі сполуки за даним винаходом і відповідні їм дані зі зв'язування. Фіг. 6 відображає ауторадіографію in vitro ряду зрізів головного мозку. Фіг. 7 відображає стійкість in vitro мічених F-18 індикаторів до змішаних мікросомних фракцій печінки людини. Індикатори у PBS без мікросомних фракцій служать як контроль. Величини (% вихідної сполуки, що не змінилася) є середніми з двох повторень. 18 Фіг. 8 відображає специфічне зв'язування [ F]2 зі змішаними гомогенатами тканин головного мозку з AD і контролю. Сіра і біла речовини висічені з кортикальних ділянок. Високоспецифічне зв'язування виявлене тільки у сірій речовині. Наведені величини є середніми ± SEM з шести вимірів. Відносно слабке зв'язування спостерігають у гомогенатах білої речовини. Навпаки, гомогенати контрольного головного мозку, і сірої і білої речовини, показують істотно більш 18 низьке специфічне зв'язування [ F]2. 18 Фіг. 9 відображає (у верхній частині) профіль ВЕРХ сполуки [ F]2 і (у нижній частині) УФзапис нерадіоактивної стандартної сполуки 2 (350 нм). Умови ВЕРХ: серія 1100 Agilent; колонка С-18 Phenomenex Gemini, 5 мкм, 250 × 4,6 мм, буфер СН3СN/форміат амонію (1 мМ), 8/2, об./об., 1 мл/хв. Кт 6,34 хв. (радіоактивного), 6,05 хв. (УФ). Інтервал у часі утримування має місце через конфігурацію детектора. Винахід стосується сполуки формули l l 55 або її фармацевтично прийнятної солі, де у зазначеній формулі n дорівнює цілому числу від одного до шести; щонайменше один, але не більше трьох, з А 1, А2, А3, А4 і A5 являє собою Ν, 2 1 інші являють собою -СН або -CR , за необхідності; R вибирають з групи, що складається з a b a b a) -(CH2)pNR R , де R і R являють собою, незалежно, водень, С1-4-алкіл, гідроксі(С1-4)алкіл або галоген(С1-4)алкіл, і p дорівнює цілому числу від 0 до 5; 3 UA 97802 C2 b) гідрокси; c) С1-4-алкокси; d) пдрокс1(С1-4)алкiлу; e) галогену; f) ціано; g) водню; h) нітро; і) (С1-C4)алкілу; j) галоген(С1-C4)алкілу; k) формілу; l) -№іСО(С1-4)алкілу і m) -ОСО(С1-4)алкілу; 2 R вибирають з групи, що складається з 5 10 i) 15 20 де q дорівнює цілому числу від 1 до 10, Ζ вибирають з групи, що складається з галогену, галогензаміщеного бензолїлокси, галогензаміщеною бензилокси, галогензаміщеного феніл(С14)алкілу, галогензаміщеного арилокси і галогензаміщеного С 6-10-арилу, або Ζ також може являти 30 31 32 33 собою гідрокси; і R , R , R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, С1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу; або Ζ являє собою гідрокси; і') x y де q дорівнює цілому числу від 1 до 10, R і R являють собою водень, гідрокси або С1-430 31 32 33 алкіл; t дорівнює 0, 1, 2 або 3; і Z, R , R , R і R мають значення, зазначені вище; ii) 25 30 де Υ вибирають з групи, що складається з галогену, галогензаміщеного бензоїлокси, галогензаміщеного феніл(С1-4)алкілу, галогензаміщеного арилокси і галогензаміщеного С 6-10арилу; U вибирають з групи, що складається з водню, гідрокси, галогену, галогензаміщеного бензоїлокси, галогензаміщеного феніл(С1-4)алкілу, галогензаміщеного арилокси і 34 35 36 37 38 39 40 галогензаміщеного С6-10-арилу: і R , R . R , R , R , R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, галогену, гідрокси, С 1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу; іі') x y 34 де R і R являють собою водень, гідрокси або C1-4-алкіл: t дорівнює 0, 1, 2 або 3; і Y, U, R , 36 37 38 39 40 R , R , R . R , R і R мають значення, зазначені вище; ііі) NR'R", де, щонайменше, один з R' і R" являє собою (СН2)dХ, де X являє собою галоген, 18 переважно, F або F, і d дорівнює цілому числу від 1 до 4; інший з R' і R" вибирають з групи, що складається з водню, С1-4-алкілу, галоген(С1-4)алкілу і гідроксі(С1-4)алкілу; iv) NR'R"-(С1-4)aлкілу, де, щонайменше, один з R' і R" являє собою (СН2)dX, де X являє собою 18 галоген, переважно, F або F, і d дорівнює цілому числу від 1 до 4; інший з R' і R" вибирають з групи, що складається з водню, С1-4-алкілу, галоген(С1-4)алкілу і гідроксі(С1-4)алкілу; ν) галоген(С1-4)алкілу; і vi) простої ефірної групи (R-O-R), що має структуру [галоген(С1-4)алкіл-О-(С1-4)алкіл]-; і 35 35 40 4 UA 97802 C2 7 5 10 15 20 25 30 35 40 45 8 R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу. Переважні сполуки включають сполуки, в яких галоген при одній або декількох появах у структурі являє собою радіоізотоп галогену. Також переважними є сполуки, в яких галоген 123 125 131 76 77 18 вибирають з групи, що складається з І, І, І, І, Br, Br, Br, F або F. Особливо 18 переважними є сполуки, що містять F. 123 Сполуки, що містять І, також є особливо переважними. 1 Застосовні значення R перераховані вище. Переважними значеннями є гідрокси або a b a b NR R (CH2)p-, де p дорівнює цілому числу від 0 до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (СH2)dХ, де X являє собою галоген, і d дорівнює цілому числу від 1 до 4. Застосовні значення p включають цілі числа від 0 до 5. Переважно, p дорівнює 0, 1 або 2. 1 a b 1 Найбільш переважно, p дорівнює 0, гак що R являє собою NR R . У переважних втіленнях R знаходиться або у мета-, або у пара-положенні відносно відповідного містка. Переважним 1 a b a b значенням R є NR R , де R і R являють собою, незалежно, водень або С1-4-алкіл. У такому a b втіленні переважно, щоб С1-4-алкіл являв собою метил. Переважно, один з R і R являє собою a водень, а інший являє собою С1-4-алкіл, такий як метил. Найбільш переважно, коли як R , так і b 1 R являє собою метил. Іншим переважним значенням R є гідрокси. Також переважними є будь1 які пролікарські групи, які після введення дають переважне значення R . Такі пролікарські групи добре відомі у техніці. Застосовні значення n включають цілі числа від 1 до 6. Переважно, величина n складає від 1 до 4. Найбільш переважно, величина n складає від 1 до 3. Особливо переважно, коли n дорівнює одиниці. 7 8 Застосовні значення R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, аміно, метиламіно, диметиламінo C1-4-алкокси, C1-4-алкілу і 7 8 гідрокси(C1-4-алкілу). Значення n визначає число груп R і/або R , що є присутніми у сполуці. 7 8 Якщо y визначеній сполуці вони є присутніми декілька разів, у кожному випадку значення R і R 7 8 7 може відрізнятися від будь-якого іншого значення R і R . У переважних втіленнях кожний з R і 8 R являє собою водень у кожному випадку. 2 Застосовні значення R включають субструктури і, і', іі, іі', ііі, iv, v і νi, відображені вище. У 2 переважних втіленнях формули І R знаходиться або у мета-, або у пара-положенні відносно 2 відповідного містка. Переважно, R являє собою субструктуру і або іі. Також переважними є субструктури v і іі'. У таких втіленнях застосовні значення q включають цілі числа від одного до 2 десяти. Переважно, у сполуці, де R являє собою і або і', q дорівнює цілому числу від 1 до 5. Найбільш переважно, q дорівнює 1-4, особливо, 3 або 4. У субструктурі і або і' застосовні 30 31 32 33 значення R , R , R і R включають, незалежно, водень, гідрокси, С1-4-алкокси, С1-4-алкіл і 30 31 гідроксі(С1-4)алкіл. Переважні сполуки включають сполуки, в яких один або декілька з R , R , 32 33 R і R являють собою водень. Більш переважні сполуки включають сполуки, в яких кожний з 30 31 32 33 R , R , R і R являє собою водень. 34 35 36 37 38 39 40 У субструктурі іі або іі' застосовні значення Y, U і R , R , R , R , R , R і R зазначені вище. Переважні сполуки включають сполуки, в яких U являє собою гідрокси. Застосовні сполуки включають такі сполуки, в яких, щонайменше, один, але не більше 2 трьох, з А1, А2, А3, А4 і А5 являє собою N. і інші являють собою -СН або -CR , за необхідності. Більш переважно, щоб N займав положення А4. Переважні сполуки формули І включають такі сполуки, в яких А 4 являє собою N, що мають формулу a b де R і R вибирають, незалежно, з водню або С1-4-алкілу, Ζ має значення, зазначені вище, і q дорівнює цілому числу від 1 до 5. Приклади переважних сполук включають 5 UA 97802 C2 де q дорівнює цілому числу від 1 до 4; такі як 2 Інші переважні сполуки формули І, де R являє собою іі, включають 5 В іншому аспекті даний винахід стосується сполук формули І. що мають структуру l 10 15 або їх фармацевтично прийнятних солей, де у зазначеній формулі, щонайменше, один, але 2 не більше трьох, з А1, А2, А3, А4 і А5 являє собою N. інші являють собою -СН або -CR , за 1 необхідності; n дорівнює, цілому числу віл і до 6; R включає всі застосовні значення, зазначені a b a b вище, переважно, гідрокси або NR R (CH2)p-, де р дорівнює цілому числу від 0 до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (СН2)dХ, де X являє собою галоген, і d 2 дорівнює цілому числу від 1 до 6; R вибирають з трупи, що складається з i) де q дорівнює цілому числу від 1 до 10; Ζ являє собою -Ch: i') 20 x y де q дорівнює цілому числу від 1 до 10; R і R являють собою водень, гідрокси або С1-430 31 32 33 алкіл; t дорівнює 0, 1, 2 або 3; і Z, R , R , R і R мають значення, зазначені вище; і Ζ являє собою -Ch; 6 UA 97802 C2 ii) 30 31 де Ζ являє собою -Ch; R , R , R 32 іR 33 мають значення, зазначені вище; і iii) 5 де Υ являє собою -Ch; U вибирають з групи, що складається з водню, гідрокси, галогену, галогензаміщеного бензоїлокси, галогензаміщеного феніл(С1-4)алкілу, галогензаміщеного 34 33 36 37 38 39 40 арилокси і галогензаміщеного С6-10-арилу; і R , R , R , R , R , R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, галогену, гідрокси, С 1-4-алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; iii') 10 15 20 x y 34 де R і R являють собою водень, гідрокси або С1-4-алкіл; t дорівнює 0, 1, 2 або 3; і Y, U, R , 36 37 38 39 40 R , R , R , R , R і R мають значення, зазначені вище; iv) -(CH2)w-O-Ch, де vv дорівнює цілому числу від 1 до 10; v) -Ch; і vi) -(CH2)w-Ch, де w дорівнює цілому числу від 1 до 10; де група "-Ch" являє собою хелатуючий ліганд, здатний до комплексоутворення з металом з утворенням металохелату. Багато лігандів відомі у техніці і підходять для використання як груп, що мітять, для сполук за даним винаходом. Фахівцям у даній галузі техніки буде зрозуміло, що такі ліганди забезпечують шлях до мічення сполук, і винахід не обмежується визначеними лігандами, багато з яких с взаємозамінними. Переважно, такий ліганд являє собою три- або тетрадентатний ліганд, такий як N3, N2S, NS2, N4 і ліганди типу N2S2, представлені, але не обмежувані цим, наведеною нижче формулою 35 P 9 10 11 12 13 14 15 де R являє собою водень або сульфгідрильну захисну групу, і R , R , R , R , R , R , R , 43 44 R , R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу. У комплексі з металом, таким як 99m-Te, -Ch має формулу 16 25 30 Крім того, з тетрадентатним лігандом може бути утворений комплекс радіоізотопу ренію, а Р не технецію. Коли хелатуюча група не знаходиться у комплексі з металом, обидва R являють собою водень або можуть являти собою будь-яку з різних захисних груп, доступних для атома сірки, у тому числі, метоксиметил, метоксіетоксиметил, п-метоксибензоїл або бензил. Захисні групи для сірки описані докладно у Greene T.W. and Wuts P.G.M., Protective Groups in Organic 7 UA 97802 C2 Р nd 5 10 15 20 25 30 35 40 45 Synthesis, 2 Edition, John Wiley and Sons, Inc., New York (1991). Захисні групи R можна видалити відповідними способами, добре відомими у техніці органічного синтезу, такими як з використанням трифтороцтової кислота, хлориду ртуті(2) або натрію у рідкому аміаку. У випадку Р лабільних груп кислоти Льюїса, включаючи ацетамідометил і бензамідометил, R може залишатися незмінним. Мічення ліганду технецієм у такому випадку буде, відщеплювати захисну групу, приводячи захищений еквівалент діаміндитіолу у незахищену форму. Далі, відомі деякі ліганди загального типу N2S2, які можуть використовуватися як взаємозамінні без зміни обсягу винаходу; і 7 8 R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу. 1 a b Переважними значеннями R є гідрокси або NR R (СН2)p-, де p дорівнює цілому числу від 0 a b до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (CH2)dX, де X являє собою галоген, і d дорівнює цілому числу від 1 до 4. Застосовні значення p включають цілі числа від 0 1 до 5. Переважно, p дорівнює 0, 1 або 2. Найбільш переважно, p дорівнює 0, так що R являє a b 1 собою NR R . У переважних втіленнях R знаходиться або у мета-, або у пара-положенні 1 a b a b відносно відповідного містка. Переважним значенням R є NR R , де R і R являють собою, незалежно, водень або С1-4-алкіл. У такому втіленні переважно, щоб С1-4-алкіл являв собою a b метил. Переважно, один з R і R являє собою водень, а інший являє собою С1-4-алкіл, такий як a b 1 метил, або як R , так і R являє собою метил. Іншим переважним значенням R є гідрокси. 1 Також переважними для R є будь-які пролікарські групи, які після введення в організм метаболізують або розкладаються до переважних значень R , зазначених вище. Такі групи для одержання проліків відомі у техніці, і групи, здатні утворювати проліки, добре відомі фахівцям у даній галузі техніки. Застосовні значення n включають цілі числа від 1 до 6. Переважно, величина n складає від 1 до 4. Найбільш переважно, величина n складає від 1 до 3. Особливо переважно, коли n дорівнює одиниці. 7 8 Застосовні значення R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4-алкокси, С1-4-алкілу і 7 8 гідроксі(С1-4)алкілу. Значення n визначає число груп R і/або R , що є присутніми у сполуці. Якщо 7 8 у визначеній сполуці вони є присутніми декілька разів, у кожному випадку значення R і R може 7 8 7 8 відрізнятися від будь-якого іншого значення R і R . У переважних втіленнях кожний з R і R являє собою водень у кожному випадку. 2 Застосовні значення R включають субструктури і, і', іі, ііі і ііі', відображені вище. У 2 переважних втіленнях формули І R знаходиться або у мета-, або у пара-положенні відносно 2 відповідного містка. Переважно, у сполуці, де R являє собою і або і', q дорівнює цілому числу від 2 до 5. Найбільш переважно, q дорівнює 3 або 4. У субструктурі і або і' застосовні значення 30 31 32 33 R , R , R і R включають, незалежно, водень, гідрокси, С1-4-алкокси, С1-4-алкіл і гідроксі(С130 31 32 33 і R 4)алкіл. Переважні сполуки включають сполуки, в яких один або декілька з R , R , R 30 31 являють собою водень. Більш переважні сполуки включають сполуки, в яких кожний з R , R , 32 33 R і R являє собою водень. 34 35 36 37 38 39 40 У субструктурі ііі або ііі' застосовні значення U і R , R . R , R , R , R i R є значеннями, зазначеними вище. Переважні сполуки включають сполуки, в яких U являє собою гідрокси. Застосовні сполуки включають такі сполуки, в яких один, але не більше трьох, з А 1, А2, А3, А4 2 і А5 являє собою N, і інші являють собою -СН або -CR , за необхідності. Переважно, що якщо тільки один з А1, А2, А3, А4 і А5 являє собою N, то це А4. В іншому аспекті даний винахід стосується сполуки формули II, що має структуру Іl 50 або її фармацевтично прийнятної солі, де у зазначеній формулі, щонайменше, один, але не 3 4 більше трьох, з А1, А2, А3, А4 і А5 являє собою N, і інші являють собою -СН, -CR або -CR , за 5 5' 1 2 необхідності; R і R являють собою, незалежно, водень або С1-4-алкіл; R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, галогену, С 1-4-алкілу, ціано, 6 7 карбоксі(С1-5)алкілу, трифторметилу, нітро, галоген(С1-4)алкілу, формілу і NR R (CH2)р-, де p 6 7 дорівнює цілому числу від 0 до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (CH2)dX, де X являє собою галоген, і d дорівнює цілому числу від 1 до 4; крім значень, 8 UA 97802 C2 1 5 10 15 20 25 30 35 2 1 2 3 зазначених вище для R і R , R і/або R також можуть являти собою, незалежно, гідрокси; R вибирають з групи, що складається з водню, галогену, С1-4-алкілу, ціано, карбоксі(С1-5)алкілу, 6 7 трифіорметилу, нітро, галоген(С1-4)алкілу, формілу і NR R (CH2)р-, де p дорівнює цілому числу 6 7 від 0 до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (СН2)dX, де X являє собою 18 18 18 галоген, і d дорівнює цілому числу від 1 до 4, ( фтор)метил, ( фтор)етил, ( фтор)пропіл і Sn(алкіл)3; 4 R вибирають з групи, що складається з a) С1-4-алкілтіо, b) С1-4-алкілсульфонілу, c) гідрокси, d) С1-4-алкокси, 6 7 6 7 e) NR R (CH2)p-, де p дорівнює цілому числу від 0 до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (CH2)dX, де X являє собою галоген, і d дорівнює цілому числу від 1 до 4, f) феніл(С1-4)алкілу, g) С6-10-арилу, h) гетероарилу, і) гетероциклілу, j) гетероцикліл(С1-4)алкілу і k) С3-6-циклоалкілу, де зазначені феніл(С1-4)алкіл, С6-і0-арил. гетероарил, гетероцикліл, гетероцикліл(С 1-4)алкіл або С3-6-циклоалкіл заміщені одним з наступних замісників: С 1-4-алкілтіо, С1-4-алкілсульфоніл, 18 метокси, гідрокси, диметиламінo або метиламіно; і X' являє собою водень, ( фтор)метил, 18 18 125 123 131 18 76 77 1 ( фтор)етил, ( фтор)пропіл, І, l, l, F, Br, Вr або Sn(алкіл)3; за умови, що один з R , 2 3 4 6 7 1 2 R , R або R являє собою NR R (CH2)p-. В іншому втіленні також умовою є те, щоб один з R , R 4 і R являв собою гідрокси. 5 5 5 5 Застосовні значення R і R включають усі значення, зазначені вище. Переважно, R і R 1 2 являють собою, незалежно водень або С1-4-алкіл, такий як метил. Також переважно R і R являють собою, незалежно, гідрокси, монометиламіно- або диметиламіногрупу. 3 3 Застосовні значення R включають усі значения, зазначені виїде. Більш переважно, R 18 18 18 125 123 131 18 являє собою водень, ( фтор)метил-, ( фтор)етил, ( фтор)пропіл, І, І, І або F. 1 2 1 2 Застосовні значення R і R включають усі значення, зазначені вище. Переважно, R і R являють собою, незалежно, водень або С1-4-алкіл, такий як метил. 4 4 Застосовні значення R включають усі значення, зазначені вище. Переважно, R являє 6 7 собою метилтіо, метилсульфоніл, гідрокси, метокси або NR R (CH2)р-. Застосовні значення X' включають усі значення, зазначені вище. Переважні значення 18 18 18 125 123 131 18 включають водень, ( фтор)метил, ( фтор)етил або ( фтор)пропіл, І, І, І і F. В усіх сполуках за даним винаходом, в яких тільки один з А1, А2, А3, А4 і А5 являє собою N, більш переважно, коли А4 являє собою N. Характерні сполуки за даним винаходом включають 40 9 UA 97802 C2 а 5 b 7 8 30 31 32 33 де -Ch являє собою хелатуючу групу типу N2S2, і X, q, R , R , R , R , R , R , R і R мають a b значення, зазначені вище. Найбільш переважно, обидва R і R являють собою метальні групи. В іншому втіленні сполуки являють собою сполуки формули l'а, що мають загальну структуру l'а 10 де, щонайменше, один, але не більше трьох, з А1, А2, А3, А4 і А5 являє собою N, і інші являють собою -CH; q дорівнює, цілому числу від 1 до 1(3; кожний з R' і R" являє собою, незалежно, водень або С1-4-алкіл, і X являє собою радіоізотоп галогену або групу -Ch. Приклади таких сполук включають сполуки формули 1а, що мають структуру lа 15 20 де, щонайменше, один, але не більше трьох, з А1, А2, А3, А4 і А5 являє собою Ν, і інші являють собою -СН; q дорівнює цілому числу від 1 до 10; і X являє собою радіоізотоп галогену або групу -Ch. Переважно, замісники моно- або ді(С1-4-алкіл)аміно, більш переважно, монометиламіно або диметиламіно, і ПЕГ (PEG) знаходяться у пара-положенні відносно етиленового містка. Також переважно, коли А4 являє собою N, і кожний з А1, А2, А3 і А5 являє собою -СН. Переваленими значеннями q є цілі числа від 2 до 5, і особливо переважними 123 18 значеннями є 3 і 4. Переважні значення X включають І і F. Найбільш переважним значенням 18 X є F. В іншому втіленні сполуки за даним винаходом являють собою сполуки формули III, що мають структуру 25 ІІl 30 або їх фармацевтично прийнятні солі, де у зазначеній формулі n дорівнює цілому числу від одного до шести; щонайменше, один, але не більше трьох, з А1, А2, А3, А4 і А5 являє собою Ν, і 1 інші являють собою -СН, -CR або -CR, за необхідності; R включає всі застосовні значення, a b зазначені вище у випадку формули 1, переважно, гідрокси або NR R (CH2)p-, де p дорівнює a b цілому числу від 0 до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (CH2)dX, де X 10 UA 97802 C2 3 125 являє собою галоген, і d дорівнює цілому числу від 1 до 4, R вибирають з групи з І, 18 18 76 77 2 F, F((C1-C4)-алкіл), Br, Br або Sn(алкіл)3; R вибирають з групи, що складається з 123 I, 131 I, і) 5 де q дорівнює цілому числу від 1 до 10; Ζ вибирають з групи, що складається з водню, 30 31 32 33 гідрокси, галогену, С1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу; і R , R , R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, С 1-4-алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; і') 10 х y де q дорівнює цілому числу від 1 до 10; R і R являють собою водень, гідрокси або С1-430 31 32 33 алкіл; t дорівнює 0, 1, 2 або 3; і Z, R , R , R і R мають значення, зазначені вище; іі) 15 де Υ і U вибирають, незалежно, з групи, що складається з водню, гідроксилу, галогену, С1-4алкокси, С1-4-алкілу і гідроксі(С1-4)алкІлгу; U вибирають з групи, ию складається з водню, гідрокси, галогену, галогензаміщецрго бензоїлокси, галогензаміщеного феніл(С1-4)алкілу, 34 35 36 37 38 39 40 галогензаміщеного арилокси і галогензаміщєного С6-10-арилу; і R , R , R , R , R , R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, галогену, гідрокси, С1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу; іі') 20 25 30 35 40 а y 34 де R і R являють собою водень, гідрокси або С1-4-алкіл; t дорівнює 0, 1, 2 або 3; і У, U, R , 36 37 38 39 40 R , R , R , R , R i R мають значення, зазначені вище; ііі) NR'R", де, щонайменше, один з R' і R" являє собою (СН2)dХ, де X являє собою галоген, 18 переважно, F або F, і d дорівнює цілому числу від 1 до 4; інший з R' і R" вибирають з групи, що складається з водню, С1-4-алкілу, галоген(С1-4)алкілу і гідроксі(С1-4)алкілу; iv) NR'R"-(С1-4)aлкiлy, де, щонайменше, один з R' і R" являє собою (CH2)dX, де X являє собою 18 галоген, переважно, F або R і d дорівнює цілому числу від 1 до 4; інший з R' і R" вибирають з групи, що складається з водню, С1-4-алкілу, галоген(С1-4)алкілу і гідроксі(С1-4)алкілу; ν) галоген(С1-4)алкілу; і vi) простої ефірної групи (R-O-R), що має структуру [галоген(С1-4)алкіл-О-(С1-4)алкіл]-; і 7 8 R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, аміно, метиламінo, диметиламіно, С1-4-алкокси, С1-4-алкілу і гідроксі(С1-4)алкілу. Переважні сполуки включають сполуки, в яких галоген, при одній або декількох появах у структурі, являє собою радіоізотоп галогену Також переважними є сполуки, в яких галоген 123 125 131 76 76 77 18 вибирають з групи, що складається з І, І, І, І, Вr, Вr, Br, F або F. Особливо 18 переважними є сполуки, що містять F. Сполуки, що містять І, також є особливо переважними. 1 Застосовні значення R перераховані вище. Переважними значеннями є гідрокси або a b a b NR R (CH2)p-, де p дорівнює цілому числу від 0 до 5, і R і R являють собою, незалежно, водень, С1-4-алкіл або (СН2)dХ, де X являє собою галоген, і d дорівнює цілому числу від 1 до 4. Застосовні значення p включають цілі числа від 0 до 5. Переважно, p дорівнює 0, 1 або 2. 1 a b 1 Найбільш переважно, p дорівнює 0, так що R являє собою NR R . У переважних втіленнях R знаходиться або у мета-, або у пара-положенні відносно відповідного містка. Переважним 35 11 UA 97802 C2 1 5 10 15 20 25 30 35 a b a b значенням R є NR R , де R і R являють собою, незалежно, водень або С1-4-алкіл. У такому a b втіленні переважно, щоб С1-4-алкiл являв собою метил. Переважно, один з R і R являє собою a водень, а інший являє собою С1-4-алкіл, такий як метил. Найбільш переважно, коли як R , так і b 1 1 R являє собою метил. Іншим переважним значенням R є гідрокси. Також переважними для R є будь-які групи, які після введення в організм метаболізують або розкладаються до переважних 1 значень R , зазначених вище. Ці групи відомі у техніці як такі, що складають проліки, і групи, здатні до утворення проліків, добре відомі фахівцям у даній галузі техніки. Застосовні значення n включають цілі числа від 1 до 6. Переважно, величина n складає від 1 до 4. Найбільш переважно, величина n складає від 1 до 3. Особливо переважно, коли n дорівнює одиниці. 7 8 Застосовні значення R і R у кожному випадку вибирають, незалежно, з групи, що складається з водню, гідрокси, аміно, метиламінo, диметиламіно, С 1-4-алкокси, С1-4-алкілу і 7 8 гідроксi(С1-4)алкілу. Значення n визначає число груп R і R , які є присутніми у сполуці. Якщо у 7 8 визначеній сполуці вони є присутніми декілька разів, у кожному випадку значення R і R може 7 8 7 8 відрізнятися від будь-якого іншого значення R і R . У переважних втіленнях кожний з R і R являє собою водень у кожному випадку. 2 Застосовні значення R включають субсіруктури і, і', іі, іі', ііі, iv, v і vi, відображені вище. У 2 переважних втіленнях формули І R знаходиться або у мета-, або у пара-положенні відносно 2 відповідною містка. Переважно, R являє собою субструктуру і або іі. Також переважними є субструктури і' і іі'. У таких втіленнях застосовні значення q включають цілі числа від одного до 2 десяти. Переважно, у сполуці, де R являє собою і або і', q дорівнює цілому числу від 1 до 5. Найбільш переважно, q дорівнює 1-4, особливо. 3 або 4. У субструктурі і або і' застосовні 30 31 32 33 значення R , R , R і R включають, незалежно, водень, гідрокси, С1-4-алкокси, С1-4-алкіл і 30 31 гідроксі(С1-4)алкіл. Переважні сполуки включають сполуки, в яких один або декілька з R , R , 32 33 R і R являють собою водень. Більш переважні сполуки включають сполуки, в яких кожний з 30 31 32 33 R , R , R і R являє собою водень. 34 35 36 37 38 39 40 У субструктурі іі або і і' застосовні значення Y, U і R , R , R , R , R , R і R зазначені вище. Переважні сполуки включають сполуки, в яких U являє собою гідрокси. Застосовні сполуки включають такі сполуки, в яких, щонайменше, один, але не більше 2 трьох, з А1, А2, A3, A4 і А5 являє собою N. і інші являють собою -СН або -CR , за необхідності. Більш переважно, щоб N займав положення А4. Особливо застосовні сполуки формули lll включають такі сполуки, в яких А4 являє собою N, 2 3 а інші являють собою -СН, -CR або -CR , за необхідності. Особливо переважні сполуки формули ІП, в яких А4 являє собою N, включають a b де R і R вибирають, незалежно, з водню або С1-4-алкілу, q дорівнює цілому числу від 1 до 3 123 18 4, і R являє собою, переважно, l або F. Приклади найбільш переважних сполук формули III включають 12 UA 97802 C2 2 інші переважні сполуки формули III, в яких R являє собою іі, включають 5 де Υ вибирають з групи, що складається з водню і F. 2 Сполуки формули III, в яких R являє собою і або і', коли t дорівнює 0, включають прості гідроксіефіри, такі як 1 10 15 20 25 30 35 2 де R і R мають значення, зазначені у випадку формули III. x y В усіх втіленнях сполук формул І і III, що містять -(CR R )t, де t відрізняється від нуля, сполуки мають зазначену далі загальну структуру, в якій є, щонайменше, один вуглецьвуглецевий зв'язок між замісником і азотвмісним циклом: Сполуки за даним винаходом також можуть містити радіоактивний ізотоп вуглецю як радіоізотоп. Це стосується сполук, що містять один або декілька радіоактивних атомів вуглецю, 11 переважно, С, з питомою радіоактивністю, що перевищує активність фонового рівня для такого атома. Добре відомо, у цьому відношенні, що елементи, які зустрічаються у природі, присутні у формі різних ізотопів, з яких деякі є радіоактивними ізотопами. Радіоактивність елементів, які зустрічаються у природі, є результатом природного розподілу або поширеності таких ізотопів і звичайно називається фоновим рівнем. Спонуки за даним винаходом з радіоізотопом вуглецю мають питому радіоактивність, яка більш висока, ніж поширена у природі, і тому вища фонового рівня. Композиція, заявлена у даній заявці, щo включає сполуку(и) за даним винаходом з радіоізотопом(ами) вуглецю, буде включати таку кількість сполуки, щоб композицію можна було використовувати для індикації, візуалізації, радіотерапії і подібного застосування. 18 У деяких втіленнях сполук, розкритих: у даному описі, галоген, перевалено, F, або хелатуючий агент з'єднуються зі стирилпіридиновою основою через ланцюг ПЕГ з різним числом етоксигруп. Фторований стирил піридин 2 демонструє високу афінність зв'язування (Kі = 2,5±0,4 нМ). Аналог з диметиламіногрупою показує найвищу афінність. Це протилежне аналогам стильбену, які мають схильність прояв чяти більш високу афінність у випадку заміщення монометиламіно. Як видно на схемах 1-3 у даному описі, введення радіоактивних ізотопів здійснюється успішно з утворенням сполук-мішеней. Синтез сполуки 2 за схемою 5 приводить до часу одержання приблизно 60 хв.; радіохімічний вихід ~35% (скоригований на розпад); радіохімічна чистота >98%, і питома радіоактивність від приблизно 1000 до приблизно 18 1500 Кі/ммоль. Біорозподіл in vivo F-пегільованого стиролпіридину у здорових мишей показує 13 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 60 виняткове проникнення у головний мозок після iν ін'єкції і швидке вимивання. Ауторадіотрафія з 2 посмертних зрізів головного мозку з AD підтверджує специфічне зв'язування, пов'язане з наявністю бляшок Αβ. Переважні значення у випадку С6-10-арилу включають феніл, нафтил або тетрагідронафтил. Переважні значення у випадку гетероарилу включають тієніл, фурил, піраніл, піроліл, піридиніл, індоліл та імідазоліл. Переважні значення у випадку гетероциклілу включають піперидиніл, піролідиніл і морфолініл. Переважне втілення С6-10-арилу, гетероарилу, гетероциклілу, гетероцикліл(С1-4)алкілу або С3-5-циклоалкілу містить цикл, заміщений одним з наступних замісників: С1-4-алкілтіо, С1-4-алкілсульфоніл, метокси, гідрокси, диметиламіно або метиламіно. Сполуки формул І, Іа, II і III також можуть бути сольватовані, особливо, гідратовані. Гідратація може відбуватися під час одержання сполук або композицій, які містять сполуки, або гідратація може відбуватися з часом через гігроскопічний характер сполук. Крім того, сполуки за даним винаходом можуть існувати у несольватованій, а також у сольватованій формах з фармацевтично прийнятними розчинниками, такими як вода, етанол і подібні розчинники. Взагалі, для цілей даного винаходу сольватовані форми вважаються еквівалентами несольватованим формам. Коли будь-яка змінна зустрічається більше одного разу у будь-якому елементі або у формулі І, Іа, II або III, її визначення з кожною появою не залежить від її визначення при будь-якій іншій появі. Також поєднання замісників і/або змінних припустимі тільки у тому випадку, якщо такі поєднання приводять до стійких сполук. Термін «алкіл», використовуваний у даному описі сам по собі або як частина іншої групи, стосується як лінійних, так і розгалужених радикалів з числом атомів вуглецю до 8, переважно, до 6 атомів вуглецю, більш переважно, до 4 атомів вуглецю, таких як метил, етил, пропіл, ізопропіл, бутил, трет-бутил та ізобутил. Термін «алкокси» у даному описі використовується для позначення лінійного або розгалуженого алкільного радикала, що має зазначені вище значення, якщо тільки довжина ланцюга обмежується зазначеним, зв'язаного з атомом кисню, включаючи, але не обмежуючись перерахованим, метокси, етокси, н-пропокси, ізопропокси і т.п. Переважно, ланцюг алкокси має 1-6 атомів вуглецю у довжину, більш переважно, 1-4 атоми вуглецю у довжину. Термін «моноалкіламіно», використовуваний у даному описі сам по собі або як частина іншої групи, стосується аміногрупи, яка заміщена однією алкільною групою, що має значення, зазначені вище. Термін «діалкіламіно», використовуваний у даному описі сам по собі або як частина іншої групи, стосується аміногрупи, яка заміщена двома алкільними групами, що мають значення, зазначені вище. Термін «гало» або «галоген», використовуваний у даному описі сам по собі або як частина іншої групи, стосується атомів хлору, брому, фтору або йоду і їх ізотопів. Термін «радіогалоген» стосується конкретно радіоактивних ізотопів галогену. Термін «галогеналкіл», використовуваний у даному описі, стосується будь-якої з описаних вище алкільних груп, заміщеної одним або декількома атомами хлору, брому, фтору або йоду, причому переважні атоми фтору і хлору, такої як хлорметил, йодметил, трифторметил, 2,2,2трифторетил і 2-хлоретил. Термін «алкілтіо», використовуваний у даному описі сам по собі або як частина іншої групи, стосується простої тіоефірної груди будови R-S, де R являє собою С1-4-алкіл, що мас значення, зазначені вище. Термін «алкілсульфоніл», використовуваний у даному описі сам по собі або як частина іншої групи, стосується сульфоногрупи будови R-SO2, де R являє собою С1-4-алкіл, що має значення, зазначені вище. Термін «арил», використовуваний у даному описі сам по собі або як частина шитої групи, стосується моноциклічних або біциклічних ароматичних груп, що містять від 6 до 12 атомів вуглецю у циклічній частиш, перевалено. 6-10 атомів вуглецю у циклічній частині, таких як феніл, нафтил або гетрагідронафтил, Термін «гетероцикліл» або «гетероциклічне кільце», використовуваний у даному описі, за винятком зазначених випадків, представляє стійку 5-7-членну моногетероциклічну систему, яка може бути насиченою або ненасиченою, і яка складається з атомів вуглецю і одного-трьох гетероатомів, вибраних з групи, що складається з Ν, Ο і S, і в якій гетероатом азоту і сірки може бути, необов'язково, окиснений. Особливо застосовними є цикли, що містять один атом азоту у поєднанні з одним атомом кисню або сірки, або два гетероатоми азоту. Приклади таких гетероциклічних груп включають піперидиніл, піроліл, піролідиніл, імідазоліл, імідазиніл, імідазолідиніл, піридил, піразиніл, піримідиніл, оксазоліл, оксазолідиніл, ізоксазоліл, 14 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 ізоксазолідиніл, тіазоліл, тіазолідиніл, ізотіазоліл, гомопіперидиніл, гомопіперазиніл, піридазиніл, піразоліл і піразинолідиніл, і найбільш переважні тіаморфолініл, піперазиніл і морфолініл. Термін «гетероатом» використовується у даному описі для позначення атому кисню ("О"), атому сірки ("S") або атому азоту ("Ν"). Слід мати на увазі, що коли гетероатом являє собою атом азоту, він може утворювати групу NRR, де групи R, незалежно одна від одної, можуть 1 являти собою водень або С1-4-алкіл, С2-4-аміноалкіл, С1-4-галогеналкіл, галогенбензил, або R і 2 R беруться разом з утворенням 5-7-членного гетероциклічного кільця, що, необов'язково, с c містить у зазначеному кільці О, S або NR , де R являє собою водень або С1-4-алкіл. Термін «гетероарил», використовуваний у даному описі, стосується груп з 5-14 атомами у циклі, 6, 10 або 14 спільними -електронами у циклі, і таких, що містять атоми вуглецю і 1, 2, 3 або 4 гетероатоми кисню, азоту або сірки (де прикладами гетероарильних груп є тієнільна, бензо[b]тієнільна, нафто[2,3-b]тієнільна, тіантренільна, фурильна, піранільна, ізобензофуранільна, бензоксазолільна, хроменільна, ксантенільна, феноксатіїнільна, 2Нпіролільна, піролільна, імідазолільна, піридильна, піразинільна, піримідинільна, піридазинільна, індолізинільна, ізоіндолільна, 3Н-індолільна, індолільна, індазолільна, пуринільна, 4Нхінолізинільна, ізохінолільна, хінолільна, фталазинільна, нафтиридинільна, хіназолінільна, цинолінільна, птеридинільна, 4аН-карбазолільна. карбазолільна, α-, β- або γ-карболінільна, фенатридинільна, акридинільна, піримідинільна, фенантролінільна, феназинільна, ізотіазолільна, фенотіазинільна, ізоксазолільна, фуразанільна і феноксазинільна групи). Термін «аралкіл» або «арилалкіл», використовуваний у даному описі сам по собі або як частина іншої групи, стосується С1-4-алкільних груп, які мають зазначені вище значення, що містять арильний замісник, таких як бензил, фенілетил або 2-нафтилметил. Інший аспект даного винаходу стосується способів одержання сполук формул І, Іа, II і III. Синтез диметиламінозаміщеного похідного стирил піридину 1 і його фторпегільованого варіанту 2 показаний на схемі 1. Сполуку 1 одержують реакцією Віттига між діетил-4(диметиламіно)бензилфосфонатом і 6-хлорнікотинальдегідом у присутності трет-бутоксиду калію у ДМФА (вихід 62%). Прямим алкілуванням сполуки 1 2-(2-(22 фторетокси)етокси)етанолом з використанням гідриду натрію у ТГФ одержують фторпегільовану сполуку 2 (вихід 33%), яку можна використовувати як холодний стандарт для введення радіоактивних ізотопів. Одержання монометиламінозаміщеного похідного 6 здійснюють способом, показаним на схемі 2. Реакція Віттига між 4-нітробензилфосфонатом і 6хлорнікотинальдегідом у присутності метоксиду натрію у метанолі при кип'ятінні зі зворотним холодильником дає сполуку 3 з високим виходом (88%). Сполуку 3 після реакції можна легко дістати фільтрацією і використовувати безпосередньо на наступній стадії; додаткового очищення не потрібно. Алкілуванням 3 2-(2-(2-фторетокси)етокси)етанолом з використанням гідриду натрію у ТГФ одержують сполуку 4 (вихід 30%). Нітрогрупу сполуки 4 можна відновити з використанням хлориду олова(2) в етанолі і одержати сполуку 5 (вихід 58%). Монометилування 5 досягають з використанням параформальдегіду, метоксиду нагрію і борогідриду натрію, і одержують сполуку 6 з відносне» високим виходом (73%). Для того, щоб одержати погрібне мічене F-18 диметиламінозаміщене похідне стирил 18 піридину [ F]2, використовують як попередник тозилат 10 (схема 3). Одержання 10 починають з алкілування 3 триетиленгліколем у ДМФА, якому сприяє мікрохвильове випромінювання, і одержують сполуку 7 (вихід 77%). Потім нітрогрупу 7 відновлюють до аміногрупи з використанням хлориду олова(2), і одержують сполуку 8 (вихід 76%), а потім йде диметилування з використанням параформальдегіду і ціаноборогідриду нагрію в оцтовій кислоті з утворенням сполуки 9 з високим виходом (95%). Спочатку намагалися мезилювати 9, однак мезилат 9 виявився дуже нестійким і розкладався під час одержання. Успішно здійснюють тозилювання 9 з використанням тозилхлориду у піридині, і одержують потрібний тозилат 10 18 (вихід 41%) як попередник для одержання міченого радіоактивним ізотопом [ F]2. 15 UA 97802 C2 5 16 UA 97802 C2 5 10 Схеми 5-7 відображають спосіб синтезу сполук формули III. Схема 5 відображає синтез деяких проміжних сполук, застосовних для одержання сполук за винаходом. Схеми 6 і 7 відображають синтез мічених радіоактивними ізотопами і немічених сполук за винаходом. У сполуках 17-110 "І" у назві сполуки означає «проміжна сполука». Реагенти і умови: (a) NIS, CH3CN, кип'ятіння зі зворотним холодильником. 1 година; (b) F(CH2CH2O)3H, Ph3P, DIAL), ТГФ, від -5°С до к.т., 2 години; (с) (І) HOCH2CH2OTBDMS, Ph3P, DIAD, ТГФ, від -5°С до к.т., 2 години; (2) 1% НСI у 95% ЕtOН, к.т., 1 година. 15 Реагенти і умови: (а) 4-заміщені сироти, K2СО3, Bu4NBr, Pd(OAch, ДМФА, 55-65°С; (b) (Bu3Sn)2, Pd(PPh3)4 толуол, 110°С; (с) K2СО3, EtOН/ТГФ, к.т., 2 години; (d) І2, ТГФ, від 0°С до кт.; (e) TMSOTf, 2,6-лутидин, DCM, від -78°С до к.т. 17 UA 97802 C2 5 10 15 20 25 30 35 40 45 Комплекси Tc-99m можна одержати наступним чином. Невелику кількість сполуки, що не містить радіоактивних ізотопів, (1-2 мг) розчиняють у 100 мкл EtOH і змішують з 200 мкл HСl (1 н) і 1 мл розчину Sn-глюкогептонату (що, містить 8-32 мкг SnCI2 і 80-320 мкг Na-глюкогептонату, 99m рН 6,67) і 50 мкл розчину ЕДТК (0,1 н). Потім додають розчин [ Тс]пертехнетату у фізіологічному розчині (100-200 мкл; коливання у межах 2-20 мКІ). Реакційну суміш гріють протягом 30 хв. при 100°С і потім охолоджують до кімнатної температури. Реакційну суміш аналізують ТШХ (EtOH : конц. NH3, 9:1) на утворення продукту реакції і для контролю чистоти. Суміш можна нейтралізувати фосфатним буфером до рН 5,0. Даний винахід також стосується способу одержання комплексу технецію-99m за даним винаходом взаємодією технецію-99m у формі пертехнетату у присутності відновника і, необов'язково, придатного хелатоутворювача з відповідною Ch-вмісною сполукою. Відновник служить для відновлення пертехнетату Тс-99m, який елююють з генератора молібдену-технецію у фізіологічному розчині. Придатними відновниками є, наприклад, дипоніт, формамідинсульфінова кислота, діаміноетандисульфінат або придатні відновлювальні іони металів, такі як Sn(II), Fе(ll), Сu(І), Ті(ІІІ) або Sb(III). Встановлено, ідо Sn(II) є особливо придатним. У випадку вказаної вище реакції утворення комплексу технецій-99т вводять у взаємодію з відповідною сполукою за винаходом у вигляді солі або у формі технецію, зв'язаного з відносно слабким хелатоутворювачеЦ. В останньому випадку потрібний комплекс технецію-99т формується за рахунок лігандного обміну. Прикладами придатних хелатоутворювачів для радіонуклеїду є дикарбонові кислоти, такі як щавлева кислота, малонова кислота, бурштинова кислота, малеїнова кислота, ортофталева кислота, яблучна кислота, молочна кислота, винна кислота, лимонна кислота, аскорбінова кислота, саліцилова кислота, або похідні таких кислот; сполуки фосфору, такі як. пірофосфати; або еноляти. Лимонна кислота, винна кислота, аскорбінова кислота, глюкогептонова кислота або їх похідні є особливо придатними хелатоутворювачами для такої мети, оскільки хелат технецію-99m з одним із зазначених хелатоутворювачів піддається потрібному лігандному обміну особливо легко. v +3 Найбільш використовувана процедура одержання комплексів [Tc O] N2S2 базується на 99m відновленні хлоридом олова(ll) [ Тс]пертехнетату - звичайної вихідної речовини. Процедура введення радіоактивного ізотопу звичайно має в основі реакцію обміну лігандами Тс-99m між (Sn)-глюкогептонатом Тс-99m і лігандом N2S2. Одержання хлориду олова(ll) і збереження його у відповідній формі олова(ІІ) критично важливо для успіху реакції введення радіоактивного ізотопу. Для того, щоб стабілізувати чутливий до повітря іон олова, звичайною практикою у медичній радіології є застосування ліофілізованого набору, в якому іон олова знаходиться у речовині у формі ліофілізованого порошку, змішаного з надлишковою кількістю глюкогептаноату, в атмосфері інертного газу, такого як азот або аргон. Одержання наборів ліофілізований хлорид олова/глюкогептаноат натрію забезпечує відтворюваність і передбачуваність реакції введення радіоактивного ізотопу. Ліганди N2S2, як правило, чутливі до повітряної атмосфери (тіоли легко окиснюються повітрям), і існують подальші реакції, що ведуть до розкладання лігандів. Найбільш поширеним і передбачуваним способом збереження лігандів є одержання ліофілізованих наборів., які містять по 100-500 мкг лігандів в атмосфері аргону або азоту. Коли сполуки за даним винаходом повинні використовуватися як засоби візуалізації, в них 125 слід ввести придатні радіоактивні ізотони галогену. Хоча ізотопи І застосовні для 18 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 лабораторного тестування, вони, як правило, незастосовні для цілей фактичного діагнозу через 125 відносно тривалий період напіврозпаду (60 днів) і низьке гамма-випромінювання (30-60 кеВ) І. 125 Ізотоп І має період напіврозпаду тринадцять годин і енергію гамма-випромінювання 159 кеВ, і тому очікується, що можливе мічення таким ізотопом лігандів, використовуваних для 131 діагностичних цілей. Інші ізотопи, які можна використовувати, включають І (період 77 76 напіврозпаду 2 години). Придатні ізотопи брому включають Вr і Вr. Сполуки за даним винаходом, що містять радіоактивні ізотопи галогенів, допускають просте одержання з матеріалів, які можуть одержати користувачі у наборах. Набори для одержання засобів для візуалізації. можуть містити, наприклад, флакон, що містить фізіологічно придатний розчин проміжної сполуки формули І, Іа, II або III, у концентрації і при рН, придатних для оптимальних умов комплексоутворення. Користувачу слід додати у флакон відповідну кількість 123 речовини, що містить радіоізотоп, наприклад, Na І, і окисника, такого як пероксид водню. Одержаний ліганд, що містить радіоактивний ізотоп, потім можна вводити внутрішньовенно пацієнту і візуалізувати рецептори у головному мозку за допомогою вимірювання їх гаммавипромінювання або фотоемісії. Оскільки радіоактивну фармацевтичну композицію за даним винаходом можна одержати легко і просто, одержання може легко здійснити користувач. Тому даний винахід також стосується набору, що включає (1) сполуку за даним винаходом, яка не містить радіоактивних ізотонів, що знаходиться, необов'язково, у сухому стані; і також необов'язково містить інертний фармацевтично прийнятний носій і/або допоміжні речовини, що додаються до неї; і (2) відновник і„ необов'язково, хелатоутворювач; де інгредієнти (1) і (2) можуть бути, необов'язково, об'єднані; і де також, необов'язково, можуть бути включені інструкції із застосування з приписом щодо здійснення вказаного вище способу шляхом введення у взаємодію реагентів (1) i (2) з технецієм-99m у формі розчину пертехнетату. Приклади придатних відновників і хелатоутворювачів для вказаного вище набору наводяться вище. Розчин пертехнетату користувач може одержати з генератора молібденутехнецію. Такі генератори доступні від ряду інститутів, які здійснюють радіодіагностичні процедури. Як зазначалося вище, інгредієнти (1) і (2) можуть бути об'єднані, за умови, що вони сумісні. Такий однокомпонентний набір, в якому об'єднані інгредієнти, переважно, ліофілізовані, винятково підходить для здійснення користувачем взаємодії з розчином пертехнетату простим способом. За бажанням радіоактивний діагностичний засіб може містити будь-яку домішку, гаку як речовини, що регулюють рН (наприклад, кислоти, основи, буфери), стабілізатори (наприклад, аскорбінову кислоту) або речовини, що додають ізотонічнісіь (наприклад, хлорид натрію). Термін «фармацевтично прийнятна сіль», використовуваний у даному описі, стосується солей карбонових кислої або солей приєднання кислот сполук за даним винаходом, які, у межах здорового глузду у медицині, підходять для застосування у контакті з тканинами пацієнтів без небажаних токсичності, подразнення, алергійної реакції і т.п., порівнянно з розумним співвідношенням сприятливий вилив/ризик і ефективні для їх передбачуваного застосування, а також цвітер-іонних форм сполук за винаходом, коли вони можливі. Термін «солі» стосується відносно нетоксичных солей приєднання неорганічних і органічних кислот сполук за даним винаходом. Він також включає солі, одержані з нетоксичними органічними кислотами, такими як аліфатичні моно- і дикарбонові кислоти, наприклад, оцтова кислота, фенілзаміщені алканові кислоти, гідроксіалканові і алкандіонові кислоти, ароматичні кислоти і аліфатичні і ароматичні сульфонові кислоти. Такі солі можна одержати in situ під час кінцевої стадії діставання і очищення сполук або окремо взаємодією очищеної сполуки у формі її вільної основи з придатною органічною або неорганічною кислотою і виділенням одержаної таким чином солі. Інші характерні солі включають гідроброміди, гідрохлориди, сульфати, бісульфати, нітрати, ацетати, оксалати, валерати, олеати, пальмітати, стеарати, лаурати, борати, бензоати, лактати, фосфати, тозилати, цитрати, малеати, фумарати, сукцинати, тартрати, нафтилати, мезилати, глюкогептонати, лактобіонати і лаурилсульфонати, пропіонати, півалати, цикламати, ізетіонати і подібні солі. Вони можуть включати катіони на основі лужних і лужноземельних металів, таких як натрій, літій, калій, кальцій, магній, і т.п., а також нетоксичні катіони амонію, четвертинного амонію і амінів, у тому числі, але без обмеження, амонію, тетраметиламонію, тетраетиламонію, метиламіну, диметиламіну, триметиламіну, триетиламіну, етиламіну і т.п. (див., наприклад, роботу Berge S.M. et al., Pharmaceutical Salts, J. Pharm. Sci., 66: 1-19 (1977), включену у даний опис як посилання). 19 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 На першій стадії способу візуалізації за даним винаходом мічену сполуку формули І, Іа, II або III вводять у тканину або пацієнту у кількості, що детектується. Сполука, типово, є частиною фармацевтичної композиції і вводиться у тканину або пацієнту способами, добре відомими фахівцям у даній галузі техніки. Введення міченої сполуки пацієнту може бути способом загального або локального введення. Наприклад, сполуку можна ввести або перорально, або ректально, парентерально (внутрішньовенно, внутрішньом'язово або підшкірно), внутрішньопорожнинно, інтравагінально, інтранеритонеально, інтравезикулярно, локально (порошки, мазі або краплі), або у вигляді внутрішньоротового або назального спрею. Мічену сполуку можна вводити пацієнту таким чином, що вона доставляється у визначений орган або тканину, що представляють інтерес. Наприклад, бажано знайти місце розташування і кількість амілоїдних відкладень у головному мозку з метою діагностики або відстеження розвитку хвороби Альцгеймера у пацієнта. Однією з найбільш бажаних властивостей засобу візуалізації in vivo головного мозку є здатність проходити через інтактний гематоенцефалічний бар'єр після ін'єкції iv ударної дози. У переважному втіленні винаходу мічену сполуку вводять пацієнту у кількості, що детектується, і після того, як пройде достатній час для того, щоб сполука асоціювалася з амілоїдними відкладеннями, мічену сполуку детектують неінвазивно в організмі пацієнта. В іншому втіленні винаходу мічену радіоактивними ізотонами сполуку формули І, Іа, II або III вводять пацієнту, залишають достатній час для того, щоб сполука асоціювалася з амілоїдними відкладеннями, і потім беруть у пацієнта зразок тканини, і детектують у тканині мічену сполуку поза організмом пацієнта. У третьому втіленні винаходу беруть у пацієнта зразок тканини, і вводять у зразок мічену радіоактивними ізотонами сполуку формули І, Іа, II або III. Через достатній час для того, щоб сполука зв'язалася з амілоїдними відкладеннями, сполуку детектують. Термін «тканина» позначає частину тіла пацієнта. Приклади тканин включають головний мозок, серце, печінку, кровоносні судини і артерії. Кількість, що детектується, являє собою кількість міченої сполуки, необхідну для виявлення вибраним способом детектування. Кількість міченої сполуки, яку вводять пацієнту для того, щоб забезпечити детектування, можуть легко визначити фахівці у даній галузі техніки. Наприклад, пацієнту можна давати зростаючі кількості міченої сполуки доти, доки сполука не буде виявлятися вибраним способом детектування. У сполуки вводять мітку для забезпечення детектування сполук. Термін «пацієнт» позначає людей та інших ссавців. Фахівці у даній галузі техніки також добре знайомі з визначенням проміжку часу, достатнього для того, щоб сполука асоціювалася з амілоїдними відкладеннями. Необхідну кількість часу можна легко визначити шляхом введення пацієнт}· кількості, що детектується, сполуки формули І, Іа, II або III і подальшого детектування міченої сполуки у різні моменти часу після введення. Термін «асоційований» позначає хімічну взаємодію між міченою сполукою і амілоїдним відкладенням. Приклади асоціацій включають ковалентні зв'язки, іонні зв'язки, гідрофільнігідрофобні взаємодії, гідрофобні-гідрофільні взаємодії і комплексоутворення. Фахівці у даній галузі техніки добре знайомі з різними способами детектування мічених сполук. Наприклад, ядерний магнітний резонанс (MRI), позитронну емісійну томографію (PET) або емісійну комп'ютерну томографію окремих фотонів (SPECT) можна використовувати для детектування сполук. мічених радіоактивними ізотопами. Радіоізотоп, що вводять у сполуку, буде залежати від бажаного способу детектування. Наприклад, якщо як спосіб детектування 11 18 вибирають PET, сполука повинна мати атом, що випромінює позитрони, такий як С або F. Радіоактивний діагностичний засіб повинен мати достатню радіоактивність і концентрацію радіоактивного фактора, що може забезпечити достовірний діагноз. Наприклад, у випадку, коли радіоактивним металом є технецій-99т, його можна включати, як правило, у кількості 0,1-50 мКі у приблизно 0,5-5,0 мл під час введення. Кількість сполуки формули І, Іа, II або III може бути такою, якої досить для утворення стійкої хелатної сполуки з радіоактивним металом. Одержана таким чином хелатна сполука як радіоактивний діагностичний засіб є досить стійкою, і тому її можна відразу ж вводити як таку або зберігати до її застосування. За необхідності радіоактивний діагностичний засіб може містити будь-яку домішку, таку як речовини, що регулюють рН (наприклад, кислоти, основи, буфери), стабілізатори (наприклад, аскорбінову кислоту) або речовини, що додають ізотонічність (наприклад, хлорид натрію). Візуалізацію амілоїдних відкладень також можна здійснити кількісно, так що можна визначити кількість амілоїдних відкладень. П Ш 125 131 18 7б Переважні сполуки для візуалізації включають радіоізотопи, такі як С, І, 1, І, F, Вг 77 або Вг. 20 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Іншим аспектом винаходу є спосіб інгібування агрегації амілоїдних бляшок. Даний винахід також стосується способу інгібування агрегації амілоїдних білків з утворенням амілоїдних відкладень шляхом введення пацієнту амілоїдінгібуючої кількості сполуки зазначеної вище формули І, Іа, II або III. Фахівці у даній галузі техніки можуть легко визначити амілоїдінгібуючі кількість шляхом простого введення пацієнту сполуки формули І, Іа, II або III у зростаючих кількостях доти, доки ріст амілоїдних відкладень не зменшиться або не припиниться. Швидкість росту можна оцінити з використанням візуалізації, як описано вище, або шляхом взяття зразка тканини у пацієнта і спостереження у ньому амілоїдних відкладень. Сполуки за даним винаходом можна вводити пацієнту при рівнях дозування в інтервалі від приблизно 0.1 до приблизно 1000 мг на добу. Для звичайної дорослої людини з масою тіла приблизно 70 кг достатнім є дозування в інтервалі від приблизно 0,01 до приблизно 100 мг на кілограм маси тіла на добу. Однак, конкретне використовуване дозування може змінюватися. Наприклад, дозування може залежати від ряду факторів, включаючи потреби пацієнта, тяжкість стану, від якого лікують, і фармакологічну активність використовуваної сполуки. Визначення оптимальних дозувань добре відоме фахівцям у даній галузі техніки. Наведені далі приклади є ілюстративними, але не обмежувальними, для способу і композицій за даним винаходом. Інші придатні модифікації і адаптації до різних умов і параметрів, що звичайно зустрічаються і очевидні для фахівців у даній галузі техніки, знаходяться у сфері суті і обсягу винаходу. Усі реагенти, використовувані у синтезах, є комерційними продуктами, використовуються без додаткового очищення, якщо не зазначено інше. Спектри Η ЯМР одержують на спектрометрі Brucker DPX (200 МГц) у CDCІ3. Хімічні зсуви наводяться у величинах δ (мільйонні частки) відносно внутрішнього стандарту ТМС. Константи взаємодії наводяться у герцах. Мультиплетність визначена наступним чином: с (синглет), д (дублет), т (триплет), уш (розширений), м (мультиплет). Елементний аналіз здійснює Atlantic MicroІab INC. У випадку кожної процедури «стандартна обробка» стосується наступних стадій: додавання зазначеного органічного розчинника, промивання органічного шару водою і потім сольовим розчином, відділення органічного шару від водного шару, сушіння об'єднаних органічних шарів безводним сульфатом натрію, відфільтровування сульфату натрію і видалення органічного розчинника при зниженому тиску. ПРИКЛАДИ ПРИКЛАД 1 Синтез сполуки 2 (Е)-2-Хлор-5-(4-диметиламіностирил)піридин(1) До розчину діетил-(4-диметиламінобензил)фосфонату (80 мг, 0,30 ммоль) у безводному ДМФА (5,0 мл) при 0°С додають трет-бутоксид калію (99 мг, 0,89 ммоль). Потім додають 2-хлор5-піридилальдегід (42 мг, 0,30 ммоль). Реакційну суміш нагрівають до кімнатної температури і перемішують протягом 4 годин. Додають воду, і суміш екстрагують MeOH/DCM (1:9, об./об.). Органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (PTLC) (як розчинник, що проявляє, 20% гексану у 1 DCM), і одержують продукт 1 (48 мг, вихід 62%). Н ЯМР (200 МГц, CDCІ3): δ 8,42 (1Н, д, J=2,2 Гц), 7,77 (1Н, д,д, J1=8,4 Гц, J2=2,4 Гц), 7,41 (2Н, д, J=8,6 Гц), 7,27 (1Н, д, J=8,2 Гц), 7,08 (1Н, д, + J=16,4 Гц), 6,77 (3Н, м), МСВР (ЕТ) m/z, обчислено для [C13H9ClN2O2] 260,0353. (Е)-2-(2-(2-(2-Фторетокси)етокси)етокси)-5-(4-диметиламіностирил)піридин (2) До розчину 2-(2-(2-фторетокси)етокси)еганолу (39 мг, 0,26 ммоль) у безводному ДМФА (5,0 мл) додають гідрид натрію (95%, 10 мг, 0,39 ммоль) Після перемішування при кімнатній температурі протягом 20 хв додають сполуку 5 (35 мг, 0,13 ммоль), і реакційну суміш гріють при 100°С протягом 2 годин. Після охолодження до кімнатної температури додають воду, і реакційну суміш екстрагують етилацетатом. Органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як 1 розчинник, що проявляє, 4% МеОН у DCM), і одержують продукт 2 (16 мг, вихід 32,9%). Н ЯМР (200 МГц. CDCІ3): δ 8,14 (1Н, д, J=2,4 Гц), 7,76 (1Н, д,д, J1=8,6 Гц, J2=2,4 Гц), 7,39 (2Н, д, J=8,8 Гц), 6,87 (2Н, м), 6,76 (3Н, м), 4,53 (2Н, д, т, J1=47,6 Гц, J2=4,2 Гц), 4,50 (2Н, т, J=4,8 Гц), 3,85 (3Н, + м), 3,70 (5Н, м), 2,99 (6Н. с). МСВР (El) m/z обчислено для [C21H28N2O4] 372,2049. ПРИКЛАД 2 Синтез сполуки 6 (Е)-2-Хлор-5-(4-нітростирил)піридин (3) У розчин діетил-(4-нітробензил)фосфонату (546 мг, 2,0 ммоль) і 2-хлор-5-піридилальдегіду (283 мг, 2,0 ммоль) у метанолі (5,0 мл) поступово додають метоксид натрію (1 М розчин у 21 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 60 метанолі, 5,0 мл). Потім реакційну суміш кип'ятять зі звороті [им холодильником протягом 1 години. Після охолодження до 0°С жовту речовину, що випала в осад, відфільтровують і промивають холодним метанолом, і одержують продукт 3 (458 мг, вихід 88%), що 1 використовують безпосередньо на наступній стадії без додаткового очищення. Н ЯМР (200 МГц, CDCІ3): δ 8,53 (1Н, д, J=2,4 Гц), 8,25 (2H, д, J=8,8 Гц), 7,85 (1Н, д,д, J1=8,4 Гц, J2=2,4 Гц), 7,65 (2Н, д, J=8,8 Гц), 7,36 (1Н, д, J=8,4 Гц), 7,19 (2Н, с), МСВР (El) m/z обчислено для + [C13H9CІN2O2] 260,0353. (Е)-2-(2-(2-(2-Фторетокси)етокси)етокси)-5-(4-нітростирил)піридин (4) У захисній атмосфері азоту при 0°С 2-(2-(2-фторетокси)етокси)етанол (60 мг, 0,39 ммоль) додають у суміш гідриду нагрію (26,4 мг, 60% дисперсія у мінеральному маслі, 0,66 ммоль) і безводного ДМФА (5 мл). Суміш перемішують при кімнатній температурі протягом півгодини, і додають сполуку 3 (85,7 мг, 0,33 ммоль). Потім реакційну суміш гріють при 100°С протягом 2 годин і охолоджують. Додають етилацетат і воду, органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як розчинник, що проявляє, 2% МеОН у DCM), і одержують продукт 4 (37 мг, вихід 30%). 1 Н ЯМР (200 МГц, CDCІ3): δ 8,22 (3Н, д, J=8,8 Гц), 7,84 (1Н, д, д, J1=8,6 Гц, J2=2,4 Гц), 7,61 (2Н, д, J=8,8 Гц), 7,20 (1Н, д, J=16,4 Гц), 7,02 (1Н, д, J=16,4 Гц), 6,84 (1Н, д, J=8,6 Гц), 4,53 (2Н, д, т, J1=47,6 Гц, J2=4,2 Гц), 4,52 (2Н, т, J=4,8 Гц), 3,85 (3Н, м), 3,70 (5Н, м); МСВР (El) m/z обчислено + для [C19H21FN2O5] 376,1435. (Е)-2-(2-(2-(2-Фторетокси)етокси)етокси)-5-(4-аміностирил)піридин (5) Сполуку 4 (34 мг, 0,09 ммоль) розчиняють в етанолі (5 мл), і потім додають хлорид олова(Н) (51,4 мг, 0,27 ммоль) і концентровану НСI (0,25 мл). Реакційну суміш кип'ятять зі зворотним холодильником протягом 2 годин і охолоджують. Використовують 2 н розчин NaOH для доведення рН до 10. Додають дихлорметан і органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як 1 розчинник, що проявляє, 3% МеОН у DCM), і одержують продукт 5 (18 мг, вихід 58%). H ЯМР (200 МГц, CDCІ3): δ 8,14 (1H, д, J=2,2 Гц), 7,76 (1Н, д,д, J1=8,6 Гц, J2-2,4 Гц), 7,32 (2Н, д, J=8,4 Гц), 6,80 (5Н, м), 4,53 (2Н, д, т, J1=47,6 Гц, J2=4,2 Гц), 4,49 (2Н, т, J=4,8 Гц), 3,85 (3Н, м), 3,70 (5Н, + м), 1,8-3,0 (2Н, ушир.); МСВР (El) m/z обчислено для [C19H23FN2O3] 376,1693. (Е)-2-(2-(2-(2-Фторетокси)етокси)етокси)-5-(4-метиламіностирил)піридин (6) До розчину сполуки 5 (15,8 мг, 0,046 ммоль) у метанолі (5 мл) додають метоксид натрію (1 Μ розчин у метанолі, 0,23 мл), а потім додають параформальдегід (6,6 мг, 0,23 ммоль). Реакційну суміш кип'ятять зі зворотним холодильником протягом 1,5 години і потім охолоджують до 0°С на льодяній бані. Обережно додають борогідрид натрію (10,4 мг, 0,27 ммоль). Суміш знову кип'ятять зі зворотним холодильником протягом І години і охолоджують. Додають дихлорметан і воду. Органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як розчинник, що проявляє, 3% МеОН 1 у DCM), і одержують продукт 6 (12 мг, вихід 73%). Н ЯМР (200 МГц, CDCІ3): δ 8 14 (1Н, д, J=2,2 Гц), 7,76 (1Н, д,д, J1=8,6Гц, J2=2,4 Гц), 7,35 (2Н, д, J=8,6 Гц), 6,92 (1Н, д, J=16,4 Гц), 6,80 (1Н, д, J=16,4 Гц), 6,76 (2Н, д, J=8,6 Гц), 4,53 (2R д. т, J1=47,6 Гц, J2=4,2 Гц), 4,49 (2Н, т, J=4,8 Гц), 3,85 + (3Н, м), 3,70 (5Н, м), 2,88 (2H, с). МСВР (EІ) m/z обчислено для [C20H25FN2O3] 360,1849, ПРИКЛАД 3 Синтез сполуки 10 (Е)-2-(2-(2-(2-Гідроксіетокси)етокси)етокси)-5-(4-нітростирил)піридин (7) Суміш карбонату калію (158,7 мг, 1,15 ммоль), сполуки 3 (100 мг, 0,38 ммоль) і триетиленгліколю (576 мг, 3,8 ммоль) у безводному ДМ ФА (5,0 мл) запаюють в ампулі для мікрохвильової електропечі (від Biotage) і піддають опроміненню мікрохвилями (система Biotage Initiator) при 180°С протягом 25 хв. Після охолодження до кімнатної температури додають воду, і реакційну суміш екстрагують етилацетатом. Органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як 1 розчинник, що проявляє, 4% МеОН у DCM), і одержують продукт 7 (110 мг, вихід 77%). Н ЯМР (200 МГц, CDCІ3): δ 8,20 (3Н, м), 7,83 (1Н. д,д, J1.=8,6 Гц, J2=2,4 Гц), 7,61 (2Н, д, J=8,8 Гц), 7,10 (2Н, м) 6,84 (1Н, д, J=8,6 Гц), 4,53 (2Н, т, J=4,8 Гц), 3,88 (2Н, т, J=4,8 Гц), 3,71 (6Н, м), 3,61 (2Н, + м), 2,10 (1Н, ушир.). МСВР (El) m/z обчислено для [C19H22N2O6] 374,1478, (Е)-2-(2-(2-(2-Гідроксіетокси)етокси)етокси)-5-(4-аміностирил)піридин (8) До розчину сполуки 7 (100 мг, 0,27 ммоль) в етанолі (10 мл) додають хлорид олова(ІІ) (202,8 мг, 1,07 ммоль), а потім додають концентровану НСI (0,5 мл). Реакційну суміш кип'ятять зі зворотним холодильником протягом 1,5 години і потім охолоджують до 0°С. Жовту речовину, що випала в осад, збирають фільтрацією і потім суспендують в етилацетаті. Додають насичений розчин NaHCO3 для доведення рН до 9. Органічний шар відділяють, промивають 22 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як розчинник, що проявляє, 5% МеОН у DCM), і одержують продукт 8 (710 мг, вихід 1 76%). H ЯМР (200 МГц, CDCІ3): δ 8,12 (1Н, д, J=2,4 Гц), 7,73 (1H, д,д, J1=8,6 Гц, J2=2,4 Гц), 7,29 (2Н, д, J=8,5 Гц), 6,84 (2Н, м), 6,75 (1Н, д, J=8,6 Гц), 6,69 (2Н, д, J=8,5 Гц), 4,48 (2Н, т, J=4,8 Гц), 3,86 (2Н, т, J=4,8 Гц), 3,71 (6Н, м). 3,60 (2Н, м), 3,32 (3Н, ушир.), МСВР (El) m/z обчислено для + [C19H24N2O4] 344,1736. (Е)-2-(2-(2-(2-Гідроксіетокси)етокси)етокси)-5-(4-диметиламіно-стирил)піридин (9) До розчину сполуки 8 (65 мг, 0,19 ммоль) і параформальдегіду (57 мг, 1,9ммоль) в оцтовій кислоті (10 мл) додають ціаноборогідрид натрію (36 мг, 0,57 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі і виливають на лід. Використовують бікарбонат натрію для доведення рН до 9. Реакційну суміш екстрагують етилацетатом. Органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як розчинник, що проявляє. 5% МеОНу DCM), і 1 одержують продукт 9 (67 мг, вихід 95%). Н ЯМР (200 МГц, СDСІ3): δ 8,14 (1Н, д, J=2,4 Гц), 7,76 (1Н, д,д, J1=8,6 Гц, J2=2,4 Гц), 7,39 (2Н, д, J=8,8 Гц), 6,87 (2Н, м), 6,76 (3Н, м), 4,50 (2Н, т, J=4,8 Гц), 3,87 (2Н, т, J=4,8 Гц), 3,70 (6Н, м), 3,61 (2Н, м), 2,98 (6Н, с), 2,49 (1Н, ушир.), МСВР (El) m/z + обчислено для [C21H28N2O4] 372,2049. (Е)-2-(2-(2-(2-Тозилоксіетокси)етокси)етокси)-5-(4-диметиламіно-стирил)піридин (10) До розчину сполуки 9 (43 мг, 0,116 ммоль) у піридині (5,0 мл) при 0°С додають тозилхлорид (52 мг, 0,27 ммоль). Реакційну суміш перемішують при 0°С протягом 1 години і потім нагрівають до кімнатної температури і перемішують протягом 3 годин. Додають воду, і реакційну суміш екстрагують етилацетатом. Органічний шар відділяють, промивають сольовим розчином, сушать над безводним сульфатом натрію і упарюють. Залишок очищають ПТШХ (як розчинник, 1 що проявляє, 4% МеОН у DCM), і одержують продукт 10 (25 мг, вихід 41%). Н ЯМР (200 МГц, CDCІ3): δ 8,14 (1Н, д, J=2,0 Гц), 7,76 (3Н, м), 7,39 (2Н, д, J=8,8 Гц), 7,32 (2Н, д, J=8,0 Гц), 6,87 (2Н, м), 6.75 (3Н, м), 4,46 (211, т, J=4,6 Гц), 4,16 (2Н, т, J=4,8 Гц), 3,81 (2Н, т, J=4,8 Гц), 3,66 (6Н, + м), 2,99 (6Н, с), 2,43 (3Н, с), МСВР (El) m/z обчислено для [C28H34N2O6S] 526,2138. ПРИКЛАД 4 Синтез сполуки 11а a. Синтез проміжних сполук 18 і 19 2-Гідрокси-3-бром-5-йодпіридин (18) Дотримуючись раніше розробленого способу (Meana A. et al., Synlett., 2003, 1678-1682) одержують сполуку Ї8 з N-йодсукциніміду (2,48 г, 11,0 ммоль) і 3-бром-2-гідроксипіридину 17 1 (1,74 г, 10,0 ммоль) у вигляді блідо-коричневої твердої речовини (2,55 г, 85%). Н ЯМР (ДМСОd6) δ 12.21 (ушир, с, 1Н), 8,08 (д, 1H, J=2,3 Гц), 7,71 (д, 1Н, J=2,3 Гц). {2-[2-(2-Фторетокси)етокси]етокси}-3-бром-5-йодпipидин (19) До суспензії 18 (0,393 г, 1,3 ммоль), 2-(2-(2-фторетокси)етокси)етанолу (0,200 г, 1,3 ммоль) і PPh3 (0,511 г, 1,95 ммоль) у 10 мл ТГФ при перемішуванні при -10°С додають по краплях розчин діізопропілазодикарбоксилату (DІAD, 0,394 г, 1,95 ммоль) у 5 мл ТГФ. Льодяну баню з сіллю видаляють, і реакційну суміш витримують при кімнатній температурі (r.t.) протягом 2 годин. Реакційний розчин концентрують, і залишок очищають ФХ (FC) (МеОН/СНСІ3, 1/99), і одержують 1 19 - безбарвну в'язку рідину (0,423 г, 75%). Н ЯМР δ 8.21 (д, 1Н, J=2,0 Гц), 8,02 (д, 1Н, J=2,0 13 Гц), 4,66 (т, 1Н, J=4,1 Гц), 4,50-4,39 (м, 3Н), 3,89-3,64 (м, 8Н). С ЯМР δ 159,4, 151,2, 148,5, + 108,5 84,9, 81,6, 81,5, 71,1, 71,0, 70,8, 70,4, 69,3, 66,9. МСВР обчислено для C11H14BrFINO3 (M ), 432,9186; знайдено, 432,9173. b. Синтез сполуки 11a (Е)-(5-Бром-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4-диметиламінофеніл)етилен (11a) Суміш 4-диметиламіностиролу (0,110 г, 0,75 ммоль), 19 (0,217 г, 0,5 ммоль), K2СО3 (0,173 г, 1,25 ммоль), броміду тетрабутиламонію (ТВАВ, 0,322 г, 1,0 ммоль) і ацетату паладію (Pd(OAc)2), 0,006 г, 0,025 ммоль) у 2 мл ДМФА звільняють від кисню, продуваючи азотом протягом 15 хв., і потім гріють при 65°С протягом 2 годин. Реакційну суміш охолоджують до r.t. і піддають стандартній обробці з етилацетатом (EtOAc). Сирий продукт реакції очищають ФХ (ЕtOАс/гeксан, 30/70), і одержують 11а у вигляді світло-жовтої твердої речовини (0,178 г, 79%). 1 Н ЯМР δ 8,08 (д, 1Н, J=2,1 Гц), 8,00 (д, 1Н, J=2,1 Гц), 7,39 (д, 2Н, J=8,8 Гц), 6,92 (д, 1Н, J=16,3 Гц), 6,74 (д, 1Н, J=16,3 Гц), 6,72 (д, 2Н, J=8,1 Гц), 4,69 (т, 1Н, J=4,2 Гц), 4,55 (т, 2Η, J=4,8 Гц), 13 4,45 (т, 1Н, J=4,2 Гц), 3,94-3,68 (м, 8Н), 3,00 (с, 6Н). С ЯМР δ 158,3, 150,4, 143,5, 138,0, 129,6, 129,5, 127,7, 125,2, 118,8, 112,5, 107,5, 85,0, 81,6, 71,2, 71,0, 70,8, 70,4, 69,6, 66,7, 40,5. МСВР + обчислено для C21H26BrFN2O3 (M ), 452,1111; знайдено, 452,1099. 60 23 UA 97802 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПРИКЛАД 5 Синтез сполуки 11b (Е)-(5-Бром-6-{2-[2-(2-фторетокси)етокси]етокси}гиридин-3-іл)-2-(4-метиламінофеніл)етилен (11b) Сполуку 11b одержують з 4-метиламіностиролу (0,073 г, 0.55 ммоль) і 19 (0,217 г, 0,50 1 ммоль) у вигляді світло-жовтої в'язкої рідини (0.113 г. вихід 52%). Н ЯМР δ 8,07 (д, 1Н, J=2,1 Гц), 8,00 (д, 1Н, J=2,1 Гц), 7,35 (д, 2H J=8,6 Гц), 6,91 (д, 1Н, J=16,3 Гц), 6,74 (д, 1Н, J=16,3 Гц), 6,60 (д, 2Н, J=8,6 Гц). 4,69 (т, 1Н, J=4,2 Гц), 4,5.) (т, 2Н, J=4,8 Гц), 4,45 (т, 1Н, J=4,2 Гц), 3,94-3,68 13 (м, 8H), 2,88 (с, 3Н). С ЯМР δ 158,4, 149,5, 143,6, 138,0, 129,8, 129,5, 127,9, 126,1, 118,9, 112,6, + 107,5, 85,0, 81,7, 71.2, 71,1, 70,8, 70,4, 69,6, 66,8, 30,7. МСВР обчислено для C20H24BrFN2O3 (M ), 438,0954, знайдено, 438,0967. ПРИКЛАД 6 Синтез сполуки 11е (Е)-(5-Бром-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-[4-N-метил-4-N-(третбутилоксикарбоніл)амінофеніл]етилен (11с) Сполуку 11с одержують з 4-N-метил-4-N-(трет-бутилоксикарбоніл)аміно-стиролу (0,219 г, 1 0,94 ммоль) і 19 (0,273 г, 0,63 ммоль) у вигляді білої в'язкої рідини (0,319 г, вихід 94%). Н ЯМР δ 8,12 (д, 1Н, J=2,1 Гц), 8,03 (д, 1Н, J=2,1 Гц), 7,44 (д, 2Н, J=8,6 Гц), 7,25 (д, 2Н, J=9,0 Гц), 6,94 (д, 2Н, J=2,1 Гц), 4,69 (т, 1Η, J=4,2 Гц), 4,56 (т, 2Η, J=4,9 Гц), 4,45 (т, 1Η, J=4,2 Гц), 3,94-3,68 (м, 8Н), 13 3,28 (с, 3Н), 1,48 (с, 9Н). С ЯМР δ 158,8, 154,5, 144,0, 143,5, 138,2, 133,6, 128,5, 128,4, 126,8, 126,6, 125,4, 122,9, 107,4, 84,8, 81,4, 80,4, 71,0, 70,9, 70,6, 70,2, 69,4, 66,7, 53,5, 37,1, 28,4. МСВР + обчислено для C25H32BrFN2O5 (М ), 538,1479; знайдено, 538,1476. (Е)-(5-Бром-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4-ацетокси-феніл)етилен (11d) Сполуку 11d одержують з 4-ацетоксистиролу (0,122 г, 0,75 ммоль) і 19 (0,217 г, 0,5 ммоль) у 1 вигляді білої в'язкої рідини (0,181 г, вихід 77%). Н ЯМР δ 8,12 (д, 1Н, J=2,1 Гц), 8,03 (д, 1Н, J=2,1 Гц), 7,50 (д, 2Н, ί=8,6 Гц), 7,10 (д, 2Н, J=8,6 Гц), 6,94 (д, 2Н, J=3,3 Гц), 4,69 (т, 1Н, J=4,2 Гц), 13 4,56 (т, 2Η, J=4,9 Гц), 4,45 (т, 1Н, J=4,2 Гц), 3,94-3,68 (м, 8Н), 2,32 (с, 3Н), 1,48 (с, 9Н). С ЯМР δ 169,3, 158,9, 150,3, 144,1, 138,2, 134,5, 128,24, 128,16, 127,4, 123,4, 121,9, 107,5, 84,8, 81,5, 71,0, + 70,9, 70,6, 70,3, 69,4, 66,7, 21,1. МСВР обчислено для С21Н23ВrFNO5 (M ), 467,0744; знайдено, 467,0731. (Ε)-(5-Βром-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4-гідрокси-феніл)етилен (11e) Ацетат 11d (0,145 г, 0,31 ммоль) і KО2СО3 (0,064 г, 0,465 ммоль) поміщають у суміш ЕtOН/ТГФ (5 мл/5 мл), і реакційну суміш перемішують при r.t. протягом 2 годин. Після стандартної обробки з EtOAc сирий продукт реакції очищають ПТШХ, і одержують 11е у вигляді 1 білої твердої речовини (0,128 г, 97%). Η ЯМР δ 8,07 (д, 1Н, J=2,1 Гц), 7,99 (д, 1Н, J=2,1 Гц), 7,35 (д, 2Н, J=8,6 Гц). 6,96-6,74 (м, 4Н), 5,22 (ушир, с, ІН), 4,69 (т, 1Н, J=4,2 Гц), 4,54 (т, 2Η, J=4,8 Гц), 13 4,45 (т, 1Η, J=4,2 Гц), 3,94-3,68 (м, 8H). C ЯМР δ 158,5, 156,4, 143,6, 138,2. 129,2. 129,0, 127,9, 120,7, 116,0, 107,6, 84,9, 81,6, 71,1, 71,0, 70,8, 70,4, 69,6, 66,8. МСВР обчислено для + C19H21BrFNO4 (M ), 425,0638; знайдено, 425,0651. ПРИКЛАД 7 Синтез сполуки 12b (Е)-(5-три-Бутил станіл-6-{2-[2-(2-фторетокси)стокси]стокси}піридин-3-іл)-2-(4метиламінофеніл)етилен (12b) Сполуку 12b одержують з 11b (0,069 г, 0,156 ммоль) у вигляді світло-жовтого масла (0,068 г, 1 вихід 68%). H ЯМР δ 8,10 (д, 1Н, J=2,5 Гц), 7,80 (д, 1Н, J=2,5 Гц), 7,36 (д, 2Н, J=8,6 Гц), 6,92 (д, 1Н, J=16,3 Гц), 6,80 (д, 1Н, J=16,3 Гц), 6,61 (д, 2Н, J=8,6 Гц), 4,69 (т, 1Н, J=4,2 Гц), 4,45 (т, 3Н, J=5,1 Гц), 3,83 (т, 3Н, J=4,4 Гц), 3,71-3,66 (м, 5Н), 2,88 (с, 3Н), 1,68-1,48 (м, 6Н), 1,43-1,25 (м, 6Н), 13 1,15-1,02 (м, 6Н), 0,91 (т, 9Η, J=7,1 Гц). С ЯМР δ 166,8, 149,1, 145,4, 143,6, 127,8, 127,7, 127,0, 123,8, 121,2, 112,6, 85,0, 81,6, 71,1, 70,9, 70,8, 70,5, 70,1, 65,0, 30,8, 29,5, 29,3, 29,1, 28,1, 27,5, + 26,9, 13,9, 13,4, 13,3, 9,9, 6,6, 6,4. МСВР обчислено для C32H51FN2O3Sn (M ), 650,2906; знайдено, 650,2894. ПРИКЛАД 8 Синтез сполуки 12е (Е)-(5-три-Бутилстаніл-6-{2-[2-(2-фторетокси)етокси]етокси}піридин[-3-іл)-2-(4гідроксифеніл)етилен (12е) Сполуку 12е одержують з 11е (0,032 г, 0,075 ммоль) у вигляді білої в'язкої рідини (0,040 г, 1 вихід 84%). Н ЯМР δ 8,11 (д. 1H, J=2,5 Гц), 7,82 (д, 1Н, J=2,5 Гц), 7,39 (д, 2Н, J=8,6 Гц), 6,986,74 (м. 4Н), 5,19 (ушир, с, 1Н), 4,71-4,66 (м, 1H), 4,48-4,43 (м, 3Н), 3,90-3,62 (м, 8Н), 1,70-1,02 24 UA 97802 C2 13 5 10 15 20 25 30 35 40 45 50 55 (м, 18Н), 0,91 (т, 9Η, J=7,1 Гц). С ЯМР δ 166,9, 156,0, 145,4, 144,0, 130,1, 127,9, 127,6, 127,4, 124,3, 123,0, 115,9, 85,0, 81,6, 71,0, 70,9, 70,7, 70,5, 70,0, 65,2, 29,5, 29,3, 29,1, 28,0. 27,5, 26,9, + 13,9, 13,4, 13,3, 9,9 6,6, 6,4. МСВР обчислено для С31Н48FNО4Sn (M ), 637,2589; знайдено, 637,2573. ПРИКЛАД 9 Синтез сполуки 13а (Е)-(5-три-Бутилстаніл-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4диметиламінофеніл)етилен (12а) Суміш 11а (0,052 г, 0,115 ммоль). біс(трибутилолова) ((Bu3Sn)2, 0,333 г, 0,57 ммоль) і тетракістрифенілфосфінпаладію (Pd(PPh3)4, 0,013 г, 10 мол. %) у толуолі гріють при 110°С протягом 18 годин. Реакційний розчин охолоджують до к.т. і обробляють 5 мл 10% KF. Після енергійного перемішування ще протягом 0,5 години стандартна обробка з EtOAc і подальша ФХ 1 (ЕtOАс/гексан, 25/75) дають 12а у вигляді світло-жовтого масла (0,052 г, 68%). H ЯМР δ 8,11 (д, 1Н, J=2,5 Гц). 7,81 (д, 1Н, J=2,5 Гц). 7,41 (д, 2Н, J=8,8 Гц), 6,93 (д, 1H, J=16,5 Гц), 6,81 (д, 1Н, J=16,5 Гц), 6,72 (д, 2Н, J=8,7 Гц), 4,69 (т, 1H, J=4,2 Гц), 4,46 (т, 3Н, J=4,9 Гц), 3,83 (т, 3Н, J=4,8 Гц), 3,71-3,66 (м, 5Н), 3,00 (с, 6H), 1,68-1,48 (м, 6Н), 1,43-1,21 (м, 6Н), 1,15-1,02 (м, 6Н), 0,91 (т, 13 9Н, J=7,1 Гц). С ЯМР δ 166,7, 150,2, 145,4, 143,6, 127,8, 127,7, 127,5, 126,0, 123,7, 121,2, 112,6, 85,0, 81,6, 71,0, 70,8, 70,7, 70,4, 70,0, 65,0, 40,6, 29,5, 29,3, 29,1, 28,1, 27,5, 26,9, 13,9, 13,4. 13,3, + 9,9, 6,6, 6,4. МСВР обчислено для С33Н53FN2О3Sn (М ), 664,3062; знайдено, 664,3037. (Е)-(5-Иод-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4-диметиламінофеніл)етилен (13а) До розчину 12а (0,114 г, 0,172 ммоль) у ТГФ (3 мл) при охолодженні на льодяній бані додають по краплях розчин йоду (I2, 0,063 г, 0,024 ммоль) у ТГФ (2 мл). Після закінчення додавання реакційну суміш перемішують при 0°С протягом 1 години. Після стандартної обробки з СН2СІ2 сирий продукт реакції очищають ФХ (EtOAc/гексан, 25/75), і одержують світло-жовту 1 тверду речовину 13а (0,037 г, 48%). H ЯМР δ 8,22 (д, 1Н, J=2,1 Гц), 8,10 (д, 1Н, J=2,1 Гц), 7,38 (д, 2Н, J=8,8 Гц), 6,92 (д, 1Н, J=16,3 Гц), 6,72 (д, 1Н, J=16,3 Гц), 6,71 (д, 2Н, J=8,8 Гц), 4,72-4,67 13 (м, 1H), 4,54-4,44 (м, 3Н), 3,93-3,69 (м, 8Н), 3,00 (с, 6Н). С ЯМР δ 160,4, 150,5, 144,6, 144,55, 129,8, 129,5, 127,8, 125,3, 118,8, 112,6, 85,1, 81,7, 80,6, 71,3, 71,1, 70,8, 70,5, 69,6, 67,1, 40,6. + МСВР обчислено для C21H26FIN2O3 (М ), 500,0972; знайдено, 500,0959. ПРИКЛАД 10 Синтез сполуки 13b (E)-(5-три-Бутилстаніл-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-]4-N-метил-4-N(трет-бутилоксикарбоніл)амінофеніл]етилен (12с) Сполуку 12с одержують з 11с (0,072 г, 0,133 ммоль) у вигляді білої в'язкої рідини (0,077 г, 1 вихід 77%). Н ЯМР δ 8,14 (д, 1Н, J=2,5 Гц), 7,83 (д, 1Н, J=2,5 Гц), 7,46 (д, 2Н, J=8,6 Гц), 7,23 (д, 2Н, J=8,5 Гц), 6,96 (с, 2Н), 4,70-4,66 (м, 1Н), 4,49-4,42 (м, 3Н), 3,86-3,66 (м, 8Н), 3,28 (с, 3Н), 1,8013 1,02 (м, 27Н), 0,90 (т, 9Н, J=7,1 Гц). С ЯМР δ 167,3, 146,1, 143,8, 143,2, 134,6, 127,0 126,8, 126,6, 125,7, 125,4, 124,1, 85,0, 81,6, 80,6, 71,1, 70,9, 70,8, 70,5, 70,0, 65,1, 37,4, 29,5, 29,3, 29,1, + 28,1, 27,5, 26,9, 13,9, 13,4, 9,9, 6,4. МСВР обчислено для C37H59FIN2O3Sn (М ), 750,343; знайдено, 750,3425. (Е)-(5-Йод-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-[4-N-метил-4-N-(третбутилоксикарбоніл)амінофеніл]етилен (13с) Сполуку 13с одержують з 12с (0,024 г, 0,032 ммоль) у вигляді білої в'язкої рідини (0,018 г, 1 98%). Н ЯМР δ 8,25 (д, 1Н, J=1,6 Гц), 8,13 (д, 1Н, J=1,6 Гц), 7,44 (д, 2Н, J=8.4 Гц), 7,24 (д, 2Н, J=8,4 Гц), 6,97 (д, 1Н, J=16,4 Гц), 6,86 (д, 1Н, J=16,4 Гц), 4,69 (т, 1Н, J=4,1 Гц), 4,53 (т, 2H, J=4,8 13 Гц), 4,45 (т, 1Н, J=4,1 Гц), 3,94-3,69 (м, 8Н), 3,28 (с, 3Н), 1,47 (с, 9Н). С ЯМР δ 161,0, 154,8, 145,3, 144,9, 143,7, 133,9, 128,9, 128,6, 126,8, 125,7, 123,1, 85,1, 81,7, 80,7, 77,4, 71,3, 71,1, 70,9, + 70,5, 69,6, 67,2, 37,4, 28,6. МСВР обчислено для C21H26FIN2O3 (M ), 500,0972; знайдено, 500,0959. (Е)-(5-Йод-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4-метиламінофеніл)етилен (13b) До розчину 13е (0,014 г, 0,024 ммоль) і 2,6-лутидину (28 мкл, 0,24 ммоль) у 2 мл СН2СІ2 при перемішуванні при 0°С додають триметилсилілфталат (34 мкл, 0,19 ммоль). Через 15 хв. реакційний розчин піддають стандартній обробці з СН 2СІ2. Сирий продукт реакції очищають 1 ПТШХ, і одержують світло-жовту в'язку рідину 13b (0,010 г, 88%). Н ЯМР δ 8,22 (д, 1H, J=2,1 Гц), 8,10 (д, 1Н, J=2,1 Гц), 7,34 (д, 2Н, J=8,6 Гц), 6,91 (д, 1Н, J=16,3 Гц), 6,70 (д, 1Н, J=16,3 Гц), 13 6,60 (д. 2Н, J=8,6 Гц), 4,71-4,67 (м, 1H), 4,54-4,43 (м, 3Н), 3,94-3,69 (м, 9Н), 2,88 (с, 3Н). С ЯМР δ 160,5, 149,5, 144,6, 129,8, 129,7, 128,0, 126,3, 118,9, 112,6. 85,1, 81,7, 80,6, 77,4, 71,3, 71,2, 25 UA 97802 C2 + 5 10 15 20 25 30 35 40 45 50 55 70,9, 70,5, 69,7, 67,2, 30,8. МСВР обчислене для С20H24FIN2О3 (М ), 486,0816; знайдено, 486,0818. ПРИКЛАД 11 Синтез сполуки 13е (Е)-(5-три-Бутилстаніл-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4гідроксифеніл)етилен (12е) Сполуку 12с одержують з 11е (0,032 г, 0,075 ммоль) у вигляді білої в'язкої рідини (0,040 г, 1 вихід 84%). H ЯМР δ 8,11 (д, 1Н, J=2,5 Гц), 7,82 (д, 1Н, J=2,5 Гц), 7,39 (д, 2Н, J=8,6 Гц), 6,986,74 (м, 4Н), 5,19 (ушир, с, 1Н), 4,71-4,66 (м, 1Н), 4:48-4,43 (м, 3Н), 3,90-3,62 (м, 8Н), 1,70-1,02 (м, 13 18Н), 0,91 (т, 9Н, J=7,1 Гц). С ЯМР δ 166,9, 156,0, 145,4, 144,0, 130,1, 127,9, 127,6, 127,4, 124,3, 123,0, 115,9, 85,0, 81,6, 71,0, 70,9, 70,7, 70,5, 70,0, 65,2, 29,5, 29,3, 29,1, 28,0, 27,5, 26,9, 13,9, + 13,4, 13,3, 9,9, 6,6, 6,4. МСВР обчислено для C31H48FNO4Sn (M ), 637,2589; знайдено, 637,2573. (Е)-(5-Йод-6-{2-[2-(2-фторетокси)етокси]етокси}піридин-3-іл)-2-(4-гідроксифеніл)етилен (13е) Сполуку 13е одержують з 12е (0,012 г, 0,019 ммоль) у вигляді білої твердої речовини (0,008 1 г, 90%). Н ЯМР δ 8,21 (д, 1Н, J=2,1 Гц), 8,08 (д, 1Н, J=2,1 Гц), 7,33 (д, 2Н, J=8,6 Гц), 6,94-6,69 (м, + 4Н), 4,71-4,67 (м, 1Н), 4,53-4,43 (м, 3Н), 3,94-3,69 (м; 8Н). МСВР обчислено для C19H21FINO4 (M ), 473,0499; знайдено, 473,0498. ПРИКЛАД 12 Синтез сполуки 14а 2-Гідрокси-3-бром-5-йодпіридин (9b) До суспензії 18 (див. приклад 4 вище) (0,906 г, 3,0 ммоль), 2-(третбутилдиметилсиланілокси)етанолу (0,554 г, 3,15 ммоль) і PPh3 (0,944 г, 3,6 ммоль) у 20 мл ТГФ при перемішуванні при 10°С додають по краплях розчин діізопропілазодикарбоксилату (DIAD) (0,728 г, 3,6 ммоль) у 10 мл ТГФ. Льодяну баню з сіллю видаляють, і реакційну суміш вигримують при r.t. протягом 2 годин. Реакційний розчин концентрують, і залишок очищають ФХ (ЕtOАс/гексан, 5/95), і одержують 2-(трет-бутилдиметилсиланілокси)етокси-3-бром-5-йодпіридин 1 безбарвну в'язку рідину (0,995 г, 72%). Н ЯМР δ 8.23 (д, 1Н, J=2,0 Гц), 8,05 (д, 1Н, J=2,0 Гц), 4,42 (т, 2Н, J=4,9 Гц), 3,98 (т, 2Н, J=4,9 Гц), 0,90 (с, 9Н), 0,10 (с, 6Н). МСВР обчислено для + C12H18BrINO2Si (М-СН3 ), 441,9335; знайдено, 441,9312. (Е)-[5-Бром-6-(2-гідроксіетокси)піридин-3-іл]-2-(4-диметиламінофеніл)етилен (14а) Сполуку 14а одержують з 4-диметиламіностиролу (0,031 г. 0,212 ммоль) і 110 (0,073 г, 0,212 1 ммоль) у вигляді світло-жовтої твердої речовини (0,022 г, вихід 29%). Н ЯМР δ 8,07 (д, 1Н, J=2,1 Гц), 8,03 (д, 1Н, J=2,1 Гц), 7,39 (д, 2Н, J=8,8 Гц), 6,94 (д, 1Н, J=16,3 Гц), 6,78-6,69 (м, 3Н), 13 4,57-4,52 (м, 2H), 3,99 (т, 2Н, J=4,3 Гц), 3,21 (ушир, с, 1Н), 3,00 (с, 6Н). С ЯМР δ 158,3, 150,4, 143,0, 138,2, 129,9, 129,8, 127,6, 124,9, 118,3, 112,3, 107,5, 69,6, 62,1, 40,3. МСВР обчислено для + C17H19BrN2O2 (М ). 362,063; знайдено, 362,0629. ПРИКЛАД 13 Синтез сполуки 14b (Е)-[5-Бром-6-(2-гідроксіетокси)піридин-3-іл]-2-(4-метиламінофеніл)етилен (14b) Сполуку 14b одержують з 4-метиламіностиролу (0,140 г, 1,05 ммоль) і 110 (0,241 г, 0,7 1 ммоль) у вигляді світло-жовтої в'язкої рідини (0,241 г, вихід 61%). Н ЯМР δ 8,07 (д, 1Н, J=2,1 Гц), 8,03 (д, 1Н, J=2,1 Гц), 7,35 (д, 2Н, J=8,6 Гц), 6,93 (д, 1Н, J=16,3 Гц), 6,74 (д, 1Н, J=16,3 Гц), 13 6,61 (д, 2Н, J=8,6 Гц), 4,57-4,52 (м, 2Н), 3,99 (ушир, с, 2Н), 3,18 (ушир, с, 1H), 2,88 (с, 3Н). С ЯМР δ 149,6, 143,3, 138,5, 130,1, 130,0, 128,0, 126,0, 118,6, 112,6, 107,7, 69,8, 62,2, 30,7. МСВР + обчислено для C17H19BrN2O2 (M ), 348,0473; знайдено, 348,0468. ПРИКЛАД 14 Синтез сполуки 14d (Е)-[5-Бром-6-(2-гідроксіетокси)піридин-3-іл]-2-(4-ацетоксифеніл)етилен (14d) Сполуку 14d одержують з 4-ацетоксистиролу (0,130 г, 0,80 ммоль) і 10 (0,244 г, 0,7 ммоль) у 1 вигляді білої в'язкої рідини (0,031 г, вихід 12%). Η ЯМР δ 8,12 (д, 1Н, J=2,1 Гц), 8,08 (д, 1Н, J=2,1 Гц), 7,50 (д, 2.11, J=6,8 Гц), 7,11 (д, 2Н, J=6,8 Гц), 6,95 (д, 2Н, J=5,2 Гц), 4,58-4,54 (м, 2H) 4,01 (ушир, с, 2Н), 3,08 (ушир, с, 1Н), 2,32 (с, 3Н). ПРИКЛАД 15 Синтез сполуки 14е (Е)-[5-Бром-6-(2-гідроксіетокси)піридин-3-іл]-2-(4-гідроксифеніл)етилен (14е) Процедурою, подібною до процедури, описаної при одержанні 11е, з ацетату 14d (0,031 г, 1 0,082 ммоль) одержують сполуку 14е у вигляді білої твердої речовини (0,020 г, 73%). H ЯМР (ДМСО-d6) δ 9,60 (ушир, с, 1Н), 8,31 (с, 1Н), 8,23 (с, 1H), 7.39 (д, 2H, J=8,3 Гц), 7,19 (д, 1Н, J=16,8 Гц), 6.94 (д, 1Н, J=16,6 Гц), 6,77 (д, 2Н, J=8,3 Гц), 4,35 (т, 2Н, J=5,1 Гц), 3,73 (т, 2Н, J=-5,1 Гц). 26 UA 97802 C2 13 5 10 15 20 25 30 35 40 45 50 55 60 G ЯМР (ДМСО-d6) δ 157,9, 157,4, 143,7, 138,1, 129,2, 129,0, 127,8, 119,8, 115,6, 106,7, 68,4, + 59,2. МСВР обчислено для C15H14BrNO3 (M ), 335,0157; знайдено, 335.0165. ПРИКЛАД 16 Синтез сполуки 15е (Е)-[5-три-Бутилстаніл-6-(2-гідроксіетокси)піридин-3-іл]-2-(4-гідроксифеніл)етилен (15е) Сполуку 15е одержують з 14е (0,031 г, 0,092 ммоль) у вигляді білої в'язкої рідини (0,012 г, 1 вихід 24%). Н ЯМР δ 8,07 (д, 1Н, J=2,5 Гц), 7,85 (д, 1Н, J=2,5 Гц), 739 (д, 2Н, J=8,6 Гц), 6,99-6,80 (м, 4Н), 5,97 (ушир., с, 1H), 5,01 (ушир, с, 1Н), 4,50-4,46 (м, 2Н), 3,98-3,94 (м, 2Н), 1,69-1,01 (м, 13 18Н), 0,91 (т, 9H,J=7,1 Гц). С ЯМР δ 167,2, 156,0, 144,9, 144,7, 144,5, 130,1, 128,0, 127,96, 124,7, 122,8, 156,0, 69,9, 63,4, 2,9,9, 29,5, 29,3, 29,1, 28,1, 27,5, 26,9, 13,9, 13,6, 13,5, 10,1, 6,7, + 6,6. МСВР обчислено для С27Н41NO3Sn (М ), 547,2108; знайдено, 547,2112. ПРИКЛАД 17 Синтез сполуки 16а (Е)-[5-три-Бутилстаніл-6-(2-гідроксіетокси)пiридин-3-іл]-2-(4-диметиламіно-феніл)етилен (15а) Сполуку 15а одержують з 14а (0,100 г, 0/275 ммоль) у вигляді світло-жовтого масла (0,105 і, 1 вихід 66%). Н ЯМР δ 8,10 (д, 1Н, J=2,5 Гц), 7,85 (д, 1Н, J=2,4 Гц), 7,41 (д, 2Н, J=8,7 Гц), 6,95 (д, 1Н, J=16,3 Гц), 6,81 (д, 1Н, J=16,6 Гц), 6,73 (д, 2Н, J=8,8 Гц), 4,48-4,44 (м, 2Н), 3,96-3,92 (м, 2Н), 13 2,99 (є, 6H), 1,68-1,01 (м, 18Н), 0,92 (т, 9Н, J=7,2 Гц). С ЯМР δ 166,6, 150,1, 144,5, 144,1, 128,2, 128,1, 127,4, 125,6, 124,0, 120,5, 112,4, 69,4, 63,0, 40,4, 29,0, 27,2, 13,6, 9,8. МСВР обчислено + для C29H46N2O2Sn (M ), 574,2581; знайдено, 574,2584. (Е)-[5-Йод-6-(2-гідроксіетокси)піридин-3-іл]-2-(4-диметиламінофeніл)етилен (16а) Сполуку 16а одержують з 15а (0,011 г, 0,019 ммоль) у вигляді світло-жовтої твердої 1 речовини (0,004 г, 50%). Н ЯМР δ 8,25 (с, 1Н), 8,10 (с, 1Η), 7,39 (д, 2Н, J=8,6 Гц), 6,94 (д, 1H, J=16,3 Гц), 6,76-6,70 (м, 3Н), 4,51 (т, 2Η, J=4,2 Гц), 4,02-3,95 (м, 2Н), 3,19 (с, 1Н), 3,00 (с, 6H). + МСВР обчислено для C17H19IN2O2 (M ), 410,0491; знайдено, 410,0489. ПРИКЛАД 18 Синтез сполуки 16b (Е)-[5-три-Бутилстаніл-6-{2-гідроксіетокси)піридин-3-іл]-2-(4-метиламінофеніл)етилен (15b) Сполуку 15b одержують з 14b (0,052 г, 0,15 ммоль) у виглядi світло-жовтого масла (0,059 г, 1 вихід 64%). H ЯМР δ 8,08 (д. 1Н, J=2,5 Гц), 7,84 (д, 1H, J=2,4 Гц), 7,37 (д, 2Н, J=8,6 Гц), 6,93 (д, 1Н, J=16,3 Гц), 6,80 (д, 1H, J=16,4 Гц), 6,61 (д, 2H, J=8,6 Гц). 4,48-4,43 (м, 2Н), 3,95-3,91 (м, 2Н), 13 2.88 (с, 3Н), 1,69-1,01 (м, 18H), 0,91 (т, 9Н, J=7,1 Гц). С ЯМР δ 166,9, 149,2, 144,7, 144,3, 128,4, 128,3, 127,8, 126,7, 124,2, 120,7, 112,6, 69,6, 63,2, 30,8, 29,5, 29,3, 29,1, 28,0, 27,5, 26,9, 13,9, + 13,5, 13,4, 10,0, 6,6, 6,5. МСВР обчислено для C28H44N2O2Sn (М ), 560,2425; знайдено, 560,2419. (Е)-[5-Йод-6-(2-гідроксіетокси)піридин-3-іл]-2-(4-метиламінофеніл)етилен (16b) Сполуку 16b одержують з 15b (0,032 г, 0,057 ммоль) у вигляді світло-жовтої твердої 1 речовини (0,005 г, 21%). Н ЯМР δ 8,24 (д, 1Н, J=2,1 Гц), 8,09 (д, 1Н, J=2,0 Гц), 7,36 (д, 2Н, J=8,5 Гц), 6,92 (д, 1Н, J=16,3 Гц), 6,76-6,64 (м, 3Н), 4,53-4,49 (м, 2Н), 4,01-3,96 (м, 2Н), 2,96 (с, 1Н), + 2,89 (с, 3Н), МСВР обчислено для C16H17IN2O2 (M ), 396,0335; знайдено, 396,0335. ПРИКЛАД 19 Йодування радіоактивними ізотопами 125 Йодовані радіоактивним ізотопом йоду [ І] сполуки 13а, 13b, 16а, 16b і 16е одержують реакцією йоддестанілування з відповідних попередників сполук трибутилолова відповідно до способу, описаного раніше (посилання). До суміші 50 мкл попередника сполуки трибутилолова 125 (4 мкг/мкл EtOH), 50 мкл 1 н НСI і [ l]NaI (1-5 мКі, закуповують у Perkin Elmer) додають пероксид водню (50 мкл, 3%, мас/об.) у запаяній ампулі. Реакції дають можливість проходити протягом 5-10 хв. при кімнатній температурі і припиняють, додаючи 100 мкл насич. розчину NaHSO3. Реакційну суміш екстрагують етилацетатом (3 × 1 мл), і екстракти нейтралізують 1,5 мл насиченого розчину бікарбонату натрію. Об'єднані екстракти упарюють досуха. Залишок розчиняють у 100 мкл EtOH і очищають ВЕРХ з використанням колонки з оберненою фазою (аналітична колонка Phenomenex Gemini С18, 4,6 × 250 мм, 5 мкм. буфер CH3CN/форміат амонію (1 мМ), 8/2 або 7/3; швидкість потоку 0,5-1,0 мл/хв.) Продукти реакції без додавання носія упарюють досуха і знову розчиняють у 100% EtOH (1 мкКі/мкл), i зберігають при -20°С до 6 тижнів для досліджень на тваринах і аутографічних досліджень. ПРИКЛАД 20 Дослідження зв'язування 125 [ Θ]IΜΡΥ з питомою активністю 2200 Кі/ммоль і радіохімічною чистотою більше 95% одержують з використанням стандартної реакції йоддестанілування і очищають за допомогою спрощеної мініколонки з С-4, як описано раніше у Kung М.-Р., Ноu С, Zhuang Z.-P., Cross A.J., 27 UA 97802 C2 5 10 15 20 25 30 35 40 45 Maier D.L., Kung H.F., "Characterization of IMPY as potential imaging agent for b-amyloid plaques in double transgenic PSAPP mice", Eur. J. Nucl. Med. Моl. Imaging, 2004, 31, 1136-1145. Аналізи конкурентного зв'язування здійснюють у пробірках з боросилікатного скла 12 × 75 мм. Реакційна 125 суміш містить 50 мкл об'єднаних гомогенатів головного мозку з AD (20-50 мкг), 50 мкл [ I]IMPY -5 -10 (0,04-0,06 нМ, розведеного у PBS) і 50 мкл інгібіторів (10 -10 М, серійно розведених у PBS, що містить 0,1% бичачого сироваткового альбуміну) у кінцевому об'ємі 1 мл. Неспецифічне зв'язування визначають у присутності 600 нМ IMP Υ у таких же аналітичних пробірках. Суміш інкубують при 37°С протягом 2 годин, і зв'язану і вільну радіоактивність розділяють фільтрацією під вакуумом через фільтри Whatman GF/B з використанням клітинного харвестера Brandel M24R з подальшим промиваннями 2 × 3 мл PBS при кімнатній температурі. Фільтри, що містять ліганд зі зв'язаним 1-125, обчислюють у лічильнику гамма-квантів (Packard 5000) з ефективністю підрахунку 70%. В умовах аналізу специфічно зв'язана фракція складає менше 15% від загальної радіоактивності. Результати експериментів з інгібування піддають нелінійному регресійному аналізу з використанням аналізу даних з рівноважного зв'язування, з яких обчислюють величини К;. Фігури 1 і 6 показують величини К; для вибраних сполук за даним винаходом. ПРИКЛАД 21 Плівкова ауторадіографія 18 Індикатори з [ F]. Зрізи головного мозку хворих AD одержують, заморожуючи головний мозок на подрібненому сухому льоді і нарізаючи на зрізи товщиною 20 мікронів. Зрізи інкубують 18 з індикаторами з [ F] (200000-250000 відліків за хв./200 мкл) протягом 1 години при кімнатній температурі. Потім зрізи занурюють у насичений розчин Li2СО3 у 40% ЕtOН (два промивання по дві. хвилини) і промивають 40%) ЕtOН (одне 2-хвилинне промивання), а потім обполіскують 18 водою протягом 30 секунд. Після сушіння зрізи, мічені F, експонують на плівку Kodak MR протягом ночі. Результати, одержані на плівці, відображені на фіг. 2. 125 Індикатори з [ І]. Для того, щоб порівняти різні зонди з використанням схожих зрізів тканини головного мозку людини, збирають макрозрізи головного мозку від 6 суб'єктів з підтвердженою AD і одного контрольного суб'єкта. Наявність і локалізацію бляшок на зрізах підтверджують імуногістохімічним забарвлюванням моноклональними антитілами проти Αβ 4G8 (Sigma). Зрізи 125 інкубують з індикаторами з [ І] (200000-250000 відліків за хв./200 мкл) протягом 1 години при кімнатній температурі. Потім зрізи занурюють у насичений розчин Li2CO3 у 40% EtOH (два промивання по дві хвилини) і промивають 40% EtOH (одне 2-хвилинне промивання), а потім 125 обполіскують водою протягом 30 секунд. Після сушіння зрізи, мічені І, експонують на плівку Kodak Biomax MR протягом ночі. ПРИКЛАД 22 Розподіл в органах у мишей У цей час під анестезією ізофураном 0,15 мл 0,1% розчину бичачого сироваткового 125 альбуміну, що містить індикатори з [ І] (5-10 мкКі), ін'єктують безпосередньо у хвостову вену мишам lCR (самці, 22-25 г). Мишей (n = 3 для кожного моменту часу) умертвляють цервікальною дислокацією у встановлені моменти часу після ін'єкції. Органи, що представляють інтерес, дістають і зважують, і підраховують радіоактивність автоматичним лічильником гамма-квантів. Дозу, у відсотках, на орган обчислюють, порівнюючи число імпульсів тканини з придатним чином розведеними аліквотами речовини, що ін'єктується. Загальну активність крові обчислюють при припущенні, що вона складає 7% від загальної маси тіла. Обчислюють % дози/г зразків, порівнюючи число імпульсів для зразків з числом імпульсів розведеної вихідної дози. Таблиця 1 18 Біорозподіл у мишей ICR після iv ін'єкції [ F]10 у 5% EtOH у фізіологічному розчині (% дози/г, середнє для 3 мишей ± сер.-кв. відх.) Орган Кров Серце М'яз Легені Нирки Селезінка 2 хв. 6,05 ± 0,33 0,75 ± 0,14 7,03 ± 1,30 1,07 ± 0,20 6,38 ± 0,95 0,43 ± 0,11 30 хв. 2,65 ± 0,22 0,17 ± 0,03 8,58 ± 0,26 0,30 ± 0,01 1,68 ± 0,11 0,15 ± 0,05 28 1 година 3,48 ± 0,47 0,22 ± 0,03 10,62±2,59 0,35 ± 0,07 1,96 ± 0,21 0,13 ± 0,03 2 годиви 2Д5 ± 0,25 0,18 ± 0,08 5,96 ± 0,06 0,20 ± 0,36 0,96 ± 1,58 0,10 ± 0,17
ДивитисяДодаткова інформація
Назва патенту англійськоюStyrylpyridine compounds useful and use thereof in imaging amyloid deposits
Автори англійськоюKung Hank F., Kung Mei-Ping
Назва патенту російськоюСтирилпиридиновые производные и их применение для связывания и визуализации амилоидных бляшек
Автори російськоюКунг Ханк Ф., Кунг Мей-Пинг
МПК / Мітки
МПК: A61K 51/04, A61K 101/02, C07D 213/63
Мітки: амілоїдних, візуалізації, зв'язування, стирилпіридинові, застосування, бляшок, похідні
Код посилання
<a href="https://ua.patents.su/37-97802-stirilpiridinovi-pokhidni-i-kh-zastosuvannya-dlya-zvyazuvannya-i-vizualizaci-amilodnikh-blyashok.html" target="_blank" rel="follow" title="База патентів України">Стирилпіридинові похідні і їх застосування для зв’язування і візуалізації амілоїдних бляшок</a>
Попередній патент: Комбайн, механізм повторного обмолоту для комбайна та спосіб вибіркового повторного обмолоту недомолоту у комбайні
Наступний патент: Генерація звітів з інтегрованим контролем якості
Випадковий патент: Пристрій для захисту двигуна внутрішнього згоряння












