Похідні стильбену та їх застосування для зв’язування та візуалізації амілоїдних бляшок
Формула / Реферат
1. Сполука формули І
 I
I
або її фармацевтично прийнятна сіль або проліки, де:
R1 вибирають з групи, яка складається з:
a) NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, (CH2)d18F, і d являє собою ціле число від 1 до 4,
b) гідрокси,
d) гідроксі(С1-4)алкілу,
e) галогену,
f) ціано,
h) нітро,
j) галоген(С1-4)алкілу і
k) формілу;
R1’ вибирають з групи, яка складається з
a) 123I,125І, 131I,18F, 76Br,
b) водню,
с) 18F(С1-4)алкілу,
d) [18F(С1-4)алкіл]аміно,
e) [18F(С1-С4)алкіл]алкіламіно,
f) 18F(С1-С4)алкокси;
R2 вибирають з групи, що складається з
і) гідроксилу, С1-4алкокси, (С1-С4)алкілоксоалк(С1-С4)окси, (С1-С4)алкілоксо(С1-С4)-алкілоксо(С1-С4)алкокси, (С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкокси, карбоксі(С1-С4)алкілу, галоген(С1-С4)алкокси, галоген(С1-С4)алкілоксо(С1-С4)алкокси, галоген(С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)-алкілокси, галоген(С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілокси, галоген(С1-С4)алкілу, феніл(С1-С4)алкілу, 18F(С1-С4)алкокси, 18F(С1-С4)алкілоксо(С1-С4)алкокси, 18F(С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілокси, 18F(С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілокси, 18F(С1-С4)алкілу;
ii) 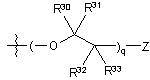 ,
,
де q являє собою ціле число від одиниці до 10; Z вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного (С1-4)алкокси, 18F заміщеного бензилокси, необов'язково 18F-фенокси, 18F заміщеного феніл(C1-4)алкілу, 18F заміщеного арилокси і 18F заміщеного С6-10арилу, необов'язково F-фенілу; і R30, R31, R32 і R33, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу;
iii) 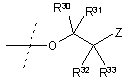 ,
,
де Z, R30, R31, R32 і R33 є такими, як описано вище;
iv) 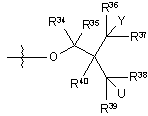 ,
,
де Y вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси, необов'язково 18F-фенокси і 18F заміщеного С6-10арилу, необов'язково 18F-фенілу;
U вибирають з групи, що складається з водню, гідрокси, 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси, необов'язково 18F-фенокси і 18F заміщеного С6-10арилу, необов'язково 18F-фенілу; і
R34, R35, R36, R37, R38, R39 і R40, у кожному випадку, незалежно вибирають з групи, що складається з водню, гідрокси, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; і
R7 і R8, у кожному випадку, незалежно вибирають з групи, яка складається з галогену, водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу, де принаймні один з R7 і R8 являє собою галоген.
2. Сполука за п. 1, де R1’ являє собою водень, і R1 являє собою NRaRb, де Ra і Rb незалежно являють собою водень або С1-4алкіл.
3. Сполука за п. 1, де R7 і R8 являють собою водень або фтор, де принаймні один з R7 і R8 являє собою фтор.
4. Сполука за п. 2, де R2 являє собою
ii) 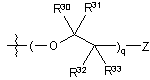 ,
,
де Z, R30, R31, R32 і R33 є такими, як описано вище.
5. Сполука за п. 4, де q являє собою ціле число від 2 до 5.
6. Сполука за п. 5, де R30, R31, R32 і R33 являють собою, у кожному випадку, водень.
7. Сполука за п. 4, де q являє собою ціле число від 3 до 4.
8. Сполука за п. 7, де Z являє собою 18F.
9. Сполука за п. 8, яка має наступну формулу:
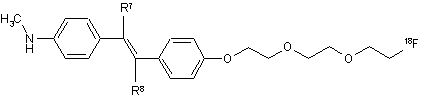 ,
,
де один з R7 і R8 являє собою водень, а інший являє собою галоген.
10. Сполука за п. 8, яка має наступну формулу:
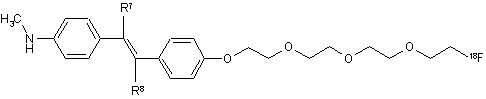 ,
,
де один з R7 і R8 являє собою водень, а інший являє собою галоген.
11. Сполука за п. 2, де R2 являє собою
iii) 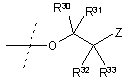 ,
,
де Z, R30, R31, R32 і R33 є такими, як описано вище.
12. Сполука за п. 11, де Z являє собою 18F.
13. Сполука за п. 12, де R30, R31, R32 і R33, у кожному випадку, являють собою водень.
14. Сполука за п. 2, де R2 являє собою
iv) 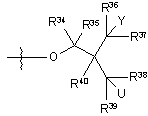 ,
,
де U являє собою гідрокси.
15. Сполука за п. 14, де R34, R35, R36, R37, R38, R39 і R40, у кожному випадку, являють собою водень.
16. Сполука за п. 15, яка має наступну структуру:
 ,
,
де один з R7 і R8 являє собою водень, а інший являє собою галоген.
17. Сполука формули II
 , II
, II
де
R1 вибирають з групи, яка складається з:
a) NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, (CH2)dX, де X являє собою 18F, і d являє собою ціле число від 1 до 4, або обидва Ra і Rb являють собою кисень з утворенням нітрогрупи,
b) гідрокси,
с) С1-4алкокси, і
d) гідроксі(С1-4)алкілу;
R2 вибирають з групи, що складається з:
i) 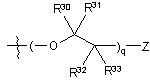 ,
,
де q являє собою ціле число від одиниці до 10; Z вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного (С1-4)алкокси, 18F заміщеного бензилокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси і 18F заміщеного С6-10арилу, і R30, R31, R32 і R33, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу;
ii) 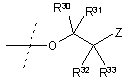 ,
,
де Z, R30, R31, R32 і R33 є такими, як обговорювалося вище,
iii) 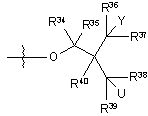 ,
,
де Y вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси і 18F заміщеного С6-10арилу;
U вибирають з групи, яка складається з водню, гідрокси, 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси і 18F заміщеного С6-10арилу; і
R34, R35, R36, R37, R38, R39 і R40, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; і
R7 і R8, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу.
18. Сполука за п. 17, де R1 являє собою NRaRb, де Ra і Rb незалежно являють собою водень або С1-4алкіл.
19. Сполука за п. 18, де R2 являє собою
i) 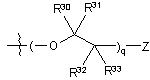 ,
,
де Z, R30, R31, R32 і R33 є такими, як описано вище.
20. Сполука за п. 19, де q являє собою ціле число від 2 до 5.
21. Сполука за п. 19, де кожний з R7 і R8 являє собою водень.
22. Сполука за п. 21, де R30, R31 R32 і R33 являють собою, у кожному випадку, водень.
23. Сполука за п. 22, яка має наступну формулу:
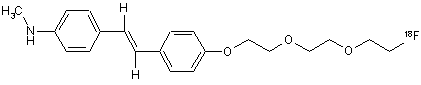 .
.
24. Сполука за п. 22, яка має наступну формулу:
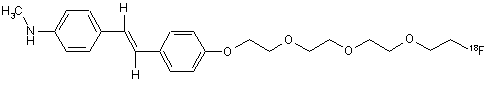 .
.
25. Сполука за п. 18, де R2 являє собою
ii) 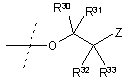 ,
,
де Z, R30, R31, R32 і R33 є такими, як описано вище.
26. Сполука за п. 25, де Z являє собою 18F.
27. Сполука за п. 26, де кожний з R7 і R8 являє собою водень.
28. Сполука за п. 27, де R30, R31, R32 і R33 являють собою, у кожному випадку, водень.
29. Сполука за п. 18, де R2 являє собою
iii) 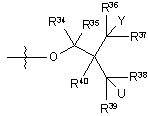 ,
,
де U являє собою гідрокси.
30. Сполука за п. 29, де R34, R35, R36, R37, R38, R39 і R40, у кожному випадку, являють собою водень.
31. Сполука за п. 30, яка має наступну структуру:
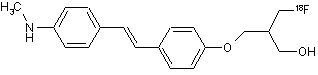 .
.
32. Сполука формули III
 , III
, III
де
n являє собою ціле число між 1 і 4;
R7 і R8, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; і
R41 вибирають з групи, яка складається з гідрокси і NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, або обидва Ra і Rb являють собою кисень з утворенням нітрогрупи.
33. Сполука за п. 32, де n дорівнює одиниці, і R41 вибирають з групи, яка складається з гідрокси, метиламіно та диметиламіно.
34. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1, 17 або 32.
35. Діагностична композиція для візуалізації амілоїдних відкладень, яка містить радіоактивно мічену сполуку за будь-яким з пп. 1, 17 або 32.
36. Спосіб візуалізації зображення амілоїдних відкладень, в якому здійснюють:
a) введення ссавцеві кількості, яка виявляється, діагностичної композиції за п. 35;
b) надання часу, достатнього для зв'язування міченої сполуки з амілоїдними відкладеннями; і
с) виявлення міченої сполуки, зв'язаної з одним або декількома амілоїдними відкладеннями.
37. Спосіб інгібування агрегації амілоїдних бляшок у ссавця, в якому вводять композицію за п. 34 у кількості, достатній для інгібування агрегації амілоїдних бляшок.
38. Сполука, вибрана з групи, яка складається з:
2-[2-(4-{2-[4-(трет-бутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етилового ефіру метансульфонової кислоти (10а);
2-{2-[2-(4-{2-[4-(трет-бутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}етилового ефіру метансульфонової кислоти (10b);
2-(2-{2-[2-(4-{2-[4-(трет-бутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}-етоксі)етилового ефіру метансульфонової кислоти (10с) і
2-(2-[2-{2-[2-(4-{2-[4-(трет-бутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}-етоксі]етоксі)етилового ефіру метансульфонової кислоти (10d).
39. Спосіб одержання сполуки формули [18F]12:
 ,
,
де n=2, 3, 4 або 5, в якому проводять взаємодію сполуки формули 10:
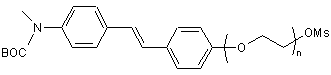
з [18F]F-/Kryptofix 222 ("K222") і K2С3 у ДМСО та обробку одержаної суміші водною НСl.
40. Набір, для одержання візуалізуючих агентів, який містить пляшечку, де пляшечка містить фізіологічно придатний розчин проміжної сполуки формули І у концентрації та при значенні рН, які придатні для оптимальних умов комплексоутворення.
41. Сполука, вибрана з групи, яка складається з:
трет-бутилового ефіру [4-(2-{4-[2-(2-гідроксіетоксі)етокси]феніл}вініл)феніл]-метилкарбамінової кислоти (9а);
трет-бутилового ефіру {4-[2-(4-{2-[2-(2-гідроксіетоксі)етоксі]етокси}феніл)вініл]феніл}-метилкарбамінової кислоти (9b);
трет-бутилового ефіру (4-{2-[4-(2-{2-[2-(2-гідроксіетоксі)етоксі]етоксі}етокси)феніл]-вініл}феніл)метилкарбамінової кислоти (9с) і
трет-бутилового ефіру [4-(2-{4-[2-(2-{2-[2-(2-гідроксіетоксі)етоксі]етоксі}етоксі)етокси]-феніл}вініл)феніл]метилкарбамінової кислоти (9d).
Текст
1. Сполука формули І R1 R7 R1' (13) 91996 (11) I або її фармацевтично прийнятна сіль або проліки, де: R1 вибирають з групи, яка складається з: a) NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, (CH2)d18F, і d являє собою ціле число від 1 до 4, b) гідрокси, d) гідроксі(С1-4)алкілу, e) галогену, f) ціано, h) нітро, j) галоген(С1-4)алкілу і k) формілу; R1’ вибирають з групи, яка складається з 123 125 131 18 76 a) I, І, I, F, Br, b) водню, с) 18F(С1-4)алкілу, d) [18F(С1-4)алкіл]аміно, e) [18F(С1-С4)алкіл]алкіламіно, f) 18F(С1-С4)алкокси; R2 вибирають з групи, що складається з і) гідроксилу, С1-4алкокси, (С1-С4)алкілоксоалк(С1С4)окси, (С1-С4)алкілоксо(С1-С4)-алкілоксо(С1С4)алкокси, (С1-С4)алкілоксо(С1-С4)алкілоксо(С1С4)алкілоксо(С1-С4)алкокси, карбоксі(С1-С4)алкілу, галоген(С1-С4)алкокси, галоген(С1-С4)алкілоксо(С1С4)алкокси, галоген(С1-С4)алкілоксо(С1С4)алкілоксо(С1-С4)-алкілокси, галоген(С1С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілоксо(С1С4)алкілокси, галоген(С1-С4)алкілу, феніл(С118 18 С4)алкілу, F(С1-С4)алкокси, F(С118 С4)алкілоксо(С1-С4)алкокси, F(С1С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілокси, 18 F(С1-С4)алкілоксо(С1-С4)алкілоксо(С1С4)алкілоксо(С1-С4)алкілокси, 18F(С1-С4)алкілу; C2 R2 UA R8 (19) (21) a200708065 (22) 19.12.2005 (24) 27.09.2010 (86) PCT/US2005/045682, 19.12.2005 (31) 60/636,696 (32) 17.12.2004 (33) US (31) 60/686,395 (32) 02.06.2005 (33) US (46) 27.09.2010, Бюл.№ 18, 2010 р. (72) КУНГ ХАНК Ф., US, КУНГ МЕЙ-ПІНГ, US, ЧЖУАНГ ЧЖИ-ПІНГ, US (73) ДЗЕ ТРАСТІЗ ОФ ЮНІВЕРСІТІ ОФ ПЕНСІЛЬВАНІЯ, US (56) LIU QIBO ET AL: "Stereoselective preparation of (E)-(1,2-difluoro-1,2-ethenediyl) bis[tributylstannane] and stereospecific synthesis of (E)-1,2difluorostilbenes." ORGANIC LETTERS 2 MAY 2002, vol. 4, no. 9, 2 May 2002 (2002-05-02), pages 14831485, XP002514428 ISSN: 1523-7060 HAN SUN YOUNG ET AL: "Design and synthesis of lignostilbene-alpha,beta-dioxygenase inhibitors." BIOORGANIC & MEDICINAL CHEMISTRY LETTERS 22 APR 2002, vol. 12, no. 8, 22 April 2002 (2002-04-22), pages 1139-1142, XP002514429 ISSN: 0960-894X YOUNG, W.R.; AVIRAM, A.; COX, R.J.: "Stilbene Derivatives. A New Class of Room Temperature Nematic Liquids" JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, vol. 94, no. 11, 1972, pages 3976-3981, XP002514430 FIALKOV,YU.A. ET AL.: "TRANSMISSION OF ELECTRONIC EFFECTS IN CONJUGATED PERFLUOROPROPYLENE SYSTEMS" JOURNAL OF ORGANIC CHEMISTRY USSR, vol. 14, 1978, pages 939-946, XP009112014 KUKHAR, V. P.; SAGINA, E. I.; KIRSANOV, A. V.: "pDialkylaminobenzalkhloridy" ZHURNAL ORGANICHESKOI KHIMII, vol. XI, no. 9, 1975, pages 1922-1929, XP009112041 PAUL RUGGLI: "Uber die Bildung eines zweifach kondensierten Indols" BERICHTE DER DEUTSCHEN CHEMISCHEN GESELLSCHAFT, 1917, pages 883893, XP002514431 US 5 521 213 US 2003/149250 A1 2 3 R30 ( 91996 4 8. Сполука за п.7, де Z являє собою 18F. 9. Сполука за п.8, яка має наступну формулу: R31 O )q Z R32 R ii) , де q являє собою ціле число від одиниці до 10; Z вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного (С118 F заміщеного бензилокси, необов'яз4)алкокси, ково 18F-фенокси, 18F заміщеного феніл(C118 F заміщеного арилокси і 18F заміщеного 4)алкілу, С6-10арилу, необов'язково F-фенілу; і R30, R31, R32 і R33, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С14алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; R7 H3C N H 33 R30 R31 Z O R7 H3C N H R36 R37 O R40 R38 U R39 iv) , де Y вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С118 F заміщеного арилокси, необов'язково 4)алкілу, 18 F-фенокси і 18F заміщеного С6-10арилу, необов'я18 зково F-фенілу; U вибирають з групи, що складається з водню, гідрокси, 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси, необов'язково 18F-фенокси і 18F заміщеного С618 F-фенілу; і 10арилу, необов'язково 34 35 36 37 38 R , R , R , R , R , R39 і R40, у кожному випадку, незалежно вибирають з групи, що складається з водню, гідрокси, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; і R7 і R8, у кожному випадку, незалежно вибирають з групи, яка складається з галогену, водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4алкокси, С14алкілу і гідроксі(С1-4)алкілу, де принаймні один з R7 і R8 являє собою галоген. 2. Сполука за п.1, де R1’ являє собою водень, і R1 являє собою NRaRb, де Ra і Rb незалежно являють собою водень або С1-4алкіл. 3. Сполука за п.1, де R7 і R8 являють собою водень або фтор, де принаймні один з R7 і R8 являє собою фтор. 4. Сполука за п.2, де R2 являє собою R30 ( R31 O )q R32 R33 Z ii) , де Z, R30, R31, R32 і R33 є такими, як описано вище. 5. Сполука за п.4, де q являє собою ціле число від 2 до 5. 6. Сполука за п.5, де R30, R31, R32 і R33 являють собою, у кожному випадку, водень. 7. Сполука за п.4, де q являє собою ціле число від 3 до 4. 18F R31 Z O R R , iii) де Z, R30, R31, R32 і R33 є такими, як описано вище. 12. Сполука за п.11, де Z являє собою 18F. 13. Сполука за п.12, де R30, R31, R32 і R33, у кожному випадку, являють собою водень. 14. Сполука за п.2, де R2 являє собою 33 32 Y O O 8 R33 R35 O O R , де один з R7 і R8 являє собою водень, а інший являє собою галоген. 11. Сполука за п.2, де R2 являє собою iii) , де Z, R30, R31, R32 і R33 є такими, як описано вище; R34 O R8 , де один з R7 і R8 являє собою водень, а інший являє собою галоген. 10. Сполука за п.8, яка має наступну формулу: R30 R32 18F O O R36 R34 R35 Y R37 O R38 R40 U R39 iv) , де U являє собою гідрокси. 15. Сполука за п.14, де R34, R35, R36, R37, R38, R39 і R40, у кожному випадку, являють собою водень. 16. Сполука за п.15, яка має наступну структуру: R7 H3C 18F N H O OH R8 , де один з R7 і R8 являє собою водень, а інший являє собою галоген. 17. Сполука формули II R7 R1 R8 R2 , II де R1 вибирають з групи, яка складається з: a) NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, (CH2)dX, де X являє собою 18F, і d являє собою ціле число від 1 до 4, або обидва Ra і Rb являють собою кисень з утворенням нітрогрупи, b) гідрокси, с) С1-4алкокси, і d) гідроксі(С1-4)алкілу; R2 вибирають з групи, що складається з: 5 R30 91996 R31 6 H H3C N H ( O )q R32 Z R33 i) , де q являє собою ціле число від одиниці до 10; Z вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного (С118 F заміщеного бензилокси, 18F заміще4)алкокси, ного феніл(С1-4)алкілу, 18F заміщеного арилокси і 18 F заміщеного С6-10арилу, і R30, R31, R32 і R33, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С14алкілу і гідроксі(С1-4)алкілу; R30 R31 Z O R R ii) , де Z, R30, R31, R32 і R33 є такими, як обговорювалося вище, 32 33 R36 R34 R35 H H3C N H O O 18F H . 25. Сполука за п.18, де R2 являє собою R30 R31 Z O R R ii) , де Z, R30, R31, R32 і R33 є такими, як описано вище. 26. Сполука за п.25, де Z являє собою 18F. 27. Сполука за п.26, де кожний з R7 і R8 являє собою водень. 28. Сполука за п.27, де R30, R31, R32 і R33 являють собою, у кожному випадку, водень. 29. Сполука за п.18, де R2 являє собою 33 32 R36 Y R34 R35 Y R37 O R38 R40 U R39 iii) , де Y вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С118 18 F заміщеного арилокси і F заміщеного 4)алкілу, С6-10арилу; U вибирають з групи, яка складається з водню, гідрокси, 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси і 18F заміщеного С6-10арилу; і R34, R35, R36, R37, R38, R39 і R40, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; і R7 і R8, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу. 18. Сполука за п.17, де R1 являє собою NRaRb, де Ra і Rb незалежно являють собою водень або С14алкіл. 19. Сполука за п.18, де R2 являє собою O O O R37 R40 ( O H . 24. Сполука за п.22, яка має наступну формулу: O R30 18F O O R31 )q Z R32 R i) , 30 31 де Z, R , R , R32 і R33 є такими, як описано вище. 20. Сполука за п.19, де q являє собою ціле число від 2 до 5. 21. Сполука за п.19, де кожний з R7 і R8 являє собою водень. 22. Сполука за п.21, де R30, R31 R32 і R33 являють собою, у кожному випадку, водень. 23. Сполука за п.22, яка має наступну формулу: 33 R38 U R39 iii) , де U являє собою гідрокси. 30. Сполука за п.29, де R34, R35, R36, R37, R38, R39 і 40 R , у кожному випадку, являють собою водень. 31. Сполука за п.30, яка має наступну структуру: H3C 18F N H O OH . 32. Сполука формули III R7 R41 (CH2)n R8 18F , III де n являє собою ціле число між 1 і 4; R7 і R8, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4алкокси, С1-4алкілу і гідроксі(С1-4)алкілу; і R41 вибирають з групи, яка складається з гідрокси і NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, або обидва Ra і Rb являють собою кисень з утворенням нітрогрупи. 33. Сполука за п.32, де n дорівнює одиниці, і R41 вибирають з групи, яка складається з гідрокси, метиламіно та диметиламіно. 34. Фармацевтична композиція, яка містить сполуку за будь-яким з пп.1, 17 або 32. 35. Діагностична композиція для візуалізації амілоїдних відкладень, яка містить радіоактивно мічену сполуку за будь-яким з пп.1, 17 або 32. 36. Спосіб візуалізації зображення амілоїдних відкладень, в якому здійснюють: 7 a) введення ссавцеві кількості, яка виявляється, діагностичної композиції за п.35; b) надання часу, достатнього для зв'язування міченої сполуки з амілоїдними відкладеннями; і с) виявлення міченої сполуки, зв'язаної з одним або декількома амілоїдними відкладеннями. 37. Спосіб інгібування агрегації амілоїдних бляшок у ссавця, в якому вводять композицію за п.34 у кількості, достатній для інгібування агрегації амілоїдних бляшок. 38. Сполука, вибрана з групи, яка складається з: 2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етилового ефіру метансульфонової кислоти (10а); 2-{2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}етилового ефіру метансульфонової кислоти (10b); 2-(2-{2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}етоксі)етилового ефіру метансульфонової кислоти (10с) і 2-(2-[2-{2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}етоксі]етоксі)етилового ефіру метансульфонової кислоти (10d). 39. Спосіб одержання сполуки формули [18F]12: Даний винахід стосується нових біоактивних сполук, способів діагностичної візуалізації з використанням радіоактивно мічених сполук і способіводержання радіоактивно мічених сполук. Хвороба Альцгеймера (AD) являє собою прогресуюче нейродегенеративне порушення, яке характеризується погіршенням пізнавальних здатностей, необоротною втратою пам'яті, порушенням орієнтації та погіршенням мови. Посмертне дослідження відділів мозку хворих AD виявляє наявні у великій кількості старечі бляшки, які складаються з (SPs) амілоїд-β (Αβ) пептидів і численні нейрофібрилярні клубки (NFTs), утворені волокнами високо фосфорилованих тау-білків (огляди останнього часу та додаткові посилання див. у Ginsberg, С. D., et al., "Molecular Pathology of Alzheimer's Disease and Related Disorders," in Cerebral Cortex: Neurodegenerative and Age-related Changes in Structure and Function of Cerebral Cortex, Kluwer Academic/Plenum, NY (1999), pp.603-654; Vogelsberg-Ragaglia, V., et al., "Cell Biology of Tau and Cytoskeletal Pathology in Alzheimer's Disease," Alzheimer's Disease, Lippincot, Williams & Wilkins, Philadelphia, PA (1999), pp.359372). Амілоїдозиз являє собою стан, який характеризується накопиченням різних нерозчинних фібрилярних білків у тканинах пацієнта. Амілоїдне 91996 8 N H [18F]F * O n [18F]12 , де n=2, 3, 4 або 5, в якому проводять взаємодію сполуки формули 10: N BOC OMs O n з [18F]F-/Kryptofix 222 ("K222") і K2С3 у ДМСО та обробку одержаної суміші водною НСl. 40. Набір, для одержання візуалізуючих агентів, який містить пляшечку, де пляшечка містить фізіологічно придатний розчин проміжної сполуки формули І у концентрації та при значенні рН, які придатні для оптимальних умов комплексоутворення. 41. Сполука, вибрана з групи, яка складається з: трет-бутилового ефіру [4-(2-{4-[2-(2гідроксіетоксі)етокси]феніл}вініл)феніл]метилкарбамінової кислоти (9а); трет-бутилового ефіру {4-[2-(4-{2-[2-(2гідроксіетоксі)етоксі]етокси}феніл)вініл]феніл}метилкарбамінової кислоти (9b); трет-бутилового ефіру (4-{2-[4-(2-{2-[2-(2гідроксіетоксі)етоксі]етоксі}етокси)феніл]вініл}феніл)метилкарбамінової кислоти (9с) і трет-бутилового ефіру [4-(2-{4-[2-(2-{2-[2-(2гідроксіетоксі)етоксі]етоксі}етоксі)етокси]феніл}вініл)феніл]метилкарбамінової кислоти (9d). відкладення утворюється при агрегації амілоїдних білків з наступним додатковим об'єднанням агрегатів і/або амілоїдних білків. Утворення та накопичення агрегатів β-амілоїдних (Αβ) пептидів у мозку є вирішальними факторами розвитку та прогресування AD. Крім ролі амілоїдних відкладень, у хворобі Альцгеймера була показана присутність амілоїдних відкладень при таких захворюваннях, як середземноморська лихоманка, синдром МакльВелла, ідіопатична мієлома, амілоїдна поліневропатія, амілоїдна кардіоміопатія, системний старечий амілоїдоз, амілоїдна поліневропатія, спадковий церебральний крововилив з амілоїдозом, синдром Дауна, Скрап'є, хвороба КрейтцфельдаЯкоба, Куру, синдром Герстамна-ШтрауслераШайнкера, медулярний рак щитовидної залози, ізольований амілоїд передсердя, β 2мікроглобуліновий амілоїд у пацієнтів при діалізі, міозити тіл включення, β2-амілоїдні відкладення при виснажливих м'язових захворюваннях та інсулінома острівців Лангерганса при діабеті типу II. Фібрилярні агрегати амілоїдних пептидів, Αβ1-40 і Αβ1-42 являють собою основні метаболічні пептиди, які утворюються з амілоїдного білкапопередника, виявленого в старечих бляшках і церебрально-васкулярних амілоїдних відкладеннях у пацієнтів з AD (Xia, W., et al., J. Рrос. Natl. 9 Acad. Sci U.S.A. 97: 9299-9304 (2000)). Запобігання та інверсія утворення Αβ бляшок є метою лікування даного захворювання (Selkoe, D., J. JAMA 283: 1615-1617 (2000); Wolfe, M.S., et al., J. Med. Chem. 41: 6-9 (1998); Skovronsky, D.M., and Lee, V.M., Trends Pharmacol. Sci. 27:161-163 (2000)). Спадкова AD (FAD) викликана множинними мутаціями генів білка-попередника А (АРР), пресенеліну 1 (PS1) і пресенеліну 2 (PS2) (Ginsberg, S. D., et al., "Molecular Pathology of Alzheimer's Disease and Related Disorders," in Cerebral Cortex: Neurodegenerative and Age-related Changes in Structure and Function of Cerebral Cortex, Kluwer Academic/Plenum, NY (1999), pp.603-654; Vogelsberg-Ragaglia, V., et al., "Cell Biology of Tau and Cytoskeletal Pathology in Alzheimer's Disease," Alzheimer's Disease, Lippincot, Williams & Wilkins, Philadelphia, PA (1999), pp.359-372). Хоча точний механізм, який лежить в основі AD, не зрозумілий повністю, усі дотепер вивчені патогенні мутації збільшують продукування більш амілоїдогенної 42-43 амінокислотної довгої форми пептиду Αβ. Таким чином, принаймні у випадку FAD, розрегулювання продукування Αβ виявляється достатнім, щоб викликати каскад випадків, які призводять до нейродегенерації. Дійсно, гіпотеза амілоїдного каскаду припускає, що утворення міжклітинних фібрилярних Αβ агрегатів у мозку може бути центральною причиною патогенезу AD (Selkoe, D. J., "Biology of β-amyloid Precursor Protein and the Mechanism of Alzheimer's Disease," Alzheimer's Disease, Lippincot Williams & Wilkins, Philadelphia, PA (1999), pp.293-310; Selkoe, D. J., J. Am. Med. Assoc. 283: 1615-1617 (2000); Naslund, J., et al., J. Am. Med Assoc. 283: 1571-1577 (2000); Golde, T. E., et al., Biochimica et Biophysica Acta 7502: 172-187 (2000)). Різні підходи спроби інгібування продукування та зменшення накопичення фібрилярного Αβ у мозку в даний час оцінюються як потенційне лікування AD (Skovronsky, D.M. and Lee, V. Μ., Trends Pharmacol. Sci. 27: 161-163 (2000); Vassar, R., et al., Science 286: 735-741 (1999); Wolfe, M. S., et al., J. Med. Chem. 41: 6-9 (1998); Moore, С. L., et al., J. Med. Chem. 43: 3434-3442 (2000); Findeis, M. A, Biochimica et Biophysica Acta 1502: 76-84 (2000); Kuner, P, Bohrmarm, et al., J. Biol. Chem. 275: 16731678 (2000)). Тому, представляє інтерес створення лігандів, які специфічно зв'язують фібрилярні Αβ агрегати. Оскільки міжклітинні SPs являють собою доступні мішені, дані нові ліганди могли б використовуватися як in vivo діагностичні інструменти і як зонди для візуалізації прогресуючих відкладень Αβ при дослідженні амілоїдогенезу AD у живих пацієнтів. З цією метою повідомлялося про розробку декількох цікавих підходів до створення лігандів, специфічних відносно фібрилярних Αβ агрегатів (Ashburn, Т. Τ, et al., Chem. Biol 3: 351-358 (1996); Han, G., et al., J. Am. Chem. Soc. 775: 4506-4507 (1996); Klunk, W. E., et al., Biol Psychiatry 35: 627 (1994); Klunk, W. E., et al., Neurobiol Aging 16: 541548 (1995); Klunk, W. E., et al., Society for Neuroscience Abstract 23: 1638 (1997); Mathis, С. A., et al., Proc. Xllth Intl. Symp. Radiopharm. Chem, 91996 10 Uppsala, Sweden: 94-95 (1997); Lorenzo, A. and Yankner, B. A., Proc. Natl Acad. Sci. U.S.A. 97: 12243-12247 (1994); Zhen, W., et al., J. Med. Chem. 42: 2805-2815 (1999)). Найбільш привабливий підхід заснований на високо кон'югованих крисаміні-G (CG) і конго червоному (CR), де останній використовується для флуоресцентного фарбування SPs і NFTs у відділах мозку хворих AD після смерті (Ashburn, Τ. Τ., et al., Chem. Biol. 3: 351-358 (1996); Klunk, W. E., et al., J. Histochem. Cytochem. 37: 1273-1281 (1989)). Константи інгібування (Кі) для зв'язування з фібрилярними агрегатами Αβ для CR, CG, і 3'-бром- і 3і-йодпохідними CG становлять 2800, 370, 300 і 250нМ, відповідно (Mathis, С. А, et al., Proc. Xllth Intl. Symp. Radiopharm. Chem, Uppsala, Sweden: 94-95 (1997)). Було показано, що дані сполуки зв'язуються селективно з агрегатами Αβ (1-40) пептиду in vitro, а також з фібрилярними відкладеннями Αβ у відділах мозку хворих AD (Mathis, С. Α., et al., Proc. Xllth Intl. Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997)). Є кілька потенційних переваг візуалізації агрегатів Αβ у мозку. Метод візуалізації буде поліпшувати діагностику за рахунок ідентифікації потенційних пацієнтів з надлишковою кількістю бляшок Αβ у мозку; отже, у них, імовірно, може розвитися хвороба Альцгеймера. Також буде корисне контролювання прогресування захворювання. Коли стане доступним лікарське лікування проти бляшок, візуалізація бляшок Αβ у мозку може забезпечити необхідний інструмент для виявлення та кількісної оцінки амілоїдних відкладень у пацієнта для контролювання процесу лікування. Таким чином, простий неінвазивний спосіб виявлення та кількісної оцінки амілоїдних відкладень у пацієнта став надзвичайно бажаним. У даний час виявлення амілоїдних відкладень включає гістологічний аналіз біопсійних і аутопсійних матеріалів. Обидва методи мають недоліки. Наприклад, аутопсію можна використовувати тільки для посмертної діагностики. Безпосередня візуалізація зображення амілоїдних відкладень in vivo є складною, оскільки відкладення мають множину тих самих фізичних властивостей (наприклад, щільність і вміст води), що і звичайні тканини. Спроби візуалізувати амілоїдні відкладення з використанням магнітнорезонансної візуалізації (MRI) і комп'ютерної томографії (CAT) не виправдали очікувань і виявляли амілоїдні відкладення тільки за певних сприятливих умов. Крім того, спроби введення мітки в амілоїдні відкладення з використанням антитіл, амілоїдного білка Ρ сироватки крові або інших молекул-зондів забезпечували деяку селективність на периферії тканин, але виявилися такими, що слабко візуалізують внутрішню частину тканин. Потенційні ліганди для виявлення агрегатів Αβ у мозку живого організму повинні перетинати гематоенцефалічний бар'єр у неушкодженому вигляді. Таке поглинання мозком можна поліпшити при використанні лігандів з відносно невеликим молекулярним розміром (у порівнянні з конго червоним) і підвищеною ліпофільністю. Високо кон'юговані тіофлавіни (S і Т) зазвичай використовують 11 як барвники для фарбування агрегатів Αβ у мозку хворих AD (Elhaddaoui, Α., et al., Biospectroscopy 7: 351-356 (1995)). Повідомлялося про високо ліпофільний трей18 сер [ F]FDDNP для зв'язування як клубків (які складаються головним чином з гіперфосфорилованого тау-білка), так і бляшок (які містять агрегати білка Αβ) (Shoghi-Jadid К, et al., Am J Geriatr Psychiatry. 2002; 10: 24-35). З використанням позитрон-емісійної томографії (PET), показано, що даний трейсер специфічно позначав відкладення бляшок і клубків у дев'яти пацієнтів, які страждають на AD, семи суб'єктів, використаних для порівняння (Nordberg A. Lancet Neurol. 2004; 3: 51927). За допомогою нового способу фармакокінетичного аналізу, який називається відносний час знаходження в ділянці мозку, що представляє інтерес, відносно мостів, була продемонстрована різниця між пацієнтами, які страждають на AD, і суб'єктами, використаними для порівняння. Відносний час знаходження був істотно вище у пацієнтів з AD. Це додатково ускладнюється цікавим виявленим фактом, який стосується того, що FDDNP конкурує з деякими НСПВС при зв'язуванні з фібрилами Αβ in vitro і бляшками Αβ ex vivo (Agdeppa ED, et al. 2001; Agdeppa ED, et al., Neuroscience. 2003; 117: 723-30). Нещодавно повідомлялося про візуалізації βамілоїду в мозку хворих AD пацієнтів з використанням бензотіазоланілінового похідного [11С]ООН-ВТА-1 (також згадується як [11С]РІВ) (Mathis CA, et al., Curr Pharm Des. 2004; 10: 1469-92; Mathis CA, et al., Arch. Neurol. 2005, 62: 196-200). На противагу до того, що спостерігалося для [18F]FDDNP, [11С]О-ОН-ВТА-1 специфічно зв'язується з фібрилярними Αβ in vivo. Для пацієнтів з діагностованою м'якою AD було продемонстровано помітне утримування [11С]О-ОН-ВТА-1 у корі головного мозку, в якій, як відомо, містяться великі кількості амілоїдних відкладень при AD. У групі пацієнтів, які страждають на AD, утримування [11C]O-OH-BTA-1 збільшувалося найбільше помітно в лобовій корі головного мозку. Велике збільшення також спостерігалося в тім'яній, скроневій і потиличній ділянках кори та в стриатумі. Утримування [11С]О-ОН-ВТА-1 було еквівалентним у хворих AD і суб'єктів, які використовувалися для порівняння, у тих ділянках, які, як відомо, є відносно неураженими амілоїдними відкладеннями (такі як підкіркова біла речовина, міст і мозочок). Недавно був досліджений інший 11С-мічений направлений зонд для Αβ-бляшок - похідне стильбену [11C]SB13. Зв'язування in vitro з використанням [11C]SB-13 дозволяє припустити, що сполука проявляє чудову афінність зв'язування, і зв'язування може бути точно виміряне в cірій речовині кори головного мозку, але не в білій речовині при захворюваннях AD (Kung М-Р., et al., Brain Res. 2004; 1025: 98105). Є дуже низьке специфічне зв'язування в гомогенатах тканин кори головного мозку для контрольних зразків мозку. Величини Kd для [11C]SB-13 у гомогенатах кори головного мозку при AD становили 2,4±0,2нМ. Спостерігалися висока здатність зв'язування і порівняльні значення (14-45пмоль/мг білка) (Id.). Як очікувалося, у пацієнтів з AD для 91996 12 [11C]SB-13 проявлялося високе накопичення в лобовій корі головного мозку (очевидно, в ділянці, яка містить високу щільність бляшок Αβ) у пацієнтів при м'якій до середньої AD, але не у випадку придатних за віком суб'єктів (Verhoeff NP, et al., Am/Geriatr Psychiatry. 2004; 12: 584-95). Було б корисно мати неінвазивні методи візуалізації та кількісної оцінки амілоїдних відкладень у пацієнта. Крім того, було б корисно мати сполуки, які інгібують агрегацію амілоїдних білків з утворенням амілоїдних відкладень і спосіб визначення здатності сполук інгібувати агрегацію амілоїдного білка. Даний винахід стосується нових сполук формули І, II і III. Даний винахід також стосується нових діагностичних композицій, які містять радіоактивно мічені сполуки формули І, II і III і фармацевтично прийнятний носій або розріджувач. Винахід, крім того, стосується способу візуалізації зображення амілоїдних відкладень, де спосіб включає введення пацієнту кількості міченої сполуки, яка виявляється, формули І, II і III або її фармацевтично прийнятної солі, складного ефіру, аміду або проліків. Даний винахід також стосується способу інгібування агрегації амілоїдних білків, спосіб включає введення ссавцеві кількості сполуки формули І, II і III, яка інгібує амілоїд, або її фармацевтично прийнятної солі, складного ефіру, аміду або проліків. Наступний аспект даного винаходу стосується способів і проміжних сполук, які використовуються для синтезу описаних тут сполук формули І, II і III, які інгібують та візуалізують амілоїд. На кресленні (Фіг.) представлені дані зв'язування Кі для декількох сполук за даним винаходом. У першому аспекті даний винахід стосується сполук формули І: I або їх фармацевтично прийнятних солей або проліків, де: R1 вибирають з групи, що складається з: a. NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, (CH2)d18F, і d являє собою ціле число від 1 до 4, b. гідрокси, с. С1-4алкокси, d. гідроксі(С1-4)алкілу, e. галогену, f. ціано, g. водню, h. нітро, і. (С1-С4)алкілу, j. галоген(С1-С4)алкілу та k. формілу; R1 вибирають з групи, що складається з a. 123I,125I,131I,18F, 76Br; b. водню. c. 18F(С1-4)алкілу, d. [18F(С1-4)алкіл]аміно, 13 є. [18F(С1-С4)алкіл]алкіламіно, f. 18F(С1-С4)алкокси; R2 вибирають з групи, що складається з і. гідроксилу, С1-4алкокси, (С1С4)алкілоксоалк(С1-С4)окси, (С1-С4алкілоксо(С1С4)-алкілоксо(С1-С4)алкокси, (С1-С4)-алкілоксо(С1С4)-алкіл оксо(С1-С4)-алкіл оксо(С1-С4)алкокси, карбоксі(С1-С4)алкілу, галоген(С1-С4)алкокси, галоген(С1-С4)алкілоксо(С1-С4)алкокси, галоген(С1С4)алкілоксо(С1-С4)алкілоксо(С1-С4)-алкілокси, галоген(С1-С4)алкілоксо(С1-С4)алкілоксо(С1С4)алкілоксо(С1-С4)алкілокси, галоген(С1-С4)алкілу, 18 NR6R6, феніл(С1-С4)алкілу, F(С1-С4)алкокси, 18 F(С1-С4)алкіл оксо(С1-С4)алкокси, 18F(С1-С4)алкіл оксо(С1-С4)алкі локсо(С1-С4)алкіл окси, 18F(С1С4)алкілоксо(С1-С4)алкіл оксо(С1-С4)алкілоксо(С1С4)алкілокси, 18F(С1-С4)алкілу, де R6 і R6' незалежно вибирають з групи, що складається з водню, гідроксі(С1-С4)алкілу та С1С4алкілу; де q являє собою ціле число від одиниці до 10; Ζ вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного бензилокси, переважно 18F-фенокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного (С1-4алкокси, 18F заміщеного арилокси та 18F заміщеного C6-10 арилу, переважно 18F-фенілу; і R30, R31, R32 і R33, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С14алкілу та гідроксі(С1-4)алкілу; де Z, R30, R31, R32 і R33 є такими, як описано вище; де Υ вибирають з групи, яка складається з 18F, F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси, переважно 18F-фенокси, і 18F заміщеного С6-10арилу, переважно 18F-фенілу; U вибирають з групи, що складається з водню, гідрокси, 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арило18 18 кси, переважно F-фенокси та F заміщеного С618 F-фенілу; і 10арилу, переважно R34, R35, R36, R37, R38, R39 і R40, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С1-4алкілу та гідроксі(С1-4)алкілу; і 18 91996 14 R7 і R8, у кожному випадку, незалежно вибирають з групи, що складається з галогену, наприклад, F, СІ, Вr, водню, гідрокси, аміно, метиламіне, диметиламіно, С1-4алкокси, С1-4алкілу та гідрок7 8 сі(С1-4)алкілу, де принаймні один з R і R являє собою галоген, переважно F. В переважному варіанті здійснення R1 незалежно вибирають з групи, яка складається з водню, галогену, наприклад, F, СІ, Вr, С1С4алкілу, ціано, гідроксилу, нітро, (С1С4)алкіламіно, ді(С1-С4)алкіламіно, галоген(С1С4)алкілу, формілу та алк(С1-С4)окси; R1' незалежно вибирають з групи, яка складається з водню, 123І, 125І, 131І, 18F, 18F(С1-4)алкілy, [18F(С1-4)алкіл]аміно, [18F(С1-С4)алкіл]алкіламіно, 18 76 F(С1-С4)алкокси та Вr; R2 незалежно вибирають з групи, яка складається з гідроксилу, С1-4алкокси, (С1С4)алкілоксоалк(С1-С4)окси, карбоксі(С1-С4)алкілу, галоген(С1-С4)алкокси, галоген(С1-С4)алкіл оксо(С1-С4)алкокси, галоген(С1-С4)алкіл оксо(С1С4)алкілоксо(С1-С4алкілокси, галоген(С1С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілоксо-(С1С4)алкілокси, галоген(С1-С4)алкілу, NR6R6', фе18 18 ніл(С1-С4)алкілу, F(С1-С4)алкокси, F(С118 С4)алкілоксо(С1-С4)алкокси, F(С1-С4)алкілоксо18 (С1-С4)алкілоксо(С1-С4)алкілокси, F(С1С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілоксо-(С1С4)алкілокси,18F(С1-С4)алкілу, R6 і R6' незалежно вибирають з групи, яка складається з водню, гідроксі(С1-С4)алкілу та С1С4алкілу. R7 і R8 вибирають з Н, F, СІ або Вr, де один з 7 R і R8 являє собою галоген. У наступному переважному варіанті здійснення R1 вибирають з групи, яка складається з водню, гідрокси, (С1-С4)алкіламіно, ді(С1С4)алкіламіно, метилу та метокси, зокрема з водню, метиламіно та диметиламіно, 1 R вибирають з групи, яка складається з вод123 125 131 ню, І, І, І і 18F, зокрема з водню, R2 вибирають з групи, яка складається з гідрокси, С1-С4алкокси, NR6R6', 18F(С1-С4)алкокси, 18 18 F(С1-С4)алкілоксо(С1-С4)алкокси, F(С1С4)алкілоксо(С1-С4)алкілоксо(С1-С4)алкілокси, 18 F(С1-С4)алкілоксо(С1-С4)алкілоксо-(С118 С4)алкілоксо(С1-С4)алкілокси, F(С1-С4)алкілу, зокрема з (С1-С4)алкілоксо(С1-С4С4)алкокси, 18 F(С1-С4)алкілоксо(С1-С4)алкілоксо(С1С4)алкілокси, і 18F(С1-С4)алкілоксо(С1-С4)алкіл оксо(С1-С4)алкілоксо(С1-С4)алкілокси, R6 і R6' незалежно вибирають з групи, яка складається з водню, гідроксі(С1-С4)алкілу та С1С4алкілу, R7 і R8 вибирають з групи, яка складається з водню та фтору, де один з двох R7 або R8 являє собою фтор. Неочікувано було встановлено, що похідні стильбену, які містять додатковий галоген, зокрема атом фтору при подвійному зв'язку, демонструють поліпшені фармакокінетичні властивості і/або підвищену метаболічну стабільність і/або підвищену стабільність та однорідність геометричних ізомерів. 15 91996 Кращі сполуки формули І мають наступні структури: де один з R7 і R8 являє собою водень, а інший являє собою галоген. Другий аспект даного винаходу стосується сполук формули II: II або їх фармацевтично прийнятних солей, де: R1 вибирають з групи, яка складається з: a. NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл, (CH2)d18F, і d являє собою ціле число від 1 до 4, або обидва Ra і Rb являють собою кисень з утворенням нітрогрупи, b. гідрокси, c. С1-4алкокси, і d. гідроксі(С1-4)алкілу; R2 вибирають з групи, яка складається з: де q являє собою ціле число від одиниці до 10; Ζ вибирають з групи, яка складається з 18F, 18F заміщеного бензоїлокси, 18F заміщеного (С118 F заміщеного бензилокси, переважно 4)алкокси, 18 F-фенокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси, і 18F заміщеного С6-10 арилу, переважно 18F-фенілу; і R30, R31, R32 і R33, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С14алкілу та гідрокcі(С1-4)алкілу; 16 де Υ вибирають з групи, яка складається з 18F, F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси, переважно 18F-фенокси, і 18F заміщеного С6-10aрилу, пере18 важно F-фенілу; U вибирають з групи, яка складається з водню, гідрокси, 18F, 18F заміщеного бензоїлокси, 18F заміщеного феніл(С1-4)алкілу, 18F заміщеного арилокси, переважно 18F-фенокси та 18F заміщеного С618 F-фенілу; і 10арилу, переважно 34 35 36 37 R , R , R , R , R38, R39 і R40, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, С1-4алкокси, С1-4алкілу та гідроксі(С1-4)алкілу; і R7 і R8, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, аміно, метиламіно, диметиламіно, С1-4алкокси, С14алкілу та гідроксі(С1-4)алкілу. Більш переважно, значення для кожного з R30, 31 R , R32, R33, R34, R35? R36, R37, R38, R39 і R40, у кожному випадку, незалежно вибирають з групи, яка складається з водню, гідрокси, аміно, метиламіно, диметиламіно та метокси. Переважно, R2 розташований або в мета-, або в пара-положенні відносно етиленового містка. Коли R2 являє собою 18 кращим значенням для R30, R31, R32 і R33, у кожному випадку, є водень, і Ζ являє собою F. Корисні значення для q включають цілі числа від одного до десяти. Переважно, q являє собою ціле число від 2 до 5. Більш переважно, значення q дорівнює 3 або 4. Кращі варіанти здійснення формули II включають наступні структури, де Ra і Rb незалежно являють собою водень або метил, переважно принаймні один з Ra і Rb являє собою метил: і X являє собою F. Краща серія сполук формули II включає мічені 18 F похідні поліетиленгліколь(ПЕГ)-стильбену, які мають наступні структури де Z, R30, R31, R32 і R33 є такими, як обговорювалося вище; 17 91996 де, q являє собою ціле число від одиниці до десяти. Більш переважні сполуки включають ті, в яких q дорівнює; двом, У даній серії сполук F зв'язаний зі стильбеном через ланцюг ПЕГ, який має змінну кількість етоксильних груп.Всі фторовані стильбени проявляють високу афінність зв'язування в аналізі з використанням посмертних гомогенатів мозку хворих AD (10=2,9-6,7нМ). Як показано на схемах 1-3 даного опису, введення радіоактивної мітки успішно здійснюють шляхом заміщення мезилатної групи в 10а-d на [18F]фторид, одержуючи цільові сполуки [18F]12a-d (EOS, питома активність 9001500Кі/ммоль; радіохімічна чистота >99%). Біороз18 поділення in vivo даних Р-лігандів у звичайних мишей показувало чудове проникнення в мозок і швидке вимивання після внутрішньовенної ін'єкції (6,6-8,1 і 1,2-2,6% дози/г через 2 хвилини та 60 хвилин відповідно). Ауторадіографія посмертних відділів мозку хворих AD з використанням [18F]12ad підтвердила специфічне зв'язування, яке стосується присутності бляшок Αβ. Крім того, введення мітки в бляшки in vivo з використанням даних мічених F агентів може бути чітко продемонстроване на трансгенних мишах (Tg2576) - корисної тваринної моделі для хвороби Альцгеймера. Даний винахід також стосується сполук формули III: III де n являє собою ціле число від 1 до 4, R7 і R8 є такими, як описано вище, і R41 вибирають з групи, яка складається з гідрокси та NRaRb, де Ra і Rb незалежно являють собою водень, С1-4алкіл або обидва Ra і Rb являють собою кисень, утворюючи нітрогрупу. Переважно, n дорівнює одиниці, і R41 являє собою гідрокси, метиламіно або диметиламіно. Кращі значення в межах С-10арилу включають феніл, нафтил або тетрагідронафтил. Кращі значення в межах гетероарилу включають тієніл, фурил, піраніл, піроліл, піридиніл, індоліл та імідазоліл. Кращі значення в межах гетероциклу включають піперидиніл, піролідиніл і морфолініл. 18 Сполуки формули І, II і III також можуть бути сольватованими, особливо гідратованими. Гідратування може відбуватися під час одержання сполук або композицій, які включають сполуки, або гідратування може відбуватися з часом внаслідок гігроскопічної природи сполук. Додатково сполуки за даним винаходом можуть існувати в несольватованій, а також сольватованій формах разом з фармацевтично прийнятними розчинниками, такими як вода, етанол і тому подібні. Зазвичай для даного винаходу сольватовані форми розглядаються як еквівалентні несольватованим формам. Також варто розуміти, що даний винахід розглядається як такий, що включає стереоізомери, такі як цис- і транс-ізомери сполук стильбенового типу. Додатково винахід включає: оптичні ізомери, наприклад, суміші енантіомерів, а також індивідуальні енантіомери та діастереомери, які виникають як наслідок структурної асиметрії вибраних сполук формули І, II або III. Коли будь-які змінні виникають більше одного разу в будь-якому компоненті або у формулі І, II або III, його визначення з кожною появою є незалежним від його визначення при кожній іншій появі. Також комбінації замісники і/або змінні є припустимими тільки в тому випадку, коли такі комбінації призводять до стабільних сполук. Термін "алкіл", як він використаний у даному описі сам по собі або як частина іншої групи, стосується як лінійних, так і розгалужених радикалів, що містять до 8 вуглеців, переважно до 6 вуглеців, більш переважно 4 вуглеці, таких як метил, етил, пропіл, ізопропіл, бутил, трет-бутил та ізобутил. Термін "алкокси" використаний у даному описі для позначення лінійного або розгалуженого алкільного радикала, як визначено вище, якщо довжина ланцюга обмежена для цього, зв'язаного з атомом кисню, включаючи, але не обмежуючись зазначеним, метокси, етокси, н-пропокси, ізопропокси і тому подібні. Переважно алкоксильний ланцюг має в довжину від 1 до 6 атомів вуглецю, більш переважно 1-4 атома вуглецю. Термін "моноалкіламін", як він використаний у даному описі сам по собі або як частина іншої групи, стосується аміногрупи, яка є заміщеною однією алкільною групою, як визначено вище. Термін "діалкіламін", як він використаний у даному описі сам по собі або як частина іншої групи, стосується аміногрупи, яка є заміщеною двома алкільними групами, як визначено вище. Термін "гало" або "галоген", використаний у даному описі сам по собі або як частина іншої групи, стосується хлору, брому, фтору або йоду, якщо не вказано іншого в конкретних застосуваннях у тексті й/або формулі винаходу. Термін "галогеналкіл", як він використаний у даному описі, стосується кожної з вищевказаних алкільних груп, заміщених одним або декількома атомами хлору, брому, фтору або йоду, де фтор і йод є кращими, таких як хлорметил, йодметил, трифторметил, 2,2,2-трифторпентил і 2-хлоретил. Термін "арил", як він використаний у даному описі сам по собі або як частина іншої групи, стосується моноциклічних або біциклічних ароматичних груп, які містять від 6 до 12 вуглеців у кільцевій 19 частині, переважно 6-10 вуглеців у кільцевій частині, таких як феніл, нафтил або тетрагідронафтил. Термін "гетероцикл" або "гетероциклічне кільце", як він використаний у даному описі за винятком відзначеного, являє собою стабільну 5-7членну моногетероциклічну кільцеву систему, яка може бути насиченою або ненасиченою і яка складається з атомів вуглецю та від одного до трьох гетероатомів, вибраних з групи, яка складається з N, O i S, і дететероатоми азоту та сірки необов'язково можуть бути окисленими. Особливо корисними є кільця, які містять один азот у поєднанні з одним киснем або сіркою, або два азоти як гетероатоми. Приклади таких гетероциклічних груп включають піперидиніл, піроліл, піролідиніл, імідазоліл, імідазиніл, імідазолідиніл, піридил, піразиніл, піримідиніл, оксазоліл, оксазолідиніл, ізоксазоліл, ізоксазолідиніл, тіазоліл, тіазолідиніл, ізотіазоліл, гомопіперидинід, гомопіперазиніл, піридазиніл, піразоліл і піразолідиніл, найбільш переважно тіаморфолініл, піперазиніл і морфолініл. Термін «гетероатом» використаний у даному описі для позначення атома кисню («О»), атома сірки («S») або атома азоту («N»). Буде зрозуміло, що коли гетероатом являє собою азот, він може утворювати фрагмент NRaRb, де Ra і Rb являють собою, незалежно один від одного, водень або С14алкіл, С2-4аміноалкіл, С1-4галогеналкіл, галогенбензил, або R1 і R2, взяті разом, утворюють 5-7членне гетероциклічне кільце, яке необов'язково c c має О, S або NR у вказаному кільці, де R являє собою водень або С1-4алкіл. Термін "гетероарил", як він використаний у даному описі, стосується групи, яка має від 5 до 14 кільцевих атомів; 6, 10 або 14 -електронів, розподілених спільно в циклічному фрагменті, та містить атоми вуглецю і 1, 2, 3 або 4 гетероатома кисню, сірки або азоту (де прикладами гетероарильних груп є групи тієніл, бензо[b]тієніл, нафто[2,3b]тієніл, тіаантреніл, фурил, піраніл, ізобензофураніл, бензоксазоліл, хроменіл, ксантеніл, феноксантиніл, 2Н-піроліл, піроліл, імідазоліл, піразоліл, піридил, піразиніл, піримідиніл, піридазиніл, індолізиніл, ізоіндоліл, 3Н-індоліл, індоліл, індазоліл, пуриніл, 4Н-хінолізиніл, ізохіноліл, хіноліл, фталазиніл, нафтиридиніл, хіназолініл, цинолініл, птеридиніл, 4аН-карбазоліл, карбазоліл, 3-карболініл, фенантридиніл, акридиніл, піримідиніл, фенантролініл, феназиніл, ізотіазоліл, фенотіазиніл, ізоксазоліл, фуразаніл і феноксазиніл). Термін "аралкіл" або "арилалкіл", як він використаний у даному описі сам по собі або як частина іншої групи, стосується С1-6алкільних груп, як 900-1500 Кі/ммоль наприкінці синтезу. 91996 20 обговорювалося вище, які мають арильний замісник, такі як бензил, фенілетил або 2-нафтилметил. Даний винахід додатково стосується способів одержання сполук вищевказаних формул І, II або III. Сполуки за даним винаходом можуть бути одержані з використанням реакцій, описаних на схемах 1-8. На схемі 1 показаний синтетичний шлях утворення тіофенвмісних похідних формули І, зокрема деяких сполук формули Іа. Фторовані ПЕГ-стильбени 12a-d одержували реакціями, показаними на схемі 1. Для одержання сполук із 2 або 3 етоксильними групами як ПЕГ зв'язувальних фрагментів, комерційно доступні хлориди 2а,b зв'язували з ОН групою 4метиламіно-4'-гідроксистильбену, 1 (Ono M, et al., Nucl Med Biol. 2003; 30: 565-71; Wilson A, et al., J Labelled Cpd Radiopharm. 2003; 46: S61), одержуючи 3a,b відповідно. Вільні ОН групи 3а,b згодом захищали з використанням TBDMSC1, одержуючи сполуки 7а,b. Для одержання сполук з 4 або 5 етоксильними групами як ПЕГ-зв'язувальної групи броміду 6c,d були одержані окремо, як показано на схемі 2, і потім зшиті зі стильбеном 1 з одержанням TBS-захищених сполук 7c,d. O-TBS захисні групи в сполуках 7c,d були вилучені обробкою TBAF (1М) у ТГФ з одержанням 3c,d. Сполуки 8a-d були одержані шляхом введення захисту в метил аміногрупи в 7a-d з використанням ВОС. Після видалення TBS захисних груп 8a-d за допомогою TBAF (1М)/ТГФ, вільні ОН групи були перетворені на мезилати шляхом взаємодії з MsCl у присутності триетиламіну з одержанням 10а-d. «Холодні» фторовані ПЕГ-стильбени 12a-d з успіхом одержували нагріванням при кипінні зі зворотним холодильником 10a-d у суміші безводний TBAF/ΤΓΦ (Сох DP, et al., J Org Chem. 1984; 49: 3216-19) з наступним перемішуванням з ТФОК для видалення ВОСзахисної групи. Для одержання цільових 18F-мічених ПЕГ18 стильбенів [ F]12a-d як попередників використовували N-BOC захищені мезилати 10а-d (Схема 3). Кожний з мезилатів, 10а-d, змішували з сумішшю [18F]фторид/карбонат калію та Kryptofix 222 у ДМСО та нагрівали при 120°С протягом 4 хвилин. Суміш потім обробляли водною НСl для видалення N-BOC захисної групи. Неочищений продукт очищали за допомогою ВЕРХ (радіохімічна чистота >99%, радіохімічний вихід 10-30%, скоректований розпад). Одержання кожної з 18F-мічених сполук [18F]12a-d займало приблизно 90 хвилин, і пипитому активність оцінювали як складову 21 Синтез сполук 15е, 16е і синтез радіоактивно мічених сполук-попередників 15d, 17d для одержання [18F]15e і [18F]6e показані на схемі 9. Для одержання сполуки 15а нітрогрупу в 4-нітро-4'гідроксистильбені, 13а, відновлюють з використанням SnCl2 в етанолі, одержуючи відповідний хемі 10) і карбонатом калію в безводному ДМФ. Сполуку 15с одержують при обробці 15b 1н НСl в ацетоні. Монотозилат 15d можна виділити з одержаної при взаємодії діолу 15с з 1,5 еквівален 91996 22 амін 14а. Аміногрупу потім обробляють (СНО)n і NaBH3CN, одержуючи диметиламінозаміщену сполуку 15а. Сполуку 15b одержують при взаємодії гідроксилстильбену, 15а, із бромідом (який був окремо одержаний, як показано на с тами хлористого тозилу в піридині суміші продуктів. Тозилат 15d перетворюють на фторид 15е шляхом нагрівання при кипінні з безводним TBAF у ТГФ. TBAF варто висушувати при 58°С у високому 23 вакуумі (99% радіохімічної чистоти з 10% радіохімічним виходом (скоректований розпад). Спосіб одержання займає 90 хвилин, а специфічну активність оцінювали як таку, що дорівнює 70Кі/ммоль наприкінці синтезу. Аналогічний спосіб проводили для одержання [18F]16e зі сполуки-попередника 17d. Після початкової реакції в ДМСО суміш обробляли водною НСl для видалення ВОС групи. Радіохімічна чистота становила >99% після ВЕРХ очищення, і радіохімічний вихід становив 15%. Загальний час синтезу складав 110 хвилин, і наприкінці синтезу специфічна активність була оцінена, як така, що дорівнює 90Кі/ммоль. 25 91996 26 27 Деякі зі сполук також можуть бути синтезовані із застосуванням мікрохвильового випромінювання, як описано нижче в прикладах 50-52. Радіоактивні галогеновані сполуки за даним винаходом легко можна пристосувати для одержання з матеріалів, які можуть бути забезпечені в наборі. Набори для одержання візуалізуючих агентів можуть містити, наприклад, пляшечку, яка містить фізіологічно придатний розчин проміжної сполуки формули І у концентрації та при рН, які придатні для оптимальних умов комплексоутворення. Користувачу потрібно буде додати в пляшечку придатну кількість радіоактивного ізотопу та окислювача, такого як пероксид водню. Одержаний мічений ліганд потім може бути введений внутрішньовенно пацієнту і рецептури мозку можуть бути візуалізовані за допомогою ви 91996 28 мірювання гамма-випромінювання або їх фотоемісій. При бажанні, радіоактивний діагностичний агент може містити будь-яку допоміжну домішку, таку як рН контролюючі агенти (наприклад, кислоти, основи, буфери), стабілізатори (наприклад, аскорбінова кислота) або ізотонічні агенти (наприклад, хлорид натрію). Термін «фармацевтично прийнятна сіль», як він використаний у даному описі, стосується тих карбоксилатних солей або кислотно-адитивних солей сполук за даним винаходом, які, у межах діючих медичних суджень, є придатними для застосування в контакті з тканинами пацієнтів, без надмірної токсичності, подразнення, алергійної реакції відповіді і тому подібного, відповідають розумному співвідношенню користь/ризик і ефективні для призначеного застосування, а також цві 29 тер-іонних форм сполук за винаходом, де це можливо. Термін «солі» стосується відносно нетоксичних адитивних солей сполук за даним винаходом з неорганічними та органічними кислотами. Термін також включає солі, одержані з нетоксичних органічних кислот, таких як аліфатичні моно- та дикарбонові кислоти, наприклад, оцтова кислота, фенілзаміщені алканові кислоти, гідроксіалканові та алкандіонові кислоти, ароматичні кислоти та аліфатичні та ароматичні сульфонові кислоти. Дані солі можуть бути одержані in situ у процесі кінцевого виділення та очищення сполук або при окремій взаємодії очищеної сполуки у вигляді вільної основи з придатною органічною або неорганічною кислотою та виділення утвореної при цьому солі. Далі ілюстративні солі включають гідробромід, гідрохлорид, сульфат, бісульфат нітрат, ацетат, оксалат, валерат, олеат, пальмітат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактіобіонатні та лаурилсульфонатні солі, пропіонат, півалат, цикламат, ізетіонат і тому подібні. Вони можуть включати катіони, одержані з лужних і лужноземельних металів, таких як натрій, літій, калій, кальцій, магній і тому подібні, а також нетоксичні катіони амонію, четвертинного амонію та амінів, включаючи, але не обмежуючись зазначеним, амоній, тетраметиламоній, тетраетиламоній, метиламін, диметиламін, триметиламін; триетияамін, етиламін, і тому подібні. (див., наприклад, Berge С. Μ., et al., Pharmaceutical Salts, J. Pharm. Sci. 66: 1-19 (1977), включену до даного опису як посилання). Даний винахід також стосується способу візуалізації амілоїдних відкладень. Одним із ключових необхідних умов для візуалізуючого агента мозку in vivo є здатність проходити в незмінному вигляді через гематоенцефалічний бар'єр після болюсної внутрішньовенної ін'єкції. На першій стадії даного способу візуалізації мічену сполуку формули І, II або III вводять у тканину пацієнта у кількості, яка виявляється. Сполука зазвичай становить частину фармацевтичної композиції, і її вводять у тканину пацієнта способами, добре відомими фахівцям у даній галузі. Наприклад, сполуку можна вводити або перорально, ректально, парентерально (внутрішньовенно, внутрішньом'язово або підшкірно), інтрацистенально, внутрішньопіхвово, внутрішньочеревинно, внутрішньоміхурово, місцево (порошки, мазі або краплі) або у вигляді букального або назального спрею. У кращому варіанті здійснення винаходу мічену сполуку вводять пацієнту у кількості, що виявляється, і після достатнього проміжку часу, який проходить для зв'язування сполуки з амілоїдними відкладеннями, мічену сполуку виявляють неінвазивним чином всередині організму пацієнта. В іншому варіанті здійснення винаходу 18F мічену сполуку формули І, II або III вводять в організм пацієнта, дають можливість пройти проміжку часу, достатньому для зв'язування сполуки з амілоїдними відкладеннями і потім видаляють зразок тканини пацієнта та виявляють мічену сполуку в тканині пацієнта ззовні організму пацієнта. У третьому 91996 30 варіанті здійснення винаходу, видаляють зразок тканини пацієнта та мічену сполуку формули І, II або III вводять у зразок тканини. Після проміжку часу, достатнього для зв'язування сполуки з амілоїдними відкладеннями, виявляють сполуку. Введення міченої сполуки пацієнту може бути здійснене за допомогою загального або місцевого шляху введення. Наприклад, мічену сполуку можна вводити пацієнту таким чином, що вона буде доставлятися через організм. Альтернативно, мічену сполуку можна вводити в орган або тканину, що представляє певний інтерес. Наприклад бажано локалізувати та кількісно оцінити амілоїдні відкладення в мозку для діагностування або простежування прогресування розвитку хвороби Альцгеймера у пацієнта. Термін «тканина» означає частину організму пацієнта. Приклади тканин включають мозок, серце, печінку, кровоносні судини та артерії. Кількість, яка виявляється, являє собою кількість міченої сполуки, необхідну для виявлення вибраним методом. Кількість міченої сполуки для введення пацієнту з метою забезпечення виявлення легко може бути визначена фахівцем у даній галузі. Наприклад, пацієнту можна давати кількості, які збільшуються, міченої сполуки доти, поки сполука не буде виявлятися вибраним методом. Мітку вводять до сполуки для забезпечення виявлення сполук. Термін «пацієнт» означає людей та інших тварин. Фахівцям у даній галузі також відоме визначення проміжку часу, необхідного для зв'язування сполуки з амілоїдними відкладеннями. Необхідна кількість часу легко може бути визначена шляхом введення пацієнту кількості міченої сполуки, яка виявляється, формули І, II або III і потім виявлення міченої сполуки в різний момент часу після введення. Термін «зв'язаний» означає хімічну взаємодію між міченою сполукою та амілоїдним відкладенням. Приклади зв'язування включають ковалентні зв'язки, іонні зв'язки, гідрофільно-гідрофобні взаємодії та утворення комплексів. Фахівці в даній галузі знайомі з виявленням позитрон-випромінюючих атомів, таких як F за допомогою позитрон-емісійної томографії. Даний винахід також стосується конкретних сполук, в яких атом 18F замінений нерадіоактивним атомом фтору. Радіоактивний діагностичний агент повинен мати достатню радіоактивність і радіоактивну концентрацію, яка може гарантувати надійний діагноз. Бажаний рівень радіоактивності можна досягти способами, розробленими в даному винаході для одержання сполук формули І, II або III. Візуалізація зображення амілоїдних відкладень також може бути проведена кількісно так, щоб можна було визначити кількість амілоїдних відкладень. Інший аспект винаходу стосується способу інгібування агрегації амілоїдних бляшок. Даний винахід також стосується способу агрегації амілоїдних білків, що призводить до утворення амілоїдних відкладень шляхом введення пацієнту кількості 31 сполуки, яка інгібує амілоїд, вищевказаних формул І, II або III. Фахівці в даній галузі легко зможуть визначити кількість, що інгібує амілоїди, шляхом простого введення сполуки формули І, II або III пацієнту в кількостях, які збільшуються, доти, поки ріст амілоїдних відкладень не зменшиться або не зупиниться. Швидкість росту може бути оцінена з використанням візуалізації зображення, як описано вище, або відбором зразка тканини пацієнта та спостереження в ньому амілоїдних відкладень. Сполуки за даним винаходом можна вводити пацієнту при рівнях дозування в діапазоні від приблизно 0,1 до приблизно 1000мг на день. Для звичайної дорослої людини, яка має масу тіла приблизно 70кг, достатнім є дозування в діапазоні від приблизно 0,01 до приблизно 100мг на кілограм ваги тіла на день. Однак, конкретні використані дозування можуть змінюватися. Наприклад, дозування може залежати від ряду факторів, включаючи вимоги пацієнта, тяжкість стану, який піддається лікуванню, та фармакологічної активності використовуваної сполуки. Визначення оптимальних дозувань для конкретного пацієнта добре відомо фахівцям у даній галузі. Радіоактивний діагностичний агент повинен мати достатню радіоактивність і радіоактивну концентрацію, що може гарантувати надійний діагноз. Бажаний рівень радіоактивності можна досягати способами, розробленими в даному винаході для одержання сполук формули І, II або III. Візуалізація зображення амілоїдних відкладень також може бути проведена кількісно так, щоб можна було визначити кількість амілоїдних відкладень. Наступні приклади є ілюстративними, а не такими, що обмежують спосіб і композиції за даним винаходом. Інші, які зазвичай зустрічаються та очевидні для фахівців у даній галузі, придатні модифікації та адаптації множини умов і параметрів входять у межі суті та обсягу даного винаходу. Всі використані для синтезу реагенти являли собою комерційні продукти та були використані без додаткового очищення, якщо не зазначено іншого. Спектри 1Н ЯМР були одержані на спектрометрі Bruker DPX (200МГц) в CDCІ3. Хімічні зсуви наведені у вигляді значень δ (мільйонні частки) відносно внутрішнього стандарту ТМС. Константи спін-спінової взаємодії наведені в герцах. Мультиплетність сигналів визначена як с (синглет), д (дублет), т (триплет), ушир, (широкий сигнал), м (мультиплет). Елементний аналіз був проведений Atlantic Microlab INC. Для кожної методики вираз «стандартна обробка» стосується наступних стадій: додавання вказаного органічного розчинника, промивання органічного шару водою, потім насиченим розчином солі, відділення органічного шару від водного шару, висушування об'єднаних органічних шарів над безводним сульфатом натрію, відфільтровування сульфату натрію та видалення органічного розчинника при зниженому тиску. Приклад 1 2-(2-{4-[2-(4Метиламінофеніл)вініл]феноксі}етоксі)етанол (3а). 91996 32 В атмосфері азоту 4-метиламіно-4'гідроксистильбен 1 (Оnо М, et al., Nucl Med Вiol. 2003; Wilson A, et al, J Labelled Cpd Radiopharm. 2003) (63мг, 0,28ммоль) і 2а (42мг, 0,34ммоль) розчиняли в безводному ДМФ (5,0мл) з наступним додаванням карбонату калію (125мг, 0,91ммоль). Суспензію нагрівали до 100°С і перемішували протягом ночі. Після охолодження до кімнатної температури, використовували стандартну обробку дихлорметаном і залишок очищали препаративною ТШХ на силікагелі (4% метанол у дихлорметані), одержуючи сполуку За (67мг, 76%): 1H ЯМР δ 7,37 (м, 4Н), 6,89 (м, 4Н), 6,63 (д, 2Н, J=8,48Гц), 4,16 (т, 2Η), 3,88 (т, 2Η), 3,78 (т, 2Η), 3,68 (т, 2Η), 2,87 (с, 3Н), 2,20 (ушир., 1Н), 1,55 (ушир., 1Н). Приклад 2 2-[-2-(2-{4-[2-(4Метиламінофеніл)вініл]феноксі}етоксі)етоксі]етанол (3b). Сполуку 3b одержували з 1 (150мг, 0,67ммоль), 2b (136мг, 0,81ммоль) і карбонату калію (277мг, 2,01ммоль) у ДМФ (10мл) з використанням такого ж способу, як описано для сполуки 3а. 3b (180мг, 76%): 1Н ЯМР δ 7,37 (м, 4Н), 6,89 (м, 4Н), 6,65 (д, 2Н, J=8,50Гц), 4,15 (т, 2Н), 3,87 (т, 2Н), 3,72 (т, 6Н), 3,62 (т, 2Н), 2,87 (с, 3Н), 2,20 (ушир., 1H), 1,60 (ушир., 1Н). Приклад 3 2-{2-[2-(2-{4-[2-(4Метиламінофеніл)вініл]феноксі}етоксі)етоксі]етоксі}етанол (3с). TBAF (1Μ у THF, 0,06мл) додавали шприцом до розчину сполуки 7с (12мг, 0,023ммоль) у ТГФ (1мл). Розчин перемішували при кімнатній температурі протягом 2 годин. Після стандартної обробки з використанням дихлорметану залишок очищали препаративною ТШХ на силікагелі (4,5% метанол у дихлорметані), одержуючи Зс (8,7мг, 94%): 1Η ЯМР δ 7,36 (м, 4Н), 6,88 (м, 4Н), 6,58 (д, 2Н, J=8,5Гц), 4,15 (т, 2Н), 3,86 (т, 2Н), 3,70 (м, 12Н), 2,86 (с, 3Н). Приклад 4 2-(2-{2-[2-(2-{4-[2-(4Метиламінофеніл)вініл]феноксі}етоксі)етоксі]етоксі}етоксі)етанол (3d). Сполуку 3d одержували з 7d (15мг, 0,027ммоль) і TBAF (1Μ у ТГФ, 0,06мл) у ТГФ (1мл), з використанням такого ж способу, як описано для сполуки 3с. 3d (7,8мг, 65%): 1Н ЯМР δ 7,36 (м, 4Н), 6,87 (м, 4Н), 6,60 (д, 2Н, J=8,5Гц), 4,14 (т, 2Η), 3,85 (т, 2Η), 3,66 (м, 16Н), 2,86 (с, 3Н). Приклад 5 2-(2-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етоксі}етоксі)етанол (5с). Тетраетиленгліколь, 4с (1,12м, 5,77ммоль) і TBDMSCI (0,87м, 5,77ммоль) розчиняли в дихлорметані (25мл) з наступним додаванням триетиламіну (1,46г, 14,4ммоль). Розчин перемішували при кімнатній температурі протягом 2 годин. Після стандартної обробки з використанням дихлорметану залишок очищали хроматографією на силікагелі (50% етилацетат у гексані), одержуючи 5с (744мг, 33 42%): 1Н ЯМР δ 3,66 (м, 16Н), 2,51 (т, 1H, J=5,86Гц), 0,89 (с, 9Н), 0,07 (с, 6Н). Приклад 6 2-[2-(2-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етоксі}етоксі)етоксі]етанол (5d). Сполуку 5d одержували з пентаетиленгліколю, 4d (1,13г, 4,72ммоль), TBDMSCl (0,78г, 5,19ммоль) і триетиламіну (1,2г, 11,8ммоль) у дихлорметані (25мл) з використанням такого ж способу, як описано для сполуки 5с. 5d (668мг, 40%): 1H ЯМР δ 3,67 (м, 20Н), 2,64 (т, 1Н, J=5,63Гц), 0,89 (с, 9Н), 0,06 (с, 6Н). Приклад 7 (2-{2-[2-(2-Брометоксі)етоксі]етоксі}етокси)трет-бутилдиметилсилан(6с). Сполуку 5с (680мг, 2,20ммоль) і чотирибромистий вуглець (947мг, 2,86мг) розчиняли в дихлорметані (20мл). Розчин прохолоджували до 0°С на льодяний бані і додавали піридин (2,0мл), а потім трифенілфосфін (749мг, 0,286ммоль). Розчин перемішували при 0°С протягом півгодини та при кімнатній температурі протягом 2 годин. Після стандартної обробки з використанням дихлорметану залишок очищали хроматографією на силікагелі (20% етилацетат у гексані), одержуючи сполуку 6с (680мг, 79,6%): 1Н ЯМР δ 3,79 (м, 4Н), 3,66 (м, 8Н), 3,56 (т, 2Н), 3,47 (т, 2Н), 0,89 (с, 9Н), 0,07 (с, 6Н). Приклад 8 [2-(2-{2-[2-(2Брометоксі)етоксі]етоксі}етоксі)етокси]-третбутилдиметилсилан (6d). Сполуку 6d одержували з 5d (624мг, 1,77ммоль), чотирибромистого вуглецю (761мг, 2,30ммоль), трифенілфосфіну (602мг, 2,30ммоль), піридину (2,0мл) у дихлорметані (20мл) з використанням такого ж способу, як описано для сполуки 6с. 6d (400мг, 52,3 %): 1Н ЯМР δ 3,79 (м, 4Н), 3,66 (м, 12Н), 3,55 (т, 2Н), 3,47 (т, 2Н), 0,89 (с, 9Н), 0,06 (с, 6Н). Приклад 9 {4-[2-(4-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етоксі}феніл)вініл]феніл}метиламін (7а). Сполуку 3а (45мг, 0,14ммоль) і TBDMSCI (33мг, 0,22ммоль) розчиняли в дихлорметані (10мл) з наступним додаванням імідазолу (20мг, 0,29ммоль). Розчин перемішували при кімнатній температурі протягом 2 годин. Після стандартної обробки з використанням дихлорметану залишок очищали хроматографією на силікагелі (1,5% метанол у дихлорметані), одержуючи 7а (56мг, 91%): 1 Н ЯМР δ 7,40 (м, 4Н), 6,90 (м, 4Н), 6,75 (д, 2Н, J=7,9Гц), 4,15 (т, 2Η), 3,88 (т, 2Н), 3,82 (т, 2Н), 3,66 (т, 2Н), 2,85 (с, 3Н), 0,92 (с, 9Н), 0,09 (с, 6Н). Приклад 10 (4-{2-[4-(2-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етоксі}етокси)феніл]вініл}феніл)метиламін (7b). Сполуку 7b одержували з 3b (136мг, 0,38ммоль), TBDMSCI (86мг, 0,57ммоль), імідазолу (52мг, 0,76ммоль) у дихлорметані (10мл) з використанням такого ж способу, як описано для сполуки 7а. 7b (170мг, 95%): 1Н ЯМР δ 7,37 (м, 4Н), 91996 34 6,88 (м, 4Н), 6,66 (д, 2Н, J=8,6Гц), 4,14 (т, 2Н), 3,86 (т, 2Н), 3,75 (м, 6Н), 3,57 (т, 2Н), 2,88 (с, 3Н), 0,90 (c, 9Η), 0,07 (c, 6Η). Приклад 11 [4-(2-{4-[2-(2-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етоксі}етоксі)етокси]феніл}вініл)феніл]мет иламін (7с). Сполуку 7с одержували з 1 (98мг, 0,44ммоль), 6с (210мг, 0,57ммоль), K2СО3 (300мг, 2,18ммоль) у ДМФ (10мл), з використанням такого ж способу, як описано для сполуки 3а. 7с (213мг, 95%): 1 ЯМР δ 7,36 (м, 4Н), 6,87 (м, 4Н), 6,59 (д, 2Н, J=8,5Гц), 4,14 (т, 2Η), 3,86 (т, 2Η), 3,75 (м, 10Н), 3,55 (т, 2Η), 2,86 (с, 3Н), 0,89 (с, 9Н), 0,06 (с, 6Н). Приклад 12 {4-[2-(4-{2-[2-(2-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етoксі}етоксі)етоксі]етокси}феніл)вініл]фе ніл}метиламін (7d). Сполуку 7d одержували з 1 (97мг, 0,43ммоль), 6d (197мг, 0,47ммоль), K2СО3 (297мг, 2,15ммоль) у ДМФ (10мл), з використанням такого ж способу, як описано для сполуки 3а. 7d (220мг, 91%): 1Н ЯМР δ 7,36 (м, 4Н), 6,87 (м, 4Н), 6,59 (д, 2Н, J=8,5Гц), 4,14 (т, 2Н), 3,85 (т, 2Н), 3,75 (м, 14Н), 3,55 (т, 2Н), 2,86 (с, 3Н), 0,89 (с, 9Н), 0,06 (с, 6Н). Приклад 13 трет-бутиловий ефір {4-[2-(4-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етокси}феніл)вініл]феніл}метилкарбаміно вої кислоти (8а). В атмосфері азоту 7а (54мг, 0,13ммоль) розчиняли в безводному ТГФ (5,0мл) з наступним додаванням Вос-ангідриду (84мг, 0,25ммоль). Розчин нагрівали при кипінні зі зворотним холодильником протягом ночі. Після стандартної обробки з використанням дихлорметану залишок очищали препаративною ТШХ на силікагелі (2% метанол у дихлорметані), одержуючи 8а (60мг, 90%): 1Η ЯМР δ 7,43 (д, 4Н, J=8,4Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,7Гц), 4,14 (т, 2Н), 3,87 (т, 2Н), 3,80 (т, 2Н), 3,64 (т, 2Н), 3,27 (с, 3Н), 1,46 (с, 9Н), 0,90 (с, 9Н), 0,08 (с, 6Н). Приклад 14 трет-бутиловий ефір (4-{2-[4-(2-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етоксі}етокси)феніл]вініл}феніл)метилкарбамін ової кислоти (8b). Сполуку 8b одержували з 7b (124мг, 0,26ммоль) і Вос-ангідриду (218мг, 0,66ммоль) у ТГФ (10мл), з використанням такого ж способу, як описано для сполуки 8а. 8b (130мг, 86%): 1H ЯМР δ 7,43 (д, 4Н, J=8,4Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,7Гц), 4,15 (т, 2Η), 3,87 (т, 2Η), 3,75 (т, 6Η), 3,57 (т, 2Н), 3,27 (с, 3Н), 1,46 (с, 9Н), 0,90 (с, 9Н), 0,07 (с, 6Н). Приклад 15 трет-бутиловий ефір [4-(2-{4-[2-(2-{2-[2-(третбутилдиметилсиланілоксі)етоксі]етоксі}етоксі)етокси]феніл}вініл)феніл]мет илкарбамінової кислоти (8с). Сполуку 8с одержували з 7с (84мг, 0,16ммоль) і Вос-ангідриду (163мг, 0,49ммоль) у ТГФ (5мл), з використанням такого ж способу, як описано для 35 сполуки 8а. 8с (86мг, 86%): 1H ЯМР δ 7,42 (д, 4Н, J=7,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,7Гц), 4,15 (т, 2Н), 3,87 (т, 2Н), 3,73 (т, 10Н), 3,57 (т, 2Н), 3,26 (с, 3Н), 1,46 (с, 9Н), 0,89 (с, 9Н), 0,07 (с, 6Н). Приклад 16 трет-бутиловий ефір {4-[2-(4-{2-[2-(2-{2-[2(третбутилдиметилсиланілоксі)етоксі]етоксі}етоксі)етоксі]етокси}феніл)вініл]фе ніл}метилкарбамінової кислоти (8d). Сполуку 8d одержували з 7d (210мг, 0,51ммоль) і Вос-ангідриду (840мг, 2,54ммоль) у ТГФ (10мл), з використанням такого ж способу, як описано для сполуки 8а. 8d (174мг, 66,7%): Ή ЯМР δ 7,42 (д, 4Н, J=8,4Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,7Гц), 4,15 (т, 2Η), 3,86 (т, 2Η), 3,72 (т, 14Η), 3,55 (т, 2Н), 3,27 (с, 3Н), 1,46 (с, 9Н), 0,89 (с, 9Н), 0,06 (с, 6Н). Приклад 17 трет-бутиловий ефір [4-(2-{4-[2-(2гідроксіетоксі)етокси]феніл}вініл)феніл]метилкарбамінової кислоти (9а). Сполуку 9а одержували з 8а (56мг, 0,11ммоль) і TBAF (1Μ у ТГФ, 0,21мл) у ТГФ (5мл), з використанням такого ж способу, як описано для сполуки 3с. 9а (36мг, 82%): 1H ЯМР δ 7,43 (д, 4Н, J=8,4Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,7Гц), 4,18 (т, 2Η), 3,88 (т, 2Η), 3,78 (т, 2Η), 3,68 (т, 2Η), 3,27 (с, 3Н) 1,46 (с, 9Н). Приклад 18 трет-бутиловий ефір {4-[2-(4-{2-[2-(2гідроксіетоксі)етоксі]етокси}феніл)вініл]феніл}метилкарбаміно вої кислоти (9b) Сполуку 9b одержували з 8b (118мг, 0,21ммоль) і TBAF (1Μ у ТГФ, 0,42мл) у ТГФ (10мл), з використанням такого ж способу, як описано для сполуки 3с. 9b (94мг, 99,7%): 1Н ЯМР δ 7,43 (д, 4Н, J=8,4Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,7Гц), 4,17 (т, 2Η), 3,87 (т, 2Η), 3,74 (т, 6Η), 3,62 (т, 2Η), 3,27 (с, 3Н), 1,46 (с, 9Н). Приклад 19 трет-бутиловий ефір (4-{2-[4-(2-{2-[2-(2гідроксіетоксі)етоксі]етоксі}етокси)феніл]вініл}феніл)метилкар бамінової кислоти (9с). Сполуку 9с одержували з 8Ь (66мг, 0,11ммоль), TBAF (1Μ у ТГФ, 0,22мл) і THF (5мл), з використанням такого ж способу, як описано для сполуки 3с. 9с (50мг, 93,0%): 1Н ЯМР δ 7,43 (д, 4Н, J=8,4Гц), 7,20 (д. 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,7Гц), 4,16 (т, 2Н), 3,87 (т, 2Н), 3,78 (т, 10Н), 3,61 (т, 2Η), 3,27 (с, 3Н), 1,46 (с, 9Н). Приклад 20 трет-бутиловий ефір [4-(2-{4-[2-(2-{2-[2-(2гідроксіетоксі)етоксі]етоксі}етоксі)етокси]феніл}вініл)феніл]мет илкарбамінової кислоти (9d). Сполуку 9d одержували з 8d (76мг, 0,12ммоль) і TBAF (1М у ТГФ, 0,24мл) у ТГФ (5мл), з використанням такого ж способу, як описано для сполуки 3с. 9d (52мг, 82,7%): 1H ЯМР δ 7,43 (д, 4Н, J=8,4Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 91996 36 (д, 2Н, J=8,7Гц), 4,16 (т, 2Н), 3,87 (т, 2Н), 3,75 (т, 14Н), 3,60 (т, 2Η), 3,27 (с, 3Н), 1,46 (с, 9Н). Приклад 21 2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етиловий ефір метансульфонової кислоти (10а). Сполуку 9а (36мг, 0,087ммоль) розчиняли в дихлорметані (5мл) з наступним додаванням триетиламіну (44мг, 0,44ммоль). Потім за допомогою шприца додавали метансульфонілхлорид (30мг, 0,26ммоль). Розчин перемішували при кімнатній температурі протягом 4 годин. Після стандартної обробки з використанням дихлорметану залишок очищали препаративною ТШХ на силікагелі (2,0% метанол у дихлорметані), одержуючи 10а (39мг, 91%): 1Η ЯМР δ 7,43 (д, 4Н, J=8,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,98 (кв, 2Н), 6,89 (д, 2Н, J=8,6Гц), 4,41 (м, 2Н), 4,16 (м, 2Н), 3,87 (м, 4Н), 3,27 (с, 3Н), 3,05 (с, 3Н), 1,46 (с, 9Н). Елементний аналіз (C25H33NO7S) С. Η. Ν. Приклад 22 2-{2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}етиловий ефір метансульфонової кислоти (10b). Сполуку 10b одержували з 9b (81мг, 0,18ммоль), метансульфонілхлориду (62мг, 0,54ммоль) і триетиламіну (88мг, 0,88ммоль) у дихлорметані (8мл), з використанням такого ж способу, як описано для сполуки 10а. 10Ь (82мг, 1 86,5%): H ЯМР δ 7,43 (д, 4Н, J=8,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,6Гц), 4,38 (м, 2Н), 4,15 (м, 2Н), 3,85 (м, 2Н), 3,76 (м, 6Н), 3,27 (с, 3Н), 3,05 (с, 3Н), 1,46 (с, 9Н). Елементний аналіз (C27H37NO8S) С. Η. Ν. Приклад 23 2-(2-{2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}етоксі)етилови й ефір метансульфонової кислоти (10с). Сполуку 10с одержували з 9с (50мг, 0,10ммоль), метансульфонілхлориду (46мг, 0,40ммоль) і триетиламіну (50мг, 0,50ммоль) у дихлорметані (5мл), з використанням такого ж способу, як описано для сполуки 10а. 10с (56мг, 96,9%): 1H ЯМР δ 7,43 (д, 4Н, J=8,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,6Гц), 4,37 (м, 2Н), 4,16 (м, 2Н), 3,86 (м, 2Н), 3,76 (м, 10Н), 3,27 (с, 3Н), 3,06 (с, 3Н), 1,46 (с, 9Н). Елементний аналіз (C29H41NO9S) С Η. Ν. Приклад 24 2-[2-(2-{2-[2-(4-{2-[4-(третбутоксикарбонілметиламіно)феніл]вініл}феноксі)етоксі]етоксі}етоксі)етоксі]е тиловий ефір метансульфонової кислоти (10d). Сполуку 10d одержували з 9d (58мг, 0,11ммоль), метансульфонілхлориду (49мг, 0,43ммоль) і триетиламіну (54мг, 0,54ммоль) у дихлорметані (5мл), з використанням такого ж способу, як описано для сполуки 10а. 10d (63мг, 95%): 1Н ЯМР δ 7,43 (д, 4Н, J=8,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J=8,6Гц), 4,37 (м, 2Н), 4,18 (м, 2Н), 3,86 (м, 2Н), 3,75 (м, 14Н), 37 3,27 (с, 3Н), 3,07 (с, 3Н), 1,46 (с, 9Н). Елементний аналіз (C31H45NO10S) С Η. Ν. Приклад 25 трет-бутиловий ефіp [4-(2-{4-[2-(2фторетоксі)етокси]феніл}вініл)феніл]метилкарбамінової кислоти (11а). Безводний TBAF (Cox DP, et al., J. Org Chem. 1984; 49: 3216-19) (38,5мг 0,15ммоль) додавали до розчину сполуки 10а (14,5мг, 0,03ммоль) у безводному ТГФ (3мл). Суміш нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Після охолодження до кімнатної температури, використовували стандартну обробку дихлорметаном і залишок очищали препаративною ТШХ на силікагелі (2% метанол у дихлорметані), одержуючи сполуку 11а (7мг, 57%): 1Η ЯМР δ 7,43 (д, 4Н, J=8,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,91 (д, 2Н, J=8,6Гц), 4,60 (д, т, 2Н, J=47Гц, J2=4,0Гц), 4,17 (т, 2Η), 3,90 (т, 3Н), 3,75 (т, 1H), 3,27 (с, 3Н), 1,46 (с, 9Н). Приклад 26 трет-бутиловий ефір {4-[2-(4-{2-[2-(2-фторетоксі)етоксі]етокси}феніл)вініл]феніл}метилкарбаміно вої кислоти (11b). Сполуку 11b одержували з 10b (21мг, 0,04ммоль) і TBAF (52мг, 0,2ммоль) у ТГФ (10мл), з використанням такого ж способу, як описано для сполуки 11а. 11b (17мг, 94%): 1H ЯМР δ 7,43 (д, 4Н, J=8,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), Η 6,91 (д, 2Н, J=8,6Гц), 4,58 (д, т, 2 , J1=48Гц, J2=4,0Гц), 4,16 (т, 2Η), 3,85 (т, 3Н), 3,74 (т, 5Η), 3,26 (с, 3Н), 1,46 (с, 9Н). Приклад 27 трет-бутиловий ефір (4-{2-[4-(2-{2-[2-(2фторетоксі)етоксі]етоксі}етокси)феніл]вініл}феніл)метилкар бамінової кислоти (11e) Сполуку 11с одержували з 10с (18мг, 0,03ммоль) і TBAF (42мг, 0,16ммоль) у ТГФ (5мл), з використанням такого ж способу, як описано для сполуки 11а. 11с (12мг, 77%): 1Н ЯМР δ 7,43 (д, 4Н, J=8,6Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,91 (д, 2Н, J=8,6Гц), 4, 67 (т, 1H), 4,55 (д, т, 2Η, J1=48Гц, J2=4,0Гц), 3,85 (т, 3Н), 3,74 (т, 9Н), 3,27 (с, 3Н), 1,46 (с, 9Н). Приклад 28 трет-бутиловий ефір [4-(2-{4-[2-(2-{2-[2-(2фторетоксі)етоксі]етоксі}етоксі)етокси]феніл}вініл)феніл]мет илкарбамінової кислоти (11d). Сполуку 11d одержували з 10d (15мг, 0,024ммоль) і TBAF (32мг, 0,12ммоль) у ТГФ (5,0мл), з використанням такого ж способу, як описано для сполуки 11а. 11d (11мг, 84%): 1Н ЯМР δ 7,43 (д, 4Н, J=8,4Гц), 7,20 (д, 2Н, J=8,4Гц), 6,97 (кв, 2Н), 6,90 (д, 2Н, J-8,6Гц), 4,55 (д, т, 2Н, J1=48Гц, J2=4,0Гц), 4,15 (т, 2Н), 3,86 (т, 3Н), 3,72 (т, 13Η), 3,26 (с, 3Н), 1,46 (с, 9Н). Приклад 29 [4-(2-{4-[2-(2фторетоксі)етокси]феніл}вініл)феніл]метиламін(12а). 91996 38 Трифтороцтову кислоту (0,5мл) додавали повільно до розчину сполуки 11а (7,0мг, 0,017ммоль) у дихлорметані (1мл). Суміш потім перемішували при кімнатній температурі протягом 1 години. Після стандартної обробки з використанням дихлорметану залишок очищали препаративною ТШХ на силікагелі (1,0% метанол у дихлорметані), одержуючи 12а (3мг, 56%): 1Η ЯМР δ 7,37 (м, 4Н), 6,90 (м, 4Н), 6,65 (д, 2Н, J=8,4Гц), 4,60 (д, т, 2Η, J1=46Гц, J2=4,0Гц), 4,17 (т, 2Н), 3,90 (т, 3Н), 3,76 (т, 1H), 2,88 (с, 3Н). Елементний аналіз. (C19H22FNO2) С. Η. Ν. Приклад 30 {4-[2-(4-{2-[2-(2фторетоксі)етоксі]етокси}феніл)вініл]феніл}метиламін (12b). Сполуку 12b одержували з 11b (17мг, 0,037ммоль) у трифтороцтовій кислоті (1мл) і дихлорметані (2мл), з використанням такого ж способу, як описано для сполуки 12а. 12b (9мг, 68%): 1H ЯМР δ 7,37 (м, 4Н), 6,88 (м, 4Н), 6,64 (д, 2Н, J=8,4Гц), 4,56 (д, т, 2Η, J1=46Гц, J2=4,0Гц), 4,15 (т, 2Η), 3,87 (м, 3Н), 3,70 (м, 5Н). 2,87 (с, 3Н). Елементний аналіз. (C21H26FNO3) С. Η. Ν. Приклад 31 (4-{2-[4-(2-{2-[2-(2фторетоксі)етоксі]етоксі}етокси)феніл]вініл}феніл)метиламін (12с). Сполуку 12с одержували з 11з (12мг, 0,024ммоль) у трифтороцтовій кислоті (0,5мл) і дихлорметані (1мл), з використанням такого ж способу, як описано для сполуки 12а. 12с (7мг, 73%): 1Н ЯМР δ 7,37 (м, 4Н), 6,89 (м, 4Н), 6,62 (д, 2Н, J=8,4Гц), 4,55 (д, т, 2Η, J1=46Гц, J2=4,0Гц), 4,15 (т, 2Η). 3,86 (м, 3Н), 3,71 (м, 9Н), 2,87 (с, 3Н). Елементний аналіз. (C23H30FNO4) С. Η. Ν. Приклад 32 [4-(2-{4-[2-(2-{2-[2-(2фторетоксі)етоксі]етоксі}етоксі)етокси]феніл}вініл)феніл]мет иламін (12d). Сполуку 12d одержували з 11d (10мг, 0,018ммоль) у трифтороцтовій кислоті (0,3мл) і дихлорметані (1мл), з використанням такого ж способу, як описано для сполуки 12а. 12d (6мг, 73%): 1Н ЯМР δ 7,37 (м, 4Н), 6,88 (м, 4Н), 6,64 (д, 2Н, J=8,4Гц), 4,55 (д, т, 2Η, J1=46Гц, J2=4,0Гц), 4,14 (т, 2Η), 3,87 (м, 3Н), 3,70 (м, 13Н), 2,87 (с, 3Н). Елементний аналіз. (C25H34FNO5) С. Η. Ν. Приклад 33 [18F][4-(2-{4-[2-(2фторетоксі)етокси]феніл}вініл)феніл]метиламін ([18F]12a). [18F]Фторид, одержаний на циклотроні з використанням реакції 18O(p,n)18F, пропускали крізь картридж Sep-Pak Light QMA у вигляді водного розчину в збагаченій [18О] воді. Картридж сушили струмом повітря та активний F елюювали з використанням 2мл розчину Kryptofix 222 (K222)/K2СО3 (22мг K222 і 4,6мг K2СО3 у суміші CH3CN/H2O 1,77/0,23). Розчинник видаляли при 120°С у струмі аргону. Залишок двічі піддавали азеотропному сушінню з 1мл безводного CH3CN при 120°С у струмі аргону. Розчин мезилатного попередника 39 10а (4мг) у ДМСО (0,2мл) додавали в реакційну посудину, яка містить висушений радіоактивний 18 F. Розчин нагрівали при 120°С протягом 4 хвилин. Додавали воду (2мл) і розчин прохолоджували протягом 1 хвилини. Потім додавали НСl (10% водний розчин, 0,5мл) і суміш знову нагрівали при 120°С протягом 5 хвилин. Додавали водний розчин NaOH для доведення рН до лужного (рН8-9). Суміш екстрагували етилацетатом (1мл 2) і об'єднаний органічний шар сушили (Na2SO4), і розчинник видаляли в струмі аргону при обережному нагріванні (55-60°С). Залишок розчиняли в CH3CN і вприскували у ВЕРХ прилад для очищення [напівпрепаративна колонка Hamilton PRP-I (7,0 305мм, 10мкм), СН3СN/диметилглутаратний буфер (5мМ, рН7) 9/1; швидкість потоку 2мл/хв.]. Час утримування для 12а складав 8,9 хвилини в даній ВЕРХ системі і сполука гарно відділялася від сполуки-попередника 10а (час утримування =12хв.), а також побічного продукту гідролізу (час утримування = 6,2 хв). Одержання займало 90 хвилин, і радіохімічний вихід становив 20% (скоректований розпад). Для визначення радіохімічної чистоти та питомої активності (пит. акт.) використовували аналітичну ВЕРХ [аналітична колонка Hamilton PRP-I (4,1 250мм, 10мкм), СН3СN/диметилглутаратний буфер (5мМ, рН7) 9/1; швидкість потоку 0,5мл/хв.]. Час утримування 12а у даній системі складав 10,8хв. і радіохімічна чистота (РХЧ) перевищувала 99%. Питому активність оцінювали шляхом порівняння інтенсивності УΦ 18 піка очищеної [ F]10 з інтенсивністю порівняльної нерадіоактивної сполуки відомої концентрації. Питома активність (пит. акт.) складала 10001500Кі/ммоль після одержання. Приклад 34 [18F]{4-[2-(4-{2-[2-(2фторетоксі)етоксі]етокси}феніл)вініл]феніл}метиламін ([18F]12b). З використанням аналогічної реакції [18F]12b одержували з 10b. Радіохімічний вихід складав 30% (скоректований розпад), і радіохімічна чистота складала >99%. Час утримування 12b у ВЕРХ складав 11,7 хвилини для описаної вище аналітичної системи (Питома активність=13001500Кі/ммоль). Приклад 35 [18F][(4-{2-[4-(2-{2-[2-(2фторетоксі)етоксі]етоксі}етокси)феніл]вініл}феніл)метиламін ([!8F]12с). З використанням аналогічної реакції [18F]12c одержували з 10с. Радіохімічний вихід становив 10% (скоректований розпад), і радіохімічна чистота становила >99%. Час утримування 12с у ВЕРХ складав 11,7 хвилини для описаної вище аналітичної системи (Питома активність=900Кі/ммоль). Приклад 36 [18F][[4-(2-{4-[2-(2-{2-[2-(2фторетоксі)етоксі]етоксі}етоксі)етокси]феніл}вініл)феніл]мет иламін ([18F]12d). З використанням аналогічної реакції [18F]12d одержували з 10b. Радіохімічний вихід становив 91996 40 20% (скоректований розпад), і радіохімічна чистота становила >99%. Час утримування 12d у ВЕРХ складав 10,7 хвилини для описаної вище аналітичної системи (Питома активність =10001500Кі/ммоль). Приклад 37 4-аміно-4'-гідроксилстильбен(14а) Хлорид двовалентного олова (11,8г, 0,062 моль) додавали до розчину сполуки 13а (Frinton Lab) (3,0г, 0,012моль) в етанолі (100мл) з наступним додаванням концентрованої соляної кислоти (5,0мл). Розчин нагрівали при кипінні зi зворотним холодильником протягом 3 годин і прохолоджували до кімнатної температури та перемішували протягом ночі. Додавали водний розчин гідроксиду натрію (1Н) для доведення рН до 8,5-9. Після стандартної обробки з використанням дихлорметану одержували неочищений продукт 14а (2,6г, 100%). Продукт використовували на наступній стадії без додаткового очищення 1H ЯМР δ (ДМСО-d6) 9,39 (с, 1Н), 7,30 (д, 2Н, J=8,5Гц), 7,20 (д, 2Н, J=8,5Гц), 6,80 (м, 2Н), 6.72 (д, 2Н, J=8,5Гц), 6,53 (д, 2Н, J=8,5Гц), 5,19 (с, 2Н). Приклад 38 4-N,N'-диметиламіно-4'-гідроксилстильбен (15а) До суміші 14а (211мг, 1,0ммоль), параформальдегіду (300мг, 10ммоль) і ціаноборгідриду натрію (189мг, 3,0ммоль) додавали оцтову кислоту (10мл). Загальну суміш перемішували при кімнатній температурі протягом ночі та потім виливали в 100мл води. Додавали карбонат натрію для доведення до рН8-9. Після стандартної обробки з використанням 5%-ного метанолу в дихлорметані залишок очищали хроматографією на силікагелі (2,5%-ний метанол у дихлорметані), одержуючи 15а у вигляді білої твердої речовини (214мг, 89,5%): 1Н ЯМР δ 7,37 (м, 4Н), 6,87 (с, 2Н), 6,75 (м, 4Н), 4,68 (с, 1H), 2,98 (с, 6Н). Приклад 39 4-N,N'-диметиламіно-4'-(2,2-диметил[1,3]діоксан-5-ілметокси)стильбен (15b) В атмосфері азоту 15а (100мг, 0,38ммоль) розчиняли в безводному ДМФ (5,0мл). До даного розчину додавали карбонат калію (140мг, 1,0ммоль) з наступним додаванням 5-бромметил2,2-диметил-[1,3]діоксану 20m1 (105мг, 0,5ммоль). Суміш нагрівали до 100°С і перемішували протягом ночі. Після охолоджування до кімнатної температури застосовували стандартну обробку з використанням дихлорметану, і залишок очищали препаративною ТШХ на силікагелі (1% метанол у дихлорметані), одержуючи сполуку 15b (100мг, 72%): 1Н ЯМР δ 7,38 (м, 4Н), 6,88 (м, 4Н), 6,70 (д, 2Н, J=8,7Гц), 4,08 (м, 4Н), 3,87 (м, 2Н), 2,96 (с, 6Н), 2,13 (м, 1H), 1,46 (с, 3Н)5 1,42 (с, 3Н). Елементний аналіз (C23H29NO3) С. Η. Ν. Приклад 40 4-N,N'-диметиламіно-4'-(1,3-Дигідроксипропан2-ілметокси)стильбен(15с) Сполуку 15b (180мг, 0,49ммоль) суспендували в ацетоні (5,0мл) і прохолоджували до 0°С на льодяний бані. Повільно додавали протягом 20 хвилин 1н НСl (5,0мл, 5.0ммоль). Під час додавання суспензія перетворювалася на прозорий розчин. 41 Розчин перемішували при 0°С додатково протягом півгодини і потім нагрівали до кімнатної температури протягом півгодини. Додавали насичений розчин бікарбонату натрію для доведення рН до 8,5-9. Після стандартної обробки з використанням дихлорметану залишок очищали препаративною ТШХ на силікагелі (5% метанол у дихлорметані), одержуючи сполуку 15с у вигляді білої твердої речовини (140мг, 87%): 1Н ЯМР δ 7,40 (м, 4Н), 6,88 (м, 4Н), 6,74 (м, 2Н), 4,10 (д, 2Н, J=5,47Гц), 3,89 (д, 4Н, J=5,28Гц), 2,98 (с, 6Н), 2,22 (м, 1H). Елементний аналіз (C20H25NO3) С Η. Ν. Приклад 41 4-N,N'-диметиламіно-4'-(1-тозил-3гідроксипропан-2-ілметокси)стильбен (15d) Сполуку 15с (158мг, 0,49ммоль) розчиняли в безводному піридині (15мл) і охолоджували до 0°С на льодяний бані. Додавали тозилхлорид (137мг, 0,72ммоль) і розчин перемішували при 0°С протягом 2 годин. Після стандартної обробки з використанням дихлорметану залишок очищали препаративною ТШХ на силікагелі (5% метанол у дихлорметані), одержуючи сполуку монотозилату, 15d, у вигляді білої твердої речовини (95мг, 41%): 1 H ЯМР δ 7,75 (д, 2Н, J=8,26Гц), 7,37 (м, 4Н), 7,26 (м, 2Н), 6,88 (м, 2Н), 6,72 (м, 4Н), 4,26 (д, 2Н, J=5,66Гц), 3,97 (д, 2Н, J=5,96Гц), 3,79 (д, 2Н, J=5,24Гц), 2,95 (с, 6Н), 2,38 (м, 4Н). Елементний аналіз (C27H31NO5S) С, Н, N. Приклад 42 4-N,N'-диметиламіно-4'-(1-фтор-3гідроксипропан-2-ілметокси)стильбен (15е) Сполуку 15d (40мг, 0,083ммоль) розчиняли в безводному ТГФ (5,0мл). В атмосфері азоту повільно додавали безводний TBAF (150мг, 0,5ммоль) у безводному ТГФ (1,0мл). Розчин потім нагрівали при кипінні зі зворотним холодильником протягом 3 годин. Після охолодження до кімнатної температури проводили стандартну обробку з використанням дихлорметану і залишок піддавали препаративній ТШХ на силікагелі (5% метанол у дихлорметані), одержуючи продукт 15е (17мг, 62%): 1Н ЯМР δ 7,40 (м, 4Н), 6,89 (м, 4H), 6,70 (д, 2Н, J=8,82Гц), 4,67 (д д, 2Н, J1=47,1Гц, J2=5,46Гц), 4,10 (д, 2Н, J=5,86 Hz), 3,88 (д, 2Н, J=5,24Гц), 2,97 (с, 6Н), 2,40 (м, 1H), 1,76 (с, 1H). Елементний аналіз (C20H24FNO2) C, H, N. Приклад 43 4-нітро-4'-(2,2-диметил-[1,3] діоксан-5ілметокси)стильбен (13b) Сполуку 13b одержували з 13а (241мг, 1,0ммоль) з використанням такого ж способу, як описано для сполуки 15b. 13b (260мг, 70%): 1Н ЯМР δ 8,19 (д, 2Н, J=8,80Гц), 7,49 (м, 4Н), 7,07 (м, 2Н), 6,90 (д, 2Н, J=8,80Гц), 4,12 (м, 4Н), 3,89 (д, 2Н), 2,10 (м, 1H), 1,48 (с, 3Н), 1,43 (с, 3Н). Елементний аналіз, обчислено для (C21H23NO5) С, Η, Ν. Приклад 44 4-нітро-4'-(1,3-дигідроксипропан-2ілметокси)стильбен (13с) Сполуку 13с одержували з 13b (260мг, 0,7ммоль) з використанням такого ж способу, як описано для сполуки 15с. 13с (190мг, 82%): 1H ЯМР (CD3OD) δ 8,19 (д, 2Н, J=8,80Гц), 7,72 (д, 2Н, J=8,80Гц), 7,55 (д, 2Н, J=8,70Гц), 7,24 (кв, 2Н), 6,96 91996 42 (д, 2Н, J=8,70Гц), 4,09 (д, 2Н, J=5,78Гц), 3,74 (д, 4Н, J=5,94Гц), 2,14(м, 1H). Елементний аналіз. (C18H19NO5) С, Η, Ν. Приклад 45 4-нітро-4'-(1-тозил-3-гідроксипропан-2ілметокси)стильбен (13d) Сполуку 13d одержували з 13с (80мг, 0,24ммоль) з використанням такого ж способу, як описано для сполуки 15d. 13d (66мг, 56%): 1Η ЯМР δ 8,18 (д, 2Н, J=8,82Гц), 7,77 (д, 2Н, J=8,32Гц), 7,58 (д, 2Н, J=8,82Гц), 7,45 (д, 2Н, J=8,73Гц), 7,28 (д, 2Н, J=8,18Гц), 7,09 (кв, 2Н), 6,81 (д, 2Н, J=8,73Гц), 4,27 (д, 2Н, J=5,70Гц), 4,01 (м, 2Н), 3,80 (д, 2Н, J=5,61Гц), 2,40 (м, 4Н), 2,02 (с, 1H). Елементний аналіз. (C25H25NO7S) С, Η, Ν. Приклад 46 4-нітро-4'-(1-фтор-3-гідроксипропан-2ілметокси)стильбен (13е). Сполуку 13е одержували з 13d (33мг, 0,069ммоль) з використанням такого ж способу, як описано для сполуки 15е. 13е (20мг, 88%): 1Н ЯМР δ 8,19 (д, 2Н, J=8,83Гц), 7,58 (д, 2Н, J=8,84Гц), 7,48 (д, 2Н, J=8,74Гц), 7,10 (кв, 2Н), 6,94 (д, 2H, J=8,68Гц), 4,69 (д д, 2Н, J1=47,1Гц, J2=5,36Гц), 4,15 (д, 2Н, J=5,89 Hz), 3,90 (д, 2Н, J=5,43Гц), 2,43 (м, 1H), 1,74 (c, 1H). Елементний аналіз. (C18H18FNO4) С, Η, Ν. Приклад 47 4-аміно-4'-(1-фтор-3-гідроксипропан-2ілметокси)стильбен (14е). Сполуку 14е одержували з 13е (37мг, 0,11ммоль) з використанням такого ж способу, як описано для сполуки 14а. 14е (24мг, 71%): 1Н ЯМР δ 7,35 (м, 4Н), 6,90 (м, 4Н), 6,66 (д, 2Н, J=8,54Гц), 4,69 (д д, 2Н, J1=47,1Гц, J2=5,46Гц), 4,12 (д, 2Н, J=5,84Гц), 3,90 (д, 2Н, J=5,56Гц), 3,70 (с, 2Н), 2,39 (м, 1H), 1,71 (с, 1Н). Елементний аналіз, (C18H20FNO2) С, Η, Ν. Приклад 48 4-N-метил-аміно-4'-(1-фтор-3-гідроксипропан2-ілметокси)стильбен (16е) В атмосфері азоту метоксид натрію (22мг, 0,4ммоль) додавали до суспензії сполуки 14е (24мг, 0,08ммоль) у метанолі (6мл) з наступним додаванням параформальдегіду (12мг, 0,4ммоль). Розчин нагрівали при кипінні зі зворотним холодильником протягом 2 годин і прохолоджували до 0°С на льодяний бані. Додавали порціями боргідрид натрію (15мг, 0,4ммоль). Реакційну суміш знову нагрівали при кипінні зі зворотним холодильником протягом 1 години і виливали на дроблений лід. Після стандартної обробки з використанням дихлорметану, залишок піддавали препаративній ТШХ на силікагелі (4,5% метанол у дихлорметані), одержуючи продукт 16е (23мг, 92%): 1Н ЯМР δ 7,37 (м, 4Н), 6,87 (м, 4Н), 6,59 (д, 2Н, J=8,56Гц), 4,69 (д, д, 2Н, J1=47,1Гц, J2=5,44Гц), 4,12 (д, 2Н, J=5,86Гц), 4,00 (с, 1Н), 3,89, (д, 2Н, J=5,52Гц), 2,86 (с, 3Н), 2,41 (м, 1Н), 1,75 (с, 1H). Елементний аналіз (C19H22FNO2) С, Η, Ν. Приклад 49 4-N-метил-аміно-4'-гідроксистильбен (16а) Сполуку 16а одержували з 14а (105мг, 0,5ммоль) з використанням такого ж способу, як описано для сполуки 16е. 16а (100мг, 89%): 1Н 43 91996 ЯМР δ 7,34 (м, 4Н), 6,86 (с, 2Н), 6,79 (д, 2Н, J=8,58Гц), 6,60 (д, 2Н, J=8,58Гц), 2,85 (с, 3Н). Приклад 50 Загальний спосіб одержання стильбену 12 (n=6, 8) під дією мікрохвильового опромінення Синтез під дією мікрохвильового опромінення: Суміш 16а, алкілу вального агента (1екв.), K2СОу (3eкв.) у ДМФ (1мл/0,05ммоль SB-13) поміщували в герметично закриту пробірку та нагрівали в мікрохвильовій печі за наступних умов: 180°С, 10 хвилин, високий рівень поглинання. Потім розчинник видаляли і препаративна тонкошарова хроматографія (ПТШХ [СН2Сl2-МеОН (97:3) як проявний розчин] давала цільовий продукт (Вихід: 42-60% залежно від використаного алкілувального агента). Приклад 51 (4-(2-(4-(2-(2-(2-(2-(2-(2фторетоксі)етоксі)етоксі)етоксі)етоксі)етокси)феніл)вініл)фе ніл)метиламін (12, n=6): Вихід =60%. 1H ЯМР (200МГц, CDCI3) δ 7,2-7,5 (4Н, м), 6,8-7,0 (4Н, м), 6,59 (2Н, д, J=8,4Гц), 4,55 (2Н, д, т, J1=46Гц, J2=4,0Гц), 4,14 (2Н, т), 3,8-3,9 (3Н, м), 3,6-3,8 (17Н, м), 2,86 (3Н, с). Мас-спектр високого розрізнення [HRMS] (ΕΘ) m/z обчислений для [C27H38FNO6]+ 491,2683, знайдено 491,2667. Приклад 52 (4-(2-(4-(2-(2-(2-(2-(2-(2-(2-(2фторетоксі)етоксі)етоксі)етоксі)етоксі)етоксі)етоксі)етокси)ф еніл)вініл)феніл)метиламін (12, n=8): 1 Вихід: 42%. Н ЯМР (200МГц, CDCI3) δ 7,3-7,5 (4Н, м), 6,8-7,0 (4Н, м), 6,73 (2Н, д, J=8,2Гц), 4,55 (2Н, д, т, J1=46Гц, J2=4,0Гц), 4,14 (2Н, т), 3,8-3,9 (3Н, м), 3,5-3,8 (25Н, м), 2,89 (3Н, с). HRMS (El) m/z обчислено для [C31H46FNO8]+ 579,3207, знайдено 579,3192. Приклад 53 Одержання гомогенатів тканини мозку Посмертні тканини мозку одержували при аутопсії пацієнтів з AD і нейропатологічний діагноз був підтверджений сучасними критеріями (NIAReagan Institute Consensus Group, 1997). Потім 44 одержували гомогенати з вирізаної сірої речовини, одержаної у пацієнтів з AD, у забуференому фосфатом фізіологічному розчині (PBS, рН7,4) при концентрації приблизно 100мг сирої тканини/мл (скляний гомогенізатор з моторним приводом з установкою на 6 для 30 секунд). Гомогенати ділили на аліквоти порціями по 1мл і зберігали при 70°С протягом 6-12 місяців без втрати сигналу зв'язування. Приклад 54 Дослідження зв'язування Як повідомлялося раніше, [125I]IMPY, з питомою активністю 2200Кі/ммоль і радіохімічною чистотою більше 95% одержували з використанням стандартної реакції йоддестанілування та очищали на спрощеній С-4 міні-колонці (Kung М-Р, et al, Euro J Nucl Med Mo Imag. 2004; 31: 1136-45). Аналізи зв'язування проводили в борсилікатних скляних пробірках розміром 12 75мм. Реакційна суміш містила 50мкл гомогенатів мозку (20-50мкг), 50мкл [125Θ]ΘΜΡΥ (0,04-0,06нМ, розведеного в PBS) і 50мкл інгібіторів (10-5-10-10М, розведені серійно в PBS, який містить 0,1% бичачого сироваткового альбуміну, БСА) у кінцевому об'ємі 1мл. Неспецифічне зв'язування визначали в присутності ΘΜΡΥ (600нМ) у таких самих пробірках для аналізу. Суміш інкубували при 37°С протягом 2 годин, і зв'язану та вільну радіоактивність відокремлювали фільтруванням у вакуумі через фільтри Whatman GF/B з використанням харвестера для клітин Brandel M-24R, з наступним промиванням 2 3мл PBS при кімнатній температурі. Фільтри, які містять зв'язаний 125І, аналізували на вміст радіоактивності з використанням гамма-лічильника (Packard 5000) з 70% ефективністю підрахунку. В умовах аналізу специфічно зв'язані фракції становили менше 15% загальної радіоактивності. Результати експериментів по інгібуванню аналізували методом нелінійної регресії з використанням EBDA, за допомогою чого розраховували величини Кі. Результати представлені в таблиці 1. Таблиця 1 IMPY SB-13 РІВ FMAPO Ki±SEM (nM) 1,4±0,4* 1,2±0,7* 2,8±0,5+ 5,0±1,2+ 3а, n=2 3b, n=3 3с, n=4 3d, n=5 Ki±SEM (nM) Х=ОН 5,2±0,4 2,8±0,2 4,6±0,2 5,2±0,2 12а, n=2 12b, n=3 12с, n=4 12d, n=5 Ki±SEM (nM) X=F 2,9±0,2 6,7±0,3 4,4±0,8 6,0±0,8 * Кожне значення одержували за трьома незалежними вимірюваннями, проведеними у дворазовій повторностi. Фторовані ПЕН-стильбени (12a-d) продемонстрували чудову афінність зв'язування (Kі=2,96,7нМ); тоді як відповідні гідроксилзаміщені аналоги (3а-d) також проявляли дуже високу афінність зв'язування (Kі=2,8-5,2нМ) (Таблиця 1). Ліпофільність даної серії мічених агентів [18F]12a-d знаходилася в придатному діапазоні (значення logP становили 2,52, 2,41, 2,05 і 2,28 для n=2-5, відповідно). Група ПЕГ здатна модулювати молекуляр ний розмір і відстань між атомом фтору та структурою ядром стильбену, не спричиняючи впливу на специфічну афінність зв'язування з Αβ бляшками. Приклад 55 Плівкова ауторадіографія Зрізи головного мозку суб'єктів з AD одержували, заморожуючи мозок у порошкоподібному сухому льоді та нарізаючи його на зрізи товщиною 45 91996 20 мікрометрів. Зрізи інкубували з міченими [18F] атомами (200000-250000 кількість імпульсів на хвилину/200мкл) протягом 1 години при кімнатній температурі. Два зрізи потім занурювали в насичений розчин Li2CO3 в 40% ЕtOН (два промивання по дві хвилини) і промивали 40% ЕtOН (одне двохвилинне промивання) з подальшим промиванням водою протягом 30 секунд. Після висушування плівку Kodak MR піддавали впливу 18F-мічених зрізів протягом ночі. Приклад 56 Введення мітки в бляшки in vivo з використанням [18F]12b і [18F]12d Оцінку in vivo проводили з використанням або двічі трансгенних APP/PS1 або однократно трансгенних АРР2576 мишей, які були люб'язно надані AstraZeneca. Після анестезії з використанням 1% ізофлурану 250-300мкКі [18F]12b або [18F]12d в 200мкл 0,1% розчину BSA вводили у вигляді ін'єкції у хвостову вену. Тварині давали можливість прийти в себе протягом 60 хвилин і потім вбивали їх шляхом відсікання голови. Мозок одразу ж видаляли та заморожували в порошкоподібному сухому льоді. Нарізали 20 мікрометрові зрізи і плівку 46 Kodak MR піддавали впливу протягом ночі. У такий спосіб одержували ex vivo плівкові ауторадіограми. Приклад 57 Розподіл в органах у нормальних мишей При анестезії ізофлураном 0,15мл 0,1% розчину бичачого сироваткового альбуміну, який містить [18F]-трейсери (5-10мкКі), вводили безпосередньо у хвостову вену мишей ICR (22-25г, самці). Мишей (n=3 для кожної часової точки) умертвляли шляхом зсування шиї через 120 хвилин після ін'єкції. Органи, які представляють інтерес, видаляли та зважували, і аналізували радіоактивність на вміст радіоактивності за допомогою автоматичного лічильника гамма-випромінювання. Розраховували відсоток дози на орган шляхом порівняння кількості імпульсів для тканин і розведених придатним чином аліквотами речовини, введеної у вигляді ін'єкції. Розраховували загальну активність крові, виходячи із припущення, що вона становить 7% від загальної маси тіла. Для зразків розраховували % дози/г шляхом порівняння кількості імпульсів для зразка з кількістю імпульсів розведеної первинної дози. Таблиця 2 Біорозподілення в мишей ІСR після внутрішньовенної інфекції [18F]12a-d в 0,1% BSA (% дози/г, середнє значення для 3 мишей ±середньоквадратичне відхилення) 2А: 12b Орган Кров Серце М'язи Легеня Нирка Селезінка Печінка Шкіра Мозок Кістки 2В: 12а, 12с, 12d 12а Кров Мозок Кістки 12с Кров Мозок Кістки 12d Кров Мозок Кістки 2хв. 3,14±0,69 6,25±1,79 1,06±0,39 6,87±1,36 10,95±2,63 4,57±1,07 21,5±4,44 1,18±0,23 7,77±1,70 1,43±0,09 30хв. 2,80±0,44 2,18±0,32 1,78±0,34 3,20±0,54 6,31±0,58 1,81±0,24 13,0±0,72 2,36±0,29 1,59±0,22 1,22±0,17 1 година 2,51±0,57 2,13±0,50 1,45±0,26 3,04±0,96 5,68±1,24 1,48±0,91 13,2±2,53 2,07±0,40 1,61±0,39 1,77±0,64 2 години 2,03±0,25 1,53±0,08 0,90±0,06 2,42±0,36 2,05±1,58 1,54±0,17 7,20±0,59 1,23±0,16 1,39±0,08 2,74±0,08 2хв. 2,64±0,55 8,14±2,03 1,89±0,25 2хв. 3,22±0,20 6,59±0,19 2,31±0,12 2хв. 4,99±0,38 7,30±1,05 2,24±0,21 30хв. 2,42±0,27 3,00±0,16 1,40±0,11 30хв. 1,88±0,08 1,27±0,03 1,00±0,02 30хв. 4,66±0,06 2,43±0,03 2,29±0,21 1 година 2,04±0,16 2,60±0,22 1,71±0,23 1 година 1,81±0,48 1,20±0,10 0,98±0,27 1 година 2,89±0,11 1,77±0,11 1,66±0,01 2 години 2,77±0,63 2,14±0,06 2,88±0,07 2 години 1,60±0,12 1,21±0,06 1,50±0,05 2 години 2,59±0,18 1,62±0,03 2,35±0,27 Радіоактивні сполуки, включаючи [18F]12a-d, проникають незачепленими крізь гематоенцефалічний бар'єр, демонструючи чудове поглинання мозком звичайних мишей (6,6-8,1% дози/г мозку) через 2 хвилин після внутрішньовенної ін'єкції (Таблиця 2А і В). Оскільки для експериментів по дослідженню біорозподілення використовували звичайних мишей, наявності Αβ бляшок у мозку даних молодих мишей не очікувалося; отже мічені 18 агенти, [ F]12a-d, швидко вимивалися з мозку (1,2-2,6% дози/г мозку) через 60 хвилин після внутрішньовенної ін'єкції. Високе первинне поглинання і швидке вимивання з мозку звичайних мишей (не мають Αβ бляшок у мозку) є надзвичайно бажаними властивості візуалізуючих агентів Αβ бляшок. Значення, представлені в таблиці 2, порівняні 47 91996 з описаними для [11С]РІВ і [11C]SB-13 (Mathis CA, et al, Curr Pharm Des. 2004; 10: 1469-92; Ono M, et al., Nucl Med Biol. 2003; Mathis CA, et al., J Med Chem. 2003). 18 Докладне біорозподілення [ F]12b показане в таблиці 2А. Очевидно, що через 2 хвилини після ін'єкції сполука поглиналася печінкою, нирками, легенями й м'язами, відбиваючи загальний характер перфузії крові. Поглинання кістками через 120 хвилин було високим (2,74% дози/г), що дозволяє припустити, що тут можливе дефторування in vivo. Однак вільний фтор не поглинався тканиною мозку; отже, поглинання в кістках було відносно низьким. Інші похідні ПЕГ-стильбену 12a,c,d, продемонстрували аналогічний характер біорозподілення (Таблиця 2В). Приклад 58 Коефіцієнт розподілу Коефіцієнти розподілу виміряні шляхом змішування в пробірці для тестування [18F]-трейсеpa з 1октанолом і буфером (0,1Μ фосфат, рН7,4), по 3г кожного. Пробірку для тестування піддавали ви Комп’ютерна верстка Т. Чепелева 48 хровому струшуванню протягом 3 хвилин при кімнатній температурі з наступним центрифугуванням протягом 5 хвилин. За допомогою ямкового лічильника проводили зчитування показань для двох зважених зразків (по 0,5 кожного), відібраних з фаз 1-октанолу і буфера. Коефіцієнт розподілу визначали, розраховуючи співвідношення кількості імпульсів на хвилину/г для 1-октанолу до такого ж значення для буфера. Для зразків, одержаних із шару 1-октанолу, проводили повторний перерозподіл до одержання стійких величин коефіцієнтів розподілу (зазвичай 3-й або 4-й розподіл). Вимірювання проводили в трикратній повторності та повторювали тричі. Звичайним фахівцям у даній галузі буде зрозуміло, що те ж саме може бути здійснене в широкому та еквівалентному діапазоні умов, препаратів і інших параметрів, не виходячи за межі обсягу винаходу або будь-якого варіанта його здійснення. Всі процитовані в даному описі патенти, патентні заявки і публікації повністю включені в нього як посилання у всій своїй повноті. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюStilbene derivatives and their use for binding and imaging amyloid plaques
Автори англійськоюKung Hank F., Kung Mei-Ping, Zhuang Zhi-Ping
Назва патенту російськоюПроизводные стильбена и их применение для связывания и визуализации амилоидных бляшек
Автори російськоюКунг Ханк Ф., Кунг Мей-Пинг, Чжуанг Чжи-Пинг
МПК / Мітки
МПК: A61K 49/00
Мітки: застосування, візуалізації, зв'язування, бляшок, похідні, амілоїдних, стильбену
Код посилання
<a href="https://ua.patents.su/24-91996-pokhidni-stilbenu-ta-kh-zastosuvannya-dlya-zvyazuvannya-ta-vizualizaci-amilodnikh-blyashok.html" target="_blank" rel="follow" title="База патентів України">Похідні стильбену та їх застосування для зв’язування та візуалізації амілоїдних бляшок</a>
Попередній патент: Способи нанесення покриття металу на підкладку автокаталітичним осадженням, ванна для здійснення способів та виріб з нанесеним покриттям
Наступний патент: Пристрій для передачі рідини, забарвлюючий пристрій та стикувальний елемент забарвлюючого пристрою
Випадковий патент: Пальниковий пристрій












