Сполука, застосовна для лікування дегенеративних і запальних захворювань
Формула / Реферат
1. Сполука формули І:
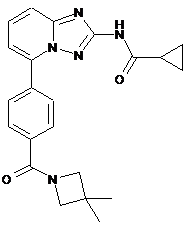
або її фармацевтично прийнятна сіль.
2. Фармацевтична композиція, що містить фармацевтично прийнятний носій і фармацевтично ефективну кількість сполуки або її фармацевтично прийнятної солі за п. 1.
3. Фармацевтична композиція за п. 2, що містить додатковий терапевтичний агент.
4. Застосування сполуки або її фармацевтично прийнятної солі за п. 1 для одержання лікарського засобу.
5. Сполука або її фармацевтично прийнятна сіль за п. 1 як лікарський засіб.
6. Сполука або її фармацевтично прийнятна сіль за п. 1, призначена для лікування, попередження і/або профілактики запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6.
7. Застосування сполуки або її фармацевтично прийнятної солі за п. 1 для одержання лікарського засобу для лікування, попередження і/або профілактики запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6.
8. Спосіб лікування або профілактики запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6, при цьому зазначений спосіб включає в себе введення ефективної кількості сполуки або її фармацевтично прийнятної солі за будь-яким із пп. 1, 4 або 5 або фармацевтичної композиції за п. 2.
9. Спосіб за п. 8, в якому запальний стан являє собою ревматоїдний артрит.
10. Спосіб за п. 8, в якому стан або захворювання включає в себе запалення.
11. Спосіб за п. 8, де сполуку за п. 1 вводять у поєднанні з додатковим терапевтичним агентом.
12. Фармацевтична композиція за п. 3, де додатковий терапевтичний агент являє собою агент для лікування, попередження або профілактики запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6.
13. Спосіб за п. 11, де додатковий терапевтичний агент являє собою агент для лікування, попередження або профілактики запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6.
Текст
Реферат: Описана сполука, що має формулу, представлену в описі винаходу. Дану сполуку можна одержати у вигляді фармацевтичної композиції, яка може бути використана для попередження і лікування ряду станів у ссавців, включаючи людей, включаючи, як необмежуючі приклади, запальні стани, аутоімунні захворювання, проліферативні захворювання, відторгнення трансплантата, захворювання, що включають у себе погіршення відновлювання хрящової тканини, природжені вади розвитку хрящової тканини і/або захворювання, пов'язані з гіперсекрецією IL6. UA 105796 C2 (12) UA 105796 C2 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується сполуки, яка є інгібітором JAK, сімейства тирозинкіназ, що беруть участь у запальних станах, автоімунних захворюваннях, проліферативних захворюваннях, відторгненні трансплантата, захворюваннях, що включають у себе погіршення відновлювання хрящової тканини, вроджені вади розвитку хрящової тканини і/або захворювання, пов'язані з гіперсекрецією IL6. У даному винаході також надані способи одержання даної сполуки, фармацевтичні композиції, що містять дану сполуку, і способи попередження і/або лікування запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6, шляхом введення сполуки даного винаходу. Янус-кінази (JAK) являють собою цитоплазматичні тирозинкінази, що передають цитокіновий сигнал від мембранних рецепторів до факторів транскрипції STAT. Описано чотири члени сімейства JAK: JAK1, JAK2, JAK3 і TYK2. При зв'язуванні цитокіну зі своїм рецептором члени сімейства JAK ауто- і/або трансфосфорилують один одного з подальшим фосфорилуванням STAT, які потім мігрують в ядро для модулювання транскрипції. Внутрішньоклітинна передача сигналу JAK-STAT забезпечується інтерферонами, більшістю інтерлейкінів, а також безліччю цитокінів і ендокринних факторів, таких як ЕРО, ТРО, GH, OSM, LIF, CNTF, GM-CSF і PRL (Vainchenker W. et al. (2008)). Генетичні моделі в поєднанні із дослідженням малих молекул інгібіторів JAK виявили терапевтичний потенціал декількох JAK. За допомогою генетики мишей і людей підтверджено, що JAK3 є імуносупресорною мішенню (O'Shea J. et al. (2004)). Інгібітори JAK3 були успішно прийняті у клінічну розробку, спочатку для випадків відторгнення трансплантата органів, але згодом також і для інших імунозапальних показань, таких як ревматоїдний артрит (RA), псоріаз і хвороба Крона (http://clinicaltrials.gov/). TYK2 являє собою можливу мішень у разі імунозапальних захворювань, що підтверджено методом генетики людини і дослідженнями нокаутних мишей (Levy D. And Loomis С. (2007)). JAK1 являє собою нову мішень у галузі імунозапальних захворювань. JAK1 гетеродимеризується з іншими JAK для передачі сигналу від прозапальних цитокінів. Отже, очікується, що інгібування JAK1 і/або інших JAK надасть сприятливий терапевтичний вплив у разі ряду запальних станів, а також інших захворювань, що передаються шляхом JAKопосередкованої передачі сигналу. Передумови до створення винаходу Дегенерація хряща є ознакою різних захворювань, серед яких найбільш відомими є ревматоїдний артрит і остеоартрит. Ревматоїдний артрит (RA) являє собою хронічне дегенеративне ураження суглоба, що характеризується запаленням і руйнуванням структур суглоба. Якщо не лікувати дане захворювання, це призводить до значної недієздатності і болю внаслідок втрати функцій суглоба, і навіть до передчасної смерті. Таким чином, метою терапії RA є не тільки сповільнити розвиток хвороби, але добитися ремісії, щоб зупинити руйнування суглоба. Внаслідок тяжкості наслідків даного захворювання, широке поширення RA (приблизно 0,8 % дорослих уражені по всьому світу) означає великий соціо-економічний вплив. (Щодо оглядів із RA автори винаходу посилаються на Smolen and Steiner (2003); Lee and Weinblatt (2001); Choy and Panayi (2001); O'Dell (2004) і Firestein (2003)). Остеоартрит (який називають також ОА, або артрит, зумовлений зношуванням) являє собою найбільш поширену форму артриту і характеризується втратою суглобового хряща, часто пов'язану з гіпертрофією кістки і болем. Стосовно вичерпного огляду з остеоартриту автори винаходу звертаються до Wieland et al., (2005). Остеоартрит насилу піддається лікуванню. У цей час відсутні надійні методи лікування, і лікування спрямоване на полегшення болю і попередження деформації ураженого суглоба. Загальноприйняті методи лікування включають у себе використання нестероїдних і протизапальних лікарських препаратів (NSAID). Незважаючи на те, що для лікування остеоартриту рекомендують харчові добавки, такі як хондроїтин і сульфат глюкозаміну, у ході недавнього клінічного дослідження було з'ясовано, що обидва методи лікування не зменшують біль, пов'язаний із остеоартритом (Clegg et al., 2006). Загалом, доступні лікарські засоби, що коректують захворювання остеоартритом, відсутні. Стимуляція анаболічних процесів, блокування катаболічних процесів або поєднання двох цих процесів, може призвести до стабілізації суглоба і, можливо, навіть реверсії ураження і, отже, попереджає подальший розвиток даного захворювання. Анаболічна стимуляція хондроцитів може стимулюватися різними спусковими механізмами. Інсуліноподібний фактор росту-I (IGF-I) є домінуючим анаболічним фактором росту в синовіальній рідині і стимулює синтез як протеогліканів, так і колагену. Крім того, було показано, що члени сімейства 1 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 морфогенетичних білків кісток (ВМР), а саме, ВМР2, ВМР4, ВМР6 і ВМР7, і члени сімейства трансформуючих факторів росту людини-β (TGF-β) здатні викликати анаболічну стимуляцію хондроцитів (Chubinskaya and Kuettner, 2003). Недавно була ідентифікована сполука, що викликає анаболічну стимуляцію хондроцитів (патент США № 6500854; ЕР 1391211). Однак для більшості із цих сполук виявляються серйозні побічні ефекти, і отже, існує значна необхідність у сполуках, що стимулюють диференціацію хондроцитів без цих побічних ефектів. Vandeghinste et al. (WO 2005/124342) виявили, що JAK1 являє собою мішень, інгібування якої може мати терапевтичне значення у випадку декількох захворювань, включаючи ОА. JAK1 належить до сімейства Янус-кіназ (JAK) цитоплазматичних тирозинкіназ, що беруть участь в опосередкованій цитокіновими рецепторами внутрішньоклітинній передачі сигналу. Сімейство JAK складається з 4 членів: JAK1, JAK2, JAK3 і TYK2. JAK залучаються до цитокінових рецепторів при зв'язуванні з цитокіном із подальшою гетеродимеризацією цитокінового рецептора і разом використовуваної рецепторної субодиниці (загальний ланцюг гамма-с, gp130). Потім JAK активуються шляхом авто- і/або трансфосфорилування іншої JAK, що призводить до фосфорилування рецепторів і рекрутингу і фосфорилування членів передавачів сигналу та активатора транскрипції (STAT). Фосфорилування STAT димеризуються і переміщуються в ядро, де вони зв'язуються з енхансерними ділянками цитокін-респонсивних генів. Нокаут гена JAK1 у мишей показав, що JAK1 відіграє істотні і не надмірні ролі в процесі розвитку: JAK1-/- мишей померли протягом 24 годин після народження, і розвиток лімфоцитів був сильно порушений. Більше того клітини JAK1-/- не були або були менш реакційноздатними стосовно цитокінів, ніж у разі використання цитокінових рецепторів II класу, цитокінових рецепторів, що використовують субодиницю гамма-с для передачі сигналу, і сімейства цитокінових рецепторів, що використовують субодиницю gp130 для передачі сигналу (Rodig et al., 1998.) Різні групи мали на увазі передачу сигналу JAK-STAT у біології хондроцитів. Li et al. (2001) показали, що онкостатин М викликає експресію генів ММР і TIMP3 у первинних хондроцитах за рахунок активації шляхів передачі сигналу JAK/STAT і МАРКА. Osaki et al. (2003) показали, що опосередковане інтерфероном-гамма інгібування колагену II у хондроцитах включає в себе передачу сигналу JAK-STAT. IL1-бета викликає катаболізм хряща за рахунок зниження експресії компонентів матриксу, і за рахунок експресії колагеназ та індукованої синтази оксиду азоту (NOS2), яка опосередковує утворення оксиду азоту (NO). Otero et al., (2005) показали, що лептин і IL1-бета синергетично спричиняють утворення NO, або експресію NOS2 мРНК у хондроцитах, і що вона блокується інгібітором JAK. Legendre et al. (2003) показали, що рецептор IL6/IL6 викликає даунрегуляцію хрящ-специфічних матриксних генів колагену II, ядра агрекану і зв'язувального білка в суглобових хондроцитах бика, і що це опосередковується передачею сигналу JAK/STAT. Отже, дані спостереження передбачають роль активності JAK-кінази в гомеостазі хряща і терапевтичні можливості для інгібіторів JAK-кіназ. Члени сімейства JAK брали участь у додаткових станах, що включають у себе мієлопроліферативні порушення (O'Sullivan et al., 2007, Mol Immunol. 44(10):2497-506), для яких були визначені мутації в JAK2. Це вказує на те, що інгібітори JAK, зокрема, JAK2, також можуть бути використані при лікуванні мієлопроліферативних порушень. Крім того, сімейство JAK, зокрема, JAK1, пов'язане з різними видами раку, зокрема, різними видами лейкозу, наприклад, гострим мієлоїдним лейкозом (O'Sullivan et al., 2007, Mol Immunol. 44(10):2497-506; Xiang et al., 2008, "Identification of somatic JAK1 mutations in patients with acute myeloid leukemia" Blood First Edition Paper, prepublished online December 26, 2007; DOI10.1182/blood-2007-05-090308) і гострим лімфобластним лейкозом (Mullighan et al., 2009), або солідними пухлинами, наприклад, лейоміосаркомою матки (Constantinescu et al., 2007, Trends in Biochemical Sciences 33(3): 122131), раком передміхурової залози (Tam et al., 2007, British Journal of Cancer, 97, 378-383). Ці результати вказують на те, що інгібітори JAK, зокрема, JAK1 і/або JAK2, можуть також бути використані при лікуванні різних видів раку (лейкозу і солідних пухлин, наприклад, лейоміосаркоми матки, раку передміхурової залози). Крім того, хвороба Кастлмана, множинна мієлома, мезангіальний проліферативний гломерулонефрит, псоріаз і саркома Капоші, мабуть, походять внаслідок гіперсекреції цитокіну IL-6, біологічні ефекти якого опосередковуються внутрішньоклітинною передачею сигналу JAKSTAT (Tetsuji Naka, Norihiro Nishimoto and Тadamitsu Kishimoto, Arthritis Res 2002, 4 (suppl 3):S233-S242). Ці результати вказують на те, що інгібітори JAK можуть також бути використані при лікуванні зазначених захворювань. Для JAK3 і Tyk2 був встановлений зв'язок з автоімунними захворюваннями. Мутації в JAK3, а також у верхніх компонентах передачі сигналу ланцюга гамма-с рецептора і IL7 складають разом приблизно 70 % випадків важкого комбінованого імунодефіциту. Потрібно зазначити, що 2 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 JAK1 співробітничає з JAK3 у передачі сигналів від ланцюга гамма-с рецептора. Поліморфізм Tyk2 помітний у системного червоного вовчака (SLE) (O'Sullivan et al., 2007, Mol Immunol. 44(10):2497-506). Тому вибирання мішенню сімейства JAK може надати терапевтичну можливість у галузі імунозапальних захворювань. Існуючі в цей час терапевтичні методи лікування не є задовільними, і отже, зберігається необхідність в одержанні інших сполук, які можуть бути корисними при лікуванні запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6. Таким чином, у даному винаході надана сполука, способи її одержання і фармацевтичні композиції, що містять сполуку даного винаходу разом із придатним фармацевтичним носієм. Зокрема, дана сполука виявляє високу ефективність і селективність стосовно JAK1 у порівнянні з іншими членами сімейства JAK, крім 385 кінази і некіназних мішеней. Крім того, дані вказують на те, що дана сполука має хороші межі безпеки. Тому зроблений висновок про те, що в даному винаході запропонована нова можливість лікування захворювань, опосередкованих JAK1, зокрема, запальних захворювань, таких як SLE (системний червоний вовчак) і RA. Крім того, у даному винаході надане використання сполук винаходу для одержання лікарського засобу для лікування даних захворювань і станів. Стислий опис суті винаходу Даний винахід ґрунтується на відкритті того факту, що інгібітори JAK, зокрема, JAK1, є застосовними для лікування запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад розвитку хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6. У даному винаході також надані способи одержання даних сполук, фармацевтичні композиції, що містять дані сполуки, і способи лікування запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад хрящової тканини і/або захворювань, пов'язаних із гіперсекрецією IL6, при введенні сполуки даного винаходу. Відповідно, у першому аспекті винаходу описана сполука даного винаходу, що має формулу I: Сполука винаходу являє собою новий інгібітор JAK, що виявляє високу ефективність і селективність стосовно JAK1 у порівнянні з іншими членами сімейства JAK, крім 385 кінази і некіназних мішеней, а також має хороші межі безпеки. Використання сполуки з таким профілем може призвести до переваг при лікуванні запальних захворювань, зокрема, SLE і RA, завдяки низькому відсотку неспецифічних ефектів. У наступному аспекті в даному винаході надані фармацевтичні композиції, що містять сполуку даного винаходу, і фармацевтичний носій, ексципієнт або розріджувач. Крім того, сполука даного винаходу, є застосовною в фармацевтичних композиціях і описаних у даному описі способах лікування, є фармацевтично прийнятною, згідно з одержанням і використанням. У даному аспекті винаходу фармацевтична композиція може також містити додаткові активні інгредієнти, придатні для використання в поєднанні зі сполукою даного винаходу. У наступному аспекті винаходу в даному винаході наданий спосіб лікування ссавця, сприйнятливого або ураженого станом із числа перерахованих у даному описі, і зокрема, таким станом, який може бути пов'язаний із аберантною активністю JAK, наприклад, запальними станами, автоімунними захворюваннями, проліферативними захворюваннями, відторгненням трансплантата, захворюваннями, що включають у себе погіршення відновлювання хрящової тканини, природженими вадами розвитку хрящової тканини і/або захворюваннями, пов'язаними з гіперсекрецією IL6, при цьому даний спосіб включає в себе введення терапевтично 3 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 ефективної кількості сполуки даного винаходу або однієї або більш розкритих в описі фармацевтичних композицій. У конкретному аспекті в даному винаході наданий спосіб лікування ссавця, сприйнятливого або ураженого станом, який може бути пов'язаний з аберантною активністю JAK, зокрема, запальними станами, проліферативними захворюваннями і захворюваннями, що включають у себе погіршення відновлювання хрящової тканини. У наступному аспекті в даному винаході надана сполука даного винаходу, призначена для лікування або попередження стану з числа перерахованих у даному описі, зокрема, таких станів, які можуть бути пов'язані з аберантною активністю JAK, такі як запальні стани, автоімунні захворювання, проліферативні захворювання, відторгнення трансплантата, захворювання, що включають у себе погіршення відновлювання хрящової тканини, природжені вади розвитку хрящової тканини і/або захворювання, пов'язані з гіперсекрецією IL6. У конкретному аспекті в даному винаході надана сполука даного винаходу, призначена для лікування або попередження стану, пов'язаного з аберантною активністю JAK1, зокрема, запальних станів, проліферативних захворювань, і захворювань, що включають у себе погіршення відновлювання хрящової тканини. У ще одному аспекті, пов'язаному зі способом лікування, у даному винаході наданий спосіб лікування ссавця, сприйнятливого або ураженого станом, причинно пов'язаним з описаною в даному описі аномальною активністю JAK, при цьому даний спосіб включає в себе введення ефективної для лікування стану або попередження стану кількості однієї або більше описаних тут фармацевтичних композицій, або сполуки даного винаходу. У конкретному варіанті здійснення аномальна активність JAK являє собою аномальну активність JAK1. У наступному аспекті в даному винаході надана сполука даного винаходу, призначена для лікування або попередження стану, причинно пов'язаного з аномальною активністю JAK. У конкретному варіанті здійснення аномальна активність JAK являє собою аномальну активність JAK1. У додаткових аспектах у даному винаході надані способи синтезу сполуки винаходу, при цьому репрезентативні методики і шляхи синтезу описані в даному описі далі. Відповідно, головною метою даного винаходу є надання сполуки, здатної модифікувати активність JAK і, таким чином, попереджати або виліковувати будь-які стани, які можуть бути причинно пов'язані з нею. Зокрема, будь-які стани, які можуть бути причинно пов'язані з активністю JAK1. Наступною метою даного винаходу є надання сполуки, здатної лікувати або полегшувати стани або захворювання, або їхні симптоми, такі як запальні стани, автоімунні захворювання, проліферативні захворювання, відторгнення трансплантата, захворювання, що включають у себе погіршення відновлювання хрящової тканини, природжені вади розвитку хрящової тканини і/або захворювання, пов'язані з гіперсекрецією IL6, які можуть бути причинно пов'язані з активністю JAK. Зокрема, будь-яке захворювання або стан, який може бути причинно пов'язаний з активністю JAK1. Ще однією метою даного винаходу є надавання фармацевтичних композицій, які можуть бути використані для лікування або попередження безлічі хворобливих станів, включаючи захворювання, пов'язані з активністю JAK, такі як запальні стани, автоімунні захворювання, проліферативні захворювання, відторгнення трансплантата, захворювання, що включають у себе погіршення відновлювання хрящової тканини, природжені вади розвитку хрящової тканини і/або захворювання, пов'язані з гіперсекрецією IL6. Зокрема, стани, пов'язані з активністю JAK1. Інші цілі і переваги будуть очевидні фахівцям у даній галузі з розгляду подальшого детального опису. Детальний опис винаходу Визначення Мають на увазі, що наступні терміни мають наведені нижче значення і корисні для розуміння опису і передбачених рамок даного винаходу. При описі даного винаходу, який може включати в себе сполуки, фармацевтичні композиції, що містять подібні сполуки і способи застосування подібних сполук і композицій, наступні терміни, у разі їхньої наявності, мають наступні значення, якщо не зазначено інакше. Потрібно також розуміти, що при описуванні в даному описі будь-яка з визначених нижче груп може бути заміщена рядом замісників, і мають на увазі, що відповідні визначення включають у себе подібні заміщені групи в свої рамки, встановлені нижче. Якщо не зазначено інакше, термін "заміщений" потрібно визначати, як встановлений далі. Крім того, потрібно розуміти, що при використанні в даному описі терміни "групи" і "радикали" можна вважати взаємозамінними. 4 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 "Фармацевтично прийнятний" означає прийнятий або такий, що може бути прийнятим регулювальним відомством федерального або державного уряду, або відповідним відомством у країнах, що відрізняються від Сполучених Штатів, або той, який перерахований у фармакопеї США або інших загальноприйнятих фармакопеях для використання для тварин, а більш конкретно, для людей. "Фармацевтично прийнятна сіль" стосується солі сполуки даного винаходу, яка є фармацевтично прийнятною і яка має необхідну фармакологічну активність вихідної сполуки. Зокрема, подібні солі не є токсичними, можуть являти собою солі приєднання неорганічних або органічних кислот і солі приєднання основ. Конкретно, подібні солі включають у себе: (1) солі приєднання кислоти, одержані з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і так далі; або одержані з органічними кислотами, такими як оцтова кислота, пропіонова кислота, капроєва кислота, циклопентанпропіонова кислота, гліколева кислота, піровиноградна кислота, молочна кислота, малонова кислота, янтарна кислота, яблучна кислота, малеїнова кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, 3-(4-гідроксибензоїл)бензойна кислота, корична кислота, мигдалева кислота, метансульфонова кислота, етансульфонова кислота, 1,2-етандисульфонова кислота, 2-гідроксіетансульфонова кислота, бензолсульфонова кислота, 4-хлорбензолсульфонова кислота, 2-нафталінсульфонова кислота, 4толуолсульфонова кислота, камфорсульфонова кислота, 4-метилбіцикло[2.2.2]окт-2-ен-1карбонова кислота, глюкогептонова кислота, 3-фенілпропіонова кислота, триметилоцтова кислота, трет-бутилоцтова кислота, лаурилсірчана кислота, глюконова кислота, глутамінова кислота, гідроксинафтойна кислота, саліцилова кислота, стеаринова кислота, муконова кислота і так далі; або (2) солі, утворені в тому випадку, коли кислий протон, що є в початковій сполуці, або заміщений іоном металу, наприклад, іоном лужного металу, іоном лужноземельного металу, або іоном алюмінію; або координований з органічною основою, такою як етаноламін, діетаноламін, триетаноламін, N-метилглюкамін і так далі. Крім того, солі включають у себе, тільки як приклад, солі натрію, калію, кальцію, магнію, амонію, тетраалкіламонію і так далі; а у випадку, коли сполука містить основну функціональну групу, солі нетоксичних органічних або неорганічних кислот, такі як гідрохлорид, гідробромід, тартрат, мезилат, ацетат, малеат, оксалат і так далі. Термін "фармацевтично прийнятний катіон" стосується прийнятного катіонного протиіона кислотної функціональної групи. Прикладами подібних катіонів є катіони натрію, калію, кальцію, магнію, амонію, тетраалкіламонію і так далі. "Фармацевтично прийнятний розріджувач" стосується розріджувача, ад'юванта, ексципієнта або носія, з яким вводять сполуку даного винаходу. "Проліки" стосуються сполук, включаючи похідні сполук даного винаходу, які містять групи, що відщеплюються, і в результаті сольволізу або у фізіологічних умовах перетворюються в сполуки даного винаходу, які фармацевтично активні in vivo. Подібні приклади включають у себе, але не обмежуються похідними холінового ефіру і так далі, N-алкілмормолінового ефіру і так далі. "Сольват" стосується форм сполуки, які асоційовані з розчинником, звичайно за реакцією сольволізу. Дана фізична асоціація включає в себе зв'язування за рахунок водневих зв'язків. Звичайні розчинники включають у себе воду, етанол, оцтову кислоту і так далі. Сполуки даного винаходу можуть бути одержані, наприклад, у кристалічній формі і можуть бути сольватовані або гідратовані. Придатні сольвати включають у себе фармацевтично прийнятні сольвати, такі як гідрати, а також включають у себе як стехіометричні сольвати, так і нестехіометричні сольвати. У деяких випадках сольват може бути виділений, наприклад, коли одна або більше молекул розчинника входять у кристалічну решітку кристалічної твердої речовини. "Сольват" включає в себе як фазу в розчині, так і сольвати, що виділяються. Показні сольвати включають у себе гідрати, етаноляти і метаноляти. "Суб'єкт" включає в себе людей. Терміни "людина", "пацієнт" і "суб'єкт" використовуються в даному описі взаємозамінно. "Терапевтично ефективна кількість" означає кількість сполуки, яка, при введенні суб'єкту для лікування захворювання, є достатньою для здійснення подібного лікування даного захворювання. "Терапевтично ефективна кількість" може змінюватися залежно від сполуки, захворювання і його тяжкості і віку, маси і так далі, підлягаючого лікуванню суб'єкта. "Попереджувальний" або "попередження" стосується зниження ризику одержання або розвитку захворювання або порушення (тобто приведення до того, що, принаймні, один із клінічних симптомів захворювання не розвивається у суб'єкта, який може зазнавати дії агента, що викликає захворювання, або схильний до захворювання до початку захворювання). 5 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "профілактика" стосується "попередження" і стосується міри або процедури, метою якою є попередження, а не лікування або вилікування від захворювання. Необмежуючі приклади профілактичних заходів можуть включати в себе введення вакцин, введення низькомолекулярного гепарину пацієнтам, що знаходяться в стаціонарі, які зазнають ризику одержати тромбоз, наприклад, внаслідок знерухомлювання, і введення протималярійного агента, такого як хлорохін, перед візитом у географічний регіон, в якому малярія є ендемічною, або де високий ризик контакту з малярією. "Лікуючий" або "лікування" будь-якого захворювання або порушення стосується, в одному з варіантів здійснення, полегшення даного захворювання або порушення (тобто зупинки захворювання або прояву, ступеня або тяжкості, принаймні, одного з його клінічних симптомів). В іншому варіанті здійснення "лікуючий" або "лікування" стосується полегшення, принаймні, одного фізичного параметра, який може бути непомітний для суб'єкта. У ще одному варіанті здійснення "лікуючий" або "лікування" стосується модулювання захворювання або порушення, або фізично (наприклад, стабілізація помітного симптому), фізіологічно (наприклад, стабілізація фізичного параметра), або і того, й іншого. У наступному варіанті здійснення "лікуючий" або "лікування" стосується сповільнення розвитку захворювання. Використовуваний у даному описі термін "запальний стан(стани)” стосується групи станів, що включають у себе ревматоїдний артрит, остеоартрит, юнацький ідіопатичний артрит, псоріаз, алергічне захворювання дихальних шляхів (наприклад, астма, риніт), запальні захворювання кишечнику (наприклад, хвороба Крона, коліт), викликані ендотоксинами хворобливі стани (наприклад, ускладнення після аортокоронарного шунтування, або хронічні ендотоксичні стани, що призводять, наприклад, до хронічної серцевої недостатності), і споріднені захворювання з участю хрящів, такі як захворювання суглобів. Зокрема, даний термін стосується ревматоїдного артриту, остеоартриту, алергічного захворювання дихальних шляхів (наприклад, астми) і запальних захворювань кишечнику. Використовуваний у даному описі термін "автоімунне захворювання(захворювання)” стосується групи захворювань, що включають у себе обструктивне захворювання дихальних шляхів, включаючи такі стани, як COPD, астму (наприклад, спадкову бронхіальну астму, пилкову астму, дитячу астму), особливо, хронічну або застарілу астму (наприклад, пізню астму, або гіперреактивність дихальних шляхів), бронхіт, включаючи бронхіальну астму, системний червоний вовчак (SLE), розсіяний склероз, цукровий діабет I типу і пов'язані з ним ускладнення, ендогенну екзему (атопічний дерматит), контактний дерматит та інші екзематозні дерматити, запальне захворювання кишечнику (наприклад, хвороба Крона і неспецифічний виразковий коліт), атеросклероз і бічний аміотрофічний склероз. Зокрема, даний термін стосується COPD, астми, системного червоного вовчака, цукрового діабету I типу і запального захворювання кишечнику. Використовуваний у даному описі термін "проліферативне захворювання (проліферативні захворювання)” стосується таких станів, як рак (наприклад, лейоміосаркома матки або рак передміхурової залози), мієлопроліферативні порушення (наприклад, істинна поліцитемія, есенціальний тромбоцитоз і мієлофіброз), лейкоз (наприклад, гострий мієлоїдний лейкоз і гострий лімфобластний лейкоз), множинна мієлома, псоріаз, рестеноз, склеродерміт або фіброз. Особливо даний термін стосується раку, лейкозу, множинної мієломи і псоріазу. Використовуваний у даному описі термін "рак" стосується злоякісного або доброякісного розростання клітин на шкірі або в органах тіла, наприклад, але без обмеження, грудей, передміхурової залози, легені, нирки, підшлункової залози, шлунка або кишечнику. Рак має тенденцію до проникнення в сусідню тканину і поширення (метастазування) до віддалених органів, наприклад, кісток, печінки, легень або мозку. Використовуваний у даному описі термін "рак" включає в себе як метастатичні типи пухлинних клітин, такі як метанома, лімфома, лейкемія, фібросаркома, рабдоміосаркома і мастоцитома, і типи тканинної карциноми, такі як, але не обмежені, колоректальним раком, раком передміхурової залози, дрібноклітинним раком легень і недрібноклітинним раком легень, раком грудей, раком підшлункової залози, раком сечового міхура, раком нирки, раком шлунка, гліобластомою, первинним раком печінки, раком яєчника, раком передміхурової залози і лейоміосаркомою матки. Використовуваний у даному описі термін "лейкоз" стосується неопластичних захворювань крові і кровотворних органів. Подібні захворювання можуть призвести до дисфункції кісткового мозку та імунної системи, що зробить реципієнта надто сприйнятливим до інфекції і кровотечі. Особливо термін лейкоз стосується гострого мієлоїдного лейкозу (AML) і гострого лімфобластного лейкозу (ALL). Використовуваний у даному описі термін "відторгнення трансплантата" стосується гострого або хронічного відторгнення ало- або ксенотрансплантатів, або клітин, тканини або солідних 6 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 органів, наприклад, панкреатичних острівців, стовбурових клітин, кісткового мозку, шкіри, м'яза, корнеальної тканини, нейронної тканини, серця, легень, об'єднаних серця-легень, нирки, печінки, кишечнику, підшлункової залози, трахеї або стравоходу, або захворювань трансплантат проти хазяїна. Використовуваний у даному описі термін "захворювання, що включають у себе погіршення відновлювання хрящової тканини" включає в себе такі стани, як остеоартрит, псоріатичний артрит, юнацький ревматоїдний артрит, подагричний артрит, септичний, або інфекційний артрит, реактивний артрит, рефлекторна симпатична дистрофія, альгодистрофія, синдром Тітце, або реберний хондрит, фіброміалгія, остеохондрит, нейрогенний, або нейропатичний артрит, артропатія, ендемічні форми артриту типу деформуючого ендемічного остеоартрозу, хвороба Мселені і хвороба Хандігоду; дегенерація, виникаюча внаслідок фіброміалгії, системного червоного вовчака, склеродермії і анкілозуючого спондилоартриту. Використовуваний у даному описі термін "природжена(і) вада(и) хряща" включає в себе такі стани, як спадковий хондроліз, хондродисплазія і псевдохондродисплазія, зокрема, але без обмеження, мікротію, анотію, метафізарну хондродисплазію і спадкові порушення. Використовуваний у даному описі термін "захворювання, пов'язане(і) з гіперсекрецією IL6" включає в себе такі стани, як хвороба Кастлмана, множинна мієлома, псоріаз, саркома Капоші і/або мезангіальний проліферативний гломерулонефрит. Використовуваний у даному описі термін "JAK" стосується сімейства янус-кіназ (JAK), які являють собою цитоплазматичні тирозинкінази, що передають цитокіновий сигнал від мембранних рецепторів до факторів транскрипції STAT. Описані чотири члени сімейства JAK: JAK1, JAK2, JAK3 і TYK2, і термін JAK може стосуватися всіх членів сімейства JAK разом або одного або більше членів сімейства JAK, як зазначено в контексті. Мають на увазі, що "сполука(и) винаходу" і еквівалентні вирази включають у себе сполуку описаної в даному описі формули, при цьому даний вислів включає в себе фармацевтично прийнятні солі і сольвати, наприклад, гідрати і сольвати фармацевтично прийнятних солей, де це дозволяє контекст. Аналогічним чином, мають на увазі, що посилання на проміжні сполуки, незалежно від того, чи заявлені вони самі, включає в себе їхні солі і сольвати, де це дозволяє контекст. Коли в даному описі посилаються на інтервали, наприклад, але без обмеження, С 1-С8 алкіл, цитування інтервалу потрібно вважати представленням кожного члена зазначеного інтервалу. Інші похідні сполук даного винаходу мають активність як у формі своїх кислот, так і формах похідних кислот, але у формі кислотної чутливої форми часто виявляють переваги розчинності, сумісності з тканинами, або уповільненого вивільнення в організмі ссавця (дивіться Bundgard, Н., Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Проліки включають у себе похідні кислот, які добре відомі практикуючим фахівцям у даній галузі, наприклад, такі як складні ефіри, одержані реакцією вихідної кислоти з придатним спиртом, або аміди, одержані реакцією сполучення вихідної кислоти із заміщеним або незаміщеним аміном, або ангідриди кислот, або змішані ангідриди. Особливо корисними проліками є прості аліфатичні або ароматичні складні ефіри, аміди та ангідриди, одержані з кислотних груп, що є бічними в сполуках даного винаходу. У деяких випадках бажано одержати проліки типу подвійних складних ефірів, такі як (ацилокси)алкілові складні ефіри або (алкоксикарбонілокси)алкілові складні ефіри. Зокрема, подібні проліки являють собою С1-С8 алкіл, С2-С8 алкеніл, арил, С7-С12 заміщений арил і С7-С12 арилалкілові складні ефіри сполук даного винаходу. Використовуваний у даному описі термін "ізотопний варіант" стосується сполуки, що містить штучні відсоткові частки ізотопів одного або більше атомів, які складають подібну сполуку. Наприклад, "ізотопний варіант" сполуки може містити один або більше нерадіоактивних ізотопів, 2 13 15 наприклад, таких як дейтерій ( Н або D), вуглецю-13 ( С), азоту-15 ( N) або тому подібного. Буде зрозумілим, що в сполуці, в якій є здійсненим подібне ізотопне заміщення, наступні атоми, у випадку, коли вони присутні, можуть змінюватися, так що, наприклад, будь-який атом водню 2 13 може являти собою Н/D, будь-який атом вуглецю може являти собою С, або будь-який атом 15 азоту може являти собою N, і що наявність і розташування подібних атомів можна визначити в межах кваліфікації в даній галузі техніки. Аналогічним чином, винахід може включати в себе одержання ізотопних варіантів із радіоізотопами, наприклад, у випадку, коли одержані сполуки можуть бути використані для досліджень розподілу лікарського засобу і/або субстрату в 3 тканинах. Для даної мети особливо корисні радіоактивні ізотопи тритій, тобто Н, і вуглець-14, 14 тобто С, у зв'язку з простотою їхнього введення і простими способами визначення. Крім того, 11 можна одержати сполуки, які заміщені ізотопами, випромінюючими позитрони, такими як С, 18 15O 13 F, і N, і застосовні в дослідженнях методом позитрон-емісійної томографії (РЕТ) для вивчення зайнятості рецепторів субстрату. 7 UA 105796 C2 5 10 15 20 25 30 35 40 45 Мають на увазі, що всі ізотопні варіанти наданих у даному описі сполук, незалежно від того, чи є вони радіоактивними чи ні, входять в обсяг даного винаходу. Стереоізомери, які не є дзеркальними відображеннями один одного, називаються "діастереомерами", а стереоізомери, що є взаємно несумісними дзеркальними відображеннями один одного, називаються "енантіомерами". Якщо в сполуці є асиметричний центр, наприклад, він зв'язаний із чотирма різними групами, можлива наявність пари енантіомерів. Енантіомер можна охарактеризувати абсолютною конфігурацією його асиметричного центра та описати за допомогою правил R- і S-послідовності Канна і Прелога, або характеру обертання даною молекулою площини поляризованого світла і визначити її як правообертальну або лівообертальну (тобто як (+)- або (-)-ізомери, відповідно). Хіральна сполука може існувати або у вигляді індивідуального енантіомеру, або у вигляді їхньої суміші. Суміш, що містить однакові кількості енантіомерів, називають "рацемічною сумішшю". "Таутомери" стосуються сполук, які являють собою взаємоперетворні форми структури конкретної сполуки, і які відрізняються розташуванням атомів водню та електронів. Так, внаслідок переміщення електронів і будь-якого атома (звичайно Н), у рівновазі можуть знаходитися дві структури. Наприклад, еноли і кетони є таутомерами, оскільки вони швидко перетворюються один в одного при обробці їх або кислотою, або основою. Іншим прикладом таутомерії є аци- і нітро-форми фенілнітрометану, які виходять аналогічним чином при обробці кислотою або основою. Таутомерні форми можуть стосуватися досягнення оптимальної хімічної реакційноздатності і біологічної активності сполуки, що розглядається. Сполука даного винаходу може містити один або більш асиметричних центрів; тому подібні сполуки можна одержати у вигляді індивідуальних (R)- або (S)-стереоізомерів, або у вигляді їхніх сумішей. Якщо не зазначено інакше, мають на увазі, що опис або назва конкретної сполуки в описі і формулі винаходу включає в себе індивідуальні енантіомери і суміші, рацемічні або інші. Методи визначення стереохімічної структури і розділення стереоізомерів добре відомі в даній галузі техніки. Сполука Даний винахід ґрунтується на тому факті, що інгібітори JAK є застосовними для лікування запальних станів, автоімунних захворювань, проліферативних захворювань, відторгненні трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад хрящової тканини і захворювань, пов'язаних із гіперсекрецією IL6. Крім того, у даному винаході надані способи одержання даної сполуки, фармацевтичні композиції, що містять дану сполуку, і способи лікування захворювань, що включають у себе руйнування хряща, руйнування кісток і/або суглобів, і/або запалення, шляхом введення сполуки даного винаходу. Дана сполука є інгібітором членів сімейства JAK, конкретно, вона інгібує активність JAK1, JAK2, JAK3 і TYK2. Зокрема, вона інгібує активність JAK1. Відповідно, у першому аспекті даного винаходу описана сполука винаходу, що має формулу I: Сполука даного винаходу являє собою {5-[4-(3,3-диметилазетидин-1-карбоніл)феніл][1,2,4]триазол[1,5-а]піридин-2-іл}амід циклопропанкарбонової кислоти. В одному з варіантів здійснення сполука даного винаходу не є ізотопним варіантом. В одному з аспектів сполука даного винаходу знаходиться у формі вільної основи. В одному з аспектів сполука даного винаходу являє собою фармацевтично прийнятну сіль. В одному з аспектів сполука даного винаходу являє собою сольват даної сполуки. В одному з аспектів сполука даного винаходу являє собою сольват фармацевтично прийнятної солі даної сполуки. 8 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких аспектах у даному винаході надані проліки і похідні сполуки відповідно до наведеної вище формули. Проліки являють собою похідні сполук даного винаходу, які містять метаболічно відщеплювані групи, і в результаті сольволізу або у фізіологічних умовах перетворюються в сполуки даного винаходу, які фармацевтично активні in vivo. Подібні приклади включають у себе, але не обмежуються складноефірними похідними холіну, складним ефіром N-алкілморфоліну і так далі. Інші похідні сполуки даного винаходу мають активність як у формі їхніх кислот, так і похідних кислот, але форма швидко реагуючої кислоти часто виявляє переваги стосовно розчинності, сумісності з тканинами або уповільненого вивільнення в організмі ссавця (дивитеся Bundgard, Н., Design of Prodrugs, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Проліки включають у себе похідні кислот, які добре відомі фахівцям, що практикують у даній галузі, наприклад, такі як складні ефіри, одержані реакцією вихідної кислоти з придатним спиртом, або аміди, одержані реакцією сполучення вихідної кислоти із заміщеним або незаміщеним аміном, або ангідриди кислот, або змішані ангідриди. Переважними проліками є прості аліфатичні або ароматичні складні ефіри, аміди та ангідриди, одержані з кислотних груп, що є бічними в сполуках даного винаходу. У деяких випадках бажано одержати проліки типу подвійних складних ефірів, такі як (ацилокси)алкілові складні ефіри або (алкоксикарбонілокси)алкілові складні ефіри. Особливо корисні С1 до С8 алкіл, С2-С8 алкеніл, арил, С7-С12 заміщений арил і С7-С12 арилалкілові складні ефіри сполук даного винаходу. Фармацевтичні композиції При використанні у ролі фармацевтичного засобу сполуку даного винаходу звичайно вводять у вигляді фармацевтичної композиції. Подібні композиції можна одержати способом, який добре відомий у галузі фармацевтики, і містять, принаймні, одну активну сполуку. Як правило, сполуку даного винаходу вводять у фармацевтично ефективній кількості. Кількість сполуки, що реально вводиться, звичайно буде визначатися лікарем, беручи до уваги обставини, що стосуються справи, включаючи підлягаючий лікуванню стан, вибраний спосіб введення, реальну сполуку, що вводиться, вік, масу і реакцію індивідуального пацієнта, тяжкість симптомів пацієнта і так далі. Фармацевтичні композиції даного винаходу можна вводити рядом способів, включаючи пероральний, ректальний, черезшкірний, підшкірний, внутрішньосуглобовий, внутрішньовенний, внутрішньом'язовий і інтраназальний. Залежно від призначеного способу доставки, зі сполуки даного винаходу переважно складають препарат або у вигляді ін'єкції, або пероральних композицій, або у вигляді мазей, у вигляді лосьйонів, або у вигляді пластирів, всі з яких призначені для черезшкірного введення. Композиції для перорального введення можуть приймати форму нефасованих рідких розчинів або суспензій, або нефасованих порошків. Однак більш загальноприйнятим є надання композицій у вигляді разових дозованих форм для полегшення точного дозування. Термін "разова дозована форма" стосується фізично дискретних одиниць, які є придатними як одиничні дози для суб'єктів, що є людьми, та інших ссавців, при цьому кожна одиниця містить попередньо визначену кількість активної речовини, розраховану для надання необхідного терапевтичного ефекту, у поєднанні з придатним фармацевтичним ексципієнтом, розріджувачем або носієм. Типові разові дозовані форми включають у себе попередньо заповнені, попередньо відміряні ампули або шприци з рідкими композиціями, або пілюлі, таблетки, капсули, або таке інше у разі твердих композицій. У подібних композиціях сполуки даного винаходу звичайно є мінорним компонентом (від близько 0,1 до близько 50 масових % або, переважно, від близько 1 до близько 40 масових %), при цьому залишок являє собою різні розріджувачі або носії або технологічні допоміжні речовини, корисні для одержання необхідної дозованої форми. Рідкі форми, придатні для перорального введення, можуть включати в себе придатний водний або неводний розріджувач із буферними речовинами, суспендувальними і диспергуючими агентами, барвниками, смаковими речовинами і так далі. Тверді форми можуть включати в себе, наприклад, будь-які з наступних інгредієнтів або сполук, що мають аналогічну природу: зв'язувальну речовину, таку як мікрокристалічна целюлоза, трагакантова смола або желатин, ексципієнт, такий як крохмаль або лактоза, розпушувальний агент, такий як альгінова кислота, примогель або кукурудзяний крохмаль, мастильну речовину, таку як стеарат магнію, глідант, такий як колоїдний двоокис кремнію, підсолоджувальну речовину, таку як сахароза або сахарин, або смаковий агент, такий як перцева м'ята, метилсаліцилат або апельсинова смакова речовина. Основу композицій для ін'єкцій звичайно складає ін'єктований стерильний фізіологічний розчин, або фізіологічний розчин із фосфатним буфером, або інші ін'єктовані носії, відомі в 9 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 даній галузі. Як і раніше, активна сполука в подібних композиціях звичайно являє собою мінорний компонент, що часто складає від близько 0,05 до 10 масових %, при цьому залишок є ін'єктованим носієм і так далі. Черезшкірні композиції звичайно складають у вигляді місцевої мазі або крему, що містить активний інгредієнт(и), звичайно в кількості, що змінюється в інтервалі від близько 0,01 до близько 20 масових %, переважно, від близько 0,1 до близько 20 масових %, переважно, від близько 0,1 до близько 10 масових % і, більш переважно, від близько 0,5 до близько 15 масових %. При складанні препарату у вигляді мазі активні інгредієнти будуть звичайно сполучені або з парафіновою основою мазі, або з основою мазі, що не змішується з водою. Альтернативним чином, з активних інгредієнтів можна скласти препарат у вигляді крему, наприклад, із кремовою основою олія-у-воді. Такі черезшкірні препарати добре відомі в даній галузі, і як правило, містять додаткові інгредієнти для підвищення шкірного проникнення, або стійкості активних інгредієнтів препарату. Всі подібні відомі черезшкірні препарати та інгредієнти включені в обсяг даного винаходу. Сполуки даного винаходу можна також вводити шляхом черезшкірного пристосування. Відповідно, черезшкірне введення можна здійснити з використанням пластиру або типу резервуара, або пористої мембрани, або ряду твердих матриць. Описані вище компоненти для композицій, що вводяться перорально, шляхом ін'єкцій або місцево, є лише репрезентативними. Інші речовини, а також методики обробки і таке інше th викладені у 8 частині Remington's Pharmaceutical Sciences, 17 edition, 1985, Mack Publishing Company, Easton, Pennsylvania, яка включена в даний опис у вигляді посилання. Сполуку даного винаходу можна також вводити у вигляді форм уповільненого вивільнення або систем доставки лікарських препаратів з уповільненим вивільненням. Опис репрезентативних речовин для уповільненого вивільнення можна знайти в Remington's Pharmaceutical Sciences. Наступні приклади препаратів ілюструють репрезентативні фармацевтичні композиції, які можна одержати згідно з даним винаходом. Однак даний винахід не обмежений наступними фармацевтичними композиціями. Препарат 1 – Таблетки Сполуку даного винаходу можна змішувати у вигляді сухого порошку зі зв'язувальною речовиною з сухого желатину в масовому співвідношенні приблизно 1:2. Як мастильну речовину можна додати мінорну кількість стеарату магнію. Із даної суміші можна сформувати таблетки по 240-270 мг (80-90 мг активної амідної сполуки на таблетку) за допомогою таблеткового преса. Препарат 2 – Капсули Сполуку даного винаходу можна змішувати у вигляді сухого порошку з розріджувачем з крохмалю в масовому співвідношенні приблизно 1:1. Даною сумішшю можна заповнити капсули по 250 мг (125 мг активної амідної сполуки на капсулу). Препарат 3 – Рідина Сполуку даного винаходу (125 мг) можна змішати з сахарозою (1,75 г) і ксантановою смолою (4 мг) й одержану суміш можна перемішати, пропустити через сито № 10 меш США, а потім змішати із попередньо приготованим розчином мікрокристалічної целюлози і карбоксиметилцелюлози натрію (11:89, 50 мг) у воді. Бензоат натрію (10 мг), смакову речовину і барвник можна розвести водою і додати при перемішуванні. Після цього при перемішуванні можна додати достатню кількість води. Потім можна додати достатню кількість води для одержання загального об'єму 5 мл. Препарат 4 – Таблетки Сполуку даного винаходу можна змішувати у вигляді сухого порошку зі зв'язувальною речовиною з сухого желатину в масовому співвідношенні приблизно 1:2. Як мастильну речовину можна додати мінорну кількість стеарату магнію. Дану суміш формують у таблетки по 450-900 мг (150-300 мг активної амідної сполуки) за допомогою таблеткового преса. Препарат 5 – Ін'єкція Сполуку даного винаходу можна розчинити або суспендувати в забуференому стерильному сольовому водному середовищі для ін'єкцій у концентрації приблизно 5 мг/мл. Препарат 6 – Місцево Стеариловий спирт (250 г) і білий петролатум (250 г) можна розплавити приблизно при 75С, а потім можна додати суміш сполуки даного винаходу (50 г), метилпарабен (0,25 г), пропілпарабен (0,15 г), лаурилсульфат натрію (10 г) і пропіленгліколь (120 г), розчинені у воді (близько 370 г), і можна перемішувати одержану суміш, поки вона не затвердіє. Способи лікування 10 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуку даного винаходу можна використати у ролі терапевтичного агента для лікування станів у ссавців, які причинно пов'язані, або стосуються аберантної активності JAK. Зокрема, стани стосуються аберантної активності JAK1. Відповідно, сполуки і фармацевтичні композиції даного винаходу знаходять застосування у ролі терапевтичних засобів для попередження і/або лікування запальних станів, автоімунних захворювань, проліферативних захворювань, відторгнення трансплантата, захворювань, що включають у себе погіршення відновлювання хрящової тканини, природжених вад хрящової тканини і захворювань, пов'язаних із гіперсекрецією IL6, у ссавців, включаючи людей. У додаткових аспектах способу лікування в даному винаході надані способи лікування ссавця, сприйнятливого або ураженого запальним станом. Даний спосіб включає в себе введення ефективної для лікування стану або попередження стану кількості однієї або більше описаних тут фармацевтичних композицій або сполук даного винаходу. У конкретному варіанті здійснення запальний стан вибирають із ревматоїдного артриту, остеоартриту, алергічного захворювання дихальних шляхів (наприклад, астма) і запальних захворювань кишечнику. У наступному аспекті в даному винаході надана сполука даного винаходу, призначена для лікування, попередження або профілактики запального стану. У конкретному варіанті здійснення запальний стан вибирають із ревматоїдного артриту, остеоартриту, алергічного захворювання дихальних шляхів (наприклад, астма) і запальних захворювань кишечнику. У додаткових аспектах способу лікування в даному винаході надані способи лікування ссавця, сприйнятливого або ураженого автоімунним захворюванням. Дані способи включають у себе введення ефективної для лікування стану або попередження стану кількості однієї або більш описаних тут фармацевтичних композицій або сполук даного винаходу. У конкретному способі здійснення автоімунне захворювання вибирають із COPD, астми, системного червоного вовчака, цукрового діабету I типу і запального захворювання кишечнику. У наступному аспекті в даному винаході надана сполука даного винаходу, призначена для лікування, попередження або профілактики автоімунного захворювання. У конкретному способі здійснення автоімунне захворювання вибирають із COPD, астми, системного червоного вовчака, цукрового діабету I типу і запального захворювання кишечнику. У наступних аспектах способу лікування в даному винаході надані способи лікування ссавця, сприйнятливого або ураженого проліферативним захворюванням, зокрема, раком (наприклад, солідними пухлинами, такими як лейоміосаркома матки або рак передміхурової залози), лейкозом (наприклад, AML або ALL), множинною мієломою і/або псоріазом. Дані способи включають у себе введення ефективної для лікування стану або попередження стану кількості однієї або більше описаних тут фармацевтичних композицій або сполук даного винаходу. У наступному аспекті в даному винаході надана сполука даного винаходу, призначена для лікування, попередження або профілактики проліферативного захворювання, зокрема, раку (наприклад, солідних пухлин, таких як лейоміосаркома матки або рак передміхурової залози), лейкозу (наприклад, AML або ALL), множинної мієломи і/або псоріазу. У наступних аспектах способу лікування в даному винаході надані способи лікування ссавця, сприйнятливого або ураженого відторгненням трансплантата. Дані способи включають у себе введення ефективної для лікування стану або попередження стану кількості однієї або більше описаних тут фармацевтичних композицій або сполук даного винаходу. У конкретному варіанті здійснення в даному винаході надані способи лікування відторгнення трансплантата органу. В аспекті способу лікування в даному винаході наданий спосіб лікування, попередження або профілактик ссавця, сприйнятливого або ураженого захворюванням, що включає в себе погіршення відновлювання хрящової тканини. Дані способи включають у себе введення ефективної для лікування стану або попередження стану кількості однієї або більше описаних тут фармацевтичних композицій або сполук даного винаходу. В іншому аспекті в даному винаході надана сполука даного винаходу, призначена для лікування, попередження або профілактики захворювань, що включають у себе погіршення відновлювання хрящової тканини. Крім того, у даному винаході наданий спосіб лікування природжених вад розвитку хрящової тканини. Дані способи включають у себе введення ефективної для лікування стану або попередження стану кількості однієї або більше описаних тут фармацевтичних композицій або сполук даного винаходу. В іншому аспекті в даному винаході надана сполука даного винаходу, призначена для лікування, попередження або профілактик природжених вад розвитку хрящової тканини. У наступному аспекті способів лікування в даному винаході надані способи лікування ссавця, сприйнятливого або ураженого захворюваннями, пов'язаними з гіперсекрецією IL6, зокрема, хворобою Кастлмана або мезангіальним проліферативним гломерулонефритом. Дані 11 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 способи включають у себе введення ефективної для лікування стану або попередження стану кількості однієї або більше описаних тут фармацевтичних композицій або сполук даного винаходу. У наступному аспекті в даному винаході надана сполука даного винаходу, призначена для лікування, попередження або профілактики захворювань, пов'язаних із гіперсекрецією IL6, зокрема, хвороби Кастлмана або мезангіального проліферативного гломерулонефриту. Як наступний аспект винаходу надана сполука даного винаходу для використання у ролі фармацевтичного засобу, особливо при лікуванні або попередженні вищезазначених станів і захворювань. Крім того, у даному описі надане використання сполуки для одержання лікарського засобу для лікування або попередження одного із згаданих вище станів і захворювань. Особливий режим даного способу включає в себе введення суб'єкту, що страждає на запальний стан, ефективної кількості сполуки даного винаходу протягом періоду часу, достатнього для зниження ступеню запалення у суб'єкта і, переважно, припинення процесів, відповідальних за зазначене запалення. Особливий варіант здійснення даного способу включає в себе введення ефективної кількості сполуки даного винаходу розглядуваному пацієнту, що страждає або сприйнятливий до розвитку ревматоїдного артриту, протягом періоду часу, якого досить, відповідно, для зниження або попередження запалення в суглобах зазначеного пацієнта, а, переважно, для припинення процесів, відповідальних за зазначене запалення. Наступний особливий режим даного способу включає в себе введення суб'єкту, що страждає на захворювання, які включають у себе погіршення відновлювання хрящової тканини (наприклад, остеоартрит), ефективної кількості сполуки даного винаходу протягом періоду часу, достатнього для зниження, а переважно, припинення самопідтримувальних процесів, відповідальних за зазначене руйнування. Конкретний варіант здійснення даного способу включає в себе введення ефективної кількості сполуки даного винаходу суб'єкту пацієнту, страждаючому або сприйнятливому до розвитку остеоартриту, протягом періоду часу, якого досить, відповідно, для зниження або попередження руйнування суглобів зазначеного пацієнта, а, переважно, для припинення самопідтримувальних процесів, що відповідають за зазначене руйнування. У конкретному варіанті здійснення зазначена сполука може виявляти анаболічні і/або антианаболічні властивості стосовно хрящової тканини. Концентрація дози для ін'єкції змінюється в інтервалі від близько 0,1 мг/кг/годину до, принаймні, 10 мг/кг/годину, значно на користь інтервалу від близько 1 до близько 120 годин і особливо від 24 до 96 годин. Для досягнення відповідних концентрацій стаціонарного стану можна також вводити попередньо наповнений болюс, що містить від близько 0,1 мг/кг до близько 10 мг/кг або більше. Очікується, що максимальна загальна доза не перевищить приблизно 2 г/день для пацієнтів масою від 40 до 80 кг, що є людьми. Для попередження і/або лікування тривалих станів, таких як дегенеративні стани, режим лікування звичайно продовжується протягом багатьох місяців або років, так, що з метою зручності і переносимості пацієнта переважною є пероральна доза. У разі перорального дозування репрезентативними режимами є від однієї до п'яти, а особливо, від двох до чотирьох, і звичайно три пероральні дози на день. При використанні даних схем дозування кожна доза надає від близько 0,01 до близько 20 мг/кг сполуки даного винаходу, при цьому кожна з конкретних доз надає від близько 0,1 до близько 10 мг/кг, а особливо, від близько 1 до близько 5 мг/кг. Черезшкірні дози звичайно вибирають для одержання схожої або більш низької концентрації в крові, ніж концентрації, які досягаються при використанні ін'єктованих доз. У разі використання для попередження початку запального стану, сполуки даного винаходу будуть вводити пацієнту, що має ризик розвитку даного стану, звичайно за порадою і під спостереженням лікаря, в описаних вище концентраціях дозування. Як правило, до кількості пацієнтів, що мають ризик розвитку конкретного стану, входять пацієнти, у сімейному анамнезі яких є даний стан, або пацієнти, для яких, за даними генетичного тестування або скринінгу, була встановлена особлива сприйнятливість до розвитку даного стану. Сполуку даного винаходу можна вводити у вигляді єдиного активного агента або її можна вводити в поєднанні з іншими терапевтичними агентами, включаючи інші сполуки, які виявляють аналогічну або схожу терапевтичну активність, і для яких встановлена безпека та ефективність у разі подібного комбінованого введення. У конкретному варіанті здійснення спільне введення двох (або більше) агентів допускає використання значно більших малих доз кожного з них, що знижує, таким чином, подібні ефекти, що спостерігаються. В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження запального стану; конкретні агенти 12 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 включають у себе, але не обмежуються імунорегуляторними агентами, наприклад, азатіоприном, кортикостероїдами (наприклад, преднізолоном, або дексаметазоном), циклофосфамідом, циклоспорином А, такролімусом, мікофенолятмофетилом, муромонабомCD3 (OKT3, наприклад, Orthocolone®), ATG, аспірином, ацетамінопрофеном, ібупрофеном, напроксеном і піроксикамом. В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження артриту (наприклад, ревматоїдного артриту); конкретні агенти включають у себе, але не обмежуються анальгетиками, нестероїдними протизапальними лікарськими засобами (NSAIDS), стероїдами, синтетичними DMARDS (наприклад, але без обмеження, метотрексатом, лефлуномідом, сульфазалазином, ауранофіном, ауротіомалатом натрію, пеніциламіном, хлорохіном, гілроксихлорохіном, азатіоприном і циклоспорином) і біологічними DMARDS (наприклад, але без обмеження, інфликсимабом, етанерсептом, адалімабом, ритуксимабом і абатасептом). В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження проліферативних порушень; конкретні агенти включають у себе, але не обмежуються: метотрексатом, лейковорином, адріаміцином, пренізоном, блеоміцином, циклофосфамідом, 5-фторурацилом, паклітакселом, доцетакселом, вінкристином, вінбластином, вінорельбіном, доксорубіцином, тамоксифеном, тореміфеном, мегестролацетатом, анастрозолом, госереліном, анти-HER2 моноклональним антитілом (наприклад, Herceptin™), капецитабіном, гідрохлоридом рабоксифену, інгібіторами EGFR (наприклад, Iressa®, Tarceva™, Erbitux™), інгібіторами VEGF (наприклад, Avastin™), інгібіторами протеасом (наприклад, Velcade™), Glivec® та інгібіторами hsp90 (наприклад, 17AAG). Крім того, сполуку даноговинаходу вводять разом з іншими терапевтичними засобами, що включають у себе, але не обмеженими, променевою терапією або хірургією. У конкретному варіанті здійснення проліферативне порушення вибирають із раку, мієлопроліферативного захворювання або лейкозу. В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження автоімунних захворювань; конкретні агенти включають у себе, але не обмежуються: глюкокортикоїдами, цитостатичними агентами (наприклад, аналогами пурину), алкілуючими агентами (наприклад, азотистим іпритом (циклофосфамід), нітрозосечовинами, сполуками платини та іншими), антиметаболітами (наприклад, метотрексатом, азатіоприном і меркаптопурином), цитотоксичними антибіотиками (наприклад, дактиноміцином, антрациклінами, мітоміцином С, блеоміцином і мітраміцином), антитілами (наприклад, анти-CD20, анти-CD25, або анти-CD3 (ОТК3) моноклональними антитілами, Atgam® і Thymoglobuline®), циклоспорином, такролімусом, рапаміцином (сіролімусом), інтерферонами (наприклад, IFN-β), TNF-зв'язувальними білками (наприклад, інфліксимабом (Remicade™), етанерсептом (Enbrel™) або адалімумабом (Himura™)), мікофенолятом, фінголімодом і миріоцином. В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження відторгнення трансплантата; конкретні агенти включають у себе, але не обмежуються: інгібіторами кальцінеурину (наприклад, циклоспорином або такролімусом (FK506)), інгібіторами mTOR (наприклад, сіролімусом, еверолімусом), антипроліферативними кортикостероїдами (наприклад, преднізолоном, гідрокортизоном), антитілами (наприклад, моноклональними антитілами до анти-IL-2Rα рецептору, базиліксимабом, даклізумабом), поліклональними анти-Т-клітинними антитілами (наприклад, анти-тимоцитарним глобуліном (ATG), анти-лімфоцитарним глобуліном (ALG)). В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження астми і/або риніту і/або COPD; конкретні агенти включають у себе, але не обмежуються: агоністами бета 2-адренорецепторів (наприклад, салбутамолом, левалбутеролом, тербуталіном і бітолтеролом), епінефрином (у вигляді інгаляції або таблеток), антихолінергічними засобами (наприклад, іпратропіумбромідом), глюкокортикоїдами (пероральними або такими, що вводяться інгаляційним шляхом), β2-антагоністами тривалої дії (наприклад, салметеролом, формотеролом, бамбутеролом і пероральним альбутеролом уповільненого вивільнення), поєднанням стероїдів, що вводяться інгаляційним шляхом, і бронходилататорами тривалої дії (наприклад, флутиказоном/салметеролом, бутезонідом/формотеролом), антагоністами та інгібіторами синтезу лейкотрієну (наприклад, монтелукастом, зафірлукастом і зилейтоном), інгібіторами вивільнення медіаторів (наприклад, кромоглікатом і кетоніфеном), біологічними регуляторами відгуку IgE (наприклад, омалізумабом), антигістамінними препаратами 13 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, цетеризином, цинаризином, фексофенадіном) і вазоконстрикторами (наприклад, оксиметазоліном, ксилометазоліном, нафазоліном і трамазоліном). Крім того, сполуку даного винаходу можна вводити в поєднанні з невідкладними терапевтичними засобами у разі астми і/або COPD, при цьому подібні види терапії включають у себе введення кисню або киснево-гелієвої суміші, розпилений сальбутамол або тербуталін (необов'язково в поєднанні з антихолінергічними препаратами (наприклад, іпратропієм), системні стероїди (пероральні, або внутрішньовенні, наприклад, преднізон, преднізолон, метилпреднізолон, дексаметазон або гідрокортизон), внутрішньовенний сальбутамол, неспецифічні бета-агоністи, що вводяться шляхом ін'єкції або інгаляції (наприклад, епінефрин, ізоетарин, ізопротеренол, метапротеренол), антихолінергічні засобу (внутрішньовенно або розпилені, наприклад, глікопіролат, атропін, іпратропій), метилксантини (теофілін, амінофілін, баміфілін), інгаляційні анестетики, що мають бронходилатуючі ефекти (наприклад, ізофлуран, галотан, енфлуран), кетамін і внутрішньовенний сульфат магнію.) В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження запальної хвороби кишечнику (IBD); конкретні агенти включають у себе, але не обмежуються: глюкокортикоїдами (наприклад, преднізоном, будезонідом), синтетичними модифікуючими захворювання імуномодулюючими агентами (наприклад, метотрексатом, лефлуномідом, сульфазалазином, мезалазином, азатіоприном, 6-меркаптопурином і циклоспорином) і біологічними модифікуючими захворювання імуномодулюючими агентами (наприклад, адалімумабом, ритуксимабом і абатасептом). В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження системного червоного вовчака; конкретні агенти включають у себе, але не обмежуються: модифікуючими захворювання протиревматичними лікарськими засобами (DMARD), такими як антималярійні препарати (наприклад, плакеніл, гідроксихлорохін), імунодепресантами (наприклад, метотрексат і азатіоприн), циклофосфамідом і мікофеноловою кислотою; імуносупресивними лікарськими засобами та анальгетиками, такими як нестероїдні протизапальні лікарські препарати, опіати (наприклад, декстропропоксифен і ко-кодамол), опіоїди (наприклад, гідрокодон, оксикодон, MS Contin або метадон) і черезшкірний пластир "Дюрогезік", що містить фентаніл. В одному з варіантів здійснення сполуку даного винаходу вводять разом з іншим терапевтичним агентом для лікування і/або попередження псоріазу; конкретні агенти включають у себе, але не обмежуються: місцевими видами лікування, такими як розчини для занурення, зволожуючі креми, лікувальні креми і мазі, що містять кам'яновугільний дьоготь, дитранол (антралін), кортикостероїди типу дезоксиметазону (Topicort™), флуоцинонід, аналоги вітаміну D3 (наприклад, кальципотриол), ретиноїди арганового масла (етретинат, ацитретин, тазаротен), системні курси лікування, такі як метотрексат, циклоспорин, ретиноїди, тіогуанін, гідроксисечовина, сульфалазин, мікофенолятмофетил, азатіоприн, такролімус, ефіри фумарової кислоти або біопрепарати, такі як Ametive™, Humira™, Remicade™, Raptiva™ і устекінумаб (блокатор IL-12 і IL-23). Крім того, сполуку даного винаходу можна вводити в поєднанні з іншими видами терапії, що включають у себе, але не обмеженими фототерапією або фотохіміотерапією (наприклад, псорален і фототерапія ультрафіолетовими променями діапазону А (PUVA)). До спільного введення входять будь-які способи доставки пацієнту двох або більш терапевтичних агентів як частини одного і того ж режиму лікування, як буде очевидно фахівцеві в даній галузі. Незважаючи на те, що два або більше агентів можна вводити одночасно у вигляді одного препарату, це не істотно. Дані агенти можна вводити в складі різних препаратів і в різний час. Загальні методики синтезу Загальне Сполуку даного винаходу можна одержати з легко доступних вихідних речовин із використанням наступних загальних способів і методик. Зрозуміло, що у випадку, коли наведені типові або переважні умови способу (наприклад, температура реакції, тривалість, молярні співвідношення реагентів, розчинники, тиск і так далі), можна також використати інші умови способу, якщо не встановлено інакше. Оптимальні умови реакції можуть змінюватися залежно від конкретних реагентів, що використовуються або розчинника, але фахівець у даній галузі може визначити такі умови шляхом стандартних способів оптимізації. Крім того, для фахівців у даній галузі буде очевидним, що можуть бути потрібні стандартні захисні групи, щоб запобігти протіканню небажаних реакцій з участю деяких функціональних груп. Вибір придатної захисної групи для конкретної функціональної групи, а також придатних 14 UA 105796 C2 5 10 15 20 25 умов для захисту і зняття захисту добре відомий у даній галузі. Наприклад, численні захисні групи та їхні введення і видалення описані у T.W. Green and P.G.M. Wuts, Protective Groups in Organic Synthesis, Wiley, New York, 1991, і у наведених там посиланнях. Наступні способи наведені детально стосовно одержання репрезентативних біциклогетероарилів, які були перераховані в даному описі раніше. Фахівець у галузі органічного синтезу може одержати сполуку даного винаходу з відомих або комерційно доступних вихідних речовин і реагентів. Всі реагенти були технічної якості і використовувалися без додаткового очищення, якщо не встановлено інакше. У реакціях, що проводяться в атмосфері інертного газу, використали комерційно доступні безводні розчинники. У всіх інших випадках використали розчинники, чисті для аналізу, якщо не зазначено інакше. Колонкову хроматографію здійснювали на силікагелі 60 (35-70 мкм). Тонкошарову хроматографію проводили на пластинах із попередньо нанесеним 1 силікагелем F-254 (товщина 0,25 мм). Спектри Н-ЯМР реєстрували на спектрометрі Bruker DPX 1 400 (400 МГц). Хімічні зсуви (δ) у спектрах Н-ЯМР наведені в мільйонних частках (м.ч.) стосовно тетраметилсилану (δ 0,00) або піка залишкового протона відповідного розчинника, тобто CHCl3 (δ 7,27) як внутрішній стандарт. Мультиплетність наведена у вигляді синглету (с), дублету (д), триплету (т), квадруплету (кв), мультиплету (м) і розширеного сигналу (розш). Константи спін-спінової взаємодії (J) наведені в Гц. Мас-спектри з електроспреєвою іонізацією реєстрували на спектрометрі Micromass platform LC/MS. Колонка, що використовується для всіх аналізів методом ВЕРХ: Waters Acquity UPLC BEH C18 1,7 мкм, 2,1 мм ID50 мм L (№ партії 186002350)). Препаративна ВЕРХ: Waters XBridge Prep C18 5 мкм ODB 19 мм ID100 мм L (№ партії 186002978). Всі методи проводили з використанням градієнтів MeCN/H 2O. У Н2О містилася або 0,1 % ТФА, або 0,1 % NH3. Наступне являє собою список скорочень, що використовуються в експериментальній частині: Хлористий метилен N, N-діізопропілетиламін Ацетонітрил Трет-бутоксикарбоніл N, N-диметилформамід Каталітична кількість Трифтороцтова кислота Тетрагідрофуран Ядерний магнітний резонанс Диметилсульфоксид Рідинна хроматографія-мас-спектрометрія Мільйонна частка Паладій на активованому вугіллі 10 % Пара-метоксибензил Гексафторборат бензотриазол-1PyBOP ілокситрис(піролідин)фосфонію EtOAc Етилацетат APCI Хімічна іонізація при атмосферному тиску Rt Час утримування с синглет розш с розширюваний синглет м мультиплет хв хвилина мл мілілітр мкл мікролітр г грам мг міліграм [1,1PdCl2dppf біс(дифенілфосфін)фероцен]дихлорпаладій(II) TEA Триетиламін MMP Матрична металопротеїназа DCM DiPEA MeCN BOC ДМФА Кат. ТФА ТГФ ЯМР ДМСО РХ-МС М.ч. Pd/С PMB 15 UA 105796 C2 Нормальні хондроцити суглобового хряща людини shРНК Малі РНК, створюючі шпильки РНК Рибонуклеїнова кислота Ad-siРНК Кодована аденовірусом siРНК Фізіологічний розчин із фосфатним буфером, що містить Tween 3,2 мМ Na2HPO4, 0,5 мМ PBST KH2PO4, 1,3 мМ KCl, 135 мМ NaCl, 0,05 % Tween 20, рН 7,4 APMA Ацетат 4-амінофенілртуті Мінімальне поживне середовище Ігла, DMEM модифіковане Дульбеко FBS Плідна бичача сироватка hCAR Клітинний рецептор аденовірусу людини 3-MOI Множинність інфекції, що дорівнює 3 dNTP Дезоксирибонуклеозидтрифосфат QPCR Кількісна полімеразно-ланцюгова реакція Комплементарна дезоксирибонуклеїнова кДНК кислота GAPDH Гліцеральдегід фосфатдегідрогенази NHAC 5 10 15 20 Синтез сполука винаходу Сполуку згідно з даним винаходом можна одержати згідно з наступною схемою Загальний спосіб синтезу Схема 1 в якій Ar являє собою феніл-L1-гетероциклоалкіл, де L1 є -СО-, і гетероциклоалкільна група необов'язково заміщена. Загальне 1.1.1 1-(6-Бромпіридин-2-іл)-3-карбетокситіосечовина (2) До розчину 2-аміно-6-бромпіридину (1) (253,8 г, 1,467 моль) у DCM (2,5 л), охолодженого до 5С, додають по краплях етоксикарбонілізотіоціанат (173,0 мл, 1,467 моль) протягом 15 хв. Потім реакційну суміш залишають нагріватися до кімнатної температури (20С) і перемішують протягом 16 годин. Внаслідок упарювання у вакуумі одержують тверду речовину, яку можна виділити фільтруванням, ретельно промивають петролейним ефіром (3600 мл) і сушать на повітрі, одержуючи (2). Дану тіосечовину можна використати на наступній стадії як таку без 1 будь-якого очищення. Н (400 МГц, CDCl3) δ 12,03 (1H, розш.с., NH), 8,81 (1H, д, J=7,8 Гц, Н-3), 8,15 (1H, розш.с., NH), 7,60 (1H, т, J=8,0 Гц, Н-4), 7,32 (1H, дд, J=7,7 і 0,6 Гц, Н-5), 4,31 (2H, кв, J=7,1 Гц, CH2), 1,35 (3H, т, J=7,1 Гц, CH3). 1.1.2 5-Бром-[1,2,4]триазол[1,5-a]піридин-2-іламін (3) 16 UA 105796 C2 5 10 15 20 25 30 35 До суспензії гідрохлориду гідроксиламіну (101,8 г, 1,465 моль) у суміші EtOH/MeOH (1:1, 900 мл) додають N, N-діізопропілетиламін (145,3 мл, 0,879 моль) і перемішують суміш при кімнатній температурі (20С) протягом 1 години. Після цього додають 1-(6-бромпіридин-2-іл)-3карбетокситіосечовину (2) (89,0 г, 0,293 моль) і суміш повільно нагрівають до кипіння зі зворотним холодильником (Примітка: для гасіння H2S, що виділяється, необхідна поглинальна трубка з хлорним вапном). Після 3 годин при кипінні зі зворотним холодильником, суміш залишають охолоджуватися і фільтрують, виділяючи осад, що випав. Додаткову кількість продукту виділяють внаслідок упарювання фільтрату у вакуумі, додавання Н2О (250 мл) і фільтрування. Об'єднані осади послідовно промивають Н 2О (250 мл), EtOH/MeOH (1:1, 250 мл) і Et2O (250 мл), потім сушать у вакуумі, одержуючи похідне триазолпіридину (3) у вигляді твердої речовини. Дану сполуку можна використати на наступній стадії як таку без будь-якого очищення. 1H (400 MГц, ДМСО-d6) δ 7,43-7,34 (2H, м, 2ароматичний Н), 7,24 (1H, дд, J=6,8 і 1,8 + Гц, ароматичний Н), 6,30 (2H, розш, NH2); m/z 213/215 (1:1, M+Н , 100 %). 1.1.3 (5-Бром-[1,2,4]триазол[1,5-a]піридин-2-іл)амід циклопропанкарбонової кислоти (4) До розчину 2-амінотриазолпіридину (3) (7,10 г, 33,3 ммоль) у сухому CH 3CN (150 мл) при 5С додають Et3N (11,6 мл, 83,3 ммоль), після чого додають циклопропанкарбонілхлорид (83,3 ммоль). Потім реакційну суміш залишають нагріватися до температури навколишнього середовища і перемішують доти, поки не витрачається вся вихідна речовина (3). За необхідності, для гарантії повного протікання реакції додають ще Et 3N (4,64 мл, 33,3 ммоль) і циклопропанкарбонілхлорид (33,3 ммоль). Після випарювання розчинника у вакуумі, одержаний залишок обробляють 7 н. розчином аміаку в метанолі (50 мл) і перемішують при температурі навколишнього середовища (протягом 1-16 годин) для гідролізу будь-якого продукту бісацилювання. Виділення продукту проводять, видаляючи леткі речовини у вакуумі з подальшим розтиранням в Et2O (50 мл). Осади виділяють фільтруванням, промивають Н 2О (250 мл), ацетоном (50 мл) і Et2O (50 мл), потім сушать у вакуумі, одержуючи необхідну бром-проміжну сполуку (4). Методика синтезу для одержання сполуки даного винаходу Сполука 1 Стадія 1: Сполучення за Сузукі До розчину (5-бром-[1,2,4]триазол[1,5-a]піридин-2-іл)аміду циклопропанкарбонової кислоти (проміжна сполука 4, 5 г, 0,018 моль) у суміші 1,4-діоксан/вода (5:1) додавали 4карбоксифенілборонову кислоту (3,5 г, 0,021 моль). До розчину додавали K 2CO3 (5,0 г, 0,036 моль) і PdCl2dppf (5 %). Після цього одержану суміш нагрівали традиційним нагріванням на масляній бані при 90С протягом 16 годин. Додавали 1 М розчин HCl, і в кислому розчині утворювався осад. Даний осад відфільтровували, сушили у вакуумі, одержуючи зазначену в заголовку сполуку, яку використали на наступній стадії без додаткового очищення. 17 UA 105796 C2 Стадія 2: {5-[4-(3,3-диметилазетидин-1-карбоніл)феніл]-[1,2,4]триазол[1,5-a]піридин-2-іл}амід циклопропанкарбонової кислоти (сполука 1) 5 10 15 До розчину 4-[2-(циклопропанкарбоніламіно)-[1,2,4]триазол[1,5-a]піридин-5-іл]бензойної кислоти (4 г, 0,012 моль) у DCM (150 мл) додавали EDCI (3,59 г, 0,019 моль), HOBt (2,53 г, 0,019 моль) і DIPEA (4,48 мл) при кімнатній температурі. Одержану суміш перемішували протягом 10 хв при кімнатній температурі. До розчину додавали гідрохлоридну сіль диметилазетидину (1,64 г, 0,013 моль) і перемішували суміш протягом 16 годин. До реакційної суміші додавали воду. Органічний шар відділяли і промивали 2 н. розчином NаOH, 2 н. розчином HCl і водою. Органічну фазу сушили над MgSO4, фільтрували і упарювали у вакуумі. Внаслідок очищення методом флеш-хроматографії (елюент: від суміші 1:1 петролейний ефір/EtOAc до чистого EtOAc) одержували {5-[4-(3,3-диметилазетидин-1-карбоніл)феніл]-[1,2,4]триазол[1,5-a]піридин2-іл}амід циклопропанкарбонової кислоти. Сполука даного винаходу, яка була одержана або яку можна одержати згідно з описаним тут способом синтезу, наведена нижче в таблиці I. Спектральні дані ЯМР сполуки винаходу представлені в таблиці II. Таблиця I Дані мас-спектрометрії сполуки винаходу № спол. 1 Структура Назва {5-[4-(3,3-диметилазетидин-1карбоніл)феніл]-[1,2,4]триазол[1,5a]піридин-2-іл}амід циклопропанкарбонової кислоти М МС визн. 389,46 390,0 Таблиця II Дані ЯМР сполуки винаходу № спол. Дані ЯМР (δ) 1 ( Н, ДМСО-d6) 11,01 (1H, розш, NH), 8,08 (2H, д, ArH), 7,79 (2H, д, ArH), 7,73 (1H, д, ArH), 7,72 (1H, с, ArH), 7,35 (1H, дд, ArH), 4,04 (2Н, розш, СН2), 3,77 (2Н, розш, СН2), 1 2,02 (1Н, розш, СН), 1,27 (6Н, с, 2СН3), 0,81 (4Н, м, 2СН2). 20 25 Біологічні приклади Приклад 1 – аналіз in vitro Приклад 1.1 Аналіз інгібування JAK1 Рекомбінантну JAK1 людини (каталітичний домен, амінокислоти 866-1154; номер за каталогом PV4774) одержували від Invitrogen. Інкубували 1 нг JAK1 із 20 нМ білка UlightJAK1(tyr1023) (номер за каталогом Perkin Elmer TRF0121) у кіназному реакційному буфері (25 мМ MOPS рН 6,8, 0,016 % Brij-35, 8,33 мМ MgCl2, 3,33 мМ DTT, 7 мкМ АТФ) у присутності або за 18 UA 105796 C2 5 10 15 20 відсутності 4 мкл, що містять сполуку, що тестують, або розріджувач (ДМСО, 1 % кінцева концентрація) у загальному об'ємі 20 мкл на білому планшеті 384 Luminotrac (Greiner, номер за каталогом 781075). Через 60 хв при кімнатній температурі, реакції зупиняли додаванням 20 мкл/ямку детекторної суміші (1детекторний буфер (Perkin Elmer, номер за каталогом CR97100С), 0,5 нМ європій-анти-фосфотирозину (РТ66) (Perkin Elmer, номер за каталогом AD0068), 10 мМ ЕДТА). Зчитування здійснювали з використанням Envision при збудженні при 320 нм і визначаючи випромінювання при 615 нм (Perkin Elmer). Кіназну активність розраховували, віднімаючи відносні одиниці флуоресценції (RFU), одержані в присутності позитивного контрольного інгібітору (10 мкМ стауроспорин) з RFU, одержаних у присутності розріджувача. Здатність сполуки, що тестується, інгібувати дану активність визначали як: відсоток інгібування=((RFU, визначені для зразка в присутності сполуки, що тестується, – RFU, визначені для зразка з позитивним контрольним інгібітором, поділене на (RFU, визначені в присутності розріджувача – RFU, визначені для зразка з позитивним контрольним інгібітором))*100. Одержували серійні розведення дози для сполук, що дозволяє тестувати вплив доза-відгук в аналізі JAK1 і обчислити IC50 для даної сполуки. Кожну сполуку тестували стандартним чином при концентрації 20 мкМ із подальшим серійним розведенням 1/5, 8 точок (20 мкМ - 4 мкМ - 800 нМ - 160 нМ - 32 нМ - 6,4 нМ - 1,28 нМ - 0,26 нМ) при кінцевій концентрації 1 % ДМСО. При підвищенні ефективності серій сполуки, готують додаткові розведення і/або знижують верхню концентрацію (наприклад, 5 мкМ, 1 мкМ). Дані представлені у вигляді середньої IC 50 з аналізів середня квадратична похибка середнього значення. Таблиця III Значення IC50 сполуки для JAK1 № сполуки JAK1 (нМ) 6,60,7 1 25 30 35 40 45 50 55 Приклад 1.2 Аналіз на визначення Ki JAK1 Для визначення Ki, із ферментом змішували різні кількості інгібітору і стежили за ферментною реакцією як функцією концентрації АТФ. Ki визначали за допомогою подвійного взаємного графічного відображення Km стосовно концентрації сполуки (графік Lineweaver-Burk). JAK1 (Invitrogen, PV4774) використали при кінцевій концентрації 500 нг/мл. Субстрат являв собою натрієву сіль Poly(Glu, Tyr) (4:1), М.м. 20000-50000 (Sigma, P0275). Реакцію проводили в 25 мМ Hepes рН 7,5; 0,01 % Tween 20, 10 мМ MgCl2 при різних концентраціях АТФ і сполуки і зупиняли додаванням 150 мМ фосфорної кислоти. Визначення включеного фосфату в PolyGT субстрату здійснювали, вміщуючи зразки на фільтруючий планшет (із використанням 33 харвестера, Perkin Elmer) із подальшим промиванням. Включений Р у PolyGT визначають на сцинтиляційному лічильнику Topcount після додавання сцинтиляційної рідини в фільтруючі планшети (Perkin Elmer). При тестуванні в даному аналізі сполуки 1 одержували значення Ki, що дорівнює 6,9 нМ. Альтернативним чином, для визначення Ki з ферментом змішували різні кількості інгібітору і стежили за ферментною реакцією як функцією концентрації АТФ. Ki визначали за допомогою подвійного взаємного графічного відображення Km стосовно концентрації сполуки (графік Lineweaver-Burk). У даному аналізі використали 1 нг JAK1 (Invitrogen, PV4774). Субстрат являв собою 50 нМ пептиду Ulight-JAK-1 (Тyr1023) (Perkin Elmer, TRF0121). Реакцію проводили в 25 мМ MOPS рН 6,8, 0,01 %, 2 мМ DTT, 5 мМ MgCl2 Brij-35 при різних концентраціях АТФ і сполуки. Фосфорилований субстрат визначали з використанням Eu-міченого антифосфотирозинового антитіла РТ66 (Perkin Elmer, AD0068). Зчитування здійснювали за допомогою Envision (Perkin Elmer) при збудженні при 320 нм і подальшому випромінюванні при 615 нм і 665 нм. При тестуванні в даному аналізі сполуки 1 одержували значення Ki, що дорівнює 5,6 нМ. Приклад 1.3 Аналіз інгібування JAK2 Рекомбінантну JAK2 людини (каталітичний домен, амінокислоти 866-1154; номер за каталогом PV4210) одержували від Invitrogen. Інкубували 0,0125 мU JAK2 з 25 нМ пептиду Ulight-JAK1(tyr1023) (номер за каталогом Perkin Elmer TRF0121) у кіназному реакційному буфері (41,66 мМ HEPES рН 7,0, 0,016 % Triton X-100, 12,5 мМ MgCl2, 3,33 мМ DTT, 7,5 мкМ АТФ) у присутності або за відсутності 4 мкл, що містять сполуку, що тестується, або розріджувач (ДМСО, 1 % кінцева концентрація) у загальному об'ємі 20 мкл на білому планшеті 384 Luminotrac (Greiner, номер за каталогом 781075). Через 60 хв при кімнатній температурі, реакції зупиняли додаванням 20 мкл/ямку детекторної суміші (1детекторний буфер (Perkin Elmer, номер за каталогом CR97-100С), 0,5 нМ європій-анти-фосфотирозину (РТ66) (Perkin Elmer, 19 UA 105796 C2 5 10 15 номер за каталогом AD0068), 10 мМ ЕДТА. Зчитування здійснювали з використанням Envision при збудженні при 320 нм і визначаючи випромінювання при 615 нм (Perkin Elmer). Кіназну активність розраховували, віднімаючи відносні одиниці флуоресценції (RFU), одержані в присутності позитивного контрольного інгібітору (10 мкМ стауроспорин) з RFU, одержаних у присутності розріджувача. Здатність сполуки, що тестується, інгібувати дану активність визначали як: відсоток інгібування=((RFU, визначені для зразка в присутності сполуки, що тестується – RFU, визначені для зразка з позитивним контрольним інгібітором, поділене на (RFU, визначені в присутності розріджувача – RFU, визначені для зразка з позитивним контрольним інгібітором))*100. Одержували серійні розведення дози для сполук, що дозволяє тестувати вплив доза-відгук в аналізі JAK2 і обчислити IC50 для даної сполуки. Кожну сполуку тестували стандартним чином при концентрації 20 мкМ із подальшим серійним розведенням 1/5, 8 точок (20 мкМ - 4 мкМ - 800 нМ - 160 нМ - 32 нМ - 6,4 нМ - 1,28 нМ - 0,26 нМ) при кінцевій концентрації 1 % ДМСО. При підвищенні ефективності серій сполуки готують додаткові розведення і/або знижують верхню концентрацію (наприклад, 5 мкМ, 1 мкМ). Дані представлені у вигляді середньої IC 50 з аналізів середня квадратична похибка середнього значення. Таблиця IV Значення IC50 сполуки для JAK2 № сполуки JAK1 (нМ) 675 1 20 25 30 35 40 45 50 55 Приклад 1.4 Аналіз на визначення Ki JAK2 Для визначення Ki із ферментом змішували різні кількості інгібітору і стежили за ферментною реакцією як функцією концентрації АТФ. Ki визначали за допомогою подвійного взаємного графічного відображення Km стосовно концентрації сполуки (графік Lineweaver-Burk). У даному аналізі використали 0,025 мU JAK2 (Invitrogen, PV4210). Субстрат являв собою натрієву сіль Poly(Glu, Tyr) (4:1), М.м. 20000-50000 (Sigma, P0275). Реакцію проводили в 10 мМ MOPS рН 7,5, 0,5 мМ ЕДТА, 0,01 % Brij-35, 1 мМ DTT, 15 мМ MgAc при різних концентраціях АТФ і сполуки і зупиняли додаванням 150 мМ фосфорної кислоти. Визначення включеного фосфату в PolyGT субстрату здійснювали, вміщуючи зразки на фільтруючий планшет (із 33 використанням харвестера, Perkin Elmer) із подальшим промиванням. Включений Р у PolyGT визначають на сцинтиляційному лічильнику Topcount після додавання сцинтиляційної рідини в фільтруючі планшети (Perkin Elmer). При тестуванні в даному аналізі сполуки 1 одержували значення Ki, що дорівнює 126 нМ. Альтернативним чином, для визначення Ki із ферментом змішували різні кількості інгібітору і стежили за ферментною реакцією як функцією концентрації АТФ. Ki визначали за допомогою подвійного взаємного графічного відображення Km стосовно концентрації сполуки (графік Lineweaver-Burk). У даному аналізі використали 0,0125 мU JAK2 (Invitrogen, PV4210). Субстрат являв собою 50 нМ пептиду Ulight-JAK-1 (Тyr1023) (Perkin Elmer, TRF0121). Реакцію проводили в 25 мМ HEPES рН 7,0, 0,01 % Triton X-100, 2 мМ DTT, 7,5 мМ MgCl2 при різних концентраціях АТФ і сполуки. Фосфорилований субстрат визначали з використанням Eu-міченого антифосфотирозинового антитіла РТ66 (Perkin Elmer, AD0068). Зчитування здійснювали за допомогою Envision (Perkin Elmer) при збудженні при 320 нм і подальшому випромінюванні при 615 і 665 нм. При тестуванні в даному аналізі сполуки 1 одержували значення Ki, що дорівнює 35 нМ. Приклад 1.5 Аналіз інгібування JAK3 Каталітичний домен рекомбінантної JAK3 людини (амінокислоти 781-1124; номер за каталогом PV3855) одержували від Invitrogen. Інкубували 0,025 мU JAK3 із 2,5 мкг субстрат polyGT (номер за каталогом Sigma Р0275) у кіназному реакційному буфері (25 мМ Tris рН 7,5, 0,5 мМ EGTA, 0,5 мМ Na3VO4, 5 мМ b-гліцеринфосфату, 0,01 % Triton X-100, 1 мкМ 33 нерадіоактивного АТФ, 0,25 мкКі Р-гамма-АТФ (GE Healthcare, номер за каталогом АН9968) кінцеві концентрації) у присутності або за відсутності 5 мкл, що містять сполуку, що тестується, або розріджувач (ДМСО, 1 % кінцева концентрація) у загальному об'ємі 25 мкл у поліпропіленовому 96-ямковому планшеті (Greiner, V-образне дно). Через 105 хв при 30С, реакції зупиняли додаванням 25 мкл/ямку 150 мМ фосфорної кислоти. Всі зупинені кіназні реакційні суміші переносили в попередньо промиті (75 мМ фосфорною кислотою) 96-ямкові фільтруючі планшети (Perkin Elmer, номер за каталогом 6005177) із використанням клітинного харвестера (Perkin Elmer). Планшети 6 разів промивали розчином 75 мМ фосфорної кислоти в 20 UA 105796 C2 5 10 15 кількості 300 мкл на ямку і щільно закривали дно планшетів. Додавали 40 мкл/ямку Microscint20, щільно закривали верх планшетів і здійснювали зчитування даних із використанням Topcount (Perkin Elmer). Активність кінази розраховували, віднімаючи кількість підрахунків на хвилину (cpm), одержаних у присутності позитивного контрольного інгібітору (10 мкМ стауроспорину), із cpm, одержаних у присутності розріджувача. Здатність сполуки, що тестується, інгібувати дану активність визначали як: відсоток інгібування=((cpm, визначені для зразка в присутності сполуки, що тестується – cpm, визначені для зразка з позитивним контрольним інгібітором, поділене на (cpm, визначені в присутності розріджувача – cpm, визначені для зразка з позитивним контрольним інгібітором))*100. Одержували серійні розведення дози для сполуки, що дозволяє тестувати вплив доза-відгук в аналізі JAK3 і обчислити IC50 для даної сполуки. Кожну сполуку тестували стандартним чином при концентрації 20 мкМ із подальшим серійним розведенням 1/3, 8 точок (20 мкМ - 6,67 мкМ 2,22 мкМ - 740 нМ – 247 нМ - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації 1 % ДМСО. При підвищенні ефективності серій сполуки готують додаткові розведення і/або знижують верхню концентрацію (наприклад, 5 мкМ, 1 мкМ). Дані наведені у вигляді середньої IC50 з аналізів середня квадратична похибка середнього значення. Таблиця V Значення IC50 сполуки для JAK3 № сполуки JAK1 (нМ) 40862 1 20 25 30 35 40 45 50 55 Приклад 1.6 Аналіз на визначення Ki JAK3 Для визначення Ki із ферментом змішували різні кількості інгібітору і стежили за ферментною реакцією як функцією концентрації АТФ. Ki визначали за допомогою подвійного взаємного графічного відображення Km стосовно концентрації сполуки (графік Lineweaver-Burk). JAK3 (Carna Biosciences, 09CBS-0625B) використали при кінцевій концентрації 10 мг/мл. Субстрат являв собою натрієву сіль Poly(Glu, Tyr) (4:1), М.м. 20000-50000 (Sigma, P0275). Реакцію проводили в 25 мМ Tris рН 7,5, 0,01 % Triton X-100, 0,5 мМ EGTA, 2,5 мМ DTT, 0,5 мМ Na3VO4, 5 мМ b-гліцеринфосфату, 10 мМ MgCl2 при різних концентраціях АТФ і сполуки і зупиняли додаванням 150 мМ фосфорної кислоти. Визначення включеного фосфату в PolyGT субстрат здійснювали, вміщуючи зразки на фільтруючий планшет (із використанням 33 харвестера, Perkin Elmer) із подальшим промиванням. Включений Р в PolyGT визначають на сцинтиляційному лічильнику Topcount після додавання сцинтиляційної рідини у фільтруючі планшети (Perkin Elmer). При тестуванні в даному аналізі сполуки 1 одержували значення Ki, що дорівнює 188 нМ. Приклад 1.7 Аналіз інгібування TYK2 Каталітичний домен рекомбінантної TYK2 людини (амінокислоти 871-1187; номер за каталогом 08-147) одержували від Carna Biosciences. Інкубували 5 нг TYK2 із 12,5 мкг субстрат polyGT (номер за каталогом Sigma Р0275) у кіназному реакційному буфері (25 мМ HEPES рН 33 7,5, 100 мМ NaCl, 0,2 мМ Na3VO4, 0,1 % NP-40, 0,1 мкМ нерадіоактивного АТФ, 0,125 мкКі Ргамма-АТФ (GE Healthcare, номер за каталогом АН9968) кінцеві концентрації) у присутності або за відсутності 5 мкл, що містять сполуку, яка тестується, або розріджувач (ДМСО, 1 % кінцева концентрація) у загальному об'ємі 25 мкл у поліпропіленовому 96-ямковому планшеті (Greiner, V-подібне дно). Через 90 хв при 30С, реакції зупиняли додаванням 25 мкл/ямку 150 мМ фосфорної кислоти. Всі зупинені кіназні реакційні суміші переносили в попередньо промиті (75 мМ фосфорною кислотою) 96-ямкові фільтруючі планшети (Perkin Elmer, номер за каталогом 6005177) із використанням клітинного харвестера (Perkin Elmer). Планшети 6 разів промивали розчином 75 мМ фосфорної кислоти в кількості 300 мкл на ямку і щільно закривали дно планшетів. Додавали 40 мкл/ямку Microscint-20, щільно закривали верх планшетів і здійснювали зчитування даних із використанням Topcount (Perkin Elmer). Активність кінази розраховували, віднімаючи кількість підрахунків на хвилину (cpm), одержаних у присутності позитивного контрольного інгібітору (10 мкМ стауроспорину), із cpm, одержаних у присутності розріджувача. Здатність сполуки, що тестується, інгібувати дану активність визначали як: відсоток інгібування=((cpm, визначені для зразка в присутності сполуки, що тестується, cpm, визначені для зразка з позитивним контрольним інгібітором, поділене на (cpm, визначені в присутності розріджувача - cpm, визначені для зразка з позитивним контрольним інгібітором))*100. 21 UA 105796 C2 5 Одержували серійні розведення дози для сполуки, що дозволяє тестувати вплив доза-відгук в аналізі TYK2 і обчислити IC50 для даної сполуки. Кожну сполуку тестували стандартним чином при концентрації 20 мкМ із подальшим серійним розведенням 1/3, 8 точок (20 мкМ - 6,67 мкМ 2,22 мкМ - 740 нМ - 247 нМ - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації 1 % ДМСО. При підвищенні ефективності серій сполуки готують додаткові розведення і/або знижують верхню концентрацію (наприклад, 5 мкМ, 1 мкМ). Дані представлені у вигляді середньої IC50 з аналізів середня квадратична похибка середнього значення. Таблиця VI Значення TYK2 IC50 для сполуки № сполуки TYK2 (нМ) 21937 1 10 15 20 25 30 35 40 Приклад 2. Клітинні аналізи Приклад 2.1 Аналіз передачі сигналу JAK-STAT Клітини HeLa витримували в мінімальному поживному середовищі Ігла, модифікованому Дульбеко (DMEM), що містить 10 % інактивованої нагріванням плідної телячої сироватки, 100 U/мл пеніциліну і 100 мкг/мл стрептоміцину. Клітини HeLa використали при 70 % злитті для трансфекції. 20000 клітин у 87 мкл середовища клітинної культури швидко трансфікували 40 нг репортера pSTAT1(2)-люциферази, 8 нг репортера LacZ у ролі внутрішнього контрольного репортера і 52 нг pBSK із використанням 0,32 мкл Jet-PEI (Polyplus) як реагента трансфекції на ямку в форматі 96-ямкового планшета. Після інкубації протягом ночі при 37С, у присутності 10 % СО2 трансфекційне середовище видаляли. Додавали 75 мкл DMEM і 1,5 % інактивованої нагріванням плідної телячої сироватки. Протягом 60 хв додавали 15 мкл сполуки в концентрації 6,7, а потім 10 мкл OSM людини (Peprotech) у кінцевій концентрації 33 нг/мл. Всі сполуки тестували по два рази, починаючи з 20 мкМ із подальшим серійним розведенням 1/3, у цілому 8 доз (20 мкМ - 6,6 мкМ - 2,2 мкМ - 740 нМ - 250 нМ - 82 нМ - 27 нМ - 9 нМ) при кінцевій концентрації 0,2 % ДМСО. Після інкубації протягом ночі при 37С, у присутності 10 % СО2 клітини лізували в 100 мкл лізисного буфера/ямку (PBS, 0,9 мМ CaCl2, 0,5 мМ MgCl2, 5 % трегалози, 0,025 % тергітолу NP9, 0,15 % BSA). 40 мкл клітинного лізату використали для зчитування активності β-галактозидази при додаванні 180 мкл розчину βGal (30 мкл ONPG 4 мг/мл і 150 мкл β-галактозидазного буфера (0,06 М Na2HPO4, 0,04 M NaH2PO4, 1 мМ MgCl2)) протягом 20 хв. Реакцію зупиняли додаванням 50 мкл 1 М Na2CO3. Поглинання зчитували при 405 нм. Активність люциферази визначали при використанні 40 мкл клітинного лізату і 40 мкл Steadylite®, як описано виробником (Perkin Elmer), за допомогою Envision (Perkin Elmer). 10 мкМ інгібітору pan-JAK використали у ролі позитивного контролю (100 % інгібування). У ролі негативного контролю використали 0,5 % ДМСО (0 % інгібування). Позитивний і негативний контроль використали для розрахунку значень z і "відсоток інгібування" (PIN). Відсоток інгібування=((флуоресценція, визначена в присутності розріджувача флуоресценція, визначена для зразка в присутності сполуки, що тестується, поділити на (флуоресценцію, визначену в присутності розріджувача - флуоресценція, визначена для зразка за відсутності тригера))*100. Значення PIN наносили на графік для сполук, що тестують, у вигляді залежності доза-відгук і набували значень ЕС50. Таблиця VII № сполуки 45 50 Значення ЕС50 сполуки при передачі сигналу STAT ЕС50 (нМ) 1 539130 Приклад 2.2 Аналіз передачі сигналу OSM/IL-1β Було показано, що OSM і IL-1β виявляють синергетичну апрегуляцію рівня ММР13 у клітинній лінії хондросаркоми людини SW11353. Клітини висівали в 96-ямкові планшети у кількості 15000 клітин/ямку в об'ємі 120 мкл DMEM (Invitrogen), що містить 10 % (об./об.) FBS і 1 % суміші пеніцилін/стрептоміцин (Invitrogen), інкубованої при 37С і 5 % СО2. Клітини попередньо інкубували в присутності 15 мкл сполуки в середовищі М199, що містить 2 % ДМСО протягом 1 години перед запуском за допомогою 15 мкл OSM і IL-1β, досягаючи 25 нг/мл OSM і 1 нг/мл IL-1β, і визначали концентрацію ММР13 у кондиціонованому середовищі протягом 48 22 UA 105796 C2 5 10 15 20 годин після запуску. Активність ММР13 визначали з використанням аналізу активності захоплення антитіла. Для цього на 384-ямкові планшети (NUNC, 460518 MaxiSorb чорний) наносили покриття 35 мкл 1,5 мкг/мл розчину антилюдського антитіла ММР13 (R&D Systems, MAB511) протягом 24 годин при 4С. Після промивання ямки 2 рази сумішшю PBS і 0,05 % Tween, сайти зв'язування, що залишилися, блокували 100 мкл 5 % нежирного сухого молока (Santa Cruz, sc-2325, Blotto) у PBS протягом 24 годин при 4С. Потім ямки промивали 2 рази сумішшю PBS і 0,05 % Tween і додавали 35 мкл супернатанту культури в розведенні 1/10, що містить ММР13 у блокувальному буфері з 100-кратним розведенням, та інкубували протягом 4 годин при кімнатній температурі. Потім ямки двічі промивали сумішшю PBS і 0,05 % Tween із подальшою активацією ММР13 при додаванні 35 мкл 1,5 мМ ацетату 4-амінофенілртуті (АРМА) (Sigma, A9563) та інкубуванні при 37С протягом 1 години. Ямки знову промивали сумішшю PBS і 0,05 % Tween і додавали 35 мкл субстрат ММР13 (Biomol, Р-126, флуорогенний субстрат OmniMMP). Після інкубування протягом 24 годин при 37С, визначали флуоресценцію трансформованого субстрату за допомогою приладу-лічильника Perkin Elmer Wallac EnVision 2102 Multilabel Reader (довжина хвилі збуджувального світла: 320 нм, довжина хвилі світла, що випромінюється: 405 нм). відсоток інгібування=((флуоресценція, визначена у присутності розріджувача – флуоресценція, визначена для зразка в присутності сполуки, що тестується, поділити на (флуоресценцію, визначену в присутності розріджувача – флуоресценція, визначена для зразка за відсутності тригера))*100. Дані виражені у вигляді середнього ЕС50 з аналізів середня квадратична похибка середнього значення. Таблиця VIII Значення ЕС50 MMP13 сполуки № сполуки. ЕС50 (нМ) 41962370 1 25 30 35 40 45 50 Приклад 2.3 Аналіз проліферації PBL Лімфоцити периферичної крові людини (PBL) стимулювали IL-2 і визначали проліферацію з використанням аналізу на вбудовування BrdU. Спочатку PBL стимулювали протягом 72 годин РНА для індукування рецептора IL-2, витримували без живлення протягом 24 годин, щоб зупинити проліферацію клітин, потім стимулювали IL-2 ще протягом 72 годин (включаючи 24годинне введення мітки в BrdU). Клітини преінкубували зі сполуками, що тестуються, протягом 1 години перед додаванням IL-2. Клітини вирощували в RPMI 1640, що містить 10 % (об./об.) FBS. Приклад 2.4 Аналіз суцільної крові (WBA) 2.4.1 Протокол стимуляції IFNα Для прогнозу селективності сполук, що тестуються, щодо інгібування JAK1- у порівнянні з JAK2-залежними шляхами передачі сигналу in vivo, була створена фізіологічно релевантна модель in vitro із використанням цілісної крові людини. У аналізі WBA кров, взяту у людейдобровольців, що дали інформовану згоду, обробляли ex vivo сполукою (1h), а потім стимулювали або протягом 30 хвилин інтерфероном (IFNα, JAK1-залежний шлях передачі сигналу), або протягом 2 годин гранулоцитарно-макрофагальним колонієстимулюючим фактором (GM-CSF, JAK2-залежний шлях передачі сигналу). 2.4.1.1 Аналіз фосфо-STAT1 При стимуляції IFNα, збільшення фосфорилування передавачів сигналу і активаторів транскрипції 1 (pSTAT1) під дією IFNα в екстрактах білих кров'яних клітин визначали за допомогою аналізу pSTAT1 ELISA. Фосфорилування передавача сигналу та активаторів транскрипції 1 (STAT1) після ініціювання інтерфероном альфа (IFNα) являє собою JAK1опосередковану подію. Аналізфосфо-STAT1, який використали для визначення рівня фосфоSTAT1 в екстрактах клітин, розробляли для того, щоб оцінити здатність сполуки інгібувати JAK1залежні шляхи передачі сигналу. Цілісну людську кров, взяту у людей-добровольців, що дали інформовану згоду, обробляли ex vivo сполукою (1h), а потім стимулювали протягом 30 хвилин IFNα. Збільшення фосфорилування STAT1 під дією IFNα в екстрактах білих кров'яних клітин визначали за допомогою аналізу фосфо-STAT1 ELISA. АСК-лізисний буфер включав у себе 0,15 М NH4Cl, 10 мМ KHCO3, 0,1 мМ ЕДТА. рН буфера становив 7,3. 23 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 10-кратний концентрат клітинного лізисного буфера (частина набору для імуноферментного аналізу ELISA сендвіч-типу PathScan Phospho-STAT1 (Tyr701) від Cell Signaling) розводили в 10 разів Н2О. Перед використанням у буфер додавали інгібітори протеїнази. 20 мкг IFNα розчиняли в 40 мкл Н2О, одержуючи 500 мкг/мл вихідного розчину. Даний вихідний розчин зберігали при -20С. Готували 3-кратні серійні розведення сполуки в ДМСО (максимальна концентрація: 10 мМ). Потім дану сполуку додатково розводили середовищем (фактор розведення залежить від необхідної кінцевої концентрації сполуки). 2.4.1.1.1 Інкубування крові із сполукою і стимуляція IFNα Людську кров збирали в гепаринізовані пробірки. Дану кров ділили на аліквоти по 392 мкл. Потім до кожної аліквоти додавали 4 мкл розведення сполуки та інкубували проби крові протягом 1 години при 37С. Вихідний розчин IFNα розводили в 1000 раз середовищем RPMI, одержуючи 500 нг/мл робочого розчини. До проб крові додавали 4 мкл 500 нг/мл робочого розчину (кінцева концентрація IFNα: 5 нг/мл). Проби інкубували при 37С протягом 30 хв. 2.4.1.1.2 Одержання екстрактів клітин У кінці періоду стимуляції до проб крові додавали 7,6 мл буферу АСК для лізування червоних кров'яних клітин. Проби перемішували, перевертаючи пробірки п'ять разів, та інкубували реакційну суміш на льоду протягом 5 хв. У процесі даного інкубування лізис RBC повинен був бути очевидним. Клітини осаджували центрифугуванням при 300 g, 4С протягом 7 хв, і видаляли супернатант. У кожну пробірку додавали 10 мл 1PBS і повторно суспендували осад після центрифугування. Проби знову центрифугували при 300 g, 4С. Супернатант видаляли і знову суспендували осад після центрифугування в 500 мкл 1PBS. Потім клітинну суспензію переносили в чисту пробірку для мікроцентрифугування на 1,5 мл. Клітини осаджували центрифугуванням при 700 g протягом 5 хв при 4С. Супернатант видаляли і розчиняли осад у 150 мкл клітинного лізисного буфера. Проби інкубували на льоду протягом 15 хв. Після цього проби зберігали при -80С до подальшої обробки. 2.4.1.1.3 Визначення фосфорилування STAT1 методом ELISA Для визначення рівня фосфо-STAT1 використали набір для імуноферментного аналізу ELISA сендвіч-типу PathScan Phospho-STAT1 (Tyr701) від Cell Signaling (за каталогом № 7234). Екстракти клітин розморожували на льоду. Пробірки центрифугували протягом 5 хв при 16000 g, 4С і одержували просвітлені лізати. У той же час мікроямкові смужки з набору приводили в рівновагу при кімнатній температурі і готували промивний буфер, розводячи промивний буфер 20×Н2О. Проби розводили в 2 рази розріджувачем проб і додавали 100 мкл в мікроямкові смужки. Смужки інкубували протягом ночі при 4С. На наступний день ямки 3 рази промивали промивним буфером. В ямку додавали 100 мкл детекторного антитіла. Смужки інкубували при 37С протягом 1 години. Потім ямку знову 3 рази промивали промивним буфером. У кожну ямку додавали 100 мкл HRP-зв'язаного вторинного антитіла та інкубували проби при 37С. Через 30 хв ямку знову промивали 3 рази і у всі ямки додавали 100 мкл субстрату ТМВ. Коли колір проб змінювався на синій, для зупинки реакції додавали 100 мкл STOP-розчину. Поглинання вимірювали при 450 нм. 2.4.1.2 ELISA IL-8 При стимуляції GM-CSF підвищення концентрації інтерлейкіну-8 (IL-8) у плазмі крові визначали за допомогою аналізу IL-8 методом ELISA. Індукована експресія IL-8 гранулоцитарно-макрофагальним колонієстимулюючим фактором (GM-CSF) являє собою JAK2опосередковану подію. ELISA IL-8, який можна використати для визначення концентрації IL-8 у зразках плазми, розробляли для того, щоб оцінити здатність сполуки інгібувати JAK2-залежні шляхи передачі сигналу. Суцільну людську кров, взяту у людей-добровольців, що дали інформовану згоду, обробляли ex vivo сполукою (1h), а потім стимулювали протягом 2 годин GM-CSF. Збільшення концентрації IL-8 у плазмі крові визначали методом ELISA IL-8. 10 мкг GM-CSF розчиняли в 100 мкл Н2О, одержуючи 100 мкг/мл вихідного розчину. Даний вихідний розчин зберігали при -20С. Готували 3-кратні серійні розведення сполуки, що тестується, у ДМСО (максимальна концентрація: 10 мМ). Потім дану сполуку додатково розводили середовищем (фактор розведення залежить від необхідної кінцевої концентрації сполуки). 2.4.1.2.1 Інкубування крові зі сполукою і стимуляція GM-CSF Людську кров збирали в гепаринізовані пробірки. Дану кров ділили на аліквоти по 245 мкл. Потім до кожної аліквоти додавали 2,5 мкл розведення сполуки та інкубували проби крові протягом 1 години при 37С. Вихідний розчин GM-CSF розводили в 100 раз середовищем RPMI, 24 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержуючи 1 мкг/мл робочого розчину. До проб кров додавали 2,5 мкл 1 мкг/мл робочого розчину (кінцева концентрація GM-CSF: 10 нг/мл). Проби інкубували при 37С протягом 2 годин. 2.4.1.2.2 Одержання зразків плазми Проби центрифугували протягом 15 хв при 1000 g, 4С. Одержували 100 мкл плазми і зберігали при -80С до подальшого використання. 2.4.1.2.3 Визначення концентрації IL-8 методом ELISA Для визначення концентрації IL-8 використали набір для хемілюмінесцентного імуноферментного аналізу IL-8 людини від R&D Systems (за каталогом № Q8000В). Промивний буфер готували, розводячи промивний буфер 20×Н2О. Робочий Glo-реагент одержували, додаючи 1 частину Glo-реагенту 1 до 2 частин Glo-реагенту В протягом від 15 хв до 4 годин перед використанням. У кожну ямку додавали 100 мкл розріджувача аналізу RDI-86. Після цього додавали 50 мкл зразка (плазми). ELISA-планшет інкубували протягом 2 годин при кімнатній температурі, 500 об/хв. Всі ямки 4 рази промивали промивним буфером і в кожну ямку додавали 200 мкл кон'югата IL-8. Після інкубування протягом 3 годин при кімнатній температурі, ямки 4 рази промивали промивним буфером і додавали в кожну ямку 100 мкл робочого Glo-реагенту. ELISAпланшет інкубували протягом 5 хв при кімнатній температурі (захищали від світла). Вимірювали люмінесценцію (час зчитування 0,5 с/ямку). 2.4.1.3 Результати pIC50 сполуки 1 при інгібуванні INFα-викликаного підвищення концентрації pSTAT1 становило 6,320,07 (SEM), тоді як pIC50 при інгібуванні GM-CSF-викликаного підвищення IL-8 становило 4,870,13 (SEM) (результати одержані при використанні 6 донорів крові). Це показує, що сполука 1 у 28 разів більш селективна стосовно JAK1-шляху, ніж стосовно JAK2-шляху. Отже, у клітинному оточенні зрозуміло, що сполука 1 виявляє селективність стосовно JAK1 у порівнянні з JAK2. Мабуть, сполука 1 виявляє більшу селективність стосовно JAK1, ніж стосовно JAK2, у порівнянні з відомими структурно родинними сполуками або іншими відомими інгібіторами JAK. 2.4.1.3 Обробка даних лікування і результати Із метою подальшого уточнення результатів, дані інгібування індукції фосфо-STAT1 під дією INFα в екстрактах клітин або інгібування індукції IL-8 під дією GM-CSF у плазмі наносили на графік стосовно концентрації сполуки і одержували значення IC50 при використанні програмного 2 забезпечення Graphpad. Дані зберігалися, якщо R перевищував 0,8 і нахил горба був меншим 3, і зберігали тільки тих донорів, для яких в обох аналізах одержували достовірні дані. Наприклад, при представленні в даний додатковий протокол аналізу даних, певна pIC 50 сполуки 1 у випадку інгібування викликаного INFα підвищення концентрації pSTAT1 становила 6,210,09 (SEM), тоді як pIC50 у разі інгібування GM-CSF-викликаного підвищення IL-8 становило 4,970,14 (SEM) (результати одержані при використанні 6 донорів крові). Це підтверджує те, що сполука 1 в 17,6 раз більш селективна стосовно JAK1-шляху, ніж стосовно JAK2-шляху. Отже, у клітинному оточенні зрозуміло, що сполука 1 виявляє селективність стосовно JAK1 в порівнянні з JAK2. Мабуть, сполука 1 виявляє більшу селективність стосовно JAK1, ніж стосовно JAK2, у порівнянні з відомими структурно родинними сполуками або іншими відомими інгібіторами JAK. 2.4.2 Протокол стимуляції IL-6 Для встановлення селективності сполуки стосовно JAK1 у порівнянні з JAK2, був також проведений проточний цитометричний аналіз ex vivo з використанням людської суцільної крові. Таким чином, кров брали у людей-добровольців, що дали інформовану згоду. Після цього кров приводили в рівновагу протягом 30 хвилин при 37С при обережному гойданні, потім відбирали аліквоти в пробірки Епендорфа. Додавали сполуку в різній концентрації та інкубували при 37С протягом 30 хвилин, а потім стимулювали протягом 20 хвилин при 37С при обережному гойданні інтерлейкіном 6 (IL-6) для стимуляції JAK1-залежного шляху, або GM-CSF для стимуляції JAK2-залежного шляху. Після цього проводили оцінку фосфо-STAT1 і фосфо-STAT5 при використанні аналізу FACS. 2.4.2.1 Аналізи фосфо-STAT1 У разі IL-6-стимульованого збільшення фосфорилування переносників сигналу та активаторів транскрипції 1 (pSTAT1) у білій кров'яній клітині, людську суцільну кров, одержану у людей-добровольців, які далі інформовану згоду, обробляли ex vivo сполукою протягом 30 хв, а потім стимулювали протягом 20 хвилин IL-6. Збільшення фосфорилування STAT1 під дією IL-6 у лімфоцитах визначали з використанням анти-фосфо-STAT1 антитіла за допомогою FACS. 5-кратний буфер Lyse/Fix (BD PhosFlow, за каталогом № 558049) розводили в 5 раз дистильованою водою і попередньо нагрівали при 37С. Розведений Lyse/Fix буфер, що залишився, відкидали. 25 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 10 мкг rhIL-6 (R&D Systems, за каталогом № 206-IL) розчиняли в 1 мл PBS 0,1 % BSA, одержуючи 10 мкг/мл вихідного розчину. Даний вихідний розчин зберігали у вигляді аліквот при -80С. Готували 3-кратне серійне розведення сполуки в ДМСО (10 мМ вихідного розчину). У зразки, оброблені контрольною речовиною, додавали ДМСО замість сполуки. Всі зразки інкубували при 1 % кінцевій концентрації ДМСО. 2.4.2.1.1 Інкубування крові із сполукою і стимуляція дією IL-6 Людську кров збирали в гепаринізовані пробірки. Дану кров ділили на аліквоти по 148,5 мкл. Потім до кожної аліквоти додавали 1,5 мкл розведення сполуки та інкубували проби крові протягом 30 хв при 37С при обережному гойданні. До проб крові додавали вихідний розчин IL-6 (1,5 мкл) (кінцева концентрація 10 нг/мл) та інкубували проби при 37С протягом 20 хв при обережному гойданні. 2.4.2.1.2 Препарат білих кров'яних клітин і введення мітки CD4 У кінці періоду стимулювання 3 мл 1-кратного попередньо нагрітого буфера Lyse-Fix вмить додавали в проби крові, недовгий час перемішували обертанням і інкубували протягом 15 хв при 37С на водяній бані, щоб лізувати червоні кров'яні клітини і фіксувати лейкоцити, потім заморожували при -80С до подальшого використання. Для наступних стадій пробірки розморожували при 37С протягом приблизно 20 хвилин і центрифугували протягом 5 хв при 400 g при 4С. Осад після центрифугування промивали 3 мл холодного 1PBS, і після центрифугування клітинний осад повторно суспендували в 100 мкл PBS, що містить 3 % BSA. Додавали FITC-кон'юговане анти-CD4 антитіло, або контрольне FITCкон'юговане ізотопне антитіло та інкубували протягом 20 хв при кімнатній температурі, у темряві. 2.4.2.1.3 Пермеабілізація клітин і введення мітки анти-фосфо-STAT1 антитілом Після промивання клітин 1PBS, клітинний осад повторно суспендували в 100 мкл льодяного 1PBS і додавали 900 мкл льодяного 100 % метанолу. Потім клітини інкубували при 4С протягом 30 хв для пермеабілізації. Після цього пермеабілізовані клітини промивали 1PBS, що містить 3 % BSA і, нарешті, повторно суспендували в 80 мкл 1PBS, що містить 3 % BSA. Додавали і перемішували 20 мкл РЕ мишачого анти-STAT1 (pY701) або РЕ мишачого IgG2aκ ізотопного контрольного антитіла (BD Biosciences, за каталогом №№ 612564 і 559319, відповідно), потім інкубували протягом 30 хв при 4С у темряві. Після цього клітини однократно промивали 1PBS та аналізували на проточному цитометрі FACSCanto II (BD Biosciences). 2.4.2.1.4 Флуоресцентний аналіз на FACSCanto II Підраховували в цілому 50000 подій і визначали фосфо-STAT1 позитивні клітини після стробування на CD4+ клітинах у лімфоцитарному гейті. Дані аналізували за допомогою програмного забезпечення FACSDiva, і вони відповідали відсотку інгібування стимуляції IL-6, розрахованому на відсоткову частку позитивних клітин для фосфо-STAT1 на CD4+ клітинах. 2.4.2.2 Аналіз фосфо-STAT5 У разі GM-CSF-стимульованого збільшення фосфорилування переносників сигналу та активаторів транскрипції 5 (pSTAT5) у білій кров'яній клітині, людську суцільну кров, одержану у людей-добровольців, які дали інформовану згоду, обробляли ex vivo сполукою протягом 30 хв, а потім стимулювали протягом 20 хвилин GM-CSF. Збільшення фосфорилування STAT5 під дією GM-CSF у моноцитах визначали з використанням анти-фосфо-STAT5 антитіла за допомогою FACS. 5-кратний буфер Lyse/Fix (BD PhosFlow, за каталогом № 558049) розводили у 5 разів дистильованою водою і попередньо нагрівали при 37С. Розведений Lyse/Fix буфер, що залишився, відкидали. 10 мкг rhGM-CSF (AbCys S. A., за каталогом № Р300-03) розчиняли в 100 мкл PBS 0,1 % BSA, одержуючи 100 мкг/мл вихідного розчину. Даний вихідний розчин зберігали у вигляді аліквот при -80С. Готували 3-кратне серійне розведення сполуки в ДМСО (10 мМ вихідного розчину). У зразки, оброблені контрольною речовиною, додавали ДМСО замість будь-якої сполуки, що тестується. Всі зразки інкубували при 1 % кінцевій концентрації ДМСО. 2.4.2.2.1 Інкубування крові зі сполукою і стимуляція дією GM-CSF Людську кров збирали в гепаринізовані пробірки. Дану кров ділили на аліквоти по 148,5 мкл. Потім до кожної аліквоти додавали 1,5 мкл розведення сполуки та інкубували проби крові протягом 30 хв при 37С при обережному гойданні. До проб крові додавали вихідний розчин 26 UA 105796 C2 5 10 15 20 25 30 35 40 45 50 55 GM-CSF (1,5 мкл) (кінцева концентрація 20 пг/мл) та інкубували проби при 37С протягом 20 хв при обережному гойданні. 2.4.2.2.2 Препарат білих кров'яних клітин і введення мітки CD14 У кінці періоду стимулювання 3 мл 1-кратного попередньо нагрітого буфера Lyse-Fix вмить додавали в проби крові, недовгий час перемішували обертанням та інкубували протягом 15 хв при 37С на водяній бані, щоб лізувати червоні кров'яні клітини і фіксувати лейкоцити, потім заморожували при -80С до подальшого використання. Для наступних стадій пробірки розморожували при 37С приблизно протягом 20 хвилин і центрифугували протягом 5 хв при 400 g при 4С. Клітинний осад промивали 3 мл холодного 1PBS, і після центрифугування клітинний осад повторно суспендували в 100 мкл PBS, що містить 3 % BSA. Додавали FITC мишаче анти-CD14 антитіло (BD Biosciences, за каталогом № 345784) або контрольну FITC мишаче IgG2bκ ізотопне антитіло (BD Biosciences, за каталогом № 555057), та інкубували протягом 20 хв при кімнатній температурі, у темряві. 2.4.2.2.3 Пермеабілізація клітин і введення мітки анти-фосфо-STAT5 антитілом Після промивання клітин 1PBS, клітинний осад повторно суспендували в 100 мкл льодяного 1PBS і додавали 900 мкл льодяного 100 % метанолу. Потім клітини інкубували при 4С протягом 30 хв для пермеабілізації. Після цього пермеабілізовані клітини промивали 1PBS, що містить 3 % BSA і, нарешті, повторно суспендували в 80 мкл 1PBS, що містить 3 % BSA. Додавали і перемішували 20 мкл РЕ мишачого анти-STAT5 (pY694) або РЕ мишачого IgG1κ ізотопного контрольного антитіла (BD Biosciences, за каталогом №№ 612567 і 554680, відповідно), потім інкубували протягом 30 хв при 4С у темряві. Після цього клітини однократно промивали 1PBS і аналізували на проточному цитометрі FACSCanto II (BD Biosciences). 2.4.2.2.4 Флуоресцентний аналіз на FACSCanto II Підраховували в цілому 50000 подій і визначали фосфо-STAT5 позитивні клітини після стробування на CD14+ клітинах. Дані аналізували за допомогою програмного забезпечення FACSDiva, і вони відповідали відсотку інгібування стимуляції GM-CSF, розрахованому на відсоткову частку позитивних клітин для фосфо-STAT5 на CD14+ клітинах. 2.4.2.3 Результати При подаванні в даний протокол для сполуки даного винаходу визначали відсоток інгібування (PIN), одержаний із середнього значення 3 здорових добровольців. Наприклад, тестували сполуку 1 і поверталися до pIC 50=6,61 при інгібуванні STAT1 фосфорилування і pIC50=5,37 при інгібуванні STAT5 фосфорилування. При порівнянні впливу сполуки 1 на STAT1 (JAK1-залежний шлях) і STAT5 (JAK2-залежний шлях) визначали 17,6-кратну селективність для JAK1 стосовно JAK2. Приклад 3. Моделі in vivo Приклад 3.1 Модель CIA 3.1.1 Матеріали Повний ад'ювант Фрейнда (СFA) і неповний ад'ювант Фрейнда (IFA) купували у Difco. Колаген корові II типу (СII), ліпополісахарид (LPS) і енбрель купували у Chondrex (Isle d'Abeau, Франція); Sigma (Isle d'Abeau, Франція), Whyett (25 мг шприц для ін'єкцій, Франція) Acros Organics (Palo Alto, CA), відповідно. Всі інші реагенти, що використовуються були хімічно чистими, і всі розчинники були аналітично чистими. 3.1.2 Тварини Щурів темного забарвлення агуті (самці, вік 7-8 тижнів) одержували з Harlan Laboratories (Maison-Alfort, Франція). Мишей DBA/1J (самці, вік 7 тижнів) одержували з Centre d'Elevage et de Reproduction JANVIER (CERJ) (Лаваль, Франція). Щурів і мишей витримували в 12-часовому циклі зміни світло/темрява (0700-1900). Температуру підтримували при 22С, і їжу і воду надавали вільно. 3.1.3 Викликаний колагеном артрит (CIA) За один день до досліду готували розчин CII (2 мг/мл) із вмістом 0,05 М оцтової кислоти і зберігали при 4С. Безпосередньо перед імунізацією змішували однакові об'єми ад'юванта (IFA) і CII за допомогою гомогенізатора в попередньо охолодженій скляній пляшці на водяній бані з льодом. Надлишковий ад'ювант і тривала гомогенізація можуть бути потрібними, якщо не утвориться емульсія. Миші: робили ін'єкцію 0,1 мл емульсії черезшкірно в основу хвоста кожної миші на 1 день, другу бустер-дозу черезшкірної ін'єкції (CII розчин при 1 мг/мл в CFA 0,1 мл фізіологічного розчину) здійснювали на 21 день. Спосіб імунізації модифікували, виходячи з опублікованих 27 UA 105796 C2 5 10 15 20 25 30 35 40 способів (David D Brand, Kary А Latham & Edward F Rosloniec. Collagen-induced arthritis. Nature methods 2(5):1269-1275, 2007). Щури: робили ін'єкцію 0,2 мл емульсії черезшкірно в основу хвоста кожному щуру на 1 день, другу бустер-дозу черезшкірної ін'єкції (CII розчин при 2 мг/мл у CFA 0,1 мл фізіологічного розчину) здійснювали на 9 день. Спосіб імунізації модифікували, виходячи з опублікованих способів (Sims NA et ah, (2004) Targeting osteoclasts with zoledronic acid prevents bone destruction in collagen-induced arthritis, Arthritis Rheum. 50 2338-2346; Jou et al., 2005). 3.1.4 Організація дослідження Терапевтичні ефекти сполук, що тестуються, досліджували на моделі щура або миші CIA. Тварин розділяли випадковим чином на рівні групи, і в кожній групі містилося 10 тварин. Всіх щурів вакцинували на 1 день і повторно вакцинували на 9 день. Всіх мишей вакцинували на 1 день і повторно вакцинували на 21 день. Терапевтичне дозування тривало з 16 по 30 день. Негативна контрольна група одержувала розріджувач (МС 0,5 %), і позитивна контрольна група – енбрель (10 мг/кг, 3 тижні, s.c.). Розглядувану сполуку звичайно тестували у вигляді 3 доз, наприклад, 3, 10, 30 мг/кг, p.o. 3.1.5 Клінічна оцінка артриту Проводили оцінку артриту згідно зі способом Khachigian 2006, Lin et al 2007 і Nishida et al 2004. Опухання кожної з чотирьох лап розцінювали за артритичною оцінкою таким чином: 0 – немає симптомів, 1 – слабке, але чітко виражене почервоніння одного типу суглобів, такого як кісточка, або зап'ясток, або чітке почервоніння і опухлість, обмежені окремими пальцями, незалежно від кількості уражених пальців, 2 – помірне почервоніння і опухлість двох, або більше типів суглобів, 3 – сильне почервоніння і опухлість цілої лапи, включаючи пальці, 4 – максимально запалена кінцівка із залученням численних суглобів (максимальна сукупна клінічна артритична оцінка 16 на тварину) (Nishida et al., 2004). Щоб допустити мета-аналіз численних досліджень, значення клінічній оцінці нормували таким чином: AUC клінічної оцінки (AUC оцінки): площу під кривою (AUC) із 1 по 14 день обчислювали для кожного окремого щура. AUC для кожної тварини ділили на середню AUC, одержану для розріджувача в дослідженні, з якого одержували дані стосовно даної тварини, і множили на 100 (тобто AUC виражали у вигляді відсоткової частки середньої AUC розріджувача на дослідження). Зростання клінічної оцінки з 1 по 14 день (рахунок кінцевої точки): Різницю в клінічній оцінці для кожної тварини ділили на середню різницю в клінічній оцінці, одержану для розріджувача в дослідженні, з якого одержували дані стосовно даної тварини, і множили на 100 (тобто AUC виражали у вигляді відсоткової частки середньої клінічної оцінки розріджувача на дослідження). 3.1.6 Зміна маси тіла (%) після початку артриту Клінічно втрата маси тіла пов'язана з артритом (Shelton et al., 2005; Argiles et al., 1998; Rall, 2004; Walsmith et al., 2004). Отже, зміну маси тіла після початку артриту можна використати як неспецифічну кінцеву точку для оцінки впливу терапевтичних засобів на модель щура. Зміну маси тіла (%) після початку артриту можна обчислити таким чином: маса тіла (6 тижнів) – маса тіла (5 тижнів) Миші: Щури: 45 50 55 3.1.7 Оцінка за Ларсеном Після смерті оцінку за Ларсеном виводили для обох задніх лапок всіх щурів, принаймні, 2 вчених. Обчислювали середнє значення даних оцінок, дістаючи одну оцінку за Ларсеном на щура. Щоб було можна провести порівняння оцінок за Ларсеном між дослідженнями, оцінку за Ларсеном для кожного щура ділили на середню оцінку за Ларсеном, одержану для розріджувача в дослідженні, до якого належить щур, і множили на 100 (тобто, виражаючи оцінку за Ларсеном у вигляді відсоткової частки середньої клінічної оцінки розріджувача на дослідження). Розраховували і порівнювали середню оцінку за Ларсеном для різних груп, що одержували лікування. 3.1.8 Рентгенологічне дослідження 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel compound useful for the treatment of degenerative and inflammatory diseases
Автори англійськоюMenet, Christel Jeanne Marie, Blanc, Javier
Автори російськоюМене Кристель Жанн Мари, Блан Хавьер
МПК / Мітки
МПК: A61P 29/00, A61K 31/437, C07D 471/04, A61P 37/00, A61P 35/00
Мітки: застосовна, дегенеративних, захворювань, запальних, лікування, сполука
Код посилання
<a href="https://ua.patents.su/39-105796-spoluka-zastosovna-dlya-likuvannya-degenerativnikh-i-zapalnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Сполука, застосовна для лікування дегенеративних і запальних захворювань</a>
Попередній патент: Спосіб зниження відображення шару електросаджуваного покриття
Наступний патент: Пристрій внутрішньосвердловинний
Випадковий патент: Спосіб добування геотермальної енергії з осередкового джерела тепла












