Фармацевтично прийнятні солі тимодепресину і спосіб їх виробництва
Номер патенту: 106580
Опубліковано: 25.09.2014
Автори: Там Тім Фет, Иу Лілі, Леунг-Тоунг Рейс, Ванг Йінгсхенг, Н'земба Блейз, Жао Йанквінг
Формула / Реферат
1. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану формули I:
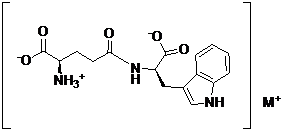 , I
, I
де M вибрано з групи, що включає калій і літій.
2. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою калій і сіль знаходиться в аморфній формі.
3. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою калій і сіль знаходиться в кристалічній формі.
4. Калієва сіль D-ізоглутаміл-D-триптофану за п. 3, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2q: 9,91, 14,84, 15,81, 18,97, 19,76, 24,04, 24,36, 24,82, 25,48, 27,49, 27,94, 28,42, 30,82, 31,28, 31,69, 32,17, 34,35, 35,81 і 36,96°.
5. Калієва сіль D-ізоглутаміл-D-триптофану за п. 3, яка характеризується рентгенограмою порошку, представленою на фіг. 1A.
6. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою літій і сіль знаходиться в аморфній формі.
7. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою літій і сіль знаходиться в кристалічній формі.
8. Літієва сіль D-ізоглутаміл-D-триптофану за п. 7, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2q: 13,57, 15,53, 18,71, 20,11, 23,34, 24,1, 25,09, 27,31, 27,72, 28,39, 29,31, 30,19, 31,21, 32,06, 33,05, 33,62 і 37,41°.
9. Літієва сіль D-ізоглутаміл-D-триптофану за п. 7, яка характеризується рентгенограмою порошку, представленою на фіг. 2A.
10. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану формули II,
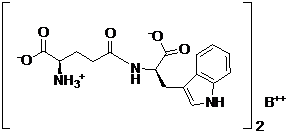 , II
, II
де B вибрано з групи, що включає кальцій і магній.
11. Фармацевтично прийнятна сіль за п. 10, в якій В являє собою магній і сіль знаходиться в кристалічній формі.
12. Кристалічна магнієва сіль D-ізоглутаміл-D-триптофану (1:2) за п. 11, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2q: 12,2, 13,74, 14,84, 16,16, 17,96, 18,52, 18,94, 19,49, 21,05, 21,56, 22,56, 23,36, 24,12, 26,27, 27,65, 28,42, 29,14, 30,55, 31,77, 32,62, 33,26, 35,05, 36,34, 37,22 і 38,05°.
13. Кристалічна магнієва сіль D-ізоглутаміл-D-триптофану (1:2) за п. 11, яка характеризується рентгенограмою порошку, представленою на фіг. 3A.
14. Фармацевтично прийнятна сіль за п. 10, в якій В являє собою кальцій і сіль має ступінь кристалічності, менший ніж приблизно 67 % по масі.
15. Кальцієва сіль D-ізоглутаміл-D-триптофану за п. 14, яка має ступінь кристалічності, менший ніж приблизно 50 %.
16. Кальцієва сіль D-ізоглутаміл-D-триптофану за п. 14, яка має ступінь кристалічності, менший ніж приблизно 25 %.
17. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули І:
 , І
, І
де M вибирають з групи, що складається з літію і калію, причому вказаний спосіб включає:
(а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом літію або калію у воді; і
(б) концентрування розчину до утворення масла і додавання ізопропанолу при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням солі металу формули І.
18. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули II
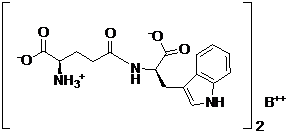 , II
, II
де B являє собою кальцій, причому вказаний спосіб включає:
(а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом кальцію у воді; і
(б) концентрування розчину при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням солі металу формули II.
19. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули II,
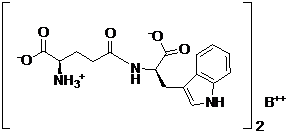 , II
, II
де B являє собою магній, причому вказаний спосіб включає:
(а) реакцію D-ізоглутаміл-D-триптофану з етоксидом магнію в ізопропанолі, таким чином формуючи розчин; і
(б) концентрування розчину до одержання твердої речовини;
(в) змішування твердої речовини з водою;
(г) відокремлення нерозчинних частинок фільтрацією, таким чином утворюючи фільтрат;
(д) розведення фільтрату водою при перемішуванні для осадження продукту;
(е) відокремлення продукту; і
(є) висушування продукту у вакуумі з одержанням солі металу формули II.
20. Спосіб одержання D-ізоглутаміл-D-триптофану формули IV
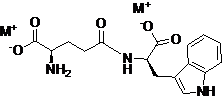 , IV
, IV
де M являє собою натрій, причому вказаний спосіб включає:
(а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом натрію у воді; і
(б) концентрування розчину до утворення масла і додавання ізопропанолу при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням сполуки формули IV.
21. Спосіб сольового обміну для утворення фармацевтично прийнятної солі D-ізоглутаміл-D-триптофану, представленої загальною формулою І,
 , І
, І
де M вибирають з групи, що складається з літію і калію, причому вказаний спосіб включає:
(а) реакцію амонієвої солі, представленої формулою VII:
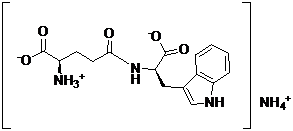 , VII
, VII
у водному розчині з 1 еквівалентом гідроксиду металу, представленим формулою MOH, де M є таким, як визначено вище;
(б) випаровування розчинника з одержанням твердої речовини; і
(в) перемішування твердої речовини з водою і ізопропанолом з одержанням фармацевтично прийнятної солі формули I.
22. Спосіб сольового обміну для отримання фармацевтично прийнятної солі D-ізоглутаміл-D-триптофану, представленої загальною формулою II:
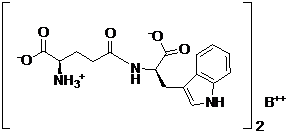 , II
, II
де B вибирають з групи, що складається з кальцію і магнію, причому вказаний спосіб включає:
(а) реакцію амонійної солі, представленої формулою VII:
 , VII
, VII
у водному розчині з приблизно 0,5 еквівалента гідроксиду металу формули B(OH)2, де B є таким, як визначено вище;
(б) випаровування розчинника з одержанням твердої речовини; і
(в) перемішування твердої речовини з водою і ізопропанолом з одержанням фармацевтично прийнятної солі формули II.
23. Спосіб за п. 21, в якому М являє собою калій, MOH являє собою гідроксид калію, і сполука представлена наступною формулою:
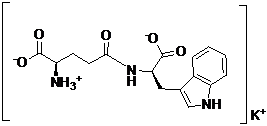 .
.
24. Спосіб за п. 21, в якому М являє собою літій, MOH являє собою гідроксид літію, і сполука представлена наступною формулою:
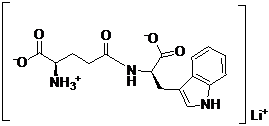 .
.
25. Спосіб за п. 22, який відрізняється тим, що B являє собою магній, B(OH)2 являє собою гідроксид магнію, і сполука представлена наступною формулою:
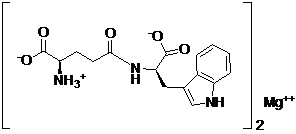 .
.
26. Спосіб за п. 22, який відрізняється тим, що B являє собою кальцій, B(OH)2 являє собою гідроксид кальцію, і сполука представлена наступною формулою:
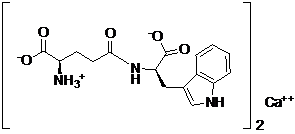 .
.
27. Фармацевтична композиція, що містить фармацевтично прийнятну сіль за будь-яким з пп. 1-16 формули і принаймні один фармацевтично прийнятний ексципієнт.
28. Спосіб одержання фармацевтичної композиції, який включає поєднання фармацевтично прийнятної солі за будь-яким з пп. 1-16 формули з як мінімум одним фармацевтично прийнятним носієм.
29. Застосування ефективної кількості фармацевтично прийнятної солі за будь-яким з пп. 1-16 формули як імунодепресанту.
30. Застосування ефективної кількості фармацевтично прийнятної солі за будь-яким з пп. 1-16 формули як засобу проти псоріазу.
31. Застосування ефективної кількості фармацевтично прийнятної солі за будь-яким з пп. 1-16 формули як засобу проти атопічного дерматиту.
32. Застосування ефективної кількості фармацевтично прийнятної солі за будь-яким з пп. 1-16 формули як селективного інгібітора розмноження гемопоетичних клітин-прекурсорів.
33. Застосування ефективної кількості фармацевтично прийнятної солі за будь-яким з пп. 1-16 формули як симулятора апоптозу гранулоцитів і лімфоцитів.
34. Застосування ефективної кількості фармацевтичної композиції за п. 27 формули для лікування псоріазу у суб'єктів, які потребують такого лікування.
35. Застосування ефективної кількості фармацевтичної композиції за п. 27 формули для імуносупресивної терапії у суб'єктів, які потребують такої терапії.
36. Застосування ефективної кількості фармацевтичної композиції за п. 27 формули для лікування атопічного дерматиту у суб'єктів, які потребують такого лікування.
37. Застосування ефективної кількості фармацевтичної композиції за п. 27 формули для селективного пригнічування розмноження гемопоетичних клітин-прекурсорів у суб'єктів, які потребують цього.
38. Застосування ефективної кількості фармацевтичної композиції за п. 27 формули для симуляції апоптозу гранулоцитів і лімфоцитів у суб'єктів, які потребують цього.
Текст
Реферат: Даний належить до фармацевтично прийнятних кристалічних або аморфних солей Dізоглутаміл-D-триптофану, а також способів їх виробництва, фармацевтичних композицій, що їх містять, та їх застосування для одержання фармацевтичних композицій для лікування різних станів та/або захворювань. Зокрема, даний винахід стосується калієвої солі D-ізоглутаміл-Dтриптофану (1:1), літієвої солі D-ізоглутаміл-D-триптофану (1:1), кальцієвої солі D-ізоглутамілD-триптофану (2:1), магнієвої солі D-ізоглутаміл-D-триптофану (2:1). UA 106580 C2 5 10 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до нових кристалічних і аморфних фармацевтично прийнятних солей D-ізоглутаміл-D-триптофану. Зокрема, даний винахід стосується калієвої солі Dізоглутаміл-D-триптофану (1:1), літієвої солі D-ізоглутаміл-D-триптофану (1:1), кальцієвої солі Dізоглутаміл-D-триптофану (2:1), магнієвої солі D-ізоглутаміл-D-триптофану (2:1) і органічних амонійних солей D-ізоглутаміл-D-триптофану (1:1), властивості яких покращені в порівнянні з аморфним D-ізоглутаміл-D-триптофаном, кристалічним D-ізоглутаміл-D-триптофаном і динатрієвою сіллю D-ізоглутаміл-D-триптофану. Даний винахід також відноситься до способів виробництва таких нових солей D-ізоглутаміл-D-триптофану. ПЕРЕДУМОВИ ВИНАХОДУ Сполука D-ізоглутаміл-D-триптофан (також відома як H-D-iGlu-D-Trp-OH або тімодепресин) являє собою синтетичний геморегуляторний дипептид, наступної формули: O O HO O HO N H NH2 NH . 15 20 25 Тімодепресин являє собою вільну двохосновну кислоту, якій привласнений реєстраційний ® номер в Службі Chemical Abstracts (CAS) 186087- 26- 3. Патент США 5,736,519 розкриває H-DiGlu-D-Trp-OH і спосіб його одержання, в ході якого сполуку очищують іонообмінною хроматографією. Сполука являє собою імунодепресант і вибірково пригнічує розмноження гемопоетичних клітин-прекурсорів і стимулює апоптоз гранулоцитів і лімфоцитів (Sapuntsova, S. G., et al. (May 2002), Bulletin of Experimental Biology and Medicine, 133(5), 488-490). Тімодепресин на даний час продається в Росії у вигляді динатрієвої солі D-ізоглутаміл-Dтриптофану у вигляді рідкого препарату для ін'єкцій і у формі для інтраназального застосування для лікування псоріазу і атопічного дерматиту. Тверда форма динатрієвої солі D-ізоглутаміл-Dтриптофану являє собою аморфний порошок, який є гігроскопічним і дуже складним з технологічної точки зору. Молекулярна формула динатрієвої солі D-ізоглутаміл-D-триптофану C16H17N3Na2O5. Її хімічна структура представлена нижче: Na+ O Na+ O O O -O N H NH2 NH , 30 35 40 45 і описана в Kashirin, D. M., et al. (2000), Pharmaceutical Chemistry Journal, 34(11), 619-622. Шляхом дослідження в нашій лабораторії, ми визначили, що ліофілізована динатрієва сіль D-ізоглутаміл-D-триптофану є надзвичайно гігроскопічною, протягом декількох хвилин перетворюється на гель у повітрі і є складною з технологічної точки зору. Порошкова або аморфна форма сполуки, призначеної для фармацевтичного застосування, може створювати виробничі проблеми за рахунок проблем з насипною щільністю, гігроскопічністю і варіюючим вмістом води, який не може бути відрегульований сушкою у вакуумі. D-Ізоглутаміл-D-триптофан являє собою дипептид, і сушка аморфної форми при підвищеній температурі, наприклад, 80–100 C, у вакуумі не рекомендується. Таким чином, виникають серйозні труднощі в ході здійснення способу очищення динатрієвої солі Dізоглутаміл-D-триптофану і одержання чистої динатрієвої солі у виробничих масштабах. Більш того, не існує опублікованої методики її одержання. Мононатрієва сіль D-ізоглутаміл-D-триптофану ідентифікована Службою Chemical Abstracts ® (CAS) і наведена в реєстрах CAS REGISTRYSM під реєстраційним номером CAS 863988-88-9. Однак, відсутні посилання, де згадувалася б субстанція, і, отже, відсутні опубліковані дані щодо її ідентичності, фізичних та/або хімічних властивостей, характеристик або методики її одержання. Ліофілізований порошок мононатрієвої і динатрієвої солі пептидних лікарських препаратів не може забезпечити контрольованого діапазону насипної щільності порошку для 1 UA 106580 C2 5 10 15 рецептури. Він може вимагати значних інвестицій в технологію диспергування ліофілізованого матеріалу. Таким чином, існує необхідність в розробці альтернативних кристалічних фармацевтично прийнятних солей D-ізоглутаміл-D-триптофану. Такі кристалічні солі в цілому можуть бути очищені більш простими способами в порівнянні з аморфною формою і можуть виявляти інші переважні властивості, наприклад, з точки зору їх специфічної кристалічної форми, та/або їх характеристик розчинності, та/або відсутності гігроскопічності, та/або їх характеристик стабільності, зокрема властивостей їх термічної стабільності, та/або їх здатності піддаватися окиснювальному розкладу. КороткИЙ ОПИС ВинаходУ Об'єктом даного винаходу є запропонувати ряд нових стабільних, фармацевтично прийнятних солей тімодепресину для розробки рецептур. Не всі солі D-ізоглутаміл-D-триптофану є хімічно стабільними (наприклад, аморфна динатрієва сіль). Однак, нами винайдені нові стабільні металеві і органічні амонійні солі Dізоглутаміл-D-триптофану (H-D-I-Glu-D-Trp-OH), які є основою даного винаходу. В одному аспекті даного винаходу пропонуються нові солі D-ізоглутаміл-D-триптофану. Такі нові форми солі являють собою сполуки формули І: O O -O O -O N H NH3+ M+ NH І, 20 де M вибирають з групи, що складається з літію і калію; формули II: O O O O -O N H NH3+ B++ NH 2 II, 25 де B вибирають з групи, що складається з магнію і кальцію; і формули III: O O -O O -O NH3+ N H A+ NH III, 30 35 де А вибирають з групи, що складається з трет-бутиламонію, трис(гідроксиметил)метиламонію і метил-(2,3,4,5,6-пентагідроксигексил)-амонію. Конкретно, в нових солях формули І катіон літію або калію замінює один атом водню в карбоксильному фрагменті сполуки D-ізоглутаміл-D-триптофану. У нашій лабораторії було визначено, що нові солі формули І за даним винаходом, де M являє собою калій (тобто монокалієва сіль D-ізоглутаміл-D-триптофану), можуть існувати в різних формах, зокрема, в аморфній або в некристалічній формі, а також у кристалічній формі. У нашій лабораторії було 2 UA 106580 C2 5 10 15 20 25 30 35 40 45 50 55 також визначено, що нові солі формули І за даним винаходом, де M являє собою літій (тобто монолітієва сіль D-ізоглутаміл-D-триптофану), можуть існувати в різних формах, зокрема, в аморфній або некристалічній формі, а також у кристалічній формі. Таким чином, даний винахід стосується монолітієвих і монокалієвих солей D-ізоглутаміл-D-триптофану в будь-якій з їх форм. В іншому аспекті даного винаходу пропонуються нові літієві солі і калієві солі D-ізоглутамілD-триптофану, сполуки формули І. В іншому аспекті даного винаходу пропонується кристалічна калієва сіль D-ізоглутаміл-Dтриптофану, сполуки формули І. В іншому аспекті даного винаходу пропонується кристалічна літієва сіль D-ізоглутаміл-Dтриптофану, сполуки формули І. Даний винахід також стосується кристалічної форми магнієвої солі D-ізоглутаміл-Dтриптофану і напівкристалічній формі кальцієвої солі D-ізоглутаміл-D-триптофану, де катіон кальцію або магнію замінює один атом водню в карбоксильному фрагменті сполука Dізоглутаміл-D-триптофану. Кальцієва або магнієва сіль D-ізоглутаміл-D-триптофану утворюється в співвідношенні 2:1, як проілюстровано формулою II. В нашій лабораторії було визначено, що магнієва сіль за даним винаходом (тобто магнієва сіль тімодепресину [1:2]) існує в кристалічній формі, тоді як кальцієва сіль за даним винаходом (тобто кальцієва сіль тімодепресину [1:2]) є напівкристалічною з відсотком кристалічності, що не перевищує приблизно 67 %. В іншому аспекті даного винаходу пропонується нова кристалічна магнієва сіль Dізоглутаміл-D-триптофану, сполуки формули II. В іншому аспекті даного винаходу пропонується кальцієва сіль D-ізоглутаміл-D-триптофану, сполуки формули II. Даний винахід також стосується органічних солей аміну формули III, де А вибирають з групи, що складається з трет-бутиламонію, трис(гідроксиметил)метиламонію і метил-(2,3,4,5,6пентагідроксигексил)-амонію. У нашій лабораторії було визначено, що такі солі формули III є аморфними. В іншому аспекті даного винаходу пропонується нова трет-бутиламонійна, трис(гідроксиметил)метиламонійна, метил-(2,3,4,5,6-пентагідроксигексил)-амонійна сіль Dізоглутаміл-D-триптофану, сполуки формули III. В іншому аспекті даного винаходу пропонується спосіб одержання солей формул І, II і III з дипептиду D-ізоглутаміл-D-триптофану. В іншому аспекті даного винаходу пропонується спосіб одержання вказаних солей Dізоглутаміл-D-триптофану (сполуки формул І та II) в результаті сольового обміну амонійної солі D-ізоглутаміл-D-триптофану (1:1). У більш ранній патентній заявці, поданій в Канаді 28 листопада 2006 р., заявник розкриває способи виробництва D-ізоглутаміл-D-триптофану і його моноамонійної солі, нової стабільної кристалічної форми D-ізоглутаміл-D-триптофану і його моноамонійної солі. D-Ізоглутаміл-Dтриптофан і його моноамонійна сіль, використовувані в даному винаході, можуть бути одержані за допомогою способу, описаного у вищезгаданій патентній заявці. В іншому аспекті даного винаходу пропонується фармацевтична композиція, до складу якої входить будь-яка з нових солей, описаних вище, і як мінімум один фармацевтично прийнятний носій. Фармацевтична композиція може бути одержана шляхом об'єднання будь-якої з нових солей, описаних вище, і як мінімум одного фармацевтично прийнятного носія. В іншому аспекті даного винаходу пропонується спосіб одержання фармацевтичної композиції, до складу якої входить будь-яка з нових солей, описаних вище, і як мінімум один фармацевтично прийнятний носій. В іншому аспекті даного винаходу пропонується застосування будь-якої з нових солей, описаних в даному винаході, з одержанням лікарського засобу для лікування псоріазу у суб'єкта, який потребує такого лікування. Інша ознака кристалічних солей за даним винаходом полягає у тому, що вони можуть також використовуватися як проміжні сполуки у виробництві некристалічної солі для забезпечення виділення некристалічної солі з рівнем чистоти і однорідністю, які підходять для препарату, що відповідає суворим фармацевтичним вимогам і специфікаціям. Прикладами таких солей є літієва сіль, натрієва, калієва і амонійна солі. Методи перекристалізації загалом видаляють домішки в ході способу, тоді як очищення аморфної субстанції пептидного лікарського засобу вимагає препаративної обернено-фазової рідинної хроматографії з високим тиском, яка є не економічною. 3 UA 106580 C2 5 10 15 20 25 30 Інші та додаткові переваги і ознаки даного винаходу будуть очевидні фахівцям в даній галузі з наступного докладного опису, який супроводжується відповідними фігурами. Короткий Опис ФІГУР На доданих фігурах: Фіг. 1A являє собою рентгенограму порошку (РГП) калієвої солі D-ізоглутаміл-D-триптофану (1:1). Фіг. 1B являє собою інфрачервоний спектр на базі Фур'є-перетворення (ІЧФП) кристалічної калієвої солі D-ізоглутаміл-D-триптофану (1:1). Фіг. 1C являє собою спектр ІЧФП аморфної калієвої солі D-ізоглутаміл-D-триптофану (1:1). Фіг. 2A являє собою РГП літієвої солі D-ізоглутаміл-D-триптофану (1:1). Фіг. 2B являє собою спектр ІЧФП кристалічної літієвої солі D-ізоглутаміл-D-триптофану (1:1). Фіг. 2C являє собою спектр ІЧФП аморфної літієвої солі D-ізоглутаміл-D-триптофану (1:1). Фіг. 3A являє собою РГП магнієвої солі D-ізоглутаміл-D-триптофану (1:2). Фіг. 3B являє собою спектр ІЧФП магнієвої солі D-ізоглутаміл-D-триптофану (1:2). Фіг. 4A являє собою РГП кальцієвої солі D-ізоглутаміл-D-триптофану (1:2). Фіг. 4B являє собою РГП кальцієвої солі D-ізоглутаміл-D-триптофану (1:2). Фіг. 4C являє собою спектр ІЧФП кальцієвої солі D-ізоглутаміл-D-триптофану (1:2), одержаний з використанням матеріалу з Фіг. 4A. Фіг. 5 являє собою графік ідентифікації складу дипептиду, D-ізоглутаміл-D-триптофану при різних показниках pH. Фіг. 6 являє собою спектр ІЧФП аморфної солі трет-бутиламіну і D-ізоглутаміл-D-триптофану (1:1). Фіг. 7 являє собою спектр ІЧФП аморфної моно-трис(гідроксиметил)амінометанової солі Dізоглутаміл-D-триптофану (1:1). Фіг. 8 являє собою спектр ІЧФП аморфної моно-N-метил-D-глюкаміновой солі D-ізоглутамілD-триптофану (1:1). дЕТАЛЬНий Опис ПЕРЕВАЖНИХ ВАРІАНТІВ Винаходу Як було вказано вище, даний винахід стосується нових металевих солей D-ізоглутаміл-Dтриптофану та органічних солей аміну і D-ізоглутаміл-D-триптофану. У даному винаході, D-ізоглутаміл-D-триптофан являє собою вільну двохосновну кислоту: O O HO O HO N H NH2 NH . 35 Хімія амінокислот або простих дипептидів ускладнена тим фактом, що група -NH2 є + основою, і група -CO2H є кислотою. Таким чином, у водному розчині іон H переміщується від одного кінця молекули до іншого з утворенням цвіттер-іону: R H H3+N COO R H H2N COOH 40 45 Цвіттер-іони одночасно електрично заряджені і електрично нейтральні. Вони містять позитивні і негативні заряди, але сумарний заряд на молекулі дорівнює нулю. Хоча основа для утворення солі не обгрунтовується повністю теорією, амінокислотний фрагмент iGlu H-D-iGlu-DTrp-OH існує у вигляді цвіттер-іона, і, таким чином, присутня тільки одна група -CO2H, яка залишається доступною для утворення солі, якщо тільки 1 екв. одновалентного гідроксиду металу, 0,5 екв. двовалентного гідроксиду металу B(OH)2 або 1 екв. органічного аміну використовується для корекції pH до нейтральних значень. Прикладами одновалентних гідроксидів металів є гідроксид натрію, гідроксид літію і гідроксид калію. Прикладами двохвалентних гідроксидів металів є гідроксид кальцію і гідроксид магнію. 4 UA 106580 C2 O O O HO O HO NH2 M+OH N H O O O -O N H NH3+ NH M+ NH NH B++ H-D-iGlu-D-Trp-OH B++(OH-)2 O O O O O O NH3+ Formula I O N H NH3+ NH O O -O N H A+ 2 Formula II Formula III 5 10 15 Якщо сіль одновалентного металу і H-D-iGlu-D-Trp-OH формули І зображається у форматі, показаному вище, тільки одна група CO2H може зв'язатися з одним іоном одновалентного металу з утворенням солі формули І. Прикладами таких одноосновних солей за даним винаходом є калієва і літієва солі (1:1). Прикладами двохосновних металевих солей за даним винаходом є магнієва і кальцієва солі. Прикладами органічних солей аміну за даним винаходом є солі трет-бутиламонію, трис(гідроксиметил)метиламонію і метил-(2,3,4,5,6пентагідроксигексил)-амонію. Хоча в опублікованій літературі вільно використовується термін "тімодепресин" для позначення як вільного двохосновного D-ізоглутаміл-D-триптофану, так і його динатрієвої солі, в межах контексту даного винаходу, тімодепресин являє собою вільну двохосновну кислоту Dізоглутаміл-D-триптофану з молекулярною формулою C16H19N3O5, а динатрієва сіль являє собою сполуку з молекулярною формулою C16H17N3Na2O5. Вони являють собою дві різні хімічні речовини з різними фізико-хімічними властивостями. У даному винаході, монолітієва або монокалієва сіль утворюється заміною одного атома водню карбоксильної групи на іон металу, літію або калію, з утворенням структури, показаної у формулі І вище. Конкретні структури показані нижче: O O -O O -O N H NH3+ NH Li+ NH K+ 20 Літієва сіль формули І O O -O O -O NH3+ N H 25 Калієва сіль формули І 5 UA 106580 C2 5 У даному винаході, магнієва або кальцієва сіль утворюється шляхом заміни одного атома водню карбоксильної групи на іон металу, магнію або кальцію, з утворенням структури, показаної формулою II вище. Термін "кальцієва сіль D-ізоглутаміл-D-триптофану (2:1)” у даному описі відноситься до Ca(D-ізоглутаміл-D-триптофан)2. Так само, термін "магнієва сіль Dізоглутаміл-D-триптофану (2:1)” відноситься в даному описі до Mg(D-ізоглутаміл-D-триптофан)2. Конкретні структури показані нижче: O O -O O -O N H NH3+ Ca++ NH 2 10 Кальцієва сіль формули II O O -O O -O N H NH3+ Mg++ NH 2 15 20 Магнієва сіль формули II У даному винаході, органічні солі аміну відносяться до солей пептиду і органічного аміну. Наприклад, трет-бутиламін, N-метил-D-глюкамін і трометамін являють собою органічні аміни. Органічна сіль аміну за даним винаходом утворена шляхом заміни одного атома водню карбоксильної групи на органічний амін з утворенням структури, показаної формулою III вище. Наприклад, органічна сіль аміну, утворена з трет-бутиламіну і D-ізоглутаміл-D-триптофану, в даному описі позначає сіль D-ізоглутаміл-D-триптофану трет-бутиламонію (1:1). Конкретна структура показана нижче: O O -O O -O NH3+ N H NH3+ NH 25 Органічна сіль аміну за даним винаходом, утворена з N-метил-D-глюкаміну і D-ізоглутамілD-триптофану, в даному описі позначає сіль D-ізоглутаміл-D-триптофану метил-(2,3,4,5,6пентагідроксигексил)-амонію (1:1). Конкретна структура показана нижче: O O -O OH O -O NH3+ NH3+ N H NH 30 6 OH OH UA 106580 C2 Органічна сіль аміну за даним винаходом, утворена з трометаміну і D-ізоглутаміл-Dтриптофану, в даному описі позначає сіль D-ізоглутаміл-D-триптофану трис(гідроксиметил) метиламонію (1:1). Конкретна структура показана нижче: O O -O HO OH H OH H N+ H3C HO OH O -O N H NH3+ NH . 5 10 15 20 25 Фармацевтично прийнятна сіль лікарської субстанції є хімічно стабільною і може використовуватися у фармацевтичній композиції. На відміну від простих ароматичних вуглеводнів, тімодепресин являє собою дипептид з декількома функціональними групами. Дипептид D-ізоглутаміл-D-триптофан містить альфа-аміногрупу, дві карбоксильні групи та індольний азот в межах однієї молекули. Ідеальна сіль повинна бути такою, для якої значення pH розчину наближується до 7 або знаходиться в діапазоні слабко основних значень pH. В ході дослідження в нашій лабораторії з метою розробки нової солі для подолання недоліків динатрієвої солі D-ізоглутаміл-D-триптофану, використовували графічне визначення складу (Фіг. 5) для визначення солей з ідеальними значеннями pH розчину і розчинністю, прийнятною для фармацевтичних препаратів. Фіг. 5 являє собою графік ідентифікації складу, H-D-iGlu-D-TrpOH в інтервалі pH від 0 до 12 з використанням експериментально визначених значень pKa. На Фіг. 5, LH2=H-D-iGlu-D-Trp-OH, LH = сіль монокарбонової кислоти, L = сіль дикарбонової кислоти, і LH3 = кислотно-адитивна сіль H-D-iGlu-D-Trp-OH. На осі X показане значення pH розчину, тоді як на осі У показано кількість форм, присутніх при конкретному значенні pH. Виходячи з нашого практичного досвіду, ми використовуємо 6 мл води на грам H-D-iGlu-D-TrpOH для цілей виділення, що відповідає концентрації розчину 0,5 M. Згідно графічному визначенню складу, показаному на Фіг. 5, pH для форми двохосновної кислоти становить від приблизно 2,7 до приблизно 3 в розчині. pH розчину для металевої солі формули I, де M являє собою калій або літій; двохосновної солі формули II, де B являє собою кальцій або магній, становить приблизно 7. Інші солі, наприклад, солі формули IV M+ O O M+ -O O O N H NH2 NH IV 30 де M є таким, як визначено вище, солі формули V B++ O O -O O O NH2 N H NH V 35 де B є таким, як визначено вище, і солі формули VI 7 UA 106580 C2 A+ O O A+ -O O O NH2 N H NH VI 5 10 15 20 25 30 35 40 45 50 55 де А є таким, як визначено вище, являють собою нові солі. Динатрієва сіль (формула IV, де M=Na) є менш стабільною хімічною формою як тверда речовина. Вона надзвичайно гігроскопічна, і її дуже важко відважувати при дослідженні рецептур. У розчині, відповідно до графічного визначення складу (Фіг. 5), pH перевищує 9,0, і значення pH розчину повинно бути доведене до значень від приблизно 7,0 до приблизно 7,4 при виготовленні препарату. Як вказано вище, шляхом дослідження в нашій лабораторії було визначено, що калієва сіль формули І може існувати в аморфній або некристалічній формі, а також в кристалічній формі, в залежності від умов, при яких вона була одержана, як описано детальніше нижче. Даний винахід стосується монокалієвої солі тімодепресину в будь-якій з її форм. В одному з варіантів даного винаходу пропонується калієва сіль формули І в аморфній формі. В іншому варіанті даного винаходу пропонується калієва сіль формули І в кристалічній формі. В іншому варіанті даного винаходу кристалічна калієва сіль формули І демонструє рентгенограму порошку, одержану при λ = 1,542 Å із застосуванням джерела радіації Cu Кα, яка містить піки при кутах 2θ — 9,91, 14,84, 15,81, 18,97, 19,76, 24,04, 24,36, 24,82, 25,48, 27,49, 27,94, 28,42, 30,82, 31,28, 31,69, 32,17, 34,35, 35,81 і 36,96°. В іншому варіанті даного винаходу кристалічна калієва сіль формули І демонструє рентгенограму порошку, істотною мірою подібну до показаної на Фіг. 1A. Як вказано вище, шляхом дослідження в нашій лабораторії було визначено, що літієва сіль формули І може існувати в аморфній або некристалічній формі, а також в кристалічній формі, в залежності від умов, при яких вона була одержана, як описано детальніше нижче. Даний винахід стосується монолітієвої солі тімодепресину в будь-якій з її форм. В одному з варіантів даного винаходу пропонується літієва сіль формули І в аморфній формі. В іншому варіанті даного винаходу пропонується літієва сіль формули І в кристалічній формі. В іншому варіанті даного винаходу кристалічна літієва сіль формули І демонструє рентгенограму порошку, одержану при λ =1,542 Å із застосуванням джерела радіації Cu Кα, яка містить піки при кутах 2θ — 13,57, 15,53, 18,71, 20,11, 23,34, 24,1, 25,09, 27,31, 27,72, 28,39, 29,31, 30,19, 31,21, 32,06, 33,05, 33,62 і 37,41°. В іншому варіанті даного винаходу кристалічна літієва сіль формули І демонструє рентгенограму порошку, істотною мірою подібну до показаної на Фіг. 2A. Як вказано вище, шляхом дослідження в нашій лабораторії було визначено, що магнієва сіль формули II існує в кристалічній формі. В іншому варіанті даного винаходу пропонується магнієва сіль формули II в кристалічній формі. В іншому варіанті даного винаходу кристалічна магнієва сіль формули II демонструє рентгенограму порошку, одержану при λ =1,542 Å із застосуванням джерела радіації Cu Кα, яка містить піки при кутах 2θ — 12,2, 13,74, 14,84, 16,16, 17,96, 18,52, 18,94, 19,49, 21,05, 21,56, 22,56, 23,36, 24,12, 26,27, 27,65, 28,42, 29,14, 30,55, 31,77, 32,62, 33,26, 35,05, 36,34, 37,22 і 38,05°. В іншому варіанті даного винаходу кристалічна магнієва сіль формули II демонструє рентгенограму порошку, істотною мірою подібну до показаної на Фіг. 3A. Відсоток кристалічності тімодепресину кальцію або кальцієвої солі формули II за даним винаходом знаходиться на рівні нижче приблизно 67 %, більш переважно — нижче приблизно 50 %, і найбільш переважно — нижче приблизно 25 %. В іншому варіанті даного винаходу пропонується кальцієва сіль формули II із ступенем кристалічності нижче приблизно 67 %. Загальна кристалічність, виміряна за допомогою техніки рентгеноструктурного аналізу порошку, забезпечує додаткову корисну інформацію для фармацевтичних матеріалів, які містять будь-який аморфний матеріал, утворений в ході процедури синтезу. Вона також є 8 UA 106580 C2 5 цінним показником з точки зору контролю довгострокових змін в кристалічних матеріалах. Не будучи пов'язаним з будь-якими конструктивними і композиційними особливостями, показник "відсоток кристалічності" може бути відповідним індикатором стабільності конкретного матеріалу як функції часу. Спосіб визначення відсотка кристалічності сполуки за даним винаходом описаний в прикладі нижче. Характерні зразки РГП кальцієвої солі D-ізоглутаміл-Dтриптофану показані на Фіг. 4A і 4B. В іншому варіанті даного винаходу пропонується сіль трет-бутиламонію формули III, як показано нижче: O O -O O -O NH3+ N H NH3+ NH . 10 В іншому варіанті даного винаходу пропонується сіль трис(гідроксиметил)метиламонію формули III, як показано нижче: O O -O OH O -O NH3+ N H NH3+ NH OH OH . 15 В іншому варіанті даного винаходу пропонується сіль метил-(2,3,4,5,6-пентагідроксигексил)амонію формули III, як показано нижче: O O -O O -O NH3+ N H NH . 20 25 30 35 HO OH H OH H N+ H3C HO OH В іншому варіанті даного винаходу пропонується спосіб одержання літієвої або калієвої солі формули І, який включає: (а) реакцію D-ізоглутаміл-D-триптофану у воді з гідроксидом літію або калію; (б) концентрування розчину до утворення масла і додавання ізопропанолу при перемішуванні для осадження солі; відокремлення утвореного осаду; і сушку продукту у вакуумі з одержанням металевої солі формули І, де M являє собою літій або калій. Зокрема, сіль карбоксилату з металом формули І утворюється при реакції суміші H-D-iGlu-DTrp-OH з гідроксидом металу в кількості менш ніж приблизно 1 еквівалент, наприклад, гідроксидом калію або гідроксидом літію, з корекцією pH за допомогою того ж гідроксиду металу до pH приблизно 7,0. Випаровування розчинника дає масло, яке обробляють ізопропанолом для осадження твердої солі. Сіль виділяють звичайними засобами і сушать у вакуумі з одержанням продукту формули І. В іншому варіанті даного винаходу пропонується спосіб одержання кальцієвої солі формули II, який включає: (а) реакцію D-ізоглутаміл-D-триптофану у воді з гідроксидом кальцію; (б) концентрування при перемішуванні для осадження солі; відокремлення утвореного осаду; і сушку продукту у вакуумі з одержанням металевої солі формули II, де B являє собою кальцій. 9 UA 106580 C2 5 10 15 20 25 30 35 40 45 Зокрема, кальцієву сіль одержують змішуванням дипептиду H-D-iGlu-D-Trp-OH з гідроксидом кальцію, переважно приблизно 0,48–0,49 екв. гідроксиду кальцію на 1 екв. H-D-iGlu-D-Trp-OH, при температурі льодяної бані при перемішуванні протягом декількох годин, переважно від приблизно 2,5 до приблизно 4 годин, з одержанням розчину. Переважна кількість води становить приблизно 12,5 мл води на 1 грам H-D-iGlu-D-Trp-OH. pH розчину доводять приблизно до 6 за допомогою насиченого розчину Ca(OH) 2, і нерозчинні частинки відфільтровують. Фільтрат упарюють до рівня від приблизно 14 % до приблизно 16 % від початкового об'єму. При перемішуванні протягом періоду від приблизно 14 до приблизно 18 годин при кімнатній температурі утворюється тверда речовина, яку відфільтровують. Кальцієву сіль сушать у вакуумі. В іншому варіанті даного винаходу пропонується спосіб одержання магнієвої солі формули II, який включає: (а) реакцію D-ізоглутаміл-D-триптофану з етоксидом магнію в ізопропанолі; (б) концентрування розчину з одержанням твердої речовини; змішування розчину з водою; відфільтровування нерозчинних частинок; розбавлення фільтрату водою при перемішуванні для осадження солі; відокремлення утвореного осаду; і сушку у вакуумі солі формули II, де B являє собою магній. Зокрема, магнієву сіль одержують додаванням H-D-iGlu-D-Trp-OH до суміші етоксиду магнію в ізопропанолі при температурі льодяної бані, переважно використовують приблизно 0,48–0,49 екв. етоксиду магнію на 1 екв. H-D-iGlu-D-Trp-OH. Суміш перемішують протягом періоду від приблизно 3 до приблизно 10 годин, переважно від приблизно 4 до приблизно 5 годин. pH розчину перевіряють, відбираючи зразок і змішуючи його з декількома краплями води. Додають додаткову кількість етоксиду магнію, переважно, від приблизно 0,1 до приблизно 0,12 екв. етоксиду магнію, і перемішують протягом періоду від приблизно 10 до приблизно 18 годин, переважно, протягом періоду від приблизно 14 до приблизно 16 годин. pH розчину перевіряють, відбираючи зразок і змішуючи його з декількома краплями води, pH становить приблизно 7,0. Розчин упарюють при зниженому тиску з одержанням твердої речовини, яка розчиняється у воді. Нерозчинні частинки відфільтровують, і фільтрат упарюють з одержанням твердої речовини. Тверду речовину перемішують з водою для утворення суспензії, і далі перемішують протягом періоду від приблизно 3 до приблизно 6 годин з утворенням осаду. Магнієву сіль відфільтровують і сушать у вакуумі. В іншому варіанті даного винаходу пропонується спосіб одержання органічної солі аміну формули III, який включає: (а) реакцію D-ізоглутаміл-D-триптофану з органічним аміном у воді, де органічний амін являє собою трет-бутиламін, N-метилглюкамін або трометамін; і (б) концентрування розчину, сумісне випаровування з ізопропанолом; додавання ацетону для осадження солі; відокремлення утвореного осаду; і сушку продукту у вакуумі з одержанням органічної амонійної солі формули III, де А являє собою трет-бутиламоній або трис(гідроксиметил)метиламоній або метил-(2,3,4,5,6-пентагідроксигексил)-амоній. Зокрема, сполуку формули III, де протиіон являє собою органічний амін, одержують змішуванням органічного аміну з H-D-iGlu-D-Trp-OH у воді при температурі навколишнього середовища, перемішуючи суміш протягом періоду від приблизно 12 до приблизно 18 годин. Розчинник випаровують спільно з ізопропанолом, і залишок упарюють у вакуумі з одержанням твердої речовини, яку перемішують з ацетоном і фільтрують. Приклади органічних амінів вибрані з групи, що складається з трис(гідроксиметил)амінометану, N-метил-глюкаміну і третбутиламіну. В іншому варіанті даного винаходу пропонується спосіб сольового обміну для солі Dізоглутаміл-D-триптофану, який включає: (а) реакцію амонійної солі, представленої формулою VII, O O -O O -O NH3+ N H NH NH4+ VII, 50 у водному розчині з приблизно 1 екв. гідроксиду металу, представленого MOH, де M являє собою калій або літій; і (б) випаровування розчинника з одержанням твердої речовини, яку 10 UA 106580 C2 5 10 15 20 25 30 35 40 45 50 55 перемішують з водою та ізопропанолом з одержанням сполуки формули І, де M являє собою калій або літій. В іншому варіанті даного винаходу пропонується спосіб сольового обміну для солі Dізоглутаміл-D-триптофану, який включає: (а) реакцію амонійної солі, представленої формулою VII, у водному розчині з приблизно 0,5 екв. гідроксиду металу B(OH) 2, де B являє собою кальцій або магній; (б) випаровування розчинника з одержанням твердої речовини, яку перемішують з водою та ізопропанолом з одержанням сполуки формули II, де B являє собою кальцій або магній. Сполука формули І може бути одержане сольовим обміном. Стабільна амонійна сіль H-DiGlu-D-Trp-OH використовується як початковий матеріал. Нижче представлений характерний спосіб одержання сполуки формули І. Розчин H-D-iGlu-D-Trp-OH, амонійної солі (1:1) змішують з гідроксидом металу у воді, після чого перемішують протягом періоду від приблизно 15 хвилин до приблизно 2 годин, переважно, протягом періоду від приблизно 15 хвилин до приблизно 45 хвилин. Розчинник видаляють випаровуванням, і рідину, що залишилася, перемішують з ізопропанолом з одержанням осаду. Гідроксид металу вибирають з групи, що складається з гідроксиду літію і гідроксиду калію. Рентгенограми порошку D-ізоглутаміл-D-триптофану калієвої солі (1:1) і D-ізоглутаміл-D-триптофану літієвої солі (1:1) показують, що вони являють собою кристалічні речовини. Якщо розчин H-D-iGlu-D-Trp-OH, амонійної солі (1:1) змішують з гідроксидом металу у воді, з подальшим перемішуванням протягом періоду від приблизно 15 хвилин до приблизно 2 годин, переважно, протягом періоду від приблизно 15 хвилин до приблизно 45 хвилин, а потім висушують ліофільною сушкою, матеріал, одержаний таким чином, є аморфним. Аморфні форми натрієвих, калієвих або літієвих солей H-D-iGlu-D-Trp-OH можуть бути одержані даним способом. Сполука формули II може бути одержана в результаті обміну амонійної солі з гідроксидом кальцію або гідроксидом магнію. Наприклад, суспензію H-D-iGlu-D-Trp-OH і гідроксиду металу у воді, наприклад, гідроксиду кальцію або гідроксиду магнію, нагрівають до приблизно 50–65 °C протягом періоду від приблизно 1 до приблизно 4 годин. Розчинник видаляють випаровуванням. Рідину, що залишилася, перемішують з ізопропанолом для осадження металевої солі H-D-iGluD-Trp-OH (2:1). Якщо метал являє собою магній, одержана металева магнієва сіль H-D-iGlu-DTrp-OH (2:1) є кристалічною, що підтверджується рентгенограмою порошку. Якщо метал являє собою кальцій, виділений H-D-iGlu-D-Trp-OH кальцій (2:1) являє собою напівкристалічну речовину, із ступенем кристалічності менш ніж приблизно 67 %. 14 N-ЯМР є корисною технікою для характеристики моноамонійної солі тімодепресину. Металеві солі формули І та II, одержані вказаним вище способом, є істотною мірою вільними від + 14 амонійної солі, про що свідчить відсутність сигналу NH4 за даними N-ЯМР. Ми застосували графічний метод визначення складу (Фіг. 5) для обчислення діапазону pH для сольових форм дипептиду H-D-iGlu-D-Trp-OH. Як показано на Фіг. 5, сіль формули І або II або III переважає при значеннях pH від приблизно 6 до приблизно 8, що робить її ідеальним кандидатом для застосування препарату або введення у фармацевтичні композиції. Вона є особливо придатною для рідких препаратів, сублінгвальних таблеток, назальних крапель і спреїв. ПРИДАТНІСТЬ І ВВЕДЕННЯ Калієві, літієві, кальцієві, магнієві солі D-ізоглутаміл-D-триптофану і органічні солі аміну і Dізоглутаміл-D-триптофану за даним винаходом можуть бути введені у фармацевтичні композиції для введення суб'єкту в терапевтично активній кількості і в біологічно сумісній формі, придатній для введення in vivo, тобто, у формі пептидів для введення, в якій терапевтичний ефект перевершує будь-які токсичні ефекти. Відповідно до методу графічного визначення складу, як показано на Фіг. 5, переважними формами при нейтральних значеннях pH є монокарбоксилатна форма тімодепресину, тобто мононатрієва сіль дипептиду D-ізоглутаміл-D-триптофану, якщо протиіон являє собою натрій. Динатрієва сіль D-ізоглутаміл-D-триптофану є надзвичайно гігроскопічною, і її дуже складно відмірювати. Аморфна або кристалічна форми солей за даним винаходом є ідеальними кандидатурами для заміни динатрієвої солі при виготовленні різних препаратів, придатних для лікування таких же станів та/або захворювань, для лікування яких застосовують тімодепресин, наприклад, псоріазу. Введення нових кристалічних і аморфних солей за даним винаходом, як описано в даному описі, може бути здійснене будь-яким із загальноприйнятих способів введення терапевтичних лікарських засобів з системною активністю. Вказані способи включають лікарські 11 UA 106580 C2 5 10 15 20 25 30 35 40 45 50 55 60 форми для перорального, парентерального та інших видів системного або місцевого застосування або застосування у формі аерозолю. В залежності від передбаченого способу введення, композиції для застосування можуть існувати у формі твердих, напівтвердих або рідких лікарських форм, таких як таблетки, супозиторії, пігулки, капсули, порошки, рідини, аерозолі, суспензії і т. п., переважно в дозованих лікарських формах, відповідних для одноразового введення точних доз. Композиції будуть містити як мінімум один традиційний фармацевтичний носій або допоміжну речовину і кристалічний тімодепресин або його фармацевтично прийнятну моноамонійну сіль, і додатково можуть містити інші лікарські засоби, фармацевтичні засоби, носії, ад'юванти і т. п. Для твердих композицій можуть бути використані традиційні нетоксичні тверді носії, які включають, наприклад, маніт, лактозу, крохмаль, магнію стеарат, натрію сахаринат, тальк, целюлозу, глюкозу, сахарозу, магнію карбонат і т. п., фармацевтичної категорії. Активна сполука, як визначено вище, може бути введена в супозиторії з використанням, наприклад, поліалкіленгліколей, наприклад, пропіленгліколю, як носія. Придатні для фармацевтичного введення рідкі композиції можуть, наприклад, бути одержані шляхом розчинення, диспергування і т. п., активної сполуку, як визначено вище, і необов'язкових фармацевтичних ад'ювантів в носії, такому як вода, сольовий розчин, водний розчин глюкози, гліцерин, етанол і т. п., з утворенням у такий спосіб розчину або суспензії. За бажанням, фармацевтична композиція для введення може також містити незначні кількості нетоксичних допоміжних субстанцій, таких як зволожуючі або емульгувальні засоби, буферизуючі засоби і т. п., наприклад, натрію ацетат, сорбітану монолаурат, натрію триетаноламіну ацетат, триетаноламіну олеат і т. п. Фактично, способи одержання таких лікарських форм відомі або будуть очевидними для фахівця в даній галузі; наприклад, див. Remington: The Science and Practice of Pharmacy, 21st Edition, 2006, частина 5, Pharmaceutical manufacturing (Виробництвоо фармацевтических препаратів), розділи 37, 39, 41-47 и 50, стр. 702-719, 745-775, 802-938 и 1000-1017, (раніше відома як Remington's Pharmaceutical Sciences), David B. Troy (Ed.), Lipincott Williams & Wilkins, Baltimore, Maryland. Композиція або рецептура для введення у будь-якому випадку будуть містити кількість активної(их) сполуку(ук) в кількості, ефективній для полегшення симптомів у суб'єкта, який потребує лікування. Парентеральне введення в цілому характеризується ін'єкцією, підшкірною, внутрішньом'язовою або внутрішньовенною. Ін'єкційні засоби можуть бути введені в традиційні форми, такі як рідкі розчини або суспензії, тверді форми, придатні для виготовлення розчину або суспензії в рідині перед ін'єкцією, або як емульсії. Придатними допоміжними речовинами, наприклад, є вода, сольовий розчин, розчин глюкози, гліцерин, етанол і т. п. Крім того, за бажанням, фармацевтичні композиції для введення можуть також містити незначні кількості нетоксичних допоміжних речовин, таких як зволожувальні або емульгувальні засоби, буферизуючі рН засоби і т. п., такі як натрію ацетат, сорбітану монолаурат, триетаноламіну олеат і т. п. Для солей за даним винаходом переважним є пероральне або назальне (інтрабронхіальне) введення, в залежності від природи розладу, що підлягає лікуванню. Для перорального введення фармацевтично прийнятну нетоксичну композицію одержують, сполучаючи будь-яку із звичайно використовуваних допоміжних речовин фармацевтичної категорії, таку як маніт, лактоза, крохмаль, стеарат магнію, натрію сахаринат, тальк, целюлоза, глюкоза, сахароза, магнію карбонат і т. п. Такі композиції можуть існувати у формі розчинів, суспензій, таблеток, пігулок, капсул, порошків, рецептур з пролонгованим вивільненням і т. п. Такі композиції можуть містити від приблизно 1 % до приблизно 95 % активного інгридієнта, переважно, від приблизно 25 % до приблизно 70 %. Пероральне і назальне введення в легені може також здійснюватися за допомогою аерозольних лікарських форм. Для аерозольного введення, активний інгридієнт переважно поставляється в тонко подрібненій формі разом з поверхнево-активною речовиною і пропелентом. Типовий відсотковий вміст активних інгридієнтів становить від приблизно 0,01 до приблизно 20 % по масі, переважно, від приблизно 0,04 % до приблизно 1,0 %. Поверхнево-активні речовини звичайно повинні бути нетоксичними, і переважно розчинними в пропеленті. Характерним прикладом таких засобів є естери або часткові естери жирних кислот, що містять від 6 до 22 атомів вуглецю, таких як капронова, каприлова, лауринова, пальмітинова, стеаринова, лінолева, ліноленова, олестеаринова та олеїнова кислоти, з багатоатомним аліфатичним спиртом або його циклічним ангідридом, таким як етиленгліколь, гліцерин, еритритол, арабітол, маніт, сорбіт, ангідрид гекситолу, одержаний з сорбіту (етери ® сорбітану, присутні на ринку під назвою SPAN ) і поліоксиетиленові та поліоксипропіленові похідні вказаних етерів. Можуть використовуватися змішані естери, такі як змішані або природні 12 UA 106580 C2 5 10 15 20 25 30 35 40 45 гліцериди. Переважними поверхнево-активними агентами є олеати або сорбітан, наприклад, ® ® присутні на ринку під назвами ARLACEL C (сорбітану сесквіолеат), SPAN 80 (сорбітану ® моноолеат) і SPAN 85 (сорбітану триолеат). Вміст поверхнево-активної речовини може становити від приблизно 0,1 % до приблизно 20 % по масі композиції, переважно, від приблизно 0,25 % до приблизно 5 %. Решта композиції звичайно являє собою пропелент. Зріджені пропеленти звичайно є газоподібними в умовах навколишнього середовища і конденсуються під тиском. Серед придатних зріджених пропелентів — нижчі алкани, що містять до п'яти атомів вуглецю, такі як бутан і пропан; і, переважно, фторовані або фторхлоровані алкани, наприклад, присутні на ® ринку під назвою FREON . Суміші вищезгаданих компонентів також можуть бути використані. У виробництві аерозолю, ємність, обладнану придатним клапаном, заповнюють відповідним пропелентом, що містить тонко подрібнений активний інгридієнт і поверхнево-активну речовину. Таким чином, інгридієнти містяться при підвищеному тиску до викиду при спрацьовуванні клапана. Для місцевого застосування такі композиції містять ефективну кількість сполуки даного класу в суміші як мінімум з одним фармацевтично прийнятним нетоксичним носієм. Придатний для композиції інтервал становить від приблизно 0,1 % до приблизно 10 % активного інгридієнта; решта композиції являє собою носії; переважно, від приблизно 1 % до приблизно 2 % активного інгридієнта. Концентрація активного інгридієнта у фармацевтичних композиціях, придатних для місцевого застосування, буде варіювати в залежності від активності конкретної сполуки, яку застосовують відповідно до присутнього стану і суб'єкта, який потребує лікування. Відповідні носії або розчинники лікарського засобу для місцевого застосування вказаних сполук включають креми, мазі, лосьйони, емульсії, розчини і т. п. Наприклад, придатна мазь для місцевого застосування сполук за даним винаходом містить від приблизно 15 до приблизно 45 % насиченого жирного спирту, що містить 16–24 атоми вуглецю, такого як цетиловий спирт, стеариловий спирт, бегеніловий спирт і т. п., і від приблизно 45 до приблизно 85 % по масі гліколевого розчинника, такого як пропіленгліколь, поліетиленгліколь, дипропіленгліколь і суміші вказаних компонентів. Мазь також може містити від приблизно 0 до приблизно 15 % по масі пластифікатора, такого як поліетиленгліколь, 1,2,6гексантріол, сорбіт, гліцерин і т. п.; від приблизно 0 до приблизно 15 % по масі зв'язуючого засобу, такого як насичені жирні кислоти, що містять від 16 до 24 атомів вуглецю, наприклад, стеаринова кислота, пальмітинова кислота, бегенова кислота, аміди жирних кислот, наприклад, олеамід, пальмітамід, стеарамід, бегенамід, і естери жирних кислот, що містять 16–24 атомів вуглецю, такі як сорбіту моностеарат, поліетиленгліколю моностеарат, поліпропіленгліколь, або відповідні моноестери інших жирних кислот, таких як олеїнова кислота і пальмітинова кислота; і від приблизно 0 до приблизно 20 % по масі засобу, що підсилює проникнення, такого як диметилсульфоксид або диметилацетамід. Терапевтично активна кількість солей за даним винаходом може варіювати у відповідності до таких чинників, як патологічний стан, вік, стать і маса тіла індивідуума. Схема лікування може бути змінена таким чином, щоб забезпечити оптимальну терапевтичну відповідь. В цілому, схема щоденного введення повинна включати дозу в інтервалі від приблизно 1 до приблизно 200 мг пептиду. Далі наведені приклади характерних рецептур, які жодним чином не обмежують винахід. Нижче проілюстровано одержання різноманітних фармацевтичних композицій за даним винаходом: Інгридієнти Активний інгридієнт Лактоза, висушена розпиленням Крохмаль кукурудзяний Стеарат магнію Кількість на таблетку (мг) 25 20 153 2 Вказані вище інгридієнти ретельно змішують і пресують в таблетки з однією рискою. Інгридієнти Активний інгридієнт Лактоза, висушена розпиленням Стеарат магнію Кількість на таблетку (мг) 100 148 2 50 13 UA 106580 C2 Вказані вище інгридієнти змішують і вводять в тверду желатинову капсулу. Інгридієнти Активний інгридієнт Лактоза Крохмаль кукурудзяний Стеарат магнію 5 Кількість на таблетку (мг) 200 145 50 5 Вказані вище інгридієнти змішують і пресують в таблетки з однією рискою. Інгридієнти Активний інгридієнт Лактоза Крохмаль кукурудзяний Стеарат магнію Кількість на таблетку (мг) 108 15 25 2 Вказані вище інгридієнти змішують і вводять в тверду желатинову капсулу. Інгридієнти Активний інгридієнт Лактоза Кількість на таблетку (мг) 150 92 10 Вказані вище інгридієнти змішують і вводять в тверду желатинову капсулу. Ін'єкційний препарат, буферизований до pH приблизно 7, одержують з наступним складом: Інгридієнти Активний інгридієнт KH2PO4 KOH (1 н розчин) Вода (дистильована, стерильна) 15 Кількість 0,2 г 2 мл необхідна кількість до pH 7 необхідна кількість до 20 мл Ін'єкційний препарат, буферизований до pH приблизно 7, одержують з наступним складом: Інгридієнти Активний інгридієнт Вода (дистильована, стерильна) NaOH (0,2 н) Кількість 0,01 г необхідна кількість до 1 мл необхідна кількість до pH 7 Суспензію для перорального застосування одержують з наступним складом: Інгридієнти Активний інгридієнт Фумарова кислота Метилпарабен Цукор Сорбіт (70 % розчин) ® VEEGUM ДО (Vanderbilt Co.) Ароматизатор Барвники Вода дистильована Кількість 0,1 г 0,5 г 2,0 г 0,1 г 25,5 г 12,85 г 1,0 г 0,035 мл необхідна кількість до 100 мл 20 14 UA 106580 C2 Препарат для місцевого застосування: Інгридієнти Активна сполука ® SPAN 60 ® TWEEN 60 Мінеральне масло Вазелін Метилпарабен Пропілпарабен BHA (бутильований гідроксианізол) Вода дистильована 5 10 15 20 25 30 35 40 45 50 Грами 0,2–2 2 2 5 10 0,15 0,05 0,01 необхідна кількість до 100 мл Всі вказані вище інгридієнти, окрім води, поєднують і нагрівають приблизно до 45C при перемішуванні. Потім додають достатню кількість води з температурою приблизно 45C при енергійному перемішуванні для емульгації інгридієнтів, і далі додають необхідну кількість води до 100 мл. Нижче даний винахід пояснюється детально з посиланням на Приклади, але даний винахід жодним чином не обмежується ними. У даному винаході пропонується фармацевтична композиція, яка містить літієву або калієву сіль формули І в будь-якій з її форм і одну або більше фармацевтично прийнятних допоміжних речовин. У даному винаході також пропонується фармацевтична композиція, яка містить кальцієву або магнієву сіль формули II в будь-якій з її форм і одну або більше фармацевтично прийнятних допоміжних речовин. У даному винаході додатково пропонується фармацевтична композиція, яка містить органічну сіль аміну формули III в будь-якій з її форм і одну або більше фармацевтично прийнятних допоміжних речовин. Подальші деталі переважних варіантів даного винаходу проілюстровані в наступних прикладах, які слід інтерпретувати як не обмежуючі щодо доданої формули винаходу. ПРИКЛАДИ Приклад 1: Одержання калієвої солі D-ізоглутаміл-D-триптофану (1:1) з D-ізоглутаміл-D-триптофану і гідроксиду калію. До круглодонної колби об'ємом 100 мл, обладнаної магнітною мішалкою, вміщують 5 мл розчину гідроксиду калію (0,5 н). Розчин охолоджують до 0 °C на льодяній бані, і додають твердий H-D-iGlu-D-Trp-OH (1,00 г, 3 ммоль). Суміш перемішують, і в цей час pH розчину доводять приблизно до 6,0, додаючи декілька крапель розчину гідроксиду калію (0,5 н). Розчин фільтрують для видалення частинок твердої речовини. Фільтрат упарюють до сухого стану при температурі бані приблизно 30 °C з одержанням твердої речовини. Після сушки у вакуумі при кімнатній температурі протягом ночі була одержана сіль з кількісним виходом і чистотою ВЕРХ (відсоток площі піку) 98,3 %. Метод ВЕРХ; колонка: XTerra МС C18; 5 мкм, 4,6 × 250 мм; рухома фаза: А = водна фаза: 4 мМ Трис, 2 мМ ЕДТА, pH 7,4; B = органічна фаза: CH 3CN; градієнт: B %: 0 хв. 5 %, 15 хв. 55 %, 30 хв. 55 %, 32 хв. 5 %, 35 хв. 5 %; швидкість потоку: 1 мл/хв; об'єм ін'єкції: 5 мкл; λ: 222, 254, 282, 450 нм; час утримання продукту: 6,41 хв. РГП даного кристалічного матеріалу показана на Фіг. 1A; вміст води за даними аналізу методом Карла Фішера становить 0,7 %; УФ (вода, з = 23,8 мкМ, λmax нм): 221 (ε 33270), 280 (ε 5417); МС + + (співвідношення маси і заряду): 372,0 [M] , 334,2 [C16H20N3O5] , 187,9 (100 %). Спектр ІЧФП (KBr) показаний на Фіг. 1B. Приклад 2: А. Одержання монокалієвої солі D-ізоглутаміл-D-триптофану (1:1) з моноамонійної солі Dізоглутаміл-D-триптофану (1:1). Розчин H-D-iGlu-D-Trp-OH, моноамонійної солі (1:1), (1,66 г, 4,05 ммоль) і гідроксиду калію (253 мг, 4,50 ммоль) у воді (20 мл) перемішують при кімнатній температурі протягом 15 хв. pH розчину становить приблизно 9. Реакційну суміш упарюють при зниженому тиску до об'єму приблизно 1 мл. Після охолоджування до кімнатної температури додають ізопропанол до утворення осаду твердої речовини. Одержану суспензію перемішують при кімнатній температурі протягом 15 хв, потім фільтрують. Тверду речовину промивають ізопропанолом (2 × 20 мл) та етилацетатом (20 мл), потім сушать у вакуумі в печі з температурою 42 °C, 15 UA 106580 C2 5 10 15 20 25 30 35 40 45 50 55 витримуючи при цій температурі протягом ночі. Одержують тверду речовину практично білого кольору (1,49 г, вихід 99 %). Вміст води за даними аналізу методом Карла-Фішера становить 2,5 %. Дані аналізу (РГП, ІЧФП і МС спектри) подібні до описаних в Прикладі 1. B. Одержання аморфної форми калієвої солі D-ізоглутаміл-D-триптофану (1:1) з моноамонійної солі D-ізоглутаміл-D-триптофану (1:1). Розчин H-D-iGlu-D-Trp-OH, моноамонійної солі (1:1), (517 мг, 1,40 ммоль) і гідроксиду калію (82 мг, 1,46 ммоль) у воді (10 мл) перемішують при кімнатній температурі протягом 30 хвилин. Одержану суміш висушують ліофільною сушкою протягом ночі. Продукт одержують у вигляді твердої речовини практично білого кольору з кількісним виходом. РГП підтвердила, що даний 1 матеріал є аморфним. H ЯМР (D2O) δ: 7,69 (д, J=7,9 Гц, 1H), 7,48 (д, J=8,2 Гц, 1H), 7,23 (т, J=7,6 Гц, 1H), 7,22 (с, 1H), 7,16 (т, J=7,4 Гц, 1H), 4,59 (дд, J=8,7, 4,8 Гц, 1H), 3,51 (дд, J=6,8, 5,8 Гц, 1H), 13 3,38 (дд, J=14,8, 4,8 Гц, 1H), 3,11 (дд, J=14,8, 8,8 Гц, 1H), 2,20-2,49 (м, 2H) і 1,85-1,94 (м, 2H); C ЯМР (D2O) δ: 181,4, 177,0, 176,6, 138,8, 129,9, 126,9, 124,5, 121,9, 121,4, 114,5, 113,2, 58,6, 57,0, 34,6 (CH2), 30,2 (CH2) і 29,3 (CH2); вміст води за даними аналізу методом Карла-Фішера становить 5,4 %; спектр ІЧФП (KBr) показаний на Фіг. 1C; МС (співвідношення маси і заряду): + + 371,7 [M] , 334,2 [C16H20N3O5] , 187,9 (100 %); чистота ВЕРХ (відсоток площі піку): 99,8 %, час утримання: 5,04 хв; умови ВЕРХ: колонка Waters Symmetry C18, 3,9 × 150 мм, 5 мкм; рухома фаза: 0,035 % HClO4, pH 2/CH3CN, 85:15 ізократична, швидкість потоку: 1 мл/хв; λ: 220, 254, 280 нм. Приклад 3: А. Одержання літієвої солі D-ізоглутаміл-D-триптофану (1:1) з моноамонійної солі Dізоглутаміл-D-триптофану (1:1) і гідроксиду літію моногідрату. Розчин H-D-iGlu-D-Trp-OH, моноамонійної солі (1:1), (1,40 г, 3,80 ммоль) і гідроксиду літію моногідрату (159 мг, 3,80 ммоль) у воді (20 мл) перемішують при кімнатній температурі протягом 20 хв. pH розчину становить приблизно 9. Реакційну суміш випаровують при зниженому тиску до об'єму розчинника приблизно 2 мл. Після охолоджування до кімнатної температури додають ізопропанол до утворення осаду твердої речовини. Одержану суспензію перемішують при кімнатній температурі протягом 20 мін, після чого фільтрують. Тверду речовину промивають ізопропанолом (2 × 20 мл) і етилацетатом (20 мл), потім сушать у вакуумі в печі з температурою 42 °C протягом ночі. Продукт одержують у вигляді твердої речовини практично білого кольору з кількісним виходом. РГП даного кристалічного матеріалу показана на Фіг. 2A. Вміст води за даними аналізу методом Карла-Фішера 10,7 %. МС (співвідношення + + маси і заряду): 340,1 [M+1] , 334,3 [C16H20N3O5] , 187,9 (100 %). Спектр ІЧФП (KBr) показаний на Фіг. 2B. B. Розчин H-D-iGlu-D-Trp-OH, моноамонійної солі (1:1), (480 мг, 1,30 ммоль) і гідроксиду літію моногідрату (57 мг, 1,36 ммоль) у воді (10 мл) перемішують при кімнатній температурі протягом 30 хв. Одержану суміш сушать ліофільною сушкою протягом ночі. Продукт одержують у вигляді твердої речовини практично білого кольору з кількісним виходом. РГП підтвердила, що даний 1 матеріал є аморфним. H ЯМР (D2O) δ: 7,69 (д, J=7,8 Гц, 1H), 7,50 (д, J=8,2 Гц, 1H), 7,23 (т, J=7,1 Гц, 1H), 7,22 (с, 1H), 7,16 (т, J=7,5 Гц, 1H), 4,57 (дд, J=8,7, 4,8 Гц, 1H), 3,36-3,43 (м, накладання т 13 і дд, 2H), 3,12 (дд, J=14,7, 8,7 Гц, 1H), 2,20-2,35 (м, 2H) і 1,78-1,92 (м, 2H); C ЯМР (D2O) δ: 181,4, 178,1, 176,7, 138,8, 129,9, 126,9, 124,5, 121,9, 121,4, 114,5, 113,2, 58,6, 57,1, 34,7 (CH2), 30,2 (CH2) і 29,3 (CH2); спектр ІЧФП (KBr) показаний на Фіг. 2C; вміст води за даними аналізу методом Карла-Фішера становить 11,5 %. Спектр МС подібний описаному в Прикладі 3A; чистота ВЕРХ (відсоток площі піку): 99,8 %, час утримання: 5,10 хв. Застосовували умови ВЕРХ, описані в Прикладі 2B. Приклад 4: Одержання літієвої солі D-ізоглутаміл-D-триптофану (1:1) з D-ізоглутаміл-D-триптофану і гідроксиду літію моногідрату. А. У круглодонній колбі об'ємом 100 мл, обладнаній магнітною мішалкою, розчиняють гідроксиду літію моногідрат (125,8 мг, 2,99 ммоль) в 10 мл води. Розчин охолоджують до 0 °C за допомогою льодяної бані. H-D-iGlu-D-Trp-OH (1,00 г, 3 ммоль) суспендують в розчині. Тверду речовину повільно розчиняють впродовж 2,5 годин з утворенням прозорого блідо-рожевого розчину. Після додаткових 30 хвилин перемішування суміш нагрівають до кімнатної температури. Розчин фільтрують і обережно упарюють до об'єму приблизно 4 мл. Повільно додають ізопропанол (25 мл) до утворення твердої речовини. Розчин фільтрують, і тверду речовину розділяють на дві рівні частини. B. Одну частину твердої речовини, одержаної за методикою А, промивають ізопропанолом (2 × 15 мл). Тверду речовину спочатку сушать у повітрі, а потім сушать у вакуумі в печі (35 °C) 16 UA 106580 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом ночі. Вміст води за даними аналізу методом Карла-Фішера становить 10,6 %. РГП та МС і ІЧФП (KBr) спектри даної сполуки подібні до описаних в Прикладі 3A. C. Другу частину твердої речовини промивають ізопропанолом (2 × 15 мл), і потім етилацетатом (2 × 10 мл). Тверду речовину спочатку сушать у повітрі, а потім сушать у вакуумі в печі (35 °C) протягом ночі. РГП і ІЧФП (KBr) спектр даної сполуки подібні до описаних в Прикладі 3A. Об'єднаний вихід матеріалу, одержаного за методиками B і C, становить 0,99 г (вихід 97,6 %). Приклад 5: Одержання магнієвої солі D-ізоглутаміл-D-триптофану (1:2) з D-ізоглутаміл-D-триптофану. До круглодонної колби об'ємом 100 мл, обладнаної магнітною мішалкою, вміщують етоксид магнію (Aldrich, 98 %, 0,206 г, 1,76 ммоль) та ізопропанол (15 мл). Розчин охолоджують до 0 °C на льодяній бані, і додають твердий H-D-iGlu-D-Trp-OH (1,20 г, 3,60 ммоль). Суспензію білого кольору перемішують при кімнатній температурі протягом 4 годин. 2–3 Краплі реакційної суміші вміщують в пробірку і додають декілька крапель демінералізованої води. Суміш струшують з утворенням прозорого розчину. pH розчину становить 4,0–4,5. До реакційної суміші додають етоксид магнію (Aldrich, 98 %, 0,050 г, 0,43 ммоль). Суміш перемішують при кімнатній температурі протягом ночі. 2–3 Краплі суспензії білого кольору вміщують в пробірку і додають декілька крапель демінералізованої води. Суміш струшують з одержанням прозорого розчину. pH розчину становить приблизно 7,0. Суміш випаровують до сухого стану при температурі бані 30 °C з одержанням твердої речовини білого кольору. Залишок розчиняють в 15 мл демінералізованої води з одержанням розчину жовтого кольору. Останній фільтрують для видалення частинок твердої речовини. Фільтрат випаровують до сухого стану при температурі бані 30 °C з одержанням твердої речовини. Тверду речовину суспендують в демінералізованій воді (20 мл), і суміш перемішують протягом 3 годин. Тверду речовину відокремлюють фільтрацією і промивають льодяною демінералізованою водою (2 × 6 мл). Тверду речовину спочатку сушать на повітрі, а потім вміщують у вакуумну піч при 42 °C, витримуючи при цій температурі протягом ночі. Таким чином було одержано 0,88 г продукту (вихід 72 %, чистота ВЕРХ [відсоток площі піку]: 99,1 %). Застосовують метод ВЕРХ, описаний в Прикладі 1. Час утримання для даного продукту становить 6,39 хв. РГП даного кристалічного матеріалу показана на Фіг. 3A. Вміст води за даними аналізу методом Карла-Фішера становить 12,2 %. МС + + (співвідношення маси і заряду): 689,3 [M] , 334,2 [C16H20N3O5] , 187,9 (100 %). УФ (вода, з = 11,7 мкМ, λmax нм): 221 (ε 57906), 280 (ε 9449). Спектр ІЧФП (KBr) показаний на Фіг. 3B. Приклад 6: Одержання магнієвої солі D-ізоглутаміл-D-триптофану (1:2) з моноамонійної солі Dізоглутаміл-D-триптофану (1:1). Суспензію D-ізоглутаміл-D-триптофану, моноамонійної солі (1:1, 1,53 г, 4,15 ммоль) і гідроксиду магнію в H2O (20 мл) нагрівають до температури від 55–60 °C, витримуючи при цій температурі протягом 3 годин. Одержану суспензію жовтуватого кольору випаровують при зниженому тиску до об'єму приблизно 1–2 мл. Потім додають ізопропанол (30 мл). Суспензію перемішують протягом 20 мін при кімнатній температурі, після чого фільтрують. Тверду речовину промивають послідовно ізопропанолом (2 × 20 мл) і етилацетатом (20 мл), потім сушать у вакуумній печі при 42 °C, витримуючи при цій температурі протягом ночі. Одержують тверду речовину жовтуватого кольору (1,5 г). Вміст води за даними аналізу методом КарлаФішера становить 8,8 %. Даний аналізу (РГП та ІЧФП і МС спектри) подібні до описаних в Прикладі 5. Приклад 7: Одержання кальцієвої солі D-ізоглутаміл-D-триптофану (1:2) з D-ізоглутаміл-D-триптофану (1:1) і гідроксиду кальцію. До круглодонної колби об'ємом100 мл, обладнаної магнітною мішалкою, вміщують гідроксид кальцію (Aldrich, 99,99 %, менше 3 % кальцію карбонату, 0,2603 г, 3,51 ммоль) і демінералізовану воду (30 мл). Каламутний розчин охолоджують до 0 °C на льодяній бані, і додають твердий H-D-iGlu-D-Trp-OH (2,404 г, 7,2 ммоль). Суміш перемішують протягом 2,5 годин з утворенням прозорого, злегка рожевого розчину. pH розчину доводять до 6,0, додаючи насичений розчин гідроксиду кальцію. Розчин фільтрують для видалення частинок твердої речовини. Фільтрат розділяють на два рівні об'єми (приблизно по 20 мл кожен): Розчин А і Розчин B. Розчин А упарюють за допомогою роторного випарника до об'єму приблизно 4–5 мл з використанням водяної бані з температурою приблизно 30 °C. Розчин залишається прозорим. Одержаний концентрований розчин енергійно перемішують при кімнатній температурі протягом 17 UA 106580 C2 5 10 15 20 25 30 35 40 17 годин з одержанням твердої речовини. Тверду речовину відокремлюють фільтрацією і промивають льодяною демінералізованою водою (3 × 6 мл). Тверду речовину спочатку сушать ліофільною сушкою, після чого сушать у вакуумній печі при 40 °C, витримуючи при цій температурі протягом ночі з одержанням 0,70 г твердої речовини (55 %, чистота ВЕРХ за даними % площі піку: 97,7 %). Застосовують метод ВЕРХ, описаний в Прикладі 1. Час утримання для даного продукту становить 6,39 хв. РГП даного матеріалу показана на Фіг. 4A. Вміст води за даними аналізу методом Карла-Фішера становить 5,4 %. МС (співвідношення + + маси і заряду): 705,6 [M+1] , 334,2 [C16H20N3O5] , 187,9 (100 %). УФ (вода, з = 10,8 мкМ, λmax нм): 221 (ε 61014), 280 (ε 9943). Спектр ІЧФП (KBr) показаний на Фіг. 4C. Розчин B випаровують до сухого стану. Додають демінералізовану воду (6 мл), і суміш перемішують протягом 16 годин. Нерозчинну тверду речовину відфільтровують і сушать під глибоким вакуумом при температурі 35 °C протягом 48 годин (0,53 г). РГП подібна до показаної на Фіг. 4A. Приклад 8: Одержання кальцієвої солі D-ізоглутаміл-D-триптофану (1:2) з моноамонійної солі Dізоглутаміл-D-триптофану (1:1) і гідроксиду кальцію. Суспензію моноамонійної солі (1:1) D-ізоглутаміл-D-триптофану, (1,49 г, 4,06 ммоль) і гідроксиду кальцію (150 мг, 2,03 ммоль) у воді (20 мл) нагрівають до температури 55–60 °C, витримуючи при цій температурі протягом 1 години. Одержаний розчин упарюють при зниженому тиску до об'єму приблизно 1–2 мл. Додають ізопропанол (30 мл). Суспензію перемішують протягом 20 мін при кімнатній температурі, після чого фільтрують. Тверду речовину промивають послідовно ізопропанолом (2 × 20 мл) і етилацетатом (20 мл), потім сушать в печі при температурі 42 °C, витримуючи при цій температурі протягом ночі. Одержують тверду речовину практично білого кольору (1,45 г). РГП даного напівкристалічного матеріалу показана на Фіг. 4B. Даний матеріал має нижчий ступінь кристалічності, ніж матеріал з Прикладу 7. Вміст води за даними аналізу методом Карла-Фішера становить 6,2 %. МС + + (співвідношення маси і заряду): 705,4 [M+1] , 334,2 [C16H20N3O5] , 187,9 (100 %). Приклад 9: Визначення відсотка кристалічності кальцієвої солі D-iGlu-D-Trp за допомогою методу рентгеноструктурного аналізу порошку. Загальний ступінь кристалічності, виміряний за допомогою техніки РГП, забезпечує додаткову корисну інформацію для фармацевтичних матеріалів, які містять будь-який аморфний матеріал, утворений в ході синтезу. Вона також є придатним показником з точки зору контролю довгострокових змін в кристалічних матеріалах. Не будучи пов'язаним з будь-якими конструктивними і композиційними властивостями, показник "відсоток кристалічності" може бути придатним індикатором стабільності конкретного матеріалу як функція часу. Відсоток кристалічності звичайно вимірюють як співвідношення між частиною дифракції кристалічної частини зразка, IC, і повною дифракцією того ж зразка, IC+B. Значення IC можуть бути одержанні після відповідного віднімання розсіяної частини від фону, IB. Для такого виду аналізів, дифракцію вимірюють як загальну площу під кривою: - суцільного зразка, одержаного в результаті синтезу (дані можна коректувати з урахуванням повітряного розсіювання) — ITOTAL, - тільки піки (IC) після віднімання фону (корекція з урахуванням повітряного розсіювання), - тільки основа з корекцією з урахуванням повітряного розсіювання — (IB). C ,% 45 50 55 Ic I total 100 , де: Itotal=Ic+Ib. Слід зазначити, що таке вимірювання не рекомендується як стандартизоване через те, що дуже складно (практично неможливо) порівняти міжлабораторні результати. Кожен дифракторметр має свій власний масштаб рівня фону і висоти піку, а також площі під кривою в залежності від багатьох інструментальних факторів, а також від факторів підготовки зразка. Описаний вище підхід можливий здебільшого для дифракторметрів "точка-детектор", в яких детектор переміщується із синхронізованою швидкістю, в 2 рази більшою, ніж швидкість переміщення зразка, для того, щоб гарантувати постійне співвідношення θ/2θ. Однак, в даному дослідженні, у зв'язку з технічними проблемами системи дифракції "точкадетектор" D5000, всі зразки були проаналізовані на системі D8, обладнаній 2D детектором площі, і вищенаведений підхід не міг бути застосований. Таким чином, була розроблена інша техніка вимірювання кристалічності зразків, проаналізованих на такій системі. Вибрана тільки вузька частина 2D зображення дифракції з одинарним піком в центрі і суміжній області, де вимірюватиметься фон. 18 UA 106580 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зразки, одержані в Прикладі 8, демонструють % кристалічності приблизно 18–20 %, тоді як зразки, одержані за способом з Прикладу 7, демонструють діапазон % кристалічності приблизно 25–50 %. Відсоток кристалічності зразка може бути покращений, якщо зразок розчинити у воді. Нерозчинні частинки відфільтровують, і твердій речовині дозволяють повільно осаджуватися з розчину. Всі зразки були виміряні для обчислення їх кристалічності з використанням вузького діапазону 21–25° з найсильнішим віддзеркаленням при 13°. Фон віднімали як лінійний, і використовували емпіричний коефіцієнт кореляції 2,5. Як було вказано вище, результати, одержані таким чином для кристалічності напівкристалічних зразків, не слід розглядати, як абсолютні. Жоден із зразків даного структурного типу не виявляє кристалічного порядку, достатньо високого для того, щоб розглядатися як абсолютний еталон. У Прикладах 7 і 8 одержана кальцієва сіль тімодепресину (1:2) з різним відсотком кристалічності. Приклад 10: Одержання моно-трет-бутиламінової солі D-ізоглутаміл-D-триптофану (1:1) з D-ізоглутамілD-триптофану і трет-бутиламіну. А. До суспензії D-iGlu-D-Trp (1,00 г, 3,00 ммоль) в 25 мл демінералізованої води додають 0,7 мл (2,22 екв.) трет-бутиламіну при кімнатній температурі. Реакційна суміш залишається прозорою, і pH розчину становить приблизно 9. Після перемішування при кімнатній температурі протягом 1 години додають ізопропанол, і леткі матеріали видаляють у вакуумі. Тверду речовину, що залишилася, суспендують в ацетоні і відокремлюють вакуумною фільтрацією. Тверду речовину сушать у вакуумі при температурі 40 °C протягом ночі з одержанням 1,16 г 1 (вихід 95 %) моносолі аміну. Дані H ЯМР підтвердили, що продукт являє собою моноадитивну 1 сіль. РГП підтвердила, що даний матеріал є аморфним. H ЯМР (D2O) δ: 7,71 (д, J=8,6 Гц, 1H), 7,39 (д, J=8,1 Гц, 1H), 7,13-7,16 (м, 2H), 7,07 (т, J=7,6 Гц, 1H), 4,48 (дд, J=8,3, 4,9 Гц, 1H), 3,44 (т, J=6,4 Гц, 1H), 3,28 (дд, J=14,8, 4,7 Гц, 1H), 3,02 (дд, J=14,7, 8,7 Гц, 1H), 2,18-2,26 (м, 2H), 1,7614 1,97 (м, 2H) і 1,26 (с, 9H). N-ЯМР (D2O) δ (проміле): 40,2 (ш) і 56,3 (с), *NH 4NO3 застосовували як зовнішній стандарт з встановленням опорного сигналу на рівні 20,689 проміле. Вміст води за даними аналізу методом Карла-Фішера становить 4,0 %. МС (співвідношення маси і заряду): + + 407,3 [M+1] (слабкий), 334,2 [C16H20N3O5] , 187,9 (100 %). ІЧ спектр показаний на Фіг. 6. УФ (вода, з = 34,8 мкМ, λmax нм): 220 (ε 31067), 280 (ε 5112). B. До суспензії D-iGlu-D-Trp (1,00 г, 3,00 ммоль) в 25 мл демінералізованої води додають 0,31 мл (1,0 екв.) трет-бутиламіну при кімнатній температурі (RT). Реакційна суміш залишається прозорою, і pH розчину становить приблизно 9. Після перемішування при кімнатній температурі протягом 1 години додають ізопропанол, і леткі матеріали видаляють у вакуумі. Тверду речовину суспендують в ацетоні, і нерозчинні частинки відокремлюють вакуумною фільтрацією. Тверду речовину сушать у вакуумі при температурі 40 °C протягом ночі з одержанням 1,16 г 1H (вихід 95 %) солі аміну. Дані аналізу для даної сполуки (РГП, ЯМР, МС, ІЧФП) подібні до описаних в Прикладі 10A вище. Приклад 11: Одержання солі монотрис(гідроксиметил)амінометану D-ізоглутаміл-D-триптофану (1:1) з Dізоглутаміл-D-триптофану і трис(гідроксиметил) амінометану (TRІS). До суспензії D-iGlu-D-Trp (1,00 г, 3,00 ммоль) в 20 мл демінералізованої води додають розчин 363 мг (1,0 екв.) трис(гідроксиметил)амінометану (TRІS) в 15 мл демінералізованої води при кімнатній температурі. Реакційна суміш залишається прозорою, і pH розчину становить приблизно 7. Після перемішування при кімнатній температурі протягом ночі додають ізопропанол, і леткі матеріали видаляють у вакуумі. Спроби перекристалізувати сполуку з використанням суміші ізопропанол/вода або метанол/діетиловий етер були невдалими. Тверду речовину, що залишилася, суспендують в ацетоні і перемішують при кімнатній температурі протягом 1 години, осад відокремлюють вакуумною фільтрацією. Тверду речовину сушать у 1 вакуумі при температурі 40 °C протягом ночі з одержанням 1,33 г продукту (вихід 97,5 %). H ЯМР (D2O) δ: 7,61 (д, J=7,9 Гц, 1H), 7,41 (д, J=8,1 Гц, 1H), 7,14-7,17 (м, 2H), 7,08 (т, J=7,4 Гц, 1H), 4,48 (дд, J=8,5, 4,8 Гц, 1H), 3,64 (с, 6H), 3,46 (т, J=6,0 Гц, 1H), 3,28 (дд, J=14,8, 4,7 Гц, 1H), 3,02 (дд, J=14,7, 8,7 Гц, 1H), 2,17-2,28 (м, 2H) і 1,74-1,90 (м, 2H). Вміст води за даними аналізу + методом Карла-Фішера становить 3,3 %. МС (співвідношення маси і заряду): 454,9 [M+1] + (слабкий), 334,0 [C16H20N3O5] , 187,9 (100 %). ІЧ спектр показаний на Фіг. 7; УФ (вода, з = 36,4 мкМ, λmax нм): 220 (ε 28373), 280 (ε 4537). Приклад 12: Одержання моно-N-метил-D-глюкаміновой солі D-ізоглутаміл-D-триптофану (1:1) з Dізоглутаміл-D-триптофану і N-метил-D-глюкаміну. 19 UA 106580 C2 5 10 15 20 25 30 До суспензії D-iGlu-D-Trp (1,00 г, 3 ммоль) в 20 мл демінералізованої води додають розчин 586 мг (1,0 екв.) N-метил-D-глюкаміну в 15 мл демінералізованої води при кімнатній температурі. Реакційну суміш перемішують протягом вихідних при кімнатній температурі. Реакційна суміш залишається прозорою, і pH розчину становить приблизно 7. Додають ізопропанол, і леткі матеріали видаляють у вакуумі. Тверду речовину суспендують в ацетоні, і осад, що залишився, відокремлюють вакуумною фільтрацією. Тверду речовину сушать у вакуумі при температурі 40 °C протягом ночі з одержанням продукту з кількісним виходом. РГП 1 підтвердила, що даний матеріал являє собою аморфним. H ЯМР (D2O) δ: 7,61 (д, J=7,9 Гц, 1H), 7,41 (д, J=8,1 Гц, 1H), 7,15-7,18 (м, 2H), 7,08 (т, J=7,5 Гц, 1H), 4,47 (дд, J=8,6, 4,8 Гц, 1H), 3,994,02 (м, 1H), 3,70-3,75 (м, 2H), 3,65-3,68 (м, 1H), 3,54-3,60 (м, 2H), 3,45 (т, J=6,2 Гц, 1H), 3,27 (дд, 14 J=14,8, 4,7 Гц, 1H), 3,02-3,13 (м, 3H), 2,68 (с, 3H), 2,19-2,26 (м, 2H) і 1,75-1,95 (м, 2H). N ЯМР (D2O) δ (проміле): 29,6 і 39,2 (ш накладання), **NH4NO3 застосовують як зовнішній стандарт з встановленням опорного сигналу на рівні 20,689 проміле. Вміст води за даними аналізу + методом Карла-Фішера становить 3,1 %. МС (співвідношення маси і заряду): 529,5 [M+1] , 334,2 + [C16H20N3O5] , 187,9 (100 %). ІЧ спектр показаний на Фіг. 8. УФ (вода, з = 41,2 мкМ, λ max нм): 220 (ε 27341), 280 (ε 4419). Приклад 13 Приклад методики одержання D-ізоглутаміл-D-триптофану, моноамонійної солі (1:1) з H-DiGlu-D-Trp-OH H-D-iGlu-D-Trp-OH (1 г) змішують з гідроксидом амонію (0,55 M, 6 мл). Суміш перемішують; pH суміші становить приблизно 4,5. Розчин гідроксиду амонію (0,55 M) додають по краплях до pH розчину 7,0–7,5. Леткі матеріали видаляють у вакуумі, і масло, що залишилося, змішують з ізопропанолом. Утворюється білий осад. Через 2 години тверду амонійну сіль відокремлюють вакуумною фільтрацією. Тверду речовину сушать до постійної маси (1 г) в глибокому вакуумі протягом 12 годин з одержанням D-ізоглутаміл-D-триптофану, амонійної солі (1:1). Хоча переважні варіанти винаходу описані в даному описі, фахівці в даній області зрозуміють, що можуть бути здійснені варіації без відходу від духу винаходу або контексту доданої формули винаходу. За довіреністю, патентний повірений М.М. Льгова ФОРМУЛА ВИНАХОДУ 1. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану формули I, O O -O O -O NH3+ N H NH M+ I, 35 40 45 50 де M вибрано з групи, що включає калій і літій. 2. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою калій, і сіль знаходиться в аморфній формі. 3. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою калій, і сіль знаходиться в кристалічній формі. 4. Калієва сіль D-ізоглутаміл-D-триптофану за п. 3, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2θ: 9,91, 14,84, 15,81, 18,97, 19,76, 24,04, 24,36, 24,82, 25,48, 27,49, 27,94, 28,42, 30,82, 31,28, 31,69, 32,17, 34,35, 35,81 і 36,96°. 5. Калієва сіль D-ізоглутаміл-D-триптофану за п. 3, яка характеризується рентгенограмою порошку, представленою на Фіг. 1A. 6. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою літій, і сіль знаходиться в аморфній формі. 7. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою літій, і сіль знаходиться в кристалічній формі. 8. Літієва сіль D-ізоглутаміл-D-триптофану за п. 7, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2θ: 13,57, 15,53, 18,71, 20,11, 23,34, 24,1, 25,09, 27,31, 27,72, 28,39, 29,31, 30,19, 31,21, 32,06, 33,05, 33,62 і 37,41°. 20 UA 106580 C2 9. Літієва сіль D-ізоглутаміл-D-триптофану за п. 7, яка характеризується рентгенограмою порошку, представленою на Фіг. 2A. 10. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану формули II, O O -O O -O N H NH3+ B++ NH 2 5 10 15 20 II, де B вибрано з групи, що включає кальцій і магній. 11. Фармацевтично прийнятна сіль за п. 10, в якій В являє собою магній і сіль знаходиться в кристалічній формі. 12. Кристалічна магнієва сіль D-ізоглутаміл-D-триптофану (1:2) за п. 11, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2θ: 12,2, 13,74, 14,84, 16,16, 17,96, 18,52, 18,94, 19,49, 21,05, 21,56, 22,56, 23,36, 24,12, 26,27, 27,65, 28,42, 29,14, 30,55, 31,77, 32,62, 33,26, 35,05, 36,34, 37,22 і 38,05°. 13. Кристалічна магнієва сіль D-ізоглутаміл-D-триптофану (1:2) за п. 11, яка характеризується рентгенограмою порошку, представленою на Фіг. 3A. 14. Фармацевтично прийнятна сіль за п. 10, в якій В являє собою кальцій, і сіль має ступінь кристалічності меншу ніж приблизно 67 % по масі. 15. Кальцієва сіль D-ізоглутаміл-D-триптофану за п. 14, яка має ступінь кристалічності меншу ніж приблизно 50 %. 16. Кальцієва сіль D-ізоглутаміл-D-триптофану за п. 14, яка має ступінь кристалічності меншу ніж приблизно 25 %. 17. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану формули III, O O -O O -O A+ N H NH3+ NH III, 25 де А вибрана з групи, що включає трет-бутиламоній, трис(гідроксиметил)метиламоній і Nметил-D-глюкoзиламоній. 18. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану за п. 17, в якій А являє собою трет-бутиламоній, і сіль має формулу: 30 O O -O O -O NH3+ NH3+ N H NH 35 причому сіль знаходиться в аморфній формі. 19. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану за п. 17, в якій А являє собою трис(гідроксиметил)метиламоній, і сіль має формулу: 21 UA 106580 C2 O O -O OH O -O NH3+ N H NH3+ OH NH 5 причому сіль знаходиться в аморфній формі. 20. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану за п. 17, в якій А являє собою метил(2,3,4,5,6-пентагідроксигексил)амоній, і сіль має формулу: O O -O HO OH H OH H N+ H3C HO OH O -O N H NH3+ NH 10 OH причому сіль знаходиться в аморфній формі. 21. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули І: O O -O O -O N H NH3+ M+ NH І, 15 де M вибирають з групи, що складається з літію і калію, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом літію або калію у воді; і (б) концентрування розчину до утворення масла і додавання ізопропанолу при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням солі металу формули І. 22. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули II 20 O O -O O -O NH3+ N H B++ NH 2 25 II, де B являє собою кальцій, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом кальцію у воді; і (б) концентрування розчину при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням солі металу формули II. 23. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули II, 22 UA 106580 C2 O O -O O -O N H NH3+ B++ NH 2 5 II, де B являє собою магній, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з етоксидом магнію в ізопропанолі; і (б) концентрування розчину до одержання твердої речовини; змішування розчину з водою; відокремлення нерозчинних частинок фільтрацією; розведення фільтрату водою при перемішуванні для осадження продукту; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням солі металу формули II. 24. Спосіб одержання органічної амонієвої солі D-ізоглутаміл-D-триптофану формули III 10 O O -O O -O NH3+ A+ N H NH III, 15 20 де А вибирають з групи, що складається з трет-бутиламонію, трис(гідроксиметил)метиламонію і метил(2,3,4,5,6-пентагідроксигексил)амонію, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з органічним аміном у воді, де органічний амін вибирають з групи, що складається з трет-бутиламіну, N-метилглюкозаміну і трометаміну; і (б) концентрування розчину шляхом сумісного випаровування з ізопропанолом; додавання ацетону для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням органічної амонієвої солі формули III. 25. Спосіб одержання D-ізоглутаміл-D-триптофану формули IV M+ O O M+ -O O O NH2 N H NH IV, 25 30 де M являє собою натрій, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом натрію у воді; і (б) концентрування розчину до утворення масла і додавання ізопропанолу при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням сполуки формули IV. 26. Спосіб сольового обміну для фармацевтично прийнятної солі D-ізоглутаміл-Dтриптофану, представленою загальною формулою І, 23 UA 106580 C2 O O -O O -O N H NH3+ M+ NH І, де M вибирають з групи, що складається з літію і калію, причому вказаний спосіб включає: (а) реакцію амонієвої солі, представленої формулою VII, 5 O O -O O -O N H NH3+ NH NH4+ VII 10 у водному розчині з 1 еквівалентом гідроксиду металу, представленим формулою MOH, де M є таким, як визначено вище; і (б) випаровування розчинника з одержанням твердої речовини, яку перемішують з водою і ізопропанолом з одержанням сполуки формули I. 27. Спосіб сольового обміну для фармацевтично прийнятної солі D-ізоглутаміл-Dтриптофану, представленої загальною формулою II, O O -O O -O N H NH3+ B++ NH 2 15 II, де B вибирають з групи, що складається з кальцію і магнію, причому вказаний спосіб включає: (а) реакцію амонійної солі, представленої формулою VII, 20 O O -O O -O NH3+ N H NH NH4+ VII 25 у водному розчині з приблизно 0,5 еквівалента гідроксиду металу формули B(OH) 2, де B є таким, як визначено вище; і (б) випаровування розчинника з одержанням твердої речовини, яку перемішують з водою і ізопропанолом з одержанням сполуки формули II. 28. Спосіб за п. 26, в якому М являє собою калій, MOH являє собою гідроксид калію, і сполука представлена наступною формулою: 24 UA 106580 C2 O O -O O O N H NH3+ NH K+. 29. Спосіб за п. 26, в якому М являє собою літій, MOH являє собою гідроксид літію, і сполука представлена наступною формулою: 5 O O -O O O N H NH3+ NH Li+. 30. Спосіб за п. 27, який відрізняється тим, що B являє собою магній, B(OH) 2 являє собою гідроксид магнію, і сполука представлена наступною формулою: 10 O O -O O -O N H NH3+ Mg++ NH 2 . 31. Спосіб за п. 27, в якому В являє собою кальцій, B(OH) 2 являє собою гідроксид кальцію, і сполука представлена наступною формулою: 15 O O -O O -O NH3+ N H Ca++ NH 2 20 . 32. Фармацевтична композиція, яка відрізняється тим, що містить фармацевтично прийнятну сіль за пп. 1, 10, 17, 18 або 19. 33. Спосіб одержання фармацевтичної композиції, який відрізняється тим, що включає об'єднання фармацевтично прийнятної солі за пп. 1, 10, 17, 18 або 19 з як мінімум одним фармацевтично прийнятним носієм. 34. Застосування фармацевтично прийнятної солі за пп. 1, 10, 17, 18 або 19 без хроматографічного очищення у фармацевтичній композиції. 25 25 UA 106580 C2 ФОРМУЛА ВИНАХОДУ 1. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану формули I: O O -O O -O N H NH3+ NH 5 10 15 20 25 ,I де M вибрано з групи, що включає калій і літій. 2. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою калій і сіль знаходиться в аморфній формі. 3. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою калій і сіль знаходиться в кристалічній формі. 4. Калієва сіль D-ізоглутаміл-D-триптофану за п. 3, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2: 9,91, 14,84, 15,81, 18,97, 19,76, 24,04, 24,36, 24,82, 25,48, 27,49, 27,94, 28,42, 30,82, 31,28, 31,69, 32,17, 34,35, 35,81 і 36,96°. 5. Калієва сіль D-ізоглутаміл-D-триптофану за п. 3, яка характеризується рентгенограмою порошку, представленою на фіг. 1A. 6. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою літій і сіль знаходиться в аморфній формі. 7. Фармацевтично прийнятна сіль за п. 1, в якій М являє собою літій і сіль знаходиться в кристалічній формі. 8. Літієва сіль D-ізоглутаміл-D-триптофану за п. 7, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2: 13,57, 15,53, 18,71, 20,11, 23,34, 24,1, 25,09, 27,31, 27,72, 28,39, 29,31, 30,19, 31,21, 32,06, 33,05, 33,62 і 37,41°. 9. Літієва сіль D-ізоглутаміл-D-триптофану за п. 7, яка характеризується рентгенограмою порошку, представленою на фіг. 2A. 10. Фармацевтично прийнятна сіль D-ізоглутаміл-D-триптофану формули II, O O -O O -O NH3+ N H NH 30 35 40 M+ B++ 2 , II де B вибрано з групи, що включає кальцій і магній. 11. Фармацевтично прийнятна сіль за п. 10, в якій В являє собою магній і сіль знаходиться в кристалічній формі. 12. Кристалічна магнієва сіль D-ізоглутаміл-D-триптофану (1:2) за п. 11, яка характеризується піками на рентгенограмі порошку з наступними значеннями 2: 12,2, 13,74, 14,84, 16,16, 17,96, 18,52, 18,94, 19,49, 21,05, 21,56, 22,56, 23,36, 24,12, 26,27, 27,65, 28,42, 29,14, 30,55, 31,77, 32,62, 33,26, 35,05, 36,34, 37,22 і 38,05°. 13. Кристалічна магнієва сіль D-ізоглутаміл-D-триптофану (1:2) за п. 11, яка характеризується рентгенограмою порошку, представленою на фіг. 3A. 14. Фармацевтично прийнятна сіль за п. 10, в якій В являє собою кальцій і сіль має ступінь кристалічності, менший ніж приблизно 67 % по масі. 15. Кальцієва сіль D-ізоглутаміл-D-триптофану за п. 14, яка має ступінь кристалічності, менший ніж приблизно 50 %. 16. Кальцієва сіль D-ізоглутаміл-D-триптофану за п. 14, яка має ступінь кристалічності, менший ніж приблизно 25 %. 17. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули І: 26 UA 106580 C2 O O -O O -O N H NH3+ M+ NH 5 ,І де M вибирають з групи, що складається з літію і калію, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом літію або калію у воді; і (б) концентрування розчину до утворення масла і додавання ізопропанолу при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням солі металу формули І. 18. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули II O O -O O -O N H NH3+ B++ NH 10 2 , II де B являє собою кальцій, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом кальцію у воді; і (б) концентрування розчину при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням солі металу формули II. 19. Спосіб одержання солі D-ізоглутаміл-D-триптофану з металом формули II, O O -O O -O NH3+ N H B++ NH 15 20 25 30 2 , II де B являє собою магній, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з етоксидом магнію в ізопропанолі, таким чином формуючи розчин; і (б) концентрування розчину до одержання твердої речовини; (в) змішування твердої речовини з водою; (г) відокремлення нерозчинних частинок фільтрацією, таким чином утворюючи фільтрат; (д) розведення фільтрату водою при перемішуванні для осадження продукту; (е) відокремлення продукту; і (є) висушування продукту у вакуумі з одержанням солі металу формули II. 20. Спосіб одержання D-ізоглутаміл-D-триптофану формули IV M+ -O O O M+ O O N H NH2 NH , IV де M являє собою натрій, причому вказаний спосіб включає: (а) реакцію D-ізоглутаміл-D-триптофану з гідроксидом натрію у воді; і (б) концентрування розчину до утворення масла і додавання ізопропанолу при перемішуванні для кристалізації солі; відокремлення утвореного осаду; і висушування продукту у вакуумі з одержанням сполуки формули IV. 27 UA 106580 C2 21. Спосіб сольового обміну для утворення фармацевтично прийнятної солі D-ізоглутаміл-Dтриптофану, представленої загальною формулою І, O O -O O -O N H NH3+ NH 5 ,І де M вибирають з групи, що складається з літію і калію, причому вказаний спосіб включає: (а) реакцію амонієвої солі, представленої формулою VII: O O -O O -O N H NH3+ NH 10 O -O O -O N H NH3+ NH B++ 2 , II де B вибирають з групи, що складається з кальцію і магнію, причому вказаний спосіб включає: (а) реакцію амонійної солі, представленої формулою VII: O O -O O -O NH3+ N H NH 20 NH4+ , VII у водному розчині з 1 еквівалентом гідроксиду металу, представленим формулою MOH, де M є таким, як визначено вище; (б) випаровування розчинника з одержанням твердої речовини; і (в) перемішування твердої речовини з водою і ізопропанолом з одержанням фармацевтично прийнятної солі формули I. 22. Спосіб сольового обміну для отримання фармацевтично прийнятної солі D-ізоглутаміл-Dтриптофану, представленої загальною формулою II: O 15 M+ NH4+ , VII у водному розчині з приблизно 0,5 еквівалента гідроксиду металу формули B(OH) 2, де B є таким, як визначено вище; (б) випаровування розчинника з одержанням твердої речовини; і (в) перемішування твердої речовини з водою і ізопропанолом з одержанням фармацевтично прийнятної солі формули II. 23. Спосіб за п. 21, в якому М являє собою калій, MOH являє собою гідроксид калію, і сполука представлена наступною формулою: 28
ДивитисяДодаткова інформація
Автори англійськоюTam, Tim, Fat, N'zemba, Blaise, Leung-Toung, Regis, Wang, Yingsheng, Zhao, Yanqing, Yu, Lily
Автори російськоюТам Тим Фет
МПК / Мітки
МПК: A61K 38/05, A61P 17/06, C07D 209/12, A61K 31/404
Мітки: прийнятні, солі, спосіб, виробництва, фармацевтично, тимодепресину
Код посилання
<a href="https://ua.patents.su/39-106580-farmacevtichno-prijjnyatni-soli-timodepresinu-i-sposib-kh-virobnictva.html" target="_blank" rel="follow" title="База патентів України">Фармацевтично прийнятні солі тимодепресину і спосіб їх виробництва</a>
Попередній патент: Спосіб пакування та зберігання харчових продуктів
Наступний патент: Паливо, одержане з біомаси
Випадковий патент: Феритна корозійностійка сталь












