Спосіб одержання 4′-дезокси-13(s)-дигідро-4′-йододоксорубіцину
Номер патенту: 18246
Опубліковано: 25.12.1997
Автори: Джузеппе Казінеллі, Тереза Бордоні, Джованні Рівола, Серджо Мерлі
Формула / Реферат
1. Способ получения 4'-дезокси-13(S)-дигидро-4'-йододоксорубицина формулы
заключающийся в том, что штамм Streptomyces peucetius DSM 2444 культивируют в аэробных условиях в питательной среде, содержащей источники азота и углерода и минеральные соли, в присутствии 4'-дезокси-4'-йододоксирубицина в форме его хлоргидрата в конечной концентрации 0,1мг/мл среды при температуре 27 - 30°C, полученную культуральную жидкость разделяют, отделенный мицелий экстрагируют ацетоном, а жидкую фазу - смесью дихлорметана и метанола в объемном соотношении 9 : 1 при pH 8,0, далее полученные экстракты объединяют и концентрируют при пониженном давлении до сухого состояния, затем концентрат растворяют в дихлорметане и хроматографируют на колонке из силикагеля, забуференного до pH 7,0, элюируют последовательно смесью дихлорметана, метанола и воды при объемном соотношении 95 : 5 : 0,25 и 90 : 10 : 0,5 соответственно, полученный второй элюат концентрируют в присутствии н-пропанола, выделяют целевой продукт и переводят в форму его хлоргидрата.
2. Способ по п.1, отличающийся тем, что культивирование ведут 3 - 5 дней.
Текст
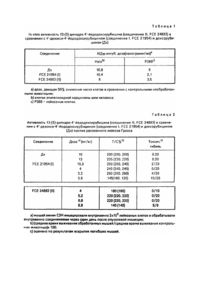
Изобретение относится к микробиологической промышленности, в частности производству антибиотиков. Для осуществления способа используют штамм Streptomyces peucetius M 87 F.1. Штамм получен селекцией путем воздействия на исходный штамм S.peucetius подвида aureus ATCC 31428 нитрозогуанидином. Штамм зарегистрирован под каталожным номером DSM 2444 в немецкой коллекции микроорганизмов, Западная Германия. Штамм применяют для стереоселективного восстановления функциональной группы кетона в 13-положении 4'-дезокси-4'-йододоксорубицина: с получением специфически 4'-дезокси-13-(S)дигидро-4'-йододоксорубицина, одного из двух возможных при С-13 стереоизомерных 4'-дезокси13-дигидро-4'-йододоксорубицинов. Новое соединение формулы (II), называемое далее как FCE 24883, является полезным в качестве противоопухолевого средства и проявляет активность на экспериментальных опухолях, сравнимую с активностью 4'-дезоксо-4'йододоксорубицина формулы (I). С убстратом для микробного стереоселективного восстановления является полусинтетический аналог доксорубицина. Получают целевой продукт формулы Морфология мутантного штамма M 87 F.1, не отличается от таковой материнского штамма S.peucetius АТСС 31428, в то время как обе культуры четко различаются по своим культуральным и биохимическим характеристикам. Так, мутантный штамм M 87 F.1, не продуцирует на агаровой среде от соломенножелтого до лимонно-желтого растворимого пигмента, который является характерным для материнского штамма S.peucetius АТСС 31428. Кроме того, мутантный штамм M 87 F.1, может избирательно превращать соединение (I) в соединение (II), тогда как материнский штамм S.peucetius АТСС 31428 не избирателен в этом отношении. Это свойство мутанта M 87 F.1, делает его высоко полезным, как описано в заявке. Стереоизбирательное биопреобразование может быть осуществлено в размножающейся культуре S.peucetius штамм M 87 F.1, при добавлении соединения (I) в качестве субстрата в культуральную среду в инкубационном периоде. Соединение (I) может быть добавлено в форме гидрохлорида после солюбилизации в стерильной дистиллированной воде. Культуру выращивают в питательней среде, содержащей источник углерода, например усваиваемый углевод, и источник азота, т.е. усваиваемое соединение азота или белковый материал. Предпочтительные источники углерода включают глюкозу, сахарозу, глицерол, крахмал, кукурузный крахмал, декстрин, мелассу и тому подобные. Предпочтительные источники азота включают настой от замачивания зерна, дрожжевой экстракт, пивные дрожжи, соевую муку, муку из семян хлопка, кукурузную мук у, казеин, рыбную муку, сухие остатки дистилляции, животный пептон, мясной экстракт, соли аммония и др. Может быть выгодно использовано сочетание таких источников углерода и азота. Процесс биопревращения может длиться примерно от 72 часов до 8 дней. Инкубационная температура в процессе биопревращения может быть в интервале примерно от 25°C до 37°C, предпочтительно 29°C. Содержимое бродильных сосудов аэрируют взбалтыванием при 250 оборотах в минуту или перемешиванием стерилизованным воздухом, чтобы способствовать росту микроорганизма и таким образом повысить эффективность процесса превращений. Ход реакции микробного превращения контролируют взятием образцов бродильной среды при различных временных интервалах и экстракцией при pH 0,0 смесью дихлорметан метанол в отношении 9 : 1. Когда пробу органического экстракта подвергают тонкослойной хроматографии, используя в качестве элюента смесь хлороформа, метанола, уксусной кислоты и воды в отношении 80 : 20 : 7 : 3 по объему, соединение FCE 24803 (II) появляется при значении Rf среды 0,50, тогда как 4-дезоксн-4йододоксорубицин (I) находят при Rf 0,60. Количественное определение двух антрациклинов может быть осуществлено после тонкослойной хроматографии с упомянутой выше элюирующей системой, соскабливанием и вымыванием метанолом соответствующи х зон с красным окрашиванием и конечным спектрометрическим определением при 496 нанометрах. Весь ферментационный бульон, в котором соединение (I) подвергается превращению в соединение FCE 24883 (II), фильтруют с помощью диатомовой земли. Отфильтрованный красный мицелий экстрагируют смешивающимся с водой органическим растворителем, таким как метанол и другие низшие спирты, диоксан, ацетонитрил и предпочтительно ацетон. Экстракты мицелия собирают, концентрируют при пониженном давлении и объединяют с профильтрованной ферментационной жидкостью, устанавливают pH 8,0, затем экстрагируют несмешивающимся с водой органическим растворителем, таким как нбутанол, хлороформ, дихлорметан или предпочтительно смесь дихлорметан - метанол в отношении 9 : 1. Органические экстракты содержат соединение FCE 24883 (II) вместе с соединением (I) и небольшими количествами други х продуктов разложения. Органический экстракт концентрируют при пониженном давлении досуха и оста ток растворяют в дихлорметане и хроматографируют на колонке силикагеля, стабилизированного буфером с pH 7,0, градиентом смеси дихлорметан - метанол - вода. Соединение (I) вымывают первым смесью в отношении 95 : 5 : 0,25, затем соединение FCE 24883 (II) смесью в отношении 90 : 10 : 0,5. Из объединенных фракций после промывки водой, концентрирования до небольших объемов в присутствии н-пропанола, добавления эквивалента хлористоводородной кислоты и избытка н-тексана, получают преципитат чистого FCE 24883 (II) в виде гидрохлорида агликону. Селективная жидкостная хроматография высокого давления позволяет разделить (два максимума с временем задержки 18,8 и 10,3 минут) два стереоизомерных спирта при С-13, присутствующи х в образце синтетического 4'дезокси-13-дигидро-4'-иододоксорубицина, полученного восстановлением йода боргидридом натрия. Используя тот же метод жидкостной хроматографии высокого давления, получают соединение FCE 24883 (II) как отдельный пик с временем задержки 19,3 минуты, соответствующим времени медленно движущейся составляющей синтетического 13дигидропроизводного. Метод жидкостной хроматографии высокого давления. Колонка: две секции RP сферисорб разделение фаз Великобритания) размером 150 ´ 4,5мм, соединенные в ряд; температура 45°C; мобильная фаза 0,05М водного подкисленного до pH 3,0 смесью - метанол в отношении 80 : 2 по объему; подвижная фаза метанол; проявление, изократное за 30 минут FCE 24883 (II) как свободное основание растворимо в полярных органических растворителях и водных спиртах, тогда как его гидрохлорид (III) растворим в воде, но мало растворим в органических растворителях. Гидрохлорид соединения CE 24883 имеет следующие физико-химические свойства: Точка плавления: 200°C (разлагается): удельное вращение [a]D29 + 188° (c = -0,05, метанол). Спектр поглощения и УФ и видимой области: 232, 254, 290 и 480 нанометров ИК-спектр (KBr): пики при следующи х частотах: 3400, 2970, 2920, 1610, 1580, 1472, 1440, 1410, 1380, 1355, 1320, 1280, 1235, 1210, 1110, 1080, 1050, 1030, 1010, 985, 965, 940, 920, 900, 890, 870, 860, 830, 810, 785, 755, 730, 710, 540, 480, 450 и 415см -1: Спектр ЯМР на ядрах 200МГц, 22°C) млн.д: 14,03 (широкий синглет, молекулярная формула: в эквиваленте к свободному основанию: 656 655 и 410 соответствующие скорость потока 0,6мл/мин; детектирование: 254 нанометра. Кислотный гидролиз соединения (II) (0,2н. хлористоводородная кислота, 80°C, 30 минут) дает красный осадок соответствующего агликона, тогда как сахарная компонента, а именно 3-амино2,3,4,6-тетрадезокси-4-иодликсогексогексоза, присутствует в водной фазе и идентифицирована в сравнении с аутентичным образцом, полученным при кислотном гидролизе соединения (I). Цитотоксическую активность соединения FCE 24883 испытывают in vitro на клетках Hela и P 388 в сравнении с соединением (I) и доксорубицином. Выявлено, что соединение (II) не менее активное, чем 4'-дезокси-4'-йододоксорубицин (I) и доксирубицин (табл.1). Активность in vivo соединения FCE 24883 (II) испытывают против рассеянного лейкоза Гросса. Мышам линии вводят внутривенно иньекцию 2 × 106 клеток на мышь, обрабатывают соединениями и изучают 24 часа после опухолевой инъекции. При оптимальной дозе соединение FCE 24883 (II) более активное, чем доксорубицин, и такое же активное, как 4'-дезокси-4'-йододоксорубицин (I), с малой токсичностью, проявленной при активных дозах. Противоопухолевую активность соединения (II), оцененную как среднее время выживания обработанных животных над контрольными мышами, можно сравнить с активностью соединения (I) и доксорубицина (табл.2). Способ иллюстрируется следующими примерами. Пример 1. Культур у микроорганизма Streptomyces peucetius штамм M 87 F.1, (D М 2444) выращивают 14 дней при 28°C на скощенном агаре следующей поддерживающей среды (Среда глюкоза 3%, пивные дрожжи 1,2%: 0,1%; 0,05%, 0,1%; 0,005%; 0,0005%; 0,0005%; 0,0005%; агар 2%, водопроводная вода до 100мл, pH 0,7. Стерилизацию проводят нагреванием в автоклаве в течение 20 минут. Споры выращенной культуры собирают и суспендируют в 3мл стерильной дистиллированной воды. Этой суспензией засевают 60мл жидкой питательной среды, содержащейся в 300мл колбах Эрленмейера: пивные дрожжи 0,3%, пептон 0,5%, 0,05%, водопроводная вода до 100мл. Стерилизацию проводят нагреванием в автоклаве при 120°C в течение 20 минут. pH этой среды после стерилизации устанавливают между 6,8 и 7,0. Инокулированные колбы встряхивают два дня при температуре 28°C на роторной мешалке при 250об/мин, описывающей окружность диаметром 7см. 1,5мл культуры, выращенной описанным способом, высевают в 300мл колбы Эрленмейера, содержащие 50мл следующей биотрансформирующей среды: дрожжевой экстракт 1,5%, 0,25%, глюкоза 1,5%, водопроводная вода до 100мл, pH 6,9. Стерилизацию проводят нагреванием в автоклаве при 115°C в течение 20 минут. Раствор глюкозы стерилизуют отдельно и добавляют к каждой стерилизованной колбе в нужной концентрации. Затем содержимое колб инкубируют при 28°C в условия х, описанных для фазы посева, в течение 24 часов. В это время в каждую колбу добавляют по 1,0мл раствора соединения (I) в стерилизованной воде в концентрации 5мг/мл. Встряхиваемые колбы инкубируют еще два дня и получают 70% - ое превращение соединения (I) в соединение (II). Пример 2. Культур у микроорганизма S.peucetius штамм M87 F.1, выращивают на твердой питательной среде, как описано в примере 1. Споры трех скошенных агаров объединяют и собирают в 10мл стерильной дистиллированной воды. Полученную таким образом суспензию высевают в 2 - х опрокидывающиеся колбы с круглым дном, содержащие 500мл посевной среды, описанной в примере 1. Колбу инкубируют 48 часов на роторной мешалке, вращающейся со скоростью 120об/мин и описывающей окружность диаметром 7см, при температуре 28°C. Весь посевной материал инокулируют в 10л бродильный чан из нержавеющей стали, содержащий 7,5л биотрансформирующей среды, описанной в примере 1 и стерилизованной водяным паром при 120°C в течение 30 минут. Раствор глюкозы стерилизуют отдельно и добавляют в стерилизованный бродильный чан в соответствующей концентрации. Культуру выращивают при 28°C при помешивании с 230об/мин и аэрации потоком воздуха со скоростью 1л/л среды/мин. Через 48 часов добавляют субстратное соединение в концентрации, описанной в примере 1, и после инкубирования культуры в течение 3 - х дней получают 60% - ную конверсию соединения (I) в соединение (II). Пример 3. Цельное сусло (5л) из ферментации, полученной по примеру 2, фильтруют с использованием 2% диатомовой земли в качестве фильтра. Влажный осадок на фильтре экстрагируют ацетоном (3л). После фильтрации проводят две дополнительных экстракции ацетоном для достижения полного выделения красных пигментов. Объединенные ацетоновые экстракты концентрируют при пониженном давлении и концентрат (1л) объединяют с профильтрованным бульоном и исчерпывающе экстрагируют при pH 8,0 смесью дихлорметан - метанол в отношении 9 : 1. Органический экстракт, содержащий соединения (I) и (II) с теми же продуктами распада, концентрируют досуха при пониженном давлении. Остаток, растворенный в дихлорметане, хроматографируют на колонке силикагеля, стабилизированного буфером с pH 7,0 (М/15 фосфа тный буфер), градиентом смеси дихлорметан - метанол - вода. После вымывания некоторых продуктов распада элюируют соединение I смесью в отношении 95 : 5 : 0,25 с последующим элюированием соединения FCE 24883 (II) смесью в отношении 90 : 10 : 0,5. Из объединенных фракций после промывки водой, концентрации до небольшого объема в присутствии н-пропанола, добавления одного эквивалента хлористоводородной кислоты и избытка н-гексана получают чистое соединение FCE 24883 (II) 0,30, 60% - ный выход, в форме гидрохлорида (т.пл. 200°C, разлагается). Повторяя процесс, выделяют также нетрансформированное соединение 1 (0,13г, 26%) в виде гидрохлорида. Пример 4. Образец соединения FCE 24833 (II) 200мг растворяют в 0,2н. водной хлористоводородной кислоте (50мл) и нагревают 30 минут при 100°C. Кристаллический красный осадок (0,12г) агликона собирают фильтрацией, промывают водой и сушат. Масс-спектр: Агликон идентифицирован как дигидроадриамицинон аутентичным образцом. сравнением с
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of 4-deoxy-13(s)-dihydro-4-iodofuricine production
Назва патенту російськоюСпособ получения 4'-дезокси-13(s)-дигидро-4'-йододоксорубицина
МПК / Мітки
МПК: C12R 1/465, C12P 1/06, G01N 33/48
Мітки: 4'-дезокси-13(s)-дигідро-4'-йододоксорубіцину, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/4-18246-sposib-oderzhannya-4-dezoksi-13s-digidro-4-jjododoksorubicinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 4′-дезокси-13(s)-дигідро-4′-йододоксорубіцину</a>
Попередній патент: Спосіб контролю якості з’єднань у процесі контактного стикового зварювання
Наступний патент: Спосіб одержання кристалів дигідрата гідрохлориду ондансетрона зменшеного розміру
Випадковий патент: Спосіб підготовки важкохворих до відеоколоноскопії