Спосіб одержання монохлормалеїнового ангідриду
Номер патенту: 3048
Опубліковано: 26.12.1994
Автори: Пятницький Юрій Ігоревич, Давиденко Ірина Вікторівна, Страшненко Анатолій Вікторович, Новіков Іван Миколайович, Білокопитов Юрій Васильович
Формула / Реферат
Способ получения монохлормалеинового ангидрида окислением хлорпроизводного бензола молекулярным кислородом на катализаторе эмпирической формулы:
V79MOaB3,8PNa3,9O6
где: а = 4 - 33,2
б - количество атомов кислорода, соответствующее числу и валентности входящих элементов, отличающийся тем, что в качестве хлорпроизводного используют произвольную смесь двух или треизомеров дихлорбензола при их суммарной концентрации в воздухе 3,6- 10-4 - 5,8- 10-4 моль/л. и процесс ведут при температуре 350-470°С и объемной скорости 1164-4500 час-1.
Текст
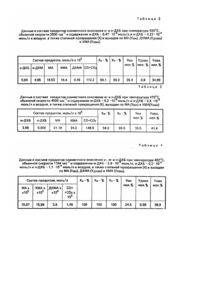
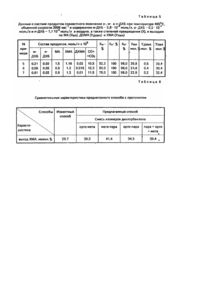
Изобретение относится к органическому синтезу, в частности к способам получения монохлормалеинового ан гидрида (ХМА), который является ценным полупродуктом для синтеза фунгицидов, инсектицидов и други х биологически активных веществ. Известен способ получения ХМА [1], сущность которого заключается в том, что через смесь 898 г малеинового ангидрида (МА) и 2,45 г безводного FeCl3 пропускают 55 минут газообразный хлор при температуре 185-190°С, заем добавляют 3,4 г ВаСІ2 и выдерживают 1 час, получают 129 г смеси, содержащей 95-96% ХМА. К недостаткам известного способа следует отнести то, что синтез ХМА является длительным и многостадийным; при его осуществлении применяют газообразный хлор, вызывающий коррозию оборудования. Способ не позволяет вести непрерывный процесс. Известен способ получения ХМА [2], заключающийся в том, что через смесь МА и FеСІ3 пропускают газообразный хлор, получают ангидрид дихлорянтарной кислоты, при дегидрохлорировании которого образуется ангидрид монохлормалеиновой кислоты, затем хлорируют до ангидрида трихлорянтарной кислоты с последующим дегидрохлорированием до дихлормалеинового ангидрида (ДХМА). Недостатки способа заключаются в том, что синтез ХМА является длительным и многостадийным; при его осуществлении применяют газообразный хлор, вызывающий коррозию оборудования, способ не позволяет вести непрерывный процесс. Наиболее близким по технической сущности к заявляемому способу является ^способ получения ХМА из хлорбензола [3]. Сущность способа заключается в том, что поры хлорбензола контактируют с многокомпонентным ванадиймолибден-фосфор-оксидным катализатором эмпирической формулы \/79 MoaB3,8PNa3,9Oб , где а -=5,5 - 33,2 и б количество атомов кислорода, соответствующее числу и валентности входящи х элементов, через который пропускают реакционную смесь. Реакционная смесь содержит пары хлорбензола в воздухе при концентрации 8,4•10-4 - 2,0•10-4 моль/л, при температуре 390-400°С и объемной скорости 5000-11200 час-1. Оптимальный выход по ХМА составляет 29,7 мол. % при температуре 395°С, объемной скорости 5115 час-1 и концентрации хлорбензола в воздухе 16•10-4 моль/л. К недостаткам способа следует отнести невысокий выход по ХМА. Задачей данного изобретения является разработка способа получения ХМА, который, за счет использования нового хлорпроизводного бензола в качестве исходного вещества, позволяет увеличить выход целевого продукта. Поставленная задача решается тем, что в заявляемом способе ХМА получают каталитическим окислением хлорпроизводного бензола молекулярным кислородом над катализатором эмпирической формулы \/79 MoaB3,8PNa3,9 Oб , где: а = 4-33,2; б - количество атомов кислорода, соответствующее числу и валентности входящи х элементов, согласно изобретения, в качестве хлорпроизводного бензола используют произвольную смесь двух или трех изомеров дихлорбензола при их суммарной концентрации в воздухе 3,6•10-4-5,8•10-4 моль/л и процесс ведут при температуре 350-470°С с объемной скоростью 1164-4500 час-1. Кроме основного продукта - ХМА - в выходящей из реактора смеси имеются МА, ДХМА, оксиды углерода, хлористый водород и пары воды. Когда степень превращения изомеров дихлорбензола была ниже 100%, в выходящей из реактора смеси имеется также не прореагировавшие изомеры дихлор.бензола. Изобретение иллюстрируют следующие примеры. Пример 1. Катализатор, содержащий оксиды ванадия, молибдена, бора, фосфора и натрия в весовом соотношении V2O5:MoO 3:B2 O3 :P2O 5:Na2O = 72,56 :22,19 ::1,32 : 0,72:1,21, готовят следующим образом. 4,82 г ванадата аммония NH4YO 3 и 1,53 г молибдата аммония (NН4)6Мо7 O24•4Н2О растворяют в 50 мл концентрированной соляной кислоты (раствор I). 0,187 г натрия фосфорнокислого двузамещенного Na2HPO4 •12Н2O и 0.187 г натрия тетраборнокислого Na2B4O7•10H2O растворяют в 50 мл дистиллированной воды (раствор 2). Затем растворы 1 и 2 сливают вместе и упаривают при перемешивании. Остаток прогревают при температуре 300°С 4 часа, затем - 8 часов при 450°С в потоке воздуха. Полученный продукт растирают в порошок, таблетируют, измельчают и просеивают, берут фракцию 0,25-0,5 м. Получают катализатор, состав которого соответствует эмпирической формуле V79 Mo16.6B 3,8PNa3.9О 257.4 (катализатор А). Процесс ведут на установке проточного типа в реакционной трубке из нержавеющей стали с внутренним диаметром 6 мм и длиной 200 мм. В трубку загружают 0,5 г (0,4 мл) катализатора. Реактор с катализатором нагревают до 350°С и пропускают через него реакционную смесь, состоящую из 1,8•10-4 моль/л о-ДХБ и 1,8•10-4 моль/л м-ДХБ в воздухе при объемной скорости 1200 час-1. Продукты, выходящие из реактора после холодильника собираютв сборник, а затем анализируют методом газожидкостной хроматографии. Собранные продукты разделяют перегонкой под вакуумом. Отгоняют вещество с температурой кипения 76-80°С при давлении 8 мм рт. ст. - жидкость желтоватого цвета, которая застывает при температуре близкой к 0°С. Через 10 часов желтоватая жидкость при комнатной температуре переходит в белое твердое вещество с температурой плавления 32-34°С (вещество I). Остаток после перегонки представляет собой белое вещество (ве щество 2). Хроматографический анализ вещества 1, проведенный на колонках, обладающих различной природой носителя (Полисорб-2 и Хроматон -N-Супер с ОУ-101), показал, что вещество 1 не содержит примесей и выходит одним пиком, причем время выхода этого вещества совпадает с временем выхода ХМА. Хроматографический анализ вещества 2 показал, что оно состоит из МА и ДХМА с примесью 0,2-0,5% ХМА. Масс-спектрометрический анализ вещества 1 методом полевой десорбции показал ) наличие в масс-спектре молекулярных масс 132 и 134, причем молекулярной массы 132 больше, чем 134. Эти массы отвечают одно- ^ му и тому же веществу - ХМА; различие масс связано с наличием в природе двух изотопов ) хлора: Сl35 и Сl37. Таким образом, идентификация вещества 1 методом хроматографии и масс-спектрометрии однозначно показывает, что оно является хлормалеиновым ангидридом. Температура плавления ХМА, полученного после отгонки его в вакууме и определенная через 10 часов (после затвердевания желтоватой жидкости и образования белого вещества), равна 33°С. Это значение согласуется с литературными данными о температуре плавления ХМА. ХМА после его перегонки в вакууме представляет собой желтоватую жидкость, затвердевающую при 0°С; затем эта форма ХМА переходит в др угую форму с температурой плавления 34,5°С. Эти данные согласуются с результатами настоящей работы. Полученный после выделения продукт отличается довольно высокой чистотой (не ниже 99,7-99,8%). Результаты исследований приведены в таблице 1. Как видно из таблицы 1 выход по ХМА составляет 39,3 мол. %, что в 1,3 раза выше, чем в прототипе. Пример 2. Процесс совместного окисления о- и п-ДХБ ведут так же, как описано в примере 1, с тем отличием, что температур у реактора поддерживают при 420°С, объемную скорость - 3800 час-1 и подают реакционную смесь, состоящую из 0,47•10-4 моль/л о-ДХБ и 4,23 •10-4 моль/л п-ДХБ в воздухе. Результаты по окислению смеси о-и п-ДХБ приведены в табл.2. Как видно из таблицы 2 выход по ХМА более, чем на 5% выше по сравнению с прототипом (34,89 мол. % против 29,7 мол. %). Пример 3. Процесс совместного окисления м- и п-ДХБ ведут также, как описано в примере 1, с тем отличием, что температуру реактора поддерживают при 470°С, объемную Скорость - 4500 час-1 и подают реакционную смесь состава 5,2•10-4 моль/л м-ДХБ и 0,6•10-4 моль/л п-ДХБ в воздухе. Результаты по совместному окислению м- и п-ДХБ приведены в таблице 3. Как видно из таблицы 3, выход по ХМА составляет 41,4%, ч+о выше в 1,39 раза ло сравнению с прототипом. Пример 4. Процесс совместного окисления м-, о- и п-ДХБ ведут также, как описано в примере 1, с тем отличием, что температур у реактора поддерживают 422°С, объемную скорость - 1164 час-1 и подают реакционную смесь, содержащую м-ДХБ -2,8•10-4 моль/л, о-ДХБ - 0,2•10-4 моль/л и п-ДХБ - 1,1•10-4 моль/л в воздухе. Результаты по совместному окислению о-, м- и п-ДХБ приведены в таблице 4. Из таблица 4 видно, что выход по ХМА при окислении смеси о-, м- и п-ДХБ составляет 38,9 мол. %, что на 9,2% выше, чем по ПООТО ТИПУ (29.7 мол. %). Отметим, что приведенное в примере 4 содержание м-, о- и п-ДХБ в реакционной смеси соответствует и х соотношению в отхода х производства хлорбензола на Днепродзержинском ПО "Азот" (ТУ 6-01-1040-75 "Полихлориды бензола"). Пример 5. Процесс совместного окисления о-, м- и п-ДХБ проводят также, как указано в примере 4, с тем отличием, что температуру реактора поддерживают 465°С и объемную скорость - 3996 час-1. Результаты по совместному окислению о-, м- и п-ДХБ приведены в таблице 5. Пример 6. Катализатор, содержащий оксиды ванадия,.молибдена, бора, фосфора и натрия в весовом соотношении V2O 5:MoO3 :B2 O3:P 2O 5:Na2O = 89,41 :6,67 : 1,62 ; 0,82:1,48, готовят так же, как в примере 1, с тем отличием, что берут 6,466 г ванадата аммония NH4VО3; 0,459 г молибдата аммония (NН4)6 Мо7О 24•4Н2 О; 0,250 г натрия фосфорнокислого двузамещенного Na2HPО4X х12Н2О и 0,248 г натрия тетраборнокислого Na2B4О7 •10Н2О. Состав катализатора отвечает эмпирической формуле V79 Мо4В3,8РNаз,9O 219,6 (катализатор Б). Процесс совместного окисления о-, м- и п-ДХБ ведут так же, как описано в примере 5. Результаты исследований приведены в таблице 5. Приме р 7. Катализатор, содержащий оксиды ванадия, молибдена, бора, фосфора и натрия в весовом соотношении V2O5 :MoO3:B 2O 3:P2 O5 :Na2O = 58,48 :38,95 :1,07 :0,58:0,98, готовят так же, как описано в примере 1, с тем отличием, что берут 3,855 г ванадата аммония NH4VО 3; 2,452 г молибдата аммония (NН4)6Мо7 O24 •4Н2O; 0,15 г натрия фосфорнокислого двузамещенного Na2HPO4 •12H2O и 0,15 г натрия тетраборнокислого Na2B4O7•10H2O. Состав катализатора соответствует эмпирической формуле V79 Mo33.2B3,8PNa3,9O307,2 (катализатор В). Процесс совместного окисления о-, м- и п-ДХБ ведут так же, как описано в примере 5. Результаты исследований приведены в таблице 5. Как видно из таблицы 5, наибольший выход ХМА (39,4 мол. %) наблюдается для катализатора эмпирической формулы V79 Mo16,6B 3,8PNa3,9O257,4 (катализатор А). Как видно из таблицы 6, предлагаемый способ выгодно отличается от известного способа. Так в предлагаемом способе выход ХМА значительно выше, чем в прототипе (41,4 мол. % против 29.7 мол. %). Использование предлагаемого способа позволит организовать одностадийный непрерывный процесс производства ХМА с большим выходом целевого продукта.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of monochloromaleic anhydride
Автори англійськоюBilokopytov Yurii Vasyliovych, Davydenko Iryna Viktorivna, Piatnytskyi Yurii Ihorevych, Strashnenko Anatolii Viktorovych
Назва патенту російськоюСпособ получения монохлормалеинового ангидрида
Автори російськоюБелокопытов Юрий Васильевич, Давиденко Ирина Викторовна, Пятницкий Юрий Ігоревич, Страшненко Анатолий Викторович
МПК / Мітки
МПК: B01J 23/04, B01J 27/14, C07C 51/21, B01J 21/02, C07D 307/32, B01J 23/16
Мітки: ангідриду, одержання, монохлормалеїнового, спосіб
Код посилання
<a href="https://ua.patents.su/4-3048-sposib-oderzhannya-monokhlormalenovogo-angidridu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання монохлормалеїнового ангідриду</a>
Попередній патент: Підігрівач шихти
Наступний патент: Штам гриба dendrochium toxicum -продуцент рорідіна н
Випадковий патент: Спосіб обробки насіння цукрових буряків захисно-стимулюючими речовинами та мікробним препаратом