Спосіб визначення нешкідливості вакцинних препаратів проти інфекційних хвороб тварин
Номер патенту: 41113
Опубліковано: 15.08.2001
Автори: Романько Марина Євгеніївна, Коваленко Лариса Володимирівна, Головко Анатолій Миколайович, Ушкалов Валерій Олександрович, Нікітенко Юрій Вікторович
Формула / Реферат
Спосіб визначення нешкідливості вакцинних препаратів проти інфекційних хвороб тварин, призначений для лабораторної оцінки нешкідливості вакцин, що включає аналіз результатів досліджень крові імунізованих і контрольних тварин та визначення показників, що характеризують рівень накопичення токсичних продуктів перекисного окислення ліпідів та активності антиоксидантної системи, який відрізняється тим, що критерієм оцінки нешкідливості служить стан прооксидантно-антиоксидантної рівноваги організму щеплених тварин.
Текст
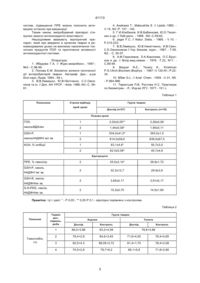
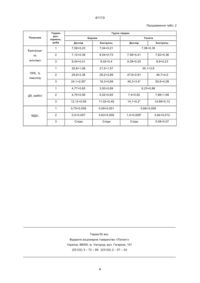
Спосіб визначення нешкідливості вакцинних препаратів проти інфекційних хвороб тварин, призначений для лабораторної оцінки нешкідливості вакцин, що включає аналіз результатів досліджень крові імунізованих і контрольних тварин та визначення показників, що характеризують рівень накопичення токсичних продуктів перекисного окислення ліпідів та активності антиоксидантної системи, який відрізняється тим, що критерієм оцінки нешкідливості служить стан прооксидантно-антиоксидантної рівноваги організму щеплених тварин. В.Ш. (13) 41113 (11) UA супресивного синдрому (Красніков Н.А., Герман В.В., Келеберда M.I.«Опрацювання схем стимуляції імунітету після щеплення птиці за гісто-морфометричними критеріями»// «Ветеринарна медицина» Міжвідомчий темат.наук.збірник. вип.78, Харків, 2000р.,1 том., С. 181-189.) та негативно впливати на потенційну здатність мембран клітин протистояти дії перекисів («Стан системи перекисного окислення ліпідів тварин при застосуванні вакцинних препаратів»/ Л. В. Коваленко, М.Є.Романько, О.В.Волосянко, А.М.Коваленко // «Ветеринарна медицина» Міжвідомчий темат. наук.збірник. вип.77, Харків, 2000р., 1том., С. 151-156.) В основу винаходу, що передбачається, поставлено завдання визначити додатковий критерій оцінки нешкідливості вакцинних препаратів. Завдання вирішується завдяки тому, що про нешкідливість вакцин судять, базуючись на аналізі даних, які характеризують стан прооксидантно-антиоксидантної системи організму щеплених тварин. Вакцину вважають нешкідливою в тому разі, коли введення препарату в рекомендованих дозах не веде до накопичення в організмі експериментальних тварин токсичних продуктів перекисного окислення ліпідів (ПОЛ) - дієнових кон'югатів та гідроперекисів ліпідів, а також зниження надійності антиоксидантного захисту. Суть винаходу полягає у слідуючому: Відомо, що під впливом токсичних для організму тварин речовин активується вільнорадикальна деструкція клітин-мішень, порушується баланс ферментативної антиокислювальної системи (19) Передбачуваний винахід відноситься до ветеринарії, а саме до ветеринарної мікробіології і біотехнології, зокрема до способів визначення нешкідливості вакцин, призначених для активної імунопрофілактики інфекційних захворювань тварин і може бути використаний при комплексній оцінці вакцин за основними показниками якості. Існують способи оцінки нешкідливості вакцин за критеріями токсичності (вірулентності), стерильності, реактогенності (Ветеринарные препараты. Справочник. Под ред. Д.Ф.Осидзе, 1981; Карпухин Г.И., Шапиро Н.И., Андриевская Р.А. Химические вакцины для профилактики кишечных инфекций.- Л.: Медицина.- 1979.-180 с.; Мешалова А.И. Теоретические основы и принципы конструирования энтеральных вакцин. - М.: Медицина.1974.-200 с.). Недоліком вказаних методів контролю є неможливість визначення ушкоджуючої дії вакцин на імунокомпетентні органи взагалі і на мембрани імунокомпетентних клітин зокрема. Прототипом може бути спосіб оцінки нешкідливості вакцин, описаний в довіднику «Ветеринарные препараты. Справочник. Под ред. Д.Ф.Осидзе, 1981», що включає підшкірне введення лабораторним тваринам препарату, що досліджується. Про нешкідливість вакцини, свідчить клінічний стан та відсоток виживання дослідних тварин. Але, застосовуючи вказаний спосіб, неможливо оцінити стан імунної та прооксидантно-оксидантної системи організму імунізованих тварин. Відомо, що досить часто введення тваринам вакцинних препаратів спричинює розвиток імуно А ____________________ 41113 (АОС), що веде до повного зрушення динамічної рівноваги в системі ПОЛ/АОС. При цьому утворюється значна кількість проміжних і кінцевих продуктів ПОЛ в плазмі крові та еритроцитах тварин (1). Знешкоджує продукти переокислення глутатіонпероксидазна система (за рахунок SH-груп відновленого глутатіону глутатіонпероксидаза (GSH-P) трансформує мембранотоксичні гідроперекиси в оксикислоти і спирти, а глутатіонредуктаза (GSH-R), підтримує концентрацію відновленого глютатіону на стабільному рівні за рахунок НАДФН+, каталази та інш.). В спеціальній літературі описано стан антиоксидантної системи в процесі розвитку інфекційних захворювань та при комплексних лікувально-профілактичних заходах (1,2). Приклад 1. Поросят віком 10-12 днів було розділено за принципом аналогів на дві групи. Тварин дослідної групи (n=27) імунізували вакциною інактивованою субодиничною проти сальмонельозу; препарат вводили внутрішньом'язово двічі з інтервалом між ін'єкціями 17 днів в дозі 1,0 см3. Тварини другої групи (інтактний контроль) вакцинації не підлягали (n=18). У експериментальних тварин відбирали проби крові з краніальної порожньої вени після 1-ої вакцинації (1) та після другого введення вакцинного препарата (11) (табл.1.) Стан прооксидантно-антиоксидантного гомеостазу організму поросят характеризували за показниками інтенсивнoсті аскорбат-індукованого ПОЛ (3), спонтанного ПОЛ за вмістом гідроперекисів ліпідів (ГПЛ)-за Asakawa (4), антиокислювальної активності (АОА) плазми крові (5), перекисної резистентності еритроцитів (ПРЕ) до спонтанного гемолізу - за Jager (6), визначали глутатіонпероксидазну (КФ 1.11.1.9 - GSH-P), глутатіонредуктазну (КФ 1.6.4.2 - GSH-R) та глюкозо6-фосфатдегідрогеназну (КФ 1.1.1.49 - G-6-PDG) активності (7,8,9). Вміст білка в пробах визначали за методом Лоурі в модифікації Міллера (10). Отримані результати обраховували статистичнo за методом Стюдента-Фішера (11). Приклад 2. Результати досліджень, проведених, як описано в прикладі 1, показали, що в крові та печінці поросят при вакцинації було зареєстровано зміни прооксидантно-антиоксидантної рівноваги організму тварин. Отримані дані (табл.1) свідчать про те, що після 1-го введення вакцинного препарата вміст в плазмі крові одного з токсичних продуктів ПОЛ ГПЛ знижувався на 12% порівняно з контролем. В той же час активність головного фермента, що утилізує ГПЛ - глутатіонпероксидази плазми крові дослідних поросят збільшувалась в 1,4 рази в порівнянні з активністю цього фермента у інтактних тварин. АОА плазми крові у щеплених поросят була вища в 1,2 рази порівняно з АОА у контрольних тварин, що вказує на підвищення рівня надійності неферментативної АОС на фоні зниження вмісту продуктів ПОЛ. Після другого введення вакцини також спостерігалося виражене зниження вмісту ГПЛ у дослідних поросят, концентрація яких складала вже 1,44±0,09 нмоль МДА/мл. Активність GSH-P плазми у відповідь на повторне введення імунізуючого препарата вірогідно не змінювалася, а АОА підвищувалась більше ніж в 1,3 рази в порівняні з контрольними показниками. Приклад 3. Контроль динаміки ПРЕ, одного з показників неферментативної АОС, дозволяє відслідковувати стан клітинних мембран, контролювати інтенсивність ПОЛ в еритроцитах крові та забезпеченість організму структурними антиоксидантами. Було встановлено, що після другого введення вакцини (табл.1) у дослідних тварин ПРЕ суттєво збільшувалась і % повного гемолізу був нижче від контрольного показника на 14,4%. В той же час активність GSH-Р еритроцитів крові поросят 1-ої групи значно не змінювалась. В еритроцитах крові у відповідь на дворазову вакцинацію також не встановлено вірогідних змін в активностях ферментів GSH-R і G-6-PDG, які забезпечують GSH-залежну АОС крові відновленим глутатіоном і NADP+. Тобто, отримані дані дають підстави вважати, що після 2-ої вакцинації експериментальним протисальмонельозним препаратом надійнiсть AОС збільшується в основному за рахунок підвищення активності неферментативної АОС. При цьому вміст ГПЛ плазми крові щеплених поросят значно знижується. Таким чином, вакцинація поросят не викликає накопичення токсичних продуктів пероксидації ліпідів, сприяє підвищенню надійності АОС та зниженню вмісту токсичних метаболітів пероксидації в крові. Тобто, отримані дані характеризують вакцину за показником нешкідливості. Приклад 4. Велику рогату худобу - тільних корів, дослідна група (n=10) і контрольна (n=5), а також телят 10-15 денного віку - дослідна група (n=10) і контрольна (n=5), імунізували вакциною інактивованою субодиничною проти сальмонельозу тварин згідно з настановою по застосуванню, тварини контрольної групи імунізації не підлягали. У дослідних тварин відбирали проби крові до вакцинації, через 14 діб і через місяць після імунізації. Приклад 5 Було встановлено, що введення в організм дослідних тварин експериментальної вакцини різнопланово впливало на систему ПОЛ (табл.2). Так, після 2-го введення вакцини ПРЕ у дослідних корів була нижчою на 24,1% від контрольних показників. Згідно данним літератури, зниження ПРЕ вказує на зменшення потенційної стійкості мембран цих клітин до дії перекисів. Однією з причин цього може бути компенсаторне витрачання пулу структурних антиоксидантів, яке в подальшому сприяє утриманню кількості продуктів ПОЛ на фізіологічному рівні у дослідних корів. Але у телят дослідних груп спостерігалась зворотня картина відносно стану процесів ПОЛ. Так, після 2-го введення вакцини відмічено вірогідне підвищення ПРЕ на 8,5% від контрольного. В цей термін досліджень спостерігалось зростання рівня первинного продукту ПОЛ - ДК і відсутності кінцевого продукту ПОЛ - МДА у крові дослідних телят. Виходячи з того, що стійкість мембран клітин до дії перекисів залежить від співвідношення концентрацій перекисних продуктів і структурних антиоксидантів та активності ферментативних АО 2 41113 систем, підвищення ПРЕ можна пояснити активацією останніх при вакцинації. Таким чином, випробуваний препарат стимулює захисні антиоксидантні властивості. Нешкідливим вважають імунізуючий препарат, який при введенні в організм тварин в рекомендованих дозах не викликає накопичення токсичних продуктів ПОЛ та пригнічення активності антиоксидантної системи. 4. Asakawa Т., Matsushita S. // Lipids.-1980. V.15, N3.-P. 137 - 140. 5. Г.И.Клебанов, И.В.Бабенкова, Ю.О.Теселкин и др. // Лаб.дело. - 1988. -N5.-C.59-62. 6. Jager F.C. // Natur. Dieta. - 1968. - V.10. P.215-223. 7. В.В.Лемешко, Ю.В.Никитченко, И.В.Свич, С.Е.Овсянников // Укр. биохим. журн. - 1987. - Т.59, N2. - С. 50-57. 8. А.М.Герасимов, Л.А.Королева, О.С.Брусков и др. // Вопр.мед.химии. - 1976. -Т.22, N11. С.89-94. 9. Baquer N.Z., Tevary K., Krishman P.S.//Arch.Biochem.Biophys. - 1967.-V.120.N1.-P.2234. 10. Miller G.L. // Anal. Chem. -1959. -V.31, N5. - P.964-966. 11. Терентьев П.В, Ростова Н.С. Практикум по биометрии. - Л.: Изд-во ЛГУ, 1977.- 151 с. Література. 1. Ибадова Г.А. // Журн.микробиол., 1997.№3.- С.96-99. 2. Попова Е.М. Біохімічні аспекти патогенної дії ентеробактерій тварин. Автореф. Дис.- д-ра біол.наук.-Львів, 1994.- 48 с. 3. В.В.Лемешко, Ю.В.Нікітченко, С.С.Овсяніков та ін. // Доп. АН УРСР. - Київ, 1986.-N3.-С. 5861. Таблиця 1 Показники Групи твaрин Строки відбору проб крові Дослід (n=27) Контроль (n=18) Плазма крові ГПЛ, 1 2,02±0,05** 2,26±0,09 нмольМДА/мл 2 1,44±0,09* 1,90±0,11 GSH-P, 1 534,0±41,0* 393,0±1,0 нмольНАДФН/ мл хв. 2 814,0±59,0 839,0±67,0 АОА, % інгібіції 1 63,1±4,6* 50,7±3,0 2 62.0±5,58* 45,7±4,8 2 25,5±2,14* 29,8±1,72 2 32,3±12,7 29,9±3,6 2 3,65±0,17 3,91±0,17 2 15,3±0,70 14,5±1,60 Еритроцити ПРЕ, % гемолізу GSH-P, нмоль НАДФН /мг хв. GSH-R, нмоль НАДФН/мг хв. G-6-PDG, нмоль НАДФН/мг хв. Примітка: тут і далі: * - Р 0,05 ; ** 0,05 Р 0,1 - вірогідно порівняно з контролем. Таблиця 2 Група тварин Гемоглобін, г/л Термін досліджень, доба Дослід Контроль 1 Показник 89,0+3,96 83,2+4,58 2 78,4+2,9 84,6+3,45 71,6+4,00 76,4+4,65 3 92,5+4,3 98,05+3,72 81,4+1,70 78,4+2,08 4 70,5+2,8 79,7+6,2 69,1+5,8 71,8+2,80 Корови Teлята 3 Дослід Контроль 78,8+3,98 41113 Продовження табл. 2 Група тварин Термін досліджень, доба Дослід Контроль 1 7,59+0,23 7,04+0,21 ти, 2 7,12+0,39 8,04+0,73 7,58+0,41 7,62+0,36 млн/мкл 3 8,04+0,41 9,02+0,4 9,38+0,25 8,9+0,23 1 20,8+1,08 21,5+1,57 2 29,8+2,36 28,2+2,89 47,6+2,91 46,7+4,0 3 24,1+2,55* 18,3+0,68 46,3+3,4* 50,6+4,08 1 4,77+0,65 3,93+0,69 2 4,75+0,56 5,52+0,65 7,4+0,92 7,86+1,89 3 12,12+0,59 11,02+0,49 14,1+0,2* 14,88+0,13 1 0,75+0,009 0,59+0,001 2 0,5+0,007 0,63+0,009 1,4+0,008* 0,64+0,012 3 Сліди Сліди Сліди 0,58+0,07 Показник Еритроци ПРЕ, % гемолізу ДК, мкМ/л МДА, Корови Teлята Дослід 7,56+0,35 30,1+3,9 6,23+0,86 0,68+0,009 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 4 Контроль
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for assessing safety of vaccines against infectious diseases of animals
Автори англійськоюUshkalov Valerii Oleksandrovych, Romanko Maryna Yevheniivna, Kovalenko Larysa Volodymyrivna, Nikitenko Yurii Viktorovych, Holovko Anatolii Mykolaiovych
Назва патенту російськоюСпособ определения безвредности вакцинных препаратов против инфекционных болезней животных
Автори російськоюУшкалов Валерий Александрович, Романько Марина Евгеньевна, Коваленко Лариса Владимировна, Никитенко Юрий Викторович, Головко Анатолий Николаевич
МПК / Мітки
МПК: A61K 39/00
Мітки: нешкідливості, визначення, тварин, інфекційних, хвороб, препаратів, вакцинних, спосіб
Код посилання
<a href="https://ua.patents.su/4-41113-sposib-viznachennya-neshkidlivosti-vakcinnikh-preparativ-proti-infekcijjnikh-khvorob-tvarin.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення нешкідливості вакцинних препаратів проти інфекційних хвороб тварин</a>
Попередній патент: Спосіб правки електрозварних прямошовних труб
Наступний патент: Спосіб прогнозування ступеня ризику виникнення професійних пилових захворювань
Випадковий патент: Спосіб виробництва карбаміду