Спосіб визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності
Номер патенту: 54725
Опубліковано: 25.11.2010
Автори: Зупанець Ігор Альбертович, Старченко Марина Георгіївна, Доброва Вікторія Євгенівна, Шаламай Анатолій Севастьянович
Формула / Реферат
Спосіб визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності на здорових добровольцях шляхом визначення основних показників стану здоров'я людини та оцінки їх змін під впливом прийому лікарських засобів за критеріями переносимості, вибраними з переліку: скарги добровольців, зокрема головний біль, запаморочення, слабкість, нездужання, алергічна реакція, нудота, блювота, діарея, запор, прискорене сечовипускання, сухість у роті, підвищення температури тіла тощо; фізикальний огляд; клінічний стан, зокрема артеріальний тиск, частота серцевих скорочень, електрокардіограма, термометрія тощо; загальний аналіз сечі, лабораторні дослідження крові, зокрема загальний аналіз крові, біохімічний аналіз крові, коагулограма; за наступною кількісною оцінкою кожного з них за рівнем статистичної значимості розбіжностей результатів досліджень за двійковою системою: "1"- при несуттєвості таких розбіжностей або "0" - у протилежному випадку, та визначенням ступеня впливу кожного з критеріїв на загальну оцінку переносимості лікарських засобів від "1" при максимальній значимості до "0" при мінімальній значимості і можливості вилучення критерію з дослідження, який відрізняється тим, що додатково визначають узагальнений критерій побічної реакції як кількість відхилень від норми показників за вибраними критеріями переносимості, розраховують коефіцієнт переносимості Кпр у балах за емпіричною формулою:
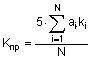 , де
, де
ai - ваговий коефіцієнт, який характеризує значимість і-го критерію переносимості та визначається у кожному клінічному дослідженні (ai =0.. .1);
ki, - оцінка статистичної значимості розбіжностей результатів досліджень і-го критерію переносимості (ki=l або 0),
а переносимість лікарських засобів оцінюють як відмінну при Кпр=5-4 або добру при Кпр = 3,9-3, або задовільну при Кпр =2,9-1, або незадовільну при Кпр=0,9-0.
Текст
Спосіб визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності на здорових добровольцях шляхом визначення основних показників стану здоров'я людини та оцінки їх змін під впливом прийому лікарських засобів за критеріями переносимості, вибраними з переліку: скарги добровольців, зокрема головний біль, запаморочення, слабкість, нездужання, алергічна реакція, нудота, блювота, діарея, запор, прискорене сечовипускання, сухість у роті, підвищення температури тіла тощо; фізикальний огляд; клінічний стан, зокрема артеріальний тиск, частота серцевих скорочень, електрокардіограма, термометрія тощо; загальний аналіз сечі, лабораторні дослідження крові, зокрема загальний аналіз крові, біохімічний аналіз крові, коагулограма; за наступною кількісною оцінкою кожного з них за рівнем статис тичної значимості розбіжностей результатів досліджень за двійковою системою: "1"- при несуттєвості таких розбіжностей або "0" - у протилежному випадку, та визначенням ступеня впливу кожного з критеріїв на загальну оцінку переносимості лікарських засобів від "1" при максимальній значимості до "0" при мінімальній значимості і можливості вилучення критерію з дослідження, який відрізняється тим, що додатково визначають узагальнений критерій побічної реакції як кількість відхилень від норми показників за вибраними критеріями переносимості, розраховують коефіцієнт переносимості Кпр у балах за емпіричною формулою: Корисна модель відноситься до медицини, а саме до способів визначення впливу на людський організм лікарських засобів і може бути використаний при проведенні першої фази клінічних досліджень лікарських засобів та дослідженні біоеквівалентності. Переносимість нового лікарського засобу при визначенні біоеквівалентності випробовується на здорових добровольцях, за станом здоров'я яких оцінюються можливі небажані реакції та клінічні ускладнення, що можуть бути спровоковані цим препаратом. Враховуючи це, необхідно ретельно визначити медичні критерії, за якими буде проводитися оцінка переносимості лікарського засобу, а також розробити адекватну математичну методику оцінки показників переносимості. Визначення переносимості при дослідженні біоеквівалентності обумовлюється вимогами Державного фармакологічного центру України, але спосіб, за яким потрібно встановлювати переносимість, та методичні рекомендації щодо вибору методів обробки результатів не визначені у цьому документі [Настанова 42-7.1:2005. Настанова з клінічних досліджень. Лікарські засоби. Дослідження біодоступності та біоеквівалентності. – Київ: Міністерство охорони здоров'я України: Видавництво «МОРІОН», 2005.– 28 с]. Відомі матеріали закордонних клінічних досліджень І фази лікарських засобів [A phase I clinical N 5 ai k i (19) UA (11) 54725 (13) U i 1 , де N ai - ваговий коефіцієнт, який характеризує значимість і-го критерію переносимості та визначається у кожному клінічному дослідженні (ai =0.. .1); ki, - оцінка статистичної значимості розбіжностей результатів досліджень і-го критерію переносимості (ki=l або 0), а переносимість лікарських засобів оцінюють як відмінну при Кпр=5-4 або добру при Кпр = 3,9-3, або задовільну при Кпр =2,9-1, або незадовільну при Кпр=0,9-0. K пр 3 trial to study the safety and tolerability of a new compound RBx 10017690 in health volunteers//http://www.ctri.in:8080/Climcaltrials/ViewT rial.isp?trialno=401]. У цих матеріалах рекомендовано в якості оцінки переносимості визначити основні вітальні показники (артеріальний тиск, частоту серцевих скорочень, температуру тіла), клінічні показники (ЕКГ) та результати лабораторних досліджень. До недоліків відомого способу слід віднести відсутність чітких рекомендацій щодо вибору критеріїв переносимості, не обґрунтовується вплив кожного з них на загальний показник, відсутня кількісна оцінка переносимості як комплексного показника. Відомий також спосіб статистичного забезпечення клінічного дослідження переносимості препарату «Альтабор» [Доброва В. Є., Старченко М. Г., Саєнко Т. В. Статистичне забезпечення клінічного дослідження переносимості препарату «Альтабор»// Клінічна фармакологія та фармакотерапія. - 2009. - Т. 13, № 14. - С. 31 - 34.], за яким визначено перелік критеріїв переносимості, введено коефіцієнт переносимості. Проте, відомий спосіб передбачає використання лише п'яти критеріїв переносимості, що обмежує об'єктивність одержаної оцінки. Завдання корисної моделі полягає у створенні способу визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності, в якому шляхом визначення критеріїв переносимості, використання запропонованого кількісного коефіцієнту переносимості, розрахованого за емпіричною формулою, та шкали переносимості одержують кількісну та якісну оцінку переносимості досліджуваного лікарського засобу. Поставлене завдання вирішується таким чином, що у способі визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності на здорових добровольцях шляхом визначення основних показників стану здоров'я людини та оцінки їх змін під впливом прийому лікарських засобів за критеріями переносимості, вибраними з переліку: скарги добровольців, зокрема, головний біль, запаморочення, слабкість, нездужання, алергічна реакція, нудота, блювота, діарея, запор, прискорене сечовипускання, сухість у роті, підвищення температури тіла тощо; фізикальний огляд; клінічний стан, зокрема, артеріальний тиск, частота серцевих скорочень, електрокардіограма, термометрія тощо; загальний аналіз сечі; лабораторні дослідження крові, зокрема, загальний аналіз крові, біохімічний аналіз крові, коагулограма; за наступною кількісною оцінкою кожного з них за рівнем статистичної значимості розбіжностей результатів досліджень за двійковою системою: «1» – при несуттєвості таких розбіжностей або «0» - у протилежному випадку, та визначення ступеня впливу кожного з критеріїв на загальну оцінку переносимості лікарських засобів від 1 при максимальній значимості до 0 при мінімальній значимості і можливості вилучення критерію з дослідження, корисною мо 54725 4 деллю передбачено, що додатково визначають узагальнений критерій побічної реакції як кількість відхилень від норми показників за вибраними критеріями переносимості, розраховують коефіцієнт переносимості К пр у балах за емпіричною формулою N 5 ai k i i 1 , де N a i - ваговий коефіцієнт, який характеризує значимість і-го критерію переносимості та визначається у кожному клінічному дослідженні ( a i =0... 1); k i - оцінка статистичної значимості розбіжностей результатів досліджень і-го критерію переносимості ( k i =l або 0), N - кількість критеріїв для оцінки переносимості. Переносимість лікарських засобів оцінюють як відмінну при К пр =5 - 4 або добру при К пр = 3,9-3 K пр або задовільну при К пр =2,9-1 або незадовільну при К пр =0,9 - 0. У відповідності з корисною моделлю до критеріїв переносимості лікарських засобів заявленого способу, а саме: скарги добровольців (головний біль, запаморочення, слабкість, нездужання, алергічна реакція, нудота, блювота, діарея, запор, прискорене сечовипускання, сухість у роті, підвищення температури тіла тощо), фізикальний огляд, клінічний стан (артеріальний тиск (AT), частота серцевих скорочень (ЧСС), електрокардіограма (ЕКГ), термометрія), загальний аналіз сечі, лабораторні дослідження крові (загальний аналіз крові, біохімічний аналіз крові, коагулограма), додатково вводять узагальнений критерій побічної реакції, який дорівнює сумі випадків відхилень від норми досліджених показників, пов'язаних з введенням лікарського засобу. Це сприяє підвищенню точності та об'єктивності оцінки при визначенні переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності. Авторами вперше запропоновано визначати необхідні для кожного конкретного дослідження критерії переносимості, за якими розраховують коефіцієнт переносимості К пр за наведеною вище емпіричною формулою для оцінки ступеню переносимості досліджуваного лікарського засобу при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності. Запропоновано також бальну шкалу, (див. таблицю) за якою одержують кількісну оцінку переносимості лікарських засобів. Задовільний шаг дискретності К пр дорівнює 0,1. Таблиця Коефіцієнт переносимості ( К пр ) 5-4 бала* Переносимість Відмінна 5 3,9-3 бала* Добра 2,9 - 1 бала* Задовільна 0,9 - 0 балів* Незадовільна Верхня межа - включно. Заявлений спосіб забезпечує кількісно обґрунтоване визначення впливу препарату на життєво важливі показники здорової людини і дозволяє об'єктивно оцінювати переносимість лікарських засобів. Заявлений спосіб здійснюють наступним чином. З переліку критеріїв переносимості визначають ті критерії, які необхідні для оцінки стану здоров'я добровольців, що приймають участь у клінічних дослідженнях (перша фаза або дослідження біоеквівалентності) у даному конкретному випадку. Для визначення медичних показників за кожним з цих критеріїв проводяться відповідні медичні процедури. Оцінка критеріїв переносимості, для яких можна визначити відповідність або невідповідність нормі, проводиться за допомогою дихотомічних змінних. Показники, які визначаються кількісно, оцінюються як числові змінні. За кожним критерієм окремо проводиться статистична обробка результатів досліджень, оцінюється статистична значимість виявлених розбіжностей та визначається коефіцієнт (ki). Якщо статистична значимість виявлених розбіжностей при оцінці і-тої змінної вважається несуттєвою, тоді відповідний коефіцієнт (ki) приймає значення «1». У протилежному випадку «0». Ступінь впливу окремого критерію на загальну оцінку переносимості визначається ваговим коефіцієнтом (аi). При максимальній значимості впливу ai=l, при необхідності вилучають відповідний критерій з дослідження, тоді аi =0. Якщо дослідник вважає, що вплив деяких критеріїв на загальну оцінку коефіцієнту переносимості є більш важливими, а деяких менш важливим, тоді вагові коефіцієнти визначаються диференційовано (аi =0,..., 1). Проводиться розрахунок коефіцієнта переносимості (Кпр) за емпіричною формулою: N 5 ai k i i 1 , де N a i - ваговий коефіцієнт, який характеризує значимість кожного з критеріїв, переносимості та визначається у кожному клінічному дослідженні (аi 0...l); k i - оцінка і-го критерію переносимості, N – кількість критеріїв для оцінки переносимості. Якщо потрібно провести порівняння преносимості між групами, які можуть відрізнятися дозою досліджуваного лікарського засобу, тоді для кожної з груп визначають запропонованим чином коефіцієнт переносимості та порівнюють їх. Заявлений спосіб дозволяє здійснити перехід від якісних суб'єктивних оцінок стану здорових добровольців, які приймають участь у першій фазі K пр 54725 6 клінічних досліджень, до чітко виважених кількісних оцінок переносимості досліджуваних засобів. Корисна модель ілюструється прикладами. Приклад 1. Дослідження переносимості одноразової дози препарату «Елгацин» на першій фазі клінічних досліджень при участі здорових добровольців Для дослідження переносимості однократної дози препарату «Елгацин»: по 7, 14 та 28 мг було сформовано три групи здорових добровольців (j=1,2,3). При оцінці переносимості досліджуваного препарату «Елгацин» використовували п'ять критеріїв переносимосимості (N=5): критерій k1 -побічні реакції визначені за скаргами добровольців, критерій k2 – фізикальний огляд, критерій k3 - клінічний стан, критерій k4 - результати загального аналізу сечі, критерій k5 - результати лабораторних досліджень крові. Всі критерії вважаються рівнозначно важливими, тому ваговий коефіцієнт аi = 1, де і=1,...5. Для змінних «побічні реакції, визначені за скаргами добровольців» (k1), «фізикальний огляд» (k2), «клінічний стан» (k3), «результати загального аналізу сечі» (k4), які оцінювалися як дихотомічні, формулювалася статистична гіпотеза про те, що у кожній групі частки невідповідностей, які виникли до прийому препарату, дорівнюють часткам невідповідностей, які з'явилися у добровольців після прийому препарату. Дослідження цих гіпотез проводилося за допомогою критерію МакНемара або за допомогою методу порівняння часток і визначалася статистична значущість їх відмінностей. Перевірка гіпотез для всіх цих змінних дала негативну відповідь про статистичну значущість відхилень відповідної змінної, тому kij=k2j=k3j=k4j=l, де j=l,2,3 номер відповідної групи добровольців. Для результатів лабораторних досліджень крові, зокрема загального та біохімічного аналізів крові, а також параметрів коагулограми розраховувалися показники описової статистики, проводилася оцінка статистичних гіпотез щодо рівності середніх оцінок параметрів, виміряних при скринінгу та у відповідний день за схемою випробувань у кожній групі. У кожній групі спостерігалися статистично значущі відмінності за наслідками лабораторних досліджень, тому змінній «результати лабораторних досліджень крові» (k5) привласнюється значення «0»: k5j=0, де j=l,2,3. Коефіцієнт переносимості, розрахований за заявленою емпірічною формулою, для кожної групи добровольців, які приймали одноразову дозу препарату «Елгацин» по 7, 14, 28 мг дорівнює Кпр1=Кпр2=Кпр3= =5-(1+1+1+1+0)/5=4. За запропонованою шкалою переносимість одноразових доз препарату «Елгацин» по 7, 14, 28 мг можна визначити як «добру». Таким чином, заявлено спосіб визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень. Спосіб дозволяє одержувати кількісно обґрунтоване визначення впливу препарату на життєво важливі показники здорової людини і обгрунтовано оцінювати иереносимість лікарських засобів. Заявлений спосіб може бути використаний також при проведенні 7 54725 доклінічних досліджень нових лікарських засобів та біологічно активних речовин. Приклад 2. Дослідження переносимості одноразової дози препарату препарату «Ліприл», таблетки по 20 мг, виробництва ЗАТ НВЦ Боріцаї овский ХФЗ» при оцінці біоеквівалентності у порівнянні з препаратом «Ацербон», таблетки по 20 мг, виробництва «AstraZeneca» при участі здорових добровольців Для дослідження переносимості однократної дози препарату «Ліприл»: по 20 мг було сформовано групу з 24 здорових добровольців. При оцінці переносимості досліджуваного препарату «Ліприл»: використовували три критерії переносимосимості (N=3): критерій k1 – побічні реакції, критерій k2 - фізикальний огляд, критерій k3 - клінічний стан (параметри артеріального тиску, частоти серцевих скорочень, температури тіла). Всі критерії вважаються рівнозначно важливими, тому ваговий коефіцієнт аi = 1, де і= 1,... 5. Всі критерії оцінювалися як дихотомічні, далі формулювалася статистична гіпотеза про те, що частки невідповідностей, які виникли до прийому препарату, дорівнюють часткам невідповідностей, які з'явилися у добровольців після прийому препарату. Дослідження цих гіпотез проводилося за до Комп’ютерна верстка Г. Паяльніков 8 помогою критерію МакНемара або за допомогою методу порівняння часток і визначалася статистична значущість їх відмінностей. Перевірка гіпотез для всіх цих змінних дала негативну відповідь про статистичну значущість відхилень відповідної змінної, тому k1=k2=k3 =1. Коефіцієнт переносимості, розрахований за заявленою емпіричною формулою, для групи добровольців, які приймали одноразову дозу препарату «Ліприл» по 20 мг дорівнює Кпр1=5(1+1+1)/3=5. За запропонованою шкалою переносимість одноразової дози препарату «Ліприл», таблетки по 20 мг, можна визначити як «відмінну». Одержані дані з визначення переносимості дослідженого препарату «Ліприл», таблетки по 20 мг, використані при оцінці його біоеквівалентності у порівнянні з відомим засобом «Ацербон», таблетки по 20 мг. Встановлено, що ці препарати тотожні за показником «переносимість». Таким чином, заявлено спосіб визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності. Спосіб дозволяє одержувати кількісно обґрунтоване визначення впливу препарату на життєво важливі показники здорової людини і обґрунтовано оцінювати переносимість лікарських засобів. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of drug tolerance at the first stage of clinical examination and research of bioequivalency
Автори англійськоюDobrova Viktoria Yevhenivna, Zupanets Ihor Albertovych, Shalamai Anatolii Sevastianovych, Starchenko Maryna Heorhiivna
Назва патенту російськоюСпособ определения переносимости лекарственных средств при проведении первой фазы клинических исследований и исследовании биоэквивалентности
Автори російськоюДоброва Виктория Евгеньевна, Зупанец Игорь Альбертович, Шаламай Анатолий Севастьянович, Старченко Марина Георгиевна
МПК / Мітки
МПК: A61B 5/00
Мітки: засобів, спосіб, проведенні, фазі, клінічних, лікарських, переносимості, досліджень, визначення, першої, дослідженні, біоеквівалентності
Код посилання
<a href="https://ua.patents.su/4-54725-sposib-viznachennya-perenosimosti-likarskikh-zasobiv-pri-provedenni-persho-fazi-klinichnikh-doslidzhen-ta-doslidzhenni-bioekvivalentnosti.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення переносимості лікарських засобів при проведенні першої фази клінічних досліджень та дослідженні біоеквівалентності</a>
Попередній патент: Газогенератор
Наступний патент: Спосіб прокатки злитків
Випадковий патент: Спосіб термохімічної обробки пласта








