2-(2-галогено-6-дифторометоксифеніламіно)імідазоліни та гідрохлориди 2-(2-галогено-6-дифторометоксифеніламіно)імідазолінів
Номер патенту: 69143
Опубліковано: 16.08.2004
Автори: Тарасова Катерина Вікторовна, Фіалков Юрій Аркадійович, Ягупольський Лев Мусійович
Формула / Реферат
2-(2-Галогено-6-дифторометоксифеніламіно)імідазоліни загальної формули (Іа, б)
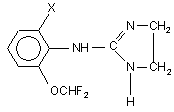 ,
,
І
де Х=Сl (Іа), Вr (Iб),
та гідрохлориди 2-(2-галогено-6-дифторометоксифеніламіно)імідазолінів загальної формули (ІІа, б)
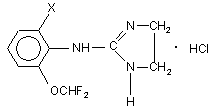 ,
,
ІІ
де Х=Сl (IIа), Вr (IIб).
Текст
Винахід належить до органічної хімії, конкретно до нових органічних сполук класу похідних ариламіноімідазолів, а саме, 2-(2-галоген-6-дифторометоксифеніламіно)імідазолінів загальної формули (І) X N CH2 NH C N OCHF2 CH2 H ,І де X=Cl (Ia), Br (Iб) та їх гідрохлоридів загальної формули (II) X N CH2 NH . C N OCHF2 HCl CH2 H , ІІ де X=Cl (IІa), Br (IІб) Гідрохлориди 2-(2-галогено-6-дифторометоксифеніламіно)імідазолінів (ІІа, б) в експериментах на тваринах виявили виразну антигіпертензивну активність. Сполуки, що заявляються, є новими і в літературі не описані. Серед відомих речовин вказаного класу треба відзначити гідрохлорид 2-(2,6-дихлорофеніламіно)імідазоліну (III), який під назвою "Клофелін" ("Клонідін") широко використовується у медичній практиці, як засіб для лікування гіпертонічної хвороби [1]. Cl N CH2 NH . C N Cl HCl CH2 H , ІІІ Клофелін (III) слід розглядати як найближчий аналог по будові та властивостям сполук, що заявляються. Задача винаходу - одержання нових сполук класу ариламіноімідазолінів з фторовмісними замісниками перспективних речовин, на основі яких можна створювати ефективні засоби для лікування гіпертонії. Задача вирішується шляхом синтезу нових хімічних з'єднань 2-(2-галогено-6дифторометоксифеніламіно)імідазолінів (Іа, б) X N CH2 NH C N OCHF2 CH2 H ,І де X=Cl (Ia), Br (Iб) та їх гідрохлоридів X N NH OCHF 2 CH2 . C N H HCl CH2 , ІІ де X=Cl (IІa), Br (IІб) Синтез нових сполук (Іа, б) та (На, б) , що заявляються, здійснюється за схемою: X X S C NH CH3J NH2 SCH3 NH CH3OH OCHF 2 C N NH HCl бензол N OCHF2 X CH2 C CH2 + NH 2 OCHF 2 X J -CH3SH N NH CH2 . C OCHF2 H (Іа, б) (H2NCH2)2 N HCl CH2 H (ІІ а, б) де Х=Сl (Ia, IIa); Br (Iб, ІІб) Вихідні з'єднання у процесі синтезу цільових продуктів - N-(2-галогено-6-дифторометоксифеніл)тіосечовини описані в заявці [2]. Вказані N-арилтіосечовини піддають метилюванню за допомогою йодистого метилу у метанолі з одержанням відповідних арилтіуроніййодидів. Ці сполуки не виділяють окремо, а після видалення розчинника нагрівають з надлишком етилендіаміну. Внаслідок цього відбувається замикання гетероциклічного кільця та утворення - 2-(2галогено-6-дифторометоксифеніламіно)імідазолінів (Іа, б). Після очистки одержані сполуки розчиняють у сухому бензолі та шляхом пропускання газоподібного хлористого водню осаджують нерозчинні в бензолі гідрохлориди. Склад та будова усіх нових сполук, що заявляються, підтверджені даними елементного аналізу та спектрами ЯМР 1Н. Відомо, що введення фторовмісних замісників, наприклад, дифторометокси- (CHF2O-) та дифторометилтіо(CHF2S-) груп у молекули потенційних біологічно активних сполук сприяє проявленню фармакологічної дії, підвищує стійкість з'єднань, знижує токсичність [3]. Як приклад можна навести створення антигіпертензивного препарату "Форидон" - [2,6-диметил-3,5-диметоксикарбоніл-4-(2-дифторометоксифе-ніл)-1,4-дигідропіридин] (IV), який виробляється у промислових масштабах. OCHF2 H CH3OOC CH3 N COOCH3 CH3 H , IV Форидон є першим у світовій практиці лікарським засобом, який містить дифторометоксигрупу [1, 4]. Далі наведені конкретні приклади одержання речовин, що заявляються, та результати вивчення фармакологічної дії сполук (ІІа, б) у порівнянні з Клофеліном (III). Приклади 1. 2-(2-Хлоро-6-дифторометоксифеніламіно)імідазолін (Іа). Розчин 2г (0.008моль) 2-хлоро-бдифторометоксифенілтіосечовини [2], 0.8мл (0.013моль) йодистого метилу у 20см3 метанолу кип'ятять 3год. Через 12год відганяють повністю метанол у вакуумі при температурі 35-40°С. Одержують біля 3г ізотіуронієвої солі. Додають 0.8мл (0.012моль) безводного етилендіаміну та розмішують одержану масу 1.5год на масляній бані при температурі 140-145°С. (Працювати під тягою - виділяється метилмеркаптан!). Охолоджують, розчиняють у 14см3 60% теплої оцтової кислоти, розчин фільтрують від невеликого осаду та на холоду до одержаного розчину додають поступово при розмішуванні розчин 8 % гідроокису натрію до лужної реакції. При цьому випадає речовина, яку, екстрагують сумішшю ефір-бензол (1:1) три рази по 50см3. Об'єднані екстракти фільтрують від осаду, промивають водою та сушать сульфатом магнію. Розчинник відганяють, залишок розчиняють у 25 см3 сухого бензолу і фільтрують бензольний розчин через колонку з силікагелем для вилучення смолистих домішок. Бензольний елюент упарюють, а залишок кристалізують із суміші гексан-бензол. Одержують 0.55г (26%) 2-(2-хлоро-6-дифторометоксифеніламіно)-імідазоліну з т.пл.86,5-88°С. Знайдено, %: Сl 13.40, 13.45; N 15.69, 15.89. С10Н10СlF2N3О. Вираховано, %: Сl 13.57; N 16.06. 2. 2-(2-Бромо-6-дифторометоксифеніламіно)імідазолін (Iб) одержан за аналогічним способом, виходячи з 2бромо-б-дифторометоксифенілтіо-сечовини [2] з виходом 32%, т.пл.103-104,50С. Знайдено, %: С38.82, 39.01; Н 2.87, 3.05; Вr 25.67, 25.81; N13.80, 13.81. C10H10BrF2N3O. Вираховано, %: С39.22; Н3.27; Br26.14; N13.73. Спектр ЯМР 1H (5, м.ч.) в СDСl3: синглет 3.55-4 протони метиленових груп; уширений синглет 4.4 - протони при атомах азоту; триплет з центром 6.55- дифторометильна група; два дублети з центрами 7.1-7.25 - ортопротони бензольного кільця атома брому та дифторометоксигрупи; триплет з центром 6.8 - пара-протон аміногрупи. 3. Гідрохлорид 2-(2-хлоро-6-дифторометоксифеніламіно)імідазоліну (Па). Розчиняють 0.52г (0.002моль) 2-(2хлоро-6-дифторометоксифеніламіно)імідазоліну (Іа) в 15см3 сухого бензолу і при охолодженні льодом з водою та ефективному розмішуванні пропускають ток сухого хлористого водню протягом 1год. Спочатку випадає злегка жовтувата маслоподібна в'язка речовина, яка потім при розмішуванні розсипається у безбарвний порошок. Розмішують на холоду ще 30хв і гідрохлорид, який випав, відфільтровують, ретельно промивають на фільтрі сухим бензолом, потім сухим гексаном та висушують у вакуумі. Одержують 0.51г (85%) гідрохлориду 2-(2-хлоро-6-дифторометокси-феніламіно)імідазоліну (Іа), т.пл. 1671690С. Знайдено, %: С40.04, 40.12; Н3.36, 3.43; Сl (загальний) 23.60, 23.75; Сl (іонний) 11.22, 11.43; N 14.14, 14.16. C10H11Cl2F2N3O. Вираховано, %: С 40.27; Н 3.69; Сl (загальний) 23.82; Сl (іонний) 11.91; N 14.09. Спектр ЯМР 1H ( d , м.ч.) у дейтеродиметилсульфоксиді: синглет 3.65 - 4 протони метиленових груп імідазолінового кідьця; триплет з центром 7.28 - дифторометильна група; триплет з центром 7.36 - пара-протон бензольного кільця; два дублети в діапазоні 7.48-7.56 - два орто-протони бензольного кільця; уширений синглет з центром 8.48 - два протони при атомах азоту імідазолінового кільця; уширений синглет з центром 10.4 -протон анілінового атома азоту. 4. Гідрохлорид 2-(2-бромо-6-дифторометоксифеніламіно)імідазоліну (IIб) одержують за аналогічним способом, виходячи з 2-(2-бромо-6-дифторометоксифеніламіно)імідазоліну (16), з виходом 70 %, т. пл. 184,5186,5 0С. Знайдено, %: С34.74, 34.81; Н3.16, 3.26; N12.10, 12.15. С10Н11ВrСlF2N3О. Вираховано, %: С35.04; Н3.21; N12.26. Спектр ЯМР 1H ( d , м.ч.) у дейтеродиметилсульфоксиді: синглет 3.6-4 протони двох метиленових груп імідазолінового кідьця; триплет з центром 7.32- дифторометильна група; триплет з центром 7.2- пара-протон бензольного кільця; два дублети з центрами 7.44 та 7.66 - орто-протони бензольного кільця атома брому та дифторометоксильної групи; синглет 8.5- два протони при атомах азоту імідазолінового кільця; синглет 10.6 протон анілінового атома азоту. Спектри ЯМР 1H записані на спектрометрі Bruker WR-200. Дослідження фармакологічної дії нових сполук (ІІа) та (ІІб). Експериментальне вивчення впливу досліджуваних сполук на серцево-судинну систему проводили на наркотизованих тіопенталом натрію білих лабораторних щурах лінії Вістар вагою 200-250г. Для отримання ізольованих смужок ворітної вени тварин забивали декапітацією і швидко вирізали судини. Після цього препарат вміщували в препарувальну ваночку, заповнену розчином Кребса, вирізали смужку довжиною L=2-3мм і товщиною 0.5-0.7мм, вміщували в проточну камеру ємністю 0.3мм і перфузували розчином Кребса. Смужку розтягували до Lmax і реєстрували силу скорочення в ізометричному режимі. Реєстрацію здійснювали за допомогою механотрону типу 6МХІС. Сигнал розбалансу містка, що виникав при скороченні препарату, подавали на вхід диференційного підсилювача постійного струму, який з'єднували з реєструючим пристроєм. Запис скорочень проводили на самописці Н-3031. Для зв'язку біологічної та вимірювальної систем використовували скляний гачок, з'єднаний із штоком механотрона, який підводили під тест - ділянку смужки судини. Шляхом вертикального переміщення механотрона задавали початкове розтягнення м'язової смужки. Смужка ворітної вени володіє пейсмекерною активністю з ритмічними скороченнями. Показники гемодинаміки отримували на поліграфі фірми "Nikon-Cohden". Частоту серцевих скорочень (ЧСС) визначали за ЕКГ, зареєстрованою у другому стандартному відведенні. Артеріальний тиск вимірювали прямим методом у сонній артерії. Речовини вводили щурам в підключичну вену та в м'яз в дозі 0.1мг/кг ваги тварини, а також вводили в перфузійні потоки в концентрації 10-5-10 -6моль. Порівняльне дослідження впливу сполуки (ІІб) та Клофеліну (III) на тонус і скоротливу активність ізольованих смужок ворітної вени щура В цій серії проведено 16 дослідів: 8 -досліджували вплив Клофеліну (III), в інших 8 - вплив сполуки (ІІб). На початку кожного з дослідів смужку перфузували розчином Кребса протягом 1год. Величину і стабільність тонусу наприкінці першої години після початку досліду приймали за вихідну (контроль). Результати показали, що обидві речовини збільшували тонус смужки ворітної вени одразу після початку перфузування порівняно з контролем відповідно: Клофелін (III) - в середньому на 439мг, сполука (Пб). на 487мг. Протягом наступних 300-500 секунд тонус поступово знижувався, але не відновлювався до вихідної величини. Так, через 400-450сек. після початку перфузування Клофеліном (III) він перевищував вихідний рівень на 275мг, а за таких саме умов для нової сполуки (ІІб) тонус був вищим за вихідний рівень на 228мг. Після відмивання розчином Кребса відбувалось істотне розслаблення смужки з відновленням тонусу до вихідного рівня. Тонус відновлювався при відмиванні від Клофеліну (III) за 743сек., при відмиванні від сполуки (ІІб) - за 771сек. Як під дією Клофеліну (III), так і під дією сполуки (ІІб) частота фазних скорочень смужки ворітної вени спочатку збільшувалась вдвічі, а протягом наступних 400сек. відновлювалась до вихідного значення. Амплітуда фазних скорочень збільшувалась під впливом Клофеліну (III) в середньому на 70мг, під дією сполуки (ІІб) збільшується тонус і скоротлива активність ізольованих смужок ворітної вени щура. Величина ефекту приблизно однакова при дії обох речовин. Очевидно, що нова сполука (ІІб) володіє властивостями, які аналогічні Клофеліну (III). Дослідження впливу сполуки (ІІб), що заявляється, на показники гемодинаміки Досліди проведені на 12 нормотензивних щурах. Одразу після введення препаратів відбувалось підвищення систолічного і діастолічного тиску з максимумом реакції, який припадав на 5-10хв. На 15хв після введення препаратів реєстрували такі зміни показників порівняно з вихідними (табл.1). Таблиця 1 Показники гемодинаміки нової сполуки (ІІ б), що заявляється, та Клофеліну (III) Препарат Сполука (ІІб) Систолічний тиск Діастолічний тиск -6% -9.9 % Частота серцевих скорочень (ЧСС) -31% Клофелін (III) 0% +6% -46% Таким чином, отримані результати свідчать про те, що при введенні досліджуваних препаратів в вену артеріальний тиск підвищується, потім відновляється до вихідного рівня і поступово знижується. Такий характер реакції, який властивен Клофеліну (III), є характерним і для сполуки (ІІб). Перевагою останньої є менша тривалість фази початкового підвищення показників гемодинаміки. Це має важливе клінічне значення, бо зменшує ризик розвитку ускладнень при необхідності лікування гіпертонічних криз, особливо тоді, коли є необхідність у внутрішньовенному введенні препарату [5]. При внутрішньом'язовому способі введення зниження артеріального тиску відбувається більш поступово, фази початкового підвищення артеріального тиску немає (див. табл.2). Таблиця 2 Вплив нових сполук (ІІа, б), що заявляються, та Клофеліну (III) на показники гемодинаміки (в дозі 0.1мг/кг при внутрішньом'язовому введенні) Препарат Систолічний тиск Діастолічний тиск Сполука (ІІа) -16 % -21% Сполука (ІІб) -24.7 % -20.4 % Клофелін (ІІІ) -29.2 % -31.8 % ЧСС Тривалість ефекту, год. 1.5-2. Мінімальне -23.7 % значення - на 55-60хв. 1.5. Мінімальне -24.1 % значення - на 55-60хв. Близько 1. Мінімальне -30.8 % значення - на 20-25хв. Ефект впливу Клофеліну (ІІІ) та сполук (ІІа, б) на показники гемодинаміки залежить від способу введення. При внутрішньовенному введенні препаратів переважає їх місцева дія як активаторів альфа-1 адренорецепторів мембран клітин глсіденької мускулатури судин і тому артеріальний тиск зростає. При введенні вищеназваних препаратів в м'язи їх надходження в кров відбувається більш поступово, при цьому зниження артеріального тиску відбувається за рахунок переважання їх центральної дії як активаторів альфа-2 адренорецепторів мембран нейронів стовбурної ретикулярної формації. Сполуки (ІІа, б) призводять до більш швидкого зниження артеріального тиску порівняно з Клофеліном (III) при внутрішньовенному введенні препаратів. Тривалість фази початкового підвищення тиску менша при введенні сполук (ІІа, б) порівняно з Клофеліном (III). При внутрішньом'язовому введенні ефекти сполуки (ІІб) наближені до ефектів Клофеліну (III). Сполука (ІІа) спричиняє більш помірні ефекти. Основною перевагою сполук (ІІа, б) порівняно з Клофеліном (III) є те, що тривалість їх дії в 1.5-2 рази довша ніж Клофеліну (III). Так, при введенні Клофеліну (III) найменші величини артеріального тиску реєструвались на 20-25хв. з моменту введення препарату, а потім відбувалось поступове відновлення тиску до вихідного рівня. При введенні сполук (ІІа, б) найменші величини тиску реєструвались на 55-60 хв. з моменту введення препаратів, і не відновлювались до вихідного рівня протягом 1.52год. з моменту введення. Другою перевагою сполук (ІІа, б) є те, що вони менше порівняно з Клофеліном (III) пригнічують частоту серцевих скорочень. Це має велике клінічне значення, бо в умовах патології (артеріальна гіпертензія) вкрай важливою є можливість знизити величину артеріального тиску саме за рахунок зменшення опору судин і при цьому зберегти насосну функцію серця, не допускаючи, по можливості, її зниження. З одержаних результатів порівняльного дослідження фармакологічної активності нових сполук (ІІа, б), що заявляються, та Клофеліну (III) можна зробити висновок, що нові речовини, які патентуються, мають об'єктивні переваги перед Клофеліном (III) і являють собою перспективні об'єкти для подальшого створення ефективних антигіпертензивних засобів для клінічного застосування. Джерела інформації: 1. Машковский М.Д. Лекарственные средства: В 2-х т.- М.: Новая волна, 2000. - T.I. - 539с. 2. 2-Галогено-6-дифторометоксипохідні нітробензолу, аніліну та N-фенілтіосечовини. Заявка ІОХ НАН України. 3. Organofluorine compounds in medicinal chemistry and biomedical applications /Eds. R.Filler, Y.Kobayashi, L.Yagupolskii, - Amsterdam, London, New York, Tokyo: Elsevier, 1993. - 386P. 4. A.c. 706410 СССР, МКИ2 С07D211/90, A61К31/435. 2,6-Диметил-3,5-дикарбметокси-4(одифторметоксифенил)-1,4-дигидропиридин, обладающий выраженной гипотензивной активностью и оказывающий действие на функции вегетативной нарвной системы /В.В.Кастрон, Р.О.Витолинь, Ю.А.Фиалков, С.В.Шеляженко, Г.Я.Дубур, А.А.Кименис, Л.М.Ягупольский.- № 2569286; Заявл.11.01.78; Госрегистр. 07.09.79. 5. Эрина Е.В. Актуальные проблемы патогенеза, лечения и профилактики гипертензивных кризов //Кардиология.- 1988. - №8. - С.108-111.
ДивитисяДодаткова інформація
Назва патенту англійською2-(2-halogen-6-difluoromethoxyphenylamino)imidazolins and 2-(2-halogen-6-difluoromethoxyphenylamino)imidazolins hydrochlorides
Автори англійськоюYahupolskyi Lev Musiiovych, Fialkov Yurii Arkadiovych
Назва патенту російською2-(2-галогено-6-дифторометоксифениламино)имидазолины и гидрохлориды 2-(2-галогено-6-дифторометоксифениамино)имидазолинов
Автори російськоюЯгупольский Лев Мусийович, Фиалков Юрий Аркадиевич
МПК / Мітки
МПК: C07B 61/00, A61K 31/415, C07D 231/06
Мітки: гідрохлориди, 2-(2-галогено-6-дифторометоксифеніламіно)імідазоліни, 2-(2-галогено-6-дифторометоксифеніламіно)імідазолінів
Код посилання
<a href="https://ua.patents.su/4-69143-2-2-galogeno-6-diftorometoksifenilaminoimidazolini-ta-gidrokhloridi-2-2-galogeno-6-diftorometoksifenilaminoimidazoliniv.html" target="_blank" rel="follow" title="База патентів України">2-(2-галогено-6-дифторометоксифеніламіно)імідазоліни та гідрохлориди 2-(2-галогено-6-дифторометоксифеніламіно)імідазолінів</a>
Попередній патент: Молоткова дробарка сипучих матеріалів
Наступний патент: 2-галогено-6-дифторометоксипохідні нітробензолу, аніліну та n-фенілтіосечовини
Випадковий патент: Спосіб виготування випромінювача для рентгенофлюоресцентного аналізу розчинів та суспензій






