Водний розчин натрієвої солі n-(2-гідроксіетил)етилендіамін-n, n’, n’-триоцтової кислоти, його застосування та спосіб одержання, та контейнер, що містить його
Формула / Реферат
1. Воднийрозчин, який містить натрієву сіль xNa+yH+ хелатоутворювальної сполуки формули (І):
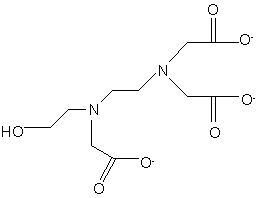 , (I)
, (I)
де х = 2,1-2,7, у = 0,9-0,3 і х+у = 3.
2. Водний розчин за п. 1, який відрізняється тим, що містить щонайменше 45 мас. % натрієвої солі xNa+yH+ хелатоутворювальної сполуки формули (І), де х = 2,1-2,7, у = 0,9-0,3 і х+у = 3.
3. Контейнер, який відрізняється тим, що містить щонайменше 0,5 кг водного розчину за пп. 1 або 2.
4. Застосування водного розчину за пп. 1 або 2 для одержання хелатного комплексу заліза.
5. Спосіб одержання водного розчину, який містить щонайменше 45 мас. % натрієвої солі xNa+yH+ хелатоутворювальної сполуки формули (І), де х = 2,1-2,7, у = 0,9-0,3 і х+у = 3, з тринатрієвої солі N-(2-гідроксіетил)етилендіамін-N,N’,N’-триоцтової кислоти (Na3-HEDTA), який відрізняється тим, що включає стадію електродіалізу при температурі 20 °С водного розчину, що містить менше 42 мас. % Na3-HEDTA, або при іншій температурі максимально при концентрації, коли в'язкість є такою ж або нижчою, ніж в'язкість 42 мас. %-ного розчину Na3-HEDTA при температурі 20 °С, з використанням біполярної і катіонної мембрани, таким чином перетворюють розчин Na3-HEDTA в розчин натрієвої солі xNa+yH+ сполуки формули (І), де х = 2,1-2,7, у = 0,9-0,3 і х+у = 3.
6. Спосіб за п. 5, який відрізняється тим, що використовують лужний електроліт.
Текст
1. Водний розчин, який містить натрієву сіль xNa+yH+ хелатоутворювальної сполуки формули (І): O C2 2 81686 1 O , (I) (19) O де х = 2,1-2,7, у = 0,9-0,3 і х+у = 3. UA O Винахід відноситься до водного розчину натрієвої солі хелатоутворювальної сполуки HEDTA [К-(2-гідроксіетил)етилен-діамін-К,КІ,М'триоцтова кислота], контейнеру, що містить вищезгаданий водний розчин, і застосування цього водного розчину для отримання хелатного комплексу заліза. Винахід відноситься, далі, до способу отримання такого водного розчину вищезгаданої натрієвої солі HEDTA. Деякі натрієві солі хелатоутворювальної сполуки HEDTA відомі з рівня техніки. Наприклад, в патенті США 5491259 описується спосіб 3 81686 отримання HEDTA з її тринатрієвої солі (тобто, Na3-HEDTA). Цей спосіб здійснюють при використанні кислого середовища зі значенням рН від 1,0 до 3,0, що встановлюється у водному завантажувальному розчині, який містить повністю протоновану HEDTA разом з неорганічною натрієвою сіллю. Потім цей водний розчин пропускають через діафільтраційну мембрану для розділення органічних і неорганічних компонентів. Динатрієва сіль HEDTA (тобто, Na2-HEDTA) також відома. Наприклад, в Європейських патентах 0054277 і 0058430 описуються мікроскопічні капсули, що містять суспензії барвників з вищезгаданою динатрієвою сіллю HEDTA. [К. Nakamoto і інш., в J. Am. Chetn. Soc, 85, 311-312 (1963)], опубліковані інфрачервоні спектри HEDTA і її моно-, ди- і тринатрієвої солі. Звичайно, коли застосовують HEDTA для хелато утворювальних іонів, використовують тринатрієву сіль HEDTA (Na3-HEDTA). Так, відповідно до патенту США 5110965, хелатні сполуки заліза можуть бути отримані з комерційно доступного 41,3 мас. %-ного водного розчину тринатрієвої солі HEDTA шля хом введення у взаємодію оксиду заліза (у вигляді його магнетиту) з Na3-HEDTA і підкислення середовища до низького значення рН. Однак, застосування тринатрієвої солі HEDTA пов'язане з деякими великими недоліками, при використанні в комерційному масштабі. Важливою проблемою є висока в'язкість концентрованих розчинів тринатрієвої солі HEDTA, яка робить такий розчин важким в поводженні. Так, висока в'язкість обмежує практичну концентрацію до значень нижче за 45мас. %. Далі, вище певних концентрацій тринатрієва сіль HEDTA має тенденцію до осадження з водного розчину, коли зазнає впливу низьких температур, викликаючи необхідність нагрівання контейнерів, перш ніж розчин можна виливати. Далі, виявлено, що водні розчини Na3-HEDTA є корозійно-агресивними по відношенню до алюмінію і, отже, обмежують його застосування в пристроях, що зазнають корозії. Ці проблеми стають особливо актуальними, коли сіль HEDTA використовують в широкомасштабних виробництвах, особливо, коли застосовують контейнери із вмістом 0,5 кг або більше. На практиці контейнери можуть містити від 25кг до 1000кг водної солі HEDTA і навіть більше. Об'єктом даного винаходу є о тримання альтернативи для водних розчинів тринатрієвої солі HEDTA, яка має низьку в'язкість, не осаджується при низькій температурі, з якою можна маніпулювати в контейнерах при більш високих концентраціях і в меншій мірі володіє корозійними властивостями. Даний винахід відноситься до водних розчинів натрієвих солей HEDTA, що задовольняють вказаним умовам. У цьому відношенні несподівано виявлено, що вказані проблеми не виникають при використанні окремого водного розчину натрієвої солі xNa+yH+ хелатоутворювальної сполуки формули (І): 4 де x = 2,1-2,7, у = 0,9-0,3 і х+у = 3. Крім того, даний винахід відноситься до контейнерів, що містять щонайменше 0,5кг водного розчину ви щезгаданої натрієвої солі. HEDTA, оскільки виявлено, що вищезгадані проблеми не виникають при використанні контейнерів, які містять щонайменше 0,5кг вказаного розчину. Мається на увазі, що термін "контейнер", що використовується у всьому даному описі, включає не тільки резервуари, в яких натрієва сіль HEDTA згідно з даним винаходом може зберігатися і/або транспортуватися, але також місткості, цистерни, баки, посудини, трубопроводи або заливні лінії, які можуть містити вказану натрієву сіль і які використовують у виробничому процесі. Контейнери згідно з винаходом містять щонайменше 0,5кг вказаного розчину, переважно, щонайменше 1кг і, більш переважно, 25кг або більше. Переважно, вказані контейнери не містять більше, ніж 2000кг, більш переважно, 1500кг вказаної розчини. Переважно, контейнери, що містять щонайменше 0,5кг водного розчину згідно з даним винаходом, виготовляють з полівінілхлориду, поліетилену, нержавіючій сталі або бітумінізованої стали. Для використання якомога меншої кількості кислоти для нейтралізації, переважним є отримання водного розчину, який є по можливості близьким до розчину тринатрієвої солі без недоліків тринатрієвої солі. Виявлено, що найбільш сприятливих умов відносно використання нейтралізуючої кислоти, в'язкості, осадження і корозійно-агресивних властивостей досягають для х, що складає близько 2,4, наприклад, в межах від 2,3 до 2,5. Далі, виявлено, що сіль згідно з винаходом може бути розчинена у воді в концентрації 45мас.% або вище без погіршення вищезгаданих переваг. Для задоволення вищезгаданим умовам водний розчин має значення рН від 7 до 11. Згідно з іншим об'єктом винаходу передбачене застосування водного розчину, що містить натрієву сіль xNa+yH+ хелатоутворювальної сполуки формули (І), де x = 2,1-2,7, у = 0,9-0,3 і х+у = 3, для отримання халатного комплексу заліза. Отримання цього типу комплексу як такого відомо з рівня техніки, наприклад, як указано вище, в [патенті США 5110965]. Коли використовують водну сіль HEDTA згідно з даним винаходом, для фа хівця очевидний спосіб отримання таких комплексів. Також можуть бути утворені комплекси з іншими ніж залізо металами, такими як інші метали групи VIII, перехідні метали, рідкоземельні 5 81686 метали і т.п. Якщо отримують комплекси Fe, водний розчин солі HEDTA переважно містить 57мас. % комплексу заліза. Об'єктом винаходу також є спосіб отримання вищезгаданих водних розчинів солі HEDTA. У цьому відношенні винахід відноситься до способу отримання водного розчину, що містить щонайменше 45 мас. % натрієвої солі xNa+yH+ хелато утворювальної сполуки формули (І), де x = 2,1-2,7, у = 0,9-0,3 і х+у = 3, з тринатрієвої солі К(2-гідроксіетил)етилендіамін-N,N',N'-триоцтової кислоти (Na 3-HEDTA), що включає стадію електродіалізу при кімнатній температурі, тобто, 20°С, водного розчину, що містить менше 42 мас. % Na3-HEDTA, або при іншій температурі максимально при концентрації, при якій в'язкість є тією ж самою або нижчою, ніж в'язкість 42мас. %ного розчину Na3-HEDTA при температурі 20°С, використовуючи біполярну мембрану і катіонообмінну мембрану, таким чином перетворюючи розчин Na3-HEDTA в розчин натрієвої солі xNa+yHT формули (І) з x = 2,1-2,7, у = 0,9-0,3 і х+у = 3. Способи електродіалізу з біполярними мембранами (EDBM) відомі з рівня техніки. Огляд таких способів можна знайти у М. Bailly, Desalination, 144, 157-162 (2002). Коли використовують такий спосіб отримання натрієвої солі HEDTA згідно з даним винаходом, переважно застосовують лужний електроліт, такий, як гідроксид натрію або калію, карбонат (гідрокарбонат) натрію і т.п. Придатними біполярними мембранами є, наприклад, [Neosepta® BP1E фірми Tokuyama Corporation Ltd. (Японія), FT-BP™ фірми FumaTech GmbH (Німеччина) або Morgane® BPM фірми Solvay (Бельгія)]. Катіонообмінну мембрану використовують для відділення кислотного простору від лужного простору і також для перенесення іонів натрію з кислотного простору в лужний простір. Катіонообмінні мембрани для цього застосування повинні бути кислото- і лугостійкими. Придатними катіонообмінними мембранами є, наприклад, [Neosepta® CMB (Tokuyama Corp.), FT-FKL™ і FT-FKB™ (обидві фірми FumaTech GmbH)], однак, можуть бути використані будь-які інші катіонообмінні мембрани, якщо тільки вони кислото- і лугостійки і стабільні в розчині HEDTA в умовах способу і електродіалізу. Чим вища температура під час електродіалізу, тим нижча в'язкість розчину Na3-HEDTA. Таким чином, чим вищі вибирають температури, тим вище, ніж 42мас. %, можуть бути використані концентрації Na3-HEDTA. Однак, коли в'язкість розчину стає ви щою, ніж в'язкість 42мас. %-ного розчину при температурі 20°С, тобто, вищою, чим приблизно 25сП, транспорт такого розчину через тонкі канали електродіалізних осередків звичайно стає дуже скрутним для досягнення ефективного процесу. Тому переважно здійснювати процес при температурах, досить високих для забезпечення того, щоб в'язкість не була вищою, ніж приблизно 25сП, але досить низьких для забезпечення того, щоб мембрани всі ще діяли належно. Коли використовують типи чутливи х до нагріву 6 мембран, процес електродіалізу переважно здійснюють при низьких температурах, нижче кімнатної температури. Спосіб електродіалізу з біполярною мембраною можна здійснювати аж до температури 90°С, яка являє собою максимальну температуру, яку може витримувати більшість катіонообмінних мембран. Переважно, температура повинна бути нижчою за приблизно 60°С, коли використовують біполярні мембрани FT-BP™ фірми FumaTech або Morgane® BPM фірми Solvay, або нижче за приблизно 45°С, коли використовують біполярну мембрану Neosepta® BP1E фірми Tokuyama Corp. З практичної точки зору спосіб найбільш переважно здійснюють при температурі від 20°С до 45°С. Помічено, що, завдяки електроосмосу, вода разом з іонами натрію мігрує з простору з HEDTA через катіонообмінну мембрану в лужний простір. Таким чином, концентрація HEDTA зростає під час процесу підкислення. Крім того, помічено, що, хоча і менш переважно, водний розчин, що містить щонайменше 45 мас. % натрієвої солі xNa+yH+ хелато утворювальної сполуки формули (І), де x = 2,1-2,7, у = 0,9-0,3 і х+у = 3, також може бути приготований з Na3-HEDTA за допомогою процесу електролізу, що включає стадію електрохімічного підкислення, як, наприклад, описується [P. Boyaval, J. Seta і С. Gavach в Enzyme Microb. Technol., 15, 683-686 (серпень 1993)]. Винахід далі пояснюється наступними прикладами. Приклад 1 Розчин Na3-HEDTA з рН = 11,05 і, що має концентрацію 41мас. % Na3-HEDTA, що виражається у вигляді значення Fe-TSV (кількість сумарного комплексоутворювального заліза), перетворюють в натрієву сіль xNa+yH+ хелато утворювальної сполуки формули (І), де x = 2,1-2,7, у = 0,9-0,3 і х+у = З, шляхом циркулювання розчину через електродіалізний пакет біполярної мембрани [Neosepta® BP1; наприклад, фірми Tokuyama Corporation Ltd.), використовуючи звичайний насос. Завдяки нагріванню, здійснюваному під час процесу підкислення, температура розчину натрієвої солі HEDTA підвищується від 30°С на початку експерименту до 45°С в кінці експерименту. Під час експерименту, значення рН в просторі з HEDTA вимірюють при використанні звичайного каліброваного рН-метра з комбінованим скляним електродом. Під час підкислення, при використанні вищезгаданого електродіалізного пакету біполярної мембрани, значення рН розчину натрієвої солі HEDTA меншає. Виявлено, що, коли значення рН досягає величини 9,6 при температурі 35°С, потік текучого розчину натрієвої солі HEDTA, який вимірюють при використанні звичайного витратоміру, починає швидко збільшува тися від 40 л/година до вище за 200 л/година без зміни регулювання насосу і/або інших умов. Це вказує на те, що в'язкість розчину натрієвої солі HEDTA у вищезгаданих умовах швидко меншає. Кінцевий розчин натрієвої солі HEDTA, який отримують, має значення рН = 9,1, 7 81686 яке відповідає натрієвій солі xNa+yH+ HEDTA, де x = 2,7 і у = 0,3. В'язкість вищезгаданого кінцевого розчину, що вимірюється за допомогою віскозиметра Брукфілда, становить 16,2сП при температурі 20°С і 7,7сП при температурі 50°С. Приклад 2 Натрієві солі xNa+yH+ хелатоутворювальної сполуки формули (І), що мають різні значення χ і у, отримують шляхом підкислення, використовуючи електродіалізний пакет біполярної мембрани, як описується в прикладі 1, до досягнення бажаного значення рН. В'язкість отриманих таким чином розчинів HEDTA вимірюють в широкій смузі концентрацій при двох різних температурах (20°С і 50°С), використовуючи віскозиметр Брукфілда. У ниженаведених таблицях представлена в'язкість (в сантипуазах) по відношенню до концентрації HEDTA (у вигляді кількості сумарного комплексоутворювального заліза, Fe-TSV, що виражається у вигляді солі Na3-HEDTA) для солі xNa+yH+ формули (І), в якій x = 3 (порівняльний приклад), х=2,4 і х=2,1, і у=0, у = 0,6 і у = 0,9, відповідно. Таблиця I В'язкість солей HEDTA в ідносно Fe-TSV при 20°С Концентрація (мас. %) 10 30 40 50 х = 3 в 'язкість (сП) 2 7Д 19 00* х=2,4 в'язкість (сП) 2 5,2 12,7 54 х=2,1 в'язкість (сП) 2 4,3 10 32,9 *: в 'язкість при в місті 50 мас. % Na3-HEOTA не може бу ти в изначена в наслідок загу снення проду кту. При низькій концентрації (10мас.%) немає значної відмінності у в'язкості між Na3-HEDTA (рівень техніки) і Na2,4-HEDTA і Na2-1-HEDTA (даний винахід). При більш високих концентраціях відмінності в'язкості стають більшими. При 50 мас. % Na 3HEDTA вже не можна використати, оскільки вона гусне, в той час як Na2-4-HEDTA і Na2-1-HEDTA все ще можна вільно використовувати. Таблиця II В'язкість солей HEDTA в ідносно Fe-TSV при 50°С Концентрація (мас. %) 10 30 40 50 х = 3 в 'язкість (сП) 1 3,1 6,7 21,1 x = 2,4 в 'язкість (сП) 1 2,3 5,2 14,2 х = 2,1 в 'язкість (сП) 1 2,3 4,2 10,1 При більш високій температурі (50°С) відмінності в'язкості між Na3-HEDTA (рівень техніки) і Na2,4-HEDTA і Na2,1-HEDTA залишаються, хоча і менше, ніж при температурі 20°С. Переваги низької в'язкості полягають в тому, що легше спорожняти баки/контейнери, заливні лінії, підтримувати потоки під час подачі насосом/маніпулюванням з продуктом, і т.д. Приклад 3 8 Класифікація засобів транспортування водних розчинів HEDTA також пов'язана з корозійним потенціалом. Тести відносно корозії проводили відповідності до стандарту NACE ТМ-01-69, використовуючи 40 мас. %-ний, що не містить лугу розчин Na3-HEDTA на алюмінії 7075 Т6, які показали, що швидкість корозії алюмінію є вище допустимої межі (максимальна середня величина швидкості корозії 6,2мм/рік). Цей тест з 40мас.%ним водним розчином Na2,3H0,7 -HEDTA показує середню величину швидкості корозії для алюмінію 7075 Т6 менше 1мм/рік. Це дозволяє маніпулювати з продуктом в алюмінієвих контейнерах і виробничому обладнанні.
ДивитисяДодаткова інформація
Назва патенту англійськоюAqueous solution of a sodium salt of [n- (2-hydroxyethyl) ethylenediamine-n, n', n'-triacetic acid, use and preparation thereof, and a container comprising said aqueous solution
Автори англійськоюHeus Martin, Lammers Hans, Lepage Jim
Назва патенту російськоюВодный раствор натриевой соли n-(2-гидроксиэтил) этилендиамин-n, n', n'-триуксусной кислоты, его применение и способ получения, и контейнер, что содержит его
Автори російськоюХеус Мартин, Ламмерс Ханс, Липейдж Джим
МПК / Мітки
МПК: C07C 229/26, B01D 61/42
Мітки: водний, розчин, спосіб, застосування, одержання, кислоти, контейнер, солі, містить, натрієвої, n-(2-гідроксіетил)етилендіамін-n, n'-триоцтової
Код посилання
<a href="https://ua.patents.su/4-81686-vodnijj-rozchin-natriehvo-soli-n-2-gidroksietiletilendiamin-n-n-n-trioctovo-kisloti-jjogo-zastosuvannya-ta-sposib-oderzhannya-ta-kontejjner-shho-mistit-jjogo.html" target="_blank" rel="follow" title="База патентів України">Водний розчин натрієвої солі n-(2-гідроксіетил)етилендіамін-n, n’, n’-триоцтової кислоти, його застосування та спосіб одержання, та контейнер, що містить його</a>
Попередній патент: Головний блок ракети-носія
Наступний патент: Спосіб передачі крутного моменту та фрикційна муфта для здійснення способу
Випадковий патент: Гідродвигун мельничука








