Спосіб одержання 4-арил(гетарил)-5-етоксикарбоніл-6-хлорометил-3,4-дигідропіримідин-2(1н)-онів
Формула / Реферат
Спосіб одержання 4-арил(гетарил)-5-етоксикарбоніл-6-хлорометил-3,4-дигідропіримідин-2(1Н)-онів загальної формули:
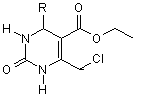 ,
,
де R = 4-СlС6Н4, 4-ЕtС6Н4, 3-NO2C6H4, 4-МеОС6Н4, 4-трет.-ВuС6Н4, 2-CHF2OC6H4, 4-МеSС6Н4, 3,4-(МеО)2С6Н3, 3-МеO-4-НОС6H4, фурил-2, тієніл-2,
який відрізняється тим, що ароматичні або гетероароматичні альдегіди піддають взаємодії з 4-хлороацетооцтовим естером та сечовиною в мольному співвідношенні відповідно 1:1:1,5 в розчині оцтової кислоти при 45-50 °С впродовж 48 год. з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання 4-арил(гетарил)-5етоксикарбоніл-6-хлорометил-3,4дигідропіримідин-2(1Н)-онів загальної формули: R O H N O 2 де R = 4-СlС6Н4, 4-ЕtС6Н4, 3-NO2C6H4 , 4-МеОС6Н4, 4-трет.-ВuС6Н4, 2-CHF2OC6H4, 4-МеSС6Н4 , 3,4(МеО)2С 6Н3, 3-МеO-4-НОС6H4, фурил-2, тієніл-2, який відрізняється тим, що ароматичні або гетероароматичні альдегіди піддають взаємодії з 4хлороацетооцтовим естером та сечовиною в мольному співвідношенні відповідно 1:1:1,5 в розчині оцтової кислоти при 45-50 °С впродовж 48 год. з наступним виділенням цільових продуктів звичайними методами. O Cl N H N Cl H де R=4-СlС6Н4, 4-ЕtС6Н4, 3-NO2C6H4, 4МеОС6Н4 , 4-трет.-ВuС6Н4, 2-CHF2OC6H4, 4МеSС6Н4, 3,4-(МеО) 2С6Н3 , 3-МеO-4-НОС6H4, фурил-2, тієніл-2, тіоніл-2. Сполуки такого типу можуть знайти застосування як вихідні для нових препаратів медичного призначення. Названі сполуки, спосіб їх отримання, властивості і застосування ні в науковій літературі, ні в патентних виданнях не описані. Найближчим структурним аналогом сполук, які заявляються є 4-заміщені 5-алкоксикарбоніл-6бромометил-3,4-дигідропіримідин-2(1Н)-они O N ALK Br H де R=Alk, Аr, Het; Alk = Et, i-Pr, Bn Похідні гетероциклічної системи 3,4дигідропіримідин-2(1Н)-ону є сполуками з широким комплексом фармакологічної дії [1]. Зокрема, серед естерів 3 заміщених 4-арил-1,4дигідропіримідин-5 - карбонової кислоти виявлені ефективні блокатори кальцієвих каналів, що стало основою для створення активних протигіпертензивних агентів [2, 3]. Крім цього, в їх ряду знайдені речовини з високою протизапальною активністю [4, 5], а також противірусною [6], бактерицидою [7] та хемотерапевтичною [8] дією. Для синтезу 5-алкоксикарбоніл-6-бромометил3,4-дигідропіримідин-2(1Н)-онів найчастіше використовують бромування їх 6-метилзаміщених аналогів за допомогою брому в розчині хлороформу [9, 10]. Незважаючи на препаративну простоту, суттєвим недоліком методу є утворення поруч із 36438 O O N (11) O N H O UA H R (19) Корисна модель відноситься до органічної хімії, а саме до способу одержання нових похідних гетероциклічної системи 3,4-дигідропіримідин2(1Н)-ону загальної формули : R O (13) U , 3 36438 4 бромометилпохідними до 10% дибромометилпохіR O дних, які практично не вдається розділити. ВикоH ристання як бромуючого агента полімернозв'язаN O ного брому в пербромідній формі дозволяє Cl уникнути побічних процесів [11], але на даний час O N такий реагент не є комерційне доступним. Спосіб трикомпонентної циклоконденсації, зреалізований H на прикладі діацетилацеталю 5-нітрофур фуролу, де R=4-СlС6Н4, 4-ЕtС6Н4, 3-NO2С6Н4, 44-бромоацетооцтового естеру та сечовини [8] не МеОС6Н4 , 4-трет.-ВuС6Н4, 2-CHF2OC6H4, 4набув подальшого розвитку, що, в значній мірі, МеSС6Н4, 3,4-(МеО)2С6Н3 , 3-МеO-4-НОС6H4 футакож обумовлено доступністю 4рил-2, тієніл-2. бромоацетооцтового естеру. Спосіб отримання сполук, які заявляються, Задачею корисної моделі є спосіб отримання полягає в тому, ароматичні або гетероароматичні нових 6-хлорометилзаміщених похідних 3,4альдегіди піддають взаємодії з 4дигідропіримідин-2(1Н)-ону загальної формули : хлороацетооцтовим естером та сечовиною в мольному співвідношенні 1:1:1.5 в розчині оцтової кислоти при температурі 45-500°С. Цільові продукти виділяють з реакційної суміші стандартними методами. Виходи становлять 72-84%. де R=4-СlС6Н4, 4-EtC 6H4, 3-NO2С6Н4, 4МеОС6Н4 , 4-трет.-ВuС6Н4, 2-CHF2OC6H4, 4MeSC6H4, 3,4-(МеО) 2С6Н3 , 3-МеО-4-НОС6Н4, фурил-2, тієніл-2. Запропонований підхід, завдяки наявності в структурі 3,4-дигідро-піримідинону екзоциклічних етоксикарбонільної та хлорометильної груп , відкриває шлях до сполук, які можуть знайти практичне застосування як фармацевтичні препарати. Окрім того, оскільки хлорометильна група за своїми алкілуючими параметрами практично не поступається бромометильній, то заявлені сполуки можуть бути успішно використані в синтезі вже відомих похідних дигідропіримідину: 5етоксикарбоніл-6-азидометил-3,4дигідропіримідин-2(1Н)-ону [12], 4,5,6,7-те трагідро3Н-піроло[3,4-d]піримідину та 4,5,6,7-те трагідро4Н-піразино[4,5-d]піримідину [10], а також 5алкоксикарбоніл-6-(1,2,3-триазол-1-іл)-3,4дигідропіримідин-2(1Н)-онів [11]. Запропоновані експериментальні умови (нагрівання реагентів в оцтовій кислоті при 45-50°С) не були заздалегідь передбачуваними, оскільки при проведенні реакції в киплячій оцтовій кислоті (120°C) селективність процесу знижується і, як наслідок, виходи цільових продуктів зменшуються вдвоє. Аналогічна картина має місце і при використанні класичних умов синтезу сполук Біджинелі (нагрівання в киплячому етанолі в присутності кислотних каталізаторів) [13]. На нашу думку це пов'язано із здатністю 4-хлороацетооцтового естеру, на відміну від ацетооцтового естеру, при підвищених температурах приймати участь в побічних конденсаціях за рахунок хлорметильної групи. Перебіг заявленої трикомпонентної циклоконденсації, як встановлено нами на прикладі взаємодії фурфуролу, 4-хлорацетооцтового естеру та сечовини в оцтовій кислоті при 45-50°C впродовж 24год, здійснюється через стадію утворення наведеного нище ациклічного продукту, який при подальшому нагріванні перетворюється в цільову сполуку шля хом циклізації вільної аміногрупи уреїдного та карбонільної групи хлорацетильного фрагментів. O O O H N NH 2 O Cl Індивідуальність та склад всіх отриманих 5етоксикарбоніл-6-хлорометил-3,4дигідропіримідин-2(1Н)-онів доведені результатами хроматомас-спектрометрії та елементного аналізу, а будова - ІЧ та Я МР 1Н спектрами. Корисна модель ілюструється загальним методом синтезу 5-етоксикарбоніл-6-хлорометил-3,4дигідропіримідин-2(1Н)-онів і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 5-етоксикарбоніл6-хлорометил-3,4-дигідропіримідин-2(1Н)-онів. Суміш 0,02 моль ароматичного або гетероароматичного альдегіду, 3,3г (0,02моль) 4хлороацетооцтового естеру і 1,8г (0,03моль) сечовини в 50мл оцтової кислоти витримували при 4550°C впродовж 48год, а потім виливали в 200мл води. Твердий осад відфільтровували, сушили і кристалізували із 60%-ного водного етанолу. Приклад 1 5-Етоксикарбоніл-6-хлорометил-4-(4хлорофеніл)-3,4-дигідро-піримідин-2(1Н)-он. Вихід 84%, т.топл. 180-181°С. ІЧ спектр, см -1: 3280 (N-H), 1710, 1670 (С=О ). Спектр ЯМР 1H d, м.ч.: 1,15т (3Н,СН3), 4,03кв (2H,CH 2), 4,57д (1HA, 2J 10,2Гц), 5 36438 6 4,76д (1НВ, 2J 10,2Гц), 5,18д (1Н,Н4, J 3,0Гц), 7,25д (3Н,СН3), 2,44с (3Н, СН3O), 4,07кв (2Н,СН 2), 4,61д (2Наром .), 7,34д (2Н, Наром .), 7,82с (1Н, NH), 9,48с (1НA, 2J 10,6Гц), 4.74д (1НВ, 2J 10,6Гц), 5,15д (1Н, NH). Знайдено, %: С 51,34; Н 4,17; N 8,36. (1Н,Н4, J 2,7Гц), 7,18с (4Наром.), 7,77с (1Н, NH), С14Н14Сl2N2О 3. Вирахувано, %: С 51,08, Н 4,29, 9,43с (1Н, NH). Знайдено, %: С 52,61, Н 4,92, N N8,51. 8,14. C15H17ClN2O3S. Вирахувано, %: С 52,86, Н Приклад 2 5,03, N 8,22. 5-Етоксикарбоніл-6-хлорометил-4-(етилфеніл)Приклад 8 3,4-дигідропіримі-дин-2(1Н)-он. Вихід 79%, т.топл. 5-Етоксикарбоніл-4-(3,4-диметоксифеніл)-6хлорометил-3,4-дигідропіримідин-2(1Н)-он. Вихід 145-146°С. ІЧ спектр, см -1: 3250 (N-H), 1710, 1665 84%, т.топл. 186-188°С. ІЧ спектр, см -1: 3290 (N-H), (С=О). Спектр ЯМР 1H, d м.ч.: 1,12-1,20м (6H,CH3), 2,59кв (2Н, CH2), 4,05кв (2H,CH2), 4,57д (1НA, 2J 1705, 1670 (С=О ). Спектр ЯМР 1Н, d, м.ч.: 1,13т 2 4 10,5Гц), 4,76д (1НВ, J 10,5Гц), 5,15д (1Н,Н , J (3Н,СН3), 3,69с (3Н, СН3О), 3,71с (3Н, СН3О), 3,0Гц), 7,14м (4Наром.), 7,73с (1Н, NH), 9,39с (1Н, 4,06кв (2H,CH2), 4,69с (2Н, СН2), 5,13д (1Н,Н4, J 3,1 NH). Знайдено, %: С 59,34; Н 6,07; N 8,46. Гц), 6,76-6,92м (3Н, Наром,), 7,80с (1Н, NH), 9,47с С16Н19СlN2О3 . Вирахувано, %: С 59,54, Н 5,93, N (1Н, NH). Знайдено, %: С 54,33, Н 5,29, N 7,78. 8,68. C16H19ClN2O5 . Вирахувано, %: С 54,17, Н 5,40, N Приклад 3 7,90. 5-Етоксикарбоніл-6-хлорометил-4-(3Приклад 9 нітрофеніл)-3,4-дигідропіри-мідин-2(1Н)-он. Вихід 5-Етоксикарбоніл-4-(4-гідрокси-3метоксифеніл)-6-хлорометил-3,475%, т.топл. 151-152°С. ІЧ спектр, см -1: 3260 (N-H), дигідропіримідин-2(1Н)-он. Вихід 73%, т.топл. 1411715, 1670 (С=O). Спектр ЯМР 1H, d, м.ч.: 1,15т (3Н,СН3), 4,06кв (2H,CH 2), 4,58д (1НA, 2J 10,8Гц), 142°С. ІЧ спектр, см -1: 3450 (О-Н), 3305 (N-H), 2 4 4,77д (1НВ. J 10,8Гц), 5,34д (1Н,Н , J 3,3Гц), 7,611715, 1675 (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,16т 7,68м (2Наром .), 7,97с (1H, NH), 8,13м (2Н, Наром .), (3Н,СН3), 3,73с (3Н, СН3О), 4,04кв (2Н.СН 2), 4,68кв 9,68с (1H, NH). Знайдено, %: С 50,04; Н 4,17; N (2Н, СН2), 5,08д (1Н,Н4, J 3,3Гц), 6,63м (2Н, Наром.), 12,36. С14Н14СlN3O5. Вирахувано, %: С 49,70, Н 6,78с (1Н, Наром.), 7,67с (1Н, NH), 8,79с (1Н,ОН), 4,14, N 12,32. 9,33с (1Н, NH). Знайдено, %: С 52,53, Н 5,19, N Приклад 4 8,38. С15Н17СlN3О5 . Вирахувано, %: С 52,87, Н 5-Етоксикарбоніл-4-(4-метоксифеніл)-65,03, N 8,22. хлорометил-3,4-дигідро-піримідин-2(1Н)-он. Вихід Приклад 10 5-Етоксикарбоніл-4-(2-фурил)-6-хлорометил79%, т.топл. 185-186°С. ІЧ спектр, см -1: 3290 (N-H), 3,4-дигідропіримідин-2(1Н)-он. Вихід 72 %, т.топл. 1705, 1665 (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,14т 165-167°С. ІЧ спектр, см -1: 3275 (N-H), 1710, 1670 (3Н,СН3), 4,04кв (2Н,СН2), 4,58д (HA, 2J 10,5Гц), 2 4 4,75д (1НВ, J 10,5Гц), 5,13д (1Н,Н , J 3,3Гц), 6,82д (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,18т (3Н,СН 3), (2Н, Наром.), 7,25д (2Наром.), 7,72с (1H, NH), 9,38с 4,09кв (2H,CH2), 4,50д (1HA, 2J 10,0Гц), 4,80д (1НВ, 2 (1H, NH). Знайдено, %: С 55,73, Н 5,40, N 6,48. J 10,0Гц), 5,24д (1Н,Н4, J 2,8Гц), 6,11с (1Н, C15H17ClN2O4 . Вирахувано, %: С 55,48, Н 5,28, Н4фурил), 6,32с (1Н, H4ф урил), 7,49с (1Н, Н4фрил), 7,79с N8,63. (1Н, NH), 9,45с (1Н, NH). Знайдено, %: С 50,37, Н Приклад 5 4,71, N 9,75. С12Н13СlN2O 4. Вирахувано, %: С 4-(2-Дифторометокси)-5-етоксикарбоніл-650,63, H 4,60, N 9,84. хлорометил-3,4-дигідро-піримідин-2(1Н)-он. Вихід Приклад 11 5-Етоксикарбоніл-4-(2-тієніл)-6-хлорометил75%, т.топл. 146-147°С. ІЧ спектр, см -1: 3300 (N-H), 3,4-дигідропіримідин-2(1Н)-он. Вихід 80%, т.топл. 1710, 1670 (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,06т 180-181°С. ІЧ спектр, см -1: 3285 (N-H), 1710, 1665 (3Н,СН3), 3,95кв (2H,CH 2), 4,6д (1HA, 2J 10,8Гц), 4,64д (1НB, 2J 10,8Гц), 5,58д (1Н,Н4, J 2,7Гц), 7,13т (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,23т (3Н,СН 3), (1Н, CHF2, J 105,9 Гц) 7,29-7,46м (4Наром.), 7,56с 4,12кв (2Н,СН2), 4,41д (1НА, 2J 10,1Гц), 4,68д (1НВ, 2 (1Н, NH), 9,47с (1Н, NH). Знайдено, %: С 47,62, Н J 10,1Гц), 5,44д (1Н,Н4, J 2,9Гц), 6,91с (1Н, Н3тієніл), 4,11, N 7,45. C15H15ClF2N2O4 Вирахувано, %: С 6,93с (1Н, Н5тієніл), 7.31м (1H, Н4тієніл ), 7,93с (1Н, 47,45, Н 3,98, N 7,38 . NH), 9,50с (1Н, NH). Знайдено, %: С 48,07, Н 4,41, Приклад 6 N 9,55. C12H13ClN2O3S. Вирахувано, %: С 47,92, Н 5-Етоксикарбоніл-4-(4-трет.-бутилфеніл)-64,36, N 9,31. хлорометил-3,4-дигідропіримідин-2(1Н)-он. Вихід Приклад 12 76 %, т.топл. 169-171°С. ІЧ спектр, см -1: 3290 (NЕтиловий естер b-[(амінокарбоніл)аміно]-a(хлороацетил)-2-фуранпропанової кислоти. Суміш H), 1715, 1660 (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,14т 1,92г (0,02моль) фур фуролу, 3,3г (0,02моль) 4(3Н,СН3), 1,25с (9Н, С(СН3)3), 4.6кв (2H,CH 2), 4,46д хлороацетооцтового естеру і 1,8г (0,03моль) сечо(1НA, 2J 10,3Гц), 4,78д (1НB, 2J 10,5Гц), 5,16д вини в 50мл оцтової кислоти витримували при 45(1Н,Н4, J 2,8Гц), 7,18д (2Наром.), 7,35д (2Н, Наром.), 7,80с (1Н, NH), 9,47с (1Н, NH). Знайдено, %: С 50°С впродовж 24год, а потім виливали в 200мл 61,41, Н 6,72, N 8,14. C18H23N2ClO3. Вирахувано, води. Твердий осад відфільтровували, сушили і %: С 61,62, Н 6,61, N 7,98. кристалізували із етанолу. Вихід 54%, т.топл. 119Приклад 7 121°С. ІЧ спектр, см -1: 3345-3280 (N-H), 1660-1680, 5-Етоксикарбоніл-4-(4-метилтіофеніл)-61715 (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,07т (3Н, хлорометил-3,4-дигідро-піримідин-2(1Н)-он. Вихід СН3), 3,62д (1НА, 2J 12,1Гц), 3,66д (1НB, 2J 12,1Гц), -1 80 %, т.топл. 204-205°С. ІЧ спектр, см : 3295 (N3,93кв (1НА), 4,03кв (1НВ), 4,91д (1Н, СН, J 12,6Гц), Н), 1715, 1665 (С=O). Спектр ЯМР 1Н, d, м.ч.: 1,17т 6,28с (1Н, Н3фурил), 6,34-6,38м (3Н, СН, NH), 6,73с 7 36438 8 (1Н, Н4фурил), 7,51с (1Н, Н5фурил). 7,79 с (1H,NH). nucleosides as potent and selective inhibitors of Знайдено, %: С 47,38; Н 5,12, N 9,36. hepatitis В virys // J. Med. Chem.- 2002.- Vol.45, C12H15ClN2О5 . Вирахувано, %: С 47,61, Н 4,99, N №10.- P.2032-2040. 9,25. 7. Brandt M., Endermann R., Gahlmann R., Література Kruger J., Raddatz S. Dihydropyrimidones - a new 1. Kappe O.C. Biologically active dihydropyrimiclass of anti-staphylococcal antibiotics // Bioorg. Med. dones of Biginelly-type - a literature survey // Eur. J. Chem. Lett- 2003.- Уо1.13,№2.- Р.241-245. Med. Chem.- 2000.-Vol.35.- P.1043-1045. 8. PatBrit. 868,030. 05 Dec 1958. Substituted 42. Mauer T.U., Kapoor T.M., Haggarty S.J., (5-nitrofuryl)-2-oxo-l,2,3,4-tetrahydropyrimidines / Hull Schreiber S.L., Mitchuson T.J. Small molecule inhibiR., Swain G. Chem.Abstr.- 1962.- Vol.56.-1463. tor of mitotic spindle bipolarity identified in a pheno9. Zigeuner G., Hamberg H., Blascke H., Sterk H. tyne-based screen // Science.1999.Zur bromiemng der 2-oxo-6Уо1.286,№5441.- Р.971-974. methyltetrahydropyrimidine.- Monatsh.Chem.- 1966.3. Rovn yak G.C., Atwal K.S., Hedberg A., Kimball Bd.97.- S.1408-1421. S.D., Moreland S., Gougoutas J.F., O'Reilly B.C., 10.George Т., Tahilraman R., Menta D.V. ConSchwartz J., Malley Н. Dihydropyridine calcium chandensed heterocycles from 5-ethoxycarbonyl-6nel blockers. 4.Basic 3-substituted 4-aryl-1,4methyltetrahydropyrimidin-2-ones // Synthesis.dihydropyridine-5-carboxylic acid esters. Potent anti1975.-№6.- P.405-407. hypertensive agents // J.Med.Chem.-1992.- Vol.35, № 11.Khanetsky В., Dallinger D., Kappe C.O. Com24.- P.3254-3263. bining Biginelli multi-component and click chemistry : 4. Modica M., Santagoti M., Santagoti A., Cutuli generation of 6-(l,2,3-triazol-l-yl)-dihydropyrodone V., Mangano N., Caruso N. Synthesis of new libraries // J. Comb. Chem.- 2004.- Vol.6, №6.- P.884[1,3,4]thiadiazolo[3,2-a]thieno[2,3-d]pyrimidinone de892. rivatives with anti-inflammatory activity // Pharmazie.12.Kappe C.O. Unexpected formation of nitriles 2000.- Vol.55.-P.500-508. from reactions of 6-(dibromomethyl)-1,2,3,45. Tozkoparan В., Ertan M., Kelian P., Demirtetrahydro-2-oxo-5-pyrimidinecarboxylates with sodamar R. Synthesis and anti-inflammatory activities of dium azide // Liebigs Ann. Chem.- 1990.- P.505-507. some thiazolo[3,2-a]pyrimidine derivatives // Far13.Kappe C.O. 100 years of the biginelli dihydromaco.- 1999.- Уо1.54,№ 9.- P.588-593. pyrimidine synthesis // Tetrahedron. - 1993. - Vol. 49, 6. Kumar R., Nath M., Туrrell D.L. Desin and №32. - P. 6937-6963. synthesis of novel 5-substituted acyclic pyrimidine Комп’ютерна в ерстка А. Крижанівський Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 4-aryl(hetaryl)-5-ethoxycarbonyl-6-chloromethyl-3,4-dihydropyrimidine-2(1h)-ones
Автори англійськоюVovk Mykhailo Volodymyrovych
Назва патенту російськоюСпособ получения 4-арил(гетарил)-5-этоксикарбонил-6-хлорометил-3,4- дигидропиримидин-2(1н)-онов
Автори російськоюВовк Михаил Владимирович
МПК / Мітки
МПК: C07D 239/00
Мітки: 4-арил(гетарил)-5-етоксикарбоніл-6-хлорометил-3,4-дигідропіримідин-2(1н)-онів, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/4-36438-sposib-oderzhannya-4-arilgetaril-5-etoksikarbonil-6-khlorometil-34-digidropirimidin-21n-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 4-арил(гетарил)-5-етоксикарбоніл-6-хлорометил-3,4-дигідропіримідин-2(1н)-онів</a>
Попередній патент: Інсекто-акарицидний препарат “ектосан”
Наступний патент: Пристрій для контролю обладнання у замкнутій камері
Випадковий патент: Канал вимірювання похилої дальності до літальних апаратів для лвс полігонного випробувального комплексу








